Способы укладки ДНК
Министерство
образования и науки Российской Федерации
Федеральное
Государственное
бюджетное
образовательное учреждение
Высшего
профессионального образования
Воронежский
Государственный Педагогический Университет
Реферат на
тему
«Способы
укладки ДНК»
Воронеж,
2014 г.
Введение
Молекулы ДНК в эукариотических клетках очень
велики. Так, длина молекул ДНК, выделенных из клеток человека, достигает
нескольких сантиметров. Принято считать, что каждая эукариотическая хромосома
содержит одну - единственную непрерывную молекулу ДНК. Учитывая видовое
количество хромосом у млекопитающих, можно сказать, что в среднем у них на
интерфазное ядро приходится около 2 м ДНК, находящейся в сферическом ядре
диаметром менее 10 мкм. При этом в ядре должен сохраняться определенный порядок
расположения молекул ДНК, чтобы обеспечить ее упорядоченное функционирование.
Именно поэтому молекулы ДНК в ядрах
эукариотических клеток всегда находятся в комплексе с белками в составе
хроматина, который образуется из хромосом после окончания деления ядер в
результате сложного процесса раскручивания (деспирализации) хромосом.
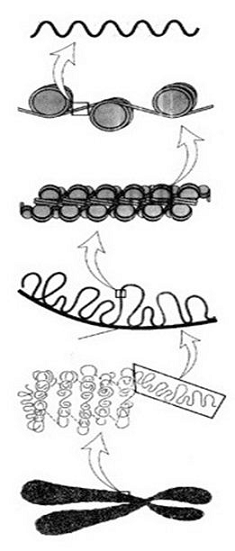
Исследуя структурную организацию хроматина и
хромосом, можно определенно говорить о нескольких уровнях компактизации ДНК.
Первый - нуклеосомный, дающий семикратное уплотнение ДНК и составе фибрилл ДНП,
второй - фибрилла диаметром 30 нм, или нуклеомерный уровень, с 40-70-кратной
степенью упаковки, третий - доменно-петлевой, или хромомерный, приводящий к
600-700-кратному уплотнению ДНК в составе этих структур. Для поддержания первых
двух уровней компактизации было достаточно участия только гистоновых белков,
тогда как петлевые и розеткоподобные доменные структуры уже требовали участия
негистоновых белков и перехода от спирального, или соленоидного, типа укладки
ДНК к образованию компактных глобулярных структур, состоящих из петель
хроматиновых фибрилл диаметром 30 нм, к структурам типа хромомеров, имеющих уже
размеры 0,1-0,2 мкм.
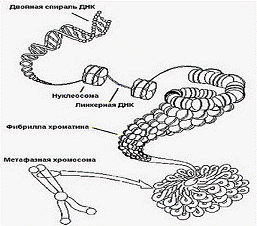
Глава 1. Упаковка ДНК в хромосомах
Компактность - принципиальное отличие генома
эукариот от прокариотического генома. При средней разнице размеров геномов на 3
порядка, линейные размеры эукариотических хромосом соизмеримы с длиной ДНК
прокариот.
Выделяют, по крайней мере, 4 уровня
компактизации ДНК. При этом нить ДНК "укорачивается" в 10 000 раз.
Это подобно тому, если нить, длиной с Останкинскую башню (500 м), уложить в
спичечный коробок (5см).
Хромосомы эукариотических клеток состоят в
основном из хроматина - комплекса двухцепочечной ДНК и пяти гистоновых белков,
обозначаемых H1, Н2А, Н2В, Н3 и Н4
Именно гистонами обеспечиваются два первых
уровня компактизации эукариотического генома- нуклеосомный и нуклеомерный.
1.1 Общая характеристика гистонов
Гистоны - основные белки. Все они обогащены
лизином и аргинином - положительно заряженными аминокислотами. В зависимости от
соотношения в структуре гистонов аминокислот обычно выделяют 5 фракций
гистонов. Нарабатывается их очень много - 60 млн. молекул каждой фракции на
клетку.
Модификации гистонов очень сильно влияют на
компактизацию ДНК. Гистоны могут метилироваться, фосфорилироваться (по серину,
треонину, тирозину), т.е. аминокислотные остатки легко модифицируются. Кроме
того, возможно алкилирование и ацетилирование гистонов.
Основные фракции гистонов:
|
Фракция
|
Лизин
|
Аргинин
|
лиз./арг
|
осн.АК/кис.АК
|
Мол.
вес (Да)
|
|
Н1
(очень богатая лизином)
|
29%
|
1%
|
>20
|
5.4
|
23000
|
|
Н2В
(умернно богатая лизином)
|
16%
|
6%
|
~2.5
|
1.7
|
13774
|
|
Н2А
(умеренно богатая лизином и аргинином)
|
11%
|
9%
|
~1
|
1.4
|
13960
|
|
Н4
(богатая аргинином и глицином)
|
11%
|
14%
|
~0.8
|
2.5
|
11282
|
|
Н3
(очень богатая аргинином); в ней есть цистеин, а в других - нет
|
10%
|
13%
|
~0.7
|
1.8
|
15348
|
Все гистоны, кроме Н1, чрезвычайно консервативны
в эволюционном отношении (у коровы и клевера разница в Н2А всего в одну
аминокислоту!). Следовательно, эти белки выполняют принципиальную функцию,
которая у всех эукариот обеспечивается одинаково. Любая мутация в гистоновых
генах летальна.
Н1 - очень вариабельная фракция. Этот гистон
различен не только у видов, но даже у одного организма, в зависимости от стадий
онтогенеза.
В гистонах лизин и аргинин кластированы. Средняя
часть гистона содержит гидрофобные аминокислоты. Положительно заряженные
аминокислоты гистонов обеспечивают электростатические взаимодействия с ДНК.
Центральная часть необходима для взаимодействия гистонов между собой.
Роль гистонов в свертывании ДНК важна по
следующим причинам:
) Если бы хромосомы состояли только из вытянутой
ДНК, трудно вообразить, как они могли бы реплицироваться и разделяться по
дочерним клеткам, не запутываясь или не ломаясь при этом.
) В вытянутом состоянии двойная спираль ДНК
каждой человеческой хромосомы пересекла бы клеточное ядро тысячи раз; таким
образом, гистоны упорядоченным образом упаковывают очень длинную молекулу ДНК в
ядро, имеющее несколько микрометров в диаметре;
) Не вся ДНК свернута одинаковым образом, и
характер упаковки района генома в хроматин , вероятно, влияет на активность
генов , содержащихся в данном районе.
.2 Нуклеосомный уровень компактизации ДНК
Первый - уровень нуклеосомной фибриллы.
Существование в хроматине дискретных повторяющихся единиц открыли в 1973 году
Д. Хьюиш и Л. Буржойн (Австралия). А. Олинс и Д. Олинс (США) с помощью
электронного микроскопа воочию убедились, что хроматиновые нити несут на себе
образования типа бусин диаметром около 10-9 м. Р. Корнберг (Великобритания)
установил, что каждая такая «бусина» содержит отрезок ДНК длиной 150-200 пар
нуклеотидов и 8 молекул гистонов разных типов. Эта частица позже была названа
«нуклеосомой».
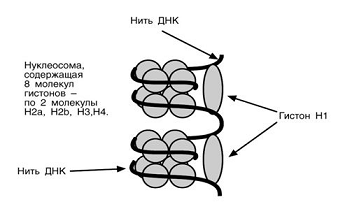
Нуклеосома представляет собой дисковидную
частицу с диаметром около 11 нм, содержащую по две копии каждого из
нуклеосомных гистонов ( Н2А , Н2В , Н3 , Н4 ). Гистоновый октамер образует
белковую сердцевину, вокруг которой дважды обмотана двуспиральная ДНК (146
нуклеотидных пар ДНК на гистоновый октамер).
Нуклеосомы, входящие в состав фибрилл,
расположены более или менее равномерно вдоль молекулы ДНК на расстоянии 10-20
нм друг от друга. В состав нуклеосом входят четыре пары молекул гистонов: H2a ,
H2b , H3 и H4 , а также одна молекула гистона H1 .
Полипептидные цепи гистонов содержат структурные
домены нескольких типов. Центральный глобулярный домен и гибкие выступающие N-
и С-концевые участки, обогащенные основными аминокислотами, получили название
плеч (arm). С-концевые домены полипептидных цепей, участвующие в
гистон-гистоновых взаимодействиях внутри кoровой частицы, находятся
преимущественно в виде альфа-спирали с протяженным центральным спиральным
участком, вдоль которого с двух сторон уложено по одной более короткой спирали.
Все известные места обратимых посттрансляционных модификаций гистонов,
происходящих на протяжении клеточного цикла или во время дифференцировки
клеток, локализованы в гибких основных доменах их полипептидных цепей ( табл.
I.2 ). При этом N-концевые плечи гистонов H3 и H4 являются самыми
консервативными участками молекул, а гистоны в целом - одними из наиболее
эволюционно консервативных белков. С помощью генетических исследований дрожжей
S. cerevisiae было установлено, что небольшие делеции и точковые мутации в
N-концевых частях генов гистонов сопровождаются глубокими и разнообразными
изменениями фенотипа дрожжевых клеток, что указывает на важность целостности
молекул гистонов в обеспечении правильного функционирования эукариотических
генов. В растворе гистоны Н3 и Н4 могут существовать в виде стабильных
тетрамеров (Н3)2(Н4)2, а гистоны Н2А и Н2В - в виде стабильных димеров.
Постепенное повышение ионной силы в растворах, содержащих нативный хроматин,
приводит к освобождению сначала димеров Н2А/Н2В, а затем тетрамеров Н3/Н4.
Уточнение тонкой структуры нуклеосом в
кристаллах было проведено в работе К. Люгера с соавт. (1997 г.) с помощью рентгеноструктурного
анализа высокого разрешения. Установлено, что выпуклая поверхность каждого
гистонового гетеродимера в составе октамера огибается сегментами ДНК длиной
27-28 п.о., расположенными по отношению друг к другу под углом 140 градусов,
которые разделены линкерными участками длиной в 4 п.о.
Пространственная структура ДНК в составе кoровых
частиц несколько отличается от B-формы: двойная спираль ДНК перекручена на
0,25-0,35 п.о./виток двойной спирали, что приводит к образованию шага спирали,
равному 10,2 п.о./виток (у В-формы в растворе - 10,5 п.о./виток). Стабильность
комплекса гистонов в составе кoровой частицы определяется взаимодействием их
глобулярных частей, поэтому удаление гибких плеч в условиях мягкого протеолиза
не сопровождается разрушением комплекса. N- концевые плечи гистонов,
по-видимому, обеспечивают их взаимодействие со специфическими участками ДНК.
Так, N-концевые домены гистона Н3 контактируют с участками ДНК на входе в
кoровую частицу и выходе из нее, тогда как соответствующий домен гистона Н4
связывается с внутренней частью ДНК нуклеосомы. Центральная часть сегмента ДНК
длиной в 121 п.о. в составе нуклеосомы образует дополнительные контакты с
гистоном H3. При этом N- концевые части полипептидных цепей гистонов H3 и H2B
проходят через каналы, образуемые малыми бороздками соседних супервитков ДНК
нуклеосомы, а N-концевая часть гистона H2A контактирует с малой бороздкой
внешней части супервитка ДНК. ДНК в составе коровых частиц нуклеосом огибает
гистоновые октамеры неравномерно. Кривизна нарушается в местах взаимодействия
ДНК с поверхностью гистонов, и такие изломы наиболее заметны на расстоянии
10-15 и 40 п.о. от центра супервитка ДНК.
.3 Нуклеомерный уровень компактизации ДНК
(Соленоидный)
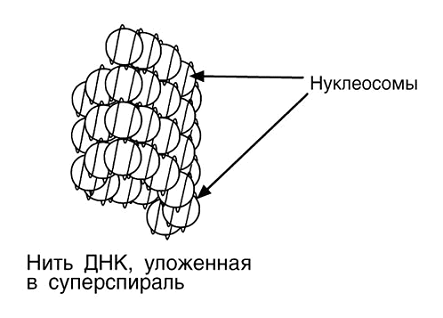
В живой клетке хроматин , вероятно, редко принимает
вытянутую форму "бусин на нитке". Наоборот нуклеосомы упаковываются
друг с другом с образованием регулярных структур более упакованной ДНК . Так,
на электронных микрофотографиях ядер после очень мягкого лизиса хроматин
выглядит как нити диаметром 30 нм, что существенно шире, чем форма хроматина в
виде "бусин на нитке". Предполагается, что хроматиновая нить в 30-нм
представляет собой спираль из нуклеосом, в которой на каждый оборот спирали
приходится шесть нуклеосом.
Относительно характера упаковки нуклеосом в
составе 30 нм фибриллы хроматина существует несколько точек зрения.
) Соленоидная модель. Цепь сворачивается в левую
спираль с шестью нуклеосомами на оборот. H1 локализован вдоль длинной оси 30nm
структуры, внутри её.
) Модель суперспирали. Аналогична соленоидной,
но H1, возможно, локализован на периферии или между нуклеосомами по всей длине
спирали.
) Кросс - линкерная модель. 10nm филаменты
сворачиваются, подобно мехам баяна, в зиг - заговую структуру, вдоль продольной
оси в виде двойной суперспирали. Нуклеосомы на периферии структуры, поперёк
продольной оси расположены линкерные участки.
) Ленточная модель. 10nm структура сложена в
ленту, которая закручена в суперспираль.
Одна из них защищает, т.н. соленоидный тип
укладки нуклеосом. Согласно этой модели, нить плотно упакованных нуклеосом
диаметром 10 нм образует в свою очередь спиральные витки с шагом спирали около
10 нм. На один виток такой суперспирали приходится 6 нуклеосом. В результате
такой упаковки возникает фибрилла спирального типа с центральной полостью,
которая иногда на негативно окрашенных препаратах бывает видна как узкий
«канал» в центре фибриллы. При частичном разворачивании, декомпактизации такой
фибриллы и нанесении ее на подложку хорошо видно «зигзагообразное» расположение
нуклеосом вдоль фибриллы. Считается, что гистон H1 обеспечивает взаимодействие
между соседними нуклеосомами, не только сближая и связывая их друг с другом, но
и обеспечивая кооперативную связь нуклеосом так, что образуется довольно
плотная спираль из 10 нм фибриллы. Удаление, даже частичное, гистона H1
вызывает переход 30 нм фибриллы в 10 нм фибриллу, а полное удаление его
вызывает разворачивание последней в структуру типа «бусин-на-нити». Такой
соленоидный тип упаковки ДНК приводит к плотности упаковки равной
приблизительно 40 (т.е. на каждый мкм нити приходится 40 мкм ДНК). Эти
представления получили подтверждение при анализе структуры хроматина с помощью
дифракции рентгеновских лучей и нейтронов. Здесь необходимо отметить, что
представление о соленоидном типе укладки получены из анализа вторично
конденсированного хроматина. Вначале были получены препараты хроматина в
присутствии ЭДТА или выделялись в растворах низкой ионной силы в присутствии
ионов магния. Во всех этих случаях первоначально хроматин деконденсировался до
уровня «бусин на нити», где отсутствует или дестабилизируется контакт между
нуклеосомами.
Если же исследовать хроматин в составе ядер или
в виде выделенных препаратов, но при поддержании определенной концентрации
двухвалентных катионов (не ниже 1мМ), то можно видеть дискретность в составе 30
нм фибрилл хроматина: она состоит как бы из сближенных глобул того же размера,
из нуклеомеров. В зарубежной литературе такие 30 нм глобулы или нуклеомеры
получили название сверхбусин («супербиды»). Было обнаружено, что если в
условиях, когда нуклеомерная структура фибрилл хроматина сохраняется, препараты
хроматина подвергнуть нуклеазной обработке, то часть хроматина растворяется.
При этом в раствор выходят частицы, имеющие размер около 30 нм с коэффициентом
седиментации равным 45S в растворах, содержащих 1 мМ магния. Если такие
выделенные нуклеомеры обработать ЭДТА, удалить ионы магния, то они
разворачиваются в нуклеосомные цепочки, содержащие 6-8 нуклеосом. Таким образом,
в состав одного нуклеомера входит отрезок ДНК, соответствующий 1600 парам
оснований или 8 нуклеосомам.
Компактность нуклеомера зависит от концентрации
ионов магния и наличия гистона H1. Негистоновые белки в конформационных
превращениях нуклеомеров не участвуют.
Таким образом основная 30 нм фибрилла хроматина
представляет собой линейное чередование нуклеомеров вдоль компактизованной
молекулы ДНК. Вероятно, что гистоны H1, находясь в центральной зоне этой
крупной частицы, взаимодействуя друг с другом, поддерживают ее целостность. В
пользу этого говорят данные о кооперативном связывании гистонов H1 в группе по
6-8 молекул.
Противоречие между соленоидной и нуклеомерной
моделью упаковки нуклеосом в составе фибрилл хроматина может быть снято, если
принять модель нерегулярного соленоида: число нуклеосом на виток спирали не
является строго постоянной величиной, что может привести к чередованию участков
с большим или меньшим числом нуклеосом на виток.
Нуклеомерный уровень укладки хроматина
обеспечивает 40 кратное уплотнение ДНК, что важно не только для достижения
целей компактизации гигантских молекул ДНК. Компактизация ДНК в составе 30 нм
фибрилл хроматина может налагать дополнительные функциональные ограничения. Так
было обнаружено, что в составе 30 нм фибриллы хроматина ДНК становится
практически недоступной для взаимодействия с таким ферментом как метилаза ДНК.
Кроме того резко падает способность хроматина связываться с РНК-полимеразой и
рядом регуляторных белков. Таким образом второй уровень компактизации ДНК может
играть роль фактора, инактивирующего гены.
Необходимо еще раз напомнить, что как
нуклеосомный, так и нуклеомерный (супербидный) уровни компактизации ДНК
хроматина осуществляются за счет гистоновых белков, которые участвуют не только
в образовании нуклеосом, но и в их кооперативном объединении в виде фибрилл
ДНП, где ДНК претерпевает дополнительную сверхспирализацию. Все остальные
уровни компактизации связаны с дальнейшим характером укладки 30 нм фибрилл в
новые компактизационные уровни, где ведущую роль играют негистоновые белки.
.4 Уровень гигантских петель
Расшифровка принципа строения элементарных
хромосомных компонентов - нуклеосом и 30 нм фибрилл - еще мало что дает для
понимания основ трехмерной организации хромосом, как в интерфазе, так и в митозе.
Сорокакратное уплотнение ДНК, которое достигается при сверхспиральном характере
ее компактизации, совершенно еще недостаточно для получения реального (1 х 104)
уровня уплотнения ДНК. Следовательно должны существовать более высокие уровни
компактизации ДНК, которые в конечном счете должны определять размеры и общие
характеристики хромосом. Такие высшие уровни организации хроматина были
обнаружены при искусственной его деконденсации, когда было найдено, что
поддержание их связано с негистоновыми белками. В этом случае специфические
белки связываются с особыми участками ДНК, которые в местах связывания образуют
большие петли или домены. Таким образом следующие более высокие уровни
компактизации ДНК связаны не с ее дополнительной спирализацией, а с образованием
поперечной петлистой структуры, идущей вдоль интерфазной или митотической
хромосомы.
Как уже указывалось, сложная структура ядра или
нуклеоида прокариот организована в виде иерархии петлевых доменов ДНК,
связанных с небольшим количеством специальных белков.
Петлевой принцип упаковки ДНК обнаруживается
также и у эукариотических клеток. Так если выделенные ядра обработать 2 М NaCI,
т.е. удалить все гистоны, то целостность ядра сохраняется, за исключением того,
что вокруг ядра возникнет т.н. «гало», состоящее из огромного числа петель ДНК.
Такая структура ядер получила название «нуклеоида» (это только
терминологическое сходство с ядерным аппаратом прокариот). Гало (или периферия
такого нуклеоида) состоит из огромного (до 50000) количества замкнутых на периферии
петель ДНК, со средним размером петель около 60 т.п.н., основание которых
закреплено где-то внутри ядра, на участках негистоновых белков. Тем самым
считается, что после удаления гистонов основания петлевых доменов ДНК, связаны
с т.н. «матриксом» или «скэффолдом» - негистоновым белковым остовом
интерфазного ядра. Оказалось, что участки ДНК, связанные с этим остовом, имеют
особое сродство к негистоновым белкам, их состав изучен, они получили название
MAR (matrix attachment region) или SAR (scaffold attachment region) участков.
Оказалось, что петлевые домены ДНК интерфазных
ядер можно выделить. В выделенных ядрах в присутствии двухвалентных катионов (2
мМ Ca++ ) в хроматине ядра выявляются небольшие сгустки величиной около 100 нм,
т.н. хромомеры. Если такие хромомеры препаративно выделить, а затем
экстрагировать из них гистоны, то под электронным микроскопом можно видеть
розетковидные петлистые структуры, где отдельные петли отходят от центрального
плотного участка. Количество петель в такой розетке может составлять 15-80, а
общая величина ДНК может достигать 200 т.п.н., с суммарной длиной ДНК до 50
мкм. Обработка таких розеток протеиназами приводит к исчезновению плотной
центральной области розетки и к разворачиванию петель ДНК.
Признаки петлевой доменной организации хроматина
можно наблюдать с помощью электронного микроскопа после помещения ядер или
хромосом в солевые растворы низкой ионной силы (0,01 М NaCI) в присутствии
низких концентраций двухвалентных катионов ( 1 мМ). В этих условиях не
происходит депротеинизации хроматина, он сохраняет свою нормальную химическую
композицию, но значительно разрыхляется и представлен стандартными фибриллами
толщиной 30 нм. При этом в некоторых местах можно видеть, что отдельные сгустки
конденсированного хроматина выявляют особую структуру. Это - розетковидные
образования, состоящие из многих петель30 нм фибрилл, соединяющихся в общем
плотном центре. Средний размер таких петлистых розеток достигает 100-150 нм.
Подобные розетки фибрилл хроматина - хромомеры - можно видеть в ядрах самых
разнообразных объектов, животных, растений, простейших.
Особенно демонстративно такие хромомеры
выявляются на тотальных препаратах хроматина из макронуклеусов инфузории
Bursaria. В этом случае можно видеть, что каждый хромомер состоит из нескольких
содержащих нуклеосомы петель, которые связаны в одном центре. Хромомеры связаны
друг с другом участками нуклеосомного хроматина, так что в целом видна цепочка
розетковилных структур.
Сходные картины можно наблюдать при разрыхлении
политенных хромосом. Здесь хромомеры в виде розеток хроматина выявляются в
зонах хроматиновых дисков, в то время как междисковые участки их не содержат.
При деконденсации хроматина ядер некоторых растений (Allium, Haemantnus,
Vicia), для которых характерна особая структура интерфазных ядер, хромомеры
видны в составе хромонемных нитей.
Подобные розетковидные петлистые структуры,
хромомеры, можно видеть также при разрыхлении и митотических хромосом как
животных, так и растений. Следовательно, хромосомные 30 нм фибриллы, состоящие
из ДНК и гистонов, упаковываются в виде петлистых розетковидных структур,
претерпевая еще дополнительную компактизацию. Это третий уровень структурной
организации хроматина, как считается, может приводить уже к 600-кратной
компактизации ДНК.
Важно отметить, что размер отдельных петлевых
доменов совпадает с размером средних репликонов и может соответствовать одному
или нескольким генам. В своих основаниях петли ДНК связаны негистоновыми
белками ядерного матрикса, в состав которых могут входить как ферменты
репликации ДНК, так и транскрипции. Такая петельно-доменная структура хроматина
обеспечивает не только структурную компактизацию хроматина, но и организует
функциональные единицы хромосом - репликоны и транскрибируемые гены. Комплекс
белков, участвующих в такой структурно-функциональной организации хроматина,
относится к белкам ядерного матрикса.
.5 Хромонемный уровень компактизации ДНК
Хромонема (др.-греч. чсῶмб
- цвет и нЮмб - нить) - это спиральная структура, которую удаётся увидеть в
декомпактизованных митотических хромосомах в световой микроскоп.
Еще в классических работах цитологов начала ХХ
века как в интерфазных ядрах, так и, особенно, в митотических хромосомах
описывались нитчатые структуры - хромонемы, имеющие толщину 0,1-0,2 мкм. Их
удавалось наблюдать как на фиксированных объектах, так и в живых клетках.
Подробные исследования ультраструктуры митотических хромосом на разных этапах
митоза с помощью электронной микроскопии полностью подтвердило наличие этого
четвертого уровня компактизации хроматина.
При изучении ультраструктурных основ строения
митотических хромсом необходимо учитывать хромонемный уровень компактизации
хроматина. Хромонему - нитчатую хроматиновую структуру со средней толщиной
0,1-0,2 мкм удается проследить в естественных условиях на разных стадиях
начальной конденсации хромосом в профазе митоза и при деконденсации хромосом в
телофазе. Причем такие хромонемы выявляются как в клетках растений, так и
животных.
Изучение профазных хромосом как животных, так и
растений показывает, что процесс конденсации хромосомного материала включает в
себя промежуточный этап - образование из фибрилл ДНП нитчатых хромонемных
структур, являющихся единицей последующей хромосомной структуризации.
В естественных условиях в составе метафазных
хромосом хромонемные элементы на ультратонких срезах не выявляются. Но по мере
деконденсации митотических хромосом в поздней анафазе и ранней телофазе снова
можно видеть признаки хромонемной организации хромосом. В поздней анафазе,
когда хромосомы достигают противоположных полюсов клетки, в их структуре снова
выявляются хроматиновые нитчатые образования с толщиной 0,2 мкм. При этом вся
структура хромосом разрыхляется, что отражает начало общей деконденсации
митотических хромосом. Эта начальная стадия деконденсации связана не с
разрыхлением фибрилл ДНП внутри хромонем, а с расхождением, обособлением
участков хромонемы друг от друга. Особенно заметным и выраженным этот процесс
становится в телофазе. В это время хромосомы начинают увеличиваться в объеме,
при этом расстояние между отдельными участками хромонемы также возрастает. В
расположении отдельных нитей хромонемы, так же как и в профазных хромосомах,
улавливаются признаки спиральности в их укладке: часто видны кольчатые или
петлистые незамкнутые участки, иногда располагающиеся параллельно друг другу.
Спиральность хромонемы в составе митотических хромосом удается наблюдать в ряде
случаев при частичной искусственной деконденсации выделенных митотических
хромосом. В поздней телофазе хромосомы уже полностью окружены ядерной оболочкой.
Хромонемные элементы расходятся на значительные расстояния, но все же зоны
отдельных хромосом еще выявляются. В это время некоторые участки хромонем
начинают разрыхляться, их толщина взрастает. Таким образом, наблюдая за
состоянием структуры и расположением хромонемных участков в ядрах и хромосомах
в телофазе, можно видеть картину, обратную той, что наблюдалась в профазе:
разрыхление хромосом за счет первоначального расхождения участков хромонемы и
последующего их разрыхления, деконденсации самих хромонем.
Ультраструктурная организация хромонемного
уровня упаковки ДНП хорошо выявляется при постепенном экспериментальном
разрыхлении хромосом при понижении концентрации двухвалентных катионов.
Оказалось, что плотное тело митотических хромосом сначала разрыхляется так, что
выявляется его хромонемная организация: на срезах видно, что хромосомы
представлены сечениями толстых (0,1-0,2 мкм) хромосомных нитей, хромонем.
Затем, при последующем снижении концентрации двухвалентных катионов, происходит
как бы распад хромонемных элементов на множество линейно расположенных
глобулярных блоков хроматина с диаметром около 0,1-0,2 мкм. В дальнейшем эти
блоки (хромомеры) начинают деконденсироваться: на их периферии видны петли
фибрилл ДНП, а в центре остается тело хромомера. Возникает розеткоподобная
структура. Важно отметить, что расположение зон с розеткоподобными хромомерами
совпадает с рисунком G-бэндирования хромосом. По мере дальнейшей деконденсации
петли увеличиваются в длину, а центральные участки хромомеров прогрессивно
уменьшаются. При полной деконденсации все тело хромосомы представлено на срезах
равномерно расположенным фибриллами ДНП. Надо отметить, что в современных
молекулярно биологических исследованиях строения хромосом хромонемный уровень,
как один из высших уровней упаковки ДНП, совершенно выпадает из поля зрения
исследователей. Лишь в последнее время некоторые исследователи на основании
косвенных данных приходят к выводам о наличии в интерфазных ядрах
хромонемо-подобных структур.
В настоящее время вопрос о способе укладки
хромонемы в составе митотической хромосомы остаётся нерешённым.
Общее "укорочение" нити ДНК составляет
10 000 раз. Чем обеспечивается этот уровень компаумзации пока не совсем
понятно. Метафазная хромосома уже удвоена. Она состоит из двух хроматид. Каждая
из них содержит одну молекулу ДНК. Сюда входят белки ядерной ламины, серия
белковых нитей, сопряженных с ядерной оболочкой и пронизывающих все ядро.
Заключение
хромосома гистон компактизация
нуклеомерный
Мы рассмотрели основные уровни компактизации
ДНК, их строение, пространственную организацию и функциональное значение для
живых организмов.
Чрезвычайно важное значение для понимания
механизмов функционирования ДНК имеет вопрос об организации пространственных
структур ДНК, составляющих основу хромосом (базовых ДНК).
Характернейшая особенность базовых ДНК -
многократная снирализация их молекул (скручивание, складывание в жгутовидные
структуры). Можно считать доказанным, что степень и форма спирализации
(компактизации) ДНК предопределяются биохимическими и физическими параметрами
клеточной среды, хотя определенное значение имеют первичная структура и
нуклеотидный состав молекулы нуклеиновой кислоты.
Список использованной литературы
1.
Смирнов А. Ф. Структурно-функциональная организация хромосом. - СПб:
Нестор-История, 2009. - 204 с
.
Молекулярная биология клетки: в 3-х томах / Б. Альбертс, А. Джонсон, Д. Льюис и
др. - М.-Ижевск: НИЦ «Регулярная и хаотическая динамика», Институт компьютерных
исследований, 2013. - Т. I. - С. 309-336. - 808 с
.
Рубцов Н. Б. Хромосома человека в четырех измерениях // Природа. - 2007. - № 8.
- С. 3-10
.
Рубцов Н. Б. Организация хромосом: 70 лет спустя // Природа. - 2012. - № 10. -
С. 24-31.
.
Разин С. В. Хроматин: упакованный геном / С. В. Разин, А. А. Быстрицкий. - М.:
БИНОМ: Лаборатория знаний, 2009. - 176 с.
.
Ченцов Ю. С., Бураков В. В. Хромонема - забытый уровень укладки хроматина в
митотических хромосомах // Биологические мембраны. - 2005
7.
http://neobio.ru/content/view/35/24/
.
http://mirgenetiki.ru/sinteticheskaya-teoriya/urovni-organizacii-dnk/