Электролитическое рафинирование меди
Министерство
образования и науки Российской Федерации
Государственное
образовательное учреждение
высшего
профессионального образования
Южно-Уральский
государственный университет
Филиал в г.
Кыштым
Кафедра
Металлургии
Пояснительная
записка к выпускной квалификационной работе
Электролитическое
рафинирование меди
Руководитель работы
проф., докт. техн. Наук
Е.И. Елисеев
Автор работы
студент группы КД-494
С.С. Петров
Кыштым 2009
Задание на выпускную квалификационную работу
Студента Ивановой Марины Михайловны
Группа КД-494
. Тема работы "Электролитическое рафинирование меди" утверждена
приказом по университету от "___"__________ 2009 г.
. Срок сдачи студентом законченного проекта работы 3 июня 20091.
. Исходные данные к работе:
данные производственной практики
отчеты о научно-исследовательских работах
материалы периодической печати (журналы "Цветная металлургия",
"Цветные металлы").
. Содержание пояснительной записки (перечень подлежащих разработке
вопросов):
краткие теоретические основы процесса электролитического рафинирования
меди;
металлургический расчет с выполнением материального и теплового балансов;
расчет основных характеристик металлургического оборудования и выбор
вспомогательного оборудования;
экономическая часть работы с составлением калькуляции себестоимости
продукции и расчетом фонда заработной платы отделения (цеха);
охрана труда.
. Перечень графического материала (с точным указанием обязательных
чертежей)
технологическая схема отделения (цеха),
чертеж основного металлургического агрегата,
чертеж наиболее важных элементов агрегата
план отделения (цеха) с расположением оборудования
таблица основных технико-экономических показателей производства
Всего 5 листов формата А1.
. Консультанты по работе с указанием относящихся к ним разделов
|
Раздел
|
Консультант
|
Подпись, дата
|
|
|
Задание выдал
|
Задание принял
|
|
Экономика
|
Двойнишникова О.Н.
|
|
|
|
Охрана труда
|
Логунова Э.Р.
|
|
|
|
Технология
|
Елисеев Е.И.
|
|
|
. Дата выдачи задания "___" _____________ 2009 г.
Руководитель _________________(Е.И. Елисеев)
Задание принял к исполнению ___________________ (М.М. Иванова)
Аннотация
Иванова М.М. КД-494. Электролитическое рафинирование меди. - Кыштым:
Филиал ЮУрГУ; 2009. 74 с. 9 ил. Библиография литературы - 16 наименований, 6
листов чертежей ф. А1.
Выпускная квалифицированная работа посвящена технологии рафинирования
меди в условиях цеха электролиза меди ЗАО "Кыштымский медеэлектролитный
завод".
Пояснительная записка содержит расчет основных показателей
электролитического рафинирования анодной меди с использованием безосновной
технологии для ЗАО "КМЭЗ". Составлены материальный, электрический и
тепловой балансы. Рассчитаны основные характеристики оборудования. Технические
расчеты выполнены на основе практических данных.
Экономический расчет выполнен по реальным ценам и нормам. Показана
эффективность безосновной технологии производства катодной меди.
В работе рассмотрены вопросы безопасности и экологичности производства.
Оглавление
Введение
.
Теоретическая часть
1.1
Физико-химические основы электролиза
1.1.1
Поведение анодов при электролизе
1.1.2
Пассивное состояние металлов
1.1.3
Перепассивация металлов
.1.4
Зарождение и рост кристаллов на катоде
1.2
Электролиз водных растворов
1.2.1
Электролиз с растворимым анодом
1.2.2
Электролиз с нерастворимым анодом
.3 Основные
сведения по безосновной технологии
2.
Технологическая часть
2.1
Технологическая схема участка электролиза меди
.2
Конструкция электролизера
.3 Параметры
работы электролизных ванн
.3.1 Состав
электролита
.3.2
Температура электролита
.3.3
Циркуляция электролита
.3.4
Плотность тока
.3.5
Межэлектродное расстояние (МЭР)
.3.6 Исходные
данные
.3.7 Размеры
электролизера
.4
Материальный баланс электролизной ванны
.4.1 Свойства
электролита
.5
Электрический баланс электролизной ванны
2.6 Тепловой
баланс электролизной ванны
2.6.1 Статьи
прихода тепла
.6.2 Статьи
расхода тепла
.7 Выбор
оборудования
3.
Экономическая часть
.1 Расчет
стоимости производственных фондов
3.1.1
Производственная мощность объекта и ее использование
.1.2 Расчёт
потребного количества оборудования
.1.3 Расчет
стоимости производственных площадей
.1.4 Полный
расчет стоимости производственных фондов
3.2
Определение численности основных производственных рабочих
3.3 Расчет
фонда заработной платы
.4 Расчет
себестоимости изготовления катода
3.5 Расчет
экономической эффективности и срока окупаемости проектируемого технологического
процесса
4.
Безопасность и экологичность производства
4.1
Опасности, присутствующие при работе в цехе электролиза
4.1.1
Характеристика веществ, используемых при работе в цехе электролиза меди
.1.2
Электробезопасность
.1.3
Опасности, связанные с перемещением грузов
.2 Вентиляция
.3 Освещение
помещений
4.4 Пожарная
безопасность
4.5
Экологичность производства
.6
Чрезвычайные ситуации
Заключение
Библиографический
список
Введение
Производства, в основе которых лежит электроосаждение меди, занимают на
медеэлектролитных предприятиях особое место. Это связано с тем, что
электролитическое рафинирование позволяет не только получать медь с минимальным
содержанием примесей, обладающую высокой электропроводностью, но и извлечь
благородные и редкие металлы (Аu, Аg, Se, Те) из черновой меди.
Электролитическое получение меди было одним из первых освоенных
гидроэлектрометаллургических процессов. По объему производства, числу
действующих предприятий и степени изученности электролитическое получение меди
в настоящее время занимает ведущее место в гидрометаллургии. Среди цветных
металлов медь уступает по уровню потребления только алюминию.
Широкое применение меди в промышленности обусловлено низким электросопротивлением
и хорошей теплопроводностью этого металла, что связано с низким содержанием
различных примесей (Fе, Ni, Аs, Sb и др.). Вследствие этого более 50% всей
меди, являющейся одним из лучших проводников электрического тока, лишь немного
уступает серебру, расходуется электротехнической и радиотехнической
промышленностью.
Большое техническое применение получили сплавы меди с Zn, Sn, Al, Si, Рb,
Ве, Ni, Мn (латуни, бронзы, мельхиор, нейзильбер и др.), которые придают
изготавливаемым изделиям необходимую коррозионную стойкость и хорошую
теплопроводность. Распространено также применение меди в качестве легирующей
добавки в сплаве на алюминиевой основе. Сплавы меди с фосфором (6-8%)
используют в качестве припоев.
Всем требованиям, предъявляемым к металлу промышленностью, вполне
удовлетворяет медь, полученная путем электролитического рафинирования.
Прочность меди на разрыв, вязкость и другие механические свойства,
имеющие решающее значение при обработке, зависят от качества примесей. Удаление
вредных примесей из меди - основная задача электролитных цехов.
Электролитическая медь идет на производство кабелей. Проводов и других
изделий, применяемых в электротехнике. Прессованные и кованные изделия высокого
качества, медные сплавы - также изготавливаются из электролитической меди.
Высокая электропроводность в соединении с большой пластичностью и
хорошими механическими свойствами определяют применение меди в машиностроении.
Потребителями меди являются также гальванотехника, сельское хозяйство (для
борьбы с вредителями растений в виде микроудобрения), металлургическая
промышленность.
1. Теоретическая часть
.1 Физико-химические основы электролиза
.1.1 Поведение анодов при электролизе
При электролизе растворов солей цветных металлов в целях их
электроизвлечения или электрорафинирования применяют растворимые и
нерастворимые аноды, материал которых выбирают в соответствии с требованиями,
предъявляемыми к составу и чистоте катодных осадков.
На аноде могут протекать следующие реакции:
1) ионизация металла
Ме - 2е = Ме2+; (1)
) образование оксида металла
Ме + Н2О - 2е = МеО + 2Н+; (2)
3) выделение кислорода
ОН- - 4е = О2 + 2Н2О (3)
Н2О - 4е = О2 + 4Н+; (4)
) перезарядка ионов с повышением их валентности
Ме2+ - пе = Ме(2+n)+; (5)
5) окисление анионов
2Сl- - 2е = С12, (6)
S2- - 2е = S, (7)
S2- + 4H2O - 8е = SO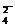 + 8Н+. (8)
+ 8Н+. (8)
Эти реакции протекают при различных потенциалах, либо в зависимости от
конкретных условий процесса (материал электрода, состав электролита, его рН,
присутствие ПАВ и т.д.) одновременно при одном потенциале. Ионизация металлов,
как правило, протекает с достаточно большой скоростью, подобно разряду ионов
этих металлов на катоде, и диффузия катионов от поверхности анода вглубь
электролита определяет скорость электродной реакции, а увеличение анодной
поляризации ∆Еа не сопровождается установлением предельного тока
диффузии.
Кинетика анодного растворения металлов определяется скоростью отвода
ионов от поверхности металла в объем электролита, зависящей от гидродинамических
условий и концентрации ионов металла у анода и в растворе; она часто
осложняется образованием на поверхности анода малорастворимых осадков,
гидроксидов и солей металлов.
Увеличение анодной поляризации металла увеличивает скорость его
растворения и сопровождается увеличением концентрации катионов в приэлектродном
слое. Когда скорость диффузии меньше скорости ионизации металла, нарастает
прианодная концентрация соли, вплоть до пересыщения раствора и ее
кристаллизации на поверхности анода. Если слой выделяющейся соли сплошной, то
анод оказывается изолированным от электролита, что сопровождается резким
возрастанием омического сопротивления участка цепи "анод-электролит",
уменьшением плотности тока и прекращением растворения металла.
При этом смещение потенциала анода в положительную сторону может быть
настолько значительным, что оказывается возможным окисление отдельных анионов
электролита и нейтральных молекул растворителя. Механизм ионизации анода
зависит от величины приложенного потенциала. Поскольку в анодном процессе могут
принимать участие молекулы растворителя, а окисление металла возможно до
различной степени окисления, металл может ионизироваться в активном, пассивном
и транспассивном состояниях.
Скорость анодного растворения металла в активном (незапассивированном)
состоянии определяется уравнением
= iо exp [βF∆E / (R - T)], (9)
где iо - ток обмена; β - число переноса; F - постоянная
Фарадея; ∆Е - перенапряжение; R - универсальная газовая постоянная; Т -
температура, и зависит от ионного состава раствора, его рН, присутствия
комплексов, состояния поверхности растворяющегося металла, наличия на ней
ингибирующих соединений.
Если в отдельных стадиях процесса анионы определяют скорость ионизации,
то концентрацию анионов учитывают в кинетическом уравнении. Например, ионизация
никеля в сульфатных растворах происходит по схеме:
+ ОН- = Ni (ОН)-адс, (10)+ (ОН)-адс - е = Ni (ОН)адс, (11)(ОН) адс + НSO4
- е = NiSO4 + Н2О, (12)
где реакция (12) является лимитирующей стадией, и в этом случае уравнение
скорости ионизации включает концентрационную компоненту
= К · [ОН-] · [НSO4-] - ехр [βF∆Е/(R - T)] (13)
В общем случае анодное растворение металла включает те же основные
стадии, что и его катодное восстановление, но протекающие в обратном порядке.
При этом образование многозарядных ионов включает несколько последовательных
одноэлектронных электрохимических промежуточных реакций, каждая из которых
протекает со все большим перенапряжением по сравнению с предыдущей.
Ионизация металла происходит в определенном порядке: в первую очередь в
реакции участвуют группы атомов с повышенной свободной энергией (активные
центры), которые составляют незначительную часть поверхностного слоя анода
(10-1 … 10-5%). Процесс протекает тем быстрее, чем больше активных центров
имеет поверхность анода и чем больше дефектов в его кристаллической решетке.
.1.2 Пассивное состояние металлов
Поверхность металла является пассивной (инертной), если она не
подвергается воздействию среды, хотя при данных условиях металл
термодинамически нестабилен. Наступление пассивности сопровождается
самопроизвольным возрастанием поляризации на аноде при одновременном уменьшении
прохождения тока через электрическую цепь. В пассивном состоянии металлы
проявляют иные физико-химические свойства, чем в активном: пассивное железо не
вытесняет медь из раствора ее солей; пассивный ром растворяется с образованием
ионов 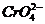 (активный - с образованием ионов
Cr3+) и т.д.
(активный - с образованием ионов
Cr3+) и т.д.
Пассивирование металлов обусловлено появлением на их поверхности химически
связанного кислорода. Механизм пассивации имеет пленочную природу, в
соответствии с которой торможение анодного растворения металла обусловлено
образованием на поверхности металлов солевых, оксидных и гидроксидных
твердофазных пленок. Такие пленки часто появляются при потенциалах анода,
соответствующих электроду второго рода; они малорастворимы и термодинамически
устойчивы. По морфологический свойствам различают пленки:
) рыхлые, пористые, с незначительным электрическим сопротивлением. Они
появляются в результате кристаллизации малорастворимого осадка и достигают
значительной толщины (до 1 мм), например галогениды меди, серебра; сульфаты
свинца, никеля, железа; оксиды кадмия, цинка и др;
2) сплошные, плотные, беспористые, с большим электрическим сопротивлением
(106 Ом/см2); их толщина составляет около10-4 см. После их
возникновения (например, на алюминии, тантале и др.) ионизация анода резко
затрудняется либо прекращается.
Пассивирующий оксид является либо продуктом электрохимической реакции:
Ме + mН2О - 2mе = МеnОm + 2mH+, (14)
либо продуктом химического взаимодействия металла с окислителем. Подобные
пленки защищают металл от дальнейшего глубокого окисления. Иногда в пассивном
состоянии, благодаря повышению анодного потенциала, развиваются другие анодные
процессы - выделение кислорода, перезарядка ионов и т.д. - аналогично тому, как
они протекают на полностью нерастворимых (например, платиновых) анодах. Это
обусловлено способностью тонких пленок оксидов многих металлов проявлять
электронную проводимость. Критерии образования защитной пленки:
) объем оксида должен быть не меньше объема металла, пошедшего на его
образование;
2) пленка должна быть однородной и иметь высокую адгезию к металлу.
Потенциал анода, выше которого на нем начинается образование оксидного
слоя и переход в пассивное состояние, называют "критическим"
потенциалом (потенциал максимума поляризационной кривой - рис. 1).
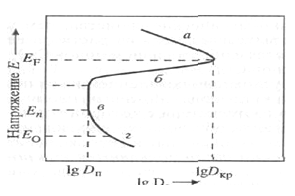
Рисунок 1 - Анодная поляризационная кривая, характеризующая переход
металла в пассивное состояние
а - активная область; б - область перехода от активного состояния к
пассивному: в - область пассивации; г - область анодного выделения кислорода Е
F - критический потенциал; Ео - потенциал выделения кислорода
Величина критического потенциала зависит от природы анодного металла,
состава электролита, его концентрации, температуры раствора. В пассивном
состоянии ток пассивации со временем уменьшается, что связано с увеличением
толщины пленки; в раствор переходят поверхностные катионы оксидного слоя, а
ионы кислорода или гидроксида мигрируют через пленку к металлу, что делает
такой электрод подобным электроду второго рода.
Если потенциал пассивности Еп, соответствующий наступлению пассивного
состояния металла линейно зависит от рН раствора
Еп = соnst - 0,0002·T · рН, (15)
то причиной возникновения пассивности являются кислородные образования.
При этом повышение рН сдвигает Еп в электроотрицательную сторону, т.е.
облегчает переход металла в пассивное состояние (за исключением металлов,
оксиды которых амфотерны). В соответствии с адсорбционной теорией пассивности,
пассивное состояние металлов обусловлено образующимся на поверхности металла
мономолекулярным слоем адсорбированного кислорода, что увеличивает работу
выхода иона металла в раствор. При этом кислород адсорбируется только на
активных участках поверхности металла. Таким образом, явление пассивности
металлов состоит в повышении перенапряжения процесса ионизации металлов
вследствие изменения заряда и свойств поверхности металлов, вызванных образованием
на ней адсорбционных или фазовых слоев оксидов.
Пассивацию цветных металлов в кислых водных средах связывают со
специфической адсорбцией кислорода воды на поверхности этих металлов, которая
происходит в несколько стадий: сначала образуется поверхностный
Ме + nH2O = МеО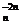 + 2nН+, (16)
+ 2nН+, (16)
а затем протекает электрохимическая стадия
МеO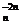 - mе = МеО
- mе = МеО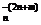 (17)
(17)
В зависимости от типа пассивации анода выбирают условия для возвращения
его в активное состояние.
Солевую пассивность устраняют перемешиванием электролита и повышением
температуры; пассивность, обусловленную образованием кислородсодержащих пленок,
устраняют введением депассиваторов (например, хлорид-ионов), препятствующих
образованию кислородного "барьера".
.1.3 Перепассивация металлов
Если при увеличении анодного потенциала пассивирующий оксид может быть
далее окислен с образованием растворимого соединения, то металл вновь начинает
растворяться, но с образованием ионов высшей валентности - наступает
перепассивация металла.
Это явление характерно для анодного растворения хрома, никеля, железа и
их сплавов, например:
СrО3 + 4Н2О - 6е = Сr2O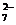 + 8H+ (18)
+ 8H+ (18)
Пассивное состояние металла нарушается и при наложении на него катодного
тока или под действием восстановителя или ионов, вызывающих растворение
оксидной пленки: галогенид-ионов, СlO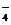 , ОН
, ОН , SO
, SO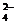 . Действие этих анионов связывают с
образованием соединений с металлом, в которых они вытесняют кислород или
гидроксид из пассивирующего фазового оксидного или адсорбционного слоя,
образуют на поверхности с металлом адсорбированный комплекс, который легко
теряет связь с основной массой металла и переходит в раствор.
. Действие этих анионов связывают с
образованием соединений с металлом, в которых они вытесняют кислород или
гидроксид из пассивирующего фазового оксидного или адсорбционного слоя,
образуют на поверхности с металлом адсорбированный комплекс, который легко
теряет связь с основной массой металла и переходит в раствор.
Пассивное состояние металла устраняется также вследствие механического
нарушения защитной пленки, приводящего к образованию микрогальванического
короткозамкнутого элемента из обнаженного активного участка металла (анод) и
оксида этого металла (катод). В процессе работы этого элемента происходит
анодное растворение металла и катодное восстановление оксидной пленки с
образованием гидратированных ионов металла промежуточной степени окисления.
.1.4 Зарождение и рост кристаллов на катоде
Образование и рост электролитических осадков определяются скоростями
одновременно протекающих процессов: появления новых центров кристаллизации и
роста ранее образовавшихся кристаллических зародышей. Если скорость первого
процесса больше, чем второго (вследствие замедленной электрохимической стадии
или транспортировки вещества к электроду), получаются мелкокристаллические
осадки; при обратном соотношении скоростей осадки становятся крупнокристаллическими.
Лимитирующей стадией электроосаждения цветных металлов является образование
двух- и трехмерных кристаллов, подчиняющееся закономерностям фазового
перенапряжения. Поскольку рост кристалла происходит на наиболее активных
участках кристаллической решетки, увеличение поляризации катодного процесса
приводит к возникновению новых центров кристаллизации и образованию осадка с
мелкокристаллической структурой, поэтому на структуру осадка можно влиять
изменением величины поляризации. Структура осадка также становится
мелкокристаллической, если, не изменяя плотности тока, уменьшать концентрацию
осаждаемого металла в электролите, так как концентрация разряжающихся частиц
определяет величину предельного диффузионного тока.
Структура катодных осадков характеризуется внешней формой, внутренним
строением и кристаллографической ориентацией и определяет его важнейшие
металлофизические свойства. По внешней форме осадки делят на монокристаллы,
дендриты, порошковые и сплошные. Внутреннее строение включает в себя взаимное
расположение, форму, размеры и сцепление зерен осадка в кристаллическом
агрегате, тип и концентрацию в кристаллах различных дефектов и включений.
Кристаллографическая ориентация характеризует преимущественное направление оси
в зернах осадка относительно подложки.
На структуру катодного осадка также влияет состояние поверхности подложки
и ее структура, которую некоторые металлы (Сu, Аg, Zn) способны воспроизводить,
если различия в значениях постоянной решеток осаждаемого металла и подложки не
превышают 15%. При этом непосредственно у поверхности подложки образуется
большое количество мелких кристаллов; часть из них в процессе электролиза
растет и в направлении, параллельном поверхности подложки, приобретая форму
геометрически правильных твердых тел, формирующих окончательную структуру
осадка.
Различие в скоростях роста граней кристалла, в том числе вызванное
адсорбцией на них вводимых ПАВ, вызывает преимущественную ориентацию кристаллов
на растущем катоде, что формирует текстуру осадка.
Существенно влияют на структуру и рост кристаллов неорганические
примеси-катионы, способные соосаждаться на катоде совместно с извлекаемым
металлом. Например, примеси меди и цинка (0.01-0.1 г/дм3) ухудшают
качество никелевого осадка, а примесь кадмия положительно влияет на него,
сглаживая поверхность. Влияние примесей на электрокристаллизацию сводится:
) к затруднению подхода ионов металла к поверхности, наблюдаемому в
присутствии коллоидов и суспензий, вследствие образования пленок на электродах.
Это существенно уменьшает предельный диффузионный ток;
) к торможению разряда вследствие комплексообразования между ионами
металла и молекулами примеси;
) к вхождению адсорбированных атомов металла в кристаллическую решетку
осадка, затрудняющему поверхностную диффузию анионов, что влияет на кинетику
образования зародышей металла.
Органические вещества оказывают наибольшее воздействие на
электрокристаллизацию, сопровождающееся некоторым улучшением качества
поверхности осадка и увеличением поляризации; при этом перенапряжение тем
больше, чем крупнее молекулы добавки и чем больше в ней ненасыщенных
электронных связей. С увеличением плотности тока и увеличением отрицательного
заряда катода органические примеси катионного типа оказывают более заметное
влияние, чем примеси анионного типа, что проявляется в увеличении шероховатости
осадка. Это связывают с торможением преимущественно зародышеобразования в
присутствии добавок, чем роста зародышей, что приводит к увеличению размеров
кристаллов. При этом органическое вещество включается в состав осадка, и его
концентрация в растворе уменьшается по мере электролиза.
Как правило, с уменьшением тока обмена осаждаемого металла действие
органической примеси становится более заметным.
Нарушение поверхности катодного осадка (шишки, дендриты) связывают с
присутствием в электролите взвешенных частиц анодного шлама, коллоидов, с
образованием оксидных и жировых пленок. Все это приводит к экранированию части
катода и нарушению нормального роста кристаллов.
При благоприятных условиях роста размеры кристаллов увеличиваются по мере
электрокристаллизации, но если электролиз прервать и возобновить спустя
некоторое время, на катоде вновь зарождается много мелких кристаллов. При
выключении тока примеси блокируют активные центры роста осадка, и новое включение
тока сопровождается увеличением перенапряжения, что вызывает образование новых
зародышей на запассивированной поверхности.
На структуру и величину кристаллов влияет природа соли электролита,
поскольку она определяет в значительной степени величину поляризации. Если в
момент зарождения новой фазы поляризация достаточно велика, металл может
выделиться и в аморфном состоянии, поскольку энергия образования зародышей
аморфной фазы выше, чем кристаллической.
.2 Электролиз водных растворов
.2.1 Электролиз с растворимым анодом
Анодная медь содержит значительные количества примесей, %: 0.1 … 0.3 Ni;
0.005 … 0.1 S; 0.006 … 0.2 Sb; 0.007 … 0.2 Аs; 0.0015 … 0.01 Вi; 0.013 …0.1 Рb;
до 0.15 Sе + Те. до 0.1 Аu + Аg.
В процессе анодного растворения меди образуются ионы Сu2+ и Сu+:
Сu - 2е = Сu2+, Е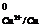 = + 0.34 В, (19)
= + 0.34 В, (19)
Сu - е = Сu+, Е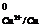 = + 0.51 В, (20)
= + 0.51 В, (20)
Сu+ - е = Сu2+, Е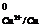 = + 0.17 В, (21)
= + 0.17 В, (21)
между которыми устанавливается равновесие в соответствии с реакцией
СuSO4 + Сu ↔ Сu2SO4 (22)
Однозарядные ионы меди нестойки, они тотчас диспропорционируют, выделяя
мелкодисперсную медь:
Сu+ = Сu2+ + Сu (23)
Константа равновесия этой реакции равна
К = аCu2+/(аCu+)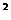 = 1.5·10
= 1.5·10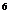 (24)
(24)
т.е. концентрация иона Сu+ почти в 106 раз меньше, чем иона Сu2+ и
соответствует уравнению:
+ = E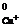 + 0,0002 · T · lga
+ 0,0002 · T · lga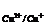 (25)
(25)
Пропускание тока через медный анод сопровождается в первую очередь
реакцией с наиболее электроотрицательным потенциалом; дальнейшая поляризация
анода, возникающая по мере увеличения плотности тока, смещает его потенциал в
положительную сторону, что может вызвать образование ионов иной степени
окисления. Потенциал медного анода может увеличиваться и в результате
накапливания на нем шлама, затрудняющего диффузию. Электрическое сопротивление
шлама в течение периода растворения анода может возрасти от 0,1 до 21,4% от
общего сопротивления ванны. При умеренных плотностях тока на медном аноде
невозможно попутное окисление
2Н2O - 4е = O2 + 4H+, Е° = 1,23 В (26)
или тем более сульфат-ионов:
SO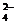 - 2е = S2O
- 2е = S2O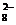 , Е° = 2,05 В, (27)
, Е° = 2,05 В, (27)
но при высокой поляризации на аноде отмечено выделение кислорода. При
электрорафинировании меди анодный выход по току всегда немного больше
катодного; иногда он превышает 100%. Это связано с механическим разрушением
(выкрашиванием) анода и переходом его в шлам в виде металлических частиц, с
химическим растворением металлической меди анода (в контакте с воздухом) и
содержащейся в аноде закиси меди в кислом
электролите по реакциям:
Сu + 0,5O2 + Н2SО4 = СuSO4 + H2O, (28)
Сu2О + Н2SO4 = СuSO4 + Н2О + Сu↓, (29)
(что вызывает обогащение электролита сульфатом меди и обеднение его
серной кислотой), с диспропорционированием ионов Сu+, в результате чего до 0,2%
анодной меди в основном переходит в шлам и частично остается в электролите во
взвешенном состоянии.
Чрезмерное накапливание меди в электролите предотвращают, регулярно
выводя его некоторое количество из циркуляционной системы электролизного цеха в
купоросный цех. Обогащение электролита медью отчасти предупреждается закрытием
зеркала электролита слоем масла, пластмассовой крошкой или пленкой (уменьшается
проникновение кислорода воздуха в электролит и его испарение), поддержанием
умеренной начальной концентрации в электролите меди и серной кислоты, интенсивной
циркуляцией электролита (выравнивается концентрация меди в приэлектродных
слоях).
Загрязнение катодного осадка, происходящее главным образом в результате
захвата раствора и плавучего шлама, предупреждают:
) регенерацией электролита промежуточным обезмеживанием в специальных
(регенеративных) ваннах с нерастворимым анодом и частичным выводом электролита
в производство медного купороса;
2) увеличением концентрации серной кислоты в электролите,
позволяющим уменьшить растворимость в нем ионов Sb3+, Вi3+;
) введением в состав электролита хлор-ионов, что уменьшает концентрацию в
нем ионов Аs3+;
) повышением скорости циркуляции электролита, чем устраняется возможное
обеднение медью прикатодного слоя.
Плавучая разновидность шлама представляет взвесь в электролите дисперсных
коллоидных частиц, коагулированных иногда до размеров относительно крупных
хлопьев. Попадая на растущий катодный осадок, шлам вызывает дефекты поверхности
катода (шишки, дендриты), загрязняет его примесями (сурьма, мышьяк, серебро),
придающими меди хрупкость. Причиной образования плавучего шлама обычно являются
вторичные химические реакции, протекающие в электролите при изменении его
состава и уменьшении температуры, например гидролиз мышьяковой и мышьяковистой
кислот, с образованием гелеобразных основных солей. Аналогичные превращения
происходят и с ионами Sb3+. Серебро входит в состав взвешенного шлама в виде
мельчайших частиц металла или хлорида, поэтому образование взвешенного шлама
предотвращают поддержанием постоянной высокой температуры электролита,
введением в состав электролита ионов хлора, переводящих соли сурьмы, мышьяка,
висмута и серебра в компактный осадок, применением добавок в электролит
реагентов-коагуляторов.
Загрязнение товарной меди кислородом происходит при плавке и розливе, он понижает
пластичность и электропроводность меди. Также нежелательна примесь серы,
переходящей в металл из газов пламенных печей; после плавки в них медь содержит
до 0,04% кислорода и 0,012% серы, а после индукционной плавки часто серы и
кислорода меньше 0,01%. При переплавке катодной меди в шахтных печах в металле
остается около 3·10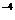 % кислорода и 1.5·10
% кислорода и 1.5·10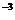 % серы.
% серы.
Катоды наращивают 6-8 суток, затем извлекают, промывают, сушат,
переплавляют в пламенных, индукционных или шахтных печах и разливают медь в
слитки особой формы, предназначенные для изготовления проволоки - вайербарсы
или иные. Обычная чистота катодов 99,95% (марка МОк).
Шлам электрорафинирования меди представляет собой рыхлый мелкодисперсный
(35-50 мкм) нерастворимый продукт ионизации анода, который под влиянием
собственного веса периодически сползает с анода и накапливается на дне ванны.
Выход шлама определяется химическим составом анода и обычно пропорционален
концентрации примесей в нем. Накапливание шлама на поверхности анода
сопровождается его поляризацией в связи с возникающими при этом диффузионными
затруднениями доставки и отвода участников электрохимического процесса.
.2.2 Электролиз с нерастворимым анодом
Для этого процесса пригодны растворы сульфата меди с концентрацией меди
не менее 30 г/дм3, получаемые разными способами, обычно
выщелачиванием окисленных руд и концентратов. Электролиз проводят в ваннах, где
катодных основ из чистой меди около 80, анодов из сплава свинца с 8-15% сурьмы
и 1% серебра на один больше. Раствор подают в каждую ванну со скоростью около 1
м3/мин. На выход по току отрицательно влияет примесь железа, которая
восстанавливается на катоде и окисляется на аноде, бесполезно расходуя
электроэнергию, поэтому перед электролизом железо, если его мало, осаждают
известью, предварительно окисляя воздухом:
4Fe2+ + О2 + 4Н+ = 4Fез+ + 2Н2O; (30)
К = (аFe3+) / ([O2] · (aFe2+) · (aH+))= 5 · 1030 (31)
· (aH+))= 5 · 1030 (31)
Получаемые гидратные осадки трудно промыть, и с ними теряется
значительное количество меди, поэтому когда концентрация ионов Fез+ слишком
высока, их перед электролизом восстанавливают цементационной медью
медь рафинирование электролитический катод
2Fез+ + Сu = 2Fе2+ + Сu2+, (32)
либо диоксидом серы
2Fез+ + SO2 + 2Н2О = 2Fе2+ + SO + 4Н+ (33)
+ 4Н+ (33)
Ионы Fе2+ окисляются на аноде при потенциале, меньшем потенциала
окисления воды, уменьшая напряжение на ванне, и это выгодно; однако возникающие
ионы Fе3+ восстанавливаясь на катоде, снижают выход меди по току.
По мере истощения электролита на катоде вместе с медью осаждается СuО и
выделяется водород:
Сu2+ + Н2О + 2е = СuО + H2, Е° = -0,22 В; (34)
осадок становится черным, губчатым, он отрывается от катода, выпадает в
шлам. Вследствие концентрационной поляризации снижается и чистота осадка,
поэтому электролиз заканчивают после уменьшения концентрации меди до 15-20
г/дм3, а отработанный электролит, в котором регенерировалась серная кислота,
направляют в оборот на выщелачивание.
1.3 Основные сведения по безосновной технологии
Основное достоинство безосновной технологии - получение более
высококачественной меди. Особенностью технологии электрорафинирования меди
безосновным способом стало наращивание катодов медных на титановых матрицах
многоразового использования, с последующей механизированной промывкой, сдиркой,
стопированием, взвешиванием и обвязкой пакетов на стрип-машине финской фирмы
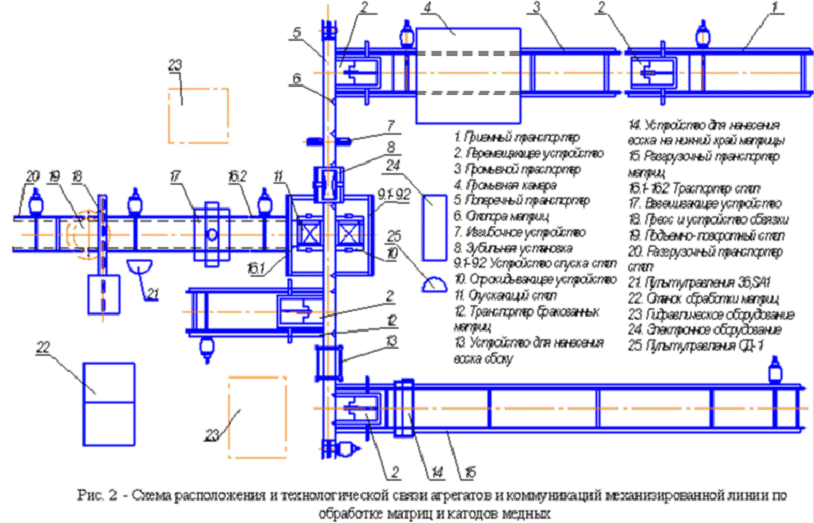
"WENMEС" (рис. 2).
В этом случае процесс электролитического рафинирования медных анодов
включает следующие оперативные работы: подготовка катодных матриц; ремонт
матриц; загрузка серий ванн анодами и титановыми матрицами; выгрузка катодов
медных; обслуживание титановых матриц и катодов; выгрузка анодных остатков;
чистка электролизных ванн; корректировка электролита; приготовление и введение
в электролит ПАВ.
Подготовку катодных матриц к загрузке производят на стрип-машине. Основой
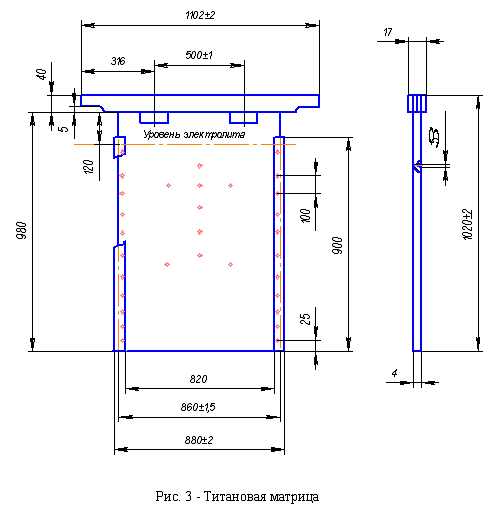
для наращивания медных осадков служит матрица из титана (рис. 3).
В процессе эксплуатации матриц нарушается обрамление кромок, образуются
оксиды на поверхности полотна. На конвейере стрип-машины электролизник
визуально оценивает целостность обрамления, составляющие поверхности матриц.
Готовые для дальнейшей эксплуатации матрицы продолжают движение на разгрузочный
конвейер. Нижнюю кромку изолируют воском в ванне, монтированной в разгрузочный
конвейер в стрип-машине методом двойного погружения, а боковые кромки изолируют
расплавленным воском при помощи форсунок.
Дефектные матрицы выводят на выбраковочный конвейер, сортируют,
укладывают в стопы для последующих операций: обработки поверхности матриц на
станках; ремонт боковых обрамлений; выравнивание поверхности матриц.
Стопы дефектных матриц с помощью крана перевозят на участок ремонта. В
качестве изоляционных боковых кромок применяют материал, обладающий
диэлектрическими свойствами, химической стойкостью и механической прочностью в
кислых средах в диапазоне рабочих температур. Изготавливают изоляционные
обрамления на установке термопласт-автомат. Для обеспечения необходимого
сцепления медного осадка к матрицам с целью удержания его до операции съема
проводят обработку поверхности матриц стальными щетками на станках перед пуском
в эксплуатацию. Изогнутые поверхности матриц выравнивают на гидропрессе.
Отремонтированные матрицы перед загрузкой в электролизные ванны промывают в
камере стрип-машины.
Аноды попадают в отделение в железнодорожных вагонетках в виде пакетов
без упаковки. С помощью крана разгружают аноды с вагонеток в стеллажи. На
стеллажах аноды вручную с помощью ломика устанавливают на фиксированном
расстоянии, которое обеспечивается конструкцией стеллажа. Специальной бороной
комплект анодов в количестве 34 штук зацепляют со стеллажей мостовым краном,
перевозят до серии и загружают в ванну.
2. Технологическая часть
.1 Технологическая схема участка электролиза меди
Приемный транспортер доставляет матрицы с катодным осадком в промывочную
камеру, где происходит трехстадийная промывка катодов от остатков электролита и
воска с нижних и боковых кромок матриц. После промывки матрицы с нарощенной
медью направляют на узел сдирки, где на первой стадии путем изгиба матриц
происходит локальное, а затем, на второй стадии при помощи ножей, полное
отделение медных осадков от матрицы. Катоды формируют в стопы на очередных
станциях стрип-машины - опрокидывающих и опускающих вилах. Взвешивают на
вмонтированный в транспортер стрип-машины весах, и направляют на станцию
упаковки. Упаковку производят на прессе и обвязочном устройстве стрип-машины.
Пакеты катодов обвязывают стальной упаковочной лентой. Вывоз пакетов из
отделения осуществляется железнодорожным или автомобильным транспортом.
Загрязненные воды из промывочной камеры через циркуляционные баки
направляют через узел очистки от воска в систему кислых растворов и на
корректировку электролита. Воск, смытый с матриц, поступает на узел сепарации и
регенерации, где он накапливается, осаждается на воскоснимателе, стекает через
фильтр в баки-сборники, проходит процесс регенерации. Далее сливается в формы
для восковки нижней кромки матрицы. Растворение анода обычно длится 15 суток.
После того, как значительная часть анода сработалось, серию отключают из
электрической цепи, останавливают циркуляцию и производят выгрузку матриц с
наращенным осадком, промывку с помощью специальных щеток поверхности анодного
остатка от шлама и выгрузку анодных остатков. Анодные остатки зацепляют на
борону, поднимают и с помощью крана выдерживают над ванной 30 секунд для стока
электролита. Затем транспортируют к стационарной промывочной ванне. В
промывочной ванне анодные остатки выдерживают около двух минут до полного смыва
шлама с их поверхности. Промывку производят горячим конденсатом при температуре
от 273 до 422 К.
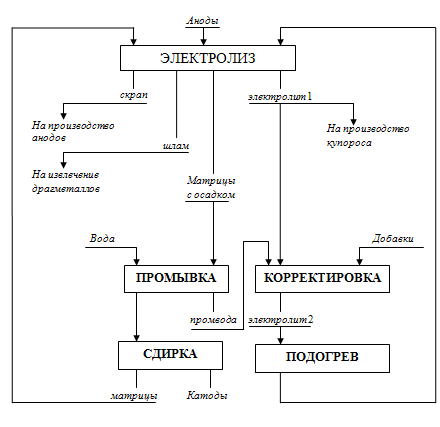
Рисунок 4 - Принципиальная технологическая схема электролитического
рафинирования меди
Промытые анодные остатки загружают в устройство укладки анодных остатков,
стопируют высотой от 500 до 700 мм, грузят на вагонетки. Анодные остатки,
составляющие 18% от первоначальной массы анода, отправляют на переплавку в
медеплавильный цех. После выгрузки матриц и анодных остатков электролит
откачивают из ванны через сборный коллектор в сборные баки с помощью сифона. В
ванне оставляют слой раствора из шламовой пульпы высотой от 70 до 150 мм в
зависимости от состава и структуры шлама. Чистку ванн от шлама производят с
помощью вакуум-системы, которая представляет собой разводку трубопроводов от
серии ванн к баку-сборнику, работающему под напряжением. Оставшийся анодный
скрап, включая мелкую осыпь, вручную смещают в угол ванны, выгружают из ванны
совком и укладывают в специальную металлическую тару. Отмывают в промывочной
стационарной ванне, перегружают в тару и отправляют в медеплавильный цех.
Электролитическое производство меди размещают в просторных, хорошо
освещенных зданиях, снабженных мощной приточно-вытяжной вентиляцией. В
продольном направлении внутренняя часть здания разделена на пролеты,
обслуживаемые мостовыми кранами грузоподъемностью от 10 до 50 т. На рабочих
площадка. пролетов смонтированы электролизные ванны.
Процесс рафинирования меди протекает при непрерывном обмене электролита.
Для этого в цехе смонтирована система его принудительной циркуляции.
Электролит, непрерывно вытекающий из ванн, после корректировки его
состава и температуры возвращается в ванны по распределительной системе.
Постоянный электрический ток к ваннам поступает от преобразовательной
подстанции, которая обычно расположена в отдельном здании рядом с корпусом электролиза.
Цех имеет несколько электрически. цепей постоянного тока, каждая из
которых состоит из ряда последовательно соединенных электролизных ванн и
самостоятельного источника постоянного тока - выпрямительного агрегата,
установленного на преобразовательной подстанции.
Назначение очистного передела - поддерживать в электролите товарных ванн
минимально допустимое содержание примесей.
Для этого часть электролита товарных ванн периодически направляют на
обезмеживание в регенерационные ванны, а затем на извлечение никелевого
купороса путем упаривания в вакуум-аппарата..
В отделении обработки готовой продукции катоды разбраковывают по внешнему
виду, увязывают в пакеты (~ 1.5 т), маркируют и отгружают потребителям.
.2 Конструкция электролизера
Электролизеры для рафинирования меди обычно называют электролитными
ваннами. Их размеры на отечественных заводах существенно разнятся и зависят от
числа и размеров применяемых электродов. Длина ванны определяется числом
электродов и расстоянием между центрами одноименных электродов. Ширина зависит
от ширины катодов: зазоры между краями катода и стенками ванны должны быть
60-70 мм.
При меньшем зазоре ухудшается циркуляция электролита, затрудняется замена
электродов; превышение этого расстояния приводит к бесполезному увеличению
размера ванн. Глубина ванн должна быть достаточной для того, чтобы шлам,
образующийся при растворении анодов, мог отстаиваться при оптимальной скорости
циркуляции электролита. Для этого необходимо, чтобы расстояние между нижними
краями катодов и дном составляло 180-200 мм.
Благодаря механизации трудоемких процессов в электролитных цехах
становится возможной работа на анодах все большей массы, а, следовательно, и
размера. В связи с этим увеличивают и размеры ванн.
Корпуса ванн чаще всего изготавливают из монолитного (рис. 5) или
сборного железобетона; в последнем случае днища делают деревянными. Внутреннюю
поверхность ванн футеруют листовым (10-15 мм) винипластом или оклеивают
рубероидом на битумной мастике и обкладывают кислотоупорным кирпичом.
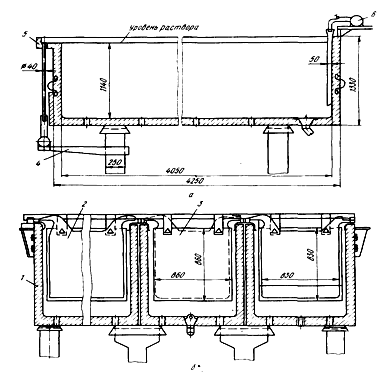
Рисунок 5 - Продольный (а) и поперечный (б) разрезы блока ванны для
рафинирования меди:
- корпус; 2 - анод; 3 - катод; 4 - сливной короб; 5 - сливной карман; 6 -
распределительная труба
Железобетонные ванны на современных заводах объединены в блоки по 5-20
ванн в каждом. Блок из сборного железобетона представляет собой единую жесткую
конструкцию; ванны в блоке имеют общие продольные стенки. Два блока составляют
серию. Блоки и ванны в блоках образуют последовательную электрическую цепь.
Электроды в каждой ванне включены параллельно. При такой схеме ток с анодов
первой ванны блока переходит на катоды второй, а затем на аноды третьей ванны и
т.д. Эта передача тока от одной ванны к другой может осуществляться либо при
непосредственном контакте анодных ушек с катодными штангами смежной ванны -
контакт Уайтхеда (рис. 6), либо через трехгранную промежуточную шину, на
которую опираются аноды первой и катодные штанги второй ванн.
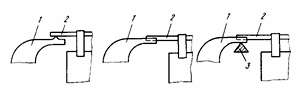
Рисунок 6 - Варианты передачи тока с помощью контакта Уайтхеда
- анод; 2 - катодная штанга; 3 - трехгранная шина
Анод (рис. 7) представляет собой медную плиту с двумя ушками, которые
служат для его подвески на ванне и подвода тока. В связи с применением
горизонтальных изложниц нижняя (при литье) плоскость анода меньше, чем верхняя.
Это необходимо, чтобы аноды после остывания легко вынимались из изложниц. По
длине анод делают в форме клина, суживающегося от ушек к противоположному краю.
Имея такую форму, аноды срабатываются более равномерно, срок их службы
увеличивается, а число обрывов ушек уменьшается.
Толщина анодов заметно влияет на технико-экономические показатели работы
электролитного передела. При работе на более толстых анодах уменьшается число
полных перегрузок серий, что ведет к сокращению трудовых затрат и расхода
вспомогательных материалов, достигается более полное использование анодов, так
как уменьшается выход анодных остатков. Но применение утолщенных анодов связано
с повышением расхода электроэнергии, так как среднее расстояние между катодами
и анодами увеличивается. Кроме того, при одной и той же длине ванны число
электродов в ней, а, следовательно, и производительность по меди будет меньшей.
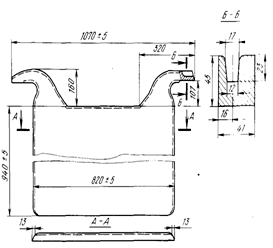
Рисунок 7 - Медный анод
На ЗАО "Кыштымский медеэлектролитный завод" медный осадок
наращивают на матрицах из титана ВТ1-0 ГОСТ 19807-91; размер рабочей
поверхности 1000 * 860 мм; обрамление матриц - полипропилен ТУ
2211-015-00203521; масса 24 кг. Токоподвод (катодная штанга) выполнен из биметалла
"титан-медь", изготовленного сваркой взрывом. Кромки матрицы перед
завешиванием в ванну изолируют воском. С целью повышения производительности
труда и надежности в процессе эксплуатации таких матриц путем исключения
самосъема осадков меди (от изменения температуры, например, при промывке)
полотно матрицы снабжено дополнительно одним или несколькими отверстиями.
При конструировании и монтаже ванны большое внимание уделяют
электрической изоляции ее частей во избежание бесполезных утечек тока. Между днищем
ванны и балками, на которые оно упирается, укладывают листы пластиката, а на
них - плитки из стекла или керамики. Борт ванн изолируют от ошиновки
наголовником из пластиката или винипласта и деревянными прокладками. Для
уменьшения токов утечки трубы, подачи электролита на ванны и отвода его в
сливные короба делают из неэлектропроводного материала - резины, полипропилена,
винипласта.
Ошиновка ванн состоит из главных, переходных и промежуточных шин. Главные
и переходные шины расположены в торцах блока, промежуточные (если они
применяются) - на бортах перегородок между ваннами блока.
Ток в серии проходит от главной анодной шины первого блока
последовательно через ванны к переходной катодной шине, установленной в
противоположном торце блока. Продолжение этой катодной шины образует переходную
анодную шину второго блока серии. Пройдя через ванны второго блока, ток
попадает на главную катодную шину, а через нее передается в соседнюю серию
ванн.
.3 Параметры работы электролизных ванн
.3.1 Состав электролита
Электролит должен быть устойчив в работе, т.е. не разлагаться химически и
не образовывать осадка солей при небольших понижениях температуры. Этим
условиям при рафинировании меди удовлетворяет электролит, состоящий из смеси
растворов CuSO4 и H2SO4 с добавками поверхностно-активных веществ (тиомочевины,
желатина, стирального порошка). В состав электролита, кроме того, входят
примеси некоторых металлов, попадающие в него при растворении анодов.
Примеси, присутствующие в медных анодах, можно подразделить на четыре
группы. В первую группу входят металлы, потенциалы разряда которых
электроотрицательнее потенциала меди: Zn, Fe, Ni, Co, Sn, Pb. Эти металлы не
могут выделяться на катоде из раствора, имеющего высокое содержание ионов меди,
поэтому постепенно накапливаются в электролите. Но их присутствие и накопление
не безвредно для процесса. При значительном содержании этих примесей
растворимость сульфата меди в электролите понижается настолько, что становится
возможным выпадение кристаллов CuSO4. Чаще всего кристаллизация CuSO4
происходит на поверхности анодов, так как прианодные слои электролита наиболее
обогащены ионами меди. Это вызывает солевую пассивацию анодов, нарушающую режим
электролиза. Вторая группа примесей - элементы, близкие к меди по потенциалам
разряда: As, Sb, Bi. Это наиболее опасные примеси, так как загрязнение ими
катодной меди наиболее вероятно и при этом ухудшаются ее электропроводимость и
механические свойства. Их разряд возможен на катодах, находящихся в зонах
слабой циркуляции электролита, где мала концентрация ионов меди. От примесей
первой и второй группы электролит очищают в купоросном отделении цеха, куда
систематически выводится часть электролита. Благодаря этому содержание примесей
удается удерживать на уровне, безопасном для технологии.
К третьей группе примесей относятся более электроположительные, чем медь,
элементы: Ag, Au и металлы платиновой группы - Pt, Pd, Ir, Rh, Os. Из них лишь
серебро в небольшом количестве (~ 1%) может переходить в раствор в виде ионов,
а затем осаждаться на катоде. Остальные благородные металлы электрохимически не
разлагаются и переходят в шлам, не оказывая заметного влияния на процесс
электролиза. Четвертая группа - интерметаллические и химические соединения -
Cu2Se, Cu2Te, Ag2Se, Ag2Te, Cu2O, Cu2S, SiO2, Al2O3. Эти примеси не разлагаются
при электрохимическом растворении анодов, плохо растворяются в электролите,
поэтому осаждаются в виде шлама.
Для получения плотной мелкокристаллической структуры катодного осадка в
электролит добавляют поверхностно-активные вещества. Нормы этих добавок на
тонну катодной меди на различных заводах следующие: стиральный порошок 20-35 г,
желатин 50-100 г, тиомочевина 50-90 г. Чтобы снизить потери серебра с катодной
медью, в электролит вводят ион хлора в составе NaCl или HCl. Серебро в этом
случае полностью переходит в шлам в виде AgCl. Установлено также, что ион хлора
взаимодействует с сурьмой, висмутом и мышьяком, в результате чего эти примеси
образуют малорастворимые основные соли.
2.3.2 Температура электролита
Электролитическое рафинирование меди ведут в нагретом до 328-338 К
электролите. Нагрев обусловливает значительное повышение растворимости сульфата
меди, увеличение электропроводимости раствора, уменьшение его вязкости.
Благодаря этому снижается вероятность солевого пересыщения электролита,
уменьшается расход электроэнергии, увеличивается скорость обмена электролита у
электродов. Это позволяет работать на более высокой плотности тока. В нагретом
электролите, кроме того, затрудняется переход сурьмы и мышьяка в катодную медь,
улучшается ее структура.
Многие из указанных преимуществ нагрева электролита стали бы еще заметнее
при дальнейшем повышении его температуры, если бы не ряд осложняющих
обстоятельств. С повышением температуры возрастает испарение электролита: с 1 м2
поверхности электролита при 323, 333 и 343 К за один час испаряется
соответственно 1,95; 4.18 и 5,95 кг воды. Следует при этом учитывать, что
воздух в цехе насыщается не только парами воды, но и аэрозолем электролита, а
это существенно увеличивает расходы на вентиляцию для создания нормальных
условий работы. При повышении температуры электролита увеличиваются потери
тепла, и для их компенсации приходится увеличивать расход пара. Наконец, с
повышением температуры усиливается химическое окисление анодов, что приводит к
увеличению объема раствора, подвергаемого дорогостоящей регенерации.
.3.3 Циркуляция электролита
При обеднении прикатодного слоя ионами меди снижается сортность катодного
металла, так как осаждаются элементы, потенциалы выделения которых близки к
потенциалу выделения меди (Аs, Вi, Sb). При значительном снижении концентрации
меди у катода (до 10 г/л) она выделяется в виде рыхлого осадка темного цвета.
Обогащение прианодного слоя ионами меди приводит к выпадению CuSO4 на аноде и
его пассивации. Возрастает также расход электроэнергии, так как повышается
напряжение на ванне из-за увеличения концентрационной поляризации.
Для выравнивания концентрации меди у электродов на всех действующих
ваннах организована непрерывная принудительная циркуляция электролита. Практика
показала, что скорость циркуляции оптимальна, когда полный обмен электролита в
ванне происходит за 3-4 ч. При такой скорости поток электролита не захватывает
оседающий на дно шлам, а вредное влияние концентрационных изменений
незначительно.
Применяются различные способы подачи электролита в ванны из
циркуляционной системы. Наиболее распространена его подача в один или в оба
торца каждой ванны. При подаче в один торец электролит движется к
противоположному торцу, где находится сливной карман. Однако при питании ванн
через торцы поток электролита направлен перпендикулярно к электродам, поэтому
его обмен в межэлектродных зазорах затруднен.
Трубчатый подогреватель электролита служит для компенсации потерь тепла в
ваннах и циркуляционной системе. Для его изготовления применяют трубы из
нержавеющей стали. Во внешнюю трубу диаметром 300-400 мм подают пар, а по
внутренним трубам диаметром 57-65 мм пропускают электролит.
Для выравнивания концентрации меди в товарных ваннах всех серий на
некоторых заводах электролит из сборника одной циркуляционной системы
перекачивают в напорный бак соседней. При повышенном шламообразовании в
циркуляционных системах применяют фильтрацию электролита.
.3.4 Плотность тока
Катодная плотность тока - важнейший технологический параметр
рафинирования меди, так как он в значительной мере определяет экономические
показатели процесса. Для каждого завода существует своя оптимальная плотность
тока, при которой себестоимость рафинированной меди минимальна. Эту плотность
тока стремятся поддерживать постоянной на всех товарных ваннах. Для ее
определения приходится учитывать большое число показателей. Так, с повышением
плотности тока возрастает производительность ванн, снижаются цеховые и
общезаводские расходы и расходы на заработную плату. Однако в связи с ростом
напряжения, утечек тока и пассивации анодов возрастает удельный расход
электроэнергии, ухудшается качество катодной меди, так как более вероятным
становится разряд вредных примесей. Возрастают также затраты на очистку
электролита и потери благородных металлов.

Рисунок 8 - Диаграмма реверсивного тока
τ0 - длительность одного периода; τn
- положительный импульс;
τр - отрицательный импульс (реверс).
Катодная плотность тока на отечественных заводах находится в пределах
240-285 А/м2. В настоящее время доказана экономическая
целесообразность работы на. плотности тока порядка 400-500 А/м2 при
условии применения реверсивного тока - постоянного по величине, но периодически
изменяющегося по направлению (рис. 14). Положительный импульс в 15-20 раз
длиннее отрицательного.
Применение реверсивного тока приводит к уменьшению концентрационной
поляризации электродов. На катоде улучшаются условия осаждения плотной меди,
растворение анодов протекает при меньшей пассивации. Кроме того, при более
высокой плотности тока в ваннах выделяется больше тепла, а значит, сокращаются
затраты на подогрев электролита. Несмотря на возрастание расхода электроэнергии
и сравнительно низкий выход по току (84-89%) рафинирование на высокой плотности
тока оказывается рентабельным.
.3.5 Межэлектродное расстояние (МЭР)
Расстояние между вертикальными осями двух соседних анодов относится к
важнейшим параметрам: чем оно меньше, тем меньше сопротивление ванны, а,
следовательно, расход электроэнергии. При равных габаритах ванна, у которой
расстояние между электродами меньше, более производительна, так как в ней
помещается больше электродов. Но с уменьшением МЭР возрастает неравномерность
распределения тока на анодах и катодах, увеличивается вероятность коротких
замыканий электродов, что приводит к снижению выхода по току и ухудшению
качества е одной меди.
В процессе рафинирования меди М/ЭР периодически изменяется. Минимальным
оно бывает при наращивании первой партии катодов после загрузки новых анодов.
Вторая и последующие партии катодов наращиваются при все возрастающем МЭР за
счет срабатывания анодов. На товарных ваннах отечественных заводов это
расстояние равно 102-110 мм; на зарубежных заводах - от 96 до 114 мм. На ваннах
регенерации электролита и матричных ваннах (не всегда) расстояния между анодами
больше, чем на товарных.
Для перехода на работу с меньшим межэлектродным расстоянием необходима
более высокая культура производства: улучшение обслуживания ванн, изготовление
более жестких маточных катодов, более точная по форме и массе отливка анодов,
улучшение их структуры.
2.3.6 Исходные данные
Годовая производительность по катодной меди, тыс.т. 100.0
Состав электролита, г/дм3: Сu 45.0
Ni 10.0
Н2SO4 160.0
Выход по току на катоде ВТК, % 96.8
Плотность тока Dк, А/м2 270
Температура электролита Тэ, К 336
Скорость циркуляции Vцирк, м3/ч 1.05
Выход анодных остатков, % 18.0
Температура воздуха в цехе Тв, К 293
Межэлектродное расстояние ℓмэр., м 0,102
Количество, шт.
- матриц nк 33
- анодов nа 34
Размеры матриц hк х bк х δк, мм 880 × 980
× 4
Размеры анодов hа х bа х δа, мм 860 × 960
× 38.5
Зазор "торец ванны - крайний электрод" ℓтбк, мм 80
Зазор "торец ванны с карманом - крайний электрод" ℓтск,
мм 120
Зазор " зеркало электролита - верхняя кромка ванны" h2, мм 60
Зазор "край катода - дно ванны" h3, мм 120
Зазор "бок ванны - электрод" ℓбк, мм 40
2.3.7 Размеры электролизера
Для электролиза используются электролизные ванны из сборного
железобетона, прямоугольной формы (рис. 9).
а) Размеры матрицы, м: ширина bк = 0.88 м; высота hк = 0.98 м; толщина δк = 0.004 м. Число катодов в ванне nк
= 33 шт.
Площадь рабочей части одного катода sк, м2:
к = bк · hк = 0.88 · 0.98 = 0.862. (35)
Площадь рабочей части всех катодов, Sк, м2:
к = 2 · nк · sк = 2 · 33 · 0.862 = 56.918. (36)
б) Размеры анода. Ширина и высота анода меньше, чем катода, что позволяет
избежать интенсивного образования дендритов и шишек на краях катода: ширина bа
= 0.86 м; высота hа = 0.96 м; толщина δа = 0.0385 м. Число анодов в ванне nа
= 34 шт.
Площадь рабочей части одного анода, sа, м2:
а = bа·hа = 0.860 · 0.960 = 0.826. (37)
в) Внутренние размеры ванны. Длина ванны L, м:
= nк·ℓмэр + δа + ℓтбк + ℓтск , (38)
= 33 · 0.102 + 0.0385 + 0.120 + 0.080 = 3.595.
Ширина ванны B, м:
В = bк + 2 · ℓбк , (39)
Высота ванны Н, м:
Н = hк + ℓд + h1, (40)
где h1 - расстояние между верхней кромкой катода и бортом ванны, м.
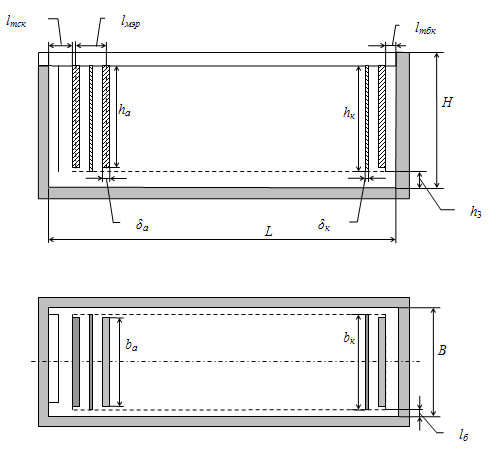
Рисунок 9 - Размеры электролизной ванны
Н = 0.98 + 0.120 + 0.08 = 1.18.
г) Внешние размеры ванны с учетом толщины торцовых стенок δт = 0.07 м; толщины боковых стенок δб = 0.07 м; толщины дна δд = 0.08 м.
L' = L + 2 · δm = 3.595 + 2·0.070 = 3.735, (41)
B' = B + 2 · δб = 0.960 + 2·0.070 = 1.100, (42)
Н' = Н + δд = 1.18 + 0.08 = 1.260. (43)
д) Внутренний объем ванны V, м3
= L·H·B, (44)
V = 3.595·0.960·1.180 = 4.072 м3.
е) Объем, занимаемый анодами и катодами Vэл, м3:
эд = (hк·bк·δк·nк) + (hа·bа·δа·nа) (45)
эд = (0.980·0.880·0.004·33) + (0.860·0.960·0.0385·34) = 1.195.
ж) Свободный объем ванны (над зеркалом электролита) Vсв, м3
св = L·B·h2, (46)
св = 3.595·0.960·0.060 = 0.207.
з) Свободная поверхность зеркала электролита, Fсв, м2
св = L · B - (nк· bк·δк + nа· bа· δа)
св = 3.595·0.960 - (33·0.88·0.004 + 34·0.86·0.0385) = 2.209.
з) Объем электролита в ванне Vэл, м3:
эл = V - (Vэд + Vсв), (47)
эл = 4.072 - (1.195 + 0.207) = 2.670.
Общий объем электролита с учетом 20%-ного запаса электролита,
находящегося в циркуляционной системе VΣ, м3:
VΣ = Vэл·1.2 = 2.670·1.2 = 3.204.
2.4 Материальный баланс электролизной ванны
Расчет материального баланса электролизера по анодному металлу необходим
для анализа распределения металлов по продуктам электролиза (скрап, шлам,
раствор, катод), для определения расходов анодов на 1 т. катодного металла,
накопление основного металла и примесей в электролите, чистоты катодного
металла и потерь с ним драгоценных металлов. Составление материального баланса
процесса электролиза позволяет определить изменение составов электролитов за счет
протекания анодных и катодных процессов, химических реакций в растворах, а
также за счет испарения воды и образования аэрозолей.
В ЗАО "КМЭЗ" медеплавильный цех перерабатывает огневым
рафинированием черновую медь, вторичную медь (отходы цветных металлов),
обеспечивая получения анодной меди следующего усредненного состава, %: Сu
99.34; Ni 0.19; Аs 0.03; Sе 0.03; Zn 0.016; Sb 0.09; Те 0.02; Fе 0.07; Вi
0.002; Аu 0.015; Sn 0.006; О2 0.15; Рb 0.13; S 0.004; Аg 0.07.
Распределение компонентов, содержащихся в анодной меди, между раствором,
шламом и катодами при электрорафинировании меди отражено в таблице 1. Расчет
выполнен по среднестатистическим показателям распределения компонентов анода
(табл. 1, колонки 4, 7, 10, 12).
Масса меди в продуктах электролиза, кг:
- в скрапе: 99.340 * 0.1800 = 17.88120
- в шламе: 99.340 * 0.0180 = 1.78812,
- в электролите: 99.340 * 0.0110 = 1.09274,
в катодах: 99.340 * 0.7910 = 78.57794,
где 99.340 - концентрация меди в аноде, %; 0.180, 0.0180, 0.0110, 0.7910 - доля меди, перешедшей
в скрап, шлам, электролит и катоды от всей растворившейся меди (18.00, 1.80,
1.10, 79.10%, соответственно).
Концентрация меди в шламе и катодах рассчитана после определения массы
этих продуктов. Так, концентрация меди в катодах равна, %:
.57794 * 100 / 78.58235 = 99.99439.
Таким образом, для получения 1 т катодной меди необходимо использовать
анодов, т: 1 * 100 / 78.57794 = 1.273.
Для остальных элементов расчеты выполнены аналогично.
Таблица 1 - Распределение примесей на 100 кг анодной меди по продуктам электролиза
|
Эле-
|
Поступило
|
Продукты электролиза
|
|
мент
|
Аноды
|
Скрап
|
Шлам
|
Электролит
|
Катоды
|
|
|
концент.,
|
масса,
|
извлеч.,
|
масса,
|
концент.,
|
извлеч.,
|
масса,
|
концент.,
|
извлеч.,
|
масса,
|
извлеч.,
|
масса,
|
концент.,
|
|
|
%
|
кг
|
%
|
кг
|
%
|
%
|
кг
|
%
|
%
|
кг
|
%
|
кг
|
%
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
|
Cu
|
99.340
|
99.340
|
18.00
|
17.88120
|
99.340
|
1.80
|
1.78812
|
84.375
|
1.10
|
1.09274
|
79.10
|
78.57794
|
99.96942
|
|
Ni
|
0.180
|
0.180
|
18.00
|
0.03240
|
0.180
|
5.70
|
0.01026
|
0.484
|
75.80
|
0.13644
|
0.50
|
0.00090
|
0.00115
|
|
Fe
|
0.070
|
0.070
|
18.00
|
0.01260
|
0.070
|
3.70
|
0.00259
|
0.122
|
77.90
|
0.05453
|
0.40
|
0.00028
|
0.00036
|
|
Pb
|
0.130
|
0.130
|
18.00
|
0.02340
|
0.130
|
80.40
|
0.10452
|
4.932
|
0.00
|
0.00000
|
1.60
|
0.00208
|
0.00265
|
|
As
|
0.030
|
0.030
|
18.00
|
0.00540
|
0.030
|
49.20
|
0.01476
|
0.696
|
31.10
|
0.00933
|
1.70
|
0.00051
|
0.00065
|
|
Sb
|
0.090
|
0.090
|
18.00
|
0.01620
|
0.090
|
81.20
|
0.07308
|
3.448
|
0.40
|
0.00036
|
0.40
|
0.00036
|
0.00046
|
|
Bi
|
0.002
|
0.002
|
18.00
|
0.00036
|
0.002
|
65.60
|
0.00131
|
0.062
|
16.00
|
0.00032
|
0.40
|
0.00001
|
0.00001
|
|
S
|
0.004
|
0.004
|
18.00
|
0.00072
|
0.004
|
80.30
|
0.00321
|
0.152
|
0.00
|
0.00000
|
1.70
|
0.00007
|
0.00009
|
|
Se
|
0.030
|
0.030
|
18.00
|
0.00540
|
0.030
|
81.50
|
0.02445
|
1.154
|
0.30
|
0.00009
|
0.20
|
0.00006
|
0.00008
|
|
Te
|
0.020
|
0.020
|
18.00
|
0.00360
|
0.020
|
81.60
|
0.01632
|
0.770
|
0.30
|
0.00006
|
0.10
|
0.00002
|
0.00003
|
|
Au
|
0.015
|
0.015
|
18.00
|
0.00270
|
0.015
|
81.50
|
0.01223
|
0.577
|
0.00
|
0.00000
|
0.50
|
0.00008
|
0.00010
|
|
Ag
|
0.067
|
0.067
|
18.00
|
0.01206
|
0.067
|
80.00
|
0.05360
|
2.529
|
2.00
|
0.00134
|
0.00
|
0.00000
|
0.00000
|
|
Zn
|
0.016
|
0.016
|
18.00
|
0.00288
|
0.016
|
0.00
|
0.00000
|
0.000
|
82.00
|
0.01312
|
0.00
|
0.00000
|
0.00000
|
|
Sn
|
0.006
|
0.006
|
18.00
|
0.00108
|
0.006
|
81.20
|
0.00487
|
0.230
|
0.00
|
0.00000
|
0.80
|
0.00005
|
0.00006
|
|
Итого
|
100.000
|
100.000
|
|
18.00000
|
100.000
|
|
2.10932
|
99.531
|
|
1.30833
|
|
78.58235
|
99.97502
|
.4.1 Свойства электролита
а) Плотность электролита ρэл, г/см3, определяется на
основании принципа аддитивности:
ρэл = 0.01(ρ1а1 + ρ2а2 + … + ρiаi), (48)
где ρ1, ρ2, … ρi - плотность компонентов раствора, кг/дм3;,
a2,… ai - объемная концентрация компонентов раствора, %.
Плотности компонентов равны: ρCuSO4 = 3.603;
ρNiSO4 = 4.010; ρH2SO4 = 1.841;
ρH2O = 1.000 (справочные данные).
Для заданного состава электролита, г/дм3 (45.0 Cu, 10.0 Ni,
160.0 H2SO4):
aCuSO4 = 45.0·159.60·100)/(63.54·3.603·1000) = 3.137;=
10.0·154.76·100/(58.70·4.010·1000) = 0.657;SO4 = 160.0·100/(1.841·1000) =
8.691;O = 100.0 - (3.137 + 0.657 + 8.691) = 87.515 (по разности).
Здесь 159.60, 154.76 - молярные массы сульфатов меди и никеля; 63.54,
58.70 - атомные массы меди и никеля.
ρэл = 0.01(3.603·3.137 + 4.010·0.657 +
1.184·8.691 + 1.000·87.515) = 1.117.
б) Теплоемкость электролита Сэл, кДж/(кг·град), также определяется на
основании принципа аддитивности:
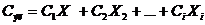 ,(49)
,(49)
где С1, С2, … Сi - удельные теплоемкости компонентов электролита,
Дж/(г·К) (табл. 2);, X2, … Xi - массовые доли компонентов электролита, доля ед.
Массовые доли компонентов Xi в электролите:
Xi = mi / ρэл(50)
где: mi - масса i - го компонента в 1 дм3 электролита, г;
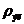 - плотность электролита, г/дм3 (1117).
- плотность электролита, г/дм3 (1117).
Таблица 2
Удельная теплоемкость компонентов электролита, Дж/(г·К)
|
Компонент
|
Температура, К
|
|
293
|
303
|
313
|
323
|
333
|
343
|
353
|
|
CuSO4
|
0.6122
|
0.6249
|
0.6370
|
0.6486
|
0.6596
|
0.6701
|
0.6802
|
|
NiSO4
|
0.8903
|
0.8930
|
0.8957
|
0.8984
|
0.9011
|
0.9037
|
0.9064
|
|
H2SO4
|
1.4052
|
1.4243
|
1.4627
|
1.4821
|
1.5016
|
1.5211
|
|
H2O
|
4.1851
|
4.1814
|
4.1804
|
4.1816
|
4.1849
|
4.1901
|
4.1970
|
Для заданного состава электролита, г/дм3 (45.0 Cu, 10.0 Ni, 160.0 H2SO4):
 = 45.0 · 159.6 / 63.54 = 113.0;
= 45.0 · 159.6 / 63.54 = 113.0;
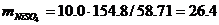
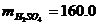
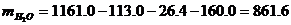
где: 45.0, 10.0 160 - концентрации компонентов (по заданию);
.6, 154.8 - молярные массы сульфатов меди и никеля;
.54, 58.71 - атомные массы меди и никеля, соответственно;= 113.0 / 1117 =
0.1012;= 26.4 / 1117 = 0.0236;SO4 = 160.0 / 1117 = 0.1432;O = 861.6 / 1117 =
0.7714.
Удельная теплоемкость компонентов электролита (табл. 5) при температуре
Тэл = 336 К, кДж/(кг·град), определяется методом интерполяции:
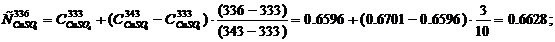
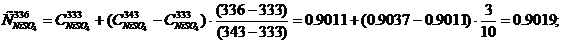
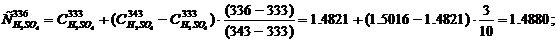
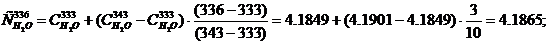
Удельная теплоемкость электролита при температуре Тэл = 336 К, кДж/(кг·град):
Cэл = 0.6628·0.1012 + 0.9019·0.0236 + 1.4880·0.1432 + 4.1865·0.7714 =
3.531.
в) Удельная электропроводность электролита κ, См/см, нелинейно зависит от
концентрации его компонентов, ее рассчитывают для электролитов с концентрацией,
г/дм3: меди Cu 30…50, никеля Ni 0…33, серной кислоты S 158…225 при
температуре T 328…348 K по полиному [3]:
κ = 0.04 - 0.2656·Сu - 0.0815·Ni + 0.3513·S +
0.3842·[T-273] + 0.0025·Сu2 + 0.00267·Ni2 -
0.000503·S2 - 0.00407·[T-273]2 + 0.00241·Сu·Ni - 0.001585·Сu·S - 0.00201·Ni·S -
0.001766·Ni·[T-273] + 0.00273·S·[T-273],(51)
где Сu - концентрация ионов меди в растворе, г/дм3 (45); Ni -
концентрация ионов никеля в растворе, г/дм3 (10); S - концентрация
серной кислоты в растворе, г/дм3 (160); T - температура электролита,
К (336).
κ = 0.04 - 0.2656·45 - 0.0815·10 +
0.3513·160 + 0.3842·60 + 0.0025·452 + 0.00267·102 - 0.000503·1602 - 0.00407·602
+ 0.00241·45·10 - 0.001585·45·160 -0.00201·10·160 - 0.001766·10·60 +
0.00273·160·60 = 56.85.
2.5 Электрический баланс электролизной ванны
Баланс напряжения на ванне складывается из следующих величин [4], В:
Uв = Ер + ΔЕа-к + ΔUэл + ΔUшл + ΔUшт + ΔUтэ + ΔUконт (52)
где Ер - напряжение разложения; ΔЕа-к - электродная поляризация; ΔUэл - падение напряжения в
электролите; ΔUшл - падение напряжения в шламе; ΔUшт - падение напряжения в катодных
штангах; ΔUтэ - падение напряжения в теле электродов; ΔUконт - падение напряжения в
контактах.
а) Напряжение разложения Ер определяется по разности термодинамических
потенциалов анода и катода:
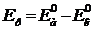 (53)
(53)
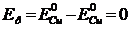
б) Электродная поляризация ΔЕа-к определяется как разность
перенапряжений анодного и катодного процессов, которые при заданных значениях
плотности тока и температуры могут быть приняты равными соответственно +0.02 В
и -0.02 В, т.е.
ΔЕа-к = ΔЕа - ΔЕк = 0.020 - (-0.020) = 0.040.
в) Падение напряжения в электролите ΔUэл
эл = Rэл · I, (54)
где Rэл - сопротивление электролита, Ом;- сила тока через электролизер,
А.
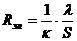 , (55)
, (55)
где 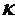 - удельная электропроводность электролита, См/см (56.85); λ
- расстояние между анодом
и катодом, м;
- удельная электропроводность электролита, См/см (56.85); λ
- расстояние между анодом
и катодом, м;
λ = (ℓмэр - δк - δа)/2 = (0.102 - 0.004 - 0.0385)/2 =
0.02975;
S - сечение электролита, по которому протекает ток между анодом и
катодом, м2:
S = 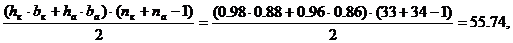
где 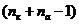 - число межэлектродных промежутков.
- число межэлектродных промежутков.
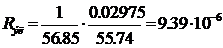 , (56)
, (56)
где Sк - рабочая поверхность катодов (матриц) м2:
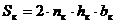 (57)
(57)
Sк = 2 · 33 · 0.88 · 0.98 = 56.92.
I = 270 · 56.92 = 15368.эл = 9.39 · 10-6 · 15368 = 0.14.
г) Падение напряжения в шламе ΔUшл составляет 10-15% от падения
напряжения в электролите [4] и равно, В:
ΔUшл = 0.14 · 0.12 = 0.017.
д) Падение напряжения в контактах ΔUконт составляет 15-17% [4] и равно:
ΔUконт = (0,15 ÷
0,17)·(Σηа,к +
ΔUэл + ΔUшл + ΔUконт), (58)
По данным практики и литературным источникам [2, 6, 7, 8] Σηа,к = 0.080 В. Тогда:
ΔUконт 0.17 · (0.08 + 0.16 + 0.0017+
ΔUконт),
ΔUконт = 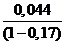 = 0,053 В
= 0,053 В
е) Падение напряжения в теле электродов ΔUтэл определяется электрическим
сопротивлением, Ом, тела анода R.та и тела катода Rтк при температуре
электролита
ΔUтэл = Iшт · (R.та + Rтк) (59)
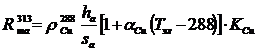 (60)
(60)
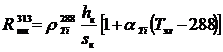 (61)
(61)
где: 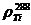
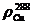 - удельное сопротивление при температуре 288 К, Ом·мм2/м,
титана (0.435) и меди (0,0175);
- удельное сопротивление при температуре 288 К, Ом·мм2/м,
титана (0.435) и меди (0,0175);
αCu , αTi - температурный коэффициент
удельного сопротивления, град-1 , меди (0.004) и титана (0.006)
КСu - коэффициент, учитывающий повышение электрического сопротивления
черновой меди по сравнению с чистой медью (10);а , hк - высота, м, анода
(0.960) и катода (матрицы - 0.980);а , sк - поперечное сечение, мм2,
анода (860·38.5) и катода (матрицы - 880·4);
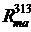 = 0.0175·0.960·[1 + 0.004·(336 - 288)] ·10 / (860·38.5) =
6.05·10-6,
= 0.0175·0.960·[1 + 0.004·(336 - 288)] ·10 / (860·38.5) =
6.05·10-6,
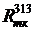 = 0,435·0,980·[1 + 0.006·(336 - 288)] / (880·4) = 1.56·10-4
= 0,435·0,980·[1 + 0.006·(336 - 288)] / (880·4) = 1.56·10-4
ΔUтэл = 466 · (6.05·10-6 + 1.56·10-4) =
0.075.
Электрический баланс ванны (таблица 3) показывает, что основная статья
баланса напряжений - падение напряжений в электролите. Снижение этой величины
является одной из задач для уменьшения удельного расхода электроэнергии при
электрорафинировании меди.
Таблица 3
Электрический баланс электролизной ванны
|
Статьи баланса
|
Падение напряжения
|
|
В
|
%
|
|
Электродная поляризация ΔЕа-к
|
0.040
|
12.3
|
|
Падение напряжения в
электролите ΔUэл
|
0.140
|
43.1
|
|
Падение напряжения в шламе
|
0.017
|
5.2
|
|
Падение напряжения в
контактах ΔUконт
|
0.053
|
16.3
|
|
Падение напряжение в теле
электродов
|
0.075
|
23.1
|
|
Итого:
|
0.325
|
100.0
|
Удельный расход электроэнергии постоянного тока Wуд, кВт·час/т:
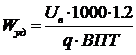 (62)
(62)
где: 1.2 - коэффициент, учитывающий падение напряжения в подводящих шинах
от подстанции до серии;- электрохимический эквивалент меди, г/(А·час)(1.186);
ВПТ - выход меди по току на катоде, % (96.8).
Wуд = 0.325 · 1000 · 1.2 / (1.186 · 0.968) = 339.7.
2.6 Тепловой баланс электролизной ванны
.6.1 Статьи прихода тепла
а) Тепло, выделяемое при прохождении электрического тока Q1:
= 3.6 · I · (Uв - ΔUконт), (63)
= 3.6 · 15368 · (0.325 - 0.053) = 15.60·103.
б) Тепло, поступающее с электролитом Q2 - рассчитывается по итогам
составления баланса.
2.6.2 Статьи расхода тепла
в) Потери тепла на испарение воды с зеркала электролита Q3, [1]:
 (64)
(64)
где:  - количество воды испаряющейся за 1 час с 1 м2 поверхности
электролита, кг:
- количество воды испаряющейся за 1 час с 1 м2 поверхности
электролита, кг:
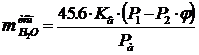 ,(65)
,(65)
где: 45.6 - плотность потока испарения при температуре окружающего
воздуха Тв (373 К) в сухой воздух (при Р1 = 0 и Р1 = Р2), кг/(м2·час)
[1]
Кв - коэффициент, характеризующий условия отвода пара (0.70 - для
медленно движущегося воздуха)
Р1 - давление насыщенного водяного пара в помещении при температуре
электролита Тэл (336 К), Па (1.992 ·104) (табл. 4);
Таблица 4
Давление насыщенного водяного пара
|
Температура, К
|
293
|
303
|
313
|
323
|
333
|
343
|
353
|
|
Давление, Па/10^4
|
0.233
|
0.425
|
0.738
|
1.234
|
1.992
|
3.117
|
4.738
|
Значение Р1 для температуры электролита 336 К найдено методом
интерполяции:
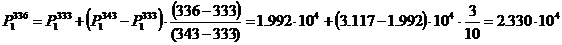 ;
;
Р2 - давление насыщенного водяного пара в помещении при температуре
окружающего воздуха Тв (293 К), Па (0.233 ·104) (табл. 5);
φ - относительная влажность в цехе, доли
ед. (0.70).а - атмосферное давление, Па (1.013 · 105);
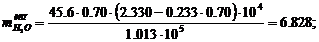 ;
;
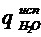 - удельная теплота парообразования воды при Тэл (336 К),
кДж/кг
- удельная теплота парообразования воды при Тэл (336 К),
кДж/кг
Значение 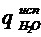 для температуры электролита 336 К найдено методом
интерполяции (табл. 5).
для температуры электролита 336 К найдено методом
интерполяции (табл. 5).
Таблица 5
Удельная теплота парообразования воды
|
Температура, К
|
293
|
303
|
313
|
323
|
333
|
343
|
353
|
|
Удельная теплота, кДж/кг
|
2448.2
|
2425.6
|
2403.0
|
2380.0
|
2356.9
|
2333.0
|
2310.0
|
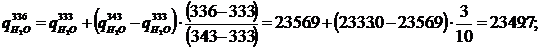
исп - свободная поверхность зеркала электролита, м2 (2.209,
стр. 38).= 6.828 · 2349.7 · 2.209 = 35.44·103.
г) Потери тепла зеркалом электролита лучеиспусканием и конвекцией Q4:
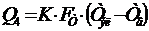 (66)
(66)
где: Fт - теплоотдающая поверхность электролита, м2 (2.209,
стр. 38);
К - коэффициент теплопередачи, кДж/(м2·час·град)
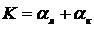 (67)
(67)
где αл и αк - коэффициенты лучеиспускания и конвекции;
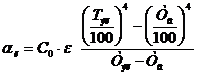 (68)
(68)
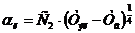 (69)
(69)
где Со - коэффициент лучеиспускания абсолютно черного тела, кДж/(м2·час)
(20.75);
ε - степень черноты излучающей
поверхности, ед. (принимаем 0.96);
С2 - коэффициент, зависящий от расположения поверхности относительно
поступающего тепла, кДж/(м2·ч) (9.009 - горизонтальная поверхность,
тепло передается снизу; 4.735 - горизонтальная поверхность, тепло передается
сверху; 7.123 - вертикальная поверхность);
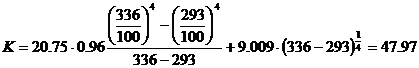 ;
;
Q4 = 47.97 · 2.209
· (336 - 293) = 4.56·103.
д) Потери тепла стенками и дном электролизера Q5 составляют в среднем
0.20 от величины Q3, т.е. Q5 = 0.20 · 35.44·103 = 7.09·103.
е) Потери тепла выступающими частями электродов Q6 составляют в среднем
0.18 от величины Q3 , т.е. Q6 = 0.18 · 35.44·103 = 6.38·103.
ж) Потери тепла с уходящим электролитом, Q7
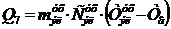 , (70)
, (70)
где  - масса электролита, уходящего из ванны, кг;
- масса электролита, уходящего из ванны, кг; 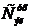 - удельная теплоемкость электролита,
уходящего из ванны, кДж/(кг·град) (3.531);
- удельная теплоемкость электролита,
уходящего из ванны, кДж/(кг·град) (3.531); 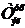 - температура электролита, уходящего
из ванны, К (принята на 3 градуса меньше заданной температуры электролита, т.е.
333).
- температура электролита, уходящего
из ванны, К (принята на 3 градуса меньше заданной температуры электролита, т.е.
333).
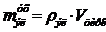 , (71)
, (71)
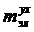 = 1.05 · 1117 = 1172.9;
= 1.05 · 1117 = 1172.9;
Q7 = 1172.9 · 3.531 · (333 - 273) = 248.49·103.
Суммарный расход тепла ΣQрас:
ΣQрас. = Q3 + Q4 + Q5 + Q6 + Q7, (72)
ΣQрас. = 35.44·103 + 4.56·103 +
7.09·103 + 6.38·103 + 248.49·103 = 301.96·103.
Тепло, поступающее с электролитом, Q2 , определяется из баланса тепла:
Q2 = ΣQрас. - Q1 = 301.96·103 - 15.60·103 = 286.36·103.
Температура поступающего электролита, T3 , К:
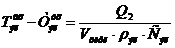 ;(73)
;(73)
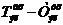 = 286.36·103 / (1.05 · 1117 · 3.531) = 69,
= 286.36·103 / (1.05 · 1117 · 3.531) = 69,
т.е. 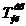 = 273 + 69 = 342 К, т.е. на 6 градусов больше заданной
температуры электролита (336 К).
= 273 + 69 = 342 К, т.е. на 6 градусов больше заданной
температуры электролита (336 К).
Повтор расчетов с 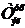 , меньшей заданной температуры электролита на 4 градуса (332
К):
, меньшей заданной температуры электролита на 4 градуса (332
К):
Q7 = 1172.9 · 3.531 · (332 - 273) = 244.35·103.
ΣQрас. = 35.44·103 + 4.56·103 +
7.09·103 + 6.38·103 + 244.35·103 = 297.82·103.
=
ΣQрас. - Q1 = 297.82·103
- 15.60·103 = 282.22·103.
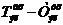 = 282.22·103 / (1.05 · 1117 · 3.531) = 68,
= 282.22·103 / (1.05 · 1117 · 3.531) = 68,
т.е. 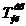 = 273 + 68 = 341 К, т.е. на 5 градусов больше заданной
температуры электролита (336 К). Значение
= 273 + 68 = 341 К, т.е. на 5 градусов больше заданной
температуры электролита (336 К). Значение 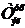 можно принять, т.к. заданная
температура электролита (336 К) с точностью до 1 градуса является средней между
можно принять, т.к. заданная
температура электролита (336 К) с точностью до 1 градуса является средней между
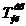 (341 К) и
(341 К) и  (332 К). Поскольку
(332 К). Поскольку  >
>  , электролит, уходящий из ванны,
необходимо нагревать (табл. 6).
, электролит, уходящий из ванны,
необходимо нагревать (табл. 6).
Таблица 6 - Тепловой баланс электролизера для рафинирования меди
|
Статьи прихода тепла
|
Q
|
Статьи расхода тепла
|
Q
|
|
мДж/ч
|
%
|
|
мДж/ч
|
%
|
|
Тепло, выделяемое при
прохождении электрического тока, Q1
|
15.60
|
5.2
|
Потери тепла на испарение
воды с зеркала электролита, Q3
|
35.44
|
12.0
|
|
Тепло, приходящее с
электролитом Q2
|
282.22
|
94.8
|
Потери тепла
лучеиспусканием и конвекцией, Q4
|
4.56
|
1.5
|
|
|
|
Потери тепла корпусом
ванны, Q5
|
7.09
|
2.4
|
|
|
|
Потери тепла выступающими
частями электродов, Q6
|
6.38
|
2.1
|
|
|
|
Тепло с уходящим
электролитом, Q7
|
244.35
|
82.0
|
|
Итого:
|
297.82
|
100.0
|
Итого:
|
297.82
|
100.0
|
2.7 Выбор оборудования
Ванна (электролизер) - основной агрегат для электрорафинирования меди.
К конструкции ванн предъявляются ряд требований, основным из которых
являются физическая прочность, способность противостоять гидростатическому
давлению электролита, высокая коррозионная стойкость, и стойкость к
термоударам, возможность компоновки ванн в серию.
На ряде предприятии в качестве материала электролизера используют ванны
из монолитного или сборного железобетона, полимербетона, чаще всего из
кислотоупорного, что позволяет несколько снизить затраты на их сооружение, и
увеличить срок службы.
Предлагается использовать ванны из железобетона, такими ваннами в
отечественной практике эксплуатируют в цехе электролиза меди на ЗАО
"КМЭЗ".
Для удобства обзора и устранения неполадок при эксплуатации электролизеры
монтируют на высоте 4,8 м от нулевой отметки.
Кроме основного оборудования каждая циркуляционная система оснащена
емкостями для приготовления добавок ПАВ, дозирующими устройствами для раздачи
ПАВ, зумпфами для сбора возможных проливов электролита и промывных вод.
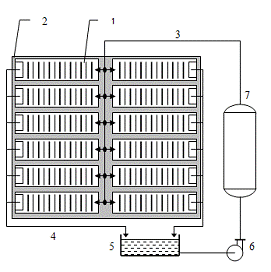
Рисунок 10 - Схема циркуляции электролита
- электролизная ванна, 2 - серия ванн, 3 - распределительная труба, 4 -
обратная труба, 5 - сборный бак, 6 - центробежный насос, 7 - теплообменник.
Циркуляционная система связана технологическими трубопроводами и
замкнутый цикл (рис. 10), с которым электролит поступает в ванны. Подача
электролита в ванны осуществляется через подающий карман у дна ванны, а слив -
через верхний сливной лоток. Из них 28 серий по 24 ванны.
Промывка, сдирка катодов с матриц, их стопирование, взвешивание и обвязка
пакетов производятся в автоматическом режиме на стрип-машине финской фирмы
"WENMEC SYSTEMS OY". Подача анодов и вывоз из отделения электролиза
меди катодов, анодных остатков и отходов производства осуществляют
железнодорожным транспортом узкой колеи.
Необходимое количество ванн и их производительность. Производительность
одного электролизера за сутки, кг:
m = q·ВТК·τ·Кмв·I·10-3, (74)
где q - электрохимический эквивалент меди, г/(А·ч) (1.186);
τ - длительность суток, час. (24);
Кмв - коэффициент машинного времени работы ванны (0.98);- токовая
нагрузка электролизера, А:
= Dк · Sк(75)
где Dк - катодная плотность тока, А/м2 (270);= 270 · 56.918 =
15368.= 1.186 · 0.968 · 24 · 0.98 · 15368 · 10-3 = 415.82.
Расчетное количество ванн N’, шт.:
’ = Q ·1000 / (m· Тк), (76)
где Q - производственная мощность участка, тонн катодов медных за год
(100000); m - производительность одного электролизера за сутки, кг (415.82); Тк
- календарный фонд рабочего времени, суки, (365 для непрерывного производства).
’ = 100000 · 1000 / (415.82 · 365) = 659. (77)
Принимаем число ванн N равным 672 (по 24 ванны в серии, 28 серий).
Производительность всех электролизеров в сутки, кг:
сут = m · N, (78)
сут = 415.82 · 672 = 279431.
3. Экономическая часть
.1 Расчет стоимости производственных фондов
.1.1 Производственная мощность объекта и ее использование
Производственная мощность цеха есть максимально возможный годовой выпуск
продукции при наиболее полном использовании оборудования и рациональной
организации труда. Производственная мощность М, т/год, проектируемого цеха
определяется на основании предварительных технологических расчетов:
М = n · П · Тэф, (79)
где n - количество единиц основного оборудования (672 электролизера); П -
часовая производительность единицы основного оборудования в натуральных
единицах (0,0155 т); Тэф - годовой эффективный фонд времени работы основного
оборудования, ч:
Тэф = Ткал - Тпр,(80)
где Ткал - режимный фонд времени, для непрерывного процесса равный 8760 ч
· 672 = 5886720 ч); Тпр - время простоя на плановых ремонтах, час. Расчет
времени простоя на плановых ремонтах с использованием нормативов представлен в
таблице 7.
Таблица 7 - Время простоя на плановых ремонтах
|
Основное оборудование
|
Периодичность ремонтов
|
Виды и количество ремонтов
в проектируемом году
|
Время простоя, ч
|
|
Вид ремонта
|
Время, ч
|
|
|
|
Электролизер
|
ППР
|
10
|
ППР, 1 ремонт в году
|
10
|
|
Итого
|
|
10
|
|
10
|
Тэф = 5886720 - 672·10 = 5880000 ч.
М = 672 · 0.0155 ·• 5880000 = 61246 т/год.
Коэффициент использования производственной мощности объекта Км, который
рассчитывается как отношение предусмотренного выпуска продукции (В) к
полученной мощности цеха:
Км = В/М = 100000/612460 = 0,95.(81)
3.1.2 Расчёт потребного количества оборудования
Правильный выбор количества оборудования определяет его рациональное
использование во времени. Этот фактор должен учитываться таким образом, чтобы
исключить простои оборудования, т.е. нужно выбирать его по производительности.
С этой целью определяют наряду с другими технико-экономическими показателями
критерии, показывающие степень использования каждого электролизера в
отдельности и всех вместе по разработанному технологическому процессу.
Для каждого электролизера в технологическом процессе должны быть
подсчитаны коэффициент загрузки и коэффициент использования по основному
времени.
Эффективный годовой фонд времени работы оборудования 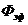 , час, рассчитывается по формуле:
, час, рассчитывается по формуле:
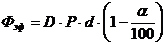 , час.(82)
, час.(82)
гдеD - число рабочих дней в году (247 дня); P - продолжительность смены
(8 часов); d - режим работы; α - потери на ремонт оборудования
(5-10%).
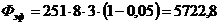 час.
час.
Расчетное количество электролизеров равно 672 шт. Стоимость
технологического оборудования вспомогательных служб, приходящихся на участок,
рассчитывается, исходя из его необходимого количества и цен. Количество
вспомогательного оборудования рассчитывается в долях от технологического.
Транспортно-заготовительные расходы принимаются в среднем равными 5% от
стоимости оборудования, затраты на его монтаж - 5-10% от цены приобретения.
Таблица 8 - Расчёт стоимости технологического оборудования
|
Наименование оборудования
|
Базовый вариант
|
Проектный вариант
|
|
Кол-во
|
Сумма, руб.
|
Кол-во
|
Сумма, руб.
|
|
Электролизные ванны
|
672
|
7830000
|
672
|
7830000
|
|
Теплообменник трубчатый
|
8
|
1495356
|
8
|
1495356
|
|
Циркуляционные сборники
электролита
|
16
|
2800520
|
16
|
2800520
|
|
Бак дегазационный
|
10
|
243572
|
10
|
243572
|
|
Бак ввода ПАВ
|
1
|
2223880
|
1
|
2223880
|
|
Бак для распаривания
желатина
|
1
|
4672250
|
1
|
4672250
|
|
Дозатор ПАВ
|
4
|
3658129
|
4
|
3658129
|
|
Бак - мерник кислоты
|
2
|
113629
|
2
|
113629
|
|
Механизированная линия по
обработке матриц и катодной меди фирмы "OUTOKUMPU"
|
1
|
10250000
|
1
|
10250000
|
|
Устройство укладки анодных
остатков
|
1
|
1366001
|
1
|
1366001
|
4
|
5464005
|
4
|
5464005
|
|
Бак циркуляционный
|
4
|
1366001
|
4
|
1366001
|
|
Насос центробежный
|
10
|
2500000
|
10
|
2500000
|
|
Насос погружной
|
6
|
1360500
|
6
|
1360500
|
|
Насос вакуумный
|
4
|
4780000
|
4
|
4780000
|
|
Итого
|
|
47322324
|
|
47322324
|
.1.3 Расчет стоимости производственных площадей
Для определения стоимости участка производится расчет общей и
производственной площади:
а) общая производственная площадь S, м2, принимается равной
12636 м2;
б) вспомогательная площадь Sвсп, м2, принимается в размере 25¸35% от производственной:всп = 12636 ·
0.25 = 3159;
в) площадь конторских и бытовых помещений Sбыт, м2,
принимается в размере 20¸30% от производственной площади:быт = 12363 · 0.2 = 2527;
г) общая площадь Sобщ, м2:общ = 12363 + 3159 + 2527 = 18322
д) объем здания V, м3:= (12363 + 3159) ·15 + 2527·3 = 240411,
где 15 высота производственных и вспомогательных помещений, м; 3 высота
бытовых помещений м;
е) стоимость производственных помещений, руб.:
·15·800 + 3159·15·450 + 2527·3·450 = 173090700,
где 800 - стоимость 1 м3 для производственных помещений, руб.;
450 - стоимость 1 м3 для вспомогательных и бытовых помещений, руб.
.1.4 Полный расчет стоимости производственных фондов
Стоимость инструмента и приспособлений принимается в размере 10% от
балансовой стоимости оборудования, производственно-хозяйственного инвентаря -
1% от стоимости здания и оборудования.
3.2 Определение численности основных производственных рабочих
К основным производственным рабочим относятся рабочие, которые участвуют
в технологическом процессе по изготовлению основной продукции. Для определения
численности основных рабочих необходимо установить, сколько в среднем часов в
году работает один рабочий, то есть определить фонд эффективного времени.
Составляется баланс рабочего времени.
Численность основных рабочих принимаем равной 83 - по штатному
расписанию.
К вспомогательным рабочим относятся рабочие, занятые обслуживанием
основного производства и способствующие труду основных рабочих.
Таблица 9 - Расчет стоимости производственных фондов
|
Группа основных
производственных фондов
|
Балансовая стоимость, руб.
|
Норма- амортизации, %
|
Годовая сумма
амортизационных отчислений, руб.
|
|
Базовый
|
Проектный
|
|
Базовый
|
Проектный
|
|
1. Здание
|
39897900
|
39897900
|
2.8
|
493826760
|
493826760
|
|
2. Рабочие машины и
оборудование
|
47322324
|
47322324
|
12.5
|
5915290
|
5915290
|
|
3. Инструменты и
приспособления
|
4732232
|
4732232
|
20.0
|
591529
|
591529
|
|
4. Контрольно-измерительные
приборы
|
1680
|
1680
|
8.5
|
134
|
134
|
|
5. Транспортные средства
|
4276737
|
4276737
|
16.5
|
705661,6
|
705661,6
|
|
6. Производственный и
хозяйственный инвентарь
|
4066400
|
4066400
|
12.5
|
508300
|
508300
|
|
Итого
|
17697069373
|
17697069373
|
|
495632385
|
495632385
|
Таблица 10 - Подъёмно - транспортные средства
|
Модель
|
Кол-во
|
Балансовая стоимость всего
оборудования
|
|
Кран электрический мостовой
|
2
|
1912816
|
|
Таль электрическая ТЭ
200-52Д-122
|
2
|
456320
|
|
Таль электрическая ТЭ
050-53Д
|
1
|
225001
|
|
Кран мостовой электрический
однобалочный
|
2
|
984300
|
|
Вентилятор приточный
|
6
|
698300
|
|
Итого
|
|
4276737
|
Таблица 11 - Баланс рабочего времени одного рабочего
|
Состав рабочего времени
|
Дни
|
Часы
|
|
Календарные дни
|
365
|
-
|
|
Выходные дни
|
-
|
-
|
|
Праздничные дни
|
-
|
-
|
|
Предпраздничные часы
|
-
|
-
|
|
Количество рабочего
времени:
|
365
|
8760
|
|
Невыходы на работу: а)
очередные и дополнительные отпуска б) отпуска в связи с беременностью и
родами в) выполнение гос. обязанностей г) по болезни
|
56 0.8 0.3 3.3
|
|
|
60.4
|
1449.6
|
|
Потери внутри работы: а)
сокращенный рабочий день б) перерывы на кормление
|
- -
|
14 94
|
|
|
22
|
|
Эффективный фонд рабочего
времени (часов): 8760-(1449+94)
|
|
7217
|
Их численность определяется по трудоемкости работ, по местам и нормам
обслуживания:
по рабочим местам определяется численность кладовщиков, транспортных
рабочих контролеров и др. - по нормам обслуживания определяется численность
дежурных слесарей, электромонтеров. Численность вспомогательных рабочих
рассчитывается укрупнено по нормативам. Количество основных рабочих на
проектируемом участке составляет до 200 человек, поэтому необходимо принять
следующее количество вспомогательных рабочих:
Численность руководителей, специалистов и служащих определяется по штатному
расписанию.
Все расчеты по численности работающих сведены в таблицу 14.
Таблица 12 - Расчет численности вспомогательных рабочих
|
Профессия
|
Расчетная единица
|
Норма обслужив.
|
Численность рабочих
|
Тарифный разряд
|
|
Наименование.
|
Кол-во
|
|
Расчетное
|
Принятое
|
|
|
Наладчик оборудования
|
Кол-во обслужен. станков
|
18
|
10
|
1.8
|
2
|
3
|
|
Уборщик
|
Производ. площади
|
540
|
300
|
1.8
|
2
|
2
|
|
Транспортные рабочие
|
Основные рабочие
|
15
|
25
|
0.5
|
1
|
3
|
|
Кладовщики и раздатчики
инструментов
|
Основные рабочие
|
15
|
20
|
0.75
|
1
|
3
|
|
Контролёр
|
Основные рабочие
|
15
|
25
|
1.67
|
2
|
5
|
Таблица 13 - Численность работающих на участке
|
Категория работающих
|
Численность
|
|
Основные рабочие
|
83
|
|
Вспомогательные рабочие
|
19
|
|
Служащие
|
14
|
|
Руководители
|
7
|
|
Итого
|
123
|
3.3 Расчет фонда заработной платы
Расчет фонда заработной платы должен соответствовать основным принципам
организации заработной платы на предприятии, т.е. правильному соотношению
величины зарплаты и результатов труда. Принимаем цеховой фонд заработной платы
рабочих, служащих и руководителей равным 24241135.65 руб.
Таблица 14 - Смета расходов по содержанию и эксплуатации оборудования
|
№ п/п
|
Статьи
|
Сумма затрат, руб.
|
|
1
|
Содержание оборудования:
|
|
|
- стоимость вспомогательных
материалов
|
2851308.25
|
|
- стоимость электроэнергии
на технологию
|
66502533.83
|
|
- стоимость сжатого воздуха
|
98564.14
|
|
- стоимость воды
технической
|
13972.09
|
|
- стоимость воды оборотной
|
597807.02
|
|
- зарплата основных рабочих
|
18993930.95
|
|
2
|
Амортизация оборудования
|
495632385.00
|
|
Итого
|
584690501.28
|
Таблица 15 - Смета цеховых расходов
|
№ п/п
|
Статьи
|
Сумма затрат, руб.
|
|
1
|
Содержание аппарата
управления:
|
|
|
- основная и
вспомогательная зарплата служащих
|
1892437.18
|
|
2
|
Содержание зданий,
сооружений:
|
|
|
- стоимость пара
|
5998253.63
|
|
- стоимость электроэнергии
|
356818.18
|
|
- стоимость воды на
хозяйственные нужды
|
59386.85
|
|
- затраты на ремонт
зданий, инвентаря
|
2053532.00
|
|
- амортизация зданий,
сооружений, инвентаря
|
11894220.00
|
|
3
|
Испытания, опыты,
исследования
|
3380.00
|
|
4
|
Охрана труда
|
2600.00
|
|
5
|
Прочие расходы
|
318762.17
|
|
Итого
|
44521255.68
|
3.4 Расчет себестоимости изготовления катода
Себестоимость - это затрата на изготовление и реализацию продукции.
Себестоимость катодов рассчитана на выпуск единицы продукции - 1 т катодов при
стоимости анодной меди 35590 руб./т. и ее норме расхода 1.233. Отсюда:
а) затраты на основные материалы 3 м, руб.:
· 1.233 = 43882.47;
б) транспортно-заготовительные расходы в размере 5% от 3 м:
.47 · 0.05 = 2194.12 руб.
в) основная заработная плата принята равной 224.86 руб.
г) дополнительная заработная плата принята равной 10% от основной
.86 · 0.10 = 22.49 руб.
д) отчисления на социальное страхование в размере 26.7% от основной
заработной платы:
.86 · 0.267 = 60.03 руб.
е) расходы по содержанию и эксплуатации оборудования
.26 · 339 / 100 = 105.97 руб.
ж) цеховые расходы приняты равными 507.97 руб.
з) общезаводские расходы
.26 · 195 / 100 = 60.96 руб.
и) производственная себестоимость составляет 47058.87 рублей
к) внепроизводственные расходы приняты равными 95% от производственной
себестоимости:
.87· 0.95 = 44705.93 руб.
л) полная себестоимость
.87 + 44705.93 = 91764.80 руб.
м) прибыль в размере 30% от полной себестоимости:
.80 · 0.30 = 27529.44 руб.
н) налог на добавленную стоимость в размере 18% от суммы полной
себестоимости и прибыли:
(91764.80 + 27529.44) · 0.18 = 21472.96 руб.
Таблица 16 - Формирование цены на изготовление продукции
|
Статьи калькуляции
|
Затраты на единицу
продукции, руб.
|
Затраты на весь объем, руб.
|
|
1. Основные материалы
|
43882,47
|
4388200000
|
|
2.
Транспортно-заготовительные расходы
|
2194,12
|
219412000
|
|
3. Основная заработная
плата
|
224,86
|
22486000
|
|
4. Дополнительная
заработная плата
|
22,49
|
2249000
|
|
5. Отчисления на социальное
страхование
|
60,03
|
6003000
|
|
6. Расходы по содержанию и
эксплуатации оборудования
|
105,97
|
10597000
|
|
7. Цеховые расходы
|
507,97
|
50797000
|
|
8. Общезаводские расходы
|
60,96
|
6096000
|
|
Производственная
себестоимость
|
47058,87
|
4705887000
|
|
9. Внепроизводственные
расходы
|
44705,93
|
4470593000
|
|
Полная себестоимость
|
91764,80
|
9176480000
|
|
10. Прибыль
|
27529,44
|
2752944000
|
|
11. Налог на добавленную
стоимость
|
21472,96
|
2147296000
|
|
Цена
|
140767,20
|
14076720000
|
3.5 Расчет экономической эффективности и срока окупаемости проектируемого
технологического процесса
Экономическая эффективность проектируемого технологического процесса:
Э = (Сб - Сп ) · N, (83)
где Сб и Сп - соответственно себестоимости единицы продукции по базовому
варианту и по проекту, руб.; N - объём производства, т/год.
Э = (62354.42 - 61854.57) · 100000 = 49985000 руб.
Срок окупаемости технического мероприятия  , год
, год
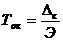 , (84)
, (84)
где Dк -
дополнительные капиталовложения, руб.
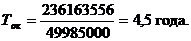
Таблица 17 -
Основные технико-экономические показатели проекта цеха электролиза меди
|
Наименование показателей
|
Значения
|
|
Наименование продукции
|
катод медный
|
|
1. Годовая программа, тн.
|
100000
|
|
2. Действительный годовой
фонд времени работы оборудования, ч.
|
5722,8
|
61854,57
|
|
4. Годовой выпуск продукции
по технологической себестоимости, руб.
|
6185457000
|
|
5. Средний коэффициент
загрузки оборудования, %
|
95
|
|
6. Количество единиц
производственного оборудования, шт.
|
672
|
|
7. Число основных рабочих,
чел
|
83
|
|
8. Фонд заработной платы
основных рабочих, руб.
|
4990604,4
|
|
9. Среднемесячная зарплата
одного рабочего руб.
|
12995,53
|
|
10. Рост производительности
труда, %
|
1
|
|
11. Экономический эффект,
руб.
|
49985000
|
|
12. Срок окупаемости, год.
|
4,5
|
4. Безопасность и экологичность производства
.1 Опасности, присутствующие при работе в цехе электролиза
В совокупности факторов, оказывающих влияние на здоровье обслуживающего
персонала, цех электролиза меди относится к производству с вредными условиями
труда.
Характерными источниками опасности в цехе являются:
аэрозоли солей никеля, меди, серной кислоты;
технологические сернокислые растворы с температурой нагрева 333-338 К;
- воздействие электрического тока;
- интенсивное передвижение грузов подъемно-транспортными устройствами.
Параметры микроклимата (допустимые значения рассматриваемых в совокупности
температуры, влажности, скорости движения воздуха) приводят к профессиональным
заболеваниям, функциональным расстройствам нервной системы, что непосредственно
сказывается на производительности труда, снижение которой достигает 20-40%. Эти
параметры являются наиболее важными из производственных факторов и требуют
тщательного контроля и поддержания согласно ГОСТ 12.1.005-88 [10].
На предприятии для осуществления процесса электролиза используются
различные электроустановки. Поражение электрическим током является одной из
тяжелых травм на производстве, поэтому проблемам электробезопасности следует
уделять повышенное внимание. Регламентируется электробезопасность ГОСТ
12.1.0300-81 [11].
В электролизном цехе имеет место большой грузопоток различных материалов
с использованием грузозахватывающих приспособлений и подъемных устройств.
Поэтому, работая в цехе, следует быть предельно внимательными к перемещающимся
грузам.
Администрация цеха должна обеспечить постоянный контроль за соблюдением
правил норм безопасности обслуживающего персонала.
Таблица 18 - Показатели условий труда в рабочей зоне
|
Наименование профессии
|
Электролизник
|
|
Категория тяжести работы
|
11 типа А
|
|
Параметры микроклимата
|
температура, 0С
|
18-20
|
|
относительная влажность, %
|
40-60
|
|
Освещенность, факт/норм, лк
|
150/150
|
|
Наименование вредного
вещества на рабочем месте
|
серная кислота
|
|
Концентрация вредного
вещества, факт/норм, мг/м3
|
0,5/1,0
|
|
Наименование
энергетического воздействия на среду
|
Повышенный уровень шума
|
|
Уровень энергетического
воздействия
|
92 дБ 80 дБ
|
|
Площадь приходящаяся на
одного работающего, факт/норма, м2
|
10/5.6
|
|
Степень риска
|
|
|
Примечание
|
|
.1.1 Характеристика веществ, используемых при работе в цехе электролиза
меди
При электролизе меди с поверхности электролита испаряется большое количество
воды, поэтому воздух цеха всегда насыщен паром. В атмосфере цеха содержится
туман, состоящий из мельчайших капель электролита (160 г/л H2SO4). Пары,
содержащиеся в цехе, легко проникают в организм человека через дыхательные
пути, поражая слизистую оболочку. При попадании на открытые участки тела серная
кислота вызывает плохо заживаемые ожоги; при поражении глаз - грозит потерей
зрения.
Кроме того, в воздухе присутствуют аэрозоли солей меди и никеля, которые,
попадая через дыхательные пути в организм человека, вызывают нарушение функций
почек и печени, а также расстройства нервной системы. Предельно допустимые
концентрации (ПДК) аэрозолей в воздухе рабочей зоны составляют, мг/м3
[12]: солей никеля - 0,005; солей меди -1,0; серной кислоты -1,0. В помещениях,
где проводятся работы с серной кислотой, всегда должны быть в наличии средства
первой медицинской помощи: питьевая вода, вата, 2-3%-ный раствор соды. В целях
профилактики все работающие в цехе обеспечиваются спецодеждой (куртка, брюки)
из сукна или перхлорвиниловой ткани, кислотостойкими рукавицами, резиновой
обувью, защитными очками или масками, респираторами типа "лепесток".
.1.2 Электробезопасность
В технологическом процессе используется постоянный электрический ток
силой 10-20 кА, являющийся источником опасности для обслуживающего персонала. В
связи с этим компоновка серий, проходы между ними и технологическим
оборудованием выполнены в соответствии с "Правилами технической
эксплуатации электроустановок" (ПЭУ) и "Правилами техники
безопасности при эксплуатации электроустановок".
В соответствии с ПЭУ по опасности поражения электрическим током цех
электрорафинирования меди относится к классу помещений с повышенной опасностью.
Особое внимание следует уделять заземлению и изоляции
электрооборудования.
В цехе должны быть в наличии средства пожаротушения электрооборудования,
изолирующие подставки, резиновые коврики.
.1.3 Опасности, связанные с перемещением грузов
Вследствие большого грузопотока материалов в цехе, перемещаемых, главным
образом, мостовыми кранами с помощью грузозахватных приспособлений (борон,
цепей, тросов), обслуживающий персонал должен соблюдать правила работы с
подъемно-транспортными устройствами, при эксплуатации которых необходимо
уделять особое внимание их состоянию, так как в агрессивной среде из-за
коррозии может наступить преждевременная потеря прочности и грузоподъемности.
Перемещение грузов с помощью грузоподъемных машин проводится в
соответствии с "Правилами устройства и эксплуатации грузоподъемных
машин".
.2 Вентиляция
Вентиляция - это комплекс взаимосвязанных устройств и процессов,
предназначенных для создания организованного воздухообмена. Вентиляция бывает
естественной (через проемы и фонари зданий) и механической, включая местную
вытяжную вентиляцию (бортовые отсосы) и общую приточную, вытяжную вентиляцию. С
целью поддержания нормального атмосферного режима в цехе выполнена
приточно-вытяжная вентиляция, обеспечивающая трехсменный обмен воздуха
производственной зоны в течение часа.
.3 Освещение помещений
Одним из важных факторов для создания благоприятных условий труда
является рациональное освещение. В цехе электролиза предусматривается
использование как естественного, так и искусственного освещения.
Естественный свет характеризуется большей степенью интенсивности и равномерности
распределения. Естественное освещение может быть боковым, верхним,
комбинированным. Процесс в цехе осуществляется непрерывно, поэтому одного
естественного освещения недостаточно, необходимо использовать искусственное
освещение по существующим нормам.
Для искусственного освещения выбирают лампы ДРЛ, что обусловлено
комплексом достоинств: большая электрическая и световая мощность,
сосредоточенная в ограниченном объеме. Их работа практически не зависит от
температуры окружающей среды и положения лампы.
Количество светильников Nn, шт, необходимое для обеспечения нормальной
освещенности электролизного цеха Е = 160 лк [13]:
Nn = Е · К · S · Z / (n · cл · h), (85)
где: К - коэффициент запаса (1.1 -1.3); S - площадь пола, м2
(12660); Z - поправочный коэффициент светильника (1.25); n - число ламп в
светильнике, шт (2); cл - световой поток, обеспечиваемый одной лампой, лм (21000), h - коэффициент использования
светового потока (0,52) [13].=150 · 1,1 · 12660 · 1,25 / (2 · 21000 · 0,52) =
120 шт.
Электрическая мощность осветительной установки W , кВт, составит:
= Nn · Р = 120 · 0,5 = 60.0. (86)
Расстояние между светильниками L, м:
= cc · h, (87)
где cc -
коэффициент светотехнически воздействующего расположения светильников (1,3); h
- расстояние от основного оборудования до светильника, м (5.0) . Тогда L = 1,3
· 5 = 6,5 м.
В цехе предусматривается устройство ремонтного освещения при проведении
работ в затемненных местах. Напряжение в сети ремонтного освещения 12 В,
мощность ламп накаливания до 100 Вт.
Также в цехе необходимо аварийное освещение:
для эвакуации людей из помещения,
для продолжения работы при аварийном отключении основного освещения,
причем Еав = 0,1 · Ер = 0,1·150 = 15 лк.
4.4 Пожарная безопасность
По степени пожарной опасности производства медеэлектролитных цехов
относят категории "Д". Для обеспечения пожарной безопасности цех
должен быть снабжен необходимым количеством огнетушителей, противопожарным
инвентарем согласно ГОСТ 12.1.004-85 Предусматриваем наличие эвакуационных
выходов, которые должны всегда держаться свободными с целью обеспечения быстрой
эвакуации людей в случае пожара.
.5 Экологичность производства
Экология является базой охраны окружающей среды - области знаний,
разрабатывающей комплекс мероприятий, направленных на предупреждение вредных
воздействий на природу. Неблагоприятная экологическая обстановка в цехе
сказывается не только на людях, но и на оборудовании, значительно (на 30-50%)
сокращая срок службы основных производственных фондов.
Медеэлектролитные производства являются крупными потребителями таких
природных ресурсов как вода и воздух. В процессе получения чистой катодной меди
значителен расход воды, но этот факт не заслуживает особого внимания, так как
достоинством производства является 100%-ный водооборот.
Проблема в данном случае заключается в предотвращении попадания
загрязненных продуктов в атмосферу, землю, природный водооборот. За
поддержанием показателей ПДК вредных веществ следит химическая лаборатория
комбината.
4.6 Чрезвычайные ситуации
Чрезвычайная ситуация - неожиданная, внезапно возникшая обстановка,
характеризующаяся резким нарушением установившегося процесса или явления и
оказывающая значительное отрицательное влияние на жизнеспособность населения,
функционирование экономики, социальную сферу и природную среду.
По причинам возникновения чрезвычайные ситуации подразделяют на стихийные
бедствия, техногенные катастрофы, социально-политические катаклизмы.
В условиях медеэлектролитного производства наиболее вероятной
чрезвычайной ситуацией является пожар, относящийся к техногенным катастрофам.
При образовании обширных очагов пожара или при быстром распространении огня
необходимо:
отключить электроэнергию;
начать тушение пожара собственными силами;
оповестить о пожаре работающих;
организовать эвакуацию работающих;
вызвать пожарную охрану.
Заключение
На основании современного состояния технологии электролитического
рафинирования меди на ЗАО "Кыштымский медеэлектролитный завод" для
производства 100 тыс. тонн катодной меди в год необходимы 672 ванны (28 серий
по 24 ванны в серии) размерами, м, 3.735 * 1.100 *1.260 и помещения общей
площадью 18.3 тыс. м2.
Товарная катодная медь соответствует марке М00К ГОСТ 859 (стандарт ИСО
197/1 - 1983).
Выполнение производственной программы обеспечивается 123 работающими, в
т.ч. ИТР - 21 чел. Цеховой фонд заработной платы рабочих, служащих и
руководителей равен 24.2 млн. руб.
Экономический эффект мероприятия - перехода на безосновную технологию
производства катодов - составил 49.9 млн. руб. при сроке окупаемости 4.5 года.
Производство катодной меди является безопасным и экологически чистым.
Библиографический список
1. Набойченко
С.С. Расчеты гидрометаллургических процессов / С.С. Набойченко, А.А. Юнь. - М.:
Металлургия, 1995. - 428 с.
. Вольхин
А.И. Анодная и катодная медь / А.И. Вольхин, Е.И. Елисеев, В.П. Жуков и др.;
под редакцией Смирнова Б.Н. - Челябинск: Полиграфическое объединение
"Книга", 2001. - 431 с.
. Набойченко
С.С. Процессы и аппараты цветной металлургии: учебник для вузов / С.С.
Набойченко, Н.Г. Агеев, А.П. Дорошкевич и др. - Екатеринбург: Изд. ГОУ ВПО
УГТУ-УПИ, 2005. - 700 с.
. Алкацев
М.И. Электропроводность медных электролитов как функция состава и температуры /
М.И. Алкацев, В.И. Карлов // Известия вузов. Цветная металлургия. - 1987. - №3
- С. 13-18.
. Основы проектирования
электрохимических производств: методические указания к курсовому и дипломному
проектированию / сост. В.Н. Самойленко, А.В. Помосов. Ч. I. - Свердловск: Изд.
УПИ, 1985. - 41 с.
. Юрьев Б.П.
Проектирование цехов электролитического рафинирования и получения тяжелых
цветных металлов. Учебное пособие. - Л.: ЛТЦ, 1981. - 76 с.
. Баймаков
Ю.В. Электролиз в гидрометаллургии / Ю.В. Баймаков, А.И. Журин;. 2-е изд.,
перераб. и доп. - М.: Металлургия, 1977. - 616 с.
. Худяков
И.Ф. Металлургия меди, никеля, сопутствующих элементов и проектирование цехов /
И.Ф. Худяков, С.Э. Кляйн, Н.Г. Агеев - М.: Металлургия, 1993. - 432 с.
. Лоскутов
Ф.М. Расчеты по металлургии тяжелых цветных металлов / Ф.М. Лоскутов, А.А.
Цейдлер - М.: Металлургия, 1963. - 542 с.
. Гудима Н.В.
Технологические расчеты в металлургии тяжелых цветных металлов / Н.В. Гудима,
Ю.А. Карасев, Б.Б. Кистяковский и др. - М.: Металлургия, 1977. - 256 с.
12. Павлов
К.Ф. Примеры и задачи по курсу процессов и аппаратов химической технологии /
К.Ф. Павлов, П.Г. Романков - М.: Химия, 1981. - 552 с.
13. Система стандартов безопасности труда: [сборник]. - М.: Изд-во
стандартов, 2002. - 102 с. - (Межгосударственные стандарты).
. ГОСТ 12.1.030 - 81. ССБТ. Электробезопасность. Защитное заземление.
Зануление. - Введ. 1981-01-01. - М.: Госстандарт России: Изд-во стандартов,
2001. - IV, 27 с.
. ГОСТ 21.1.007 - 2001. ССБТ. Вредные вещества. Классификация и общие
требования безопасности. - Введ. 2002-01-01. - М.: Госстандарт России: Изд-во
стандартов, 2001. - IV, 27 с.
16. СНиП
Строительные нормы и правила. Нормы проектирования. Естественное и
искусственное освещение - М.: Стойиздат, 1995. - 57 с.