Растворимость солей в неводных растворителях
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
УКРАИНЫ
ХАРЬКОВСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ
ИМЕНИ В.Н. КАРАЗИНА
Кафедра физической химии
РАСТВОРИМОСТЬ СОЛЕЙ В НЕВОДНЫХ
РАСТВОРИТЕЛЯХ
Курсовая работа
студентки гр. Х-134 химического факультета
СИНЬКО АННЫ ЕВГЕНЬЕВНЫ
Научный руководитель:
старший преподаватель Т.А. Чейпеш
ХАРЬКОВ 2014
Реферат
Курсовая работа содержит 24 страницы, 2 раздела, рисунков,
таблицы, литературных источников.
Целью данной курсовой работы было изучение растворимости и
растворимости солей в неводных растворителях.
В ходе работы были изучены такие понятия: растворимость,
растворитель, неводный растворитель. Рассмотрены численные характеристики
растворимости, а так же методы их определения; виды растворителей и их
классификация; характеристики растворителей, определяющие растворимость
различных классов веществ. Найдены литературные данные относительно
растворимости 3 разных веществ в пяти различных растворителях, охарактеризованы
закономерности растворимости и выделены основные причины различий растворимости
веществ в разных растворителях.
КЛЮЧЕВЫЕ СЛОВА: РАСТВОРИТЕЛЬ, РАСТВОРИМОСТЬ, РАСТВОР,
НЕВОДНЫЕ РАСТВОРИТЕЛИ, РАСТВОРЯЕМОЕ ВЕЩЕСТВО, ПОЛЯРИЗАЦИЯ
Содержание
Реферат
Вступление
1. Понятие "растворимость"
2. Методы определения численных характеристик
2.1 Растворимость твердых веществ в жидкости
2.2 Растворимость газов в жидкости
2.3 Взаимная растворимость жидкостей
3. Растворители
3.1 Понятие "растворитель"
3.2 Требования, предъявляемые к растворителям
4. Классификация растворителей
5. Характеристики растворителей
5.1 Неорганические растворители
5.2 Органические растворители
6. Применение
7. Экспериментальная часть
7.1 Неводные растворы
7.2 Зависимость растворимости от природы растворенного вещества
7.3 Зависимость растворимости от природы растворителя
Список литературы
Вступление
Исторически применения растворителей достигает времен
алхимии, и первым веществом, которое использовали в качестве растворителя, была
вода. Длительный процесс поиска универсального растворителя, хотя и не имел
успеха, привел ко многим новым растворителей, новых реакций, а также известного
химического правила - подобное растворяется в подобном. Образование раствора
является прежде всего химическим процессом. Растворитель выступает в роли
активного участника химического процесса, существенно влияет на скорость,
селективность, а иногда и на направление реакции.
Применение неводных растворителей в современной
лабораторно-заводской практике расширяется с каждым днем. Использование таких
жидких растворителей, как аммиак, фтороводород, уксусная кислота и других идет
уже в промышленном масштабе. В неводных средах можно успешно получать такие
вещества, которые иным способом синтезировать невозможно. Это безводные
сульфиды щелочных металлов, применяемые в технологии изготовления
полупроводниковых материалов и светящихся составов, различные полупродукты
множества органических синтезов, Неводные растворители позволяют, с одной
стороны, дифференцировать по силе те кислоты и основания, у которых кислотность
или основность нивелирована в водном растворе.
С другой стороны, неводные растворители способны усилить
протолитические способности разных веществ (по сравнению с водным раствором), и
вызвать появление кислотно-оснόвных свойств у тех
веществ, которые в водной среде ведут себя как непротолиты.
В изучении химии неводных растворителей достигнуты немалые
успехи, но она все еще таит в себе много неожиданного и ждет новых
исследователей. Дальнейшие исследования в этом направлении несомненно сыграют
большую роль в формировании единой физико-химической теории растворов кислот и
оснований.
Процесс взаимодействия растворителя и растворённого вещества
называется сольватацией (если растворителем является вода - гидратацией).
Растворение протекает с образованием различных по форме и
прочности продуктов - гидратов. При этом участвуют силы как физической, так и
химической природы. Процесс растворения вследствие такого рода взаимодействий
компонентов сопровождается различными тепловыми явлениями.
Энергетической характеристикой растворения является теплота
образования раствора, рассматриваемая как алгебраическая сумма тепловых
эффектов всех эндо - и экзотермических стадий процесса. Наиболее значительными
среди них являются:
поглощающие тепло процессы - разрушение кристаллической
решётки, разрывы химических связей в молекулах;
выделяющие тепло процессы - образование продуктов
взаимодействия растворённого вещества с растворителем (гидраты) и др.
растворимость соль неводный растворитель
1. Понятие
"растворимость"
Растворимость - способность вещества образовывать с другими
веществами однородные системы - растворы
<https://ru.wikipedia.org/wiki/%D0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80>,
в которых вещество находится в виде отдельных атомов
<https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC>, ионов
<https://ru.wikipedia.org/wiki/%D0%98%D0%BE%D0%BD>, молекул
<https://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D0%B0>
или частиц. Растворимость выражается концентрацией
<https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%BD%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B0%D1%86%D0%B8%D1%8F_%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%BE%D0%B2>
растворённого вещества в его насыщенном растворе
<https://ru.wikipedia.org/wiki/%D0%9D%D0%B0%D1%81%D1%8B%D1%89%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9_%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80>
либо в процентах
<https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%86%D0%B5%D0%BD%D1%82>,
либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит
от температуры и давления. Растворимость жидких
<https://ru.wikipedia.org/wiki/%D0%96%D0%B8%D0%B4%D0%BA%D0%BE%D1%81%D1%82%D1%8C>
и твёрдых веществ - практически только от температуры. Все вещества в той или
иной степени растворимы в растворителях. В случае, когда растворимость слишком
мала для измерения, говорят, что вещество нерастворимо. Для систем жидкость-газ
и жидкость-твёрдое тело растворителями принято считать жидкофазный компонент;
для систем жидкость-жидкость и твердое тело-твердое тело - компонент,
находящийся в избытке.
Растворение - сложный физико-химический процесс. Физическая его
часть - это разрушение структуры растворяемого вещества и распределение его
частиц между молекулами растворителя. Химическая сторона процесса растворения -
взаимодействие молекул растворителя с частицами растворенного вещества. В
результате этого взаимодействия образуются сольваты - продукты переменного
состава.
Растворимость вещества зависит от его природы и агрегатного
состояния до растворения, а также от природы растворителя и температуры
приготовления раствора.
2. Методы
определения численных характеристик
2.1
Растворимость твердых веществ в жидкости
На растворимость любых веществ, прежде всего, влияет природа
растворителя и растворенного вещества. Идеальные растворы образуются
веществами, сходными по химическому составу и по физическим свойствам. Часто
сходство и различие выражается в виде полярности молекул и отражается на
растворимости: полярные вещества проще растворяются в полярных растворителях, а
неполярные - в неполярных растворителях.
из внешних факторов наиболее значимым является температура.
При образовании идеальных растворов твердого вещества в жидкости влияние
температуры определяется уравнением И.Ф. Шредера:
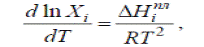
Где
Хi - растворимость i-го компонента
(молярная доля i-го компонента в насыщенном растворе); ∆Нiпл
- его молярная теплота плавления.
Поскольку ∆Нiпл>0, то 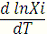
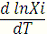 >0, следовательно, идеальная растворимость твердого вещества в
жидкости приповышении температуры всегда увеличивается.
>0, следовательно, идеальная растворимость твердого вещества в
жидкости приповышении температуры всегда увеличивается.
Интегрирование уравнения в пределах от Хі1 до
Хі2 и от Т1 до Т2 приводит к
уравнению:
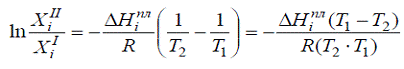
Если Хi1 (чистый компонент) Т1
=Ті0 пл, тогда:
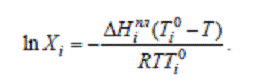
Для реальных растворов уравнение имеет другой вид:
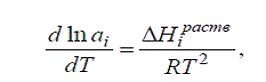
Где аi - растворимость, выражается в виде
активности растворенного вещества; ∆Ніраств
- молярная теплота растворения вещества в насыщенном растворе.
Поскольку ∆Ніраств может иметь
и положительные, и отрицательные значения, и даже равняться нулю, то и первая
производная 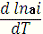
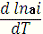 , так же имеет разные знаки:
, так же имеет разные знаки:
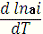
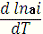 > 0, с ростом температуры растворимость увеличивается;
> 0, с ростом температуры растворимость увеличивается;
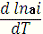
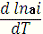 < 0, с ростом температуры растворимость уменьшается;
< 0, с ростом температуры растворимость уменьшается;
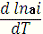
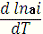 = 0, изменение температуры влияет на растворимость.
= 0, изменение температуры влияет на растворимость.
2.2
Растворимость газов в жидкости
Влияние давления газа на растворимость выражается законом
Генри:
Р2=КХ2
Где Р2 - парциальное давление
расстворенного газа, К - константа Генри, Х2-молярная
доля растворенного газа в растворе;
Закон Генри был получен для газов, не вступающих в химическое
взаимодействие с растворителем, применим при постоянной температуре и невысоких
давлениях.
Он может быть применен и для растворов летучих жидкостей при
образовании бесконечно разбавленого раствора.
Рис. 1.1 Зависимость давления от состава раствора в реальных
системах
Рассмотрим линию парциального давления компонента А. В
области растворов с большим содержанием компонента А он является растворителем,
и зависимость PA=f (XA), выражается прямой,
совпадающей с прямой PA=PA0∙XA
(пунктирная линия по закону Рауля). В области больших содержаний компонента
В, компонент А является растворенным веществом, заависимость PA=f
(XA) на этом участке так же прямолинейна, но подчиняется закону Генри
РА=КХА и идет по прямой не совпадающей с
пунктирной линией, так как в реальных газах К≠РА С
расширением интервала концентраций идеального состояния раствора прямолинейные
отрезки кривых увеличиваются. Если же раствор будет идеальным при всех концентрациях,
то уравнение законов Рауля и Генри будут тождвестнными, К=Р20.
В этом случае кривые становятся прямыми линиями.
Закон Генри будет записан в другой форме.
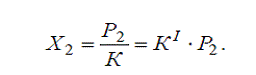
Растворимость газа не вступающего в химическое взаимодействие
с растворителем, прямопорциональна его парциальному давлению в газовой фазе.
Мерой растворимости газа служит так же а - коэффициент
поглощения (коэффициент адсорбции). Это объем газа, приведенный к нормальным
условиям, растворенный в одном объеме растворителя.
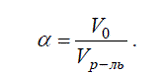
На растворимость газов влияет присутствие и третьего
компонента. Так в водных солевых растворах растворимость газа меньше.
Зависимость растворимости газа в водном растворе от
концентрации соли выражается уравнением Сеченова:
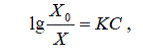
Где Х0, Х - мольные доли газа в жидкой воде
и солевом растворе соответственно, С-концентрация соли, моль/л; К -
константа характерная для данной соли.
При совместной растворимости нескольких газов каждый газ
растворяется в жидкости независимо от других газов.
2.3 Взаимная
растворимость жидкостей
На растворимость жидкостей друг в друге, кроме природы
жидкостей, большое влияние оказывает температура.
Возрастание растворимости с повышение температуры:
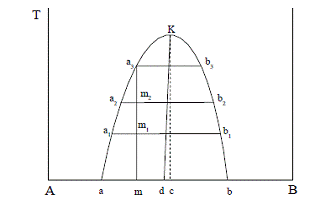
Рис. 1.2 Диаграмма взаимной растворимости двух жидкостей
Линия аК - линия растворимости В и А в зависимости от
температуры. Линия bК - линия растворимости А и В. Область аКb - область
равновесного существования двух жидких фаз, состав которых находится на линиях
аК и bК. Точка К - верхняя критическая точка растворения.
При повышении температуры взаимная растворимость компонентов
увеличивается и состав равновесных жидких фаз изменяется.
положение верхней критической температуры можно определить,
применив правило Алексеева: середины нод ложаться на общую прямую, которая
заканчивается в критической точке растворения.
3.
Растворители
3.1 Понятие
"растворитель"
Растворители - индивидуальные химические соединения или их смеси,
способные растворять различные вещества, то есть образовывать с ними однородные
системы переменного состава двух или большего числа компонентов.
К растворителям относятся вещества, обладающие свойствами:
обладающие активной растворимостью;
неагрессивны к растворяемому веществу и аппаратуре;
отличающиеся минимальной токсичностью и огнеопасностью;
доступны и дешевы.
3.2
Требования, предъявляемые к растворителям
В принципе, любое вещество может быть растворителем для
какого-либо другого вещества. Однако на практике к растворителям относят только
такие вещества, которые отвечают определённым требованиям.
должны быть устойчивыми при хранении, химически и
фармакологически индифферентными
должны обладать высокой растворяющей способностью
должны быть дешевыми, общедоступными и иметь простой способ
получения
не должны обладать неприятным вкусом и запахом
не должны быть огнеопасными и летучими
не должны служить средой для развития микроорганизмов
4.
Классификация растворителей
Растворители классифицируют по физическим и химическим
свойствам.
По физическим свойствам растворы классифицируют:
По диэлектрической проницаемостью (ε) растворители подразделяются на растворители с низкой (1,9-12),
средней (12-50) и высокой (?50) величиной проницаемости;
По плотности растворители подразделяют на растворители с
низкой плотностью (?2 спз), со средней (2-10 спз) и высокой (?10 спз) плотностью;
По температуре кипения (при 760 мм рт. Ст) делятся на
растворители с низкой (?100° С), средней (100-150° С) и высокой (?150° С) температурой
кипения;
По возможности до испарения в соответствии с температурой
испарения растворы подразделяются на легколетучие (˂10), средне летучие
(10-35) и трудно летучие (˃35) растворители.
По сочетанием восьми физических характеристик: функции
Кирквуда, мольной рефракции, параметру растворимости Гильдебранда, показателя
преломления, температуры кипения, дипольного момента, а также энергий высшей
заполненной и нижней незаполненной молекулярных орбиталей:
) апротонных диполярного (ацетонитрил, нитрометан, ацетон,
1,2-дихлорэтан);
) апротонных высоко полярные (пропилен карбонат, нитробензол
и др.);
) апротонных високодиполярни и високополяризуеми (сульфолан);
) Ароматические неполярные (бензол, толуол);
) Ароматические относительно полярные (хлорбензол, о-дихлорбензол,
ацетофенон);
) Електроннодонорни (триэтиламин, простые эфиры, диоксан);
) Растворители с Н-связью (спирте, карбоновые кислоты);
) Сильно ассоциированные растворители с Н-связью (формамид,
диэтиленгликоль, вода);
) Растворители с неопределенной функцией (сероуглерод,
хлороформ).
По химическим свойствам растворы классифицируют:
В зависимости от участия в кислотно-основной протеолитический
равновесии:
Протолитические - растворители, которые проявляют
протонодонорну или протоноакцептторну функцию относительно растворенного
вещества. В зависимости от этого протеолитические растворители подразделяют на
протогенни (кислые), протофильни (основные) и амфипротонни (амфотерные).
Апротонных - растворители не способны к кислотно-основного
взаимодействия, связанного с переносом протона.
За способность к образованию Н-связей:
Первый класс - жидкости, способные к образованию объемной
трехмерной сетки. Имеют высокую диэлектрическую проницаемость и хорошо
растворимые друг в друге (вода, муравьиная кислота, гликолиз и др.).
Второй класс - растворители, в которых возникает двумерная
сетка Н-связей. Имеет слабее стремление к образованию подобных связей.
Большинство растворителей данного типа имеют ОН-группу (фенолы, одноосновные
ниже карбоновые кислоты, одноатомные спирты).
Третий класс - жидкости, молекулы которых имеют в своем
составе атомы азота, кислорода, серы, фтора и некоторые другие способны
образовывать Н-связи с протоном партнеру (эфиры, амины, кетоны. Альдегиды и
вещества других классов органических соединений).
Четвертый класс - жидкости, молекулы которых имеют атом
водорода, способный участвовать в Н-связи, но не имеют атомов, которые могли бы
быть акцепторами протона (хлороформ, дихлорэтан и др.).
Пятый класс - растворители, молекулы которых при обычных условиях
не способны к образованию Н-связей - ни как доноры, ни как акцепторы (углеводы,
четырех хлорный углерод, пергалогенвуглець и др.).
По возможности растворителя сольватуваты ионы (классификация
Паркера):
аполярных апротонные растворители - жидкости с низкой
диэлектрической проницаемостью (˂ 15) и низким дипольным моментом (0-2 D)
(углеводороды и их галогенпроизводных, сероуглерод, третичного амины и др.)
диполярного апротонные растворители - жидкости со
сравнительно небольшими диэлектрической проницаемости (˃ 15) и дипольными
моментами (˃ 2,5) (серный ангидрид, нитробензол, ацетонитрил,
диметилформамид и др.).
Протонные растворители содержат группы, в атом водорода
соединен электроотрицательным атомом, что обусловливает его способность
вступать в Н-связь. Имеют высокую диэлектрическую проницаемость [11].
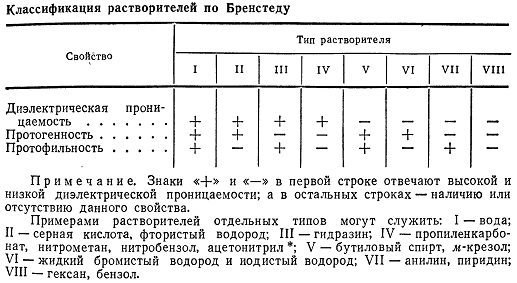
По Бренстедом, сочетая диэлектрическую проницаемость
растворителя и его протогеннисть или протофильнисть. [11]
5.
Характеристики растворителей
5.1
Неорганические растворители
Самым распространенным и универсальным растворителем является
вода. В ней в тех или иных количествах могут растворяться почти все вещества.
Характеристика некоторых неорганических растворителей К числу неорганических
растворителей относятся:
вода (самый распространённый растворитель в природе);
жидкий аммиак (хороший растворитель для щелочных
металлов), -жидкий сернистый ангидрит (растворитель для многих
органических и неорганических соединений)
расплавленные металлы (ртуть, галлий)
углеводороды:
>алифатические - пентан, гексан, гептан и др.;
>алициклические - циклопентан, циклогексан, декалин и др.;
Углеводороды хорошо растворяют жиры, масла, смолы, каучуки и
др. В воде они практически не растворяются. Они летучи и огнеопасны (пары их с
воздухом могут образовывать взрывчатые смеси). Многие углеводороды токсичны.
>галоидопроизводные углеводороды: алифатического ряда -
хлористый метилен, хлороформ, четыреххлористый углерод, дихлорэтан, трихлорэтан
и др.;
>ароматические растворители обладают более высокой
растворяющей способностью по сравнению с другими углеводородными растворителями
и в качестве составляющих компонентов входят в большинство смесевых
растворителей.
Бензол СбН6. Получают из продуктов пиролиза
нефти и из каменноугольного сырого бензола, является растворителем масел,
жиров, восков, каучуков, простых и сложных эфиров целлюлозы,
крезолоформальдегидных и некоторых кремнийорганических смол. При нагревании
растворяет полиэтилен. В настоящее время из-за высокой токсичности практически
не используется в качестве растворителя.
Толуол СбН5СН3. Получают из
нефтяных фракций и каменноугольной смолы. По растворяющей способности подобен
бензолу, однако в отличие от него не растворяет природные смолы шеллак и копал,
а также сложные эфиры целлюлозы. Применяется для растворения тощих алкидов
Ксилол СбН5 (СН3) 2. По получению и
свойствам подобен толуолу. Из трех изомеров наилучшей растворяющей способностью
обладает о-ксилол. Однако смесь изомеров является более плохим
растворителем, чем толуол. Это, повидимому, можно объяснить высоким содержанием
в технических растворителях м - и n-ксилолов. Применяется ксилол
для растворения алкидностирольных и дивинилацетиленовых (лак этиноль)
полимеров, бутанолизированных меламиноформальдегидных смол.
Изопропилбензол С6Н5СН (СН3)
2 ГОСТ 14198-78. Получают путем алкилирования бензола. Растворяет
полиакрилаты, полиметакрилаты, полистирол и другие полимеризационные полимеры.
Как растворитель используется сравнительно редко.
Сольвент. Получают в процессе коксования каменного угля и при
пиролизе нефтяных фракций. Сольвент каменноугольный представляет собой смесь
ароматических углеводородов с небольшим содержанием нафтенов, парафинов и
непредельных циклических углеводородов. Так, в нефтяном сольвенте присутствует
около 56 % ароматических углеводородов, а остальное составляют непредельные
углеводороды. Перспективным является использование в качестве растворителей
тяжелых сольвентов с интервалом температур кипения 180-290°С. Сольвент применяется
для растворения масел, битумов, каучуков, мочевино - и меламиноформальдегидных
олигомеров, полиэфиров терефталевой кислоты, полиэфирамидов и полиэфиримидов,
меламиноалкидных лакокрасочных материалов.
Тетралин (тетрагидронафталин) С10Н12;.
Получают путем восстановления нафталина водородом. Растворитель жиров, масел,
битумов, каучука. Используется в смывках старых масляных красок.
6. Применение
Применение неводных растворителей в современной
лабораторно-заводской практике расширяется с каждым днем. Использование таких
жидких растворителей, как аммиак, фтороводород, уксусная кислота и других идет
уже в промышленном масштабе. В неводных средах можно успешно получать такие
вещества, которые иным способом синтезировать невозможно. Это безводные сульфиды
щелочных металлов, применяемые в технологии изготовления полупроводниковых
материалов и светящихся составов, различные полупродукты множества органических
синтезов, например, фтор - и хлорсульфоновая кислоты HSO3F и HSO3Cl, соединения
титана (IV) и циркония (IV) типа Ti (NO3) 4 и Zr (SO4) 2, гидридные комплексы
типа Li [AlH4], гидроксид серебра AgOH и многие другие химические соединения.
Неводные растворители позволяют, с одной стороны,
дифференцировать по силе те кислоты и основания, у которых кислотность или
основность нивелирована в водном растворе. Так, например, хлорная кислота HClO4
и азотная кислота HNO3 в водном растворе ведут себя как одинаково сильные
кислоты, нацело подвергаясь протолизу, но в неводном растворителе - уксусной
кислоте СН3СООН, судя по значениям констант кислотности, азотная кислота
становится в 30952 раза слабее хлорной.
С другой стороны, неводные растворители способны усилить
протолитические способности разных веществ (по сравнению с водным раствором), и
вызвать появление кислотно-оснόвных свойств у тех
веществ, которые в водной среде ведут себя как непротолиты.
Так, анилин C6H5NH2 в воде - весьма слабое основание с
константой основности 3,8.10-10 (при 25° С), но в муравьиной кислоте он
становится очень сильным акцептором протонов (Kо = 0,36).
7.
Экспериментальная часть
7.1 Неводные
растворы
Неводные растворы - это жидкие растворы, в которых
растворителем является любая жидкость, кроме воды.
Растворимость твердых веществ в жидкостях почти не зависит от
давления, но, как правило, сильно изменяется с температурой.
Обычно растворимость твердых веществ возрастает с повышением
температуры, но известны вещества, как например Са (ОН) 2, Са (С2Н3O2)
2 и др., растворимость которых с повышением температуры понижается.
Предельная растворимость многих веществ неводных
растворителях представляет собой постоянную величину, соответствующую
концентрации насыщенного раствора при данной температуре. Она является
качественной характеристикой растворимости и приводится в справочниках в
граммах на 100 г растворителя (при определённых условиях).
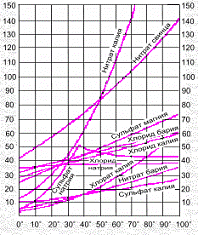
Рис. 2.1 Зависимость растворимости от температуры
Растворимость зависит от природы растворяемого вещества и
растворителя, температуры и давления.
Таблица 2.1 Растворимость HgCl2 в неводных
растворителях
|
Растворитель
|
Температура
(t), ̊С
|
Растворимость
(s)
|
|
Глицерин
|
20 25
|
53,5 79,2
|
|
Ацетон
|
20
|
120-160
|
|
Пиридин
|
0 20 145
|
15,1 22,5 230
|
|
Метиловый спирт
|
10 20 22 40 60
|
53,5 65,3 70,4
76,0 85,1
|
|
Этиловый спирт
|
-60 -40 0 20 40
80 100 120
|
3,1 10,9 42,5
47,1 55,3 90,5 118,8 159,7
|
Таблица 2.2 Растворимость KBr в неводных
растворителях
|
Растворитель
|
Температура
(t), ̊С
|
Растворимость
(s)
|
|
Аммиак
|
0
|
26,87
|
|
Глицерин
|
20 20 25
|
20,6 17,2 17,8
|
|
Метиловый спирт
|
0 10 20 40 60
|
1,82 1,93 2,08
2,37 2,74
|
|
Этиловый спирт
|
20 40 55
|
0,455 0,566
0,54
|
|
ацетон
|
25
|
0,004
|
Таблица 2.3 Растворимость NaCl в неводных
растворителях
|
РастворительТемпература
(t), ̊СРастворимость
(s)
|
|
|
|
Аммиак
|
0 -30
|
12,9 4,2
|
|
Ацетон
|
18
|
0,000032
|
|
Глицерин
|
25
|
|
Метиловый спирт
|
25
|
1,31
|
|
Этиловый спирт
|
25
|
0,065
|
7.2
Зависимость растворимости от природы растворенного вещества
Важнейшим фактором, который нужно учитывать при
термодинамическом анализе процесса сольватации в растворах является энергия реорганизации
растворителя зависящая от размера молекул растворённого вещества.
Так NaCl растворимость в одних и тех же неводных
растворителях меньше, чем у KBr, так как молекула хлорида натрия меньше.
Так же растворимость зависит от поляризующего действия катиона
и поляризации аниона.
Из таблицы 2.1 хорошо видно, что повышение температуры
повышает и значение растворимости.
Поляризация оказывает влияние на растворимость солей в
полярных растворителях, сопровождающуюся диссоциацией электролита на ионы:
увеличение поляризационного эффекта обычно сопровождается понижением
растворимости. Поляризуемость галогенид-анионов возрастает в ряду F-<Cl-<Br-<I-.
Поляризация облегчает разрушение кристаллической решетки
ионных соединений. Это явление обусловлено тем, что в результате поляризации
ионы дополнительно сближаются, что приводит к деформации решетки и делает ее
менее устойчивой. Следствием этого процесса является, в частности, понижение
температуры плавления соединений с ув. еличением поляризационного эффекта. Так,
ионы Ca2+ и Hg2+ имеют близкие ионные радиусы (114 и 116
пм); однако поляризующая способность иона ртути, имеющего конфигурацию 5d10,
выше поляризующей способности иона кальция, в результате чего соли кальция
имеют более высокую температуру плавления, чем соли ртути с теми же анионами
7.3
Зависимость растворимости от природы растворителя
Специфической особенностью неводных жидкостей является способность
их молекул <http://www.chemport.ru/data/chemipedia/article_2219.html>
выступать в качестве доноров или акцепторов протонов и электронных пар
<http://www.chemport.ru/data/chemipedia/article_2680.html>. Протонные
электролиты неводные содержат подвижный протон Н+ - это спирты
<http://www.chemport.ru/data/chemipedia/article_6333.html>, фтороводород
и др. Как правило, они хорошо сольватируют малые анионы с образованием прочных
водородных связей. Растворители, не содержащие подвижного протона, наз.
диполярными апротонными (диметилформамид, диметилсульфоксид
<http://www.chemport.ru/data/chemipedia/article_1121.html>. ацетон, и
др.); они активно взаимодействуют с большими легко поляризуемыми анионами.
Электронодонорные растворители содержат атомы
<http://www.chemport.ru/data/chemipedia/article_322.html> с неподеленными
электронными парами: О (спирты, эфиры, кетоны), N (амины, амиды), S (сульфиды,
сульфоксиды), Р (фосфины) и др. Они характеризуются высокой способностью
сольватировать преимущественно катионы
<http://www.chemport.ru/data/chemipedia/article_1607.html>.
Электроноакцепторные растворители могут быть как протонными (спирты, фенолы и
др.), так и апротонными (уксусный ангидрид, нитробензол
<http://www.chemport.ru/data/chemipedia/article_6150.html>. нитрометан и
др.). Поскольку донорами электронной пар
<http://www.chemport.ru/data/chemipedia/article_2680.html>. является
большинство анионов, электроноакцепторные растворители сольватируют
преимущественно анионы
<http://www.chemport.ru/data/chemipedia/article_236.html>.
Список
литературы
1.
Кипнис А.Я., Развитие химической термодинамики в России/ А.Я. Кипнис-М. - Л. 1964
.
Руководство по физической химии / [Стенникова М.Ф., Мусько Н.П., Беушева О.С.,
Комарова Н. Г.], изд-во АлтГТУ, 2010 - 15с.
.
Справочник химика/ [З.И. Грова, В.А. Коц, В.Д. Паастро, С.Л. Помарченко]. - М.:
Химия, 1965. - 291с 4. Мищенко К.П., Полторацкий Г.М. Термодинамика и строение
водных и неводных растворов электролитов // Санкт-Петербург - 1976. -
С.253-269.
.
Фиалков Ю.Я., Тевтуль Я.Ю. // ЖНХ - 1983. - №9 С.2342-2347 6. Фиалков Ю.Я.
Двойные жидкие системы // Санкт-Петербург - 1984 - С.144-161.
.
Э. Амис. Влияние растворителя скорость и механизм реакции/ Амис Э. - М.: Химия,
1968 с
8.
http://school-sector. relarn.ru/nsm/chemistry/Rus/Data/Text/Ch1_6-1.html
<http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch1_6-1.html>
. Вісник Харківського
національного університету. 2010. № 932. Хімія. Вип. 19 (42)
.
<http://studall.org/all-8895.html>
. Ю.А. Фиалков.
Растворитель как средство управления химическим процессом/ Фиалков Ю.А. - М.:
Химия, 1990 с.