Периодическая система химических элементов с точки зрения современной науки
Тема:
Периодическая система химических элементов с точки зрения современной науки
АБСТРАКТ
Периодическая таблица является
графическим выражением закона
<#"822359.files/image001.gif">) и
характеризует структуру системы со стороны ее упорядоченности, а вторая,
именуемая как энтропия отражения (S), является показателем структурного хаоса
[9]. Чем большее разнообразие проявляют элементы системы по какому-либо
признаку, тем выше энтропия отражения и ниже аддитивная негэнтропия. И чем
более однородны элементы, тем больше аддитивная негэнтропия и меньше энтропия
отражения. При этом в любой системе A с фиксированным числом элементов m(A)
всегда наблюдается равенство: 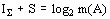 . То есть, при любых структурных
преобразованиях системы, происходящих без изменения числа ее элементов, сумма
порядка и хаоса сохраняет свое постоянное значение. При этом необходимо
отметить, что приведенное равенство асимптотически эквивалентно уравнению
перехода системы идеальных газов из структурно-упорядоченного состояния в
состояние термодинамического равновесия, выраженному с помощью энтропии Л.
Больцмана.
. То есть, при любых структурных
преобразованиях системы, происходящих без изменения числа ее элементов, сумма
порядка и хаоса сохраняет свое постоянное значение. При этом необходимо
отметить, что приведенное равенство асимптотически эквивалентно уравнению
перехода системы идеальных газов из структурно-упорядоченного состояния в
состояние термодинамического равновесия, выраженному с помощью энтропии Л.
Больцмана.
Отмеченные информационные
особенности отражения системных образований позволяют в качестве обобщенной
характеристики их структурной организации использовать так называемую
R-функцию, представляющую собой отношение порядка к хаосу, то есть:
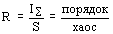
Для произвольной системы А с числом
элементов m(A), разделенной по какому-либо признаку на N частей B1, B2, ... ,
BN с числом элементов в каждой части соответственно равным m(B1), m(B2), ... ,
m(BN) 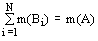 . В этих
обозначениях формулы аддитивной негэнтропии и энтропии отражения имеют вид:
. В этих
обозначениях формулы аддитивной негэнтропии и энтропии отражения имеют вид:
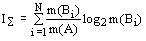 ,
, 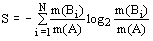 . Тогда:
. Тогда: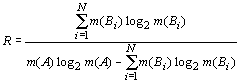
......Значения R-функции показывают,
что и в какой мере преобладает в структурной организации системы: хаос или
порядок. Так, если  , то в
структурной организации системы преобладает порядок, в противном случае, когда
, то в
структурной организации системы преобладает порядок, в противном случае, когда  - хаос.
Если
- хаос.
Если 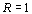 , то хаос и
порядок уравновешивают друг друга, структурная организация системы является
равновесной.
, то хаос и
порядок уравновешивают друг друга, структурная организация системы является
равновесной.
Синергетическая теория информации по
своей сущности является физической теорией. Данные выше выражения по своей
форме подобны законам сохранения (энергии, количества движения и т.д.),
присущим физическим системам.
.2.1 Структурная организация
электронных систем
в плоскости орбитального квантового числа
Электронные системы атомов
химических элементов состоят из конечного множества электронов, число которых
равно порядковому номеру элементов (Z) в периодической системе Д.И. Менделеева.
Рассматривая эти системы в плоскости какого-либо квантового числа, можно по
значениям последнего выделять системные объекты и с помощью R-функции оценивать
соответствующую структурную организацию систем.
Если в качестве системных объектов
взять совокупности электронов с одинаковым значением 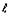 , иначе
говоря, s, p, d, f совокупности (символами s, p, d, f обозначаются электроны со
значениями
, иначе
говоря, s, p, d, f совокупности (символами s, p, d, f обозначаются электроны со
значениями 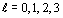 ,
соответственно) и обозначить количество электронов в указанных совокупностях
через
,
соответственно) и обозначить количество электронов в указанных совокупностях
через 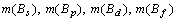 , то
методика расчета R-функции будет следующая.
, то
методика расчета R-функции будет следующая.
Например, у атома криптона 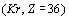 электронная
конфигурация имеет вид:
электронная
конфигурация имеет вид: 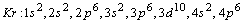 . Здесь.
. Здесь. 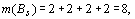
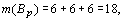
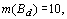
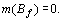
Подставляя эти значения в формулу
R-функции и, учитывая, что 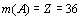 , получаем:
, получаем:
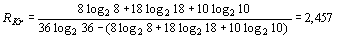 .
.
По данной методике проведен расчет значений
R-функции в плоскости орбитального квантового числа для электронных систем всех
атомов химических элементов с порядковым номером 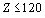 (рисунок
1).
(рисунок
1).
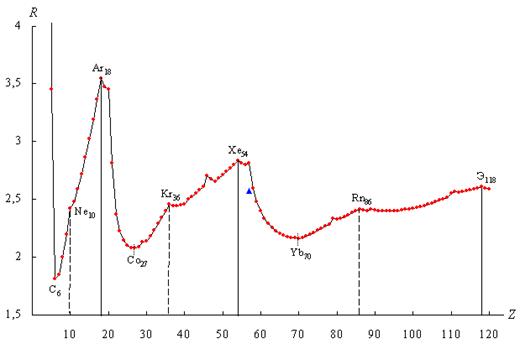
График имеет ярко выраженный периодический
характер и включает в себя четыре основных периода ( Т ), границы которых
проходят по “региональным” максимумам R-функции, наблюдаемым у химических
элементов с порядковыми номерами Z = 2, 18, 54, 118. Количество элементов в
периодах (m(TN ), N - номер периода) соответственно равно:
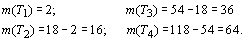
Дадим этим периодам общее название - орбитальные
периоды структурной организации электронных систем атомов химических элементов.
На протяжении второго, третьего и четвертого орбитальных периодов график
R-функции имеет форму бегущей волны, то есть, наблюдается общий резкий спад
значений в начале периода и относительно плавное их повышение при движении к
его концу. В связи с этим второй, третий и четвертый периоды будем называть
также орбитально-волновыми периодами.
 - значение
R-функции при
- значение
R-функции при 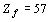
Рисунок 1. График R-функции электронных систем
атомов химических элементов в плоскости орбитального квантового числа
При более детальном рассмотрении графика можно
заметить, что сначала имеет место последовательное понижение значений,
заканчивающееся “региональными” минимумами R-функции у элементов с порядковыми
номерами Z = 6, 27, 70. Затем следует возрастание значений, относительно
равномерно продолжающееся до достижения “локальных” максимумов у элементов с Z
= 10, 36, 86. После этих максимумов значения R-функции претерпевают
незначительное понижение (во втором периоде просто существенное замедление
возрастания значений), которое сменяется практически монотонным повышением
значений, идущим до конца периодов (“региональных” максимумов) и имеющим более
плавный характер, чем возрастание до “локальных” максимумов. При этом, по мере
возрастания Z, изменение значений в “региональных” и “локальных” максимумах
имеет различный характер: значения R-функции в “региональных” максимумах
интенсивно снижаются 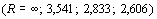 , а в “локальных”
максимумах сохраняют относительно постоянное значение
, а в “локальных”
максимумах сохраняют относительно постоянное значение
(R = 2,421; 2,457; 2,413). “Локальные” максимумы R-функции наблюдаются у
элементов с порядковыми номерами равными полусумме порядковых номеров тех
элементов ,
которые обладают смежными с ними “региональными” максимумами:.
,
которые обладают смежными с ними “региональными” максимумами:.
Отмеченные закономерные особенности поведения
R-функции внутри орбитально-волновых периодов позволяют говорить о том, что в
структурной организации электронных систем атомов химических элементов,
рассматриваемых в плоскости орбитального квантового числа, присутствует еще
одна (вторичная) периодичность, которая делит каждый орбитально-волновой период
на два полупериода с одинаковым количеством элементов. Эти количества элементов
в орбитальных полупериодах равны:
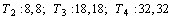
Количество элементов в орбитально-волновых
периодах связано с их номером квадратичной зависимостью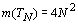 .
То есть:.
.
То есть:.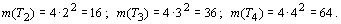
Все орбитальные периоды и полупериоды
структурной организации электронных систем, так же как химические периоды
периодической системы, заканчиваются инертными газами, а начинаются следующими
за ними химическими элементами. При этом каждый орбитально-волновой период
охватывает два химических периода (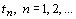 -
номер периода) с одинаковым числом элементов
-
номер периода) с одинаковым числом элементов 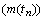 ,
то есть:
,
то есть:
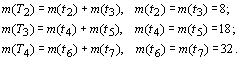
Соответственно, все орбитальные полупериоды в
точности совпадают с химическими периодами и равны с ними по числу элементов.
Поэтому в дальнейшем орбитальные полупериоды будем также обозначать символом
tn.
Количество элементов в химическом периоде
зависит от того, к какому периоду структурной организации он принадлежит. Так
как число элементов во всех орбитально-волновых периодах связано с их номером
квадратичной зависимостью, то количество элементов в химических периодах имеет
следующее выражение:
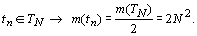
Применяя последнюю формулу к семи известным
химическим периодам периодической системы Д.И. Менделеева, получаем числовой
ряд:
, 8, 8, 18, 18, 32, 32, члены которого в
точности соответствуют количеству их элементов. При этом первый орбитальный
период по своей сущности является орбитально-волновым полупериодом.
Таким образом, количество элементов в химических
периодах периодической системы Д.И. Менделеева равно удвоенному квадрату номера
орбитального периода структурной организации электронных систем, к которым они
принадлежат.
В каждом орбитальном периоде у атомов химических
элементов появляются электроны с новым значением орбитального квантового числа.
То есть, в первом периоде наблюдаются только s электроны 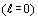 ,
во втором периоде дополнительно появляются p электроны
,
во втором периоде дополнительно появляются p электроны 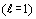 ,
в третьем - d электроны
,
в третьем - d электроны 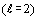 и в четвертом
периоде - f электроны
и в четвертом
периоде - f электроны 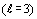 . Иначе говоря, во
всех орбитальных периодах структурной организации электронных систем атомов
химических элементов орбитальное квантовое число принимает ряд значений,
максимальное из которых
. Иначе говоря, во
всех орбитальных периодах структурной организации электронных систем атомов
химических элементов орбитальное квантовое число принимает ряд значений,
максимальное из которых 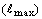 выражается
формулой:
выражается
формулой: 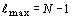 , а общее число
этих значений равно, соответственно, номеру периода N. При этом в каждом
орбитальном полупериоде наблюдаются все N значений орбитального квантового
числа, а соответствующее число s, p, d, f электронов
, а общее число
этих значений равно, соответственно, номеру периода N. При этом в каждом
орбитальном полупериоде наблюдаются все N значений орбитального квантового
числа, а соответствующее число s, p, d, f электронов 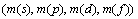 в
атомах их элементов (как и число самих s, p, d, f элементов) достигает
величины:
в
атомах их элементов (как и число самих s, p, d, f элементов) достигает
величины:
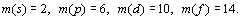
В орбитальных полупериодах число электронов с
данным значением орбитального квантового числа 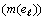 связано
с номером орбитального периода, в котором они впервые появились, зависимостью:
связано
с номером орбитального периода, в котором они впервые появились, зависимостью: 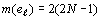
Заменяя N на 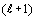 ,
получаем общую формулу числа электронов при данном значении орбитального
квантового числа, хорошо известную из курса теории строения атома:
,
получаем общую формулу числа электронов при данном значении орбитального
квантового числа, хорошо известную из курса теории строения атома: 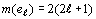 .
.
Число элементов в орбитальном полупериоде
конкретизируется в виде формулы: 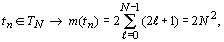 из
которой в отношении числа элементов орбитально-волновых периодов (как и в
отношении числа образующих их электронов) следует:
из
которой в отношении числа элементов орбитально-волновых периодов (как и в
отношении числа образующих их электронов) следует: 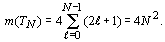 ..
..
В химических периодах максимальное значение
орбитального квантового числа у электронов атомов их элементов подчиняется
условию:
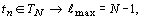 то есть орбитальное
квантовое число в химических периодах принимает ряд значений
то есть орбитальное
квантовое число в химических периодах принимает ряд значений 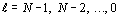 .
.
Изложенное свидетельствует, что в
орбитально-волновых периодах структурной организации электронные системы атомов
химических элементов обоих полупериодов дополняются одними и теми же
электронами. При этом в каждом случае число электронов в s, p, d, f подгруппах
сохраняет свое постоянное значение. Иначе говоря, процесс эволюции электронных
систем атомов химических элементов, в пределах орбитально-волновых периодов их
структурной организации, идет таким образом, что два раза подряд повторяется
один и тот же набор значений 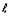 и
и 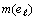 .
В отношении орбитальных полупериодов и химических периодов системы Д.И.
Менделеева данный факт обуславливает попарное повторение числа элементов в их
пределах.
.
В отношении орбитальных полупериодов и химических периодов системы Д.И.
Менделеева данный факт обуславливает попарное повторение числа элементов в их
пределах.
Чтобы объяснить это явление, введем в
рассмотрение понятие орбитальный номер электрона 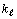 ,
которым будем обозначать порядковый номер электрона в подгруппе. То есть:
,
которым будем обозначать порядковый номер электрона в подгруппе. То есть:
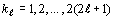
и, соответственно: 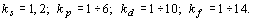
Совокупность значений 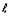 и
и
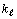 описывает
электронные состояния в атомах химических элементов, находящихся в пределах
орбитально-волновых периодов структурной организации. При этом в каждом
орбитально-волновом полупериоде разнообразие электронных состояний с различными
значениями
описывает
электронные состояния в атомах химических элементов, находящихся в пределах
орбитально-волновых периодов структурной организации. При этом в каждом
орбитально-волновом полупериоде разнообразие электронных состояний с различными
значениями 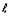 и
и 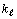 полностью
исчерпывается. Однако согласно принципу запрета Паули: “внутри атома может
находиться с данным состоянием только один электрон”. Орбитальные особенности
движения электронов в атомах, помимо орбитального квантового числа,
характеризуются, как известно, спиновым квантовым числом
полностью
исчерпывается. Однако согласно принципу запрета Паули: “внутри атома может
находиться с данным состоянием только один электрон”. Орбитальные особенности
движения электронов в атомах, помимо орбитального квантового числа,
характеризуются, как известно, спиновым квантовым числом 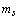 ,
которое отражает собственное движение электрона (вращение или спин) и принимает
только два значения
,
которое отражает собственное движение электрона (вращение или спин) и принимает
только два значения 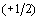 и
и 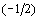 ,
соответствующих антипараллельным направлениям вращательного движения. Значения
,
соответствующих антипараллельным направлениям вращательного движения. Значения 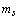 обычно
указываются противоположно направленными стрелками
обычно
указываются противоположно направленными стрелками 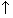 и
и
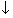 ,
обозначающими положительное и отрицательное направления спина, соответственно.
При рассмотрении электронных конфигураций атомов по умолчанию принято считать,
что при данном значении
,
обозначающими положительное и отрицательное направления спина, соответственно.
При рассмотрении электронных конфигураций атомов по умолчанию принято считать,
что при данном значении 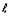 сначала появляются
электроны с положительным значением
сначала появляются
электроны с положительным значением 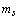 ,
а затем, когда их число достигнет величины
,
а затем, когда их число достигнет величины 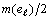 ,
к ним присоединяются электроны с отрицательным значением
,
к ним присоединяются электроны с отрицательным значением 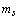 ,
число которых также становится равным
,
число которых также становится равным 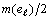 .
Вместе с тем, ничто не мешает допустить, что в орбитально-волновых периодах
структурной организации электронных систем, при данном значении
.
Вместе с тем, ничто не мешает допустить, что в орбитально-волновых периодах
структурной организации электронных систем, при данном значении 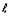 ,
в первом полупериоде сначала появляются электроны с положительным значением
,
в первом полупериоде сначала появляются электроны с положительным значением 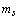 ,
а во втором полупериоде - с отрицательным значением
,
а во втором полупериоде - с отрицательным значением 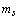 .
Например, во втором орбитальном периоде заполненные p подгруппы электронов
.
Например, во втором орбитальном периоде заполненные p подгруппы электронов 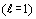 наблюдаются
в первом полупериоде у неона (Ne10), а во втором - у аргона (Ar18), и с учетом
орбитального номера электронов
наблюдаются
в первом полупериоде у неона (Ne10), а во втором - у аргона (Ar18), и с учетом
орбитального номера электронов 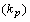 , будем иметь
следующие схемы распределения значений спинового квантового числа:
, будем иметь
следующие схемы распределения значений спинового квантового числа:
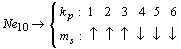 .......
.......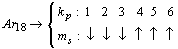
Сделанное допущение позволяет сформулировать
(подобно принципу Паули) орбитальный принцип запрета: в совокупности
электронов, образующих орбитально-волновой период структурной организации
электронных систем атомов химических элементов, при данном значении
орбитального квантового числа не может быть двух электронов с одинаковым
орбитальным номером и одинаковым значением спина.
Соответственно, можно говорить о том, что в
каждом орбитально-волновом периоде TN два раза повторяется процесс формирования
подгрупп электронов со значениями орбитального квантового числа 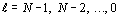 ,
который идет таким образом, что электроны с одинаковыми значениями
,
который идет таким образом, что электроны с одинаковыми значениями 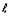 и
и
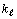 имеют
антипараллельные спины. Это обуславливает деление орбитально-волновых периодов
структурной организации электронных систем на два одинаковых полупериода
(зеркально-симметричных друг другу по спину образующих их электронов) и, как
следствие, объясняет факт наличия в периодической системе Д.И. Менделеева
периодов с одинаковым количеством химических элементов. Иначе говоря, можно
утверждать, что химическая периодичность элементов периодической системы Д.И.
Менделеева является вторичной по отношению к орбитальной периодичности
структурной организации их электронных систем. Кроме того, принятие
орбитального принципа запрета позволяет говорить о том, что одним из атрибутов
общего хода эволюции электронных систем атомов химических элементов является
тот факт, что появлению электронов с новым значением орбитального квантового
числа
имеют
антипараллельные спины. Это обуславливает деление орбитально-волновых периодов
структурной организации электронных систем на два одинаковых полупериода
(зеркально-симметричных друг другу по спину образующих их электронов) и, как
следствие, объясняет факт наличия в периодической системе Д.И. Менделеева
периодов с одинаковым количеством химических элементов. Иначе говоря, можно
утверждать, что химическая периодичность элементов периодической системы Д.И.
Менделеева является вторичной по отношению к орбитальной периодичности
структурной организации их электронных систем. Кроме того, принятие
орбитального принципа запрета позволяет говорить о том, что одним из атрибутов
общего хода эволюции электронных систем атомов химических элементов является
тот факт, что появлению электронов с новым значением орбитального квантового
числа 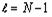 предшествует
реализация всего разнообразия электронных состояний, характеризуемых различными
сочетаниями
предшествует
реализация всего разнообразия электронных состояний, характеризуемых различными
сочетаниями 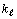 и
и 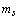 при
при
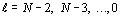 .
.
.2.2 Структурная организация электронных систем
в плоскости электронных подоболочек
Обозначая количество электронов в подоболочке
(системном объекте) через 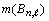 , R-функцию
структурной организации электронной системы атома химического элемента с
порядковым номером Z можно представить в следующем виде:
, R-функцию
структурной организации электронной системы атома химического элемента с
порядковым номером Z можно представить в следующем виде:
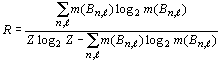
Для атома криптона: 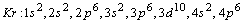 ,
,
расчет R-функции ведется следующим образом:
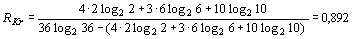 .
.
С помощью указанной формулы проведена оценка
структурной организации электронных систем всех атомов химических элементов,
образующих семь известных периодов периодической системы Д.И. Менделеева
(рисунки 2-4).
График зависимости значений R-функции от
порядкового номера элементов (рисунок 2) имеет периодический, в целом
затухающий характер. В горизонтальном направлении таблицы во всех рядах
наблюдается одна и та же закономерность: последовательное понижение значений
R-функции в начале ряда и повышение значений по мере приближения к его концу,
что коррелируется с общим характером ослабления металлических свойств
химических элементов в начале периодов и усилением металлоидных свойств в их
конце. График средних значений R-функции по группам таблицы ПС (рисунок 4)
имеет глубокий минимум на четвертой группе. При этом типические элементы
четвертой группы - углерод и кремний - занимают главенствующее положение по
разнообразию соединений с другими элементами соответственно в живой и неживой
природе, причем углерод обладает минимальным значением R-функции среди всех
химических элементов.
Периодический характер графика приращений
R-функции  (рисунок 3)
согласуется с периодическим изменением свойств химических элементов в
горизонтальном направлении периодической таблицы: в пределах каждого ряда, на
всем его протяжении, значение
(рисунок 3)
согласуется с периодическим изменением свойств химических элементов в
горизонтальном направлении периодической таблицы: в пределах каждого ряда, на
всем его протяжении, значение  последовательно
увеличивается, а при переходе в начало следующего ряда резко падает. Таким
образом, величина
последовательно
увеличивается, а при переходе в начало следующего ряда резко падает. Таким
образом, величина 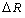 является
обобщенной количественной характеристикой изменения свойств химических
элементов при их последовательном рассмотрении.
является
обобщенной количественной характеристикой изменения свойств химических
элементов при их последовательном рассмотрении.
В пределах вертикальных групп таблицы Д.И.
Менделеева также наблюдается устойчивая взаимосвязь изменения значений
R-функции и свойств химических элементов, проявляющаяся в частности в том, что
усилению металлических свойств в главных подгруппах элементов с увеличением
номера больших периодов, соответствует понижение значений R-функции
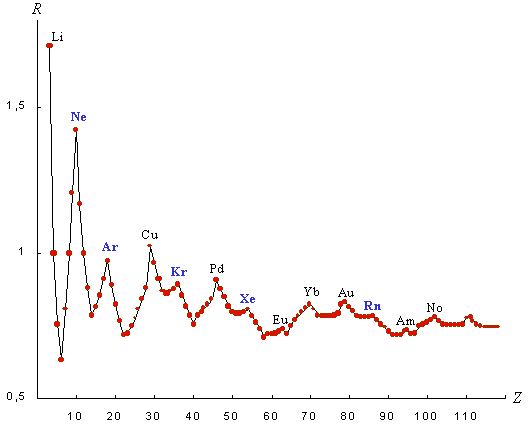
Рисунок 2. График R-функции систем электронных
подоболочек
атомов химических элементов
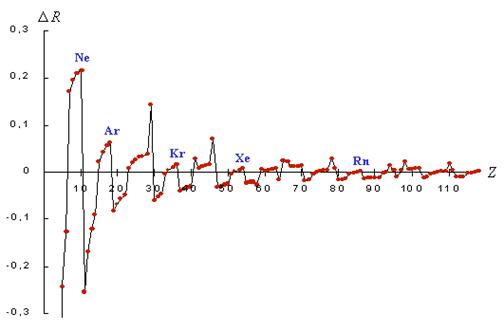
Рисунок 3. График приращения R-функции систем электронных подоболочек атомов
химических элементов
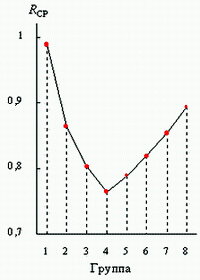
Рисунок 4. Графики R-функции и средних значений
R-функции систем электронных электронных подоболочек атомов по группам ПС
Таким образом, изменение свойств химических
элементов, как в горизонтальном, так и в вертикальном направлении периодической
таблицы Д.И. Менделеева, согласуется с изменением значений R-функции систем
электронных подоболочек их атомов. Это позволяет периодическому закону Д.И.
Менделеева дать следующую интерпретацию: периодичность изменения свойств
химических элементов является отражением периодического изменения значений
R-функции систем электронных подоболочек их атомов.
.2.3 Решение вопроса верхней границы
периодичской системы Д.И. Менделеева
Помимо квадратичной зависимости, между числом
элементов в периоде 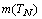 и его номером N
существует еще одна связь, математическая форма которой асимптотически близка к
кубической зависимости:
и его номером N
существует еще одна связь, математическая форма которой асимптотически близка к
кубической зависимости:
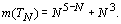
При N = 1, 2, 3, 4 данная формула образует ряд
чисел: 2, 16, 36, 68. То есть, в данном случае имеется точное выражение числа
элементов для первого второго и третьего орбитальных периодов и приближенное
выражение, с относительной погрешностью 6%, для четвертого периода.
Подставляя значение 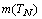 из
выражения квадратичной зависимости в выражение кубической зависимости, получаем
уравнение:
из
выражения квадратичной зависимости в выражение кубической зависимости, получаем
уравнение: 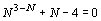
В отношении химических периодов 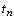 периодической
системы Д.И. Менделеева сказанное означает, что наблюдаемая закономерность
изменения числа их элементов
периодической
системы Д.И. Менделеева сказанное означает, что наблюдаемая закономерность
изменения числа их элементов 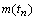 действует только
до седьмого периода включительно, последний элемент которого имеет порядковый
номер Z = 118.
действует только
до седьмого периода включительно, последний элемент которого имеет порядковый
номер Z = 118.
Из распределения элементов по орбитальным
периодам структурной организации электронных систем следует, что число
элементов в каждом последующем орбитальном периоде превосходит общее число
элементов, образующих предыдущие периоды:
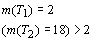 ........
........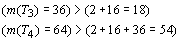
То есть, имеется закономерность: 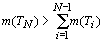 ......................
......................
Вместе с тем, если допустить существование
пятого орбитального периода, охватывающего гипотетические восьмой и девятый
химические периоды системы Д.И. Менделеева, то согласно квадратичной
зависимости будем иметь, что 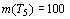 . Но это число
элементов явно меньше, чем
. Но это число
элементов явно меньше, чем 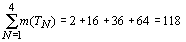 и, следовательно,
можно утверждать, что закономерность при
и, следовательно,
можно утверждать, что закономерность при 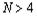 исчезает.
Если же определить число элементов пятого периода с помощью квазикубической
зависимости, то получим значение
исчезает.
Если же определить число элементов пятого периода с помощью квазикубической
зависимости, то получим значение 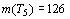 ,
которое формально удовлетворяет выражению, поскольку 126 > 118. Но, в этом
случае, будет нарушен орбитальный принцип запрета, который ограничивает число
электронов, образующих орбитальный период, квадратичной зависимостью, дающей
для пятого орбитального периода значение 100.
,
которое формально удовлетворяет выражению, поскольку 126 > 118. Но, в этом
случае, будет нарушен орбитальный принцип запрета, который ограничивает число
электронов, образующих орбитальный период, квадратичной зависимостью, дающей
для пятого орбитального периода значение 100.
Закономерность с позиций электронных
конфигураций атомов объясняется тем, что при 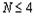 разнообразие
электронов, образующих данный орбит В пределах вертикальных групп таблицы Д.И.
Менделеева также наблюдается устойчивая взаимосвязь изменения значений
R-функции и свойств химических элементов, проявляющаяся в частности в том, что
усилению металлических свойств в главных подгруппах элементов с увеличением
номера больших периодов, соответствует понижение значений R-функции
разнообразие
электронов, образующих данный орбит В пределах вертикальных групп таблицы Д.И.
Менделеева также наблюдается устойчивая взаимосвязь изменения значений
R-функции и свойств химических элементов, проявляющаяся в частности в том, что
усилению металлических свойств в главных подгруппах элементов с увеличением
номера больших периодов, соответствует понижение значений R-функции
Орбитальный период, превышает суммарное
разнообразие электронов, образующих предыдущие периоды (с учетом номера
последних). При 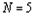 такого превышения
не происходит, так как гипотетические g электроны
такого превышения
не происходит, так как гипотетические g электроны 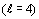 ,
в количестве
,
в количестве 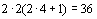 , не могут его
обеспечить. Данную интерпретацию закономерности и ее нарушения при
, не могут его
обеспечить. Данную интерпретацию закономерности и ее нарушения при 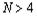 наглядно
можно проиллюстрировать следующей схемой. Возьмем пять концентрических кругов с
радиусами
наглядно
можно проиллюстрировать следующей схемой. Возьмем пять концентрических кругов с
радиусами 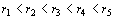 (рисунок 5),
такими, что площадь каждого круга превосходит сумму площадей всех кругов с
меньшим радиусом.
(рисунок 5),
такими, что площадь каждого круга превосходит сумму площадей всех кругов с
меньшим радиусом.
Если теперь этим кругам, в порядке возрастания
их радиусов, поставить в соответствие разнообразие электронов, образующих
орбитальные периоды c 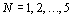 , то в пятом круге
окажется удаленной часть кольца с внутренним и внешним радиусами
, то в пятом круге
окажется удаленной часть кольца с внутренним и внешним радиусами 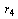 и
и
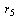 ,
площадь которой пропорциональна разности
,
площадь которой пропорциональна разности 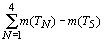 .
.
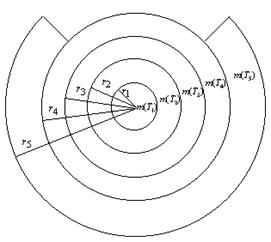
Рисунок 5. Пояснительная схема к нарушению
закономерности при N = 5
Эмпирически установлено, что химическими
элементами, в электронных системах атомов которых впервые появляются электроны
с новым значением орбитального квантового числа, являются водород (sэлектроны, 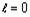 ),
бор (р электроны,
),
бор (р электроны, 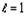 ), скандий (d
электроны,
), скандий (d
электроны, 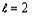 ) и церий (f электроны,
) и церий (f электроны,
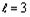 ).
Их порядковые номера
).
Их порядковые номера 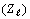 образуют,
соответственно, ряд чисел:
образуют,
соответственно, ряд чисел:
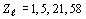 .
.
Сравнение этого ряда с границами орбитальных
периодов 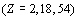 показывает,
что во втором и третьем периодах новые электроны (p и d) появляются у третьего
элемента периода, а в четвертом периоде (f) - у четвертого элемента. Это
свидетельствует о том, что между значениями
показывает,
что во втором и третьем периодах новые электроны (p и d) появляются у третьего
элемента периода, а в четвертом периоде (f) - у четвертого элемента. Это
свидетельствует о том, что между значениями 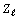 при
при
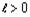 и
номерами орбитальных периодов N существует закономерная взаимосвязь, которая,
учитывая весьма незначительное отклонение
и
номерами орбитальных периодов N существует закономерная взаимосвязь, которая,
учитывая весьма незначительное отклонение 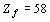 от
от
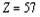 ,
может быть представлена в следующем виде:
,
может быть представлена в следующем виде:
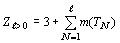
По поводу замены 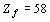 на
на
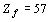 следует
сказать, что такая замена при количественном анализе периодичности электронных
конфигураций применяется довольно часто. Дело в том, что
следует
сказать, что такая замена при количественном анализе периодичности электронных
конфигураций применяется довольно часто. Дело в том, что 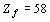 и
и
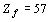 являются
эмпирическим и теоретическим значениями
являются
эмпирическим и теоретическим значениями 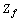 ,
соответственно. В последнем случае принимается, что первый f электрон
появляется у лантана и имеет место так называемая (по А. Зоммерфельду)
идеальная система заполнения электронных оболочек, в которой не учитываются
нюансы энергетической стабильности электронных состояний и “электроны образуют
оболочки и подгруппы в правильной последовательности”. В атоме лантана, вместо
теоретически предсказываемого появления
,
соответственно. В последнем случае принимается, что первый f электрон
появляется у лантана и имеет место так называемая (по А. Зоммерфельду)
идеальная система заполнения электронных оболочек, в которой не учитываются
нюансы энергетической стабильности электронных состояний и “электроны образуют
оболочки и подгруппы в правильной последовательности”. В атоме лантана, вместо
теоретически предсказываемого появления 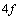 электрона,
фактически наблюдается
электрона,
фактически наблюдается 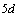 электрон. В
энергетическом отношении
электрон. В
энергетическом отношении  и границы
соответствующих электронных подоболочек практически неразличимы. Поэтому в
дальнейших наших построениях, имеющих теоретический характер, будем считать,
что
и границы
соответствующих электронных подоболочек практически неразличимы. Поэтому в
дальнейших наших построениях, имеющих теоретический характер, будем считать,
что 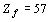 .
.
Так как число элементов в орбитально-волновом
периоде 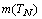 может
быть выражено через его номер N двумя способами, то выражение также имеет две
реализации вида
может
быть выражено через его номер N двумя способами, то выражение также имеет две
реализации вида 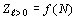 . Квадратичная
зависимость для первого орбитального периода дает завышение значения
. Квадратичная
зависимость для первого орбитального периода дает завышение значения 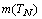 на
2 элемента, которое при непосредственном использовании выражения автоматически
распространяется на все значения
на
2 элемента, которое при непосредственном использовании выражения автоматически
распространяется на все значения 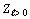 .
Поэтому в данном случае имеем:
.
Поэтому в данном случае имеем:
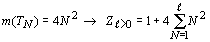 .
.
Используя, в свою очередь, квазикубическую
зависимость, получаем:
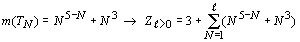
Однозначная закономерность появления электронов
с новым значением орбитального квантового числа, имеющая место во втором,
третьем и четвертом орбитальных периодах, в гипотетическом пятом периоде
сменяется неопределенностью. Это ставит под вопрос сам факт существования в
природе электронхов с 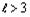 и, как следствие,
- орбитальных периодов структурной организации электронных систем атомов с
порядковым номером
и, как следствие,
- орбитальных периодов структурной организации электронных систем атомов с
порядковым номером 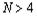 .
.
Таким образом, с позиций структурной организации
электронных систем атомов химических элементов в плоскости орбитального
квантового числа, последним элементом периодической системы Д.И. Менделеева
является элемент с порядковым номером 118, который замыкает седьмой химический
период.
Мы имеем дело с новой -
информационно-синергетической - теорией периодической системы Д.И. Менделеева.
Не исключено, что данный факт может являться началом верификации философских
предсказаний о том, что, “как на смену механической пришла энергетическая
картина мира, так и последняя постепенно уступит место кибернетической,
информационной картине мира”.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
.1 Основные положения теории И.Н. Нурлыбаева
Особенность Периодического закона среди других
фундаментальных законов заключается в том, что он не имеет выражения в виде
математического уравнения. В учебниках и учебных пособиях школ и ВУЗов СНГ
определение периодического закона дается следующим образом: «Свойства элементов
и их соединений находятся в периодической зависимости от атомного заряда и
порядкового номера элементов». По мнению профессора И.Н. Нурлыбаева данная
трактовка не соответствует сути периодического закона .
Во-первых, явной зависимости между увеличением
заряда ядра и периодичностью изменения свойств не прослеживается. Заряд ядра
увеличивается постепенно, а свойства при переходе от периода к периоду меняются
скачкообразно.
Во-вторых, как и другие законы, периодический
закон должен опираться на математические (алгебраические) уравнения и расчеты.
В учебнике Н.А. Глинка «Общая химия» дается
такое определение периодического закона: «Физико-химические свойства элементов
периодически изменяются вследствие периодического изменения электронного
строения элементов» [10]. Таким образом, периодически меняющиеся характеристики
элементов находятся в зависимости не столько от заряда ядра, сколько от
электронного строения элемента.
По мнению Нурлыбаева И.Н. при определении закона
должен быть раскрыт его физический смысл.
Если рассмотреть порядок заполнения электронных
орбиталей по периодам, то можно заметить следующую закономерность: в первом
периоде заполняется только одна 1s орбиталь; во втором и третьем периоде
заполняются 2,3 s- и 2,3 p- орбитали, поэтому количество элементов в этих
периодах равно восьми; в четвертом и пятом периодах идет заполнение
соответствующих (внешних, предвнешних) s-, p- и d- орбиталей, количество
элементов в этих периодах равно восемнадцати; в шестом и седьмом периоде
заполняются соответствующие s-, p-, d- и f-орбитали, на них могут располагаться
32 электрона, что соответствует 32 элементам в периоде. Эту закономерность
можно представить в виде таблицы (таблица 1).
Таблица 1. Введение понятия «подобные периоды»
|
Подобные
периоды
|
1
(р1)
|
2
и 3 (р2)
|
4
и 5 (р3)
|
6
и 7 (р4)
|
|
Периоды
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Заполняемые
орбитали
|
1s2
|
2s2,
2p6
|
3s2,
3p6
|
4s2,
3d10, 4p6
|
5s2,
4d10, 5p6
|
6s2,
4f14, 5d10, 6p6
|
7s2,
5f14, 6d10, 7p6
|
|
Число
элементов
|
2
|
8
|
8
|
18
|
18
|
32
|
32
|
Физическим смыслом и главной причиной периодичности
свойств
элементов
является периодическое повторение однотипных электронных конфигураций внешних
электронных подоболочек с ростом заряда ядра.
Профессор Нурлыбаев И.Н. предлагает уточненную
формулировку периодического закона: свойства химических элементов и их
соединений находятся в периодической зависимости от периодически возобновляемых
(повторяемых) внешних электронных конфигураций (оболочек) атомов при
последовательном возрастании заряда ядра атомов элементов [11].
Если учесть подобие в заполнении электронных
орбиталей по энергетическим уровням в периодах, то количество электронов,
заполняющих эти уровни, равно количеству элементов в них (Z). Обозначив
подобные периоды как рn: 1 (р1), 2 и 3 (р2), 4 и 5 (р3), а также 6 и 7 (р4) ,
предлагается математическое выражение периодического закона в виде
= 2pn2
2.2 Исторические предпосылки возникновения
теории Нурлыбаева
. В 1864 году появилась первая таблица немецкого
химика Лотара Мейера; в неё были включены 28 элементов, размещённые в шесть
столбцов согласно их валентностям. Мейер подчеркивал закономерное изменение
атомной массы в рядах сходных элементов (таблица 2). Можно видеть прообраз
подобных периодов Нурлыбаева. Здесь подчеркивается средняя разница атомных
масс, одинаковая для I и II рядов Мейера (подобного периода р2 Нурлыбаева), III
и IV рядов Мейера (р3 Нурлыбаева),V и VI рядов Мейера (р4 Нурлыбаева)
Таблица 2. Система Мейера 1864 г
|
Валент-ность
IV
|
Вален-тность
III
|
Вален-тность
I
|
Валент-ность
I
|
Вален-тность
II
|
Разность
масс
|
|
I
ряд
|
|
|
|
|
Li
<#"822359.files/image120.jpg">
Рисунок 7. Лестничная форма периодической
системы
.3 Подтверждение теории Нурлыбаева согласно
аппарату СТИ
. Расчет R-функции (глава 1) показывает наличие
четырех основных орбитальных периодов (Т) структурной организации электронных
систем атомов химических элементов (таблица 4), соответствующих подобным
периодам Нурлыбаева. Каждый из Т-периодов (кроме первого) состоит из двух
орбитальных полупериодов, идентичных химическим периодам ПС
Таблица 4. Соответствие Т-периодов подобным
периодам Нурлыбаева
|
Т-периоды
СТИ
|
Т1
|
Т2
|
Т3
|
Т4
|
|
Подобные
периоды Нурлыбаева
|
р1
|
р2
|
р3
|
р4
|
|
Химические
периоды Менделеева
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Число
элементов в полупериодах
|
2
|
8
|
8
|
18
|
18
|
32
|
32
|
|
Число
элементов в периодах
|
2
|
16
|
36
|
64
|
. Количество элементов в орбитально-волновых
периодах связано с их номером квадратичной зависимостью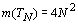 Количество
элементов орбитального полупериода (химического периода) зависит от номера
Т-периода Количество
элементов орбитального полупериода (химического периода) зависит от номера
Т-периода 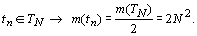 Эта формула
идентична формуле Нурлыбаева, связывающей количество элементов Z химического
периода (орбитального полупериода по СТИ) с номером подобного периода
Нурлыбаева Z = 2pn2 Эта формула
идентична формуле Нурлыбаева, связывающей количество элементов Z химического
периода (орбитального полупериода по СТИ) с номером подобного периода
Нурлыбаева Z = 2pn2
В Т-периодах орбитальное квантовое число
принимает ряд значений, максимальное из которых 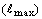 выражается
формулой: выражается
формулой: 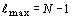 , а общее число
этих значений равно, соответственно, номеру периода N (таблица 5). , а общее число
этих значений равно, соответственно, номеру периода N (таблица 5).
С позиций структурной организации электронных
систем атомов химических элементов в плоскости орбитального квантового числа,
последним элементом периодической системы Д.И. Менделеева является элемент с
порядковым номером 118.
Таким образом, физический смысл должны иметь
именно подобные периоды Нурлыбаева, а не традиционные периоды, соответствующие
главным квантовым числам [13]. Как принято в современной теории строения атома
главное квантовое число определяет количество l электронных орбиталей,
некоторые из которых согласно СТИ неосуществимы (6g, 6h, 7g, 7h, 7?). Поэтому
место традиционных химических периодов должны занять именно подобные периоды
Нурлыбаева, реально соответствующие главным квантовым числам.
Таблица 5. Связь орбитального квантового числа и
подобного периода
|
Т-периоды
СТИ
|
Т1
|
Т2
|
Т3
|
Т4
|
|
Номер
Т-периода
|
1
|
2
|
3
|
4
|
|
Химические
периоды
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
lmax
|
0
(s)
|
1
(p)
|
2
(d)
|
3
(f)
|
|
lобщее
|
s,p
|
s,p,d
|
s,p,d,f
|
|
|
|
|
|
|
|
|
Таблица 6. Теория СТИ и теория Нурлыбаева
снимают противоречия классической теории строения атома
|
Т-периоды
СТИ
|
Т1
|
Т2
|
Т3
|
Т4
|
|
Подобные
периоды Нурлыбаева
|
р1
|
р2
|
р3
|
р4
|
|
Химические
периоды Менделеева
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Число
электронных орбиталей на уровне (теория строения атома)
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
1s
|
2s
2p
|
3s
3p 3d
|
4s
4p 4d 4f
|
5s
5p 5d 5f 5?
|
6s
6p 6d 6f 6 6
|
7s
7p 7d 7f 7 7 7
|
|
Число
реально заполняемых орбиталей
|
1
|
2
|
2
|
3
|
3
|
4
|
4
|
|
1s
|
2s
2p
|
3s
3p
|
4s
3d 4p
|
5s
4d 5p
|
6s
4f 5d 6p
|
7s
5f 6d 7p
|
ЗАКЛЮЧЕНИЕ
Периодический закон лежит в основании всего
многообразия проявлений химического движения вещества. По мере развития науки
он все совершенствуется и видоизменяется. Открываются все новые элементы,
уточняется изотопный состав элементов. Удобным выражением этого многогранного
закона является его наглядное графическое изображение в виде таблиц, диаграмм,
графиков. При этом различные исследователи вкладывают свой профессионально
специфический смысл в представляемые изображения и макеты. Поэтому имеется такое
разнообразие периодических систем. При работе с ресурсами интернет было
обнаружено 560 различных представлений периодической системы.
Как известно, рассмотренный фундаментальный
закон природы был открыт при сопоставлении свойств химических элементов и величин
их атомных масс. Это был химический этап развития периодического закона.
Следующий физический этап выявил физический смысл и связь наблюдаемых
закономерностей с электронным строением атомов элементов. Сейчас вся физическая
наука стоит на переломном этапе своего развития: “как на смену механической
пришла энергетическая картина мира, так и последняя постепенно уступит место
кибернетической, информационной картине мира”.
В этом состоит актуальность и новизна данного
исследования - рассмотреть процесс становления периодического закона и
периодической системы на основе современных научных представлений.
В работе в соответствии с положениями
синергетической теории информации (СТИ) была рассмотрена структура
периодической системы и выявлена периодичность в изменении информационных
свойств элементов как организованных структур, согласующаяся с периодичностью
изменения свойств элементов, установленных и принятых химическим сообществом.
Выводы, сделанные при использовании
математического аппарата СТИ, находятся в соответствии с основными положениями
теории атомного строения, использующимися для обоснования периодического закона
химических элементов. Вместе с тем, были получены нестандартные результаты,
которые прекрасно объясняют и дополняют теорию нашего современника - профессора
Нурлыбаева И.Н., неоднократно предлагавшему широкой химической общественности
свой вариант формулировки периодического закона Д.И. Менделеева. Математическое
выражение периодического закона, найденное Нурлыбаевым И.Н. посредством визуального
анализа периодической таблицы Д.И. Менделеева, полностью совпадает с
квадратичной зависимостью числа элементов от номера Т-периода согласно СТИ.
Т-периоды как открытие СТИ являются полными аналогами подобных периодов
(р-периодов) И.Н. Нурлыбаева.
Следующим этапом в химии должен явиться
пересмотр таких понятий как главное квантовое число и вытекающих отсюда
основных положений строения атома.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Менделеев
Д. И. <http://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2,_%D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B9_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87>,
- Периодическая законность химических элементов
<http://ru.wikisource.org/wiki/%D0%AD%D0%A1%D0%91%D0%95/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D0%B7%D0%B0%D0%BA%D0%BE%D0%BD%D0%BD%D0%BE%D1%81%D1%82%D1%8C_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2>
// Энциклопедический словарь Брокгауза и Ефрона
<http://ru.wikipedia.org/wiki/%D0%AD%D0%BD%D1%86%D0%B8%D0%BA%D0%BB%D0%BE%D0%BF%D0%B5%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%81%D0%BB%D0%BE%D0%B2%D0%B0%D1%80%D1%8C_%D0%91%D1%80%D0%BE%D0%BA%D0%B3%D0%B0%D1%83%D0%B7%D0%B0_%D0%B8_%D0%95%D1%84%D1%80%D0%BE%D0%BD%D0%B0>:
В 86 томах (82 т. и 4 доп.). - СПб., 1890-1907.
Агафошин
Н. П. Периодический закон и периодическая система элементов Д. И. Менделеева. -
М.: Просвещение, 1973. - 208 с.
Евдокимов
Ю. К истории периодического закона. Наука и жизнь, № 5 (2009), С. 12-15.
Макареня
А. А., Рысев Ю. В. Д. И. Менделеев. - М.: Просвещение, 1983. - 128 с.
Макареня
А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. - М.: Просвещение,
1969. - 160 с.
Щеголев
В.А. За краем таблицы Менделеева // Природа. 2003, № 1
Оганесян
Ю.И. В поисках “островов стабильности” (материал А. Ваганова) // Что нового в
науке и технике. 2003, № 1 и др.
Немец
О.Ф., Гофман Ю.В. Справочник по ядерной физике. Киев, 1975.
Вяткин
В.Б. Синергетическая теория информации: общая характеристика и примеры
использования // Мат. рег. науч.-практ. конф. «Наука и оборонный комплекс -
основные ресурсы российской модернизации». - Екатеринбург: УрО РАН, 2001. -
http://vbvvbv.narod.ru.
Глинка
Н.А. Общая химия. (Изд. тридцатое. Под ред. А.И. Ермакова.) М., 2003. С. 89.
Нурлыбаев
И.Н., Семкина К.Ю. О формулировке периодического закона и подобии периодов
периодической системы Д.И. Менделеева // XIX Менделеевс. съезд по общей и
прикл. химии. Тезисы докл. - Волгоград. - 2011. - том 4. - С. 561. периодический
химический нурлыбаев
И.Н.
Нұрлыбаев, Б.С. Иманғалиева. Д.И. Менделеевтің периодтық
заңының тұжырымдамасын қорыту // Вестник КазНУ. Сер.
химическая, №4 (64), 2011 г, С. 176.
Похожие работы на - Периодическая система химических элементов с точки зрения современной науки
|