Производство аммиачной селитры
Министерство образование и науки РФ
Государственное образовательное
учреждение
Высшего профессионального образования
«Тверской государственный технический
университет»
Кафедра ТПМ
Курсовая работа
по дисциплине: «Общая химическая
технология»
на тему:
Производство аммиачной селитры
Тверь 2012
Содержание
Введение
.
Физико-химические свойства аммиачной селитры
.
Методы производства
.
Основные стадии производства аммиачной селитры из аммиака и азотной кислоты
.1
Получение растворов аммиачной селитры
.1.1
Основы процесса нейтрализации
.1.2
Характеристика нейтрализационных установок
.1.3
Установки нейтрализации, работающие при атмосферном давлении
.1.4
Установки нейтрализации, работающие при разрежении
.
1 5 Основное оборудование
.
Материальные и энергетические расчеты
.
Термодинамический расчет
.
Утилизация и обезвреживание отходов в производстве аммиачной селитры
Заключение
Список
использованных источников
Приложение
А
Введение
В природе и в жизни человека азот имеет исключительно важное значение. Он
входит в состав белковых соединений (16-18%), являющихся основой растительного
и животного мира. Человек ежедневно потребляет 80-100 г белка, что
соответствует 12-17 г азота.
Для нормального развития растений требуются многие химические элементы.
Основные из них - углерод, кислород, водород, азот, фосфор, магний, сера,
кальций, калий и железо. Первые три элемента растения получают из воздуха и
воды, остальные - извлекают из почвы.
Особенно большая роль в минеральном питании растений принадлежит азоту,
хотя его среднее содержание в растительной массе не превышает 1,5%. Без азота
не может жить и нормально развиваться ни одно растение.
Азот является составной частью не только растительных белков, но и
хлорофилла, с помощью которого растения под действием солнечной энергии
усваивают углерод из находящейся в атмосфере двуокиси углерода СО2.
Природные соединения азота образуются вследствие химических процессов
разложения органических остатков, при грозовых разрядах, а также биохимическим
путем в результате деятельности особых бактерий - азотобактера, непосредственно
усваивающих азот из воздуха. Такой же способностью обладают клубеньковые
бактерии, которые живут в корнях бобовых растений (горох, люцерна, бобы, клевер
и др.).
Значительное количество азота и других питательных веществ, необходимых
для развития сельскохозяйственных культур, ежегодно выносится из почвы с
получаемым урожаем. Кроме того, часть питательных веществ теряется в результате
вымывания их грунтовыми и дождевыми водами. Поэтому для предотвращения снижения
урожайности и истощения почвы требуется пополнять ее питательными веществами
путем внесения различных видов удобрений.
Известно, что почти каждое удобрение обладает физиологической
кислотностью или щелочностью. В зависимости от этого оно может оказывать на
почву подкисляющее или подщелачивающее действие, что учитывается при его
использовании под определенные сельскохозяйственные культуры.
Удобрения, щелочные катионы которых быстрее извлекаются растениями из
почвы, вызывают ее подкисление; растения, которые быстрее потребляют кислотные
анионы удобрений, способствуют подщелачиванию почвы.
Азотные удобрения, содержащие катион аммония NН4 (аммиачная селитра, сульфат аммония) и амидную группу NН2 (карбамид), подкисляют почву.
Подкисляющее действие аммиачной селитры слабее, чем сульфата аммония.
В зависимости от характера почвы, климатических и других условий под
различные культуры требуется вносить различное количество азота.
В ассортименте азотных удобрений значительное место занимает аммиачная
селитра (нитрат аммония, или азотнокислый аммоний), объем мирового производства
которой исчисляется миллионами тонн в год.
В настоящее время примерно 50% азотных удобрений, применяемых в сельском
хозяйстве нашей страны, приходится на долю аммиачной селитры.
Аммиачная селитра имеет ряд преимуществ перед другими азотными
удобрениями. Она содержит 34-34,5% азота и в этом отношении уступает только
карбамиду СО(NН2) 2, содержащему 46% азота. Другие
азотные и азотсодержащие удобрения имеют значительно меньше азота (содержание
азота приведено в пересчете на сухое вещество):
Таблица 1 - Содержание азота в соединениях
|
Удобрения
|
N, %
|
|
Сульфат аммония (NH4)2SO4
|
Около 21
|
|
Известково-аммиачная
селитра
|
20,5
|
|
Цианамид кальцияCaCN2
|
18,5 - 20,2
|
|
Натриевая селитра NaNO3
|
16,0 - 16,2
|
|
Кальциевая селитра Ca(NO3)2
|
14,0 - 16,5
|
|
Калиевая селитра KNO3
|
13,8
|
Аммиачная селитра является универсальным азотным удобрением, так как
одновременно содержит аммиачную и нитратную формы азота. Она эффективна во всех
зонах, почти под все сельскохозяйственные культуры.
Весьма важно, что формы азота аммиачной селитры используются растениями в
разное время. Аммонийный азот, непосредственно участвующий в синтезе белка,
быстро усваивается растениями в период роста; нитратный азот усваивается относительно
медленно, поэтому действует более продолжительное время. Установлено также, что
аммиачная форма азота может использоваться растениями без предварительного
окисления.
Эти свойства аммиачной селитры весьма положительно сказываются на
увеличении урожайности почти всех сельскохозяйственных культур.
Высокое содержание азота в аммиачной селитре, сравнительно несложный
способ ее получения и относительно невысокая стоимость в ней единицы азота
создают хорошие предпосылки для дальнейшего развития этого производства.
Аммиачная селитра входит в состав большой группы устойчивых взрывчатых
веществ. Взрывчатые вещества на основе аммиачной селитры и аммиачная селитра
чистая или обработанная некоторыми добавками применяются для взрывных работ.
Небольшое количество селитры расходуется на получение закиси азота,
используемой в медицине.
Наряду с увеличением объема производства аммиачной селитры путем
модернизации действующих и строительства новых производств осуществляются
мероприятия по дальнейшему улучшению качества готового продукта (получение
продукта 100%-ной рассыпчатости и сохранение гранул после длительного хранения
продукта) [1].
1.
Физико-химические свойства аммиачной селитры
В чистом виде аммиачная селитра представляет собой белое кристаллическое
вещество, содержащее 35% азота, 60% кислорода и 5% водорода. Технический
продукт - белого цвета с желтоватым оттенком, содержит не менее 34,2% азота.
Аммиачная селитра является сильным окислителем ряда неорганических и
органических соединений. С расплавами некоторых веществ она бурно реагирует
вплоть до взрыва (например, с нитритом натрия NaNO2).
Если над твердой аммиачной селитрой пропускать газообразный аммиак, то
быстро образуется весьма подвижная жидкость - аммиакат 2NH4NO3*2NH3
или NH4NO3*3NH3.
Аммиачная селитра хорошо растворяется в воде, этиловом и метиловом
спиртах, пиридине, ацетоне и в жидком аммиаке. С повышением температуры
растворимость аммиачной селитры значительно возрастает [1], [3].
При растворении аммиачной селитры в воде поглощается большое количество
тепла. Например, при растворении 1 моль кристаллической NH4NO3в 220-400 моль воды и температуре 10-15 °С происходит
поглощение 6,4 ккал тепла.
Аммиачная селитра обладает свойством сублимироваться. При хранении
аммиачной селитры в условиях повышенных температуры и влажности воздуха ее
объем увеличивается примерно вдвое, что обычно приводит к разрыву тары.
Под микроскопом на поверхности гранул аммиачной селитры отчетливо видны
поры и трещины. Повышенная пористость гранул селитры весьма отрицательно
сказывается на физических свойствах готового продукта.
Аммиачная селитра отличается высокой гигроскопичностью. На открытом
воздухе в тонком слое селитра весьма быстро увлажняется, теряет кристаллическую
форму и начинает расплываться. Степень поглощения солью влаги из воздуха
зависит от его влажности и давления паров над насыщенным раствором данной соли
при данной температуре.
Между воздухом и гигроскопичной солью происходит влагообмен. Решающее
влияние на этот процесс оказывает относительная влажность воздуха.
Кальциевая и известково-аммиачная селитры имеют сравнительно низкое
давление водяных паров над насыщенными растворами; при определенной температуре
им соответствует наиболее низкая относительная влажность воздуха. Это самые
гигроскопичные соли среди указанных выше азотных удобрений. Наименее
гигроскопичен сульфат аммония и практически совершенно негигроскопична калиевая
селитра.
Влага поглощается только сравнительно небольшим слоем соли,
непосредственно граничащим с окружающим воздухом. Однако даже такое увлажнение
селитры сильно ухудшает физические свойства готового продукта. Скорость
поглощения аммиачной селитрой влаги из воздуха с повышением его температуры
резко увеличивается. Так, при 40 °С скорость поглощения влаги в 2,6 раза
больше, чем при 23 °С.
Предложено много способов уменьшения гигроскопичности аммиачной селитры.
Один из таких способов основан на смешении или сплавлении аммиачной селитры с
другой солью. При выборе второй соли исходят из следующего правила: для
понижения гигроскопичности давление водяных паров над насыщенным раствором
смеси солей должно быть больше их давления над насыщенным раствором чистой
аммиачной селитры.
Установлено, что гигроскопичность смеси двух солей, имеющих общий ион,
больше, чем наиболее гигроскопичной из них (исключение составляют смеси или
сплавы аммиачной селитры с сульфатом аммония и некоторые другие). Смешение же
аммиачной селитры с негигроскопичными, но нерастворимыми в воде веществами
(например, с известняковой пылью, фосфоритной мукой, дикальцийфосфатом и др.)
не уменьшает ее гигроскопичности. Многочисленные опыты показали, что все соли,
которые имеют такую же или большую растворимость в воде, чем аммиачная селитра,
обладают свойством увеличивать ее гигроскопичность.
Соли же, способные уменьшать гигроскопичность аммиачной селитры,
приходится добавлять в больших количествах (например, сульфат калия, хлористый
калий, диаммонийфосфат), что резко снижает содержание в продукте азота.
Наиболее эффективным способом уменьшения поглощения влаги из воздуха
является покрытие частиц селитры защитными пленками из не смачиваемых водой
органических веществ. Защитная пленка в 3-5 раз снижает скорость поглощения
влаги и способствует улучшению физических свойств аммиачной селитры.
Отрицательным свойством аммиачной селитры является ее способность
слеживаться - терять при хранении сыпучесть (рассыпчатость). При этом аммиачная
селитра превращается в твердую монолитную массу, с трудом поддающуюся
измельчению. Слеживаемость аммиачной селитры вызывается многими причинами.
Повышенное содержание влаги в готовом продукте. В частицах аммиачной
селитры любой формы всегда содержится влага в виде насыщенного (маточного)
раствора. Содержание NH4NO3 в таком растворе соответствует
растворимости соли при температурах ее загрузки в тару. Во время остывания
готового продукта маточный раствор часто переходит в пересыщенное состояние.
При дальнейшем понижении температуры из пересыщенного раствора выпадает большое
количество кристаллов размерами 0,2- 0,3 мм. Эти новые кристаллы цементируют
ранее не связанные частицы селитры, что приводит к превращению ее в плотную
массу.
Низкая механическая прочность частиц селитры. Аммиачная селитра
выпускается в виде частиц округлой формы (гранул), пластинок или мелких
кристаллов. Частицы гранулированной аммиачной селитры имеют меньшую удельную
поверхность и более правильную форму, чем чешуйчатой и мелкокристаллической,
поэтому гранулы меньше слеживаются. Однако в процессе гранулирования образуется
некоторое количество пустотелых частиц, отличающихся низкой механической прочностью.
При складировании мешки с гранулированной селитрой укладывают в штабеля
высотой 2,5 м. Под давлением верхних мешков происходит разрушение наименее
прочных гранул с образованием пылевидных частиц, которые уплотняют массу
селитры, увеличивая ее слеживаемость. Практика показывает, что разрушение
пустотелых частиц в слое гранулированного продукта резко ускоряет процесс его
слеживания. Это наблюдается даже если при загрузке в тару продукт был охлажден
до 45 °С и основная масса гранул имела хорошую механическую прочность.
Установлено, что пустотелые гранулы разрушаются также вследствие
рекристаллизации.
При повышении температуры окружающего воздуха гранулы селитры почти
полностью теряют свою прочность, и такой продукт сильно слеживается.
Термическое разложение аммиачной селитры. Взрывоопасность. Огнестойкость.
Аммиачная селитра с точки зрения взрывобезопасности относительно мало
чувствительна к толчкам, трению, ударам, сохраняет устойчивость при попадании
искр различной интенсивности. Примеси песка, стекла и металлические примеси не
повышают чувствительности аммиачной селитры к механическим воздействиям. Она
способна взрываться только под действием сильного детонатора или при
термическом разложении в определенных условиях.
При продолжительном нагревании аммиачная селитра постепенно разлагается
на аммиак и азотную кислоту:
4NO3=NH3+HNO3 - 174598,32
Дж (1)
Этот процесс, протекающий с поглощением тепла, начинается при температуре
выше 110°С.
4NO3= N2О + 2Н2О + 36902,88 Дж (2)
Термическое разложение аммиачной селитры протекает по таким
последовательным стадиям:
· гидролиз (или диссоциация) молекул NH4NO3;
· термическое разложение азотной кислоты, образующейся при гидролизе;
· взаимодействие двуокиси азота и аммиака, образующихся на
первых двух стадиях.
При интенсивном нагревании аммиачной селитры до 220-240 °С ее распад
может сопровождаться вспышками расплавленной массы.
Весьма опасен нагрев аммиачной селитры в замкнутом объеме или в объеме с
ограниченным выходом газов, образующихся при термическом разложении селитры.
В этих случаях разложение аммиачной селитры может протекать по многим
реакциям, в частности, по следующим:
4NO3 = N2+2Н2О + ½ 02 + 1401,64 Дж/кг (3)
2NH4NO3 = N2 +2NO+ 4Н20 + 359,82 Дж/кг (4)
ЗNH4NO3=
2N2 + N0 + N02 + 6Н20 + 966,50 Дж/кг (5)
Из приведенных выше реакций видно, что аммиак, образующийся в начальный
период термического разложения селитры, часто отсутствует в газовых смесях; в
них протекают вторичные реакции, в ходе которых аммиак полностью окисляется до
элементарного азота. В результате вторичных реакций резко увеличивается
давление газовой смеси в замкнутом объеме и процесс разложения может
закончиться взрывом.
Медь, сульфиды, магний, колчедан и некоторые другие примеси активируют
процесс разложения аммиачной селитры при ее нагревании. В результате
взаимодействия этих веществ с нагретой селитрой образуется неустойчивый нитрит
аммония, который при 70-80 °С бурно разлагается со взрывом:
4NO3=N2+ 2Н20 (6)
С железом, оловом и алюминием аммиачная селитра не реагирует даже в
расплавленном состоянии.
С повышением влажности и увеличением размера частиц аммиачной селитры
чувствительность ее к взрыву сильно уменьшаетcя. В присутствии примерно 3% влаги селитра становится
нечувствительной к взрыву даже при действии сильного детонатора.
Термическое разложение аммиачной селитры с повышением давления до
определенного предела усиливается. Установлено, что при давлении около 6
кгс/см2 и соответствующей температуре происходит распад всей расплавленной
селитры.
Решающее значение для уменьшения или предотвращения термического
разложения аммиачной селитры имеет поддержание щелочной среды при упаривании
растворов. Поэтому в новой технологической схеме производства неслеживающейся
аммиачной селитры целесообразно добавлять к горячему воздуху небольшое
количество аммиака.
Учитывая, что в определенных условиях аммиачная селитра может являться
взрывоопасным продуктом, в процессе ее производства, при хранении и перевозке
следует строго соблюдать установленный технологический режим и правила по
технике безопасности.
Аммиачная селитра относится к негорючим продуктам. Поддерживает горение
только закись азота, образующаяся при термическом разложении соли.
Смесь аммиачной селитры с измельченным древесным углем при сильном
нагревании способна самовоспламеняться. Некоторые легко окисляемые металлы
(например, порошкообразный цинк) в контакте с влажной аммиачной селитрой при
небольшом нагреве также могут вызвать ее воспламенение. В практике наблюдались
случаи самопроизвольного воспламенения смесей аммиачной селитры с
суперфосфатом.
Бумажные мешки или деревянные бочки, в которых находилась аммиачная
селитра, могут загораться даже под действием солнечных лучей. При возгорании
тары с аммиачной селитрой возможно выделение окислов азота и паров азотной
кислоты. При пожарах, возникающих от открытого пламени или вследствие
детонации, аммиачная селитра расплавляется и частично разлагается. В глубину
массы селитры пламя не распространяется [3], [8].
2. Методы
производства
аммиачный селитра нейтрализация кислота
В промышленности широко применяется только метод получения аммиачной
селитры из синтетического аммиака (или аммиаксодержащих газов) и разбавленной
азотной кислоты.
Производство аммиачной селитры из синтетического аммиака (или
аммиаксодержащих газов) и азотной кислоты является многостадийным. В связи с
этим пытались получать аммиачную селитру непосредственно из аммиака, окислов
азота, кислорода и паров воды по реакции
NH3 +
4NO2 + 02 + 2Н20 = 4NH4NO3 (7)
Однако от этого способа пришлось отказаться, так как наряду с аммиачной
селитрой образовывался нитрит аммония - неустойчивый и взрывоопасный продукт.
В производство аммиачной селитры из аммиака и азотной кислоты внедрен ряд
усовершенствований, которые позволили сократить капитальные затраты на
строительство новых установок и уменьшить себестоимость готового продукта.
Для коренного усовершенствования производств аммиачной селитры
потребовалось отказаться от сложившихся в течение многих лет представлений о
невозможности работать без соответствующих резервов основного оборудования
(например, выпарных аппаратов, грануляционных башен и др.), об опасности
получения для гранулирования почти безводного плава аммиачной селитры.
В России и за рубежом твердо установлено, что только строительство
агрегатов большой мощности, с использованием современных достижений науки и
техники, может дать существенные экономические преимущества по сравнению с
действующими производствами аммиачной селитры.
Значительное количество аммиачной селитры в настоящее время производится
из отходящих аммиаксодержащих газов некоторых систем синтеза карбамида. По
одному из способов его производства на 1 т карбамида получается от 1 до 1,4 т
аммиака. Из такого количества аммиака можно выработать 4,6-6,5 т аммиачной
селитры. Хотя работают и более совершенные схемы синтеза карбамида,
аммиаксодержащие газы - отходы этого производства-еще некоторое время будут
служить сырьем для получения аммиачной селитры.
Способ производства аммиачной селитры из аммиаксодержащих газов
отличается от способа ее получения из газообразного аммиака только на стадии
нейтрализации.
В небольших количествах аммиачную селитру получают путем обменного
разложения солей (конверсионные способы).
Эти способы получения аммиачной селитры основываются на выпадении одной
из образующихся солей в осадок или на получении двух солей с разной
растворимостью в воде. В первом случае растворы аммиачной селитры отделяют от
осадков на вращающихся фильтрах и перерабатывают в твердый продукт по обычным
схемам. Во втором случае растворы упаривают до определенной концентрации и
разделяют их дробной кристаллизацией, которая сводится к следующему: при
охлаждении горячих растворов выделяют большую часть аммиачной селитры в чистом
виде, затем в отдельной аппаратуре проводят кристаллизацию из маточных
растворов с получением загрязненного примесями продукта.
Все способы получения аммиачной селитры обменным разложением солей
сложны, связаны с большим расходом пара и потерей связанного азота. Их обычно
применяют в промышленности только в случае необходимости утилизации соединений
азота, получаемых как побочные продукты.
Современный способ производства аммиачной селитры из газообразного
аммиака (или аммиаксодержащих газов) и азотной кислоты непрерывно
совершенствуется. [3]
3. Основные
стадии производства аммиачной селитры из аммиака и азотной кислоты
Процесс производства аммиачной селитры состоит из следующих основных
стадий:
1. Получение растворов аммиачной селитры нейтрализацией
азотной кислоты газообразным аммиаком или аммиаксодержащими газами.
2. Упаривание растворов аммиачной селитры до состояния
плава.
3. Кристаллизация из плава соли в виде частиц округлой
формы (гранул), чешуек (пластинок) и мелких кристаллов.
4. Охлаждение или сушка соли.
5. Упаковка в тару готового продукта.
Для получения малослеживающейся и водоустойчивой аммиачной селитры кроме
указанных стадий необходима еще стадия приготовления соответствующих добавок.
.1 Получение
растворов аммиачной селитры
.1.1 Основы
процесса нейтрализации
Растворы аммиачной селитры получают в результате взаимодействия аммиака с
азотной кислотой по реакции:
NН3 + НNO3 = NН4NO3 + Q Дж (8)
Образование аммиачной селитры протекает необратимо и сопровождается
выделением тепла. Количество тепла, выделяющегося при реакции нейтрализации,
зависит от концентрации применяемой азотной кислоты и ее температуры, а также
от температуры газообразного аммиака (или аммиаксодержащих газов). Чем выше
концентрация азотной кислоты, тем больше выделяется тепла. При этом происходит
испарение воды, что позволяет получать более концентрированные растворы
аммиачной селитры. Для получения растворов аммиачной селитры применяют
42-58%-ную азотную кислоту.
Применение азотной кислоты концентрацией выше 58% для получения растворов
аммиачной селитры при существующем оформлении процесса не представляется
возможным, так как в этом случае в аппаратах-нейтрализаторах развивается
температура, значительно превышающая температуру кипения азотной кислоты, что
может привести к ее разложению с выделением окислов азота. При упаривании
растворов аммиачной селитры за счет тепла реакции в аппаратах-нейтрализаторах
образуется соковый пар, имеющий температуру 110-120 °С [2],[7].
При получении растворов аммиачной селитры максимально возможной концентрации
требуются относительно небольшие теплообменные поверхности выпарных аппаратов,
и на дальнейшее упаривание растворов расходуется малое количество свежего пара.
В связи с этим вместе с исходным сырьем стремятся подводить в нейтрализатор
дополнительное количество тепла, для чего подогревают соковым паром аммиак до
70 °С и азотную кислоту до 60 °С (при более высокой температуре азотной кислоты
происходит значительное ее разложение, и трубы подогревателя подвергаются
сильной коррозии, если они изготовлены не из титана).
Применяемая в производстве аммиачной селитры азотная кислота должна
содержать не более 0,20% растворенных окислов азота. Если кислота недостаточно
продута воздухом для удаление растворенных окислов азота, они образуют с
аммиаком нитрит аммония, быстро разлагающийся на азот и воду. При этом потери
азота могут составить около 0,3 кг на 1 т готового продукта.
В соковом паре, как правило, содержатся примеси NН3, NHО3 и
NН4NO3. Количество этих примесей сильно зависит от стабильности
давлений, при которых должны подаваться в нейтрализатор аммиак и азотная
кислота. Для поддержания заданного давления азотную кислоту подают из напорного
бака, снабженного переливной трубой, а газообразный аммиак - с помощью
регулятора давления.
Нагрузка нейтрализатора также в значительной степени определяет потери
связанного азота с соковым паром. При нормальной нагрузке потери с конденсатом
сокового пара не должны превышать 2 г/л (в пересчете на азот). При превышении
нагрузки нейтрализатора между аммиаком и парами азотной кислоты протекают
побочные реакции, в результате которых в газовой фазе образуется, в частности,
туманообразная аммиачная селитра, загрязняющая соковый пар, и увеличиваются
потери связанного азота. Получаемые в нейтрализаторах растворы аммиачной селитры
накапливаются в промежуточных емкостях с мешалками, донейтрализуются аммиаком
или азотной кислотой, после чего направляется на упаривание.
3.1.2
Характеристика нейтрализационных установок
В зависимости от применяемого давления современные установки для
получения растворов аммиачной селитры с использованием тепла нейтрализации
подразделяются на установки, работающие при атмосферном давлении; при
разрежении (вакууме); при повышенном давлении (несколько атмосфер) и на
комбинированные установки, работающие под давлением в зоне нейтрализации и при
разрежении в зоне отделения соковых паров от раствора (плава) аммиачной
селитры.
Установки, работающие при атмосферном или небольшом избыточном давлении,
отличаются простотой технологии и конструктивного оформления. Они также легко
обслуживаются, пускаются в работу и останавливаются; случайные нарушения
заданного ре-жима работы обычно быстро устраняются. Установки такого типа
получили наиболее широкое распространение. Основным аппаратом этих установок
является аппарат-нейтрализатор ИТН (использование тепла нейтрализации). Аппарат
ИТН работает под абсолютным давлением 1,15-1,25 атм. Конструктивно он оформлен
таким образом, что почти не происходит вскипания растворов- с образованием
туманообразной аммиачной селитры.
Наличие циркуляции в аппаратах ИТН исключает перегрев в зоне реакции, что
позволяет проводить процесс нейтрализации с минимальными потерями связанного
азота.
В зависимости от условий работы производства аммиачной селитры соковый
пар аппаратов ИТН используется для предварительного упаривания растворов
селитры, для испарения жидкого аммиака, подогрева азотной кислоты и
газообразного аммиака, направляемых в аппараты ИТН, и для испарения жидкого
аммиака при получении газообразного аммиака, применяемого в производстве
разбавленной азотной кислоты.
Растворы аммиачной селитры из аммиаксодержащих газов получают на
установках, основные аппараты которых работают при разрежении (испаритель) и
при атмосферном давлении (скруббер-нейтрализатор). Такие установки громоздки и
в них трудно поддерживать стабильный режим работы вследствие непостоянства
состава аммиаксодержащих газов. Последнее обстоятельство отрицательно
сказывается на точности регулирования избытка азотной кислоты, в результате
чего в получаемых растворах аммиачной селитры часто содержится повышенное
количество кислоты или аммиака.
Установки нейтрализации, работающие под абсолютным давлением 5-6 атм.,
мало распространены. Они требуют значительного расхода электроэнергии для
сжатия газообразного аммиака и подачи в нейтрализаторы азотной кислоты под
давлением. Кроме того, на этих установках возможны повышенные потери аммиачной
селитры вследствие уноса брызг растворов (даже в сепараторах сложной
конструкции брызги не удается полностью улавливать).
В установках, основанных на комбинированном методе, сочетаются процессы
нейтрализации азотной кислоты аммиаком и получения плава аммиачной селитры,
который можно непосредственно направлять на кристаллизацию (т. е. из таких
установок исключаются выпарные аппараты для концентрирования растворов
селитры). Для установок такого типа требуется 58-60%-ная азотная кислота,
которую промышленность выпускает пока сравнительно в небольших количествах.
Кроме того, часть аппаратуры должна быть выполнена из дорогостоящего титана.
Процесс нейтрализации с получением плава селитры приходится проводить при
весьма высоких температурах (200-220 °С). Учитывая свойства аммиачной селитры,
для осуществления процесса при высоких температурах необходимо создать особые
условия, предотвращающие термическое разложение плава селитры.
3.1.3
Установки нейтрализации, работающие при атмосферном давлении
В состав этих установок входят аппараты-нейтрализаторы ИТН (использование
теплоты нейтрализации) и вспомогательная аппаратура.
На рисунке 1 изображена одна из конструкций аппарата ИТН, применяемая на
многих действующих производствах аммиачной селитры.
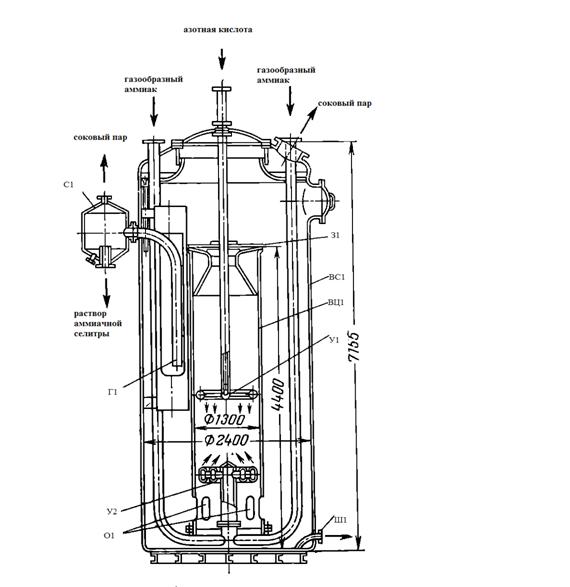
З1 - завихритель; ВС1 - внешний сосуд (резервуар); ВЦ1 - внутренний
цилиндр (нейтрализационная часть); У1 - устройство для распределения азотной
кислоты; Ш1 - штуцер для слива растворов; О1 - окна; У2 - устройство для
распределения аммиака; Г1 - гидрозатвор; С1 - сепаратор-ловушка
Рисунок 1 - Аппарат-нейтрализатор ИТН с естественной циркуляцией
растворов
Аппарат ИТН представляет собой вертикальный цилиндрический сосуд
(резервуар) 2, в котором помещен цилиндр (стакан) 3 с полками 1 (завихритель)
для улучшения смешения растворов. В цилиндр 3 подведены трубопроводы для ввода
азотной кислоты и газообразного аммиака (реагенты подаются противотоком); трубы
заканчиваются устройствами 4 и 7 для лучшего распределения кислоты и газа. Во
внутреннем цилиндре происходит взаимодействие азотной кислоты с аммиаком. Этот
цилиндр носит название нейтрализационной камеры.
Кольцевое пространство между сосудом 2 и цилиндром 3 служит для
циркуляции кипящих растворов аммиачной селитры. В нижней части цилиндра имеются
отверстия 6 (окна), соединяющие нейтрализационную камеру с испарительной частью
ИТН. Из-за наличия этих отверстий производительность аппаратов ИТН несколько
снижается, зато достигается интенсивная естественная циркуляция растворов, что
приводит к уменьшению потерь связанного азота.
Выделяющийся из раствора соковый пар отводится через штуцер в крышке
аппарата ИТН и через ловушку-сепаратор 9. Образующиеся в цилиндре 3 растворы
селитры в виде эмульсии - смеси с соковым паром поступают в сепаратор через
гидрозатвор 5. Из штуцера нижней части ловушки-сепаратора растворы аммиачной
селитры направляются в донейтрализатор-мешалку для дальнейшей обработки.
Гидрозатвор, имеющийся в испарительной части аппарата, позволяет поддерживать в
нем постоянный уровень раствора и препятствует выходу сокового пара без
промывки от увлекаемых им брызг раствора.
Паровой конденсат образуется на тарелках сепаратора вследствие частичной
конденсации сокового пара. При этом теплота конденсации отводится оборотной
водой, проходящей по змеевикам, уложенным на тарелках. В результате частичной
конденсации сокового пара получается 15-20%-ный раствор NН4NO3, который направляется на упаривание вместе с основным
потоком раствора аммиачной селитры.
На рисунке 2 представлена схема одной из установок нейтрализации,
работающих при давлении, близком к атмосферному.
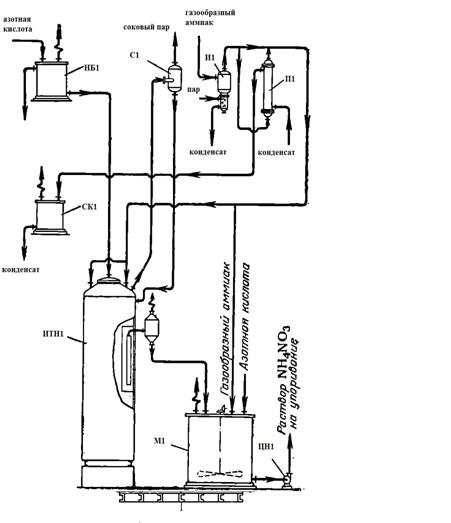
НБ1 - напорный бак; С1 - сепаратор; И1 - испаритель; П1 - подогреватель;
СК1 - сборник для конденсата; ИТН1 - аппарат ИТН; М1 - мешалка; ЦН1 -
центробежный насос
Чистая или с добавками азотная кислота подается в напорный бак снабженный
постояннодействующим переливом избытка кислоты в хранилище.
Из напорного бака 1 азотная кислота направляется непосредственно в стакан
аппарата ИТН 6 или через подогреватель (на рисунке не показан), где нагревается
теплом сокового пара, отводимого через сепаратор 2.
Газообразный аммиак поступает в испаритель 3 жидкого аммиака, затем в
подогреватель 4, где нагревается теплом вторичного пара из расширителя или
горячим конденсатом греющего пара выпарных аппаратов, и далее направляется по
двум параллельным трубам в стакан аппарата ИТН 6.
В испарителе 3 брызгоунос жидкого аммиака испаряется и происходит
отделение загрязнений, обычно сопутствующих газообразному аммиаку. При этом
образуется слабая аммиачная вода с примесью смазочного масла и катализаторной
пыли цеха синтеза аммиака.
Получаемый в нейтрализаторе раствор аммиачной селитры через
гидравлический затвор и брызгоуловитель-ловушку непрерывно поступает в
мешалку-донейтрализатор 7, откуда после нейтрализации избыточной кислоты
направляется на упаривание.
Выделяющийся в аппарате ИТН соковый пар, пройдя сепаратор 2, направляется
для использования в качестве греющего пара в выпарные аппараты первой ступени.
Конденсат сокового пара из подогревателя 4 собирается в сборнике 5,
откуда расходуется на разные производственные нужды.
Перед пуском нейтрализатора выполняются подготовительные работы,
предусмотренные в рабочих инструкциях. Отметим только некоторые из
подготовительных работ, связанных с нормальным ведением процесса нейтрализации
и с обеспечением техники безопасности.
Прежде всего, требуется залить в нейтрализатор раствор аммиачной селитры
или паровой конденсат до пробоотборного краника.
Затем необходимо наладить непрерывную подачу азотной кислоты в напорный
бак и ее перелив в складское хранилище склада. После этого требуется принять
газообразный аммиак из цеха синтеза аммиака, для чего необходимо на короткое
время открыть задвижки на линии отвода в атмосферу сокового пара и вентиль
выхода раствора в мешалку-донейтрализатор. Этим предупреждается создание в
аппарате ИТН повышенного давления и образование небезопасной аммиачно-воздушной
смеси при пуске аппарата.
В этих же целях до пуска нейтрализатор и взаимосвязанная с ним
коммуникация продуваются паром.
После достижения нормального режима работы соковый пар из аппарата ИТН
направляется на использование в качестве греющего пара[1],][8].
3.1.4
Установки нейтрализации, работающие при разрежении
Совместная переработка аммиаксодержащих газов и газообразного аммиака
нецелесообразна, так как связана с большими потерями аммиачной селитры, кислоты
и аммиака из-за наличия в аммиаксодержащих газах значительного количества
примесей (азот, метан, водород и др.)- Эти примеси, барботируя через
образующиеся кипящие растворы аммиачной селитры, уносили бы с соковым паром
связанный азот. Кроме того, соковый пар, загрязненный примесями, нельзя было бы
использовать в качестве греющего пара. Поэтому аммиаксодержащие газы, как
правило, перерабатывают отдельно от газообразного аммиака.
В установках, работающих при разрежении, использование тепла реакции
осуществляется вне нейтрализатора- в вакуум-испарителе. Здесь горячие растворы
аммиачной селитры, поступающие из нейтрализатора, кипят при температуре,
соответствующей вакууму в аппарате. В состав таких установок входят: нейтрализатор
скрубберного типа, вакуум-испаритель и вспомогательное оборудование.
На рисунке 3 представлена схема установки нейтрализации, работающей с
применением вакуум-испарителя.
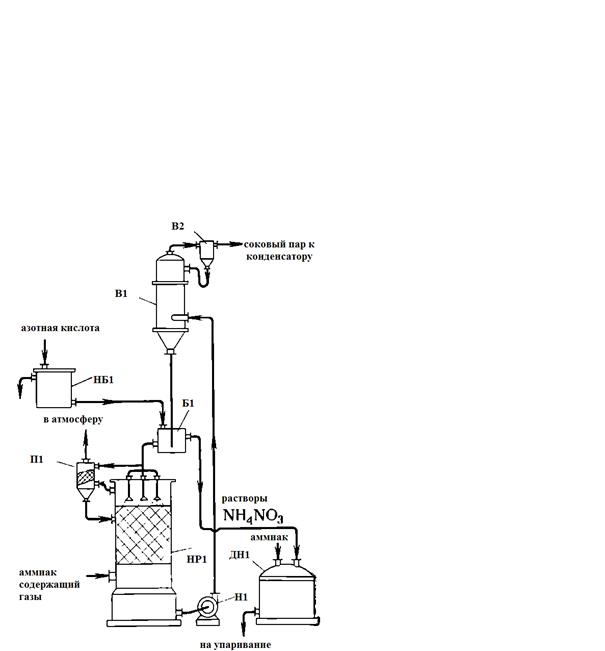
НР1 - нейтральзатор скрубберного типа; Н1 - насос; В1 -
вакуум-испаритель; В2 - вакуум-сепаратор; НБ1 - напорный бак азотной кислоты;
Б1 - бак (затворсмеситель); П1 - промыватель; ДН1 - донейтрализатор
Рисунок 3 - Схема установки нейтрализации с вакуум-испарителем
Аммиаксодержащие газы при температуре 30-90 °С под давлением 1,2-1,3 атм
подаются в нижнюю часть скруббера-нейтрализатора 1. В верхнюю часть скруббера
из бака- затвора 6 поступает циркуляционный раствор селитры, в который обычно
непрерывно подается из бака 5 азотная кислота, иногда предварительно нагретая
до температуры не выше 60 °С. Процесс нейтрализации проводится при избытке
кислоты в пределах 20-50 г/л. В скруббере 1 обычно поддерживается температура
на 15-20 °С ниже температуры кипения растворов, что позволяет предотвращать разложение
кислоты и образование тумана аммиачной селитры. Заданная температура
поддерживается благодаря орошению скруббера раствором из вакуум-испарителя,
который работает при разрежении 600 мм рт. ст., поэтому раствор в нем имеет
более низкую температуру, чем в скруббере.
Получаемый в скруббере раствор селитры засасывается в вакуум-испаритель
5, где при разрежении 560-600 мм рт. ст. происходит частичное испарение воды
(упаривание) и повышение концентрации раствора.
Из вакуум-испарителя раствор стекает в бак-гидрозатвор 6, откуда большая
его часть снова поступает на орошение скруббера 1, а остальное количество
направляется в донейтрализатор 8. Соковый пар, образующийся в вакуум-испарителе
3, через вакуум-сепаратор 4 направляется в поверхностный конденсатор (на
рисунке не показан) или в конденсатор смесительного типа. В первом случае
конденсат сокового пара используется в производстве азотной кислоты, во втором
- для различных других целей. Разрежение в вакуум-испарителе создается
благодаря конденсации сокового пара. Несконденсировавшиеся пары и газы
отсасываются из конденсаторов вакуум-насосом и отводятся в атмосферу.
Отработанные газы из скруббера 1 поступают в аппарат 7, где промываются
конденсатом для удаления капель раствора селитры, после чего также удаляются в
атмосферу. В мешалке-донейтрализаторе растворы нейтрализуются до содержания
0,1-0,2 г/л свободного аммиака и вместе с потоком раствора селитры, полученного
в аппаратах ИТН, направляются на упаривание.
На рисунке 4 представлена более совершенная схема вакуум-нейтрализации.
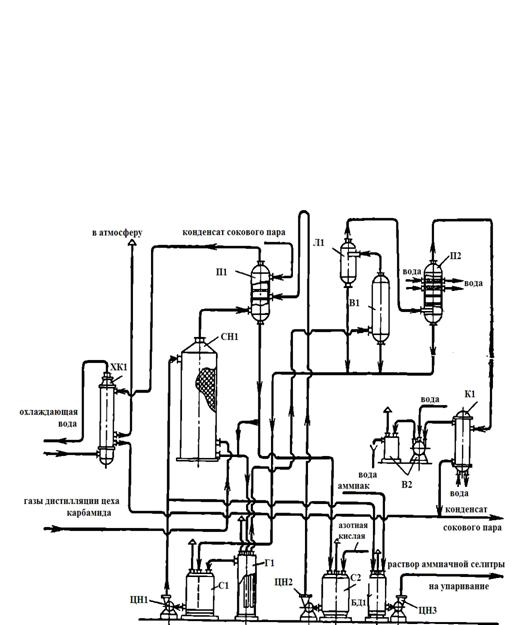
ХК1 - холодильник-конденсатор; СН1 - скруббер-нейтрализатор; С1, С2 -
сборники; ЦН1, ЦН2, ЦН3 - центробежные насосы; П1 - промыватель газов; Г1 -
гидрозатвор; Л1 - ловушка; В1 - вакуум-испаритель; БД1 - бак-донейтрализатор;
В2 - вакуум-насос; П2 - промыватель сокового аппарата; К1 - конденсатор
поверхностный
Рисунок 4 - Схема вакуум-нейтрализации:
Газы дистилляции направляются в нижнюю часть скруббера нейтрализатора 2,
орошаемого раствором из сборника 3 с помощью циркуляционного насоса 4.
В сборник 3 через гидрозатвор 6 поступают растворы из
скруббера-нейтрализатора 2, а также растворы после ловушки вакуум-испарителя 10
и промывателя сокового пара 14.
Через напорный бак (на рисунке не показан) азотная кислота раствор из
промывателя газов 5, орошаемого конденсатом сокового пара, непрерывно поступают
в сборник 7. Отсюда растворы циркуляционным насосом 8 подаются в промыватель 5,
пройдя который возвращаются в сборник 7.
Горячие газы после промывателя 5 охлаждаются в холодильнике-конденсаторе
1 и выбрасываются в атмосферу.
Горячие растворы аммиачной селитры из гидрозатвора 6 засасываются с
помощью вакуум-насоса 13 в вакуум-испаритель 10, где концентрация NH4NO3 увеличивается на несколько процентов.
Выделяющиеся в вакуум-испарителе 10 соковые пары, пройдя ловушку 9,
промыватель 14 и поверхностный конденсатор 15, вакуум-насосом 13 выбрасываются
в атмосферу.
Раствор аммиачной селитры с заданной кислотностью отводится из
нагнетательной линии насоса 4 в бак-донейтрализатор. Здесь раствор
нейтрализуется газообразным аммиаком и насосом 12 направляется на выпарную
станцию.
3.1. 5
Основное оборудование
Нейтрализаторы ИТН. Применяется несколько типов нейтрализаторов,
отличающихся главным образом размерами и конструкцией устройств для
распределения аммиака и азотной кислоты внутри аппарата. Часто применяются
аппараты следующих размеров: диаметр 2400 мм, высота 7155 мм, стакан - диаметр
1000 мм, высота 5000 мм. Эксплуатируются также аппараты диаметром 2440 мм и
высотой 6294 мм и аппараты, из которых удалена ранее предусмотренная мешалка
(рисунок 5).
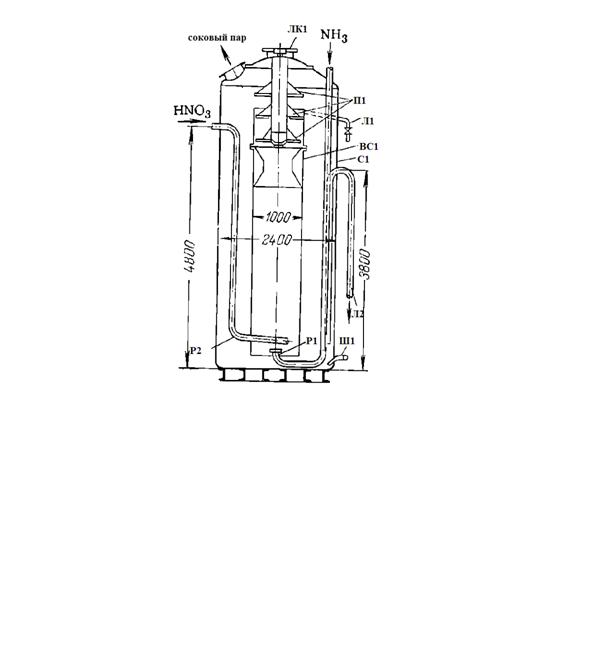
ЛК1 - люк; П1 - полки; Л1 - линия для отбора проб; Л2 - линия вывода
растворов; ВС1 - внутренний стакан; С1 - сосуд внешний; Ш1 - штуцер для слива
растворов; Р1 - распределитель аммиака; Р2 - распределитель азотной кислоты
Рисунок 5 - Аппарат-нейтрализатор ИТН
В отдельных случаях для переработки небольших количеств аммиаксодержащих
газов используются аппараты ИТН диаметром 1700 мм и высотой 5000 мм.
Подогреватель газообразного аммиака - кожухотрубный аппарат из
углеродистой стали. Диаметр корпуса 400-476 мм, высота 3500-3280 мм. Трубчатка
часто состоит из 121 трубки (диаметр трубки 25x3 мм) с общей поверхностью
теплообмена 28 м2. Газообразный аммиак поступает в трубки, а греющий пар или
горячий конденсат - в межтрубное пространство.
Если для обогрева применяется соковый пар из аппаратов ИТН, то
подогреватель выполняется из нержавеющей стали 1Х18Н9Т.
Испаритель жидкого аммиака представляет собой аппарат из углеродистой
стали, в нижней части которого расположен паровой змеевик, а в средней -
тангенциальный ввод газообразного аммиака.
В большинстве случаев испаритель работает на свежем паре давлением
(избыточным) 9 атм. Внизу испарителя аммиака имеется штуцер для периодической
продувки от накапливающихся загрязнений.
Подогреватель азотной кислоты - кожухотрубный аппарат диаметром 400 мм,
длиной 3890 мм. Диаметр трубок 25x2 мм, длина 3500 мм; общая поверхность
теплообмена 32 м2. Обогрев ведется соковым паром абсолютным давлением 1,2 атм.
Нейтрализатор скрубберного типа - вертикальный цилиндрический аппарат
диаметром 1800-2400 мм, высотой 4700-5150 мм. Применяются также аппараты
диаметром 2012 мм и высотой 9000 мм. Внутри аппарата для равномерного
распределения циркуляционных растворов по сечению расположено несколько
дырчатых тарелок или насадка из керамических колец. В верхней части аппаратов,
оборудованных тарелками, уложен слой колец размерами 50x50x3 мм, являющийся
отбойником брызг растворов.
Скорость газов в свободном сечении скруббера при диаметре 1700 мм и
высоте 5150 мм составляет около 0,4 м/сек. Орошение аппарата скрубберного типа
растворами осуществляется при помощи центробежных насосов производительностью
175-250 м3/ч.
Вакуум-испаритель - вертикальный цилиндрический аппарат диаметром
1000-1200 мм и высотой 5000-3200 мм. Насадка - керамические кольца размерами
50x50x5 мм, уложенные правильными рядами.
Промыватель газа - вертикальный цилиндрический аппарат из нержавеющей
стали диаметром 1000 мм, высотой 5000 мм. Насадка- керамические кольца
размерами 50x50x5 мм.
Мешалка-донейтрализатор - цилиндрический аппарат с мешалкой, вращающейся
со скоростью 30 об/мин. Привод осуществляется от электродвигателя через
редуктор (рисунок 6).
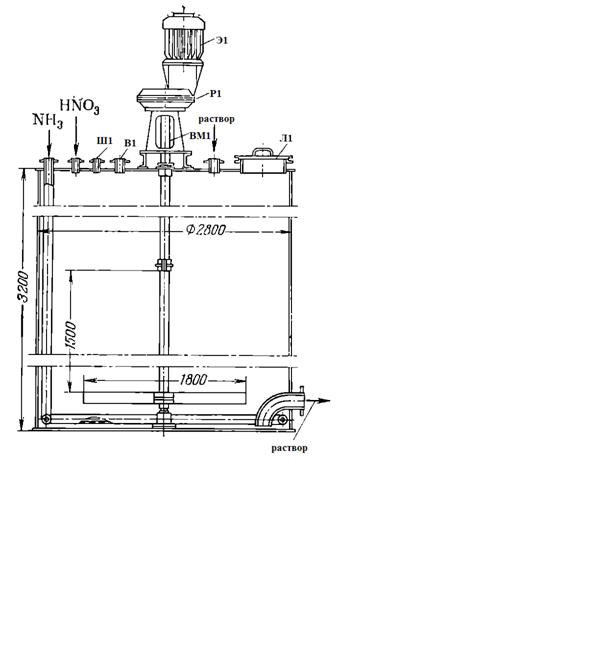
Ш1 - штуцер для установки измерителя уровня; В1 - воздушник; Э1 -
электродвигатель; Р1 - редуктор; ВМ1 - вал мешалки; Л1 - лаз
Рисунок 6 - Мешалка-донейтрализатор
Диаметр часто применяемых аппаратов 2800 мм, высота 3200 мм. Они работают
под атмосферным давлением, служат для донейтрализации растворов аммиачной
селитры и в качестве промежуточных емкостей для растворов, направляемых на
упаривание.
Поверхностный конденсатор - вертикальный кожухотрубный двухходовой (по
воде) теплообменник, предназначенный для конденсации сокового пара,
поступающего из вакуум-испарителя. Диаметр аппарата 1200 мм, высота 4285 мм;
поверхность теплопередачи 309 м2. Он работает при разрежении примерно 550- 600
мм рт. ст.; имеет трубки: диаметр 25x2 мм, длина 3500 м общее число 1150 шт.;
вес такого конденсатора - около 7200 Кг
В отдельных случаях для ликвидации выбросов в атмосферу сокового пара,
сбрасываемого при продувках из выпарных аппаратов, ловушек аппаратов ИТН и
гидрозатворов, устанавливается поверхностный конденсатор со следующей
характеристикой: диаметр корпуса 800 мм, высота 4430 мм, общее количество
трубок 483 шт., диаметр 25x2, общая поверхность 125 м2.
Вакуум-насосы. Применяются разные типы насосов. Насос типа ВВН-12 имеет
производительность 66 м3/ч, скорость вращения вала 980 об/мин. Насос
предназначен для создания вакуума в вакуум-нейтрализационной установке.
Центробежные насосы. Для циркуляции раствора аммиачной селитры на
установке вакуум-нейтрализации часто применяются насосы марки 7ХН-12 производительностью
175-250 м3/ч. Установочная мощность электродвигателя 55 квт [1].
4.
Материальные и энергетические расчеты
Произведем расчет материального и теплового баланса процесса. Расчеты
нейтрализации азотной кислоты газообразным аммиаком выполняю на 1 т продукта.
Исходные данные беру из таблицы 2, используя методику пособий [4], [5], [6].
Принимаем, что процесс нейтрализации будет протекать в следующих
условиях:
Начальная температура, °С
газообразного аммиака...........................................................................50
азотной
кислоты......................................................................................20
Таблица 2 - Исходные данные
|
Производительность
установки, кг/ч
|
1000
|
|
состав селитры, % :
аммиачная селитра вода
|
98 2
|
|
состав азотной кислоты, % :
азотная кислота вода
|
60 40
|
|
состав аммиачной воды, %
аммиак вода
|
25 75
|
100 100
|
Материальный расчет
Для получения 1 т селитры по реакции:
+HNO3=NH4NO3 +Q Дж (9)
теоретически требуется следующее количество сырья (в кг):
аммиака
- 80 х = 1000*17/80 = 212,5
х - 1000
азотной кислоты
- 80 х = 1000*63/80 = 787,5
х - 1000
Где 17, 63 и 80 - молекулярные массы аммиака, азотной кислоты и аммиачной
селитры соответственно.
Практический расход NH3 и HNO3 несколько выше теоретического, так
как в процессе нейтрализации неизбежны потери реагентов с соковым паром через
неплотности коммуникаций вследствие небольшого разложения реагирующих
компонентов и селитры и т.д.
. Определим количество аммиачной селитры в товарном продукте:
0,98*1000=980 кг/ч
или
/80=12,25 кмоль/ч,
а также количество воды:
-980=20 кг/ч
. Рассчитаю расход азотной кислоты (100%-ной) на получение 12,25 кмоль/ч
селитры. По стехиометрии ее расходуется столько же (кмоль/ч), сколько
образовалось селитры: 12,25 кмоль/ч, или 12,25*63=771, 75 кг/ч
Поскольку в условиях задана полная (100%-ная) конверсия кислоты, это и
будет ее поданное количество.
В процессе участвует разбавленная кислота - 60%-ная:
,75/0,6=1286,25 кг/ч,
в том числе воды:
,25-771,25=514,5 кг/ч
. Аналогично, расход аммиака (100%-ного) на получение 12,25 кмоль/ч, или
12,25*17=208,25 кг/ч
В пересчете на 25%-ную аммиачную воду это составит 208,25/0,25= 833 кг/ч,
в том числе воды 833-208,25=624,75 кг/ч.
. Найду общее количество воды в нейтрализаторе, поступившее с реагентами:
,5+624,75=1139,25 кг/ч
. Определим количество водяного пара, образовавшегося про упаривании
раствора селитры (20 кг/ч остается в товарном продукте): 1139,25 - 20=1119,25
кг/ч.
. Составим таблицу материального баланса процесса производства аммиачной
селитры.
Таблица 3 - Материальный баланс процесса нейтрализации
|
Приход
|
Расход
|
|
компонент
|
кг/ч
|
%
|
компонент
|
кг/ч
|
%
|
|
60%-ная азотная кислота В
том числе: азотная кислота вода
|
1286,25 771,25 514,5
|
60,69 60 40
|
98%-ная аммиачная селитра В
том числе: аммиачная селитра вода
|
1000 980 20
|
47,19 98 2
|
|
25%-ная аммиачная вода В
том числе: аммиак вода
|
833 208,25 624,75
|
39,31 25 75
|
Водяной пар
|
1119,25
|
52,81
|
|
Итого
|
2119,25
|
100
|
|
2119,25
|
100
|
. Рассчитаем технологически показатели.
· теоретические расходные коэффициенты:
по кислоте - 63/80=0,78 кг/кг
по аммиаку - 17/80=0,21 кг/кг
· фактические расходные коэффициенты:
по кислоте - 1286,25/1000=1,28 кг/кг
по аммиаку - 833/1000=0,83 кг/кг
В процессе нейтрализации проходила только одна реакция, конверсия сырья
равняла 1 (т.е. произошло полное превращение),потери отсутствовали, значит
фактически выход равен теоретическому:
Qф/Qт*100=980/980*100=100%
Энергетический расчет
Приход тепла. В процессе нейтрализации приход тепла складывается из
тепла, вносимого аммиаком и азотной кислотой, и тепла, выделяющегося при
нейтрализации.
1. Тепло, вносимое газообразным аммиаком, составляет:
Q1=208,25*2,18*50=22699,25
кДж,
где 208,25 - расход аммиака, кг/ч
- температура аммиака, °С
. Тепло вносимое азотной кислотой:
Q2=771,75*2,76*20=42600,8
кДж,
где 771,25 - расход азотной кислоты, кг/ч
,76 - теплоемкость азотной кислоты, кДж/(кг*°С)
- температура кислоты, °С
. Теплоту нейтрализации предварительно рассчитывают на 1 моль
образующейся аммиачной селитры по уравнению:
3*3,95H2O(жидк) +NH3(газ)
=NH4NO3*3,95H2O(жидк)
где HNO3*3,95H2O соответствует
азотной кислоте.
Тепловой эффект Q3
этой реакции находим из следующих величин:
а) теплота растворения в воде азотной кислоты:
+3,95 H2O=HNO3*3,95H2O
(10)
б) теплота образования твердого NH4NO3 из 100%-ной азотной кислоты и
100%-ного аммиака:
HNO3 (жидк) +NH3(газ) =NH4NO3(тв) (11)
в) теплота растворения аммиачной селитры в воде с учетом расхода реакционного
тепла на упаривание получаемого раствора от 52,5% (NH4NO3 *H2O) до 64% (NH4NO3 *2,5H2O)
NH4NO3 +2,5H2O= NH4NO3*2,5H2O, (12)
где NH4NO3*4H2O соответствует концентрации 52,5% NH4NO3
Величина NH4NO3*4H2O рассчитывается
из соотношения
*47,5/52,5*18=4H2O,
где 80 - молярный вес NH4NO3
,5 - концентрация HNO3 ,
%
,5 - концентрация NH4NO3 , %
- молярный вес H2O
Аналогично рассчитывается величина NH4NO3*2,5H2O, соответствующая 64%-ному раствору NH4NO3
*36/64*18=2,5H2O
По реакции (10) теплота растворения q азотной кислоты в воде равна 2594,08 Дж/моль. Для
определения теплового эффекта реакции (11) требуется из теплоты образования
нитрата аммония вычесть сумму теплот образования NH3(газ) и HNO3
(жидк).
Теплота образования этих соединений из простых веществ при 18°С и 1 атм
имеет следующие значения (в Дж/моль):
NH3(газ):46191,36(жидк):174472,8NO3(тв):364844,8
Общий тепловой эффект химического процесса зависит только от теплот
образования исходных взаимодействующих веществ и конечных продуктов. Из этого
следует, что тепловой эффект реакции (11) составит:
q2=364844,8-(46191,36+174472,8)=144180,64
Дж/моль
Теплота q3 растворения NH4NO3 по реакции (12) равна 15606,32 Дж/моль.
Растворение NH4NO3 в воде протекает с поглощение
тепла. В связи с этим теплота растворения принимается в энергетическом балансе
со знаком минус. Концентрирование же раствора NH4NO3 протекает
соответственно с выделением тепла.
Таким образом, тепловой эффект Q3 реакции
3 +*3,95H2O(жидк)+ NH3(газ)
=NH4NO3*2,5H2O(жидк)+1.45 H2O(пар)
составит:
3=q1+q2+q3=
-25940,08+144180,64-15606,32=102633,52 Дж/моль
При выработке 1 т аммиачной селитры тепло реакции нейтрализации составит:
,52*1000/80=1282919 кДж,
где 80 - молекулярный вес NH4NO3
из приведенных выше расчетов видно, что суммарный приход тепла составит:
с аммиаком 22699,25, с азотной кислотой 42600,8, за счет тепла нейтрализации
1282919 и всего 1348219,05 кДж.
Расход тепла. При нейтрализации азотной кислоты аммиаком тепло отводится
из аппарата получаемым раствором аммиачной селитры, расходуется на испарение
воды из этого раствора и теряется в окружающую среду.
Количество тепла, уносимого раствором аммиачной селитры, составляет:
Q=(980+10)*2,55
tкип ,
где 980 - количество раствора аммиачной селитры, кг
- потери NH3 и HNO3 ,кг
tкип -
температура кипения раствора аммиачной селитры, °С
Температуру кипения раствора аммиачной селитры определяем при абсолютном
давлении в нейтрализаторе 1,15 - 1,2 атм; этому давлению соответствует
температура насыщенного водяного пара 103 °С. при атмосферном же давлении
температура кипения раствора NH4NO3 составляет 115,2 °С. температурная
депрессия равна:
∆t=115,2
- 100=15,2 °С
Вычисляем температуру кипения 64%-ного раствора NH4NO3
tкип =
tнас. пара+∆t*η
=103+15,2*1,03 = 118,7
°С ,
где η - коэффициент температурной депрессии при любом давлении; при
103 °С он равен 1,03.
Определяем количество тепла, отводимого покидающим нейтрализатор
раствором NH4NO3
Q’=1575*2,55*118,7=476728,88
кДж
Количество тепла, расходуемого на испарение воды из раствора:
Q”=1119,25*640=716320
кДж,
где 1119,25 - количество образующегося сокового пара, кг
- энтальпия сухого пара при абсолютном давлении 1,2 атм, кДж/кг.
Таким образом, общий расход тепла в процессе нейтрализации составит:
’ + Q”=476728,88+716320=1193048,88 кДж
Если вычесть из прихода тепла его расход, получим величину потерь тепла в
окружающую среду:
,05 -1193048,88=155170,17 кДж
Эта величина составляет около 3% общего расхода тепла, что соответствует
практике работы аппарата.
Таблица 4 - Энергетический баланс процесса нейтрализации
|
Приход
|
кДж
|
%
|
Расход
|
кДж
|
%
|
|
С аммиаком С азотной
кислотой Тепло реакции нейтрализации
|
1,68 3,16 95,16
|
С раствором аммиачной
селитры С соковым паром Потери в окружающую среду
|
476728,88 716320
155170,17
|
35,36 53,13 11,51
|
|
Всего
|
1348219,05
|
100
|
Всего
|
1348219,05
|
100
|
Из энергетического баланса видно, что приход и расход тепла совпадают.
5.
Термодинамический расчет
Термодинамический расчет веду исходя из уравнений (13) - (19), используя
таблицу 5 [7].
Расчетные формулы:
1. ΔH298=ΣvΔH298 (продуктов) - ΣvΔH298(исх. веществ) (13)
. ΔHТ = ΔH298 + ΔСРdT; (14)
. ΔSТ = ΔS298 + (ΔСР/T) dT; (15)
4. ΔGТ = ΔHT - T*. ΔSТ ; (16)
. СР = a + bT + c/T2; ΔСР = Δa + ΔbT + Δc/T2 (17)
6. Δa = Σva(продуктов) - Σva(исходных веществ); (18)
. К = е - ΔG/RT. (19)
Процесс нейтрализации протекает по следующей реакции (при 110°С):
3+HNO3=NH4NO3 (20)
Таблица 5 - Справочные данные для расчета
|
Величина
|
NH3
|
HNO3
|
NH4NO3
|
|
ΔH298, кДж/моль
|
-45,94
|
-173,00
|
-365,43
|
|
S298, Дж/моль
|
192,66
|
156,16
|
151,04
|
|
ΔG298,
кДж/моль
|
-16,48
|
-79,90
|
-183,93
|
|
а в*103 с*10-5
|
29,80 25,48 -1,67
|
109,87 ─ ─
|
139,33 ─ ─
|
Расчет теплоемкости для веществ в реакторе:
СР (NH3)=29,80+25,48*10-3*383+(-1,67)*105/3832=
-779,47 Дж/моль*К
СР (HNO3) = 109,87 Дж/моль*К
СР (NH4NO3)= 139,33 Дж/моль*К
ΔСР=(139,33-109,87-29,80)+(-25,48)*10-3*383+1,67*105/3832=-8,96
Дж/моль*К
Расчет энтальпий веществ в реакторе:
ΔH298 = -365,43-(-173,00)-( -45,94) = -146,49 кДж/моль
ΔH383=-146,49 103+8,96 (383-298) = -145,73 кДж/моль
Расчет энтропии веществ:
ΔS298 р-ции =151,04-192,66-156,16 = -197,78 Дж/моль
ΔS383 =-197,78 +8,96/383 = -197,76 Дж/моль
Расчет энергии Гиббса:
ΔG298=-183,93-(-16,48)-( -79,90) = -87,55 кДж/моль
ΔG383= 145,73 *103-383*(-197,76) = 69,99 кДж/моль
Константа равновесия: К= 0,98
Исходя
из полученных данных можно сделать вывод, что реакция является экзотермической,
т.к. 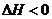 ,
, 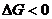 ,
следовательно, реакция идет самопроизвольно. ΔS<0, значит,
можно говорить о том, что система стационарна. Константа равновесия равна 0,98
следовательно, реакция смещена в прямом направлении (в сторону образования
продуктов) и значит, реакция является необратимой.
,
следовательно, реакция идет самопроизвольно. ΔS<0, значит,
можно говорить о том, что система стационарна. Константа равновесия равна 0,98
следовательно, реакция смещена в прямом направлении (в сторону образования
продуктов) и значит, реакция является необратимой.
6. Утилизация
и обезвреживание отходов в производстве аммиачной селитры
Отходами производства аммиачной селитры являются:
· конденсат свежего греющего пара;
· конденсаты соковых паров стадий получения растворов аммиачной
селитры и упаривания;
· шлам, образующийся при получении некоторых неорганических
добавок, вносимых для уменьшения слеживаемости готового продукта.
Кроме того, в атмосферу выбрасываются огромные количества загрязненного
воздуха после грануляционных башен и охладителей, а также после доупарочных
аппаратов.
При производстве аммиачной селитры в крупных масштабах вопросы утилизации
и обезвреживания отходов приобрели первостепенное значение.
Разработаны и частично внедрены два способа очистки конденсатов соковых
паров.
Был разработан способ очистки от селитры отработанного воздуха на
агрегате мощностью 1400 т/сутки. В отработанном воздухе, выбрасываемом из
грануляционных башен в атмосферу, аммиачная селитра содержится в виде
мелкодисперсных частиц, которые известными механическими устройствами
(циклонами, рукавными фильтрами и т. п.) невозможно уловить. Такие частицы
образуются в башнях вследствие сублимации аммиачной селитры в процессе
разбрызгивания плава, при дроблении струй плава на капли и особенно за счет
истирания пустотелых гранул в кипящем слое.
Унос с воздухом этих частиц из грануляционных башен должен значительно
увеличиться ввиду повышения нагрузки, увеличения скорости воздуха во всем
объеме башни и перехода на двухступенчатое охлаждение в кипящем слое.
Следует отметить, что чем выше скорость воздуха в грануляционной башне,
тем более крупные частицы селитры могут быть унесены воздушным потоком.
Например, при скорости воздуха 3 м/с из башни уносятся все частицы селитры
размером менее 515 мк; при скорости же 1 м/с - лишь частицы менее 190 мк. В
первом случае, при прочих равных условиях, общий унос частиц из грануляционной
башни мощностью 500 т/сутки составит 350 т в год, а во втором случае (скорость
1 м/с) будет унесено примерно 25 т/год. Другими словами, повышение скорости
воздуха в башне в три раза вызывает увеличение уноса селитры в 14 раз.
Количество конденсатов и содержание в них примесей NH3 и NН4NO3 зависит от
концентрации применяемой азотной кислоты, производительности нейтрализаторов и выпарных
аппаратов, стабильности их работы, а также от брызгоуноса. В среднем на 1 т
готового продукта в процессе нейтрализации выделяется 350- 500 кг соковых
паров, а при выпаривании растворов селитры - около 300 кг.
Из-за недостатка на многих азотных предприятиях чистого парового
конденсата для питания абсорбционной системы азотнокислотных цехов приходится
частично или 'полностью применять конденсаты соковых паров производств аммиачной
селитры.
В результате этого в узле абсорбции кислотных цехов протекают следующие
побочные реакции:
+ NO2 + 2NH4ОН =
2N2 + 5Н2O (21)ОН + НNO3 = NН4NO3 + Н2O (22)
NН3 + 4NO + О2 + 2Н20 = 4NH4NO3 (23)NO3+ NO= NO2 +NH4NO2 (24)NO2 =N2+2H2O (25)
Из приведенных реакций видно, что при использовании конденсатов соковых
паров образуются нитрит и нитрат аммония и теряется некоторое количество
связанного азота. Особенно важно то, что часть нитрита и нитрата аммония,
образующегося в газовой фазе колонн (башен), не разрушается и не отмывается
кислотой, а уносится отходящими газами в виде аэрозолей. Последние же обладают
способностью частично осаждаться из газового потока в машинах центробежного
действия (газодувках, вентиляторах и рекуперационных турбинах).
Для предотвращения возможного попадания нитрит-нитратных солей в машины
приходится принимать дополнительные меры (например, нейтрализовать аммиак
конденсатов соковых паров азотной кислотой, питать верхние тарелки колонн
чистым паровым конденсатом, а несколько ниже - на 36-38-ю тарелки - подавать
конденсат соковых паров; применять промывку или пропарку машин от осадков солей
и др.) Эти меры весьма важны, так как в практике известны случаи, когда такие
отложения - осадки самопроизвольно взрывались с большой силой.
Очистка конденсатов ионитами
Ионитами называются твердые материалы, практически нерастворимые в воде и
во многих других растворителях, способные к обмену своих ионов на ионы,
находящиеся в растворе.
Являясь химически активными частицами, ионы вступают в различные реакции
с атомами, молекулами и между собой.
Большинство ионитов - природные или искусственные соединения (их также
называют иоиообменниками). В промышленности применяются главным образом
искусственные иониты - ионообменные смолы, отличающиеся высокой поглотительной
способностью, механической прочностью и химической устойчивостью.
По типу химических групп в своем составе иониты подразделяются на
катиониты - материалы, способные обменивать катионы, которыми они «заряжаются»
при регенерации, на анионы, содержащиеся в растворе; аниониты - материалы,
способные обменивать анионы, которыми они «заряжаются» при регенерации, на
катионы, содержащиеся в растворе.
Ионный обмен происходит в эквивалентных отношениях и в большинстве
случаев является обратимым. Количество катионов или анионов, поглощенных
ионитом из пропущенного через него раствора до установления равновесия,
характеризует обменную способность ионита в статических условиях.
Обменная способность ионита зависит от многих факторов: химического
состава, чистоты растворов, скорости их пропускания, рН среды, полноты
регенерации и т. д.
В последние годы созданы иониты, которые способны поглощать даже 5-8
мг-экв иона на 1 г сухого ионита.
Извлечение ионов из растворов осуществляют, пропуская последние через
фильтры с зернами ионитов, имеющих размеры 2- 0,3 мм и влажность 45-50%. Для
очистки конденсатов соковых паров ионитные фильтры часто соединяют
последовательно: два с катионитом и два с анионитом.
Фильтр - цилиндрический аппарат со сферическим днищем и крышкой; он
выполняется из двухслойной стали или углеродистой стали, покрытой изнутри
несколькими слоями антикоррозионного материала, например, полиизобутиленом.
Размеры фильтров: диаметр 2000-2500 мм, высота 2000-4800 мм.
В фильтрах располагаются распределительные устройства в виде труб с
колпачками или прорезями. Последние служат для равномерной подачи конденсатов и
растворов в фильтр, для взрыхления ионитов при регенерации и предотвращения их
уноса потоками жидкости.
При очистке конденсатов от NH3 и NН4NО3 с помощью КУ-2 (рабочая емкость по иону аммония 1100
мг-экв/л) и анионита марки АН-2Ф или АН-31 (рабочая емкость 700-800 мг-экв/л)
протекающие процессы обмена ионами можно изобразить следующим образом:
Катионирование (Кат.) Н + NН4NО3 ↔(Кат.) NН4 + НNO3
(Кат.) Н + NН4ОН ↔
(Кат.) NН4 + Н2O
(Кат.) NН4+ НNO3 ↔ [регенерация] (Кат.) Н + NН4NО3
Анионирование (Аи.) ОН + НNO3↔
(Ан.) NO3 + Н2O
(Ан.) NО3 + NН4ОН ↔ [регенерация] (Ан.) ОН + NН4NО3
Вначале конденсаты соковых паров очищаются на фильтрах с катионитом, а
затем .на фильтрах с анионитом. После этого фильтры обоих типов подвергают
регенерации, которая состоит из следующих операций: в течение 15 мин иониты
взрыхляют потоком промывной воды, подаваемой в фильтр снизу вверх, опускают
промывные воды для предотвращения разбавления регенератора, подают в фильтр
регенерационные растворы в течение примерно 1 ч, спускают их и далее отмывают
катионит чистым конденсатом.
Процесс фильтрования продолжают до истощения емкости катионита, что
определяется проскоком иона аммония (1 мг/л), и истощения емкости анионита (до
2 мг/л аниона NН3).
Для восстановления обменной способности Н-катионитового фильтра применяют
15-20%-ный раствор азотной кислоты, а фильтра с анионитом - 10%-ный раствор
аммиачной воды.
Растворы, получаемые при регенерации ионитов, перерабатывают в
производстве аммиачной селитры по общепринятой схеме.
Эти растворы содержат примерно 30-65 г/л селитры и 40-80 г/л азотной
кислоты.
При использовании конденсатов соковых паров в азотнокислотном
производстве их направляют туда сразу после катионирования (минуя анионитные
фильтры).
Заключение
В своей курсовой работе я изучила производство аммиачной селитры методом
нейтрализации. Я провела анализ физико-химических свойств аммиачной селитры и
определила наиболее эффективные методы производства данного продукта.
Также я произвела расчет материального и энергетического балансов
процесса нейтрализации аммиачной селитры. Производство методом нейтрализации,
на мой взгляд, является самым эффективным и экономически выгодным. Основным
достоинством метода является то, что выход продукта близок к теоретическому.
Я определила основные методы утилизации и обезвреживания отходов, с
помощью которых производство становится еще более выгодным и экологически более
чистым.
Список
использованных источников
1
Производство аммиачной селитры/М.А. Миннович - М.: «Химия», 1974, 240с.
Справочник
химика-Кн.2.-М.:Химия, 1987, 464 с.
Технология
аммиачной селитры/Под ред. В.М. Олевского -М.: Химия, 1978,311с.
Общая
химическая технология/Под ред. И.П. Мухленова-М.: Высш. Школа, 1984, 288 с.
Общая
химическая технология. Примеры материальных и тепловых балансов. Учебное
пособие. Л., СЗПИ, 1969г, 256 с.
Расчеты
химико-технологических процессов. Под ред. И. П. Мухленова. Л., «Химия», 1976 -
299 с.
Краткий
справочник физико-химических величин. Изд., 8-е, перераб./Под ред. А. А.
Равделя и А. М. Пономаревой - Л.: «Химия», 1983. 232с.
.
Автоматизация производственных процессов в химической промышленности /
Голубятников В.А., Шувалов В.В. - М.: «Химия», 1985, 352 с.
Приложение А
Справка о патентно-технических исследованиях дипломной (курсовой) работы
Название дипломной (курсовой) работы:_Производство аммиачной селитры
Предмет поиска Производство аммиачной селитры
Автор дипломной (курсовой) работы (Ф.И.О.) _Сильченко Виктория
Александровна
|
Страна выдачи охранного
документа (по стандартам ВОИС)
|
Индекс МПК
|
Источники информации
|
Глубина поиска
|
Номер охранного документа
(аналоги)
|
|
RU RU
|
C01C1/18 C05G1/08
|
Описания к авторским
свидетельствам и патентам
|
2000-2012г
2000-2012г
|
2401247 2252206
|
Поиск осуществлен по патентному фонду Тверского государственного
технического университета и открытой базе данных Интернет
Поиск осуществил______Сильченко Виктория Александровна
Полноту и достоверность приведенных сведений удостоверяю
Государственный патентный эксперт
ТГТУ________________________________________Е.И.Ханькевич