Законы классической термодинамики
Министерство
образования и науки Российской Федерации
Федеральное
государственное бюджетное образовательное учреждение
высшего
профессионального образования
"Национальный
исследовательский Томский политехнический университет"
Контрольная
работа
Законы
классической термодинамики
Томск,
2015
1. Законы классической термодинамики
термодинамика смесь фазовый
равновесие
1.1 Теоретическая часть
а) В чем состоит предмет термодинамики (что
изучает термодинамика)?
Ответ:
Термин "термодинамика" произошел от
двух греческих слов: "тепло" и "сила".
Термодинамика - раздел физики, изучающий
соотношения и превращения теплоты и других форм энергии.
Термодинамика изучает макроскопические системы,
состоящие из огромного числа частиц и процессы, происходящие в таких системах,
описываются макроскопическими величинами, такими как давление или температура,
которые не применимы к отдельным молекулам и атомам.
Законы термодинамики носят общий характер и не
зависят от конкретных деталей строения вещества на атомарном уровне. Поэтому
термодинамика успешно применяется в широком круге вопросов науки и техники,
таких как энергетика, двигатели, фазовые переходы, химические реакции, явления
переноса и даже чёрные дыры.
Термодинамика имеет важное значение для самых
разных областей физики и химии, химической технологии, аэрокосмической техники,
машиностроения, клеточной биологии, биомедицинской инженерии, материаловедения
и находит своё применение даже в таких областях, как экономика.
Классическая термодинамика включает в себя
следующие разделы:
· начала термодинамики (иногда также
называемые законами или аксиомами);
· уравнения состояния и свойства
простых термодинамических систем (идеальный газ, реальный газ, диэлектрики и
магнетики и т.д.);
· равновесные процессы с простыми
системами, термодинамические циклы;
· неравновесные процессы и закон
неубывания энтропии;
· термодинамические фазы и фазовые
переходы.
(По материалам https://ru.wikipedia.org)
Базаров И.П. в своей книге
"Термодинамика" [1, стр. 14] дает такое определение термину:
"Термодинамика изучает закономерности
теплового движения в равновесных системах и при переходе систем в равновесие
(классическая, или равновесная, термодинамика), а также обобщает эти
закономерности на неравновесные системы (неравновесная термодинамика, или
термодинамика необратимых процессов)".
б) В чем заключаются самые важные следствия
третьего начала термодинамики?
Ответ:
В начале XX в. (1906-1912 гг.) в результате
исследований свойств тел при низких температурах Нернстом было установлено третье
начало термодинамики, которое после долгих лет обсуждения в настоящее время так
же прочно обосновано, как и первые два начала.
Непосредственной областью применимости третьего
начала являются процессы при низких температурах. Однако оно играет существенную
роль и в более широком температурном интервале, так как позволяет определять
аддитивные постоянные в выражениях для энтропии, которые нельзя вычислить
каким-либо другим термодинамическим путем.
В результате этих исследований было
сформулировано третье начало термодинамики:
"По мере приближения температуры к 0 К
энтропия всякой равновесной системы при изотермических процессах перестает
зависеть от каких-либо термодинамических параметров состояния и в пределе (Т=0
К) принимает одну и ту же для всех систем универсальную постоянную величину,
которую можно принять равной нулю" (см. [1], стр. 91).
В радикальной формулировке Макса Планка имеет
вид начального (или предельного) условия для системы дифференциальных
уравнений, определяющих энтропию: полагается, что при выключении температуры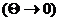 энтропия системы также стремится к нулю:
энтропия системы также стремится к нулю:
lim S(Θ,
V, a, N) = 0 (см. [2],
стр. 47).
Три важных общих следствий III начала
термодинамики:
Третье начало позволяет сделать заключение о
поведении термодинамических величин при 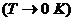 .
Рассмотрим следствия третьего начала.
.
Рассмотрим следствия третьего начала.
. Первое следствие:
Третье начало термодинамики позволяет описать
поведение калорических величин в области низких температур.
Если при 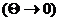 PV=const,
то вблизи нуля
PV=const,
то вблизи нуля 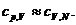
Если же при 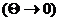 PV~Θk,
то
PV~Θk,
то
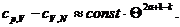
2. Недостижимость 0 К.
Из третьего начала непосредственно следует
недостижимость температуры 0 К.
Действительно, охлаждение системы осуществляется
повторением следующих друг за другом процессов адиабатного расширения (при
котором понижается температура) и изотермического сжатия (при котором
уменьшается энтропия).
По третьему началу при изотермических процессах,
когда температура приближается к 0 К, энтропия перестает изменяться при сжатии.
Поэтому состояние с S=0 за конечное число
указанных процессов недостижимо и, следовательно, недостижим и 0 К.
К температуре 0 К можно лишь асимптотически
приближаться.
. Поведение термических коэффициентов при T →
0
Термический коэффициент расширения 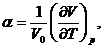 термический
коэффициент давления
термический
коэффициент давления 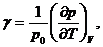 как и вообще
термодинамические величины
как и вообще
термодинамические величины 
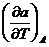 и
и 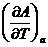 должны,
по третьему началу, приближаться к нулю при
должны,
по третьему началу, приближаться к нулю при 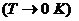 .
.
.2 Практическая часть
Задача №1
Газовая смесь задана процентным составом
компонентов смеси СО2, Н2, СО, Н2О, О2, N2, SO2 в массовых долях (табл. 1).
Давление смеси равно Рсм (табл. 1, строка 8). Объем смеси равен Vсм (табл. 1,
строка 9). Температура смеси равна tсм (табл. 1, строка 10). В интервале
температур t (табл. 1, строка 11) смесь нагревается.
Данные для соответствующего варианта берутся из
табл. 1.
Определить:
. Объемный состав смеси.
. Газовые постоянные компонентов Ri и смеси Rсм,
кДж/(кг∙К).
. Среднюю молярную массу смеси µсм через
объемные и массовые доли, кг/кмоль.
. Парциальные давления компонентов через
объемные и массовые доли.
. Массу смеси Мсм, кг и массы компонентов Мi,
кг.
. Парциальные объемы компонентов Vi, м3.
. Плотности компонентов и смеси при нормальных
физических условиях через объемные и массовые доли.
. Массовые теплоемкости с, кДж/(кг К) при
рсм=соnst; Vсм=const; для температуры смеси tсм, °С, (строка 10).
. Количество теплоты, необходимое для нагревания
(охлаждения) 7 кг смеси в интервале температур (строка 11) при р=const.
Таблица 1
|
Данные
|
Вариант
15
|
|
СО,
%
|
10
|
|
Н2,
%
|
20
|
|
О2,
%
|
|
N2,
%
|
50
|
|
рсм,
МПа
|
0,85
|
|
Vсм,
м3
|
7
|
|
t
°С
|
1000
|
|
Δ
t°С,
|
950
- 400
|
. Определение объемного состава смеси
Процентный состав компонентов смеси изобразим на
диаграмме (рис. 1):
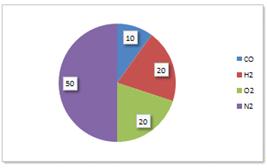
Рисунок 1 - Диаграмма компонентов смеси (в
процентах)
Вычисление объемной доли
Определим объемную долю компонентов (табл. 2):
Таблица 2
|
Компоненты
|
Объемная
доля (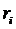 ) )
|
|
СО,
%
|
0,10
|
|
Н2,
%
|
0,20
|
|
О2,
%
|
0,20
|
|
N2,
%
|
0,50
|
. Вычисление средней молярной массы смеси через
объемные и массовые доли
Определим средний молекулярный вес смеси (через
объемные доли):
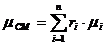 ,
,
где 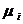 -
молярная масса компонента смеси, в данном случае
-
молярная масса компонента смеси, в данном случае
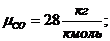
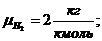

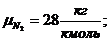
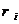 - объемная доля
компонента смеси (см. табл. 2):
- объемная доля
компонента смеси (см. табл. 2):
Имеем:
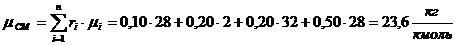
Найдем массовые доли каждого компонента смеси
газов:
Используем формулу:
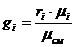 .
.
Имеем:
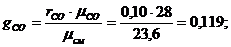
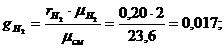
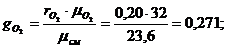
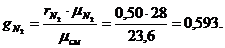
Сделаем проверку:
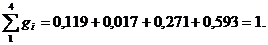
Определим средний молекулярный вес смеси (через
массовые доли):
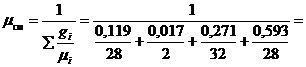
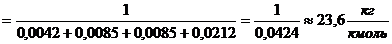
Вывод: получен тот же результат, что и в
расчетах, проведенных выше.
. Вычисление газовых постоянных компонентов и
смеси
Газовые постоянные компонентов смеси:
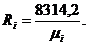
Имеем:
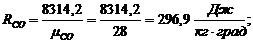

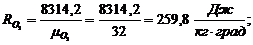
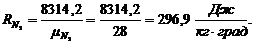
Газовая постоянная смеси:
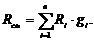
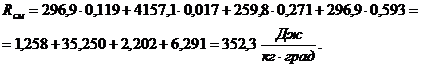
Сделаем проверку:
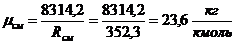
Вывод: расчет проведен правильно.
. Вычисление парциального давления компонентов
через объемные и массовые доли
Определим парциальные давления через объемные
доли:
По условию Pсм =
0,85 МПа.
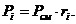
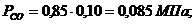
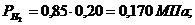
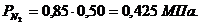
Определим парциальные давления через массовые
доли:
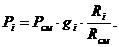
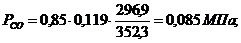
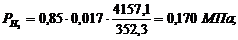
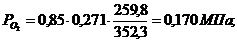
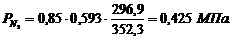
Вывод: результаты
получились одинаковыми.
5. Вычисление массы смеси и массы компонентов
Определение массы смеси:
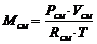 ,
,
где: Рсм = 0,85 Мпа = 0,85·106 Па;см = 7 м3;
см = 352,3 Дж/(кг·град) =0,352 кДж/(кг·град
Т = 1000+273=1273 К.
Подставляем:
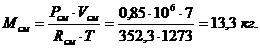
Определение массы компонентов:
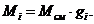
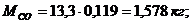
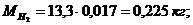
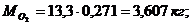
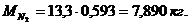
Создадим диаграмму
компонентов смеси (в кг) рис. 2. Она отличается от диаграммы компонентов
смеси (в %) (см. рис.1). Это и понятно. Водород - очень легкий газ и не может
обладать большой массой, сколько бы его не было в составе смеси.
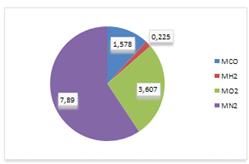
Рисунок 2 - Диаграмма компонентов смеси (в кг)
Проверка:
,578 + 0,225 + 3,607 + 7,890 = 13,3 кг
6. Вычисление парциальных объемов компонентов
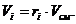
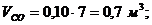
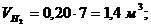
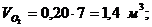
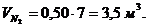
Проверка:
,7 + 1,4 + 1,4 + 3,5
= 7 м3.
7. Вычисление плотности компонентов и смеси при
нормальных физических условиях через объемные и массовые доли
Вычисление плотности компонентов:
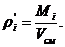
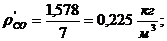
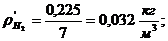
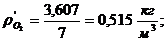
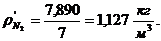
Вычисление плотности смеси при заданных
условиях:
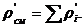
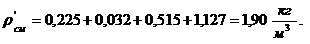
Проверка:
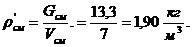
Вывод: вычисления произведены верно.
. Вычисление массовых теплоемкостей
Вычислим массовые теплоемкости с, кДж/(кг К) при
рсм=соnst; Vсм=const; для температуры смеси tсм, = 1000°С.
Для расчетов воспользуемся таблицей (табл. 2, см
[6], стр. 200, стр. 210).
Таблица 2 - Удельная изобарная теплоемкость
элементов cp, Дж/(кг·К)
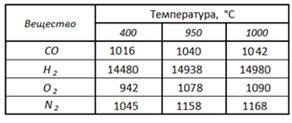
Замечание: В таблице справочника [6] нет
значений для температуры 950°С, поэтому нам пришлось прибегнуть к экстраполяции.
Массовая теплоемкость при постоянном давлении
при tсм,=1000°С:
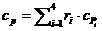
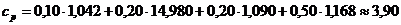 кДж/(кг·К)
кДж/(кг·К)
Массовая теплоемкость при постоянном объеме при
tсм,=1000°С:
Воспользуемся законом Майера:
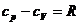
Тогда
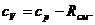
Получаем:
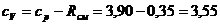 кДж/(кг·К)
кДж/(кг·К)
Ответ: cp = 3,90 кДж/(кг·К);= 3,55 кДж/(кг·К);
. Вычисление количества теплоты
Вычислим затраты тепла на нагревание в процессе
при постоянном давлении (здесь мы взяли ср при 1000°С, поскольку отличия в
удельной теплоемкости при температуре 400°С и 950°С невелики, составляя разницу
только в третьей значащей цифре. Поэтому без особо большой погрешности
определяем):
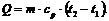
где m = 7 кг;
ср = 3,90 кДж/(кг·К)= 400°C= 950°C
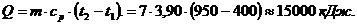
Ответ: 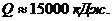
Задача №2
Определить изменение энтропии ΔS
для
m кг азота в изохорном процессе, имеющему температуру t1, если подводится 100
кдДж тепла. Теплоемкость азота считать постоянной. Данные для соответствующего
варианта берутся из табл. 3.
Таблица 3
|
№
варианта
|
М,
кг
|
t1,
°С
|
Q,
Дж
|
|
15
|
3,3
|
128
|
100
|
Дано:= 3,3 кг-
const
cv - const= 128°С;
Т1 = 128+273 = 401 К= 100 кДж = 1·105 Дж
Найти:
ΔS - ?
Решение:
Изменение энтропии в изохорном процессе
соответствует выражению:
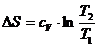 (1)
(1)
По условию Т2 не задана.
Воспользуемся вторым началом термодинамики для
изохорного процесса:
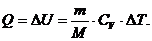 (2)
(2)
Поскольку молекула азота N2 состоит из двух
атомов, то число степеней свободы у нее пять: i = 5.
Молярная теплоемкость:
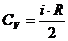 , (3)
, (3)
где R=8,31 Дж/(К·моль) - универсальная газовая
постоянная.
Получили формулу:
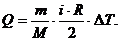 (4)
(4)
Выразим изменение температуры:
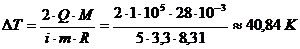
Тогда
Т2 = Т1+ΔТ
= 401+40,84 = 440,84 К ≈ 442 К.
Рассчитаем удельную теплоемкость азота:
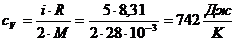
По формуле (1) находим изменение энтропии:
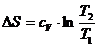 =
=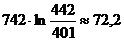 Дж/К
Дж/К
Ответ: ΔS = 72,2
Дж/К.
2. Фазовые равновесия и фазовые переходы.
Термодинамические свойства
.1 Теоретическая часть
Что такое "фаза"? Приведите примеры
фазовых переходов.
Ответ:
Определенной структуре вещества соответствуют
вполне определенные физические свойства. Поэтому с микроскопической точки
зрения под фазой следует понимать упорядоченную структуру с соответствующей ей
совокупностью физических свойств.
Фазой называется совокупность гомогенных
(однородных) частей системы, одинаковых по составу, химическим и физическим
свойствам и отделенных от других частей системы поверхностью.
В узком смысле слова под фазовым превращением
понимают лишь такие изменения структуры, которые не сопровождаются каким-либо
изменением состава, т.е. изменения в простых веществах.
Гораздо более широкое определение фазовых
переходов включает в рассмотрение изменения структуры, сопровождаемые
изменением химического состава. В этом случае до и после фазового превращения в
системе может существовать больше, чем одна фаза.
Понятие фазы можно связать с микроскопической
структурой вещества.
Поверхности раздела фаз образуются некоторым
количеством молекул, расположенных на границе области, заполненной данной
фазой. Молекулы, образующие поверхностный слой, находятся в особых условиях,
вследствие чего поверхностный слой обладает особыми свойствами, не присущими
веществу, находящемуся в глубине фазы. Образования, составленные из небольшого
числа молекул, не могут быть разделены на поверхностный слой и внутреннюю массу
вещества, поэтому к образованиям с очень малым объемом понятие
"фаза", вообще говоря, неприменимо [3].
Примером может служить система
"газ-жидкость", поместив ее в цилиндр под поршнем, зафиксировав
температуру, одинаковые давления всюду и общее число частиц. Условие равновесия
такой системы следует из простейшей вариационной задачи с условием, связывающим
количества вещества в фазах (Каждая из фаз находится при одинаковых температуре
и давлении).
Таким образом, при изменении внешних воздействий
на равновесную гетерогенную систему вещество из одной фазы может переходить в
другую, например из жидкости в пар, из одной кристаллической модификации в
другую, из нормального проводника в сверхпроводник, из ферромагнетика в
парамагнетик и т. д.
Такие превращения вещества из одной фазы в
другую при изменении внешних условий называются фазовыми переходами.
При равновесном переходе вещества из одной фазы
в другую, как и при фазовом равновесии, температура, давление и химический
потенциал вещества в фазах одинаковы. Что же касается других термических и
калорических величин или соответствующих им производных от энергии Гиббса
G(T,p), то они при одних фазовых переходах терпят разрыв, а при других -
непрерывны.
Поэтому различают прерывные и непрерывные
фазовые переходы.
Прерывными называются фазовые превращения, при
которых первые производные от G:  испытывают
скачки, а непрерывными - переходы, при которых первые производные непрерывны, а
терпят разрыв производные второго и более высоких порядков: теплоемкость,
сжимаемость, коэффициент теплового расширения и т. д.
испытывают
скачки, а непрерывными - переходы, при которых первые производные непрерывны, а
терпят разрыв производные второго и более высоких порядков: теплоемкость,
сжимаемость, коэффициент теплового расширения и т. д.
Прерывные превращения называются фазовыми переходами
первого рода. При этих переходах, следовательно, скачком изменяется удельный
объем v или плотность ρ вещества
Непрерывные переходы, при которых вторые
производные от энергии Гиббса (или химического потенциала) испытывают скачки,
называются фазовыми переходами второго рода, когда же эти производные при
переходе обращаются в бесконечность - критическими переходами, а аномальное
поведение свойств веществ в этой области - критическими явлениями.
.2 Практическая часть
. Вычислите свободную энергию F и
термодинамический потенциал Ф для идеального газа, у которого теплоемкость
СV=a+bT
(где a и b некоторые постоянные).
Решение: Функция F называется свободной энергией
Гельмгольца (изохорно-изотермический потенциал):
= U - T·S,
где U - внутренняя энергия идеального газа;-
абсолютная температура газа;- энтропия газа.
Внутренняя энергия определяется по формуле:
= CV·T + U0,
где CV - молярная теплоемкость при постоянном
объеме;- начальное значение внутренней энергии.
Энтропия вычисляется по формуле:
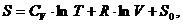
где: V - объем газа;- универсальная газовая
постоянная.
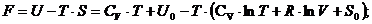
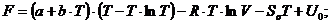
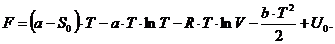
Термодинамический потенциал Ф для идеального
газа находится по формуле
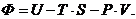
Учтем, что для одного моля идеального газа:

Логарифмируем и находим:
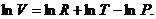
Тогда:
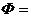
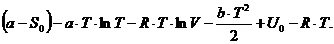
Подставляя в полученное выражение вычисленный
выше lnV и приведя подобные члены получаем:
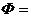
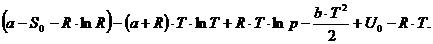
Ответ:
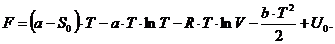
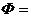
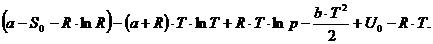
. Найдите уравнение состояние газа, если для
него известна свободная энергия в виде функции характеристических параметров:
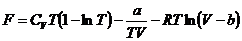
где CV , a, b - постоянные величины. Вычислите
внутреннюю энергию газа.
Решение:
Запишем уравнение Гиббса-Гельмгольца:
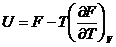 .
.
Из этого уравнения следует:
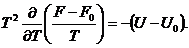
Считая начальные параметры равными нулю,
получаем (см. [1], стр. 108):
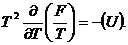
Давление р находится из формулы:
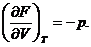
Вычислим давление.
Считая T=const, получаем:
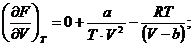
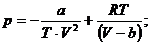
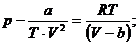
Или окончательно:
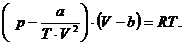
Получена формула, именуемая как уравнение
состояния Бертло.
Далее вычислим внутреннюю энергию газа.
Для этого:
· разделим F на T;
· найдем частную производную от
полученного выражения по Т;
· умножим полученное выражение на
(-Т2).
Таким образом будет вычислена внутренняя
энергия.
Имеем:
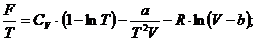
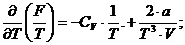
Окончательно:
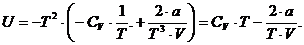
Ответ:
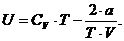
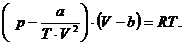
3. Элементы технической термодинамики. Введение
в химическую термодинамику
.1 Теоретическая часть
а) Время релаксации реакции.
Релаксационные методы исследования кинетики
химических реакций основаны на том принципе, что при быстром внешнем
воздействии на систему (изменение температуры, давления, электрического поля)
время, которое нужно системе для достижения нового равновесного (или
стационарного) состояния, зависит от скорости химической реакции (или иногда от
скорости диффузии реагентов).
Переход системы к новым равновесным (или
стационарным) концентрациям реагентов называют химической релаксацией. Если
отклонение от равновесия, вызванное внешним воздействием, невелико, кинетика
релаксации будет весьма простой (ее удается описать с помош,ью линейных
дифференциальных уравнений с постоянными коэффициентами).
Время релаксации скорости реакции определяется
как время, за которое при постоянных концентрациях всех веществ отклонение
скорости реакции от значения, соответствующего стационарному протеканию,
уменьшается в е раз.
Для оценки верх, границы времени релаксации
каталитических реакций в простых случаях может служить время оборота
катализатора.
Так, например, многие химические реакции,
которые обычно протекают только при высоких температурах или только в сильно
кислой или сильно щелочной среде, в присутствии соответствующих ферментов могут
идти быстро и количественно при комнатной температуре и при значениях pH,
близких к нейтральному. Время релаксации химической реакции при равновесных
условиях ее протекания могут быть найдены из условия:
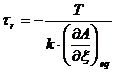
где: А - сродство реакции;
ζ - координаты реакции;
Т - абсолютная температура;- константа скорости
химической реакции;
Так, например, если T-const и V-const, то время
релаксации можно найти по формуле:
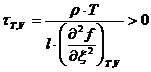 (См. [3], Лекция 10).
(См. [3], Лекция 10).
б) Расчет КПД модельного цикла Ренкина.
Недостаток, присущий паровому циклу Карно,
устраняется, если процесс конденсации отработанного в машине пара довести до
полного его превращения в воду (2-3 на следующих рисунках), а затем насосом
подать ее в парогенератор-котел (процесс 3-4). Впервые такой цикл с полной
конденсацией отработанного пара предложил У.Дж. Ренкин, заменив в схеме паросиловой
установки компрессор 4 на водяной насос.
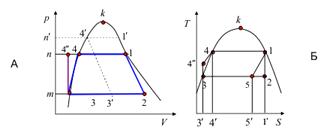
В паровом цикле Ренкина вода (конденсат)
сжимается до давления p1 не по изохоре 3-4, а по адиабате. Поэтому ее удельный
объем несколько уменьшается, а температура возрастает, вследствие чего
происходит термическое расширение воды и адиабатный процесс сжатия практически
сливается с нижней пограничной кривой.
Кроме того, в цикле Ренкина за счет полной
конденсации отработанного пара удается получить более глубокий вакуум, чем в
цикле Карно. Однако термический кпд цикла Ренкина все же остается меньшим кпд
цикла Карно при одинаковых параметрах, что связано с большей затратой теплоты в
цикле Ренкина: в цикле Карно теплота расходуется только на процесс
парообразования; в цикле Ренкина расходуется дополнительное количество теплоты
на подогрев воды в процессе 4'' - 4.
Для расчетов кпд цикла Ренкина целесообразно
использовать sh- диаграмму:
Например, кпд цикла по sh- диаграмме определится
отношением отрезков 12 и 13.
Если учесть, что h3=Tkck, где Tk - температура
конденсата - "питательной воды", а ck =4,1868 кДж/(кг·К) - ее
теплоемкость, то получим:
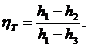
Обычно термический кпд цикла Ренкина равен
30-40%.
(См. [3], Лекция 12)
3.2 Практическая часть
. Рассчитайте изменение энергии Гиббса (ΔG°298)
для процесса Na2O(т) + H2O(ж) → 2NaOH(т) по значениям стандартных энергий
Гиббса образования веществ (табл. 3). Возможно ли самопроизвольное протекание
реакции при стандартных условиях и 298К?
Возможно ли при 95°С самопроизвольное протекание
процесса?
Таблица 3
Стандартные термодинамические характеристики
некоторых веществ
|
Вещество
|
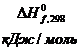
|
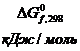
|
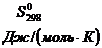
|
|
H2O
(ж)
|
-286
|
-237
|
70
|
|
Na2O
(т)
|
-416
|
-378
|
75,5
|
|
NaOH
(т)
|
-427,8
|
-381,1
|
64,16
|
При стандартных условиях (Р0=101325 Па) и
температуре 298 К можно рассчитать процесс по значениям стандартных энергий
Гиббса образования веществ, используя таблицу 3.
Рассчитывать будем как разность суммарной
энергии Гиббса образования продуктов реакции и суммарной энергии Гиббса
образования исходных веществ.
Нам заданы:
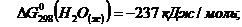
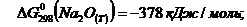
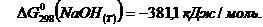
Находим:
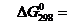
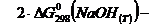
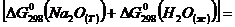
= 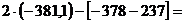 -147,2
кДж
-147,2
кДж
Получили отрицательное значение, значит
самопроизвольное протекание реакции возможно.
Переведем температуру в шкалу Кельвина:
Т = 273 + 95 = 368 К.
Для расчета воспользуемся уравнением:
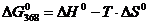
Рассчитаем величины изменения энтальпии и
энтропии:
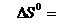
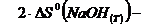
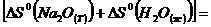
= 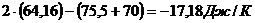
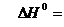
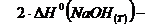
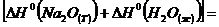
= 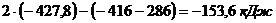
Переведем:
,18 Дж/К = -0,01718 кДж/К.
И тогда:
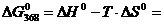
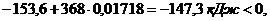
поэтому
самопроизвольное протекание данного процесса при 95°С возможно.
Ответ: -147,3 кДж;
возможно.
2. Идеальный газ совершает цикл Карно.
Температура нагрева равна 470 К, температура холодильника равна 280 К. При
изотермическом расширении газ совершает работу 100 Дж. Определить КПД, а также
количество теплоты, которое газ отдает холодильнику при изотермическом сжатии.
Дано:
Т1 = 470 К
Т2 = 280 К- const (изотермический процесс)
А = 100 Дж
Найти:
η - ?- ?
Решение:
КПД цикла Карно равен:
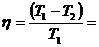

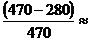 0,404 или 40,4%.
0,404 или 40,4%.
С другой стороны, КПД цикла Карно равен:
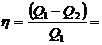
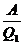 (1)
(1)
Или
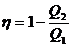 ; (2).
; (2).
При изотермическом процессе изменение внутренней
энергии равно нулю, поэтому всё подводимое тепло идет на совершение работы:
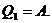
Имеем из формулы (2):
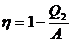 ;
;
отсюда:
Окончательно:
 .
.
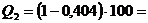 59,6 Дж.
59,6 Дж.
Ответ:  ;
;
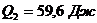 .
.
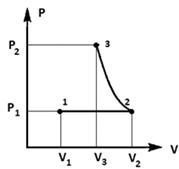
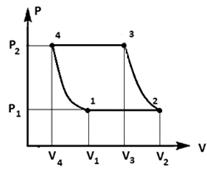
. Идеальный газ совершает цикл, состоящий из
двух адиабат и двух изобар. На каких участках: а) совершенная газом работа
больше (меньше) нуля; б) полученное газом тепло больше (меньше) нуля? Ответ
обосновать.
Решение:
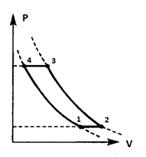
Для примера рассмотрим цикл газотурбинной
установки со сгоранием топлива при р = const (см. [2], стр. 179).
На участке 1-2:
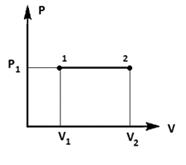
Процесс изобарный (р1 - const).
По закону Гей-Люссака: 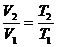 ,
но
,
но 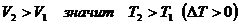 .
.
Работа при изобарном процессе на участке 1-2
больше нуля:
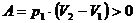 .
.
Количество теплоты при изобарном процессе на
участке 1-2 больше нуля:
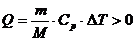 .
.
На участке 2-3:
Процесс адиабатический (Q=0).
При адиабатическом процессе связь между
начальным и конечным состоянием:
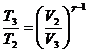 , но
, но 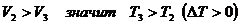 .
.
Работа при адиабатическом процессе на участке
2-3 меньше нуля:
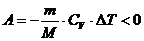
Количество теплоты при адиабатическом процессе
равно нулю: 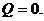
На участке 3-4:

Процесс изобарный (р2 -const).
По закону Гей-Люссак а: 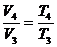 ,
но
,
но 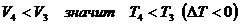 .
.
Работа при изобарном процессе на участке 3-4
меньше нуля:
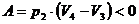
Количество теплоты при изобарном процессе на
участке 3-4 меньше нуля:
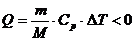
На участке 4-1:
Процесс адиабатический (Q=0).
При адиабатическом процессе связь между
начальным и конечным состоянием:
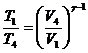 , но
, но 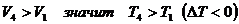 .
.
Работа при адиабатическом процессе на участке
4-1 больше нуля:
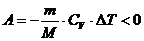
Количество теплоты при адиабатическом процессе
равно нулю: 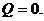
Замечание: Если изменить
направление обхода по циклу на противоположное, то знаки для работы и
количества теплоты тоже сменятся на противоположные.
Список литературы и Интернет-ресурсов,
использованных при выполнении контрольной работы
1.
Базаров И.П. Термодинамика: Учеб. для вузов. - М.: Высш. шк., 1991. - 376с.
.
Квасников И.А. Термодинамика и статистическая физика. Т. 1: Теория равновесных
систем: Термодинамика: Учебное пособие. - М.: Едиториал УРСС, 2002. - 240 с.
.
Термодинамика: конспект лекций (презентаций) / сост. А.Г. Князева. - Томск:
Изд-во ТПУ, 2014.
.
Серова Ф.Г., Янкина А.А. Сборник задач по термодинамике. - М.:
"Просвещение", 1976. - 166 с.
.
Чертов А.Г., Воробьев А.А. Задачник по физике: Учеб. пособие. - М.: Высш.
школа, 1981. - 496 с.
.
Физические величины. Справочник / Под ред И.С. Григорьева, Е.З. Мейлихова. - М:
Энергоатомиздат, 1991. - 1232 с.
.
Энциклопедия https://ru.wikipedia.org.
.
Химический факультет МГУ http://www.chem.msu.su/