Оценка токсичности наночастиц серебра in vitro
Реферат
Курсовая работа 28 страниц, 5 рисунков, 3
таблицы, 20 источников.
ОЦЕНКА ТОКСИЧНОСТИ НАНОЧАСТИЦ СЕРЕБРА IN VITRO
Объектом исследований являются наночастицы
серебра, методы определения токсичности наночастицы серебра in vitro.
Цель исследования: разработать методологические
подходы к определению токсичности наночастицы серебра для гигиенической оценки
их безопасности.
В процессе выполнения решались следующие задачи:
разработать тест-модель для оценки токсичности наноматериалов in vitro;
разработать алгоритм исследований токсичности наноматериалов in vitro;
обосновать критерии оценки токсичности наноматериалов in vitro.
В ходе выполненной курсовой работы был выбран
вид наноматериала (наночастицы серебра) для проведения тестирования in vitro;
определены клеточные линии для изучения цитотоксического действия наночастиц с
учетом возможных органов-мишеней; проведен анализ научной литературы,
касающейся методических аспектов изучения цитотоксического действия
наноматериалов для токсикологической оценки. В экспериментах определены
приемлемые диапазоны концентраций наночастиц для тех или иных методов
исследования.
Список сокращений
АОЗ - антиоксидантная защита
АФК - активные формы кислорода
АТФ - аденозинтрифосфат
ДНК - дезоксирибонуклеиновая кислота
ЖКТ - желудочно-кишечный тракт
ЛДГ - лактатдегидрогеназа
НМ - наноматериалы
НЧ - наночастицы
ЦНС - центральная нервная система
ЭФК - эмбриональные фибробласты крысы-
эмбриональные фибробласты мыши- (4, 5-диметил-2-тиазолил)-2,
5-дифенил-2H-тетразолия бромид, редокс-краситель
UFPs -
ультратонкие частицы
Оглавление
Введение
1. Наночастицы
1.1 Состояние проблемы
.2 Определение наночастиц
.3 Классификация наночастиц
.4 Свойства наночастиц
.5 Пути поступления и биокинетика
наночастиц
.6 Системные эффекты наночастиц
.7 Иисследование цитотоксичности
наночастиц
2. Обьекты, методы исследований,
приборы, оборудование
2.1 Наночастицы, используемые в
экспериментах in vitro
2.1.1 Характеристика наночастиц
серебра
2.2 Культуры клеток, используемые
для изучения токсичности in vitro
2.2.1 Культура клеток карциномы
легкого человека (А549)
.2.2 Культура клеток амниона
человека, сублиния FL
.2.3 Культура лимфоцитов человека
.2.4 Культура кардиомиоцитов крыс
линии SHR
2.3 Методы изучения цитотоксичности
наноматериалов в культурах клеток млекопитающих
2.3.1 Метилтетразолиевый тест
.3.2 Метод оценки жизнеспособности
клеток в культуре с помощью окраски трипановым синим (метиленовым синим)
.3.3 Метод оценки жизнеспособности
клеток в культуре с помощью определения активности ЛДГ
2.4 Перечень испытательного
оборудования
3. Результаты исследований
3.1 Влияние наночастиц серебра на
жизнеспособность клеток линий А549, SHR и сублинии FL по результатам МТТ-теста
.2 Влияние наночастиц на
жизнеспособность лимфоцитов человека по результатам МТТ-теста
.3 Изучение цитотоксичности
наноматериалов для клеток линии А549 с помощью окраски метиленовым синим
.4 Изучение жизнеспособности клеток
в культуре по активности лактатдегидрогеназы в среде культивирования
Заключение
Список литературы
наночастица клетка
токсичность vitro
Введение
В последние два десятилетия в научную лексику
стремительно "ворвались" ряд новых слов с префиксом "нано":
наноструктура, нанотехнология, наноматериал, нанокластер, нанохимия,
наноразмерный материал, наноколлоиды, нанореактор и т.п. Издается ряд новых
журналов, посвященных исключительно этой тематике, появились монографии, в
названии которых присутствует префикс "нано", а также
"нано"-профилированные институты, кафедры и отдельные лаборатории,
проводятся многочисленные конференции. В
настоящее время в Республике Беларусь выполняется Государственная комплексная
программа "Нанотехнологии и наноматериалы", которая предполагает
разработку сверхтвердых, тугоплавких, магнитных и композиционных
наноматериалов, наноэлектроники, а также изучение физико-химических
особенностей наноразмерных величин. Детально изучается влияние нанодобавок на
свойства металлов, сплавов, пластмасс, резины, керамики. Преимущество
модифицированных материалов - в их высокой прочности и износостойкости, а также
хорошем коэффициенте трения.
Разработка новых наноматериалов, рост
производства и расширение возможностей их применения неминуемо приведет к
увеличению их воздействия на население и окружающую среду. Становится
очевидным, что для обеспечения безопасного обращения наноматериалов необходимо
понимание возможных эффектов производимых и используемых в различных товарах
наноматериалов на различных уровнях организации живых систем, характеристика
воздействия и оценка риска на каждом этапе жизненного цикла товара или
материала. Важная составляющая таких знаний - результаты токсикологической
оценки наночастиц, а именно выявление зависимостей доза-эффект,
доза-время-эффект с учетом природы и размера наночастиц, что является предметом
изучения нанотоксикологии.
1. Наночастицы
.1 Состояние проблемы
Число наименований наноматериалов и объемы их
применения в различных областях науки, медицины, энергетики, промышленности
стремительно растут. Скорость развития нанотехнологий опережает разработку
методов оценки их безопасности и регламентирующих документов [1]. В настоящее
время практически не проводятся исследования потенциальных токсических свойств
наноматериалов.
Негативные эффекты наночастиц зависят от пути
воздействия и включают цитотоксичность, развитие неспецифических воспалительных
реакций и окислительного стресса, онкогенность.
Оценка токсического действия наночастиц
различного химического состава и структуры является актуальной и своевременной.
Установление принципов и процедур тестирования с целью обеспечить безопасное
производство и применение наноматериалов на рынке необходимо и достижимо [2].
Исследования с целью разработки адекватных подходов к прогнозу риска влияния
наночастиц на здоровье человека с учетом химической структуры, размеров, формы,
физико-химических свойств, технологии производства и сферы применения на
начальном этапе целесообразно проводить in vitro.
Проблема токсического действия наночастиц на
живые системы не является абсолютно новой. По определению наночастицы -
объекты, один из размеров которых составляет < 100 нм, поэтому к ним можно
отнести не только наночастицы, полученные с целью придания заданных свойств, но
и ультратонкие частицы природного происхождения (UFP), например, асбестовые
волокна, частицы, возникшие в результате вулканической деятельности, горения
лесов, а также антропогенной деятельности - в результате сгорания топлива,
курения. Эффекты, вызываемые наночастицами, независимо от их происхождения,
схожи.
.2 Определение наночастиц
Термин ≪наночастица≫
или ≪наноразмерная
частица≫
прочно вошел в научный лексикон около 20 лет назад, однако критерий
наноразмерности до сих пор является предметом многих научных дискуссий.
Нано-объект - это физический объект исследований
(и разработок), размеры которого принято измерять в нанометрах.
Нанотехнология имеет дело как с отдельными
нано-объектами, так и с материалами на их основе, а также процессами на
нано-уровне. К наноматериалам относятся такие материалы, основные физические
характеристики которых определяются содержащимися в них нанообъектами.
Наноматериалы делятся на компактные материалы и
нанодисперсии; к первым относятся так называемые
"наноструктурированные" материалы [3], т.е. изотропные по
макросоставу материалы, повторяющимися элементами, структуры которых являются
группировки (области), имеющие размеры нескольких нанометров, иногда десятки
нанометров и более [4]; иными словами, наноструктурированные материалы состоят
из непосредственно контактирующих между собой нанообъектов. В отличие от этого,
нанодисперсии состоят из среды диспергирования (вакуум, газ, жидкость или
твёрдое тело), в которой распределены изолированные друг от друга нано-объекты.
Расстояние между нано-объектами в нанодисперсиях может меняться в достаточно
широких пределах от десятков нанометров до долей нанометра; в последнем случае
мы имеем дело с нанопорошками, где нано-объекты разделены тонкими (часто -
моноатомными) слоями из лёгких атомов, препятствущих их агломерации.
Наночастица - это квази-нульмерный нанообъект, у
которого все характерные линейные размеры имеют один порядок величины; как
правило, наночастицы имеют сфероидальную форму; если в наночастице наблюдается
ярко выраженное упорядоченное расположение атомов (или ионов), то такие
наночастицы называют нанокристаллитами. Наночастицы с выраженной дискретностью системы
уровней энергии часто называют "квантовыми точками" или
"искусственными атомами"; чаще всего они имеют состав типичных
полупроводниковых материалов[5].
.3 Классификация наночастиц
Согласно международной конвенции IUPAC,
предельный (максимальный) размер наночастиц соответствует 100 нм, хотя эта
величина является чисто условной и необходима только для формальной
классификации. Различают два типа наночастиц: нанокластеры, или нанокристаллы,
и собственно наночастицы. К первому типу относят частицы упорядоченного
строения (часто центросимметричные) размером 1−5 нм, содержащие до 1000
атомов, ко второму- собственно наночастицы размером 5−100 нм, состоящие
из 103−108 атомов. Нитевидные и пластинчатые частицы могут содержать
гораздо большее количество атомов и иметь один или даже два линейных размера,
пре-вышающих пороговое значение, но их свойства в определенном направлении
остаются характерными для вещества в нанокристаллическом состоянии. Если
наночастица имеет сложную форму и строение, то в качестве характеристического
рассматривают не линейный размер частицы в целом, а размер ее структурного
элемента. Такие частицы, как правило, называют наноструктурами, причем их
линейные размеры могут значительно превышать 100 нм.
Различия в линейных размерах наночастиц делают
целесообразным подразделять их на нуль-,одно-, двух- и трехмерные
(соответственно, 0D-, 1D-, 2D- и
3D-наночастицы). К нульмерным наноструктурам относят свободные и
стабилизированные кластеры, фуллерены и эндофуллерены и квантовые точки. Класс
одномерных наноструктур представлен гораздо бoльшим разнообразием нанообъектов:
это наностержни, нанонити (вискеры), нанотрубки и наноленты. Среди двумерных
наноструктур выделяют тонкие пленки толщиной до сотен нанометров,
гетероструктуры, пленки Лэнгмюра−Блоджетт, нанопластины, адсорбционные и
самособирающиеся монослои, а также
двумерные массивы объектов, размеры которых лежат в нанометровом диапазоне. К
классу трехмерных наноструктур следует относить как сами наночастицы и
наночастицы в оболочке, так и нанокомпозиты и трехмерные самоорганизованные
массивы нанообъектов. При этом сами композиты могут включать нуль-, одно- и
двумерные объекты, то есть представлять собой массивы квантовых точек, нитей,
многослойные пленки или слоистые соединения, а также различные комбинации этих
типов наноструктур. На наноуровне оказалось возможным и существование структур
промежуточной размерности, т.н. фракталов и дендримеров, обладающих
самоподобием и рассматривавшихся ранее лишь в качестве математических моделей.
В последние годы большие усилия исследователей
направлены на получение наночастиц заранее заданных формы и размера, а
следовательно, обладающих определенными физико-химическими свойствами - описано
множество различных синтетических подходов, каждый из которых обладает своими
преимуществами, но и не лишен определенных недостатков. Сегодня все
методы
получения наноматериалов разделяют на две большие группы по типу формирования
наноструктур: методы снизу-вверх (Bottomup) характеризуются ростом наночастиц
или сборкой наночастиц из отдельных атомов; а методы сверху-вниз (Top-down)
основаны на дроблении частиц до наноразмеров.[6]
.4
Свойства наночастиц
Малые размеры наночастиц приводят к
многократному увеличению удельной поверхность материалов, что способствует
транзиту самых различных веществ за счет увеличения адсорбционной емкости.
Возрастает химическая реакционная способность и каталитические свойства
вещества. На эти параметры прямо влияют также физико-химические свойства,
включая форму, поверхностную структуру, полярность. Поэтому увеличивается
вероятность развития различных процессов внутри отдельных клеточных структур:
органелл, биологических мембран, проникновение и контакт с клеточным ядром и
ДНК. Во многом цитотоксические свойства наночастиц объясняются их способностью
к агрегации внутри клеток[7].
По информации, имеющейся в международной базе
данных, количество зарегистрированных наименований наноматериалов в настоящее
время превысило 2900, среди них 714 - углеродные нанотрубки и 85 - наночастицы
серебра. Международные организации и правительства развитых стран проявляют
огромный интерес к проблеме развития нанотехнологий.
.5 Пути поступления и биокинетика
наночастиц
Большинство исследований по оценке
биологического действия наночастиц проводились на млекопитающих и были
направлены на изучение эффектов со стороны дыхательной системы. Однако имеются
и другие пути воздействия, такие как кожа, желудочно-кишечный тракт (рисунок
1).
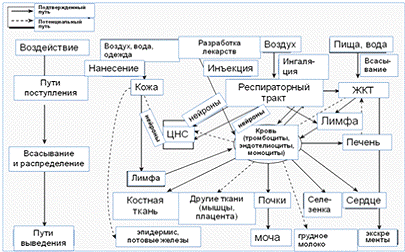
Рисунок 1 - Биокинетика наночастиц в организме
Следует принимать во внимание тот факт, что
механизмы защиты, специфичные для того или иного пути поступления, способные
оградить организм от вредных химических веществ, не всегда состоятельны в
отношении наночастиц [8]. Необходимо учитывать также, что наночастицы могут
попадать в кровеносную систему как из окружающей среды, так и при
терапевтических вмешательствах, а также в результате поступления в организм
любыми другими путями.
Абсорбция и распределение в органах дыхания. В
ходе распределения и удаления в дыхательной системе наночастицы и частицы
большего размера ведут себя не одинаково. Основной механизм распределения
наночастиц - диффузия при столкновении с молекулами воздуха. Электростатическое
осаждение имеет место только в том случае, если наночастицы несут существенный
электрический заряд. Наночастицы могут оседать в носоглотке, трахеобронхиальной
области и в альвеолах. Имеются защитные механизмы, которые на всем протяжении
дыхательных путей обеспечивают освобождение слизистых оболочек от частиц,
попадающих при вдыхании. После оседания в дыхательных путях наночастицы легко
перемещаются, покидают легкие и достигают других органов-мишеней различными
путями и механизмами.
Наиболее важный механизм удаления твердых частиц
обеспечивается альвеолярными макрофагами путем фагоцитоза[9]. Однако в
экспериментах на крысах было показано, что лишь 20% полистирольных наночастиц
было обнаружено в макрофагах, тогда как для частиц диаметром 0,5, 3 и 10 мкм
этот показатель составил 80 %. Таким образом, большая часть наночастиц
поступает в эпителий и интерстиций.
Результаты исследований ультратонких частиц дыма
и наночастиц диоксида титана (TiO2) показали, что наночастицы после оседания в
легких путем трансцитоза через эпителий дыхательных путей попадают в
интерстиций. Так как проникновение наночастиц через альвеолярный эпителий в
большей мере характерно для крупных млекопитающих (собаки, приматы), чем для
грызунов, такой путь имеет место в организме человека. Достигнув межклеточного
пространства в легких, наночастицы попадают в кровеносную и лимфатическую
систему. При интратрахеальном введении крысам наночастиц золота обнаружено, что
через 30 минут после воздействия большая часть наночастиц аккумулировалась в
тромбоцитах легочных капилляров. Транслокация через эпителиальные и
эндотелиальные мембраны определяется размером частиц, физико-химическими
свойствами поверхности и, возможно, зарядом[10].
Альбумин, наиболее распространенный белок в
плазме и интерстиции, способствует эндоцитозу наночастиц подобно лецитину и
фосфолипидам. Так, например, частицы полистирола размером 240 нм проникали
через альвеолярно-капиллярный барьер в том случае, если были покрыты лецитином.
Поэтому одновременное присутствие альбумина и фосфолипидов на поверхности
альвеолярного эпителия может быть важным фактором, облегчающим поглощение
наночастиц эпителиальными клетками после распределения в альвеолярном
пространстве.
Абсорбция и распределение в нервной системе.
Транслокация твердых частиц в дыхательных путях может происходить посредством
аксонов нейронов. В назальной и трахеобронхиальной части дыхательных путей
находятся чувствительные окончания обонятельного и тройничного нервов.
Обонятельный нерв может являться путем поступления наночастиц в ЦНС человека.
Имеются также дополнительные пути - через тройничный нерв, окончания
чувствительных нервов, находящиеся в трахее и бронхах, как показано в
экспериментах при интраназальной инстилляции наночастиц.
Воздействие через желудочно-кишечный тракт и
кожу. Наночастицы, которые удаляются из дыхательной системы мукоцилиарным
эпителием, могут попадать в ЖКТ. Наночастицы могут также поступать в ЖКТ с
системами доставки лекарств. Многочисленные исследования показали, что наночастицы
при попадании в ЖКТ быстро выводятся из организма. Другой потенциально важный
путь поступления - через кожу. Установлено, что наночастицы, поступившие в
дерму, локализуются впоследствии с помощью макрофагов кожи и дендритических
клеток в регионарных лимфоузлах. Это поднимает вопрос о потенциальном изменении
иммунного ответа на наночастицы после взаимодействия макрофагов и
дендритических клеток, содержащих наночастицы, с Т-лимфоцитами.
Легочная канцерогенность. Малотоксичные, плохо
растворимые частицы, такие как углерод, диоксид титана индуцируют хроническое
воспаление, фиброз, неопластические изменения и рак легких у крыс. Опухоли
легких, связанные с воздействием таких частиц, происходят из альвеоцитов 2-го
типа (бронхоальвеолярные опухоли), либо из участков сквамозной метаплазии
(эпидермоидные опухоли). Продолжительное присутствие высоких уровней
нетоксичных частиц приводит к ухудшению их выведения альвеолярными макрофагами,
затем вызывает их быстрое накопление, хроническое воспаление, фиброз, опухолеобразование.
Воспалительный процесс является основной причиной возникновения опухолей
легких, так как наночастицы реализуют мутагенный потенциал и действуют на
пролиферативную активность[11].
.6 Системные эффекты наночастиц
Независимо от пути поступления после попадания в
кровеносную систему наночастицы с кровью разносятся по всему организму и могут
вмешиваться в процессы передачи сигналов. Наночастицы диаметром > 40 нм по
размеру сопоставимы с большими протеинами, могут формировать с ними различные
комплексы в зависимости от свойств поверхности. Комплексы могут иметь другую
биокинетику, активность и даже функцию. Если частица не распадается и ее размер
свыше 5 нм, наночастица не может быть выведена через почки и, таким образом,
может вызвать более выраженные повреждающие эффекты в организме. Высвобождение
медиаторов воспаления вследствие накопления наночастиц в легких может стать
причиной гиперкоагуляции крови и увеличить кардиоваскулярный риск. Развитие
атеросклероза также связывают с воздействием наночастиц. Наночастицы способны
преодолевать гематоэнцефалический барьер и проникать в ЦНС.
Основной путь воздействия UFPs ингаляционный.
Считается, что размер UFPs позволяет им долгое время оставаться в воздухе,
попадать в нижние отделы дыхательных путей, проникать в межклеточное
пространство, что препятствует выведению из организма. UFPs, даже если по
химическому составу не являются токсичными, могут вызвать окислительный стресс
[12], высвобождение медиаторов воспаления и способствовать возникновению заболеваний
легких и других системных эффектов [13, 14].
Воздействие на человека может быть
профессиональным, непосредственно в процессе производства, либо опосредованно
через контаминацию воздуха рабочей зоны или офисного помещения [15], а также
случайным, в результате загрязнения атмосферного воздуха, эмиссии побочных
продуктов [16]
.7 Иисследование цитотоксичности наночастиц
Реализация токсичности наноматериалов
обеспечивается следующими свойствами: физическое сродство к биологическим
структурам, например посредством электростатического или гидрофобного
взаимодействия; каталитическиие свойства, с активацией
окислительно-восстановительных реакций, например индукция молекул кислорода и
воды с образованием АФК; распад наночастиц с образованием токсичных соединений
К основным проблемам токсичности наноматериалов
можно отнести следующие. Во-первых токсичность наночастиц не может быть
производной токсичности аналогов в макродисперсной фазе или в форме сплошной
фазы, а во-вторых, имеющиеся токсикологические методологии основаны на
определении токсичности вещества относительно массовой концентрации, что не
приемлемо для наноматериалов, для которых определяющим свойством может быть
площадь поверхности или число наночастиц.
Недавние инновации в науке и технике позволили
разработать ряд тестов in
vitro, позволяющих
прогнозировать токсичность для животных. Поскольку требования для тестирования
нанматериалов еще законодательно не установлены, ученые имеют возможность
осуществлять поиск методов, основанных на новейших достижениях науки и
применять их на практике.
Многие модели in vitro превосходят методы
изучения токсичности, основанные на использовании животных, которые традиционно
применялись в области токсикологии. Модели с использованием животных не только
негуманны, но и часто недостаточно надежны с точки зрения прогнозирования
эффектов у человека. Область нанотоксикологии обязана включить доступную
технологию. Далее представлены наиболее многообещающие методы in vitro,
доступные в настоящее время для проведения оценки безопасности наноматериалов.
Для изучения действия наноматериалов на типы
клеток, соответствующие "входным воротам", применяется ряд методов,
позволяющих определить цитотоксичность, способность наноматериалов вызывать
воспаление, окислительный стресс, а также генотоксичность.
Токсические эффекты НЧ связывают, в первую
очередь, с формированием окислительного стресса и накоплением
свободнорадикальных продуктов [17].
Методы in vitro на культурах клеток позволяют
изучить: окислительный стресс и АОЗ, воспаление, жизнеспособность клеток,
пролиферацию, апоптоз, некроз, нарушение функции митохондрий, влияние на
мембраны, клеточную локализацию наночастиц.
Тесты на цитотоксичность традиционно используют
в фармацевтической промышленности для скрининга биологически активных соединений.
В настоящее время их широко применяют для оценки наноматериалов. Существует
множество способов оценки цитотоксического действия. Один из них - определение
числа живых и погибших клеток.
Оценка целостности клеточной мембраны является
одним из наиболее распространенных способов измерить жизнеспособность клетки и
цитотоксические эффекты. Соединения, обладающие цитотоксичностью, часто
вызывают нарушение целостности клеточной мембраны, что можно установить с
помощью витального окрашивания трипановым синим или йодидом пропидия, которые
свободно проникают через поврежденную мембрану и окрашивают внутриклеточные
компоненты, но в здоровых клетках отсутствуют [18]. Целостность мембран может
быть оценена другим способом - путем определения лактатдегидрогеназы, имеющей в
норме внутриклеточную локализацию, во внешней среде [19]. Цитотоксичность может
также быть определена с использованием MTT теста, основанного на способности
митохондриальных дегидрогеназ конвертировать водорастворимый
3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид (МТТ) в формазан.
Подобный тест, основанный на окислительно-восстановительном потенциале, был
разработан с применением флуоресцентного красителя - диазорезорцина. В
дополнение разработан тест in
vitro с АТФ в качестве маркера
жизнеспособности [20].
Доказана неодинаковая чувствительность к
наночастицам различных линий клеток, что обязательно следует учитывать при
оценке цитотоксичности наночастиц.
Таким образом, иисследование цитотоксичности
может включать:
.Определение повреждения мембран;
подсчет с помощью световой микроскопии
поврежденных и погибших клеток, окрашенных красителем (например, трипановым
синим), пассивно поступающим внутрь;
спектрофотометрическое определение живых клеток,
активно захватывающих краситель (например, нейтральный красный);
лизис клеток с высвобождением внутриклеточных
ферментов (например, ЛДГ) в культуральную среду, спектрофотометрическое
определение (доступны диагностические наборы).
.Изучение внутриклеточных метаболических
изменений;
определение активности ферментов I и II фазы
биотрансформации с помощью спектрометрии, масс-спектрометрии, газовой
хроматографии, высокоэффективной жидкостной хроматографии и др.;
определение в МТТ-тесте нарушения функции
митохондрий;
определение содержания АТФ в клетках.
. Изучение процессов апоптоза, вызывающего ряд
биохимических и морфологических изменений, определяемых количественно;
каспазной активности (в частности, каспазы-3);
экспрессии Apaf-1, Bcl-2 протеинов Bax и Bid,
p53.
Изучение воспалительных эффектов наноматериалов
на различных культурах клеток человека in vitro необходимо для оценки
потенциальной токсичности наночастиц. Цитокины, хемокины наряду с другими
маркерами воспаления часто позволяют получить представление о механизме
действия и токсичности наноматериалов. Использование соответствующих типов
клеток человека имеет критическое значение.
Показано, что наночастицы способны проникать в
клетки, минуя любые барьеры. Они способны к трансцитозу через эпителиальные и
эндотелиальные клетки, распространяются по ходу дендритов и аксонов нервов,
циркулируют в кровеносных и лимфатических сосудах, имеют тропность к
определенным тканям. Опасение по поводу поступления наноччастиц в клетки,
связанное с влиянием на здоровье человека и окружающую среду, побудило исследовтелей
оценивать способность наноматериалов проникать через клеточные мембраны во
внутриклеточные компартменты и ядро. Чтобы оценить риск, важно определить
способ воздействия и решить, способны ли данные наночастицы проникать через
мембраны клеток. Перемещение можно регистрировать с помощью конфокальной
флюоресцентной микроскопии, трансмиссионной электронной микроскопии.
Из-за уникальных свойств и активности,
наноматериалы могут пересекать клеточные мембраны, встраиваться в ДНК,
повреждать белки. Как только "входные ворота" для наноматериалов
определены, культуры клеток соответствующих тканей можно изучать в отношении
повреждения протеинов и ДНК. Следует отдавать предпочтение культурам клеток
человека.
Среди методов in vitro, применимых для изучения
генотоксичности/мутагенности наноматериалов: тест Эймса, тест на хромосомные
аберрации, тест на внеплановый синтез ДНК, тест на сестринский хроматидный
обмен.
Каждый из тестов может быть частичной или полной
заменой для методов in vivo. Отрицательные результаты теста не требуют
проведения дополнительных исследований in vivo. Кроме того, генотоксичность
можно оценивать, используя другие доступные, надежные методы, например, Cоmet
тест.
Таким образом, достижения в области высоких
технологий, аналитических методов позволяют проводить адекватное тестирование
токсичности без использования животных. Электронная микроскопия и клеточные
культуры, диагностические наборы предоставляют исследователям возможность
оценивать клетки/органеллы/ДНК в ходе токсикологических исследований и
регистрировать химические изменения в этих структурах, вызванные
наноматериалами.
С точки зрения безопасности для здоровья
человека и окружающей среды необходимо, чтобы нанотоксикология строилась на
фундаменте надежных, адекватных тестов in vitro, позволяющих прогнозировать
эффект наноматериалов.
2. Обьекты,
методы исследований, приборы, оборудование
2.1 Наночастицы,
используемые в экспериментах in vitro
.1.1 Характеристика наночастиц серебра
Для проведения исследований использованы
наночастицы серебра производства фирмы Aldrich, содержание наночастиц серебра
99,5% (следовые количества металлов), размер частиц <100 нм. Частицы имеют
органическое покрытие для дисперсии в полярном растворителе.
2.2 Культуры
клеток, используемые для изучения токсичности in vitro
2.2.1 Культура
клеток карциномы легкого человека (А549)
Клетки культивируют в среде ДМЕМ с добавлением
10%-ой инактивированной телячьей эмбриональной сыворотки (FBS), 45 ЕД/мл
пенициллина и 45 мг/мл стрептомицина в 5%-ой CO2
среде
при 37 °C в CO2-инкубаторе
(рисунок 2).
Рисунок 4 - Культура клеток А549
2.2.2 Культура
клеток амниона человека, сублиния FL
Морфология: эпителиоподобная. Способ
культивирования: монослойный. Условия культивирования: среда - 199 или ЕМЕМ,
сыворотка - КРС 10% (199); эмбриональная бычья10% (ЕМЕМ). Процедура пересева -
cнятие клеток, используя версен 0,02% c химопсином 0,1 мг/мл, кратность рассева
1:4 - 1:10, оптимальная плотность 0,5-1,0х105 клеток/мл. Кариология: 2n=46,
пределы изменчивости по числу хромосом 47-66, модальное число хромосом 60,
количество маркеров 9, из которых 3 - специфичны для клеток НеLa (N 1,2,3, G
диски). Изоэнзимы Г6ФДГ, А.16. Чувствительность к интерферону человека. Область
применения: вирусология, канцерогенез, клеточная биология.
.2.3 Культура
лимфоцитов человека
Культура лимфоцитов человека является одной из
обязательных тест-систем при оценке влияния мутагенных факторов окружающей
среды. Одним из достоинств этой тест-системы является то, что по наблюдаемым
типам аберраций можно достаточно определенно идентифицировать тип мутагенного
воздействия.
Культивирование лимфоцитов. Кровь отбирают из
локтевой вены, помещают в стерильную пробирку, содержащую раствор гепарина (200
ЕД/мл крови). В стерильных условиях образцы крови переливают по 0,8 мл в
приготовленные для культивирования флаконы Карреля с культуральной средой.
Состав культуральной среды: 6,16 мл среды МЕМ; 1,6 мл инактивированной телячьей
сыворотки; 0,08 мл L-глютамина; 0,08 мл р-ра антибиотика; 0,15 мл
фитогемагглютинина. Флаконы помещают в термостат при 37°С для инкубации клеток
в течение 48 ч. Для блокирования митоза на стадии метафазы за 2 ч до окончания
инкубации во флаконы добавляют раствор демеколцина в концентрации 0,2 мкг/мл
среды.
Гипотонизация клеток. После окончания культивирования
культуру клеток переливают в центрифужные пробирки и центрифугируют при 10007
об./мин в течение 15 мин для осаждения клеток. Надосадочную жидкость удаляют с
помощью водоструйного насоса, добавляют предварительно подогретый до 37°С
гипотонический раствор (0,75 М KCl) и ресуспендируют в нем осадок. Далее
пробирки с культурой клеток выдерживают на водяной бане (37°С) 10-12 мин. По
окончании гипотонизации вновь центрифугируют при тех же условиях с последующим
удалением надосадочной жидкости.
Фиксация клеток. Для фиксации клеток осадок
ресуспендируют в 1-1,5 мл свежеприготовленного фиксатора (смесь метилового
спирта и ледяной уксусной кислоты в пропорции 3:1) на шейкере и доводят его
объем до 10 мл. Смену фиксатора с последующим центрифугированием производят
трижды.
.2.4 Культура
кардиомиоцитов крыс линии SHR
Исходный материал для первичной культуры
кардиомиоцитов крыс получают путем дезагрегации 0,25%-ным раствором трипсина
при 37ºС
в течение 30 мин сердечной ткани 12-14-суточных эмбрионов крысы. После удаления
трипсина осадок суспендируют в ростовой среде (90% среды Игла, 10%
эмбриональной сыворотки телят с добавлением антибиотиков). Суспензию пропускают
через капроновый фильтр (ячейка 0,3 х 0,3 мм). После подсчета в камере Горяева
клетки высевают в 96-луночные планшеты и культивируют в ростовой среде DMEM.
.3 Методы
изучения цитотоксичности наноматериалов в культурах клеток млекопитающих
2.3.1 Метилтетразолиевый
тест
МТТ-тест предназначен для выявления
метаболических нарушений, а именно нарушений функции митохондрий, отражающих
влияние на жизнеспособность клеток. Клетки выращивали в СО2-инкубаторе (Herra
Cell) при 37°С, 5% СО2, относительной влажности воздуха 80 % на 96-луночных
планшетах (посевная концентрация - 50-70 тыс. кл./мл). В лунки с прикрепившимися
клетками (вторые сутки культивирования) вносили исследуемые концентрации
наносеребра, растворенного в сыворотке (Fetal Bovine Serum, Sigma, USA). После
24-часовой экспозиции исследуемых образцов фотометрически измерялась суммарная
активность митохондриальных дегидрогеназ клеток в каждой лунке в
метилтетразолиевом тесте (МТТ). Этот тест основан на способности живых
метаболически активных клеток переводить соль тетразолина (MTS) в формазан,
растворимый в среде культивирования. Таким образом, поглощение формазана прямо
пропорционально количеству жизнеспособных клеток в культуре.
Для проведения
МТТ
использовали
набор
CellTiter 96® AQueous One Solution Cell Proliferation Assay (MTS), Promega. Для
измерения поглощения формазана клетки инкубировали с МТS в течение 20 минут в
термостате, измерение поглощения формазана при λ = 492 нм
проводили на приборе для иммуноферментного анализа фирмы Awareness, Microplate
Rider Stat Fax 3200.
.3.2 Метод оценки
жизнеспособности клеток в культуре с помощью окраски трипановым синим
(метиленовым синим)
Оценка целостности клеточной мембраны является
одним из наиболее распространенных способов измерить жизнеспособность клетки и
цитотоксические эффекты. Соединения, обладающие цитотоксичностью, часто
вызывают нарушение целостности клеточной мембраны, что можно установить с
помощью витального окрашивания трипановым синим (метиленовым синим), который
свободно проникает через поврежденную мембрану и окрашивает внутриклеточные
компоненты, но в здоровых клетках отсутствует.
Для оценки жизнеспособности более надежным
способом является окрашивание клеточных суспензий, поскольку при окрашивании
прикрепленных клеток они могут открепляться от субстрата и теряться. Главным
недостатком этого метода является невозможность выявления клеток с нарушенной
способностью к размножению [14].
Для проведения эксперимента с различными
концентрациями НЧ серебра (100, 300 мкг/мл) клетки линии А549 рассевали в
24-луночные планшеты. После окончания экспозиции (8 и 24 ч) клетки отмывали от
наночастиц физиологическим раствором, окрашивали 0,4% раствором красителя.
Количество мертвых окрашенных клеток подсчитывали в пяти произвольных полях
зрения.
.3.3 Метод оценки
жизнеспособности клеток в культуре с помощью определения активности ЛДГ
Измерение активности лактатдегидрогеназы
используется как один из основных тестов на цитотоксичность. Метод базируется
на увеличении активности присутствующего в цитоплазме живых клеток фермента в
среде культивирования, куда он выделяется через поврежденные мембраны мертвых
или умирающих клеток. Небольшие количества культуральной среды берутся через
определенные промежутки времени после воздействия на клетки для измерения
высвобожденной лактатдегидрогеназы и определения зависимости токсического
эффекта от временного фактора. В данном тесте можно оценить общую цитотоксичность
в режиме реального времени.
Лактатдегидрогеназа - оксидоредуктаза, которая
катализирует превращение пирувата и лактата. Клетки выделяют ЛДГ в кровяное
русло после повреждения или гемолиза эритроцитов. Поскольку ЛДГ является
стабильным ферментом, его широко используют для оценки наличия повреждения или
токсичности для тканей и клеток. ЛДГ также повышается при определенных
патологических условиях, таких как рак. В используемом наборе ЛДГ
восстанавливает НАД+ в НАДН+, который специфически детектируется
колориметрическим методом (450 нм).
Исходные растворы наночастиц готовили путем
диспергирования в дистиллированной воде с добавлением альбумина при помощи
четырехкратной ультразвуковой обработки общей продолжительностью 1 ч.
Концентрация наносеребра - 100, 300, 600, 800, 1000 мкг/мл.
Для
проведения теста использовали набор MAK066 Lactate Dehydrogenase Activity Assay
Kit, Promega. Содержание ЛДГ определяли в бесклеточной среде путем добавления
субстрата (НАД+, соль тетразолина, натрия лактат и др.). В ходе определения
происходят следующие реакции: первая реакция - ЛДГ восстанавливает НАД+ в НАДН
путем окисления лактата до пирувата). Во второй реакции катализатор (диафораза)
передает H/H+ от НАДН к соли тетразолина, образуя формазан.
Для
анализа использовали пробы сыворотки. Добавляли 2-50 мкл пробы в лунки
96-луночного планшета в двух повторностях. Пробы доводили до окончательного
объема 50 мкл буфером для анализа ЛДГ. В
каждую лунку вносили по 50 мкл основной реакционной смеси. Хорошо перемешивали
пипетированием. Через 2-3 минуты определяли Tисходное. Измеряли оптическую
плотность (A450) при длине волны λ=450 нм
в начальный момент времени. Планшеты инкубировали при 37 °C, проводя измерения
(A450) каждые 5 минут. Время предпоследнего измерения - Tконечное. Для
измерения поглощения формазана пробы инкубировали в течение 5 минут в
термостате, измерение поглощения формазана проведено на приборе для
иммуноферментного анализа фирмы Awareness, Microplate Rider Stat Fax 3200.
Определение концентрации продукта реакции
превращения 7-этоксирезоруфина в 7-гидроксирезоруфин осуществляли на основании
калибровки, построенной по экспериментальным данным (рисунок 3).
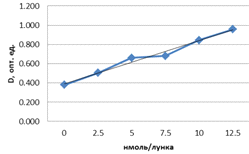
Рисунок 3 - Калибровочная прямая для определения
активности ЛДГ
Согласно калибровке относительная единица
оптической плотности соответствовала содержанию ЛДГ 0,430 нмоль/мин/мл (мЕ/мл).
2.4 Перечень
испытательного оборудования
Все работы с культурами клеток проводились в
стерильном ламинарном боксе, культивирование клеток - в СО2-инкубаторе.
Перечень необходимого оборудования представлен в
таблице 1
Таблица 1 - Испытательное оборудование, средства
измерения
|
Наименование,
тип
|
|
Центрифуга
лабораторная ОПН-3,02
|
|
Микроскоп
Axioskop40
|
|
Термостат
ТС 80М-2 электрический суховоздушный
|
|
Сушильный
шкаф СНОЛ-67/350
|
|
Микроскоп
АУ-12
|
|
Весы
электронные Adventurer OHAUS
|
|
Инкубатор
СО2
|
3. Результаты
исследований
.1 Влияние
наночастиц серебра на жизнеспособность клеток линий А549, SHR и сублинии FL по
результатам МТТ-теста
Гибель клеток, индуцированную наночастицами,
оценивали по изменению оптической плотности раствора по отношению к контролю.
Результаты представлены на рисунках 4.
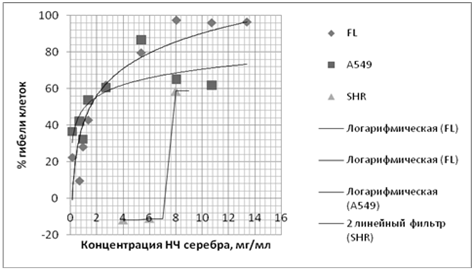
Рисунок 4 - Влияние НЧ серебра на клетки
различных линий
Как показали результаты МТТ-теста, средняя
ингибиторная концентрация (IC50) наночастиц серебра - концентрация, которая на
50 % подавляет способность клеток переводить соль тетразолина в формазан,
определенная графическим способом, для клеток линии А549 и сублинии FL
практически совпала и составила 1,3 и 1 мг/мл соответственно. В эксперименте на
кардиомиоцитах крысы IC50 наночастиц серебра определена на уровне 8 мг/мл.
Таким образом, данные, полученные в
эксперименте, свидетельствуют о более высокой чувствительности клеток линий
А549 и FL к действию наночастиц по сравнению с кардиомиоцитах крысы. Вероятно,
это связано с более высокой скоростью деления трансформированных клеток и
клеток амниона, а также интенсивностью метаболизма.
.2 Влияние
наночастиц на жизнеспособность лимфоцитов человека по результатам МТТ-теста
В эксперименте на лимфоцитах человека, которые
культивировали в течение 48 ч, продемонстрирована с наночастицами серебра (IC50
= 100 мкг/мл). Средняя ингибиторная концентрация определялась графически.
Результаты эксперимента представлены на рисунках 5.
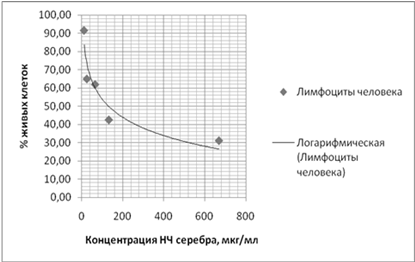
Рисунок 5 - Влияние НЧ серебра на лимфоциты
человека
Сопоставив результаты МТТ-теста на лимфоцитах
человека и предыдущего эксперимента, можно сделать вывод о том, что НЧ серебра
для лимфоцитов на порядок токсичнее, чем для любой использованной ранее
культуры клеток.
3.3 Изучение
цитотоксичности наноматериалов для клеток линии А549 с помощью окраски
метиленовым синим
Клетки линии А549 высевали в 24-луночные
планшеты, куда вносили НЧ серебра. Для оценки жизнеспособности клеток
использовали 0,4 % раствор метиленового синего. Окрашивание проводили через 8 и
24 ч после внесения наночастиц. Подсчет числа клеток проводили в 5 произвольных
полях зрения, рассчитывали среднее значение Результаты эксперимента
представлены в таблице 2.
Таблица 2 - Влияние НЧ серебра в различных
концентрациях на жизнеспособность клеток линии А549
|
Вариант
опыта
|
Число
клеток
|
|
8
ч
|
24
ч.
|
|
Общее
число клеток
|
Число
окрашенных клеток
|
%
гибель
|
Общее
число клеток
|
Число
окрашенных клеток
|
%
гибель
|
|
НЧ
серебра, 100 мкг/мл
|
67,2
|
4,6
|
6,8
|
88,4
|
5,6
|
6,3
|
|
НЧ
серебра, 300 мкг/мл
|
74
|
29
|
37,3
|
42,2
|
32,6
|
77,2
|
Показано, что при увеличении времени воздействия
эффект наночастиц серебра на клетки возрастает. Можно
сделать вывод о применимости метода окраски клеток в культуре метиленовым синим
для определения цитотоксического действия НЧ путем оценки целостности мембран
клеток.
.4 Изучение
жизнеспособности клеток в культуре по активности лактатдегидрогеназы в среде
культивирования
Изучена активность лактатдегидрогеназы (далее -
ЛДГ) в среде культивирования клеток А549 при добавлении НЧ серебра в
концентрациях от 100 до 1000 мкг/мл, экспозиция составила 24 ч (таблицы 3).
Таблица 3 - Результаты изучения влияния НЧ
серебра на активность ЛДГ в среде культивирования клеток линии А549
|
Концентрация
НЧ, мкг/мл
|
Активность
ЛДГ, мЕ/мл
|
|
100
|
|
300
|
302
|
|
600
|
366
|
|
800
|
414
|
|
1000
|
420
|
В результате активность ЛДГ при максимальных
концентрациях наноматериала возрастала в 1,5 раза.
Заключение
Наиболее перспективными объектами для изучения
являются наночастицы серебра т.к установлено, что наночастицы серебра являются
одним из наиболее перспективных типов наночастиц металлов. По меньшей мере, 235
видов товаров народного потребления, включая зубную пасту, перевязочные
материалы, средства для депиляции, содержат наносеребро. Вероятно, наночастицы
серебра найдут широкое применение в производстве текстиля, косметических
средств, антисептиков, полимеров, лакокрасочных материалов.. Их производство и
сфера применения увеличиваются, что может привести к негативному воздействию на
здоровье человека и окружающую среду.
В MTT тесте среднесмертельная концентрация
наночастиц серебра для клеток линии А549 и сублинии FL практически совпала и
составила 1,3 и 1 мг/мл соответственно, что на порядок выше, чем
среднесмертельная концентрация для лимфоцитов человека. В эксперименте на
кардиомиоцитах крысы LC50 наночастиц серебра определена на уровне 8 мкг/мл.
В эксперименте на клетках линии А549 оценивали
пригодность окраски трипановым синим для определения числа погибших (с
нарушенной проницаемостью мембраны) клеток. Число погибших клеток, определенное
по числу окрашенных клеток, оказалось несколько завышенным по сравнению с
результатами подсчета разницы между живыми клетками в контроле и в опыте после
смывания округлившихся и открепленных клеток. Можно сделать вывод о
применимости метода окраски клеток в культуре метиленовым синим для определения
цитотоксического действия НЧ путем оценки целостности мембран клеток.
При изучении влияния наноматериалов на
целостность мембраны клеток установлено, что активность ЛДГ при максимальных
концентрациях наноматериалов возрастала в 1,5 раза.
Список литературы
1 KemI (2008) Nanotechnology -
high risk with small particles? / KemI Report 6/07. - Swedish Chemicals Agency,
2008. - 74 p.
Toxic potential of materials at
the nanolevel / A. Nel [at al.] // Science. - 2006. - N 5761, Vol. 311. - P.
622 - 627.
Webster, T.J. Nanotechnology
for the regeneration of hard and soft tissues / T.J. Webster. - Singapore,
2007. - P. 207-214.
Air pollution, oxidative stress
and dietary supplementation: A review / I. Romieu [et al.] // European
respiratory journal. - 2008. - Vol. 31. - P. 179-197
Pulmonary applications and
toxicity of engineered nanoparticles / J. Card [et al.] // Aamerican journal of
physiology and lung cell molecular physiology. - 2008. - Vol. 295. - P.
400-411.
Long-term air pollution
exposure is associated with neuroinflammation, an altered innate immune
response, disruption of the blood-brain barrier, ultrafine particulate
deposition, and accumulation of amyloid β-42
and α-synuclein
in children and young adults / L. Calderón-Garcidueñas
[et al.] // Toxicologic pathology. - 2008. - Vol. 36. - P. 289-310.
Seaton, A. Nanotechnology and
the occupational physician / A. Seaton // Occupational medicine. - 2006. - Vol.
56, N 5. - P. 312-316.
The toxicity of diesel exhaust:
implications for primary care / I. Krivoshto [et al.] // Journal of the
American board of family medicine. - 2008. - Vol. 21, N1. - P. 55-62.
Assessing toxicity of fine and
nanoparticles: comparing in vitro measurements to in vivo pulmonary toxicity
profiles / C.M. Sayes [et al.] // Toxicological sciences. - 2007. - Vol. 97,
N1. - P. 163-180.
Dreher, K.L. Health and
environmental impact of nanotechnology: toxicological assessment of
manufactured nanoparticles / K.L. Dreher // Toxicological sciences. - 2004. -
Vol. 77. - P. 3-5.
Meng, H. A predictive
toxicological paradigm for the safety assessment of nanomaterials / H. Meng et
al. // ACS. - 2009. - Vol. 3, N 7. - P. 1620-1627.
Riss, T.L., Moravec, R.A. Use
of multiple assay endpoints to investigate the effects of incubation time, dose
of toxin, and plating density in cell-based cytotoxicity assays / T.L. Riss,
R.A. Moravec // Assay Drug Dev. Technol.
Decker, T., Lohmann-Matthes, M.L.
A quick and simple method for the quantitation of lactate dehydrogenase release
in measurements of cellular cytotoxicity and tumor necrosis factor (TNF)
activity / T. Decker, M.L. Lohmann-Matthes // J. Immunol. Methods.
- Vol. 115, N 1. - P. 61-69.
Культура животных клеток. Методы:
пер. с англ. / под ред. Р. Фрешни. - М.: Мир, 1989. - 333 с.
Комплексная биологическая оценка
объектов природного и искусственного происхождения на Tetrahymena pyriformis:
метод. рекомендации / разраб.: Белорус. науч.-иссл. сан.-гиг. ин-т; авт.-сост.
А.С.
Богдан.
- Минск,
1996. - 19 с.
Maron, D.M. Revised Methods for
the Salmonella Mutagenicity Test / D.M. Maron, B.N. Ames // Mutat. Res. - 1983.
- Vol. 113, N 3-4. - P. 173-215.
OECD Guideline 471, Bacterial
Reverse Mutation Test, updated and adopted July 21, 1997.
18 Фонштейн, Л.М. Методы первичного
выявления генетической активности загрязнителей среды с помощью бактериальных
тест-систем: Методические указания / Л.М. Фонштейн [и др.]. - М., 1985. - 34 с.
Гузев, B.C., Левин, C.B. Техногенные
изменения сообщества почвенных микроорганизмов / B.C. Гузев, C.B. Левин // Тез.
докл. конф. "Перспективы развития почвенной биологии". - Москва,
2001. - С. 178-219.
Наплекова, H.H. Микробная индикация
состояния почв / Н.Н. Наплекова // Тез. докл. конф. "Оценка современного
состояния микробиологических исследований в Восточно-Сибирском регионе". -
Иркутск, 2002.