Производство серной кислоты нитрозным методом
Производство серной кислоты нитрозным методом
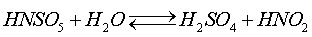
Сущность нитрозного метода
состоит в том, что обжиговый газ после очистки от пыли обрабатывается
серной кислотой, в которой растворены оксиды азота, — так называемой нитрозой. Диоксид серы поглощается нитрозой и затем
окисляется оксидами азота по реакции
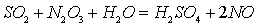
Образующийся 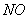 плохо растворим в нитрозе
и поэтому выделяется из нее, а затем
частично окисляется кислородом в газовой фазе до диоксида
плохо растворим в нитрозе
и поэтому выделяется из нее, а затем
частично окисляется кислородом в газовой фазе до диоксида 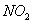 . Смесь оксидов азота
. Смесь оксидов азота 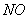 и
и 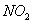 вновь
поглощается серной кислотой и т. д. Оксиды азота, по существу,
не расходуются в нитрозном процессе и возвращаются в
производственный цикл. Однако вследствие неполного
поглощения их серной кислотой они частично уносятся отходящими газами; это
составляет невозвратимые потери оксидов.
вновь
поглощается серной кислотой и т. д. Оксиды азота, по существу,
не расходуются в нитрозном процессе и возвращаются в
производственный цикл. Однако вследствие неполного
поглощения их серной кислотой они частично уносятся отходящими газами; это
составляет невозвратимые потери оксидов.
Процесс производства серной
кислоты нитрозным методом состоит из следующих стадий:
1)получение  ;
;
2)поглощение
 нитрозой;
нитрозой;
3)окисление
 нитрозой;
нитрозой;
4)освобождение нитрозы от оксидов азота (денитрация);
5)окисление
выделившегося из нитрозы оксида азота кисло
родом в газовой фазе;
6)поглощение
оксидов азота серной кислотой.
Раньше нитрозный процесс
осуществляли в свинцовых камерах, потому он назывался камерным
способом. В настоящее время этот способ, как малопроизводительный,
в СССР не применяется. Вместо него применяют башенный способ, по которому
все основные и промежуточные процессы переработки  протекают
не в камерах, а в башнях, заполненных насадкой и орошаемых серной кислотой.
протекают
не в камерах, а в башнях, заполненных насадкой и орошаемых серной кислотой.
На рис.1 изображена принципиальная схема
производства серной кислоты башенным
способом. Первая башня, в которую поступает
горячий обжиговый газ, предназначена для выделения оксидов азота из кислоты, орошающей башню. Этот
процесс называют денитрацией серной
кислоты, а башня 1 носит название денитрационной. Около 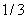 денитрационной кислоты, вытекающей из этой башни, передают на склад как
готовую продукцию, а остальное
поступает на орошение последней башни 4.
денитрационной кислоты, вытекающей из этой башни, передают на склад как
готовую продукцию, а остальное
поступает на орошение последней башни 4.
Рис.1 Принципиальная схема башенной
системы.
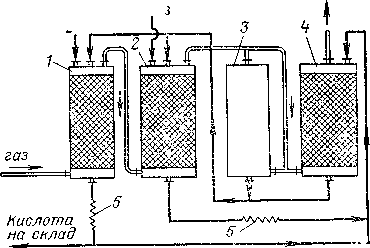
1-денитрационная башня;
2-продукционная башня;
3-окислительная башня;
4-абсорбционная башня;
5-холодильники кислоты.
Денитрационная башня
орошается небольшим количеством серной кислоты, поэтому
кислота в ней сильно нагревается, что способствует выделению оксидов азота.
Одновременно с денитрацией кислоты в башне 1 диоксид серы
частично абсорбируется серной кислотой и окисляется оксидами
азота. По характеру протекающих процессов первую башню можно схематически разделить
на три зоны. В нижней зоне происходит упаривание серной кислоты с
выделением паров воды в газовую фазу, в средней зоне оксиды азота выделяются из
нитрозы в результате наибольшего ее разбавления, в верхней зоне
конденсируются поступающие снизу пары воды и, следовательно,
происходит разбавление нитрозы и частичное окисление растворяющегося
в ней  .
.
Строгого разделения
перечисленных процессов по зонам провести нельзя, так как
частично они совмещаются друг с другом. Кроме протекания этих процессов, в
первой башне из газа улавливаются также остатки пыли, поглощаются
мышьяковистый ангидрид и диоксид селена, конденсируются пары серной кислоты (образуются из 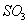 , присутствующего в обжиговом газе) и др. Туман серной кислоты лишь частично
поглощается в первой башне, большая
часть его поступает в последующие башни системы, где вследствие большой суммарной поверхности частиц тумана он
оказывает существенное влияние на протекающие в башнях процессы.
, присутствующего в обжиговом газе) и др. Туман серной кислоты лишь частично
поглощается в первой башне, большая
часть его поступает в последующие башни системы, где вследствие большой суммарной поверхности частиц тумана он
оказывает существенное влияние на протекающие в башнях процессы.
Готовую продукцию в башенных
системах отводят только из денитрационной башни, где
почти полностью улавливаются все примеси обжигового газа,
поэтому башенная кислота загрязнена мышьяком, селеном, огарковой
пылью и другими примесями.
Основное назначение второй башни— абсорбция
диоксида серы из обжигового газа серной
кислотой и окисление  нитрозой.
В этой башне образуется большая часть серной кислоты (70—80% всей
продукции), поэтому ее часто называют продукционной
башней. Процесс образования кислоты протекает по всей высоте башни 2,
однако основное количество
нитрозой.
В этой башне образуется большая часть серной кислоты (70—80% всей
продукции), поэтому ее часто называют продукционной
башней. Процесс образования кислоты протекает по всей высоте башни 2,
однако основное количество  окисляется в ее нижней части, где создаются условия,
наиболее благоприятные для этого
процесса. Оксиды азота, выделяющиеся
из нитрозы при окислении
окисляется в ее нижней части, где создаются условия,
наиболее благоприятные для этого
процесса. Оксиды азота, выделяющиеся
из нитрозы при окислении  ,
частично поглощаются в верхней части башни орошающей ее нитрозой,
но большая часть оксидов поступает вместе с газовым потоком в
окислительную башню
3. Здесь окисляется такое количество оксида азота, которое требуется,
чтобы соотношение между
,
частично поглощаются в верхней части башни орошающей ее нитрозой,
но большая часть оксидов поступает вместе с газовым потоком в
окислительную башню
3. Здесь окисляется такое количество оксида азота, которое требуется,
чтобы соотношение между 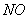 и
и 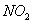 соответствовало
образованию
соответствовало
образованию 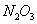 ; в
таком виде оксиды азота наиболее полно поглощаются в абсорбционных
башнях.
; в
таком виде оксиды азота наиболее полно поглощаются в абсорбционных
башнях.
В башне 3 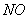 окисляется кислородом,
содержащимся в газе. Степень его окисления
регулируют, пропуская часть газа по обводному
газопроводу помимо башни (байпас). Из окислительной башни газ поступает
в башню 4, где оксиды азота поглощаются
орошающей ее серной кислотой; эту башню называют абсорбционной, или поглотительной.
окисляется кислородом,
содержащимся в газе. Степень его окисления
регулируют, пропуская часть газа по обводному
газопроводу помимо башни (байпас). Из окислительной башни газ поступает
в башню 4, где оксиды азота поглощаются
орошающей ее серной кислотой; эту башню называют абсорбционной, или поглотительной.
При охлаждении обжигового газа и
образовании серной кислоты выделяется большое количество тепла,
поэтому в денитрационной и продукционных башнях орошающая кислота нагревается
и перед возвратом на орошение ее приходится охлаждать. Для этого установлены холодильники 5.
При производстве башенной кислоты
неизбежны потери оксидов азота с
отходящими газами, с продукционной кислотой и др. Для восполнения этих потерь в денитрационную башню 1 и
продукционную башню 2 подается азотная кислота. Вода, необходимая для образования серной кислоты, также вводится
в эти башни.
Физико-химические основы нитрозного процесса
В нитрозном процессе окисление ЗО2 происходит с
помощью оксидов азота, растворенных в серной кислоте, поэтому
прежде всего необходимо рассмотреть свойства оксидов азота и абсорбцию
их серной кислотой.
Оксид азота 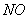 представляет собой
бесцветный газ, сжижающийся в бесцветную
жидкость при атмосферном давлении и температуре — 151,8 °С. Кислород
окисляет
представляет собой
бесцветный газ, сжижающийся в бесцветную
жидкость при атмосферном давлении и температуре — 151,8 °С. Кислород
окисляет 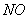 в газовой фазе
в газовой фазе
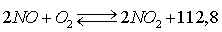 кДж (1)
кДж (1)
Эта реакция отличается от
большинства гомогенных реакций тем, что ее скорость понижается с
повышением температуры.
В зависимости от температуры и концентрации 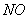 и
и 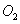 в газовой фазе устанавливается определенное равновесие между компонентами реакционной массы. Зависимость
константы равновесия
в газовой фазе устанавливается определенное равновесие между компонентами реакционной массы. Зависимость
константы равновесия 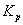 реакции (1)
реакции (1)
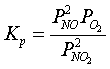 (2)
(2)
от абсолютной
температуры Т выражается уравнением
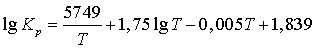 (3)
(3)
где 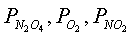 -парциальные давления
-парциальные давления 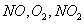 в газовой фазе,МПа.
в газовой фазе,МПа.
Следует полагать, что окисление 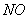 кислородом протекает также и в жидкой фазе
кислородом протекает также и в жидкой фазе
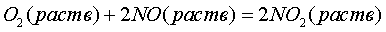 (4)
(4)
Диоксид азота 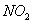 — темно-бурый газ, сжижающийся при атмосферном давлении уже в условиях комнатной
температуры (20,7 °С). Диоксид азота превращается в тетраксид (бесцветный газ) по реакции
— темно-бурый газ, сжижающийся при атмосферном давлении уже в условиях комнатной
температуры (20,7 °С). Диоксид азота превращается в тетраксид (бесцветный газ) по реакции
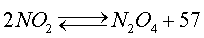 кДж (5)
кДж (5)
Зависимость
константы равновесия этой реакции
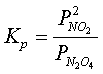 (6)
(6)
от температуры выражается уравнением
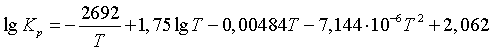 (7)
(7)
где 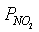 ,
,
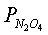 -парциальные давления
-парциальные давления 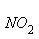 и
и 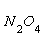 в газовой фазе, МПа.
в газовой фазе, МПа.
В нитрозных газах общее
содержание оксидов азота меньше 15%, а степень окисления 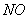 редко превышает 0,5,
поэтому из уравнения (7) следует, что возможное содержание
редко превышает 0,5,
поэтому из уравнения (7) следует, что возможное содержание 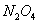 в газах нитрозного процесса
очень мало.
в газах нитрозного процесса
очень мало.
С серной кислотой диоксид азота
образует нитрозилсерную и азотную кислоты
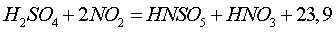 кДж (8)
кДж (8)
Оксид азота 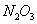 (азотистый ангидрид) при
комнатной температуре представляет собой газ; это соединение
устойчиво только
при высоком давлении. При 25 °С и давлении 0,1 МПа лишь 10,5% эквимолекулярной
смеси оксидов азота
(азотистый ангидрид) при
комнатной температуре представляет собой газ; это соединение
устойчиво только
при высоком давлении. При 25 °С и давлении 0,1 МПа лишь 10,5% эквимолекулярной
смеси оксидов азота 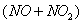 находится
в виде
находится
в виде 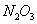 ; остальное количество
азотистого ангидрида разлагается на
; остальное количество
азотистого ангидрида разлагается на 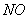 и
и 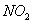 . При температуре 3,5 °С азотистый ангидрид снижается с образованием жидкости
сине-голубого цвета, которая также быстро разлагается.
. При температуре 3,5 °С азотистый ангидрид снижается с образованием жидкости
сине-голубого цвета, которая также быстро разлагается.
Равновесие реакции
образования азотистого ангидрида
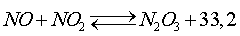 кДж (9)
кДж (9)
сдвигается вправо при понижении температуры и
повышении давления, причем состояние равновесия устанавливается
очень быстро. Константа равновесия этой реакции
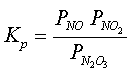 (10)
(10)
определяется при различной температуре следующими
уравнениями
при 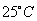
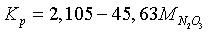 (11)
(11)
при 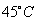
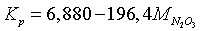 (12)
(12)
где М - условная мольная
концентрация всех оксидов азота.
В пересчете на 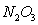 (в моль/л) условная мольная концентрация составляет
(в моль/л) условная мольная концентрация составляет
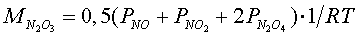 (13)
(13)
В условиях нитрозного процесса
содержание азотистого ангидрида в газе по сравнению с суммарным
содержанием  весьма незначительно.
весьма незначительно.
С серной кислотой 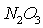 образует нитрозилсерную
кислоту
образует нитрозилсерную
кислоту
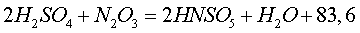 кДж (14)
кДж (14)
Свойства нитрозы
В технике нитрозой называют
растворы оксидов
азота (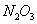 ) в водных растворах серной кислоты. Оксиды азота в зависимости от степени их окисления
образуют нитрозилсерную кислоту в соответствии с уравнением (14) или
нитрозилсерную и азотную кислоты - с уравнением (8).
) в водных растворах серной кислоты. Оксиды азота в зависимости от степени их окисления
образуют нитрозилсерную кислоту в соответствии с уравнением (14) или
нитрозилсерную и азотную кислоты - с уравнением (8).
Нитрозилсерная кислота представляет собой бесцветные
гигроскопические кристаллы (т. пл. 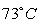 ),расплывающиеся при соприкосновении
с влажным атмосферным воздухом. Нитрозилсерная кислота, полученная при растворении
оксидов азота в безводной серной кислоте, вполне устойчива, в водных же
растворах серной кислоты она гидролизуется
),расплывающиеся при соприкосновении
с влажным атмосферным воздухом. Нитрозилсерная кислота, полученная при растворении
оксидов азота в безводной серной кислоте, вполне устойчива, в водных же
растворах серной кислоты она гидролизуется
 (15)
(15)
Степень гидролиза
нитрозилсерной кислоты увеличивается с повышением температуры и
понижением конденсации серной кислоты. В зависимости от содержания 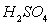 в исходной кислоте
степень гидролиза нитрозилсерной кислоты при комнатной температуре
изменяется следующим образом:
в исходной кислоте
степень гидролиза нитрозилсерной кислоты при комнатной температуре
изменяется следующим образом:
Содержание 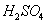 , % 98 95 92 90 87
80 70 57
, % 98 95 92 90 87
80 70 57
Степень гидролиза
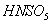 , % . . . . 1,1 4,0 7,3
12,4 19,4 27,7 49,8 100
, % . . . . 1,1 4,0 7,3
12,4 19,4 27,7 49,8 100
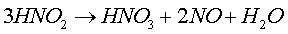 (16)
(16)
Растворимость 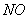 в водных растворах
серной кислоты очень мала; в нитрозе она
несколько больше, растворимость повышается
при увеличении концентрации нитрозилсерной кислоты и исходной серной кислоты и понижается с ростом
температуры. Ниже приведены данные о
растворимости оксида азота в нитрозе (в %) при давлении, равном 0,1 МПа
(760 мм рт. ст.) и температуре 40 °С:
в водных растворах
серной кислоты очень мала; в нитрозе она
несколько больше, растворимость повышается
при увеличении концентрации нитрозилсерной кислоты и исходной серной кислоты и понижается с ростом
температуры. Ниже приведены данные о
растворимости оксида азота в нитрозе (в %) при давлении, равном 0,1 МПа
(760 мм рт. ст.) и температуре 40 °С:
Содержание
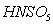 , % . 2 4 6
8 10
, % . 2 4 6
8 10
Растворимость
в
75%-ной 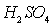 . . 0,04 0,11 0,17 0,26 0,28
. . 0,04 0,11 0,17 0,26 0,28
в 92%-ной 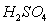 . 0,08 0,19 0,28 0,31 0,32
. 0,08 0,19 0,28 0,31 0,32
Растворимость 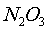 в водных растворах серной
кислоты, пропорциональна давлению оксидов азота и понижается с ростом
температуры.
в водных растворах серной
кислоты, пропорциональна давлению оксидов азота и понижается с ростом
температуры.
Над растворами смеси нитрозилсерной
и азотной кислот парциальное давление оксидов азота повышается
с увеличением концентрации 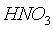 .
Давление над такими смесями больше, чем над растворами
нитрозилсерной кислоты и растворами азотной кислоты при одинаковом содержании
.
Давление над такими смесями больше, чем над растворами
нитрозилсерной кислоты и растворами азотной кислоты при одинаковом содержании
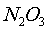 .
.
Скорость
абсорбции оксидов азота
В газе башенных систем содержатся оксиды азота
различной степени окисления (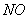 ,.
,.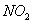 ,
,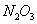 ). Они должны быть возможно
полнее выделены из газа в последней стадии нитрозного процесса,
так как окисление
). Они должны быть возможно
полнее выделены из газа в последней стадии нитрозного процесса,
так как окисление 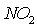 протекает
в жидкой фазе, непоглощенные оксиды удаляются в атмосферу с
отходящими газами и таким образом теряются.
протекает
в жидкой фазе, непоглощенные оксиды удаляются в атмосферу с
отходящими газами и таким образом теряются.
Экспериментально показано, что
скорость абсорбции оксидов азота из эквимолекулярной смеси 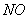 и
и 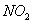 почти в 2 раза выше, чем из газа, содержащего только
почти в 2 раза выше, чем из газа, содержащего только 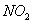 . Следовательно, эквимолекулярное соотношение
. Следовательно, эквимолекулярное соотношение 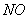 и
и 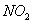 в газе является оптимальным условием для протекания процесса абсорбции
оксидов азота серной кислотой.
в газе является оптимальным условием для протекания процесса абсорбции
оксидов азота серной кислотой.
Скорость этого процесса в
башне с насадкой зависит от многих факторов (скорости газа в
насадке, плотности орошения, температуры и др.). Влияние каждого из
них определяется конкретными условиями. Для установления оптимальных условий
абсорбции оксидов азота нитрозой были проведены многочисленные исследования, позволившие
определить влияние различных факторов на этот процесс. Оказалось,
что до определенной скорости газового потока в насадке
наиболее медленной стадией является диффузия газа через газовую пленку. Увеличение
скорости газа оказывает большое влияние на скорость абсорбции
оксидов азота серной кислотой, орошающей насадку. При дальнейшем же
повышении скорости газа диффузия через газовую пленку перестает
лимитировать процесс абсорбции и скорость газового потока уже не оказывает
влияния на скорость абсорбции.
С увеличением плотности орошения
насадки скорость абсорбции оксидов азота вначале возрастает; по
достижении определенной плотности орошения дальнейшее увеличение скорости
абсорбции не наблюдается.
С повышением концентрации 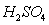 скорость абсорбции
скорость абсорбции 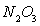 серной кислоты возрастает:
серной кислоты возрастает:
Концентрация 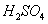 ,%
73,4 76,6 80,8 84 95,6
,%
73,4 76,6 80,8 84 95,6
Коеффициент скорости 6,4
6,6 6,8 7,1 7,9
абсорбции, 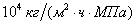
Увеличение температуры приводит к уменьшению
скорости абсорбции оксидов азота серной
кислотой:
Температура, 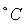 20 30 40 50 60
20 30 40 50 60
Относительная скорость
аб- 1 0,9 0,7 0,65 0,56
сорбции 76%-ной 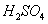
Характер зависимости
скорости абсорбции оксидов азота серной кислотой от скорости
газа и плотности орошения насадки башен показывает, что
основное влияние на скорость поглощения оказывает химические процессы,
протекающие в жидкой фазе, а не диффузионные процессы в газовой и
жидкостной пленках. Об этом же свидетельствует повышение скорости абсорбции
с увеличением концентрации серной кислоты и понижением температуры,
так как в этих условиях уменьшается гидролиз нитрозилсерной
кислоты.
На основании сказанного
можно сделать следующие выводы.
1) Процесс абсорбции
оксидов азота серной кислотой сопровождается химической реакцией в жидкой фазе.
2)Максимальная скорость абсорбции соответствует эквимолекулярному
соотношению 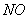 и
и 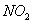 в газе.
в газе.
3)При достаточно больших скоростях газа в насадке и
плотностях орошения скорость общего процесса определяется в основном скоростью
химических процессов, протекающих в жидкой фазе.
Потери оксидов азота с
отходящими газами в нитрозном процессе слагаются из статических потерь, обусловленных парциальным давлением оксидов над нитрозой, орошающей
последнюю башню системы, и потерь, которые зависят от технологических дефектов оформления процесса
(недостаточная поверхность насадки,
неравномерность орошения насадки по сечению башни, несоблюдение
оптимальных условий процесса -недостаточное
или слишком глубокое окисление оксидов азота и др.).
Рис.2 Относительные статистические потери оксидов азота (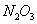 ) с выхлопными газами.
) с выхлопными газами.
На рис.2 видно, что значительное уменьшение
статических потерь оксидов азота возможно
при увеличении концентрации кислоты, орошающей последнюю башню, до 80% 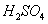 . Дальнейшее
повышение концентрации кислоты незначительно влияет на статические потери, поэтому его рекомендуют лишь в тех
случаях, когда 80%-ная и более концентрированная .серная кислота могут быть получены без ущерба для работы продукционной зоны башенной системы или когда
концентрированная серная кислота
может быть введена в систему со стороны.
. Дальнейшее
повышение концентрации кислоты незначительно влияет на статические потери, поэтому его рекомендуют лишь в тех
случаях, когда 80%-ная и более концентрированная .серная кислота могут быть получены без ущерба для работы продукционной зоны башенной системы или когда
концентрированная серная кислота
может быть введена в систему со стороны.
Абсорбции диоксида серы нитрозой
Так как в нитрозном процессе
окисление  оксидами азота протекает в
жидкой фазе, то оно может происходить только после того, как
диоксид серы будет поглощен нитрозой. Поэтому скорость абсорбции
оксидами азота протекает в
жидкой фазе, то оно может происходить только после того, как
диоксид серы будет поглощен нитрозой. Поэтому скорость абсорбции  является одним из основных
факторов, определяющих скорость нитрозного процесса получения
серной кислоты.
является одним из основных
факторов, определяющих скорость нитрозного процесса получения
серной кислоты.
Поскольку абсорбция диоксида
серы осложняется протеканием химической реакции, скорость этого процесса
зависит как от
диффузии  через газовую и жидкостную пленки, так и от скорости реакции в жидкой фазе. Влияние каждого
из этих факторов проявляется в
определенных условиях и пределах, поэтому
для установления оптимальных условий процесса следует учитывать каждый из них в отдельности и во
взаимосвязи с другими факторами.
через газовую и жидкостную пленки, так и от скорости реакции в жидкой фазе. Влияние каждого
из этих факторов проявляется в
определенных условиях и пределах, поэтому
для установления оптимальных условий процесса следует учитывать каждый из них в отдельности и во
взаимосвязи с другими факторами.
Существенное влияние
процесса окисления  нитрозой
на скорость его абсорбции подтверждается зависимостью скорости
поглощения
нитрозой
на скорость его абсорбции подтверждается зависимостью скорости
поглощения  от содержания оксидов азота
в нитрозе, концентрации исходной серной кислоты и температуры. С ростом
концентрации
от содержания оксидов азота
в нитрозе, концентрации исходной серной кислоты и температуры. С ростом
концентрации 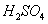 скорость абсорбции
скорость абсорбции  нитрозой повышается вначале медленно,
затем очень быстро (рис.3), достигая резко выраженного максимума при 57%
нитрозой повышается вначале медленно,
затем очень быстро (рис.3), достигая резко выраженного максимума при 57% 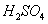 (что соответствует
(что соответствует
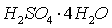 ). Дальнейшее увеличение концентрации
серной кислоты вызывает понижение скорости абсорбции
). Дальнейшее увеличение концентрации
серной кислоты вызывает понижение скорости абсорбции  до минимума при 84,5% (т. е.
до минимума при 84,5% (т. е. 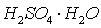 ), затем снова начинается
ее медленное повышение.
), затем снова начинается
ее медленное повышение.
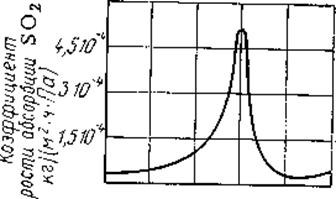
Рис.3 Зависимость скорости абсорбции  нитрозой от концентрации исходной кислоты.
нитрозой от концентрации исходной кислоты.
Поскольку абсорбированный диоксид серы
окисляется продуктами гидролиза нитрозилсерной кислоты, наиболее высокая степень абсорбции  57% -ной серной кислотой обусловлена полным гидролизом нитрозилсерной кислоты при этой
концентрации
57% -ной серной кислотой обусловлена полным гидролизом нитрозилсерной кислоты при этой
концентрации 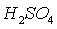 . С увеличением содержания
. С увеличением содержания 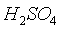 в нитрозе сверх 57% скорость абсорбции
в нитрозе сверх 57% скорость абсорбции  уменьшается в соответствии со снижением степени гидролиза нитрозилсерной
кислоты, что объясняется, по-видимому, уменьшением содержания
уменьшается в соответствии со снижением степени гидролиза нитрозилсерной
кислоты, что объясняется, по-видимому, уменьшением содержания 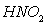 в нитрозе, определяющего
скорость окисления
в нитрозе, определяющего
скорость окисления  .
.
С повышением температуры и увеличением
концентрации оксидов азота в нитрозе скорость абсорбции 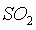 ею возрастает.
ею возрастает.
В нитрозном процессе концентрация 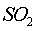 в газе изменяется в узких
пределах; концентрация кислорода меняется также очень незначительно.
Эти изменения не оказывают существенного влияния на скорость
абсорбции диоксида серы нитрозой.
в газе изменяется в узких
пределах; концентрация кислорода меняется также очень незначительно.
Эти изменения не оказывают существенного влияния на скорость
абсорбции диоксида серы нитрозой.
Окисление
 нитрозой
нитрозой
Существует много теорий
процесса окисления диоксида серы в нитрозном способе, но ни
одна из них пока не получила широкого признания. Экспериментально
установлено, что нитроза, в которой нитрозилсерная кислота
не гидролизована, не реагирует с  , и
нитрозилсерная кислота и продукты ее гидролиза не окисляются
кислородом, если
нитроза содержит 75-92%
, и
нитрозилсерная кислота и продукты ее гидролиза не окисляются
кислородом, если
нитроза содержит 75-92% 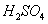 . Таким образом, сама нитрозилсерная кислота не окисляет диоксида серы и
не связывает кислорода. В жидкой
фазе
. Таким образом, сама нитрозилсерная кислота не окисляет диоксида серы и
не связывает кислорода. В жидкой
фазе  окисляется продуктами гидролиза
нитрозилсерной кислоты (в частности,
окисляется продуктами гидролиза
нитрозилсерной кислоты (в частности, 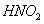 ),
причем активность нитрозы по отношению к
),
причем активность нитрозы по отношению к 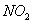 тем больше, чем выше степень
гидролиза нитрозилсерной кислоты.
тем больше, чем выше степень
гидролиза нитрозилсерной кислоты.
Наиболее вероятной можно
считать следующую схему реакций образования серной кислоты в
нитрозном процессе:
поглощение
газа жидкостью (нитрозой)
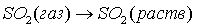
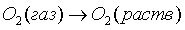
реакции в жидкой фазе
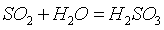
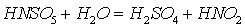
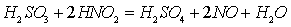
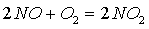
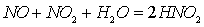
выделение оксида из жидкой фазы
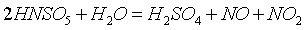
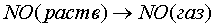
окисление оксидов азота в газовой фазе
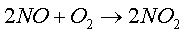
Возможность окисления  в газовой фазе не установлена. Такая реакция если и протекает, то в очень
незначительной степени и не оказывает
существенного влияния на общий процесс
образования серной кислоты в нитрозном процессе.
в газовой фазе не установлена. Такая реакция если и протекает, то в очень
незначительной степени и не оказывает
существенного влияния на общий процесс
образования серной кислоты в нитрозном процессе.
Удаление
оксидов азота из нитрозы (денитрация)
Из кислоты,
орошающей денитрационную башню, оксиды азота должны
быть удалены возможно более полно. Это необходимо для уменьшения
потерь оксидов азота и получения продукции высокого качества.
Поэтому денитрация серной кислоты является важной стадией нитрозного
процесса.
Скорость денитрации серной
кислоты уменьшается с повышением ее концентрации и увеличивается с
повышением температуры. С увеличением содержания  в газе скорость денитрации
повышается вследствие возрастания скоростей окисления
в газе скорость денитрации
повышается вследствие возрастания скоростей окисления 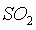 и образования
и образования 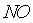 , плохо растворимой в
кислоте. С повышением содержания кислорода в
газе процесс денитрации несколько
замедляется, так как часть оксида азота окисляется в жидкой фазе; образующаяся при этом смесь оксидов
азота лучше растворяется в серной
кислоте.
, плохо растворимой в
кислоте. С повышением содержания кислорода в
газе процесс денитрации несколько
замедляется, так как часть оксида азота окисляется в жидкой фазе; образующаяся при этом смесь оксидов
азота лучше растворяется в серной
кислоте.
Наиболее интенсивно процесс
денитрации серной кислоты в денитрационной башне протекает в средней зоне, где
происходит наибольшее разбавление серной кислоты. Однако в этой башне
не удается полностью удалить оксиды азота из кислоты. Для некоторых
же потребителей серной кислоты присутствие в ней 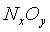 недопустимо,
поэтому изучалась возможность удаления оксидов азота из башенной
кислоты путем добавления к ней реагентов, восстанавливающих растворенные оксиды до
недопустимо,
поэтому изучалась возможность удаления оксидов азота из башенной
кислоты путем добавления к ней реагентов, восстанавливающих растворенные оксиды до 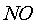 или до
элементарного азота. В качестве таких реагентов испытывали элементарную серу, сероводород, сульфат
аммония, карбамид (мочевину),
формалин, амидосульфоновую кислоту, ее соли,
сульфит, бисульфит, тиосульфат натрия. Наиболее эффективными оказались сульфат аммония, формалин,
амидосуль-фоновая кислота и карбамид,
которые реагируют с оксидами азота.
или до
элементарного азота. В качестве таких реагентов испытывали элементарную серу, сероводород, сульфат
аммония, карбамид (мочевину),
формалин, амидосульфоновую кислоту, ее соли,
сульфит, бисульфит, тиосульфат натрия. Наиболее эффективными оказались сульфат аммония, формалин,
амидосуль-фоновая кислота и карбамид,
которые реагируют с оксидами азота.
Окисление NO кислородом в газовой фазе
Оксиды азота лучше
всего поглощаются серной кислотой в виде эквимолекулярной смеси 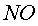 и
и 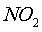 . Недостаточная или
слишком высокая степень окисления оксидов
азота (по сравнению с содержанием их
в эквимолекулярной смеси) снижает полноту абсорбции оксидов азота в поглотительных башнях и повышает
их потери с отходящими газами.
Поэтому в нитрозном процессе степень окисления
оксидов азота тщательно контролируется и регулируется. Регулирование степени окисления оксидов ведут
путем изменения времени пребывания
газа в окислительной башне или режима
работы продукционных башен (если отсутствует окислительная башня) с таким расчетом, чтобы на выходе
газа из последней абсорбционной башни соотношение в нем
. Недостаточная или
слишком высокая степень окисления оксидов
азота (по сравнению с содержанием их
в эквимолекулярной смеси) снижает полноту абсорбции оксидов азота в поглотительных башнях и повышает
их потери с отходящими газами.
Поэтому в нитрозном процессе степень окисления
оксидов азота тщательно контролируется и регулируется. Регулирование степени окисления оксидов ведут
путем изменения времени пребывания
газа в окислительной башне или режима
работы продукционных башен (если отсутствует окислительная башня) с таким расчетом, чтобы на выходе
газа из последней абсорбционной башни соотношение в нем 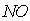 и
и 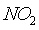 было
возможно ближе к составу эквимолекулярной смеси.
было
возможно ближе к составу эквимолекулярной смеси.
Степень окисления оксидов
азота, соответствующую условиям равновесия, можно определить из уравнения:
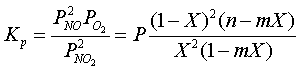 (17)
(17)
где 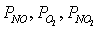 -парциальное давление
-парциальное давление 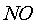 ,
, 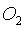 ,
, 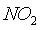 в газовой фазе соответственно,0,1 МПа;
Р- общее давление газа,0,1 МПа;X-равновесная
степень окисления
в газовой фазе соответственно,0,1 МПа;
Р- общее давление газа,0,1 МПа;X-равновесная
степень окисления 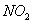 ,доли единицы;n-объем кислорода в
,доли единицы;n-объем кислорода в 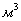 газа,
газа, 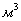 ;m-объем
;m-объем  в 1
в 1 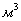 газа,
газа, 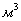 .
.
Чтобы определить степень окисления 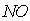 при определенной температуре и заданном составе исходной главной смеси, необходимо в это уравнение подставить значение
при определенной температуре и заданном составе исходной главной смеси, необходимо в это уравнение подставить значение 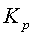 при
данной температуре,
найденное по уравнению (3). При температуре ниже 200 °С содержание
при
данной температуре,
найденное по уравнению (3). При температуре ниже 200 °С содержание 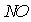 в равновесной газовой смеси
в равновесной газовой смеси 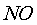 ,
, 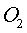 и
и 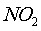 ничтожно. Поэтому можно
принять, что в нитрозном процессе скорость диссоциации
ничтожно. Поэтому можно
принять, что в нитрозном процессе скорость диссоциации 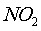 очень мала и при подсчете скорости окисления
очень мала и при подсчете скорости окисления 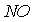 по реакции (1) скорость обратной реакции можно не учитывать. В этих условиях время
по реакции (1) скорость обратной реакции можно не учитывать. В этих условиях время 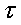 , необходимое для окисления
, необходимое для окисления 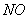 до степени X, можно найти из уравнения
до степени X, можно найти из уравнения
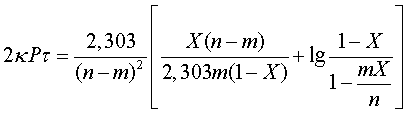 (18)
(18)
где 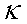 -константа скорости реакции окисления
-константа скорости реакции окисления  по реакции (1).
по реакции (1).
Отсюда время окисления
половины всего оксида азота (Х=0,5) составит
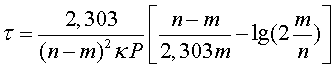 (19)
(19)
Ниже приведена зависимость
константы 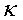 скорости
реакции (1)
от температуры t (содержание компонентов выражено через парциальные давления в МПа):
скорости
реакции (1)
от температуры t (содержание компонентов выражено через парциальные давления в МПа):
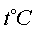 0 30 60 90
140 200 240
0 30 60 90
140 200 240
Из этих данных следует, что
скорость реакции окисления уменьшается с повышением температуры.
Это и отличает реакцию (1) от большинства гомогенных газовых реакций.
Список использованных источников
1. Амелин А.Г: Технология серной кислоты. учебное пособие для
вузов.-2-ое изд.,перераб.-М.,Химия,1983.-360 с.,ил.
2.Боресков Г.К.: Катализ в производстве серной
кислоты.М.Госхимиздат,1954.
3. Материалы с сайте URL: http://www.engineer-oht.ru
4. Боресков Г.К, Слинько М.Г, Бесков В.С.-Количество
катализатора, устойчивость и параметрическая чувствительность в контактных
аппаратах окисления двуокиси серы. Химпром.,1968,№ 3,с. 13.
Содержание
с.
Производство серной кислоты нитрозным
методом 2
Физико-химические основы нитрозного
процесса 6
Свойства
нитрозы
8
Скорость абсорбции оксидов азота 10
Абсорбции диоксида серы
нитрозой 13
Окисление диоксида серы
нитрозой 14
Удаление оксидов азота из
нитрозы(денитрация) 15
Окисление NO кислородом в газовой
фазе 16
Список использованных источников 19