Хлорид аммония: химический анализ
ГОУ
ВПО Пермская государственная фармацевтическая академия
Кафедра
аналитической химии
Курсовая
работа
ХЛОРИД
АММОНИЯ NH4Cl
Выполнила Пикулева Елена
Сергеевна
Пермь,
2008.
Содержание
Описание
вещества
Качественный
химический анализ катиона NH4+
Качественный
химический анализ аниона Cl-
Количественный
химический анализ
Гравиметрический
анализ
Тириметрический
анализ
Инструментальные
методы анализа
Применение
хлорида аммония в фармации
Список
литературы
Описание вещества
Аммония хлорид (NH4Cl)
- белый кристаллический, слегка гигроскопичный порошок без запаха;
"холодящего" солоноватого вкуса.
Молекулярная масса 53,49.
При нагревании до 338 °C полностью распадается
на NH3 и HCl.
Легко растворим в холодной воде (1:3), ещё легче
- в горячей (1:1,3). Растворы имеют слабокислую реакцию; хорошо растворим в
жидком аммиаке.

Качественный химический анализ
катиона NH4+
Катион аммония (NH4+)
относится к первой аналитической группе катионов. Катион аммония благодаря
своему строению обладает рядом отличительных свойств.
. Катион аммония неустойчив в основной среде:
NH4+
+ OH-
↔ NH3↑
+ H2O
Эта реакция используется в анализе для
обнаружения и удаления иона NH4+.
. Катион аммония обладает восстановительными
свойствами:
NH4+
+ 4Cl2
↔ N2↑
+ 8HCl
В качестве окислителей могут быть использованы
хлор, хлорамин, гипохлориты (например, NaClO),
хлорная известь и другие реагенты.
. Соли аммония термически нестойки: при
прокаливании они разлагаются с образованием газообразных азотсодержащих
продуктов. Реакция протекает без изменения степени окисления элементов, если
соль образована кислотой, не являющейся окислителем.
4Cl
↔
NH3↑ + HCl↑
(NH4)2CO3
↔ 2NH3↑
+ CO2↑
+ H2O
Реакция протекает с изменением степени окисления
элементов, если присутствует анион кислоты-окислителя.
4NO3
↔ N2O↑
+ 2H2O
В анализе эти реакции используют для удаления
катиона аммония.
. Водный раствор аммиака является слабым
основанием, соли аммония и сильных кислот гидролизованы по катиону (pH
<
7).
4+
+ HOH ↔
NH4OH + H+
Реакция с гидроксидом натрия (ГФ).
NH4Cl + NaOH ↔
NH3↑ + H2O
+ NaCl
Реакцию проводят в пробирке или "газовой
камере" ("висячая капля"). Реакция специфична.
Методика проведения реакции в "газовой
камере": в тигель помещают 3-5 капель раствора хлорида аммония и такое же
количество щёлочи. На предметное стекло прикрепляют кусочек влажной лакмусовой
бумаги или фильтровальной бумаги, смоченной фенолфталеином. Закрывают тигель
стеклом и осторожно нагревают на водяной бане. Выделяющиеся пары аммиака
окрасят лакмусовую бумагу в синий цвет, а фенолфталеиновую - в красный.
Реакция с реактивом Несслера
K2[HgI4]
+ KOH.
Образуется аморфный осадок бурого цвета - иодид
амминоксодиртути (II)
(иодид оксомеркураммония).
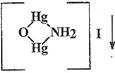
NH4Cl
+ 2 K2[HgI4]
+ 4KOH ↔
+ KCl
+ 7 KI + 3H2O
Методика проведения реакции в "газовой
камере": в тигель помещают 3-5 капель раствора хлорида аммония и такое же
количество щёлочи. На предметное стекло наносят каплю тетраиодомеркурата (II)
калия. Накрывают тигель стеклом каплей вниз и осторожно нагревают. На стекле
появится бурое пятно.
Качественный химический анализ
аниона Cl-
Анион хлора (Cl-)
относится к третьей аналитической группе анионов. Хлорид-ион является анионом
весьма сильной кислоты (KHCl=
1·107).
Анион хлора является восстановителем, окисляясь
чаще всего до молекулярного хлора.
В химическом анализе используют
восстановительные свойства хлорид-иона по отношению к ряду реагентов:
. К перманганату калия в сернокислой среде:
10NH4Cl + 2KMnO4
+ 8H2SO4 ↔ 5Cl2 + 2MnSO4 + K2SO4
+ 5(NH4)2SO4 + 8H2O
химический хлорид аммоний рефрактометрический
Аналитический сигнал: обесцвечивание раствора KMnO4.
Для окисления хлорид-ионов необходимы жёсткие
условия - нагревание в присутствии 3М H2SO4.
. К дихромату калия в сернокислой среде:
NH4Cl + K2Cr2O7
+ 3 H2SO4 ↔ K2SO4 + 2CrO2Cl2↑
+ 2(NH4)2SO4 + 3H2O
Аналитический сигнал: изменение цвета раствора
от оранжево-жёлтого до зелёного (Cr3+)
или красно-бурого (CrO2Cl2
- хлористый хромил).
Реакция с раствором AgNO3
(ГФ).
Методика: к 2 каплям раствора хлорида аммония
прибавляют 1 каплю разбавленной HNO3
и 3 капли раствора AgNO3.
Наблюдаемый белый творожистый осадок растворим в NH4OH
и насыщенном растворе (NH4)2CO3.
NH4Cl + AgNO3 →
AgCl↓ + NH4NO3
Раствор [Ag(NH3)2]Cl
делят на 2 части: к одной добавляют концентрированную HNO3
до кислой реакции среды, к другой - концентрированный раствор KI.
Наблюдают выпадение осадков или помутнение раствора.
[Ag(NH3)2]Cl +
2HNO3 ↔ AgCl↓ + 2NH4NO3
[Ag(NH3)2]Cl
+ KI + 2H2O
↔
AgI↓ + KCl
+ 2 NH4OH
Количественный химический анализ
Количественный анализ осуществляется различными
методами анализа по определённым методикам.
В основе количественного химического анализа
лежит измерение интенсивности аналитического сигнала (масса, объёма), по
которой рассчитывают массовое содержание (Q)
или массовую долю (ω, %) вещества
или его составных частей в анализируемом объекте.
Аналитическую навеску для проведения анализа
берут в виде точного объёма (V)
жидкого или газообразного вещества, или в виде точной массы (а) твёрдого
материала.
|
метод
|
принцип
метода
|
|
1.
Гравиметрический (весовой)
|
Измерение
массы определяемого вещества или его составных частей, выделяемых в виде
соответствующих соединений
|
|
2.
Титриметрический (объёмный)
|
Измерение
объёма раствора реагента точной концентрации, израсходованного на реакцию с
определённым количеством анализируемого вещества
|
|
3.
Газовый
|
Измерение
объёма газа, поглощённого специальным поглотителем
|
Гравиметрический анализ
Гравиметрический анализ - метод количественного
химического анализа, основанный на измерении массы определяемого вещества или
его составных частей, выделяемых в химически чистом состоянии или в виде
соответствующего соединения точно известного состава, полученного с помощью
химической реакции или в результате физических или физико-химических процессов.
Для гравиметрического определения NH3
в хлориде аммония используется метод отгонки. В этом случае навеску образца
обрабатывают щелочью (NaOH):
NH4Cl
+ NaOH ↔
NH3↑
+ H2O
+ NaCl
Выделившийся NH3
отгоняют в предварительно взвешенный сосуд, содержащий поглотитель (точное
количество стандартного раствора хлороводородной кислоты):
NH3
+ HCl ↔
NH4Cl
HCl + NaOH
↔
NaCl + H2O
При этом на взаимодействие с аммиаком
расходуется эквивалентное аммонийной соли количество кислоты.
в 53,49 г NH4Cl
содержится 17,03 г NH3
ωтеор
= 17,03 × 100 / 53,49 = 31,84%
ωпрак
= mNH3
×
100 / аNH4Cl
Абсолютная ошибка: Аабс
= ωпрак - ωтеор
Относительная ошибка: Дотн = Аабс
×
100 / ωтеор
= (%)
Титриметрический анализ
Кислотно-основное титрование
В основе метода лежит протолитическая реакция:
H+
+ OH-
→ H2O
Поскольку реакция нейтрализации не
сопровождается видимым внешним эффектом, конечную точку титрования определяют с
помощью кислотно-основных индикаторов. Определение содержания хлорида аммония
алкалиметрическим методом (вариант обратного титрования).
Определение основано на реакции хлорида аммония
с избытком гидроксида натрия, непрореагировавшую часть которого оттитровывают
раствором соляной кислоты.
NH4Cl
+ NaOH ↔
NH3↑
+ H2O
+ NaCl (+NaOHост)
NaOHост
+ HCl →
NaCl + H2O
Индикатор: фенолфталеин fэ
= 1
= CэNaOH×МэNH4Cl×(VNaOH×КпNaOH-VHCl×КпHCl)/1000
ω = Q
× 100% / а
Определение содержания хлорида аммония
алкалиметрическим методом (вариант титрования по заместителю).
Определение основано на взаимодействии хлорида
аммония со вспомогательным реагентом - формальдегидом с выделением
эквивалентного количества хлороводородной кислоты, который оттитровывается
раствором гидроксида натрия.
4NH4Cl + 6CH2O
= (CH2)6N4 + 4HCl + 6H2O+ NaOH →
NaCl + H2O
Индикатор:
фенолфталеин
fэ
=
Q = cэNaOH×MэNH4Cl×VNaOH×КпNaOH
/ 1000
ω = Q
× 100% / а
Осадительное титрование.
Методы осадительного титрования основаны на
образовании труднорастворимых соединений.
Метод Гей-Люссака - представляет собой вариант
прямого титрования галогенид-ионов раствором AgNO3
без индикаторов. Окончание титрования фиксируют визуально, по прекращению
образования осадка соли и просветлению раствора. В основе метода лежит реакция:
NH4Cl + AgNO3 →
AgCl↓ + NH4NO3
В настоящее время метод не применяется.
Метод Мора - представляет собой вариант прямого
титрования в присутствии 5% раствора K2CrO4.
В основе метода лежат реакции:
NH4Cl + AgNO3 →
AgCl↓ + NH4NO32CrO4 + 2AgNO3 →
Ag2CrO4↓ + 2KNO3
В ходе процесса титрования вначале образуется
белый осадок хлорида серебра, при прибавлении избыточной капли титранта в
присутствии индикатора приводит к красному окрашиванию Ag2CrO4.
Метод Мора имеет широкое применение в
фарманализе.
Индикатор: K2CrO4,
5%
fэ
= 1
Q = cэAgNO3×MэNH4Cl×VAgNO3×КпAgNO3
/ 1000
ω = Q
× 100% / а
Метод Фаянса-Ходакова - представляет собой
вариант прямого титрования галогенид-ионов раствором AgNO3
в присутствии адсорбционных индикаторов. В основе метода лежат реакции:
NH4Cl + AgNO3 →
AgCl↓ + NH4NO3
{(AgCl)n nCl-(n-x)
NH4}x-· xNH4+
[(AgCl)n]0
в конечной точке титрования:
{(AgCl)n nAg+(n-x)NO3-}x+·
xNO3-
{(AgCl)n nAg+(n-x)Jnd-}x+·
xNO3-
Индикатор:
флюоресцеин
fэ
= 1
Q = cэAgNO3×MэNH4Cl×VAgNO3×КпAgNO3
/ 1000
ω = Q
× 100% / а
Метод Фольгарда - представляет собой вариант
обратного титрования в присутствии металло-хромного индикатора.
Для проведения анализа к раствору NH4OH
прибавляют разбавленную азотную кислоту и точно известное количество избытка
нитрата серебра, перемешивают смесь и титруют оставшиеся ионы серебра
стандартным раствором NH4SCN
до красноватой окраски раствора.
NH4Cl + AgNO3 →
AgCl↓ + NH4NO3 + (AgNO3)3 +
NH4SCN → AgSCN↓ + NH4NO3
в конечной точке титрования:
FeNH4(SO4)2
+ 3NH4SCN → Fe(SCN)3 + 2(NH4)2SO4
Индикатор: железо-аммониевые квасцы - FeNH4(SO4)2·12H2O.
= CэAgNO3×МэNH4Cl×(VAgNO3×КпAgNO3-VNH4SCN×КпNH4SCN)/1000
ω = Q
× 100% / а
Комплексометрическое титрование.
Меркуриметрия - метод основан на образовании
малодиссоциируемых солей ртути (II).
Образующийся при титровании дихлорид ртути (II)
очень мало диссоциирует и в растворе до точки эквивалентности отсутствуют ионы
ртути (II).
Метод представляет собой вариант прямого
титрования раствора хлорида аммония раствором Hg(NO3)2
в азотнокислой среде. В основе метода лежит реакция:
HgNO3
+ 2NH4Cl→
[HgCl2]
+ 2NH4NO3
Индикаторы: дифенилкарбазон, дифенилкарбазид. fэ
= ½
Q = cэHg(NO3)2×MэNH4Cl×VHg(NO3)2×КпHg(NO3)2
/ 1000
ω = Q
× 100% / а
Инструментальные методы анализа
Фотоколориметрический метод.
Метод применяется для количественного анализа
хлорида аммония, так как NH4Cl
образует окрашенные продукты реакции при взаимодействии с реактивом Несслера
(определение по фотометрической реакции).
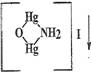
NH4Cl
+ 2 K2[HgI4]
+ 4KOH ↔
+ KCl
+ 7 KI + 3H2O
Для определения хлорида аммония готовят его
стандартный раствор с титром 3 мг/см3. В пять мерных колб
вместимостью 50 см3 вносят из быретки 1, 2, 3, 4 и 5 см3
приготовленного стандартного раствора хлорида аммония, прибавляют равное
количество реактива Несслера. Доводят объём мерных колб дистиллированной водой
до метки, перемешивают.
Измеряют оптическую плотность эталонного
раствора №3 на фотоколориметре относительно раствора сравнения
(дистиллированной воды) при разных длинах волн (светофильтрах). Проводят два
параллельных измерения, результаты заносят в таблицу:
|
№
светофильтра
|
λ
светофильтра,
нм
|
А1
|
А2
|
Асреднее
|
|
1
|
400
|
|
|
|
|
2
|
440
|
|
|
|
|
3
|
490
|
|
|
|
|
4
|
540
|
|
|
|
|
5
|
590
|
|
|
|
По полученным данным строят график зависимости
оптической плотности раствора от длины волны. Для дальнейшей работы выбирают ту
длину волны λmax,
при которой наблюдается максимум оптической плотности на полученном спектре.
Измеряют оптическую плотность приготовленных
эталонных растворов при выбранной, аналитической длине волны относительно
дистиллированной воды, проводят два параллельных измерения и заносят результаты
в таблицу:
|
№
эталонного раствора
|
Т,
мг/см3
|
См,
моль/дм3
|
А1
|
А2
|
Асреднее
|
εi
|
|
1
|
0,0600
|
|
|
|
|
|
|
2
|
0,1200
|
|
|
|
|
|
|
3
|
0,1800
|
|
|
|
|
|
|
4
|
0,2400
|
|
|
|
|
|
|
5
|
0,3000
|
|
|
|
|
|
Рассчитывают молярный коэффициент поглощения для
каждого эталонного раствора:
ε = A/CMi×l
Из пяти рассчитанных значений молярных
коэффициентов поглощения находят среднее значение.
По полученным данным строят градуировочный
график, откладывая на оси абсцисс титр (Т, мг/см3) растворов, а но
оси ординат - оптическую плотность А.
Определение концентрации NH4Cl
в растворе
Точный объём раствора помещают в мерную колбу
вместимостью 50 см3, прибавляют реактив Несслера. Доводят объём
дистиллированной водой до метки, перемешивают. Измеряют оптическую плотность
полученного раствора в ранее найденных условиях.
. По градуировочному графику находят
концентрацию (Т, мг/см3) анализируемого раствора и делают пересчет
на молярную концентрацию:
См = Т(г/см3)×1000/M;
Т(г/см3) = Т(мг/см3)/1000.
. Рассчитывают концентрацию анализируемого
раствора по значению молярного коэффициента поглощения ε:
См = А/εср×l.
. Рассчитывают концентрацию анализируемого
раствора по способу стандарта, используя экспериментальные данные выбранного
эталонного раствора (Аст, Сст):
См = Сст×АХ/Аст.
Рефрактометрия - оптический метод анализа,
основанный на измерении показателя преломления светового луча исследуемым
веществом на границе раздела двух различных оптических сред.
Показателем преломления называют отношение
скорости распространения света в испытуемом веществе.
Различная скорость распространения света в
различных средах вызывает изменение его направления при переходе из одной среды
в другую, т.е. рефракцию.
Характер преломления светового луча на границе
раздела двух сред

По известному закону рефракции относительный
показатель преломления - постоянная величина для данного вещества, равная
отношению синусов угла падения (α) и
угла преломления (β) и отношению
скоростей распространения света в этих средах:
n = sinα
/ sinβ = V1/V2
Рефрактометрическое определение хлорида аммония
в водном растворе.
В градуировочных пробирках готовят 10 разведений
10% стандартного раствора хлорида аммония согласно таблице.
На призму рефрактометра наносят несколько капель
воды и по шкале находят показатель преломления (проверка работы рефрактометра: nD20H2O
= 1,333).
|
объём
стандартного раствора, см3
|
объём
воды, см3
|
концентрация
вещества в полученном разведении, %
|
nD20
|
Fi
|
|
1
|
9
|
1
|
|
|
|
2
|
8
|
2
|
|
|
|
3
|
7
|
3
|
|
|
|
4
|
6
|
4
|
|
|
|
5
|
5
|
5
|
|
|
|
6
|
4
|
6
|
|
|
|
7
|
3
|
7
|
|
|
|
8
|
2
|
8
|
|
|
|
9
|
1
|
9
|
|
|
|
10
|
0
|
10
|
|
|
По полученным данным: 1. Строят калибровочный
график зависимости показателя преломления от концентрации стандартного раствора
хлорида аммония; 2. Рассчитывают рефрактометрический фактор пересчета для каждой
концентрации стандартного раствора
F = nст
- n0
/ Сст
. Рассчитывают среднее значение
рефрактометрического фактора пересчета анализируемого вещества
Fср
= 1/n ΣFi
. Затем измеряют показатель преломления раствора
вещества неизвестной концентрации и определяют его концентрацию по:
градуировочному графику;
рефрактометрическому фактору пересчета
Cx
= nx - n0
/ Fср;
рефрактометрическим таблицам показателей
преломления.
Потенциометрические методы анализа основаны на
использовании зависимости ЭДС электрохимической ячейки от концентрации хлорида
аммония в растворе.
В идеальном случае эта зависимость оценивается
уравнением Нернста:
= E0
+ 0,059×lg([Ox]a/[Red]b)/n
Измеряют ЭДС специально подобранной электродной
пары, состоящей из индикаторного электрода и электрода сравнения, опущенных в
раствор хлорида аммония, компенсационным или некомпенсационным способами.
В аналитической практике применяют прямую и
косвенную потенциометрию (потенциометрическое титрование).
Прямая потенциометрия - метод определения концентрации
ионов хлора Cl-,
основанный на измерении электрохимического потенциала индикаторного электрода,
погруженного в раствор хлорида аммония.
Концентрацию ионов хлора в растворе хлорида
аммония находят по градуировочному графику, построенному в координатах E
- pC (C
- концентрация стандартных растворов) или расчетным путем, используя уравнение,
описывающее зависимость потенциала электрода от активности (концентрации) ионов
хлора в растворе:
E = E0
+ 0,059×lg(CCl-)/n
Косвенная потенциометрия (потенциометрическое
титрование) основана на установлении точки эквивалентности по резкому изменению
(скачку) потенциала в процессе титрования. При этом выбор электродной системы
определяется типом аналитической реакции, потенциал индикаторного электрода
должен зависеть от концентрации ионов, принимающих участие в реакции или
образующихся в процессе титрования.
Характеристика электродных систем
различных методов титрования хлорида аммония
|
метод
титрования
|
индикаторный
электрод
|
электрод
сравнения
|
|
кислотно-основной
|
стеклянный,
хингидронный, сурьмяный, водородный
|
каломельный,
хлорсеребряный
|
|
осадительный
|
металлические
(серебряный, платиновый), ионселективные
|
каломельный,
хлорсеребряный
|
При работе с обычной бюреткой титрант прибавляют
по 1-2 капли до нахождения конечной точки титрования.
Отмечают общий объём титранта V2
и вычисляют объём 1 капли V3,
исходя из общего числа капель m:
V3 = (V2 - V1)/m
Объём титранта, отвечающий конечной точке
титрования, находят по формуле:
VTP = V1 + [(m
+ n/2)V3],
где: m
- число капель, прибавленное до скачка потенциала; n
- число капель, вызвавшее скачок потенциала. Результаты измерений заносят в
таблицу. Для нахождения точки эквивалентности по полученным данным строят одну
из возможных графических кривых титрования.
Типы кривых титрования
Потенциометрическое определение хлорида аммония.
Определение основано на установлении точки эквивалентности при титровании
хлорида аммония раствором нитрата серебра (метод Гей-Люссака) по резкому изменению
потенциала системы.
NH4Cl + AgNO3 →
AgCl↓ + NH4NO3э
= 1
= cэAgNO3×MэNH4Cl×VAgNO3×КпAgNO3
/ 1000
ω = Q
× 100% / a
Хроматографический метод. Для количественного
анализа хлорида аммония используется газовая хроматография, т.к. при нагревании
до 338˚С он полностью распадается на NH3
и HCl.
Газовая хроматография - метод разделения и
определения летучих соединений.
Исследуемая проба хлорида аммония (0,1-1 мкл)
микрошприцом или дозатором вводится в поток газа-носителя, в специальном
устройстве (нагревателе) выделяется NH3
и в токе газа проходит через колонку с сорбентом, где многократно протекают
процессы сорбции, десорбции и распределения. Аммиак током газа-носителя
элюируется из колонки, регистрируется детектором, в котором изменение состава
проходящей через него смеси преобразуется в изменение выходного сигнала, и
автоматически фиксируется самописцем на бумаге в виде пиков.
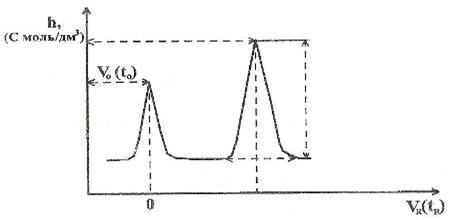
0(t0)
hNH3
aNH3
NH3
Результаты рассчитывают по формуле:
ωx%
= Sx×100%/Sст;
Sx = 1/2
a×h
где: Sx
- площадь пика анализируемых образца;
Sст
- площадь пика стандартного образца;
a - основание пика; h
- высота пика.
Ионообменная хроматография основана на обратимом
стехиометрическом обмене ионов в растворах электролитов на подвижные ионы
ионообменного сорбента - ионита.
Для хроматографирования хлорида аммония
используется колонка, заполненная катионитом. Определение хлорида аммония
основано на обратимом обмене катионов аммония в растворе хлорида аммония на
подвижные ионы водорода ионообменного сорбента.
Катионит-Н + NH4Cl
↔
Катионит-NH4
+ HCl
HCl + NaOH
↔
NaCl + H2O
Индикатор: метиловый оранжевый
fэ
= 1
Q = cэNaOH×MэHCl×VNaOH×КпNaOH
/ 1000
ω = Q
× 100% / а
Метод анализа вещества по ослаблению падающего
излучения называют турбидиметрическим. Турбидиметрическим методом можно
определить хлорид ионы в составе хлорида аммония.
Перед началом анализа хлорид-ионы переводят в
малорастворимое соединение (хлорид серебра), которое находится в виде взвеси.
При турбидиметрических измерениях величина S,
называемая мутностью, соответствует оптической плотности и определяется из
соотношения, аналогичного закону Бугера-Ламберта-Бера:
S = lg I0/I = kbN,
Где k
- коэффициент мутности; b
- длина пути; N - число
рассеивающих частиц.
Метод, в котором содержание вещества находят по
интенсивности рассеянного излучения, называют нефелометрическим.
Нефелометрическим методом можно определить хлорид ионы в составе хлорида
аммония.
Перед началом анализа хлорид-ионы переводят в
малорастворимое соединение (хлорид серебра), которое находится в виде взвеси.
c = I/kαI0,
где с - концентрация; kα
-
эмпирическая константа системы;α
- угол, под которым проводят измерения.
Применение хлорида аммония в
фармации
Аммония хлорид оказывает диуретическое действие;
вместе с тем как кислотообразующее средство аммония хлорид является эффективным
средством для коррекции алкалоза.
Как диуретическое средство аммония хлорид
назначают иногда при отеках сердечного происхождения.
Аммония хлорид оказывает также отхаркивающее
действие и применяется при бронхите, пневмонии и т.п.
Список литературы
Машковский
М. Д. Лекарственные средства. В двух частях. - М.: Медицина, 1993.
Гороновский
И. Т., Назаренко Ю. П., Некряч Е. Ф. Краткий справочник по химии. - К.: Наукова
думка, 1974.
Аналитическая
химия. Химические методы анализа/под ред. О. М. Петрухина. - М: Химия, 1992.
Основы
аналитической химии. В 2 кн. Кн. 1. Общие вопросы. Методы разделения. Кн. 2.
Методы химического анализа: учеб. для вузов/под ред. Ю. А. Золотова. - М.:
Высш. шк., 1996.
Качественный
химический анализ. Учебно-методическое пособие. - П.: ПГФА, каф. Аналитической
химии, 2003.
Количественный
химический анализ. Учебно-методическое пособие. - П.: ПГФА, каф. Аналитической
химии, 2004.
Инструментальные
(физико-химические) методы анализа. Учебно-методическое пособие. - П.: ПГФА,
каф. Аналитической химии, 2004.