|
Химическая
формула фосфата
|
Температура
плавления
|
Молекулярная
теплоёмкость
|
Стандартная
энтальпия образования
|
|
Ca3(PO4)2.
|
1777°C
|
231,6
Дж/(моль·К)
|
-4112,9 кДж/моль
|
|
Na3PO4
|
1340°C
|
195,5 Дж/(моль·К)
|
-1922,8 кДж/моль
|
|
Mg3(PO4)2
|
1375°C
|
184,86 Дж/(моль·К)
|
- 1458,3 кДж/моль
|
|
AlPO4
|
1800°C
|
93,24
Дж/(моль·К)
|
−1735 кДж/моль
|
|
K3PO4
|
1640°C
|
164,8
Дж/(моль·К)
|
-1988,2 кДж/моль
|
|
Ba3(PO4)2
|
1727°C
|
142,13 Дж/(моль·К)
|
-1564,1 кДж/моль
|
|
Cd3(PO4)2
|
1500°C
|
171,5 Дж/(моль·К)
|
-946,97
кДж/моль
|
Средние фосфаты. Общее свойство безводных солей - стабильность при
нагревании до температуры плавления. Ортофосфаты М(II)3(РО4)2
плавятся при: 1375 (M = Mg), 1777 (Ca), 1600 (Sr), 1605 (Ba), 1152 (Mn), 1345
(Ni), 1060 (Zn), 1014 0C (Pb), дифосфаты MII2P2O7 - при 1382 (Mg), 1355 (Ca),
1375 (Sr), 1430 (Ba), 1195 (Mn), 1400 (Ni), 1020 (Zn), 830 (Pb) градусов
Цельсия. Исключение составляют неустойчивые фосфаты (с катионами NH+4, Hg2+),
например Hg3(PO4)2,
из которого часть ртути
улетучивается при
температуре ниже температуры плавления. Кристаллогидраты многих ортофосфатов и некоторых конденсированных фосфатов при
нагревании теряют кристаллизационную
воду ступенчато, без изменения состава
аниона. На этом свойстве основан топохимический способ синтеза безводных солей, которые не удается получить другими способами. Так, топохимическим путем из (NH4)5P3O10·хH2O,
где х=I, 2, в среде газообразного NH3 получен кристаллический (NH4)5P3O10.
Средние фосфаты металлов в высоких степенях окисления не растворимы в воде, щелочных металлов и аммония
- растворимы, их водные растворы имеют рН > 7. Анионы
конденсированных фосфатов неорганических не стабильны в водных растворах, они последовательно превращаются
в анионы низших фосфатов.
Кислые и основные фосфаты. Растворимость в воде кислых и основных фосфатов выше, чем у
средних, в раствор переходят даже некоторые соли металлов в высоких степенях
окисления. Благодаря этому свойству
кислые фосфаты используют в качестве удобрений. При рН < 7 сложные анионы
быстрее разлагаются до простых (по сравнению с рН > 7). При нагревании в результате конденсации кислые соли
меняют анионный состав ниже температуры
плавления, благодаря чему они служат исходными соединениями для получения многих конденсированных фосфатов. Помимо
гидро- и дигидроортофосфатов щелочных металлов известны кристаллические кислые
ортофосфаты: M(II)HPO4, где M = Be, Mg, Ca, Sr, Ba, Mn, Zn, Cd, Sn,
Pb, Hg, их кристаллогидраты с одной молекулой воды (M = Be, Mg, Cu, Zn), двумя
(Ca, Со, Ni), тремя (Mg, Mn, Zn) и семью (Mg); M(II)(Н2РО4)2,
где M = Mg, Sr, Ba, Cu, Cd, Sn, Pb, их кристаллогидраты с одной молекулой воды
(M = Ca, Sr), двумя (Mg, Mn, Fe, Со, Ni, Zn, Cd) и четырьмя (Mg); содержащие
несколько анионных форм: Со(Н2РО4)2·2H3PO4,
NaH2PO4·Na2HPO4 (используется при
получении триполифосфата Na). MnHPO4·3H2O во влажной среде в их объеме
возникают и растут жидкие и твердые включения продуктов распада исходной кислой
соли на менее протонированную соль и свободную кислоту. Что
касается химических свойств, то фосфаты ведут себя аналогично другим солям. В
основном, им свойственны реакции по обменному механизму с солями, щелочами,
оксидами и кислотами с образованием недиссоциирующего или слабодиссоциирующего
вещества [6],[7],[8].
1.3 Возможности и области
практического применения
.3.1 Применение фосфорной кислоты
Область применения фосфорной кислоты поистине огромна, ниже приведен
перечень некоторых из них:
Производство удобрений.
Для этих целей используется большая часть всей добываемой
фосфорной кислоты. Каждый год лишь при производстве удобрений повсеместно
используется свыше 90 процентов фосфорсодержащей руды. К основным
производителям удобрений данного типа можно отнести Россию, США и Марокко,
тогда как к основным потребителям можно отнести практически все
Западноевропейские, Азиатские и Африканские страны.
Соли фосфорной кислоты потребляются растениями в виде
анионов, а также соли полифосфорных кислот при проведении гидролиза. Фосфор
используется растениями при образовании наиболее важных своих частей, а именно
семян и плодов. Также за счет фосфорной кислоты увеличивается зимостойкость
растений, они становятся устойчивей к засухе. Особенно важным условием является
применение фосфорсодержащих удобрений в северных регионах с непродолжительным
вегетативным периодом. Благотворно она воздействует и на саму почву, вызывая
активное развитие почвенных бактерий.
Пищевая промышленность.
Е338 (ортофосфорная кислота) относится к группе
антиоксидантов - добавок, защищающих продукты питания от окисления и изменения
цвета. Ортофосфорная кислота применяется для подкисления продуктов питания и
напитков. Она обеспечивает острый или кислый вкус. От природных подкислителей,
например, лимонной кислоты, ее отличают низкая стоимость и легкость получения,
что позволяет ее широко использовать при изготовлении: Хлебопекарных порошков;
Плавленых сыров; Колбас; Сахара; Ароматизированных напитков - кока-колы,
пепси-колы, спрайта. Хотя ортофосфорная кислота как пищевая добавка разрешена к
применению в большинстве стран, в результате многих исследований было
установлено ее вредное воздействие на организм. Так, она нарушает
кислотно-щелочной баланс, увеличивая его кислотность. Это может провоцировать
развитие различных заболеваний, например, кариеса и остеопороза. Частое
употребление ортофосфорной кислоты в составе различных продуктов может вызывать
нарушения работы пищеварения - рвоту, тошноту. Также длительное применение
продуктов с этой пищевой добавкой может привести к отвращению к пище и потере
веса.
Звероводство.
Незаменимым веществом для профилактики камней в почках и
повышенной кислотности желудка является фосфорная кислота.
Деревообрабатывающая промышленность.
Растворы фосфорной кислоты используются в
деревообрабатывающей промышленности для пропитки древесины, благодаря чему
дерево становится негорючим.
Производство строительных материалов и бытовой химии.
С применением данной кислоты производятся устойчивые к
пламени лакокрасочные материалы, такие как: эмаль, лак и пропитки, а также
огнестойкий фосфатный пенопласт, плиты, изготовленные из древесины и иного рода
стройматериалы.
Соли фосфорной кислоты используются, чтобы смягчить воду,
также они содержатся в составе моющих средств и средств, удаляющих с накипь
Медицина.
Ортофосфорная кислота широко применяется в
стоматологии при пломбировании зубов. Ею протравливают зубную эмаль перед
процедурой. Основной сложностью является невозможность проконтролировать
глубину и степень деминерализации дентина и эмали, а также ее полное удаление
перед началом пломбировки. Остатки ортофосфорной кислоты могут привести к
снижению прочности бондинга и образованию «кислотной мины». Также в
незначительных количествах ортофосфорная кислота применяется в составах отбеливателей
для зубов.
В результате промышленных опытов доказана
целесообразность применения фосфорной кислоты для интенсификации
производства обесфторенных фосфатов. Обработка апатитового концентрата
небольшими количествами фосфорной и кремнефтористо-водородной кислот ( 2 % от
количества апатитового концентрата) позволяет вести процесс гидротермической
переработки без добавления кремнезема и снизить температуру процесса
обесфторивания на 50 - 100 С по сравнению с температурой обесфторивания шихты,
содержащей на 100 кг апатитового концентрата 2 кг песка, или достигать большей
производительности при одинаковом температурном режиме процесса. [9]
1.3.2 Применение фосфатов
Соли фосфорной кислоты (фосфаты) широко
используются в различных отраслях промышленности, в частности в нефтедобыче и электротехнике,
при производстве
строительных материалов, лаков, красок и различных специальных покрытий, а также зубных паст
и стоматологических
цементов.
Фосфаты применяются при получении различных видов
стекла, включая оптическое, и фарфора. В тяжелой промышленности они используются в литейном
производстве и металлообработке, а в легкой - при производстве текстиля и кожи.
В химической промышленности фосфаты нашли самое
широкое применение при изготовлении моющих и чистящих средств, реагентов для тушения пожаров,
фотоматериалов, бумаги.
В сельском хозяйстве фосфаты различных металлов используются для производства
удобрений и кормов для животных. Ниже приведены названия наиболее часто
применяемых для технических целей фосфатов и их химические формулы:
Таблица 4.
Наиболее часто применимые для технических целей фосфаты
|
Моноалюминий
фосфат Al(Н2PO4)3 Триалюминий фосфат AlPO4
Триполифосфат алюминия AlН2P3O10
Метафосфат алюминия [Al(PO3)3]n
Моноаммоний фосфат NH4H2PO4
Диаммоний фосфат (NH4)2HPO4
Монобарий фосфат Ва(Н2PO4)2
Фосфат бора ВPO4 Монокальций фосфат Са(H2PO4)2
Дикальций фосфат СаHPO4 Трикальций фосфат Са5(PO4)3ОН
β-Трикальций фосфат Са3(PO4)2 Пирофосфат
кальция Са2P2O7 Фосфат карбамида СО(NH2)2 x H3PO4
Пирофосфат меди (II) Cu2P2O7
Ортофосфат железа (III) FePO4 Пирофосфат железа (III) Fe4(P2O7)3
Монолитий фосфат LiH2PO4
Трилитий фосфат Li3PO4
Фосфат магния Mg(H2PO4)2
Димагний фосфат MgHPO4 Тримагний фосфат Mg3(PO4)2
Метафосфат магния [Mg(PO3)2]n
Мономарганец фосфат Mn(H2PO4)2
Димарганец фосфат MnHPO4 Тримарганец фосфат Mn3(PO4)2
Фосфонаты Монокалий фосфат КH2РО4 Дикалий фосфат К2HРО4 Трикалий фосфат К3РО4 Тетракалий пирофосфат К4Р2О7
Триполифосфат калия К5Р3О10
Полифосфат калия (КРО3)n
Мононатрий фосфат NaH2PO4
Динатрий фосфат Na2HPO4
Тринатрий фосфат Na3PO4
Кислый пирофосфат натрия Na2H2Р2О7
Тринатрий пирофосфат Na3HР2О7
Тетранатрий пирофосфат Na4Р2О7
Триполифосфат натрия Na5Р3О10
Триметафосфат натрия (NaРО3)3
Гексаметафосфат натрия (NaРО3)n
Моноцинк фосфат Zn(H2PO4)2
Трицинкфосфат Zn3(PO4)2
Пирофосфат цинка Zn2P2O7
|
[10]
Фосфаты являются одними из традиционных и
широко используемых влагосвязывающих агентов в переработке мяса и рыбы,
кондитерской и молочной промышленности.
Фосфаты, к применению в пищевой промышленности разрешены моно-, ди-, три-, пиро- и поли- фосфаты.
Специфика
применения фосфатов в разных сферах пищевой
отрасли сильно различается. Например в мясном и рыбном производстве используют пищевые фосфаты обладающие высокой растворимостью в
воде и солевых растворах:
1. ди - или пирофосфаты Е450, соли пирофосфорной
кислоты Н4Р2О7;
2. трифосфаты Е451, соли триполифосфорной кислоты
Н5Р3О10;
. полифосфаты Е452, смеси солей линейно
конденсированных полифосфорных кислот.
Фосфаты
бывают кислыми,
нейтральными и щелочными. В целом для эмульгированных мясных продуктов лучше
всего подходят фосфаты с рН от 7,0 до 8,3, а при приготовлении
рассолов для цельномышечных мясных продуктов используют фосфаты с рН от 8,3
до 9,3.
Дифосфаты обладают сходными с АТФ свойствами и могут восстанавливать естественную
способность белков связывать влагу.Дифосфаты нейтрализуют поперечную сшивку между
актином и миозином, образующуюся в процессе посмертного окоченения ( rigor
mortis) и содействуют распаду актомиозинового комплекса на отдельные волокна.
Фосфаты ослабляют электростатическое взаимодействие внутри актомиозинового
комплекса. Только фосфаты могут расщеплять актин и миозин, и
это является главной причиной повсеместного распространения фосфатов.
Практически все пищевые фосфаты и их смеси, используемые в
мясоперерабатывающей и рыбной промышленности, имеют щелочную реакцию. Добавка
щелочных фосфатов к мясу и рыбе приводит к возрастанию рН, и как следствие, к
увеличению влагосвязывающей способности белков.
Кислые фосфаты используют для размягчения и
набухания соеденительнотканных белков и улучшения цветообразования.
Фосфаты увеличивают ионную силу мышечной ткани и изменяет соотношение
активированных и набухающих белков, способствуя иммобилизации добавленной воды
и эмульгированию жира.
Благодоря вышеперечисленным действиям пищевые фосфаты увеличивают выход
готовой продукции, сокращают потери и миграцию влаги при размораживании,
термической обработке, сокращают продолжительность посола, улучшают текстуру и
консистенцию, цвет и вкус готовых мясо и рыбопродуктов, замедляют прогорание
жиров.
Обработанные пищевыми фосфатами мясные, рыбные и морепродукты более сочные, нежные и
более ценные с пищевой точки зрения. Обработка фосфатами мяса, рыбы и
морепродуктов осуществляется только до тепловой обработки, т.е.пищевые фосфаты
взаимодействуют с нативными, неденатурированными белками.
Смеси фосфатов
На сегодняшний день, индивидуальные фосфаты редко используются в современных промышленных технологиях.
Обычно применяются смеси
фосфатов имеющие опрделённые свойства
такие как, значение рН, растворимость в холодной воде и растворах соли и т.д.
При самостоятельном составлении смесей учитываю свойства
индивидуальных пищевых фосфатов. В частности, хорошо растворимые в холодной
воде длинноцепочечные полифосфаты обычно составляют основу фосфатных смесей для шприцовочных
рассолов.
Фосфатные смеси для эмульгированных сосисок и колбас преимущественно состоят из
короткоцепочечных фосфатов, наиболее активным компонентом которых в отношении
мышечных белков является пирофосфат.
Монофосфаты демонстрируют хорошую буферную ёмкость, которая помогает стабилизировать
рН конечного продукта на длительное время, но сами не влияют на мышечные белки. Пирофосфаты и триполифосфаты лучше других способствуют
эмульгированию жира.
Нельзя забывать о том, что максимально разрешённые количества
фосфатов добавленные на 1 кг. мясного сырья в пересчёте на Р2О5, не должны
превышать 5 грамм. Максимально разрешённые количества тех же фосфатов в рыбные
продукты зависят от их вида, и обычно составляют от 1 до 5 гр. на кг.в
пересчёте на Р2О5.
Потребление сверх разрешённых норм фосфатов может негативно
отразиться на здоровье человека, из-за чего происходит ухудшение усвоения
кальция, что приводит к отложению в почках кальция и фосфора, и способствует
развитию остеопороза.[11]
Фосфатные удобрения.
Фосфор, как азот и калий, необходимы для нормального развития
растений. Источником фосфора для растений является фосфаты почвы, главным
образом фосфат кальция Са3(РО4)2. Но в большинстве почв фосфата кальция мало.
Кроме того, в связи с его нерастворимость в воде он практически недоступен для
растений. Поэтому внесение в почву растворимых фосфатов, так называемых
фосфорных удобрений, имеет чрезвычайно большое значение для повышения урожая
сельскохозяйственных культур.
Характеристика важнейших фосфорных удобрений.
Суперфосфат
Суперфосфат простой получают обработкой размолотого апатита
или фосфорита серной кислотой. При действии серной кислоты на фосфатное сырье
происходит разложение апатита или фосфорита с образованием водорастворимого
однозамещенного фосфата кальция Ca(H2PO4)2 и
гипса CaSO4, не растворимого в воде:
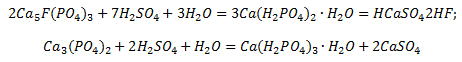
Гипс остается в составе удобрения и занимает около 40% его массы,
фосфора в таком суперфосфате почти вдвое меньше, чем в исходном сырье. По этой
причине низкопроцентные фосфориты не используют для изготовления суперфосфата.
Простой суперфосфат из апатита содержит 14-20% усвояемого фосфора в
расчете на Р2О5. Большая часть фосфора в суперфосфате
находится в виде монокальцийфосфата, 5-5,5% массы удобрения содержится в виде
свободной фосфорной кислоты. В суперфосфате находится небольшое количество
дикальцийфосфата СаНРО42·Н2О, а также трикальцийфосфата,
фосфатов железа и алюминия. Суперфосфат оценивается по содержанию в нем
усвояемого фосфора, то есть растворимого в воде и цитратном растворе (аммиачный
раствор лимонно-кислого аммония). Усвояемый фосфор в суперфосфате составляет
88-98% общего содержания.
Суперфосфат выпускается в виде гранул размером 1-4 мм. Гранулированный
суперфосфат обладает хорошими физическими свойствами: не слеживается, сохраняет
хорошую рассеваемость. При гранулировании свободная фосфорная кислота
нейтрализуется и суперфосфат высушивается, поэтому содержание воды и свободной
фосфорной кислоты снижается соответственно до 1-4% и 1-1,5%.
При нейтрализации свободной кислотности суперфосфата аммиаком получают аммонизированный
суперфосфат с содержанием азота около 1,5-3%.
Двойной суперфосфат в
отличие от простого имеет высокое содержание усвояемого фосфора в расчете на Р2О5
- 42-49% и не содержит гипса. Фосфор находится в нем в виде водорастворимого
монокальцийфосфата Ca(H2PO4)2·Н2О и
небольшого количества свободной фосфорной кислоты (2,5-5,0%).
При производстве двойного суперфосфата апатит (или фосфорит)
обрабатывают серной кислотой. Ее берут больше, чем при производстве простого
суперфосфата, для того чтобы получить не монокальцийфосфат, а фосфорную
кислоту, которой затем обрабатывают новую порцию сырья и получают двойной
суперфосфат - Ca(H2PO4)2·Н2О.
Химические и физические свойства, применение и эффективность его такие
же, как и простого. Только при удобрении культур, положительно реагирующих на
гипс (клевер и другие бобовые), более сильное положительное действие оказывает
простой суперфосфат.
В почве фосфор суперфосфата вследствие химического взаимодействия с
полуторными окислами, карбонатами кальция и магния (или поглощенным кальцием)
превращается в не растворимые в воде фосфаты, менее доступные для растений,
т.е. подвергается химическому поглощению, или ретроградации. На почвах,
насыщенных основаниями, - черноземах и особенно сероземах и других карбонатных
почвах - образуются слаборастворимые фосфаты кальция (октокальцийфосфат и др.).
В кислых дерново-подзолистых почвах и красноземах, содержащих большое
количество подвижных форм полуторных окислов, образуются фосфаты алюминия и
железа, фосфор из которых слабо доступен для растений. Чем больше содержится в
почве подвижных форм полуторных окислов, тем сильнее происходит химическое
поглощение фосфора суперфосфата. В результате этого уменьшается использование
фосфора растениями и снижается его эффективность.
Фосфор суперфосфата почти полностью закрепляется в месте его внесения и
очень слабо передвигается в почве. При внесении до посева в качестве основного
удобрения суперфосфат следует заделывать под плуг, с тем чтобы удобрение
находилось в более глубоком и постоянно влажном слое почвы, где размещается
основная масса деятельных корней растений. Особое значение глубокая заделка
суперфосфата имеет в засушливых условиях.
При мелкой заделке суперфосфата основная масса удобрения оказывается в
верхнем слое почвы, который быстро высыхает. Корни в этом слое отмирают,
поэтому фосфор удобрения хуже используется растениями. Поверхностное внесение
его в подкормку без заделки (под зерновые и другие культуры сплошного посева)
малоэффективно.
Связывание фосфора суперфосфата в кислых почвах происходит сильнее при
более полном контакте удобрения с почвой (разбросное внесение, мелкие размеры
частиц), фосфор гранулированного суперфосфата меньше закрепляется почвой, чем
порошковидного. На нейтральных и карбонатных почвах фосфор удобрения лучше
усваивается при более равномерном распределении в почве и гранулирование
суперфосфата существенно не повышает эффективность удобрения.
Закрепление фосфора суперфосфата, особенно гранулированного, в кислых
почвах снижается при местном внесении его в рядки или гнезда при посеве, а
также при ленточном внесении до посева. Поэтому и эффективность
гранулированного суперфосфата на кислых почвах при одинаковых способах внесения
(как при разбросанном внесении до посева, так и при местном внесении в рядки или
лунки при посеве) значительно выше, чем порошковидного. При рядковом внесении
небольшие дозы суперфосфата дают такие же прибавки урожая, как и значительно
большие дозы при разбросном допосевном внесении. Это обусловлено снижением
химического связывания фосфора вследствие уменьшения площади соприкосновения
удобрения с кислой почвой, а также тем, что удобрение размещается вблизи
прорастающих семян и обеспечивается питание растений легкодоступным фосфором с
самого раннего периода роста. В рядки при посеве зерновых, зернобобовых
культур, льна и сахарной свеклы вносится 10-15 кг P2O5 на
1 га в виде суперфосфата; в лунки при посадке картофеля и овощных культур -
15-30 кг Р2О5на 1 га; при посеве кукурузы - 4-8 кг P2O5
на 1 га.
Коэффициент использования фосфора из суперфосфата в год его внесения
при допосевном его применении вразброс под вспашку составляет 10-15% внесенного
количества, а при рядковом внесении возрастает в полтора - два раза. За 2-3
года коэффициент использования фосфора суперфосфата составляет примерно 40%.
Для получения высокого урожая сахарной свеклы, кукурузы, льна,
картофеля, зерновых, овощных и других культур целесообразно сочетать внесение
суперфосфата в основном удобрении до посева с внесением небольшой дозы его в
рядки или лунки при посеве. При этом создаются хорошие условия питания растений
фосфором как в первый период роста за счет рядкового удобрения, так и в
последующие периоды за счет основного удобрения, внесенного под плуг. Однако на
почвах с высоким содержанием подвижного фосфора или при внесении очень высоких
доз фосфорных удобрений до посева применение суперфосфата в рядки при посеве
может не давать эффекта.
Преципитат, томасшлак, термофосфаты, обесфторенный фосфат
Преципитат - СаНРО4·2Н2О - двухзамещенный фосфат кальция
(дикальцийфосфат) содержит 38% фосфора в расчете на P2O5.
Получается путем кислотной переработки фосфатов при осаждении фосфорной кислоты
известковым молоком или мелом, а также в качестве отхода при желатиновом
производстве.
Фосфор преципитата не растворим в воде, но растворяется в
лимонно-кислом аммонии и хорошо усваивается растениями. Удобрение обладает
ценными физическими свойствами: не слеживается, сохраняет хорошую
рассеваемость, может смешиваться с любым удобрением. Преципитат можно применять
как основное удобрение под различные культуры на всех почвах. Его фосфор
меньше, чем суперфосфата, закрепляется в почве, поэтому преципитат более
эффективен на богатых полуторными окислами кислых почвах и карбонатных
сероземах. На черноземах преципитат близок по эффективности к суперфосфату.
Фосфатшлак мартеновский - побочный продукт переработки мартеновским способом
богатых фосфором чугунов на сталь и железо. Содержит фосфор в основном в виде
силикофосфатов и свободную окись кальция. Состав может быть условно представлен
как 4СаО+P2O5·CaSiO3. Применяемый в качестве
удобрений фосфатшлак должен содержать не менее 10% растворимого в 2%-ной
лимонной кислоте фосфора (в расчете на Р2О5) и иметь
тонкий помол (80% продукта должно проходить через сито с диаметром 0,18 мм).
Может использоваться как основное удобрение на всех почвах, но наиболее
эффективен благодаря щелочным свойствам на кислых дерново-подзолистых и серых
лесных почвах. Фосфатшлак нельзя смешивать с аммонийными удобрениями во
избежание потерь азота в форме аммиака.
Подобными свойствами обладает томасшлак- 4СаО·P2O5+4СаО·P2O5·CaSiO3
- побочный продукт при переработке богатых фосфором чугунов на сталь и железо
по щелочному способу Томаса. В мировом производстве фосфорных удобрений
томасшлак занимает существенное место. В нашей стране томасшлак (производимый
из керченских руд) применяется в ограниченных количествах. В нем должно
содержаться не менее 14% растворимого в 2%-ной лимонной кислоте фосфора в
расчете на P2O5.
Термофосфаты - Na2O·3CaO·P2O5+SiO2 -
получают сплавлением или спеканием размолотого фосфорита или апатита с
щелочными солями - содой или поташом, или природными магниевыми силикатами, а
также с сульфатами калия, натрия и магния. При этом образуются усвояемые
растениями кальциево-натриевые или кальциево-калиевые фосфорнокислые соли, а
также другие фосфаты и силикофосфаты.
Термофосфаты содержат 20-30% лимонно-растворимого фосфора в расчете на
P2O5. По свойствам и эффективности они близки к
томасшлаку. Могут применяться как основное удобрение на всех почвах, но как
щелочные удобрения эффективнее на кислых почвах.
При сплавлении фосфорита или апатита с силикатами магния получаются
плавленые магниевые фосфаты. Они содержат 19-21% усвояемого
лимонно-растворимого фосфора в расчете на P2O5 и 8-14%
MgO, особенно эффективны на бедных магнием легких песчаных и супесчаных почвах.
Термофосфаты также применяют как основное удобрение и их нельзя смешивать с
аммонийными удобрениями.
Обесфторенный фосфат получают из апатита путем обработки водяным паром
смеси апатита с небольшим количеством кремнезема (2-3% SiO2 при
температуре 1450-1550°С. При этом разрушается кристаллическая решетка
фторапатита и удаляется фтор в газообразной форме, а фосфор переходит в
усвояемую (лимонно-растворимую) форму.
Обесфторенный фосфат содержит не менее 36% P2O5,
растворимой в 0,4%-ной НСl. Удобрение негигроскопично, не слеживается. Тонина
помола такова, что 95% продукта должны проходить через сито диаметром 0,15 мм.
Обесфторенный фосфат, так же как томасшлак, нельзя смешивать с
аммонийными удобрениями. Может применяться как основное удобрение на всех
почвах. На дерново-подзолистых и черноземных почвах по эффективности не
уступает суперфосфату.
Фосфоритная мука
Получается путем размола фосфорита до состояния тонкой муки. Фосфор в
ней содержится в виде соединений фторапатита, гидроксилапатита, карбонатапатита
(то есть находится в основном в форме трехкальциевого фосфата Са3(PO4)2.
Эти соединения не растворимы в воде и слабых кислотах и слабодоступны для
большинства растений.
Фосфоритная мука негигроскопична, не слеживается, может смешиваться с
любым удобрением, кроме извести. Туковая промышленность выпускает четыре сорта
фосфоритной муки с общим содержанием P2O5высший сорт -
30%; 1-й - 25; 2-й - 22; 3-й - 19%.
Для изготовления фосфоритной муки могут быть использованы
низкопроцентные фосфориты, непригодные для химической переработки в
суперфосфат. Фосфоритная мука - самое дешевое фосфорное удобрение.
Эффективность фосфоритной муки зависит от состава фосфоритов, тонины
помола, особенностей растений, свойств почвы и сопутствующих удобрений.
Фосфориты желвакового типа, более молодые по геологическому возрасту и не
имеющие хорошо выраженного кристаллического строения, доступнее для растений.
При их размоле получается мука, пригодная для непосредственного удобрения. Фосфориты
более древнего происхождения, имеющие кристаллическое строение (например,
фосфориты Каратау), труднодоступны и поэтому непригодны для приготовления
фосфоритной муки.
Эффективность фосфоритной муки увеличивается с повышением тонины
помола. Чем тоньше частицы, тем больше их поверхность и соприкосновение с
почвой и лучше происходит разложение фосфоритной муки под действием почвенной
кислотности до усвояемых растениями соединений. Значение тонины помола для
повышения эффективности фосфоритной муки особенно велико на почвах, имеющих
недостаточную кислотность для ее разложения, на оподзоленных и выщелоченных
черноземах. По стандарту не менее 80% частиц должно проходить через сито с
размером ячеек 0,18 мм,
Лишь немногие растения (люпин, горчица, гречиха и отчасти эспарцет,
горох и конопля) могут усваивать фосфор фосфоритной муки при нейтральной
реакции почвенного раствора, т. е. без предварительного разложения ее под
действием почвенной кислотности. В лаборатории Д. Н. Прянишникова было
установлено, что кислые выделения корней люпина сильно подкисляют почву, что
оказывает растворяющее действие на трехзамещенный фосфат, способствует его
переводу в усвояемую форму. Исследования Ф. В. Чирикова показали, что у
растений, способных усваивать фосфорит, отношение СаО : P2O5
в золе больше 1,3, а у растений, неспособных усваивать, - меньше 1,3.
Значительно большее потребление растениями кальция по сравнению с фосфором
приводит к обеднению питательной среды кальцием, в результате чего облегчается
переход Са3(PO4)2 в усвояемую форму.
Большинство растений - все злаки, лен, свекла, картофель - могут
использовать фосфорит только при определенной кислотности почвы, достаточной
для его разложения, поэтому на почвах с нейтральной реакцией (обыкновенные,
мощные и южные черноземы) применение фосфоритной муки малоэффективно. На кислых
дерново-подзолистых и серых лесных почвах, красноземах и выщелоченных
черноземах она не может уступать суперфосфату.
В разложении фосфоритной муки участвует не только актуальная, но и
потенциальная кислотность. Под влиянием почвенной кислотности фосфоритная мука
превращается -в усвояемый растениями дикальцийфосфат СаНPO4
Исследования показали, что на почвах, имеющих гидролитическую кислотность
меньше 2-2,5 мэкв на 100 г, разложение фосфоритной муки происходит слабо и
эффективность ее очень низкая. Чем больше гидролитическая кислотность, тем выше
эффективность фосфоритной муки. Однако действие ее зависит не только от
величины кислотности почвы, но и от емкости поглощения (Т) и степени
насыщенности основаниями (V).
При одной и той же гидролитической кислотности действие фосфоритной
муки тем выше, чем меньше емкость поглощения почвы .
Норма фосфоритной муки устанавливается также в зависимости от
кислотности почвы. На сильно- и средне-кислых почвах (рН 5,0 и меньше) можно
вносить фосфоритную муку в той же норме, что и суперфосфат, а на слабокислых
почвах - в двойной и даже тройной норме. На произвесткованных почвах
эффективность ее снижается.
Фосфоритная мука применяется как основное удобрение, вносить ее лучше заблаговременно,
с осени, и обязательно с глубокой заделкой под плуг. Наиболее эффективно
внесение ее вместе с навозом в пару под озимые культуры, а также под пропашные
культуры - сахарную свеклу, картофель, кукурузу и др. Положительное действие
фосфоритной муки продолжается в течение нескольких лет. Чем больше норма
фосфоритной муки, тем выше и продолжительнее ее действие.
Для увеличения содержания подвижного фосфора в кислых почвах
практикуется прием фосфоритования - внесения высоких норм фосфоритной муки. При
этом одновременно достигается некоторое снижение кислотности почвы.[12]
1.4 Методы синтеза фосфорной кислоты и
фосфатов
.4.1 Получение фосфорной кислоты
Сырье для производства фосфорной кислоты
В природе известно более 120 минералов. Наиболее распространены
и имеют промышленное значение минералы апатитовой группы - фторапатит Ca10F2(PO4)6,
гидрокисдапатит Ca10(PO4)6(OH)2,
хлорапатит.
К фосфатам группы апатита относятся минералы с общей формулой
Ca10R2(PO4)6, где R - F, Cl, OH.
Некоторая часть Са в апатитах замещена Sr, Ba, Mg, Mn, Fe и
трехвалентными редкоземельными элементами в сочетании со щелочными металлами.
Мощность пластов достигает 200 м. Минералы, входящие в руду
отличаются по физико-химическим и флотационным свойствам, что позволяет при
флотации обогащать полученный концентрат с содержанием целевого продукта
92-93%.
Чистый кальций-фторапатит содержит: 42,22% Р2О5;
55,6% СаО, 3,76% - F.
По происхождению фосфаты бывают магматические и осадочные.
Магматические, или собственно апатитовые породы образовались либо при
непосредственном застывании расплавленной магмы, либо в отдельных жилах в
процессе кристаллизации магматического расплава (гематитовые жилы), либо при
выделении из горячих водных растворов (гидротермальные образования), либо при
взаимодействии магмы с известняком (контактовые).
Апатитовые породы имеют зернистую крупнокристаллическую
структуру и характеризуются отсутствием полидисперсности и микропористости.
Осадочные фосфаты - фосфориты. Они образовались в результате
выветривания горных пород, взаимодействия с другими горными породами - и
отложения их как в рассеянном состоянии, так и с образованием крупных
скоплений.
Фосфоритные руды отличаются от апатитовых высокой
дисперсностью содержащихся в них фосфатных минералов и тесным срастанием их с
сопутствующими минералами (примесями) Фосфориты быстрее растворяются в
кислотах, чем апатиты.
Лучшее сырье для получения экстракционной фосфорной кислоты -
апатитовый концентрат, содержащий 2% R2О3или 5% от общего содержания Р2О5.
В нем почти отсутствуют карбонаты. Вследствие этого на его разложение
расходуется наименьшее (по сравнению с другими видами сырья) количество серной
кислоты.
Другие виды фосфоритов - песчанистые (актюбинские,
щигровские), глинисто-глауконитовые (вятские, рязанско-егорьевские) даже после
обогащения, достигаемого современными методами, в настоящее время не
применяются для получения фосфорной кислоты. Они могут быть использованы в
смеси с апатитовым концентратом. Количество добавляемого апатита должно
обеспечить такое отношение R2O3: Р2О5, которое позволяет осуществить процесс с
минимальными потерями.[13]
Термический способ получения ортофосфорной кислоты
Термический метод заключается в высокотемпературном
восстановлении фосфатов и возгонке в электрических печах элементарного фосфора
в присутствии углерода и кремнезема
Са3(РО4)2 + 5С + 2SiO2
= P2 + 5CO + Ca3Si2O7 - 1460
кДж/моль.
Полученный фосфор окисляют до фосфорного ангидрида, а затем
последний гидратируют водой; в результате образуется ортофосфорная кислота
2Р2 + 5О2 = 2Р2О5; Р2О5 + 3Н2О = 2Н3РО4.
Далее, осуществляют конденсацию Н3РО4 и улавливание тумана из
газовой фазы.
По принципу охлаждения газов процессы получения фосфатов на
основе элементарного фосфора могут быть классифицированы на системы с
изменением агрегатного состояния хладагента и системы без изменения агрегатного
состояния хладагента. Хладагентами в любом случае являются вода или фосфорная
кислота
Главное преимущество термического способа, по сравнению с
экстракционным, заключается в возможности переработки любых видов сырья, в том
числе и низкокачественных фосфоритов, и получение кислоты высокой чистоты. [13]
Экстракционный способ получения фосфорной кислоты
Кислотный метод основан на вытеснении сильными кислотами
фосфорной кислоты из фосфатов. Наибольшее распространение на практике нашел
метод сернокислотной экстракции.
Процесс протекает по следующему суммарному уравнению:
Ca5F(PO4)3 + 5H2SO4
= 5CaSO4(тв) + 3Н3РО4 + HF.
В зависимости от температуры процесса и концентрации Р2О5 в
растворе сульфат кальция (фосфогипс) выделяется в виде CaSO4·2H2O (дегидратный
режим), СаSO4·0,5H2O (полугидратный режим) и СаSO4 (ангидридный режим).
Промышленное распространение нашли первые два режима.
Образующийся фтористый водород взаимодействует с H2SiO3
4HF + H2SiO3 = SiF4 + 3H2O.
При этом SiF4 частично выделяется в газовую фазу,
а частично остается в растворе ЭФК в виде H2SiF6.
Обычно получаемая экстракционная кислота загрязнена примесями
сырья и имеет низкую концентрацию (25-32% Р2О5), поэтому
ее необходимо упаривать до более высокой концентрации.
Основными преимуществами экстракционного процесса является
его простота и возможность производства более дешевой Н3РО4.
Недостаток - получаемая ЭФК загрязнена примесью полуторных оксидов (Al2O3,
Fe2O3), соединениями фтора и СаSO4.[14]
Производство фосфорной кислоты дигидратным и полугидратным
методами
Существуют различные способы получения фосфорной кислоты
разной концентрации с выделением дигидрата сульфата кальция. Наиболее удобна
классификация и оценка разных способов в зависимости от концентрации получаемой
кислоты, так как именно она - основной показатель качества продукции и один из
главных технологических параметров, определяющих все другие - температуру,
длительность взаимодействия реагентов, форму и фильтрующие свойства
выделяющихся кристаллов сульфата кальция и т.п.
В настоящее время дигидратным способом производят Н3РО4
с содержанием 20-25% Р2О5 (обычно из низкосортного сырья
- бедных фосфоритов) и 30-32% Р2О5 (из
высококачественного сырья - апатитового концентрата)
При получении кислоты, содержащей 30-32% Р2О5
полугидратно-дегидратным способом, процесс осуществляют в две стадии. Первую
стадию - разложение фосфата - проводят при таких условиях, когда сульфат
кальция выделяется в виде относительно устойчивого полугидрата, не
оводняющегося в процессе экстракции до гипса. Во второй стадии выделившийся
полугидрат, не отделенный от жидкой фазы, перекристаллизовывают в реакционной
пульпе в дигидрат в присутствии затравочных кристаллов гипса с выделением
крупных, хорошо образованных и быстро фильтрующих кристаллов.
Преимуществами указанного способа является максимальное (до 98,5%) извлечение из сырья фосфорной
кислоты в раствор при минимальном расходе серной кислоты и получение гипса
высокого качества, содержащего не более 0,3% общей Р2О5
(вместо обычных 0,5-1,5%) и 0,02-0,08% водорастворимой Р2О5. Это
объясняется предотвращением замещения сульфат-ионами в кристаллической решетке
осадка и высвобождением ионов НРО4-, которые удерживались (адсорбировались на
поверхности первоначально выделившихся частиц твердой фазы, так как полугидрат
при этом предварительно перешел в жидкую фазу.
В отличие от применяемого в настоящее время дигидратного
метода полугидратным методом можно поучить кислоту, содержащую 45-50% Р2О5.
Это позволяет увеличить мощность действующих цехов в 1,5 - 1,8 раза и несколько
уменьшить количество отхода - сульфатного остатка.
Для производства концентрированных фосфорных и сложных
удобрений требуется фосфорная кислота, содержащая 37-55% Р2О5 и более, а для
получения полифосфатов аммония и концентрированных жидких удобрений - кислота,
содержащая 72-83% Р2О5. Поэтому во многих случаях экстракционную фосфорную
кислоту подвергают концентрированию методом выпаривания.
На стадии опытной разработки находится получение фосфорной
кислоты, содержащей до 55% Р2О5 ангидритным методом (без
упарки). Наиболее просто получают кислоту, содержащую 53-55% Р2О5,
поскольку процесс сводится только к выпариванию воды и не сопровождается
дегидратацией фосфорной кислоты и образованием фосфорного ангидрита не в
орто-форме. Однако и этот процесс осложняется сильной коррозией аппаратуры и
выделением примесей, содержащихся в кислоте.
Горячая фосфорная кислота оказывает сильное корродирующее
действие на большинство известных металлов, сплавов и силикатно-керамических
материалов. Выделяющиеся в процессе упаривания осадки могут забивать
аппаратуру, в результате чего резко снижается ее производительность. Это
затрудняет использование для упаривания фосфорной кислоты типовых и широко
распространенных выпарных установок. Кислота, содержащая 53 - 55% Р2О5, может
быть получена из относительно мало загрязненных фосфатов - апатитового
концентрата или обогащенных высокосортных фосфоритов [15]
Производство фосфорной кислоты другими методами
В промышленности представляет интерес метод получения Н3РО4,
основанный на окислении фосфора водяным паром на медно-циркониевом
катализаторе, оптимальные условия процесса: t = 973°C, соотношение водяного
пара и фосфора равно 20:1
Р4 + 16Н2О = 4Н3РО4
+ 10Н2 + 1306,28 кДж.
В лабораторных условиях Н3РО4 получают
3Р + 5HNO3 + 2H2O = 3Н3РО4
+ 5NO
Экстракция фосфорной кислоты из фосфатов серной кислотой
обладает существенными недостатками: большой расход серной кислоты (2,5 - 3,1 т
моногидрата на 1 т Р2О5) и необходимость перерабатывать или складировать
значительное количество отхода - фосфогипса (4,5 -6,0 т на 1 т Р2О5 в пересчете
на сухое вещество), переработка которого в серную кислоту связана с выпуском
одновременно значительных количеств цемента или извести, не везде находящих
достаточный сбыт. Поэтому непрерывно изыскиваются возможности экстрагирования
фосфорной кислоты другими неорганическими кислотами - азотной, соляной,
фтористо- и кремнефтористоводородной.
Основными затруднениями при разложении фосфатом азотной или
соляной кислотой является отделение фосфорной кислоты от хорошо растворимых
нитрата и хлорида кальция. При использовании кремнефтористой или
фтористоводородной кислот выделяется осадок, легко отделяемы фильтрацией.
Однако в этом случае регенерация кислоты требует применение высоких температур,
но зато можно осуществлять процесс без дополнительных реагентов - кислот,
используя фтор, содержащийся в сырье.[13]
1.4.2 Получение фосфатов
Содержание в растворе различных анионных форм зависит от рН раствора. Все
фосфаты щелочных металлов и аммония хорошо растворимы в воде. Для остальных
металлов растворимы лишь дигидрофосфаты. Растворы средних фосфатов щелочных
металлов вследствие гидролиза имеют сильнощелочную реакцию. (0,1 М раствор Na3PO4 имеет рН 12,7). В этих условиях, при
наличии средних фосфатов щелочных металлов в качестве реактива, получить
средние фосфаты других металлов не удаётся - из растворов осаждаются либо
основные соли, либо гидроксиды и оксиды:
4Na3PO4 + 5CaCl2 + H2O = Ca5(PO4)3OH
+ 10NaCl + Na2HPO4
AgNO3 + 2Na3PO4 + H2O
= Ag2O + 2Na2HPO4 + 2NaNO3
Поэтому, для получения средних солей фосфорной кислоты необходимо
уменьшить рН. Это достигается использованием раствора гидрофосфата натрия в
присутствии аммиака:
2Na2HPO4 + CaCl2 + 2 NH3
= Ca3(PO4)2 + 2 NH4Cl + 4NaCl
Также получить фосфаты (как средние, так и кислые) можно путём обменных
реакций, где имеет место масса различных вариаций реактивов:
.Непосредственное взаимодействие металла с фосфорной кислотой:
2H3PO4+3Ca= Ca3(PO4)2+
3H2
. Реакция
между основным оксидом и фосфорной кислотой:
2H3PO4+3CaО= Ca3(PO4)2+
3H2О
. Обменная
реакция между солями, одна из которых обязательно содержит фосфат- или ди- гидрофосфат-анион:
2Na3PO4 + 3CaCl2 = Ca3(PO4)2
+ 6NaCl.
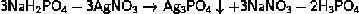
.
Реакция обмена фосфорной кислоты
и гидроксида:
2Н3PO4 + 3Ca(OH)2 = CaНРО4·2H2О
2Н3PO4 + 3NaOH = Na3PO4
+ 3H2О
5. Реакция обмена фосфата и гидроксида:
2Na3PO4 + 3Ca(OH)2 = Ca3(PO4)2
+ 3 NaOH
6. Взаимодействие дигидрофосфатов или гидрофосфатов с щёлочью:
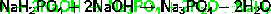
Существует возможность получения фосфата непосредственно из простого
вещества фосфора. Белый фосфор растворяют в щелочном растворе перекиси
водорода:
Р4 + 10Н2О2 + 12NaOH = 4Na3PO4
+ 16H2O
Основным методом контроля чистоты полученного нерастворимого в воде
фосфата, является его обильное промывание водой при фильтровании осадка. Что
касается растворимых в воде фосфатов аммония и щелочных металлов, для контроля
чистоты необходима аккуратная и неодноразовая кристаллизация, а также
предварительная фильтрация раствора от возможных нерастворимых примесей.
Все вышеприведенные методы синтеза фосфатов применимы как в лабораторных
условиях, так и в промышленности[3],[4].
Часть 2. Зачётный синтез. Синтез
фосфата висмута (|||)
.1 Теоретическая часть
2.1.1
Общая характеристика синтезируемого вещества. Возможные методики синтеза
Фосфат
висмута (|||) (BiPO4 ) - неорганическое соединение, соль металла висмута
<#"731862.files/image014.gif"> [16],
[17], [18]
Для выполнения зачётного синтеза, был избран вариант получения BiPO4 №3, ввиду наличия в учебной
лаборатории необходимых реактивов.
2.1.2 Перечень используемых реактивов
и химической посуды
Для выполнения синтеза необходимы: Bi(NO3)3·5H2O , Na2HPO4, HNO3, дистиллированная вода, весы, чашка Петри, шпатель,
стеклянная палочка, химический стакан термоустойчивый(объём от 100мл.),
пипетка, груша, воронка Бюхнера, колба Бюнзена, фильтровальная бумага,
фарфоровая чашка, калька, сушильный шкаф, микропробирки. Вещества необходимые для
исследования свойств полученного вещества: H2SO4(разб), H2SO4(конц), K2Cr2O7, KI, AgNO3, H2O.
2.1.3 Условия проводимого синтеза
Синтез может проводиться в обычных условиях, то есть при комнатной
температуре(около 20 0С) и при атмосферном давлении.
2.1.4 Техника безопасности
Аккуратная работа с солями. Обязательно избегать попадания в ротовую
полость и пищевод. Осторожное обращение с концентрированной азотной кислотой.
Забор кислоты производить исключительно под вытяжкой.
2.1.5 Расчёты
Масса получаемого вещества: 4,1 г. BiPO4
Bi(NO3)3 + Na2HPO4 =
BiPO4 + 2NaNO3 + HNO3
М (BiPO4) = 304 г/моль
n (BiPO4) = 0,0135 моль
m (Bi(NO3)3
* 5H2O) = 485 * 0,0135 = 6,55 (г)
M (Na2HPO4) = 142 г/моль
m (Na2HPO4) = 142 * 0,0135 = 1,917 (г)
s25C (Na2HPO4) = 7,66 г.
V (H2О) = 25 мл.
2.2 Практическая часть
.2.1 Обоснование методики синтеза
Готовят насыщенные растворы Bi(NO3)3·5H2O и Na2HPO4. Раствор Na2HPO4 должен быть
предварительно подкислен азотной кислотой. Затем оба раствора смешиваются. Если
осадок не выпадает, значит раствор был сильно подкислен, в таком случае
необходимо добавить воды и выкристаллизовать вещество. При получении осадка,
его отсасывают и промывают дистиллированной водой, а затем сушат в сушильном
шкафу при температуре не менее 50 С. Данный метод позволяет эффективно получить
вещество, с наибольшим выходом, ввиду исключения затрат и потерь на количестве
стадий синтеза.
2.2.2 Изучение полученного вещества.
Качественные реакции
При добавлении в полученное вещество AgNO3 был получен жёлтый осадок, что традиционно доказывает
принадлежность соединения к классу фосфатов.
После добавления к веществу K2Cr2O7, было получено ярко-оранжевое соединения бихромата висмута,
что является качественной реакцией на катион висмута (III).
Далее была проведена ещё одна качественная реакция на катионы висмута,
путём добавления KI. Было получено
комплексное соединение висмута ярко-жёлтого цвета.
С водой и разбавленной серной кислотой вещество не прореагировало, что
доказывает его нейтральное отношение к воде, то есть его нерастворимость.
При добавлении концентрированной серной кислоты, имеет место обменная
реакция, которая на практике происходит без видимых отображений.
К нагреванию до 90-100 0С вещество оказалось абсолютно
устойчиво
Таким образом, было установлено, что полученное вещество на самом деле
относится к классу фосфатов, более того, содержащего трёхзарядный катион
висмута. Из свойств, была продемонстрирована нерастворимость в воде и высокая
термическая устойчивость, которая, в принципе, характерна для всех фосфатов,
исключая фосфаты щелочных металлов, ртути и аммония.
2.2.3 Выводы
Данная методика синтеза позволила получить довольно высокие показатели
процентного выхода вещества (88%). Практически было получено 3,6 г. из 4,1 г.
теоретических. При помощи качественных реакций была доказана принадлежность
полученной субстанции к синтезируемому веществу. Были практически изучены
свойства и склонности полученного фосфата, которые продемонстрировали общую
закономерность свойств фосфатов, включая растворимость, окраску и термическую
устойчивость.
Заключение
Было
проведено изучение и систематизация всевозможных характеристик фосфорной
кислоты и фосфатов. Были рассмотрены и характеризированы все области применения
данной кислоты и её солей. Рассмотрены способы получения в промышленности и
лаборатории, один из которых был избран для реализации на практике в химической
учебной лаборатории. В результате проведённого синтеза все закономерности были
изучены практически, а теоретические знания систематизированы. Цель данной
курсовой полноценно выполнена. Тематика, избранная для рассмотрения, была
раскрыта почти во всех возможных областях и разделах курса неорганической
химии, что позволяет, опираясь на отображённый в работе теоретический материал
и подтверждающий материал практического исследования проводить новые, более
глубокие исследования фосфорной кислоты и её солей.
Список использованных источников
1) Фосфорная кислота [электронный ресурс]: многопредметная научная
коллекция - 2008- режим доступа:
<http://ido.tsu.ru/schools/chem/data/res/neorg/uchpos/text/g3_7_11.html>/
14.04.2014
) Строение
фосфорной кислоты [электронный
ресурс]: химический сборник - 2003- режим доступа: <http://www.chemport.ru/data/chemipedia/article_4093.html>
/14.04.2014
) Неорганическая химия: В 3
т./ под ред. Ю.Д. Третьякова. Т.2: химия непереходных элементов: Учебник для
студ. Высш. Учеб. Заведений/ А.А. Дроздов, В.П. Зломанов, Г.Н. Мазо, Ф.М.
Спиридонов - Москва: Издательский центр «Академия», 2004. - 368 с.
) Ф.Н. Капуцкий, В.Ф.Тикавый Пособие
по химии для поступающих в вузы.- Минск: Выш. школа, 1979. - С. 384
) Строение
фосфатов [электронный
ресурс]: химическая энциклопедия- 2013 - режим доступа: <http://www.xumuk.ru/bse/2904.html>/ 28.04.2014
) Строение фосфатов [электронный ресурс]: химическая энциклопедия- 2013 - режим доступа: <http://www.xumuk.ru/encyklopedia/1833.html> /28.04.2014
) Строение фосфатов [электронный ресурс]: химическая энциклопедия- 2013 - режим доступа: <http://www.xumuk.ru/encyklopedia/2/2786.html>/ 28.04.2014
) Фосфаты / Химическая энциклопедия / Под ред. И.
Л. Кнунянц.- М.: «Советская энциклопедия», 1988. - Т. 1. -
С. 217-218.
)Применение фосфорной кислоты [электронный ресурс]: химическая статья- 2012 - режим доступа: http://hawkish.ru/%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%BD%D0%B0%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0/
01.05.2014
) Применение фосфатов [электронный ресурс]: химическая статья- 2013 - режим доступа: http://www.neomart.ru/fosfat_tech.phtml/ 03.05.2014
11) Применение фосфатов [электронный ресурс]: химическая статья- 2010 - режим доступа: <http://nordspb.ru/fosfats> /05.05.2014
) Фосфорные удобрения [электронный ресурс]: химическая статья- 2012 - режим доступа: <http://agromage.com/stat_id.php?id=54>/ 05.05.2014
13) Кислотные методы
переработки фосфатного сырья в фосфорную кислоту и удобрения / под ред. Я.К. Балабакович. -
М.: Гидрометеоиздат, 1986. - 180с.
) Производство
фосфорной кислоты концентрацией 32% Р2О5 разложением апатита серной кислотой с
кристаллизацией гипса / под ред. С.К. Воскресенского. - М.:
НИУИФ, 1962. - 163 с.
) Копылев, Б.А. Технология
экстракционной кислоты: учебное пособие / Б.А. Копылев.-Л.:
Химия, 1981.- 221с.
) Химическая энциклопедия / Ред. кол.:
Кнунянц И.Л. и др..- М.: Советская энциклопедия, 1988. - Т.1.- 623 с.
17) Справочник химика / Ред. кол.: Никольский Б.П. и
др..- 3-е изд., испр.-Л.: Химия, 1971.- Т. 2.-
1168 с
) Брауэр, Г.А.
Руководство по неорганическому синтезу: учебное пособие/ Г.А. Брауэр.
- М : Химия, 1985 - 360 с
Похожие работы на - Фосфорная кислота и фосфаты