Противоопухолевый иммунитет
Введение
Онкопатология занимает второе место после
сердечно-сосудистых заболеваний среди причин смерти в цивилизованных странах.
Опухоли (новообразования) возникают, когда по каким-либо причинам наблюдается
неконтролируемая избыточная пролиферация клеток. Обычно во всех органах и
тканях поддерживается баланс между процессами гибели клеток и их
новообразованием. Это обеспечивается механизмами контроля и регуляции
гомеостаза тканей.
Главной отличительной особенностью опухолевых
клеток от нормальных является способность к неограниченному росту и потеря
механизмов аутокринной и паракринной регуляции. Для злокачественных клеток
также характерна инвазия окружающих тканей и метастазирование в отдаленные
участки организма. Распространение опухолевых клеток происходит по
лимфатическим путям и через кровоток.
Опухоли способны возникать спонтанно, без
видимых на то причин, а также могут быть индуцированы. У человека, как правило,
появляющиеся опухоли - это спонтанные, хотя отличить спонтанно возникшую
опухоль от индуцированной чрезвычайно трудно. Опухоли, искусственно вызванные,
называются индуцированными. Индуцировать канцерогенез способны различные
химические вещества (метилхолантрен, бензпирен, афлатоксин В1), физические
факторы (ультрафиолетовый свет, ионизирующая радиация), вирусы (папова-,
герпес-, адено- и ретровирусы). У человека 3 типа вирусов тесно связаны с
опухолями, это вирус Эпштейна-Барр (лимфома Беркита), цитомегаловирус (саркома
Капоши) и вирус папилломы.
1. Концептуальные аспекты
Идея о том, что опухоли, как потенциальные
носители соматических мутаций, должны вызывать иммунную реакцию отторжения,
впервые была высказана П. Эрлихом в начале ХХ века. Эта идея была возрождена на
новой теоретической основе Л. Томасом в конце 1950-х годов и развита в концепцию
иммунного надзора Ф.М. Бернетом в 1970 г.
Эта концепция предполагает постоянный надзор со
стороны Т-лимфоцитов за антигенным составом собственных клеток организма и
элиминацию клеток, подвергшихся трансформации, признаком которой является
появление на поверхности клетки измененных антигенов. Действительно, частота
соматических мутаций в организме многоклеточных животных и человека такова, что
за сутки должно возникнуть около миллиона мутантных клеток, среди которых
значительная часть должна выходить из-под контроля регуляторных систем, т.е.
малигнизироваться. Причину несопоставимо более низкой частоты реализации
опухолевой трансформации и формирования опухолей последователи концепции
иммунного надзора объясняют элиминацией измененных клеток с помощью иммунологических
механизмов вследствие экспрессии ими чужеродных, точнее -«измененных своих»
молекул. Дальнейшее изучение природы распознавания антигенов Т-клетками
способствовало укоренению подобного взгляда («измененное свое» как объект
распознавания, осуществляемого Т-клетками). Временная трудность возникла в
связи с тем, что у бестимусных мышей nude, у которых нарушено развитие
Т-лимфоцитов, развитие опухолей не становится более частым. Однако вскоре
выяснилось, что противоопухолевая резистентность у этих мышей обусловлена
NK-клетками - другим типом клеток, осуществляющих иммунный надзор.
В соответствии с данной концепцией на обычный
вопрос: «Если существует иммунный надзор, почему же развиваются злокачественные
опухоли?», должен следовать ответ: «В отсутствие иммунного надзора их было бы
значительно больше». Тем не менее концепция иммунного надзора встречает
многочисленные возражения и отнюдь не является общепризнанной, особенно в среде
онкологов.
Ни у кого не вызывает сомнений роль
иммунологических механизмов в защите от опухолей вирусной природы. Из опухолей
человека к ним относят ассоциированный с папилломавирусом рак шейки матки,
лимфомы и другие иммунобластные опухоли, вызываемые вирусами (в частности,
вирусом Эпштейна-Барр), а также саркома Капоши, вызываемая вирусом герпеса
человека - ВГЧ-8. Сторонники концепции иммунного надзора приводят свидетельства
более широкой значимости иммунологических механизмов в обеспечении
резистентности к опухолям. В качестве доводов они приводят следующие соображения:
Длительное применение иммунодепрессантов при
аллотрансплантации органов повышает частоту развития многих опухолей, в том
числе тех, этиология которых не связана с вирусами (меланома, рак почек,
толстой кишки, легких, эндокринных органов, мочевого пузыря). Разные авторы
зарегистрировали при этом повышение частоты развития различных опухолей
указанной локализации в 3-25 раз.
При росте злокачественных опухолей
регистрируется реакция со стороны иммунной системы. У мышей повторная подсадка
сингенной опухоли после хирургического удаления первого трансплантата вызывает
реакцию отторжения. У человека при росте опухоли происходит накопление
сывороточных антител, а также выявляют клеточные реакции, не приводящие к
отторжению.
Опухоль инфильтрируется лимфоцитами (TIL -
Tumor-infiltrating lymphocytes), причем интенсивность инфильтрации положительно
кореллирует со сроком выживаемости пациентов, являясь независимым
прогностическим признаком.
Таким образом, участие иммунной системы в
противоопухолевой защите в настоящее время имеет серьезные обоснования.
Разногласия относятся лишь к выраженности этого участия и степени
протективности иммунной защиты. Никто не сомневается в полезности
иммунодиагностики опухолей, но многие проявляют скепсис в отношении
перспективности иммунотерапии.
. Антигены, ассоциированные с опухолями
Первое четкое доказательство существования
антигенов, связанных со злокачественными опухолями, было получено отечественным
ученым Г.И. Абелевым в начале 60-х годов ХХ века. Им было установлено, что в
сыворотке крови мышей-носителей первичного рака печени появляется α-фетопротеин
- эмбриональный эквивалент сывороточного альбумина. Вскоре Ю.С. Татаринов
подтвердил эту закономерность для человека. На выявлении этого белка основан
диагностический тест, обладающий высокой информативностью при этой форме рака.
Позже были описаны другие антигенные онкомаркеры, как секретируемые и
накапливающиеся в сыворотке крови, так и мембранные, связанные с опухолевыми
клетками. К сывороточным опухолеассоциированным антигенам относят
ракоэмбриональный антиген (накапливается при раке толстой кишки и ряда других
локализаций), сывороточный специфический антиген простаты (PSA), хорионический
гонадотропин (гормон, в норме продуцируемый в плаценте, но также выявляемый при
хориокарциноме, семиноме и других опухолях, происходящих из эмбриональных
тканей). Эти и ряд других антигенов используют в иммунодиагностике опухолей. В
подавляющем большинстве случаев эти антигены синтезируются вследствие
экспрессии в клетках взрослого организма генов, в норме активных только в
эмбриональном периоде.
В реализации противоопухолевого иммунитета
больший интерес представляют опухолевые трансплантационные антигены. Такие
антигены выявляют не на всех опухолях. Наличие опухолевых антигенов на клетках
делает их потенциально чувствительными к действию факторов иммунной защиты. Для
обозначения таких опухолей введено понятие «иммунозависимые опухоли». К ним
относят, помимо вирусных опухолей, меланому, рак почки, молочных желез и т.д.
Примером злокачественных опухолей, независимых или слабо зависимых от
иммунологических механизмов, могут служить рак желудка, мелкоклеточный рак
легких и т.д.
Для выявления опухолевых антигенов используют
подходы, основанные на методах молекулярной биологии и иммунологии.
Первоначально кандидатные антигены тестировали на способность стимулировать
клоны Т-клеток, выделенных из лимфоидных органов носителей опухоли. В настоящее
время обычно используют SEREX-технологию (Serological expression cloning).
В качестве исходного материала используют
библиотеки генов, экспрессируемых в опухолях или (чаще) в таких органах, как
семенники (в них экспрессируются многие эмбриональные гены). Продукты генов,
клонированных из таких библиотек, скринируют на взаимодействие с
аутоантителами, присутствующими в сыворотке крови опухоленосителей.
Существует несколько классификаций опухолевых
антигенов. Как видно из представленных данных, большинство
опухолеассоциированных антигенов представляют нормальные продукты генов
организма. Все опухолевые антигены - белки, обычно гликозилированные.
Таблица1. Классификация и характеристика
опухолевых антигенов.
|
Группа
антигенов
|
Индивидуальные
антигены
|
Характеристика
|
|
Вирусные
|
EBNA (EBV), E6, E7 (HPV), HHV-8
|
Антигены
вирусов - возбу- дителей опухоли
|
|
Мутантные
(уникальные)
|
p53,
Cdk4, Cas8, β-катенин
|
Продукты
мутантных генов, в норме контролирующих апоптоз, клеточный цикл и т.д.
|
|
Ракосеменниковые
|
Серии
MAGE (1-12), BAGE, GAGE, NY-ESO-1, SSX2
|
Антигены,
экспрессируемые у эмбрионов и в некоторых органах (гонадах) взрослых
|
|
Дифференцировочные
|
Melan A/VART-1, тирозиназа,
gp100, PSA, ANKRD30A/NY-BR-1, GF-AP, TG
|
Нормальные
дифференцировочные антигены
|
|
Амплифицированные
|
HER-2/neu, BIRC, циклины
B1 и
D1, Bcr/Abl
|
Нормальные
усиленно экс- прессируемые антигены
|
|
Продукты
аномального процессинга
|
MUC-1
- MUC-7
|
Нормальные
антигены с чрезмерным гликозилированием
|
Вирусные антигены - продукты вирусных генов,
экспрессируемые в инфицированных клетках. Остальные антигены являются обычными
(«своими») антигенами с измененной экспрессией, количественно превосходящей
норму, проявляющейся в необычные временные сроки или в нехарактерном месте.
Очень редко антигены бывают уникальны для конкретной опухоли или для
конкретного носителя опухоли. Во всех случаях это - продукты мутантных генов,
например гена β-катенина. Однако
нередко мутация гена связана с происхождением опухолевого антигена более
опосредованно. Наиболее известный пример - белок р53, служащий онкосупрессором.
Он контролирует нарушения целостности ДНК и сигнализирует о нерепарированных
разрывах и других нарушениях, запуская механизм апоптоза. В норме эта молекула
практически не выявляется. Примерно в половине опухолей присутствуют мутации
гена р53, следствие которых - экспрессия нефункционального белка с более
продолжительным сроком жизни. Белок выявляют с разной частотой при различных
опухолях (до 20-35%), а в 15-20% в сыворотке регистрируют антитела к нему. При
этом специфичность В-эпитопа не связана с мутационным изменением белка, и
выявляемые антитела в равной степени реагируют с интактным и мутантным белками.
Распространенный вариант опухолевых антигенов -
эмбриональные антигены, т.е. белки, в норме экспрессируемые только (или
преимущест-венно) в эмбриональном периоде. К этой группе относят также
онкосе-менниковые антигены, поскольку некоторые из эмбриональных белков
продолжают экспрессироваться в семенниках. Именно поэтому библиотеки генов,
экспрессируемых в семенниках, очень часто используют в качестве исходного
материала, для отбора генов, кодирующих белки, против которых направлены обнаруживаемые
в сыворотках крови раковых больных антитела, или белки, соответствующие
теоретически рассчитанным (на основе биоинформационного анализа) критериям.
Такой подход позволил идентифицировтаь больше 40 семейств генов
ракосеменниковых антигенов (СТА - Cancer-testis antigen), включающих от одного
до 12 генов. Первым на этой основе был обнаружен антиген MAGE-1, маркирующий
клетки меланомы. MAGE-1 относится к самому большому семейству, содержащему 12
генов (MAGE-1 был идентифицирован с помощью клонирования Т-клеточных эпитопов).
В нормальных тканях, помимо семенников, белки группы ракосеменниковых антигенов
не выявляют, однако и в опухолевых клетках они экспрессируются достаточно редко
- в 5-10%.
Несбалансированное усиление экспрессии
(амплификация) характерна для некоторых опухолевых антигенов, например для
Her-2/neo - варианта рецептора для эпидермального фактора роста (EGFR2).
Выявление этого антигена широко используют для диагностики рака молочной железы
и некоторых других опухолей. Гиперэкспрессия характерна для белков BIRC -
представителей семейства ингибиторов апоптоза IAP (Inhibotors of apoptosis), а
также двух циклинов (B1 и D1).
Дифференцировочные антигены являются
органоспецифическими антигенами нормальных тканей. При опухолях их экспрессия
значительно повышается, что обусловливает нарушение естественной
аутотолерантности. В этом смысле эти антигены близки ракосеменниковым. Иногда
иммунный ответ на дифференцировочные антигены становится проявлением
аутоиммунного процесса и сопровождается повреждением нормальных тканей и
нарушением их функций. Яркий пример этого - паранео-пластические
неврологические синдромы, обусловленные повреждением нервной системы в
результате перекрестного реагирования антител к онконевральным антигенам с
нормальными клетками. В ряде случаев появление у молекулы свойств опухолевого
антигена обусловлено чрезмерным ее гликозилированием. Так происходит с
антигенами семейства MUC.
Эти белки имеют повторяющиеся домены, содержащие
О-гликозильные группы, которые разделены участками, включающими остатки
цистеина. В норме эти белки служат рецепторами молекул адгезии. Муцины
характерны для карцином кишечника. Они способны индуцировать как клеточный, так
и гуморальный иммунный ответ.
Опухолевые антигены маркируют отнюдь не только
конкретные опухоли (это свойственно в большей степени дифференцировочным
антигенам). Часто экспрессия этих антигенов свидетельствует о наличии
злокачественного процесса как такового. В иммунодиагностике опухолей удобнее
выявлять не ассоциированный с опухолевыми клетками антиген, а сывороточные
аутоантитела к этим антигенам. Такой подход имеет как преимущества,
обусловленные удобством работы с сывороткой и специфичностью метода выявления
антител, так и недостатки, главный из которых - относительная редкость
выявления антител к конкретному антигену (около 10% больных данной формой
рака). Именно поэтому для диагностики используют панели из нескольких
антигенов, что позволяет повысить вероятность выявления опухолеассоциированных
антител. Например, для диагностики колоректального рака рекомендуют
использовать панель, включающую 13 антигенов, что позволяет повысить
чувствительность до 46% (при 3-8% для каждого отдельного антигена, включенного
в панель).
Данные об опухолевых антигенах преимущественно
относятся к антигенам, распознаваемым антителами (В-антигена), что обусловлено
простотой серологических подходов к тестированию антигенов. Эти сведения очень
полезны для иммунодиагностики рака. Однако с точки зрения противоопухолевой
защиты больший интерес представляют данные об опухолевых антигенах,
распознаваемых Т-лимфоцитами (Т-антигенах). Практически всегда молекулы,
несущие В-эпиопы, содержат также Т-эпитопы, причем оба типа эпитопов часто
перекрываются. Для понимания характера иммунного ответа на опухолевые антигены
отметим, что опухоли не содержат PAMP, мобилизующие факторы врожденного
иммунитета и способствующие развитию адаптивного иммунного ответа.
Помимо классических антигенов опухоли
экспрессируют молекулы MICA и MICB - так называемые стрессорные молекулы,
кодируемые генами MHC класса I. MICA и MICB по своей третичной структуре сходны
с классическими молекулами MHC-I, отличаясь от них отсутствием легкой цепи (β2-микроглоублина)
и желобка для связывания пептида. Молекулы MICA и MICB в норме представлены на
некоторых клетках кишечника, а на других клетках экспрессируются в условиях
стресса и при инфицировании вирусами. На опухолевых клетках они экспрессируются
с достаточно высокой частотой. Эти молекулы распознаются поликлонально
естественными киллерами и γδТ-лимфоцитами.
. Эффекторные механизмы противоопухолевого
иммунитета
иммунитет защита опухоль вирусный
При рассмотрении противоопухолевого иммунитета
следует учитывать «историю» формирования опухоли: между появлением
трансформированной клетки и образованием опухоли должно произойти несколько
событий, обозначаемых опухолевой прогрессией и знаменующих приобретение клеткой
все большей автономии. После этого опухолевые клетки формируют своеобразный
орган с собственной стромой и внутренней иерархией клеток. Эти процессы сопровождаются
не столько приобретением новых антигенных свойств, сколько антигенным
упрощением (уменьшением интенсивности и разнообразия экспрессируемых
антигенов). Кроме того, постепенное развитие опухоли способствует формированию
иммунологической толерантности организма к неоантигенам. Тем не менее на
экспериментальных моделях не только показана возможность развития иммунного
ответа на опухолевые антигены, но и детально проанализированы его механизмы.
Одна из современных концепций предлагает
трехстадийную динамику иммунологических взаимоотношений между опухолью и
организмом.
В соответствии с обозначением этих стадий -
удаление (elimination), равновесие (equilibrium) и ускользание (escape) - она
может быть обозначена как «концепция трех Е». На стадии элиминации срабатывают
механизмы иммунологического отторжения чуждых по антигенному составу клеток.
Успешная элиминация трансформированных клеток предотвращает развитие опухоли.
Если малигнизированная клетка избегает гибели под влиянием эффекторных
механизмов иммунитета, наступает длительный период равновесия между
сдерживающим влиянием иммунной системы и пролиферативным потенциалом опухолевых
клеток. Прогрессирование опухолевого процесса приводит к наступлению последней
фазы, когда опухоль полностью выходит из-под контроля иммунных механизмов. По
данным исследований в модельных системах и косвенных свидетельств, полученных
из опыта иммунотерапии опухолей человека, ключевую роль в иммунном повреждении
опухолевых клеток играют 2 типа: цитотоксических лимфоцитов - естественные
киллеры (NK-клетки) и цитотоксические Т-лимфоциты. Первые распознают
стрессорные молекулы MICA и MICB, экспрессируемые опухолевыми клетками,
реагируют поликлонально без предварительной дифференцировки. Вторые образуются
в результате достаточно длительного иммунного ответа. Их предшественники (CD8+
Т-лимфоциты) распознают опухолевые анти- гены, презентируемые дендритными
клетками в составе молекул МНС-I; при этом активируются клетки ограниченного
числа клонов, в соответствии со специфичностью их TCR. Механизм действия
цитотоксических клеток сходен: они используют классический перфорин-гранзимовый
механизм контактного цитолиза, а также Fas-зависимую индукцию апоптоза
опухолевых клеток.
При противоопухолевой иммунной защите большую
роль играет индукция апоптоза, опосредованная через взаимодействие молекулы
TRAIL (TNF-related apoptosis induсing ligand) и ее рецептора DR5 (Death domain
5). TRAIL спонтанно экспрессируется на NK-клетках, а под влиянием интерферонов
I и II типов еще и на моноцитах и дендритных клетках. DR5 экспрессируется на
опухолевых клетках. Контактное взаимодействие клеток упомянутых типов с
опухолевой клеткой обеспечивает передачу летального сигнала в опухолевую
клетку.
В активации CD8+ Т-клеток и экспансии их клонов
принимают участие CD4+ Т-лимфоциты, а точнее - Th1-клетки. Сами по себе
Th1-лимфоциты вносят вклад в защиту, инициируя «иммунное воспаление»,
сопровождающееся активацией макрофагов, продукты которых способствуют местным
нарушениям кровотока и формированию тромбов. Это приводит к нарушению трофики и
служит косвенной причиной гибели опухолевых клеток.
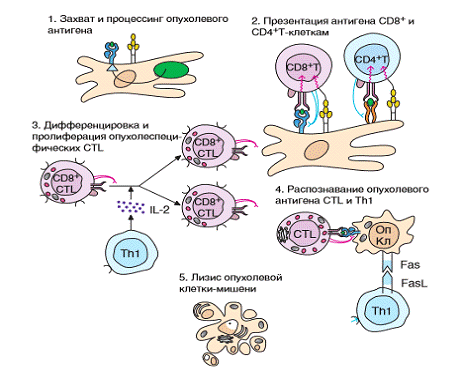
Рис.1. Стадии эффективного иммунного ответа на
антигены опухолевой клетки. Показан ход успешного иммунного ответа на
опухолевые антигены, возможный на стадии становления опухоли или при
использовании эффективного вакцинного препарата.
Четвертая разновидность лимфоцитов, участвующих
в иммунной защите от опухолевых клеток - γδТ-клетки.
Хотя механизм их противоопухолевого действия не выяснен (вероятнее всего, это
прямой цитолиз), факт их участия в противоопухолевой защите подтвержден
повышением частоты индукции опухолей у мышей с нокаутом генов γ-
или
δ-цепей
TCR (причем оно выражено даже сильнее, чем при выключении генов αβTCR).
Показатель вовлечения Т-лимфоцитов в
противоопухолевую защиту - инфильтрация опухоли лимфоидными клетками,
называемыми лимфоцитами, инфильтрирующими опухоль - TIL (Tumor-infiltrating
lymphocytes). Это преимущественно CD8+ Т-клекти с признаками активации. Однако
подавляющее большинство этих клеток функционально инертны, по-скольку в них
блокирована экспрессия цепей TCR-комплекса - обычно ζ-,
реже
ε-цепи.
После инкубации in vitro с цитокинами (IL-2 и другими) экспрессия цепей
восстанавливается, и туморинфильтрирующие лимфоциты проявляют высокую
противоопухолевую активность. Предполагается также присутствие в окружении
опухоли активированной формы естественных киллеров - LAK-клеток, для которых
характерна (по данным опытов in vitro) не только более высокая активность, но и
более широкий спектр клеток-мишеней.
Среди эндогенных противоопухолевых факторов
прежде всего следует назвать IFNγ. При
иммунных процессах его раньше всего продуцируют NKT-клетки, несколько позже -
NK- и Th1-клетки. Противоопухолевая активность IFNγ
имеет
множество проявлений. Он подавляет пролифера-цию опухолевых клеток (через
индукцию белков р21 и р27, ослабляющих экспрессию циклинзависимых киназ -
соответственно Cdk2 и Cdk4, обеспечивающих продвижение клеток по циклу. IFNγ
способствует
развитию апоптоза опухолевых клеток, индуцируя экспрессию каспазы 1, а также
Fas-рецептора на опухолевых клетках и Fas-лиганда на цитотоксических
Т-лимфоцитах. Этот цитокин индуцирует выработку опухолевыми и стромальными
клетками хемокинов CXCL9 (MIG) и CXCL10 (IP-10), которые привлекают в опухоль
Т-лимфоциты, экспрессирующие рецептор для этих хемокинов - CXCR3. Кроме того,
IFNγ
подавляет
ангиогенез, что влияет на трофику опухоли и усиливает гибель опухолевых клеток
по механизму некроза. Наконец, IFNγ - мощный
активатор макрофагов и индуктор развития Th1-клеток - Т-хелперов, необходимых
для развития и усиления противоопухолевого иммунитета.
Иммунная реакция на опухолевые антигены включает
также гуморальный иммунный ответ, однако он не имеет протективного характера.
Вероятно, это связано с неэффективностью комплемента, компоненты которого
разрушаются факторами, представленными на поверхности всех клеток организма,
включая опухолевые. Неэффективность Fc-зависимого привлечения макрофагов и
других фагоцитирующих клеток связана, по-видимому, со слабым уровнем активации
клеток врожденного иммунитета и отсутствием должного провоспалительного фона
для развития эффективной защитной реакции. Способность антител блокировать
антигены-мишени приводит к защите опухолевой клетки от клеточных эффекторных
факторов. Это защитное действие было описано достаточно давно и обозначено
термином «эффект усиления опухолевого роста» (enhancing effect). Таким образом,
антитела к опухолеассоциированным антигенам, образуемые при росте опухолей, в
лучшем случае сигнализируют о наличии опухолевого процесса. Как отмечалось
выше, антитела к конкретному антигену выявляют в сыворотке больных раком не
очень часто (около 10% случаев), но антитела к одному из нескольких
опухолеассоциированных антигенов появляются примерно у половины больных, что
позволяет успешно использовать их определение с диагностической целью. На
основе таких антител разрабатывают иммунотерапевтические препараты -
иммунотоксины. В экспериментах на мышах показано формирование иммунологической
памяти при ответе на опухолевые антигены. Наличие Т-клеточной памяти у
экспериментальных животных обеспечивает эффективное отторжение повторно
трансплантируемой опухоли. Устойчивость к перевивке сингенных опухолей может
быть перенесена с Т-клетками интактным реципиентам. При этом активность
проявляют как CD8+, так и CD4+ Т-клетки, однако CD8+ более эффективны.
Возможность формирования эффективной проти-воопухолевой иммунологической памяти
вселяет надежды на возможность ее индукции путем вакцинации, реализовать которую
пока не удается. Таким образом, при успешном запуске противоопухолевого
иммунного ответа в его осуществление вовлекаются почти все звенья врожденного и
адаптивного иммунитета. В то же время основной эффект защитной реакции (гибель
опухолевых клеток) реализуют преимущественно киллерные клетки - естественные
киллеры и цитотоксические Т-лимфоциты. Иммунные механизмы не способны вызвать
отторжение сформировавшейся опухоли. Это обусловлено как их недостаточной
эффективностью, так и способностью опухолевых клеток избегать действия
эффекторных факторов иммунитета.
. Механизмы избегания опухолью иммунного надзора
Опухолевые клетки располагают разнообразными
механизмами, позволяющими им избежать действия факторов иммунного надзора (рис.
2). Некоторые из этих факторов направлены на затруднение распознавания
чужеродных компонентов в составе опухоли и запуска иммунных процессов. Другие
механизмы препятствуют реализации эффекторных механизмов.
Опухолевые клетки не экспрессируют PAMP. Это
сильно влияет на их иммуногенность, поскольку презентация антигенных эпитопов
Т-клеткам осуществляют в этом случае дендритные клетки, не подвергшиеся
стимуляции в условиях провоспалительного окружения, индуцируемого PAMP. Такие
дендритные клетки слабо экспрессируют костимулирующие молекулы CD80 и CD86,
секретируют мало IL-12 и могут вырабатывать IL-10. Как известно, такие условия
презентации вызывают скорее развитие анергии, чем активацию Т-клеток. Тем не
менее, вероятно под действием кофакторов, Т-клеточный иммунный ответ может
запуститься и без влияния PAMP. О том, что это не уникальное явление,
свидетельствует факт развития трансплантационного иммунитета - отторжения
аллогенных тканей, тоже необъяснимого с рассматриваемой точки зрения.
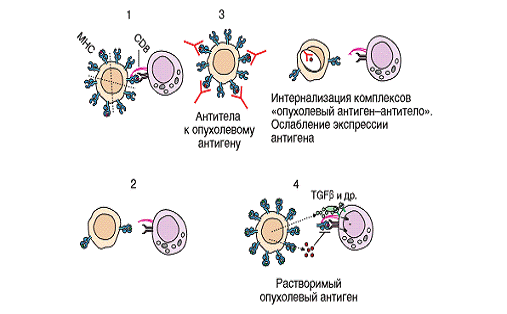
Рис. 2. Механизмы избегания опухолевой клеткой
действия защитных иммунных реакций: 1 - опухолевая клетка экспрессирует
специфический эпитоп в большом количстве, что обеспечивает успешную атаку со
стороны распознающего его цитотоксического Т-лимфоцита; 2 -
опухолеассоциированный эпитоп не экспрессируется опухолевой клеткой, что
позволяет ей избежать цитолитического действия Т-киллера; 3 - антитела к
опухолевому антигену связываются с ним и интернализуются, что защищает опухолевую
клетку от действия цитотоксического Т-лимфоцита; 4 - опухоль выделяет
блокирующие факторы - супрессорные цитокины (TGFβ и
др.), простагландины, растворимые антигены, которые предотвращают распознавание
и цитолиз опухолевой клетки.
В связи с вышесказанным в большинстве случаев к
опухолевым антигенам развивается иммунологическая толерантность.
Если опухолевая клетка несет на своей
поверхности и классические молекулы MHC-I - А, В и С, и неклассические молекул
HLA-G или E, она подвергается цитотоксическому действию CD8+ Т-клеток,
распознающих классические молекулы MHC-I. NK-лимфоциты не могут лизировать
такие клетки, так как их активность блокируется молекулами MHC-I (классическими
и неклассическими). Если опухолевая клетка утратила все молекулы MHC (что часто
происходит в ходе опухолевой прогрессии), но экспрессирует стрессорные
молекулы, она становится мишенью естественных киллеров. В этой ситуации
цитотоксические Т-лимфоциты не могут распознать клетку, лишенную MHC-I, а
следо-вательно и опухолеспецифического пептида. Однако если опухолевая клетка
утратила классические молекулы MHC-I, но сохранила неклассические молекулы, она
становится недоступной для действия киллеров - ни естественных (их реакцию
блокирована неклассическими МНС-I), ни CD8+-Т-клеточных (распознаваемый ими
комплекс анти-генного петида с молекулой MHC-I отсутствует). Это позволяет
опухоли избежать иммунного надзора.
Опухолевый антиген, против которого направлены
клеточные эффекторные механизмы, может исчезнуть с поверхности клетки в результате
мутации или модуляции. Возможность модуляции опухолевых антигенов показана на
примере антигена TL, ассоциированного с Т-лимфомой мышей. Введение в
культуральную среду антител к этому антигену приводит к его стойкому
исчезновению с поверхности клетки. Экспрессия антигена на поверхности
восстанавливается только после удаления антител. Предполагают, что этот
механизм может срабатывать in vivo, хотя его реальную роль в защите опухолевых
клеток от эффекторных механизмов оценить затруднительно.
Опухолевые клетки секретируют супрессорные
цитокины - IL-10, TGFβ, а
также простагландин Е, подавляющие иммунный ответ, особенно его воспалительную
и цитотоксическую формы. Росту опухоли способствует выработка опухолевыми
клетками ростовых факторов (эпидермального, тромбоцитарного, фибробластного), а
развитию стромы и улучшению трофики опухоли - выработка сосудистого ростового
фактора VEGF (Vascular endothelium growth factor). Результатом действия
опухолевых клеток, вероятно реализу-емого через секретируемые факторы, является
упоминавшаяся выше блокада экспрессии ζ- и
других цепей рецепторного комплекса, что сопровождается утратой функциональной
активности туморинфильтрирующих лимфоцитов.
При росте опухоли активируются регуляторные
Т-клетки: естественные, индуцированные (в частности Th3), секретирующие TGFβ
и
IL-10, а также регуляторные Т-клетки фенотипа CD4+ CD25hi FOXP3+.
Гистологические исследования показывают, что регуляторные Т-клетки
сосредоточиваются в окружении опухоли и в региональных лимфатических узлах и
напрямую контактируют с дендритными клетками. Регуляторные клетки ослабляют
иммунный ответ, действуя на эффекторные Т-лимфоциты (как CD8+, так и CD4+).
. Пути активизации противоопухолевой защиты
Из представленных выше данных следует, что при
развитии опухолей в случаях наличия в опухолевых клетках субстанций, которые
могут выступать в качестве антигенов, включаются иммунные процессы. Их
значимость ограничивается рядом факторов, проявляющихся как на этапе запуска иммунного
ответа, так и при реализациия его конечных эффектов.
В соответствии с этим подходы к усилению
противоопухолевого иммунитета разрабатывают в двух основных направлениях:
. усиление иммуногенности опухолей;
. усиление эффекторных механизмов противоопухолевого
иммунитета.
Целенаправленные поиски способов повышения
эффективности противоопухолевого иммунитета начались в 70-е годы прошлого века,
когда для лечения опухолей стали использовать адъюванты (усилители иммунного
ответа) на основе микобактерий (вакцина БЦЖ), а также Сorinebacterium parvum.
Результаты лечения оказались неоднозначными, однако с современных позиций
следует признать, что направление поисков было выбрано правильно, поскольку они
были связаны с попытками добавить к действию иммуногена (опухолевые клетки)
эффекта PAMP, т.е. сформировать полноценный иммуногенный стимул. Продолжением
этого направления в настоящее время стали попытки создания противоопухолевых
вакцин на основе дендритных клеток, нагруженных опухолевыми антигенами и получивших
стимулы, усиливающие иммуностимулирующую активность этих клеток и ослабляющие
их толерогенность. Недостаточная эффективность этих подходов, очевидно,
отражает неполноту наших знаний в данной области. Это направление остается
основным в разработке методов иммунотерапии рака.
Подходы, направленные на усиление
результативности эффекторных механизмов, как правило, связаны с введением в
организм больного эффекторных продуктов или факторов, способствующих их
образованию.
В настоящее время используются или находятся в
процессе разработки следующие подходы к иммунотерапии опухолей:
цитокинотерапия;
использование препаратов моноклональных антител;
использование иммунотоксинов на основе
моноклональных антител;
иммуноцитотерапия;
применение лечебных онковакцин.
Иммунодиагностика рака
В настоящее время иммунодиагностика опухолей
основана на выявлении в сыворотке и жидкостях больного опухолеспецифических
антигенов или маркеров опухолевого роста (опухолеассоциированных белков). Для
их выявления используется иммуноферментный анализ, метод двойного
сэндвича.Промышленностью производятся следующие тест-системы:
СЕА; используется для выявления РЭА,
положительный тест при карциноме толстой кишки и поджелудочной железы.
AFP; используется для выявления
альфа-фетопротеина, положительный тест при первичном раке печени.
СА-125; содержит маркер рака яичника.
СА-15-3; содержит маркер рака молочной железы.
СА-19-9; содержит маркер рака ЖКТ.
СА-242; содержит маркер рака поджелудочной
железы, толстой и прямой кишки.
PSA EIA; содержит специфический антиген
простаты.
PSA Free; содержит специфический антиген
простаты, используется для определения свободного PSA.
NSE; содержит маркер мелкоклеточного рака
легких.
UBC; содержит маркер рака мочевого пузыря.
CASA; содержит маркер рака яичника.
MSA; содержит маркер рака молочной железы.
Chromogranin A; содержит маркеры опухолей
эндокринного происхождения.
CD30 (Ki-1 Antigen); используется в диагностике
опухолей лимфопролиферативного происхождения.
Заключение
Создание вакцин ограничено тем, что многие
опухоли содержат антигены, появившиеся в результате случайных мутаций в геноме
клетки, что делает их антигенно-уникальными. Известно, что опухоли даже одного
типа у разных индивидуумов существенно различаются по антигенному спектру. В
последние годы предпринимались попытки индукции противоопухолевого иммунитета
путем создания вакцин из собственных клеток больного (аутовакцины). Несмотря на
внесение в такие препараты адъювантов, они не вызывали заметной активации
иммунных сил организма.
Для усиления иммуногенности опухолевых клеток
предлагается введение больному ранее полученных от него инактивированных
опухолевых клеток, несущих трансфектный ген В7, ИЛ-2, ИЛ-4, ГМ-КСФ, ИНФ-гамма.
Полагают, что повышенная экспресия на клетках молекул В7 будет способствовать
более интенсивной генерации эффекторных Т-цитотоксических лимфоцитов, а
секреция ГМ-КСФ, ИНФ-гамма способствовать более качественной презентации
опухолевых антигенов антигенпредставляющими клетками. Все это, по мнению
исследователей, должно стимулировать иммунный ответ.
Литература
Лавровский
В.А./ Иммунные свойства опухолевых клеток определяют степень их
злокачественности// Успехи совр.биол., 1981, в.2, т.91, с.228-242.
Суслов
А.П./ Макрофаги и противоопухолевый иммунитет// ИНИТ, 1999, с.19.
Ярилин
А.А./ Иммунология и аллергология// Иммунология, 2010, с. 749.