Очистка почв от нефтяных загрязнений с использованием углеводородокисляющих микроорганизмов
Реферат
Дипломная работа выполнена в лаборатории
“Микробиологического мониторинга и биоремедиации почв” Всероссийского
научно-исследовательского института сельскохозяйственной микробиологии. Работа
посвящена селекции штаммов ассоциативных микроорганизмов обладающих
углеводородокисляющей и ростстимулирующей активностью. В экспериментальной
части данного исследовательского проекта была проведена сравнительная оценка 30
штаммов микроорганизмов относящихся к родам Rhodococcus, Variovorax,
Arthrobacter, Bacillus, Micrococcus и Pseudomonas. По результатам поставленных
опытов были выявлены 11 штаммов микроорганизмов, обладающих биодеструктивным
потенциалом к углеводородам нефти. Отобранные микроорганизмы были изучены на
предмет ростстимулирующей активности, и по экспериментальным данным мной были
выявлены: 5 штаммов микроорганизмов, отличающихся наибольшей способностью к
продукции фитогормонов ауксинов, 2 штамма - к продукции АЦК дезаминазы и 3
штамма, обладающих способностью к разложению труднодоступных фосфатов. По
результатам всей экспериментальной части было выявлено 3 наиболее активных
штамма для создания консорциума бактерий, обладающих несколькими или одним из
ростстимулирующих свойств и углеводородокисляющей активностью, которые важны
для разработки новых технологий фиторемедиации нефтезагрязненных почв.
Ключевые слова: бактерии, Rhodococcus,
Variovorax, АЦК дезаминаза,
ауксины, ризосфера, нефть, фито- и биоремедиация.
Оглавление
Введение
. Аналитический обзор
.1 Проблема загрязнения почв
нефтью
.1.1 Актуальность проблемы и
источники нефтяного загрязнения
.1.2 Факторы определяющие характер
и степень нефтяного загрязнения почв
.1.3 Предельно допустимые
концентрации загрязнений
.2 Влияние нефти и
нефтепродуктов на растения и почвенные микроорганизмы
.2.1 Влияние нефтяного загрязнения
на растения
.2.2 Влияние нефтяного загрязнения
на микробиологические процессы в почве
.3 Микробная деградация
углеводородов нефти
.3.1 Микроорганизмы - деструкторы
нефти и нефтепродуктов
1.3.2.1 Пути поступления
углеводородов нефти в клетки микроорганизмов
1.3.2.2 Микробиологическое
окисление углеводородов нефти и нефтепродуктов
1.4 Растительно-микробные системы
для биоремедиации нефтезагрязненных почв
.4.1 Ростстимулирующие ризосферные
бактерии
.4.2 Образование ассоциативного симбиоза
.4.3 Механизмы положительного
действия ризосферных бактерий на растения
.4.4 Особенности приживаемости
ризобактериальных инокулятов
.5 Ремедиация нефтезагрязненных
почв
1.5.1 Биоремедиация
неффтезагрязненных почв с помощью микроорганизмов
1.5.2 Фиторемедиация
нефтезагрязненных почв
. Цели и задачи
. Экспериментальная часть
.1 Объекты исследования
.2 Материалы и методы
исследования
.2.1 Определение
углеводородокисляющей активности
.2.2 Определение способности к
продуцированию ауксинов по выявлению фитогормонов с использованием ВЭЖХ
.2.3 Выявление АЦК-утилизирующих
микроорганизмов и определение активности продуцируемого ими фермента АЦК
дезаминазы
.2.4 Определение способности к
разложению труднодоступных фосфатов
.3 Результаты исследования, их
анализ и обсуждение
.3.1 Результаты опыта по
определению углеводородокисляющей активности
.3.2 Результаты опыта по
определению способности к продуцированию ауксинов по выявлению фитогормонов с
использованием ВЭЖХ
.3.3 Результаты опыта по выявлению
АЦК-утилизирующих микроорганизмов и активности продуцируемого ими фермента АЦК
дезаминазы
.3.4 Результаты опыта по
определению способности к разложению труднодоступных фосфатов
Выводы по работе
Список литературы
Введение
Загрязнение почв нефтью и нефтепродуктами
является одной из важнейших мировых экологических проблем и имеет особенно
острую необходимость решения для нефтедобывающих стран, в том числе и для
России. Широкое применение в очистке нефтезагрязненных почв получили
углеводородокисляющие микроорганизмы, которые служат основой для различного
типа биопрепаратов и технологий биоремедиации. Нефть - чрезвычайно сложный и
разнообразный по составу субстрат, и это, с одной стороны, определяет трудности
очистки почв, но с другой стороны обуславливает широкий спектр микроорганизмов,
которые могут использовать различные компоненты и фракции нефти для питания.
Углеводородокисляющие бактерии широко
распространены и присутствуют в различных типах почв и климатических регионах.
Поэтому выбранный тип технологии биоремедиации основан на активизации
растительно-микробного взаимодействия наилучшим образом обеспечивающим
осуществление комплексной очистки нефтезагрязненных почв.
Актуальными являются разработка способов
повышения устойчивости растений к стрессовым факторам и улучшения их
минерального питания. Создание сортов растений с повышенной устойчивостью к
стрессам связано с большими трудностями, поскольку генетика и селекционный
процесс видов растений, используемых для фиторемедиации, изучены слабо, а в
природе часто несколько стрессовых факторов действуют одновременно, что также
усложняет решение проблемы этим подходом.
Перспективным направлением исследований по
повышению адаптации растений к стрессовым факторам является активизация их
взаимодействий с полезными симбиотическими микроорганизмами, которые фиксируют
атмосферный азот, стимулируют рост продуцируемыми фитогормонами, повышают
доступность растениям элементов минерального питания, осуществляют биоконтроль
фитопатогенов и индуцируют системную устойчивость.
Основная цель выполняемой работы заключается в
отборе и детальной характеристике штаммов антистрессовых симбиотических
бактерий, повышающих адаптационный потенциал растений к стрессовым факторам
среды и осуществляющих деструкцию нефтезагрязнений почвы.
1. Аналитический обзор
.1 Проблема загрязнения почв нефтью
.1.1 Актуальность проблемы и источники нефтяного
загрязнения
Загрязнение почв нефтью и нефтепродуктами
является одной из важнейших мировых экологических проблем и имеет особенно
острую необходимость решения для нефтедобывающих стран, в том числе и для
России.
Большинство земель в той или иной мере
загpязнены сейчас нефтепродуктами. Особенно сильно это выражено в тех регионах,
через которые проходят нефтепроводы, а также богатых предприятиями химической
промышленности, использующими в качестве сырья нефть или природный газ.
Ежегодно десятки тонн нефти загpязняют полезные земли, снижая ее плодородие, но
до сих пор этой проблеме не оказывают должного внимания [1].
Основной источник загpязнения почвы нефтью -
антропогенная деятельность. В естественных условиях нефть залегает под
плодородным слоем почвы на больших глубинах и не производит существенного на
нее влияния. В нормальной ситуации нефть не выходит на поверхность, происходит
это только в редких случаях в результате подвижек горных пород, тектонических
процессов, сопровождающихся поднятием грунта.
Основные загpязнения нефтью происходят в районах
нефтепромыслов, нефтепроводов, а также при перевозке нефти по сухопутным и,
особенно, морским магистралям. Так, при одном порыве нефтепровода выбрасывается
в среднем 2 т нефти, что выводит из строя 1000 м³
земли, а в результате аварии на газоконденсатопроводе на землю в среднем
попадает не менее 2 млн. т/год нефтепродуктов. В районах наземных
нефтепромыслов и нефтепроводов периодически происходят локальные утечки нефти и
нефтепродуктов, которые не распространяются на большие площади [2].
Районы и источники загрязнений нефтью можно
условно разделить на две гpуппы: временные и постоянные («хронические»). К
временным районам можно отнести нефтяные пятна на водной поверхности, разливы
при транспортировке. К постоянным относятся районы нефтедобычи, на территории
которых земля буквально пропитана нефтью в результате многократных утечек.
Экологические последствия загрязнения почв
нефтью и нефтепродуктами зависят от параметров загpязнения, свойств почвы и
характеристик внешней среды.
Нефть представляет собой жидкость от желто или
светло-бурого до черного цвета, с характерным запахом. Это смесь углеводов и их
производных, каждый из которых может рассматриваться как самостоятельный
токсикант. В ее составе обнаруживается свыше 1000 индивидуальных органических
веществ, содержащих 83 - 87% углерода, 12 14% водорода, 0,5 - 6,0% ceры, 0,02 -
1,7% азота, 0,005 - 3,6% кислорода и незначительную примесь минеральных
соединений; зольность нефти не превышает 0,1 %. Нефть легче воды: плотность
различных видов нефти колеблется от 0,73 до 0,97. К нефтепродуктам обычно
относят различные углеводородные фракции, получаемые из нефтей. Основные компоненты
нефтепродуктов - углеводороды. Наряду с углеводородами в нефтепродуктах, как и
в нефтях, также содержатся соединения серы, азота и кислорода [3].
В зависимости от месторождения нефть имеет
различный состав как качественный, так и количественный. Больше всего
предельных углеводородов содержится в нефти, добываемой в штате Пенсильвания
(США). Бакинская нефть сравнительно бедна предельными углеводородами, но богата
так называемыми нафтеновыми углеводородами, содержащимися в количестве до 90%.
Значительно богаче предельными углеводородами гpозненская нефть, сураханская и
ферганская (Средняя Азия) [4].
1.1.2 Факторы определяющие характер и степень
нефтяного загрязнения почв
К первой гpуппе факторов относятся химическая
природа загpязняющих веществ, концентрация их в почве, срок от момента
загpязнения и др. Как было отмечено выше, нефть состоит из многих фракций,
существенно различающихся между собой по физико-химическим свойствам. Поэтому
их поведение в почве различно.
Наибольшей проникающей способностью обладают
легкие фракции, которые капиллярными силами затягиваются на глубину до 1 метра.
Будучи загpязнена только легкими фракциями, почва со временем может
самоочиститься, так как эти фракции обладают низкими температурами кипения и
довольно быстро испаряются. Легкая фракция нефти, куда входят наиболее простые
по строению низкомолекулярные метановые (алканы), нафтеновые (циклопарафины) и
ароматические углеводороды - наиболее подвижная часть нефти. Большую часть
легкой фракции составляют метановые углеводороды с числом углеводородных атомов
от 5 до 11 (пектан, гексан, гептан, октан, нонан, декан, ундекан). Нормальные
(неразветвленные) алканы составляют в этой фракции 50-70%. Метановые
углеводороды легкой фракции, находясь в почвах, оказывают наркотическое и токсическое
действие на живые организмы. Особенно быстро действуют нормальные алканы с
короткой углеводородной цепью, содержащиеся в основном в легких фракциях нефти.
Эти углеводороды лучше растворимы в воде, легко проникают в клетки организмов
через мембраны, дезорганизуют цитоплазменные мембраны организма. Нормальные
алканы, содержащие в цепочке менее 9 атомов углерода, большинством
микроорганизмов не ассимилируются, хотя могут быть окислены. Их токсичность
ослабляется в присутствии нетоксичного углеводорода, который уменьшает общую
растворимость алканов [5].
Многие исследователи отмечают сильное
токсическое действие легкой фракции на микробные сообщества и почвенных
животных. Легкая фракция, мигрируя по почвенному профилю и водоносным
горизонтам, расширяет, иногда значительно, ореол первоначального загрязнения.
С содержанием легкой фракции коррелируют другие
характеристики нефти: углеводородный состав, количество смол и асфальтенов. С
уменьшением содержания легкой фракции ее токсичность снижается, но возрастает
токсичность ароматических соединений, относительное содержание которых растет.
Значительная часть легкой фракции нефти разлагается и улетучивается еще на
поверхности почвы или смывается водными потоками. Путем испарения из почвы
удаляется от 20 до 40% легкой фракции [6].
Содержание твердых метановых углеводородов
(парафина) в нефти (от очень малых количеств до 15-20%) - важная характеристика
при изучении нефтяных разливов на почвах. Твердый парафин не токсичен для живых
организмов, но вследствие высоких температур застывания (+18 ºС
и выше) и растворимости нефти (+40 ºС)
в условиях земной поверхности он переходит в твердое состояние, лишая нефть
подвижности.
Твердый парафин очень трудно разрушается, с
трудом окисляется на воздухе. Он надолго может «запечатать» все поры почвенного
покрова, лишив почву свободного влагообмена и «дыхания». Это, в свою очередь,
приводит к полной деградации биоценоза [7].
К циклическим углеводородам в составе нефти
относятся нафтеновые (циклоалканы) и ароматические (арены). Общее содержание
нафтеновых углеводородов в нефти изменяется от 35 до 60%, в некоторых случаях
составляя меньше или больше приведенных крайних значений. О токсичности
нафтеновых углеводородов сведений почти не имеется. Циклические углеводороды с
насыщенными связями окисляются очень трудно. Биодеградацию циклоалканов
затрудняет их малая растворимость и отсутствие функциональных групп.
Ароматические углеводороды - наиболее токсичные
компоненты нефти. В концентрации всего 1% в воде они убивают все водные
растения; нефть, содержащая 38% ароматических углеводородов, значительно
угнетает рост высших растений. С увеличением ароматичности нефти увеличивается
ее гербицидная активность. Содержание ароматических углеводородов в нефти
изменяется от 5 до 55%, чаще всего от 20 до 40%. Основную массу ароматических
структур составляют моноядерные углеводороды - гомологи бензола.
Полициклические ароматические углеводороды, т. е. углеводороды, состоящие из
двух и более ароматических колец, содержатся в нефти в количестве от 1 до 4%
[8].
Бензол и его гомологи оказывают более быстрое
токсическое действие на организм, чем полициклические ароматические
углеводороды (ПАУ). Последние действуют медленнее, но более длительное время,
являясь хроническими токсикантами. Ароматические углеводороды трудно поддаются
разрушению. Обычно они окисляются микроорганизмами [5].
Смолы и асфальтены относятся к
высокомолекулярным неуглеводородным компонентам нефти. В составе нефти они
играют исключительно важную роль, определяя во многом ее физические свойства и
химическую активность. Структурный каркас смол и асфальтенов составляют
высококонденсированные полициклические ароматические структуры, состоящие из
десятков колец, соединенных между собой гетероатомными структурами, содержащими
серу, кислород, азот.
По содержанию смол и асфальтенов нефти
разделяются на малосмолистые (от 1-2 до 10% смол и асфальтенов), смолистые
(10-20%), высокосмолистые (23-40%). Смолы и асфальтены содержат основную часть
микроэлементов нефти, в том числе почти все металлы. Общее содержание
микроэлементов в нефти - сотые, десятые доли процента. Смолистые вещества очень
чувствительны к элементарному кислороду и активно присоединяют его. На воздухе
смолистая нефть быстро густеет, теряет подвижность. Если нефть просачивается
сверху, ее смолисто-асфальтеновые компоненты сорбируются в основном в верхнем,
гумусовом горизонте, иногда прочно цементируя его. При этом уменьшается поровое
пространство почвы. Смолисто-асфальтеновые компоненты гидрофобны. Обволакивая
корни растений, они резко ухудшают поступление к ним влаги, в результате чего
растения засыхают. Эти вещества малодоступны микроорганизмам, процесс их
метаболизма идет медленно, иногда десятки лет. Токсическое же влияние оказывают
некоторые тяжелые металлы в составе смол и асфальтенов. Последние малодоступны
микроорганизмам и обычно остаются в почвах в виде прочного органно-минерального
комплекса [9].
Из различных соединений серы в нефти наиболее
часто обнаруживаются сероводород, меркаптаны, сульфиды, дисульфиды, свободная
сера. Сернистые соединения оказывают вредное влияние на живые организмы.
Особенно сильным токсическим действием обладают сероводород и меркаптаны.
Ко второй гpуппе факторов принадлежат структура
почвы, гpанулометрический состав, влажность почвы, активность микробиологических
и биохимических процессов и др. Чем крупнее частицы почвы, тем легче нефть и
нефтепродукты проходят внутрь ее, в ее нижние слои. От структуры почвы также
зависит степень аэрации почвы, а следовательно, интенсивность испарения и
окисления нефти. Влажная почва отталкивает гидрофобные нефть и нефтепродукты,
препятствуя ее впитыванию [5].
К внешним факторам относятся температура
воздуха, ветреность, ypoвень солнечной радиации и особенно доля
ультрафиолетового излучения в свете, растительный покров и пр. Чем выше
температура воздуха, тем выше скорость окислительных процессов, посредством
которых разлагается на воздухе нефть. Соответственно в летнее время нефть
быстрее разлагается: легкие фракции испаряются, тяжелые окисляются. Зимой, при
отрицательной температуре, большинство тяжелых фракций переходят в твердое
состояние и вообще не окисляются, поэтому основная часть (если не все)
процессов разложения нефти и нефтепродуктов происходят именно летом. Ветер
обдувает верхний слой почвы свежим воздухом, создавая динамически повышенную
концентрацию кислорода над ней, способствуя окислению. К тому же ветер создает
токи воздуха в воздушной системе почвы, по крайней мере той ее части, что
осталась после загpязнения. Выветривание верхнего загpязненного и окисленного
слоя также содействует дальнейшему очищению. Ультрафиолетовое излучение
способствует окислительным реакциям и поэтому сильно ускоряет разложение нефти
на поверхности земли и, особенно, на водных гладях [10].
При сильном нефтяном загpязнении растительный покров
обычно вымирает. Однако, если загpязнение не очень велико, то он может
способствовать очищению почвы. Образующийся от него за несколько лет
растительный опад создает над загpязненным слоем чистый гyмусовый слой, богатый
аэробной микрофлорой, которая может вести окисление лежащих ниже нефтепродуктов
[11].
.1.3 Предельно допустимые концентрации
загрязнений
Предельно допустимые концентрации нефтяных
загрязнений в почвах зависят от вида нефтепродуктов (НП) и составляет для почвы
0,1 мг/кг. Однако ПДК суммарного содержания нефтепродуктов в почве не
стандартизовано; установлены ПДК для некоторых видов нефтепродуктов: бензол -
0,3 мг/кг, толуол - 0,3 мг/кг, ксилол - 0,3 мг/кг [12].
Минимальный уровень содержания нефтепродуктов в
почвах и грунтах, выше которого наступает ухудшение качества природной среды,
рассматривается как верхний безопасный уровень концентрации (ВБУК). ВБУК
нефтепродуктов в почвах зависит от сочетания многих факторов, таких как тип,
состав и свойства почв и грунтов, климатические условия, состав нефтепродуктов,
тип растительности, тип землепользования и др. Эти нормы должны различаться в
зависимости от климатических условий и типов почвообразования.
Верхний безопасный уровень концентрации НП в
почвах можно принять за ориентировочный уровень допустимой концентрации (ОДК) в
почвах. Ориентировочным допустимым уровнем загрязнения почвы НП предлагается
считать нижний допустимый уровень загрязнения, при котором в данных природных
условиях почва в течение одного года восстановит свою продуктивность, а
негативные последствия для почвенного биоценоза могут быть самопроизвольно
ликвидированы. Такая оценка ОДК как общесанитарного показателя может быть дана
для верхнего гумусо-аккумулятивного горизонта почв (примерно до глубины 20-30
см).
Вполне очевидно, что ОДК нефти и НП в почве не
может быть единым для всех типов почв и природных зон. Он зависит от факторов,
определяющих влияние вещества на свойства почв и растений, от потенциала
самоочищения почв, от данного вида загрязнения [13].
.2 Влияние нефти и нефтепродуктов на растения и
почвенные микроорганизмы
.2.1 Влияние нефтяного загрязнения на растения
На современном этапе развития общества растения
испытывают разнообразные антропогенные воздействия, в ответ на которые они
меняют стратегии поведения. Изменение стратегий поведения проявляется в
возникновении механизмов адаптации к новым экологическим факторам на разных
уровнях организации растений. Основным антропогенным фактором, оказывающим
стрессовое воздействие на растения, является нефтяное загрязнение. Изучение
адаптационных механизмов растений в ответ на действие нефти делает возможным
выявление признаков, обеспечивающих устойчивость растений в условиях нефтяного
загрязнения, с целью их использования в процессе разработки методов
рекультивации и подборки для неё устойчивых к нефтяному загрязнению растений.
Изучаемые признаки можно использовать как индикаторы для характеристики
состояния почв при нефтяном загрязнении [14].
Опасность загрязнения нефтью и нефтепродуктами
связана, прежде всего, с высокой чувствительностью к нему высших растений, при
том, что они занимают ключевое положение практически во всех наземных
экосистемах, определяя существование и состав остальных биологических
компонентов биогеоценозов: животных и микроорганизмов.
Влияние нефти на растения обусловлено, как ее
непосредственным токсическим воздействием, так и трансформацией почвенной среды
[15].
Морфологические и анатомические изменения
растений.
Нефть оказывает отрицательное влияние на рост,
метаболизм и развитие растений, подавляет рост надземных и подземных частей
растений, в значительной степени задерживает начало цветения. Загрязненные
нефтью цветки редко образуют семена [16].
Нефтяное загрязнение в значительной мере
изменяет морфологию растения. Наблюдается уменьшение роста стебля в высоту,
уменьшение его радиального роста, нефтяное загрязнение ингибирует ростовые
процессы. В условиях загрязнения нефтью значительно снижается площадь
ассимиляционной поверхности растений (у мезофитных и ксерофитных растений).
Корневая система уменьшает свои размеры, меняет свою морфологию (переход от
мочковатого типа корневой системы к стержневому). Прекращается формирование
клубеньков и развитие корневых волосков.
Значительным изменениям подвергаются
анатомические особенности растений. Увеличивается толщина листовой пластинки,
исчезает кутикула, уменьшаются размеры клеток и количество хлоропластов. В
корневой системе растений происходит утолщении эпидермы, увеличивается
количество ксилемных элементов и размер центрального цилиндра, объем воздухоносных
тканей. Размеры ксилемных элементов сокращаются, что обеспечивает корню более
выгодный энергетически механизм поглощения и транспорта воды и минеральных
элементов.
Изменения анатомии и морфологии органов
направлены на создание защитных механизмов и выполняют компенсаторную функцию в
ответ на нефтяное загрязнение. Ответная реакция растений на нефтяное
загрязнение зависит от их принадлежности к экологической группе. Наблюдается
усиление ксероморфных признаков у устойчивых к нефтяному загрязнению растений,
что обеспечивает им защиту от токсического действия нефти.
В литературе отмечается различная реакция
растений на нефть в зависимости от их биоморфы и систематической принадлежности
[17].
В целом на нефтезагрязненых почвах у растений
отмечаются следующие физиономические и фенологические отклонения от нормы:
) появление гигантских и карликовых форм;
) нарушение нормальных пропорций во внешнем
облике растений;
) возникновение наростов, наплывов, утолщений,
придающих отдельным экземплярам уродливый облик;
) нарушение нормального ритма развития
(повторное цветение видов, нормально цветущих один раз в сезон);
) сильная поврежденность растений вредителями
[18].
Биохимические и физиологические изменения.
Нефтяное загрязнение почв в значительной мере
влияет на уровни содержания фотосинтетических и флавоноидных пигментов в
листьях растений.
У растений, произрастающих в условиях
нефтезагрязнения, наблюдается снижение содержания всех фотосинтетических
пигментов (хлорофилла а, хлорофилла b,
каротиноидов) и возрастание количества флавоноидных соединений. Так же нефтяное
загрязнение может способствовать накоплению антоциановых пигментов [14].
С ростом концентрации нефти в почве уменьшается
содержание нитратов в корнеплодах, и заметно увеличивается концентрация витамина
С. Повышение концентрации витамина в корнеплодах обусловлено ухудшением условий
минерального питания расений.
На клеточном и физиологическом уровне
воздействие углеводородов нефти на растения проявляется в нарушении структуры
хлоропластов и фотосинтеза. Углеводороды повреждают мембраны хлоропластов,
митохондрий, мембраны клеток корня. Растения, растущие при нефтяном загрязнении
почвы, содержат значительно большее количество веществ со стресспротективными
свойствами.
Поступая в клетки и сосуды растений, нефть
вызывает токсические эффекты. Они проявляются в быстром повреждении,
разрушении, а затем в отмирании всех живых, активно функционирующих тканей
растений в вегетирующем состоянии [19].
Таким образом под действием нефтяных загрязнений
в растениях происходят различные изменения как внешние, которые можно различить
визуально, так и внутренние, которые можно обнаружить только с помощью
специальных исследований и проведения ряда анализов.
Устойчивость растений к нефтяному загрязнению
сильно зависит от стадии их развития и биомассы. Наиболее чувствительны к
токсическому воздействию нефтепродуктов растения, находящиеся на ранних стадиях
развития, а устойчивы - многолетние взрослые растения, так как у них происходит
отрастание новых органов из спящих почек после гибели части растений после
загрязнения [17].
Очевидно, что способность различных растений
произрастать в условиях нефтяного загрязнения неодинакова. Выявление и изучение
растений, способных не только произрастать на нефтезагрязненных почвах, но и
способствовать их восстановлению является важным аспектом для повышения
эффективности очистки нефтезагрязненных почв [20].
.2.2 Влияние нефтяного загрязнения на
микробиологические процессы в почве
Процесс естественного фракционирования и
разложения нефти начинается с момента ее поступления на поверхность почвы.
Выделяют три наиболее общих этапа трансформации нефти в почвах:
) физико-химическое и частично
микробиологическое разложение алифатических углеводородов;
) микробиологическое разрушение главным образом низкомолекулярных
структур разных классов, новообразование смолистых веществ;
) трансформация высокомолекулярных соединений;
смол, асфальтенов, полициклических углеводородов.
Длительность всего процесса трансформации нефти
в разных почвенно-климатических зонах различна: от нескольких месяцев до
нескольких десятков лет [21].
Загрязнение нефтью оказывает отрицательное
воздействие на химические, физические и биологические свойства почв. Под
влиянием нефти и ее компонентов изменяется численность микроорганизмов основных
физиологических групп, ухудшаются агрофизические, агрохимические свойства
почвы, снижаются активность окислительно-восстановительных и гидролитических
ферментов, обеспеченность почвы подвижными формами азота и фосфора [23].
На разложение нефти в почве решающим образом
влияет функциональная активность комплекса почвенных микроорганизмов,
обеспечивающих полную минерализацию нефти и нефтепродуктов до углекислого газа
и воды. На первой стадии изменение почвенной биоты характеризуется массовой
гибелью мезо- и микрофауны; на второй стадии - «бумом» микробиологической
активности специализированных микроорганизмов и последующей постепенной
эволюцией биоценоза, коррелирующей с постоянно изменяющейся геохимической
ситуацией в почве.
В работе Н.А. Киреевой показана токсичность
ароматических углеводородов для микроорганизмов почвы и их негативное
воздействие на ферментативную активность. Наиболее чувствительными к
загрязнению ароматическими углеводородами являются нитрифицирующие и
целлюлозоразрушающие микроорганизмы, которые могут служить индикаторами
загрязнения почв [22].
Загрязнение нефтью существенно изменяет комплекс
почвенных актиномицетов, снижая их численность и обедняя видовой состав. Кроме
того, в загрязненной нефтью почве возрастает число фитопатогенных и
фитотоксичных видов микроскопических грибов. Развитие фитотоксичных форм грибов
может усилить отрицательное воздействие на почву нефтяного загрязнения.
Показано, что загрязнение нефтью приводит к
существенному (на два порядка) снижению численности гетеротрофной части
микробного комплекса, отмеченного на начальных этапах воздействия нефти. Через
три месяца происходит восстановление численности гетеротрофов.
Первоначально, в интервале концентраций нефти
соответствующих зоне гомеостаза (до 1 мл/кг), она не оказывает существенного
влияния на почвенную микробиоту, выступает как биологический стимулятор. Более
высокие дозы (зона стресса 1-30 мл/кг) приводят к необратимым изменениям
микробиологических свойств почвы, а в дальнейшем, - к нарушению
её водно-воздушного режима. Затем, в зоне резистентности, она становится
основным трофическим субстратом для углеводородокисляющих микроорганизмов,
одновременно угнетая жизнедеятельность
других гетеротрофных микроорганизмов, растений и животных. Наконец, при ещё
больших дозах, в зоне репрессии, нефть выступает как ингибитор биологической
активности почвы.
Изменения микробиологических параметров почвы
первыми рассматриваются как значимые экологические нарушения. Они зафиксированы
при концентрациях нефти более 1-5 мл/кг в зависимости от типа почвы [23].
1.3 Микробная деградация углеводородов нефти
.3.1 Микроорганизмы - деструкторы нефти и
нефтепродуктов
Способность усваивать углеводороды нефти присуща
микроорганизмам, представленным различными систематическими группами. К ним
относятся различные виды микромицетов, дрожжей и бактерий. Наиболее активные
деструкторы нефти встречаются среди бактерий. Они характеризуются способностью
к усвоению широкого спектра углеводородов, включая и ароматические, обладают
высокой скоростью роста и, следовательно, представляют большой практический
интерес.
Микроорганизмы, использующие углеводороды,
широко распространены в природе. Активные формы микроорганизмов выделяются из
разнообразных водных и почвенных экосистем, особенно загрязнённых углеводородами
или нефтью, а также из микрофлоры нефти и пластовых вод нефтяных месторождений.
Были описаны 22 рода бактерий, 31 род микроскопических грибов и в том числе 19
родов дрожжей, выделенных из почвенных экосистем, способных к биодеградации
различных нефтяных углеводородов. Из морской среды обитания выделено 25 родов
бактерий и 27 родов углеводородокисляющих микроскопических грибов. В их числе
бактерии родов Achromobacter,
Acinetobacter, Alcaligenes,
Arthrobacter, Bacillus,
Brevibacterium, Citrobacter,
Clostridium, Corynebacterium,
Desulfovibrio, Eneribacer,
Escherichia, Flavobacterium,
Methanobacterium, Micrococcus,
Micromonospora, Mycobacterium,
Nocardia, Rhodococcus,
Pseudomonas, Sarcina,
Serratia, Spirillum,
Streptomyces, Thiobacillus,
Vibrio; мицелиальные
грибы родов Aspergillus,
Cephalosporium, Penicillium,
Mucor, Fusarium,
Trichoderma; дрожжи Candida,
Debaryomyces, Endomyces,
Endomycopsis, Hansenula,
Rhodotorula, Saccharomyces,
Torulopsis, Trichosporon;
цианобактерии Agmenellum,
Aphanocapsa, Lyngbya,
Microcoleus, Oscillatoria,
Phormidium, Plectonema
[24].
Как видно, углеводородокисляющая группа
микроорганизмов природного происхождения таксономически очень разнообразна.
Наиболее активные бактериальные штаммы относятся к родам: Pseudomonas,
Arthrobacter, Rhodococcus,
Acinetobacter, Flavobacterium,
Corynebacterium, Xanthomonas,
Alcaligenes, Nocardia,
Brevibacterium, Mycobacterium,
Beijerinkia, Bacillus,
Enterobacteriaceae, Klebsiella,
Micrococcus, Sphaerotilus.
Среди актиномицетов внимание привлекает многочисленный род Streptomyces.
Из дрожжей выделяют род Candida
и Torulopsis [25].
Постоянными и доминирующими компонентами
естественных биоценозов нефтяных загрязнений являются родококки, их основная
экологическая функция - аккумуляция газообразных н-алканов, жидких
углеводородов нефти и трансформация их в биомассу. Бактерии этого рода
отличаются высокой жизнестойкостью при действии неблагоприятных факторов -
низкой температуры, солнечного ультрафиолета, длительного отсутствия
питательных веществ. Естественная нефтеокисляющая микрофлора нефтезагрязненной
тундровой почвы представлена главным образом бактериями R.
Еrythropolis. В связи с этим
понятен интерес к родококкам - деструкторам нефти [24].
В настоящее время активно ведётся поиск
микроорганизмов, разрушающих нефть, в особенности при низких температурах. Т.В.
Коронелли провел скрининг коллекции углеводородокисляющих бактерий родов Pseudomonas,
Arthrobacter, Rhodococcus
на агаризованной среде с парафином при температуре 6°С с целью выбора штамма,
сохраняющего углеводородокисляющую активность при низких температурах.
Отобранные таким образом 17 штаммов выращивали в жидкой среде с нефтью при
температуре 8°С. Через 14 суток определяли концентрацию нефтяных углеводородов
методом ИК-спектроскопии. Оказалось, что 12 штаммов использовали от 13 до 36%
внесенной нефти, два штамма - 5-6%, а три были неэффективными. Все 12 штаммов
являлись представителями рода Rhodococcus:
11 штаммов принадлежали к виду R.
Еrythropolis, один - к виду R.
Мaris [25].
Немалый интерес представляют спорообразующие
бактерии, так как они наиболее устойчивы к различным неблагоприятным
воздействиям окружающей среды [26].
Выбор активного микроорганизма-деструктора
углеводородных загрязнений должен производиться с учетом ряда требований. При
поиске микроорганизма-деструктора необходимо учитывать, что вносимая в почву
микробная биомасса не должна быть чужеродной для почвенной микрофлоры. Еще
одним важным требованием к вносимым в почву микроорганизмам является их
непатогенность. В связи с тем, что технология микробиологической очистки
загрязненных почв предусматривает аэробные условия, необходимо вести выбор
микроорганизма-деструктора среди аэробных и факультативно-анаэробных
микроорганизмов. Микробные клетки могут подвергаться воздействию неблагоприятных
факторов окружающей среды, следовательно, микроорганизм-деструктор должен
обладать высокой жизнестойкостью [27].
.3.2 Процесс микробиологического окисления
углеводородов нефти
Микробиологические превращения углеводородов
представляют собой особую область из-за некоторых особенностей этих процессов.
Их специфика обусловлена своеобразием углеводородов как химических соединений с
предельной восстановленностью и связанными с этим гидрофобными свойствами.
Оказалось, что гидрофобность углеводородной молекулы имеет большое значение для
химизма микробиологического окисления этих соединений, их транспорта в
микробную клетку, динамики роста культур, их физиологии, многих аспектов
технологии процессов, связанных с применением субстратов углеводородной природы.
Все реакции микробиологического превращения
углеводородов являются окислительными. Предельная восстановленность этих
веществ делает необходимым для их окисления присутствие кислорода. Гидрофобный
характер молекулы является причиной того, что процессы окисления осуществляются
оксигеназами, в отличие от окисления более гидрофильных веществ, происходящего
под действием дегидрогеназ. Гидрофобность углеводородных субстратов и их плохая
растворимость в воде определяют способы транспорта веществ в клетку.
Характерной особенностью процесса ассимиляции
углеводородов в качестве источника углерода является часто встречающееся
накопление промежуточных продуктов в культуральной среде микроорганизмов,
растущих за счёт таких субстратов [28].
Окисление углеводородов большинством известных
микроорганизмов осуществляется с помощью адаптивных энзимов (ферментов). Этот
факт установлен многочисленными экспериментами по окислению углеводородов
клетками микроорганизмов, выращенных на неуглеводородных субстратах.
.3.2.1 Пути поступления углеводородов в клетки
микроорганизмов
Имеющиеся разнообразные данные о поступлении
углеводородов в клетки микроорганизмов, локализации углеводородокисляющих
ферментов и образующихся продуктов не оставляют сомнений в том, что
углеводороды окисляются внутриклеточно. Отсюда вытекает необходимость объяснить
поступление нерастворимого в воде субстрата в клетку.
Различают следующие виды транспорта
углеводородов в клетки микроорганизмов:
пассивный перенос:
а) простая диффузия - неспецифическое поступление
веществ в клетку, при котором различные соединения проникают в клетку, не
взаимодействуя с каким-либо переносчиком;
б) облегчённая диффузия - специфический процесс,
при котором переносимое вещество обратимо связывается с переносчиком,
находящимся в мембране, и поступает в клетку в виде субстрат-белкового
комплекса. При этом скорость поступления веществ равна скорости его выхода из
клетки.
Оба эти процесса не требуют энергии, и скорость
их зависит от концентрации субстрата в среде.
активный перенос - вещество поступает в клетку
против градиента концентрации в среде; процесс требует затрат энергии и
происходит с помощью специфических белков-переносчиков (пермеаз).
Дальнейшие ограничения связаны с растворимостью
субстрата в воде. Поступление субстрата в микробную клетку может осуществляться
либо из состояния истинного раствора, либо при непосредственном контакте его с
клеткой.
Процесс поглощения определяется как активный
транспорт в соответствии со следующими параметрами:
специфичность по отношению к субстрату; на
наружной поверхности мембраны образуется комплекс переносчик - субстрат;
потребность в метаболической энергии; переносчик
обладает высоким сродством к субстрату, если он обращен к внешней поверхности
мембраны, и низким сродством к нему, если обращен к ее внутренней поверхности.
На эти изменения переносчика и расходуется энергия;
транспорт соответствующего субстрата против
градиента концентрации; это происходит за счет изменения сродства переносчика к
субстрату при переходе снаружи внутрь;
освобождение в цитоплазму немодифицированного
субстрата (в отличие от переноса групп).
Только низкомолекулярные жидкие углеводороды от C5
до C11,
а также некоторые ароматические углеводороды могут незначительно растворяться в
воде, более высокомолекулярные гомологи практически нерастворимы [29].
.3.2.2 Микробиологическое окисление
углеводородов нефти и нефтепродуктов
Окисление нормальных парафинов
Пути окисления нормальных парафинов
микроорганизмами, использующими эти соединения в качестве источников углерода и
энергии, изучены достаточно подробно.
В преобладающем большинстве случаев в результате
первичной ферментативной атаки молекулы н-парафина происходит окисление
терминального атома углерода. Первыми стабильными продуктами окисления
углеводородов являются первичные спирты.
Следующий этап составляют обычные биологические
превращения спирта в альдегид и альдегида в кислоту. Общая схема реакций
выглядит следующим образом:
R-CH2-CH3+
[O] → R-CH2-CH2OH
- 2H →
R-CH2-CHO
- 2H + HOH
→
(1) R-CH2-COOH
Дальнейший механизм усвоения жирных кислот,
возникающих при окислении углеводородов, протекает путем β-окисления,
заключающегося в последовательном отщеплении двууглеродных фрагментов в виде
активного ацетата, поступающего в цикл трикарбоновых кислот [30].
H.B.
Lukins и J.W.
Foster установили, что
некоторые микобактерии метаболизируют н-алканы через метилкетоны с
промежуточным образованием перекиси и вторичного спирта [31].
Дальнейшее окисление кетонов изучено пока
недостаточно.
На основании работ F.W.
Forney и A.J.
Markovetz деградация
тридекана культурой Pseudomonas
aeruginosa представляется
следующим образом [32]:
СН3(СН2)11СН3
→ СН3(СН2)10СНОНСН3 →
СН3(СН2)10СОСН3→ СН3(СН2)9СН2ОСОСН3
→СН3(СН2)9СН2ОН+СН3СООН↓СН3(СН2)9СООН.
(2)
Окисление алкенов
Микробиологическое окисление алкенов может
включать следующие реакции:
а) окисление метильной группы с образованием
ненасыщенных кислот; б) образование эпоксидов по двойной связи; в) образование
диолов. Ненасыщенные углеводороды могут окисляться одновременно и по метильной
концевой группе и по двойной связи молекулы.
Еще в 60-е гг. Стюарт с сотрудниками показали,
что эфирообразующие бактерии Micrococcus
cerificans окисляли метильную
группу алкенов-1, не затрагивая двойную связь молекулы. Впоследствии детальные
исследования, проведенные Ван-дер-Линденом и Тийссе выявили и другой путь
окисления алкенов, ведущий к образованию эпоксидов, диолов, α-оксикислот
и ненасыщенных кислот [33].
Изучая окисление тетрадецена культурой Pseudomonas
aeruginosa, A.J.
Markovetz с сотрудниками
обнаружили оба пути окисления. Ими были выделены и идентифицированы
тетрадеценовая-13 кислота и тетрадеканол-2. Это свидетельствовало о том, что и
метильная группа и терминальная двойная связь подвергались атаке этой
культурой. Позже были обнаружены оба пути окисления гексадецена-1 и
октадецена-1 культурой Micrococcus
cerificans [34].
На основании этих работ можно дать схему реакций
окисления алкенов бактериями, представленную на рисунке 1:
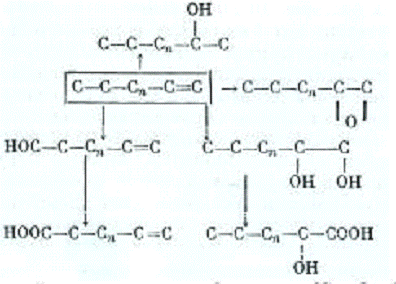
Рисунок 1 - Схема реакций окисления алкенов
бактериями
Окисление циклоалканов
Описано несколько примеров полной деградации
циклопарафинов и их производных, причем показано, что деградации циклоалканов
нередко предшествует их ароматизация.
Впервые микробиологическая трансформация
циклопарафинов описана J.S.
Ooyama и J.W.
Foster. Микроорганизм Mycobacterium
vaccae, способный
усваивать изоалканы, в частности 2-метилбутан, окислял циклические алканы до
соответствующих кетонов суспензиями отмытых клеток.
Гомологи ряда циклопарафинов от С3 до
С8 превращались в соответствующие цикломонокетоны. Окисление
циклоалканов до циклокетонов, по-видимому, происходило через образование
цикломоноспиртов.
Детально исследовалось окисление циклоалканов G.S.
Fonken с сотрудниками.
Была изучена большая группа грибов и бактерий на способность окислять
циклопентаны при росте на различных субстратах: пептоне, декстрозе, солодовом и
кукурузном экстрактах.
Авторам удалось с помощью этих организмов
провести окисление циклогексана, фенилциклогексана, циклогексилсульфонов,
циклопентилсульфонов и других до соответствующих оксипроизводных. На рисунке 2
и 3 приводятся типичные примеры окислительных трансформаций циклоалканов [35]:
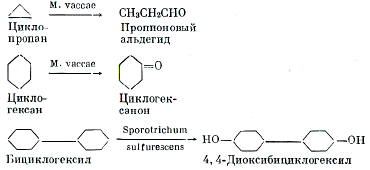
Рисунок 2 - Схема реакций окисления
циклопропана, циклогексана и бициклогексила
Деградация фенантрена
К настоящему времени описано 2 различных пути
деградации фенантрена, которые представлены на рисунке 4. Сначала фенантрен в
результате последовательных реакций трансформируется до 1-гидрокси-2-нафтойной
кислоты. Дальнейшие биохимические пути деградации этого соединения могут быть
различны: 1-гидрокси-2-нафтойная кислота метаболизируется либо через салицилат
и катехол, либо через образование о-фталата и прокатехата. Катехол и
протокатехат далее расщепляется по орто- или мета-пути до интермедиатов цикла
Кребса.
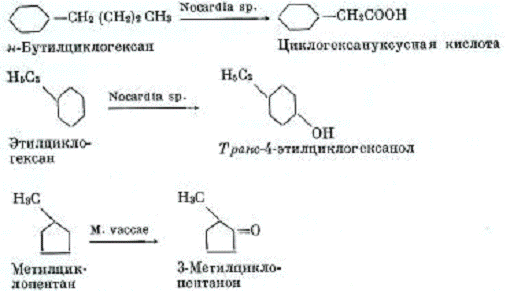
Рисунок 3 - Схема реакций окисления
н-бутилциклогексана, этилциклогексана и метилциклопентана
Большим катаболическим потенциалом в отношении
ароматических углеводородов обладают бактерии рода Pseudomonas.
Они способны полностью утилизировать или частично трансформировать такие
соединения, как нафталин, фенантрен, флуорен и др.
Структурное сходство нафталина и фенантрена и
данные относительно ферментов, участвующих в катаболизме этих соединений,
позволили предположить возможность модификаций генетических систем
биодеградации нафталина с приобретением ими способности детерминировать
деградацию фенантрена [36].
Деградация антрацена
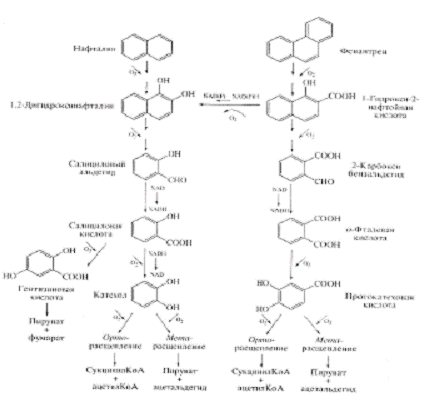
Рисунок 4 - Пути микробной деградации нафталина
и фенантрена
При биотрансформации антрацена, антрахинон
является тупиковым соединением и часто накапливается в культуральной жидкости
микроорганизмов. 6,7-бензокумарин является продуктом спонтанного замыкания
кольца продукта экстрадиольного расщепления цис-1,2-дигидроксиантрацена, что
предполагает обязательное существование и антрацен цис-1,2-дигидродиола -
первого интермедиата в пути разложения антрацена, найденного у других
микроорганизмов. Были предложены два пути частичной конверсии антрацена
представленных на рисунке 8, включающие в себя трансформацию антрацена в
антрахинон и параллельный процесс последовательного превращения антрацена через
цис-1,2-дигидрокси-1,2-дигидроантрацен, 1,2-дигидроантрацен в 6,7-бензокумарин.
Деградация флуорена
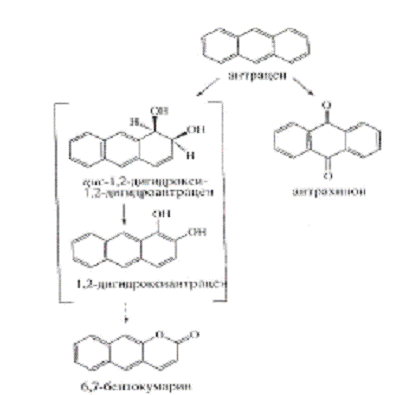
Рисунок 5 - Схема биоконверсии антрацена
Изучение превращения флуорена микроорганизмами
проводилось как смешанными, так и чистыми культурами. Большую роль в
детоксикации флуорена и ряда других ароматических углеводородов играют бактерии
рода Rhodococcus,
широко распространенные в окружающей среде [37].
Родококками
Обозначения: 1 - 9-гидроксифлуорен; 2 -
2-гидроксифлуорен; 3 - 9-флуоренон; 4 - гидроксифлуоренон; 5 -
дигидроксифлуорен; 6 - β-инданон-β-гидроксиуксусная
кислота; 7 - формилинданон; 8 - 1-инданон; 9 - 3,4-дигидрокумарин.
Окисление алкилзамещённых ароматических
углеводородов
Использование микроорганизмами алкилзамещенных
ароматических углеводородов для роста достаточно хорошо известно, хотя и не
является обычным свойством микробных культур. Описано окисление толуола
культурами Nocardia
и Pseudomonas, м- и n-
ксилолов, кумола, цимола, псевдокумола, 1- и 2-метилнафталинов различными
видами рода Pseudomonas.

Рисунок 6 - Предполагаемые пути трансформации
флуорена
Ассимиляция простейшего метилпроизводного
бензола - толуола - свойственна небольшому числу микроорганизмов. Описано всего
несколько культур Nocardia
и Pseudomonas, способных
потреблять это соединение как субстрат для роста. У разных организмов начальные
этапы окисления толуола связаны или с первоочередным окислением метила, или
гидроксилированием ядра.
Алкилнафталины, как субстрат для роста
микроорганизмов, изучены более поверхностно. Тем не менее, показано, что
культуры Pseudomonas
окисляют 1- и 2-метилнафталины.
Микрорганизм рода Pseudomonas
E. Leibnitz
с сотрудниками в опытах окислял ксиленолы до соответствующих оксикислот в
процессе роста на среде с кукурузным экстрактом [38]:
Биогенное окисление нефтей различных по
химическому составу
В процессе окисления нефти большую роль играет
взаимное влияние угдеводородных и неуглеводородных компонентов, входящих в её
состав. При анаэробном и аэробном микробиальном разрушении независимо от типа
нефтей повышается их плотность, увеличивается содержание смолисто-асфальтеновых
соединений, серы и уменьшается концентрация парафиновых углеводородов в
системе. При этом отмечено остаточное накопление нафтеновых углеводородов.
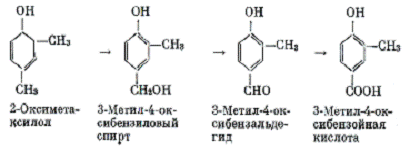
Рисунок 7 - Окисление 2-оксиметаксилола
бактериями рода Pseudomonas
Снижение парафинового потенциала нефтей при
биохимическом окислении происходит за счёт удаления из модельных систем
н-алканов как веществ, преимущественно потребляемых микроорганизмами. Среди
н-алканов бактериями лучше усваиваются низкомолекулярные соединения, что было
доказано на углеводородах ряда от C14
до C20.
Кроме того, не установлено какой-либо избирательности в биоокислении
углеводородов с чётным или нечётным числом атомов C
в молекуле.
От физиологических особенностей каждого рода
микроорганизмов зависит направленность процесса деструкции индивидуальных
углеводородов и их смесей, обладающих различной степенью устойчивости к
окислению.
Изменение группового состава нефтей необходимо
учитывать при разработке технологии очистки почв от нефтяного загрязнения.
Практическая помощь нефтяной микробиологии в
решении этой проблемы заключается в выделении чистых культур
углеводородокисляющих микроорганизмов, установлении их родовой принадлежности и
степени активности в окислении нефтей и нефтепродуктов.
Таблица 1 - Классификация компонентов нефтей по
их способности к биодеградации
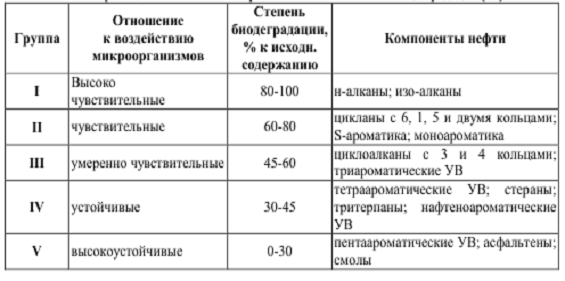
Наиболее активные штаммы углеводородокисляющих
микроорганизмов, окисляющие в значительной степени устойчивые к биодеградации
компоненты нефти, являются наиболее перспективными для создания на их основе
биопрепаратов по очистке почв от нефтяного загрязнителя.
Исследование же способности микроорганизмов окислять
конкретные классы углеводородов в составе нефтей, как было показано выше,
позволяет в перспективе создавать биопрепараты целевого назначения [39].
.4 Растительно-микробные системы для
биоремедиации нефтезагрязненных почв
.4.1 Ростстимулирующие ризосферные бактерии
Ростстимулирующие ризобактерии (plant
growth promoting
rhizobacteria - PGPR)
играют важную роль в адаптации растения к внешним воздействиям. Таксономически
эти бактерии чрезвычайно разнообразны (наиболее изучены представители родов
Azospirillum, Azotobacter, Klebsiella, Psеudomonas и Bacillus). Они обитают в
ризосфере (зона почвы, непосредственно соприкасающаяся с корнями), которая
служит их основной экологической нишей с наиболее благоприятными условиями, и
на поверхности корней. В ризосферу из корней активно поступают сложные смеси
легкодоступных органических источников энергии и углерода, что обусловливает ее
высокую микробиологическую активность и образование отличающихся от почвенного
микробоценоза специфических ризосферных микробных сообществ. Разнообразие таких
сообществ во многом определяется количественным и качественным составом
корневых выделений, зависящим от вида, возраста и условий выращивания растения,
а также от влияния комплекса почвенно-климатических факторов. В свою очередь,
микробиологическая активность в ризосфере приводит к существенному изменению
химических и физических свойств этой зоны и накоплению продуктов
жизнедеятельности микроорганизмов, биологически активных по отношению к
растению. Для изучения взаимодействий растений с полезными формами бактерий в
ризосфере продуктивна концепция, согласно которой ризобактерии образуют с
растением единую растительно-микробную систему (ассоциацию) с новыми
свойствами, детерминированными положительным взаимодействием партнеров.
В развивающемся устойчивом земледелии применение
ризобактерий для улучшения роста и питания сельскохозяйственных культур служит
одним из перспективных подходов. Однако механизмы взаимодействия компонентов
растительно-микробных систем, условия реализации ростстимулирующего потенциала
ризобактерий и критерии отбора наиболее эффективных ассоциативных штаммов во
многом еще требуют фундаментального изучения [40].
1.4.2 Образование ассоциативного симбиоза
Корневые экссудаты
Важнейшим фактором образования ассоциативных
симбиозов является выделительная функция корней растений.
Сведения о корневых выделениях пополнились в
результате изучения их качественного состава. Большая серия работ
продемонстрировала специфичность набора экссудатов в ризосфере у разных видов растений.
Состав корневых выделений зависит также от стадии развития растения, условий
роста, физико-химических свойств среды, в которой развивается корневая система.
Корневые экзометаболиты проявляют неодинаковые физиологические свойства и
представлены спектром органических соединений из разных классов. Это
водорастворимые вещества, поступающие из корней в почву; высокомолекулярные
полисахариды (муцигель), образующие тонкие слои на поверхности корней;
отслаивающиеся клетки корневого чехлика, которые частично остаются в корневой
зоне; отмирающие клетки эпидермиса; летучие и газообразные метаболиты
прорастающих семян и корней [41].
Корневые выделения оказывают значительный эффект
на рост и активность почвенных микроорганизмов. Благодаря использованию
современных методов исследования появилось множество экспериментальных
доказательств изменения структуры микробных сообществ ризосферы в зависимости
от состава корневых экзометаболитов. Хорошо изученным примером взаимного
влияния растений и микроорганизмов служит бобово-ризобиальный симбиоз. На
ранней стадии его формирования состав и количество сигнальных молекул
(флавоноидов) в корневых выделениях определяет специфичность и интенсивность
взаимодействия растения с определенными видами клубеньковых бактерий, активность
которых в ризосфере, в свою очередь, изменяет экссудацию сигнальных молекул
растением. Похожий механизм выявлен и у арбускулярной микоризы.
Не только симбиотические, но и другие
ризосферные микроорганизмы воздействуют на корневую экссудацию. Ее усиление
может происходить за счет дополнительного градиента концентрации органических
соединений, направленного от поверхности корня и вызванного трофической
активностью микроорганизмов, а также влияния микробных экзометаболитов.
Обнаружение в корневых выделениях веществ, аналогичных по механизму действия
бактериальным сигналам кворум-сенсинга (QS
signal mimics),
приводит к выводу о способности растения регулировать рост и активность
популяций ассоциативных ризобактерий в ризосфере. Основываясь на полученных данных
о роли микроорганизмов в физиологических процессах у растений, современная
почвенная экология рассматривает ризосферу как систему с обратными связями, в
которой трансформация биогенных элементов, сигнальных молекул и энергии
определяется степенью интеграции метаболических процессов и физико-химическим
состоянием партнеров.
Возможность генетической модификации растений с
целью изменения состава и количества корневых экзометаболитов, открывает
перспективы для формирования микробно-растительных систем с улучшенной
способностью к адаптации в стрессовых условиях и высокой продуктивностью, на
что и ориентирована современная селекция [42].
Известна способность ростстимулирующих
ризобактерий повышать интенсивность фотосинтеза, что может усиливать приток
фотосинтатов в корни и экссудацию. Интерес также представляет повышение
содержания в корневых выделениях органических кислот. Они играют важную роль в
ассоциативной азотфиксации и конкурентной колонизации корней ризобактериями,
повышают антифунгальную активность штаммов - антагонистов фитопатогенных
грибов. Селекция подобных генотипов требует глубокого изучения корневых
выделений у сельскохозяйственных культур и их метаболизма в ризосфере,
поскольку необходимо четко определить процедуры проверки результатов отбора
[43].
Важную роль в образовании
растительно-бактериальных ассоциаций могут играть бактериальные гликопротеины -
лектины, которые участвуют в колонизации корней бактериями, а также стимулируют
активность растительных ферментов и ростовые процессы. Выявлено сильное
ростстимулирующее действие летучих метаболитов ацетоина и 2,3-бутандиола,
продуцируемых штаммами Bас.
subtilis и Bас.
amyloliquefaciens, в
отношении Arabidopsis
thaliana [44].
Колонизация корней ризобактериями
К необходимым условиям эффективного
взаимодействия интродуцируемых популяций ризобактерий с растениями относится
способность интродуцента активно колонизировать корни и поддерживать
экологически значимую численность популяции. Колонизация корней ризобактериями
- сложный мультистадийный и энергоемкий процесс, за который ответственно
большое число бактериальных и растительных генов. Он может быть разделен на
несколько стадий: хемотаксис к корневым экзометаболитам, адсорбцию,
формирование микроколоний в местах интенсивной экссудации корневых метаболитов,
миграцию вдоль корневой поверхности и конкуренцию с другими микроорганизмами.
По данным сканирующей электронной микроскопии, микроколонии ризобактерий на
поверхности корней покрыты слизеподобным слоем, предохраняющим клетки и колонию
в целом от неблагоприятных воздействий.
Для успешной колонизации корней важна
способность бактерий утилизировать основные компоненты корневых выделений, в
особенности низкомолекулярные органические кислоты. В ризосфере у диплоидных
генотипов пшеницы с высоким относительным содержанием органических кислот в
корневых выделениях численность ассоциативных азотфиксаторов и других
ризобактерий росла интенсивнее.
Активная колонизация ризосферы и поверхности
корней служит важным критерием отбора полезных форм ризобактерий,
предназначенных для инокуляции растений [45].
1.4.3 Механизмы положительного действия
ризосферных бактерий на растения
Азотфиксация
В основном изучены взаимодействия растений с
азотфиксирующими ризобактериями (диазотрофами). Наиболее изученные ассоциативные
азотфиксаторы - бактерии родов Azospirillum,
Azotobacter и Klebsiella.
Показано, что ассоциативная азотфиксация при определенных условиях вносит
существенный вклад в обеспечение растений азотом. Среди недавних таких
исследований представляет интерес сообщение, что при инокуляции бактерией Azospirillum
amazonense растения риса
содержали до 27 % N2
атмосферы.
Продуцирование фитогормонов
К важнейшим механизмам взаимодействия в
растительно-бактериальных ассоциациях относится продуцирование бактериями фитогормонов
(ауксинов, цитокининов и гиббереллинов), витаминов и других биологически
активных веществ. Наибольшее внимание уделялось роли бактериальных ауксинов в
стимуляции роста и питания растений, поскольку способность синтезировать
индолил-3-уксусную кислоту (ИУК) широко распространена среди ризобактерий.
Изучены биохимические пути и гены, ответственные за синтез ИУК, а также
фенотипические эффекты экзогенных ауксинов на растения. Выявлен положительный
эффект бактериальных ауксинов на инициацию и удлинение корней, развитие боковых
корней и корневых волосков, что может иметь значение для ускоренного роста,
потребления питательных элементов и устойчивости растения к стрессам. Синтез
ауксинов ризосферными микроорганизмами в значительной степени определяется составом
корневых выделений, содержащих их основной метаболитический предшественник L-триптофан.
Многие ризобактерии способны синтезировать цитокинины и гиббереллины [46].
Необходимо также учитывать, что некоторые
бактерии могут не только продуцировать, но и деградировать фитогормоны. Так,
описаны штаммы Ps.
putida, расщепляющие ИУК,
что может быть использовано для снятия ингибирующего действия суперпродуцентов
ИУК, к которым относятся фитопатогены, на растения. Однако как ризобактерии,
расщепляющие фитогормоны, так и реакция растений на эту деструкцию требуют
более детального изучения [47].
Способность к растворению труднодоступных
фосфатов
Способность ризосферных бактерий растворять
труднодоступные почвенные фосфаты давно рассматривается как важный механизм
положительного действия на фосфорное питание растения. Недавно были обобщены
результаты многолетних исследований по экологии, селекции и таксономии
фосфатмобилизующих бактерий, а также их ассоциаций с растениями и эффективности
инокуляции. Изучены бактериальные гены кислых фосфатаз и фитаз, расщепляющих
органофосфаты, а также гены, участвующие в растворении минеральных фосфатов,
например ответственные за биосинтез глюконовой кислоты. Многие бактерии могут
повышать доступность фосфататов для растения за счет простого подкисления среды
в процессе жизнедеятельности, в частности при утилизации сахаров с образованием
органических кислот. Благодаря такому неспецифическому эффекту в определенных
условиях очень многие ризобактерии могут функционировать как фосфатмобилизующие.
Другие механизмы, облегчающие потребление
питательных элементов у растений, обнаружены при изучении их взаимодействия с
бактериями рода Azospirillum.
Так, инокуляция активизировала транспорт протонов из клеток корней и приводила
к подкислению ризосферы, что могло мобилизовать связанные в минералах
питательные элементы, в том числе фосфор. Известны азоспириллы, обладающие
пектолитической активностью, что вызывает повышенную ионную проницаемость у
кортикальных клеток корней. Кроме того, при инокуляции растения потребление
питательных элементов может изменяться из-за их трансформации в ризосфере,
например с участием бактериальной нитратредуктазы [48].
Продуцирование сидерофоров
Важную роль в повышении доступности питательных
элементов способны играть бактериальные сидерофоры - низкомолекулярные
вещества, хелатирующие железо и другие металлы с образованием устойчивых
комплексов. В большей степени изучены сидерофоры, синтезируемые бактериями рода
Pseudomonas. Продукция
сидерофоров ризобактериями связана с удовлетворением их потребностей в железе и
ингибированием конкурентной микрофлоры за счет образования недоступных для нее Fe-сидерофорных
комплексов. Важно, что такие комплексы могут усваиваться растениями, хотя и в
меньшей степени, чем Fe-содержащие
соединения некоторых синтетических хелаторов железа и фитосидерофоров [49].
Интерес к механизмам прямого воздействия
ризобактерий на системы поглощения и транспорта элементов в растениях в
настоящее время возрастает. Наиболее вероятно, что вышеперечисленные
специфические эффекты бактерий служат причиной повышения содержания
определенного элемента в растительных тканях. Существенное влияние бактерий на
рост биомассы растения может не проявиться, если дефицит этого элемента не
представляет собой ростлимитирующий фактор. Однако чаще наблюдают только
повышение накопления (выноса) определенных элементов, обусловленное увеличением
биомассы инокулированных растений. Такое действие бактерий может быть связано
со стимуляцией роста корней, приводящей к освоению ими большего почвенного
пространства и, следовательно, дополнительных питательных ресурсов [50].
Продуцирование АЦК дезаминазы
Универсальным антистрессовым эффектом обладают
бактерии, содержащие фермент 1-аминоциклопропан-1-карбоксилат (АЦК) дезаминазу,
благодаря которому в растениях снижается содержание этилена - сигнальной
молекулы в каскаде неспецифических стрессовых реакций. Бактерии колонизируют
корни растений и используют АЦК в качестве источника питания, что приводит к
снижению ее содержания и, соответственно, интенсивности биосинтеза этилена в
корнях. В результате ингибирующий эффект стрессового этилена на рост растения
подавляется [51].
В настоящее время имеется ряд сообщений о
защитном эффекте АЦК-утилизирующих ризобактерий в условиях токсического действия
тяжелых металлов, дефицита или избытка почвенной влаги, а также осмотического
стресса при засолении почвы.
У растений аминокислота АЦК окисляется АЦК
оксидазой до этилена с образованием углекислого газа, циановой кислоты и воды,
то есть служит непосредственным предшественником при биосинтезе фитогормона
этилена. Этилен вовлечен во многие звенья процессов роста и развития растений,
включая прорастание семян, инициацию и удлинение тканей и органов, цветение,
созревание плодов, старение тканей и реакции на стрессовые факторы. Активизация
биосинтеза АЦК и этилена - неспецифическая реакция растений на различные
стрессы, в которых последний действует как негативный регулятор ростовых
процессов [52].
Известно, что аминокислота АЦК входит в состав
корневых экссудатов и растение поддерживает ее баланс внутри и вне тканей (в
ризосфере ее количество может достигать нескольких микромолей). Симбиотрофные
бактерии используют АЦК как источник азотного и углеродного питания. Для
поддержания равновесия концентраций растение увеличивает отток АЦК из корней в
ризосферу, что приводит к снижению интенсивности биосинтеза этилена в корнях и
его ингибирующего действия на растение.
Таким образом, 1-аминоциклопропан-1-карбоксилат
(АЦК) деаминаза широко распространена у симбиотрофных бактерий.
АЦК-утилизирующие бактерии снижают ингибирование роста растений этиленом,
синтезируемым при абиотических и биотических стрессах, часто присутствуют на
корнях растений и могут быть важным элементом растительно-микробных систем,
особенно в условиях стрессов. Поэтому их следует считать перспективным
компонентом нового типа бактериальных биопрепаратов со специфическим
антистрессовым эффектом [53].
Многие из этих описанных свойств бактерий и
механизмов их положительного влияния на растения могут играть важную роль в
защите последних от неблагоприятных условий среды и абиотических стрессов. Это
обусловлено потенциальной направленностью действия ризобактерий против
негативных эффектов и последствий воздействия стрессоров.
.4.4 Особенности приживаемости ризобактериальных
инокулятов
Эффективность инокуляции растений смешанными
культурами ризобактерий.
Совместное использование нескольких штаммов
ризобактерий с неодинаковыми свойствами и механизмами взаимодействия с
растением неоднократно рассматривалось как возможность улучшения эффективности
инокуляции. Прием основан на расширении экологической пластичности и диапазона
совместимости многокомпонентных бактериальных инокулятов с растением и
использовании принципов аддитивности и синергизма при взаимодействии с
растением нескольких ассоциантов.
В условиях сосуществования в одной
пространственной зоне и конкуренции за корневые экссудаты между активно
взаимодействующими друг с другом ризобактериями образуются трофические и
регуляторные связи. Например, способность фиксировать атмосферный азот делает
диазотрофов чрезвычайно привлекательными партнерами для многих микроорганизмов,
усваивающих только минеральные формы азота. Показано, что бактерии рода Azospirillum
образуют ассоциации с целлюлозоразлагающими (Cellulomonas),
пектинолитическими (Bacillus)
и другими ризосферными бактериями. Такие ассоциации основаны на свойстве
азоспирилл использовать в качестве источника углерода продукты разложения
полимеров бактериями-ассоциантами, снабжая последние фиксированным азотом.
Ризобактерии также играют роль «вспомогательных»
агентов для активизации симбиотических отношений при инокуляции растений
клубеньковыми бактериями и микоризными грибами. Стимулирующее действие может
быть обусловлено как прямым, так и опосредованным влиянием ризобактерий на
микросимбионты (в последнем случае - через положительный эффект на растение)
[54].
Ассоциации интродуцируемых ризобактерий с
аборигенной микрофлорой
Попадая с семенами в почву, интродуценты
вступают в тесный контакт с аборигенной микрофлорой и должны занять
экологическую нишу в корневой зоне прорастающих семян, которая привлекает
многих полезных и вредных для растений микроорганизмов. Как уже отмечалось,
интродуцируемые ризобактерии легко вступают в ассоциации с разнообразными микроорганизмами.
С одной стороны, аборигенные микроорганизмы могут повышать доступность
дополнительных питательных ресурсов для интродуцента, его выживаемость и
активность в зоне корней. С другой стороны, в ризосфере в большой степени
развиты взаимодействия микробов по типу антагонизма и конкуренции за корневые
выделения.
Интродуцируемые ризобактерии образуют ассоциации
не только с полезными, но и с вредными для растений ризосферными аборигенами.
Таким образом, один из важных факторов выживания
и активности интродуцируемых бактерий в ризосфере - взаимодействие с
аборигенными микроорганизмами, в частности устойчивость к их влиянию. Слабая
конкурентоспособность интродуцентов, а также образование ими ассоциации с
вредной для растений микрофлорой или ингибирование активности полезных форм
микроорганизмов может влиять на эффективность инокуляции и искажать ожидаемую
реакцию растений на внесение ризобактерий в почву [55].
1.5 Ремедиация нефтезагрязненных почв
Нефтяное загрязнение отличается от многих других
антропогенных воздействий тем, что оно дает не постепенную, а, как правило,
«залповую» нагрузку на среду, вызывая быструю ответную реакцию. При оценке
последствий такого загрязнения не всегда можно сказать, вернется ли экосистема
к устойчивому состоянию или будет необратимо деградировать. Во всех
мероприятиях, связанных с ликвидацией последствий загрязнения, с
восстановлением нарушенных земель, необходимо исходить из главного принципа: не
нанести экосистеме больший вред, чем тот, который уже нанесен при загрязнении.
Суть восстановления загрязненных экосистем - максимальная мобилизация
внутренних ресурсов экосистемы на восстановление своих первоначальных функций.
Самовосстановление и рекультивация представляют собой неразрывный
биогеохимический процесс.
Естественное самоочищение природных объектов от
нефтяного загрязнения - длительный процесс. В связи с этим, разработка способов
очистки почвы от загрязнения углеводородами нефти - одна из важнейших задач при
решении проблемы снижения антропогенного воздействия на окружающую среду [56].
.5.1 Биоремедиация нефтезагрязненных почв с
помощью микроорганизмов
Существующие механические, термические и
физико-химические методы очистки почв от нефтяных загрязнений дорогостоящи и
эффективны только при определенном уровне загрязнения (как правило, не менее 1%
нефти в почве), часто связаны с дополнительным внесением загрязнения и не
обеспечивают полноты очистки. В настоящее время одной из наиболее перспективной
технологии очистки нефтезагрязненных почв считается интродуцирование в почву
различных комплексов микроорганизмов, отличающихся повышенной способностью к
биодеструкции тех или иных углеводородных компонентов нефти и нефтепродуктов.
Нефть - чрезвычайно сложный и разнообразный по составу субстрат, и это, с одной
стороны, определяет трудности очистки почв, но с другой стороны обуславливает
широкий спектр микроорганизмов, которые могут использовать различные компоненты
и фракции нефти для питания. Способность утилизировать трудноразлагаемые
вещества антропогенного происхождения (ксенобиотики) обнаружена у многих
организмов.
Это свойство обеспечивается наличием у
микроорганизмов специфических ферментных систем, осуществляющих катаболизм
таких соединений. Поскольку микроорганизмы имеют сравнительно высокий потенциал
разрушения ксенобиотиков, проявляют способность к быстрой метаболической
перестройке и обмену генетическим материалом, им придается большое значение при
разработке путей биоремедиации загрязненных объектов [57].
Под термином «биоремедиация» принято понимать
применение технологий и устройств, предназначенных для биологической очистки
почв, т.е. для удаления из почвы уже находящихся в ней загрязнителей.
Биоремедиация включает в себя два основных подхода:
биостимуляция - активизация деградирующей
способности аборигенной микрофлоры внесением биогенных элементов, кислорода,
различных субстратов;
биодополнение - интродукция природных и
генноинженерных штаммов-деструкторов чужеродных соединений.
Биостимуляция in
situ (биостимуляция в
месте загрязнения).
Механизм самовосстановления экосистемы после
нефтяного загрязнения достаточно сложен. С помощью агротехнических приемов
можно ускорить процесс самоочищения нефтезагрязненных почв путем создания
оптимальных условий для проявления потенциальной активности микроорганизмов,
входящих в состав естественного микробиоценоза. Микроорганизмы, потребляющие
углеводороды нефти, являются обычными компонентами биоценозов почв. Во всех
почвах в большом количестве содержатся микроорганизмы, способные окислять
углеводороды различного происхождения (растительного, животного, нефтяного).
Поступление в почву свежего энергетического материала вызывает интенсивное
развитие углеводородоокисляющей микрофлоры, что обеспечивает утилизацию
поллютанта.
Подход in
situ основан на
стимулировании роста природных микроорганизмов, обитающих в загрязненной почве
и потенциально способных утилизировать загрязнитель, но не способных делать это
эффективно из-за недостатка основных биогенных элементов (соединений азота,
фосфора, калия и др.) или неблагоприятных физико-химических условий.
Обеспеченность почв биогенными элементами - азотом, фосфором и калием - важный
фактор, определяющий интенсивность разложения нефти и нефтепродуктов.
Недостаток биогенных элементов необходимо восполнять путем внесения в почву
минеральных удобрений. Практически во всех случаях внесение биогенных элементов
в виде минеральных удобрений стимулирует разложение углеводородов в почве.
Наиболее интенсивно разложение углеводородов протекает при ежегодном внесении
комплекса N, P,
K - содержащих удобрений
в сочетании с навозом, а также при внесении в почву биогумуса.
В этом случае в ходе лабораторных испытаний с
использованием образцов загрязненной почвы устанавливают, какие именно
компоненты и в каких количествах следует внести в загрязненный объект, чтобы
стимулировать рост микроорганизмов, способных утилизировать загрязнитель.
Биостимуляция in
vitro.
Отличие этого подхода в том, что биостимуляция
образцов естественной микрофлоры загрязненной почвы проводится сначала в
лабораторных или промышленных условиях (в биореакторах или ферментерах). При
этом обеспечивается преимущественный и избирательный рост тех микроорганизмов,
которые способны наиболее эффективно утилизировать данный загрязнитель.
«Активизированную» микрофлору вносят в загрязненный объект одновременно с
необходимыми добавками, повышающими эффективность утилизации загрязнителя.
Существующие два пути интенсификации
биодеградации ксенобиотиков в окружающей среде - стимуляция естественной
микрофлоры и интродукция активных штаммов, не только не противоречат, но и
дополняют друг - друга [58].
Биорекультивация нефтезагрязненных почв - это
многостадийный биотехнологический процесс, включающий физико-химические методы
детоксикации загрязнителя, применение органических и минеральных добавок,
использование биопрепаратов.
Основными факторами, влияющими на ход
биоразрушения органических загрязнителей, являются их химическая природа
(которая обусловливает возможные пути биотрансформации), концентрация и
взаимодействие с другими загрязнителями (на уровне их непосредственного
взаимодействия или взаимного влияния на трансформацию) [59].
К основным неблагоприятным физико-химическим
условиям, лимитирующим деградацию микроорганизмами ксенобиотиков в окружающей
среде, можно отнести недостаточное содержание кислорода и неблагоприятную
температуру. Нефтяное загрязнение в значительной мере ухудшает газовый обмен
почвы, создает условия для усиления восстановительных процессов. Для окисления
углеводородов микроорганизмами необходимо наличие молекулярного кислорода, в
анаэробных условиях процесс окисления крайне затруднен. Приемы обработки почв,
способствующие улучшению аэрации, стимулируют активность микроорганизмов,
усиливают окислительные процессы. Интенсификация разложения нефти и
нефтепродуктов в почве возможна путем рыхления, частой вспашки или дискования.
Температура также является важным фактором, при
прочих равных условиях определяющих интенсивность микробиологического
разложения нефти и нефтепродуктов. Оптимальной температурой для разложения
нефти и нефтепродуктов в почве считается 20-37°С. В связи с этим особое
внимание исследователей в последнее время привлекают природные микроорганизмы,
обладающие высокой устойчивостью к низким температурам.
Так же, к неблагоприятным физико-химическим
условиям можно отнести низкую или чрезмерную влажность почвы, неблагоприятную
кислотность, низкую концентрацию или доступность ксенобиотиков, наличие
альтернативных, более предпочтительных субстратов и т.д. Среди биологических
факторов отмечены поедание интродуцируемых микроорганизмов простейшими, обмен
генетической информацией в популяции, физиологическое состояние и плотность
интродуцируемой микробной популяции. Некоторые из перечисленных проблем могут
быть решены путем создания генетически сконструированных штаммов-деструкторов и
их консорциумов, усовершенствования методов интродукции, оптимизации условий
существования природных микробных популяций.
Таким образом, интродукция микроорганизмов
приводит к положительным результатам только при создании соответствующих
условий для развития внесенной популяции, для чего необходимо знать
физиологические особенности интродуцента, а также учитывать складывающиеся
микробные взаимодействия [60].
1.5.2 Фиторемедиация нефтезагрязненных почв
Фиторемедиация представляет собой использование
растений для очистки окружающей среды. В этой технологии используются природные
процессы, с помощью которых растения деградируют и накапливают различные
поллютанты. Фиторемедиация является высокоэффективной технологией очистки от
ряда органических и неорганических поллютантов.
Органические поллютанты в окружающей среде
представлены, главным образом, веществами антропогенного происхождения, и для
большинства организмов являются чужеродными (ксенобиотиками); многие из них
токсичны, некоторые канцерогенны. В зависимости от их свойств, органические
поллютанты могут или разрушаться в корневой зоне растений, или поглощаться с
последующим разрушением, изолированием или испарением.
Наряду с преимуществами фиторемедиация имеет ряд
ограничений. Растения, производящие очистку, должны находится в зоне
загрязнения и быть способными воздействовать на поллютант. Следовательно,
свойства почвы, уровень токсичности и климат должны позволять рост и развитие
растений. Если почва токсична, её можно сделать более пригодной для роста с
помощью внесения определённых почвенных добавок.
Нужно также учитывать, что очистка ограничена
уровнем глубины корней, т.к. растения должны иметь контакт с поллютантом. Корни
травянистых растений обычно достигают глубины 50 см, деревьев - 3 м, хотя некоторые
растения (особенно в аридных районах) способны достигать глубины 15 и более
метров.
В зависимости от вовлечённых биологических
процессов, фиторемедиация может занять больший период времени, чем другие
методы очистки. Деградация поллютантов растениями работает довольно быстро
(дни/месяцы), тогда как очистка путём аккумуляции растениями занимает годы.
Также фиторемедиация может ограничиваться
доступностью поллютантов растению. Биодоступность поллютантов зависит от
химических свойств поллютанта, свойств почвы, условий среды, различных
биологических процессов. Биодоступность поллютантов может быть увеличена путём
внесения в почву определённых добавок (например, органические кислоты, понижая
рН и хелатируя катионы, делают более доступными для растения загрязняющие
металлы, а сурфактанты - гидрофобные органические поллютанты) [61].
Для достижения максимальной эффективности
очистки фиторемедиация может использоваться в сочетании с другими методами
биоремедиации и небиологическими технологиями очистки. Например, наиболее
загрязнённые части субстрата могут удаляться путём экскавации, после чего
дальнейшая очистка может проводиться с помощью растений.
За последние десять лет фиторемедиация приобрела
большую популярность, что отчасти связано с её низкой стоимостью. Так как в
процессе фиторемедиации используется только энергия солнца, данная технология
на порядок дешевле методов основанных на применении техники (таких как
экскавация, промывка и сжигание почвы). То, что данная технология применяется
прямо в районе загрязнения (in
situ) способствует
снижению затрат и уменьшению контакта загрязнённого субстрата с людьми и
окружающей средой [62].
Ризофильтрация
Растения могут применяться как фильтры в
созданных искусственно заболоченных участках или в промышленных установках. К
данной технологии в частности относится ризофильтрация - использование растений
в гидропонных установках для фильтрации загрязнённой воды. Для фиторемедиации в
искусственно созданных заболоченных территориях применяются различные водные
виды: ряска Lemna
sp. и Azolla
sp. - для
неорганических поллютантов (хорошие накопители металлов и лёгкий сбор
биомассы), виды родов Myriophyllum
и Elodea - для органических
поллютантов (высокий уровень деградирующих ферментов). В процессе
ризофильтрации осуществляется интенсивное аэрирование, что позволяет
использовать также наземные растения, часто используются горчица Brassica
juncea и подсолнечник Helianthus
annuus.
Фитоэкстракция
Данная технология заключается в использовании
растений для экстрагирования поллютантов и аккумулирования их в тканях, после
чего надземная растительная биомасса собирается. Растительный материал может
далее либо использоваться для непищевых целей (производство дерева, картона)
либо сжигаться с последующим вывозом золы на свалку или, в случае ценных
металлов, рециркуляцией накопленных элементов. Для фитоэкстракции часто
применяют горчицу Brassica
juncea и подсолнечник Helianthus
annuus из-за их быстрого
роста, большой биомассы и высокой устойчивости к поллютантам [63].
Фитодеградация
Некоторые растения могут напрямую деградировать
органические поллютанты с помощью своих ферментов, обычно внутри тканей, до
неорганических соединений или до стабильных интермедиатов, накапливающихся в
растении. Технология использования растений для деградации поллютантов получила
название фитодеградация. Она эффективна против органических поллютантов
обладающих хорошей подвижностью в растении (гербициды, ТНТ, трихлорэтилен).
Применяемые для фитодеградации виды характеризуются наличием обширной плотной
корневой системой и высоким уровнем синтеза ферментов деградации (наиболее
часто применяют растения тополя).
Фитоиспарение
Технология, получившая название фитоиспарение,
основывается на том, что после поглощения некоторые поллютанты могут покидать
растение в летучей малотоксичной форме. Если летучее соединение всё же
токсично, то после испарения растением оно разбавляется в атмосфере до уровня
не представляющего угрозы. Фитоиспарение может быть использовано для летучих
органических соединений (трихлорэтилен) и некоторых неорганических веществ,
способных переводиться растением в летучее состояние (селен, ртуть). Обычно в
данной технологии применяют всё тот же тополь благодаря высокому уровню
транспирации [64].
Фитостимуляция
Технология фитостимуляции состоит в применении
растений для стимуляции биодеградации поллютантов микрооргаизмами в ризосфере.
Такая стимуляция биодеградации осуществляется за счёт секреции растениями
органических веществ, используемых ризосферными микроорганизмами в качестве
источника энергии и углерода, а также различных вторичных метаболитов,
активирующих гены, ответственные за синтез деградирующих ферментов. Для
фитостимуляции микроорганизмов-деструкторов корневой зоны применяются растения
обладающие обширной плотной корневой системой и секретирующие специфические
вещества, способствующие росту этих микроорганизмов. Фитостимуляция применяется
для очистки от гидрофобных органических поллютантов, в основном от
углеводородов нефти, которые не могут быть поглощены растениями, но могут быть
деградированы микроорганизмами [65].
Среди перечисленного наибольшую актуальность
приобретают методы, основанные на использовании объединенного метаболического
потенциала микроорганизмов и растений. Микроорганизмы-деструкторы проявляют
большой углеводородокисляющий потенциал, но в процессе биоремедиации
нефтезагрязненных почв возникает проблема их приживаемости. В связи с этим
используется симбиотическое взаимодействие растений и
микроорганизмов-деструкторов, так как ризосфера является природной экосистемой,
обеспечивающей высокую численность микробных популяций и ее естественное
поддержание.
Основными механизмами для фиторемедиации
нефтезагрязненных почв являются стимуляция растениями почвенных микроорганизмов
через ризосферный эффект и активизация деятельности микробного сообщества, и,
как следствие, интенсификация биохимических и химических процессов
трансформации чужеродных соединений в почве.
Таким образом, важной и основной ролью растений
в детоксикации поллютантов играет ризосфера растений, которая является областью
активного развития микроорганизмов-деструкторов углеводородного загрязнения
почв [66].
2. Цели и задачи работы
Подход проекта основан на селекции штаммов или
консорциумов бактерий, обладающих комплексом антистрессовых свойств и
способности к биодеструкции нефти. Основная цель данной работы сводится к
отбору и детальной характеристике штаммов микроорганизмов, повышающих
адаптационный потенциал растений к стрессовым факторам среды и осуществляющих
деструкцию нефтезагрязнений почвы.
Это позволит интенсифицировать процесс
фиторемедиации одновременно в двух направлениях: 1 - стимуляция роста растений
за счет оптимизации гормонального статуса и улучшения минерального и водного
питания; 2 - активизация процессов очистки почвы за счет биодеструкции нефтезагрязнений.
Важно подчеркнуть, что биодеструкция нефтезагрязнений на этапе фиторемедиации в
основном осуществляется ассоциированными с растениями микроорганизмами, которые
используют ресурсы растительного происхождения для углеводородокисляющих
деструктивных процессов. Повышение численности их популяций обеспечит в
дальнейшем интенсивную колонизацию корней растений, образование эффективных
растительно-микробных систем и нитенсификацию фиторемедиации.
В ходе исследовательской работы поставлены
следующие задачи:
. Отобрать штаммы микроорганизмов отличающихся
нефтедеструктивной способностью и охарактеризовать их углеводородокисляющий
потенциал для разработки перспективных биотехнологических методов эффективной
фиторемедиации нефтезагрязненных почв.
. Выявить способность исследуемых штаммов
микроорганизмов продуцировать фитогормоны типа ауксинов и определить
количественное содержание продуцируемых фитогормонов с помощью
высокоэффективной жидкостной хроматографии.
. Выявить АЦК-утилизирующие микроорганизмы и
определить у них способность к продукции фермента АЦК дезаминазы.
. Определить способность исследуемых штаммов
микроорганизмов к разложению труднодоступных фосфатов и выявить активных
мобилизаторов фосфатов.
Так же должна быть проверена возможность
создания консорциума штаммов бактерий, обладающих по возможности несколькими
или одним из свойств (наличие антистрессового фермента АЦК дезаминазы,
способности продуцировать фитогормоны ауксины, способности растворять
труднодоступные фосфаты и утилизировать углеводороды нефти), которые важны для
разработки новых технологий фиторемедиации нефтезагрязненных почв.
нефть углеводород бактерия
деструкция
3.
Экспериментальная часть
.1 Объекты исследования
Микроорганизмы, использованные в работе,
включают в себя 30 штаммов бактерий, взятых из коллекции ассоциативных
микроорганизмов. В рамках экспериментальных исследований данного проекта не
планируется выделение штаммов бактерий из природных источников или генетическая
модификация микроорганизмов. Поэтому работа будет основана на результатах
изучения свойств коллекционных штаммов для получения антистрессовых и
углеводородокисляющих бактерий. Все исследуемые штаммы микроорганизмов
депонированы в Ведомственной коллекции полезных микроорганизмов
сельскохозяйственного значения (ВКСМ) Россельхозакадемии.
Основными объектами данной исследовательской
работы являются микроорганизмы родов: Rhodococcus,
Variovorax, Arthrobacter,
Bacillus, Micrococcus
и Pseudomonas. Важно
подчеркнуть, что большинство ассоциативных бактерий, в том числе содержащих АЦК
дезаминазу, и продуцентов ауксинов относятся к выше перечисленным родам [47].
К тем же таксономическим группам относятся и
многие углеводородокисляющие бактерии - биодеструкторы нефти [25]. Это
обуславливает высокую вероятность селекции штаммов, которые сочетают в себе
полезные для роста растений свойства и способные утилизировать органические
загрязнения в виде нефти и нефтепродуктов.
Эти бактерии являются уникальным по
биоразнообразию и функциональности биоресурсом и будут служить основным
объектом исследований, что позволит успешно выполнить поставленные задачи.
Таблица 2 - Штаммы микроорганизмов исследуемых в
экспериментальной части работы
|
№
|
Вид
|
Штамм
|
Источник
выделения
|
Краткая
характеристика
|
|
1
|
Rhodococcus erythropolis
|
192
|
почва Лен.
области
|
стимулятор
роста, продуцент каротиноидов
|
|
2
|
Rhodococcus erythropolis
|
196
|
почва Лен.
области
|
стимулятор роста,
продуцент каротиноидов
|
|
3
|
Rhodococcus fascians
|
394
|
семена
ячменя, Дагестан
|
стимулятор роста,
продуцент каротиноидов
|
|
4
|
Rhodococcus erythropolis
|
395
|
корни
яблони
|
стимулятор
роста, продуцент каротиноидов
|
|
5
|
Rhodococcus pyyridinivorans
|
398
|
колос
пшеницы
|
эпифит
|
|
6
|
Rhodococcus fascians
|
399
|
проростки
овса
|
стимулятор
роста, продуцент каротиноидов
|
|
7
|
401
|
листья
проростков овса
|
эпифит
|
|
8
|
Rhodococcus erythropolis
|
402
|
листья
проростков пшеницы
|
эпифит
|
|
9
|
Rhodococcus erythropolis
|
403
|
листья
проростков овса
|
эпифит
|
|
10
|
Rhodococcus sp.
|
393
|
корни
яблони
|
стимулятор
роста, продуцент каротиноидов
|
|
11
|
Rhodococcus maris
|
346
|
листья
черной смородины
|
эпифит
|
|
12
|
Rhodococcus fascians
|
392
|
корни
проростков пшеницы
|
стимулятор
роста, продуцент каротиноидов
|
|
13
|
Rhodococcus sp.
|
191
|
почва Лен.
области
|
стимулятор
роста, продуцент каротиноидов
|
|
14
|
Bacillus subtilis
|
440
|
почва
из-под плодовых деревьев, Украина
|
антагонист
фитопатогенов
|
|
15
|
Pseudomonas aeruginosa
|
478
|
почва Лен.
области
|
продуцент пигментов
|
|
16
|
Micrococcus luteus
|
220
|
корни
пшеницы
|
стимулятор
роста, продуцент каротиноидов
|
|
17
|
Arthrobacter histidinolovorans
|
352
|
корни
табака
|
стимулятор
роста, продуцент каротиноидов
|
|
18
|
Micrococcus luteus
|
396
|
почва Лен.
области
|
продуцент
β-каротина
|
|
19
|
Arthrobacter citreum
|
426
|
почва Лен.
области
|
продуцент
аминокислот
|
|
20
|
Bacillus endophyticus
|
107
|
почва Лен.
области
|
антагонист
фитопатогенов
|
|
21
|
Bacillus megaterium
|
64
|
почва Моск.
области
|
фосфатредуктор
|
|
22
|
Bacillus koreensis
|
154
|
почва Лен.
области
|
фосфатредуктор
|
|
23
|
Bacillus pumilus
|
128
|
почва Горьк.
области
|
антагонист
фитопатогенных грибов
|
|
24
|
Variovorax paradoxus
|
5c2
|
ризосфера
горчицы сарептской
|
стимулятор
роста
|
|
25
|
Rhodococcus sp.
|
4n44
|
ризосфера
горчицы сарептской
|
стимулятор
роста
|
|
26
|
Variovorax paradoxus
|
5p3
|
ризосфера
горчицы сарептской
|
стимулятор
роста
|
|
27
|
Arthrobacter sp.
|
D12str
|
ризосфера
ячменя
|
стимулятор
роста
|
|
28
|
Arthrobacter histidinolovorans
|
409
|
корни
овса
|
колонизатор
ризосферы
|
|
29
|
Bacillus subtilis niger
|
120
|
почва,
Башкортостан
|
антагонист
фитопатогенов
|
|
30
|
Pseudomonas
aeruginosa
|
188
|
почва
Лен. области
|
продуцент
пигментов
|
В ходе работы будут изучены следующие функциональные
характеристики вышеперечисленных микроорганизмов: устойчивость бактерий к
углеводородам нефти и их биодеструктивный потенциал, их ростстимулирующая
активность, а именно, способность к продукции фитогормонов-ауксинов,
АЦК-утилизирующая способность и продукция АЦК дезаминазы, а так же способность
к растворению труднодоступных фосфатов.
.2 Материалы и методы исследования
.2.1 Определение углеводородокисляющей
активности
Изучение деструктивной активности штаммов по
отношению к углеводородам нефти проводили, культивируя микроорганизмы в жидких
средах, содержащих углеводородный субстрат (сырую нефть) в качестве
единственного источника углерода и энергии.
Минеральный состав питательной среды:
K2HPO4
- 1 г/л;
MgSO4·7H2O
- 0,2 г/л;
NaCl - 5 г/л;
NH4H2PO4
- 1 г/л.
Так же в минеральную среду был добавлен
дрожжевой экстракт из расчета 20мг/л (200мкл/л из stock
solution - 100 мг/мл) для
затравки микроорганизмов.
После автоклавирования питательная среда
разливалась в стерильные пробирки по 5мл в каждую.
Для посева использовалась 3-х суточная культура
выбранных 30ти штаммов микроорганизмов. Концентрация вносимых в питательную
среду ресуспензированных в физиологическом растворе микроорганизмов - 105
клеток на 5 мл среды.
При определении углеводородокисляющей активности
использовался гравиметрический метод. Для выявления активности в пробирки с
питательной средой была внесена стерильная сырая нефть по 25 мкл в каждую из
расчета 5 г/л. Контролем служили пробирки с питательной средой и нефтью без
внесения микроорганизмов.
При определении прироста биомассы
углеводородокисляющих бактерий проводился сравнительный анализ на
фотоэлектрическом колориметре. Контролем для определения прироста служили
пробирки с питательной средой и микроорганизмами без внесения нефти.
Культивирование проходило при температуре 280С,
на круговой качалке при 110 об/мин, в течение 7 суток. Эксперимент поставлен в
двукратной повторности.
Для определения деструктивной активности
гравиметрическим методом по окончании культивирования была проведена экстракция
нефти. При экстрагировании был использован органический растворитель хлороформ
(СHСl3)
в объеме 1 мл на каждую из пробирок. Хлороформ, будучи тяжелее культуральной
жидкости, и экстрагированная в нем нефть переходили в нижний слой раствора. Экстракция
проводилась в трехкратной повторности, каждая в течение 5 минут. Экстракты
удалялись со дна пробирки пипеткой, объединялись и затем помещались в
предварительно взвешенные алюминиевые кюветы. После полного удаления
растворителя кюветы повторно взвешивались для определения количества частично
разложившейся нефти. Наибольшая разница между массой нефти из контрольной
пробирки и массой нефти из пробирок с исследуемыми культурами соответствует
наибольшему количеству разложившихся углеводородов нефти до СО2 и Н2О,
что говорит о наибольшей углеводородокисляющей активности штамма.
Для определения прироста биомассы был проведен
сравнительный анализ на фотоэлектрическом колориметре Smart-Spec-Plus
(Biorad, США). Наибольшая
разница между оптическими плотностями культуральной жидкости исследуемых
образцов и контроля соответствовала наибольшему приросту биомассы
углеводородокисляющих бактерий. Измерения проводились при длине волны λ=540
нм. Опыт проводился в двукратной повторности.
По окончании опыта по экспериментальным данным
было отобрано 11 наиболее активных штаммов микроорганизмов, которые
подвергались дальнейшим исследованиям для изучения их ростстимулирующих
свойств.
.2.2 Определение способности к продуцированию
ауксинов по выявлению фитогормонов с использованием ВЭЖХ
Способность бактерий продуцировать ауксины
изучена с помощью периодических культур.
Состав питательной среды для культивирования
отобранных штаммов микроорганизмов:
KH2PO4
- 0,4 г/л;
K2HPO4
- 0,1 г/л;
MgSO4·7H2O
- 0,2 г/л;
NaCl - 0,1 г/л;
Дрожжевой экстракт - 50 мг/л;
Глюкоза - 5 г/л.
В качества предшественника в биосинтезе ауксинов
в питательную среду было внесено 250 мг/л L-триптофана.
Для посева использовалась 3-х суточная культура,
посевная доза которой составляла 106 клеток на 5 мл среды. Бактерии
культивировались в пробирках до стационарной фазы роста при 280С, в
течение 5 суток в темноте.
По окончании культивирования суспензии были
центрифугированы и фильтрованы через мембранные фильтры с диаметром пор 0,22
мкм.
Для выявления штаммов с наиболее интенсивной
способностью к продуцированию основного фитогормона типа ауксинов,
определяющего фитостимуляцию - индолил-3-уксусной кислоты (ИУК) - был проведен
сравнительный анализ на фотоэлектрическом колориметре.
Для анализа использовался реактив Сальковского,
дающий характерное розово-красное окрашивание с ИУК. Наиболее интенсивное
окрашивание соответствует наиболее интенсивному продуцированию ИУК.
Состав для приготовления реактива Сальковского:
FeCl3
- 1 г;
H2O
- 250 мл;
H2SO4
(конц.) - 150 мл.
Реакция проводилась в соотношении супернатант :
реактив Сальковского - 1 : 2, объем реакционной смеси - 1,5 мл.
Контролем для сравнительного анализа служила
питательная среда без внесения микроорганизмов с добавлением того же количества
реактива Сальковского. Показания снимались при длине волны λ=540
нм. Эксперимент проводился в двукратной повторности.
По окончании эксперимента было отобрано 5
штаммов микроорганизмов отличающихся наиболее активным продуцированием ИУК.
Отобранные в ходе эксперимента 5 штаммов
микроорганизмов подвергались дальнейшему исследованию на предмет определения
точного количества продуцируемого фитогормона ИУК и некоторых его производных.
Анализ проводился с помощью высокоэффективной
жидкостной хроматографии (ВЭЖХ) с использованием системы Ультра
Производительной жидкостной хроматографии (UPLC)
на колонке с обращенной фазой Waters
ACQUITY UPLC
BEH Shield
RP18 (Waters,
США) с флуоресцентным детектором. Данная система предназначена для выполнения
исследований как с применением новейших методик и материалов UPLC,
так и традиционными методами высокоэффективной жидкостной хроматографии (HPLC).
Суспензии отобранных культур были также
центрифугированы и фильтрованы через мембранные фильтры. Для выделения ауксинов
культуральные жидкости и исходные стерильные среды были экстрагированы
этилацетатом, подкисленным 0,4 N
HCl до рН=3,0.
Полученный экстракт был выпарен при 35°C
на вакуумном роторном испарителе и растворен в 150 мкл 18% ацетонитрила с
последующей фильтрацией через нейлоновый мембранный фильтр Spin-X
с диаметром пор 0,22 мкм (Corning,
США). Идентификацию ауксинов проводили с использованием флуоресцентного
детектора. Длина возбуждающей волны детектора - 280 нм, эмиссионной волны - 350
нм. Объем пробы - 150 мкл.
Ауксины разделялись на колонке 150 мм  5
мм с обращенной фазой С18 в течение 5 минут в буфере ацетонитрил - вода -
уксусная кислота. Скорость подачи буфера - 0,3 мл/мин.
5
мм с обращенной фазой С18 в течение 5 минут в буфере ацетонитрил - вода -
уксусная кислота. Скорость подачи буфера - 0,3 мл/мин.
Количество фитогормонов в исследуемых образцах
рассчитывали с помощью стандартного раствора, в котором концентрация ауксинов
была заранее известна. В 5 мкл стандарта содержится: 0,0025 мкг
индолил-3-молочной кислоты (ИМК); 0,05 мкг индолил-3-карбоновой кислоты (ИКК);
0,02 мкг индолил-3-уксусной кислоты (ИУК).
По окончании эксперимента у исследуемых образцов
было определено количество продуцируемых фитогормонов.
3.2.3 Выявление АЦК-утилизирующих
микроорганизмов и определение активности продуцируемого ими фермента АЦК
дезаминазы
Выявление АЦК (1-аминоциклопропан-1-карбоксилат)
- утилизирующих бактерий проводили, культивируя микроорганизмы на специальной
питательной среде для селекции бактерий, утилизирующих АЦК в качестве источника
азота, с добавлением смеси органических кислот и АЦК.
Состав питательной среды:
KH2PO4
- 0,4 г/л;
K2HPO4
- 0,1 г/л;
MgSO4·7H2O
- 0,2 г/л;
NaCl - 0,1 г/л;
Агар - 15 г/л;
Глюкоза - 5 г/л;
Маннит - 2,5 г/л;
Смесь органических кислот - 0,2 г/л.
Состав смеси органических кислот:
Na-citrate
(Na3C6H5O7
- натриевая соль лимонной кислоты);
Na-pyruvate
(CH3COCOONa
- натриевая соль пировиноградной кислоты);
Na-D-gluconic
acid (NaC6H11O7
- натриевая соль альдоновой (глюконовой) кислоты);
Na-acetate
(CH3COONa
- натриевая соль этановой (уксусной) кислоты);
Na-succinate
(Na2C4H4O4
- натриевая соль бутандиовой (янтарной) кислоты);
Na-malic
acid (Na2C3H2O4
- натриевая соль пропандиовой (малоновой) кислоты).
На данной выше основе было приготовлено 3
варианта питательных сред:
. В качестве источника азота был добавлен
NH4NO3
из расчета 0,4 г/л. Данная среда служила положительным контролем, с помощью
которого определялась оптимальность состава среды и оценивалась эффективность
выбранных источников углеродного и азотного питания для исследуемых
микроорганизмов.
. В качестве источника азота был добавлен
АЦК в той же концентрации, что и NH4NO3.
По росту биомассы на данной среде были выявлены АЦК-утилизирующие
микроорганизмы.
. Среда без добавления источника азота и
АЦК. Данная среда служила отрицательным контролем. При сравнении роста
микроорганизмов на данной среде с ростом микроорганизмов на среде с добавлением
АЦК были выявлены АЦК-утилизирующие штаммы.
Засев культур на твердую питательную среду
осуществлялся репликаторным методом. В 11 ячеек репликатора было добавлено по
150 мкл физиологического раствора с ресуспензированными в нем клетками
исследуемых образцов. Для приготовления посевного материала использовалась 3-х
суточная культура.
Культивирование микроорганизмов на всех средах
проводилось в термостатах при температуре 280С.
Для выявления наиболее активных
АЦК-утилизирующих бактерий на 5-е сутки культивирования была проведена
сравнительная визуальная оценка интенсивности и особенности роста исследуемых
штаммов микроорганизмов на разных питательных средах.
Наиболее активные АЦК-утилизирующие бактерии
подвергались дальнейшему исследованию на предмет изучения активности
продуцируемого этими бактериями фермента АЦК дезаминазы.
Активность фермента определяли биохимическим
методом Салеха и Глика.
Культуры отобранных активных АЦК-утилизирующих
штаммов микроорганизмов были выращены в течение 24 часов при температуре 300С.
Состав питательной среды для культивирования
отобранных штаммов микроорганизмов:
KH2PO4
- 0,4 г/л;
K2HPO4
- 0,1 г/л;
MgSO4·7H2O
- 0,2 г/л;
NaCl - 0,1 г/л;
Дрожжевой экстракт - 50 мг/л;
Глюкоза - 5 г/л.
После культивирования микроорганизмов
культуральные жидкости были центрифугированы в течение 10 минут при 9000g,
ресуспензированы в 0,1 М трис-HCl
буфере (рН = 7,5) и вновь центрифугированы. Затем клетки были ресуспензированы
в 600 мкл 0,1 М трис-HCl
буфере (рН = 8,5).
К приготовленной суспензии было добавлено 30 мкл
толуола, и клетки были разрушены путем интенсивного встряхивания смеси в
течение 1 минуты.
Затем к 100 мкл клеточных экстрактов было
добавлено 10 мкл 0,5 М АЦК, 100 мкл 0,1 М трис-HCl
буфера (рН = 8.5), и реакционная смесь инкубировалась в течение 30 минут при
температуре 30оС.
Реакция была остановлена добавлением 1 мл 0,56 М
HCl, после чего смесь
центрифугировалась в течение 5 минут при 14000g.
По окончании центрифугирования к 500 мкл
супернатанта было добавлено 400 мкл 0,56 М HCl
и 150 мкл 0,2% раствора 2,4-динитрофенилгидразина в 2 М NaOH,
и реакционная смесь вновь инкубировалась в течение 30 минут при температуре 30оС.
После инкубации был добавлен 1 мл 2 М NaOH.
Активность фермента АЦК дезаминазы определяли по
количеству α-кетобутирата,
который образовывается при расщеплении бактериями АЦК, спектрофотометрически
при длине волны λ
= 540 нм.
Для определения активности АЦК дезаминазы
использовался калибровочный график зависимости концентрации α-кетобутирата
от оптической плотности реакционной смеси.
3.2.4 Определение способности к разложению
труднодоступных фосфатов
Изучение способности бактерий к разложению
труднодоступных фосфатов проводили, культивируя микроорганизмы на агаризованной
питательной среде, содержащей в качестве труднодоступных растениям соединений
трехзамещенный фосфат кальция (Ca3(PO4)2)
и фитат Ca, которые в
существенной мере снижают биодоступность фосфора. Проявление способности
характеризуется зонами просветления на питательных средах вокруг колоний
выросших микроорганизмов.
Состав питательной среды для культивирования
отобранных штаммов микроорганизмов:
Пептон - 5 г/л;
Гидролизат козеина - 5 г/л;
MgSO4·7H2O
- 1,5 г/л;
Агар - 15 г/л.
На данной выше основе было приготовлено 3
варианта питательной среды:
1. С добавлением 3 г/л Ca3(PO4)2
в качестве труднодоступного фосфата.
2. С добавлением 3 г/л фитата Са в качестве
труднодоступного фосфата.
. С добавлением 1,5 г/л K2HPO4
в
качестве легкодоступного фосфата.
Для засева культур на твердую питательную среду
использовался репликаторный метод. В 11 ячеек репликатора было добавлено по 150
мкл физиологического раствора с ресуспензированными в нем клетками. Для
приготовления посевного материала использовалась 3-х суточная культура.
Культивирование микроорганизмов на всех средах
проводилось в термостате при температуре 280С.
По результатам эксперимента можно было визуально
сравнить рост биомассы бактерий, выросших на среде с добавлением
легкодоступного источника фосфора, и бактерий, выросших на среде с труднодоступными
фосфатами.
Так как среды с добавлением фосфата и фитата Са,
в отличие от прозрачной среды с добавлением K2HPO4,
были белесовато-мутными, то способность к растворению труднодоступных фосфатов
можно было оценить по площади зон просветления на питательных средах вокруг
колоний выросших микроорганизмов. Наибольшая площадь зоны просветления
соответствовала наилучшей способности к разложению труднодоступных фосфатов.
Результаты эксперимента фиксировались на 7-е
сутки культивирования.
.3 Результаты исследования, их анализ и
обсуждение
.3.1 Результаты опыта по определению
углеводородокисляющей активности
Прирост биомассы углеводородокисляющих бактерий.
Для определения прироста биомассы был проведен
сравнительный анализ оптических плотностей культуральной жидкости исследуемых
образцов на фотоэлектрическом колориметре Smart-Spec-Plus
(Biorad, США). Контролем
служила культуральная жидкость бактерий выросших при тех же условиях, но
употреблявших в качестве единственного источника углерода и энергии стартовое
количество дрожжевого экстракта, присутствующего в среде вместо углеводородов
нефти.
Показания снимались при длине волны λ=540нм.
Так как опыт проводился в двукратной
повторности, численные значения для каждого исследуемого образца были
усреднены.
Таблица 3 - Оптическая плотность культуральной
жидкости исследуемых образцов
|
№ штамма
|
D540 (оптическая плотность)
|
D540ср.
|
№ штамма
|
D540 (оптическая плотность)
|
D540ср.
|
|
1
|
0,015
|
0,007
|
16
|
0,081
|
0,082
|
|
-0,001
|
|
|
0,083
|
|
|
2
|
0,042
|
0,036
|
17
|
0,002
|
0,011
|
|
0,030
|
|
|
0,020
|
|
|
3
|
0,071
|
0,070
|
18
|
0,031
|
0,024
|
|
0,069
|
|
|
0,017
|
|
|
4
|
-0,024
|
- 0,014
|
19
|
-0,009
|
-0,003
|
|
-0,004
|
|
|
0,003
|
|
|
5
|
0,017
|
0,023
|
20
|
-0,002
|
-0,020
|
|
0,029
|
|
|
-0,038
|
|
|
6
|
0,058
|
0,054
|
21
|
0,038
|
0,031
|
|
0,049
|
|
|
0,024
|
|
|
7
|
0,078
|
0,081
|
22
|
-0,001
|
0,008
|
|
0,083
|
|
|
0,017
|
|
|
8
|
0,030
|
0,012
|
23
|
0,073
|
0,071
|
|
-0,006
|
|
|
0,068
|
|
|
9
|
-0,013
|
0,001
|
24
|
0,047
|
0,055
|
|
0,015
|
|
|
0,063
|
|
|
10
|
0,023
|
0,010
|
25
|
0,085
|
0,086
|
|
-0,003
|
|
|
0,087
|
|
|
11
|
0,037
|
0,025
|
26
|
0,061
|
0,064
|
|
0,013
|
|
|
0,066
|
|
|
12
|
0,028
|
0,013
|
27
|
0,067
|
0,070
|
|
-0,002
|
|
|
0,073
|
|
|
13
|
0,006
|
-0,008
|
28
|
0,023
|
0,015
|
|
-0,022
|
|
|
0,007
|
|
|
14
|
0,059
|
0,065
|
29
|
0,055
|
0,060
|
|
0,070
|
|
|
0,064
|
|
|
15
|
0,036
|
0,019
|
0,072
|
0,079
|
|
0,002
|
|
|
0,085
|
|
Наибольшая оптическая плотность культуральной
жидкости соответствует наибольшему приросту биомассы и характеризует то, что углеводороды
нефти в качестве единственного источника углерода и энергии, являются
приемлимыми для роста и развития микроорганизмов.
По результатам эксперимента из 30 исследуемых
образцов можно выделить 11 штаммов микроорганизмов, которые наилучшим образом используют
углеводороды нефти в качестве источника питания и энергии, а именно: №25, №16,
№7, №30, №23, №3, №27, №14, №26, №29, №24. Номера штаммов микроорганизмов
указаны в порядке убывания оптической плотности их культуральной жидкости.
Убыль углеводородного субстрата из среды.
Выявленный прирост биомассы у 11 из 30 штаммов
исследуемых микроорганизмов по результатам проведенного опыта дает основания
полагать, что выбранные штаммы активно использовали углеводороды нефти для
собственного роста и развития и, как следствие, обладают деструктивным
потенциалом.
Для подтверждения углеводородокисляющей
активности выбранных штаммов была зафиксирована убыль углеводородного субстрата
из среды гравиметрическим методом.
Для определения массы нефти, оставшейся по окончании
культивирования, вычислялась разница между массой предварительно взвешенной
пустой кюветы и массой этой же кюветы, содержащей экстрагированную нефть.
M1
= m2
- m1,
(1)
где m1
- масса пустой кюветы, [мг];
m2
- масса кюветы, содержащей экстрагированную нефть, [мг];
M1
- масса нефти, оставшейся по окончании культивирования, [мг].
Так как опыт проводился в двукратной
повторности, численные значения были усреднены для каждого исследуемого штамма.
Для определения количества разложившейся нефти
вычислялась разница между массой нефти из контрольной пробирки и массой нефти,
оставшейся по окончании культивирования.
M2
= Мк - M1,
(2)
где Мк - масса нефти из контрольной
пробирки, [мг];
Мк = m2
- m1
= 103,9 - 81,5 = 22,4 мг.
M2
- масса разложившейся нефти, [мг].
Деструктивная способность исследуемых штаммов
микроорганизмов выражалась в процентах убыли углеводородного субстрата из среды
- M2,
%.
Таблица 4 - Промежуточные и итоговые данные по
нахождению массы разложившейся нефти исследуемых образцов
|
№ штамма
|
m1, мг
|
m2, мг
|
M1, мг
|
M1ср., мг
|
M2, мг
|
M2,
%
|
|
3
|
100,9
|
117,8
|
16,9
|
16,4
|
6,0
|
26,7
|
|
99,3
|
115,2
|
15,9
|
|
|
|
|
7
|
100,6
|
116,0
|
15,4
|
14,3
|
8,1
|
36,2
|
|
102,3
|
115,5
|
13,2
|
|
|
|
|
14
|
101,7
|
115,6
|
13,9
|
14,9
|
7,5
|
33,5
|
|
103,5
|
119,3
|
15,8
|
|
|
|
|
16
|
99,3
|
116,4
|
17,1
|
17,0
|
5,4
|
24,1
|
|
100,1
|
117,0
|
16,9
|
|
|
|
|
23
|
105,0
|
120,0
|
15,0
|
15,2
|
7,2
|
32,1
|
|
100,4
|
115,7
|
15,3
|
|
|
|
|
24
|
101,9
|
117,4
|
15,5
|
14,3
|
8,1
|
36,2
|
|
99,0
|
112,1
|
13,1
|
|
|
|
|
25
|
104,4
|
120,8
|
16,4
|
16,1
|
6,3
|
28,1
|
|
100,8
|
116,5
|
15,7
|
|
|
|
|
26
|
102,4
|
116,2
|
13,8
|
14,9
|
7,5
|
33,5
|
|
103,8
|
119,7
|
15,9
|
|
|
|
|
27
|
100,6
|
116,7
|
16,1
|
15,8
|
6,6
|
29,5
|
|
101,3
|
116,7
|
15,4
|
|
|
|
|
29
|
103,7
|
115,4
|
11,7
|
13,8
|
8,6
|
38,4
|
|
100,4
|
116,3
|
15,9
|
|
|
|
|
30
|
100,9
|
118,1
|
17,2
|
15,4
|
7,0
|
31,3
|
|
102,8
|
116,5
|
13,7
|
|
|
|
Наибольшее значение М2 соответствует
наибольшему количеству углеводородов нефти, разложившихся до СО2 и Н2О,
и деструктивной способности в целом. Деструктивная способность охарактеризована
у следующих штаммов микроорганизмов: №29, № 7, №24, №14, №26, №23, №30, №27,
№25, №3, №16. Номера штаммов указаны в порядке убывания их
углеводородокисляющей активности.
По результатам данного опыта у 11 отобранных
штаммов микроорганизмов, проявляющих наибольшую интенсивность роста, была
подтверждена их углеводородокисляющая активность, выраженная в процентах убыли
углеводородного субстрата из среды.
.3.2 Результаты опыта по определению способности
к продуцированию ауксинов по выявлению фитогормонов с использованием ВЭЖХ
отобранных в предыдущем опыте штаммов
микроорганизмов подвергались предварительному анализу на определение их
способности к продукции фитогормонов ауксинов.
Для выявления штаммов, отличающихся наиболее
интенсивной способностью к продуцированию индолил-3-уксусной кислоты (ИУК) был
проведен сравнительный анализ с использованием реактива Сальковского на
фотоэлектрическом колориметре. Контролем для сравнительного анализа служила
питательная среда без внесения микроорганизмов с добавлением того же количества
реактива Сальковского. Показания снимались при длине волны λ=540нм.
Таблица 5 - Оптическая плотность реакционной
смеси исследуемых образцов
|
№ штамма
|
D540 (оптическая плотность)
|
|
3
|
0,134
|
|
7
|
0,380
|
|
14
|
0,052
|
|
16
|
0,002
|
|
23
|
0,005
|
|
24
|
0,039
|
|
25
|
0,001
|
|
26
|
0,005
|
|
27
|
0,008
|
|
29
|
0,006
|
|
30
|
0,061
|
Так как наибольшее значение оптической плотности
соответствует наиболее яркому окрашиванию реакционной смеси, а значит и
наиболее активному продуцированию ИУК, то по результатам эксперимента было
отобрано 5 штаммов микроорганизмов отличающихся наиболее активным
продуцированием ИУК: №7, №3, №30, №14, №24. Номера штаммов исследуемых
микроорганизмов указаны в порядке убывания их активности продуцирования ИУК.
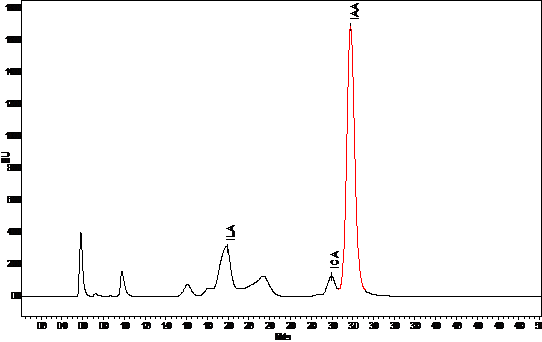
Рисунок 8 - Хроматограмма разделения ауксинов
продуцируемых штаммом № 3
Отобранные штаммы подвергались дальнейшему
исследованию на предмет определения точного количества продуцируемого
фитогормона ИУК и некоторых его производных с использованием ВЭЖХ.

Рисунок 9 - Хроматограмма разделения ауксинов
продуцируемых штаммом № 7
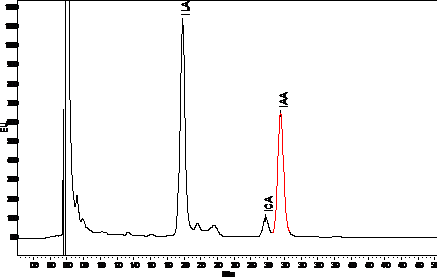
Рисунок 10 - Хроматограмма разделения ауксинов
продуцируемых штаммом № 14
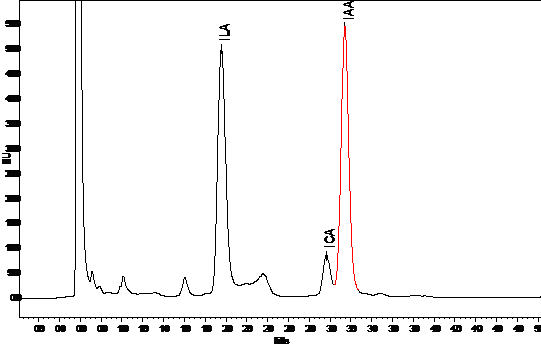
Рисунок 11 - Хроматограмма разделения ауксинов
продуцируемых штаммом № 30
По окончании разделения и идентификации
ауксинов, системой UPLC
была произведена обработка данных, в результате которой нами были получены
диаграммы хроматографии каждого исследуемого штамма микроорганизмов,
позволяющие рассчитать точное количество продуцируемого ими основного
фитогормона ИУК и его производных.
Обозначения принятые в рис.8-11:
EU -
интенсивность флуоресценции (Emission
Units - единицы
эмиссии);
ILA -
индолил-3-молочная кислота (ИМК);
ICA -
индолил-3-карбоновая кислота (ИКК);
IAA -
индолил-3-уксусная кислота (ИУК).
Для определения точного количества продуцируемых
штаммами фитогормонов был использован стандартный раствор с заранее известной
концентрацией ауксинов. В 5 мкл стандарта содержится: ИМК - 2,5·10-6
нг; ИКК - 5·10-5 нг; ИУК - 2·10-5 нг.
Чтобы определить количество любого из трех
ауксинов, содержащихся в одной единице эмиссии, нужно соотнести концентрацию
ауксина стандартного раствора и площадь пика на диаграмме хроматографии этого
же стандартного раствора. Как правило, эти данные так же заранее известны,
таким образом:
k ИМК = 1,21·10-7;
k ИКК = 2,04·10-6;
k ИУК = 4,97·10-8,
где k
ИМК - количество индолил-3-молочной кислоты в 5мкл стандартного раствора отнесенное
к одной единице эмиссии;
k ИКК- количество
индолил-3-карбоновой кислоты в 5мкл стандартного раствора отнесенное к одной
единице эмиссии;
k ИУК - количество
индолил-3-уксусной кислоты в 5мкл стандартного раствора отнесенное к одной
единице эмиссии.
Зная площадь пиков на диаграммах хроматографии
исследуемых штаммов микроорганизмов, можно определить точное количество
продуцируемых ими ауксинов:
ИМК=kИМКsИМК200;
ИКК=kИККsИКК200;
ИУК=kИУКsИУК200,
(3)
где s
ИМК, s ИКК, s
ИУК - площадь пиков соответствующих ауксинов на диаграмме [EU2];
ИМК, ИКК, ИУК - количество соответствующих
ауксинов исследуемого образца [нг/мл];
- кратность 1 мл к 5 мкл.
Таблица 6 - Количество ауксинов в 1 мл
культуральной жидкости исследуемых образцов
|
№ штамма
|
s ИМК
|
s ИКК
|
s ИУК
|
ИМК,
нг/мл
|
ИКК,
нг/мл
|
ИУК,
нг/мл
|
ИМК+
ИКК+ ИУК, нг/мл
|
|
3
|
5507205
|
3621342
|
87965148
|
133,3
|
1477,5
|
874,4
|
2485,2
|
|
7
|
142194628
|
5499558
|
300159765
|
3441,1
|
2243,8
|
2983,6
|
8668,5
|
|
14
|
44866130
|
3464215
|
30090478
|
1085,8
|
1413,4
|
299,1
|
2798,3
|
|
24
|
6429752
|
-
|
7595573
|
155,6
|
-
|
75,5
|
231,1
|
|
30
|
25577146
|
2626492
|
26488684
|
619,0
|
1071,6
|
263,3
|
1953,9
|
По результатам проведенного эксперимента видно,
что штаммы №3, №14 и №30 наиболее активно продуцируют ИКК, в отличие от штамма
№24, который ИКК не продуцирует, штамм №7 наиболее активно продуцируют ИМК, а
штамм №24 - ИМК, нежели основной фитогормон ИУК. Штамм №7 наиболее активно
продуцирует каждый из трех идентифицированных ауксинов. По количеству всех
продуцируемых фитогормонов штаммы исследуемых микроорганизмов располагаются в
следующей последовательности, начиная с наиболее активного продуцента: №7, №14,
№3, №30, №24.
.3.3 Результаты опыта по выявлению
АЦК-утилизирующих микроорганизмов и активности продуцируемого ими фермента АЦК
дезаминазы
Для выявления наиболее активных
АЦК-утилизирующих бактерий по окончании культивирования была проведена
сравнительная визуальная оценка интенсивности и особенности роста исследуемых
штаммов микроорганизмов на разных питательных средах.
Оценка производилась на 5е сутки культивирования
микроорганизмов.
Так как на среде без внесения источников азота
наблюдался незначительный рост биомассы большинства из 11 исследуемых
микроорганизмов, то предполагается, что минимальное количество азота попало в
питательную среду из посторонних источников, например с внесением некоторых
компонентов питания, в меньшей вероятности рост микроорганизмов на голодной
среде объясняется их азотфиксирующими способностями.
Из 11 исследуемых штаммов микроорганизмов штаммы
№24 и №25 проявили более интенсивный рост на среде с добавлением АЦК в качестве
источника азота, по сравнению с ростом на положительном и отрицательном
контроле. Отсутствие роста наблюдалось у штаммов №16, №23, №26 и №29.
По результатам данного эксперимента было
отобрано 2 штамма микроорганизмов обладающих наиболее активной
АЦК-утилизирующей способностью: №24 и №25. Они подвергались дальнейшему
исследованию на предмет изучения активности продуцируемого этими бактериями
фермента АЦК дезаминазы, разлагающего АЦК до α-кетобутирата
и аммония.
Активность фермента АЦК дезаминазы определяли
биохимическим методом Салеха и Глика. Количество α-кетобутирата,
который образовывается при расщеплении бактериями АЦК, определяли
спектрофотометрически при длине волны λ
= 540 нм.
Оптическая плотность реакционной смеси штамма
№24 D540
= 0,71
Оптическая плотность реакционной смеси штамма
№25 D540
= 0,85
По численным значениям оптической плотности с
помощью калибровочного графика была найдена концентрация α-кетобутирата
(Сα-кетобутират)
в каждом из исследуемых образцов.
Штамм №24: Сα-кетобутират
= 0,69±0,02 мкмоль/мл;
Штамм №25: Сα-кетобутират
= 0,79±0,05 мкмоль/мл.
По результатам проведенного опыта штамм №25
является наиболее активным продуцентом АЦК дезаминазы из всех 11 исследуемых
штаммов микроорганизмов.
.3.4 Результаты опыта по определению способности
микроорганизмов разлагать труднодоступные фосфаты
Для определения способности разлагать
труднодоступные фосфаты и их ингибирующего действия на рост и развитие
микроорганизмов была проведена визуальная сравнительная оценка прироста
биомассы бактерий, выросших на среде с добавлением легкодоступного источника
фосфора, и прироста биомассы бактерий, выросших на среде с труднодоступными
фосфатами.
Если прирост биомассы бактерий, выросших на
среде с добавлением труднодоступных фосфатов (фосфат и фитат Са), более
интенсивен, чем прирост биомассы на среде с легкодоступным фосфатом (K2HPO4),
то для этих бактерий фосфат и фитат Са не оказывают ингибирующего действия на
их рост и развитие.
Разница между интенсивностью роста биомассы
бактерий, культивированных на среде с добавлением K2HPO4,
и интенсивностью роста бактерий, культивированных на среде с добавлением
фосфата и фитата Са, в среднем была незначительной.
Штаммы микроорганизмов с более интенсивным
ростом на среде с труднодоступными фосфатами, по сравнению с ростом на среде с
добавлением K2HPO4:
№7, №24, №27, №30. Остальные штаммы проявляли меньшую интенсивность роста, по
сравнению с ростом на среде с добавлением K2HPO4,
отсутствие роста наблюдалось у штаммов №3,№16,№23, №29.
По результатам визуального сравнения
интенсивности роста микроорганизмов на разных средах можно сделать вывод, что у
штаммов №7, №24, №27 и №30 трудноразлагаемые фосфаты не оказывают ингибирующего
действия на их рост и развитие.
Для выявления штаммов микроорганизмов,
отличающихся наиболее активной способностью растворять труднодоступные фосфаты,
сравнивалась площадь зон просветления на питательных средах вокруг колоний
бактерий выросших на 7е сутки культивирования.
На чашках Петри фиксировались диаметры зон
просветления на питательной среде с добавлением Ca3(PO4)2
(d1)
и на питательной среде с добавлением фитата Са (d2).
Сравнивая численные значения d1
и d2
можно сделать вывод, что фитат Са - более труднодоступное соединение для
микроорганизмов, чем Ca3(PO4)2.
Таблица 7 - Диаметр зон просветления на
питательных средах
|
№ штамма
|
d1, мм
|
d2, мм
|
|
3
|
-
|
-
|
|
7
|
7,6
|
5,8
|
|
14
|
4,3
|
-
|
|
16
|
-
|
-
|
|
23
|
-
|
-
|
|
24
|
10,2
|
9,4
|
|
25
|
6,4
|
-
|
|
26
|
-
|
-
|
|
27
|
5,1
|
-
|
|
29
|
-
|
-
|
|
30
|
7,4
|
5,9
|
Так как наибольшая площадь зоны просветления
соответствует наилучшей способности к разложению труднодоступных фосфатов, то
из 11 исследуемых штаммов микроорганизмов можно выделить 3 штамма, обладающих
способностью к разложению труднодоступных фосфатов: №24, №7 и №30.
Выводы по работе
. По результатам опыта по выявлению
углеводородокисляющей способности из 30 исследуемых штаммов микроорганизмов
было отобрано 11 штаммов отличающихся наиболее активной углеводородокисляющей
способностью, а именно: №25 (Rhodococcus
sp. 4n44),
№16 (Micrococcus
luteus 220), №7 (Rhodococcus
erythropolis 401), №30 (Pseudomonas
Aeruginosa 188), №23 (Bacillus
pumilus 128), №3 (Rhodococcus
fascians 394), №27 (Arthrobacter
sp. D12str),
№14 (Bacillus subtilis 440), №26 (Variovorax paradoxus 5p3), №29 (Вacillus
subtilis niger 120), №24 (Variovorax paradoxus 5с2). Способность
к биодеструкции углеводородов нефти была подтверждена экспериментальными
данными выражающими убыль углеводородного субстрата из среды.
. По результатам опыта по выявлению способности
к продукции фитогормонов ауксинов наилучшие результаты показали штаммы №3 (Rhodococcus
fascians 394), №7 (Rhodococcus
erythropolis 401), №14 (Bacillus
subtilis 440), №24 (Variovorax
paradoxus 5с2), №30 (Pseudomonas
Aeruginosa 188). Наилучшую
продукцию ауксинов выявил штамм №7 (Rhodococcus
erythropolis 401).
. По результатам численных значений опыта на
выявление АЦК дезаминазной активности наилучшим образом проявили себя штаммы
№24 (Variovorax paradoxus 5с2) и №25 (Rhodococcus sp. 4n44).
. При выявлении штаммов микроорганизмов
обладающих способностью к разложению труднодоступных фосфатов были отобраны 3
из 11 исследуемых образцов: №7 (Rhodococcus erythropolis 401), №24 (Variovorax
paradoxus 5с2), №30 (Pseudomonas Aeruginosa 188).
По результатам экспериментальной части всей
исследовательской работы предоставляется возможность создания консорциума
штаммов бактерий, обладающих несколькими или одним из ростстимулирующих свойств
и углеводородокисляющей активностью, которые важны для разработки новых
технологий фиторемедиации нефтезагрязненных почв, а именно: штаммы №7 (Rhodococcus
erythropolis 401), №24 (Variovorax
paradoxus 5с2) и №30 (Pseudomonas
aeruginosa 188).
Считаю целесообразным проведение вегетационного
опыта для определения эффективности выбранного консорциума штаммов при
фиторемедиации нефтезагрязненных почв.
Список литературы
1. Шаркова С.Ю. Агрохимические
свойства серых лесных почв при загрязнении их нефтью / С.Ю. Шаркова Е.В.
Надежкина / Плодородие, 2008.- №4.- 45с.
. Вальков В.Ф. Экология почв:
Учебное пособие для студентов вузов Часть 3. Загрязнение почв / В.Ф. Вальков,
К.Ш. Казеев, С.И. Колесников / Ростов-на-Дону: УПЛ РГУ, 2004. - 54 с.
3. Воеводина Л.А. О
биологических методах мелиорации земель. / Л.А. Воеводина, О.В. Воеводин //
Вестник государственного аграрного университета, Кубанский государственный
аграрный университет, 2005. - № 13. - с. 71-77.
4. Емельянова, Е.К.
Биорекультивация загрязненных нефтью объектов в Тюменской области / Е.К.
Емельянова // Вестник Новосибирского государственного университета. Серия:
Биология, клиническая медицина, 2010. - Т. 8, № 4, с. 155-161
5. Гриценко А.И. Экология.
Нефть и газ / А.И. Гриценко, Г.С. Акопов, В.М. Максимов. - М.: Наука, 1997.-598
с.
6. Восстановление
нефтезагрязнённых почвенных экосистем / Под ред. М.А. Глазковской.- М. Наука,
1988.- 264 с.
. Шамаева А.А. Исследование
процессов биоремедиации почв и объектов, загрязненных нефтяными углеводородами:
Автореферат диссертации на соискание ученой степени кандидата биол. Наук:
14.11.2007 / Башкирский гос. унив-т.- Уфа.- 2007.
. Панов Г.Е. Охрана окружающей
среды на предприятиях нефтяной и газовой промышленности / Г.Е. Панов, Л.Ф.
Петряшин, Г.Н. Лысяный. - М.: Недра, 1986.- 244 с.
9. Проскуряков В.А. Химия нефти
и газа / В.А. Проскуряков.- СПб.: Химия, 1995. - с.448.
10. Андреева И.И. Ботаника: учеб
для с/х вузов / И.И. Андреева, Л.С. Родман.- М.: Колос, 2005. - 528с.
11. Саксонов М.А. Экологический
мониторинг нефтегазовой отрасли / М.А. Саксонов, А.Д. Абалаков, Л.В. Данько,
О.А. Бархатова, А.Э. Балаян, Д.И. Стом // Физико-химические и биологические
методы. - Иркутск: Иркут. Ун-т, 2005.-114 с.
12. Пиковский Ю.И. Проблема
диагностики и нормирования загрязнения почв нефтью и нефтепродуктами / Ю.И.
Пиковский, А.Н. Геннадиев, С.С. Чернянский, Г.Н. Сахаров // Почвоведение.-№
9.-2003.-с.1132-1140.
13. Колесниченко А.В. Процессы
биодеградации в нефтезагрязненных почвах / А.В. Колесниченко, А.И. Марченко,
Т.П. Побежимова, В.В. Зыкова.- Москва: «Промэкобезопасность», 2004. - 194 с.
14. Джамбетова П.М. Влияние
нефтезагрязнений на морфологические и цитогенетические характеристики растений
/ П.М. Джамбетова, Н.В. Реутова, М.Н. Ситников // Экологическая генетика
[электронный ресурс]: Рецензируемый научно-практический журнал.- СПб.- 2005.
. Мазунина Л.Е. Особенности
анатомии и морфологии растений в условиях нефтяного загрязнения / Л.Е. Мазунина
М. : Изд-во ЛКИ, 2008. - 336 с.
. Бочарникова Е.Д. Влияние
нефтяного загрязнения на свойства серо-бурых почв Апшерона и серых лесных почв
Башкирии / Е.Д Бочарникова // Автореф. Дис. … канд. биол. наук.- М.: 1990.-16
с.
. Киреева Н.А. Рост и развитие
растений яровой пшеницы на нефтезагрязненных почвах и при биоремедиации / Н.А.
Киреева, А.М. Мифтахова, Г.М. Салахова // Агрохимия.- 2006.- №1.- с.85-90.
. Левин С.В.
Эколого-микробиологическое нормирование содержания нефти в почве / С.В. Левин,
Э.М. Халимов, В.С. Гузев // Токсикологический вестник.-1995.- №1.- с. 11-15.
. Мазунина Л.Е. Особенности
анатомии и морфологии растений в условиях нефтяного загрязнения
20. Чупахина Г.Н. Адаптация
растений к нефтяному загрязнению / Г.Н. Чупахина, П.В. Масленников // Экология.-
2004.- №5.-с.330-335.
21. Иерусалимский Н.Д.
Исследование микрофлоры сточных вод нефтеперераба-тывающих предприятий / Н.Д.
Иерусалимский, Е.А. Андреева, Е.Л. Гришанкова, Е.Л. Головлев, В.В. Дорохов,
Л.Н. Жукова // Прикладная биохимия и микробиология. - 1965.- № 2.-с.163-166.
22. Киреева Н.А. Микробиологическая
оценка почвы, загрязненной нефтяными углеводородами / Н.А. Киреева // Баш. Хим.
ж.-1995.-2, № 3-4.-с. 65-68.
23. Киреева Н.А. Влияние
загрязнения почв нефтью и нефтепродуктами на численность и видовой состав
микромицетов / Н.А. Киреева, Н.Ф Галимзянова // Почвоведение, 1995.- №2,-
с.211-216.
24. Бабаев Э.Р., Преобразование
нефти в процессе её микробиологической деградации в почве // Э.Р. Бабаев,
Мовсумзаде М.Э. / Башкирский химический журнал, 2009. - Т.16. - №3. - С. 80-87.
25. Скрябин Г.К., Головлёва Л.А.
Использование микроорганизмов в органическом синтезе / Г.К. Скрябин, Л.А.
Головлёва М.:Наука, 1976. - 332 с.
26. Crawford R.L., Frick
T.D. Purification and properties of gentisate-l,2-dioxygenase from Moraxella
osloensis // Journal of Bacteriology. - 1975. - Vol. 121. - P. 794-799.
. Gasellas, M., Grifoll
M., Sebate J., Solanas A.M. Isolation and characterization of a fluorenone-
degrading bacterial strain and
its role in synergistic degradation of fluorene by a consortium // Canadian
journal of Microbiology. - 1998. - Vol. 44. - P. - 734-742.
. Grifoll М.,
Gasellas М., Bayona J.,
Solanas A.M. Isolation and characterization of a fluorenedegrading bacterium:
identification of ring oxidation and ring fission products // Applied and
Environmental Microbiology. - 1992. - Vol. 58. - P. 2910-2917.
29. Kastner M.,
Breuer-Jammali M., Mahro H. Enumeration and characterization of the soil
microflora from hydrocarbon-contaminated soil sites able to mineralize
polycyclic aromatic hydrocarbons (PAH) //Applied Microbiology and
Biotechnology. - 1994. - Vol. 41. - P. 267-273.
. Kiyohara H., Nagao K.,
Nomi R. Degradation of phenanthrene through o-phthalic acid bv an
Aeromonas sp. // Agricultural
and biological chemistry. - 1976. - Vol.40. - P. 1075-1082.
. Kiyohara H., Nagao K.
The catabolism of phenantrene and naphthalene by bacteria// Journal
ofMicrobiology. - 1978. - Vol. 105. - P. 69-75.
. Kiyohara H., Nagdd K.,
Yana K. Rapid screen for bacteria degrading water-insoluble, solidon agar
plates // Applied and Environmental Microbiology. - 1982. - Vol. 43. - P. 454
457.
. Samanta S.K., Singh О.V.
Polycyclic aromatic hydrocarbons: environmental pollution and// Trends in
Biotechnology. - 2002. - Vol. 20. - P. 243-248.
. Sukplanga P., Thongmeea
A., Velaa G. Roland. Degradation of Linseed Oil Vapors by Soil Bacteria in
Trickling Biofilters // Bioremediation Journal. - 1999. -Vol. 3. - P. 189-200.\
. Yamada К.,
Horiguchi S., Takahashi J. Studies on the utilization of hydrocarbons by
microorganisms// Agricultural and biological chemistry. - 1965. - Vol. 29. - P.
943-948.
. Crawford R.L., Frick
T.D. Purification and properties of gentisate-l,2-dioxygenase from Moraxella
osloensis // Journal of Bacteriology. - 1975. - Vol. 121. - P. 794-799.
. Cerniglia СЕ.
Biodegradation of polycyclic aromatic hydrocarbons //Biodegradation. - 1992.
-Vol. 3.- P. 351-368.
. Bar-Ness E., Chen Y.,
Hadar Y. Siderophores of Pseudomonas putida as an iron source for dicot and
monocot plants. Plant and Soil, 1991, 130: 231-241.
. Becker D., Stanke R.,
Fendrik I. Expression of the NH4+-transporter gene LEAMT1:2 is induced in
tomato roots upon association with N2-fixing bacteria. Planta, 2002, 215:
424-429.
. Mantelin S., Touraine
B. Plant growth-promoting bacteria and nitrate availability: impacts on root
development and nitrate uptake. J. Exp. Bot., 2004, 55: 27-34.
. Czarny J.C., Grichko
V.P., Glick B.R. Genetic modulation of ethylene biosynthesis and signaling in
plants. Biotech. Adv., 2006, 24: 410-419.
. Glick B.R., Jacobson
C.B., Schwarze M.M.K. 1-aminocyclopropane-1-carboxylic acideaminase mutants of
the plant growth promoting rhizobacterium Pseudomonas putida GR12-2 do not
stimulate canola root elongation. Can. J. Microbiol., 1994, 40: 911-915.
. Belimov A.A., Dodd
I.C., Hontzeas N. Rhizosphere bacteria containing ACC deaminase increase yield
of plants grown in drying soil via both local and systemic hormone signaling.
New Phytol., 2009, 181: 413-423.
. Glick B.R.
Phytoremediation: synergistic use of plants and bacteria to clean up the
environment. Biotech. Adv., 2003, 21: 383-393.
. Safronova V.I.,
Stepanok V.V., Engqvist G.L. Root-associated bacteria containing
1-aminocyclopropane-1-carboxylate deaminase improve growth and nutrient uptake
by pea genotypes cultivated in cadmium supplemented soil. Biol. Fertil. Soils,
2006, 42: 267-272.
. Belimov A.A., Wenzel
W.W. The role of rhizosphere microorganisms in heavy metal tolerance of higher
plants. Aspe. Appl. Biol., 2009, 98: 81-90.
. Belimov A.A., Dodd
I.C., Safronova V.I. e.a. ACC deaminase-containing rhizobacteria improve
vegetative development and yield of potato plants grown under water-limited
conditions. Aspe. Appl. Biol., 2009, 98: 163-169.
. Mayak S., Tirosh T.,
Glick B.R. Plant growth-promoting bacteria that confer resistance in tomato to
salt stress. Plant Physiol. Biochem., 2004, 42: 565-572.
. Bloemberg G.V.,
Lugtenberg B.J.J. Molecular basis of plant growth promotion and biocontrol by
rhizobacteria. Curr. Opin. Plant Biol., 2001, 4: 343-350.
. Duffy B., Keel C.,
Defago G. Potential role of pathogen signaling in multitrophic plant-microbe
interactions involved in disease protection. Appl. Environ. Microbiol., 2004,
70: 1836-1842.
. Van Loon L.C., Bakker
P.A.H.M., Pieterse C.M.J. Systemic resistance induced by
rhizosphere bacteria. Annu.
Rev. Phytopathol., 1998, 36: 453-483.
. Lugtenberg B.J.J.,
Dekkers L., Bloemberg G.V. Molecular determinants of the rhizosphere
olonization by pseudomonas. Annu. Rev. Phytopathol., 2001, 39: 461-490.
54. Кравченко Л.В., Азарова Т.С.,
Леонова-Ерко Е.И. и др. Корневые выделения томатов и их влияние на рост и
антифунгальную активность штаммов Pseudomonas. Микробиология, 2003, 72(1):
48-53.
55. Simons M., Permentier
H.J., De Weger L.A. e.a Amino acid synthesis is necessary for tomato root
colonization by Pseudomonas fluorescens strain WCS365. MPMI, 1997, 10: 102-106.
. Kuiper I., Bloemberg
G.V., Lugtenberg J.J. Selection of a plant-bacterium pair as a novel tool for
rhizostimulation of polycyclic aromatic hydrocarbon-degrading bacteria. MPMI,
2001, 14:
57. Кочергин И.Е., Ознобихин В.И.,
Савельев А.В. Опыт биоремедиации нефтезагрязненной почвы в рамках полевого
эксперимента в условиях северного Сахалина / И.Е Кочергин, В.И. Ознобихин, А.В.
Савельев / Сборник статей РЭА, №1, 2009, 84-96с.
. Назаров А.В. Ризосферное
микробно-растительное взаимодействие - основа новых биотехнологических методов
восстановления нефтезагрязненных почв. / А.В. Назаров. Вестник Пермского
научного центра. Пермь, 2011, № 4, 19-24.
59. Швец А.А. Фиторемедиация
загрязненных нефтью почв в условиях северо-западного Кавказа: Автореферат
диссертации на соискание ученой степени кандидата с/х наук: 25.12.2009 /
Кубанский гос. техн. унив-т.- Краснодар.- 2009.
60. Алиев С.А. Рекомендации по
рекультивации нефтезагрязненных земель / С.А. Алиев, Гвозденко Д.В., Бабаев
М.П., Гаджиев Д.А.- Баку: Элм, 1981.-26 с.
61. Колесниченко А.В. Процессы
биодеградации в нефтезагрязненных почвах / А.В. Колесниченко, А.И. Марченко,
Т.П. Побежимова, В.В. Зыкова.- Москва: «Промэкобезопасность», 2004. - 194 с.
. Коронелли, Т.В. Принципы и
методы интенсификации биологического разрушения углеводородов в окружающей
среде (обзор) / Т.В. Коронелли // Прикладная биохимия и микробиология.-1996.-
32, № 6.- с.579-585.
. Логинов О.Н.
Биотехнологические методы очистки окружающей среды от техногенных загрязнений /
О.Н. Логинов, Н.Н, Силищев, Т.Ф. Бойко, Н.Ф. Галимзянова.-Уфа: Гос. изд.
научно-тех. литературы «Реактив», 2000. - 100 с.
. Сидоров Д.Г. Полевой
эксперимент по очистке почв от нефтяного загрязнения с использованием
углеводородокисляющих микроорганизмов / Д.Г. Сидоров, И.А. Борзенков, Р.Р.
Ибатулин, Е.И. Милехина, И.Т. Храмов, С.С. Беляев, М.В. Иванов // Прикладная
биохимия и микробиология.- 1997.- Т.33, №5.- с.497-502.
65. Шаркова С.Ю. Агрохимические
свойства серых лесных почв при загрязнении их нефтью / С.Ю. Шаркова Е.В.
Надежкина // Плодородие.- 2008.- №4.-с.45.
66. Оборин А.А. Нефтезагрязненные
биогеоценозы (процессы образования, научные основы восстановления,
медико-экологические проблемы): монография / А.А. Оборин. - Пермь, 2008. - 511
с.