Углеводородокисляющие микроорганизмы – перспективные объекты экологической биотехнологии
«Углеводородокисляющие
микроорганизмы - перспективные объекты экологической биотехнологии»
Содержание
Введение
. Методы микробиологической
химии
.1 Трансформация растущей
культурой
.2 Трансформация суспензиями
неразмножающихся клеток
.3 Трансформации,
осуществляемые спорами грибов и актиномицетов
.4 Непрерывные методы
микробиологической трансформации органических соединений
.5 Соокисление и кометаболизм
.6 Политрансформации
. Роль микробиологической
трансформации
.1 Роль микробиологической трансформации
в процессах деградации чужеродных соединений
.2 Трансформация
феноксиуксусных кислот17
.3 Трансформация
феноксиалкилкарбоновых кислот
.4 Трансформация
галогенпроизводных циклических углеводородов
.5 Трансформация карбаматов
.6 Трансформация замещенных
мочевины
.7 Трансформация триазинов
.8 Биодеградация
поверхностно-активных углеводородов
. Характеристика основных
углеводородокисляющих микроорганизмов
.1 Краткая характеристика
микроорганизмов рода Acinetobacter
.2 Краткая характеристика
микроорганизмов рода Candida
.3 Краткая характеристика
микроорганизмов рода Pseudomonas
.4 Краткая характеристика
микроорганизмов рода Arthrobacter
.5 Краткая характеристика
микроорганизмов рода Bacillus
.6 Краткая характеристика
микроорганизмов рода Actinomyces
.7 Краткая характеристика
микроорганизмов рода Nocardia
.8 Краткая характеристика
микроорганизмов рода Rhodococcus
. Биодеструкция нефтешламов
.1 Деструкция нефтешламов
ассоциациями микроорганизмов
.1.1 Раздельное и совместное
культивирование микроорганизмов-деструкторов нефти родов Pseudomonas и
Rhodococcus
.1.2 Культивирование
Pseudomonas sp. 142NF(pNF142)и Rhodococcus sp. S67 в виде монокультур или в
смешанной культуре
.1.3 Обезвреживание
нефтешламов ассоциацией микроорганизмов родов Bacillus, Rhodococcus и Fusarium
.2 Биоремедиация нефтешламов
компостированием
.3 Биоремедиации почв и
водной среды
.3.1 Использование
психротолерантных штаммов-нефтедеструкторов для биоремедиации почв и водной
среды
.3.2 Биоремедиация почв в
условиях северных регионов России
.4 Биодеструкция
углеводородов нефти методом непрерывного культивирования
.5 Биоремедиация черноземной
почвы, загрязненной нефтью
Список использованных
источников
Введение
Предприятия нефтедобывающей и нефтеперерабатывающей
промышленности являются одним из основных источников загрязнения окружающей
среды. Неблагоприятное воздействие нефтешламов на окружающую природную среду и
невозобновляемость углеводородного сырья делают вопрос переработки отходов
весьма актуальным.
Существуют различные способы переработки и утилизации
отходов нефтеперерабатывающей промышленности с помощью механических,
физико-химических, химических и биологических методов. При выборе способа
утилизации приоритет в основном отдается способам, направленным на извлечение
из нефтешламов углеводородного сырья. Однако не решена проблема доочистки
образовавшихся в результате переработки твердых отходов и водной фазы. Наиболее
перспективным способом очистки нефтешламов представляется комплекс мер,
сочетающих различные методы очистки.
В настоящее время все большее применение находят
биологические методы очистки почвы и воды от нефтяных загрязнений, основанные
на применении активных микробных штаммов, проявляющих способность использовать
в качестве источника углерода и энергии углеводороды нефти и нефтепродуктов.
Соединения, которые подвергаются полной деградации,
могут использоваться микроорганизмами в качестве источника углерода, а также
источника энергии или в процессах метаболизма. Разрушение стойких органических
соединений в природе происходит, как правило, в результате совместного действия
микроорганизмов и абиотических факторов. Микробиологическая минерализация
является наиболее эффективным и экологически приемлемым способом удаления
органических ксенобиотиков из окружающей среды.[1]
Целью бакалаврской работы является анализ и
систематика современных литературных данных по использованию
углеводородокисляющих микроорганизмов для решению экологических проблем. Для
достижения поставленной цели были поставлены следующие задачи:
получить представление о современных методах борьбы с
нефтяными загрязнениями воды и почвы;
рассмотреть свойства известных на сегодняшний момент
микроорганизмов, способных утилизировать углеводороды нефти;
ознакомиться с культуральными, морфологическими и
биохимическими свойствами углеводородокисляющих микроорганизмов
1. Методы микробиологической химии
Современная методология микробиологической
трансформации позволяет использовать для осуществления того или иного
химического превращения любой микроорганизм. В исследовательской и
производственной практике набор микробных культур, используемых для
трансформационных реакций, намного меньше, чем полный список всех известных
микроорганизмов. В первую очередь находят применение в качестве
культур-трансформаторов сапрофитные организмы, способные развиваться на
сравнительно простых средах, гетеротрофы, отличающиеся интенсивным обменом
веществ.
Существуют, наконец, «звезды» микробиологической трансформации -
отдельные виды или даже штаммы, известные своей способностью проводить разнообразные
превращения. В настоящее время такими «звёздами» являются следующие штаммы
микроорганизмов-нефтедеструкторов: Pseudomonas sp.
22, Rhodococcus erythropolis 21, Microbacterium tefaciens 6, Pseudomonas sp. 9, Bacillus sp. 282, Arthrobacter sp. 283, штаммы дрожжей NF 4-2 и NF
5-1, Y. lipolytica NF5-1, Pseudomonas sp. KL-1, Rhodococcus
erythropolis BKM AC-1339Д, Pseudomonas sp. 142NF (pNF142), Rhodococcus sp. S67,
Rhodococcus erythropolis AC-1339 Д, Bacillus subtilis ВКМ
1742 Д, Fusarium species №56, Pseudomonas
aureofaciens 1393, Rhodococcus erythropolis Sh5, Microbacterium liquefaciens
AshlO, Pseudomonas putida Sh-1, Pseudomonas sp. Ash-10, Rhodococcus sp. Sh-5 и Pseudomonas sp. KL-1.
В настоящее время существуют следующие методы использования энзиматической
активности отдельных участков метаболической системы микробной клетки для
осуществления химических превращений экзогенных веществ:
. Использование ферментативных свойств нормально развивающихся культур:
а) Трансформация растущей культурой в периодических условиях.
б) Использование ферментативной активности определенных фаз развития:
трансформация суспензиями неразмножающихся клеток;
трансформация спорами;
непрерывные методы.
. Методы, основанные на дезорганизации обменных процессов клетки:
а) применение в различной степени поврежденных и дезинтегрированных
клеток;
б) ингибирование определенных участков метаболических путей;
в) применение мутантов с блокированным синтезом определенных ферментов.
. Использование ферментных препаратов, иммобилизованных ферритов и
клеток.
. Политрансформация.
. Соокисление и кометаболизм
Практически реализуемые методы обычно представляют собой результат
комплексного применения нескольких подходов. [2]
1.1 Трансформация растущей культурой
Наиболее прост метод проведения трансформационных
реакций, когда трансформируемый субстрат вносится в культуру, растущую на
какой-либо полноценной питательной среде. Большая часть микробиологических
превращений стероидов осуществляется этим методом. Обычно трансформирующая
культура выращивается на оптимальной питательной среде, трансформируемое
вещество вводится или в начале процесса, или по ходу развития культуры. Продукт
реакции экстрагируется в момент, когда его концентрация в культуральной
жидкости достигает наибольшего значения.
В преобладающем большинстве случаев трансформационная
активность микроорганизмов существенно меняется в процессе роста культуры, а
максимальная скорость образования продукта проявляется клетками лишь в
определенном физиологическом возрасте, в определенной фазе развития. Известно,
что важнейшей характеристикой ферментационного процесса является соотношение
между ростом клеточного вещества и образованием продуктов. Разные ферментации
заметно различаются по этому признаку. Наиболее естественной классификацией ферментационных
процессов является схема, разработанная Гейденом. Основные принципы этой схемы
могут быть положены и в основу классификации физиологических типов
трансформационных процессов.
Трансформации I типа характеризуются тесной связью
между- ростом и накоплением продукта, так что второй тип процессов является
непосредственным результатом превращения источника углерода в энергетическом
обмене. К процессам этого типа относятся трансформации, представляющие собой
накопление промежуточных продуктов катаболизма, например неассимилируемых
фрагментов молекул ростового субстрата. Типичными примерами могут служить
окисление нафталина с образованием салициловой кислоты, алкилбензолов с
длинными алифатическими заместителям в ароматические кислоты и т.п. В этих процессах
ростовой субстрат является и трансформируемым веществом. Отличительная черта
этих трансформаций - совпадение максимумов скоростей ростового и
трансформационного процессов. Поэтому воздействия, регулирующие рост,
соответственно, влияют на накопление продукта трансформации.
Сложнее для изучения и регулирования процессы, где
ростовой трансформируемый субстраты различны. У трансформаций II типа максимумы
скоростей ростового и трансформационного процессов несколько сдвинуты. Типичен
случай, когда наибольшая трансформационная активность приходится на фазу
замедления роста (следующую за экспоненциальной). Биомасса в это время
нарастает линейно.
Трансформация III типа отличается четко выраженной
двухфазностью. Трансформационный процесс является в данном случае типичным
вторичным процессом, его максимальная удельная скорость соответствует
стационарной фазе роста культуры. В некоторых случаях трансформация начинается
лишь по окончании роста. Так идет окисление цис-пропенилфосфоновой кислоты в
фосфомицин культурой Penicillium spinulosum.
Изучение корреляции между ростовым и трансформационным
процессами служит непременным условием для успешного регулирования оптимизации
трансформации. Установив фазу развития, в которой культура проявляет наибольшую
трансформирующую активность, исследователи пытаются использовать для проведения
реакции клетки, тем или иным путем стабилизированные именно в этом состоянии.
Существуют, по крайней мере, два подхода, позволяющие это сделать -
использование суспензий неразмножающихся клеток и стабилизация физиологического
состояния культуры с помощью методов непрерывного культивирования.
1.2 Трансформация суспензиями неразмножающихся клеток
Этот метод широко распространен в микробиологической
практике особенно в области трансформации стероидов. Он может быть использован
сравнительно легко в тех случаях, когда трансформации осуществляются грибными
культурами, мицелий которых может быть без особых технологических затруднений
отделен от среды выращивания в нужный момент и ресуспендирован в буферном
растворе или даже водопроводной воде, где и осуществляется трансформационная
реакция. Достоинство этого; метода заключается и в том, что простая
трансформационная среда облегчает выделение продукта в отличие от
трансформаций, осуществляемых растущей культурой, где в качестве сред часто
используют очень сложные по составу растворы, включающие, например, такие
комплексные ингредиенты, как кукурузный экстракт.
Метод трансформации суспензиями неразмножающихся
клеток позволяет использовать культуру определенного физиологического
состояния, которое соответствует строго определенному возрасту. Так, в
гидроксилирование кортексолоны с помощью культуры Ticghemella Hi 333 наиболее
интенсивно осуществляется 19-часовым мицелием. Суспензии отмытых клеток
используются также для трансформации кортексолонов в гидрокортизон и ацетат
кортизона, дезацетилирования ацетата кортизона (Mycobac-album 726) и ряда
других превращений.
1.3 Трансформации, осуществляемые спорами грибов и
актиномицетов
Трансформации, осуществляемые спорами, заслуживают
специального внимания. Они обладают рядом удобств как технологические процессы.
Неожиданно высокая энзиматическая активность, которую демонстрируют споры,
осуществляющие трансформации органических веществ, еще раз напоминают, насколько
условны многие схемы, воспринимаемые как не подлежащие сомнению.
В конце 50-х годов было обнаружено, что давно
известное превращение жирных кислот в метилкетоны, осуществляемое некоторыми
плесенями в процессе созревания сыра «Рокфор», является функцией спор.
Особенность этой трансформации заключается в том, что проросшие споры и
мицелиальные клетки практически не обладают трансформирующей активностью.
Отмытые споры (0 час) образуют кетон и поглощают кислород с максимальной
интенсивностью. 16-часовая культура, у которой около половины спор проросло,
продуцирует по сравнению с исходной суспензией спор меньше половины кетона и
значительно меньше поглощает кислорода. Через 48 часов все споры прорастают,
образование кетона и поглощение кислорода прекращаются.
Описания трансформация - не уникальное свойство
культуры Penicillium roqueforti. Она широко распространена среди грибов,
представителей как рода Penicillium, так и других родов - Aspergillus,
Curvularia, Paecilomyces, Scopulariopsis.
1.4 Непрерывные методы микробиологической трансформации
органических соединений
Процессы получения продуктов, непосредственно
связанные с ростом микроорганизмов в условиях непрерывного культивирования,
осуществляются сравнительно легко. Некоторые из них - производство уксусной кислоты,
этилового спирта - уже нашли применение в промышленности.
Основным достоинством непрерывного культивирования
является возможность поддерживать микробную культуру в течение длительного
времени в стабильном физиологическом состоянии при постоянных условиях
культивирования. Техника многостадийных систем позволяет стабилизировать
культуры даже в состоянии, физиологически весьма далеком от фазы наиболее
интенсивного (экспоненциального) роста, что необходимо в случае
микробиологических процессов, не связанных с ростом.
Проточные системы интенсивно используется при
трансформации соединений, не связанных непосредственно с ростом культур. Для
реализации таких трансформаций первостепенное значение имеет правильное
понимание соотношения процессов роста и превращения трансформационного
субстрата, изучение оптимальных условий для той или иной фазы развития.
Двухстадийный непрерывный процесс позволяет расчленить фазы развития культуры.
Используют для биодеструкции углеводородов нефти такие
микроорганизмы как Rhodococcus, Candida, Pseudomonas, Bacillus, Fusarium, Nocardia и другие.
1.5 Соокисление и кометаболизм
Термин «соокисление» возник в мировой литературе в
конце 1950-х годов. Он впервые был упомянут в работах по окислению
углеводородов микроорганизмами Pseudomonas methanica. Эта
культура использует в качестве источника углерода и энергии метан, но не
способна расти за счет его гомологов, тем не менее окисляет этан, пропан и
бутан в процессе роста за счет метана или будучи выращенной на метане. Это
явление и было названо «соокисление».
В 1960-х годах был предложен более общий термин
«кометаболизм». Строгое определение понятия «кометаболизм» отсутствует, и
разные авторы толкуют его весьма произвольно.
Некоторые исследователи - специалисты в области
почвенной микробиологии - называют кометаболизмом процессы трансформации
органических соединений (в частности, пестицидов), осуществляемые
микроорганизмами, растущими или выращенными на субстратах, индуцирующих синтез
трансформирующей ферментной системы.
Большинство специалистов-микробиологов определяют
кометаболизм как ферментативные процессы, которые осуществляются
микроорганизмами лишь сопряженно с использованием ростовых субстратов. Другими
словами, этот феномен характеризуется тем, что трансформационная реакция
проявляется лишь в присутствии ростового субстрата определенной структуры и при
условии его использования. Тесная взаимосвязь между ростовыми и
трансформационными процессами, зависимость трансформационного процесса от
природы ростового субстрата и являются характерными и отличительными чертами
кометаболизма.
Взаимосвязь между окислением ростового субстрата и
превращением трансформируемого вещества может быть очень тесной. Например,
культура Nocardia corallina 1А окисляет 3-метилпиридин, п-ксилол
и ряд других структурно близких соединений в циклические кислоты только при
наличии в среде ростового субстрата. Отмытые клетки этой культуры в буферном
растворе названные соединения не окисляют. Трансформация начинается только
после внесения ростового субстрата в систему. Наиболее интенсивно окисляется
3-метилпиридин культурой, растущей на полноценной питательной среде.
Ярким примером полифункциональности, которая
реализуется в условиях кометаболизма, могут быть реакции культуры Nocardia corallina 1А. Этот организм окисляет метилы у
таких соединений, как м- и п-ксилолы, 3-метилпиридин, м- и п-нитротолуолы; при
этом накапливаются соответствующие циклические кислоты. При появлении
аминогруппы в молекуле трансформируемого субстрата культура в тех же условиях
осуществляет ее ацелирование, не действуя на метил. У хлортолуолов
элиминируется хлор и расщепляется кольцо, крезолы расщепляются без окисления
метила и т.д.
Представители родов Arthrobacter, Brevibacterium, Cellumonas, Corynebacterium, Mycobacterium, Nocardia способны осуществлять различные
окислительные превращения бензола и п-ксилола в соокислительных условиях, т.е.
в процессе роста на н-парафинах или на глюкозе. Схема превращения бензола
изображена на рисунке 1, схема превращения ксилола на рисунке 2.
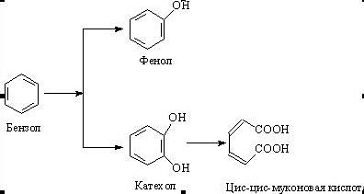
Рисунок 1 - Превращение бензола в соокислительных
условиях
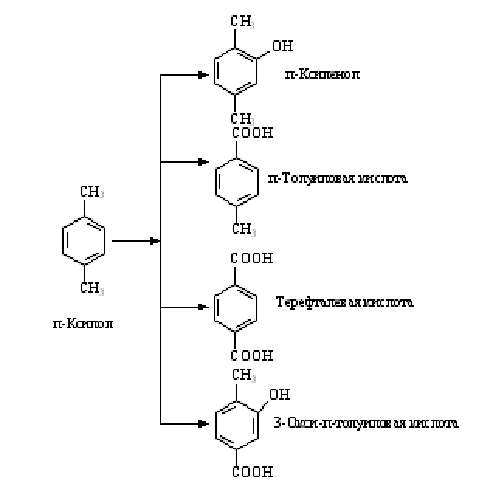
Рисунок 2 - Превращение п-ксилола в соокислительных
условиях
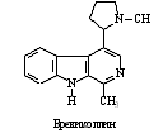
Интересным примером процессов кометаболизма является
превращение алкалоида бревикарина в бревиколлин грибными культурами Penicillium sp. и Rhizopus sp., которое
заключается в циклизации алифатического радикала. В таблице 1 основные типы
процессов, осуществляемых микроорганизмами в условиях кометаболизма.
Таблица 1 - Основные типы процессов, осуществляемых
микроорганизмами в условиях кометаболизма
|
Микроорганизм
|
Ростовой субстрат
|
Трансформируемый субстрат
|
Продукты трансформации
|
|
1
|
2
|
3
|
4
|
|
Nocardia corallina 1А
|
Глюкоза, н-алканы и др.
|
 3-метилпиридин 3-метилпиридин
|
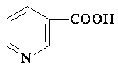 Никотиновая кислота Никотиновая кислота
|
|
Nocardia corallina V-49
|
н-гекса-декан
|
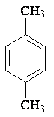 п-Ксилол п-Ксилол
|
 3,6-диметилкатехол 3,6-диметилкатехол
|
|
Nocardia corallina V-49
|
н-гекса-декан
|
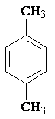 п-Ксилол п-Ксилол
|
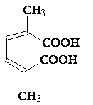 Цис, цис - 1,3-диметилмуконовая кислота Цис, цис - 1,3-диметилмуконовая кислота
|
|
Nocardia corallina 1А
|
Бутират
|
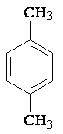 п-Ксилол п-Ксилол
|
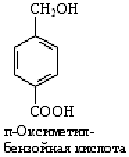
|
|
Mycobacterium vaccae
JOB-5
|
2-Метилбутан
|
 Циклогексан Циклогексан
|
 Циклогексанон Циклогексанон
|
|
Pseudomonas
methanica
|
Метан
|
Пропан
|
Пропанол
|
|
Arthrobacter sp.
|
Дрожжевой экстракт
|
Гекадекан
|
Смесь 2-,3-,4-
гесадеканонов
|
|
Candida cloacae
M-1
|
Ацетат
|
Гексадекан
|
Тетрадекандикарбоновая
кислота
|
|
Nocardia corallina 1А
|
Глюкоза, гексадекан
|
 п-Толуидин п-Толуидин
|
 П-Ацетаминтолуол П-Ацетаминтолуол
|
|
Pseudomonas
ovalis 6-1
|
Этанол
|
|
|
|
Pseudomonas
ovalis 6-1
|
Этанол
|
|
|
|
Corynebacterium
sp
|
Глюконат
|
D-ксилоза
|
Ксилит
|
|
Penicillium sp., Rhizopus sp.
|
Сахароза
|
|
|
Таким образом, реакции кометаболизма очень
разнообразны и часто встречаются в мире микроорганизмов. Характерная черта этих
процессов - взаимосвязь между превращениями трансформируемых субстратов и
косубстратов. Косубстраты можно разделить на три группы:
а) соединения, являющиеся легко используемыми
субстратами для роста, но при росте на которых удельный выход продукта
трансформации невысок - глюкоза, манит;
б) соединения, на которых культура слабо растет или
вообще не растет, но активно трансформирует - мальтоза, глицерин, ксилоза;
в) соединения, являющиеся плохими субстратами как для
роста, так и для трансформации - ацетат, этанол.
Особенность кометаболизма заключается в том, что субстрат
не обязательно служит источником углерода. В некоторых случаях косубстрат
претерпевает лишь частичные превращения, т.е. трансформируется, также как и
основной трансформируемый субстрат, например, при окислении 3 - метилпиридина и
п-ксилола культурой Nocardia
corallina 1А в присутствии кислозы, которая
превращается данным организмом в частично окисленные продукты.
В настоящее время выделяют три типа кометаболизма:
) трансформация основного субстрата в процессе роста
микроорганизма за счет косубстрата;
) трансформация основного субстрата в процессе
трансформации косубстрата, который в данном случае не является источником
углерода;
) деградация основного субстрата в процессе роста
культуры за счет косубстрата.
1.6 Политрансформации
Трансформация сложных органических молекул часто
предполагает более чем одну ферментативную реакцию. В ряде случаев для
получения практически ценных продуктов требуются весьма существенные
перестройки молекулы субстрата, которые могут быть реализованы только действием
комплекса ферментов. Отдельные трансформации, осуществляемые этими ферментами,
могут относиться к различным классам, например окисление и гидролиз, или
окисление, восстановление и гидролиз и т.п.
В тех случаях, когда не удается подобрать
микроорганизм, осуществляющий сразу несколько превращений трансформируемого
субстрата, или выход политрансформации монокультурой недостаточно высок,
используют последовательно или одновременно несколько микроорганизмов.
При осуществлении последовательной трансформации
возникают технологические трудности. При работе со смешанными культурами
появляются проблемы, связанные с взаимодействием микроорганизмов. В ряде
случаев в условиях совместного культивирования микроорганизмы функционируют
иначе, чем в монокультуре. Культивирование в смеси может не только угнетать, но
и индуцировать ферментативную активность.
2. Роль микробиологической трансформации
2.1 Роль микробиологической трансформации в процессах
деградации чужеродных соединений
В последнее время накапливается все больше данных о
том, что микробиологическая трансформация играет существенную роль в процессах
обезвреживания и полной деградации чужеродных веществ, загрязняющих среду в
результате деятельности человека. Попадая в почву или воду, эти соединения
видоизменяются или распадаются до конечных продуктов в основном в результате
физико-химических процессов, микробиологического разложения и поглощения
высшими растениями. Микробиологические процессы имеют важное значение, в
частности, в деградации пестицидов вносимых в почву в больших количествах.
Поэтому микробиологическая трансформация и деградация пестицидов с точки зрения
экологической проблемы имеет целенаправленное использование для очистки
окружающей среды.
Существуют четыре возможных пути превращения
пестицидов:
1) энзиматическое воздействие, которое
ведет к полной потере ингибиторных свойств, так называемая детоксикация, или
инактивация;
2) трансформация пестицидов в
токсические вещества - процесс, именуемый активацией;
3) трансформация, результатом которой
является превращение пестицида в соединение с другим спектром ингибирующего
действия;
4) трансформация с образованием
соединения-стимулятора.
Во всех случаях анализ продуктов превращения
пестицидов, безусловно, очень важен, так как промежуточные единения в свою
очередь влияют на микробную популяцию, урожай и т.д.
Современный этап исследований микробиологического
воздействия на пестициды характеризуется выраженным интересом к метаболическим
путям их деградации, закономерностям накопления промежуточных продуктов и их
свойствам. В связи с накоплением интермедиатов производится детальное
исследование кооперативного действия почвенной микрофлоры на чужеродные
соединения так называемого комменсализма.
Пристальное внимание уделяется кометаболизму как
феномену регуляции ферментативной активности микроорганизмов, позволяющему
мобилизовать потенциальные возможности микроорганизмов.
Кометаболизм играет существенную роль в деградации
микроорганизмами многих пестицидов, в том числе и тех, которые ранее были
внесены в список «устойчивых». Например, ДДТ и его аналоги, а также
полихлорароматика (2,3,6-ТБК и 2,4,5-Т) были описаны как устойчивые вещества,
поскольку не удавалось выделить микроорганизмы, использующие их как субстрат
для роста. В условиях кометаболизма появилась возможность осуществить частичную
деградацию этих соединений. Кометаболизм гербицидов, например галогепированных
производных бензола, чистыми культурами может привести к образованию
промежуточных продуктов - фенолов и катехолов, которые в свою очередь могут
метаболизироваться другими бактериальными формами. Если кометаболизм гербицидов
осуществляется смесью культур с внесением дополнительного субстрата как
источника углерода и энергии, то можно осуществить полную минерализацию
гербицида.
углеводородокисляющий микроорганизм гриб кометаболизм
2.2 Трансформация феноксиуксусных кислот
Хлорзамещенные феноксиуксусные кислоты введены в
качестве селективных гербицидов в конце Второй мировой войны. Они применяются
для борьбы с сорняками на хлебных посевах и газонах. Особенно широкое
применение нашли 2,4 -дихлорфеноксиуксусная кислота (2,4-Д),
2-метил-4-хлорфеноксиуксусная кислота (2М-4Х), 2,4,5-трихлорфеноксиуксусиая
кислота (2,4,5-Т).
Первые работы по микробному превращению
феноксиалкановых кислот касались в основном устойчивости этих соединений и
воздействию микроорганизмов. Было показано, что 2,4-Д разлагается быстро, а
2М-4Х и 2,4,5-Т - медленно. Автоклавирование ингибирует этот процесс, а тепло,
влага и органические вещества ускоряют разложение гербицидов.
Способность использовать феноксиалкановые кислоты в
качестве единственного источника углерода характерна для многих представителей
почвенной микрофлоры. Это в основном представители родов Achrornobacter, Arthrobacter, Flavobacterium, Pseudomonas, Corynebacteriurn. Концентрации феноксиуксусных
кислот, разлагаемые микроорганизмами, могут быть достаточно высокими от 300
мг/л до 2,0 г/л и выше.
В зависимости от таксономического положения
микроорганизмов пути метаболизма феноксиалкановых кислот различны. В настоящее
время известно два пути: через оксифеноксиуксусные кислоты и через фенолы. Эти
пути представлены на рисунке 3.
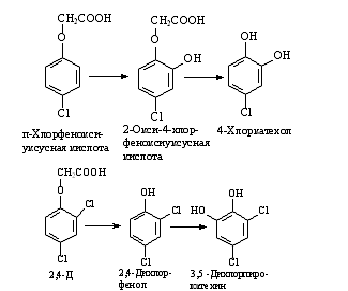
Рисунок 3 - Пути метаболизма: через
оксифеноксиуксусные кислоты и через фенолы
2.3 Трансформация феноксиалкилкарбоновых кислот
В метаболизме высших ω- и γ-кислот существенную роль играет ß-окисление. Расщепление
2,4-дихлорфеноксиалкилкарбоновых кислот бактериями рода Flavobacterium происходит двумя путями:
) ß - окисление боковой алифатической
цепи;
) расщепление эфирной связи.
При ß-окислении ω-дихлорфеноксиалкилкарбоновых кислот
с четным числом атомов в боковой цепи наблюдается ступенчатое отщепление
двууглеродных фрагментов и образуются простые феноксиалкановые кислоты. Этот
механизм отражён на рисунке 4.
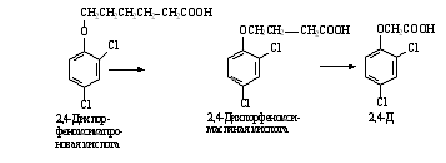
Рисунок 4 - Ступенчатое отщепление двууглеродных
фрагментов при ß-окислении ω-дихлорфеноксиалкилкарбоновых кислот
При ß-окислении алифатической боковой цепи
с нечетным числом углеродных атомов образуется 2,4-дихлорфеноксиформиат, спонтанно
разлагающийся в соответствующие фенолы. Реакции данного преобразования
изображены на рисунке 5.
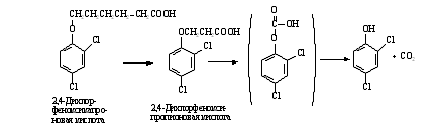
Рисунок 5 - 2,4-дихлорфеноксиформиат, спонтанно
разлагающийся в соответствующие фенолы
Гриб Aspergillus niger осуществляет бетта-окисление
боковой цепи и гидроксилирование гамма-феноксимасляной и
омега-феноксивалериановой кислот в ароматическом ядре. При этом образуются
соответственно 4-оксифеноксиуксусная и бетта-(4-оксифеноксипропионовая)
кислоты. Помимо бетта-окисления, видимо, в молекуле 2,4-дихлорфеноксимасляной
кислоты (2,4-ДМ) происходит разрыв эфирной связи (омега-связи), в результате
образуются фенолы и жирные кислоты. Данная реакция изображена на рисунке 6.
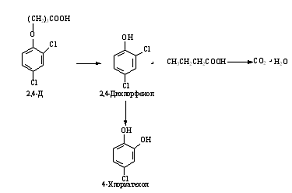
Рисунок 6 - Разрыв эфирной связи в молекуле
2,4-дихлорфеноксимасляной кислоты (2,4-ДМ)
Разрыв эфирной связи, в отличие от бетта-окисления,
немедленно инактивирует гербицид.
2.4 Трансформация галогенпроизводных циклических углеводородов
Галогенпроизводные циклических углеводородов остаются
в почве неизменными в течение многих лет после внесения. Хлордан сохраняется в
почве 12 лет после обработки, гептахлор - 9, альдрин - 4 года. Альдрин при этом
превращается в диэльдрин, который накапливается в почве в количестве 10% от
внесенной дозы.
Устойчивость хлорфенолов к микробному разложению в
трансформации зависит от положения и числа атомов хлора в фенольном кольце.
Широко применяемый гербицид пентахлорфенол (пента) считается одним из наиболее
персистентных соединений семейства хлорфенолов. Наиболее активным
трансформантом пентахлорфенола является Trichoderma virigatum. Данная культура
метилирует пестицид до пентахлорфенола, который менее токсичен.
Полихлорзамещенные бифенилы могут деградироваться и
трансформироваться культурами Achromobacter, причем при деградации
n'n'-дихлорбифенила образуется n-хлорбензойная кислота, а второе бензольное
кольцо расщепляется по мета-пути.
Разложение фунгицида хлоронеба
(1,4-дихлор-2,5-диметоксибегоола) и продукта его деградации - 2,5-дихлор-4-метоксифенола
осуществляется культурами Fusarium sp., Trichoderma viride и Mucor ramannanus
только в присутствии ростовых факторов.
Дихлордифенилтрихлорэтан относится к особо устойчивым
соединениям. Трансформация ДДТ чистыми культурами актиномицетов и бактерий
осуществляется успешно, но в почве деградация минимальна. Многим исследователям
удалось осуществить деградацию ДДТ до водорастворимых метаболитов с помощью
грибов, но внесение спор грибов в почву, загрязненную ДДТ, не приносило
желаемого результата. Большое влияние ни разложение ДДТ культурами и почве
оказывает присутствие аборигенной микрофлоры, метаболитов микроорганизмов,
остаточных количеств инсектицидов.
2.5 Трансформация карбаматов
В последнее время широкое применение нашли пестициды,
в основе которых лежат анилиновые основания. Возможность их дектосикации с
помощью микроорганизмов изучается весьма интенсивно. Первоначально ацетанилид,
пропанилид и другие производные гидролизуются до соответствующих анилиновой и
алькильной частей, затем анилиновые производные трансформируются в
соответствующие азобензолы. Возможна также детоксикация образующихся
хлоранилинов путем микробиологического ацетилирования, гидроксилирования или
окисления аминогруппы.
Хлорпрофам может быть гидролизован ферментными препаратами
Pseudomonas striata по механизму,изображённому на рисунке 7.
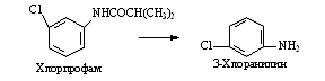
Рисунок 7 - Гидролиз хлорпрофама
На скорость ферментативного гидролиза фенилкарбаматов
большое влияние оказывают индукционный, стерический, резонансный эффект и
размеры молекулы. Скорость гидролиза убывает в ряду С2H5, n-С3H7,изо- С3H7,
С6H7CH2 ,когда эти группы находятся в эфирной части.
Широкое применение в трансформации карбаматов нашел
фермент - арилациламидаза, который был выделен из культуры Bacillus sphaericus
AT2123.
Фермент обладает субстратной специфичностью и катализирует
расщепление большого разнообразия субстратов фениламидного типа (ациланилидные
гербициды и фенилкарбаматы) до соответствующих анилинов. Наибольшая активность
проявлялась в отношении простых ациланилидов.
2.6 Трансформация замещенных мочевины
Условия, благоприятствующие росту микроорганизмов,
например, оптимальная температура и влажность, способствуют инактивации
гербицидов - производных мочевины. Представители родов Xanthomonas, Sarcina,
Bacillus, PeniciUium, Aspcrgillus могуг использовать монурон как единственный
источник углерода.
Микроорганизмы способны отщеплять метильные группы и
окислять их, а также дезаминировать и декарбоксидировать молекулу гербицида.
В настоящее время предложен следующий механизм
разложения хлороксурона, представленный на рисунке 8, состоит в
последовательном метилировании и дезаминировании-декарбоксилировании:
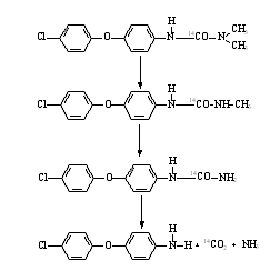
Рисунок 8 - Механизм разложения хлороксурона
2.7 Трансформация триазинов
Триазины - гербициды, обладающие широким спектром
биологической активности. Селективность триазинов зависит от заместителей в
триазиновом ядре. Замещенные хлортриазины, такие как симазин, атразин
используются в качестве источника азота грибами Fusarium oxysporum, Fusarium
avenaceum, Penicilliuin cyclopium, Penicillium lanosocoerubum, Cylindrocarpon
radicicola, Stachybotrys sp., но вышеуказанные организмы не способны усваивать
углерод этих соединений.
.8 Биодеградация поверхностно-активных углеводородов
Поверхностно-активные углеводороды (ПАУ) тем устойчивее
к биодеградации, чем больше конденсированных ароматических ядер в молекуле.
Полициклические ароматические углеводороды с 2-3 ароматическими кольцами:
нафталин, фенатрен, антрацен - менее токсичны и более подвержены воздействию
микроорганизмов.
В почвах ПАУ потенциально доступны для многих
организмов. Они окисляются отдельными видами бактерий родов Pseudomonas,
Mycobacterium, Bacillus, Flavobacterium, Nocardia и грибов Aspergillus,
Pemcillium
В процессе окисления ароматические группы ПАУ
подвергаются гидроксилированию с последующим расщеплением дигидроксилированного
кольца. Разрыв кольца катализируется диоксигеназами. Дальнейшее расщепление
осуществляется через раскрытие ароматического кольца. На рисунке 9 представлены
схемы разрыва дигидроксилированного кольца. [2]
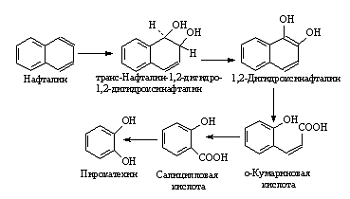
Рисунок 9 - Расщепление нафталина
3. Характеристика основных углеводородокисляющих
микроорганизмов
При разложении органических загрязнений, попадающих в
окружающую среду, ведущая роль принадлежит микроорганизмам.
Наиболее активными и широко распространенными
деструкторами нефтепродуктов оказались бактерии родов Pseudomonas, Rhodococcus,
Arthrobacter, Candida, Actinomyces, Bacillus, Nocardia и Acinetobacter. Отселектированные
микроорганизмы являются природными изолятами, нетоксичными и непатогенными.
Микробные культуры активно утилизируют нефть и нефтепродукты, в том числе,
трудноразлагаемые, тяжелые фракции нефти. Способность ряда микроорганизмов к
деструкции углеводородов нефти при низких температурах позволяет использовать
их в биоремедиации загрязненных территорий в условиях холодного климата.[3]
Для свежезагрязненных почв характерна высокая численность почвенных
микроорганизмов, представляющих собой бесцветные колонии бактерий родов
Pseudomonas и Arthrobacter. Пигментированные колонии рода Rhodococcus,
характеризующиеся, как правило, высокой степенью ферментативной активности -
единичны. В отличие от свежезагрязненной почвы на более поздних срезках после
загрязнения нефтью в почвах увеличивается численность групп олиготрофной
микрофлоры, олигонитрофилов и целлюлозоразрушающих микроорганизмов. Общая
численность остается по-прежнему высокой, Преобладающими видами среди бактерий
являются представители родов Rhodococcus и Pseudomonas, относительно высока
численность родов Arthrobacter, Flavobacterium, Agrobacterium. Отмечено
присутствие грибов родов Mucor, Penicillium и Trichoderma, которые
встречающихся также и в незагрязненной почве. [4]
3.1 Краткая характеристика микроорганизмов рода Acinetobacter
Acinetobacter является грам-отрицательных бактерий рода принадлежащих
Gammaproteobacteria. Виды рода Acinetobacter строго аэробные неферментирующие
грам-отрицательные бактерий. Микроорганизмы представляют собой вытянутые
палочки с закруглёнными концами. Рисунок 10 представляет собой фотографию
микроорганизма рода Acinetobacter.
Рисунок
10 - Микроорганизмы вида Acinetobacter baumanni
<#"516431.files/image029.gif">
Рисунок 11 - Микроорганизмы рода Candida
Единственной формой размножения грибов рода Candida
является почкование (в формировании дочерней клетки участвуют все слои
материнской клеточной стенки).
Вместе с тем, характерной особенностью грибов рода
Candida является их диморфность. При определенных условиях, в частности, при
развитии инфекции, эти грибы способны формировать гифы или псевдогифы,
повышающие способность гриба проникать внутрь тканей.[4]
3.3 Краткая характеристика микроорганизмов рода Pseudomonas
Хемоорганогетеротроф
<#"516431.files/image030.gif">
Рисунок 12 - Микроорганизмы рода Pseudomonas
На
твёрдых питательных средах диссоциирует на три формы- R-, S-. и M- форму.
Продуцирует характерные пигменты <#"516431.files/image031.gif">
Рисунок
13 - Микроорганизмы вида Arthrobacter crystallopoietes
Рисунок 14 - Микроорганизмы вида Arthrobacter crystallopoiete
По мере роста культуры палочки распадаются на мелкие
кокки диаметром 0,6-1,0 мкм, располагающиеся одиночно, парами и в скоплениях
неправильной формы. Являются облигатными аэробами с метаболизмом окислительного
типа, оптимальная температура для роста 25-300С. Колонии
Arthrobacter устойчивы к высыханию и голоду. [4]
.5 Краткая характеристика микроорганизмов рода Bacillus
Bacillus - обширный род
<#"516431.files/image033.gif">
Рисунок
15 - Микроорганизмы вида Bacillus stearothermophilus
Большинство бацилл - почвенные сапрофиты. Являются аэробами или факультативными анаэробами,
большинство представителей хемоорганогетеротрофы и растут на простых питательных средах. Крупные и
среднего размера прямые или слабоизогнутые палочки, способные к образованию
устойчивых к неблагоприятным воздействиям, таким как экстремальная температура,
высушивание, ионизирующее излучение
<#"516431.files/image034.gif">
Рисунок
16 - Микроорганизмы рода Actinomyces
Микроорганизм
рода Actinomyces окрашиваются по методу Грама
<#"516431.files/image035.gif">
Рисунок 17 - Микроорганизмы рода Nocardia
3.8 Краткая характеристика микроорганизмов рода Rhodococcus
является родом нокардиоформных актиномицетов, аэробны,
неспорообразующие, частично кислотоустойчивые, неподвижные грамположительные
бактерии тесно связананные с микобактериями и коринебактериями. Рисунок 18 представляет собой фотографию
микроорганизма рода Rhodococcus. [5]
Рисунок 18 - Микроорганизмы рода Rhodococcus
Способны обитать в широком диапазоне сред и условий,
включая почву и воду. Rhodococcus чувствительны к лизоциму. Возможно
образование различных форм от палочек до обильно разветвлённого мицелия.
Использование Rhodococcus свидетельствует о его
способности к метаболизму вредных экологических загрязнителей, таких как толуол,
нафталин и гербициды.способны использовать в качестве единственного источника
углерода натриевую соль бензойной кислоты, тестостерона, андостерон. Используют
в качестве источника азота аланин, глюкозиды, треонин, ацетамид и аспаргин.
Для биодеструкции нефтешламов в настоящее время
активно используют микроорганизмы рода Rhodococcus. Многие авторы утверждают (Головцев
и другие), что данные микроорганизмы наибольшую углеводородокисляющую
активность проявляют в консорциуме с микроорганизме рода Bacillus и Fusarium.[2]
4. Биодеструкция нефтешламов
.1 Деструкция нефтешламов ассоциациями микроорганизмов
Масштабы загрязнения окружающей среды углеводородами
нефти огромны. Существуют различные методы очистки почвы и воды. Однако,
наибольшую роль в этом процессе играют микроорганизмы. Существуют несколько
способов рекультивации загрязненных земель:
стимуляция аборигенной микрофлоры;
внесение селекционных культур углеводородокисляющих
микроорганизмов;
внесение сорбента в почву, загрязненную углеводородами
нефти;
внесение селекционных культур и факторов роста
аборигенной микрофлоры.
Практически все вышеуказанные способы направлены на
использовании различных углеводородокисляющих микроорганизмов. Как показывает
практика, для биоремедиации почвы лучше использовать биопрепараты, содержащие
ассоциации микроорганизмов. Ассоциации микроорганизмов обеспечивают наибольшую
степень утилизации загрязнителей. При разработке биопрепаратов возникают
проблемы конкурентных отношений между микроорганизмами ассоциации и аллохтонной
микрофлоры.
4.1.1 Раздельное и совместное культивирование
микроорганизмов-деструкторов нефти родов Pseudomonas и Rhodococcus
А.Е. Филонов, К.В. Петриков, Т.В. Якшина и их коллеги
из Тульского государственного университета осуществили подбор оптимальных параметров
как раздельного культивирования нефтеокисляющих микроорганизмов, так и
выращивания в смешанной культуре с сохранением наибольшей жизнеспособности
клеток и активности ключевых ферментов деградации углеводородов нефти.
В работе были использованы два штамма активных
психротроф-ных микроорганизмов - деструкторов углеводородов нефти из коллекции
лаборатории биологии плазмид ИБФМ: Pseudomonas sp.
142NF(pNF142), содержащий плазмиду биодеградации
полиароматических углеводородов pNF142,
и Rhodococcus sp. S67.
Для получения чистой рабочей культуры отдельные
колонии пересевали три раза подряд на чашки Петри с агаризованной средой
в присутствии нафталина (для бактерий рода Pseudomonas) или дизельного топлива (ДТ) (для
бактерий рода Rhodococcus). Условия создавались аэробные.
В качестве добавок использовали салицилат натрия или
ДТ. Добавки вносили в экспоненциальной фазе роста.
Условия ферментации штамма Rhodococcus sp. S67 были сходными
с условиями культивирования псевдомонад. Состав среды отличался по содержанию
кислотного гидролизата казеина (5 г/л) и дрожжевого автолизата (100 мл/л), а
также присутствием пептона (5 г/л).
Выращивание смешанной культуры Pseudomonas и Rhodococcus осуществляли в условиях
культивирования, аналогичным условиям культивирования родококков. Посев
микроорганизмов p. Pseudomonas производили через 12 ч после начала
культивирования родококков, одновременно добавляли глюкозу. В конце
экспоненциальной фазы роста в среду вносили дизельное топливо. Длительность
совместной ферментации составляла 26 ч.
Культивирование штаммов-нефтедеструкторов Pseudomonas sp. 142NF(pNF142) и Rhodococcus sp. S67 проводили в
периодическом режиме в ферментерах. В состав использованной питательной среды
КГКДА входили: кислотный гидролизат казеина и дрожжевой автолизат.
Ферментацию штамма Pseudomonas sp. 142NF(pNF142) проводили с добавлением
салицилата натрия, поскольку известно, что салицилат является индуктором
ферментов деградации полиароматических углеводородов, входящих в состав тяжелых
фракций нефти, а также ряда ферментов, обладающих достаточно широкой
субстратной специфичностью, а, следовательно, способствует наиболее полной
деградации компонентов нефти. На рисунке 22 отображено влияние салицилата, ДТ и
глюкозы на кинетику роста штамма Pseudomonas sp. 142NF (pNF142).
В другом эксперименте для индукции ферментных систем
деградации углеводородов в процессе культивирования было использовано ДТ в
экспоненциальной фазе роста, после чего наблюдали кратковременный рост
культуры, а затем его снижение (что можно наблюдать на рисунке 19). Для
поддержания роста, в среду добавляли глюкозу. Ферментацию прекращали в фазе
замедления роста культуры. [10]
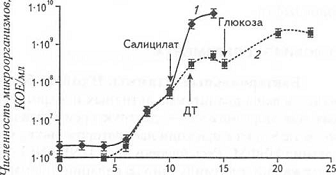
Время роста, ч
Рисунок 19 - Влияние салицилата, ДТ и глюкозы на
кинетику роста штамма Pseudomonas sp. 142NF (pNF142) (данные двух ферментации): 1 - ферментация с
салицилатом; 2 - ферментация с ДТ
4.1.2 Культивирование Pseudomonas sp. 142NF(pNF142)и
Rhodococcus sp. S67 в виде монокультур или в смешанной культуре
Штаммы-деструкторы родов Pseudomonas и Rhodococcus значительно различаются по удельной
скорости роста, поэтому для получения близких значений количества клеток разных
штаммов в смешанной культуре необходимо вносить посевной материал более быстро
растущей культуры псевдомонад после инокуляции родококков. В результате подбора
времени инокуляции посевной культуры псевдомонад при проведении совместной
ферментации указанных микроорганизмов посев штамма Pseudomonas sp. 142NF
производили через 12 ч после начала культивирования штамма Rhodococcus sp. S67.
На рисунке 24 представлены кривые роста
микроорганизмов в смешанной культуре. Как видно из графиков на рисунке 20,
время посева псевдомонад совпало с началом экспоненциальной фазы роста
родококков. Следует отметить синхронность достижения стационарной фазы роста
обеими культурами; при этом значения численности микроорганизмов обоих штаммов
близки,данные об этом приведены в таблице 2.
Таблица 2 - Ферментация штамма Pseudomonas sp. 142NF(pNF142)
|
Ферментация
|
Максимальная численность
микроорганизмов, КОЕ/мл
|
Время культивирования, ч
|
Максимальная удельная
скорость роста д, ч (час роста)
|
Выход сырой биомассы, г КС
|
Численность микроорганизмов
в КС, КОЕ/мл
|
|
|
|
|
|
|
|
Pseudomonas (с
салицилатом)
|
6,7-109
|
14
|
1,99 (10-й)
|
160
|
4,2-10'°
|
|
Pseudomonas
(сДТ)
|
2,1-Ю9
|
23
|
1,76 (10-й)
|
136
|
1, 8-10'°
|
|
Rhodococcus
|
4,9-1010
|
24
|
0,65 (18-й)
|
200
|
1,3-1012
|
|
Совместная
|
Р.-4,3-108 Rh-
6,3-108
|
26
|
Р.-0,54 (7-й) /8й.-0,44
(15-й)
|
208
|
Р.-3,4-10'° Rh- 3,8-10'°
|
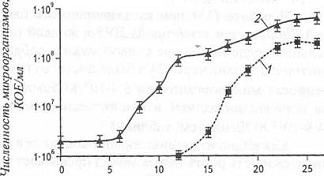
Рисунок 20 - Кинетика роста штаммов Pseudomonas sp. 142NF (pNF142) (1) и Rhodococcus sp. S67 (2) в
смешанной культуре
Как видно из данных таблицы 2, по основным показателям
совместная ферментация лишь незначительно уступает раздельному культивированию
псевдомонад и родококков, а ее преимущества очевидны: число большинства
необходимых технологических операций сокращается почти в два раза. Кроме того,
соотношение, равное 1:1, штаммов Pseudomonas sp. 142NF и Rhodococcus sp. S67 в КС можно
априори считать эффективным, а их численность (3,4-1010 КОЕ/мл и
3,8-1010 КОЕ/мл, соответственно) достаточно высока для использования
в составе жидкой формы биопрепарата.
Таким образом, в данной работе были подобраны условия
культивирования, позволяющие получить биомассу
микроорганизмов-нефтедеструкторов родов Pseudomonas и Rhodococcus с высокой численностью живых
микроорганизмов, а также с сохранением активности ферментных систем
биодеградации углеводородов нефти. Режим совместного культивирования был
подобран таким образом, чтобы получать биомассу с равным соотношением
численности штаммов Pseudomonas sp. 142NF(pNF142) и Rhodococcus sp. S67 при наименьшей
длительности процесса ферментации. [11]
4.1.3 Обезвреживание нефтешламов
ассоциацией микроорганизмов родов Bacillus, Rhodococcus и Fusarium
Головцов М.В. из Уфимского государственного нефтяного
технического университета в своих исследованиях установил, что наибольшую активность при биодеструкции
нефти и нефтепродуктов проявляет консорциум следующих непатогенных
микроорганизмов: Rhodococcus erythropolis AC-1339 Д, Bacillus subtilis ВКМ 1742
Д и Fusarium species №56, взятых в соотношении 1:1:1. Данный консорциум
способен использовать в качестве источника углерода нефть и нефтепродукты в
количестве 1-5 % масс. Деструкцию гексадекана, дизельного топлива, мазута
микроорганизмы способны осуществлять в полной минеральной среде. Подобранный
консорциум способен разлагать не только легкие фракции нефти, такие как
гексадекан, но и более тяжелые фракции нефти, например мазут, т.е.
деструктировать широкий спектр углеводородов. Причем консорциум не теряет свою
окислительную активность при содержании гексадекана, дизельного топлива, нефти
и мазута при 5% масс. Максимальная биодеструкция наблюдается при содержании
исследуемых нефтепродуктов в количестве 1% масс. и составляет через 48 суток
для гексадекана- 90%, дизельного топлива- 85%, нефти- 82%, мазута- 52%, эти
данные иллюстрирует рисунок 21.
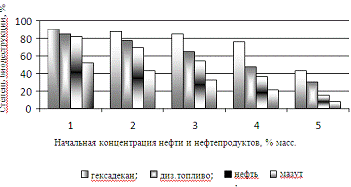
Рисунок 21 - Степень биодеструкции нефти и
нефтепродуктов ассоциацией микроорганизмов в полной минеральной среде
Причем степень биодеструкции нефти и нефтепродуктов
консорциумом на 10-15% выше по сравнению с монокультурой Rhodococcus erythropolis AC-1339 Д.
Вышеуказанный консорциум способен утилизировать
углеводороды нефти и в жидкой полной минеральной среде. В зависимости от
количества инокулята и условий культивирования степень биодеструкции будет
отличаться. Данные отражены в таблице 3.
Таблица 3 - Степень биодеструкции нефти
|
№ опыта
|
Нефтешлам
|
Количество инокулята
|
Условия
|
Степень биодеструкции
|
|
11
|
1% масс.
|
3% от общего объёма массы
|
Культивирование - в течение
четырех суток на термостатированной качалке при температуре 25-30 0С
и 90 об/мин. Экстракция органическим растворителем.
|
72%
|
|
22
|
1% масс.
|
После экстракции ксилолом
нефтешлама вносили 3% от общего объёма массы.
|
Экстракция нефтешлама
ксилолом. Биодеструкция в течение четырех суток на термостатированной качалке
при температуре 25-30 0С и 90 об/мин
|
91%
|
|
33
|
1% масс.
|
без внесения
микроорганизмов после экстракции ксилолом
|
Экстракция ксилолом
|
57%
|
|
44
|
1% масс.
|
без внесения
микроорганизмов
|
-
|
-
|
Очистка нефтешлама при применении консорциума на 15%
больше, чем при экстракции ксилолом, и составляет 72%. Наибольшая степень
очистки, более 91%, наблюдается после предварительной экстракции нефтепродуктов
из нефтешлама ксилолом и использовании подобранного консорциума. В процессе
культивирования консорциума наблюдается прирост гетеротрофных микроорганизмов.
Такая тенденция отражена на рисунке 22.

Рисунок 20 - Рост гетеротрофных микроорганизмов в
полной минеральной среде
Биоочистку нефтешлама можно осуществлять путем
послойного расположения. Для этого между слоями можно закладывать песок,
чернозем и перфорированные трубы для аэрации. С целью уменьшения испарения
нефтепродуктов дно и поверхность установки герметизируют покрытием.
Для увеличения эффективности биодеструкции
углеводородов нефти в нефтешлам добавляют опилки, а в качестве биостимулятора -
спиртовую барду, фосфогипс.
Доочистка нефтешлама подобранным консорциумом с
внесением биодобавок (спиртовой барды, фосфогипса) и опилок значительно
интенсифицирует процесс очистки нефтешлама. Так, уже на 180-240 сутки степень
биодеструкции нефти и нефтепродуктов с консорциумом на 10-15% выше, чем с
монокультурой Rhodococcus erythropolis AC-1339 Д. Зависимость содержания нефти в почве и времени
показана на рисунке 23. Фосфогипс 1-5 % масс. и спиртовая барда 1-5 % масс.
являются активными стимуляторами роста нефтеокисляющих микроорганизмов.[1]
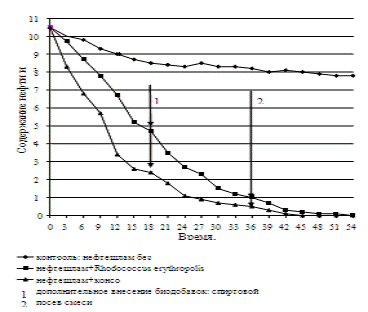
Рисунок 23 - Динамика содержания нефти и
нефтепродуктов в нефтешламе на протяжении всего процесса биоочистки
Доочистка с применением подобранного консорциума,
отходов спиртового производства и фосфогипса позволяет снизить содержание нефти
и нефтепродуктов в нефтешламе до 0,2 мг/г почвы за 450 сут. В случае с
монокультурой содержание нефти и нефтепродуктов в нефтешламе составило 0,2 мг/г
почвы только на 540 сут.
Таким образом, данный способ доочистки нефтешлама
биологическим методом позволяет снизить содержание нефти и нефтепродуктов до
нормативно допустимого и может быть рекомендован к промышленному применению.[1]
4.2 Биоремедиация нефтешламов компостированием
В Казанском государственном университете была оценена
эффективность обезвреживания и переработки концентрированного нефтехимического
шлама путем компостирования в опытно-полевых условиях с помощью комплексного
токсико-биологического и химического мониторинга. Компостирование нефтешлама
осуществляют на огражденной барьером бетонной площадке с фильтрованием и сбором
избыточной жидкости. В качестве разрыхляющего агента использовали отработанный
сорбент биофильтра слоем 0,3 м на подготовленной площадке. Извлеченный из
шламонакопителя нефтешлам распределяли поверх разрыхлителя с последующим
отведением избыточной жидкости. Компостируемые смеси формировали методом
послойной укладки. Соотношение шлама и разрыхлителя составляло около 1:2 (по
объему). Аэрацию компостируемых смесей обеспечивали с помощью полиэтиленовых
перфорированных труб.
Процесс биоремедиации нефтехимического шлама в
опытно-полевых условиях можно разделить на две фазы: активную,
характеризующуюся высокой скоростью деструкции загрязнений (0-4 мес), и более
медленную, отличающуюся низкой скоростью деградации остаточных в основном
труднодоступных компонентов нефтяного загрязнения (5-18 мес).
Снижение содержания нефтяных углеводородов при
компостировании нефтешлама в комбинации с другими промышленными отходами
(какие) представлено в таблице 3. Наибольшее снижение загрязнения происходит
при компостировании с добавлением ОПЛ (таблица 3, вариант В).
Таблица 3 - Химический состав нефтешлама в процессе
компостирования
|
Добавки Показатели
|
A (NPK)
|
Б (NPK+дизельное топливо)
|
В (NPK+ твердый отход
производства лапрола)
|
|
Длительность компостирования,
месс
|
0
|
3
|
18
|
0
|
3
|
18
|
0
|
3
|
18
|
|
Углеводороды нефти, г/кг
|
54,7
|
34,0
|
22,3
|
61,2
|
36,5
|
24,5
|
56,7
|
27,0
|
12,3
|
|
Сумма восьми испытанных
ПАУ, мг/кг
|
454,4
|
77,5
|
28,6
|
462,1
|
82,1
|
35,6
|
449,9
|
76,1
|
25,5
|
|
Сумма гуминовых и фульвовых
кислот, г/кг
|
16,7
|
19,8
|
30,6
|
18,7
|
19,4
|
32,8
|
16,2
|
18,7
|
34,5
|
|
рН
|
7,2
|
7,5
|
7,0
|
7,2
|
7,2
|
6,8
|
7,1
|
7,0
|
6,7
|
При компостировании нефтепродуктов численность
спорообразующих бактерий в начальный период, соответствующий активной фазе
ремедиации, снижалась на порядок.(рисунок 24, б. В соответствии с характером
используемого метода этот факт может отражать как снижение содержания
собственно спор, так и переход данной части микробиоценоза в вегетативную форму
со сниженной токсико-резистентностью. [7]
В конце теплого сезона количество бактерий в состоянии
спор обычно восстанавливается до начального уровня и в дальнейшем не
претерпевает резких изменений (рисунок 24, б), что свидетельствует об
устойчивости спор, в том числе в условиях неблагоприятного температурного
режима.
Число актиномицетов в процессе компостирования
нефтешлама увеличивается на первом этапе. В нефтешламе численность микромицетов
изменяется в широких пределах.
Такая динамика может отражать как избирательную
токсичность углеводородов и/или их метаболитов, так и конкурентные или
антагонистические отношения с другими представителями биоценоза.
Деградация загрязнений является результатом активной
жизнедеятельности микробного сообщества, обитающего в нефтешламе, о чем
свидетельствует, в частности, повышение числа деструкторов. При создании относительно
благоприятных условий собственная микрофлора нефтешламом загрязненных объектов
способна к разложению умеренной дозы контаминирующих агентов (5-10 %
углеводородов нефти) в результате увеличения численности и повышения активности
эндогенного микробного сообщества. Во втором ремедиационном периоде наблюдается
уменьшение доли ПАУ-деструкторов, что свидетельствует об исчерпании доступных
ростовых субстратов соответствующей химической структуры и о снижении
биодоступности остаточного загрязнения.
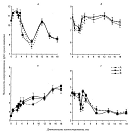
Рисунок 24 - Динамика роста различных физиологических
групп микроорганизмов в процессе компостирования: а - аэробные гетеротрофы; б -
спорообразующие бактерии; е - актиномицеты; г - микромицеты; А, Б, В - варианты
пилотно-полевого компостирования
Снижение биоразлагаемости может являться также
результатом связывания продуктов метаболизма нефтяного загрязнения с
компонентами гумуса и гумусоподобными веществами, количество которых
существенно увеличивалось при компостировании нефтешлама.[8]
Изучение численности микробных популяций в процессе
компостирования нефтешлама позволяет выявить следующие закономерности. В
течение первого трехмесячного этапа в первую очередь возрастает численность
аэробных гетеротрофных бактерий, к которым принадлежат и специфические
деструкторы нефтяного загрязнения, что характерно и для нефтешламо-загрязненных
почв, не подвергающихся очистительным процедурам. Для весенне-летнего сезона
второго ремедиационного периода наиболее показательно увеличение числа актиномицетов,
что объясняется их экологической стратегией, а именно, ростом количества этих
спорообразующих прокариот на поздних стадиях деструкции труднодоступных
субстратов.
При компостировании происходит снижение нефтяного
загрязнения до 90%. Полученный грунт не токсичен для растений и инфузорий. [7]
4.3 Биоремедиации почв и водной среды
Еева, Е.К. Емельянова, ОН. Загребельный, СЕ. Олькин,
И.К. Резникова, В.Е. Репин в венном научном центре вирусологии и
биотехнологии "Вектор" выделяли психрофильные и галотолерантные
микроорганизмы-нефтедеструкторов, способных эффективно деградировать нефть и
нефтепродукты в климатических условиях северных регионов с перспективой их
использования в целях биоремедиации.
Исследователями был проведён скрининг штаммов по признаку
нефтепоглощающей активности. В ходе исследования природных
субстратов были выделены мезофильные и психрофильные микроорганизмы и была
доказана их нефтеокисляющая способность.
Полученные группой учёных штаммы-нефтедеструкторы
идентифицированы как представители родов Arthrobacter, Bacillus, Pseudomonas, Rhodo:cus, Mycobacterium, Actinomyces, Nocardia и выделены также утилизирующие нефть
штаммы дрожжей (в том числе Yarrowia lipolylicd) и
плесневых грибов. При различных условиях микроорганизмы-деструкторы утилизировали
нефть с разной эффективностью. Отличительной чертой -значительной части штаммов
коллекции является способность к росту и окислению нефтепродуктов при
пониженных температурах.
Для ряда штаммов (Bacillus sp. 282, Arthrobacter sp. 283, штаммов дрожжей
NF 4-2 и NF 5-1) степень биодеградации нефти была выявлена весовым
методом. Учёные показали, что за 7 суток культивирования исследованные штаммы
утилизировали от 69 до 84 % от исходного содержания нефти. Групповой состав
компонентов нефти позволил им выявить соотношение углеводородов к смолам и
асфальтенам после биодеградации. Наибольшая деструкция смол и асфальтенов,
относящихся к наиболее трудно утилизируемым микроорганизмами фракциям нефти,
обнаружена в образцах со штаммами дрожжей NF 4-2 и NF 5-1.
Исследователями было выяснено, что штаммы
микроорганизмов-деструкторов Y. lipolytica NF5-1 я Pseudomonas sp. KL-1, входящие в состав ассоциации
(исходное соотношение 1:1), способны расти и утилизировать нефтепродукты в
широком диапазоне температур (4-35°), рН среды (4-8,5) и при повышенных
концентрациях соли (NaCl до 7 %).
При повышенных концентрациях соли, ассоциация штаммов Pseudomonas sp. KL-1 и Y. lipolytica NF5-1 достаточно активно окисляла нефть При 5% NaCl степень утилизации достигала 78 %, а
при 7% NaCl - 73 % за 6 сут. Эта же ассоциация
достаточно эффективно утилизировала. [9]
4.3.1 Использование психротолерантных
штаммов-нефтедеструкторов для биоремедиации почв и водной среды
Исследования показали, что при совместном
использовании штаммы-нефтедеструкторы Pseudomonas sp. KL-1 и Y. lipolytic; NF5-1 обладают высокой биоэмульгирующей
и нефтеокисляющей активностью, а также устойчивостью к неблагоприятным факторам
окружающей среды (способны утилизировать нефть в условиях значительных
колебаний температуры и рН среды, а также при ее засоленности).,а также
выявлена высокая степень утилизации нефти разного фракционного состава
выделенными штаммами-деструкторами. Эффективными углеводород-утилизирующими
культурами являются Pseudomonas sp. KL-1, Y. lipolytica NF5-1, Candida sp. Nb 2, Arthrobacter sp. Ja 285p, и Arthrobacter sp. Ja 269p., Они перспективны для
биотехнологических разработок. Штаммы являются также психротолерантными и
солеустойчивыми (до 5-10% NaCl).
Это предполагает возможность их использования в засоленных природных субстратах
при пониженных температурах.[17]
Было показано, что ассоциация штаммов Pseudomonas sp. KL-1 и Y. lipolytica NF5-1 является эффективной в широком интервале температур (в
том числе пониженных); составляющие ее штаммы не проявляют антагонизм по
отношению друг к другу и к представителям эндогенной микрофлоры почв, что
позволяет рекомендовать данную ассоциацию для дальнейшей разработки комплексных
препаратов биоремедиации в условиях северных регионов. [18]
4.3.2 Биоремедиация почв в условиях северных регионов России
Н.Н. Волченко и Э.В. Карасёва в Кубанском
государственном университете провели скрининг штаммов - продуцентов биоПАВ
среди нефтеокисляющих бактерий. Объектом исследования являлись изоляты
углеводородокисляющих бактерий, полученных из коллекции культур.
Сущность метода заключается в колориметрической оценке
количества клеток, находящихся между гидрофильной и гидрофобной фазами.
Для определения эффективности смеси используется
индекс эмульгирования (ИЭ). ИЭ представляет собой показатель, характеризующий
эмульгирующую активность микробной культуры. Принцип определения заключается в
оценке объема эмульсии, образовавшейся в результате встряхивания образца
культуры-эмульгатора с гидрофобной жидкостью. ИЭ вычисляют по формуле
ИЭ = (УЭ/УП) • 100%,
где V3 - объем эмульсии,
Vn - полный объем жидкости, включающий
в себя объем водный фазы (культура или супернатант) + объем углеводородной фазы
(в нашем случае - дизтопливо) + объем образовавшейся эмульсии.
Первичному скринингу на наличие поверхностно-активных
свойств подверглись 39 изолята углеводородокисляющих бактерий, большая часть
которых принадлежала к группе нокардиоморфных актиномицетов. Клетки некоторых
штаммов, выращенные на питательном агаре, обладали поверхностно-активными
свойствами - эмульгировали дизельное топливо, но не снижали уровень
поверхностного натяжения среды. Исследуемые изоляты были проверены на
способность к деградации нормального гексадекана в жидкой минимальной среде. В
результате были отобраны 10 культур, продемонстрировавшие разную интенсивность
роста.
Наиболее активными являлись культуры F2, В2, J8, в то время как культуры S6, Z5 и HI не проявили активного роста на среде
МС-С16. Кроме того, ПН последних культур слабо изменилось по сравнению с ПН при
росте на исходной неинокулированной среде. Гидрофобность клеток бактерий также
значительно различалась у разных изолятов: максимальной гидрофобностью (87-96
%) обладали бактерии штаммов J8, F2, В2, а минимальной (4-13 %) -
штаммы S6 и Z5.
Важным биотехнологическим свойством
культур-продуцентов является локализация синтезируемых клетками биоПАВ вне
клетки, в цитоплазме или оболочке. Сравнение величин ПН и ИЭ жидких культур и
их супернатантов свидетельствует о том, что у большинства изолятов
поверхностно-активные свойства связаны с биомассой бактерий, а не с
супернатантом КЖ. Процесс биоремедиации лучше проводить при инокуляции
нефтешлама коллекционными культурами - продуцентами биоПАВ и аборигенными
углеводородокис-ляющими бактериями, активированными in vitro. Этот метод является самым эффективным и диаграммы
рисунка 26 свидетельствуют об этом.[14]
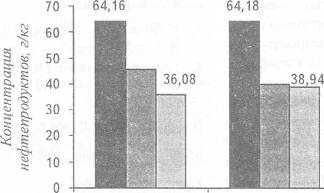
Рисунок 26 - Концентрация нефтепродуктов в нефтешламе
при различных вариантах обработки
При внесении аборигенных штаммов процент деградации
нефти аборигенными штаммами был несколько выше. В таблице 5 представлены данные
деградации нефти гетеротрофными и нефтеокисляющими микроорганизмыми при
добавлении различных агентов. [15]
Таблица 5 - Микрофлора нефтезагрязненного чернозема и
уровень деградации нефти в модельном эксперименте при обработке различными
агентами (время обработки - 30 суток)
|
№
|
Вносимые агенты
|
Гетеротрофные бактерии,
КОЕ/г
|
Нефтеокисляющие бактерии,
КОЕ/г
|
Деградация нефти, %
|
|
1 2
|
Коммерческие ПАВ
|
Гидробрейк БОК-3
|
7,4*107 1,8*108
|
8,85*107 2,3*108
|
57 56
|
|
3
|
Минеральный стимулятор
|
NH4S2O8
|
5,0*107
|
4,66*107
|
55
|
|
4 5 6
|
Коллекционные культуры -
продуценты биоПав
|
Rhodococcus sp.
F2 Rh. erythropolis Rhodococcus sp.J8
|
2,6*108 3,0*108
1.8*108
|
1,0*108 2,43*108
1.21*108
|
61 61 63
|
|
7
|
Контроль
|
Вода
|
1,1*108
|
5,06*108
|
58
|
При сравнении результативности бактериальных культур
были получены данные, проиллюстрированные в таблице 6.
Таблица 6. Концентрация микрофлоры в процессе
биоремедиации нефтешлама
|
Физиологическая группа
бактерий
|
Вносимые бактериальные
культуры
|
На 15-е сутки инкубации,
КОЕ/г
|
На 30-е сутки инкубации,
КОЕ/г
|
|
Коллекционные
|
9,5 • 107
|
1,3 • 10s
|
|
Гетеротрофные
|
|
|
|
|
Аборигенные
|
5,2 • 107
|
1,0- 107
|
|
Углеводородокисляющие
|
Коллекционные Аборигенные
|
3,9 • 107 7,4 • 10s
|
3,9 • 106 4,9 •
105
|
Таким образом, результатом ремедиации
нефтезагрязненной почвы с использованием ПАВ-продуцирующих бактерий является
уменьшение концентрации нефтепродуктов, увеличение содержания микрофлоры,
снижение токсичности по отношению к высшим растениям. При этом указанные
процессы осуществлялись не менее, а иногда и более активно при использовании
коллекционной микрофлоры по сравнению с аборигенной. [16]
4.4 Биодеструкция углеводородов нефти методом непрерывного
культивирования
В Институте биохимии и физиологии микроорганизмов им.
Т.К. Скрябина РАН А.Н. Шкидченко и Е.С. Иванова изучили возможность
восстановления нефтедеструктивной активности микроорганизмов в процессе
непрерывного культивирования.
В качестве объектов исследования использовали психрофильные штаммы
Pseudomonas sp. 22 ,Rhodococcus erythropolis 21, Microbacterium tefaciens 6 и Pseudomonas sp. 9.
В качестве источника углерода использовали дизельное
топливо. Культивирование осуществляли в батареи реакторов непрерывного
действия. Впервом реакторе осуществяли получение эмульсии и деструкцию легких
фракций углеводородов нефти. Во второй реактор подавали нефть в виде
20%-ной водной эмульсии. Третий реактор служил для дополнительного окисления
трудно-разлагаемых фракций углеводородов нефти.
Выделенные из нефтезагрязненных регионов психротрофные
штаммы обладали достаточно высокой исходной нефтедеструктивной активностью при
культивировании в жидкой питательной среде с нефтью в качестве единственного
источника углерода . Влияние длительного хранения микроорганизмов на их
нефтедеструктивную активность отображено на рисунке 27.
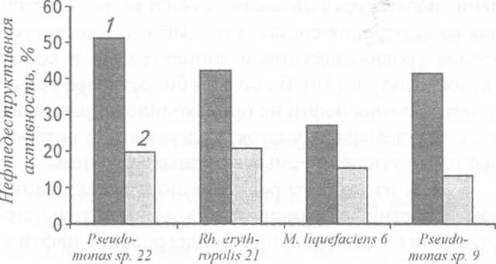
Рисунок 27 - Влияние длительного хранения
микроорганизмов на их нефтедеструктивную активность: / - исходная активность; 2
- активность после 8 лет хранения
Десятидневная инкубация культур при 4-6°
сопровождалась биодеструкцией до 50% внесенной нефти. Однако после 8 лет
хранения культур на агаризованных средах с периодическими пересевами на среды с
нефтью активность штаммов существенно изменилась. Так, для Pseudomonas sp. 9 она снизилась на 67,8%, для Pseudomonas sp. 22 - на 61%, а для Rh. erythropolis 21 -
на 50% от исходной величины.
Для проточного культивирования исследуемые штаммы
нефтедеструкторов выращивали раздельно и смешивали перед внесением в
биореактор. В таблице 7 приведены данные об исходном соотношении
интродуцированных в инокуляте штаммов-нефтедеструкторов.
В результате длительного непрерывного культивирования
интродуцированных штаммов микроорганизмов не только возросла их нефтедеструктивная
активность, но также была селекционирована устойчивая ассоциация
микроорганизмов-нефтедеструкторов, конкурентоспособная в открытой системе.
Для проверки устойчивости полученной ассоциации почву,
содержавшую 5% нефти инкубировали при 4-6° в течение длительного времени. Через
90 сут инкубации содержание углеводородов нефти в почве снизилось на 29% от
исходной. Полученные в модельном эксперименте данные подтверждают устойчивость
созданной ассоциации микроорганизмов-нефтедеструкторов в открытых системах.
[12]
Таблица 7 - Содержание интродуцированных
штаммов-нефтедеструкторов при проточном культивировании
|
Штаммы
|
Соотношение
штаммов-нефтедеструкторов
|
|
в инокуляте
|
после периодического
культивирования в течение 48 ч
|
в результате проточного
культивирования, ч
|
|
|
|
300
|
800
|
|
Pseudomonas sp.
22
|
36
|
17
|
0,5
|
2
|
|
Rh. erythropolis
21
|
14
|
2
|
94
|
94
|
|
M. liquefaciens
6
|
32
|
29
|
0,5
|
3
|
|
Pseudomonas sp.9
|
18
|
24
|
1
|
0
|
|
Аборигенная микрофлора
|
-
|
28
|
4
|
1
|
4.5 Биоремедиация черноземной почвы,
загрязненной нефтью
В. Карасёва, И.Е. Гирич. А.А. Худокормов и их коллеги
в Кубанском государственном университете города Краснодар создали метод
эффективной биоремидиации чернозёмной почвы после реального нефтяного
загрязнения с использованием аборигенной микрофлоры, азотно-фосфатных удобрений
и препарата микроорганизмов.
За время проведения эксперимента из образцов
нефтезагрязненной почвы выдели культуры аборигенных микроорганизмов, cпособных снижать концентрацию нефти
более чем на 70%. В процессе идентификаи были обнаружены представители следующих
родов: Arthrobacter, Tsukamuriella, Rhodococc Gordonia, Bacillus и Pseudomonas. Динамика численности гетеротрофов в
нефтезагрязненной почве подчинялась закономерностям, выявленным в ходе
экспериментальной работы в лаборатории. Рост плотности популяции микробных
клеток в течение первых ста дней очистки сопровождался наиболее быстрой
деструкцией углеводородов.
За семь месяцев биоремедиационных работ содержание
углеводородов в нефтезагрязненном черноземе было снижено на 98,2%, и при
концентрации нефтепродуктов 0,48 г/кг земля была возвращена в
сельскохозяйственный оборот. [13]
Заключение
Способ утилизации нефтешламов микроорганизмами очень перспективен, т. к.
нефтяные загрязнения являются серьёзной экологической проблемой. Работа
является актуальной т.к. представляет собой системный анализ методов
использования углеводородокисляющих микроорганизмов.
В ходе проведения работы были сделаны следующие выводы:
. Существуют различные способы переработки и утилизации отходов
нефтеперерабатывающей промышленности с помощью механических, физико-химических,
химических и биологических методов. При выборе способа утилизации приоритет в
основном отдается способам, направленным на извлечение из нефтешламов
углеводородного сырья.
. Для биоремедиации земель используют следующие
микроорганизмы-деструкторы: Pseudomonas sp., Rhodococcus sp, Microbacterium sp, Bacillus sp., Arthrobacter sp., Y. lipolytica NF5-1, Fusarium species, Candida sp.
. На основе литературных данных изучены культуральные,
морфологические и биохимические свойствами углеводородокисляющих
микроорганизмов
. Анализ литературных данных показал, что для биоремедиации почвы
лучше всего использовать консорциум микроорганизмов. Ассоциация микроорганизмов
позволяют деструктировать не только легкие фракции нефти, но и тяжелые, такие
как дизельное топливо, мазут, нафталин.
. Для увеличения степени биодеструкции углеводородов нефти в почве
необходимо использовать не только биохимическую активность селекционных
культур, но и стимулировать углеводородокисляющую аборигенную микрофлору.
Проведенный анализ практических результатов свидетельствует о том, что
источники фосфора и азота влияют на скорость деструкции углеводородов нефти в
почве.
Список использованных источников
1. Головцов,
М.В. Переработка нефтешламов с последующей доочисткой до экологически
безопасного уровня: автореферат дис. [Электронный
ресурс]/М.В.Головцов.-Электрон.дан.-[Б.м.], 2008.-Режим доступа: http//www.disert.info/golovcov_3442167.html
. Прутенская,
Е.А. Основы биотехнологии / Прутенская Е.А., Ожимкова Е.В..- Тверь: ТГТУ.
-2009.- 115с.
. Абдрахманов,
Т.А. Роль нефтеокисляющих бактерий при очистке нефтезагрязнённых
лугово-аллювиальных почв. [Электронный ресурс]/ / Т.А. Абдрахманов,
З.А.Жаббаров, А.Х.Вахабов.- Электрон.дан.- [Б.м.], 2006.-Режим доступа: http//ej.kybagro.ru/2006/01/pdf/14.pdf
. Определитель
бактерий Берджи / Под ред. Дж.Хоулта, Н.Крига, П.Снита, ДЖ. Стейли. -М.: Мир.-
Т. 2. - 1994.- 368 с.
. Микроорганизмы
[Электронный ресурс] / - Электрон. дан. - Режим доступа к дан.: http://www. wikipedia.ru/
. Биоремедиация
черноземной почвы, загрязненной нефтью / В.Карасёва, Н. Гирич, И. Худокормов,
Н. Алешина, С. Карасёв// Биотехнология.- 2006.-№1.-С.27-34
. Волченко,Т.И.
Скрининг углеводородокисляющих бактерий - продуцентов поверхностно-активных веществ
биологической природы и их применение в опыте по ремедиации нефтезагрязненной
почвы и нефтешлама/ Н.Н. Волченко, Э.В. Карасёва // Биотехнология.-
2008.-№6.-С.
. Назаров,
А.В. Потенциал использования микробно-растительного взаимодействия для биоремедиации//
А.В. Назаров, С.А. Иларионов // Биотехнология, -2007.- № 3.-C.56-64
. Пырченкова
И.А, Гафаров А.Б., Пунтус И.Ф. и др. // Прикл. биохим. микробиол. - 2006. - Т.
42. -№ 3. - С. 298-305.
10. Evans,
C.G.T., Herbert, D., Tempest, D.B. //Methods in Microbiology. - 1970. - V. 2. -
P. 277-327.
. Carhart,
G., Hegeman, G. II Appl. Microbiol. - 1975. - V. 30.
-P. 1046.
. Методы
общей бактериологии /Под ред. Герхарда и др. Т.З. - М: Мир, 1984 - 264 с.21-26
. Голубев,А.В.
Потенциал использования микробно-растительного взаимодействия для биоремедиации
// А.В. Назаров, С.А. Иларионов // Биотехнология, -2005, -№ 2/-C.23-28
. Пат.
2145419 Российская федерация, МПК G 01К 11/24, 11/36. Bacillus sp. 282/ С.П.
Иванов .-№98769834/06, заявл. 13.03.2003, опубл.15.11.2005, Бюл.№23.- 3с.
. Шкидченко,
Л.Н. Влияние длительности хранения суспензии микроорганизмов-нефтедеструкторов
на их физиологическую активность// Л.Н. Шкидченко // Биотехнология, -2006, -№
2,-C.51-55
. Гафаров
А.Б. Деградация нефтешламов аборигенными и продуцированными микроорганизмами //
А.Б. Гафаров // Биотехнология, -2008, -№ 6, С. 80-85
. Коронелли
Т.В. Принципы и методы интенсификации биологического разрушения углеводородов в
окружающей среде (Обзоры /Прикладная биохимия и микробиология. 1996. Т. 32. №6.
С.579-585
. Ившина
И.Б. Ассимиляция-углеводородов бактериями рода Rhodococcus // Экология и
популяционная генетика микроорганизмов: труды УрО РАН. Ин-т Экологии и генетики
микроорганизмов. Свердловск. УНЦ АН СССР, 1987. С. 41-46.
. Влияние
нефтяного загрязнения на некотрые компоненты агросистемы / Хазиев Ф.Х., Тишкина
ЕИ., Киреева Н.А., Кузахметов Г.Г. // Агрохимия.- 1988.- № 2. С. 56-61.
. Оценка
эффективности некоторых приемов воздействия на разложение нефти в почве
/Усачева Г.М., Самосова С.М.,Мартынов А.А., Фильченков В.И., Петрова Л.М. //
Усп. газовой хромотографии. - Казань.- 1982. Вып. 6. С. 105-114.
. Волченко,
Н.Н. Скрининг углеводородокисляющих бактерий - продуцентов
поверхностно-активных/ Н.Н. Волченко. Э.В. Карасёва / /Биотехнология,- 2006,- №
2, С. 45-60
. Назаров
А.В. Потенциал использования микробно-растительного взаимодействия для
биоремедиации/ А.В. Назаров, С.А. Иларионов//Биотехнология,- 2005,- №5. С.75-84
. Есикова,Т.Е.
Деградация нефтешламов продуцированными микроорганизмами/ Т.Е.Есикова //
Биотехнология.- 2004.-№3.-С.4-13