Методы определения плотности растворов веществ и твердых тел
Республиканская
научно-исследовательская конференция школьников, посвященная памяти видного
татарского
ученого-просветителя
Ибрагима Хальфина
Секция:
математика, физика, информатика
Исследовательская
работа
«Методы
определения плотности растворов веществ и твердых тел»
Дардымов Анатолий
Викторович
МБОУ «Гимназия
№36», Авиастроительный район, г.Казань
класс
Научные
руководители:
Франова Евгения
Владимировна,
учитель химии
Абрамова Наталья
Юрьевна,
учитель физики
МБОУ «Гимназия №36»
Авиастроительного
района г.Казани
Казань
2013
Содержание
Введение
Теоретическая
часть
.
Описание веществ, выбранных для опытов:
а)
глюкоза
б)
хлорид натрия
в)
гипс
г)
мел
д)
мрамор
.
Методы определения плотности жидкостей
.
Методы определения плотности твердого тела
Экспериментальная
часть
.
Эксперимент по определению плотностей растворов глюкозы и хлорида натрия
.
Эксперимент по определению плотностей гипса, мела
Список
литературы
Введение
Наука начинается там, где начинают измерять.
Точная наука немыслима без меры.
Д. И. Менделеев
Тела, окружающие нас, состоят из различных
веществ: дерева, железа, резины и т. д. Вещества же обладают разнообразными
свойствами, которые характеризуются различными физическими величинами. Среди
них - плотность вещества.
И в промышленности, и в медицине и в сельском
хозяйстве есть необходимость знать плотность используемых веществ. Например,
массу и объем бетона по его плотности рассчитывают бетонщики при заливке
фундамента, колонн, стен, мостовых опор и т. д. Плотность вещества - это
физическая величина, характеризующая массу тела, отнесенную к его объему.
ρ=m/V
При этом предполагается, что тело является
сплошным, без пустот и примеси другого вещества. Данная величина для различных
веществ отражена в справочных таблицах. Но интересно знать, каким образом
заполняются такого рода таблицы, как определяют плотность неизвестных веществ.
Самые простые способы определения плотности веществ:
• для жидкостей с помощью ареометра;
• Для жидкостей и твердых тел путем измерения
объема и массы и
вычисления
по формуле.
Иногда по причине неправильной формы тел или их
больших размеров бывает трудно или даже невозможно определить их объем с
помощью линейки или мензурки. Тогда возникает вопрос, каким способом определить
их плотность, не прибегая к измерению объема, или нет возможности определить
массу вещества?
Цель работы: Решение экспериментальных задач по
определению плотности твердых веществ и растворов, с различной массовой долей
растворенного вещества.
Задачи:
Приготовить растворы веществ различной
концентрации.
Изучить различные методы определения плотности
вещества, описанные в литературе.
Измерить плотность веществ методами,
предложенными в литературе и оценить границы погрешностей каждого метода.
Установить зависимость плотности растворов от их
концентрации.
Оборудование: Весы электронные, химические
стаканы, измерительный цилиндр (мензурка), шпатель, пипетки, измерительная
линейка, экспериментальная установка, состоящая их сообщающихся сосудов,
соединенных через тройник резиновыми трубками.
Вещества: Глюкоза, поваренная соль, гипс, мел,
мрамор, дистиллированная вода
Гипотеза: Возможно ли в лабораторных условиях
достаточно точно измерить плотность растворов и твердых тел.
плотность вещество погрешность
концентрация
Теоретическая часть
. Описание веществ, выбранных для опытов
Обоснованием выбора веществ для проведения
эксперимента явился факт широкого использования их в медицине.
а) Глюкоза
Глюко́за (греч. γλυκόζη,
от
γλυκύς
сладкий)
(<#"705010.files/image001.gif">
Строение молекулы. Имеет
молекулярную кристаллическую решетку и ковалентный полярный тип связи в
молекуле.
Получение. В промышленности глюкозу
получают гидролизом крахмала. В природе глюкоза образуется растениями в
процессе фотосинтеза.
Химические свойства. Глюкоза может
восстанавливаться в шестиатомный спирт сорбит, который люди, больные сахарным
диабетом, используют в качестве сахарозаменителя. Глюкоза легко окисляется. Она
восстанавливает серебро из аммиачного раствора оксида серебра. Данную реакцию
человек использует для изготовления стеклянных елочных украшений и дорогих
зеркал. Конечными продуктами окисления глюкозы являются углекислый газ и вода.
Биологическая роль. Глюкоза -
основной продукт фотосинтеза. В организме человека и животных глюкоза является
основным и наиболее универсальным источником энергии для обеспечения
метаболических процессов. Глюкоза участвует в образовании гликогена, питании
тканей мозга, работающих мышц. В крови человека содержится около 0,1% глюкозы.
Применение. Глюкозу используют при
интоксикации (например при пищевом отравлении или деятельности инфекции), так
как она является универсальным антитоксическим средством. Также препараты на
основе глюкозы и сама глюкоза используется эндокринологами при определении
наличия и типа сахарного диабета у человека.
б) Хлорид натрия
Хлори́д на́трия -
химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным
компонентом которой он является. Хлорид натрия в значительном количестве
содержится в морской воде (77,8%), создавая её солёный вкус. Встречается в
природе в виде минерала галита (каменная соль). Интересно отметить, что
название это произошло от греческого слова hals - соль. Чистый хлорид натрия
имеет вид бесцветных кристаллов, но с различными примесями его цвет может
принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
История потребления ее человечеством уже насчитывает не менее десяти тысяч лет.
Еще Гомер называл поваренную соль “божественной”.
В повседневных заботах мы как-то не задумываемся над тем, что обыкновенная соль
- вещество необычайной важности. Соль используют более чем в 14 тысячах
производств.
Физические свойства. Температура
плавления 800,8 С, кипения 1465 С. Умеренно растворяется в воде, растворимость
мало зависит от температуры. Вступает в реакции обмена. В чистом виде хлорид
натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями
(преимущественно ионами Ca 2 +, Mg 2 + и SO4 -4), и такая соль на воздухе
сыреет. Смесь измельченного льда с мелким порошком хлорида натрия является
эффективным охладителем.
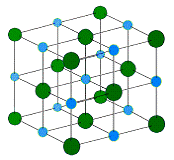
Строение молекулы. В ионной
кристаллической решетке между атомами преобладает ионная химическая связь, что
является следствием действия электростатического взаимодействия противоположных
по заряду ионов.
Получение и химические свойства.
Учитывая огромные природные запасы хлорида натрия, необходимости в его
промышленном или лабораторном синтезе нет. Однако, его можно получить
различными химическими методами как основной или побочный продукт. Например,
реакцией нейтрализации щелочи гидроксида натрия соляной кислотой:ОН + НCl →
NaCl + Н2О
Поскольку хлорид натрия в водном
растворе почти полностью диссоциирован на ионы: NaCl → Na+ + Cl−,
его химические свойства в водном растворе определяются соответствующими
химическими свойствами катионов натрия и хлорид-анионов. С раствором нитрата
серебра образует белый осадок хлорида серебра (качественная реакция на
хлорид-ион).
Биологическая роль складывается из
совместного действия ионов Na+ и Cl−. Оба относятся к макроэлементам
организма человека. Натрий является жизненно важным межклеточным и
внутриклеточным элементом; регулирует уровень артериального давления; является
одним из основных элементов водного обмена; участвует в передаче нервного
импульса.
Применение. Соль и организм
человека. Суточная потребность в поваренной соли взрослого человека составляет
10-15 г. Длительное солевое голодание может привести к гибели
организма.Поваренная соль служит источником образования в желудке соляной (хлороводородной)
кислоты. Его кислотность характеризуется значением рН=1,5-2,0.
Хлорид натрия нужен организму
человека или животного не только для образования соляной кислоты в желудочном
соке. Эта соль входит в тканевые жидкости и в состав крови, где ее концентрация
равна 0,5-0,6 %. Уменьшение содержания NaCl в плазме крови приводит к нарушению
обмена веществ в организме.
Водные растворы NaCl в медицине
используют в качестве кровезамещающих жидкостей после кровотечений и при
явлениях шока. Гипертонические растворы (10 % р-р) используют при отёке
головного мозга, для поднятия давления, при отравлении нитратом серебра.
Не получая NaCl извне, организм
извлекает его из крови и тканей.
Хлорид натрия способствует
задерживанию воды в организме, что, в свою очередь, приводит к повышению
артериального давления. Поэтому при гипертонической болезни, ожирении, отеках
врачи рекомендуют снижать суточное потребление поваренной соли. Избыток в
организме NaCl может вызвать острое отравление и привести к параличу нервной системы.
Организм человека быстро реагирует
на нарушение солевого баланса появлением мышечной слабости, быстрой
утомляемостью, потерей аппетита, возникновением неутолимой жажды.
Поваренная соль обладает хотя и
слабыми, но антисептическими свойствами. Развитие гнилостных бактерий
прекращается при ее содержании в 10-15 %. Это свойство широко используют в
пищевой отрасли промышленности и при сохранении пищевых продуктов в домашних
условиях.
В коммунальном хозяйстве хлорид
натрия, смешанный с другими солями, песком или глиной - так называемая
техническая соль - применяется как антифриз против гололеда.

в) Гипс
Гипс - минерал из класса сульфатов,
по составу CaSO4•2H2O, не растворимый в воде. Волокнистая разновидность гипса
называется селенитом, а зернистая - алебастром. Блеск стеклянный или
шелковистый, расщепляется на тонкие пластинки. Цвет белый, серый, иногда
красноватый, при наличии примесей имеет серую, желтоватую, розоватую, бурую
окраску. Плотность - 2,3 - 2,7 г/см³, твёрдость по шкале Мооса - 2.
При 140-150 °C частично теряет воду, переходя в серый или белый порошок
полуводного гипса или жженного гипса (CaSO4•0,5Н2О, который обладает
способностью затвердевать в соединении с водой. Необходимо указать, что
затвердевание свойственно только продукту, полученному при слабой степени жара
(не выше 250°); продукт же, подвергшийся долгому и сильному накаливанию,
становясь плотным, теряет эту способность (становится "мертвым»).
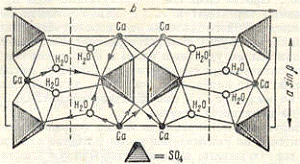
Применение. Волокнистый гипс
(селенит) используют для недорогих ювелирных изделий. Из алебастра издревле
вытачивали крупные ювелирные изделия - предметы интерьера (вазы, столешницы,
чернильницы и т. д.). В «сыром» виде используется как удобрение и в
целлюлозно-бумажной промышленности, в химической для получения красок, эмали,
глазури. Обожжённый гипс применяют для отливок и слепков (барельефы, карнизы и
т. д.), как вяжущий материал в строительном деле, в медицине.
Желтоватые и более плотные разновидности гипса являются хорошим поделочным
материалом.Используется для получения строительного гипса, высокопрочного
гипса, гипсоцементно-пуццоланового вяжущего.
В России славится гипс казанский,
находимый в пермских отложениях по среднему течению Волги, например,
месторождения гипса в Верхнем Услоне на правом берегу Волги; в Тетюшском районе
в Сюкеево, в Чистопольском районе на реке Шешма.

г) Мел
Мел - горная порода белого цвета,
достаточно рассыпчатая и мягкая. Состав мела это практически исключительно (до
99% от всей массы) мелкие зерна скрытокристаллического кальцита (минерал,
природный карбонат кальцияСаСО3). Так же, в состав мела входит обычно небольшие
примеси кварца.
Мел - одно из самых используемых
веществ в мире. Мел был долгое время, да и остается до сих пор, основным
материалом для побелки стен, заборов и потолков. Еще мел используют в сельском
хозяйстве - разбавляют в воде, и получившимся раствором поливают деревья,
делается это, что бы вредители не забирались на деревья и не портили урожай. В
резиновой промышленности мел занимает первое место по количеству наполнителей.
В стекольной промышленности мел
используется при варке стекла, придает ему устойчивость против выветривания и
химических реагентов, прочность и термическую стойкость. Строительная
промышленность самый крупный потребитель мела, используется при производстве
извести, цемента. Так же мел используется в бумажной промышленности - как
пигмент и наполнитель при производстве картона и бумаги. В фармации при
производстве лекарств.
д) Мрамор

Мра́мор
(др.-греч. μάρμαρος
- «белый
или блестящий камень») - метаморфическая горная порода, состоящая из кальцита
CaCO3. Твёрдость - 2,5-5 по шкале Мооса, плотность - 2500-2800 кг/м³.
В мраморе почти всегда содержатся
примеси других минералов, а также органические соединения. Примеси различно
влияют на качество мрамора.Окраска мрамора также зависит от примесей. Оксид
железа окрашивает его в красный цвет, сульфид железа - в сине-чёрный, железосодержащие
силикаты- в зелёный, гидроксиды железа и карбонаты железа и марганца - в жёлтые
и бурые тона. Серые, голубоватые и чёрные цвета могут быть обусловлены также
примесями битумов или графита.
Мрамор используется как камень для
памятников, для наружной облицовки и внутренней отделки зданий. Мраморные доски
из чистого кальцитового мрамора применяют в электротехнике (панели приборных,
распределительных, диспетчерских щитов). Мраморная крошка используется при
изготовлении каменной мозаики и штукатурки. Мраморная мука находит применение в
сельском хозяйстве.
2. Методы определения плотности
жидкостей
Метод сравнения с плотностью воды

Для определения плотности раствора
вещества методом сравнения с плотностью воды собирают установку. Для этого
готовят из стеклянных трубок два сообщающихся сосуда, закрепляют их на
подставке, имеющей шкалу деления (если таковой нет, то можно воспользоваться
вместо шкалы миллиметровой бумагой).
Соединяют два из четырех свободных
конца трубок между собой через тройник. На третий сосок тройника надевают
резиновую трубку достаточной длины. Конец этой трубки опускают в мензурку с
водой.
В один из сообщающихся сосудов
наливают некоторое количество дистиллированной воды. В другой - такое же
количество исследуемого раствора. Свободный конец трубки вытаскивают из
мензурки и фиксируют положение жидкостей в сообщающихся сосудах.
Снова опускают конец трубки в
мензурку и снова фиксируют положение жидкостей в сообщающихся сосудах.
Находят разность высот столбов
жидкостей и производят расчет, учитывая, что высота уровня жидкости обратно
пропорциональна ее плотности:
∆hв/∆hр = ρр/ρв, или ρр=∆hвρв/∆hр,
где ρВ и ρр -
соответственно плотности дистиллированной воды и, а ∆hв и ∆hр -
разности высот столбов дистиллированной воды и исследуемого раствора.
Метод определение плотности
жидкостей разной концентрации
Метод основан на определении
плотности по измеренным в ходе эксперимента массе и объему растворов разной
концентрации. Для опыта готовят навески вещества, например 5, 10, 15, 20г и
т.д. Растворяют эти порции в достаточном для получения 100г раствора количестве
воды. Расчет количества воды производят воспользовавшись формулой:
ω(растворенного в-ва ) =
m(растворенного в-ва) /m(раствора )
Измеряют объем получившихся
растворов. Производят расчет плотности по формуле:
ρр-ра= mр-ра/Vр-ра
3. Методы определения плотности
твердого тела
Метод позволяет определить плотность
вещества, имеющего плотность больше, чем у воды, и основан на действии
архимедовой силы. Для проведения эксперимента готовят мензурку с водой и
отмечают положение мениска жидкости. Взвешивают на весах исследуемое вещество.
Затем погружают это вещество в мензурку с водой и снова фиксируют положение
мениска жидкости. Производят расчет плотности по формуле:
ρв= mв/ V2- V1 ,
где ρв -
плотность исследуемого вещества, V2 и V1 - объемы жидкости после погружения и
до погружения вещества соответственно.
Экспериментальная часть
. Эксперимент по определению
плотностей растворов глюкозы и хлорида натрия
Ход работы:
) Приготовили растворы:
А) Раствор глюкозы
Для того чтобы получить раствор с
разной концентрацией, отмерили на весах 5,10,40 г глюкозы. Растворили данные
навески в воде для получения 100 мл раствора.

Б) Раствор хлорида натрия
Проделали то же самое, что и в
предыдущем опыте только солью.

) Собрали установку для измерения
плотности растворов методом сравнения с плотностью воды (описание см. выше).
) Один из сообщающихся сосудов
налили 20 мл воды. В другой - 20 мл 5% раствора глюкозы. Свободный конец трубки
вытащили из мензурки и зафиксировали положение жидкостей в сообщающихся
сосудах.
) Снова опустили конец трубки в
мензурку и снова зафиксировали положение жидкостей в сообщающихся сосудах.
) Нашли разность высот столбов
жидкостей и произвели расчет, учитывая, что высота уровня жидкости обратно
пропорциональна ее плотности:
∆hв/∆hгл = ρгл/ρв, или ρгл=∆hвρв/∆hгл,
где ρВ и ρгл -
соответственно плотности дистиллированной воды и глюкозы, а ∆hв, ∆hгл
- разности высот столбов дистиллированной воды и глюкозы.
) То же самое (п.3-5) проделали с 10
% -ым и 40 %- ым растворами глюкозы.
) Полученные результаты занесли в
сводную таблицу:
|
Концентрация
раствора, С %
|
Начальная
высота h1, мм
|
Конечная
высота h2, мм
|
Разность
высот ∆h, мм
|
Плотность
ρ,
г/мл
|
|
Н2О(
дистил.)
|
142
|
185
|
43
|
|
5
|
152
|
185
|
33
|
1,3
|
|
10
|
172
|
203
|
31
|
1,38
|
|
40
|
173
|
200
|
27
|
1,59
|
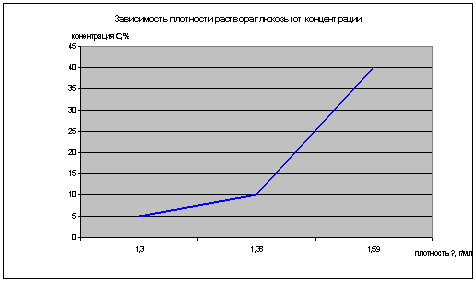
Описанным выше способом провели исследования
растворов хлорида натрия различной концентрации:
|
Концентрация
раствора, С %
|
Начальная
высота h1, мм
|
Конечная
высота h2, мм
|
Разность
высот ∆h, мм
|
Плотность
ρ,
г/мл
|
|
Н2О(
дистил.)
|
146
|
174
|
28
|
1
|
|
5
|
176
|
202
|
26
|
1,07
|
|
10
|
184
|
209
|
25
|
1,12
|
|
15
|
178
|
201
|
23
|
1,217
|
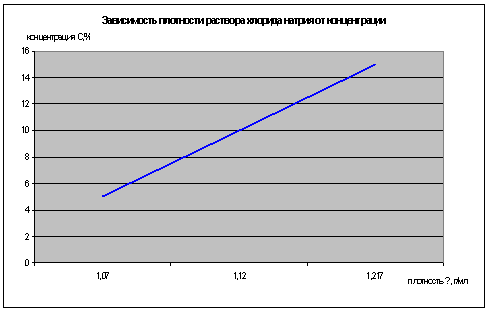
2. Измерение плотности твердого вещества
Эксперимент по определению плотности гипса,
мела, мрамора

Ход работы:
) Налили в мензурку 50 мл воды, отвесили на
весах 5г гипса.
Данную навеску высыпали в мензурку и
зафиксировали изменение объема.
) По данным опыта произвели расчет плотности
гипса по формуле
ρ =m/∆V, где ρ
- плотность
гипса, m -масса навески гипса, ∆V - разность объемов до и после
погружения гипса.
) Повторили эксперимент с навесками в 10 и 15г,
для получения достоверных результатов.
) Этим же методом сравнили плотности мела и
гипса.
) Полученные результаты занесли в сводную
таблицу:
|
вещество
|
Масса
навески вещества, m г
|
Начальный
объем, V1 мл
|
Конечный
объем, V2 мл
|
Разность
объемов, ∆V мл
|
Плотность
вещества, ρ
г/мл
|
|
гипс
|
5
|
50
|
52
|
2
|
2,5
|
|
10
|
50
|
54
|
4
|
|
15
|
50
|
56
|
6
|
2,5
|
|
мел
|
5
|
50
|
52,
5
|
2,5
|
2
|
|
мрамор
|
5
|
50
|
51,8
|
1,8
|
2,8
|
Заключение и выводы
В результате проделанной работы был рассмотрен
материал о веществах, их свойствах, применении. Изучен теоретический материал о
плотности веществ; приборах, позволяющих определить данную физическую
характеристику веществ, и изучены различные методы ее измерения.
Проведена серия опытов по определению плотности
растворов веществ различной концентрации и твердых тел.
Были определены плотности следующих веществ:
) растворов глюкозы, хлорида натрия
) твердых тел, плотность которых больше
плотности воды: мела, гипса, мрамора
Оценка погрешностей измерений плотности веществ
различными методами показывает, что все методы дают близкие результаты к
табличным. Для уменьшения статистических погрешностей, необходимо увеличить
серию опытов и использовать приборы с более высоким классом точности.
В ходе работы установлено, что одинаковый состав
вещества при одинаковой массе не гарантирует одинаковых параметров плотности,
так как на показатели плотности влияет еще и структура вещества, тип
кристаллической решетки.
Данная работа будет продолжена, так как
рассмотрены не все способы определения плотности веществ. Она может быть
использована для развития практики решения экспериментальных задач.
Список литературы
.
О.С. Габриелян Химия 8 класс - М.: Дрофа, 2009
.
А.В. Перышкин Физика 8 класс - М.: Дрофа, 2009 3. Р.А. Лидин Справочник по
общей и неорганической химии -М.: Просвещение, 2007
.
Википедия - свободная энциклопедия http://ru.wikipedia.org/wiki