Антигистаминные средства
Оглавление
Введение
.
Общие положения
.1
Нормальная физиология
.2
Патологическая физиология
.
История антигистаминных препаратов
.
Классификация по группам. химическое строения, механизм действия, источники
происхождения
.
Механизм биологической активности антигистаминной группы - подгруппа блокаторов
Н2- рецепторов гистамина
.1
Блокираторы Н 2-рецепторов гистамину в клинической практике
.1.1
Общая характеристика группы
.
Методы получения
.1
Синтез диазолина
.2
Синтез фамотидина
.
Фармакопейный анализ препаратов
.1
Dimedrolum
.2
Циметидин
.3
Омепразол
.
Сводная таблица препаратов
Словарь
терминов
Список
литературы
Введение
В течение последних лет отмечается существенный
рост частоты и выраженности аллергических заболеваний и реакций. Это связано с
загрязнением окружающей среды, увеличением концентрации озона, изменением
образа жизни людей. Существенно увеличиваются и затраты на лечение больных с
атопической астмой, аллергическими ринитами, атопическим дерматитом. Эти
состояния, как правило, не являются жизнеугрожающими, однако требуют активного
терапевтического вмешательства, которое должно быть эффективным, безопасным и
хорошо переносимым пациентами.
В развитии аллергических реакций значительную
роль играют медиаторы различной химической структуры - биогенные амины
(гистамин, серотонин), лейкотриены, простагландины, кинины, хемотоксические
факторы, катионические протеины и др. В последние годы удалось синтезировать и
апробировать новые препараты с антимедиаторными эффектами - антагонисты
лейкотриеновых рецепторов (зафирлукаст, монтелукаст), ингибиторы
5-липоксигеназы (зелиутон), антихемотоксические агенты. Однако наиболее широкое
применение в клинической практике нашли препараты с антигистаминным действием.
Целесообразность применения антигистаминных препаратов
при различных аллергических заболеваниях (крапивницах, атопическом дерматите,
аллергических ринитах и коньюнктивитах, аллергической гастропатии) обусловлена
широким спектром эффектов гистамина. Этот медиатор способен оказывать влияние
на дыхательные пути (вызывая отек слизистой носа, бронхоспазм, гиперсекрецию
слизи), кожу (зуд, волдырно-гиперемическую реакцию), желудочно-кишечный тракт
(кишечные колики, стимуляцию желудочной секреции), сердечно-сосудистую систему
(расширение капиллярных сосудов, повышение проницаемости сосудов, гипотензию,
нарушение сердечного ритма), гладкую мускулатуру (спазм).
1. Общие
положения
.1 Нормальная физиология
Гистамин обладает высокой активностью. В
физиологических концентрациях он необходим для поддержания нормального
функционирования организма
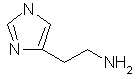
Гистамин.
В больших концентрациях он вызывает
ряд эффектов - расширение капилляров и повышение их проницаемости, приводящие к
снижению количества циркулирующей крови и падению артериального давления.
Гистамин вызывает повышения тонуса гладких мышц, усиления секреции желудочного
сока, увеличение выброса адреналина и глюкокортикоидов . Гистамин набирает
главную роль в возникновении аллергических заболеваний.
.2 Патологическая физиология
Высвобождении гистамина определяется
соотношением в клетке цАМФ и цГМФ, из которых первый ингибирует, а второй
стимулирует высвобождение гистамина. Из-за этого возникает аллергия. Причиной
развития аллергия являются антигены, вызывающие состояния повышенной чувствительности
организма. Они могут быть экзо- или эндогенной природы. Антигены вызывают
образование в организме антител (сенсибилизация организма), и взаимодействие
антиген-антитела может вызвать аллергичискую реакцию. Клеточные антитела
вызывают реакцию замедленного (дерматиты, аутоиммунные реакции), а свободные
антитела - реакции немедленного типа (анафилактический шок, отек Квинке,
крапивница и др.). Образование комплекса антиген-антитело стимулирует
ферментативные процессы, которые обеспечивают высвобождение гистамина (а также
брадикинина) и обусловленные этим аллергические реакции. При аллергиях
немедленного типа используют противогистаминные средства и препараты,
препятствующие высвобождению и тормозящие активность гистамина и других
медиаторов аллергии и воспаления. Гистаминовые рецепторы локализованные в ЦНС,
сосудах, сердце, бронхах, ЖКТ, мочевом пузыре, желчном пузыре, матке, в
эндокринной системе.
2. История антигистаминных препаратов
Исторически сложилось так, что под термином
«антигистаминные препараты» понимают средства, блокирующие Н1-гистаминовые
рецепторы, а лекарства, воздействующие на Н2-гистаминовые рецепторы (циметидин,
ранитидин, фамотидин и др.), называют Н2-гистаминоблокаторами. Первые
используются для лечения аллергических заболеваний, вторые применяются в
качестве антисекреторных средств.
Гистамин, этот важнейший медиатор различных
физиологических и патологических процессов в организме, был химически
синтезирован в 1907 году. Впоследствии его выделили из тканей животных и
человека (Windaus A., Vogt W.). Еще позднее были определены его функции:
желудочная секреция, нейромедиаторная функция в ЦНС, аллергические реакции,
воспаление и др. Спустя почти 20 лет, в 1936 году, были созданы первые
вещества, обладающие антигистаминной активностью (Bovet D., Staub A.). И уже в
60-е годы доказана гетерогенность рецепторов в организме к гистамину и выделены
три их подтипа: Н1, Н2 и Н3, различающиеся по строению, локализации и
физиологическим эффектам, возникающим при их активации и блокаде. С этого
времени начинается активный период синтеза и клинического тестирования
разнообразных антигистаминных препаратов. Начало 80-х годов было ознаменовано
появлением антигистаминных средств нового поколения (терфенадин, астемизол,
лоратадин), по антиаллергической активности сопоставимых с препаратами первой
генерации, но при этом лишенных седативного эффекта.
Таблица 2.1
|
№п/п
|
Дата
|
Событие
|
|
1
|
1907
|
Химически
синтезирован гистамин
|
|
2
|
1936
|
Созданые
первые вещества обладающие антигистаминной активностью (Bovet D., Staub A.)
|
|
3
|
1937
|
Синтез
тимоксидиэтиламина (Bovet D.)
|
|
4
|
1947
|
Введены
в клиническую практику лекарственные средства блокирующие гистаминовые
рецепторы.
|
|
5
|
1957
|
Bovet
D. получил Нобелевскую премию за синтез тимоксидиэтиламина
|
|
6
|
60-е
|
Даказана
гетерогенность рецепторов в организме к гистамину, выделены три подтипа Н1,
Н2 и Н3
|
|
7
|
1977
|
Синтез
терфенадина
|
|
8
|
80-е
|
Появления
нового поколения антигистаминных средств (терфенадин, астемезол, лоратодин).
|
|
9
|
1981
|
Регестрация
терфенадина в США и Европе.
|
|
10
|
1996
|
Регестрация
фексофенадина
|
|
11
|
Запрет
на терфенадин в США
|
3. Классификация по группам. химическое
строения, механизм действия, источники происхождения.
Таблица 3.1 Три поколения антигистаминных
препаратов (в скобках представлены торговые наименования)
|
I
поколение
|
II
поколение
|
III
поколение
|
|
·
Дифенгидрамин
(димедрол, бенадрил, аллергин) · Клемастин
(тавегил) · Доксиламин
(декаприн, донормил) ·
Дифенилпиралин
· Бромодифенгидрамин
· Дименгидринат
(дедалон, драмамин) ·
Хлоропирамин
(супрастин) · Пириламин · Антазолин · Мепирамин · Бромфенирамин · Хлорофенирамин · Дексхлорфенирамин · Фенирамин (авил) · Мебгидролин (диазолин) · Квифенадин (фенкарол) · Секвифенадин (бикарфен) · Прометазин (фенерган,
дипразин, пипольфен) ·
Тримепразин
(терален) · Оксомемазин
· Алимемазин
· Циклизин · Гидроксизин (атаракс) · Меклизин (бонин) · Ципрогептадин (перитол)
|
·
Акривастин
(семпрекс) · Астемизол
(гисманал) · Диметинден
(фенистил) · Оксатомид
(тинсет) · Терфенадин
(бронал, гистадин) ·
Азеластин
(аллергодил) · Левокабастин
(гистимет) · Мизоластин
· Лоратадин
(кларитин) · Эпинастин
(алезион) · Эбастин
(кестин) · Бамипин
(совентол)
|
·
Цетиризин
(зиртек) · Фексофенадин
(телфаст)
|
Механизм действия препаратов.
Димедрол (дифенгидрамин). Обладает достаточно
высокой антигистаминной активностью и снижает выраженность аллергических и
псевдоаллергических реакций. За счет существенного холинолитического эффекта
имеет противокашлевое, противорвотное действие. Но вызывает сухость слизистых,
задержку мочеиспускания, обладает сильным седативным и снотворным эффектом и
может использоваться как снотворное. Оказывает местноанестезирующий эффект,
вследствие чего иногда применяется как альтернатива при непереносимости
новокаина и лидокаина. Димедрол представлен в различных лекарственных формах, в
том числе и для парентерального применения. Димедрол имеет значительный спектр
побочных эффектов, непредсказуемость последствий и воздействия на ЦНС.
· Димедрол раствор для инъекций 1% 1мл
амп. №10
· Димедрол таб. 50мг №10
· Супп. с димедролом 100мг №5
· Димедрол таб. 100мг №10
Диазолин (мебгидролин). Седативный эффект
слабее, чем у димедрола, может вызывать возбужденное состояние ЦНС. При приеме
могут возникать побочные эффекты: раздражение слизистых ЖКТ, нарушение
мочеиспускания, головокружение, сонливость, заторможенность двигательной и
психической реакции. В печать поступали сведения о токсическом влиянии
диазолина на нервные клетки, особенно молодого организма.
· Диазолин гранулы для приготовления
суспензии 9г
· Диазолин драже 100мг №10
· Диазолин драже 100мг №20
· Диазолин драже 50мг №10
· Диазолин драже 50мг №20
· Диазолин таб. 100мг №10
Супрастин (хлоропирамин) - один из самых широко
применяемых седативных антигистаминных препаратов. Обладает значительной
антигистаминной активностью, периферическим антихолинергическим и умеренным
спазмолитическим действием. Эффективен в большинстве случаев для лечения
сезонного и круглогодичного аллергического риноконъюнктивита, отека Квинке,
крапивницы, атопического дерматита, экземы, зуда различной этиологии; в
парентеральной форме - для лечения острых аллергических состояний, требующих
неотложной помощи. Не накапливается в сыворотке крови, поэтому не вызывает
передозировку при длительном применении. Эффект быстро наступает, но
кратковременный, для увеличения продолжительности его комбинируют с
неседативными Н1-блокаторами.
· Супрастин раствор для инъекций 2% 1мл амп. №5
(Egis, Венгрия)
· Супрастин таб. 25мг №20 (Egis,
Венгрия)
· Хлоропирамина г/х таб. 25мг №40
Тавегил (клемастин) - высокоэффективный антигистаминный
препарат, сходный по действию с димедролом. Обладает высокой
антихолинергической активностью, но через гематоэнцефалический барьер проникает
в меньшей степени. В инъекционной форме, которая может использоваться как
дополнительное средство при анафилактическом шоке и ангионевротическом отеке,
для профилактики и лечения аллергических и псевдоаллергических реакций. Однако
аллергия бывает и на тавегил.
· Тавегил раствор для инъекций 0.1% 2мл амп. №5
(Novartis, Швейцария)
· Тавегил таб. 1мг №20 (Novartis,
Швейцария)
Перитол (ципрогептадин) наряду с антигистаминным
обладает значительным антисеротониновым действием.Он часто используется при
некоторых формах мигрени, повышает аппетит.
· Перитол сироп 2мг/5мл 100мл (Egis, Венгрия)
· Перитол таб. 4мг №20 (Egis, Венгрия)
Пипольфен (прометазин) - выраженное воздействие
на ЦНС, применяется как противорвотное средство и для потенцирования наркоза.
· Пипольфен др. 25мг №20 (Egis, Венгрия)
· Пипольфен раствор для инъекций 50мг
2мл амп.№10 (Egis, Венгрия)
· Дипразин таб. 25мг №20
Фенкарол (квифенадин) - обладает меньшей
антигистаминной активностью, чем димедрол, однако характеризуется и меньшим
проникновением через гематоэнцефалический барьер, что определяет более низкую
выраженность его седативных свойств. Кроме того, фенкарол не только блокирует
гистаминовые Н1-рецепторы, но и снижает содержание гистамина в тканях. Может
использоваться при развитии привыкания к другим седативным антигистаминным
препаратам.
· Фенкарол таб. 25мг №20 (Латвия)
Антигистаминные препараты второго поколения
(неседативные).
В отличие от первого поколения они почти не
обладают седативным и холинолитическим эффектами, не проникают через
гематоэнцефалический барьер, не снижают умственной и физической активности, не
адсорбируются с пищевыми продуктами в желудочно-кишечном тракте, имеют высокое
сродство к Н1-рецепторам, обладают быстрым терапевтическим эффектом. Однако для
них в разной степени отмечен кардиотоксический эффект; при их приеме требуется
постоянный контроль сердечной деятельности (назначаются амбулаторно). Их нельзя
принимать пациентам с нарушениями сердечно-сосудистой системы, пожилым больным.
Эффект наступает быстро и на более
продолжительное время (замедленного выведение).
При использовании препаратов в терапевтических
дозах наблюдается минимальный седативный эффект. У некоторых особенно
чувствительных лиц может наблюдаться умеренная сонливость, которая не требует
отмены препарата.
Отсутствие тахифилаксии (снижениея
антигистаминной активности) при длительном приеме.
Кардиотоксическое действие возникает из-за
способности блокировать калиевые каналы сердечной мышцы, риск возникновения
кардиотоксического эффекта увеличивается при сочетании антигистаминных средств
с противогрибковыми (кетоконазолом и интраконазолом), макролидами (эритромицином
и кларитромицином), антидепрессантами (флуоксетином, сертралином и
пароксетином), при употреблении грейпфрутового сока, а также у пациентов с
выраженными нарушениями функции печени.
Парентеральных форм нет, только энтеральные и
местные лекарственные формы.
Наиболее распространенные антигистаминные
средства второго поколения:
Трексил (терфенадин) - первый антигистаминный
препарат второго поколения, нет угнетающего действия на ЦНС, но с значительным
кардиотоксическим действием и повышенной способностью вызвать фатальные
аритмии.
· Трексил таб. 60мг №100 (Ranbaxi,
Индия)
Гисталонг (астемизол) - один из самых длительно
действующих препаратов группы (до 20 суток). Ему свойственно необратимое
связывание с Н1-рецепторами. Практически не оказывает седативного действия, не
взаимодействует с алкоголем. Эффективен при хронических аллергических
заболеваниях, при остром процессе его применение нецелесообразно. Но возрастает
риск развития серьезных нарушений сердечного ритма, иногда фатальных. В связи с
этими опасными побочными явлениями продажа астемизола в США и некоторых других
странах приостановлена.
· Астемизол таб. 10мг №10
· Гисталонг таб. 10мг №20 (Индия)
Семпрекс (акривастин) - препарат с высокой
антигистаминной активностью при минимально выраженном седативном и
антихолинергическом действии. Лечебный эффект достигается быстро, но
кратковременно.
· Семпрекс капс. 8мг №24
(GlaxoWellcome, Великобритания)
Фенистил (диметенден) - наиболее близок к
антигистаминным препаратам первого поколения, однако отличается от них
значительно меньшей выраженностью седативного эффекта, более высокой
противоаллергической активностью и длительностью действия чем препараты первого
поколения. Есть гель для наружного применения.
· Фенистил капли 20мл (Novartis,
Швейцария)
· Фенистил гель 0.1% 30г (Novartis,
Швейцария)
Кларитин (лоратадин) - один из самых покупаемых
препаратов второго поколения. Его антигистаминная активность выше, чем у
астемизола и терфенадина, из-за большей прочности связывания с периферическими
Н1-рецепторами. Седативного эффекта нет, он не потенцирует действие алкоголя.
Практически не взаимодействует с другими лекарственными средствами и не
обладает кардиотоксическим действием. Его можно принимать водителям, детям с 1
года.
· Кларитин сироп 5мг/5мл 120мл (Schering-Plough,
США)
· Кларитин таб. 10мг №10
(Schering-Plough, США)
· Лоратадин таб. 10мг №10
· Агистам таб. 10мг №12
Антигистаминные препараты третьего поколения
(метаболиты).
Являются активными метаболитами антигистаминных
препаратов второго поколения. Не обладают седтивным и кардиотоксическим
эффектом. В связи с этим препараты разрешены к применению лицам, деятельность
которых требует повышенного внимания.
Зиртек, цетрин (цетиризин) - высокоселективный
блокатор периферических Н1-рецепторов. Цетиризин почти не метаболизируется в
организме, скорость его выведения зависит от функции почек. Он хорошо проникает
в кожу, и эффективен при кожных проявлениях аллергии. Эффект появляется через 2
часа после приема и сохраняется 24 часа. Не обладают седтивным и кардиотоксическим
эффектом в терапевтических дозах. С осторожностью назначают при нарушении
функции почек.
· Цетрин таб. 10мг №20 (Dr. Reddy's
Laboratories, Индия)
Телфаст (фексофенадин) - метаболит терфенадина.
Не метаболизирует в организме, не взаимодействует с лекарствами, не оказывает
седативного действия и не влияет на психомоторную деятельность. Эффективный и
максимально безопасный препарат среди антигистаминных средств.
· Телфаст таб. 120мг №10 (Hoechst
Marion Roussel)
· Телфаст таб. 180мг №10 (Hoechst
Marion Roussel)
4. Механизм биологической активности
антигистаминной группы - подгруппа блокаторов Н2- рецепторов гистамина
.1 Блокираторы Н 2-рецепторов гистамину в
клинической практике
.1.1 Общая характеристика группы
Фармакодинамика
Противоязвенная активность этих препаратов
обусловлена их ингибирующим влиянием на секрецию соляной кислоты за счет
блокады гистаминовых рецепторов 2- го типа париєнтальних клеток оболочки
желудку. Это связано с тем, что молекула Н 2-блокиратора содержит структурный
фрагмент, который за пространственными и физик-химическими свойствами является
аналогом гистамина. Этот фрагмент по принципу " ключ-замок"
встраивается в рецептор вместо гистамина.
Препараты удручают базальную и стимулированную
секрецию соляной кислоты, уменьшают объем и кислотность желудочного сока,
уменьшают выделение пепсина.
Кроме того, Н 2-блокираторы имеют дополнительные
механизмы действия, связанные с их способностью частично повышать синтез
простагландинов в слизистой желудку, который, в свою очередь, может приводить
к:
активации кровотоку в слизистой желудку;
повышении синтеза бикарбонатов, нейтрализующих
соляную кислоту желудочного сока;
оказывают содействие восстановлению
(регенерации) клеток поврежденного эпителия в зоне эрозии или дефекта язвы;
возможно, стимулируют продукцию слизи и повышают
тонус нижнего сфинктера пищевода (вчастности, ранитидин), что особенно важно
для устранения изжоги.
Фармакокинетика
Фармакокинетично Н 2-блокираторы различаются по
биодоступности, периода полувывода и продолжительности действия, степени
печеночного метаболизма.
Циметидин как можно меньше гидрофильный, что
обуславливает короткий период полувывода и значащий метаболизм в печени. Он
вступает во взаимодействие с микросомальним ферментом - цитохромом Р-450,
изменяя скорость печеночного метаболизма ксенобиотиков. Циметидин -
универсальный ингибитор печеночного метаболизма многих врачебных препаратов,
из-за чего он может вступать в фармакокинетическое взаимодействие с другими
лекарством, обычно приводя к их кумуляции и усилению риска развития побочных
эффектов.
Циметидин лучше за другие Н 2-блокираторов
способен проникать в ткани, вызывая развитие побочных эффектов. Он способен
вытеснять из связи с рецепторами эндогенный тестостерон, предопределяя тем
самым нарушение половой функции.
Ранитидин и особенно фамотидин, низатидин,
роксатидин меньше проникают к органам и тканям, которые снижает количество
побочных эффектов. Эти препараты не взаимодействуют с андрогенами и практически
не вызывают половых разладов. Следует отметить, что наличие в молекуле
фамотидину нескольких основных функциональных групп также оказывает содействие
нейтрализации определенного количества соляной кислоты в желудке за счет
образования солей. Такими центрами основности в молекуле фамотидину есть
гуанидиновый фрагмент, а также третичный атом азота в остатке тиазола.
Результатом этого являются основные свойства фамотидину и способность этого
вещества растворятся в кислотах.
5. Методы получения
.1 Синтез диазолина

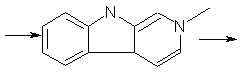
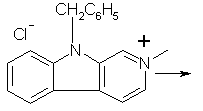
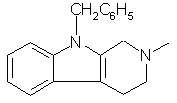

. Растворяют при нагревании
1,14г метилсульфата2метил -
 -карболиния(1) в 20мл воды и к
горячему раствору прибавляют 20 мл 50% раствора КОН. Выпавший светло-желтый
осадок (2) отфильтровывают, промывают в 3мл холодной воды и
перекристализовывают из 2-пропанола. Получают 0,65 г (93%) соединении (2).
Температура плавления 79-81ºС.
-карболиния(1) в 20мл воды и к
горячему раствору прибавляют 20 мл 50% раствора КОН. Выпавший светло-желтый
осадок (2) отфильтровывают, промывают в 3мл холодной воды и
перекристализовывают из 2-пропанола. Получают 0,65 г (93%) соединении (2).
Температура плавления 79-81ºС.
. К раствору 0,4 г (2ммоль)
3метил-
 -карболина(2) в 5 мл 2-пропанола
прибавляют 0,4 мл (3,8 ммоль) хлористого бензила и смесь кипятят в течении
3-3,5 часа. Охлаждают, выпавший осадок (3) отфильтровывают и перекристализовывают
из спирта. Выход 0,6 г (88%). Температура плавления 337-340ºС.
-карболина(2) в 5 мл 2-пропанола
прибавляют 0,4 мл (3,8 ммоль) хлористого бензила и смесь кипятят в течении
3-3,5 часа. Охлаждают, выпавший осадок (3) отфильтровывают и перекристализовывают
из спирта. Выход 0,6 г (88%). Температура плавления 337-340ºС.
. К раствору 0,4 г (1,3ммоль)
3-метил-9-бензил-
 -карболиний хлорида (3) в 15 мл
70%этилового спирта при интенсивном перемешивании, при комнатной температуре
прибавляют по частям 0,12г (3,16ммоль) боргидрида натрия в течении 0,5 часов.
Спустя сутик раствор упаривают и из сухого остатка продукт реакции экстрагируют
бензолом. После очистки из гексана получают 0,25 г (73%) соединение 4.
Температура плавления 72-73ºС.
-карболиний хлорида (3) в 15 мл
70%этилового спирта при интенсивном перемешивании, при комнатной температуре
прибавляют по частям 0,12г (3,16ммоль) боргидрида натрия в течении 0,5 часов.
Спустя сутик раствор упаривают и из сухого остатка продукт реакции экстрагируют
бензолом. После очистки из гексана получают 0,25 г (73%) соединение 4.
Температура плавления 72-73ºС.
.2 Синтез фамотидина



1 Стадия. Получение N-(
2-ил)-гуанидина гидрохлорида (или 1-( 2-тиазолил) гуанидина)
В ацетоне растворяют 1,
3-дибромацетон (92%-ной, что эквивалентно 46,6 г; 0,216 моль)(І) и охлаждают до
5°С. К полученному раствору прибавляют імінотиодисечовину(ІІ), реакционную
смесь перемешивают в продолжение часа при температуре окружающей среды, а потом
еще час при температуре 50-55°С. После охлаждения к комнатной температуре,
продукт (ІІІ) фильтруют, промывают ацетоном, и высушивают под вакуумом.
Получают порошок белого цвета. Выход на стадии составляет 98%.
Стадия. Получение 1-(4-(цианоэтилтиометил)-
2-тиазолил) гуанидина (или N''-(4-((( 2-цианоэтил)тио)метил)-
2-тиазолил)-гуанидина)
Тиомочевину (ІV) (30,4 г, 0,40 моль)
растворяют в воде и прибавляют продукт предыдущей стадии (ІІІ) (124,5 г, 0,394
моль) и перемешивают смесь в продолжение часа при 50-55°С. После охлаждения до
5°С прибавляют хлоропропионитрил (V) (41,2 г, 0,46 моль) и изопропанол (VІ)
(215 мл); за час подливают раствор NaOH (65 г) в воде (240 мл)(температуру
поддерживают ниже 10°С). Перемешивают реакционную смесь на протяжении 2ч при
0°С, фильтруют, и твердый продукт (VІІ) промывают водой. Субстанцию сушат под
вакуумом. Выход на стадии 89%.
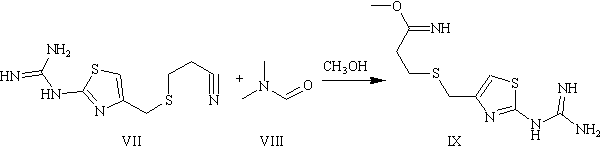
Стадия .Получение метилового эфира
?-( 4-илсульфамил)-пропионимидовой кислоты
В емкость в условиях инертной
атмосферы прибавляют 1 л безводного диметилформамида (VІІІ), продукта
предыдущей стадии (VІІ)(502 г, 2,08 моль) и 1 л безводного метанола.
Реакционную смесь охлаждают к -20°С і прибавляют 1,04 кг НCl на протяжении 8
часов (поддерживая температуру ниже 5°С). После перемешивания реакционной смеси
на протяжении двух дней (0-5°С) смесь переносят в охлажденный водный раствор
4,375 г K2CO3 в 12,1 л этилацетата. Смесь перемешивают на протяжении двух часов
при температуре 0-5°С. Осадок (ІX) собирают и высушивают. Выход на стадии 82%.
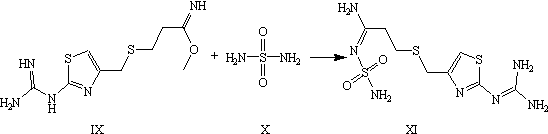
Стадия. Получение субстанции
фамотидину (3-[[[2-[(Аминоиминометил) амино]- 4-тиазолил]
метил]тио]-N-(аминосульфонил) пропанимидамид)
г (4,125 моль) сульфаміда (X)
прибавляют до 1,5 л безводного метанола. Смесь нагревают до 55°С, чтобы
растворить сульфамид. Раствор охлаждают до 30°С і прибавляют 512 г (1,875 моль)
продукта, полученного из предыдущей стадии ІX. Смесь перемешивают на протяжении
двух дней при комнатной температуре. Целевой продукт (XІ) в виде кристаллов
фильтруют, промывают охлажденным метанолом, и высушивают воздухом при комнатной
температуре. Выход на стадии 49%
6. Фармакопейный анализ препаратов
.1 Dimedrolum
· Димедрол
· Diphenhydramini Hydrochloridum *
· р-Диметиламиноэтилового эфира
бензгидрола гидрохлорид
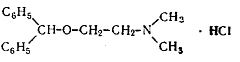
·
· C17H21NO·HCI M.
в. 291,82 Описание. Белый мелкокристаллический порошок, без запаха или с едва
уловимым запахом, горького вкуса, вызывает на языке чувство онемения.
Гигроскопичен.
· Растворимость. Очень легко растворим
в воде, легко растворим в спирте и хлороформе, очень мало растворим в эфире и
бензоле.
· Подлинность. На часовое стекло
наносят 3-4 капли концентрированной серной кислоты и прибавляют 0,02 г
препарата: появляется ярко-желтое окрашивание, постепенно переходящее в
кирпично-красное. От прибавления нескольких капель воды окраска исчезает.
· К 0,01 г препарата прибавляют 2 мл
смеси, состоящей из 1 мл концентрированной азотной кислоты и 9 мл
концентрированной серной кислоты; появляется красное окрашивание. Прибавляют по
каплям при постоянном помешивании и охлаждении 5 мл воды; окраска переходит в
коричневую, желтую и затем в оранжевую. При взбалтывании полученного раствора с
3 мл хлороформа хлороформный слой окрашивается в фиолетовый цвет.
· 0,1 г препарата растворяют в 5 мл
воды, прибавляют 2 мл разведенной соляной кислоты и кипятят в течение 3 минут.
После охлаждения кристаллы отфильтровывают и перекристаллизовывают из
небольшого количества воды. Температура плавления полученного бензгидрола
62-67°.
· Раствор препарата (1:100) дает
характерную реакцию на хлориды (стр. 747).
· Температура плавления 166-170°.
· Прозрачность раствора. Раствор
препарата (1 :5) должен быть прозрачным.
· Кислотность. 0,5 г препарата
растворяют в 10 мл свежепрокипяченной и охлажденной воды, прибавляют 1 каплю
метилового красного. Появившееся красное окрашивание должно перейти в желтое от
прибавления не более 0,1 мл 0,05 н. раствора едкого натра.
· Сульфаты. 10 мл раствора препарата
(1 : 10) должны выдерживать .испытание на сульфаты (не более 0,01% в
препарате).
· Потеря в весе при высушивании. Около
0,5 г препарата (точная навеска) сушат при 100-105° до постоянного веса. Потеря
в весе не должна превышать 0,5%.
· Сульфатная зола и тяжелые металлы.
Сульфатная зола из 0,5 г препарата не должна превышать 0,1% и должна
выдерживать испытание на тяжелые металлы (не более 0,001 % в препарате).
· Количественное определение. Около
0,3 г препарата (точная навеска) растворяют в 10 мл безводной уксусной кислоты,
прибавляют 5 мл раствора ацетата окисной ртути и титруют 0,1 н. раствором
хлорной кислоты до зеленовато-голубого окрашивания (индикатор - кристаллический
фиолетовый).
· Параллельно проводят контрольный
опыт.
· 1 мл 0,1 н. раствора хлорной кислоты
соответствует 0,02918 г C17H21NO·HCI, которого в препарате должно быть не менее
99,0%.
· Хранение. Список Б. В хорошо
укупоренной таре, предохраняющей от действия света и влаги.
· Высшая разовая доза внутрь 0,1 г.
· Высшая суточная доза внутрь 0,25 г.
· Высшая разовая доза внутримышечно
0,05 г.
· Высшая суточная доза внутримышечно
0,15 г.
· См. также статью «Su-lutio
Dirnedroli 1 % pro injectionibus».
· Противогистаминное
(противоаллергическое) средство
.2 Циметидин
Молекулярная формула. C10H16N6S
Относительная молекулярная масса. 252,3
Структурная формула.
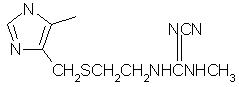
Химическое наименование.
2-циано-1-метил-3-[2-[[(5-метилимидазол-4ил)метил]-тио]этил]гуанидин;
N”-циано-N-метил-N’-[2-[[(5-метил-1Н-имидазол-4ил)метил]-тио]этил]гуанидин;
1-циано-2-метил-3-[2-[[(5-метилимидазол-4ил)метил]-тио]этил]гуанидин;
N-циано-N’-метил-N”-[2-[[(5-метил-1Н-имидазол-4ил)метил]-тио]этил]гуанидин.
Описание. Белый или почти белый
порошок без запаха или с легким запахом.
Категория. Средство для лечения
язвенной болезни желудка.
Хранение. Циметидин следует хранить
в хорошо укупоренной таре.
Дополнительная информация. Циметидин
существует в трех полиморфных формах. Полиморфная модификация, описанная в этой
статье, соответствует кристаллической форме циметидина СО.
ТРЕБОВАНИЯ
Общее требование. Циметидин содержит
не менее 98,5 и не более 101,0% C10H16N6S в пересчете на высушенное вещество.
Подлинность
А. Проводят испытание, как описано в
разделе «Спектрофотометрия в инфракрасной области спектра»(т.1,с.45).
Инфракрасный спектр, полученный с испытуемым веществом в твердом состоянии без
предшествующего растворения, соответствует спектру, аналогичным образом
полученному со стандартным образцом циметидина СО, или спектру сравнения
циметидина; не должно быть пика или плеча волны 1180см-1 (подтверждения
полиформной формы).
Б. Температура плавления около 142ºС.
Тяжелые металлы. Используют 1,0г используемого
вещества для приготовления испытательного раствора по методике 3, описанной в
раскладе «Испытание на тяжелые металлы» (т. 1, с. 136); Содержание тяжолых
металлов определяют методом А (т. 1, с. 137); не более 20мкг/г.
Сульфатная зола. Не более 1,0мг/г.
Потеря при высушивание. Высушивают до постоянной
массы при 105ºС; потеря не более
10,0мг/г
рН раствора. рН раствора испытуемого вещества с
концентрацией 5,0мг/мл в свободной от диоксидина углерода воде Р составляет
8,0-9,5.
Посторонние примеси. Проводят испытание, как
описано в дополнениях к тому 1 в разделе «Высокоэффективная жидкостная
хроматография», используя колонку высотой 25см и внутренним диаметром 4,6 мм,
заполненную частицами пористого селикагеля 5-10 мкм в диаметре, поверхность
которых модифицирована химически связанными октадецилсилильными группами.
Готовят смесь растворителей следующим образом: разводят 1 мл ледяной уксусной
кислоты Р количеством воды, достаточным для получения 200 мл. К 190 мл этого
раствора добавляют 10 мл раствора ацетата аммония (2 г/л) ИР. В качестве
продвижной фазы используют дегазированную смесь растворителей и 16 объемов
ацетонитрила Р. для оценки пригодности системы готовят раствор, сод. 18мкг
испытуемого вещества в 1мл смеси растворителей (раствор Б). Применяют скорость
элюции около 1мл/мин. В качестве детектора используют ультрафиолетовый спектрофотометр
на длине волны около 228 нм, снабженный подходящим записывающим устройством.
Последовательно вводят 6 порций по 10 мкл раствора а. Измеряют площади пиков;
стандартное отклонение отношений площадей пиков циметидина к сумме площадей
всех пиков на хроматограмме, за исключением пиков смеси растворителей, не более
2,0%, а коэффициент разрешения между кофеином и циметидином не менее 3,0.
Относительное время задержки для кофеина около 1,0, а для циметидина - около
1,4. Затем вводят 10 мкл раствора Б и измеряют площади пиков; отношение
площадей пиков циметидина к сумме площадей всех пиков на Хроматограмме,
исключая площади пиков смеси растворителей, не менее 0,99.
Количественное определение. Растворяют около
0,25 мг испытуемого вещества (точная навеска) в 30 мл ледяной уксусной кислоты
Р1 и титруют хлорной кислотой (0,1 моль/л) ТР, определяя конечное значение
поцентрометрически по методу А, описанному в разделе «Неводное титрование» (т.
1, с.151). Каждый миллилитр хлорной кислоты (0,1 моль/л( ТР соответствует 25,23
мг C10H16N6S.
.3 Омепразол

H19N3O3S М.м. 345,4
Омепразол содержит не менее 99,0% и
не больше 101,0%
5-метокси-2-[(RS)-[(4-метокси-3,5диметилпиридн-2-ил)метил]сульфинил]-1Н-бензимидазола,
в пересчете на сухое вещество.
Свойства.
Описание. Кристаллический порошок
белого или почти белого цвета.
Растворимость. Оченнь
малорастворимый в воде Р, растворимый в метилхлориде Р, относительно
растворимый в 96% спирте Р и метаноле Р. (Растворяется в разведенных растворах
гидроксидов щелочных металлов). (Проявляет полиморфизм).
Идентификация
А. 2,0 мг субстанции растворяют в
0,1 М растворе гидроксида натрия Р и доводят оббьем раствора тем самым
растворителем до 100,0 мл. Ультрофиолетовый спектр поглощения(2.2.25)
полученного раствора в области от 230 нм до 305 нм. Отношение оптической
плотности в максимуме по длине волны 305нм к оптической плотности в максимуме
по длине волны 276 нм должно быть от 1,6 до 1,8.
В. Инфракрасный спектр (2.2.24)
субстанции должен соответствовать спектру ФСЗ омепразола. В случаи разнице
спектров субстанции и ФСЗ омепразола растворяют в метаноле Р, выпаривают до
суха и повторно записывают спектры полученных остатков.
С. На хроматограмме испытуемого
раствора (b), получ. в испытании «Примеси С омепразола», должно проявлятся
основное пятно на уровне основного пятна на хромотограмме раствора сравнения
(а), соответствующая ей размером. Пластинку помещают в камеру, насышенную паром
уксусной кислоты Р; пятна на хромотограмме быстро окрашеваются в коричневый цвет.
Испытания на чистоту.
Раствор S. 0,50 г. субстанции
растворяют в метиленхлориде Р и доводят обьем раствора тем самым растворителем
до 25мл.
Прозрачность раствора (2.2.1).
Раствор S должен быть прозрачным.
Оптическая плотность (2.2.25)
Оптическая плотность раствора S по длине волны 440 нм не должна превышать 0,10.
(Эта граница соответствует 0,035% примеси Fомепразола или примеси Gомепразола).
Примесь С омепразола. Определение
проводят методом ТШХ(2.2.27), используя ТШХ пластинки с шаром селикагеля F254P.
Испытуемый раствор (а). 0,10 г
субстанции растворяют в 2,0 мл смеси равных объемов метанолу Р и метиленхлорида
Р.
Испытуемый раствор (b). 1,0 мл
испытуемого раствора (а) доводят метанолом Р до объема 10 мл.
Раствор сравнения (а). 10 мг ФСЗ
омепразола растворяют в 2,0 мл метанола Р.
Раствор сравнения (b). 1мл
испытуемого раствора (а) доводят смесью равных объемов метанола Р и
метиленхлорида Р до объема 10мл. 1 мл полученного раствора доводят той же самой
смесью до объема 100мл.
На линию старта хроматографичной
пластины наносят 10 мкл (500мкг) испытуемого раствора (а), 10 мкл (50мкг)
испытуемого раствора (b), 10 мкл (50 мкг) раствора сравнения (а) и 10 мкл (0,5
мкг) раствора сравнения (b). Пластину помещают в камеру со смесью растворителей
2-пропанол Р-метиленхлорид Р, предварительно насыщенных раствором
концентрированного аммиака Р, готовят таким обазом: в делительной лейке сливают
100 мл метиленхлорида Р с 30 мл раствора концентрированого аммиака Р.
Полученный раствор выдерживают до расшарования фаз и используют нижний шар.
Когда фронт растворителя пройдет 15
см от линии старта, пластинку вынимают из камеры, сушат на воздухе и
пересматривают в УФ-свете за длины волн 254 нм.
На хроматограмме испытуемого
раствора (а) какое либо пятно с Rf большим, чем Rf пятна омпепразола, не должно
быть интенсивнее за пятно на хроматограмме раствора сравнения (b)(0.1%).
Сопровождаюящие примеси. Определения
проводят методом хромотографии (2,2,29)
Испытуемый раствор. 3,0г субстанции
растворяют в движущей фазе и доводят объем раствора движущей фазы до 25,0 мл.
Раствор сравнения (а). 1,0 мг ФСЗ
омепразола и 1,0 мг ФСЗ примеси D омепразола растворяют в движущей фазе и
доводят объем раствора движущей фазы до 10,0 мл.
Раствор сравнения (b). 1,0 мл
испытуемого раствора доводят движущей фазой до объема 100,0 мл. 1,0 мл
полученного растворадоводят движущей фазой до объема 10,0 мл.
Хроматографирование проводят на
жидкостном хроматографе с УФ-детектором при таких условиях:
колонка с нержавеющей стали размером
0,15м х 4мм, заполненная октилсилильным селикагелем для хроматографии Р с
размером частиц 5мкм;
движущая фаза: ацетонитрил Р -
раствор 1,4 г/л динатрию гидрофосфату Р,
рН которого предварительно доводят
до 7,6 фосфатной кислотой Р,(27:73);
скорость движущей фази 1 мл/мин.;
детектирование по длине волны 280
нм.
При хроматографировании по описанным
условиям время удержания пика омепразола должно быть приблизительно 9 мин. ,
относительное время удержания примеси D омепразола - приблизительно
0,8.Хроматографируют 40мкл раствора сравнения (а) и 40 мкл раствора сравнения
(b). Чуствительность системы регулируют таким образом, чтоб высота основного
пика на хроматограмме раствора сравнения (b) составляла не менее 15% шкалы
реестрирующего прибора.
Хроматографическая система считается
пригодной, если коэффициент разделения пиков примеси D омепразола и омепразола
на хроматограмме раствора сравнения (а) составляет больше 3. Если необходимо,
регулируют рН движущей фазы или содержание ацетонитрилу Р; уменьшение рН
улучшает разделение.
Хроматографируют 40 мкл испытуемого
раствора. Время хроматографирования должно быть в 3 раза больше времени
удержания омепразола.
На хроматограмме испытуемого
раствора площадь любого пика, кроме основного, не должна превышать площадь
основного пика на хроматограмме раствора сравнения (b)(0,1%).
Остаточные количества органических
растворителей. Не больше 0,005% (50ppm) хлороформа, 0,01% метилхлорида.
Определение проводят методом парофазной газовой хроматографии (2.2.28),
используя метод стандартных добавок.
Хроматографирование проводят на
газовом хроматографе с пламене-ионезационным детектором при таких условиях:
колонка кварцевая размером 30 м х
0,32 мм, покрытая шаром поперечно-сшитого
поли[(цианопропил)(фенил)][(диметил]силоксан Р толщиной 1,8 мкм;
газ-носитель азот для хроматографии
Р;
подхожий блок ввода паровой фазы.
,50 г субстанции помещают в посуду
для парофазного анализа емкостью 10мл, добавляют 1,0 мл диметилацетамида Р и
закрывают посуду. Для установления равновесия фазы емкость выдерживают при
температуре 80ºС на протяжении
1 часа.
потеря в массе при высушивании.
(2.2.32). Не больше 0,2% 1,000г субстанции сушат под высоким вакуумом при
температуре 60ºС на
протяжении 4 часов.
Сульфатная зала (2.4.14). Не больше
0,1%. Определение проводят с 1,0 г субстанции.
Количественное определение
4. 100г субстанции растворяют в смеси 10
мл води Р и 40 мл 96% спирта Р. Полученный раствор титруют 0,5М раствором
гидрокидом натрия потенциометрически (2.2.20)
мл 0,5М раствора гидроксида натрия соответствует
0,1727 г C17H19N3O3S.
Хранение
В воздухонепроникающем контейнере, в защищенном
от света месте, при температуре от 2ºС
до 8ºС.
Примеси
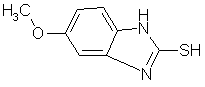
А. 5-метокси-1Н-бензимидазол-2-тиол
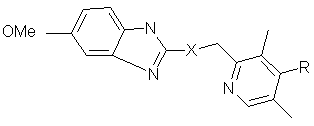
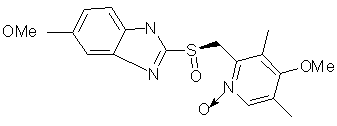
В. R=H, X=SO:
2-[(RS)-[(3.5-диметилпиридин-2-ил)метил]сульфинил]-5-метоки-1Н-бензимидозол,
С. R=OCH3, X=S:
5-метокси-2-[[(4-метокси-3,5-диметилпиридин-2-ил)метил]сульфанил]-1Н-бензимидазол
(омепразола сульфон), и энантиомер
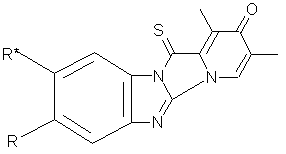
. R=OCH3, R/=H : 1,3-
диметил-8-метокси-12-тиоксопиридо[1,2:3,4]имидазо [1,2-а]бензимидазол-2(12Н)-он,.
R=H, R/= OCH3:1,3-диметил -9-метокси - 12-тиоксопиридо [1,2:3,4]имидазо
[1,2-а]бензимидазол-2(12Н)-он.
7. Сводная таблица препаратов
|
№п\п
|
Структурная
формула
|
Систематическое
и химическое название
|
1. 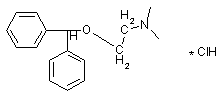 Димедрол
Димедрол
|
  - Диметиламиноэтилового эфира
бензгидрола гидрохлорид - Диметиламиноэтилового эфира
бензгидрола гидрохлорид
|
|
|
|
2.
|
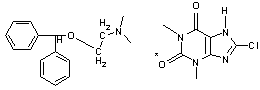 Дименгидринат
8-Хлортеофиллинат Дименгидринат
8-Хлортеофиллинат  - Диметиламиноэтилового эфира
бензгидрола - Диметиламиноэтилового эфира
бензгидрола
|
|
|
3.
|
 Фенкарол
Хинуклидин -3-Дифенилкабинола гидрохлорид Фенкарол
Хинуклидин -3-Дифенилкабинола гидрохлорид
|
|
a.  Бикарфен
Бикарфен
|
(Хинуклидин
-3-)-Ди-(орто-толил)-карбинола гидрохлорид
|
|
|
|
4.
|
 Дипразин
10-(2-Диметиламинопропил)-фенотиазина гидрохлорид Дипразин
10-(2-Диметиламинопропил)-фенотиазина гидрохлорид
|
|
a. 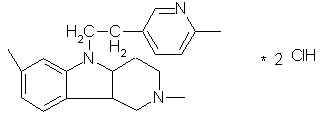 Димебон
Димебон
|
3,6-Диметил-9-(2-метил-пиридил-5)-этил-1,2,3,4-тетрагидро-  -карболина дигидрохлорид -карболина дигидрохлорид
|
|
b. 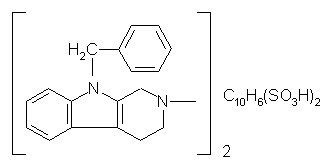 Диазолин
Диазолин
|
3-метил-9-бензил-1,2,3,4-тетрагидрокарболина
нафталин-1,5-дисульфонат
|
|
c. 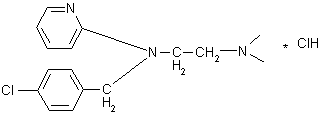 Супрастин
Супрастин
|
Гидрохлорид
N-диметиламиноэтил-N-(пара-хлорбензил)-аминопиридина
|
|
d.  Тавегил
Тавегил
|
1-метил-2[2-(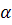 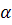 -метил-пара-хлорбензгидрилокси)-этил]-пирролидин -метил-пара-хлорбензгидрилокси)-этил]-пирролидин
|
|
e.  Цетиризин
Цетиризин
f.  Сетастин
Сетастин
|
1-[-2[(пара-хлор-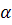 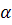 -фенилбензил)окси]-этил]гексагидро-1Н-азепин -фенилбензил)окси]-этил]гексагидро-1Н-азепин
|
|
g.  Астемизол
Астемизол
|
1-(пара-фторбензил)-2-[[1-(пара-метоксифенил-этил)-4-пиперидил]амино]-бензимидазол
|
|
h. 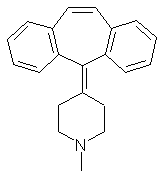 Ципрогептадин
Ципрогептадин
|
4-(5-дибензо[а,d]циклогептатриенилиден)-1-метилпиперидина
гидрохлорид
|
|
i. 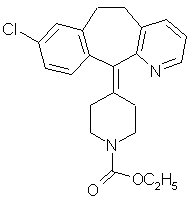 Лоратадин
Лоратадин
|
Этиловый
эфир 4-[8-хлор-5,6-дигидро]-1[Н-бензо[5,6]циклогепта[1,2-в]пиридин-[1-илиден]-1пиперидинкарбоновой
кислоты
|
|
j.  Терфенадин
Терфенадин
|
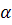 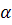 -[п-терт-бутилфенил]-4-(гидроксидиметилфенилметил)-1-пиперидинбутанол -[п-терт-бутилфенил]-4-(гидроксидиметилфенилметил)-1-пиперидинбутанол
|
|
k. 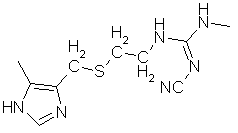 Циметидин
Циметидин
|
1-циано-2-метил-3[2-(5-метилмидазол-4-ил)-метил-тиоэтил]гуанидин
|
|
l. 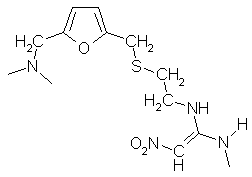 Ранитидин
Ранитидин
|
N-[2-[[[5-(диметиламино)метил]фурфурил]-тио]-этил]-N”-метил-2-нитро-1,1-этилендиамин
|
|
m.  Фамотидин
Фамотидин
|
[1-амино-3-[[[2-[(диаминометилен)-амино]-4-тиазолил]метил]тио]пропилиден]сульфамид
|
|
n.  Низатидин
Низатидин
|
N-2-[[[2-[(Диметиламино)метил]-4тиазолил]метил]тио]этил-N.-метил
-2-нитро-1,1-этилендиамин
|
|
o. 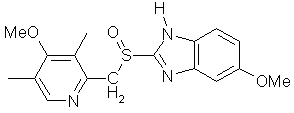 Омепразол
Омепразол
|
5-Метокси-2-[[(4-метокси-3,5-диметил-2-пиридин)метил]сульфинил]бензимидозол
|
|
p.  Кромолин-натрий
Кромолин-натрий
|
Динатриевая
соль 5,5,-[(2-окситриметилен)диокси бис(-4-оксо)-4Н-1-бензопиран-2-карбоновой
кислоты]
|
|
q. 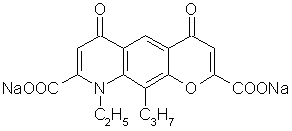 Недокромил-натрий
Недокромил-натрий
|
9-Этил-6,9-дигидро-4,6-диоксо-10-пропил-4Н-пирано[3,2-g]хинолин-2,8-дикарбоновой
кислоты динатриевая соль
|
|
r. 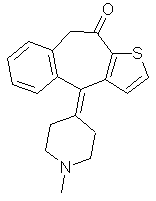 Кетотифен
Кетотифен
|
4,9-дигидро-4-(1-метил-4-пипиридиниледен-10Н-бензо[4,5]циклогепта[1,2-b]-теофен-10-он(гидрофумарат)
|
|
s. 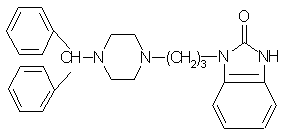 Оксотомид
Оксотомид
|
1-{3-[4-(дифенилметил)-1-пиперазинил]пропил}-2-бензимидозолинон
|
|
Словарь терминов
рецептор гистамин препарат неседативный
1. Агонист
- вещество, которое при взаимодействии со специфическим рецептором вызывает
изменения, приводящие к биологическим эффектам (внутренняя активность).
2. Активный
транспорт - перенос растворенного вещества против градиента концентрации,
требующий энергетических затрат.
. Алерген
- 1) вещество антигенной или гаптенной природы способно сенсибилизировать
организм и вызывать аллергию; 2) препарат для диагностики и лечения
аллергичесих заболеваний, изготовленный из экзогенных А., обычно не вызывающих
сенсибилизации организма и аллергических реакций при правильном его применении.
. А.
Бактериальный - А., придставляющий собой компонент бактериальной клетки,
продукт ее жизнедеятельности или специально изготовлены из них препарат.
. А.
Бытовой - А., с которым человек контактирует в быту.
. А.
Вирусный - А., представляющий собой компонент вируса, продукт его
взаимодействия с клеткой или специально изготовленный из них препарат.
. А.
Гельминтный - А., представляющий собой продукт обмена или распада гильминта или
специально изготовленный из них препарат.
. А.
Грибковый - А., представляющий собой компонент грибка, продукт его жизнедеятельности,
или специально изготовленный из них препарат.
. А.
Диагностический - А., применяемый для диагностики болезней путем подстановки
специфических аллергических диагностичеких проб.
. А.
Ингаляционный - А., попадающий в организм в естественных условиях через органы
дыхания.
. А.
Инфекционный - А., представляющий собой компонент возбудителя инфекционной
болезни, продукт его жизнедеятельности, или специально изготовленный из них
препарат.
. А.
Контактный - А., попадающий в организм в естественный условиях через кожу,
конъюнктиву или слизистую оболочку рта.
. А.
Лекарственный - А., представляющий собой лекарственное средство или какой либо
его компонент.
. А.
Микробный - А., представляющий собой компонент микроорганизма продукт его
жизнедеятельности, или специально изготовленный из них препарат.
. А.
Пищевой - А., представляющий собой компонент пищевого продукта, или специально
изготовленный из них препарат.
. А.
Промышленный - А., представляющий собой вещество, входящие в состав исходного,
промежуточного или конечного продукта промышленного производства.
. А.
Протозойный - А., представляющий собой компонент организма, относящегося к типу
простейших, продукт его жизнедеятельности, или специально изготовленный из них
препарат.
. А.
Профессиональный - А., с которым человек контактирует в условиях
профессиональной деятельности.
. А.
Пылевой - А., представляющий собой компонент домашней (бытовой) пыли, или специально
изготовленный из них препарат.
. Аллергенность
- способность факторов различной природы вызывать аллергию.
. Аллергиды
- общие название сыпи аллергической природы.
. Аллергическая
диагностическая проба - метод диагностики аллергических заболеваний или
болезней с аллергическим компонентом в патогенезе.
. Аллергическая
реакция - общие название клинических проявлений повышенной чувствитльности
организма к аллергенам.
. Аллергия
- состояние измененной реактивности организма в виде повышения его чувствительности
к повторным воздействием каких-либо веществ или компонентов собственных тканей.
. Аллергология
- раздел иммунологии изучающий этиологию, патогенез, клинические проявления
болезней и реакций, разрабатывающий методы их диагностики, лечения и профилактики.
. Анатомия
патологическая (anatomia pathologica; син.: морфология патологическая,
патоморфология) - медицинская наука, изучающая патологические процессы и
болезни с помощью морфологических методов исследования.
. Биотрансформация
лекарственного вещества (син. метаболизм лекарственного вещества) -
совокупность химических превращений лекарственного вещества в организме.
. Декарбоксилирование
- процесс отщепления карбоксильной группы от молекулы органических кислот, в т.
ч. аминокислот, с образованием двуокиси углерода; Д. играет важную роль в
обмене веществ, является частью механизма превращения аминокислот.
. Декарбоксилазы
- ферменты класса лиаз (КФ 4.1.1.), катализирующие реакции декарбоксилирования
кетокислот и аминокислот; участвуют в обмене веществ в организме; применяются в
лабораторной практике для количественного определения аминокислот .
. Доза
(dosis; греч. порция, доза) в фармакологии и токсикологии - количество
вещества, введенное или попавшее в организм, выражается в весовых, объемных или
условных (биологических) единицах.
. Ингибитор
(-ы) (лат. inhibeo, inhibitum сдерживать, останавливать) - общее название
веществ, подавляющих или задерживающих течение физиологических и
физико-химических (гл. обр. ферментативных) процессов.
. Патологическая
реакция - реакция организма, возникающая в ответ на действие патологических
раздражителей и приводящая к нарушению гомеостаза.
Список литературы
1. Лекарственные
препараты в России: Справочник.- М.: АстраФармСервис, 1995.- 1168 с.
. Терапевтический
справочник Вашингтонского университета: Пер. с англ./Под ред. М. Вудли, А.
Уэлан.- М.: Практика, 1995.- 832 с.
. Яковлєва
Л. В., Чікіткіна В. В., Шаповал О. М. та ін.//Вісник фармації.- 1996.- № 1-2.-
С. 47-50.
. Шустов
Е.Б., Ихалайнен А.А. БЛОКАТОРЫ H-2 -РЕЦЕПТОРОВ ГИСТАМИНА В КЛИНИЧЕСКОЙ ПРАКТИКЕ
// Фарминдекс. - 2006. - №1. С.6.
. Пат.
№012736 ЄС, C 07 D 277/18. Novel 2-guanidinothiazoline compounds, their
preparation, and their use as intermediates / Hirata, Yasufumi; Omiya-shi
Saitama (JP) - №15-107,477-1; Заявл. 07.06.83; Опубл. 19.12.84; Bulletin 84/51.
. Пат.
5856501 США, МПК6 С 07 D 277138. Synthesys of thiazole derivatives / Malcolm
Arcelio J., Wu Tse-Chong; Albemarie Corp. - №989096; заявл. 11.12.1997; Опубл.
05.01.1999; НПК 548/193.
. Пат.
5856500 США, МПК6 С 07 D 277188. Synthesys of thiazole derivatives / Matthews
Michael D., Malcolm Arcelio J.; Albemarie Corp. - №816112; Заявл. 11.03.1997;
Опубл. 05.01.1999; НПК 548/148.
. Пат.
4942243 США, Int.Cl.5 C 07 D 277/48. Process for preparing N’’-[4-[[(2-cyanoethyl)thio]methyl]-2-thiazolyl]guanidine
/ Moon G.Koh, Jai M.Shin, Don S.Kim, Choon S.Lee; Hanil Pharmaceutical Ind.,
Co., Ltd. - №179267; Заявл. 8.04.1988; Опубл. 17.07.1990.
. Пат.
389510 Венгрия, МПК4 С 07 D 277/48. VERFAHREN ZUR HERSTELLUNG VON 2-GUANIDINOTHIAZOLDERIVATEN
/ Bod Peter, Harsanyi Kalman, Agai Eva, Trischler Ferenc; Richter Gedeon
Vegyeszeti Gyar R.T. - №816112; Заявл. 20.10.87; Опубл. 27.12.89; НПК 277/87.
. Пат.
№0284536 ЄС, C 07 D 277/48. A process for the preparation of 3-(2-guanidinothiazol-4-yl-methylthio)propionitrile
/ Ballester Rodes, Palomo Nicolau, Palomo Coll; Centro Marga Para La
Investigation S.A. - №8700719; Заявл. 20.02.87; Опубл. 28.09.88; Bulletin
88/16.
. Пат.
9840367 США, МПК6 С 07 D 277/48. Guanidine derivatives of imidazoles and
thiazoles / Ramachandran Venkataraman, Malcolm Arcelio J; Albemarie Corp. -
№08/816113; Заявл. 11.03.1997; Опубл. 17.09.1998; НПК 530/80.
. Пат.
5856500 США, МПК3 С 07 D 277/40. Guanidine derivatives of imidazoles and
thiazoles / David J.Gilman, James M.Wardleworth, Tobias O.Yellin; Imperial
Chemichal Industries Ltd. - №172302; Заявл. 25.07.1980; Опубл. 31.08.1982; НПК
530/76.
. Вартанян
Р.С. Синтез основных лекарственных средств. - М.: Медицинское информационное
агенство, 2004. - 845с.
. Технологія
ліків - промислового виробництва: Підруч. для студ. вищ. фармац. навч. закл. і
фармац. ф-тів вищ. мед. навч. закл. ІІІ - ІV рівнів акредитації / Чуєшов В.І.,
Хохлові Л.М., Ляпунова О.О. та ін.;За ред. Чуєшова В.І. - Х.: Вид-во НФаУ;
Золоті сторінки, 2003. - 720 с.