Развитие химической технологии на основе синтез-газа
Санкт-Петербургский
государственный технологический институт (технический университет)
Реферат
На
тему: Развитие химической технологии на основе синтез-газа
Выполнила
Студентка Аванесян
А.Ю.
Проверил:
Доцент Громова В.В.
Санкт-Петербург
Содержание
Введение
Способы
получения синтез газа
Применение
синтез - газа
Получение
метанола
Применение
метанола
Продукты
синтеза Фишера - Тропша
Гидроформилирование
олефинов
Заключение
Список
использованной литературы
Приложение
Введение
За многие миллионы лет природа накопила
богатейшие запасы углерода в виде угля, нефти и природного газа. Сейчас эти
ископаемые используются человечеством для получения энергии и химических
продуктов. В конце прошлого - начале нынешнего века большинство продуктов органической
химии производилось из каменных углей. По мере увеличения добычи нефти
химические вещества угольного происхождения начали вытесняться продуктами
нефтехимического синтеза, производимыми более простыми и менее энергоемкими
методами. Однако оценка разведанных мировых запасов различных видов ископаемого
органического сырья приводит к выводу о том, что месторождения нефти и газа
будут в значительной степени исчерпаны уже в первые десятилетия. Поэтому очень
важно найти такое альтернативное нефти сырье для производства основных
продуктов нефтехимии.
В своей работе я бы хотела исследовать
возможность применения синтез - газа в виде альтернативного нефти сырья. И его
роль в современной химической технологии.
Способы получения синтез газа
Источники получения синтез - газа и основные
направления его использования (см. Приложение №1).
В настоящее время существует три основных
промышленных метода получения синтез - газа.
Первым способом получения синтез - газа была
газификация каменного угля, которая была осуществлена еще в 30-е годы XIX века
в Англии с целью получения горючих газов.
Процесс основан на взаимодействии угля с водяным
паром:
+ H2O ↔ H2 + CO
Эта реакция является эндотермической, равновесие
сдвигается вправо при температурах (900-10000С). Разработаны технологические
процессы, использующие парокислородное дутье, при котором наряду с упомянутой
реакцией протекает экзотермическая реакция сгорания угля, обеспечивающая нужный
тепловой баланс:
+ 1/2O2 → CO
Второй способ это конверсия метана. Эта реакция
взаимодействия метана с водяным паром проводится в присутствии никелевых
катализаторов (Ni - Al2O3) при повышенных температурах (800-9000С) и давлении:
+ H2O → CO + 3H2
В качестве сырья вместо метана может быть
использовано любое углеводородное сырье.
И третий способ это парциальное окисление
углеводородов. Процесс заключается в неполном термическом окислении
углеводородов при температурах выше 13000C.
n+2 +1/2nO2 → nCO + (n + 1)H2
Способ применим к любому углеводородному сырью,
но наиболее часто в промышленности используют высококипящую фракцию нефти -
мазут.
Соотношение СО : Н2 существенно зависит от
применяемого способа получения синтез-газа. При газификации угля и парциальном
окислении это соотношение близко к 1 : 1, тогда как при конверсии метана
соотношение СО : Н2 составляет 1 : 3. В настоящее время разрабатываются проекты
подземной газификации, то есть газификации угля непосредственно в пласте.
Интересно, что эта идея была высказана Д.И. Менделеевым более 100 лет назад. В
перспективе синтез-газ будут получать газификацией не только угля, но и других
источников углерода вплоть до городских и сельскохозяйственных отходов.
Применение синтез - газа
Синтез-газ служит исходным сырьем для
производства многих химических и нефтехимических продуктов, таких как метанол и
другие оксигенаты, продукты синтеза Фишера-Тропша, а также используется для
восстановления железной руды (см. Приложение №2).
Получение метанола
Метанол, один из основных продуктов
многотоннажной химии, широко используется для получения множества ценных
химических веществ: формальдегида, сложных эфиров, аминов, растворителей,
уксусной кислоты. Мировое производство метанола превышает 20 млн. т в год, и
спрос на него постоянно растет, что связано с наметившейся тенденцией
использовать метанол в новых областях, например для получения высокооктановых
бензинов, топлива для электростанций, как сырья для синтеза белка и т.д.
С этапами изучения химии метанола связаны имена
величайших химиков. Впервые метанол был обнаружен еще в середине XVII века
Робертом Бойлем при изучении продуктов перегонки дерева, однако в чистом виде
метиловый спирт, или древесный, получаемый этим способом, был выделен только
через 200 лет: тогда впервые удалось очистить его от примесей сопутствующих
веществ, прежде всего уксусной кислоты и ацетона. В 1857 году Марселен Бертло
получил метанол омылением хлористого метила. Процесс сухой перегонки древесины
долгое время оставался, пожалуй, единственным способом производства метанола.
Сейчас он полностью вытеснен каталитическим синтезом из оксида углерода и
водорода. Получение метанола из синтез - газа впервые было осуществлено в
Германии в 1923 году фирмой BASF. Процесс проводился под давлением 100-300 атм.
на оксидных цинк-хромовых катализаторах (ZnO-Cr2O3) в интервале температур
320-4000С, производительность первой промышленной установки доходила до 20
т/сутки. Интересно, что в 1927 году в США был реализован промышленный синтез
метанола, основанный не только на монооксиде, но и на диоксиде углерода. В
настоящее время в результате развития и усовершенствования процесса получения
метанола из синтез - газа используются реакторы большой мощности с
производительностью до 2000 т метанола в сутки. Разработаны более активные
катализаторы на основе оксидов цинка и меди, которые позволили смягчить условия
синтеза - снизить давление до 50-100 атм., а температуру - до 2500C.
Суммарная реакция образования метанола:
CO + 2H2 ↔ CH3OH
является сильно экзотермичной. Поскольку реакция
протекает с уменьшением объема, повышение давления способствует увеличению
конверсии синтез - газа.
Было предложено несколько механизмов образования
метанола. Один из них предполагает ряд последовательных стадий гидрирования
хемосорбированного на катализаторе монооксида углерода, при этом образуются
промежуточные поверхностные соединения:
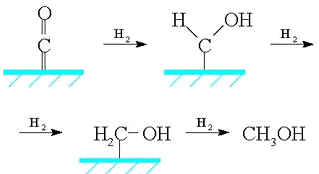
Второй механизм предполагает образование
поверхностного гидрида, внедрение монооксида углерода в связь металл-водород с
образованием поверхностного формильного производного, дальнейшее гидрирование
которого приводит к образованию гидроксиметиленового производного, аналогичного
приведенному в предыдущей схеме:
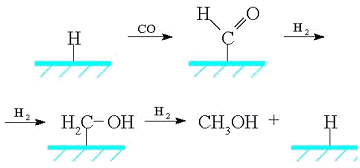
Согласно третьему механизму, СО внедряется в
поверхностный гидроксил, при этом образуются промежуточные соединения,
связанные с поверхностью катализатора через кислородный мостик. Последующее
гидрирование образующегося формиата и дегидратация приводят к метанолу:
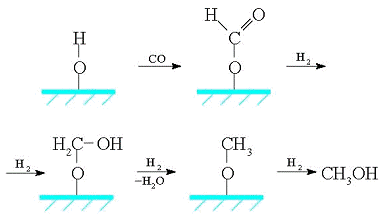
Следует отметить еще один экспериментально обоснованный
механизм синтеза (А.Я. Розовский), согласно которому метанол образуется при
восстановлении диоксида углерода. Монооксид углерода является лишь источником
CO2:
+ H2O = CO2 + H2+ 3H2 = CH3OH + H2O
Как и во многих других случаях, однозначное
установление истинных механизмов химических реакций представляет значительную
трудность, и до сих пор в синтезе метанола имеются неразгаданные моменты.
Применение метанола
Химическая промышленность.
В данной индустрии метанол или метиловый спирт
применяется как полупродукт большинства промышленных синтезов. Метанол вступает
в реакцию со многими органическими соединениями, что позволяет производить на
его основе различные органические вещества и полимеры. Наибольшее количество
метанола (~ 50 %) уходит на производство формальдегида. Метанол является
метилирующим агентом при производстве таких веществ как: метилметакрилат,
диметилтерефталат, некоторые виды пестицидов. Метиловый спирт - это сырье для
получения таких продуктов как метиламин (~ 9 % от всего выпускаемого метанола),
уротропин, пентаэритрит. Он используют в производстве фотопленки, карбамидных,
ионообменных, поливинилхлоридных смол, как растворитель в лакокрасочной
промышленности. Большим спросом метанол стал пользоваться на аммиачных
установках. Метиловый спирт применяется также для производства лекарственных
средств, его добавляют к топливу, метанол может использоваться как топливо на
электростанциях, выступать в роли заменителя бензина для автомобилей или
применяться в смеси с бензином, метиловый спирт входит в состав ряда
антифризов, там, где позволяют требования безопасности. В настоящее время
метанол применяется в производстве метил-третбутилового эфира - МТБЭ,
являющегося одной из широко применяемых октано-повышающих присадок к бензинам.
Метиловый спирт востребован и в производствах лекарственных средств. Он
используется для получения таких химикатов как карбофос, хлорофос, бромистого и
хлористого метила.
Нефтеперерабатывающая промышленность.
В данной отрасли метанол востребован как
селективный растворитель, который применятся для очистки бензина от
меркаптанов. Метанол является азеотропным реагентом для выделения толуола в
процессах его ректификации. Используется метиловый спирт в смеси с
этиленгликолем для экстракции толуола из бензина.
Прочие отрасли промышленности.
В других отраслях химической промышленности без
метилового спирта не обходится производство уксусной кислоты, карбамидных смол,
синтетических каучуков (~ 11% от общего объема). Метиловый спирт широко
используется для очистки от вредных соединений азота, который содержится в
сточных водах. Многими предприятиями ведутся исследования в области применения
метанола как источника энергии, в качестве газового топлива, моторного топлива
и как составляющего компонента автомобильного бензина. Автомобильный бензин
благодаря добавке метанола обладает улучшенными антидетонационными свойствами,
в результате добавления метанола повышается КПД двигателя, а также происходит
снижение выбросов вредных веществ выхлопных газов.
В перспективе использование метанола возможно в
различных химических генераторах электрической энергии (как носителя
кислорода). Это направление только разрабатывается, и его разработка и
внедрение технологий такого рода использования метанола следует ожидать на
протяжении ближайших трех десятилетий. Но в тоже время полученные на сегодня
опыты, результаты, научные разработки по использованию метанола, по мнению
ученых, с уверенностью дают понять, что метанол - это топливо будущего.
Продукты синтеза Фишера - Тропша
Синтез Фишера-Тропша может рассматриваться как
реакция восстановительной олигомеризации монооксида углерода, при которой
образуются углерод - углеродные связи, и в общем виде она представляет собой
сложную комбинацию ряда гетерогенных реакций, которую можно представить
суммарными уравнениями:
nCO + 2nH2 = (CH2)n + nH2O,
nCO + nH2 = (CH2)n + nCO2 .
Продуктами реакции являются алканы, алкены и
кислородсодержащие соединения, то есть образуется сложная смесь продуктов,
характерная для реакции полимеризации. Первичными продуктами синтеза
Фишера-Тропша являются α- и β-
олефины,
которые превращаются в алканы в результате последующего гидрирования. Природа
применяемого катализатора, температура, соотношение СО и Н2 существенно
сказываются на распределении продуктов. Так, при использовании железных
катализаторов велика доля олефинов, тогда как в случае кобальтовых
катализаторов, обладающих гидрирующей активностью, преимущественно образуются
насыщенные углеводороды. В настоящее время в качестве катализаторов синтеза
Фишера-Тропша в зависимости от поставленных задач:
повышение выхода бензиновой фракции
увеличение выхода низших олефинов и др.
используются как высокодисперсные железные
катализаторы, нанесенные на оксиды алюминия, кремния и магния, так и
биметаллические катализаторы:
железо-молибденовые и др.
За 70 лет с момента открытия синтеза не утихают
споры по поводу механизма реакции. В настоящее время рассматриваются три
различных механизма:
Первый механизм, называемый карбидным, впервые
предложенный Фишером и Тропшем и в дальнейшем нашедший поддержку у других
исследователей, предполагает образование С-С-связей в результате олигомеризации
метиленовых фрагментов на поверхности катализатора. На первой стадии происходит
адсорбция СО и образуется поверхностный карбид, а кислород превращается в воду
или СО2:
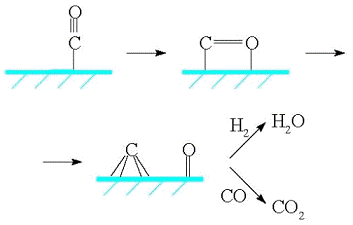
На второй стадии поверхностный карбид
гидрируется с образованием фрагментов СНx (х = 1-3):
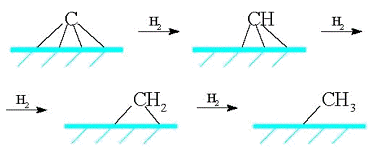
Удлинение цепи происходит в результате реакции
поверхностных метила и метилена и далее путем внедрения метиленовых групп идет
рост цепи:
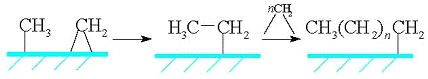
Стадия обрыва цепи происходит в результате десорбции
алкена с поверхности катализатора:
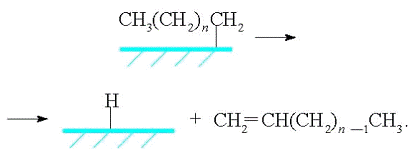
Второй механизм, названный гидроксикарбеновым,
предполагает также гидрирование координированного на металле СО с образованием
поверхностных гидроксикарбеновых фрагментов, в результате конденсации которых и
происходит образование С-С-связей:
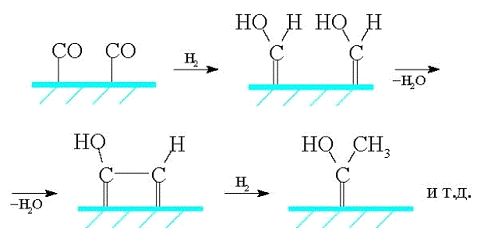
Третий механизм, который можно назвать
механизмом внедрения, предполагает образование С-С-связей в результате
внедрения СО по связи металл-углерод:
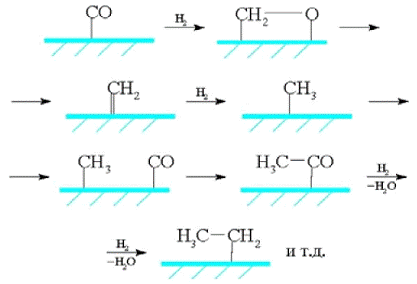
Накоплен достаточно богатый экспериментальный
материал, свидетельствующий в пользу того или иного варианта механизма, однако
приходится констатировать факт, что к настоящему моменту невозможно сделать
однозначный выбор между ними. Можно предположить, что в связи с большой
важностью синтеза Фишера-Тропша исследования в этом направлении будут
интенсивно продолжаться, и мы станем свидетелями новых воззрений на механизмы
протекающих реакций.
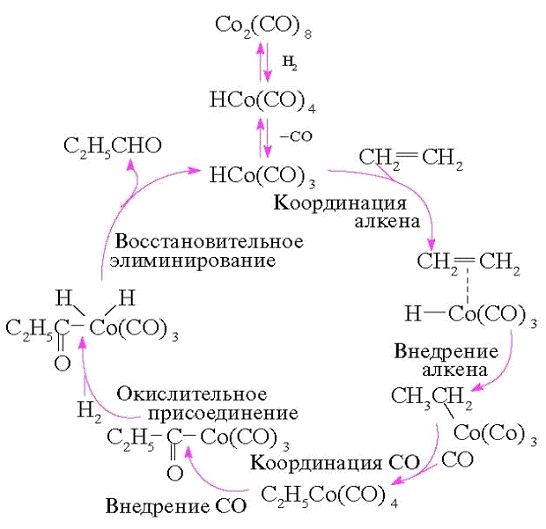
Гидроформилирование олефинов
Одним из наиболее важных примеров промышленных
процессов с участием синтез-газа является реакция гидроформилирования
(оксо-синтез). В 1938 году Релен, исследуя механизм синтеза Фишера-Тропша,
открыл эту замечательную реакцию, значение которой трудно переоценить. В этом
процессе алкены в присутствии катализаторов, главным образом кобальтовых или
родиевых, при давлениях свыше 100 атм. и температурах 140-180°C взаимодействуют
с синтез-газом и превращаются в альдегиды - важнейшие полупродукты в
производстве спиртов, карбоновых кислот, аминов, многоатомных спиртов и др. В
результате реакции гидроформилирования получаются альдегиды с прямой и
разветвленной цепью, содержащие на один атом углерода больше, чем в исходной
молекуле:
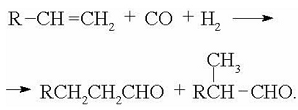
Наиболее ценными являются нормальные альдегиды,
тогда как альдегиды изо-строения можно рассматривать как нежелательные побочные
продукты. Мировое производство альдегидов по процессу гидроформилирования
достигает 7 млн. т. в год, при этом около половины приходится на н-масляный
альдегид, из которого получают н-бутиловый спирт. Альдольной конденсацией с
последующим гидрированием получают 2-этилгексанол, используемый для
производства пластификаторов поливинилхлорида.
В качестве катализаторов гидроформилирования
наиболее широко используются карбонилы кобальта, в последнее время описано
применение родиевых катализаторов, которые позволяют проводить процесс в более
мягких условиях.
Механизм гидроформилирования можно наглядно
представить в виде каталитического цикла (см. Приложение №3).
Заключение
Процесс освоения производства альтернативных
видов топлива начался еще в предвоенной Германии. Она была лишена доступа к
нефтяным источникам, вследствие чего назревал жесткий дефицит топлива,
необходимого для функционирования мощной военной техники. Располагая
значительными запасами ископаемого угля, Германия была вынуждена искать пути
его превращения в жидкое топливо. Эта проблема была успешно решена усилиями
превосходных химиков, из которых, прежде всего, следует упомянуть Франца Фишера
и Ганса Тропша. При получении жидкого топлива на основе синтеза Фишера - Тропша
разнообразные соединения углерода (природный газ, каменный и бурый уголь,
тяжелые фракции нефти, отходы деревообработки) конвертируют в синтез-газ (смесь
СО и Н2), а затем он превращается в синтетическую «сырую нефть» - синтнефть.
Из всего выше сказанного можно сделать вывод,
что роль синтез - газа в химической технологии неоспоримо велика. Из него можно
получить основные продукты нефтехимии и для этого не придется использовать
нефть, запасов которой осталось не так много, и природный газ. Также за
последние годы в исследованиях в области синтезов на основе СО и Н2 достигнуты
впечатляющие успехи.
Список использованной литературы
Караханов
Э. А. «Что такое нефтехимия» Соросовский Образовательный журнал. 1996. № 2. С.
65─73.
Кузнецов
Б. Н. «Новые подходы в химической переработке углей» Соросовский
Образовательный Журнал. 1996. № 6. С. 50─58.
«Новая
иллюстрированная энциклопедия», М., ООО «Мир Книги», Научное издательство
«Большая российская энциклопедия» 2005г.
Шелдон
Р. А. «Химические продукты на основе синтез - газа», Пер. с англ. М.: Химия,
1987г.
Шиллинг
Г.-Д., Бонн Б., Краус У. «Газификация угля» / Пер. с нем. и ред. С. Р. Исламова
- МЖ «Недра», 1986г.
Караваев
М.М., Леонов Е.В., Попов И.Г., Шепелев Е.Т. «Технология синтетического
метанола», М., 1984г.
Приложение №1
Источники получения синтез - газа и основные
направления его использования
т
Приложение №2
Потребность в синтез - газе для мирового
производства основных нефтехимических продуктов
|
Продукт
|
Требуемое
соотношение H2/CO, моль/моль
|
Объем
производства, т/год
|
Потребность
в синтез - газе, м3/ч (н.у.)
|
|
Метанол
|
2:1
|
160000-1275000
|
48000-1900000
|
|
Уксусная
кислота
|
0:1
|
275000-545000
|
18000-36000
|
|
Уксусный
ангидрид
|
0:1
|
90000
|
3500
|
|
Продукты
оксосинтеза
|
2:1
|
115000-275000
|
12000-25000
|
|
Фосген
|
0:1
|
45000-160000
|
3500-12000
|
|
Муравьиная
кислота
|
0:1
|
45000
|
3500
|
|
Метилформиат
|
0:1
|
9000
|
600
|
|
Пропионовая
кислота
|
45000-68000
|
2400-3500
|
|
Метилметакрилат
|
1:1
|
45000
|
4700
|
|
1,4-бутандиол
|
2:1
|
45000
|
4700
|
Приложение №3
синтез газ метанол
гидроформилирование
Механизм гидроформилирования