|
Связь
|
Энергия, кДж/моль
|
Связь
|
Энергия, кДж/моль
|
|
C-H
|
414
|
O-H
|
460
|
|
C-C
|
339
|
N-H
|
389
|
|
C=C
|
611
|
N-N
|
163
|
|
CºC
|
833
|
C-Cl
|
326
|
|
C-O
|
360
|
C-Br
|
272
|
|
C=O
|
749
|
C-J
|
238
|
|
C-N
|
305
|
O-O
|
146
|
|
C=N
|
594
|
-H…O= (водородная)
|
-21
|
|
CºN
|
887
|
-H…Nº (водородная)
|
-8
|
|
O=O
|
498
|
|
|
Ковалентная связь
Ковалентной связью называется
химическая связь, осуществляемая за счет одной или нескольких электронных пар,
сильно взаимодействующих с ядрами обоих связываемых атомов. Если связаны два
одинаковых атома, то пара электронов в одинаковой степени принадлежит обоим
атомам (неполярная ковалентная связь).
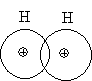
Атомы разных элементов,
обладая неодинаковой электроотрицательностью, образуют полярную ковалентную
связь, в которой обобществленная электронная пара смещена в сторону более
электроотрицательного атома. Такая связь является промежуточным случаем между
неполярной ковалентной связью и ионной связью.
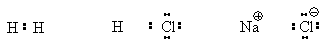
При образовании
ковалентной связи происходит слияние атомных орбиталей и образование
молекулярных электронных орбиталей, электроны которых принадлежат обоим ядрам
связываемых атомов а электронная плотность локализована в межядерном
пространстве. В зависимости от характера распределения электронной плотности в
молекуле различают s- и p-молекулярные орбитали.
Молекулярная орбиталь
(МО), в которой максимум электронной плотности располагается на прямой,
соединяющей ядра атомов, называется s-МО. Такие орбитали возникают при слиянии
s-s- и s-p-, p-p-орбиталей а также гибридных орбиталей.
Молекулярная орбиталь,
возникающая в результате бокового перекрывания p-орбиталей взаимодействующих
атомов так, что ее максимальная электронная плотность сосредоточена вне прямой,
соединяющей ядра атомов, называется p-МО.
Ковалентные связи,
движение общих электронных пар которых описывается s- и p-молекулярными
орбиталями, называются соответственно s- и p-связями. s-Связи прочнее, чем
p-связи, так как электронная пара в них находится ближе к ядрам атомов и
сильнее взаимодействует с ними.
Любая химическая связь
характеризуется длиной и энергией.
Формулы Льюиса
Льюис предложил
представлять атом в виде «остова» и внешних электронов; остов состоит из ядра и
внутренних электронов и в ходе химических превращений остается без изменений. В
химических реакциях участвуют внешние (валентные) электроны. Стабильной
считается комбинация из восьми электронов. Исключение составляет водород - в
нем два электрона.
3. Свойства
ковалентной связи
Кратность ковалентной
связи характеризуется количеством электронных пар между соединяемыми атомами. С
увеличением кратности связи уменьшается ее длина и повышается суммарная
прочность.
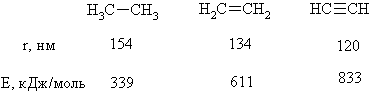
Как видно, Es > Ep
Насыщаемость
Каждый атом может
образовать по обменному механизму такое количество связей, сколько неспаренных
электронов он имеет на валентном уровне.
Направленность
Атомные орбитали имеют
разную форму и различную ориентацию в пространстве. При образовании ковалентной
связи может происходить гибридизация атомных орбиталей.
Гибридизацией называется
гипотетический процесс смешения различного типа, но близких по энергии атомных
орбиталей атома с образованием того же числа новых (гибридных) орбиталей,
одинаковых по форме и энергии.
В органических молекулах
наблюдается гибридизация трех видов: sp3, sp2, sp.
Идея гибридизации
атомных орбиталей позволяет наглядно объяснить структуру молекулы путем
комбинации атомных орбиталей.
Полярность
Полярная ковалентная
связь образуется между атомами разных элементов, отличающихся
электроотрицательностью. Электронная плотность оказывается смещенной к более
электроотрицательному элементу. Такие молекулы называются диполями. В
двухатомных молекулах величина дипольного момента связи является мерой
полярности молекул в целом. Для много атомных молекул дипольный момент равен
векторной сумме дипольных моментов отдельных связей.HCl = 1,0D, mH2O
= 1,86D
Поляризуемость
Наряду с полярностью,
ковалентная связь обладает способностью поляризоваться под влиянием внешних
электромагнитных полей, что выражается в изменении ее дипольного момента и
может быть причиной электролитической диссоциации. В качестве внешнего поля
может выступать поле соседней молекулы или иона. Поляризуемость молекулы
зависит от подвижности общей электронной пары и связана с поляризуемостью
образующих ее атомов. Чем больше размер частицы и чем большим количеством
электронов она обладает, тем выше поляризуемость (mHF = 1,5D; mHI
= 0,4D, но при этом в воде HI диссоциирует легче, чем HF).
Механизмы возникновения
ковалентной связи. Известно два механизма: обменный и донорно-акцепторный.
При обменном механизме в
образовании связи оба атома поставляют на молекулярную орбиталь один электрон и
одну атомную орбиталь.
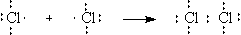
При донорно-акцепторном
механизме один атом поставляет пару электронов на заселенной атомной орбитали
другому атому, который поставляет свободную атомную орбиталь.
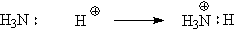
Близкими по характеру к
донорно-акцепторным связям находятся связи в координационных соединениях.
Однако они менее прочны, т.к. электроны передаются не полностью. Такие связи
называют семиполярными.
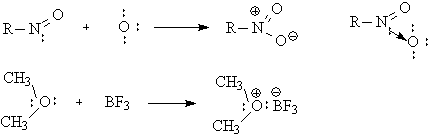
В органической химии
большое значение играют соединения с семиполярной связью, где в качестве
доноров электронов выступают заполненные p-орбитали.
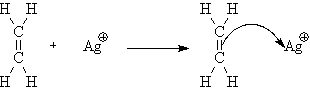
4. Ионная связь
Если в ходе реакции один
из атомов отдает свой электрон другому атому, то образуются две противоположно
заряженные частицы.
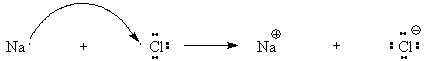
Химическая связь, для которой
характерно сильное взаимодействие общей электронной пары с ядром только одного
из соединяемых атомов, что приводит к образованию противоположно заряженных
ионов, которые электростатически притягиваются друг к другу, называется ионной
связью. В ионных соединениях молекулы в строгом понимании этого слова
отсутствуют и сами ионы располагаются в узлах кристаллической решетки. Таким
образом, каждый ион натрия в нашем примере оказывается одновременно связанным с
шестью ионами хлора.
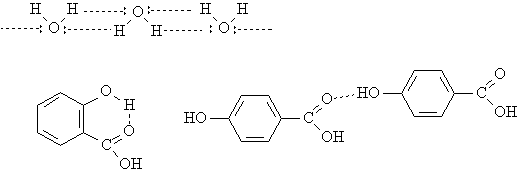
5. Водородная связь
В тех случаях, когда
атом водорода связан полярной ковалентной связью (активный атом), он может
проявлять остаточное сродство к электрону и за счет этого образовывать
дополнительную связь с теми атомами, которые имеют неподеленные электронные
пары. Образование водородной связи обусловлено тем, что атом водорода может
близко подходить к неподеленным электронным парам других атомов, потому что он
имеет малые размеры и слабо экранирован. Водородная связь бывает
межмолекулярной и внутримолекулярной.
6. Способы разрыва
химической связи
Двухэлектронная связь
может быть разорвана двумя способами: гетеролитическим и гомолитическим. При
гетеролизе связи пара электронов остается с одним из бывших партнеров, при этом
возникает два иона: катион и анион. При этом в случае разрыва связи С-Х
соединения R3C-X возможны несколько вариантов:
. При гетеролитическом
разрыве связи Х превращается в положительно заряженную частицу. Тогда
органический остаток, приобретя лишний электрон, становится карбанионом
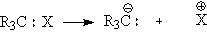
2. При гетеролитическом
разрыве связи Х уносит с собой электронную пару и R3C становится
обладателем вакантной орбитали и положительного заряда - карбкатион
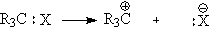
. Гомолиз связи приводит
к образованию двух нейтральных частиц, каждая из которых обладает неспаренным
электроном. Такие частица в органической химии называются радикалами. В
неорганической химии неспаренными электронами обладают атомы водорода,
галогенов.
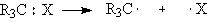
Реакционные частицы
могут быть выделены в редких случаях, но строение продуктов реакции является
свидетельством их участия в реакционных актах.
Карбанионы
Центральный атом
углерода в карбанионах предельного ряда сохраняет sp3-гибридизацию.
Электронная пара заселяет вакантную орбиталь и может легко претерпевать
инверсию. Карбанионы винильного типа сохраняют sp2-гибридизацию и
существуют в цис- и транс-конфигурации.

Карбанионы образуются при
ионизации металлоорганических соединений и при действии сильных оснований на
кислые С-Н-группы.
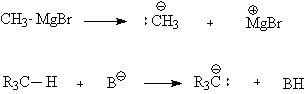
Их устойчивость и,
соответственно, легкость образования зависят от гибридного состояния атома
углерода
Карбанион (рКа
для сопряженной кислоты): R3C: - (40); H2C=CH:
- (36); HCºC: - (25).
а также от характера
соседних групп: группы с сильным - I-эффектом повышают устойчивость
карбанионов, оттягивая электронную пару:
(CF3)3C:
- pKa = 7; NºC: - pKa = 11
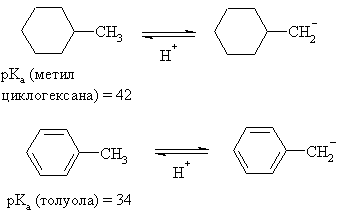
Группы, способные делокализовать
электронную пару, также стабилизируют карбанионы:
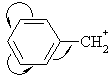
Карбкатионы
Геометрия карбкатионов
соответствует плоскому атому углерода, имеющему вакантную орбиталь
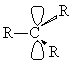
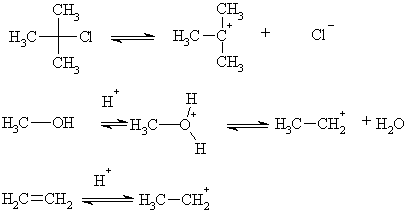
Образование карбкатионов
происходит в результате ионизации соединений содержащих группу с сильным -
I-эффектом под действием полярных сред, кислот Льюиса, а также при
присоединении протона к этиленовой связи, или координации на карбонильный
кислород и т.д.
Стабилизации
карбкатионов способствуют соседние группы, обладающие положительным индуктивным
и мезомерным эффектом.
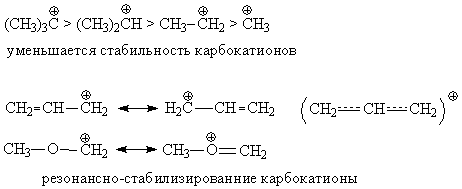
Наиболее эффективная
стабилизация наблюдается при делокализации p-электронов посредством
ароматической системы
Свободные радикалы
Геометрия радикалов, как
и карбанионов, пирамидальная и может легко претерпевать инверсию.
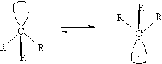
Для получения радикалов
применяют термолиз или фотолиз.
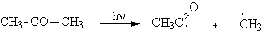
Другой способ генерации
радикалов - одноэлектронное восстановление катионов диазония
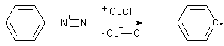
Факторы, повышающие
устойчивость свободных радикалов индуктивный, мезомерный эффекты, сопряжение
p-электронов.
. Электронные
эффекты
Индуктивным эффектом
называют смещение электронов s-связи (полярность связи). Он определяется
разницей электроотрицательностей связываемых атомов элементов. Если атом или
группа атомов оттягивает электронную плотность, она проявляет отрицательный
индуктивный эффект. В результате на атоме углерода наводится частичный
положительный заряд (-I-эффект). Напротив, атомы более электроположительных,
чем углерод элементов проявляют положительный индуктивный эффект (+I-эффект),
благодаря которому на С-атоме возникает частичный отрицательный заряд.
Индуктивный эффект
вызывает поляризацию молекул и появление дипольного момента m = d ·
l, который измеряется в кулон-метрах (Кл·м) или в дебаях (Д) 1Д=3,4·10-30
Кл·м. Дипольный момент - величина векторная.
По углеродной цепи
индуктивный эффект передается плохо, он быстро затухает:
|
Кислота
|
рКа
|
|
масляная кислота
|
4,8
|
|
a-Хлормасляная кислота
|
2,9
|
|
b-Хлормасляная кислота
|
4,1
|
|
g-Хлормасляная кислота
|
4,6
|
Индуктивный эффект аддитивен:
|
Кислота
|
рКа
|
|
Уксусная
|
4,7
|
|
Хлоруксусная
|
2,8
|
|
Дихлоруксусная
|
1,6
|
|
Трихлоруксусная
|
0,7
|
Мезомерный эффект. Эффект
перераспределения электронной плотности в молекуле, происходящий с участием
p-орбиталей, называется мезомерным эффектом. Он может быть положительным, если
атом (группа атомов) повышает электронную плотность на реакционном центре
(+М-эффект).
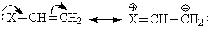
В противоположном случае
эффект отрицателен (-М-эффект).
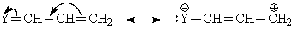
Индуктивный и мезомерный
эффекты действуют в нереагирующей молекуле. При поляризации молекулы в
реакционном акте эффекты называются индуктомерный (±ID) и
электромерный (±Е) и характеризуют поляризуемость молекулы.
Резонанс
Структурные формулы не
отражают распределение электронной плотности. Поэтому была придумана теория
резонанса, согласно которой состояние молекулы может быть описано набором
структур, в которых атомы остаются на своих местах, а электроны смещаются в
крайние положения (резонансные структуры). Реальная молекула представляет собой
гибрид резонансных структур. Чем большим числом неразличимых структур
описывается молекула, тем она стабильнее.
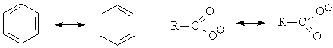
Резонанс не является
физическим явлением. Это - лишь один из способов приблизить изображения
химических структур к выражению их реального состояния.
. Кислоты и
основания
Бренстед и Лоури (1923)
сформулировали общую протолитическую теорию кислот и оснований.
Кислота - молекула или ион,
способные отдавать протон.
Основание - молекула или ион,
способные присоединять протон. Основание - акцептор протонов.
Кислота, отдавая протон,
превращается в сопряженное основание. Основание, присоединяя протон,
превращается в сопряженную кислоту. Эти пары частиц называют сопряженными
кислотно-основными парами. Чем сильнее кислота, тем слабее сопряженное
основание и наоборот.
Существуют амфолиты - молекулы или
ионы, способные как отдавать, так и присоединять протон, и, следовательно,
проявляют свойства кислот и оснований (вода, аминокислоты).
Протолитическое, или
кислотно-основное, равновесие устанавливается в результате конкуренции за
протон между основаниями взаимодействующих сопряженных кислотно-основных пар.
Протолитическое равновесие всегда смещается в сторону образования более слабой
кислоты.
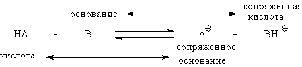
Протолитическое
равновесие наблюдается при ионизации слабых электролитов в воде. Анион слабой
кислоты и вода, как слабое основание, конкурируют за протон. Это - обратимый
процесс и он характеризуется константой равновесия Ка:

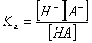
Литература
углерод химический
ковалентный кислота
1. Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. -
М.: Бином, лаборатория базовых знаний, 2004.
2. Названова Г.Ф. Введение в практикум по органической химии:
Учебное пособие. Самара: Изд-во «Самарский университет», 2002.
. Данилин А.А., Названова Г.Ф. Лабораторный практикум по
органической химии. Учебное пособие. Самара: Изд-во «Самарский университет»,
2003.
. Названова Г.Ф. Нитрование ароматических соединений.
Методические указания к лабораторным работам по курсу «Органическая химия».
Самара: Изд-во «Самарский университет», 2001.
. Названова Г.Ф. Очистка и идентификация органических
соединений. Часть 1. Перегонка. Методические указания. Самара: Изд-во
«Универс-групп», 2005.
. Вишняков В.В., Зайцев В.В., Потапова И.А., Пурыгин П.П.
Основы стереохимии. Учебное пособие. Самара: Изд-во «Самарский университет»,
2005. - 36 с.