Использование топологических индексов в химии
МИНОБРНАУКИ
РОССИИ
Федеральное
государственное бюджетное образовательное учреждение высшего профессионального
образования
«Тверской
государственный технический университет»
Кафедра
биотехнологии и химии
Реферат
на тему:
ИСПОЛЬЗОВАНИЕ ТОПОЛОГИЧЕСКИХ ИНДЕКСОВ В ХИМИИ
Выполнила: Ткачева А.И.
Проверил: Косивцов Ю.Ю.
Тверь 2013
Содержание
Введение
. Графическое
представление молекул и их свойств - теория графов в химии
. Методы
расчета топологических индексов
. Применение
топологических индексов
Заключение
Список
литературы
Введение
Важной проблемой в современной теоретической химии является определение
свойств химических соединений исходя из их молекулярной структуры. Как
известно, все свойства молекулы закодированы в ее структуре, а нахождение
количественного соотношения ”структура - свойство” часто помогает наилучшим
образом расшифровать их. Это помогает понять, как структура влияет на свойства
соединений, на их способность вступать в различного рода взаимодействия.
Повышенный интерес к проблеме ”структура - свойство” обусловлен наличием
большого количества синтезированных к настоящему времени веществ, а также
широкого спектра возможностей их применения. Решение данной задачи, даже в
рамках одного класса соединений, позволит прогнозировать свойства
гипотетических молекул, вести синтез новых соединений с заданными
свойствами[1]. Для нахождения взаимосвязи между структурой и свойством
используются различные методы математического моделирования, выбор которых
зависит от природы исследуемых химических соединений, анализируемых свойств.
Среди этих методов особое место занимают топологические подходы, использующие
только информацию, содержащуюся в структурной формуле исследуемого соединения
[1]. В таких подходах химическую структурную формулу представляют молекулярным
графом, вершины которого соответствуют атомам (ядрам), а ребра -химическим
связям молекулы. При этом, как правило, рассматриваются только скелетные атомы
(атомы водорода обычно не включаются в граф) и связи между ними. Каждый молекулярный
граф можно представить либо матрицей, либо полиномом, либо числовым индексом
[2]. Представление структурной формулы в виде числового значения, часто
называемого топологическим индексом , может осуществляться несколькими
способами [3-5]. Наиболее часто применяется построение матрицы смежности A(G) и
матрицы расстояний D(G) на графе. Топологические индексы (структурные
дескрипторы) включают информацию о размере и форме молекулы, о соединении
атомов и структурных групп в ней и их взаимном расположении. Кроме того, с их
помощью можно учитывать особенности электронного и пространственного строения
молекул, выбирая соответствующим образом веса вершин и ребер молекулярного
графа.
В настоящее время топологические индексы используются для кодирования
химической информации, оценки реакционной способности молекул, при планировании
химического эксперимента, для количественного описания химических структур при
анализе связи между структурой молекулы, ее свойствами, а также активностью.
Способность различать очень близкие по строению и составу соединения делает
топологические индексы одними из наиболее распространенных молекулярных
дескрипторов в корреляционном анализе. Их преимущество состоит в том, что они
не требуют сложных экспериментальных определений или квантово-химических
расчетов, а вычисляются непосредственно из структурной формулы соединений. Это
особенно важно, когда речь идет об оценке свойств гипотетических структур, для
которых нет никаких данных. Однако имеется и очевидный недостаток - учитываются
не все особенности молекулярного строения. Топологическим индексам трудно дать
физико-химическую интерпретацию, поскольку их значения получают путем
формальных операций над графами. Тем не менее, корреляционные соотношения,
полученные с их помощью, даже без достаточно ясного физического смысла, могут
оказаться полезными в решении различных практических вопросов [6]. Существует
точка зрения [7], что нет необходимости какой-либо физической или
физико-химической интерпретации топологических (или графово-теоретических)
индексов, так как они являются математическими абстракциями, но в то же время
должна существовать связь между топологией молекулы и физико-химическими
свойствами соединения.
1. Графическое представление молекул и их свойств -
теория графов в химии
Изучение связи свойств веществ с их строением - одна из основных задач
химии. Большой вклад в ее решение внесла структурная теория органических
соединений, в число создателей которой входит великий российский химик
Александр Михайлович Бутлеров (1828-1886). Именно он первым установил, что
свойства вещества зависят не только от его состава (молекулярной формулы), но и
от того, в каком порядке связаны между собой атомы в молекуле. Такой порядок
назвали «химическим строением». Бутлеров предсказал, что составу C4H10
могут соответствовать два вещества, имеющие разное строение - бутан и изобутан,
и подтвердил это, синтезировав последнее вещество[8].
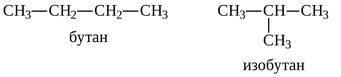

Атомы водорода в таких графах не указываются, так как их расположение
можно однозначно установить по структуре углеродного скелета. Напомним, что
углерод в органических соединениях четырехвалентен, поэтому в соответствующих
графах от каждой вершины может отходить не более четырех ребер[11].
Графы - это математические объекты, поэтому их можно характеризовать с
помощью чисел. Отсюда появилась идея выражать строение молекул числами, которые
связаны со структурой молекулярных графов. Эти числа в химии называют
«топологическими индексами». Рассчитав какой-либо топологический индекс для
большого числа молекул, можно установить связь между его значениями и
свойствами веществ, и затем использовать эту связь для предсказания свойств
новых, еще не синтезированных веществ [11]. К настоящему моменту химиками и
математиками предложены сотни разнообразных индексов, характеризующих те или
иные свойства молекул.
2. Методы расчета топологических индексов
Способы расчета топологических индексов могут быть самыми разнообразными,
но все они должны удовлетворять вполне естественным требованиям:
) каждой молекуле соответствует свой, индивидуальный индекс;
)близкие по свойствам молекулы имеют похожие индексы.
Посмотрим, как реализуется эта идея на примере предельных углеводородов -
алканов. Ключевым для построения многих индексов служит понятие «матрицы
расстояний» D[3]. Так называют матрицу, элементы которой показывают число
ребер, разделяющих соответствующие вершины молекулярного графа. Построим эту
матрицу для трех изомерных углеводородов состава C5H12.
Для этого изобразим их молекулярные графы и перенумеруем вершины (в
произвольном порядке):
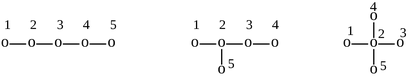
Диагональные элементы матрицы расстояний для углеводородов равны 0. В
первом графе вершина 1 связана с вершиной 2 одним ребром, поэтому элемент
матрицы d12 = 1. Аналогично, d13 = 2, d14 = 3,
d15 = 4. Первая строка в матрице расстояний нормального пентана
имеет вид: (0 1 2 3 4). Полные матрицы расстояний для трех графов:
молекула
химия топологический индекс
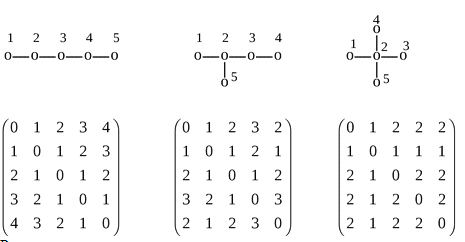
Расстояние между вершинами не зависит от порядка их перечисления, поэтому
матрицы расстояний симметричны относительно диагонали.
Первый топологический индекс, отражающий структуру молекулярного графа
(G), был предложен в 1947 г. Винером [3]. Он определяется как сумма
диагональных элементов матрицы расстояний плюс полусумма ее недиагональных
элементов:
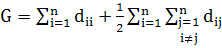 (1)
(1)
Для указанных выше графов, соответствующих пентанам C5H12,
индекс Винера принимает значения 20, 18 и 16. Можно предположить, что он
описывает степень разветвленности углеводорода: наибольшие значения
соответствуют наименее разветвленным углеводородам. С увеличением длины
углеродного скелета индекс Винера растет, так как в матрице расстояний
становится больше элементов. Статистический анализ на примере нескольких сотен
углеводородов показал, что индекс Винера коррелирует с некоторыми физическими
свойствами алканов: температурами кипения, теплотами испарения, молярным
объемом.
Другой тип индексов основан не на расстояниях между вершинами, а на числе
ближайших соседей для каждой вершины. В качестве примера рассчитаем индекс
Рандича [11], который определяется следующим образом:
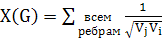 (2)
(2)
где vi - степень i-й вершины, то есть число ребер, от нее
отходящих. Для указанных выше графов индекс Рандича равен:
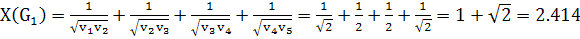 (3)
(3)
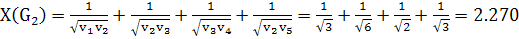 (4)
(4)
Этот индекс также уменьшается с увеличением степени разветвленности
углеродного скелета и может быть использован для описания физических свойств
алканов.
Алканы - самый скучный с химической точки зрения тип органических
молекул, так как он не содержит никаких «особенностей» - двойных и тройных
связей или атомов других элементов, кроме водорода и углерода (такие элементы
называют гетероатомами). Введение гетероатомов в состав молекулы может
кардинально изменить свойства вещества. Так, добавление всего одного атома
кислорода превращает довольно инертный газообразный этан C2H6
в жидкий этанол C2H5OH, проявляющий довольно высокую
химическую и биологическую активность.
Следовательно, в топологических индексах молекул, более сложных, чем
алканы, надо учитывать присутствие кратных связей и гетероатомов. Это делается
путем присвоения вершинам и ребрам графов определенных числовых коэффициентов -
«весов» [7]. Например, в матрице расстояний диагональные элементы можно
определить через заряд ядра Zi (напомним, что для углерода Z = 6):
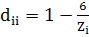 (6)
(6)
Недиагональные элементы определяются суммированием по ребрам, причем
каждому ребру, соединяющему атомы с зарядами Zi и Zj,
присваивается вес
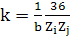 (7)
(7)
где b равно порядку связи между атомами (1 для одинарной связи, 2 для
двойной, 3 для тройной). Для обычных одинарных связей углерод-углерод, k = 1.
Сравним индексы Винера пропана C3H8 и трех близких по
составу кислородсодержащих веществ: пропилового спирта C3H8O,
изомерного ему изопропилового спирта C3H8O и ацетона C3H6O[10].
Для этого рассчитаем по указанным правилам матрицы расстояний. В
молекулярных графах укажем все атомы, кроме атомов водорода .1) Пропан
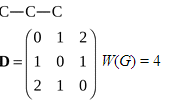
) В молекуле пропилового спирта кислород связан с крайним атомом
углерода:
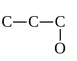
Для одинарной связи C-O
весовой коэффициент равен 36/(6×8) = 0.75. Диагональный
элемент матрицы, отвечающий кислороду:44 = 1 - 6/8 = 0.25.

Для молекул, содержащих
гетероатомы, индекс Винера перестает быть целым. 3) В молекуле изопропилового
спирта кислород связан со средним атомом углерода:

) В ацетоне порядок
соединения атомов - такой же, как в изопропиловом спирте, но связь между
углеродом и кислородом - двойная:
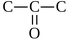
Для двойной связи C=O весовой
коэффициент равен 36/(2×6×8) = 0.375

Как видно, добавление
гетероатома в структуру алканов приводит к возрастанию индекса Винера за счет
увеличения размера матрицы расстояний. Добавление кратных связей и увеличение
степени разветвления молекулы уменьшает этот индекс. Эти правила выполняются и
для более сложных молекул[7]. Первоначально топологические индексы
разрабатывались только с целью предсказания физико-химических свойств веществ.
Однако впоследствии их стали применять и для решения других задач. Рассмотрим
некоторые из них. Одно из приложений топологических индексов связано с
классификацией органических соединений и созданием органических баз данных.
Задача состоит в том, чтобы найти такой индекс, который взаимно однозначно
характеризует химическую структуру и по которому эту структуру можно
восстановить. Требуемый индекс должен обладать хорошей дискриминирующей
способностью, то есть различать между собой даже близкие по структуре молекулы.
Эта задача - грандиозная, поскольку органических структур известно уже более 20
миллионов. Ее решение, по-видимому, будет найдено в результате использования
составных топологических индексов.
· поиск
веществ с заранее заданными свойствами (поиск зависимостей типа
«структура-свойство
<http://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D0%B8%D1%81%D0%BA_%D0%BA%D0%BE%D0%BB%D0%B8%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D1%8B%D1%85_%D1%81%D0%BE%D0%BE%D1%82%D0%BD%D0%BE%D1%88%D0%B5%D0%BD%D0%B8%D0%B9_%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D0%B0-%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%BE>»,
«структура-фармакологическая активность»),
· первичная
фильтрация структурной информации для бесповторной генерации молекулярных
графов заданного типа,
· предварительное
сравнение молекулярных графов при их тестировании на изоморфизм
<http://ru.wikipedia.org/wiki/%D0%98%D0%B7%D0%BE%D0%BC%D0%BE%D1%80%D1%84%D0%B8%D0%B7%D0%BC_%D0%B3%D1%80%D0%B0%D1%84%D0%BE%D0%B2>.
Топологический
индекс зависит только от структуры молекулы, но не от ее состава, поэтому
молекулы одинаковой структуры (на уровне структурных формул
<http://ru.wikipedia.org/wiki/%D0%A1%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D0%BD%D0%B0%D1%8F_%D1%84%D0%BE%D1%80%D0%BC%D1%83%D0%BB%D0%B0>),
но разного состава, например, фуран <http://ru.wikipedia.org/wiki/%D0%A4%D1%83%D1%80%D0%B0%D0%BD>
и тиофен
<http://ru.wikipedia.org/wiki/%D0%A2%D0%B8%D0%BE%D1%84%D0%B5%D0%BD> будут
иметь равные индексы. Для преодоления этого затруднения был предложен ряд
индексов, например, индексы электроотрицательности
<http://ru.wikipedia.org/wiki/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BE%D1%82%D1%80%D0%B8%D1%86%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D1%81%D1%82%D1%8C>[6-8].
Наиболее
перспективные применения топологических индексов связаны с разработкой лекарственных
препаратов и других биологически активных веществ. Разработка каждого нового
лекарства занимает не менее 10 лет, требует вложения более 100 млн. долларов и
проведения десятков тысяч испытаний для веществ-кандидатов[11].
Использование
топологических индексов для характеристики биологической активности препаратов
позволяет значительно сэкономить время и средства, отбросив большое число
веществ, которые по результатам расчета индексов заведомо не обладают
требуемыми свойствами.
Для
подобных исследований в научной литературе сформировалась устойчивая
аббревиатура - QSAR (Quantitative structure-activity relationships), по-русски
- КССА (количественные соотношения структура-активность). Фундаментальной
научной ценностью эти исследования не обладают, так как их результаты не имеют
глубокого физико-химического обоснования, а носят, в значительной степени,
статистический характер. И все же, их достоинство в том, что они количественно
отражают одну из основных идей химии: «Структура определяет свойства»[9].
Заключение
Развитие системного анализа и обработки химической информации привело к
возможности оценки токсических эффектов химических соединений на основе
исследования их структурных формул, собранных в базу данных. Предварительный
вычислительный эксперимент по компьютерной оценке вредных свойств исследуемых
соединений с использованием химической информации, в частности, по оценке
канцерогенной опасности (КО), позволяет снизить непроизводительные затраты и
свести к минимуму возможность использования экологически опасных веществ.
В этой работе было рассмотрено несколько примеров, показывающих, как
математика используется в химии. Они дают определенное, хотя, конечно, неполное
представление о задачах, решаемых химиками с помощью математики, и ограничениях,
которые химия накладывает на применяемую в ней математику. Топологические
индексы (структурные дескрипторы) включают информацию о размере и форме
молекулы, о соединении атомов и структурных групп в ней и их взаимном
расположении. Кроме того, с их помощью можно учитывать особенности электронного
и пространственного строения молекул, выбирая соответствующим образом веса
вершин и ребер молекулярного графа.
Список литературы
1. Химические
приложения топологии и теории графов / Под ред.Р. Кинга. М.: Мир, 1987. 560 с.
. Химия и
жизнь-XXI век, 1997, № 2, с. 541.
. В.В.Еремин,
Н.Е.Кузьменко, А.А.Дроздов, В.И.Теренин, В.В.Лунин. Химия. 10 класс. Учебник
для общеобразовательных учреждений. - М.: Дрофа, 2008.4. Y.He, T.Ye, M.Su,
C.Zhang, A.Ribbe, W.Jiang, C.Mao. Nature, 2008, v. 452, p. 198.
5.
SeyboldP.G., May M., Bagal U.A. Molecular structure -property relationships//
J. Chem. Educ. 1987. V. 64. P. 575-581.
.
D. Ajami, O. Oeckler, A. Simon, R. Herges. Nature, 2003, v. 426, p. 819.7.
M.Stepien, L.Latos-Grazynski, N. Sprutta, P.Chwalisz, L. Szterenberg. Angew. Chem. Int. Edn, 2007, v. 46, p.
7869 (сообщение об этом открытии - Nature, 2007, v. 450, p. 406.)
8.
Galvez J., Garcia-DomenechR., Gregorio-Alapont C. Indices of differences of
path lengths: novel topological descriptors derived from electronic
interferences in graphs // J. Comput. - Aided Molecular Design. 2000. No. 14. P. 679-687.
.
СтанкевичМ.И., СтанкевичИ.В., ЗефировН.С. Топологические индексы в органической
химии // Успехи химии. 1988. Т. 57. №3. С. 337-366.
.
K.Soai, T.Shibata, H.Morioka, K.Choji. Nature, 1995, v. 378, p. 767.11. Химические приложения топологии и
теории графов. - М.: Мир, 1987.В.В.Еремин