Термодинаміка потоків рідини і газу
Реферат
ТЕРМОДИНАМІКА
ПОТОКІВ РІДИНИ І ГАЗУ
Рівняння першого закону
термодинаміки для потоку. Загальна схема теплової машини, яка працює за
принципом відкритої системи наведена на рис.1.
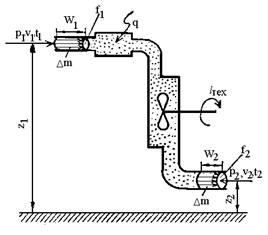
Рис.1. Загальна схема
відкритої системи.
В стаціонарних потоках масова
витрата постійна в кожному перетині:
=fwr=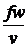 =const, або
mv=fwrv
= fw (1)
=const, або
mv=fwrv
= fw (1)
Потік має повну енергію:
= u + pv + 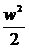 + gz (2)
+ gz (2)
Вираз першого закону
термодинаміки для потоку припускаючи, що g2z2 » g1z1:
1 + p1v1 + 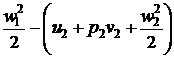 = q = lmеx,
(3)
= q = lmеx,
(3)
Або після перетворень з
урахуванням, що u + pv= h,
отримаємо:
= Dh +D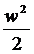 + lmеx. (4)
+ lmеx. (4)
Якщо використати другу форму
запису першого закону термодинаміки, то можна отримати:
= 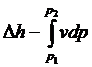 (5)
(5)
З виразів (4) і (5)
отримаємо:
D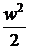 + lmеx =
+ lmеx = 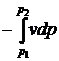 . (6)
. (6)
Інтеграл у виразі (6)
зображається на р-v діаграмі (рис.2) площею |12р2р1| і
являє собою частину роботи розширення (площі |12v2v1|),
яка може бути корисно застосована на зміну кінетичної енергії потоку і на
здійснення технічної роботи. Тому цей інтеграл називають доступною роботою:
дос =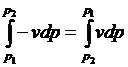 . (7)
. (7)
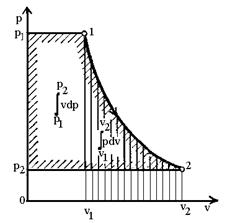
Рис.2. Схема до визначення
доступної роботи і роботи зміни об’єму.
Якщо на вході і виході
системи швидкості потоку однакові, то доступна робота буде складатися лише з
технічної роботи:
=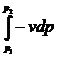 . (8)
. (8)
Якщо крива 1-2 є політропою з
показником n,
то:
дос =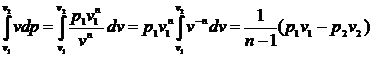 , (9)
, (9)
тобто доступна робота в n
разів більше роботи зміни об’єму
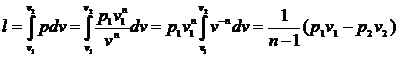 .
.
Отже, вираз першого закону
термодинаміки для потоку набуде вигляду:
= Dh + lдос.
(10)
Витікання газу і пари.
Приймається, що течія в соплах - адіабатна, тобто q =0,
технічна робота не здійснюється dlmex = 0. Тоді
рівняння першого закону термодинаміки:
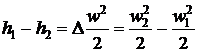 . (11)
. (11)
Звідки швидкість адіабатного
витікання:
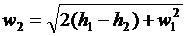 . (12)
. (12)
В багатьох випадках w2 >> w1,
тоді:
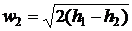 . (13)
. (13)
Різницю h1 - h2 = z0
називають доступним теплоперепадом. Для водяної пари доступний теплоперепад
можна визначити за допомогою h-s де пряма
1-2 зображує адіабатний процес витікання.
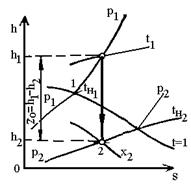
Рис.3. h-s
діаграма адіабатного процесу витікання водяної пари.
З виразу 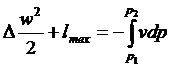 при lmex = 0 отримаємо:
при lmex = 0 отримаємо:
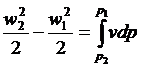 . (14)
. (14)
Звідки після інтегрування і
перетворень, прийнявши w1 = 0 i 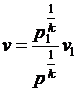 для
адіабатного витікання ідеального газу отримаємо вираз:
для
адіабатного витікання ідеального газу отримаємо вираз:
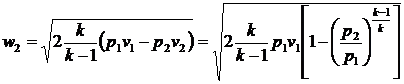 . (15)
. (15)
Секундна масова витрата газу
при площі поперечного перетину сопла f2 буде 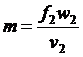 . З
урахуванням співвідношення v2 = v1
. З
урахуванням співвідношення v2 = v1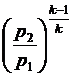 отримаємо:
отримаємо:
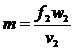
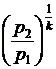 . (16)
. (16)
витікання газ
ідеальний тиск
Підставивши швидкість
витікання w2 з
(15), одержимо:
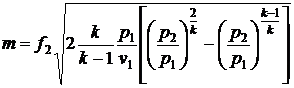 , кг/с. (17)
, кг/с. (17)
На рис.4 зображений графік
залежності витрати газу від відношення тисків
b =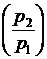 .
.
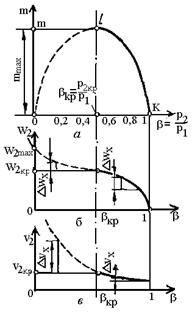
Рис.4. Залежність витрати
(а), швидкості (б) і питомого об’єму (в) газу
при витіканні від відношення тисків.
Тут крива k-l-0 -
теоретична теоретична, k-l-m - реальна
залежності. Тиск, відношення тисків і швидкість, при яких досягається
максимальна витрата називаються критичними (р2кp, b кp, w2кp).
Продиференціювавши (4.17) по 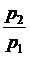 і
прирівнюючи похідну до 0, отримаємо значення b кp.
і
прирівнюючи похідну до 0, отримаємо значення b кp.
b кp= 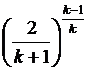 . (18)
. (18)
Для двохатомних газів k =
1,4 і b kp =
0,529 для багатоатомних газів і перегрітої пари k =
1,3 і b кp =
0,546.
Залежність профіля сопла від
швидкості встановлюється з рівняння нерозривності fw = mv,
диференціювання якого при m = сonst
дає:
+ fdw = mdv.
(19)
Розділивши це рівняння на
рівняння нерозривності, отримаємо:
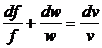 , або
, або 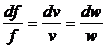 . (20)
. (20)
При b >b кp,
або в закритичній області 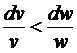 і
і 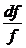 < 0, тобто
сопло по довжині повинне звужуватися, а при b < bкp,
або в закритичній області
< 0, тобто
сопло по довжині повинне звужуватися, а при b < bкp,
або в закритичній області 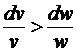 і
і 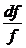 > 0, тобто
сопло по довжині повинне розширюватися (рис.5).
> 0, тобто
сопло по довжині повинне розширюватися (рис.5).
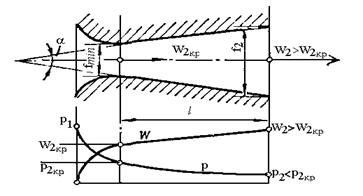
Рис.5. Комбіноване сопло
Лаваля.
Таке комбіноване сопло
називається соплом Лаваля. Якщо газ з початковими параметрами р1, v1
витікає через сопло Лаваля в середовище з тиском р2< р2кp,
тоді у вузькому перетині встановлюються критична швидкість w2кp і
критичний тиск р2кp. Далі тиск знижується, а швидкість
збільшується до значення w2 > w2кp,
яке визначається із співвідношенням (4.15).
Для водяної пари w2кp
можна визначити, користуючись h-s
діаграмою, якщо у вираз 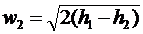 , підставити
значення h = h2кp,
яке визначається перетином адіабати 1-2 з ізобарою р2кp= bкp р1
(рис.6):
, підставити
значення h = h2кp,
яке визначається перетином адіабати 1-2 з ізобарою р2кp= bкp р1
(рис.6):
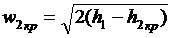 . (21)
. (21)
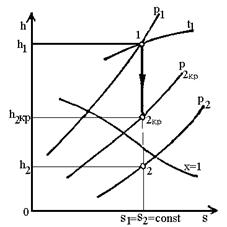
Рис.6. Схема визначення
критичної швидкості витікання.
Дифузор є пристроєм, який за
дією протилежний соплу. З виразу 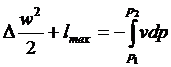 випливає, що підвищення тиску в
дифузорі відбувається за рахунок зменшення кінетичної енергії, або, згідно з
виразом
випливає, що підвищення тиску в
дифузорі відбувається за рахунок зменшення кінетичної енергії, або, згідно з
виразом 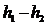 =
=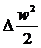 , приріст
ентальпії потоку в дифузорі дорівнює зменшенню кінетичної енергії (рис.7):
, приріст
ентальпії потоку в дифузорі дорівнює зменшенню кінетичної енергії (рис.7):
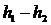 =
=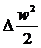 . (22)
. (22)
Внаслідок втрат енергії на
тертя між робочим тілом і поверхнею сопла, а також на завихрення та внутрішнє
тертя в потоці, дійсна швидкість витікання w2д
буде менше теоретичної:
2д = j w2,
(23)
Витрати енергії на тертя, яка
перетворюється на теплоту і збільшує ентальпію потоку на виході з сопла:
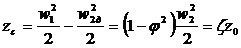 , (24)
, (24)
де 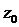 - теоретичний
теплоперепад; z
- теоретичний
теплоперепад; z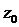 - j2 - коефіцієнт
втрати енергії.
- j2 - коефіцієнт
втрати енергії.
Отже, дійсний корисно
використаний теплоперепад 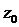 буде менше
теоретичного
буде менше
теоретичного 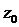 на величину
на величину
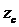 :
:
д = z0 - zс.
(25)
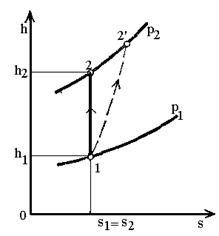
Якщо величину втрати z0
відкласти вниз по адіабаті 1-2 (рис.8) і провести горизонталь до перетину з
ізобарою р2, то отримана точка 2д буде характеризувати стан пари за соплом при
дійсному процесі витікання, а пунктирна крива 1-2¢д буде
умовно зображати необоротний адіабатний процес витікання.
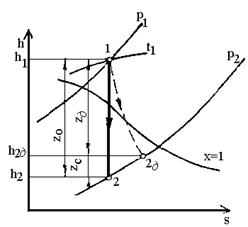
Рис.8. Оборотний (1-2) і
необоротний (1-2д) адіабатні процеси витікання водяної пари.
Дроселювання газу і пари.
Явище зниження тиску потоку в результаті його проходження через місцевий опір
без здійснення роботи називається дроселюванням (рис.9).
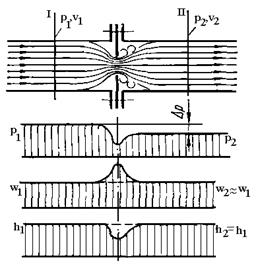
Рис.9. Дроселювання газу при
проходженні через діафрагму.
За відсутності теплообміну (q=0),
і якщо потік не здійснює технічну роботу (lmex =
0) перший закон термодинаміки q = Dh + 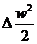 + lmex
набуде вигляду:
+ lmex
набуде вигляду:
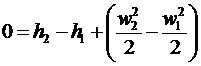 або
або 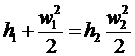 . (26)
. (26)
Оскільки зміною швидкості до
і після дроселювання можна знехтувати, то згідно з (24):
1 = h2.
(27)
Враховуючи, що для ідеального
газу h2 - h1 =
cpm(t2 - t1),
то з (27) випливає, що t2=t1.
Явище зміни температури реальних
газів при дроселюванні називається ефектом Джоуля-Томпсона. Для газу,
властивості якого описуються рівнянням Ван-дер-Ваальса справедливий вираз:
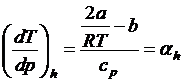 (28)
(28)
де t2
- t1-
диференціальний дросель-ефект.
Оскільки при дроселюванні завжди dp
<
0, ср> 0, то знак dT
буде залежати від знаку чисельника виразу (4.28). При цьому можливі три
випадки:
ah < 0 і dT< 0 при 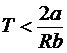 ; (29)
; (29)
ah > 0 і dT > 0 при 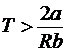 ; (30)
; (30)
ah = 0 і dT = 0
при 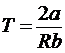 ; (31)
; (31)
Зміна знаку дросель-ефекту
називається інверсією, а температура, при якій ah=0 -
температурою інверсії:
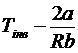 . (32)
. (32)
Для кожного газу існує певна
температура інверсії, яка приблизно становить:
Тінв = 6,75 Ткр, (33)
де Ткр - критична температура
газу, К.
Процес дроселювання є
необоротним і зображається на Т-s діаграмі
пунктирною лінією 1-2, яка співпадає в початковій і кінцевій точках з
ізоентальпою (рис.4.10).
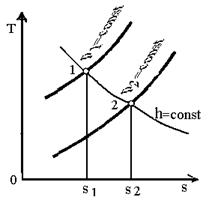
Рис.10. Умовне зображення
процесу дроселювання в Т-s діаграмі.
На h-s діаграмі
умови дроселювання визначаються перетином горизонталі (h1=h2),
яка проходить через початкову точку, з ізобарою кінцевого тиску (рис.11).
Рис.11. Умовне зображення
процесу дроселювання водяної пари в h - s
діаграмі.
При дроселюванні температура водяної
пари зменшується, і після дроселювання вона може бути вологою (a - b), сухою
насиченою (а - с) або перегрітою (а - d).
При дроселюванні водяної пари
зменшується доступний теплоперепад, який характеризується відрізками 1 - 1¢
до дроселювання і 2 - 2¢ після нього,
внаслідок чого зменшується енергетична цінність потоку.
Нагнітання газу і пари. При роботі
поршневого компресора (рис.12) під час руху поршня 2 зліва направо відбувається
заповнення циліндра 1 через клапан 3 (процес а - 1 на рис.13).
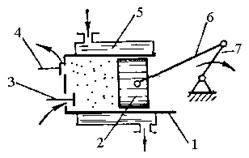
Рис.12. Схема поршневого
компресора.
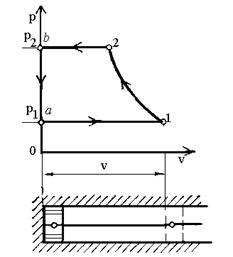
Рис.13. р-v
діаграма робочого процесу в ідеальному компресорі.
При зворотному ході поршня
здійснюється стискання газу до необхідного тиску (процес 1-2) і виштовхування
його через клапан 4 (процес 2 - b).
Вираз першого закону
термодинаміки для потоку q = Dh + 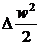 + lmex з
урахуванням знаків роботи (lmex = -lн) і
теплоти (q = -qхол)
запишеться так:
+ lmex з
урахуванням знаків роботи (lmex = -lн) і
теплоти (q = -qхол)
запишеться так:
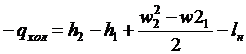 , (34)
, (34)
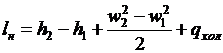 , (35)
, (35)
Для більшості компресорів
можна припустити, що w2 » w1, тоді:
н = h2 = h1 + qхол.
(36)
Вираз (34) називається
основним рівнянням термодинаміки нагнітання.
Залежно від кількості
теплоти, яка відводиться, стискання може бути ізотермним (процес 1-2із на
рис.4.14), адіабатним (1-2ад), політропним (1-2пол).
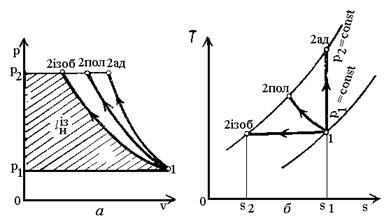
Рис.14. Графіки стискання
газу в р - v i T - s координатах.
При ізотермному стисканні
робота нагнітання 1кг газу буде відповідати пл.|1-2ізр2р1| і аналітично
визначатися із виразу lн = h2 = h1 + qхол.
Для ідеального газу h1 - h2,
тоді, з урахуванням співвідношення для ізотермного процесу 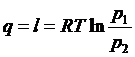 , отримаємо:
, отримаємо:
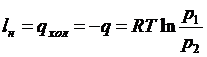 . (37)
. (37)
Для ізотермного процесу
стискання справедливе також співвідношення
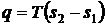 , згідно з яким:
, згідно з яким:
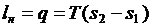 . (38)
. (38)
При адіабатному стисканні (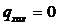 ) з виразу lн=h2=h1 + qхол
отримаємо:
) з виразу lн=h2=h1 + qхол
отримаємо:
н = h2 - h1.
(39)
Для ідеального газу механічна
робота, затрачувана в одноступінчастому компресорі на адіабатний стиск 1кг
газу, дорівнює:
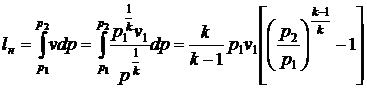 , (40)
, (40)
де 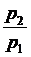 = l - ступінь
підвищення тиску.
= l - ступінь
підвищення тиску.
При політропному стисканні
для роботи нагнітання маємо:
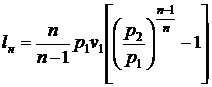 . (41)
. (41)
де 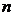 - показник
політропи; для частково охолоджуваних компресорів
- показник
політропи; для частково охолоджуваних компресорів 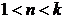 .
.
Роботу для політропних
процесів стискання визначають за допомогою розрахованих значень роботи для
ізотермного або адіабатного стискання і відповідних к.к.д.
Для охолоджуваних компресорів
ізотермний к.к.д.
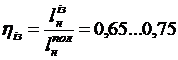 . (42)
. (42)
Для неохолоджуваних
компресорів адіабатний к.к.д:
Добуток ізотермного або
адіабатного і механічного к.к.д. називають ефективним к.к.д. компресора:
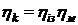 або
або 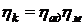 (44)
(44)
Потужність, яка споживається
двигуном компресора для m кілограмів
газу:
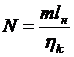 . (45)
. (45)
Експериментальна залежність
між тиском газу р і об’ємом V, який він
займає в циліндрі поршневого компресора, називають індикаторною діаграмою
(рис.15).
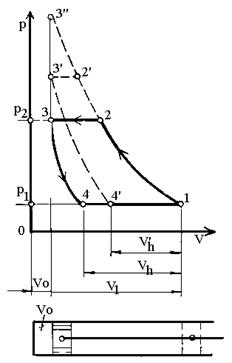
Рис.15. Індикаторні діаграми
поршневого компресора.
В реальному компресорі завжди
повинен бути зазор між поршнем в крайньому верхньому положенні і кришкою
циліндра, якому відповідає об’єм шкідливого простору V0.
Оскільки при всмоктуванні частина об’єму циліндра уже заповнена повітрям
шкідливого простору, що розширилось, корисний об’єм циліндра V1
зменшується до дійсного об’єму всмоктування Vh.
Об’ємний
к.к.д. компресора:
 . (46)
. (46)
З підвищенням тиску
нагнітання (точка 2¢)
продуктивність і об’ємний к.к.д. компресора зменшуються і можуть стати рівними
нулю (точка 3¢¢).
При цьому також підвищується температура повітря, а отже, і мастила, яка може
при одноступеневому стисканні перевищити допустиму межу (200 0С), вище якої
мастило коксується, або спалахує мастильно-повітряна суміш. Тому для тиску
нагнітання 1,0...1,2 МПа і вище використовуються багатоступінчасті компресори
(рис.16).
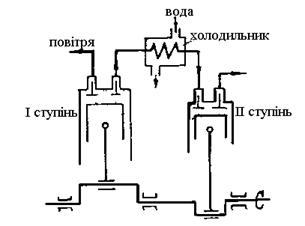
Рис.16. Схема двоступінчатого
компресора.
Тут повітря після стискання в
ступіні І (процес 1 - 2) надходить у холодильник (рис.17).
Рис.17. Графіки процесу
стискання в двоступінчастому компресорі.
Після ізобарного охолодження
(процес 2 - 3) повітря надходить в ступінь ІІ, де остаточно стискається (процес
3 - 4) до необхідного тиску р3. Заштрихована площа пл.|2344¢2|
відповідає економії енергії на стискання за рахунок проміжного охолодження. При
збільшенні числа ступіней процес стискання може наблизитися до ізотермного
(процес 1 - 2 - 5)
Відношення тисків у кожній
ступіні:
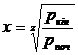 . (47)
. (47)
де z -
число ступіней; 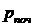 ,
, 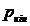 - тиски на
вході в першу ступінь і на виході з останньої ступуні.
- тиски на
вході в першу ступінь і на виході з останньої ступуні.
Для обчислення роботи, яка
витрачається на стискання в z ступінях
достатньо визначити роботу в одній ступіні і збільшити її в z
разів.
Література
1.Парселл
Э. Берклеевский курс физики. Электричество и магнетизм. М.: Наука, 2009.
.Рейф
Ф. Берклеевский курс физики. Статистическая физика. М.: Наука, 2007.
.Савельев
И.В. Курс физики, т.т. 1-5. М.: Наука, 2007.
.Сивухин
Д.В. Общий курс физики, т.т. 1-5. М.: Высшая школа, 2008.
.Трофимова
Т.И. Краткий курс физики. М.: Высшая школа, 2009.
.Фейнман
Р., Лейтон Р., Сэндс М. Фейнмановские лекции по физике. т.т. 1-9. М.: Мир,
2007.
.Хайкин
С.Э. Физические основы механики. М.: Наука, 2007.
.Яворский
Б.М., Пинский А.А. Основы физики, т.т. 1-2. М.: ФИЗМАТЛИТ, 2008.