Госпитальная терапия
ГОМЕЛЬСКИЙ
ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ ИНСТИТУТ
КАФЕДРА
ВНУТРЕННИХ БОЛЕЗНЕЙ №1
Методические
рекомендации по госпитальной терапии
Для
студентов пятого курса.
Гомель
2002
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА
Врожденные аномалии сердца и
сердечно-сосудистой системы встречаются примерно в 7-10 случаях на 1000
родившихся живыми (0,7-1,0 %). Таким образом, эти заболевания являются
наиболее часто встречающимися среди врожденных и составляют примерно 30%
врожденных заболеваний у взрослых. Не смотря на то, что частота ревматических
поражений сердца в развитых странах неуклонно снижается, врожденные пороки
сердца становятся основной кардиальной патологией у детей. Прогресс в области
диагностики сердечно-сосудистых заболеваний и их лечения, успехи анестезиологии
и интенсивной терапии привели к тому, что большинство пороков стали
операбельными, причем большинство больных живут после этого долгое время. В
прошлом, не оперированные тяжелые пороки сердца у взрослых встречались редко,
поскольку больные просто не доживали до зрелого возраста, однако сейчас
положение вещей в значительной степени изменилось: мы видим мало таких пороков
не потому, что больные рано умирают, а потому, что радикальные или паллиативные
операции по этому поводу выполняются в раннем детском возрасте или у
подростков. Не леченые пороки у взрослых можно видеть тогда, когда
декомпенсация кровообращения развивается поздно, в связи с кальцификацией
пораженных клапанов, проявляются аритмии, прогрессирует недостаточность
сократительной функции миокарда, легочная гипертензия или инфекционный
эндокардит.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ:
Врожденные пороки сердца.
Определение. Этиология. Патогенез. Классификация. Общие признаки.
Открытый артериальный проток (ОАП).
Нарушение внутрисердечной гемодинамики. Симптоматология, течение. Диагноз.
Показания к хирургическому лечению. Медикаментозная терапия. Прогноз.
Коарктация аорты (КА). Нарушение
внутрисердечной гемодинамики. Симптоматология, течение. Диагноз. Показания к
хирургическому лечению. Медикаментозная терапия. Прогноз.
Дефект межпредсердной перегородки
(ДМПП). Нарушение внутрисердечной гемодинамики. Симптоматология, стадийность
течения. Дифференциальный диагноз. Лечение. Показание к хирургическому лечению.
Дефект межжелудочковой перегородки
(ДМЖП). Нарушение внутрисердечной гемодинамики. Симптоматология, стадийность
течения. Дифференциальный диагноз. Лечение. Показание к хирургическому лечению.
ОТВЕТЫ НА ВОПРОСЫ
ВПС представляют собой аномалии
структуры и (или) функции сердечно- сосудистой системы, возникающие в
результате нарушения ее эмбрионального развития.
Этиология обусловлена
взаимодействием генетических факторов и факторов внешней среды.
При клинических исследованиях
установлена связь возникновения ВПС со следующими экзогенными факторами,
воздействующими на организм матери во время беременности:
коревой краснухой, реже другими
вирусными инфекциями (корь, ветряная оспа, энтеровирусная инфекция);
хроническим злоупотреблением
алкоголя;
употреблением некоторых лекарств.
Классификация
Встречается более 90 вариантов ВПС и
множество их сочетаний. В Институте сердечно-сосудистой хирургии им. А.Н.
Бакулева АМН СССР была разработана классификация, основанная на распределении
ВПС с учетом анатомических особенностей порока и гемодинамических нарушений.
. ВПС бледного типа с
артериовенозным шунтом: дефект межжелудочковой перегородки (ДМЖП), дефект
межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП); открытый
атриовентрикулярный канал.
. ВПС синего типа с веноартериальным
шунтом: транспозиция магистральных сосудов, тетрада Фалло (ТФ), триада Фалло,
атрезия трикуспидального клапана (АТК) и т.д.
. ВПС без сброса, но с препятствием
на пути кровотока из желудочков (стенозы легочной артерии и аорты). Такое
деление охватывает 9 наиболее распространенных ВПС.
Нарушение гемодинамики при
врожденных пороках сердца
ВПС вызывает ряд изменений
компенсаторного характера, которые заставляют перестраиваться весь организм
ребенка, но при длительном существовании порока процессы компенсации ведут к
выраженным деструктивным изменениям органов и систем, что приводит к гибели
больного.
В зависимости от состояния малого
круга кровообращения в организме больного с ВПС наблюдаются следующие
патологические изменения:
• при наличии увеличенного кровотока
в легких (пороки бледного типа с артериовенозным шунтом) развивается
гиперволемия и гипертензия малого круга кровообращения;
• при наличии обедненного кровотока
в легких (пороки синего типа с веноартериальным шунтом) у больного развивается
гипоксемия;
• при увеличении кровотока в малом
круге кровообращения развивается гиперволемия и легочная гипертензия.
При цианотических формах ВПС наличие
сброса венозной крови в артериальную или смешение крови ведут к увеличению
объема крови в большом круге кровообращения и уменьшению в малом, что приводит
к снижению насыщения крови кислородом и к появлению цианоза кожи и слизистых.
Для улучшения доставки кислорода к органам и повышения эффективности вентиляции
происходит развитие коллатерального кровообращения между сосудами большого и малого
круга кровообращения. Перестройка коллатеральной сети кровообращения происходит
в сосудах всех органов. Особенно это выражено в сосудах сердца, легких и
головного мозга.
Благодаря компенсаторным механизмам
состояние больного с цианотическими формами ВПС, несмотря на тяжелые нарушения
гемодинамики, может быть длительно удовлетворительным, но постепенно
компенсаторные механизмы истощаются, длительная гиперфункция миокарда приводит
к развитию тяжелых необратимых дистрофических изменений в сердечной мышце. Поэтому
оперативное вмешательство при цианотических пороках (радикальное или
паллиативное) показано в самом раннем детском возрасте.
Диагностика
Первичная диагностика ВПС
основывается на данных неинвазивных методов исследования. Большое значение для
диагностики имеет целенаправленный сбор анамнеза у родителей ребенка. Методом
перкуссии определяют размеры сердца, печени и селезенки.
Аускультация является наиболее
информативным методом физикального обследования больных с ВПС. При аускультации
можно отметить изменение тонов сердца (усиление, ослабление или расщепление),
появление шумов, а также их локализацию, иррадиацию и место максимального
выслушивания. Интенсивность шума не всегда коррелирует с тяжестью порока,
например, при ВПС с легочной гипертензией и синих пороках со стенозом легочной
артерии эта зависимость носит обратный характер. При аускультации легких можно
выявить признаки застоя в малом круге.
Физикальное исследование дополняется
проведением неинвазивного инструментального обследования, которое включает ЭКГ,
ФКГ, ЭхоКГ и рентгенографию органов грудной клетки.
ЭКГ позволяет судить о гипертрофии
различных отделов сердца, патологических отклонениях электрической оси, наличии
нарушений ритма и проводимости. Изменения на ЭКГ не являются специфичными для
какого-либо порока, но в сочетании с данными, полученными при клиническом
обследовании и с помощью других неинвазивных методов, позволяют судить о
тяжести порока. Разновидностью метода ЭКГ является холтеровское суточное
ЭКГ-мониторирование, которое помогает выявить скрытые нарушения ритма и
проводимости.
Следующим неинвазивным методом
обследования кардиологических больных является ФКГ, которая воспроизводит
данные аускультации сердца и позволяет более детально и количественно оценить
характер, продолжительность и локализацию сердечных тонов и шумов.
Рентгенография органов грудной
клетки дополняет предыдущие методы и позволяет оценить: состояние малого круга
кровообращения (наличие артериального или венозного застоя, снижение наполнения
сосудов легких); расположение, форму, размеры сердца и его отдельных камер;
изменения со стороны других органов и систем. Наиболее высокоинформативным
неинвазивным методом исследования является эхокардиография (ЭхоКГ). С
появлением данной методики, особенно двухмерной ЭХОКГ, значительно расширились
возможности диагностики ВПС. Этот метод позволяет провести анатомически точную
диагностику дефектов перегородок сердца, поражения атриовентрикулярных и
полулунных клапанов, размеры и расположение камер сердца и магистральных сосудов,
а также оценить сократительную способность миокарда.
Тактика хирургического лечения
Тактика оказания помощи больным с
ВПС строится с учетом течения порока, эффективности консервативного лечения,
возможности и риска проведения хирургического лечения.
Радикальная коррекция простых
неосложненных пороков не представляет технических трудностей для
специализированной кардиохирургической клиники. При ДМЖП и ДМПП выполняется
ушивание или пластика дефектов заплатой, при ОАП - перевязка или пересечение
протока. При выраженной гипоксемии первым этапом у больного с ВПС проводится
паллиативная операция - наложение различных межсистемных анастомозов. После
проведения операции улучшается насыщение крови кислородом, что позволяет
ребенку развиваться в более благоприятных условиях. Выполнение двухэтапных
операций, по данным различных авторов, не только не увеличивает риск
вмешательства, но уменьшает летальность при радикальной коррекции.
При некоторых анатомически сложных
ВПС, когда отсутствуют или недоразвиты различные отделы сердца (атрезия
трикуспидального и митрального клапанов, единственный желудочек сердца,
двухкамерное сердце и т. д.) выполнение радикальной операции не представляется
возможным, и единственной операцией может быть гемодинамическая коррекция
внутрисердечной гемодинамики, которая позволяет разделить артериальные и
венозные потоки крови, не устраняя полностью анатомические пороки.
Открытый артериальный проток
Открытый артериальный проток (ОАП)
представляет собой аномальное сообщение между легочной артерией (в месте ее
бифуркации на правую и левую ветви) и нисходящим отделом аорты (сразу под
местом отхождения от нее подключичной артерии), которое стойко сохраняется в
постнатальный период.
Первичные нарушения гемодинамики
обусловлены шунтированием артериальной крови из аорты в легочную артерию по
градиенту давления между ними, который сохраняется в течение и систолы, и
диастолы. Увеличение легочного кровотока вызывает увеличение притока к левым
отделам сердца и его перегрузку. Компенсация обеспечивается гиперфункцией и
гипертрофией ЛЖ.
В ответ на увеличение легочного
кровотока развиваются склеротические процессы в легочных артериолах, что
приводит к повышению давления в легочной артерии и уменьшению сброса крови. При
этом, однако, возникает перегрузка сопротивлением правого желудочка, который
гипертрофируется. Нарушения компенсации проявляются развитием лево- и
правожелудочковой недостаточности. При наличии широкого артериального протока
при высоком легочном сосудистом сопротивлении возможен сброс крови справа налево.
Больные жалоб не предъявляют или
отмечают одышку при физической нагрузке, слабость, утомляемость, которые
нарастают с развитием легочной гипертензии.
При пальпации - усиленный
верхушечный толчок. При аускультации - грубый непрерывный систолодиастолический
шум с эпицентром в 1-2 межреберье слева у края грудины, акцент 2 тона над ЛА.
На ЭКГ - признаки гипертрофии ЛЖ, а
при нарастании легочной гипертензии также ПЖ.
При рентгенологическом исследовании
выявляют:
увеличение ЛЖ;
увеличение ЛП, степень которого
зависит от величины объемной перегрузки;
увеличение ствола ЛА;
усиление легочного сосудистого
рисунка;
расширение дуги Аорты.
На ЭхоКГ отмечаются признаки
увеличения левых отделов сердца, а также ПЖ, легочной гипертензии.
Течение и прогноз зависят главным
образом от развития легочной гипертензии.
Лечение ОАП хирургическое. Оно
показано во всех случаях, кроме "синих" форм со сбросом крови справа
налево.
Коарктация аорты.
Коарктация аорты (КА) - врожденное
сужение просвета аорты в области перешейка или проксимальнее. Первичные
нарушения гемодинамики обусловлены снижением АД дистальнее места сужения аорты,
что приводит к недостаточности кровообращения в нижней части туловища, в том
числе ишемии почек. Компенсация осуществляется:
путем гиперфункции и гипертрофии ЛЖ;
вследствие развития коллатерального
кровообращения за счет анастомозирования артерий выше и ниже места сужения.
Нарушения компенсации:
артериальная гипертензия верхней
половины туловища усугубляется и приобретает признаки злокачественной под влиянием
активации РААС как следствия ишемии почек;
перегрузка ЛЖ сопротивлением
приводит к его недостаточности.
Клиника определяется артериальной
гипертензией верхней половины туловища и гипотензией - нижней, а также
выраженностью коллатералей. Жалобы обычно появляются в 20-30 лет. Больных
беспокоят:
одышка при физической нагрузке;
головная боль, головокружение,
появление "мушек" перед глазами;
быстрая утомляемость н/конечностей,
иногда боль в них при физической нагрузке по типу перемежающей хромоты.
При объективном исследовании
обращает на себя внимание, выраженное развитие мышц плечевого пояса по
сравнению с н/ конечностями. Важным диагностическим критерием является усиление
пульсации сонных артерий и повышение АД, преимущественно систолического на
в/конечностях при резком ослаблении или отсутствии пульсации на бедренных
артериях и дистальнее. Данные аускультации и ФКГ не специфичны.
На ЭКГ определяются признаки
гипертрофии ЛЖ. На рентгенограмме отмечается аортальная форма сердца с
увеличением ЛЖ и значительным расширением восходящей части Аорты и ее дуги.
Течение и прогноз неблагоприятные.
Лечение хирургическое. Операция показана практически всем больным при
отсутствии серьезных осложнений - злокачественной АГ, тяжелой почечной и
сердечной недостаточности.
Дефект межпредсердной перегородки.
(ДМПП) - это патологическое
сообщение между 2мя предсердиями. ДМПП классифицируются в зависимости от их
локализации. ДМПП типа ostium primum составляет часть общего
атриовентрикулярного канала, в который входит также дефект межжелудочковой
перегородки, соединение нижней части межпредсердной перегородки с базальной
частью межжелудочковой, слияние передней створки митрального клапана с
септальной створкой трехстворчатого клапана. Самый распространенный вариант
ДМПП - это дефект типа ostium secundum; он характеризуется отсутствием ткани в
области овального окна в середине межпредсердной перегородки. Третий тип ДМПП -
sinus venosus расположен высоко в межпредсердной перегородке в области впадения
верхней, реже - нижней полой вены.
Первичное нарушение гемодинамики
связанно с шунтированием крови через дефект слева направо, в результате чего
артериальная кровь из ЛП подмешивается к венозной в ПП. Такое направление
сброса обусловлено:
большей диастолической податливостью
ПЖ по сравнению с ЛЖ и меньшим сопротивлением сосудов малого круга
кровообращения по сравнению с большим;
различием давления в предсердиях.
Шунтирование крови приводит к:
диастолической перегрузке
(перегрузке объемом) ПЖ и ПП;
увеличению легочного кровотока;
уменьшению поступления крови в левые
отделы сердца и Аорты.
Компенсация обеспечивается
гиперфункцией и гипертрофией ПЖ. Нарушение компенсации связано с развитием
склеротических процессов в легочных артериолах и стойкой артериальной
гипертензии. Повышение диастолического давления в ПЖ и среднего давления в ПП
обусловливают снижение диастолической податливости ПЖ и выравнивание давления в
предсердиях, вследствие чего, величина сброса крови через дефект значительно
уменьшается. Особенностью ДМПП у взрослых является развитие недостаточности ЛЖ
вследствие детренированности функционально недогруженного желудочка и его
поражением вследствие сопутствующих заболеваний - ИБС, АГ и др. Недостаточность
ЛЖ может увеличивать объем лево-правого шунта. Происходит повышение диастолического
давления во всех камерах сердца и появляется или усугубляется застой в венах
большого круга кровообращения.
Клиника. Жалобы появляются в
возрасте после 30 лет. Больных беспокоят прогрессирующая одышка, слабость,
утомляемость, реже сердцебиение и перебои. При осмотре и пальпации определяют
усиленный правожелудочковый толчок. При аускультации выслушивают незвучный
мезосистолический шум (изгнания) во втором межреберье слева у края грудины,
обусловленный увеличением кровотока через клапаны легочной артерии; акцент и
расщепление 2 тона над легочным стволом. На ЭКГ: признаки гипертрофии ПЖ и ПП.
На рентгенограмме грудной клетки определяются:
увеличение правых отделов сердца;
сглаженная талия вследствие
выбухания ствола легочной артерии;
усиление легочного рисунка;
уменьшение дуги Ао.
На ЭхоКГ определяется дилатация
легочной артерии и ПЖ, можно увидеть дефект из субкостальной позиции либо на 4х
камерном апикальном изображении сердца.
Основными осложнениями и причинами
смерти являются:
нарушения ритма, чаще всего
фибрилляция предсердий, вначале пароксизмальная, а затем и постоянная форма;
застойная сердечная недостаточность
(лево- и правожелудочковая);
легочная гипертензия и синдром
Эйзенменгера;
инфекционный эндокардит.
Оперативное лечение показано всем
больным с неосложненным заболеванием. Хирургическое лечение противопоказано:
при высокой артериальной гипертензии
с минимальным сбросом или с изменением направления сброса;
при значительной левожелудочковой
недостаточности.
Медикаментозная терапия
симптоматическая и включает:
активное лечение респираторных
инфекций;
антиаритмическую терапию;
лечение застойной сердечной
недостаточности.
Дефект межжелудочковой перегородки
(ДМЖП) это патологическое сообщение
между желудочками. Функциональные нарушения, связанные с ДМЖП, зависят от
размеров дефекта и легочного сопротивления. Функционально ДМЖП разделяют на
рестриктивные и нерестриктивные. Рестриктивные ДМЖП сопровождаются высоким
систолическим градиентом давления между желудочками. Нерестриктивные ДМЖП
характеризуются выравниванием систолического давления в полостях правого и
левого желудочков и отсутствием кровотока через дефект. У пациентов с большим
ДМЖП повышено легочное сосудистое сопротивление и возможно шунтирование крови
справа налево.
Нарушения гемодинамики зависят от
величины сброса крови, которая определяется размерами дефекта и сопротивлением
сосудов большого и малого кругов кровообращения. Первичным нарушением
гемодинамики является сброс крови через дефект из ЛЖ в ПЖ по градиенту
давления. Это вызывает увеличение легочного кровотока и притока к левым отделам
сердца и объемную перегрузку ЛЖ И ЛП.
Компенсация достигается
гиперфункцией и гипертрофией мощного ЛЖ. В ответ на переполнение кровью (при
больших дефектах) постепенно развивается сужение легочных артериол вследствие
гипертрофии медии и склероза. Нарастает легочная гипертензия.
Повышенно сосудистое сопротивление
значительно увеличивает нагрузку на ПЖ и вызывает его гиперфункцию и
гипертрофию. Когда сопротивление сосудов малого круга кровообращения начинает превышать
сопротивление сосудов большого круга кровообращения, развивается синдром
Эйзенменгера - сброс крови справа налево. Нарушение компенсации проявляется
развитием недостаточности функционально отягощенных желудочков - левого и
правого.
Клиника. Небольшие дефекты
проявляются лишь типичным грубым систолическим шумом с эпицентром в 3-4
межреберье у левого края грудины. Жалоб нет, Данные рентгенологического и ЭКГ
исследования без патологии. При дефекте больших размеров появляются симптомы
нарушений гемодинамики. На ЭКГ - признаки гипертрофии ЛЖ и ЛП, а при развитии
легочной гипертензии и ПЖ. При рентгенологическом исследовании грудной полости:
увеличение ЛЖ;
увеличение ЛП;
увеличение ЛА;
усиление легочного рисунка;
уменьшение дуги Аорты.
Двухмерная ЭхоКГ, особенно с
доплеровским исследованием, в большинстве случаев верифицирует диагноз,
позволяя точно определить локализацию и размеры дефекта, наличие и направление
шунта.
Осложнения ДМЖП включают:
осложнения, связанные с
прогрессированием легочной гипертензии и развитием синдрома Эйзенменгера -
тромбозы различной локализации, легочное кровотечение, эмболии в большой круг
кровообращения, правожелудочковую недостаточность, внезапную смерть;
инфекционный эндокардит с
локализацией вегетаций чаще в ПЖ в месте удара струи крови;
аортальную недостаточность
вследствие пролапса створки клапана в дефект, которая способствует
прогрессированию левожелудочковой недостаточности;
левожелудочковую недостаточность при
больших шунтах.
Лечение хирургическое. Оно показано
во всех случаях наличия значительного лево-правого шунта, когда легочной
кровоток превышает системный в 2 раза и более. Хирургическое лечение
противопоказано, когда давление в легочной артерии равно или превышает давление
в Аорты и имеется право-левый шунт.
Медикаментозная терапия
симптоматическая. Помимо лечения сердечной недостаточности, она включает
антикоагулянты для предотвращения тромбозов и кровопускание при выраженной
полицитемии.
ЛИТЕРАТУРА
Внутренние болезни под руководством
Ф. И. Комарова, В. Г. Кукеса, А. С. Сметнева. 2 изд., - М., Медицина, 1990
Маколкин В. И., Овчаренко С. И.
Внутренние болезни. М., Медицина, стр. 1089, 1994.
Милькаманович В. К. Методическое
обследование, симптомы и симптомокомплексы в клинике внутренних болезней. МН.
ООО Полифакт - Альфа; 1994.
КОМБИНИРОВАННЫЕ ПОРОКИ СЕРДЦА
Введение: Приобретенными пороками
страдает примерно 0,5-1 % населения умеренного пояса, причем они составляют
20-25 % всех органических заболеваний сердца. Для сложных, т. е.
многоклапанных, приобретенных пороков сердца, в отличие от изолированных,
характерны более выраженные нарушения гемодинамики и снижение МОС, что приводит
в более ранней декомпенсации. Диагностика значительно усложняется, т. к.
признаки каждого из пороков оказываются измененными и подчас нивелируют друг
друга. Уточнить их выраженность и решить вопрос о необходимости и тактике
хирургического лечения позволяет лишь инвазивное обследование.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
Определение комбинированный и
сочетанный порок сердца. Сочетанный митральный порок. Этиология. Нарушение
внутрисердечной гемодинамики. Клиника. Диагностика (ЭКГ, рентгенограмма грудной
клетки, эхокардиограмма). Дифференциальная диагностика с ДМПП, гипертрофической
кардиомиопатией. Осложнения. Хирургическое лечение. Медикаментозная терапия.
Прогноз.
Сочетанный аортальный порок.
Причины. Нарушения внутрисердечной гемодинамики. Инструментальная диагностика.
Выявление преобладания порока. Осложнения. Хирургическое лечение.
Медикаментозная терапия.
Митрально-аортальный стеноз.
Нарушение внутрисердечной и системной гемодинамики. Клинические проявления.
Выявление преобладания порока. Диагностика.
Митрально-аортальный порок:
митральный стеноз и аортальная недостаточность. Клинические проявления.
Признаки преобладания порока. Диагностика. Лечение.
Митрально-аортальный порок с
преобладание недостаточности обоих клапанов. Нарушение внутрисердечной и
системной гемодинамики. Клиника. Инструментальная диагностика. Выявление
преобладания порока. Хирургическое лечение. Медикаментозная терапия.
ОТВЕТЫ НА ВОПРОСЫ
При сочетанном митральном пороке
нарушения внутрисердечной гемодинамики особенно неблагоприятны, т. к. во время
систолы часть крови выбрасывается в ЛП, откуда она должна вновь попасть в
желудочек через суженное отверстие. Вследствие этого митральная регургитация
редко достигает значительной величины, а МОС заметно снижен. Рано
присоединяется мерцательная аритмия и правожелудочковая недостаточность.
Осложнения сочетанного митрального
порока:
мерцательная аритмия;
системные эмболии, тромбоэмболии из
левого предсердия;
легочная артериальная гипертензия.
При сочетанном аортальном пороке
фигурация обычно не настолько выражена, чтобы вызывать перегрузку ЛЖ объемом. С
другой стороны, вследствие связанного с ней увеличение УОС градиент давления на
клапане возрастает непропорционально больше степени сужения его отверстия. При
значительной гипертрофии ЛЖ и уменьшении его диастолической податливости
повышение УОС достигается за счет существенного прироста КАД и, следовательно,
давления в ЛП, легочных венах и капиллярах.
Данные аускультации сердца и ФКГ при
митральном пороке в зависимости от характера преобладающего порока
|
Признак
|
Преобладание
|
|
стеноза
|
недостаточности
|
|
1 тон
|
усилен
|
ослаблен
|
|
Щелчок открытия митрального клапана
|
громкий
|
тихий или отсутствует
|
|
Интервал q-T
|
удлинен
|
не изменен
|
|
Левожелудочковый 3 тон
|
отсутствует
|
звучный
|
|
Систолический шум
|
Отсутствует или низкоамплитудный, низкочастотный
|
Громкий, высокочастотный, проводится в подмышечную область
|
Особенности клинических проявлений
сочетанного аортального порока:
большая выраженность одышки и
признаков венозного застоя в легких;
относительно меньшая выраженность
периферических признаков аортальной регургитации, даже при ее существенной
величине, вплоть до их исчезновения при развитии недостаточности.
Данные аускультации сердца, ФКГ и
других инструментальных методов исследования при аортальном пороке в
зависимости от преобладания стеноза или недостаточности
|
Признак
|
преобладание
|
|
стеноза
|
недостаточности
|
|
1 тон
|
ослаблен
|
чаще не изменен
|
|
2 тон
|
Ослаблен, представлен 1-м компонентом или патологически
расщеплен
|
Ослаблен только при выраженной недостаточности
|
|
Систолический шум на основании сердца
|
Очень громкий
|
Громкий шум не исключает значительную регургитацию
|
|
Диастолический шум
|
Короткий и слабый
|
Громкий и продолжительный, проводится на верхушку
|
|
Форма кривой артериального пульса
|
Замедленный подъем с зазубриной в виде петушиного гребня
|
Высокая амплитуда, крутой подъем, анекротическая волна
|
|
Дилатация полости левого желудочка
|
Отсутствует или мало выражена
|
выражена
|
|
УОС
|
Не изменен или снижен
|
повышен
|
|
Градиент систолического давления на аортальном клапане
|
значительный
|
незначительный
|
При митрально-аортальном стенозе
сужение левого атриовентрикулярного отверстия, создавая препятствие притоку
крови в ЛЖ, уменьшает его нагрузку и тем самым "смягчает" проявления
аортального стеноза. В результате характерные для стеноза устья аорты
патофизиологические изменения (гипертрофия и последующая дилатация ЛЖ) и
клинические проявления (ангинозная боль, обмороки) выражены значительно слабее
и развиваются относительно медленнее.
При сочетании митрального стеноза с
выраженной аортальной недостаточностью вызываемое ею повышение КАД в ЛЖ
приводит к нарушению опорожнения ЛП, что усугубляет митральный стеноз. С другой
стороны, сужение левого атриовентрикулярного отверстия до некоторой степени
уменьшает отрицательное влияние аортальной регургитации на ЛЖ. Это, однако,
достигается "ценой" перегрузки слабых ЛП и ПЖ.
При преобладании митрального стеноза
единственным признаком аортальной недостаточности является дующий
протодиастолический шум вдоль левого края грудины, который сопровождается
ослаблением 2 тона над аортой. Этот шум необходимо отличать от шума
Грехена-Стилла. Периферические признаки аортальной регургитации - изменения артериального
пульса и давления могут отсутствовать.
При преобладании аортальной
недостаточности на первый план выступают характерные жалобы (ангинозная боль,
обмороки), периферические признаки и данные аускультации.
Методы хирургической коррекции
пороков сердца.
Митральная вальвулопластика -
показана при "чистом" митральном стенозе 2, 3, 4 стадии без
кальциноза клапанов:
а) "Закрытая" митральная
полиауротомия особенно эффективна у молодых больных при сохранении синусового
ритма и подвижности передней створки при отсутствии тромбов в ЛП по данным
ЭхоКГ.
б) "Открытая"
вальвулотомия требует применения искусственного кровообращения и позволяет под
контролем зрения рассечь створки, удалить небольшие кальцинаты и тромбы в ЛП.
Чрескожная митральная
вальвулопластика с помощью баллончика - показана больным молодого возраста при
отсутствии кальциноза и грубой деформации подклапанных структур и тромбов в ЛП,
а также больным пожилого возраста с тяжелыми внесердечными заболеваниями и
повышенным риском оперативного вмешательства.
Протезирование митрального клапана.
Показано при митральном стенозе в случаях значительной сопутствующей
регургитации, при грубом кальцинозе и резкой деформации клапана, а также после
предшествующей вальвулотомии при ее неудовлетворительном результате. Используют
протезы 2 видов - механические (шаровые, типа Старро-Эдварса, или дисковые,
типа Бьорка-Ширли) и биологические. Протезирование митрального клапана показано
при ревматической митральной недостаточности.
Пластика митрального клапана
показана при отсутствии грубого фиброза и кальциноза.
Оперативная вальвулотомия
аортального клапана рекомендуется при наличии гемодинамически значимого стеноза
и относительно удовлетворительной функции миокарда, при отсутствии кальциноза
клапана.
Чрезкожная баллончиковая
вальвулопластика аортального клапана. Показана в качестве паллиативной меры,
особенно пожилым людям с резким кальцинированным стенозом и высоким риском
радикальной коррекции вследствие тяжелой сердечной недостаточности или
внесердечной патологии, либо больным детского и юношеского возраста с
врожденным пороком, чтобы выиграть время перед имплантацией.
Протезирование аортального клапана.
Используют гомо- и гетеропротезы, шаровые клапаны Старра-Эдварса,
низкопрофильные двустворчатые клапаны и дисковые. Показано у взрослых больных с
обезвествленным аортальным стенозом, при аортальной недостаточности, сочетанном
аортальном пороке.
ЛИТЕРАТУРА
Основная:
Внутренние болезни под руководством
Ф. И. Комарова, В. Г. Кукеса, А. С. Сметнева. 2 изд., - М., Медицина, 1990
Маколкин В.И., Овчаренко С.И.
Внутренние болезни. М., Медицина, стр. 1089,1994.
Милькаманович В. К. Методическое
обследование, симптомы и симптомокомплексы в клинике внутренних болезней. Мн.,
ООО Полифакт -Альфа;1994.
Дополнительная:
Болезни сердца и сосудов.
Руководство для врачей (в 4 томах). Под ред. Е. И.Чазова. М., Медицина, 1992.
Василенко В. Х., Фельдман С. Б.,
Могилевский Э. Б. Пороки сердца. Ташкент. Медицина. 1983.
Маколкин В. И. Приобретенные пороки
сердца. М., Медицина,-1986.
Сумароков А. В., Моисеев В. С.
Клиническая кардиология. М., "Универсум Паблишинг",-1995.
КАРДИОМИОПАТИИ
ВВЕДЕНИЕ
К кардиомиопатиям относят
заболевания не установленной этиологии, некоронарогенного, неревматического
происхождения.
В настоящее время имеются убедительные
данные, что КМП встречаются во всем мире. Для некоторых типов КМП характерны
географические расовые и этнические различия, в некоторых районах мира
отмечается относительно высокая частота случаев КМП. Наиболее широко
распространена дилатационная КМП, а реже всего встречается рестриктивная.
Гипертрофическая КМП занимает,
вероятно, промежуточное положение, и для этой формы выявлены расовые различия.
Дилатационная и гипертрофическая КМП встречается в странах Азии и Тихого
океана. Эндомиокардиальный фиброз особенно часто диагностируется в странах
Африки, а также Центральной и Южной Америки, однако в азиатских странах эта
форма встречается редко, исключение составляют некоторые районы Индии.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
Кардиомиопатии. Определение,
этиопатогенез, классификация.
Дилатационная кардиомиопатия.
Гипертрофическая кардиомиопатия.
Рестриктивная кардиомиопатия.
ОТВЕТЫ НА ВОПРОСЫ
Кардиомиопатия - это острое,
подострое или хроническое поражение сердечной мышцы неизвестной или неясной
этиологии, характеризующееся кардиомегалией и недостаточностью кровообращения и
часто сочетающееся с поражением эндокарда и перикарда.
Классификация
кардиомиопатийДилатационнаяГипертрофическая:
.Симметричная
.Асимметричная:
гипертрофия перегородки
а) без обструкции
б) с обструкцией путей оттока
стенозом (субаортальный)
гипертрофия верхушки
гипертрофия папиллярных
мышцРестриктивная:
.Эндомиокардиальный фиброз
.Эндокардит Леффлера.
Дилатационная кардиомиопатия
Это тяжелое заболевание миокарда,
характеризующееся расширением полостей сердца, снижением сократительной
способности, развитием сердечной недостаточности, нарушением ритма сердца,
тромбоэмболиями, сопровождающееся высокой смертностью.
Этиологический фактор остается
неизвестным.
Главным гемодинамическим нарушением
является снижение систолического выброса и ударного объема крови и, как
результат, реакция на физическую нагрузку слабее, чем в норме. Отмечается также
повышение конечного диастолического давления в левом желудочке, что может
привести к пассивной легочной гипертензии. Камеры сердца расширяются, однако
стенки желудочков почти не гипертрофируются.
В результате расширения желудочков
нередко наблюдается митральная и трикуспидальная регургитация. Степень
регургитации варьирует пропорционально тяжести сердечной недостаточности.
Патоморфологическая картина не имеет каких-либо специфических особенностей. Все
полости сердца резко расширены. Стенка левого желудочка обычно не утолщена, т.
к. дилатация маскирует гипертрофию. Отмечается умеренное утолщение эндокарда.
Просвет коронарных артерий не изменен.
Клинические проявления сводятся к
симптомам хронической сердечной недостаточности, синдрому аритмий,
тромбоэмболическому синдрому.
По течению можно выделить варианты с
быстрым и медленным прогрессированием.
Выделяют 5 основных периодов
развития заболевания:
.Период "случайной
находки" кардиомегалии, характеризующийся отсутствием жалоб.
.Период проявлений сердечной
недостаточности I-II а стадии.
.Период развернутых клинических
проявлений с нарушением кровообращения II б стадии с присоединением
тромбоэмболий.
.Период - стабилизация состояния на
фоне поддерживающей терапии
.Терминальный период - с истощением
и ишемическими повреждениями органов.
Диагностические критерии:
.Прогрессиующая недостаточность
кровообращения, резистентная к лечению.
.Кардиомегалия с наличием
относительной недостаточности двухстворчатого и трехстворчатого клапанов.
.Тромбоэмболический синдром,
нарушения ритма, проводимости.
.Высокое содержание в крови КФК.
.Относительно молодой возраст.
.Отсутствие признаков ИБС,
ревматизма, порока сердца, гипертонической болезни.
.Отсутствие признаков
воспалительного процесса.
.Отсутствие связи развития
заболевания с инфекционным или каким-либо другим этиологическим фактором.
Лечение представляет большие
трудности и является симптоматическим. Используются сердечные гликозиды,
негликозидные инотропные стимуляторы (допамин, добутамин, сальбутамол,
пенальтерол), диуретики, периферические вазодилататоры (нитраты, блокаторы АПФ,
антагонисты кальция, бета-блокаторы), антикоагулянты непрямого действия,
антиаритмические препараты.
При неэффективности консервативного
лечения проводится хирургическое лечение - трансплантация сердца.
Гипертрофическая кардиомиопатия
Это первичное заболевание сердца
неизвестной этиологии, проявляющееся диффузной или асимметричной гипертрофией
миокарда левого желудочка и выраженными изменениями диастолического наполнения
при отсутствии дилатации его полости и причин, вызывающих гипертрофию сердечной
мышцы.
Выделяют несколько морфологических
типов гипертрофической КМП:
.Симметричная ГКМП с концентрической
гипертрофией миокарда ЛЖ.
.Асимметричная ГКМП:
идиопатический гипертрофический
субаортальный стеноз с непропорциональной гипертрофией МЖП, обструкцией
выходного тракта ЛЖ, утолщением эндокарда под аортальным клапаном, утолщением и
парадоксальными движениями передней створки митрального клапана к перегородке в
систолу
асимметричная гипертрофия
перегородки без изменений аортального и митрального клапанов и без обструкции
выходного тракта левого желудочка
верхушечная ГКМП с ограничением зоны
гипертрофии областью верхушки
гипертрофия папиллярных мышц
Этиология неизвестна. Наиболее
изученной формой ГКМП является идиопатический субаортальный стеноз. Заболевание
чаще поражает мужчин (2-1).
Макроскопически пи ГКМП выявляется
асимметричная гипертрофия МЖП, непропорциональная остальным отделам ЛЖ.
Микроскопическая картина
характеризуется нарушением взаимной ориентации мышечных волокон, которые имеют
тенденцию к завихрениям.
Эндокард неспецифически утолщен.
Коронарные артерии не изменены.
Гемодинамика: при данном типе ГКМП
нарушается функция изометрического расслабления миокарда ЛЖ. Гемодинамические
изменения заключаются в повышении фракции выброса из левого желудочка.
Отмечается повышение конечного диастолического давления в ЛЖ, имеется градиент
давления в пределах левого желудочка во время его систолы.
Систолический выброс остается
нормальным, но при длительном заболевании снижается. У 1/4 больных имеется
умеренная легочная гипертензия в связи с повышением давления в левом предсердии.
В клинической картине отмечаются
кардиалгии, одышка, обмороки, головокружения, синкопальные состояния в связи с
физическим напряжением, аритмический синдром: желудочковые тахикардии,
мерцательная аритмия (реже, чем при ДКМП), нарушения АВ-проведения, синдром
WPW. У больных велика опасность внезапной смерти.
Диагностические критерии
.Данные анамнеза с наличием семейных
случаев заболевания, молодой и средний возраст больных.
.Жалобы на боли в области сердца,
слабость, одышку, обмороки, перебои в обл. сердца, приступы сердцебиений.
.Кардиомегалия.
.Систолический шум над верхушкой
сердца или у левого края грудины в 3-4 межреберье, сохранение II тона на аорте.
.ЭКГ и R-логические признаки
гипертрофии миокарда ЛЖ.
.ЭХО-КГ признаки гипертрофии
различных отделов ЛЖ, отношение толщины гипертрофированного участка к толщине
свободной стенки ЛЖ в конце диастолы более 1,3, парадоксальное движение створок
митрального клапана к перегородке.
.Отсутствие признаков
воспалительного процесса.
.Отсутствие связи развития
заболевания с инфекционным или каким-либо другим этиологическим фактором.
.Отсутствие признаков ИБС,
ревматизма, пороков сердца, гипертонической болезни, миокардита, рубцовых
изменений миокарда по данным радиоизотопного исследования с таллием.
Лечение: существует два направления:
консервативное и хирургическое.
Основным средством консервативной
терапии являются бета-адреноблокаторы. При неэффективности назначают верапамил.
Назначение сердечных гликозидов и
нитратов противопоказано.
При аритмиях используются
антиаритмические препараты.
При формировании выраженного
внутрижелудочкового систолического градиента и развитии сердечной
недостаточности возникает вопрос об оперативном лечении. Выполняется миотомия,
миоэктомия, трансплантация сердца.
Рестриктивная кардиомиопатия
Это заболевание, характеризующееся
нарушением диастолической функции сердца в результате морфологических изменений
эндокарда, субэндокарда и миокарда.
Этиология и патогенез: Заболевание
обусловлено эозинофилией и инфильтрацией дегранулированных эозинофилов
эндомиокарда. Механизм проникновения белка дегранулированных эозинофилов внутрь
сердечной клетки остается неясным.
Патология: утолщение эндокарда до
нескольких мм, особенно на пути притока и оттока из желудочка. Аппарат
митрального клапана пронизан фиброзной тканью, которая простирается в миокард и
достигает верхушки. Прогрессирование приводит к подтягиванию верхушки в
направлении АВ-клапанов, обусловливая облитерацию полостей. Часто отмечают
кальцификацию и даже оссификацию миокарда. Волокна миокарда имеют признаки
гипертрофии, но ориентированы правильно.
Гемодинамика: отмечается сочетание
нарушения диастолической функции (изометрического расслабления), различной
степени АВ-регургитации с перикардиальным выпотом на поздних стадиях и
снижением нагнетательной функции сердца.
Клиника зависит от того, какой отдел
сердца поражен, от выраженности и локализации фиброза. Проявления: признаки
право - левожелудочковой или тотальной недостаточности, перикардиальный выпот,
аритмический и тромбоэмболический синдром.
Диагностика: изменения ЭКГ, данные
R-графии, ЭХО КГ.
Лечение является трудной задачей.
На ранних стадиях используют
преднизолон. При гиперэозинофилии используется лейкофорез. В стадии фиброза -
хирургическое лечение - эндокардэктомия с протезированием клапанов.
ЛИТЕРАТУРА
ОСНОВНАЯ:
Внутренние болезни под ред. Комарова
Ф. И., М.: Медицина, 1990 г.
Маколкин В. И., Овчаренко С. И.
Внутренние болезни. М., Медицина, 1994 г.
Окороков А. Н. Лечение болезней
внутренних органов, том 3., Мн., Выш. школа, Витебск: Белмедкнига, 1996 г.
ДОПОЛНИТЕЛЬНАЯ:
Болезни сердца и сосудов Руководство
для врачей, том 2. под ред. Чазова Е. И. М., Медицина, 1992-93 г.
Сумароков А. В., Моисеев В. С.
Клиническая кардиология М., Универсум паблишинг, 1995 г.
Терапевтический справочник
Вашингтонского университета.
Мухарлямов Н. М. Кардиомиопатии. М.,
Медицина, 1990 г.
Болезни сердечно-сосудистой системы,
ревматические болезни, том 1. Под ред. Гогина Е. Е.,М., Медицина, 1991 г.
МИОКАРДИОДИСТРОФИИ
ВВЕДЕНИЕ: Термин миокардиодистрофия
был предложен Г. Ф. Лангом еще в 30х годах, к МКД он относил дистрофии
миокарда, развивающиеся в результате анемии, эндокринных нарушений,
интоксикации, инфекции. В настоящее время к МКД относят также состояния,
возникающие вследствие алкогольного опьянения, острого или хронического
физического перенапряжения, полного или частичного голодания, ожирения,
закрытых травм сердца, хронического тонзиллита.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
.Миокардиодистрофии. Определение,
этиопатогенез. Классификация.
.Клиника, диагностика,
дифференциальный диагноз миокардиодистрофий.
.Лечение, прогноз при
миокардиодистрофиях.
ОТВЕТЫ НА ВОПРОСЫ
Миокардиодистрофии -
невоспалительное поражение миокарда различной этиологии, характеризующееся
нарушением обмена веществ и образования энергии в миокарде.
Это обратимые процессы в миокарде,
обусловленные биохимическими и нередко структурными нарушениями на субклеточном
уровне в мышце сердца.
Этиология:
. Токсические влияния на миокард.
. Интоксикация алкоголем.
. Ожирение.
. Эндокринные заболевания
(токсический зоб, гипотиреоз, акромегалия, феохромоцитома, гипопитуитаризм,
гиперкортицизм, сахарный диабет, климакс и др.).
. Алиментарная недостаточность и
гиповитаминозы.
. Воздействие физических факторов
(радиация, невесомость, вибрация, перегревание, переохлаждение, чрезмерная
инсоляция, ожоги, закрытая травма грудной клетки и др.)
. Острое и хроническое физическое
перенапряжение.
. Заболевания ЖКТ с нарушением
всасывания в кишечнике, хронические гепатиты и циррозы печени.
. Болезни "накопления"
(гемохроматоз, амилоидоз, гликогеноз).
.Острые и хронические инфекции, в
т.ч. и тонзиллит.
.Различные анемии.
.Заболевания, приводящие к
гипоксемии (хроническая недостаточность кровообращения, хроническое легочное
сердце).
.Нарушения электролитного баланса
крови различного генеза.
.Нейрогенные дисфункции, НЦД.
В патогенезе МКД играют роль:
.Недостаточное поступление в миокард
веществ, необходимых для энергообеспечения работы сердца.
.Нарушение
окислительно-восстановительных биохимических процессов в миокарде и процессов
трансмембранного обмена (нарушение электролитного баланса, тканевого дыхания,
дефицит иди снижение активности ферментов и коферментов).
.Гиперфунуция миокарда.
.Нарушение нейроэндокринной
регуляции обмена веществ и энергии в миокарде.
Развитие МКД связано с нарушением
транспорта ионов кальция: увеличение проницаемости мембран миофибрилл для
кальция или снижение активности кальциевого насоса саркоплазматической сети и
сарколеммы, значительное накопление в саркоплазме кальция приводит к возникновению
кальциевой триады (по Мейерсону):
нарушению расслабления миофибрилл с
повышением диастолического давления или развитием контрактуры отдельных групп
клеток миокарда
увеличению поглощения митохондриями
кальция, способствующего разобщению процессов окисления и фосфорилирования с
уменьшением эффективности использования кислорода миокардом или значительному
дефициту АТФ и вторичному энергодефицитному его повреждению - повышение
активности кальций-зависимых протеаз, разрушающих Z-структуры миофибрилл и
активации кальций-зависимых фосфолипаз в митохондриях.
Нарушение гипоталамической
регуляции, изменения нейроэндокринных влияний, активация симпатоадреналовой
системы и ее влияние на сердце приводит к уменьшению утилизации миокардом
кислорода и повышает потребность в нем.
Активируются процессы перекисного
окисления липидов, и накопление свободных радикалов усугубляет поражение
миокарда.
В основе клинической картины МКД
лежат незначительные увеличение сердца и смещение его левой границы кнаружи до
0,5-1 см., а также слабо выраженные признаки снижения сократительной функции
миокарда с развитием сердечной недостаточности 1стадии, кардиалгии, некоторые
нарушения ритма, чаще по типу экстрасистолии.
Отсутствие специфических признаков
МКД затрудняет ее диагностику. Учитывая вторичный характер МКД, распознавание
ее должно основываться на выявлении заболеваний, которые сопровождаются
дистрофическими изменениями миокарда, динамическом наблюдении и систематическом
целенаправленном клинико-инструментальном обследовании лиц с указанной
патологией. В комплексе диагностических мероприятий особое внимание необходимо
уделять исследованиям, которые позволяют своевременно распознавать нарушения
сократительной функции миокарда, ритма сердца и другие симптомы, которыми может
проявляться МКД.
Лабораторные данные не характерны,
обусловлены основным заболеванием. Признаков воспалительного процесса нет.
На ФКГ: снижение амплитуды тонов
сердца, неинтенсивный систолический шум на верхушке, на основании сердца, при
выраженной дистрофии миокарда - патологический III тон, ритм галопа, удлинение
электрической систолы при уменьшении механической систолы (расстояние I-II
тон), интервал Т - II тон больше 0,2с.
На R-скопии увеличение размеров
сердца.
ЭХО-КГ: диффузные изменения миокарда
и увеличение размеров полостей.
ВЭМ: снижение толерантности к
физической нагрузке.
Лечебная программа при МКД включает:
.Лечение основного заболевания,
устранение причины, вызвавшей МКД.
.Улучшение процессов метаболизма в
миокарде: рибоксин, милдронат, неотон, кокарбоксилаза, никотинамид, липоевая
кислота, АТФ, калия оротат, фосфаден.
.Антиоксидантная терапия: вит. Е,
антиоксидантный комплекс.
.Влияние на кальциевый
патогенетический механизм МКД: антагонисты кальция (верапамил, финоптин).
.Стабилизация лизосомных мембран:
эссенциале, пармидин.
.Устранение гипоксии и ацидоза в
миокарде: оксигенотерапия, ГБО.
.Устранение дисбаланса электролитов
в миокарде: поляризующая смесь, р-р калия хлорида.
.Устранение влияния избытка
катехоламинов на миокард: анаприлин, корданум.
.Симптоматическая терапия.
ЛИТЕРАТУРА
ОСНОВНАЯ:
Внутренние болезни под ред. Комарова
Ф. И.,М., Медицина,1990г.
Маколкин В. И., Овчаренко С. И.
Внутренние болезни, М., Медицина, 1994г.
Окороков А. Н. Лечение болезней
внутренних органов, том 3, Минск, Выш. школа, Витебск, Белмедкнига, 1996г.
ДОПОЛНИТЕЛЬНАЯ:
Болезни сердца и сосудов. Руководство
для врачей в 4х томах. Под ред. Чазова Е. И.,М., Медицина,1992-93 г.
Василенко В. Х. и др.
Миокардиодистрофии. М., Медицина,1989г.
Маколкин В. И., Абакумов С. А.
Нейроциркуляторная дистония в терапевтической практике. М., Медицина, 1985г.
ДЕФОРМИРУЮЩИЙ ОСТЕОАРТРОЗ
Первичный остеоартроз - одно из
наиболее часто встречающихся заболеваний человека. Социальная значимость
болезни определяется не только ее широким распространением (при популяционных
исследованиях остеоартроз обнаруживают у 6-12 % обследованных), но и тем, что
остеоартроз является одной из частых причин временной нетрудоспособности. По
современным представлениям первичный остеоартроз понимают как болезненный
процесс, включающий в себя нарушение нормального баланса разрушения
(деградации) и восстановления в суставном хряще и подхрящевой кости и
сопровождающийся фиброзом суставной капсулы, краевых остеофитов и небольшим
воспалением.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
. Деформирующий остеоартроз.
Определение термина. Первичный и вторичный остеоартроз. Основные этиологические
факторы (дисплазии, нарушение статики, функциональная перегрузка, травма
сустава, инфекционный артрит, неспецифическое воспаление сустава, хронический
гемартроз, ишемия кости и остеонекроз, остеодистрофия, нарушение метаболизма, нервные,
эндокринные нарушения, наследственность). Патогенез. Количественные и
качественные изменения суставного хряща.
. Клиника остеоартроза. Наиболее
частая локализация поражаемых суставов. Характеристика болевого синдрома
(механические боли, стартовые боли, "костная мигрень",
"суставной блок"). Осмотр, поверхностная и бимануальная пальпация
суставов. Гониометрия. Основные клинические формы остеоартроза: коксартроз,
гонартроз, узелки Гебердена, узелки Бушара, остеоартроз пястно-запястного
сустава большого пальца, полиостеоартроз.
. Исследование синовиальной
жидкости. Возможные изменения в общем анализе крови, биохимических показателей
сыворотки крови. Биопсия синовиальной оболочки. Клинико-рентгенологические
стадии (Коненская Н. С.). Рентгенологические стадии по KELLGREN.
Диагностические критерии остеоартроза (институт ревматологии, г. Москва).
. Лечение больных остеоартрозом.
Предотвращение дальнейшего прогрессирования дегенеративного процесса в хряще:
разгрузка пораженных суставов, нормализация массы тела, лечение
хондропротекторами, метаболическая терапия, улучшение микроциркуляции;
физиотерапия, бальнеотерапия. Уменьшение боли в суставах и лечение реактивного
синовиита. Улучшение функции суставов: лечебная физкультура, массаж,
санаторно-курортное лечение, ортопедическое лечение. Диспансеризация больных
остеоартрозом.
ОТВЕТЫ НА ВОПРОСЫ
Первичный остеоартроз.
(ПОА) - болезненный процесс,
включающий в себя нарушение нормального баланса разрушения и восстановления в
суставном хряще и подхрящевой кости и сопровождающийся фиброзом суставной
капсулы, формированием краевых остеофитов и небольшим воспалением.
Факторы риска
Экзогенные: микротравматизация,
перегрузка, гипермобильность, неполноценное питание, интоксикация, избыточная
масса тела. Эндогенные: эндокринные, генетические, нарушение статики, аномалии
развития, сосудистые.
Суставной хрящ вместе с подхрящевой
костью, капсулой сустава и мышцами поглощает энергию давления массы тела. В
норме суставной хрящ эластичен и способен сжиматься, поверхности сустава при
высоких нагрузках давления покрываются особой смазкой, что обеспечивает плавное
движение почти без трения. За эти свойства хряща ответственны коллаген,
протеогликаны и гиалуроновая кислота. Форма и прочность хряща при растяжении
обеспечиваются коллагеном типа II, который характерен только для суставов.
Молекула протеогликана состоит из гликозаминогликанов, хондроитинсульфата и
кератинсульфата, которые выступают из сердцевины белка, придавая этой молекуле
конфигурацию щетки для чистки бутылок. Отдельные молекулы протеогликана связаны
длинной цепью гиалуроновой кислоты.
Крупные агрегаты протеогликанов
чрезвычайно гидрофильны и связывают большую часть воды, содержащейся в хряще
(70 % хряща - вода).
Крупные гидрофильные агрегаты
протеогликанов переплетены друг с другом и стянуты сетью волокон коллагена,
придавая хрящу эластичность. Нормальный суставной хрящ претерпевает непрерывное
внутреннее обновление своей структуры. Хондроциты секретируют коллаген и
протеогликаны так же, как и ферменты, которые вызывают деградацию матрикса. К
числу этих ферментов относятся катепсин D, нейтральные протеазы и коллагеназа.
Вещество, называемое катаболин, которое высвобождается из мононуклеарных клеток
синовиальной оболочки, стимулирует выработку хондроцитами ферментов, вызывающих
деградацию матрикса хряща. Процесс деградации контролируется белками,
угнетающими эти ферменты, секретируемыми клетками синовиальной оболочки.
Пусковой механизм, ведущий к
стимулированию хондроцитов и изменениям хряща неизвестен. Таким инициирующим
фактором могут быть микропереломы подхрящевой кости, которые происходят при
повторных ударных нагрузках. Заживление таких переломов делает подхрящевую
кость жесткой и утолщенной, плохо поглощающей энергию давления массы тела.
Поэтому на хондроцит суставного хряща начинает действовать повышенное давление,
которое стимулирует деление клеток и синтез ДНК, коллагена и протеогликанов, а
также ферментов, вызывающих деградацию хряща (металлопротеиназ, лизосомальных
ферментов). В конечном итоге процесс деградации начинает преобладать. Продукты
распада хряща стимулируют высвобождение коллагеназы и других гидролитических
ферментов из клеток синовиальной оболочки. Дегенеративные изменения в хрящевой
ткани проявляются деполимеризацией и убылью компонентов протеогликанов. Содержание
протеогликанов в артрозном хряще уменьшается главным образом за счет
хондроитинсульфата. Одновременно происходит снижение функции и гибель
хондроцитов в поверхностных слоях хряща при пролиферации этих клеток в более
глубоких слоях. Хрящ теряет свою эластичность, разволокняется, в нем появляются
трещины, в дальнейшем хрящ может полностью исчезнуть. Отсутствие амортизации
при давлении на суставную поверхность проводит к субхондальному остеосклерозу с
образованием участков склероза, ишемии и кист. По краям суставных поверхностей
хрящ компенсаторно разрастается, а затем происходит окостенение - образуются
краевые остеофиты.
Отломки хряща фагоцитируются
лейкоцитами, высвобождаются лизосомальные ферменты, что приводит периодически к
синовииту, а при рецидивах - к фиброзным изменениям синовии и капсулы. В
последнее время показана роль повышения функции Т-хелперов в развитии
аутоиммунных процессов, в результате которых появляются специфические
аутоантигены хряща, синовии, аутоантитела и имунные комплексы, повреждающие
хрящ.
Механический характер болей - при
нагрузке на больной сустав при ходьбе, боли тупые, наиболее интенсивны по
вечерам, после дневной нагрузки.
Стартовые боли - возникают при
первых шагах больного, которые затем быстро исчезают. Стартовые боли могут
возникать при трении друг о друга пораженных хрящей, на поверхности которых
оседает хрящевой детрит. При первых движениях в суставе этот детрит
выталкивается в суставную полость и боли прекращаются.
Постоянные боли обусловлены
синовитом, тендобурситом и рефлекторным спазмом близлежащих мышц.
Прогрессирующий фиброз капсулы
сустава ведет к сдавлению нервных окончаний, результатом чего являются боли,
связанные с растяжением капсулы при движении в суставе.
Венозная гиперемия и стаз в
субхондральной кости вызывают непрерывные ночные боли, исчезающие при ходьбе.
"Суставной блок" -
внезапная острая боль, лишающая больного возможности сделать малейшее движение
в данном суставе, вследствие ущемления "суставной мыши" между
суставными поверхностями.
Клинические формы остеоартроза:
) Коксартроз - поражение
тазобедренных суставов в 40 % случаев.
) Гонартроз - поражение коленных
суставов - в 30 % случаев.
) Артроз дистальных и проксимальных
межфаланговых суставов до 20 %.
) Деформирующий спондиллез 5-6 %.
) Межпозвоночный остеохондроз 5-6 %.
) Полиостеоартроз.
Коксартроз - наиболее тяжелая форма
болезни. Чаще является следствием дисплазии сустава, травмы, перенесенного
артрита. Клиника: "утиная" походка, боли в бедрах, ягодицах, паху.
Вначале ограничиваются ротационные движения, а затем сгибательные. Развиваются
хромота, гипотрофия мышц бедра и ягодицы, отмечается локальная болезненность
при пальпации в области головки бедра.
Гонартроз. Манифестация часто
связана с травмой. Начало постепенное, боли носят нарастающий характер. В
начальной стадии боль появляется лишь при особых ситуациях (спуск по лестнице,
в начале движений). Пассивные и активные движения могут сопровождаться хрустом.
Постепенно боль приобретает более выраженный характер, иногда развивается
синовиит. При выраженном артрозе может наблюдаться симптом блокады.
Остеоартроз дистальных межфаланговых
суставов кисти (узелки Гебердена). Узелки Гебердена возникают главным образом у
женщин в период менопаузы. Они обычно множественные, но в первую очередь
возникают на 1 и 3 пальцах кисти. Через несколько месяцев или лет обычно
происходит симметричное поражение и других дистальных межфаланговых суставов.
Узелки располагаются на тыльно-боковой поверхности суставов.
Остеоартроз проксимальных
межфаланговых суставов кистей (узелки Бушара). По форме они отличаются тем, что
располагаются на боковой поверхности сустава, вызывая боковое увеличение
сустава, отчего палец приобретает веретенообразную форму.
Деформирующий спондиллез.
Характеризуется наличием краевых костных разрастаний в области позвонков.
Остеофиты растут в данном случае непосредственно из костей (в других случаях
возможен рост остеофитов из соединительной оболочки сустава). Заболевание
начинается примерно с 20 лет. Дегенерация межпозвонковых дисков преимущественно
выражена на периферии. Костная ткань представлена в виде губчатых наслоений с
дефектами. Остеофиты выглядят как выбухание, возникает отек из-за сдавления
сосудов. Отмечается тугоподвижность позвоночника, иногда бывают неврологические
расстройства (корешковый синдром).
Межпозвонковый остеохондроз. Иногда
сочетается с деформирующим спондилезом, искривлением позвоночника. Происходит
дегенерация диска, выпячивание ядра в различные стороны, что приводит к
травматизации. Костные поверхности имеют узурации, склерозирование.
Одновременно происходит разрастание остеофитов и увеличивается поверхность
сустава. Страдает сосудистая оболочка сустава, возникает васкулит. Болевой
синдром выражен и является ведущим. При этом отмечается внезапное развитие
корешкового синдрома, связанное с тяжелой физический нагрузкой и
переохлаждением. На фоне этих изменений возникают грыжи Шморля, что более
типично для травмы.
Клинико-рентгенологические стадии
остеоартроза.
- незначительное ограничение
движений, небольшое, неотчетливое, неравномерное сужение суставной щели, легкое
заострение краев суставных поверхностей (начальные остеофиты).
- ограничение подвижности в суставе,
грубый хруст при движениях, умеренная амиотрофия, выраженное сужение суставной
щели, значительные остеофиты, субхондральный остеосклероз и кистовидные
просветления в эпифизах.
- деформация суставов, ограничение
его подвижности, полное отсутствие суставной щели, деформация и уплотнение
суставных поверхностей, обширные остеофиты, суставные мыши, субхондральные
кисты.
Стадии остеоартроза по КЕLLGREN
- Остеофиты у края сухожильных
поверхностей или у прикрепления сухожилий.
- Периартикулярная оссификация
дистальных и проксимальных межфаланговых суставов.
- Сужение суставной щели и
субхондральный остеосклероз.
- Кистовидные просветления в
эпифизах.
- Изменение формы суставов.
Биоптат синовиальной оболочки -
покровные клетки расположены в один ряд, ворсины атрофичны, сосудов мало,
значительные поля фиброза, жирового перерождения.
Синовиальная жидкость прозрачная или
слабо мутная, высокой или средней вязкости, муциновый сгусток плотный.
Количество клеток небольшое до 5000 в 1мм3, нейтрофилы до 50 %, могут быть
фрагменты хрящевой ткани.
Большинство хондропротекторов
являются структурными аналогами протеогликанов или гликозаминогликанов.
Способствуя восстановлению клеток и основного вещества хрящевой ткани,
стимулируя обменные процессы, ингибируя ферменты деградации (металлопротеиназы,
лизосомальные ферменты), хондропротекторы действуют патогенетически. Основным
препаратом из группы хондропротекторов, применяемым для базисной терапии
остеоартроза является структум.
Структум состоит из хондроитинсерной
кислоты или хондроитинсульфата в форме натриевой соли. Этот препарат действует
по нескольким направлениям:
) напрямую заменяет недостающий
хондроитинсульфат суставного хряща;
) ингибирует ферменты деградации в
хрящевом матриксе - металлопротеиназы, в частности, лейкоцитарную эластазу;
) стимулирует функционирующие
здоровые хондроциты в глубоких слоях хряща при синтезе компонентов матрикса;
) подавляется продукция лейкотриена
В4 и простагландина Е2. Рекомендуемая оптимальная доза препарата - по 3капсулы
(по 250мг) 2 раза в день в первые 3 недели, затем по 2 капсулы 2 раза в день -
не менее 3 месяцев.
ЛИТЕРАТУРА
ОСНОВНАЯ:
Внутренние болезни под ред. Комарова
Ф. И. М., Медицина, 1991.
В. И. Маколкин, С. И. Овчаренко.
Внутренние болезни М., Медицина, 1994.
Окороков А. Н. Лечение болезней
внутренних органов. Практ. руководство в 3х т. Т.2 Мн., Выш. шк., 1996.
ДОПОЛНИТЕЛЬНАЯ:
Насонова А. А., Астапенко М. Г.
Клиническая ревматология. М., Медицина, 1989. Стр. 432-497.
Справочник ревматолога Матвейков и
др., 1983.
Дедух Н. В., Зупанец И. А., Черных
В.Ф., Договоз С. М. Остеоартрозы. Пути фармакологической коррекции. Харьков,
1992. - 140 с.
Сорока Н. Ф. Фармакотерапия
первичного остеоартроза Рецепт. 1996. №1. Стр. 31-33.
Справочник по ревматологии. Под ред.
В. А.Насоновой. 3е изд. М.: Медицина, 1995. - 272 с.
ПОДАГРА
ВВЕДЕНИЕ
Подагра - хроническое заболевание,
связанное с нарушением мочекислого обмена - повышением содержания в крови
мочевой кислоты и отложением в тканях кристаллов натриевой соли мочевой
кислоты, что клинически проявляется рецидивирующим острым артритом и
образованием подагрических узлов - тофусов. В последние годы во всех странах
наблюдается увеличение заболеваемости подагрой. Распространение подагры в
наиболее развитых странах связано со значительным употреблением продуктов,
богатых пуринами (мясо, рыба) и алкогольных напитков. Подагрой болеют
преимущественно мужчины. Первый приступ подагры может быть в любом возрасте, но
в большинстве случаев после 40 лет. В последние годы наблюдается некоторое
учащение случаев развития подагры в молодом возрасте (20-30 лет).
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
. Подагра. Определение термина.
Нормальный обмен мочевой кислоты в организме. Этиологические факторы, ведущие к
гиперурикемии. Патогенез подагры. Патогенез острого приступа подагры, поражения
мягких тканей и почек.
. Клиническая картина подагры.
Клиника острого подагрического приступа. Характеристика суставного синдрома.
Клиника поражения почек. Поражение мягких тканей (тофусы). Варианты течения
подагры.
. Рентгенография суставов.
Лабораторная диагностика: исследования мочекислого обмена, общий анализ крови,
мочи, биохимический анализ крови, проба Зимницого, исследование синовиальной
жидкости. Морфологическое исследование синовиальной оболочки. Морфологическое
исследование подкожного тофуса.
. Критерии постановки диагноза (Рим
1963г.). Критерии американской ревматической ассоциации (1966г.).
. Лечение подагры. Купирование
острого приступа подагры. Антиподагрическая диета. Базисная терапия
(урикодепрессанты и урикоэлиминаторы). Выбор медикаментов для длительного
лечения. Физические и курортные факторы. Фитотерапия. Хирургическое лечение.
Профилактика. Прогноз. Диспансеризация.
ОТВЕТЫ НА ВОПРОСЫ
Источником образования мочевой
кислоты в организме являются пуриновые основания, которые поступают с пищей, а
также образуются в организме в процессе обмена нуклеотидов. Синтез пуринов
начинается с того, что из молекулы фосфорибозилпирофосфата и глутамина под
влиянием аминотрансферазы образуется фосфорибозиламин.
Из этого соединения образуется
первый пуриновый нуклеидинозиновая кислота, значительная часть которой
превращается в пуриновые нуклеотиды нуклеиновых кислот - адениловую и
гуаниловую кислоты, которые идут на построение нуклеиновых кислот. Однако часть
адениловой и гуаниловой кислот метаболизируется, превращаясь в простые пурины:
гуанин, ксантин и другие, которые под влиянием фермента ксантин оксидазы превращаются
в мочевую кислоту, большая же их часть при участии ГГФТ вновь образует
гуаниловую кислоту.
Таким образом, непосредственными
предшественниками мочевой кислоты являются пурины - гуанин и ксантин.
Запасы мочевой кислоты в организме
составляют в норме 1000мг при скорости их обновления 650 мг/сутки.
В плазме крови мочевая кислота
находится в виде свободного урата натрия. Нормальное содержание урата натрия в
сыворотке, определяемого с помощью калориметрического метода составляет для
мужчин 0,3 ммоль/л, для женщин 0,24 ммоль/л. Верхняя граница нормы для мужчин
0,42 ммоль/л, для женщин 0,36 ммоль/л.
Первичная гиперурикемия - это
конституциональный диспуринизм, т. е. семейно-генетическая аномалия пуринового
обмена, детерминированная несколькими генами.
Причины:
) увеличение синтеза эндогенных
пуринов, так называемый метаболический тип гиперурикемии, характеризующийся
высокой урикозурией и нормальным клиренсом мочевой кислоты;
) нарушение выведения мочевой
кислоты почками (почечный тип гиперурикемии), обусловленный низким клиренсом
мочевой кислоты;
) сочетание обеих причин (смешанный
тип первичной гиперурикемии, проявлением которого является нормальная или
пониженная уратурия при нормальном клиренсе мочевой кислоты).
Факторы риска гиперурикемии:
переедание, неумеренное употребление алкоголя, гипертензия,
гипертриглицеридемия, стрессовые ситуации, дегидратация.
Наиболее частой причиной вторичной
гиперурикемии является почечная недостаточность. Некоторые болезни крови -
эссенциальная полицитемия, хронический миелолейкоз, хроническая гемолитическая
анемия, пернициозная анемия, миеломная болезнь могут сопровождаться
гиперурикемией вследствие распада клеточных ядер и усиленного катаболизма
клеточных нуклеотидов. Повышение содержания мочевой кислоты в крови может наблюдаться
при обширном псориазе вследствие обновления эпидермальных клеток кожи и
усиленного образования пуринов из клеточных ядер. У лиц, длительно страдающих
гипертонической болезнью, микседемой, гиперпаратиреозом, диабетом, токсикозом
беременности, свинцовой интоксикацией, может развиться гиперурикемия вследствие
торможения канальцевой экскреции и замедления выведения мочевой кислоты из
организма.
Основным механизмом развития подагры
является длительная гиперурикемия, в ответ на которую в организме возникает ряд
приспособительных реакций, направленных на снижение содержания мочевой кислоты
в виде повышения выделения мочевой кислоты почками и отложения уратов в тканях.
Гиперурикемия ведет к повышению содержания мочевой кислоты в синовиальной
жидкости, выпадению ее в виде кристаллов с последующим проникновением их в хрящ
и синовиальную оболочку, где они откладываются в виде игольчатых кристаллов
мочекислого натрия. Через дефекты хряща мочевая кислота проникает до кости
субхондрально, где, образуя тофусы, обуславливает деструкцию костного вещества.
Одновременно в синовиальной оболочке возникает синовиит с гиперемией,
пролиферацией синовиоцитов и лимфоидной инфильтрацией.
Подагрическая нефропатия -
собирательное понятие, включающее в себя всю почечную патологию, наблюдающуюся
при подагре: тофусы в паренхиме почки, уратные камни, интерстициальный нефрит,
гломерулосклероз и артериолосклероз с развитием нефросклероза. Отличительной
особенностью при подагре является поражение почек - интерстициальный нефрит
(вследствие повсеместного отложения в межуточной ткани почек уратов).
Первым клиническим проявлением
подагры является приступ острого артрита, развивающегося внезапно, как бы среди
полного здоровья, хотя за 1-2дня могут наблюдаться продромальные явления: общее
недомогание, нервозность, диспепсия, лихорадка, бессонница, озноб.
Факторы, провоцирующие острый
приступ подагры: переедание, особенно употребление пищи, богатой пуринами,
злоупотребление алкоголем, травмы и микротравмы, физическая перегрузка,
инфекции, изменение погоды, прием диуретиков.
Клиническая картина острого
подагрическая приступа состоит во внезапном появлении (обычно ночью) резчайших
болей, чаще всего в 1 плюснефаланговом суставе, с его припухлостью, яркой
гиперемией кожи и последующим шелушением. Эти явления быстро нарастают,
достигая максимума за несколько часов и сопровождаются лихорадкой, ознобом,
лейкоцитозом, увеличением СОЭ. Мучительные боли, усиливающиеся даже при
соприкосновении больного сустава с одеялом, обуславливают полную неподвижность
больной конечности. Через 5-6 дней признаки воспаления постепенно стихают и в
течение последующих 5-10 дней у большинства больных полностью исчезают.
Атипичные формы первого приступа
подагры:
) ревматоидоподобная форма с
затяжным течением приступа и локализацией процесса в суставах кистей или 1-2
крупных или средних суставах;
) псевдофлегманозная форма -
моноартрит крупного или среднего сустава с выраженными местными и общими
реакциями (резкий отек, гиперемия кожи, выходящие за пределы сустава, высокая
лихорадка);
) полиартрит, напоминающий
ревматический с быстрым обратным развитием;
) подострая форма с типичной
локализацией в суставах большого пальца ноги, но с небольшими подострыми
явлениями;
) астеническая форма - небольшие
боли в суставах без их припухлости;
) периартритическая форма с
локализацией процесса в сухожилиях и бурсах при интактных суставах.
Вторым характерным проявлением
подагры является отложение уратов под кожей с образованием плотных, довольно
четко отграниченных и возвышающихся над поверхностью кожи подагрических узлов
или тофусов. Они развиваются в среднем за 6 лет после первого приступа. Размеры
различные - от булавочной головки до небольшого яблока. Они локализуются на
ушных раковинах, в области суставов, чаще всего локтевых, коленных, на стопах,
кистях, в области пяточного сухожилия, сухожилий тыла кисти. При поверхностных
отложениях уратов сквозь покрывающую их кожу просвечивает содержание тофусов
белого цвета. При изъязвлении тофуса образуются свищи.
Наиболее характерным
рентгенографическим признаком поражения суставов при подагре являются
"пробойники" - округлые, четко очерченные дефекты костной ткани в
эпифизах вследствие образования костных тофусов в субхондральной кости.
Рентгенологические стадии
хронического подагрического артрита:
- крупные кисты (тофусы) в
субхондральной кости и в более глубоких слоях, иногда уплотнение мягких тканей;
- крупные кисты вблизи сустава и
мелкие эрозии на суставных поверхностях; постоянное уплотнение околосуставных
мягких тканей, иногда с кальцификатами;
- большие эрозии не менее чем на 1/3
суставной поверхности; остеолиз эпифиза, значительное уплотнение мягких тканей
с отложением извести.
Для выяснения гиперурикемии
определяют содержание мочевой кислоты в суточной моче после недельного
пребывания больного на диете с низким содержанием пуринов. Если за 24 часа
выделяется более 3,6ммоль/л мочевой кислоты, гиперурикемия обусловлена
повышенным образованием пуринов; если менее 1,8 ммоль/л - недостаточным
выделением уратов почками. Если 1,8-3,6 ммоль/л, гиперурикемия обусловлена
обоими механизмами.
Критерии диагностики подагры (Рим,
1963г.):
) повышение содержания мочевой
кислоты в сыворотке крови (более 0,42 ммоль/л у мужчин и у женщин 0,36
ммоль/л);
) тофусы;
) кристаллы урата натрия в
синовиальной жидкости или в тканях, выявленные при микроскопическом или
химическом исследовании;
) острые приступы артрита,
возникающие внезапно, с полной клинической ремиссией в течение 1-2 недель.
Критерии американской ревматической
ассоциации (1966 г.):
) более одной атаки острого артрита;
) воспаление сустава достигает
максимума в 1й день болезни;
) моноартикулярный характер артрита;
) покраснение кожи над суставами во
время атаки;
) припухание и боль в 1
плюснефаланговом суставе;
) одностороннее поражение 1
плюснефалангового сустава;
) одностороннее поражение суставов
стопы;
) подозрение на тофусы;
) гиперурикемия;
) асимметричные изменения суставов
на рентгенограмме;
) субкортикальные кисты без эрозий
на рентгенограмме;
) отсутствие флоры при посеве
синовиальной жидкости.
Наиболее сильным средством,
подавляющим острый подагрический артрит, является препарат безвременника -
колхицин. Механизм действия колхицина заключается в его подавляющем влиянии на
функции полиморфно-ядерных лейкоцитов - миграцию и фагоцитоз кристаллов урата. Доза
колхицина 1 мг. каждые 2 часа или 0,5 мг. через каждый час, но не более 4 мг. в
первые сутки лечения с последующим постепенным снижением дозы. На 2й и 3й день
дозу уменьшают на 1 и 1,5 мг/сут, на 4й и 5й день - на 2 и 2,5мг/сут
соответственно.
Эффективными средствами лечения
острой подагры являются также пиразолоновые (бутадион, реопирин, кетазон) и
индольные препараты (индометацин, метиндол).
Антиподагрическая диета должна быть
бедна пуринами, белками и липидами. Из рациона должны быть исключены все продукты,
богатые пуринами: мясные супы и экстракты, почки, печень, легкие, мозги, дичь,
раки, жирные сорта рыбы, жареное мясо, мясо молодых животных, бобовые растения
(горох, бобы, фасоль), зеленый горошек, цветная капуста.
Мясо или рыбу употребляют только в
вареном виде 2-3 раза в неделю. Из мясных продуктов рекомендуются куры и
ветчина. Количество белков не более 1 г/кг. Следует исключить продукты, богатые
жирами: яйца, колбасные изделия, жирные сорта молока и молочных продуктов.
Количество жиров не более 1 г/кг. Запрещаются алкогольные напитки, крепкий чай
и крепкий кофе. Больным подагрой не рекомендуется голодание. При избыточной
массе рекомендуются разгрузочные дни (овощные или фруктовые) 1 раз в неделю.
Для достаточного выведения мочевой кислоты больные должны иметь хороший диурез
(не менее 1,5 л/сут), поэтому рекомендуется обильное щелочное питье - до 2-2,5
л в день.
Базисные антиподагрические
препараты, применяемые для длительного лечения подагры, делят на:
) средства, уменьшающие синтез
мочевой кислоты путем ингибирования фермента ксантиноксидазы, превращающего
гипоксантин в ксантин, ксантин в мочевую кислоту (урикодепрессивные препараты);
) средства, повышающие экскрецию
мочевой кислоты путем реабсорбции уратов почечными канальцами (урикозурические
препараты).
К урикозурическим препаратам
относятся аллопуринол и его аналоги - милурит, тиопуринол, а также
гепатокаталаза, оротовая кислота. К группе урикозурических средств относятся
антуран, кетазон, пробенецид, этамид, ацетилсалициловая кислота (в больших
дозах).
ЛИТЕРАТУРА
ОСНОВНАЯ:
Внутренние болезни под ред. Комарова
Ф. И. - М., Медицина, 1990.
В. И. Маколкин, С. И. Овчаренко.
Внутренние болезни М., Медицина, 1994.
Окороков А. Н. Лечение болезней
внутренних органов. Практ. руководство в 3х т. Т.2 Мн., Выш. шк., 1996.
ДОПОЛНИТЕЛЬНАЯ:
Насонова А. А., Астапенко М. Г.
Клиническая ревматология. М., Медицина, 1989. Стр. 380-408.
Пихлюк Э. Г. Подагра. М., Медицина,
1970.
РЕВМАТОИДНЫЙ АРТРИТ
ВВЕДЕНИЕ
Ревматоидный артрит - это одно из
тяжелейших заболеваний суставов иммунокомплексного характера. Он занимает одно
из ведущих мест в ряду ревматических болезней, а по тяжести клинической картины
и своим последствиям (анкилозирование) не имеет себе равных среди других видов
артрита. Социальное значение ревматоидного артрита определяется его
распространенностью, нередко тяжелой инвалидизацией больных молодого (20-50
лет) возраста (10 % больных через 10-15 лет от начала заболевания становятся
инвалидами). Женщины болеют чаще мужчин примерно в 3-5 раз.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
. Ревматоидный артрит, определение,
этиопатогенез, классификация.
. Клинические проявления
ревматоидного артрита.
. Диагностика ревматоидного артрита.
. Лечение ревматоидного артрита.
ОТВЕТЫ НА ВОПРОСЫ
Ревматоидный артрит (РА) это одно из
тяжелейших заболеваний суставов иммунокомплексного характера.
Из всех больных РА 10 % через 10-15
лет становятся инвалидами. Женщины болеют в 3 раза чаще мужчин. Заболевание
может начинаться в любом возрасте, но чаще проявляется у молодых и в 40-50 лет
уже яркая картина. Поражаются в основном синовиальные суставы, процесс
локализуется в 1 или нескольких суставах и затем распространяется на другие.
Этиология неизвестна, хотя имеется
множество теорий. Не последнюю роль играет инфекция и травмы, однако эти теории
не объясняют всех механизмов и неудовлетворительны.
Доказано, что есть генетическая
предрасположенность к определенному патомеханизму РА, которая построена на
нарушении иммунного статуса, т. е. доказано, что РА - иммунокомплексное
заболевание. Существует 2 антигенных маркера РА: это антигены
гистосовместимости HLA - DR4 и DW4.У всех больных РА выявлены эти антигены.
Антиген гистосовместимости HLA - B8 означает, что человек высоко предрасположен
к аутоиммунным заболеваниям вообще.
Патогенез: в результате образования,
в силу неизвестных причин, иммунного комплекса - ревматоидного фактора, который
представляет собой антитела к Ig М и имеет тропность к синовиальным оболочкам,
вследствие выброса большого количества интерлейкина, вовлекается в процесс
масса клеток синовиальной оболочки и возникает гипертрофия синовиальных ворсин.
Отмечается выброс большого количества лизосомальных ферментов (в частности
протеолитических) и отдельные выросты паннуса приклеиваются к хрящу, костной
ткани и разрушают их, что приводит к образованию краевых узур. Через поры кости
выросты проникают внутрь и образуются кисты. Кость теряет свою прочность,
развивается остеопороз суставных концов кости. Когда этот процесс запущен, он
поддерживает себя и необратим.
Сначала клиническая картина
напоминает банальный воспалительный процесс (повышение кожной температуры,
припухлость, болезненность сустава). В течение длительного времени болезнь
проявляется микросимптомами (у 70-80 % больных): преходящие артралгии, артриты,
проходящие бесследно после лечения, незначительная утренняя скованность.
Клинически: поражаются проксимальные
межфаланговые суставы, 2-3 пястно-фаланговые суставы, обычно симметрично. Реже
могут поражаться коленные суставы, плечевые, лучезапястные, суставы стоп, но
тоже отмечается симметричность поражения.
Для начала заболевания характерна
припухлость, деформация сустава, боли, утренняя скованность, появляются
подвывихи и вывихи в суставах, обусловленные разрушением сустава и возникает
характерная ревматоидная кисть, напоминающая лапу моржа, пальцы в боковой
проекции напоминают лебединую шею. Пораженная зона сустава способствует
нарушению кровообращения и развивается амиотрофия, кисть как бы истощена.-
логические признаки:
.Остеопороз вблизи пораженного
сустава.
.Эрозии, кистовидные просветления,
узуры суставных поверхностей.
.Равномерное сужение суставной щели.
.Деструкция сустава с явлениями
фиброзного, а затем и костного анкилоза.
Выделяют 2 иммунологические формы
РА:
серопозитивный (в сыворотке крови
больного есть РФ в титре не менее 1:40)
серонегативный (РФ не
обнаруживается)
Внесуставные проявления РА:
ревматоидные узелки
кожный васкулит: синдром Рейно, язвы
голеней, дигитальный артериит
периферическая нейропатия
амиотрофия
лимфоаденопатия
ревматоидное легкое
поражение сердца: экссудативный
перикардит
поражение глаз: склериты, увеиты,
кератоконъюнктивиты, как проявление синдрома Шегрена
поражение почек: очень часто
интерстициальный нефрит, амилоидоз и в итоге ХПН
Диагностические критерии РА
(Американская ревматологическая ассоциация,1987г)
.Утренняя скованность более 1 часа.
.Артрит 3х и более суставов.
.Типичное поражение проксимальных
межфаланговых и пястно-фаланговых суставов.
.Симметричность поражения.
.Ревматоидные узелки.
.Ревматоидный фактор.
.R-логические изменения.
Для постановки диагноза необходимо
иметь 4 критерия, и они должны наблюдаться у больного не менее 6 недель.
Рабочая классификация:
По клинической характеристике:
моноартрит
олигоартрит
полиартрит
с системными проявлениями (васкулит,
нефрит и т. д.)
с преимущественным поражением
суставов
серопозитивный
серонегативный
По течению:
медленно прогрессирующий
быстро прогрессирующий
По степени активности:
нулевая - ремиссия
I - минимальная
II - умеренная
III - максимальнаялогическая стадия
по Штейнброкеру:
. околосуставной остеопороз
. сужение суставной щели и единичные
эрозии
. множественные узуры
. фиброзные или костные анкилозы
Функциональная способность:
сохранена, ограничена или утрачена.
Лечение РА включает:
базисную терапию
противовоспалительную терапию
Базисная терапия основана на
применении препаратов длительного действия. Это мощная терапия в первые 3-5 лет
заболевания, а иногда и всю жизнь.
препараты аминохинолинового ряда:
резохин, делагил, плаквенил
препараты золота: кризанол, тауридон
препараты Д-пенициламина: купренил,
металкоптаза
цитостатики: метотрексат,
азатиоприн, циклофосфан, сандиммун
сульфосалазин, салазопиридазин
левамизол
Обычно назначают один из препаратов
базисной группы, но при тяжелом течении их можно комбинировать:
Д-пенициламины с салазопиридазином
кризанол с метатрексатом
кризанол с Д-пенициламинами
комбинации цитостатиков как при
лейкозах
Противовоспалительная терапия: НПВС
и кортикостероиды
НПВС: Индометацин, вольтарен,
препараты пиразолонового ряда: реопирин, менее эффективны: флугалин, напроксен,
аспирин, хлотазол, ибупрофен.
Кортикостероиды можно назначать
внутрь: медрол, метилпреднизолон, метилпред, только в тяжелых случаях и не
более 2х месяцев.
Ни в коем случае не начинать с них,
т. к. будет быстрый и кратковременный эффект, но картина стирается и угнетается
пролиферация сохранившегося хряща.
Может использоваться пульс-терапия:
солюмедрол, бетаметазон, целестон.
Лучше применять ГКС в/суставно:
депо-медрол, кеналог, но не чаще 4 раз в год в один сустав.
Хирургическое лечение: синовэктомия,
пластика суставов.
Экстракорпоральные методы:
гемосорбция, плазмоферез.
Симптоматическая терапия.
Физиотерапия.
ЛИТЕРАТУРА
ОСНОВНАЯ:
В. И. Маколкин, С. И. Овчаренко
Внутренние болезни, М., Медицина,1994 г
Внутренние болезни под ред.Ф. И.
Комарова М.:Медицина,1991 г
ДОПОЛНИТЕЛЬНАЯ:
Дормидонтов С. Н., Коремунов Н. И.,
Фриден Б. Н. Ревматоидный артрит, М., Медицина,1981 г.
Копьева Г.Н. Патология ревматоидного
артрита, М., Медицина,1998
Насонова В. А., Астапенко М. Г.
Клиническая ревматология: Руководство для врачей, АМН СССР М., Медицина,1989г
Окороков А. Н. Лечение болезней
внутренних органов, том 2, Мн., Выш. школа, Витебск: Белмедкнига, 1996 г.
Практические навыки терапевта под
ред. Г. П. Матвейкова. Мн., Выш. школа, 1996 г.
Сорока Н. Ф. Боли в суставах.
Справочник
Сигидин Л. А. Ревматоидный артрит.
Диффузные болезни соединительной ткани, М., Медицина, 1994 г.
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА
В соответствие с современными
представлениями СКВ можно определить как хроническое полисиндромное заболевание
преимущественно молодых женщин и девушек, развивающееся на фоне генетически
обусловленного несовершенства иммунорегуляторных процессов, приводящего к
неконтролируемой продукции антител к собственным клеткам и их компонентам, с
развитием аутоиммунного и иммунокомплексного хронического воспаления. СКВ
встречается во всех климатогеографических зонах и на всех континентах.
Распространенность ее составляет 48 на 100000 населения.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ:
. Определение термина системная
красная волчанка. Эпидемиология. Этиология (современные аспекты). Роль вирусной
этиологии,
генетических факторов (антигены
гистосовместимости). Основные предрасполагающие факторы. Патогенез СКВ.
Развитие аутоиммунных и иммунокомплексных процессов.
. Классификация СКВ (Насонова В.А.,
1965-1986гг.) Клиника СКВ. Полисиндромность поражения. Артрит. Поражение кожи и
ее дериватов. Поражение сердечно-сосудистой системы: люпус кардит, атипичный
бородавчатый эндокардит Либмана-Сакса. Синдром Рейно. Пневмонит. Волчаночный
гломерулонефрит. Поражение нервно-психической сферы.
. Лабораторная диагностика СКВ.
Общий анализ крови. Биохимические показатели. Реакция Кумбса. Иммунологические
исследования: LE - клетки, АНА, АНФ, ЦИК, иммунофлюоресцентные тесты. Изменения
анализов мочи (общий анализ, анализ по Нечипоренко, анализ по Земницкому).
. Диагностика СКВ. Диагностические
критерии СКВ (АРА, пересмотра 1982г.).
. Дифференциальный диагноз СКВ с
ревматизмом, ревматоидным артритом, системной склеродермией, узелковым
периартериитом).
. Лечение больных СКВ. Режим. Диета.
Лечение гормональными и негормональными иммунодепрессантами, иммунотерапия.
Интенсивная терапия (пульс-терапия). Эфферентные методы лечения.
Диспансеризация. Прогноз. Профилактика.
ОТВЕТЫ НА ВОПРОСЫ
В настоящее время накоплены
косвенные данные о возможной роли хронической вирусной инфекции при СКВ
(повышение титров к ряду РНК-содержащих вирусов - кори, краснухи, парагриппа,
паротита и других, а также ДНК-содержащих - герпетических вирусов, вируса
Эпштейна-Барра, цитомегаловируса, вируса простого герпеса). Однако выявленная
корреляция с одновременным повышением содержания IgM и IgG в первом случае и
невозможность подтверждения присутствия вирусных частиц во втором позволили
отнести эти находки к разряду неспецифических, связанных с общей гипереактивностью
В-лимфоцитов и повреждением клеток в фазу высокой активности болезни. Имеются
некоторые данные о роли хронической вирусной инфекции, обусловленной латентными
или медленными вирусами (ретровирусами). Так, у больных СКВ и у окружающих их
близких людей обнаруживаются такие маркеры хронической вирусной инфекции, как
лимфоцитотоксические антитела, а у больных, родственников и медперсонала,
работающего с больными, антитела к вирусной двуспиральной РНК. Вновь повысился
интерес к вирусной инфекции в связи с обнаруженным сходством иммунных нарушений
при СКВ и СПИД.
Для обоих заболеваний характерны
лимфоцитопения, снижение количества Т-хелперов, снижение цитотоксичности,
нарушение функции моноцитов и активация В-лимфоцитарного синтеза, а также
увеличение ЦИК, бета-2 микроглобулина, антител к фосфолипидам, ревматоидных
факторов и др.
СКВ можно отнести к болезням с
полигенным предрасположением, критериями которых являются: семейная агрегация,
конкордантность монозиготных близнецов, связь с отдельными иммуногенетическими
маркерами и доказательство роли инбридинга в создании экспериментальных
моделей.
Многочисленными исследованиями
показана ассоциация между носительством определенных HLA и СКВ. При СКВ чаще
встречаются антигены HLA - А11, В7, а также DR2 и DR3, кроме того, отмечалось
некоторое снижение DR7.
Для СКВ характерно развитие
иммунного ответа по отношению к компонентам ядер и цитоплазмы клеток -
антинуклеарных антител (АНА). Характерной чертой СКВ является избыточная
продукция антител к нативной ДНК. При СКВ выявлен широкий спектр аутоантител к
ядерным антигенам - нДНК, антитела к дезоксинуклеопротеину, гистону, антитела к
цитоплазматическим антигенам. Патогенетическое значение АНА состоит в их
способности формировать ЦИК, которые, откладываясь в структурах различных
органов, могут вызывать их повреждение. Гиперпродукция АНА при СКВ обусловлена
избыточной активностью В-лимфоцитов, связанной с нарушением иммунорегуляторных
механизмов. Установлены нарушения как супрессорной, так и хелперной Т-клеточной
регуляции, недостаточная продукция интерлейкина-2 и/или экспрессия рецепторов
интерлейкина-2 и интерлейкина-1.
Наиболее типичны эритематозные
высыпания на лице в области скуловых дуг и спинки носа ("бабочка").
Повторяющие очертания "бабочки" воспалительные высыпания на носу и
щеках имеют большое диагностическое значение и наблюдаются в разных вариантах,
отличающихся выраженностью и стойкостью воспалительных явлений:
) сосудистая (васкулитная) бабочка -
нестойкое, пульсирующее, разлитое покраснение кожи с цианотичным оттенком в
средней зоне лица, усиливающееся при воздействии внешних факторов или волнении;
) "бабочка" типа
центробежной эритемы.
Среди кожных проявлений необходимо
отметать неспецифическую экссудативную эритему на коже конечностей, грудной
клетки, признаки фотодерматоза на открытых частях тела, очаги дискоидной
эритемы на лице, груди, конечностях. Большое диагностическое значение имеют
капилляриты на ладонях. Кожные высыпания часто сочетаются с энантемой на
твердом небе. Диагностическое значение имеют и другие поражения слизистой
оболочки полости рта - стоматит, поражение красной каймы губ.
Признаки классической
диагностической триады при СКВ - дерматит, артрит, полисерозит.
Особенно часто выявляют поражения
плевры, перикарда, реже - брюшины, обычной в виде сухого или выпотного,
серозиты. При этом выпоты, как правило, невелики. Артрит наблюдается в виде
мигрирующих артралгий или артритов, реже в виде стойкого болевого синдрома с
болевыми контрактурами.
Поражаются преимущественно мелкие
суставы кистей, лучезапястные, голеностопные суставы, но иногда и крупные. У
ряда больных может развиться деформация мелких суставов. На рентгенологическом
исследовании обнаруживается эпифизарный остеопороз преимущественно суставов
кистей и лучезапястных суставов; лишь при хроническом полиартрите и деформациях
отмечаются сужение суставной щелей, главным образом в межфаланговых суставах
кисти, реже в запястно-пястных и лучезапястных суставах, истончение
субхондральных пластинок, мелкие узуры суставных концов костей с подвывихами.
Эндокардит Либмана-Сакса -
характернейший патоморфологический признак СКВ. Для него характерно появление
грубого систолического шума и ослабление 1 тона на верхушке сердца, а также
усиление 2 тона на легочной артерии.
В основе люпус-пневмонита лежит
фиброзирующий, преимущественно интерстициальный, легочно-плевральный
симптомокомплекс, проявляющийся дыхательной недостаточностью в виде одышки,
болями в грудной клетке при дыхании, невозможностью глубокого вдоха, сухим
почти постоянным кашлем.
Рентгенологическая симптоматика
пневмонита - высокое стояние диафрагмы, стойкое усиление легочного рисунка и
деформация его очагово-сетчатого характера преимущественно в нижних и средних
отделах легких.
Люпус-нефрит - классический
иммунокомплексный нефрит - наблюдается в половине случаев, обычно в период
генерализации процесса. Встречаются различные варианты поражения почек -
изолированный мочевой синдром, нефритический, нефротический. Наибольшее
значение в распознавании волчаночной природы гломерулонефрита имеет биопсия
почек.
Поражение нервно-психической сферы
при СКВ. В самом начале болезни отмечается астеновегетативный синдром -
слабость, быстрая утомляемость, адинамия, раздражительность, подавленное
настроение, головная боль, нарушение сна. В разгар заболевания можно наблюдать
полиневрит с болезненностью нервных стволов, снижением сухожильных рефлексов,
чувствительности, парестезиями. Изредка отмечается поперечный миелит с
расстройствами функции тазовых органов, в тяжелых случаях -
минингоэнцефалополирадикулоневрит.
Наблюдаются быстропреходящие
изменения эмоциональной сферы, неустойчивое, подавленное настроение или
эйфория, бессонница, снижение памяти и интеллекта. Обычно могут быть бредовые
состояния, слуховые или зрительные галлюцинации, эпилептиформные припадки,
нарушение суждений, критики, переоценка своих возможностей.
Гематологические нарушения:
гемолитическая анемия; лейкопения (лейкоцитов менее 4*109/л) при двух
определениях и более; лимфопения (лимфоцитов менее 1,5*109/л) при двадцати
исследованиях и более; тромбоцитопения (менее 100*109/л) не связанная с приемом
лекарств.клетки, в основе которых лежат циркулирующие антитела к
дезоксирибонуклеопротеиду, представляют собой зрелые нейтрофилы, в цитоплазме
которых обнаруживаются круглые или овальные крупные включения в виде гомогенных
аморфных глыбок. Диагностическое значение имеет обнаружение их в количестве 5 и
более на 1000 лейкоцитов.
Наибольшее распространение получило
определение АНФ методом иммунофлюоресценции с использованием в качестве
субстрата ядер клеток крысиной печени или чаще клеточной культуры.
Значительно большее диагностическое
значение имеет определение антител к нДНК в средних и высоких титрах или
процентах связывания при использовании радиоизотопных методов. Абсолютное
диагностическое значение имеют антитела к Sm-ядерному антигену, однако они
обнаруживаются не более чем у 1/3 больных. Из других АНА можно определять
антитела к ДНП, РНП и другим компонентам ядра.
К диагностическим, следует отнести
иммунофлюоресцентные тесты для выявления фиксированных иммунных комплексов или
отдельно IgG, IgM и комплемента в биоптатах непораженной кожи предплечья
(базальная мембрана дермоэпидермального стыка) и почки (базальная мембрана
клубочка).
Глюкокортикостероиды являются
лекарствами первого ряда при СКВ. Критерии эффективности терапии ГКС:
уменьшение активности процесса, поддерживающие дозы гормональных препаратов,
объективно определяющие устойчивую стабилизацию заболевания, продолжительность
жизни от начала лечения, трудоспособность больных.
Для выбора индивидуальной дозы ГКС
следует руководствоваться вариантом течения болезни и степенью ее активности,
характером органной патологии к началу лечения, возрастом больных, характером
предыдущего лечения (наличие синдромов отмены).
При остром течении с самого начала
болезни, а при подостром и хроническом течении при III-II степени активности
патологического процесса показаны ГКС. Преднизолон в подавляющей дозе 40-50
мг/сут назначают при остром и подостром течении болезни (III степень
активности), а при наличии нефротического синдрома или менингоэнцефалита - в
дозе 60 мг и более. При остром и подостром течении II степени активности СКВ, а
также при хроническом течении III-II степени активности подавляющая доза должна
быть меньше 30-40 мг, а при I степени активности 15-20 мг/сут.
Продолжительность приема преднизолона в подавляющей дозе определяется снижение
клинико-лабораторных параметров активности до уровня 1 степени, а при
нефротическом синдроме и мозговой симптоматике - до уменьшения клинических
признаков, т. е. не менее 3 мес., а при необходимости до 6 мес. и более.
Показания к назначению цитостатиков:
) высокая активность процесса и
быстро прогрессирующее течение;
) активные нефротический и
нефритический синдромы;
) недостаточная эффективность ГКС;
) необходимость быстро уменьшить
подавляющую дозу преднизолона из-за плохой переносимости и выраженности
побочных эффектов;
) необходимость уменьшить
поддерживающую дозу преднизолона, если она превышает 15-20 мг/сут;
) кортикостероидозависимость.
Пульс-терапия показана при быстром
развитии почечной патологии, особенно нефротического синдрома, прогрессировании
болезни, высокой поддерживающей дозе ГКС, т. е. в случаях, когда обычная
терапия уже неэффективна.
Внутривенно назначают 1000 мг
метилпреднизолона 3 дня подряд или 3 раза через день. В этой дозе препарат
вводят капельно одномоментно в 100 мг изотонического раствора хлорида натрия
или по 500 мг в 2 приема. В капельницу добавляют 5000 ед. гепарина, при
необходимости супрастин.
При комбинированной пульс-терапии в
1й день внутривенно капельно в течение 30-40 мин вводят 1000 мг
метилпреднизолона и 1000 мг циклофосфана, а в последующие 2 дня больные
получают капельно по 1000 мг метилпреднизолона. В капельницу добавляют 100 мл
изотонического раствора хлорида натрия, 5000-10000 ед. гепарина.
ЛИТЕРАТУРА
ОСНОВНАЯ:
Внутренние болезни под ред. Комарова
Ф. И. М., Медицина, 1991.
В. И. Маколкин, С. И. Овчаренко.
Внутренние болезни М., Медицина, 1994.
Окороков А. Н. Лечение болезней
внутренних органов. Практ. руководство в 3х т. Т.2 Мн., Выш. шк., 1996.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА:
Насонова А. А., Астапенко М. Г.
Клиническая ревматология. М. Медицина, 1989. Стр. 432-497.
Справочник ревматолога Матвейков и
др., 1983.
Горбачев В. А. Трудности и ошибки в
диагностике некоторых заболевания сердечно - сосудистой системы, Минск, 1978.
Стр. 127-138.
Насонова В. А. Системная красная
волчанка, М., 1972. - 246 с.
Тареев Е. М. Коллагенозы. М.,
Медицина, 1965. - 380 с.
Серов В. В., Шехтер А. Б.
Соединительная ткань. М., Медицина, 1981. - 312 с.
СИСТЕМНАЯ СКЛЕРОДЕРМИЯ.
ДЕРМАТОМИОЗИТ
ВВЕДЕНИЕ
В международной классификации
болезней и причин смерти в классе "Болезни соединительной ткани и
опорно-двигательного аппарата" выделяется подкласс диффузных болезней
соединительной ткани, в который включена группа нозологических форм,
характеризующихся системным типом воспаления различных органов и систем,
сочетающимися с развитием аутоиммунных и иммунокомплексных процессов, а также
избыточным фиброзированием. Особенностью этих заболеваний является мультифакториальный
тип предрасположения с определенной ролью иммуногенетических факторов,
связанных с 6й хромосомой. Эти заболевания отличаются схожестью отдельных
клинических проявлений, особенно в ранней стадии болезни, и необходимостью
проведения дифференциальной диагностики, общими лабораторными показателями
воспалительной активности, общими групповыми маркерами и, наконец, близкими
принципами противовоспалительного, иммуносупрессивного лечения.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
. Системная склеродермия,
определение, этиология, патогенез.
. Классификация системной
склеродермии.
. Клинические проявления системной
склеродермии.
. Диагностика и диф. диагностика
системной склеродермии.
. Лечение системной склеродермии.
Прогноз.
. Дерматомиозит, определение,
этиология, патогенез, классификация.
. Клиника дерматомиозита.
. Диагностика и диф. диагностика
дерматомиозита.
. Лечение, прогноз при
дерматомиозите.
ОТВЕТЫ НА ВОПРОСЫ
Системная склеродермия -
прогрессирующее полисиндромное заболевание с характерным поражением кожи, опорно-двигательного
аппарата, внутренних органов и вазоспастическими реакциями (синдром Рейно), в
основе которого лежат процессы дезорганизации соединительной ткани с
преобладанием фиброзно-склеротических изменений и сосудистая патология по типу
облитерирующего эндартериолита.
В основе патогенеза ССД лежит
гиперпродукция коллагена с последующим нарушением образования коллагеновых
фибрилл.
Дезорганизация соединительной ткани
сопровождается нарушением иммунитета, воспалительными реакциями с преобладанием
пролиферативных и дегенеративных изменений. Поражаются сосуды преимущественно
микроциркуляторного русла, в них отмечается утолщение, гиперплазия интимы с
быстрым развитием склероза, концентрическим сужением или пол ной облитерацией
их просвета.
Этиология неизвестна, но
предполагают, что причинами развития ССД могут быть:
генетическая предрасположенность
охлаждение
травмы
стрессовые ситуации
эндокринные сдвиги
очаги хронической инфекции
Клиника: Первыми и наиболее ранними
симптомами являются слабость, утомляемость, снижение веса, ухудшение аппетита,
периодические артралгии различной интенсивности, зябкость и парестезии
дистальных отделов конечностей.
Синдром Рейно может быть ранним
признаком всех болезней соединительной ткани, но для ССД - это ведущий признак,
встречается в 100% случаев и задолго до основных проявлений ССД.
Наиболее частые варианты клинических
проявлений: длительно существующий синдром Рейно, поражение легких - одышка,
связанная с реализацией синдрома Рейно в легких, дисфагия, боли в животе по
типу "абдоминальной жабы", классические кожные проявления, поражение
сердца, почек.
Поражение кожи протекает в несколько
стадий:
. Стадия плотного отека: кожа
блестящая, отечная, без морщин, бледная - "маскообразное лицо",
"муляжные руки".
. Стадия индурации (уплотнения):
спаянность кожи с подлежащими тканями, т.е. ее нельзя сместить, собрать в
складку, почти полное исчезновение подкожно-жирового слоя, черты лица заостряются,
губы тонкие, зубы обнажаются, глаза широко открыты, все больные становятся
похожими: нос тонкий как лезвие, лицо называется птичьим, на пальцах рук
стойкие сгибательные контрактуры - симптом "птичьей лапы", кожа
пестрая из-за отложения пигмента.
. Стадия атрофии или мумификации:
кожа плотная, атрофичная, ногти ломкие, очаговая аллопеция. Выражены
трофические нарушения.
Поражение слизистых оболочек:
конъюнктивит, стоматит, ринит, фарингит.
Поражение ОДА: миалгии, атрофии
мышц, фиброзирующий миозит и мышечные контрактуры, приводящие к псевдоартритам.
В результате нарушения микроциркуляции - остеолиз костной ткани, особенно
пальцев рук и ног. Кальций, вымываясь из костей, откладывается в окружающих
мягких тканях - оссифицирующий миозит (синдром Тибьерж-Вейсенбаха).
Поражение сердца: склеродермический
миокардоз и прогрессирующая сердечная недостаточность.
Поражение легких: диффузный
базальный пневмосклероз, на фоне усиления легочного рисунка кистозные изменения
в виде пчелиных сот. Нарастающая легочная гипертензия и усугубление сердечной
недостаточности.
Поражение ЖКТ: встречается у 90 %
больных. Отмечается замещение мышечного и подслизистого слоя соединительной
тканью, что приводит к дискинезии ЖКТ, нарушению всасывания по типу синдрома
мальабсорбции и кахексии.
Поражение почек: склеродермическая
почка - постепенное развитие фиброза и ХПН. Возможно острое поражение по типу
острого гломерулонефрита с быстрым развитием ХПН.
Поражение нервной системы:
ВНС: нарушение терморегуляции,
потоотделения и кожные вазомоторные реакции.
ЦНС: признаки нарастающего склероза
сосудов головного мозга с нарушением интеллекта, очаговой симптоматикой.
ПНС: полиневриты с двигательными и
чувствительными расстройствами.
Лабораторные данные: специфических
тестов нет.
В крови: умеренная анемия, может
отмечаться лейкоцитоз или лейкопения, сдвиг формулы влево, умеренное увеличение
СОЭ, повышение остро фазовых показателей. У 40 % выявляется ревматоидный
фактор. У 40 % отмечено увеличение экскреции оксипролина с мочой вследствие
нарушения метаболизма коллагена.
Классификация ССД:
По стадии развития:
. Начальная: синдром Рейно,
артралгии, одышка, кашель, дисфагии, боли животе.
. Генерализованная: изменения кожи,
подкожно-жировой клетчатки, костей.
. Терминальная: далеко зашедшие
дистрофические, склеротические и сосудисто-некротические изменения с
функциональной недостаточностью органов.
По течению:
острое
подострое
хроническое - встречается наиболее
часто
Диагностические критерии:
Основные:
. Периферические:
синдром Рейно
поражение кожи
суставно-мышечный синдром с
контрактурами
остеолиз
синдром Тибьерж-Вассельбаха
. Висцеральные:- базальный
пневмосклероз
крупноочаговый кардиосклероз
поражение ЖКТ
склеродермическая почка
Дополнительные: - трофические
нарушения
потеря веса
полисерозит
Диагностическое значение имеет
биопсия кожно-мышечного лоскута, где выявляются изменения микроциркуляции.
Лечение:
Режим. Диета.
Медикаментозное лечение:
. Препараты Д-пенициламина
. Кортикостероиды в небольших дозах
только при активном воспали тельном процессе.
. Иммунодепрессанты в тяжелых
случаях.
. Препараты, улучшающие
микроциркуляцию: антагонисты ионов кальция, антиагреганты, симпатолитики.
Физиотерапевтическое лечение:
тепловые процедуры, грязи, массаж, электрофорез с лидазой на пораженные участки
кожи, сероводородные, радоновые ванны.
ДЕРМАТОМИОЗИТ.
ДЕРМАТОМИОЗИТ - это системное
воспалительное заболевание скелетной и гладкой мускулатуры и кожи.
У 25 % больных кожа не поражается, и
тогда заболевание называют полимиозитом. У 30 % больных заболевание развивается
в результате имеющейся в организме злокачественной опухоли и является ее
клиническим выражением.
Этиология и патогенез изучены
недостаточно. Предполагается персистирующая вирусная инфекция.
В патогенезе наиболее признана
иммунная теория, которая рассматривает дерматомиозит как реакцию сенсибилизации
на различные антигены и раздражители (опухоли, инфекции, травмы). У больных
обнаруживаются сенсибилизированные лимфоциты к антигенам мышечной ткани. В
клетках находят вирусоспецифические включения.
Патоморфологически: очаговые
воспалительные изменения в мышцах в виде инфильтратов, состоящих
преимущественно из лимфоцитов и гистиоцитов, плазматических клеток и
эозинофилов, локализующихся в межмышечной соединительной ткани, вокруг мелких
сосудов. Характерен также некроз мышечных волокон, регенерация и избыточный
фагоцитоз. При хронизации процесса - развитие фиброза и атрофия мышечных
волокон.
Диагностические критерии:
. Кожный синдром: эритема открытых
частей тела в виде свежего солнечного ожога или пурпурно-меловой оттенок кожи,
то же и над суставами - дерматомиозитические очки: параорбитальный отек и
эритема верхнего века с меловым оттенком; капиллярит ладоней, подушечек
пальцев; плотный тестоватый отек лица, кистей, стоп, голеней, туловища
. Скелетно-мышечный синдром:
генерализованное поражение поперечно-полосатой мускулатуры и на ранних этапах
нарастание мышечной слабости мышц плечевого пояса и проксимальных отделов
нижних конечностей без признаков полиневрита, миалгии при движениях,
надавливании, отек мышц, позже развивается склероз, уплотнение мышц и их
атрофия на проксимальных отделах конечностей. Больные не могут сидеть, стоять,
походка шаткая, далее самостоятельно не могут встать с постели.
. Висцерально-мышечный синдром:
поражение дыхательных мышц, включая диафрагму (высокое стояние диафрагмы,
вялость ее дыхательных экскурсий), что приводит к возникновению одышки,
снижению ЖЕЛ и дыхательной недостаточности; поражение гладких мышц ЖКТ:
дисфагия с поперхиванием, пища выходит через нос, гнуса вый голос в результате
поражения мышц глотки, пищевода и гортани; поражение сердца: миокардит,
миокардиодистрофия и в результате сердечная недостаточность.
. Общие явления: тяжелое общее
состояние, лихорадка, выпадение волос, аменорея.
. Лабораторные данные: креатинурия,
повышение активности в крови АЛТ, АСТ, альдолазы, креатинфосфокиназы, ЛДГ.
Диагноз достоверен при наличии 2-3
признаков с обязательным кожным и/или мышечным синдромом, т. к. с поражения
внутренних органов дерматомиозит не начинается.
Подтверждение диагноза: биопсия
кожно-мышечного лоскута, электромиография, но они неспецифичны.
Лечение: Базисная терапия состоит в
назначении больших доз кортикостероидов длительно.
Симптоматическая терапия.
Прогноз неблагоприятный, средняя
продолжительность жизни 5-10 лет.
ЛИТЕРАТУРА
ОСНОВНАЯ:
В. И. Маколкин, С. И. Овчаренко.
Внутренние болезни М., Медицина. 1994 г
Внутренние болезни под редакцией Ф.
И. Комарова М., Медицина. 1991 г
Лекционный материал.
ДОПОЛНИТЕЛЬНАЯ:
А. А. Насонова, М. Г. Астапенко.
Клиническая ревматология М., Медицина 1989 г.
Внутренние болезни под ред.
Харрисона Т. Р. книга 7 М., Медицина 1996 г.
ФУНКЦИОНАЛЬНЫЕ ЗАБОЛЕВАНИЯ КИШЕЧНИКА
ВВЕДЕНИЕ
Функциональные заболевания кишечника
- весьма распространенное явление и самый частый вид функциональной патологии желудочно-кишечного
тракта. Функциональные заболевания кишечника отмечаются у 40-70 % больных
гастроэнтерологического профиля. Поскольку кишечник представляет собой огромное
рецептивное поле и является активным в гормональном отношении, психогенные
влияния довольно часто вызывают нарушения его деятельности. К
функциональным заболеваниям кишечника относят дискинезии, диспепсии, синдром
раздраженной кишки, функциональный запор. Заболевание встречается у женщин
чаще, чем у мужчин. Заболевание может начаться в детском возрасте, но чаще
всего дебют болезни приходится на третье или четвертое десятилетие жизни.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
Функциональные заболевания
кишечника. Определение.
Дискинезии кишечника (первичные и
вторичные). Основные варианты нарушения моторики кишечника. Клиническая
картина. Диагноз.
Синдром раздраженного кишечника.
Дифференциальный диагноз с органическими заболеваниями кишечника, роль
рентгенконтрастных, эндоскопических исследований. Лечение. Профилактика.
Запор. Этиологические факторы, основные
патогенетические механизмы. Клиническая картина. Классификация. Основные методы
исследования моторики кишечника. Роль эндоскопии. Лечение. Дифференцированная
терапия запора в зависимости от этиологических факторов и патогенеза.
ОТВЕТЫ НА ВОПРОСЫ
Дискинезия кишечника.
Дискинезия кишечника - комплекс
кишечных расстройств, обусловленных нарушениями двигательной функции кишечника
при отсутствии его органических изменений.
Чаще всего в клинике дискинезий
преобладают нарушения функций толстой кишки, функциональные расстройства тонкой
кишки менее выражены и обычно протекают скрыто.
Классификация дискинезий толстой
кишки (Фролькис А. В., 1986 г.)
По этиологии:
первичная;
вторичная (гастрогенная,
гепатогенная, панкреатогенная, аллергическая, медикаментозная)
По клиническому течению:
с запором (изменчивым стулом);
с безболевым поносом;
с изолированным болевым синдромом;
со слизистой коликой.
По характеру двигательных нарушений
кишечника:
с преобладанием гипермоторики
(гиперкинетическая);
с преобладанием гипомоторики
(гипокинетическая).
При первичной дискинезии
двигательные нарушения кишечника и связанная с ними симптоматика представляют
собой основное ведущее проявление болезни.
При вторичной дискинезии
двигательные нарушения являются следствием другого заболевания, это
симптоматическая дискинезия.
Этиология и патогенез функциональных
заболеваний толстой кишки достаточно сложны. Общепризнанна роль психогенных
факторов.
Среди других этиологических факторов
дискинезий кишечника следует указать на роль инфекционного фактора (шигелл,
вируса гепатита и др.)
В качестве причины дискинезий
кишечника упоминают также некоторые виды пищевой нетолерантности. Это может
быть связано с влиянием отдельных компонентов пищи на моторику кишечника в
связи с ее извращенной реакцией на многие нервные и гуморальные раздражители
(гастрин, холецистокинин). Нередко встречается непереносимость отдельных
пищевых продуктов психогенного генеза.
Определенное значение придается
гипокинезии, а также изменениям характера питания со снижением содержания в
пище продуктов, богатых пищевыми волокнами.
Нарушения двигательной деятельности
толстой кишки у больных с дискинезиями кишечника характеризуются следующими
признаками:
усилением сокращений кишечной стенки
у больных запорами и ослаблением их при поносах;
усилением ретроградных сокращений
кишки;
корреляцией моторики и болей;
усилением двигательной реакции кишки
на прием пищи;
усилением двигательной реакции кишки
на введение парасимпатомиметических средств, холецистокинина;
повышенной двигательной реакцией
кишки на эмоциональные воздействия, на стресс;
увеличением продолжительности
низкочастотного (3 цикла в мин.) ритма миоэлектрической активности кишки.
Указанные расстройства являются
основным патофизиологическим механизмом дискинезий толстой кишки, который и
определяет возникновение их клинических симптомов.
Нарушения моторики вызывают
изменения скорости транзита содержимого по кишечнику и в связи с этим являются
ведущим механизмом расстройств стула, особенно запоров.
Дифференциальная диагностика гипер-
и гипомоторных нарушений толстой кишки
|
Метод исследования кишечника
|
Тип нарушений моторики
|
|
Гипермоторные
|
Гипомоторные
|
|
Пальпация живота
|
Сигмовидная кишка сокращена, перистальтирует, прощупываются
комки кала
|
Сигмовидная кишка расширена, не перистальтирует, комки кала не
прощупываются
|
|
Пальцевое исследование прямой кишки
|
Прямая кишка пуста, может быть болезненна
|
Прямая кишка может быть расширена
|
|
Осмотр кала
|
Кал фрагментирован, бобовидный, иногда лентовидный,
шнурообразный
|
Кал может быть объемным
|
|
Ректороманоскопия
|
Слизистая оболочка кишки влажная, видна перистальтика, быстро
меняется окраска.
|
Слизистая оболочка кишки сухая, тусклая, прямая кишка иногда
спавшаяся
|
|
Колоноскопия
|
Циркулярные складки высокие, пространства между ними уменьшены,
просвет кишки сужен, большая его часть закрыта гаустрами
|
Циркулярные складки снижены, пространства между ними увеличены,
просвет кишки расширен, открыт для осмотра
|
|
Рентгенологическое исследование
|
Гаустрация глубокая, частая, кишка сужена
|
Кишка может быть растянута, гаустрация слабо выражена
|
|
Тензографическое исследование
|
Показатели амплитудных и временных характеристик повышены
|
Показатели амплитудных и временных характеристик снижены
|
Синдром раздраженного кишечника.
(СРК) - комплекс функциональных
расстройств толстой кишки, продолжающийся свыше 3 месяцев.
Этиологические факторы:
нервно-психические факторы и
психоэмоциональные стрессовые ситуации;
нарушение привычного режима питания;
недостаточное содержание балластных
веществ, растительной клетчатки в рационе;
малоподвижный образ жизни,
отсутствие надлежащего санитарно-гигиенического состояния туалета (способствует
подавлению позывов на дефекацию и развитию запоров);
гинекологические заболевания
(вызывают рефлекторные нарушения моторики толстой кишки)
эндокринные нарушения - климакс,
дисменорея, предменструальный синдром, ожирение, гипотиреоз, сахарный диабет и
др.;
перенесенные острые кишечные
инфекции с последующим дисбактериозом.
В патогенезе СРК в основном
участвуют те же механизмы, что и при дискинезиях кишечника, частным видом
которых СРК является.
У многих больных с СРК имеются
избыточная микробная контаминация в тонкой кишке и дисбактериоз толстой кишки.
В результате жизнедеятельности бактерий в тонкой кишке в избыточном количестве
могут образовываться и накапливаться свободные (деконъюгированные) желчные
кислоты, гидроксиды жирных кислот, бактериальные токсины, протеазы и различные
метаболиты (фенолы, биогенные амины и др.) В результате в толстую кишку
поступает химус, обладающий агрессивными свойствами, что приводит к
расстройствам моторно-секреторной функции кишки. Чрезмерная сократительная
активность и двигательные расстройства толстой кишки являются основными
причинами болей.
По классификации Weber и Mc. Callum
(1992 г.) выделяют три основных варианта СРК:
вариант с преобладанием диареи:
жидкий стул 2-4 раза в сутки, преимущественно в утренние часы после завтрака,
иногда с примесью слизи и остатков непереваренной пищи, неотложные
(императивные) позывы на дефекацию (изредка), отсутствие диареи в ночное время;
вариант с преобладанием запоров:
отсутствие дефекации в течение 3 и более суток, чередование запоров и поносов,
чувство неполного опорожнения кишечника;
вариант с преобладанием болей в
животе и метеоризма: схваткообразные боли, усиливающиеся перед актом дефекации
и исчезающие после опорожнения кишечника, вздутие живота (метеоризм),
напряжение передней брюшной стенки и болезненность по ходу всех отделов
кишечника.
Ведущим клиническим симптомом при
СРК являются боли в животе, которые чаще сочетаются с запорами, а иногда
возникают и при нормальном стуле. В небольшой группе больных боли отсутствуют,
а преобладающим симптомом является диарея. При запорах стул твердый, в виде
маленьких шариков. При поносах стул скудный по объему, жидкий или мягкой
консистенции, может быть и гетерогенным, когда оформленная первая порция
сменяется жидкой или кашицеобразной. Как при поносах, так и при запорах
возможна примесь слизи, но никогда не обнаруживается кровь, если нет геморроя
или сфинктерита. Слизь появляется, вероятно, в результате преобладания
парасимпатической иннервации на функцию бокаловидных клеток. Иногда слизи
много, она выделяется комками или лентами, прозрачная или беловатого цвета.
Сопутствующие заболевания органов
пищеварения, часто встречающаяся аэрофагия, а также дисбактериоз кишечника и
вторичная гиполактазия обусловливают отрыжку воздухом, вздутие живота, урчание,
переливание в нем, повышенное отхождение газов, тошноту, неприятный вкус во
рту, боли в пилородуоденальной зоне. Нарушения психологического статуса приводят
к быстрой утомляемости, слабости, головным болям, пониженному аппетиту,
нарушению сна, парестезиям, сердцебиению, потливости, приступам "нехватки
воздуха", учащенному мочеиспусканию, субфебрильной температуре. Ряд
больных страдают канцерофобией. Потеря массы тела нехарактерна.
При осмотре пальпируется спастически
сокращенная болезненная нисходящая ободочная кишки, иногда восходящая и
поперечная ободочные. Спазм различных отделов толстой кишки, так же как и
болезненность при пальпации, непостоянен и может менять локализацию в разные
дни. Во время проктологического исследования часто наблюдаются спазмы сфинктера
заднего прохода и болезненность.
Диагностические критерии СРК
(международная рабочая встреча экспертов в Риме 1989, 1992 гг. Thompson, Creed,
Drossman)
Непрерывное сохранение или
рецидивирование следующих симптомов на протяжении, по крайней мере, 3 месяцев:
Боль или дискомфорт в животе,
которые уменьшаются после дефекации или сопровождаются изменением частоты стула
или консистенции стула в сочетании, по крайней мере, с двумя из следующих
признаков:
Изменение частоты стула (более 3 раз
в день или менее 3 раз в неделю)
Изменение формы стула
Нарушение пассажа стула (напряжение,
императивные позывы, ощущение неполного опорожнения кишечника)
Выделение слизи
Вздутие живота
Кроме указанных диагностических
критериев следует учитывать следующие симптомы:
Отсутствие болей и диареи в ночное
время;
Отсутствие так называемых
"симптомов тревоги" (примеси в кале, лихорадка, необъяснимое
похудание, анемия, увеличение СОЭ и др.)
Длительный анамнез заболевания,
изменчивый характер жалоб, несоответствие между обилием и
"красочностью" жалоб и хорошим общим состоянием больного;
Отсутствие прогрессирования болезни;
Связь ухудшения самочувствия с
психоэмоциональными факторами и стрессовыми ситуациями;
Отсутствие патологических изменений
со стороны общего и биохимического анализов крови, а также признаков
органических изменений при колоноскопии, ректороманоскопии, ирригоскопии,
нормальная гистологическая картина биоптатов слизистой оболочки толстой кишки.
Для выявления тех или иных нарушений
двигательной функции желудочно-кишечного тракта в настоящее время используется
много различных инструментальных диагностических методов.
Наиболее старым из них является
рентгенологический метод, который находит, однако, сейчас весьма ограниченное
применение. Это связано с тем, что изучение двигательной функции любых отделов
пищеварительного тракта требует определенного времени, тогда как
продолжительность пребывания больного за рентгеновским экраном строго
ограничена.
Сцинтиграфический метод
предусматривает прием больным пищи, меченной радиоактивными изотопами технеция
или индия. Последующая регистрация показателей датчика позволяет сделать вывод
о скорости эвакуации пищи из желудка.
Ультразвуковой метод получает в
настоящее время все более широкое распространение при исследовании моторики
пищеварительного тракта. Применение специальных ультрасонографических методик
позволяет оценить характер эвакуации из желудка, сократительную способность желчного
пузыря.
Манометрический метод осуществляется
технически с помощью баллонной кимографии или методики открытых катетеров. Он
дает возможность определить тонус различных участков желудочно-кишечного тракта
(например, давление в нижнем пищеводном сфинктере или сфинктере Одди).
Регистрация электрической активности
мышечных клеток позволяет сделать вывод о состоянии тонуса и перистальтики тех
или иных отделов пищеварительной системы. На этом основаны методы
электрогастрографии и электромиографии, с помощью которых, в частности,
определяют тонус желудка и анального сфинктера.
Широкое распространение в
клинической практике получило в настоящее время суточное мониторирование
внутрипищеводного рН. Каждый эпизод гастроэзофагеального рефлюкса
сопровождается падением нормальных показателей рН в просвете пищевода (5,5-7)
ниже 4. Мониторируя показатели внутрипищеводного рН на протяжении 24 ч., можно
определить общее число эпизодов гастроэзофагеального рефлюкса в течение суток
(в норме не больше 50) и их общую продолжительность (в норме не более 1 ч.).
Кроме того, сопоставляя данные рН-граммы с записями в дневнике больного, в
котором он фиксирует время приема пищи, возникновения и исчезновения болей,
приема лекарственных препаратов и т.д., можно определить, связаны ли
возникающие у больного боли в подложечной области или области сердца с наличием
в этот момент гастроэзофагеального рефлюкса.
Перспективным методом исследования
двигательной функции кишечника является дыхательный тест с Н+, основанный на
определении в выдыхаемом воздухе Н+ после предварительного приема лактулозы,
меченной данным изотопом. После приема внутрь лактулоза начинает расщепляться
только в слепой кишке. Поэтому по времени, которое проходит с момента приема
меченной лактулозы до появления Н+ в выдыхаемом воздухе, можно судить о
продолжительности орально-цекального транзита.
Лечение СРК
Лечебное питание: Больным с
преобладанием запоров назначают диету № 3. Хороший эффект оказывают пшеничные
отруби. Больным с преобладанием поносов в период обострения назначают диету № 4
в.
Устранение психоэмоциональных
нарушений: помощь психоневролога или психотерапевта.
Регуляция моторно-эвакуаторной
функции кишечника.
При поносах симптоматический эффект
оказывают препараты, тормозящие продвижение химуса по ЖКТ: иммодиум (лоперамид)
по 0,002-0,004 г. (1-2 капсулы) утром после жидкого стула, фосфат кодеина,
назначаемый по 0,015 г. 3 раза в день за 30 мин. до еды.
При атонических вариантах нарушения
моторики - дебридат (тримебутин малеат), который относится к синтетическим
энкефалинам и оказывает регулирующее влияние на моторику кишечника путем
воздействия на энкефалиновые рецепторы энтериновой системы. Назначают дебридат
по 0,1-0,2 г. 3 раза в день. Курс лечения 2-4 недели и более.
Прокинетики: координакс по 0,005 г.
3 раза в день, реглан (церукал, метоклопрамид) по 0,01 г. 3 раза в день за
10-15 мин. до еды.
При спастических формах показаны
спазмолитики: но-шпа 0,04 г 4 раза в день, папаверина гидрохлорид 0,04 г. 3-4
раза в день, платифиллина гидротартрат 0,05 г. 3 раза в день.
В качестве прокинетиков могут
использоваться антагонисты ионов Са++, нифедипин, верапамил, дилтиазем,
оказывающие спазмолитическое действие на гладкие мышцы кишечника. Созданный
недавно препарат дицетел представляет собой прототип нового класса антагонистов
Са++. Он оказывает спазмолитическое действие, но не обладает
антихолинергическими кардиоваскулярными эффектами и может оказаться
перспективным в лечении СРК.
Новые препараты цилансетрон и
алосетрон усиливают тонус и моторику ЖКТ, уменьшают тошноту и рвоту, а также
время транзита содержимого по кишечнику. Они относятся к группе селективных
конкурентных антагонистов серотониновых 5-НТ3-рецепторов в периферических
тканях и ЦНС. Их назначают по 4-8 мг. в день в течение 2-4 недель и более.
Антибактериальные и бактериальные
препараты.
Клиническими показаниями для
назначения антибактериальных препаратов при СРК являются упорные поносы, не
поддающиеся лечению диетой и вяжущими средствами, стойкий выраженный метеоризм
и выраженные боли в животе.
Рекомендуются следующие препараты:
Сульфаниламиды: сульгин, фталазол по
1 г. 3 раза в день, бисептол-480, бактрим по 1 таб. 2 раза в день.
Производные нитрофурана: фурадонин,
фуразолидон по 0,1 г. 4 раза в день, эрсефурил по 1-2 капсулы 4 раза в день в
течение 5 дней.
Метронидазол (трихопол) по 0,5 г. 3
раза в день после еды 10 дней.
Производные оксихинолона: интетрикс
1 капс. 3 раза в день 5 дней, нитроксолин 0,1 г. 4 раза в день 7-10 дней,
невиграмон (неграм) по 0,5 г. 4 раза в день 7-10 дней.
После окончания курса
антибактериальной терапии обычно назначают бактериальные препараты:
бифидумбактерин по 5-10 доз в сутки до еды в течение 1,5-2 мес. Бактисубтил от
3 до 6 капсул в день 5-10 дней. Хилак форте по 40-60 капель 3 раза в день перед
едой, после улучшения по 20-30 капель 3 раза в день 10-20 дней.
Симтоматические средства
При обострении СРК назначаются
вяжущие, антиспастические, обволакивающие и нейтрализующие органические кислоты
препараты: основной нитрат висмута, дерматол, танальбин, белая глина,
осажденный карбонат кальция, смекта, а также отвары из трав аналогичного
действия (ромашка, мята перечная, зверобой, ольховые шишки, ягоды черники и
черемухи). С той же целью можно использовать антацидные препараты (альмагель,
фосфалюгель, маалокс) препараты, содержащие висмут - вентер.
При поносах, болях в животе
применяют микроклизмы из отвара ромашки, крахмальные клизмы перед сном без
предварительного очищения кишечника.
При запорах назначают масляные
клизмы с растительным маслом в чередовании с микроклизмами из 0,1 % р-ра
протаргола или 1 % р-ра колларгола. При наличии трещин, сфинктерита, геморроя
назначают свечи с облепиховым маслом, новокаином, ксероформом, красавкой,
бальзамом Шостаковского, анестезином и дерматолом.
Физиотерапевтическое лечение.
При болях в животе с преобладанием
диареи применяют легкое тепло в виде согревающих компрессов на живот,
электрофорез новокаина, хлорида кальция, сульфата цинка, теплые хвойные о
радоновые ванны. При запорах применяют импульсные токи Бернара, массаж живота
для повышения тонуса мышц передней брюшной стенки и мышц кишечника.
Санаторно-курортное лечение: в
санаториях Ессентуки, Железноводск.
Запор.
Запором называют замедленное,
затрудненное или систематически недостаточное опорожнение кишечника.
Однократный стул в день не является
строго обязательным признаком нормальной деятельности кишечника. Хроническую
задержку опорожнения кишечника более чем на 48 часов следует рассматривать как
запор. Иногда при запоре может быть несколько дефекаций в день незначительным
количеством кала без чувства удовлетворения. Важно учитывать изменения
привычных для больного частоты и ритма стула.
Этиология и патогенез.
Запор вызывается нарушением
процессов формирования и продвижения кала по кишечнику. Основными причинами
этого являются расстройства кишечной моторики, ослабление позывов к дефекации,
возникновение изменений структуры кишечника или близлежащих органов,
препятствующих нормальному продвижению содержимого по кишечнику, несоответствие
между емкостью толстой кишки и объемом кишечного содержимого.
При запоре часто усилены
непропульсивные сегментирующие движения толстой кишки, которые перемешивают
содержимое и способствуют формированию кала, но не вызывают его продвижения, а
скорее его задерживают. Пропульсивная активность снижена, ретроградные движения
усилены. Опорожнению кишечника могут препятствовать и сокращения функциональных
сфинктеров толстой кишки. Имеются наблюдения, что повышение тонуса и
перистальтики кишки свойственно только начальной фазе запора (до 1 года), затем
наступает их снижение. Одним из механизмов функциональных запоров могут быть
нарушения функций аноректальной области, играет роль недостаточная способность
внутреннего и наружного сфинктеров заднего прохода к расслаблению, а также
снижение чувствительности прямой кишки к давлению.
Позывы на дефекацию находятся под
контролем коры головного мозга. Ослабление позывов на низ может возникнуть
первично вследствие различных психогенных воздействий и вторично на почве
запоров различного генеза. Нарушениям привычного ритма дефекации и ослаблению
позывов способствуют позднее вставание, утренняя спешка, когда подавляются
позывы на низ, работа в различные смены, изменения обычных условий жизни и
труда, антисанитарные условия в туалетах, иногда чувство ложного стыда и т. п.
Условнорефлекторные механизмы позывов особенно легко ранимы у детей, у
невропатов. Моторика кишечника в этих случаях мало страдает, при этом кал
скапливается преимущественно в прямой кишке.
Пропульсивная деятельность толстой
кишки в значительной степени зависит от объема кишечного химуса и формирующихся
каловых масс, их консистенции. Учащение запоров связывают с питанием
рафинированной пищей, содержащей мало пищевых волокон. Пищевыми волокнами
называют часть растительного материала пищи, которая резистентна к действию
пищеварительных соков: целлюлоза и гемицеллюлоза - углеводной природы,
пектиновые субстанции и легнин - не углеводной природы. Капуста увеличивает
фекалий на 64 %, морковь - на 61 %, яблоки - на 44 %. Пищевые волокна
способствуют снижению концентрации глюкозы в крови, снижают содержание
триглицеридов, холестерина.
Алиментарные факторы нередко
сочетаются с малоподвижным образом жизни.
Причиной функциональных запоров
могут быть различные гормональные влияния: снижения уровня мотилина,
вазоактивного кишечного пептида в крови.
Классификация запоров
По длительности: острый,
хронический.
По этиологическим и патогенетическим
признакам:
Алиментарный
Неврогенный: дискинетический;
рефлекторный;
запор вследствие подавления позывов
не дефекацию (привычный)
Гиподинамический
Запор вследствие воспалительных
заболеваний кишечника
Проктогенный
Механический
Запор вследствие аномалий развития
толстой кишки
Токсический
Медикаментозный
Эндокриный
Запор вследствие нарушений
водно-электролитного обмена
По характеру двигательных нарушений
кишечника:
С преобладанием гипермоторики
(гиперкинетический)
С преобладанием гипомоторики
(гипокинетический)
Лечебная программа при запорах
включает:
Этиологическое лечение
Режим физической активности
Лечебное питание
Слабительные средства
Нормализация моторной функции
кишечника
Лечение минеральными водами
Физиотерапевтическое лечение
Лечебная физкультура, специальная
гимнастика, массаж.
ЛИТЕРАТУРА
Основная:
Маколкин В. И., Овчаренко С. И.
Внутренние болезни. М., Медицина. 1999. - 592 с.
Окороков А. Н. Диагностика болезней
внутренних органов: Т1. Диагностика болезней органов пищеварения. М., Мед. лит.
2000. - 560 с.
Окороков А. Н. Лечение болезней
внутренних органов. - Практ. руководство в 3х т. Т.1. Мн., Выш. шк. 1995. 522
с.
Дополнительная:
Гончарик И. И. Гастроэнтерология:
стандартизация диагностики и обоснование лечения: Справ. пособие. Мн.,
"Беларусь". - 2000. - 143 с.
Логинов А. С., Парфенов А. И.
Болезни кишечника: Руководство для врачей. М., Медицина. 2000. - 632 с.
Фролькис А. В. Функциональные
заболевания желудочно-кишечного тракта. Л.: Медицина. - 1991. - 224 с.
Фролькис А. В. Прокинетические
средства (прокинетики) в лечении моторных расстройств в желудочно-кишечном
тракте // Тер. архив. 1998. № 2. Стр. 69-72.
ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ КИШЕЧНИКА
ВВЕДЕНИЕ
Воспалительные заболевания кишечника
делятся на две большие группы: известной этиологии (острые хронические
энтериты, колиты) и неизвестной этиологии (болезнь Крона, язвенный колит).
Воспалительные заболевания кишечника встречаются приблизительно одинаково среди
лиц мужского и женского пола. Пиковый возраст начала болезней приходится на
второе - четвертое десятилетия жизни.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
Хронический энтерит. Определение.
Этиология. Патогенез. Роль дисбактериоза, энзимопатий, перенесенных острых
кишечных инфекций, аллергии. Классификация. Клиника. Основные
клинико-лабораторные синдромы (синдром мальабсорбции, мальдигестии,
дискинетический синдром). Диагноз. Лечение.
Хронический колит. Определение.
Этиология. Патогенез. Значение дисбактериоза, перенесенных кишечных инфекций.
Клиника. Диагностика: роль рентгенконтрастных и эндоскопических исследований.
Классификация. Лечение: диета, медикаментозная терапия, физиотерапия. Показания
и противопоказания к санаторно-курортному лечению. Прогноз.
Неспецифический язвенный колит:
этиология, патогенез, клиника, диагностика, лечение.
Болезнь Крона: этиология, патогенез,
клиника, диагностика, лечение.
Болезнь Уипла (кишечная
липодистрофия): основные синдромы, диагноз, лечение.
ОТВЕТЫ НА ВОПРОСЫ
Хронический энтерит.
Хронический энтерит -
полиэтиологическое заболевание тонкого кишечника, характеризующееся развитием
воспалительно-дистрофических процессов, дисрегенераторными изменениями,
атрофией слизистой оболочки тонкой кишки различной степени, нарушением всех
функций тонкого кишечника, в первую очередь всасывательной и пищеварительной.
Классификация (А.В. Фролькис, 1996г,
с изменениями)
Этиология:
Инфекционные.
Паразитарные.
Токсические.
Медикаментозные.
Алиментарные.
Радиационные.
После операций на тонкой кишке.
Врожденные аномалии кишечника и
энзимопатии.
При недостаточности илеоцекального
клапана и большого дуоденального соска.
Вторичные (при других заболеваниях).
Преимущественная локализация.
Хронический еюнит.
Хронический илеит.
Хронический тотальный энтерит.
Характер морфологических изменений
тонкой (тощей) кишки.
Еюнит без атрофии.
Еюнит с умеренной парциальной
ворсинчатой атрофией.
Еюнит с субтотальной ворсинчатой
атрофией.
Клиническое течение.
Легкое течение.
Средней тяжести.
Тяжелое течение.
Фаза заболевания.
Фаза обострения.
Фаза ремиссии.
Характер функциональных нарушений
тонкого кишечника.
Синдром недостаточности пищеварения
(мальдигестия).
Синдром недостаточности кишечного
всасывания (мальабсорбция).
Синдром экссудативной энтеропатии.
Синдром многофункциональной
недостаточности тонкой кишки (энтеральная недостаточность).
Степень вовлечения толстой кишки.
Без сопутствующего колита.
С сопутствующим колитом.
Экстраинтестинальные расстройства.
Клиническая картина, диагностика и лечение
хронического энтерита см. п. 1-4 основного списка литературы.
Под синдромом мальабсорбции понимают
комплекс расстройств, возникающий в результате нарушения всасывания нутриентов.
витаминов и микроэлементов в тонкой кишке. В настоящее время в широком смысле
этот термин включает в себя и синдром нарушенного пищеварения, поскольку
различные расстройства процессов переваривания пищи, развивающиеся при данном
синдроме, приводят вторично и к нарушению процессов всасывания.
Этиология и патогенез
Синдром мальабсорбции может
встречаться при многих заболеваниях: постгастрорезекционном синдроме,
экзокринной панкреатической недостаточности (у больных хроническим
панкреатитом, муковисцидозом и раком поджелудочной железы), заболеваниях
печени, желчевыводящих путей (чаще всего в тех случаях, когда они
сопровождаются нарушением выделения желчи), при синдроме короткой кишки (после
резекции тонкой кишки, выполненной в связи с тромбозом и эмболией
мезентериальных артерий, травматических повреждениях кишечника, осложненных
формах болезни Крона), интестинальных ферментопатиях (например, лактазной
недостаточности).
Нередкой причиной возникновения
синдрома мальабсорбции служат поражения тонкой кишки, развивающиеся при
целиакии, тропической спру, болезни Уиппла, эозинофильном гастроэнтерите,
системном мастоцитозе, амилоидозе, иммунодефицитных синдромах, лимфомах тонкой
кишки и радиационном воздействии. В рамках синдрома мальабсорбции часто
выделяют так называемый синдром экссудативной энтеропатии, который может
возникать при инфекционных и паразитарных заболеваниях кишечника (например,
амебиаз, туберкулез), лимфангиэктазии тонкой кишки, болезни Менетрие, синдроме
Золлингера-Эллисона и других заболеваниях.
Нарушения процессов всасывания в
кишечнике отмечаются нередко при синдроме избыточного роста бактерий, который
может развиваться при замедлении пассажа по тонкой кишке (после резекции
желудка по Бильрот I и резекции кишечника с наложением анастомоза бок в бок или
конец к бок, возникновении послеоперационного спаечного процесса в кишечнике,
межкишечных свищах, формировании стриктур кишечника у больных болезнью Крона,
опухолях кишечника и мезентериальных лимфоузлов), вследствие ретроградного
заброса содержимого толстой кишки в тонкую после резекции илеоцекального
клапана, при ахлоргидрии.
Патогенез диареи, являющейся главным
фактором, приводящим к развитию синдрома мальабсорбции, и его основным
клиническим признаком, может включать в себя различные механизмы. Так, в основе
возникновения диареи при дисахаридазной недостаточности лежит накопление в
просвете кишечника осмотически активных частиц (непереваренных углеводов).
Нарушение переваривания и всасывания жиров при внешнесекреторной
недостаточности поджелудочной железы ведет к развитию стеатореи. При этом
непереваренные жиры гидроксилируются в просвете толстой кишки бактериями, в
результате чего стимулируется секреторная активность колоноцитов. При
постгастрорезекционном синдроме диарея обусловливается слишком быстрым
поступлением осмотически активных компонентов пищи в верхние отделы тонкой
кишки, в результате чего нарушаются процессы переваривания и всасывания, и
развивается стеаторея. Дополнительным патогенетическим фактором в таких случаях
может выступать синдром избыточного роста бактерий, развивающийся в результате
снижения секреции соляной кислоты. Возникновение диареи при экссудативной
энтеропатии объясняется выходом высокомолекулярных белков плазмы в просвет
кишечника и их последующим расщеплением кишечной микрофлорой па осмотически
активные частицы, связывающие воду. Несколько звеньев включает в себя патогенез
диареи при синдроме короткой кишки. Во-первых, обширная резекция тонкой кишки
вызывает нарушение всасывания углеводов и повышение осмолярности химуса; при
этом расстройства всасывания жиров приводят к возникновению стеатореи. Резекция
топкой кишки способствует, кроме того, гиперсекреции соляной кислоты,
вследствие чего инактивируются панкреатические ферменты. Во-вторых, резекция
подвздошной кишки обусловливает снижение всасывания желчных кислот и их
увеличенное поступление в просвет толстой кишки. Снижение энтерогепатической
циркуляции желчных кислот усугубляет стеаторею, а попадание свободных желчных
кислот в толстую кишку тормозит абсорбцию натрия и стимулирует секрецию
хлоридов, что также усиливает диарею. Наконец, устранение запирательного
механизма илеоцекального клапана при резекции подвздошной кишки способствует
возникновению синдрома избыточного роста бактерий.
Патогенез диареи при целиакии связан
со снижением общей всасывательной поверхности слизистой оболочки тонкой кишки,
возникающим в результате лимфоплазмоцитарной инфильтрации ее собственной
пластинки с последующей атрофией ворсинок и пролиферацией клеток крипт.
Структурные изменения слизистой оболочки тонкой кишки обусловливают
возникновение диареи и нарушений процессов всасывания при таких заболеваниях,
как болезнь Уиппла, эозинофильный гастроэнтерит, системный мастоцитоз,
амилоидоз кишечника, синдром вариабельного неклассифицируемого иммунодефицита,
В- и Т-клеточпая лимфома, радиационные поражения кишечника.
Клиника
Диарея при синдроме мальабсорбции
характеризуется обычно увеличением объема стула (полифекалия), кал имеет
кашицеобразную или водянисто консистенцию, часто приобретает неприятный запах и
при наличии стеатореи плохо смывается со стенок унитаза. При нарушении синтеза
желчных кислот или затруднении поступления их в кишечник (холестазе) стул
становится ахоличным и приобретает жирный блеск. При лактазной недостаточности
диарея появляется после употребления молока и молочных продуктов и
сопровождается урчанием и схваткообразными болями в животе. Боли в верхней
половине живота, иррадиирующие в поясничную область или приобретающие
опоясывающий характер, сопровождают диарею при наличии хронического
панкреатита.
Частым симптомом, встречающимся при
синдроме мальабсорбции, является снижение массы тела, обусловленное
недостаточным поступлением в организм основных питательных веществ. У детей и
подростков (в частности, страдающих целиакией), синдром мальабсорбции приводит
к задержке роста и инфантилизму. Снижение уровня белка, особенно выраженное при
экссудативной энтеропатии, обусловливает возникновение отеков. Ухудшение
всасывания железа и витамина B12 служит причиной развития анемии. Больные с
синдромом мальабсорбции часто жалуются на общую слабость, утомляемость,
снижение работоспособности.
У многих больных отмечаются
клинические признаки дефицита различных витаминов: В1 (парестезии), В2 (глоссит
и ангулярный стоматит), D (боли в костях, тетания), К (повышенная
кровоточивость), А (фолликулярный гиперкератоз, расстройства сумеречного
зрения), никотиновой кислоты (пеллагра) и др. При длительном и тяжелом течении
синдрома мальабсорбции прогрессирует кахексия, присоединяются симптомы
полигландулярной недостаточности (надпочечников, половых желез), мышечная
атрофия, психические нарушения.
Могут выявляться и другие
клинические симптомы, обусловленные особенностями заболевания, приведшего к
возникновению синдрома мальабсорбции. Так, при болезни Уиппла отмечаются боли в
суставах, увеличение лимфатических узлов, поражения легких (бронхит, плеврит),
сердца (эндокардит, перикардит) и центральной нервной системы. При системном
мастоцитозе наблюдаются головные боли, тахикардия, изменения кожи по типу
пигментной крапивницы. При иммунодефицитных синдромах определяется высокая частота
инфекционных заболеваний верхних дыхательных путей. При синдроме
Золлингера-Эллисона отмечаются упорные и часто рецидивирующие язвы желудка и
двенадцатиперстной кишки. Лимфомы кишечника протекают с лихорадкой, изменениями
пальцев рук в виде барабанных палочек, гепато- и спленомегалией. При
радиационных поражениях кишечника проявления синдрома мальабсорбции часто
сочетаются с клиническими признаками лучевого проктита (частый стул небольшими
порциями, тенезмы, примесь в кале алой крови - гематохезия).
Диагностика и дифференциальная
диагностика. При лабораторном исследовании у больных с синдромом мальабсорбции
часто выявляют в крови снижение содержания альбумина, холестерина, железа,
кальция, магния, витамина А, фолиевой кислоты.
Важную роль в диагностике синдрома
мальабсорбции играет исследование кала. Прежде всего, уточняется общая масса
кала, выделяемая больным в течение суток. Для этого необходимо измерять
суточное количество кала, собирая его (желательно в специальные пластиковые
контейнеры) не менее 3 дней. Для синдрома мальабсорбции характерна значительная
масса кала (обычно более 500 г. в сутки), которая уменьшается на фоне голодания
(важный признак, позволяющий исключить секреторный характер диареи). При этом
обращают внимание на обнаружение при микроскопическом исследовании кала
мышечных волокон (креаторея), нейтрального жира (стеаторея) и крахмала
(амилорея) и определяют суточную потерю жира с калом. У здорового человека 95%
жиров подвергается перевариванию и всасыванию даже при очень высоком их содержании
в пищевом рационе (150 г. в сутки), так что в норме с калом выделяется не более
7 г жиров в день. Значительная потеря жиров с калом (более 14 г. в сутки)
свидетельствует о выраженной внешнесекреторной недостаточности поджелудочной
железы.
При расстройствах переваривания и
всасывания в тонкой кишке может меняться рН кала. Так, при нарушении
переваривания углеводов (например, при дисахаридазной недостаточности) за счет
активации процессов брожения происходит сдвиг показателей рН в кислую сторону (<6,0).
Оценку всасывательной функции тонкой
кишки проводят с помощью D-ксилозного теста. Больной принимает 25 г. D-ксилозы,
после чего в течение 5 ч собирает мочу. При нормальном уровне всасывания в
тонкой кишке количество выделенной за это время D-ксилозы должно быть не менее
5 г. Тест с 75Se-гомотаурохолевой кислотой позволяет обнаружить снижение
всасывания желчных кислот в терминальном отделе подвздошной кишки и помогает в
диагностике так называемой хологенной диареи. Повышенная потеря белка через
кишечник (при болезни Уиппла, злокачественной лимфоме, лучевой энтеропатии)
выявляется при применении теста с 51сг-альбумином.
Для оценки всасывания витамина В12
используют тест Шиллинга. В норме после приема меченого витамина В12 показатели
его экскреции с мочой в течение суток составляют не менее 10 %. Показатели
суточной экскреции витамина В12 с мочой ниже 5% свидетельствуют о нарушении его
всасывания в тонкой кишке.
Точные данные о процессах всасывания
в тонкой кишке можно получить с помощью ее перфузионного исследования. При этом
в тощую кишку вводят зонд, через который осуществляют перфузию растворами с
известными концентрациями Na, Cl и других веществ. Расчеты, проводимые после
повторного измерения концентрации данных электролитов в дистальных отделах
тонкой кишки, позволяют сделать вывод о характере процессов всасывания.
При подозрении на синдром
мальабсорбции проводят рентгенологическое исследование тонкой кишки, выявляющее
его типичные признаки (фрагментацию столба взвеси сульфата бария, утолщение и
огрубение складок слизистой оболочки), а иногда помогающее распознать
заболевания, послужившие причиной его развития: слепые петли тонкой кишки,
межкишечные анастомозы, множественные дивертикулы, лимфома тонкой кишки,
синдром кишечной псевдообструкции при системной склеродермии, признаки
узелковой лимфоидной гиперплазии при синдроме общего вариабельного
иммунодефицита и др.).
Эндоскопическое исследование тонкой
кишки с биопсией из ее проксимальных отделов и последующим гистологическим и
гистохимическим исследованием дает возможность диагностировать такие
заболевания, как болезнь Уиппла, лимфома тонкой кишки, эозинофильный
гастроэнтерит, целиакия, тропическая спру, системный мастоцитоз, амилоидоз.
Для диагностики синдрома избыточного
роста бактерий в настоящее время используют дыхательный тест с Н2, проводимый с
лактулозой или глюкозой. Принцип метода основан на том, что бактерии могут
ферментировать лактулозу, в результате чего освобождается Н2, концентрацию
которого затем можно измерить в выдыхаемом воздухе. В норме расщепление
лактулозы происходит лишь в толстой кишке. Более раннее появление Н2 в
выдыхаемом воздухе свидетельствует о бактериальном расщеплении субстрата в
тонкой кишке. Диагноз синдрома избыточного роста бактерий подтверждают также с
помощью посева дуоденального аспирата и последующего обнаружения в нем
увеличенного содержания микроорганизмов (106/мл).
Для диагностики основного
заболевания, послужившего причиной развития синдрома мальабсорбции, применяют
дополнительные методы исследования. Так, при подозрении на внешнесекреторную
недостаточность поджелудочной железы помимо определения суточной потери жиров с
калом проводят секретин-панкреозиминовый тест, тест Лунда. панкреолауриловый
тест и тест с р-аминобензойной кислотой (NBT-PABA-тсст), оценивают содержание
химотрипсина и эластазы-1 в кале. Характерные признаки панкреатита выявляются
при ультразвуковом исследовании органов брюшной полости, эндоскопической
ретроградной холангиопанкреатографии.
Для распознавания лактазной
недостаточности дополнительно проводят пробу с нагрузкой лактозой. Больной
принимает внутрь 50 г. лактозы, после чего определяют содержание глюкозы к
крови. Возникновение диспепсических расстройств, а также отсутствие повышения
содержания глюкозы в крови после нагрузки лактозой подтверждают диагноз
лактазной недостаточности. Специфическим диагностическим тестом для выявления
целиакии служит повышение титра антител к глиадину. При подозрении па системный
мастоцитоз определяют уровень гистамина в крови и секрецию его метаболитов с
мочой. Диагноз вариабельного неклассифицируемого иммунодефицита подтверждается
при обнаружении выраженного снижения уровня иммуноглобулинов всех классов.
Выявление конкретного заболевания, послужившего причиной возникновения синдрома
мальабсорбции, позволяет проводить более дифференцированную терапию.
Лечение: В основе лечения синдрома
мальабсорбции лежат два основных принципа: воздействие на течение основного
заболевания, способствовавшего развитию этого синдрома (I), и коррекция
нарушений процессов нарушенного всасывания в кишечнике (II).
Выполнение первого принципа играет,
в частности, важную роль в лечении больных с целиакией. Исключение продуктов из
пшеничной и ржаной муки, манной крупы и ячменя и замена их продуктами из риса и
кукурузы позволяют значительно улучшить состояние больных и даже добиться их
полного выздоровления. Исключение молока и ряда молочных продуктов способствует
прекращению диареи у больных с лактазной недостаточностью. Длительная
антибиотикотерапия приводит к прекращению диареи у больных с болезнью Уиппла.
Своевременное хирургическое лечение, проводимое при обнаружении межкишечных
свищей и больших дивертикулов, послуживших причиной развития синдрома
избыточного роста бактерий, устраняет нарушения кишечного всасывания у таких
пациентов.
Второй принцип лечения включает в
себя соблюдение определенных диетических рекомендаций, назначение
заместительной терапии, а также препаратов, нормализующих нарушенные функции
кишечника.
Больным с синдромом мальабсорбции
показана диета с высоким содержанием белка (до 130 г. в сутки). Напротив,
содержание жиров в пищевом рационе больных (особенно при наличии стеатореи)
должно быть снижено примерно на 50 % по сравнению с нормальным. Вместо них
рекомендуются среднецепочечные триглицериды, которые легче перевариваются
панкреатической липазой и всасываются без образования мицелл. У больных с
низким уровнем белка в крови хороший эффект удается получить при назначении им
специальных смесей для энтерального питания (портаген, изокал и др.),
содержащих все необходимые нутриенты, включая витамины и микроэлементы. Для
более полного усвоения эти смеси лучше всего вводить в желудок капельно через
зонд. В тяжелых случаях больных переводят на парентеральное питание с введением
20-40 % растворов глюкозы, 10-20 % жировых эмульсий, 5-10 % L-аминокислотных
смесей, растворов электролитов, содержащих соли калия, натрия, магния, кальция
и фосфора, а также микроэлементов. Проводят заместительную терапию витаминами
A, D. Е, К, В12, фолиевой кислотой и препаратами железа.
В тех случаях, когда синдром
мальабсорбции протекает с выраженной стеатореей и креатореей, для улучшения
полостного пищеварения назначают ферментные препараты. При выборе конкретных
лекарственных средств следует обращать внимание не только на необходимость
высокого содержания липазы в их составе, но и на их форму выпуска. В настоящее
время рекомендуются такие ферментные препараты, в которых лиофилизированный
экстракт панкреатина (получаемый главным образом из поджелудочной железы
свиньи) заключен в специальные микросферы (пеллеты), устойчивые к действию
желудочного сока. Последние в свою очередь должны находиться в капсуле,
покрытой желатиной. Эти капсулы быстро растворяются в желудочном содержимом,
после чего микросферы, смешиваясь с химусом и не подвергаясь действию желудочного
сока, поступают в просвет двенадцатиперстной кишки, где при рН 5,5 из микросфер
происходит высвобождение лекарственного препарата. Суточная доза препаратов (в
пересчете на содержание липазы) должна составлять 140000-150000 ЕД. Если у
больных с синдромом мальабсорбции отмечается ускорение транзита содержимого по
кишечнику, могут применяться препараты, ослабляющие кишечную перистальтику.
Обычно назначается лоперамид в дозе 2 мг. на прием. Общая суточная доза
препарата определяется частотой стула. Больным, у которых синдром мальабсорбции
протекает на фоне исходно ослабленной моторики кишечника и кишечного стаза (при
диабетической энтеропатии, системной склеродермии, амилоидозе), применение
лоперамида противопоказано. В тяжелых случаях для купирования диареи используют
синтетические аналоги соматостатина (октреотид), которые угнетают моторику
кишечника, улучшают всасывание и тормозят кишечную секрецию. Октреотид
назначается по 100-250 мкг. 3 раза в сутки. С симптоматическими целями могут
применяться вяжущие и обволакивающие средства (смекта, аттапульгит и др.).
Синдром мальдигестии (синдром
нарушенного пищеварения) - комплекс кишечных симптомов (нарушения стула,
метеоризм, боли и др.), появляющихся в результате плохого переваривания пищевых
веществ.
Нарушения пищеварения в той или иной
степени свойственны большинству гастроэнтерологических больных и объясняются
снижением продукции пищеварительных ферментов и желчных кислот или торможением
их активности.
Нарушения пищеварения могут быть
связаны с недостаточностью полостного гидролиза и мембранного гидролиза пищевых
белков, жиров и углеводов. Наиболее тяжелые нарушения полостного пищеварения
наблюдаются при заболеваниях поджелудочной железы, протекающих с ее
внешнесекреторной недостаточностью. Панкреатическая недостаточность развивается
в результате уменьшения функционирующей ткани поджелудочной железы и
наблюдается при хроническом панкреатите и раке поджелудочной железы. Нарушение
внешнесекреторной функции поджелудочной железы может наблюдаться при снижении
продукции панкреозимина, секретина и энтерокиназы в слизистой оболочке
двенадцатиперстной кишки. Кроме того, снижение Ph в просвете тонкой кишки ведет
к инактивации энтерокиназы и панкреатических ферментов в полости тонкой кишки.
Следовательно, нарушения полостного пищеварения возможны у больных с
атрофическими изменениями слизистой оболочки тонкой кишки и с повышенной
кислотообразующей функцией желудка.
Кишечное пищеварение нарушается и
при отсутствии достаточного количества желчных кислот, необходимых для переваривания
жира. Концентрация желчных кислот в кишечнике снижается при тяжелых
заболеваниях печени, механической желтухе и повышенных потерях желчи с калом.
Особенно значительные потери желчных кислот наблюдаются у больных после
резекции подвздошной кишки. У больных с бактериальным обсеменением верхних
отделов тонкой кишки могут происходить преждевременная микробная деконъюгация и
всасывание желчных кислот. В результате уменьшается пул желчных кислот,
участвующих в эмульгировании жиров.
Недостаточность мембранного
пищеварения возникает при уменьшении количества панкреатических ферментов,
адсорбированных на мембране щеточной каемки энтероцитов и дефиците собственно
кишечных ферментов при патологических изменениях слизистой оболочки тонкой
кишки.
Клиника. Больные предъявляют жалобы
на вздутие живота, избыточное газообразование, ощущение переливания и урчание в
животе. В более выраженных случаях появляется полифекалия, стеаторея, диарея и
похудание. Тем не менее трофические расстройства (сухость кожи, тусклость и ломкость
ногтей и волос, трещины в углах губ и на языке и др.) практически не
развиваются. В этом и заключается принципиальное отличие синдрома нарушенного
пищеварения от синдрома нарушенного всасывания.
У больных хроническим панкреатитом с
выраженной недостаточностью внешнесекреторной функции поджелудочной железы
резко увеличивается объем стула, в нем наблюдается повышенное содержание жира,
мышечных волокон, крахмала. У больных с заболеваниями печени и желчных путей,
сопровождающихся дефицитом желчных кислот, нарушается переваривание жиров и
появляется стеаторея. Расстройствам пищеварения у больных с хроническими
заболеваниями желудка или после операций на нем способствуют бактериальное
обсеменение верхних отделов тонкой кишки и нарушение контакта химуса с пищеварительными
соками. Недостаточность желудочного пищеварения надежно компенсируется на
последующих этапах ассимиляции пищевых веществ. Доказательством этого служат
больные пернициозной анемией и больные после резекции желудка, у которых
желудочная ахилия не сопровождается заметными расстройствами пищеварения.
Нарушение мембранного пищеварения
клинически проявляется плохой переносимостью пищевых веществ, содержащих те
олигомеры, переваривание которых нарушено. Пищевые интолерантности,
обусловленные недостаточностью мембранного пищеварения, развиваются только при
дефиците собственно кишечных (а не адсорбированных) мембранных ферментов. Чаще
всего речь идет о недостаточности кишечных карбогидраз и плохой переносимости
лактозы, трегалозы, сахарозы и других дисахаридов. Нарушения мембранного
пищеварения наблюдаются у больных с измененной слизистой оболочкой тонкой
кишки. Тем не менее, чаще этот тип мальдигестии протекает без нарушений
всасывания и проявляется лишь нарушением переносимости одного или нескольких
пищевых веществ.
Диагностика: Наиболее простым
способом лабораторной оценки эффективности пищеварительных процессов служит
копрологическое исследование. Нарушения переваривания сопровождаются
увеличением суточного количества кала, появлением в нем большого количества
мышечных волокон, глыбок крахмала, капель жира. Одним из ранних симптомов
нарушения переваривания пищевых веществ является стеаторея. Кал становится
жирным, блестящим, липким. При микроскопическом исследовании видны капли жира.
Более точное представление о степени стеатореи можно получить, исследуя
содержание жира в суточном количестве кала по методу Ван-Де-Камера. При
панкреатической недостаточности количество не усвоенного жира, главным образом
нейтрального, превышает 5-7 г.
У больных с синдромами мальдигестии
и мальабсорбции создаются благоприятные условия для размножения микробной флоры
в верхних отделах тонкой кишки. Этому способствует медленная утилизация химуса,
нарушения моторики и снижение продукции лизоцима энтероцитами. Поэтому важным
методом диагностики сопутствующего дисбактериоза является определение
количества и состава микробов в кишечном соке.
Несмотря на сходство клинических
симптомов у больных с преимущественной недостаточностью полостного пищеварения,
мембранного пищеварения и всасывания, а также с нарушением проходимости
лимфатических сосудов тонкой кишки, тем не менее, имеются и некоторые отличия.
Так, водянистая диарея чаще наблюдается при патологии всасывания. Пищевые
интолерантности наиболее характерны для недостаточности мембранного
пищеварения, синдром нарушенного всасывания - для патологии всасывательной
функции тонкой кишки, а синдром экссудативной энтеропатии - для окклюзии
лимфатических путей. Помогают дифференциальной диагностике гистологические и
гистохимические исследования слизистой оболочки тонкой кишки. С их помощью
можно выявлять нарушения структуры слизистой оболочки, свойственные нарушению
всасывания, дефицит мембранных ферментов, характерный для патологии мембранного
пищеварения, и признаки лимфостаза, наблюдающиеся при патологии лимфатического
аппарата кишки.
В таблице 1 приведены
дифференциально-диагностические признаки нарушений уровня ассимиляции пищевых
веществ.
Таблица 1
|
Признак
|
Уровень нарушения ассимиляции пищевых веществ
|
|
полостное пищеварение
|
мембранное пищеварение
|
всасывание
|
лимфатическая обструкция
|
Может отсутствовать
|
Связана с пищевыми интолерантностями
|
Систематическая, обильная, чаще водянистая
|
Преобладает кашицеобразный частый стул
|
|
Полифекалия
|
+++
|
+-
|
+++
|
+++
|
|
Стеаторея
|
+++
|
+-
|
+++
|
+++
|
|
Пищевые интолерантности
|
-
|
+++
|
-
|
-
|
|
Качественные нарушения трофики
|
+-
|
+-
|
+++
|
+ -
|
|
Энтеральная экссудация белка, гипопротеинемические отеки
|
-
|
-
|
++
|
+++ Часто резистентные к терапии
|
|
Остеопороз, боли в костях
|
-
|
-
|
+++
|
-
|
|
Снижение уровня железа сыворотки крови
|
-
|
-
|
++
|
-
|
|
Снижение уровня фолиевой кислоты
|
-
|
-
|
++
|
-
|
|
Снижение уровня витамина В12
|
-
|
-
|
++
|
-
|
|
Гипохолестеринемия
|
-
|
-
|
+++
|
+++
|
|
Тест с d-ксилозой
|
Норма
|
Норма
|
Снижен
|
Норма
|
|
Тест с 131I-триолеином
|
+++
|
+-
|
+++
|
+++
|
|
Водородный тест с лактозой
|
Норма
|
Повышен при гиполактазии
|
Повышен
|
Норма
|
|
Гистологическая картина слизистой оболочки тонкой кишки
|
Нормальная
|
Нормальная
|
Дистрофия или атрофия
|
Лимфостаз
|
|
Гистохимические показатели ферментов тонкой кишки
|
Норма
|
Снижение синтеза ферментов
|
Снижение синтеза ферментов
|
Норма
|
Лечение. В комплексной терапии
синдрома мальдигестии главным является диетическое питание, особенности
которого зависят от основного заболевания и степени тяжести кишечных
расстройств. Пища должна быть механически щадящей, содержать повышенное
количество белка (100-150 г.) и углеводов (400-500 г.), пониженное количество
жира (30-40 г.). Из рациона исключают трудноусвояемые жиры, сырые овощи и
фрукты. При плохой переносимости молока, сахара, грибов или крахмала, связанной
с нарушением мембранного пищеварения, назначают соответствующую индивидуальную
элиминационную диету.
Медикаментозное лечение направлено
на устранение обменных нарушений, улучшение кишечного пищеварения, подавление
патогенной микрофлоры и регулирование моторики. Расстройства обмена веществ,
обезвоживание, витаминную недостаточность устраняют парентеральным введением
гидролизатов белка, интралипида, глюкозы, минеральных солей и витаминов. У
больных с нарушение пищеварения панкреатогенного генеза хорошее терапевтическое
действие оказывают ферменты поджелудочной железы. Наиболее эффективны креон,
панцитрат и др.
Для лечения стеатореи гепатогенного
генеза могут быть рекомендованы препараты, содержащие, помимо ферментов,
компоненты желчи (панзинорм, дигестал, фестал, энзистал и др.) или желчегонные
(панкурмен). При гастрогенной недостаточности пищеварения целесообразно
применять абомин, содержащий пепсин, и панзинорм, содержащий хлористоводородную
кислоту и пепсин.
У больных с синдромом мальдигестии
практически всегда развивается дисбактериоз тонкой и толстой кишок, поэтому
одновременно с ферментными препаратами назначают и антибактериальные препараты:
антибиотики группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны и
метронидазол. Они назначаются внутрь в обычных дозах в течение 7-10 дней.
Хронический колит - хроническое
воспалительное заболевание толстой кишки, характеризующееся развитием
воспалительно-дистрофических, а при длительном существовании - атрофических
изменений слизистой оболочки, а также нарушением функции толстого кишечника.
Этиология, патогенез, клиника,
диагностика, лечение хронического колита см. п. 1-4 списка основной литературы.
Болезнь Крона: особенности
патогенеза, клиники и лечения
Терминальный илеит стал
нозологически очерченной формой только после работы B. Crohn, в 1932 г.
подробно описавшего клиническую картину 14 случаев заболевания. Дальнейшие
наблюдения показали, что воспалительный процесс, аналогичный описанному,
поражает не только тонкую кишку, но может с большей или меньшей частотой
распространяться на все отделы пищеварительного тракта: слепую и восходящую
кишку (В. Crown, 1949), желудок и двенадцатиперстную кишку (H. Fahimi и соавт.,
1963), пищевод (N. Dyer и соавт., 1969). Изолированное поражение толстой кишки,
а также вовлечение в процесс анального канала было описано H. Lockhart-Mummery
и соавт., I960, 1964.
Общепринятое название данного
заболевания - "болезнь Крона", однако и до настоящего времени для ее
обозначения используют и другие термины: гранулематозный колит, гранулематозный
энтерит, регионарный колит, трансмуральный колит и т. п. Термин "болезнь
Крона" представляется наиболее удачным, так как включает в себя все
многочисленные формы заболевания.
Эпидемиология
Трудность оценки истинной
распространенности заболевания вытекает из сложности ее дифференциальной
диагностики от других поражений тонкой и толстой кишки. Не нашел достаточного
объяснения факт более широкого распространения заболевания среди жителей
развитых стран; в странах Европы и Северной Америки общая распространенность
заболевания составляет 40-60 случаев на 100 000 населения. Существенного
полового различия в распространенности заболевания не отмечается, хотя женщины
болеют все же несколько чаще.
Этиология и патогенез
Этиология болезни Крона окончательно
не установлена. Существует предположение о том, что генетические факторы играют
существенную роль в возникновении заболевания. Еще в 1949 г. B. Crown обнаружил
11 случаев болезни у близких родственников.
Несмотря на имеющиеся сведения о
более высокой частоте выявления улиц, страдающих болезнью Крона, различных
штаммов микобактерий и вирусных инфекций. В настоящее время нет оснований,
считать инфекционные агенты явным этиологическим фактором заболевания.
В последнее время особое внимание
исследователей привлекает концепция иммунопатогенеза хронических воспалительных
заболеваний кишечника. Можно считать доказанным, что при болезни Крона
повышается местная выработка антител и обнаруживается сдвиг соотношения
секреции IgG и IgA в сторону увеличения продукции IgG. Повышение местной
выработки антител способно опосредовать эффекторные функции (активацию
комплемента, клеточную цитотоксичность). В активации В-лимфоцитов и контроле их
функции принимают участие большое количество различных факторов: освобождение
определенных цитокинов, взаимодействие с Т-клетками и т.д. Кроме того,
отсутствие пролиферативного ответа Т-клеток иммунной системы, ассоциированной
со слизистой оболочкой (MALT), может служить подтверждением их региональной
супрессии.
Таким образом, воспаление
сопровождается закономерным вовлечением в процесс различных компонентов
иммунной системы слизистой оболочки кишки. В последнее время также активно
обсуждается вопрос о роли васкулита в патогенезе данного заболевания.
В качестве триггерных механизмов
развития болезни Крона можно считать доказанной роль курения (риск развития
заболевания повышен в 1,8-4,2 раза). Остальные обсуждавшиеся ранее механизмы
(роль некоторых видов жиров, повышенное потребление сахара, оральные
контрацептивы), очевидно, не играют сколько-нибудь существенной роли.
Морфология: Одним из кардинальных
микроскопических признаков болезни Крона является распространение
воспалительного инфильтрата на все слои кишечной стенки. Воспалительный процесс
начинается с подслизистого слоя, поэтому слизистая оболочка представляется
вначале малоизмененной. Причем для раннего периода заболевания характерна
макрофагальная и лимфоцитарная инфильтрация кишечной стенки. Присоединяющееся
изъязвление эпителия сопровождается инфильтрацией нейтрофилами Неравномерная
плотность инфильтрата собственной пластинки слизистой оболочки также является
закономерной при болезни Крона. Во всех слоях кишечной стенки могут возникать
лимфоидные скопления ("неполные гранулемы"). В 60% случаев болезни
Крона встречаются гранулемы саркоидного типа. Они состоят из эпителиоидных и
гигантских клеток типа Пирогова-Лангханса, окруженных фиброзным ободком и
поясом из лимфоцитов. В отличие от туберкулезных гранулем в них отсутствует
казеозный распад в центре. Подобные гранулемы могут обнаруживаться не только в
стенке кишки, но и в регионарных лимфатических узлах.
Глубокие и узкие язвы, обычно
ориентированные вдоль или поперек оси кишки (булыжная мостовая), фиброз
кишечной стенки, многочисленные спайки - закономерно наблюдаемая картина при
развернутой стадии заболевания. Морфологические изменения сосудов также
выражены в виде отложения фибрина в артериолах, а также их окклюзии.
Клиническая картина
Клиническая симптоматика зависит от
локализации поражения и глубины патологических изменений в кишечной стенке.
Наиболее общими симптомами у лиц, страдающих болезнью Крона, являются диарея,
абдоминальные боли и похудание. Астенизация больного и лихорадка обычно
возникают на фоне активной атаки заболевания. Для поражения подвздошной кишки
характерны симптомы острого аппендицита. Кроме того, при данной локализации
нередко возникают явления кишечной непроходимости. При объективном осмотре в
правой подвздошной области сравнительно часто можно пропальпировать
опухолевидное образование.
При поражении толстой кишки тяжелая
диарея встречается чаще, чем при тонкокишечной локализации процесса.
Клиническое течение в этом случае напоминает симптоматику неспецифического
язвенного колита (особенно при поражении левых отделов толстой кишки).
Возникает стул с примесью крови, резкие позывы к дефекации в ночное время. При
вовлечении в процесс дистальных отделов толстой кишки заболевание может
проявить себя симптомами острого парапроктита, а также развитием анальных или
ректальных стенозов, обусловливающих запор.
Выделение осложнений болезни Крона
весьма условно, поскольку в клинической практике очень сложным представляется
дифференцировать отдельные проявления тяжелого течения этого заболевания от
собственно осложнений. К осложнениям болезни Крона относятся стриктуры,
наружные и внутренние свищи, перфорации, кровотечения. Стриктуры - одни из
наиболее частых осложнений болезни Крона. Их наличие клинически проявляется
схваткообразными болями в животе, запорами, развитием частичной или реже полной
кишечной непроходимости. Массивные кровотечения, связанные с деструктивными
изменениями стенки сосудов в месте изъязвлений, проявляют себя, в зависимости
от локализации процесса, наличием алой крови в каловых массах, меленой, а при
поражении желудка и рвотой цвета кофейной гущи, а также общими симптомами
анемизации организма.
Воспалительный процесс при болезни
Крона постепенно распространяется из подслизистого на мышечный и серозный слои
стенки кишки и может привести к образованию инфильтратов и абсцессов в брюшной
полости и последующему возникновению свищей. Свищи могут располагаться между
кишкой и полым органом, а также между петлями кишки. Наружные свищи открываются
выходным отверстием на передней брюшной стенке (обычно в области
послеоперационного рубца).
Перфорации при болезни Крона чаще
встречаются прикрытыми, что важно иметь в виду для правильного понимания
клинического течения заболевания.
В ряде случаев можно предположить,
что длительное хроническое воспаление оболочки толстой кишки способствовало
малигнизации, однако частота возникновения злокачественных опухолей при болезни
Крона существенно ниже, чем при язвенном колите.
Внекишечные проявления болезни Крона
весьма многообразны, их можно подразделить на связанные с активностью процесса
и не связанные с этим (см. таблицу).
Внекишечные проявления болезни Крона
|
Осложнения, связанные с активностью процесса Артриты,
некротизирующая пиодермия, афтозный стоматит, узловая эритема, эписклерит
|
|
Осложнения, не связанные с активностью процесса Первичный
склерозирующий холангит, сакроилеит, анкилозирующий спондилит
|
|
Осложнения, связанные с мальабсорбцией вследствие поражения
тонкой кишки Нефролитиаз, холецистолитиаз, амилоидоз и т. д.
|
Диагноз: Те или иные проявления
обширного симптомокомплекса, характерного при болезни Крона (диарея,
абдоминальные боли, лихорадка и прогрессирующее похудание, поражения
терминальной области), должны заставить врача-интерниста заподозрить
возможность данного заболевания.
Лабораторные исследования крови
выявляют анемию как следствие кровопотери или развития синдрома мальабсорбции;
различные проявления интоксикации и воспаления: лейкоцитоз с палочкоядерным
сдвигом, увеличение СОЭ, повышение активности острофазных белков крови. Как и
анемия, гипоальбуминемия и электролитные нарушения присоединяются при
прогрессировании вторичного синдрома мальабсорбции.
Эндоскопический метод исследования
пищеварительного тракта имеет важнейшее значение в диагностике болезни Крона,
Неравномерное утолщение слизистой оболочки, наличие узких язв-трещин, сужение
просвета кишки - картина "булыжной мостовой", характерна при болезни Крона.
Однако при начальных стадиях заболевания и формировании рубцовых изменений
подобной типичной картины получить не удается. Прицельная биопсия, выполненная
при эндоскопическом исследовании, может подтвердить диагноз. Следует помнить,
что при болезни Крона патологический процесс вначале возникает в подслизистом
слое, поэтому необходимо включать участок данного слоя в биопсийный материал.
Тем не менее, обнаружить патогномичные для болезни Крона саркоидоподобные
гранулемы удается далеко не всегда.
Рентгенологические исследования -
ирригоскопия, серийная рентгенография тонкой кишки - также имеют немаловажное
значение. Однако для уточнения состояния тонкой кишки наиболее информативным
является не обычный пероральный прием бариевой взвеси, а его введение через
зонд за трейцерову связку.
Ультразвуковое исследование брюшной
полости, компьютерная томография дают ценную информацию при диагностике
абсцессов, нередко встречающихся при болезни Крона. При наличии наружных свищей
показано проведение фистулографии.
Дифференциальная диагностика
Наиболее часто болезнь Крона
приходится дифференцировать от язвенного колита, туберкулезного поражения
кишки, ишемического колита, иерсиниоза, острого аппендицита.
Язвенный колит, протекающий с
сопутствующим парапроктитом или ретроградным илеитом, может послужить причиной
диагностической ошибки. К тому же даже с использованием современных
эндоскопических, рентгенологических методов исследования, гистологического
изучения биоптатов примерно в десятой части случаев не удается разграничить эти
два заболевания ("недифференцируемый колит").
Развития рубцовых изменений,
кишечных свищей характерны не только для болезни Крона, но и для туберкулеза
кишечника. Абдоминальные боли, кишечные кровотечения - симптомы ишемического
колита также могут быть адекватно оценены лишь после надлежащего
клинико-инструментального обследования.
Лечение: Сульфалазин и месалазин.
Сульфалазин являлся первым
препаратом, успешно примененным в лечении болезни Крона. Составные части
препарата - сульфапиридин и 5-аминосалициловая кислота - освобождаются в
кишечнике благодаря расщеплению азотной связи под воздействием бактерий. Далее
сульфапиридин абсорбируется, а 5-аминосалициловая кислота (5-ASA) остается в
кишечнике и экскретируется с фекалиями.
Другие препараты 5-ASA не содержат
сульфогруппы. К этому классу препаратов относится месалазин. Месалазин
проявляет свою биологическую активность, контактируя непосредственно со
слизистой оболочкой кишки, в связи с этим его терапевтическая активность
непосредственно связана с адекватной концентрацией в просвете кишки. Достижение
препаратом соответствующего участка кишечника, и, следовательно, реализация его
биологически активного действия зависят от "транспортной упаковки". В
одной из лекарственных форм месалазин заключен в оболочку, растворение которой
происходит при соответствующих значениях рН среды дистальных отделов тонкой
кишки и проксимальных толстой. Позже была разработана лекарственная форма, в
которой месалазин содержится в гранулах, покрытых этилцеллюлозой, растворение
которой не зависит от соответствующих значений рН среды. После приема препарата
и растворения наружной оболочки микрогранулы освобождаются и проявляют свой
терапевтический эффект на всем протяжении кишки. Препараты 5-ASA уменьшают
активность воспалительного процесса при болезни Крона, ингибируя синтез
метаболитов арахидоновой кислоты, активность нейтрофильной липоксигеназы. Они
также тормозят миграцию, дегрануляцию и фагоцитоз нейтрофилов.
Иммуномодуляторное действие 5-ASA проявляется также и в подавлении секреции
лимфоцитами иммуноглобулинов.
Сульфасалазин эффективен в лечении
болезни Крона, но только в случаях изолированного поражения тонкой кишки. Не
доказана эффективность данного препарата для профилактики возникновения
рецидивов (в том числе и после хирургического лечения). Препараты месалазина
доказали свой клинический эффект при болезни Крона в случаях поражения как
тонкой, так и толстой кишки, однако лишь при назначении сравнительно больших
дозировок препарата (4 г. в сутки). Для поддержания клинической ремиссии дозы
месалазина могут составлять 2-3 г в сутки. Вместе с тем эффективность
месалазина в поддержании клинической ремиссии после хирургического лечения
болезни Крона остается спорной.
Кортикостероиды
Кортикостероиды наиболее эффективны
в лечении активной болезни Крона. Но длительность приема этих препаратов
ограничивают системные побочные проявления, а также малая эффективность в
поддержании клинической ремиссии. Стероидная зависимость или рефрактерность к
их приему развиваются почти у половины больных, получающих их.
Противовоспалительное и иммуносупрессивное действие этих препаратов вытекает из
следующих механизмов их действия: уменьшение образования арахидоновой кислоты и
как следствие образования простагландинов, лейкоцитарной активности; понижение
активности цитокинов (интерлейкина - 1,2,4,6,8, интерферона-у). Из вновь
разработанных кортикостероидов, обладающих быстрой метаболизацией в печени и,
соответственно, менее выраженными нежелательными последствиями, только
будесонид оказался эффективным в лечении активной болезни Крона (3-6 мг. в
сутки). Однако, как и традиционные кортикостероиды, будезонид не поддерживает
ремиссию.
В генезе воспаления слизистой
оболочки печени при болезни Крона микробный фактор может играть определенную
роль. Антибиотики уменьшают воспаление непосредственно благодаря своему
антибактериальному эффекту, а также иммуномодуляторному действию.
Метронидазол оказался эффективен в
лечении пациентов с легким и среднетяжелым течением болезни Крона, а также
такого осложнения заболевания, как парапроктит. Метронидазол может назначаться
и для профилактики рецидива заболевания после резекции терминального отдела
подвздошной кишки.
Эффективность ципрофлоксацина при
лечении легких и среднетяжелых форм болезни Крона сходна с таковой месалазина.
Высказываются мнения, что при комбинации ципрофлоксацина и метронидазола эффект
от лечения улучшается.
Иммуномодуляторы
Использование этих препаратов
становится вполне оправданным с учетом роли иммунных нарушений в патогенезе
болезни Крона. Показания к применению иммуномодуляторов за последние годы
расширились. Если ранее эти препараты назначали лишь больным, рефрактерным к
стероидной терапии, то в настоящее время иммуномодуляторы применяют уже
вначале, что позволяет нередко избежать использования кортикостероидов, а также
продлить период ремиссии; кроме того, они доказали свою эффективность при
лечении наружных и внутренних свищей - частого осложнения болезни Крона.
Азатиоприн и 6-меркаптопурин снижают количество Т-лимфоцитов и нарушают синтез
иммуноглобулинов. Механизм их действия объясняется тем, что их активный
метаболит 6-тиогуанин является конкурентным антагонистом пуриновых оснований.
Для получения видимого клинического
эффекта азатиоприн и 6-меркаптопурин следует принимать не менее 3 мес. в соответствующих
дозах (2-2,5 мг/кг в день азатиоприна и 1-1,5 мг/кг в день 6-меркаптопурина).
Во избежание развития тяжелых
побочных реакций (нарушение костномозгового кровообращения, лекарственные
гепатиты, аллергические состояния) все больные, получающие данные препараты,
должны находиться под постоянным врачебным контролем.
Метотрексат
Метотрексат первоначально
использовался как химиотерапевтический препарат в лечении онкологических
заболеваний, а также ревматоидного артрита, псориаза и астмы. Механизм действия
препарата связан с ингибированием им фермента дигидрофолатредуктазы, которая
участвует в метаболизме фолиевой кислоты. Иммуномодуляторная активность
препарата связана с ингибированием интерлейкина-1 и супрессией Т-лимфоцитов.
Парентеральное введение еженедельно 25 мг. метотрексата (подкожное или
внутримышечное) у лиц с активной болезнью Крона давало достоверно положительный
клинический эффект. В меньших дозах (15 мг.) препарат используется и для
поддержания клинической ремиссии. В то же время пероральный прием препарата
неэффективен. В процессе лечения необходим внимательный контроль показателей
форменных элементов крови и печеночных маркеров.
Циклоспорин
Это циклический пептид, обычно
используемый в ходе пересадки органов. Помимо возможного использования у
больных неспецифическим язвенным колитом, циклоспорин хорошо зарекомендовал
себя в лечении болезни Крона.
Биологические препараты
Инфликсимаб явился первым препаратом
биологического происхождения, примененным для лечения болезни Крона. По своей
природе инфликсимаб представляет собой моноклональный иммуноглобулин, который
связывает циркулирующий и фиксированный на мембранах фактор некроза опухоли
(TNFa). Ир1фликсимаб может также лизировать активированные Т-лимфоциты и
макрофаги. Внутривенное однократное введение 10 или 20 мг. на 1 кг. массы тела
вызывает у большинства больных клиническую и эндоскопическую ремиссию;
позволяет уменьшить или вовсе отказаться от приема кортикостероидов. Побочные
эффекты сводятся, главным образом, к возникновению головных болей или
аллергических реакций.
Большой интерес вызывает также
применение в лечении болезни Крона других препаратов биологического действия:
интерлейкина-10,11, ингибиторов липооксигеназы, а также талидомида. Клинические
аспекты использования данных препаратов активно разрабатываются.
В лечении болезни Крона к
лекарственным средствам первого ряда относится та или иная комбинация
аминосалицинатов, кортикостероидов, антибиотиков и иммуномодуляторов.
Применение же новых препаратов биологического происхождения может являться
ценным
Неспецифический язвенный колит.
(НЯК) - это некротизирующее
воспаление слизистой оболочки прямой и ободочной кишки, характеризующееся
интерметтирующим течением, склонным к прогрессированию и осложнениям
(перфорация, дилатация, кровотечение, сепсис и др.).
Этиология, патогенез.
Этиология не установлена. Причиной
НЯК в разное время предположительно считались вирусы, различные
цитоплазматические токсины, бактерии.
В патогенезе имеет значение
нарушение микрофлоры в толстой кишке и появление микроорганизмов в отделах, в
которых они не встречаются в норме, что способствует воспалительным процессам и
служит источником интоксикации.
Доказана роль иммунных нарушений. В
ранней активной стадии колит проявляется сосудистой реакцией, нарушением целостности
эпителия, позднее - эрозиями слизистой, которые захватывают лишь подслизистый
слой. При выраженной стадии слизистая оболочка (СО) отечна, полнокровна со
многими большими или небольшими язвами неправильной формы. В отдельных случаях
возникает сплошная язвенная поверхность, покрытая пленкой фибрина
желтовато-бурого цвета. На этой поверхности могут развиваться псевдополипы,
напоминающие истинные. Их появление связано с изъязвлениями СО и регенерации
эпителия.
Воспаление начинается в прямой кишке
и затем распространяется на ободочную кишку. В период обострения и в ранней
стадии в воспалительном инфильтрате преобладают лимфоциты, а при длительном
течении заболевания - плазматические клетки и эозинофилы. Усиленная клеточная
инфильтрация сохраняется на протяжении многих лет. На дне язвы разрастается
грануляционная ткань, покрытая фибрином и окруженная сплошным валом из
лимфоцитов, плазматических клеток и эозинофилов, которые противостоят микробной
инвазии.
При НЯК существенное значение имеют
три вида антигенов: алиментарные, бактериальные и аутогенные. Молоко, яйца,
апельсины, орехи, томаты, картофель могут вызвать обострение, что говорит о
связи алиментарных антигенов с НЯК. В крови были обнаружены антитела к
молочному белку, а также к собственной оболочке толстой кишки (при другой
патологии их нет).
Бактериальный антиген может вызывать
аутоаллергическую реакцию или сенсибилизировать слизистую оболочку толстой
кишки в отношении бактерий и их токсинов. Бактерии, способные к денатурации
кишечной слизи, и антитела, возникающие на поврежденной слизи, вступают в
реакцию с нативной слизью. Через СО, поврежденную бактериями, в организм
проникает пищевой белок, к которому возможна повышенная чувствительность
организма.
Классификация:
По клиническому течению:
Острая форма.
Хроническая форма:
а) фаза обострения;
б) фаза затухающего обострения;
в) фаза ремиссии.
Хроническая непрерывно
рецидивирующая форма.
По распространенности процесса:
Тотальное поражение.
Сегментарное поражение:
а) правостороннее;
б) поперечноободочное;
в) левостороннее.
По тяжести процесса:
а) легкая степень;
б) средняя степень;
в) тяжелая степень.
По характеру поражения толстой
кишки:
Поверхностное.
Глубокое (язва, псевдополипоз,
склероз стенок толстой кишки).
Осложнения:
Местные:
а) перфорация;
б) токсическая дилатация;
в) кровотечение;
г) малигнизация;
д) стриктуры.
Общие:
а) гепатит, холангит;
б) артрит (синовит);
в) стоматит, глоссит;
г) кожные изменения;
д) конъюнктивит, ирит.
Клиника.
В клинике преобладают боли в животе,
диарея с кровью, слизью и гноем. Характерна болезненность живота при пальпации.
Интоксикационный синдром. Синдром системных проявлений: полиартрит; узловатая
эритема; поражение кожи в виде дерматитов, пиодермии, изъязвлений, пустулезных
и уртикарных высыпаний; поражение глаз в виде склерита, ирита, иридоциклита,
увеита, кератита, панофтальмита; поражения печени и внепеченочных желчных
протоков в виде жировой дистрофии, портального фиброза, хронического активного
гепатита, цирроза печени, склерозирующего холангита; поражение СО полости рта,
нефротический синдром, аутоиммунный тиреоидит, аутоиммунная гемолитическая
анемия. Дистрофический синдром.
Критерии диагноза НЯК.
Явления проктита (начальные
проявления НЯК): тенезмы, фрагментированный кал с примесью кровянистой и
гноевидной слизи. При средней степени тяжести частота стула 4-8 раз в сутки,
жидкой консистенции с примесью крови и слизи (проктосигмоидит). При тяжелой
форме с тотальным поражением толстого кишечника - стул более 8 раз в сутки,
жидкий, водянистый, со значительным количеством крови и слизи.
Болевой синдром при поражении
дистальных отделов кишечника, иногда по типу кишечной колики. Боли усиливаются
в период дефекации, а после нее стихают или уменьшаются.
Диспептические расстройства:
тошнота, рвота (тяжелая форма).
Внекишечные, системные проявления:
анемия, гипопротеинемия, гипокалиемия, полиартрит, ирит, трофические язвы
голеней, стоп, амилоидоз, снижение массы тела.
Лабораторные данные: ускорение СОЭ,
лейкоцитоз, увеличение фибриногена, положительный СРБ, диспротеинемия, признаки
анемии.
Копрограмма: слизь, гной,
эритроциты, лейкоциты, положительная реакция Грегерсена.
Данные ректороманоскопии и
колоноскопии: отек, гиперемия, контактная кровоточивость, изъязвления слизистой
оболочки, слизисто-гнойный геморрагический экссудат, псевдополипоз, сужение
просвета кишки. Характерны зернистость, повышенная ранимость, кровоточивость
слизистой при контакте с аппаратом, изъязвления, псевдополипоз.
Биопсия слизистой оболочки толстой
кишки: признаки НЯК.
Лечение.
Диетотерапия диета № 4 или 4б (белок
110-120 г).
Фармакотерапия:
Сульфасалазин (салазопиридазин,
салазодиметоксин) - эффективен при легкой и средней степени тяжести. 0,5 г. 4
раза в сутки, дозу можно увеличивать каждые 2-3 дня на 1 г. до клинического
улучшения (не более 6 г. в сутки). При наступлении ремиссии лечение продолжают
3-4 недели, затем дозу постепенно снижают до 1-2 г. в сутки в течение
нескольких месяцев с коррекцией каждые 3-5 недель.
При ограниченном процессе (прямая
кишка) р-р сульфасалазина (2 г в 60 мл.) или суспензию (5 % р-р) вводят
ректально 1-2 раза в день 3-4 недели.
Гормональная терапия назначается при
тяжелом и среднетяжелом течении (при 10-12 дневном неэффективном лечении
сульфаниламидами) с целью оказания противовоспалительного и иммуносупрессивного
действия.
При локализации процесса в прямой и
сигмовидной кишке гормоны назначают в микроклизмах, суппозиторях, путем
внутриректального капельного орошения (гидрокортизон 125 мг., преднизолон 30-60
мг. на 50-100 мл. физраствора).
При субтотальных и тотальных формах
кортикостероиды принимаются per os в суточной дозе 40-60 мг. в пересчете на
преднизолон. После наступления клинической ремиссии доза постепенно снижается
на 5 мг. в неделю.
Симптоматическая терапия:
Парентеральное питание (гидролизат
казеина, аминопептид, вамин, аминозол интралипид, липофундин, глюкоза и др.)
Коррекция водно-электролитных
нарушений (введение р-ов хлорида натрия, панангина, калия хлорида)
Витаминотерапия (витамины группы В,
С, К, РР и др.)
Антидиарейные препараты (иммодиум
или лоперамид, фосфат кодеина, препараты висмута, танальбина).
При НЯК может развиться ДВС-синдром,
который чаще носит латентный и субклинический характер. Однако при тяжелой
форме, больших объемах поражения кишечника и генерализации процесса,
клинические проявления ДВС могут манифестировать. Эффективным средством лечения
является включение в базисную терапию ДВС криосупернатантной плазмы.
Показаниями к срочному оперативному
вмешательству служат перфорация кишки, септическое состояние, связанное с
острой токсической дилатацией толстой кишки, а также профузное кровотечение.
В отсроченном оперативном
вмешательстве нуждаются больные в случае неэффективного консервативного лечения
при тяжелом течении НЯК и при массивных кровотечениях.
Относительным показанием к
оперативному лечению (резекция толстой кишки в пределах здоровых тканей) служит
прогрессирующее течение язвенного колита, несмотря на проводимую комплексную
медикаментозную терапию.
Болезнь Уиппла.
Болезнь Уиппла - системное
инфекционное заболевание тонкой кишки, возникающее у лиц с нарушением
Т-клеточного иммунитета и макрофагов, неспособных переваривать бактерии или
бактериальные антигены. В результате закупорки лимфатических сосудов тонкой
кишки и других органов гликозаминогликановыми комплексами бактериального происхождения
развиваются синдромы экссудативной энтеропатии и нарушенного всасывания,
артралгия, полисерозит и неврологические нарушения.
Заболевание впервые описано
американским патологом J. H. Whipple в 1907 году под названием
"Интестинальная липодистрофия".
Этиология и патогенез.
В основе патогенеза лежит блокада
лимфатического аппарата СО, лимфатических сосудов брыжейки и лимфатических
узлов тонкой кишки PAS-положительными макрофагами.
Этиология изучена недостаточно. При
электронной микроскопии выяснено, что гликозаминогликановые комплексы являются
или бактериями, или продуктами фагоцитарной деятельности, имеющими
бактериальное происхождение. Клетки, содержащие эти вещества, в настоящее время
обнаруживаются при этом заболевании не только в тонкой кишке, но и в других
органах и тканях, чем и объясняется системность поражения.
Стойкое угнетение Т-клеточного
иммунитета, сохраняющееся и после лечения, свидетельствует о том, что оно
первично и в возникновении заболевания имеет большое значение реактивность
макроорганизма. У мужчин болезнь Уиппла встречается в 5 раз чаще, чем у женщин.
Клиника.
Клиническая картина характеризуется
симптомами нарушенного всасывания и внекишечными проявлениями. У большинства
больных наблюдаются поносы, снижение массы тела и боли в животе. Из внекишечных
проявлений наиболее типичны лимфоаденопатии забрюшинных, реже и периферических
желез, полиартропатии, периодическая лихорадка. Менее часто наблюдаются
пигментация кожи, миокардиты, плевроперикардиты, перитонит, амилоидоз,
нервно-психические синдромы (снижение памяти, нарушение поведения,
офтальмоплегия, нистагм, парез лицевого нерва).
В начальной стадии болезнь чаще
протекает с преобладанием внекишечных симптомов (боли в животе, суставах,
кашель, субфебрильная температура). Характерные симптомы нарушенного всасывания
с диареей, стеатореей и похуданием наблюдаются уже в период развернутой
клинической картины.
Однако и в этот период кишечные
симптомы могут затушевываться поражением других органов. Так, примерно у
половины больных увеличиваются лимфатические узлы, на коже появляются
геморрагии и узловая эритема. У 1/3 больных расширяются границы сердца,
появляются сердечные шумы и нарушения сердечного ритма в результате поражения
миокарда. По мере прогрессирования болезни нарастают кахексия и системные
поражения. У больных может развиться перикардит, панкардит, полисерозит с
выпотом в перикард, плевральную и брюшную полости, суставы. Возможны тяжелые
поражения нервной системы с парезом глазодвигательных мышц, атаксией, нистагмом
и тремором. Иногда развиваются психические расстройства в форме деменции,
нарушений сна. Могут появляться полифагия и полидипсия, свидетельствующие об
эндокринных нарушениях.
Диагноз.
Диагноз устанавливают на основании
гистологического исследования СО тонкой кишки (биоптаты получают во время
дуоденофиброскопии из постбульбарного отдела двенадцатиперстной кишки). При
дуоденоскопии можно наблюдать гиперемию, отек и резкое утолщение складок кишки
из-за лимфостаза. В биоптаптатах выявляется инфильтрация собственной пластики СО
тощей кишки крупными пенистыми PAS-положительными клетками (своеобразные
макрофаги). Ворсинки могут быть булавовидной формы за счет большого количества
лимфы, жира и жирных кислот.
При электронной микроскопии в СО
тонкой кишки находят большое количество мелких грамположительных бацилл,
которые исчезают при повторных биопсиях после длительного лечения
антибактериальными препаратами. PAS-положительные макрофаги можно обнаружить
также в лимфатических узлах, сердечной мышце, легких, печени и нервных стволах.
Лабораторные исследования
подтверждают нарушения всасывания (снижение концентрации белка, кальция и калия
в сыворотке крови) и наличие воспалительных явлений (лейкоцитоз, повышенная СОЭ
и др.).
Лечение.
Основу лечения болезни Уиппла
составляет антибактериальная терапия. Препараты назначают на длительный срок с
перерывами. Больные хорошо реагируют на лечение пенициллином в дозе 1200000 ЕД.
и стрептомицином по 1 г. в сутки в течение 2 недель, с последующим применением
тетрациклина в дозе 1 г. в сутки в течение года. Может использоваться также
триметоприм в сочетании с сульфаметоксазолом, т. е. бисептол (бактрим). В
случае рецидива болезни во время лечения тетрациклином необходимо провести
повторный курс лечения пенициллином и стрептомицином. Продолжительность лечения
определяется результатами повторных гистологических исследований СО тонкой
кишки и состоянием больного. Для лечения тяжелобольных, помимо антимикробной
терапии, может потребоваться назначение глюкокортикоидов, но для лечения одного
лишь артрита использовать их нецелесообразно. Для устранения суставных
симптомов могут оказаться полезными НПВС.
Одновременно проводят коррекцию
нарушенного обмена веществ. В связи с особенно плохим всасыванием жиров в диету
надо включать средне- и короткоцепочечные триглицериды (жировой энпит,
порталак), заменяя или обычные жиры. Применение их ведет к исчезновению
стеатореи, т.к. среднецепочечные и короткоцепочечные триглицериды всасываются
не в лимфатическую, а в венозную портальную систему. Гипопротеинемию и
расстройства водно-электролитного обмена устраняют путем систематического
переливания белковых и солевых растворов.
ЛИТЕРАТУРА
Основная:
Внутренние болезни. Под ред.
Комарова Ф. И. М., Медицина. 1990. - 688 с.
Маколкин В. И., Овчаренко С. И.
Внутренние болезни. М., Медицина. - 1999. - 592 с.
Окороков А. Н. Диагностика болезней
внутренних органов: Т1. Диагностика болезней органов пищеварения. М., Мед. лит.
2000. - 560 с.
Окороков А. Н. Лечение болезней
внутренних органов. Практ. руководство в 3-х т. Т.1 Мн. Выш. шк. 1995. - 522 с.
ЗАБОЛЕВАНИЯ ПЕЧЕНИ
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
Жировой гепатоз. Этиология,
патогенез, клиника, диагностика, лечение.
Пигментные гепатозы. Болезнь и
синдром Жильбера, Криглера-Найара, Ротора, Дабина-Джонсона. Этиология,
патогенез, клиника, диагностика, лечение.
Гемохроматоз. Этиология, патогенез,
клиника, диагностика, лечение.
Болезнь Вильсона-Коновалова.
Этиология, патогенез, клиника, диагностика, лечение.
Амилоидоз печени. Этиология,
патогенез, клиника, диагностика, лечение.
Эхинококкоз. Этиология, патогенез,
клиника, диагностика, лечение.
ОТВЕТЫ НА ВОПРОСЫ
Стеатоз печени или жировая дистрофия
- самостоятельное заболевание или синдром, обусловленный жировой дистрофией
гепатоцитов.
Основными причинами стеатоза печени
являются злоупотребление алкоголем, сахарный диабет в сочетании с ожирением,
ожирение, синдром Кушинга, микседема, несбалансированное питание (белковая
недостаточность), хронические заболевания пищеварительной системы с синдромом
нарушенного всасывания, воздействие гепатотоксических веществ.
В патогенезе жирового гепатоза имеют
значение два фактора:
) увеличение поступления жира в
печень;
) затруднение удаления (выхода) жира
из печени.
Причин увеличенного поступления жира
много - перегрузка пищевыми жирами и углеводами, обеднение печени гликогеном,
уменьшение окисления жира в организме при алкоголизме, дыхательной
недостаточности. Анемии, повышенная секреция соматотропного гормона гипофиза.
Удаление жиров из печени также может быть обусловлено многими факторами -
пониженным образованием бета-липопротеидов, торможением распада жирных кислот и
другими.
Основным морфологическим признаком
стеатоза печени является повышенное количество жировых капель в гепатоците. При
этом если в норме жировые капли в гепатоците располагаются вдоль синусоид или
желчных капилляров, то для стеатоза характерна их диффузная локализация.
Клинически стеатоз печени чаще всего
проявляется только гепатомегалией. УЗИ обычно подтверждает наличие
гепатомегалии, выявляется также эхогенная диффузная неоднородность печени.
Функциональные и индикаторные тесты в большинстве случаев в норме, но может
быть очень умеренное повышение уровня билирубина в сыворотке крови и повышение
активности трансаминаз.
Если при этом определяются нарушения
углеводного и липидного обмена, имеются указания в анамнезе на заболевания, при
которых часто развивается стеатоз, диагностика нетрудна. Четко дифференцировать
стеатоз печени с такими формами ее поражения как персистирующий гепатит или
реактивный гепатит можно только с помощью биопсии печени.
Лечение: важнейшее значение имеет
диета. В основном она соответствует требованиям 5 стола, но должна содержать
больше белка - до 100-120 г. с ограничением животных жиров. В диету должны
входить творог, гречневая, овсяная крупы, витамины и микроэлементы, обладающие
липотропными свойствами.
Имеется ряд лекарственных средств с
липотропным действием. Сюда относятся препараты-гепатопротекторы:
эссенциале-форте, легалон; витамин В12, липоевая кислота, липофарм, липостабил.
Назначаются курсами по 3 недели, примерно 1 раз в квартал.
Синдром Жильбера
Синдром Жильбера развивается
вследствие врожденного или приобретенного снижения активности фермента
глюкуронилтрансферазы, снижения захвата и конъюгации билирубина из крови
гепатоцитами. Генетически обусловленный синдром Жильбера называют также
болезнью Жильбера, синдром развивается также у больных после острого гепатита и
называется постгепатитной гипербилирунемией. Клинически они не различаются.
Синдром Жильбера проявляется
умеренной рецидивирующей желтухой, в крови повышается свободный
неконъюгированный билирубин. Уробилин в моче обычно не определяется. Больные в
момент усиления желтухи жалуются на слабость, снижение работоспособности,
иногда боли в правом подреберье. Дифференциальный диагноз проводится с
гемолитической анемией и хроническим персистирующим гепатитом. Гемолитическая
анемия исключается, когда нет анемии, спленомегалии, признаков повышенного
гемолиза. Дифференцировать с персистирующим гепатитом клинически крайне трудно.
Приходится прибегать к биопсии печени. У больных синдромом Жильбера изменений в
печени обычно не бывает, в определенном проценте случаев можно выявить
отложение липофусцина в гепатоцитах, купферовских клетках, гликогеноз ядер
гепатоцитов.
Лечение. Проводится фенобарбиталом,
который является мощным индуктором ферментов, в частности
глюкуронилтрансферазы. Препарат назначается по 0,1 два раза в день, особенно в
периоды обострения заболевания.
Синдром Криглера-Наджара (Найяра)
Синдром Криглера-Наджара - редкое
заболевание, при котором развивается желтуха с повышением в крови свободного
билирубина вследствие полного отсутствия или значительного снижения в
гепатоцитах глюкуронилтрансферазы. Выделяют два типа болезни. I тип встречается
у детей до 1 года, протекает очень тяжело из-за поражения базальных ганглиев
головного мозга и приводит к летальному исходу. II тип протекает менее тяжело,
им заболевают подростки. Желтуха у этих больных постоянная, имеются небольшие
неврологические нарушения. Решающий метод диагностики - биопсия печени.
Обнаруживается либо неизмененная ткань, либо небольшая жировая дистрофия
печени.
Лечение проводится фенобарбиталом -
по 0,1 два раза в день курсами по 20-30 дней.
Синдромы Дабина-Джонсона и Ротора
Оба синдрома относятся к
доброкачественным функциональным гипербилирубинемиям с повышением содержания
конъюгированного прямого билирубина.
Для синдрома Дабина-Джонсона
характерны постоянная или интермиттирующая желтуха, повышение прямого
билирубина, изменение единственного функционального теста - бромсульфалеиновой
пробы. Достоверно диагноз устанавливается на основании данных морфологического
исследования. Исключаются органические причины желтухи. Обнаруживается
отложение крупнозернистого меланиноподобного пигмента в центральных отделах
долек.
При синдроме Ротора морфологически вообще
никаких изменений не обнаруживают.
Лечение синдромов не разработано.
Гемохроматоз
Определение. Классификация
Гемохроматоз (пигментный цирроз
печени, бронзовый диабет) - наследственное заболевание, характеризующееся
повышением всасывания железа в кишечнике и отложением в органах и тканях
железосодержащих пигментов. Кроме наследственного (идиопатического, первичного)
гемохроматоза существует и вторичный, развивающийся на фоне определенных
заболеваний.
Рабочая классификация гемохроматозов
(Ю. Н. Токарев, Д. А. Сеттарова, 1988). Наследственный (идиопатический,
первичный) гемохроматоз.. Вторичный гемохроматоз, формы:
Посттрансфузионный (при хронической
анемии, в лечении которой длительно применяются гемотрансфузии).
Алиментарный (гемохроматоз африканского
племени банту, алкогольный цирроз печени, вероятно, болезнь Кашина-Бека и др.).
Метаболический (нарушение
метаболизма железа при промежуточной В-талассемии, у больных циррозом печени
после операции портокавального анастомоза, при закупорке протока поджелудочной
железы, кожной порфирии и др.).
Смешанного происхождения (при
большой талассемии, некоторых видах дизэритропоэтической анемии).
Наследственный гемохроматоз
Этиология. В настоящее время
доказана роль генетических факторов в развитии заболевания. Распространенность
гена наследственного гемохроматоза составляет 0,03-0,07 % при частоте
гетерозиготности в европейской популяции около 10 %. Заболевание развивается в
3-5 случаях на 1000 носителей гена наследственного гемохроматоза. Установлена
связь между наследственным гемохроматозом, врожденным ферментным дефектом,
приводящим к накоплению железа во внутренних органах, и антигенами
гистосовместимости системы HLA - А3, В7, B14. А11
Патогенез. Первичным функциональным
дефектом является нарушение регуляции захвата железа клетками слизистой
оболочки желудочно-кишечного тракта, что приводит к неограниченному всасыванию
железа с последующим чрезмерным отложением его в печени, поджелудочной железе,
сердце, яичках и других органах (отсутствие «ограничения всасывания»). Это
обусловливает гибель функционально активных элементов и развитие
склеротического процесса. Возникает клиническая симптоматика цирроза печени,
сахарного диабета, метаболической кардиомиопатии. В организме здорового
человека содержится 3-4 г. железа, при гемохроматозе - 20-60 г.
Клинические симптомы. Болеют
преимущественно мужчины (соотношение мужчин и женщин 6: 1), в возрасте 40-60
лет. Начало болезни постепенное, характерные симптомы появляются лишь спустя
1-3 года.
Основные клинические признаки:
Пигментация кожи (меланодермия) - у
52-94 % больных (С. Д. Подымова, 1984). Выраженность пигментации зависит от
давности заболевания. Кожа имеет дымчатую, бронзовую, сероватую окраску,
наиболее заметную на открытых участках тела (лице, руках), на ранее пигментированных
местах, в подмышечных впадинах, в области половых органов.
Увеличение печени наблюдается у 97 %
больных в развернутой стадии болезни, печень плотная, нередко болезненная. В
дальнейшем развивается клиническая картина цирроза печени с асцитом, портальной
гипертензией, спленомегалией.
Сахарный диабет отмечается у 80 %
больных, обусловлен отложением железа в островках Лангерганса, проявляется
жаждой, полиурией, гипергликемией, глюкозурией. Редко осложняется ацидозом и
комой.
Другие эндокринные расстройства -
гипогенитализм (снижение потенции, атрофия яичек, исчезновение вторичных
половых признаков, феминизация, у женщин - аменорея, бесплодие); гипокортицизм
(резкая слабость, снижение АД, выраженное похудание).
Кардиомиодистрофия сопровождается
увеличением сердца, нарушениями ритма, постепенным развитием сердечной
недостаточности, резистентной к лечению сердечными гликозидами.
Метаболический синдром мальабсорбции
(см. Синдром мальабсорбции).
Лабораторные данные.: признаки
анемии (не у всех больных), увеличение СОЭ.
ОА мочи: возможна умеренная
протеинурия, уробилинурия, глюкозурия.
БАК: уровень сывороточного железа
более 37 мкмоль/л, ферритина сыворотки крови - более 200 мкмоль/л, процент
насыщения трансферрина железом - более 50 %, увеличение показателей АлАТ,
гамма-глобулинов, тимоловой пробы, нарушение толерантности к глюкозе или
гипергликемия.
Снижение содержания в крови 11-ОКС,
17-ОКС, натрия, хлоридов, гидрокортизона, уменьшение суточной экскреции с мочой
17-ОКС, 17-КС, снижение в крови и моче уровня половых гормонов.
В биоптатах кожи - избыточное
отложение меланина, в биоптатах печени - отложение гемосидерина, липофусцина,
картина микронодулярного цирроза печени.
Инструментальные исследования.
Ультразвуковое и радиоизотопное
сканирование: увеличение печени, поджелудочной железы, диффузные изменения в
них, спленомегалия.
ФГДС: при развитии цирроза печени
выявляется варикозное расширение вен пищевода и желудка.
Эхокардиография: увеличение размеров
сердца, снижение сократительной функции миокарда.
ЭКГ: диффузные изменения миокарда
(снижение зубца Т, интервала S-Т).
Программа обследования.
ОА крови, мочи, анализ мочи на
глюкозу, уробилин, билирубин.
БАК: билирубин, трансаминазы, общий
белок и белковые фракции, глюкоза, калий, натрий, хлориды, сывороточное железо,
ферритин сыворотки, процент насыщения трансферрина железом. При нормальной
гликемии - тест на толерантность к глюкозе.
Ультразвуковое сканирование печени,
селезенки, поджелудочной железы, почек.
Эхо-кардиография.
ЭКГ.
Определение содержания в крови
половых гормонов, гидрокортизона.
Определение суточной экскреции с
мочой 17-ОКС, 17-КС.
Биопсия кожи, печени.типирование.
Гепатолентикулярная дегенерация
(болезнь Вильсона-Коновалова).
Гепатолентикулярная дегенерация
(болезнь Вильсона-Коновалова) -- редкое генетически детерминированное
заболевание. Нарушена выработка фермента церулоплазмина в печени, что приводит
к выраженным нарушениями обмена меди в организме. Она в большем количестве
депонируется в органах, в то же время недостаточно поступает к ферментам
тканевого дыхания.
В детском и подростковом возрасте
заболевание начинается как острый вирусный гепатит с последующим переходом в
хронический гепатит. Необычным для этого заболевания являются почечные
нарушения. У больных постоянно наблюдается гематурия, фосфатурия и
аминоацидурия. Предположение о болезни Вильсона возникает, когда наряду с
указанными нарушениями появляются симптомы поражения нервной системы.
Характерны экстрапирамидные расстройства - мелкоамплитудное дрожание верхних и
нижних конечностей, ригидность мышц, расстраивается походка, появляются
затруднения при письме. По мере прогрессирования заболевания появляется синдром
портальной гипертензии. На поздних стадиях можно выявить патогномоничный
симптом гепатолентикулярной дегенерации - кольцо Кайзера-Флейшера на роговице.
Диагноз подтверждается данными о
нарушениях обмена меди. Снижается содержание церулоплазмина в плазме крови
(ниже 350 мг/л), повышается экскреция меди с мочой (более 200 мкг/сутки, в
норме выделяется менее 70 мкг/сутки). Используется также тест с радиоактивной
медью.
Лечение. В диете ограничиваются
продукты, богатые медью - баранина, курица, рыба, грибы, щавель, редис,
бобовые, орехи, чернослив.
Из лекарственных средств применяются
препараты, связывающие и выводящие медь из организма - британский антилюизит и
унитиол курсами, а также Д-пеницилламин (купренил). Последний препарат при
хорошей переносимости должен приниматься пожизненно. Оптимальная доза 0 0,9-1,2
г/сутки.
Амилоидоз
Амилоидоз - заболевание, обусловленное
отложением измененного белка амилоида во внутренних органах, чаще всего в
почках, печени, селезенке. Различают первичный (идиопатический) и вторичный
амилоидоз. Диагностика вторичного амилоидоза более легкая задача, если помнить,
что он осложняет ряд заболеваний. Это хронические гнойные инфекции
(остеомиелит, бронхоэктатическая болезнь), туберкулез, диффузные заболевания
соединительной ткани и гемобластозы. Обнаружение у больных этими заболеваниями
увеличения печени и селезенки в ряду причин должно заставить подумать об
амилоидозе. Одновременное обнаружение протеинурии, диспротеинемии и
гипер-альфа-2-глобулинемии делают это предположение вполне вероятным. Решающим
методом диагностики амилоидоза является биопсия одного из органов-мишеней, где
чаще всего можно обнаружить амилоид. Чаще всего вначале производят биопсию
десневого сосочка или слизистой прямой кишки, при отрицательных результатах -
печени и почек. Амилоид обнаруживается в виде гомогенных масс, окрашивающихся
конго-рот в розовый цвет.
Значительно труднее диагностировать
первичный амилоидоз, особенно если он вначале проявляется только гепатомегалией
или гепатолиенальным синдромом. Первичный, идиопатический амилоидоз относится к
генетически детерминированным заболеваниям с передачей предрасположенности по
рецессивному типу. Поэтому генеалогический анамнез не всегда помогает.
Генетическим маркером заболевания может быть национальность больного. Первичный
амилоидоз в нашей стране встречается у армян и евреев. Выявление у них гепато-
и спленомегалии без предшествующих заболеваний печени должно нацеливать врача
на мысль о первичном амилоидозе. Общая схема обследования таких больных такая
же, как и при вторичном амилоидозе.
Эхинококкоз печени
Развивается вследствие глистной
инвазии Echinococcus granulosus, при поражении печени развиваются кисты -
одиночные или множественные. Они локализуются в основном в правой доле печени.
Симптомы заболевания обусловлены сдавлением растущей кистой или кистами
паренхимы печени, кровеносных сосудов и желчных путей, а также токсическим и
сенсибилизирующим воздействием паразита на организм человека.
Клинически эхинококкоз чаще всего
проявляется болями в правом подреберье, гепатомегалией, реже бывают желтуха,
кожный зуд. Для картины крови характерна эозинофилия. Осложнения - прорыв кисты
в желчные пути с развитием механической желтухи; нагноение кисты с
соответствующей клинической симптоматикой (лихорадка, боли, ознобы, проливные
поты, выраженная болезненность при пальпации печени). Основную диагностическую
информацию дают УЗИ и КТ, когда выявляются очаговые образования в печени. Для
эхинококковых кист характерны гетерогенность содержимого и наличие участков
обызвествления в стенке кист и других участках печени. КТ в этом плане более
информативна, чем УЗИ. Определенное значение имеют серологические исследование
с специфическими диагностикумами - реакция Кацони, гемагглютинации и
латекс-агглютинации.
Единственным радикальным методом
лечения считается хирургический.
ЛИТЕРАТУРА
Основная:
Внутренние болезни. Под ред.
Комарова Ф. И. М., Медицина. 1990. - 688 с.
Маколкин В. И., Овчаренко С. И..
Внутренние болезни. М., Медицина. 1999. - 592 с.
Окороков А. Н. Диагностика болезней
внутренних органов: Т1. Диагностика болезней органов пищеварения: М., Мед. лит.
2000. - 560 с.
Окороков А. Н. Лечение болезней
внутренних органов. Практ. руководство в 3х Т.1 Мн. Выш. шк. 1995. - 522 с.
Дополнительная литература:
Бацков С. С., Иноземцев С. А.,
Ткаченко Е. И. Болезни желчного пузыря и поджелудочной железы (новое в
диагностике и лечении). - СПб.: Стройлеспечать. 1996. - 95 с.
Внутренние болезни. В 10 книгах.
Книга 7. Пер. с англ. / Под ред. Е. Браунвальда и др. М., Медицина. 1993. - 560
с.
Гончарик И. И. Гастроэнтерология:
стандартизация диагностики и обоснование лечения: Справ. пособие. Мн., Беларусь.
2000. - 143 с.
Лычев В. Г. Основы клинической
гастроэнтерологии. М., Мед. книга; Н. Новгород: Изд-во НГМА. 2000. - 186 с.
Подымова С. Д. Болезни печени.
Руководство для врачей. М., Медицина. 1993. - 544 с.
Шулутко Б. И. Болезни печени и
почек. СПб., Издательство Санкт-Петербургского санитарно-гигиенического
мединститута. 1993. 480 с.
ЗАБОЛЕВАНИЯ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ
ПУТЕЙ (занятие 2)
ВВЕДЕНИЕ
Желчно-каменная болезнь (ЖКБ)
встречается достаточно часто, особенно среди населения западных стран. По
данным аутопсий, 20 % женщин и 8% мужчин в возрасте старше 40 лет страдают ЖКБ.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
Желчнокаменная болезнь. Этиология.
Патогенез. Клиника. Диагностика. Осложнения.
Желчнокаменная болезнь. Лечение:
консервативное и оперативное. Прогноз. Профилактика.
Желчная колика. Проявления.
Диагностика. Купирование приступа.
Постхолецистэктомический синдром.
Патогенез. Клинические формы. Диагностика. Лечение.
ОТВЕТЫ НА ВОПРОСЫ
Желчно-каменная болезнь (ЖКБ) -
обменное заболевание гепатобилиарной системы, характеризующееся образованием
желчных камней в желчном пузыре (холецистолитиаз, хронический калькулезный
холецистит), в общем, желчном протоке (холедохолитиаз), в печеночных желчных
протоках (внутрипеченочный холелитиаз).
Желчные камни представляют собой
кристаллические структуры, образующиеся путем слипания нормальных или
аномальных компонентов желчи.
Различают следующие виды желчных
камней: холестериновые, пигментные и смешанные. Смешанные и холестериновые
камни составляют 80 % всех камней и содержат более 70 % моногидрата холестерина
и примесь солей кальция, желчных кислот и пигментов, протеины, жирные кислоты и
фосфолипиды. Пигментные камни составляют около 20 % всех камней и состоят,
прежде всего, из билирубината кальция, а также менее 10 % холестерина.
Этиология.
К внешним факторам риска ЖКБ относят
высококалорийную пищу, богатую животными жирами и рафинированными углеводами,
которая в последующем способствует развитию ожирения и сахарного диабета.
Беременность является одной из причин, способствующих развитию ЖКБ. Из
внутренних факторов отмечают определенную связь развития ЖКБ с генетическими
дефектами и образованием в печени "литогенной желчи", перенасыщенной
холестерином, при одновременном снижении уровня фосфолипидов и желчных кислот.
Патогенез.
Желчные камни формируются в
результате осаждения нерастворимых компонентов желчи: холестерина, желчных
пигментов, солей кальция и некоторых типов белков. Это происходит вследствие
сочетанного действия таких факторов, как генетическая предрасположенность,
нерациональное питание, нарушение обмена веществ, беременность, стаз желчи,
которые приводят к изменению физико-химических свойств желчи, способствующему
образованию камней.
Факторы, предрасполагающие к
образованию желчных камней:
Холестериновые и смешанные желчные
камни
Демографические факторы: Северная
Европа, Северная и Южная Америка в большей степени, чем страны Востока;
вероятно, имеются семейная и наследственная предрасположенность
Лечение клофибратом (усиление
выделения холестерина)
Нарушение всасывания желчных кислот
(заболевания подвздошной кишки или ее резекция, снижение секреции желчных
солей)
Женские половые гормоны: после
наступления зрелого возраста женщины чаще подвержены риску, чем мужчины;
пероральные контрацептивы и другие эстрогены (снижение секреции желчных солей)
Возраст, особенно у мужчин
Прочие факторы: беременность,
сахарный диабет, полиненасыщенные жиры в пище (усиление выделения холестерина)
Длительное парентеральное питание
Пигментные камни
Демографические / генетические
факторы: Восток, сельская местность
Хронический гемолиз
Алкогольный цирроз
Хроническая инфекция желчных путей,
гельминтоз
Преклонный возраст
Клиника.
Различают латентную, диспептическую,
болевую торпидную и болевую приступообразную формы, которые в определенном
смысле можно рассматривать как стадии развития болезни. Однако такая
последовательность проявлений заболевания далеко не обязательна.
Обследование.
Обязательные лабораторные
исследования
Однократно:
Холестерин, амилаза, сахар крови;
Группа крови, резус-фактор;
Бактериологическое исследование
дуоденального содержимого;
Копрограмма
Двукратно:
Общий анализ крови и мочи;
Общий билирубин и его фракции, АСТ,
АЛТ, ЩФ, ГГТП;
Общий белок и белковые фракции;
С-реактивный белок.
Обязательные инструментальные
исследования
Рентгенография брюшной полости;
Рентгенография органов грудной
клетки;
УЗИ печени, желчного пузыря,
поджелудочной железы и селезенки;
Эндоскопическая ретроградная
холангиопанкреатография;
Электрокардиография
Дополнительные исследования
Проводятся в зависимости от
предполагаемого диагноза и осложнений.
Диагноз.
На вероятность ЖКБ могут указывать
женский пол, возраст после 40 лет, частые роды, полнота пациента, большое
количество кристаллов холестерина и крупинок билирубината кальция в
дуоденальном содержимом, низкий холатохолестериновый коэффициент. Решающая роль
в диагностике принадлежит УЗИ и рентгенологическому методу исследования,
которые позволяют выявить камни в желчном пузыре и желчный осадок.
Лечение.
См. п. 4 списка основной литературы.
Желчная (печеночная) колика.
Под желчной коликой понимают
приступообразные боли в правом подреберье, возникающие при заболеваниях
желчевыводящих путей: холелитиазе, холецистите, стенозе большого дуоденального
сосочка, стриктурах, сдавлении желчных протоков, наличии гельминтов или
инородных тел в билиарном тракте, гемобилии, а также дискинезиях желчных путей.
Боли возникают в результате блокады
оттока желчи. Они обусловлены спастическим сокращением гладкой мускулатуры
желчного пузыря и протоков, "стремящейся преодолеть" препятствие току
желчи. При этом резко повышается давление в желчевыводящей системе.
Интенсивность и характер боли бывают различными. Обычно боли сильные, иногда
периодические. Могут наблюдаться продромальные симптомы, такие как чувство
тяжести и распирание в правом подреберье. Приступ провоцируют погрешности в
диете, прием алкоголя, охлажденных газированных напитков, иногда физическая
перегрузка, тряская езда, эмоциональное напряжение и т. д. Боль локализуется в
правом подреберье, эпигастральной области, иногда в левом подреберье,
иррадиирует в спину, грудную клетку справа, правое надплечье, лопатку и правую
руку. Нередки тошнота и рвота, не приносящая облегчения, метеоризм и задержка
стула. Может развиться холецисто-кардиальный синдром. Иногда отмечается
кратковременное повышение температуры.
Во время приступа определяются
местная болезненность при пальпации в правом подреберье и положительные
желчно-пузырные симптомы, а также зоны гиперестезии у правой реберной дуги и
справа от ThIX-ThXI.
Приступ желчной колики может длиться
от нескольких минут до многих часов с волнообразным усилением и ослаблением
болей. Во время длительного болевого приступа и после него иногда наблюдают
преходящий кожный зуд, повышение активности щелочной фосфатазы и концентрации
билирубина в крови, выделение темной мочи и светлого кала. Диагноз может быть
подтвержден УЗИ.
Лечение. Больного с некупирующейся
желчной коликой следует госпитализировать в хирургическое отделение. Для
купирования используются спазмолитики: нитроглицерин (под язык), подкожно 1 мл.
1 % р-ра атропина сульфата, 1-2 мл. 0,2 % р-ра платифиллина гидротартрата, 1-2
мл. р-ра папаверина гидрохлорида или но-шпы. Можно использовать в/венное введение
5-10 мл. 2,4 % р-ра эуфиллина. Эти препараты для усиления эффекта можно
комбинировать с дроперидолом и анальгином. Если приступ не купируется, атропин,
но-шпу, анальгин и дроперидол вводят в/венно капельно в 200-300 мл. 5 % р-ра
глюкозы. Эффективным средством является баралгин. При отсутствии эффекта вводят
промедол в сочетании с атропином.
Устранению спазма способствует
применение грелки. Хороший эффект наблюдается от новокаиновых блокад
(субксифоидной новокаиновой блокады или блокады круглой связки печени).
Постхолецистэктомический синдром.
(ПХЭС) - условное обозначение
различных нарушений, рецидивирующих болей и диспептических проявлений,
возникающих у больных после холецистэктомии.
Примерно в 25 % случаев
холецистэктомия не приносит облегчения больным.
Спазм сфинктера Одди, дискинезия
внепеченочных желчных протоков, желудка и двенадцатиперстной кишки, микробная
контаминация, гастродуоденит, длинный пузырный проток после холецистэктомии
могут быть причиной некоторых симптомов, входящих в ПХЭС, который следует
расшифровывать по результатам обследования.
Удаление желчного пузыря не
избавляет больных от обменных нарушений, в том числе и от печеночно-клеточной
дисхолии. Определяется литогенная желчь с низким холатохолестериновым
коэффициентом. Нарушается пассаж желчи, что сопровождается расстройством
пищеварения, всасывания жира и других веществ липидной природы. Изменение
химического состава желчи приводит к микробному обсеменению двенадцатиперстной
кишки, ослаблению роста и функционирования нормальной кишечной микрофлоры,
расстройству печеночно-кишечной регуляции желчных кислот и других компонентов
желчи. Под влиянием патологической микрофлоры желчные кислоты подвергаются
деконъюгации, что сопровождается повреждением СО двенадцатиперстной, тонкой и
толстой кишки, обуславливая, наряду с бактериальным обсеменением, развитие
дуоденита, рефлюкс-гастрита, энтерита, колита. Общий пул желчных кислот в
организме при этом снижается. Дуоденит сопровождается дуоденальной дискинезией,
функциональной дуоденальной недостаточностью. Гипертензией, дуодено-гастральным
рефлюксом и забросом содержимого в общий желчный проток и проток поджелудочной
железы. Присоединяются реактивный панкреатит и гепатит.
Спазм сфинктера Одди и общего
желчного протока развивается в связи с выпадением функции регуляции давления со
стороны желчного пузыря на общий желчный проток и сфинктер Одди, которое и
приводит к депонированию желчи. Примерно у 50 % оперированных больных
преобладает гипертонус сфинктера Одди и двенадцатиперстной кишки. У пациентов наблюдается
плохая переносимость жиров.
Обследование. Обязательные
лабораторные исследования
Однократно:
Общий анализ крови и мочи;
Общий билирубин и его фракции, АСТ,
АЛТ, ЩФ, ГГТП;
Исследование порций А и С
дуоденального содержимого, включая бактериологическое;
Копрограмма, кал на дисбактериоз и
гельминты;
Обязательные инструментальные
исследования
Эзофагогастродуоденоскопия с
биопсией СО;
Эндоскопическая ретроградная
холангиопанкреатография;
УЗИ органов брюшной полости;
Ректосигмоскопия.
Консультации специалистов:
обязательные - хирурга, колопроктолога.
Диагноз.
В диагностике спазма общего желчного
протока имеют значение повторная внутривенная холангиография и многомоментное
дуоденальное зондирование с применением фармакологических проб.
Для определения обструкционного
синдрома учитывают указания на перенесенную желтуху, даже скрытую, а также
расширенный общий желчный проток при рентгенологическом исследовании больного.
При УЗИ конкременты общего желчного протока имеют вид округлых эхопозитивных
образований, расположенных в его просвете.
Стеноз большого дуоденального
сосочка при дуоденоскопии имеет точечное выходное отверстие с
рубцово-измененной слизистой оболочкой и скудным поступлением желчи. При
рентгенологическом исследовании печеночный проток в течение длительного времени
остается широким.
Избыточную культю пузырного протока
удается обнаружить при внутривенной холангиографии.
Билиарный панкреатит подтверждается
определением активности амилазы в крови и диастазы в моче. Помогают в
диагностике эхография и компьютерная томография, которые выявляют увеличение
поджелудочной железы.
Лечение.
Через 1,5-2 месяца после операции
рекомендуется диета № 5, обогащенная клетчаткой (пшеничные отруби, морковь,
капуста, кукуруза, овсянка и т. д.). Такая диета нормализует химический состав
желчи и в первую очередь содержание холестерина и холатохолестериновый
коэффициент.
При застое желчи назначают
липотропно-жировую диету № 5. обогащенную белковыми липотропными продуктами,
полиненасыщенными жирными кислотами, витаминами группы В.
Фармакотерапия состоит в
использовании средств нормализующих функцию сфинктеров желчных протоков и
двенадцатиперстной кишки (нитроглицерин, дебридат, но-шпа и др.), средств
адсорбирующих деконъюгированные желчные кислоты (ремагель, фосфалюгель, холестирамин),
уменьшающих воспаление слизистой оболочки 12 перстной кишки (де-нол, викаир,
вентер и др.), подавляющих активность патологической микробной флоры
(энторосидив, фуразолидон, бисептол, эритромицин и др.)
При неспецифическом реактивном
гепатите назначают гепатозащитные средства (эссенциале, гепатофальк, планта,
липамид и др.), а при панкреатите - адекватные дозы ферментных препаратов
(панкреатин, трифермент и др.), а в ряде случаев ингибиторы панкреатической
секреции.
Показанием к назначению холеретиков
и холекинетиков больным после холецистэктомии служит сохраняющаяся литогенность
желчи.
Вопросы профилактики
камнеобразования у больных, перенесших холецистоэктомию, связаны с проблемой
ожирения. В связи с этим наряду с гипокалорийной диетой, обеспечивающей
уменьшение массы тела, для нормализации химического состава желчи рекомендуются
препараты желчи (лиобил и др.) а также холонертон и розанол, но наиболее
эффективны препараты урео- и хенодезоксихолевой кислот.
Если неудовлетворительный результат
холецистэктомии обусловлен поражением органов билиопанкреатопапиллярной зоны,
возникают показания к повторному оперативному вмешательству на желчных путях. К
абсолютным показаниям к операции относят холестаз, обусловленный
гепатохоледохолитиазом, стенозирующим процессом печеночных и общего желчного
протоков, или большого соска двенадцатиперстной кишки, а также хроническим
индуративным панкреатитом.
Прогноз больных в
постхолецистэктомическом периоде зависит от причин, обусловливающих
неудовлетворительный исход операции, но при прочих равных условиях - от сроков
хирургического лечения. Ближайшие и отдаленные исходы операции оказываются
более благоприятными, если холецистэктомия проводится в раннем неосложненном
периоде болезни и в состоянии ремиссии воспалительного процесса, в том числе
наступившим под влиянием адекватного консервативного лечения в предоперационном
периоде.
ЛИТЕРАТУРА
Основная:
Внутренние болезни. - Под ред.
Комарова Ф. И. М., Медицина. 1990. - 688 с.
Маколкин В. И., Овчаренко С. И..
Внутренние болезни. М., Медицина. 1999. - 59 с.
Окороков А. Н. Диагностика болезней
внутренних органов: Т1. Диагностика болезней органов пищеварения: М., Мед. лит.
2000. - 560 с.
Окороков А. Н. Лечение болезней
внутренних органов. Практ. руководство в 3х т. Т.1 Мн. Выш. шк. 1995. - 522 с.
Дополнительная литература:
Бацков С. С., Иноземцев С. А.,
Ткаченко Е. И. Болезни желчного пузыря и поджелудочной железы (новое в
диагностике и лечении). - СПб.: Стройлеспечать. 1996. - 95 с.
Внутренние болезни. В 10 книгах.
Книга 7. Пер. с англ. Под ред. Е. Браунвальда и др. М., Медицина. 1993. - 560
с.
Гончарик И. И. Гастроэнтерология:
стандартизация диагностики и обоснование лечения: Справ. пособие. Мн.:
"Беларусь". 2000. - 143 с.
ЗАБОЛЕВАНИЯ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ
ПУТЕЙ (занятие 3)
ВВЕДЕНИЕ
Дискинезии желчевыводящих путей
имеют широкое распространение и зачастую являются предрасполагающим моментов в
развитии хронического холецистита и ЖКБ. Хронический холецистит встречается в
72 случаях на 1000 населения. Он выявляется у 20 % женщин и 10 % мужчин США и
Западной Европы.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
Хронические холециститы и холангиты.
Этиология и патогенез.
Клиника, диагностика хронических
холециститов и холангитов.
Осложнения хронических холециститов
и холангитов. Лечение. Прогноз.
Дискинезии желчевыводящих путей.
Определение. Этиология. Патогенез.
Клиника, диагностика ДЖВП.
Дифференциальная диагностика ДЖВП.
Лечение ДЖВП.
ОТВЕТЫ НА ВОПРОСЫ:
Холецистит.
Холецистит - воспалительное
заболевание инфекционной природы (бактериальной, вирусной или паразитарной),
вызывающее поражение стенки желчного пузыря, образование в нем камней и
моторно-тонические нарушения желчевыделительной системы.
Клинически выделяют две основные
формы холецистита - некалькулезный и калькулезный. При этом воспаление может
быть катаральным, гнойным, в период выраженного обострения холецистита могут
развиваться деструктивные формы. При бескаменном холецистите воспалительный
процесс чаще всего локализуется в шейке пузыря.
Этиология.
Наиболее частой причиной развития
хронического холецистита является бактериальная инфекция - различные виды
кишечной палочки, протей, энтерококки, стафилококки, стрептококки, в большей
части случаев грамотрицательная флора. Дискутируется роль вирусов, в частности
вирусов гепатита. Определенное значение имеют паразитарные инвазии, чаще всего
лямблиоз желчных путей.
Воспалительный процесс в желчном
пузыре может формироваться и без участия инфекции. Так, любые временные или
постоянные обтурационные процессы в желчных путях приводят к нарастанию
осмотического давления в пузыре. Наступает растяжение и отек его стенок, могут
быть разрывы и инфаркты с вторичным асептическим воспалением. Такие же явления
могут происходить в желчном пузыре при повреждении его стенок камнями.
Все механизмы формирования
холецистита можно свести к трем, тесно связанным между собой, процессам:
Дискинезии желчевыводящих путей
(ДЖВП) с образованием стаза желчи.
Дискринии (патологическая секреция
либо печени, либо желчных путей, а также изменение их способности к всасыванию
ингредиентов желчи).
Воспалительные и
инфекционно-аллергические изменения стенок желчных путей.
Инфицирование желчных ходов и пузыря
может происходить следующими путями: 1) восходящим, 2) нисходящим, 3)
гематогенным, 4) лимфатическим. В то же время надо иметь в виду, что пока идет
свободный отток желчи, инфицированная желчь не может вызвать клинической
картины холецистита, но как только наступит небольшая задержка оттока,
развивается воспалительный процесс.
К застою желчи приводят камни,
рефлекторное сужение пузырного или общего желчного протоков, новообразование.
Застой желчи могут вызвать такие факторы, как: частая беременность, ожирение,
гиподинамия, привычка затягивать пояс, систематическое переполнение желудка
обильной пищей, висцеро-висцеральные рефлексы при заболеваниях желудка,
двенадцатиперстной кишки, толстого кишечника и женской половой сферы.
ДЖВП создает основу для немикробного
«асептического» воспаления, к которому в последующем присоединяется
инфекционный агент, вызывая бактериальное воспаление. Последнее способствует
всасыванию холатов из пузырной желчи с нарушением нормального соотношения
ингредиентов желчи (холестерина, желчных кислот, липидного комплекса,
билирубина), что способствует трансформации бескаменного холецистита в
калькулезный.
Четвертым важным фактором
патогенеза, при бескаменном холецистите весьма значимым является нарушение
иммунного статуса.
Клиника.
Характеризуется ощущением тупой,
ноющей боли или чувством давления в правом подреберье и иррадиацией в правую
ключицу, лопатку, плечо. Первоначально боли носят легкий характер, но со
временем усиливаются. Могут обнаруживаться признаки реактивного гепатита и
панкреатита. Примерно у 25 % больных холецистит может протекать в виде
атипичных форм (кардиальный, артритический, субфебрильный, неврастенический,
диэнцефальный и аллергический варианты).
Клиника хронического холецистита
складывается из двух групп симптомов - местных, обусловленных, главным образом,
двигательными нарушениями в билиарной системе, и общих, связанных с
воспалительным процессом в желчном пузыре. У больных калькулезным холециститом
в большей части случаев обострение процесса проявляется приступами печеночной
колики. Внезапно возникают сильные схваткообразные боли в правом подреберье с
характерной иррадиацией в правое плечо, правую лопатку, сопровождающиеся
тошнотой, многократной рвотой, не приносящей облегчения. Боли эти вызваны
движением конкрементов в пузыре, его сильными спастическими сокращениями. Может
развиться быстро преходящая или длительная желтуха в зависимости от того,
прошел ли камень из холедоха в 12 перстную кишку или обтурировал общий желчный
проток. Объективно может пальпироваться увеличенный желчный пузырь,
определяться болезненность в правом подреберье, напряжение мышц брюшного
пресса, резко положительные симптомы Кера, Мэрфи, Мюсси. При некалькулезном
холецистите, протекающем на фоне гиперкинетической дискинезии, картина может
быть похожей на колику, но интенсивность болей и их продолжительность обычно
меньше, чем при желчнокаменной болезни. Чаще у больных некалькулезным
холециститом бывает гипокинетическая дискинезия. В этих случаях боли в правом
подреберье постоянные, ноющие, усиливаются при нарушении диеты, тряской езде.
Пузырь обычно не пальпируется, могут быть положительными симптомы Кера, Мэрфи,
Мюсси. При нередком присоединении воспаления в желчных ходах бывают
положительными симптомы Ортнера, Василенко. Характерны также диспептические
расстройства, но менее выраженные, чем при калькулезном холецистите.
К общим симптомам относится
лихорадка, иногда ознобы, ухудшение общего самочувствия.
Данные лабораторных и
инструментальных исследований
При исследовании крови в фазу
обострения хронического холецистита, особенно калькулезного, выявляются
лейкоцитоз, нейтрофилез, ускорение СОЭ. У больных некалькулезным холециститом
этих признаков воспалительного процесса может не быть. Дуоденальное
зондирование как метод диагностики холецистита потеряло свое значение,
поскольку было доказано, что лейкоциты в желчи - индикаторы воспалительного
процесса, очень быстро разрушаются. Метод должен использоваться главным образом
для микробиологического исследования желчи, выделения микрофлоры, определения
ее чувствительности к антибиотикам. При исследовании дуоденального содержимого
выявляются также лямблии.
В современных условиях наиболее
распространенным методом стало УЗИ. По мнению большинства исследователей, это
наиболее надежный метод выявления конкрементов в желчном пузыре, аномалий
развития, которые способствуют развитию воспаления в пузыре и протоках.
Признаками воспалительного процесса является утолщение стенки пузыря более 3
мм, гиперэхогенность передней стенки, неравномерность и нечеткость контуров,
уменьшение прозрачности желчи. В связи с широким внедрением в практику лечебных
учреждений УЗИ менее широко применяются рентгенологические методы - пероральная
и внутривенная холецистография. С их помощью также достаточно надежно
диагностируются камни в желчном пузыре, оценивается его двигательная функция,
однако, это только косвенные признаки воспаления.
План обследования. Обязательные
лабораторные исследования
Однократно:
холестерин, амилаза, сахар крови,
группа крови и резус-фактор;
бактериологическое, цитологическое и
биохимическое исследование дуоденального содержимого;
копрограмма.
Двукратно:
общий анализ крови и мочи;
билирубин и его фракции, АСТ, АЛТ,
ЩФ, ГГТП;
общий белок и его фракции,
С-реактивный белок.
Обязательные инструментальные
исследования
УЗИ печени, желчного пузыря,
поджелудочной железы.
дуоденальное зондирование
(энтеральное хроматическое дуоденальное зондирование или другие варианты);
эзофагогастродуоденоскопия;
рентгеновское исследование грудной
клетки.
Дополнительные исследования
проводятся в зависимости от предполагаемого диагноза и осложнений.
Обязательна консультация хирурга.
Диагноз.
Ставят на основании клинической
картины (характерный болевой синдром, болевые точки) и подтверждают
лабораторным и параклиническим обследованием. При дуоденальном зондировании в
период обострения обнаруживают мутную с хлопьями желчь, значительную примесь
слизи, цилиндрического эпителия, перекисей липидов, высокую литогенность желчи.
Рентгенохолецистография определяет снижение интенсивности тени пузыря, аномалию
его развития, перихолецистит, дискинетические расстройства. Сонография
обнаруживает снижение интенсивности тени желчного пузыря, перетяжки,
деформации, перегибы пузыря; утолщение стенок более 3-4 мм., неровность
контуров, увеличение размеров пузыря при отсутствии эхоотражений от
конкрементов в его полости.
Лечение
Этиотропное лечение назначается, как
правило, в фазы обострения процесса. Из антибиотиков рекомендуется назначать
препараты широкого спектра действия, которые поступают в желчь в достаточно
высокой концентрации. Это макролиды, особенно последнего поколения
(кларитромицин) и более известные (эритромицин, олететрин), пролонгированные
тетрациклины (метациклин, доксициклин), ампициллин. Из группы сульфамидов
хорошо зарекомендовал себя комбинированный препарат бисептол, а также
сульфамиды среднего и продолжительного действия (сульфамонометоксин,
сульфален). Из синтетических антибактериальных препаратов предпочтение отдается
нитрофуранам (фурагин). Все препараты назначаются в обычных терапевтических
дозах курсами 7-10 дней. При лямблиозе желчных путей эффективны аминохинолин,
метронидазол.
Нарушения оттока желчи у больных
хроническим холециститом корригируется желчегонными препаратами. Различают
желчегонные средства холеретического действия, которые стимулируют образование
и выделение желчи печенью, и холекинетические препараты, усиливающие мышечное
сокращение желчного пузыря и поступление желчи в 12 перстную кишку.
Холеретические препараты: синтетические средства - аллахол, дехолин, холензим,
лиобил, оксафенамид, циквалон, никодин; растительного происхождения - фламин,
бессмертник, холагон, кукурузные рыльца; ферментные препараты, содержащие
желчные кислоты - фестал, дигестал, котазим. Холекинетические препараты:
холецистокинин, сульфат магния, сорбит, ксилит, карловарская соль, облепиховое
и оливковое масло. Холеретические препараты могут применяться при обеих основных
формах холецистита, в фазах затихающего обострения или ремиссии, назначаются
обычно на 3 недели, затем препарат целесообразно сменить. Холекинетики не
следует назначать больным калькулезным холециститом, они показаны больным
некалькулезным холециститом с гипомоторной дискинезией желчного пузыря.
Эффективны у больных некалькулезным холециститом лечебные дуоденальные
зондирования, 5-6 раз через день, особенно при гипомоторной дискинезии. В фазе
ремиссии таким больным следует рекомендовать "слепые дуоденальные
зондирования" 1 раз в неделю или две недели. Для их проведения лучше
использовать ксилит и сорбит. Больным калькулезным холециститом дуоденальные
зондирования противопоказаны из-за опасности развития механической желтухи.
Больным калькулезным холециститом, с
нарушениями физико-химических свойств желчи (дискринией) показано назначение в
течение длительного периода времени (3-6 месяцев) пшеничных отрубей,
энтеросорбентов.
Больным калькулезным холециститом
принципиально показано удаление камней (см. лечение желчнокаменной болезни).
Эффективно лечение больных
хроническим холециститом на курортах с минеральными водами, оказывающих
холеретическое и холекинетическое действие. Российские курорты - Ессентуки,
Железноводск, Пятигорск, Белокуриха, Марциальные воды. Назначаются также
одноименные бутылочные минеральные воды. Курс питьевого лечения 25-30 дней, по
200-250 мл. воды 3 раза в день до еды в теплом виде.
Хронический холангит.
Хронический холангит представляет
собой хроническое бактериальное воспаление желчных протоков (вне- и
внутрипеченочных).
Наиболее часто холангиты имеют
бактериальную природу. Возбудителями являются кишечная палочка, энтерококки,
бацилла Фридлендера, пневмококки, стрептококки. Причинами могут являться также
токсические и ишемические повреждения печени и желчных путей, желчнокаменная
болезнь, аномалии желчных протоков, а также некоторые заболевания:
цитомегаловирусная инфекция, гистиоцитоз Х, холангиокарцинома.
Клиника.
Выделяют латентную, рецидивирующую,
затяжную септическую и склерозирующую формы.
Латентная форма проявляется
нерезкими болями в правом подреберье, которые могут отсутствовать, слабостью,
периодическими ознобами, длительным субфебрилитетом, изредка иктеричность кожи
и слизистых, зуд кожи, увеличение печени.
Рецидивирующая форма: характерны
боли и болезненность при пальпации в правом подреберье, тошнота, горечь во рту,
кожный зуд, в периоде обострения - желтуха, лихорадка с ознобами, длительный
субфебрилитет, увеличение и уплотнение печени, селезенки.
Затяжная септическая форма
характеризуется тяжелым течением с лихорадкой, ознобами, болями в правом
подреберье, значительным увеличением печени, селезенки, тяжелой интоксикацией,
поражением почек, желтухой.
Склерозирующая форма: общая
слабость, недомогание, лихорадка, ознобы, кожный зуд, желтуха, увеличение
печени, селезенки.
В поздних стадиях хронического
холангита возможно развитие билиарного цирроза печени.
Лабораторные данные.
В общем анализе крови лейкоцитоз,
сдвиг формулы крови влево, увеличение СОЭ, анемия.
Отмечается повышение билирубина с
преобладанием конъюгированной фракции, a2- и g-глобулинов,
трансаминаз, щелочной фосфатазы, g-глютамилтранспептидазы, сиаловых кислот, фибрина, серомукоида.
В моче - появление белка, цилиндров,
билирубина.
Инструментальные данные.
Увеличение размеров печени,
расширение желчных протоков на УЗИ, увеличение селезенки. Внутривенная
холангиография или эндоскопическая ретроградная панкреатохолангиография
выявляет расширенные желчные протоки, при склерозирующем холангите -
внутрипеченочные протоки в виде четок, часто резко суженные с уменьшенной
ветвистостью, сужение в некоторых отделах или на всем протяжении общего
желчного протока.
Диагноз в затруднительных случаях
устанавливается при лапароскопии с холангиографией и прицельной биопсии печени.
Лечение.
Антибактериальная терапия с учетом
чувствительности микрофлоры к антибиотикам (посев желчи, полученной при
фракционном дуоденальном зондировании). В остальном лечение по принципам
лечения хронического холецистита.
Первичный склерозирующий холангит
(ПСХ) - хроническое аутоиммунное заболевание неизвестной этиологии,
характеризующееся деструктивным воспалением, облитерирующим склерозом и
сегментарной дилатацией как внепеченочных, так и внутрипеченочных протоков.
Прогрессирование патологического процесса приводит к развитию билиарного
цирроза печени, портальной гипертензии и печеночной недостаточности.
В патогенезе ПСХ играют роль
иммунные и аутоиммунные нарушения, генетически обусловленные. В пользу этого
свидетельствует частое сочетание ПСХ с таким аутоиммунным заболеванием как
неспецифический язвенный колит, нарушения клеточного и гуморального иммунитета
(нарушение баланса Т-лимфоцитов, увеличение содержания IgM, ЦИК, обнаружение в
крови антинейтрофильных цитоплазматических антител и др.).
В результате развивается
деструктивное воспаление и обструктивный склероз желчных протоков с их очаговой
дилатацией.
Клиника
Чаще всего заболевают мужчины
молодого и среднего возраста. Основными клиническими проявлениями является
кожный зуд, желтуха, лихорадка, слабость. Часто ПСХ сочетается с язвенным
колитом и болезнью Крона с соответствующей клиникой этих заболеваний.
Объективно выявляются гепатомегалия, спленомегалия.
Течение заболевания обычно
длительное. Наиболее частые осложнения - бактериальный холангит, выраженные
стриктуры, камни желчных протоков, у 10-15 % больных развивается
холангиокарцинома.
Чаще всего ПСХ необходимо
дифференцировать с первичным билиарным циррозом. В том и другом случае
центральными симптомами являются желтуха и холестаз. Первичным билиарным
циррозом чаще болеют женщины среднего и пожилого возраста, при циррозе
выявляются гиперпигментация кожи и ксантелазмы, он сочетается чаще с синдромом
Шегрена, аутоиммунным тиреоидитом.
Окончательно диагноз решается с
помощью инструментальных и лабораторных исследований.
Данные лабораторных и
инструментальных методов
Наиболее характерным симптомом
является повышение активности ЩФ. Иногда это бывает намного раньше, чем
появляются другие признаки холестатического синдрома - гипербирубинемия и
гиперхолестеринемия. В большинстве случаев наблюдается умеренное повышение АСТ
и АЛТ. При иммунологическом обследовании отмечается повышение содержание
гамма-глобулинов, IgM, ЦИК. Антимитохондриальные антитела не выявляются, что
отличает ПСХ от первичного билиарного цирроза печени.
Информативными инструментальными
методами являются гепатобилисцинтиграфия, эндоскопическая ретроградная
панкреатохолангиография (ЭРХПГ) и биопсия печени.
С помощью гепатохолесцинтиграфии
обнаруживаются множественные очаги накопления радиофармпрепарата, которые
соответствуют стазу желчи внутри протоков, а также замедление времени выведения
изотопа. Рентгенологически при ЭРХПГ отмечаются множественные стриктуры
внутрипеченочных желчных путей, чередующиеся с нормальными протоками и
мешотчатыми расширениями ("четкообразные" изменения). Примерно такого
же типа изменения характерны также для внепеченочных протоков.
Гистологически выявляются признаки
холестаза, пролиферация желчных протоков в одних портальных трактах, и их
отсутствие в других, деструкция клеток желчных протоков, лимфоцитарная и
нейтрофильная инфильтрация вокруг пораженных протоков, явления фиброза.
Страдают также гепатоциты, обнаруживаются лестничные некрозы в дольках. На
конечных этапах патологического процесса выявляется картина цирроза печени.
Лечение
Трансплантация печени по современным
представлениям является эффективным методом лечения ПСХ, к сожалению, мало
доступным в широкой практике. Из патогенетических методов апробируется
назначение Д-пеницилламина, циклоспорина, метотрексата. Наиболее распространено
симптоматическое лечение, направленное на борьбу с холестазом. Применяются
холестирамин по 4-16 г/сутки, рифампицин - 0,15-0,45 г/сутки, фенобарбитал -
0,1-0,3 г/сутки, уродезоксихолевая кислота - 10-15 мг/кг/сутки. Необходимо назначение
витаминов А, Д, Е, К.
Дискинезии желчных путей
Дискинезия желчных путей - это
комплекс расстройств билиарной системы, обусловленных нарушениями двигательной
функции желчного пузыря и протоков при отсутствии их органических изменений. У
больных отмечается чрезмерное или недостаточное сокращение желчного пузыря,
несогласованная деятельность сфинктеров Одди, Люткенса, Мирицци. Данное
определение справедливо для первичных дискинезий, возникших как самостоятельное
функциональное заболевание билиарной системы, а также для вторичных дискинезий
желчного пузыря и протоков у больных с заболеваниями желудка, кишечника,
поджелудочной железы. Дискинетические расстройства характерны практически для
всех органических заболеваний билиарной системы, в этих случаях их клиника
вписывается в "программу" болезней и не выделяется в диагнозе, хотя
характер двигательных нарушений обязательно учитывается особенно при назначении
лечения. В силу этого в настоящем разделе речь пойдет о первичных дискинезиях
желчных путей.
По характеру преобладания изменений
тонуса и моторики желчного пузыря выделяют гиперкинетическую (гипертоническую),
гипокинетическую (гипотоническую) и смешанные формы дискинезий.
Первичная дискинезия желчного пузыря
рассматривается как психосоматическое заболевание, когда главным этиологическим
фактором признаются острые и хронические психотравмирующие ситуации, глубинные
внутриличностные конфликты. Три обстоятельства говорят в пользу такого
предположения. Отрицательные эмоции, стрессовые ситуации влияют на двигательную
активность желчного пузыря, снижается, в частности, секреция желчи, она
застаивается в желчном пузыре. Введение транквилизаторов предотвращает эти
изменения. В анамнезе больных дискинезиями в большом проценте случаев
выявляются психотравмирующие ситуации, семейные, сексуальные и профессиональные
трудности. При оценке психологического статуса больных дискинезиями клинически
и психометрически у подавляющего большинства выявляются те или иные
психопатологические сдвиги. Помимо психогенных расстройств в качестве
этиологических факторов называют пищевую аллергию.
Доказано, что значительную роль в
патогенезе этого заболевания играют нарушения холинэргической и адренергической
регуляции желчного пузыря и протоков, а также определенные изменения в уровнях
гастроинтестинальных гормонов - холецистокинина, секретина, соматостатина и
некоторых других. Все это приводит к нарушению, главным образом, двигательной
функции желчного пузыря.
Клиника дискинезий желчного пузыря
характеризуется двумя группами признаков - "местные" симптомы, в
основном боли, и общие симптомы, проявляющиеся изменениями психологического
статуса больных.
Больные жалуются на боли в правом
подреберье. Они бывают неопределенного характера, тупые, ноющие, чаще без
иррадиации или с иррадиацией в правое плечо, правую лопатку, длительностью от
нескольких часов до нескольких дней. Такие боли характерны для гипокинетической
дискинезии желчного пузыря. При гиперкинетической дискинезии боли могут быть
острыми, схваткообразными, чаще всего кратковременные. Практически никогда не
разворачивается картина печеночной колики. Объективно иногда выявляется
болезненность в правом подреберье, симптомы Кера, Мэрфи, Ортнера и другие чаще
всего отрицательные или результаты их проверки неопределенные. Желтухи, лихорадки
не бывает.
В психологическом статусе
преобладают признаки астении, депрессии и ипохондрии. Больные жалуются на
постоянную усталость, плохое настроение, расстройства сна и аппетита, нередко у
мужчин снижение либидо, у женщин проблемы с менструальным циклом. Нередко
больные строят гипотезы по поводу своего "тяжелого" состояния и
активно убеждают в своей правоте лечащего врача. Состояние усугубляется
наличием признаков вегетативной дистонии.
Проведение комплекса современных
методов исследования билиарной системы позволяет решить две задачи:
) исключить органическое поражение
желчного пузыря и протоков;
) подтвердить наличие функциональных
двигательных нарушений в билиарной системе и оценить их характер.
Кроме того, должно быть проведено
обследование других органов пищеварительной системы для исключения вторичной
дискинезии.
У больных дискинезией желчного
пузыря анализы крови в пределах нормы, визуализирующие методы -
рентгеноконтрастное исследование пузыря, УЗИ не выявляют признаков
органического поражения.
Для верификации диагноза дискинезии
наиболее информативными методами являются динамическое УЗИ, холецистография и
динамическая гепатобилисцинтиграфия. Последний метод в практике применяется, к
сожалению, мало. Для оценки функционального состояния желчного пузыря
холецистография проводится обязательно с применением пробного завтрака (обычно
2 яичных желтка). В норме после завтрака желчный пузырь освобождается от
контраста в течение 1,5-2 часов. Если период сокращения заканчивается в течение
одного часа, говорят о гиперкинетической дискинезии, при гипотонической
дискинезии продолжительность опорожнения пузыря увеличивается до 3 часов. Для
гипотонической дискинезии характерно увеличение объема пузыря, гипотонической -
уменьшение. С помощью УЗИ сократительная способность желчного пузыря
оценивается по изменению его размеров до и после желчегонного завтрака.
Измерения производят натощак, а затем каждые 5 минут в течение 20 минут после
желчегонного завтрака, после этого - каждые 20 минут до достижения первоначального
объема пузыря. Более простая методика - повторное измерение объема пузыря через
45 минут. Через 45 минут после пробного завтрака объем пузыря должен
уменьшиться на 1/3. При гипотонической дискинезии пузырь уменьшается на меньшую
часть объема, гипертонической - более чем на 1/2 объема.
С учетом того, что первичные
дискинезии желчного пузыря относятся к психосоматическим заболеваниям, большое
значение придается проведению психотерапевтических мероприятий - рациональной
терапии, аутогенной тренировке, которые могут рассматриваться как этиотропное
лечение. Следует, правда, сказать, что проводить такое лечение должен
квалифицированный психотерапевт, а больные с большой неохотой обращаются к
нему, поскольку считают, что страдают чисто соматическими заболеванием.
Психотропные препараты должны назначаться с учетом нарушений психологического
статуса больных, формы и структуры этих нарушений. При депрессивных тенденциях
показаны антидепрессанты, ипохондрии - сочетание дневных транквилизаторов с
легкими нейролептиками, при преобладании тревоги и вегетативных нарушений
транквилизаторы. Дозы препаратов в начале должны быть минимальными, далее их
можно постепенно повышать, но в основном они должны быть меньше, чем при
лечении неврозов.
Дальнейшее лечение зависит от вида дискинезии.
У больных гипотонически-гипокинетической дискинезии рекомендуются продукты,
обладающие желчегонным действием, обогащенные магнием, включающие
холекинетические препараты (сорбит, ксилит). Показано проведение слепых
дуоденальных зондирований 1-2 раза в неделю. Применяются минеральные воды
высокой минерализации. Эффективны лечебная физкультура, массаж, диадинамические
токи или амплипульс в проекции желчного пузыря. При
гипертонически-гиперкинетической дискинезии в диете ограничиваются механические
и химические раздражители, показано назначение спазмолитических средств,
дуоденальные слепые зондирования лучше не проводить, назначаются минеральные
воды малой минерализации. Из желчегонных препаратов назначаются холеретики.
ЛИТЕРАТУРА
Основная:
Внутренние болезни. Под ред.
Комарова Ф. И. М., Медицина. 1990. -688 с.
Маколкин В. И., Овчаренко С. И..
Внутренние болезни. М.: Медицина. 1999. - 592с.
Окороков А. Н. Диагностика болезней
внутренних органов: Т1. Диагностика болезней органов пищеварения: М., Мед. лит.
2000. - 560 с.
Окороков А. Н. Лечение болезней
внутренних органов. Практ. руководство в 3х т. Т.1 Мн. Выш. шк. 1995. - 522 с.
Дополнительная литература:
Бацков С. С., Иноземцев С. А.,
Ткаченко Е. И. Болезни желчного пузыря и поджелудочной железы (новое в
диагностике и лечении). СПб.: Стройлеспечать. 1996. - 95 с.
Внутренние болезни. В 10 книгах.
Книга 7. Пер. с англ. Под ред. Е. Браунвальда и др. М., Медицина. 1993. - 560
с.
Гончарик И. И. Гастроэнтерология:
стандартизация диагностики и обоснование лечения: Справ. пособие. Мн.,
"Беларусь". 2000. - 143 с.
Лычев В. Г. Основы клинической
гастроэнтерологии. М., Мед. книга; Н. Новгород: Изд-во НГМА. 2000. - 186 с.
ГЕМОРРАГИЧЕСКИЕ ДИАТЕЗЫ. ГЕМОФИЛИЯ.
ТРОМБОЦИТОПЕНИЧЕСКАЯ ПУРПУРА. ГЕМОРРАГИЧЕСКИЙ ВАСКУЛИТ. ГЕМОРРАГИЧЕСКАЯ
ТЕЛЕАНГИЭКТАЗИЯ
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
Определение, причины развития,
классификация геморрагических диатезов.
Общие признаки, патогенез, типы
кровоточивости.
Методы исследования системы
гемостаза.
Этиология, патогенез, клиника и
течение гемофилии.
Прогноз, лечение и профилактика при
гемофилии.
Этиология, патогенез, клиника,
диагностические критерии тромбоцитопенической пурпуры.
Дифференциальный диагноз
тромбоцитопенической пурпуры с симптоматическими тромбоцитопениями. Принципы
лечения тромбоцитопенической пурпуры.
Клиника, варианты течения,
диагностические критерии геморрагических васкулитов.
Принципы лечения геморрагических
васкулитов.
Патогенез, клиника, диагностические
критерии, лечение геморрагической телеангиоэктазии.
ОТВЕТЫ НА ВОПРОСЫ
Геморрагический диатез.
Геморрагический диатез - это
синдром, основными клиническими признаками которого являются повышенная
кровоточивость, склонность к повторным кровотечениям и кровоизлияниям,
самопроизвольным или после незначительных травм.
Можно выделить три основных пути
патогенеза геморрагического диатеза (см. схему)

Первый путь - нарушение
тромбоцитарного звена гемостаза - уменьшение количества тромбоцитов
(тромбоцитопении) или нарушение их функционального состояния (тромбоцитопатии).
Чаще всего в клинической практике встречается тромбоцитопеническая пурпура
(болезнь Верльгофа). Второй путь - нарушение плазменного звена патогенеза
вследствие дефицита факторов свертываемости или противосвертывающей системы -
коагулопатии. Типичным представителем этой группы является гемофилия. Третий
путь - нарушения сосудистой стенки - вазопатии; геморрагический васкулит.
Сосудисто-тромбоцитарный
гемостаз - одна из систем, реализующих гемостаз в организме, т. е. обеспечивает
сохранение жидкого состава крови, предупреждает кровотечение или останавливает
его путем поддержания структурной целостности стенок кровеносных сосудов и
достаточно быстрого их тромбирования в случае повреждения.
Стенки сосудов играют
важную роль в поддержании нормального гемостаза. Эндотелий сосудов синтезирует
и секретирует мощный ингибитор агрегации тромбоцитов - простациклин; фиксирует
на своей поверхности ряд естественных антикоагулянтов, вырабатывает активаторы
фибринолиза. Остановка кровотечения обеспечивается выработкой эндотелиальными
клетками факторов, направленных на образование тромба - фактора Виллебранда,
коллагена. В тесной связи с сосудистым находится тромбоцитарный фактор.
Тромбоциты влияют на процессы гемостаза по четырем направлениям. Во-первых, они
обладают ангиотрофической функцией, поддерживают нормальную структуру и функцию
эндотелиальных клеток микрососудов. При уменьшении количества тромбоцитов,
нарушениях их функции резко возрастает проницаемость сосудистой стенки для
эритроцитов. Во-вторых, при малейшем повреждении стенки сосудов тромбоциты
приклеиваются к поврежденному месту (адгезия) и способствуют организации
тромбоцитарных агрегатов, в этом процессе активно участвует тромбоксан -
метаболит арахидоновой кислоты, синтезирующийся в тромбоцитах. В-третьих,
тромбоциты поддерживают спазм сосудов, который закономерно развивается при их
повреждении. В-четвертых, тромбоциты непосредственно активируют систему
свертывания крови путем выработки ряда факторов, а также влияют на систему фибринолиза.
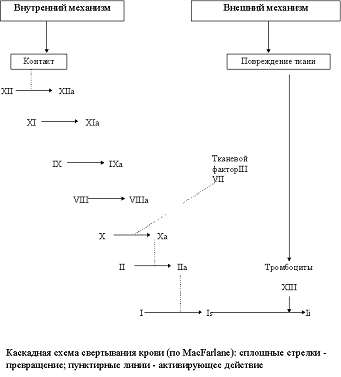
Международная
номенклатура плазменных факторов свертывания крови (по З.С.Баркагану)
|
Цифровое обозначение
|
Наиболее употребительные наименования
|
|
I
|
Фибриноген
|
|
II
|
Протромбин
|
|
III
|
Тканевой тромбопластин, тканевой фактор
|
|
IV
|
Ионы кальция
|
|
V
|
Ас-глобулин, проакцелерин, лабильный фактор
|
|
VII
|
Проконвертин, стабильный фактор
|
|
VIII
|
Антигемофильный глобулин
|
|
IX
|
Плазменный компонент тромбопластина, фактор Кристмасса,
антигемофильный фактор В.
|
|
X
|
Фактор Стюарта-Праузра, протромбиназа
|
|
XI
|
Плазменный предшественник тромбопластина
|
|
XII
|
Фактор Хагемана, контактный фактор.
|
|
XIII
|
Фибринстабилизирующий фактор
|
Имеется два различных механизма
активации свертывания крови. Один обозначается как внешний механизм, поскольку
запускается поступлением из тканей или из лейкоцитов крови тканевого фактора
(фактор III). При взаимодействии с фактором VII, быстро активируется Х фактор,
который трансформирует протромбин (II) в тромбин (IIa), а тромбин в свою
очередь преобразует фибриноген (I) в фибрин (Is). Второй путь активации
называется внутренним, он начинается с активации XII фактора. Это возникает
вследствие разных причин - контакт крови с поврежденной сосудистой стенкой, с
измененными клеточными мембранами, под влиянием адреналина или протеаз. Далее
процесс идет по каскаду как это видно на рисунке, в конце концов, протромбин
переходит в тромбин, а тот в свою очередь переводит фибриноген в фибрин и
образуется тромб.
Система гемостаза является
саморегулирующейся, активация системы свертывания сразу включает в действие
противосвертывающую систему и систему фибринолиза.
Все факторы противосвертывающей
системы - антикоагулянты - можно разделить на две группы: 1) физиологические
антикоагулянты, образующиеся независимо от свертывания крови, фибринолиза; 2)
образующиеся в процессе протеолиза, вторично.
К I группе относятся антитромбин
III, гепарин, альфа-1-антитрипсин, альфа-2-макроглобулин и некоторые другие.
Наиболее универсален из них антитромбин. Ко второй группе относятся антитромбин
I, продукты деградации фибриногена.
Активация свертывания крови
неизбежно вызывает усиление противосвертывающих механизмов. Точные механизмы
включения противосвертывающих факторов до конца не изучены.
Лизис фибрина в организме
осуществляется фибринолитической или плазминовой системой. Основной компонент
ее - фибринолизин или плазмин, который содержится в плазме в виде профермента
плазминогена. Кроме того, существует система неферментативного фибринолиза.
Клинические типы кровоточивости.
В основе клинических проявлений
геморрагического диатеза лежит геморрагический синдром. Тщательно собранный
анамнез и объективное исследование позволяют выявить тип кровоточивости, что
имеет большое значение для дифференциального диагноза геморрагического диатеза.
Выделяют пять клинических типов кровоточивости.
Для гематомного типа характерны
следующие признаки:
массивные, глубокие, напряженные и
болезненные кровоизлияния в крупные суставы, мышцы, под апоневрозы и фасции, в
подкожную и забрюшинную клетчатку;
профузные спонтанные посттравматические
или послеоперационные кровотечения, в том числе из внутренних органов
(желудочно-кишечные, почечные), которые нередко возникают не сразу после
операции или травмы, а через несколько часов.
Петехиально-пятнистый (синячковый)
тип характеризуется:
поверхностными кровоизлияниями в
кожу, они не напряжены, безболезненны, не сдавливают и не разрушают окружающие
ткани;
кровоподтеками (синяками) на коже,
которые больше петехий по размерам, но также не напряжены и безболезненны;
петехии и синячки возникают спонтанно или при малейшей травматизации.
десневые, носовые и маточные
кровотечения.
Для смешанного,
синячково-гематомного типа, характерны:
петехиальные высыпания и синячки,
которые возникают раньше гематом;
гематомы в забрюшинной и подкожной
клетчатке, как правило, немногочисленные, но больших размеров, практически
отсутствуют кровоизлияния в суставы и их деформация.
Васкулитно-пурпурный тип
характеризуется:
геморрагическими высыпаниями на
коже, чаще всего симметричными; элементы сыпи ограничены, слегка приподняты над
кожей, их появлению нередко предшествуют волдыри или пузырьки, которые затем
пропитываются кровью; геморрагические элементы могут сливаться, эпидермис над
ними некротизируется с образованием корочки; после исчезновения сыпи остаются
очаги пигментации кожи;
кровотечениями из внутренних органов
- желудочно-кишечными, почечными.
Ангиоматозный тип характеризуется:
и повторяющимися кровотечениями
одной-двух, реже упорными больше локализаций (например, носовые, легочные);
отсутствием спонтанных и
посттравматических кровоизлияний в кожу, подкожную клетчатку.
Исследование
сосудисто-тромбоцитарного гемостаза
|
Метод исследования
|
Показатели в норме
|
Изменения в патологии
|
|
Пробы на резистентность, ломкость капилляров - манжеточная,
баночная, ангиорезистометрия
|
Обычно после прекращения сжатия сосудов петехий быть не должно
или единичные
|
Появление петехий указывает на ломкость сосудов, а также
встречается при тромбоцитопении и тромбоцитопатиях.
|
|
Определение длительности кровотечения - проба Дьюка
|
В норме время кровотечения не превышает 4 минут
|
Время кровотечения увеличивается при тромбоцитопениях,
тромбоцитопатиях
|
|
Подсчет числа тромбоцитов в крови
|
180 -320 х 109/л
|
Тромбоцитопения Тромбоцитопатия
|
|
Изучение в мазке размера тромбоцитов
|
|
Изменяются при тромбоцитопениях и тромбоцитопатиях
|
|
Исследование адгезивно-аггрегационной функции тромбоцитов -
специальные методы исследования - оценка ретенции тромбоцитов на стекле,
гемолизат-агрегационный тест, исследование агрегации тромбоцитов под влиянием
ристомицина.
|
Тесты проводятся в специализированных отделениях для расшифровки
более редких форм патологии сосудисто-тромбоцитарного гемостаза
|
Изменяются при васкулитах, тромбоцитопениях, тромбоцитопатиях
|
Исследование свертывающей системы
крови
Количество исследований вследствие
сложности самой системы очень велико, здесь характеризуются группы и принципы
исследования.
Общие ориентировочные коагуляционные
тесты.
Определение времени свертывания
цельной нестабилизированной крови. Норма по Мас-Магро 6-8 минут, по Ли-Уайту -
5-10 минут.
Активированное парциальное
протромбиновое время - норма 40-50 сек.
Тромбиновое время - норма 13-17 сек.
Протромбиновое время - норма 15-20
сек., норма протромбинового индекса 80-100 %.
Общие ориентировочные коагуляционные
тесты позволяют получить представление о состоянии всего гемокоагуляционного
статуса.
Дифференцирующие тесты дают
возможность установить точный диагноз коагулопатии, т. е. выявить дефицит
отдельных факторов свертывания, что крайне важно в ряде случаев для
рациональной терапии. Эти тесты основаны на принципе коррекции - определении
того, в какой степени выявленные нарушения свертывания крови устраняются или не
корригируются образцами плазмы, не содержащих тех или иных факторов
свертываемости.
Исследование фибринолиза
Базисным методом является
определение фибринолитической активности эуглобулиновой фракции плазмы.
Замедление эуглобулинового лизиса свидетельствует о недостаточности
фибринолитической системы и наличии тромбофилического состояния.
Тромбоцитопатии - нарушения гемостаза,
обусловленные качественной неполноценностью и дисфункцией кровяных пластинок.
Это группа достаточно распространенных заболеваний и синдромов, которые
клинически характеризуются пятнисто-синячковым типом кровоточивости. При этом
количество тромбоцитов чаще всего не изменяется. Среди наследственных
геморрагических диатезов тромбоцитопатии занимают первое место.
Распознавание и дифференцировка
тромбоцитопатий базируются на комплексном исследовании микроциркуляторного
гемостаза, адгезивно-агрегационной и коагуляционной функции кровяных пластинок,
оценке содержания в них и реакции освобождения тромбоцитарных факторов и
гранул, определении числа, размера, морфологии тромбоцитов, а также
мегакариоцитов.
На рисунке 1 представлена
двухволновая кривая агрегации тромбоцитов при стимуляции процесса добавлением к
плазме АДФ. Первая волна вызвана введением извне агрегирующего фактора, вторая
- реакцией освобождения эндогенных агрегирующих агентов.
На рисунке 2 отсутствие
агрегации тромбоцитов при добавлении АДФ у больного с одной из форм
тромбоцитопатии - тромбастении Гланцмана
На рисунках приведены
агреграммы нормальных тромбоцитов и тромбоцитов при одной из форм
тромбоцитопатий - тромбастении Гланцмана. При тромбоцитопатиях изменяются
функциональные свойства тромбоцитов.
Количество
тромбоцитопатий достаточно велико, распознавание их отдельных форм должно
проводится в специализированных гематологических центрах. Врачу-интернисту
необходимо заподозрить тромбоцитопатию. Здесь следует руководствоваться
несколькими положениями. О тромбоцитопатии следует думать у больных с
пятнисто-синячковым типом кровоточивости при нормальном количестве тромбоцитов
или, если имеется тромбоцитопения, при сохраняющемся геморрагических
проявлениях после нормализации числа тромбоцитов. Генетически обусловленные
формы патологии тромбоцитов обычно относятся к тромбоцитопениям.
Выделяют наследственные
и врожденные формы тромбоцитопатий и приобретенные тромбоцитопатии. Кроме того,
тромбоцитопении разделяются в зависимости от нарушения того или иного дефекта,
выявляемого при функциональном исследовании тромбоцитов.
Различают следующие
основные формы тромбоцитопатий:
Тромбоцитопатии с
нарушением адгезии тромбоцитов.
Тромбоцитопатии с
нарушением агрегации тромбоцитов: а) к АДФ; б) к коллагену; в) к ристомицину;
г) тромбину; д) к адреналину.
Тромбоцитопатии с
нарушением реакции высвобождения.
Тромбоцитопатии с
дефектом "пула накопления" высвобождающихся факторов.
Тромбоцитопатии с
дефектом ретракции.
Тромбоцитопатии с
сочетанием вышеизложенных дефектов.
Важнейшим условием
правильного лечения тромбоцитопатий является устранение воздействий, способных
вызывать или усиливать геморрагические проявления. В диете исключаются блюда,
содержащие специи. Категорически запрещается прием алкоголя. В пище должно быть
много продуктов, содержащих витамины С, Р и А.
Есть ряд лекарственных
препаратов, которые могут усугублять функциональные нарушения тромбоцитов. Их
надо избегать. Это нестероидные противовоспалительные средства, карбенициллин,
аминазин, антикоагулянты непрямого действия. Гепарин может назначаться только
при ДВС-синдроме.
Из лекарственных
препаратов показано назначение e-аминокапроновой кислоты в/в и внутрь;
парааминометилбензойной кислоты (ПАМБА), которые обладают нормализующим
действием на агрегацию тромбоцитов. Таким же действием обладают синтетические
гормональные противозачаточные препараты - инфекундин, местранол. При
парциальных тромбоцитопатиях применяется АТФ в сочетании с сернокислой
магнезией. При тромбоцитопатических кровотечениях часто применяется дицинон.
Есть сведения о применении в малых дозах лития. Неплохие результаты получены
при применении антагонистов брадикинина - продектина, пармидина.
Тромбоцитопении - большая
группа заболеваний и синдромов, при которых снижается количество тромбоцитов
(менее 100-150 х 109/л) и, как правило, удлиняется время кровотечения и бывает
положительным симптом жгута.
Основные причины
развития тромбоцитопений приведены в таблице (по R. J. Handin)
|
Механизм развития
|
Патологические состояния
|
|
Снижение продукции мегакариоцитов в костном мозге
|
Инфильтрация костного мозга (опухолевый рост, фиброз)
Недостаточность функции костного мозга (апластическая анемия)
|
|
Секвестрация циркулирующих тромбоцитов селезенкой
|
Гипертрофия селезенки (опухоль, портальная гипертензия)
|
|
Усиленное разрушение тромбоцитов в периферической крови
|
Разрушение неимунной природы - при сепсисе, сосудистом
протезировании, протезировании клапанов, ДВС-синдроме, васкулитах. Разрушение
иммунной природы при образовании аутоантител к тромбоцитам; образовании
антител, ассоциированных с приемом лекарственных средств; образовании
циркулирующих иммунных комплексов (вирусные заболевания, диффузные
заболевания соединительной ткани, бактериальный сепсис)
|
В практической деятельности врач
чаще всего встречается с тремя формами тромбоцитопений - идиопатической
аутоиммунной тромбоцитопенией, гетероиммунными тромбоцитопениями и
симптоматическими тромбоцитопениями различного механизма возникновения.
При гетероиммунных тромбоцитопениях
антитела вырабатываются против антигена, фиксированного на поверхности
тромбоцитов. Это могут быть вирусы, некоторые лекарства. В отличие от
идиопатических форм в данных ситуациях причина тромбоцитопении известна.
Клинические проявления петехиально-синячкового типа кровоточивости возникают
через 2-3 дня, иногда 2-3 недели после перенесенной вирусной инфекции или
приема лекарственного препарата. Количество тромбоцитов снижается значительно,
увеличивается время кровотечения, геморрагические проявления могут быть очень
выражены. Обычно наступает выздоровление.
Лекарственные препараты могут
вызывать тромбоцитопению не только иммунным путем. В таблице (по R. J. Handin)
приведен список лекарственных препаратов, вызывающих тромбоцитопению и
предполагаемых механизмов развития
|
Механизм действия
|
Лекарственные препараты
|
|
Подавление продукции тромбоцитов
|
Миелодепрессивные препараты - цитозин арабинозид, даунорубицин,
циклофосфан, миелосан, метотрексат. Тиазидовые диуретики Этанол Эстрогены
|
|
Иммунологическая деструкция тромбоцитов
|
Клинические подозрения, обоснованные специальными методами
исследования - сульфатиазол, новобиоцин, хинидин, хинин, препараты мышьяка,
дигитоксин, метилдофа, стибофен. Клинические подозрения, пока еще не
обоснованные - аспирин, хлорпропрамид, хлорохин, соли золота, сульфамиды
|
Симптоматические или вторичные
тромбоцитопении могут развиться при ряде заболеваний. Трудности в их
распознавании возникают тогда, когда геморрагический синдром является ведущим в
клинике этих заболеваний. Помогают тщательный расспрос больного, объективное
исследование, ряд специальных методов. Симптоматические тромбоцитопении
возникают при лейкозах, апластической анемии, В12-дефицитной анемии. При этих
заболеваниях существенную помощь в распознавании истинной причины
тромбоцитопении оказывают стернальная пункция, трепанобиопсия. В ряде случаев
тромбоцитопения развивается вследствие повышенного механического разрушения
тромбоцитов - при гемангиомах, спленомегалии различного генеза, протезировании
клапанов сердца, сосудистых операциях. Особую группу составляют тромбоцитопении
потребления, развивающиеся при ДВС-синдроме, массивных тромбозах.
Гемофилия.
Гемофилия - это генетическое
заболевание, наследуемое по рецессивному типу, сцепленному с полом. Ген,
контролирующий образование VIII и IX факторов свертываемости, локализуется в
Х-хромосоме, женщины являются кондукторами генного дефекта, а заболевают
практически только мужчины.
При уменьшении или отсутствии VIII,
IX, XI факторов нарушается внутренний механизм свертывания крови, и развивается
геморрагический синдром с гематомным типом кровоточивости. При этом тяжесть
заболевания зависит от уровня антигемофилических факторов: от 0 до 1 %
нормального содержания этих факторов - крайне тяжелая форма; от 1 до 2 % -
тяжелая форма; от 2 до 5 % - форма средней тяжести; выше 5 % - легкая форма.
В зависимости от дефицита того или
иного фактора различают гемофилию. А - при дефиците VIII фактора; гемофилию В -
при дефиците IX фактора; гемофилию С - при дефиците XI фактора.
Гемартрозы приводят к суставной
инвалидизации больных.
Диагностика гемофилии.
Рутинные тесты - значительно
удлиняется время свертывания крови, число тромбоцитов в норме, длительность
кровотечения в норме, симптом жгута отрицательный.
Специальные тесты - позволяют
выявить форму гемофилии. Применяется аутокоагуляционный тест по З.С.Баркагану.
Он заключается в том, что плазма исследуемого больного тестируется в трех
пробирках: с адсорбированной сульфатом бария плазмой, старой сывороткой. и
смесью адсорбированной плазмы и сыворотки. Если свертывание нормализуется с
нормальной адсорбированной плазмой, в которой есть фактор VIII, но нет фактора
IX, диагностируется гемофилия А., Если нормализация происходит только под
воздействием старой сыворотки (источник фактор IX) - у больного гемофилия В.
При нормализации свертывания под влиянием, как адсорбированной плазмы, так и
старой сыворотки следует ставить диагноз гемофилии С. Применяются также
"тесты смешивания", когда к плазме больных добавляются образцы плазмы
с заведомо известной формой гемофилии.
Лечение гемофилии патогенетическое.
Больным переливают гемопрепараты, содержащие отсутствующие факторы свертывания
- антигемофильную плазму, криопреципитат, концентраты VIII фактора. Особенно
эффективно применение криопреципитата. В ургентных ситуациях эффективны прямые
повторные переливания крови.
Симптоматическая терапия применяется
в основном у больных гемартрозами. Показана иммобилизация пораженных суставов,
назначение нестероидных противовоспалительных средств, местное применение
глюкокортикоидов.
Идиопатическая тромбоцитопеническая
пурпура.
Идиопатическая тромбоцитопеническая
пурпура (болезнь Верльгофа) - наиболее частая нозологическая форма
тромбоцитопений у взрослых. Она называется идиопатической, поскольку не удается
установить причину ее развития, аутоиммунной, так как причиной гибели
тромбоцитов являются выработка против них аутоантител. При этом антитела могут
вырабатываться против антигена тромбоцитов, против антигена мегакариоцитов или
антигена общего предшественника тромбоцитов, лейкоцитов и эритроцитов.
Основным фактором патогенеза
является повышенное разрушение тромбоцитов макрофагами селезенки и печени. Это
связано с тем, что лимфоидные клетки селезенки больных идиопатической
аутоиммунной анемией продуцируют IgG, который фиксируется на тромбоцитах, и
вследствие изменения антигенной структуры последних становится как бы
"чужим" для макрофагов.
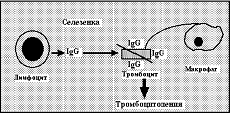
Резко укорачивается
продолжительность жизни тромбоцитов. Компенсаторно происходит повышение их
продукции в костном мозге. При его исследовании выявляется увеличение
количества мегакариоцитов в костном мозге.
Начало заболевания
постепенное или острое. Характерен петехиально-пятнистый тип кровоточивости -
петехии и экхимозы возникают спонтанно или после небольших травм, положительные
симптомы щипка и жгута. Могут быть носовые, желудочно-кишечные, маточные
кровотечения, реже кровохарканье и легочные кровотечения.
При исследовании крови
количество тромбоцитов снижено, иногда они полностью отсутствуют. Изменяется
форма и величина тромбоцитов.
В костном мозге
увеличено число мегакариоцитов и их молодых форм, отсутствует отшнуровка
тромбоцитов.
Время свертывания крови
в норме, длительность кровотечения удлинено. В специальных тестах выявляется
нарушения адгезии и агрегации тромбоцитов.
Патогенетическая терапия
складывается из трех основных компонентов: использование глюкокортикоидов,
спленэктомия, лечение иммунодепрессантами.
Также использование
симптоматических средств, направленных на улучшение свертывания крови. Как
правило, терапию начинают с назначения глюкокортикоидов - преднизолона. В
среднем дозировка 1 мг/кг веса тела (60-100 мг/сут). Оценка эффективности
терапии проводится через 3-4 месяца после назначения терапии. В тех случаях
когда эффект не полный или нестабильный (отсутствует в 10-15 % случаев),
возникает показание к спленэктомии. Эффективность спленэктомии достигает 75 %.
Спленэктомию производят, как правило, на фоне глюкокортикоидной терапии. Обычно
дозу глюкокортикоидов повышают за 4-5 дней до операции, затем за 2 дня операции
дозу удваивают. При отсутствии эффекта или противопоказаниях к спленэктомии
возникает вопрос о терапии иммунодепрессантами.
Наиболее часто
используются - имуран, азатиоприн (2-3 мг/кг веса тела, курс 3-5 мес.),
циклофосфан (200-400 мг. в сутки, парентеральное введение, на курс 6-8 г.),
винкристин (1-2 мг/м2 поверхности тела, 1 раз в неделю в течение 2х месяцев).
Довольно перспективным
является метод лечения тромбоцитами нагруженными винкристином. По этой методике
тромбоциты нагружаются винкристином и вводятся больному, при этом эти
тромбоциты активно поглощаются макрофагами, а макрофаги непосредственно
ответственны за разрушение тромбоцитов.
Симптоматическое
лечение:
местные и общие
гемостатические средства (эпсилон-аминокапроновая кислота, андроксон,
гемостатическая губка, криотерапия и т.д.).
гемотрансфузии.
Повторные гемотрансфузии в лечении таких больных являются малоэффективными,
более того они могут усугубить тромбоцитопению за счет избыточного образования
антител.
Геморрагическая
телеангиоэктазия.
Геморрагическая
телеангиоэктазия (болезнь Рандю-Ослера) связана с патологией сосудистой стенки,
в результате чего образуются гемангиомы. В основе лежит дефицит стенки,
изменение ее субэндотелиального слоя. Стенка не только не участвует в
гемостазе, но и легко травмируется. Как правило, заболевание носит
наследственный характер. Наследуется рецессивно. Чаще всего проявляется на
слизистой рта, ЖКТ, коже лица, губах. Как правило, проходит три стадии в своем
развитии - стадия пятнышка, звездочки и гемангиомы. Особенность диагностики -
при надавливании эти образования бледнеют.
Клиническая картина
характеризуется ангиоматозным типом кровоточивости. Состояние тромбоцитарного
звена нормальное, плазменные факторы нормальны.
Терапия симптоматическая
- в ряде случаев эти образования могут иссекаться.
Геморрагический
васкулит.
Геморрагический
васкулит. Ведущее звено патогенеза - это нарушение сосудистого гемостаза.
Наиболее часто встречается болезнь Шенляйн-Геноха (геморрагический иммунный
микротромбоваскулит). В основе лежит множественные микротромбоваскулиты.
Поражаются сосуды кожи и внутренних органов.
Чаще встречаются у детей,
23-25 на 10000 населения. Может поражение кишечника (острый живот), почек
(гематурия). Иммунокомплексное воспаление абсолютно не специфично, и может
возникнуть в ответ на воздействие любого фактора - прививка, инфекция,
лекарственные препараты. Тип кровоточивости - васкулитно-пурпурный: возвышающие
на поверхностью кожи геморрагии; симметричное поражение кожи конечностей. Также
поражаются внутренние органы.
Лечение: гепарин
(препятствует микротромбообразованию) 300-400 ед. на кг. веса в сутки через
каждые 6 часов. Используют преднизолон (малоэффективен). Препараты улучшающие
реологические свойства крови - трентал. Используют лечебный плазмоферез.
ЛИТЕРАТУРА
Основная:
Внутренние болезни под
редакцией Ф. И. Комарова. М., Медицина. 1991 г.
Маколкин В. И., Овчаренко
В. И. Внутренние болезни. М., Медицина. 1994 г.
Внутренние болезни (в
двух томах) под редакцией А.В. Сумарокова. М., Медицина. 1993 г.
Практические навыки
терапевта под редакцией Г. П. Матвейкова. Минск, Вышэйшая школа. 1993 г.
Машковский М. Д. Лекарственные
средства (в двух томах). М., Медицина. 1993 г.
Окороков А. Н. Лечение
болезней внутренних органов: Практическое руководство в 3 т. Мн., Выш. шк.,
Белмедкнига. 1995-1996 гг.
Дополнительная:
Баркаган З. Д.
Геморрагические синдромы. М., Медицина. 1988 г.
Руководство по
гематологии (в двух томах) / под ред. А.И. Воробьева. М., Медицина 1986 г.
Иванов Е. П. Руководство
по гемостазиологии. Минск, Беларусь. 1991 г.
Файнштейн Ф. Э., Козинец
Г. И., Бахрамов, Хохлова М. П. Болезни системы крови. Ташкент: Медицина. 1987
г.
Окороков А.Н. Лечение
болезней внутренних органов: Практическое руководство: в 3 томах. Т.3 Мн.,
Белмедкнига. 1996 г.
госпитальная терапия
хирургический
СИСТЕМНЫЕ ВАСКУЛИТЫ.
УЗЕЛКОВЫЙ ПЕРИАРТЕРИИТ
ОСНОВНЫЕ ВОПРОСЫ
Классификация системных
васкулитов.
Гранулематоз Вегенера,
клиника, диагностика, лечение.
Неспецифический
аортоартериит, клиника, диагностика, лечение.
Гигантоклеточный
темпоральный артериит, клиника, диагностика, лечение.
Ревматическая
полимиалгия, клиника, диагностика, лечение.
Узелковый периартериит,
определение, патогенез, диагностические критерии, лечение.
ОТВЕТЫ НА ВОПРОСЫ
Классификация системных
васкулитов (американская ассоциация ревматологов 1994г):
Васкулиты крупных
сосудов:
Гигантоклеточный
артериит.
Артериит.
Такаясу.
Васкулиты с поражением
сосудов среднего калибра:
Узелковый периартериит.
Болезнь Кавасаки.
Васкулиты с поражением
сосудов мелкого калибра:
Гранулематоз Вегенера.
Микроскопический
полиангеит.
Синдром Чардж-Стросса.
Пурпура Шейлейна-Геноха.
Эссенциальный
криоглобулинемический васкулит.
Гранулематоз Вегенера.
Гранулематоз Вегенера -
системный гранулематозно-некротический васкулит, при котором вначале поражаются
верхние дыхательные пути и легкие, а затем почки.
Этиология болезни точно
не установлена, в качестве пусковых механизмов описываются носоглоточная
инфекция, прием антибиотиков в течение длительного времени. Обсуждается роль
вирусной инфекции.
В патогенезе заболевания
основу составляют иммунные нарушения. Отмечается гиперреактивность гуморального
иммунитета. Повышается содержание сывороточных и секреторных IgA,
обнаруживаются циркулирующие и фиксированные иммунные комплексы.
Патоморфологически в
сосудах различного калибра или рядом с ними обнаруживаются характерные
гранулемы с большим количеством гигантских клеток. Чаще всего они
обнаруживаются в верхних дыхательных путях и легких. В почках также могут быть
гранулемы, но чаще развивается диффузный гломерулонефрит.
Наиболее характерным
проявлением является поражение верхних дыхательных путей. Появляются боли в
околоносовых пазухах, гнойные, кровянистые выделения из носа, изъязвления
слизистой носа. Нередко развивается перфорация носовой перегородки и в связи с
этим седловидная деформация носа.
Почти всегда поражаются
легкие. Отмечается кашель, кровохарканье, одышка и боли в грудной клетки,
объективно признаки уплотнения легочной ткани.
Довольно быстро можно
выявить поражение почек, сначала только с помощью лабораторных данных -
гематурия, протеинурия, цилиндрурия. Довольно быстро развивается картина почечной
недостаточности.
Могут быть также
поражения кожи, глаз, сердца.
При исследовании крови
отмечается лейкоцитоз, ускорение СОЭ. Положительные острофазовые реакции.
Повышается содержание IgG, IgA, часто обнаруживаются ревматоидные факторы, ЦИК.
В анализах мочи
постоянно обнаруживаются протеинурия и гематурия. При прогрессировании почечной
патологии быстро нарастает олигурия, азотемия.
При рентгенологическом
исследовании придаточных пазух выявляется их затемнение. Очень часто, иногда
даже без клинических проявлений, обнаруживаются изменения при
рентгенологическом исследовании легких. Определяются множественные,
двусторонние инфильтраты, нередко с признаками распада.
Решающее значение для
диагностики васкулита имеет гистологическое исследование биоптатов слизистой
верхних дыхательных путей, легких, почек. Обнаруживаются гигантоклеточные
гранулемы, признаки воспаления и некроза.
Основным препаратом для
лечения гранулематоза Вегенера является циклофосфан. Вначале его назначают в
течение 2-7 дней в зависимости от тяжести процесса в/в в дозе 5-10мг/кг, далее
в течение 2-3 недель внутрь по 1-2 мг/кг, затем в поддерживающих дозах 25-50
мг. в день до 1 года. При плохой переносимости препарата можно применить
азатиоприн.
На начальных этапах
лечения вместе с циклофосфаном назначается преднизолон по 20-30 мг/сутки, при
поражении кожи и миокарда до 40 мг/сутки.
Неспецифический
аортоартериит.
Неспецифический
аортоартериит (болезнь Такаясу) - название заболевания, которое имеет много
синонимов: множественный облитерирующий панартериит, болезнь отсутствия пульса,
синдром дуги аорты.
Это системное
заболевание, при котором развиваются воспалительные и деструктивные изменения в
стенки дуги аорты и ее ветвей, проявляющиеся стенозированием и ишемией. Точная
причина заболевания неизвестна. Предполагают значение генетических факторов. В
пользу этого говорит преимущественное поражение женщин молодого возраста. Есть
сведения о связи заболевания с антигенами системы HLA - B5, B10.
В патогенезе основную
роль играют аутоиммунные механизмы. Изменены показатели клеточного и
гуморального иммунитета. Значительную роль играют нарушения реологических
свойств крови.
Патоморфологически
отмечается панартериит, т. е. поражение всех оболочек артерий. Наблюдаются
пролиферация клеток внутренней оболочки, фиброз, надрывы эластической мембраны,
формирование стенозов и аневризм. Поражается преимущественно дуга аорты и ее
крупные ветви. В соответствующих органах развивается ишемия.
Клиническая картина
зависит от преимущественного поражения того или иного артериального бассейна.
Чаще всего поражаются подключичные, сонные артерии, как правило, несимметрично.
В этих ситуациях больные жалуются на усталость в конечностях, боли при усилении
нагрузки. Наиболее важные объективные симптомы - отсутствие или значительное
различие пульса на обеих радиальных артериях, асимметрия артериального
давления. Поражения сонных и почечных артерий ведет к развитию стойкой
гипертензии. Могут быть обмороки, нарушения зрения, что является проявление
преимущественного поражения сонных артерий.
Течение заболевания чаще
всего длительное, хроническое, реже подострое.
В активной фазе процесса
у больного отмечается лейкоцитоз, ускорение СОЭ и изменение острофазовых
показателей. При хроническом течении все эти показатели могут быть в пределах
нормы. Диагноз верифицируется с помощью ангиографии. Устанавливается точная
локализация поражения артерий, наличие стенозов и аневризм.
В активную фазу процесса
назначаются глюкокортикоиды - преднизолон в начальной дозе 30-40 мг/сутки с
постепенным снижением дозы. Если процесс неактивен, можно ограничиться
применением нестероидных противовоспалительных средств в обычных
терапевтических дозах.
Показано назначение
ангиопротекторов - продектина, трентала и др.
Хирургическое лечение
заключается в резекции пораженного сегмента артерии с протезированием.
Гигантоклеточный
темпоральный артериит.
Гигантоклеточный
темпоральный артериит (болезнь Хортона) - системное заболевание лиц пожилого и
старческого возраста, при котором поражается средняя оболочка аорты и отходящих
от нее крупных артерий, в основном, височных и черепных.
В качестве
этиологических факторов предполагаются вирусы гепатита В, острых респираторных
заболеваний. В то же время, несомненно, значение генетических особенностей
макроорганизма. Может быть семейная предрасположенность к заболеванию,
установлена связь с носительством ряда антигенов гистосовместимости системы HLA
- B8, B14, A10.
В патогенезе играют роль
нарушения иммунитета, отмечается повышение уровня иммуноглобулинов, ЦИК, а
также фиксированных на стенках артерий иммунных комплексов.
Патоморфологически для
болезни Хортона характерно сегментарное поражение аорты и ее крупных ветвей в
бассейне сонных артерий. Средняя оболочка артерий утолщается, в ней
пролиферируют лимфоидные клетки, образуются гранулемы из гигантских
многоядерных клеток. Все это приводит к стенозированию артерий и создает
условия для развития пристеночных тромбов.
У больных пожилого
возраста возникает волнообразная лихорадка, слабость, недомогание, похудание.
Наряду с этим появляются пульсирующие головные боли, усиливающиеся при жевании,
припухлость в височной области. Височные артерии извитые, утолщенные,
болезненные при пальпации. При поражении сосудов сетчатки отмечаются нарушения
зрения вплоть до развития полной слепоты. Реже поражается аорта и развивается
синдром Такаясу, симметричное или асимметричное ослабление или исчезновение
пульса на лучевых артериях, ишемический синдром - стенокардия, инфаркт
миокарда.
При исследовании крови
обнаруживаются лейкоцитоз, нейтрофилез, особенно характерно значительное
ускорение СОЭ. Как правило, значительно изменены все острофазовые показатели.
Повышается содержание гаммаглобулинов и иммуноглобулинов.
Из инструментальных
методов исследования определенную информацию дает ангиография височных артерий,
а также их биопсия. При гистологическом исследовании биоптатов определяются
гигантоклеточные гранулемы.
Препаратами выбора
являются глюкокортикоиды. Назначается преднизолон по 60-80 мг/сутки в течение
нескольких дней до появления признаков клинического и лабораторного улучшения,
затем дозу постепенно снижают, но лечение продолжается длительно в течение
нескольких месяцев. В случае поражения сосудов глаз и нарастании глазных
симптомов рекомендуется пульс-терапия метилпреднизолоном в дозе 1000 мг/сутки
в/в в течение 3 дней с переходом в последующем на прием преднизолона per os в
достаточно большой дозе и постепенным ее снижением.
При стойких сосудистых
изменениях показаны ангиопротекторы - продектин, трентал и др.
Узелковый периартериит.
Узелковый периартериит -
системный некротизирующий васкулит с сегментарным поражением артерий мелкого и
среднего калибра. Поражаются артерии мышечного типа в области их разветвления
или бифуркации. Одновременно поражается эндотелий сосудов, внутренней
эластичной мембраны и периваскулярной ткани. Пораженные артерии четкообразно
утолщены. Сосуды облитерируются, что приводит к ишемии и инфарктам в различных
органах.
Болеют УП
преимущественно мужчины.
Узелковый периартериит в
классической его форме был описан в 1866 году Kussmaul и Maier. Это
полисистемный некротизирующий васкулит мышечных артерий мелкого и среднего
калибра, поражающий почечные артерии и артерии внутренних органов. Средний
возраст больных узелковым периартериитом около 45 лет, соотношение числа
пораженных мужчин и женщин 2,5:1.
Этиология УП точно не
установлена. Обсуждается вопрос о роли бактериальных и вирусных агентов.
Особенно убедительны данные в пользу этиологической роли вируса гепатита В. В
сыворотке крови больных УП часто обнаруживается HBs-антиген и антитела к нему,
а также ЦИК, содержащие этот антиген. Роль провоцирующих факторов играют ОРЗ,
лекарственная непереносимость, введение вакцин и лечебных сывороток.
По патогенезу УП относят
к иммунокомплексным заболеваниям с активацией комплемента. Наблюдаются типичные
черты иммунокомплексного воспаления. Большое значение имеют гемореологические
нарушения, развитие ДВС-синдрома.
Начальными проявлениями
заболевания является высокая лихорадка, боли в мышцах, отсутствие аппетита,
повышенная потливость и немотивированное похудание. На фоне этих
неспецифических симптомов, диагностическая оценка которых представляет
значительные трудности, появляются признаки полисистемного поражения.
Со стороны
опорно-двигательного аппарата отмечаются миалгии, артралгии и реже артриты.
Могут наблюдаться моно- полиневриты, инсульты, судорожные припадки, нарушения
психики. Кожные изменения - различного рода сыпи, геморрагии, появление
узелков, синдром Рейно. У половины больных наблюдаются признаки поражения
желудочно-кишечного тракта. Часто они протекают по типу острых абдоминальных
кризов, когда внезапно возникают сильные боли в животе, тошнота, рвота. Они
обусловлены ишемией кишечника и могут закончиться развернутой картиной инфаркта
органа и его перфорацией. Поражаются желчный пузырь, поджелудочная железа,
печень. Поражения дыхательной системы характеризуются появлением астматических
приступов.
Чаще всего и закономерно
поражаются почки. Морфологическая сущность поражения почек при узелковом
периартериите - васкулит почечных сосудов. Выделяют различные варианты
поражения почек. Наблюдается латентная форма, когда при исследовании мочи
определяются протеинурия, гематурия без экстраренальных выраженных проявлений.
Довольно часто бывает мочевой синдром в сочетании с тяжелой гипертензией. Реже
развивается типичный нефротический синдром. В финале развивается почечная
недостаточность.
При исследовании крови
наблюдается умеренная анемия, лейкоцитоз, нейтрофилез, в ряде случаев
эозинофилия, ускорение СОЭ. Практически всегда имеются изменения мочи -
протеинурия, гематурия, цилиндрурия. Изменена протеинограмма - диспротеинемия,
гипергаммаглобулинемия. Часто выделяется HBs-антиген.
Решающими методами для
диагностики УП являются ангиография и биопсия кожи, мышц, почек. При этом
должно быть сочетание выявленных признаков поражения сосудов с соответствующей
клиникой. На ангиограммах выявляются аневризмы сосудов почек, печени и других
внутренних органов, при этом характерно поражение артерий мелкого и среднего
калибра. В биоптатах мышц и кожи выявляются признаки васкулита.
Правильнее говорить об
опорных признаках для диагностики УП. Заболевание развивается чаще у мужчин,
длительная лихорадка, снижение массы тела, полиневрит, абдоминальные кризы,
пневмонит, эозинофилия.
В настоящее время
наиболее эффективными лекарственными средствами для лечения УП считаются
глюкокортикоиды и иммунодепрессанты. Начальные дозы глюкокортикоидов 60-100 мг.
в сутки, при достижении положительного эффекта довольно быстро следует
переходить на более низкие и поддерживающие дозы. Применение глюкокортикоидов
часто лимитируется такими признаками как высокая гипертензия и почечная
недостаточность. В этой связи для длительного, многолетнего лечения более
показаны цитостатические средства - циклофосфан, азатиоприн. Они назначаются вначале
по 150-200 мг/сутки, затем по 50-100 мг. Сочетанное применение цитостатиков и
глюкортикоидов позволяет применять меньшие дозы тех и других и признается более
эффективным. Из методов активной терапии в настоящее время все более широко
применяется плазмоферез с целью элиминации ЦИК. В комплексной терапии УП
применяются также антикоагулянты (гепарин), антиагреганты (курантил, аспирин).
Для лечения гипертензии и почечных поражений применяются ингибиторы
превращающего фермента (каптоприл, эналаприл) и антагонисты кальция
(нифедипин).
ЛИТЕРАТУРА
Внутренние болезни под
редакцией Ф. И. Комарова. М., Медицина. 1991 г.
Маколкин В. И.,
Овчаренко В. И. Внутренние болезни. М., Медицина. 1994 г.
ГЕМОЛИТИЧЕСКИЕ АНЕМИИ.
АГРАНУЛОЦИТОЗ
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
Классификация, общие
признаки гемолитических анемий.
Наследственный
микросфероцитоз - патогенез, диагностические критерии, лечение, прогноз.
Энзимопатии,
гемоглобинопатии - патогенез, диагностические критерии, лечение, прогноз.
Аутоиммунные
гемолитические состояния - патогенез, диагностические критерии, лечение,
прогноз.
Показания к
иммуносупрессивной терапии.
Пароксизмальная ночная
гемоглобинурия - диагностические критерии, лечение, прогноз.
Агранулоцитоз -
патогенез, клинические варианты, критерии диагностики, лечение, прогноз.
ОТВЕТЫ НА ВОПРОСЫ
Гемолитические анемии
представляют собой обширную группу заболеваний, различающихся по этиологии,
патогенезу, клинической картине, методам лечения. Основным признаком
гемолитических анемий является повышенный распад эритроцитов и укорочение
продолжительности их жизни. В физиологических условиях продолжительность жизни
эритроцитов составляет 100-120 дней. Стареющие эритроциты подвергаются
секвестрации в синусах селезенки, а также в костном мозге. Образовавшийся в результате
физиологического распада эритроцитов пигмент билирубин циркулирует в крови в
виде свободного (неконъюгированного) билирубина, который транспортируется в
печеночную клетку, где при участии ферментов соединяется с глюкуроновой
кислотой. Образовавшийся билирубин-глюкуронид (конъюгированный) проникает из
печеночных клеток в желчные ходы и выделяется вместе с желчью в кишечник. При
гемолитических анемиях вследствие усиленного разрушения эритроцитов
продолжительность их жизни укорачивается до 12-14 дней. Патологический гемолиз
может быть преимущественно внутрисосудистым. Внутриклеточный распад эритроцитов
происходит в клетках ретикулогистиоцитарной системы, главным образом в
селезенке, и сопровождается повышением в сыворотке свободного билирубина,
увеличением экскреции уробилина с мочой и калом, наклонностью к образованию
камней в желчном пузыре и протоках. При внутрисосудистом гемолизе гемоглобин
поступает в повышенном количестве в плазму и выделяется с мочой в неизмененном
виде или в виде гемосидерина, который может откладываться во внутренних органах
(гемосидероз). По течению гемолиз может быть острым или хроническим. Все
гемолитические анемии делятся на две большие группы: наследственные и
приобретенные.
Наследственные
гемолитические анемии являются следствием различных генетических дефектов в
эритроцитах, которые становятся функционально неполноценными и нестойкими.
Приобретенные
гемолитические анемии связаны с воздействием различных факторов, способствующих
разрушению эритроцитов (образование антител, гемолитические яды, механические
воздействия и прочее).
Наследственный
микросфероцитоз (болезнь Минковского-Шоффара).
Наследственный
микросфероцитоз был впервые описан в 1900 году Минковским, а в дальнейшем более
подробно - Шоффаром.
В основе заболевания
лежит генетический дефект белка мембраны эритроцита. Имеющаяся аномалия
мембраны приводит к проникновению в эритроцит избытка ионов натрия и
повышенному накоплению в нем воды, вследствие чего образуются сферические
эритроциты (сфероциты). Сфероциты, в отличие от двояковогнутых нормальных
эритроцитов, не обладают способностью деформироваться в узких участках
кровотока, например при переходе в синусы селезенки. Это ведет к замедлению
продвижения эритроцитов в синусах селезенки, отщеплению части поверхности эритроцита
с образованием микросфероцитов (отсюда название болезни - микросфероцитоз) и
постепенной их гибели. Разрушенные эритроциты поглощаются макрофагами
селезенки. Постоянный гемолиз эритроцитов в селезенке ведет к гиперплазии
клеток ее пульпы и увеличению органа. В связи с усиленным распадом эритроцитов
в сыворотке повышается содержание свободного билирубина. Поступающий в
повышенном количестве в кишечник билирубин выводится из организма с мочой и
главным образом с калом в виде стеркобилина. Суточное выделение стеркобилина
при наследственном микросфероцитозе превышает норму в 10-20 раз. Следствием
повышенного выделения билирубина в желчь является плейохромин желчи и
образование пигментных камней в желчном пузыре и протоках.
Кожа и внутренние органы
при наследственном микросфероцитозе бледны и желтушны. Костный мозг в плоских и
трубчатых костях гиперплазирован за счет эритроидного ростка, отмечаются
явления эритрофагоцитоза ретикулярными клетками. В селезенке наблюдаются резко
выраженное кровенаполнение пульпы, гиперплазия эндотелия синусов, уменьшение
размеров и количества фолликулов. В печени, костном мозге, лимфатических узлах
нередко выявляется гемосидероз.
Клиника зависит от
выраженности гемолиза. В большинстве случаев первые признаки выявляются в
юношеском или зрелом возрасте. У детей болезнь обнаруживается обычно при
обследовании по поводу заболевания их родственников. Жалобы вне обострения
заболевания могут отсутствовать. В период обострения отмечаются слабость,
головокружение, повышение температуры. Одним из основных клинических симптомов
является желтуха, которая долгое время может оставаться единственным признаком
заболевания. Выраженность желтухи зависит, с одной стороны, от интенсивности
гемолиза, а с другой - от способности печени к конъюгированию свободного
билирубина с глюкуроновой кислотой. В моче билирубин не обнаруживается, так как
свободный билирубин не проходит через почки. Кал интенсивно окрашен в
темно-коричневый цвет вследствие повышенного содержания стеркобилина. В связи
со склонностью к камнеобразованию у больных могут наблюдаться приступы
желчнокаменной болезни, нередко сопровождающиеся признаками холецистита. В
случае закупорки камнем общего желчного протока возникает синдром обтурационной
желтухи (значительное повышение содержания билирубина наличие желчных пигментов
в моче, кожный зуд и так далее). Кардинальным симптомом наследственного
микросфероцитоза является увеличение селезенки, которая обычно выступает из-под
подреберья на 2-3 см. При длительно протекающем гемолизе наблюдается значительная
спленомегалия, в связи, с чем больные жалуются на тяжесть в левом подреберье.
Печень при неосложненном заболевании обычно нормальных размеров, но иногда у
больных, длительно страдающих гемолитической анемией, обнаруживается ее
увеличение. Могут наблюдаться признаки замедленного развития, а также нарушения
лицевого скелета в виде "башенного черепа", седловидного носа,
высокого стояния неба, нарушения расположения зубов, узких глазниц.
Выраженность анемического синдрома различна. Часто отмечается умеренное
снижение гемоглобина. У некоторых больных анемия вообще отсутствует. Наиболее
резкая анемизация наблюдается в период гемолитических кризов. У лиц среднего и
пожилого возраста иногда встречаются плохо поддающиеся лечению трофические язвы
голени, связанные с агглютинацией и распадом эритроцитов в мелких капиллярах
конечностей. Течение заболевания характеризуется так называемыми
гемолитическими кризами, проявляющимися резким усилением симптомов на фоне
непрерывно текущего гемолиза. При этом повышается температура в связи с
массовым распадом эритроцитов, увеличивается интенсивность желтухи, появляется
сильные боли в животе, рвота. Гемолитические кризы возникают обычно после
интеркуррентных инфекций, переохлаждения, у женщин в связи с беременностью. Частота
кризов различна, у ряда больных они не возникают.
Анемия при
наследственном микросфероцитозе носит нормохромный характер. В мазке крови
преобладают микросфероциты, отличающиеся отсутствием характерного для
нормальных эритроцитов центрального просветления. Преобладание микроцитов
выявляется графически на кривой Прайс-Джонса, отражающей количественные
соотношения эритроцитов различных диаметров (средний диаметр нормального
эритроцита составляет 7-7,5 мкм). При наследственном микросфероцитозе вершина
кривой Прайс-Джонса растянута и сдвинута влево в сторону микроцитов. Количество
ретикулоцитов увеличено. Число лейкоцитов обычно нормально. При гемолитических
кризах отмечается нейтрофильный лейкоцитоз со сдвигом влево. Количество
тромбоцитов варьирует в пределах нормы. В костном мозге отмечается выраженная
гиперплазия эритроидного ростка. Содержание непрямого билирубина в крови
повышено умеренно и, как правило, не превышает 50-70 мкмоль/л. Определяется
повышенное содержание уробилина в моче и стеркобилина в кале. Диагноз
наследственного микросфероцитоза ставится на основании течения заболевания
(чередование кризов и ремиссий), клинической картины (желтуха, спленомегалия,
боли в правом подреберье, анемия), данных исследования периферической крови
(нормохромная анемия, ретикулоцитоз, микросфероцитоз). Важное значение имеет
обследование родственников больных, у которых могут определяться едва уловимые
признаки гемолиза или микросфероцитоз без клинических проявлений.
Дополнительными диагностическими критериями может служить ряд лабораторных
тестов. Характерным лабораторным признаком заболевания является снижение
осмотической резистентности эритроцитов по отношению к гипотоническим растворам
хлористого натрия. Начало гемолиза при наследственном микросфероцитозе соответствует
0,6-0,7 %, а конец - 0,4 % вместо 0,48 и 0,22 % в норме. Снижение осмотической
резистентности свидетельствует о преобладании в крови эритроцитов сферической
формы - сфероцитов, которые, менее стойки к осмотическому гемолизу, чем
нормальные макропланоциты. Правильному диагнозу способствует проба Кумбса,
выявляющая фиксированные на эритроцитах аутоантитела при аутоиммунных
гемолитических анемиях.
Единственным методом
лечения больных наследственным микросфероцитозом является спленэктомия, которая
оказывается эффективной в 100 % случаях. После спленэктомии у больных наступает
практическое излечение, несмотря на то, что эритроциты сохраняют свои
патологические свойства (микросфероцитоз, снижение осмотической
резистентности). Прекращение гемолиза после спленэктомии объясняется удалением
основного плацдарма разрушения микросфероцитов. Спленэктомия показана при
частых гемолитических кризах, резкой анемизации больных, инфарктах селезенки,
приступах печеночной колики. При наличии соответствующих показаний в некоторых
случаях одновременно со спленэктомией может быть произведена холецистэктомия.
При легких компенсированных формах заболевания у взрослых показания к
спленэктомии следует ограничивать. В качестве предоперационной подготовки
анемизированных больных показаны переливания эритроцитарной массы.
Глюкокортикоидные гормоны при наследственном микросфероцитозе неэффективны.
Прогноз при наследственном микросфероцитозе относительно благоприятен. Многие
больные доживают до старости.
Наследственные
гемолитические анемии, связанные с дефицитом активности ферментов.
Эта неоднородная группа
заболеваний обозначается также как несфероцитарные гемолитические анемии. В
отличие от микросфероцитоза они характеризуются нормальной формой эритроцитов с
тенденцией к макропланоцитозу, нормальной или повышенной осмотической
резистентностью эритроцитов, рецессивным типом наследования, отсутствием
эффекта от спленэктомии.
В основе патогенеза
несфероцитарных гемолитических анемий лежит дефицит активности некоторых
ферментов эритроцитов, в результате чего эритроциты становятся чувствительными
к воздействию различных веществ растительного происхождения, лекарственных
средств. Наиболее распространенной среди этой группы заболеваний является
острая гемолитическая анемия, связанная с дефицитом
глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ). Согласно сведениям ВОЗ, в мире
насчитывается около 100 миллионов человек с дефицитом активности Г-6-ФДГ.
Дефицит Г-6-ФДГ наследуется по рецессивному типу, сцепленному с полом, в связи,
с чем клинические проявления данной патологии наблюдаются преимущественно у
мужчин. При низкой активности Г-6-ФДГ в эритроцитах нарушаются процессы
восстановления никотинамиддинуклеотидфосфата (НАДФ) и превращения окисленного
глютатиона в восстановленный, предохраняющий эритроцит от разрушающего действия
потенциальных гемолитических агентов (фенилгидразин, некоторые медикаменты,
бобовые и т. д.). Гемолиз происходит преимущественно внутрисосудисто. Кожа и
внутренние органы желтушны. Отмечается увеличение и полнокровие печени и селезенки,
умеренное увеличение и набухание почек. Микроскопически в почечных канальцах
обнаруживают гемоглобинсодержащие цилиндры. В печени и селезенке наблюдается
макрофагальная реакция с наличием в макрофагах гемосидерина.
Как правило, дефицит
Г-6-ФДГ не проявляется клинически без воздействия различных гемолитических
агентов. Спровоцировать гемолитический криз могут противомалярийные препараты,
сульфаниламиды, анальгетики, некоторые химиопрепараты (фурадонин, ПАСК),
витамин К, растительные продукты (бобовые, стручковые). Выраженность
гемолитического процесса зависит от степени дефицита Г-6-ФДГ и от дозы
принятого препарата. Гемолиз наступает не сразу, а через 2-3 дня после приема
препаратов. В тяжелых случаях у больных появляется высокая температура резкая
слабость, боли в животе и спине, обильная рвота. Отмечается выраженная одышка,
сердцебиение, нередко развитие коллаптоидного состояния. Характерным симптомом
является выделение темной мочи, имеющей иногда черный цвет, что связанно с
внутрисосудистым распадом эритроцитов и выделением с мочой гемосидерина. В
некоторых случаях вследствие закупорки почечных канальцев продуктами распада
гемоглобина и резкого снижения клубочковой фильтрации возможно развитие острой
почечной недостаточности. При объективном исследовании отмечается желтушная
окраска кожных покровов и слизистых оболочек, увеличение селезенки, реже
печени. Через неделю гемолиз прекращается, независимо от того, продолжается
прием препарата или нет.
В течение первых двух
суток гемолитического криза у больных развивается выраженная нормохромная
анемия с падением гемоглобина до 30 г/л и ниже. Отмечается высокий
ретикулоцитоз, наличие нормоцитов в крови. Особенностью эритроцитов является
присутствие в них телец Гейнца, представляющих собой денатурированный гемоглобин
и выявляющихся при суправитальной окраске. Осмотическая резистентность
эритроцитов нормальная или повышена. Со стороны белой крови во время криза
отмечается лейкоцитоз со сдвигом влево до миелоцитов и более молодых форм. В
костном мозге наблюдается гиперплазия эритроидного ростка и явления
эритрофагоцитоза. Диагноз острой гемолитической анемии, связанной с дефицитом
Г-6-ФДГ, ставится на основании типичной клинико-гематологической картины
острого внутрисосудистого гемолиза, связи заболевания с приемом лекарств и
данных лабораторных исследований, выявляющих снижение активности Г-6-ФДГ в
эритроцитах больных, а иногда их родственников. Основным методом лечения острой
гемолитической анемии при выраженном падении содержания гемоглобина являются
повторные переливания свежецитратной одногруппной крови по 250-500 мл. 1-2 раза
в неделю внутривенные вливания больших количеств физиологического раствора или
5 % раствора глюкозы. В качестве противошоковых препаратов применяют морфин,
преднизолон, промедол. Из сосудистых средств используют кордиамин, камфору. При
развитии острой почечной недостаточности проводят обычный комплекс
терапевтических мероприятий, при отсутствии эффекта показано проведение
гемодиализа. При нетяжелых гемолитических кризах в качестве антиоксидантного
препарата назначают эревит внутримышечно по 2 мл. 2 раза в день. Профилактика
гемолитических кризов заключается в тщательном сборе анамнеза перед назначением
средств, способных спровоцировать гемолитический криз при дефиците Г-6-ФДГ. При
необходимости применения этих препаратов у лиц с дефицитом Г-6-ФДГ
рекомендуется использовать средства для восстановления глютатиона. С этой целью
применяют ксилит в суточной дозе 30 г. в комбинации с рибофлавином в дозе 0,03
г. в течение 1-2 месяцев. Прогноз неблагоприятен при развитии анурии и почечной
недостаточности. При молниеносных формах заболевания смерть наступает от шока
или острой аноксии.
Аутоиммунная
гемолитическая анемия.
Аутоиммунная
гемолитическая анемия является наиболее часто встречающимся заболеванием среди
приобретенных гемолитических анемий. Развитие заболевания связано с появлением
в организме больного антител к собственным эритроцитам, которые агглютинируются
и подвергаются распаду в клетках ретикулогистиоцитарной системы.
Различают симптоматические
и идиопатические аутоиммунные гемолитические анемии. Симптоматические
аутоиммунные анемии возникают на фоне различных заболеваний, сопровождающихся
нарушениями в иммунокомпетентной системе. Наиболее часто они встречаются при
хроническом лимфолейкозе, лимфогранулематозе, остром лейкозе, системной красной
волчанке, ревматоидном артрите, хронических гепатитах и циррозах печени. В тех
случаях, когда появление аутоантител не удается связать с каким-либо
патологическим процессом, говорят об идиопатической аутоиммунной гемолитической
анемии, которая составляет около 50 % всех аутоиммунных анемий. Образование
аутоантител происходит в результате нарушения в системе иммунокомпетентных
клеток, которые воспринимают эритроцитарный антиген как чужеродный и начинают вырабатывать
к нему антитела. После фиксации аутоантител на эритроцитах последние
захватываются клетками ретикулогистиоцитарной системы, где подвергаются
агглютинации и распаду. Гемолиз эритроцитов происходит главным образом в
селезенке, печени, костном мозге. Аутоантитела к эритроцитам принадлежат к
различным типам. По серологическому принципу аутоиммунные гемолитические анемии
делятся на несколько форм:
анемии с неполными
тепловыми агглютининами
анемии с тепловыми
гемолизинами
анемии с полными
холодовыми агглютининами
анемии с двухфазными
гемолизинами
анемии с агглютининами
против нормобластов костного мозга
Каждая из этих форм
имеет некоторые особенности в клинической картине, течении и серологической
диагностике. Наиболее часто встречаются анемии с неполными тепловыми
агглютининами, составляющие 70-80 % всех аутоиммунных гемолитических анемий.
По клиническому течению
выделяют острую и хроническую аутоиммунную гемолитическую анемию. При острых
формах у больных внезапно появляется резкая слабость, сердцебиение, одышка,
лихорадка, желтуха. При хронических формах заболевание развивается исподволь.
Общее состояние больных изменяется мало. Одышка и сердцебиение могут
отсутствовать, несмотря на выраженную анемизацию, что связано с постепенной
адаптацией больных к гипоксии. Объективно выявляется увеличение селезенки, реже
- печени. При аутоиммунной анемии, связанной с холодовыми агглютининами
(холодовая агглютининовая болезнь), отмечается плохая переносимость холода и
развитие на холоду таких симптомов, как крапивница, синдром Рейно,
гемоглобинурия. Течение заболевания характеризуется наклонностью к обострениям
(гемолитическим кризам) под влиянием инфекций чаще вирусных или при воздействии
холода. Отмечается нормохромная или умеренно гиперхромная анемия различной степени,
ретикулоцитоз, нормоцитоз. Для аутоиммунной гемолитической анемии с холодовыми
агглютининами характерна агглютинация эритроцитов, наблюдающаяся сразу после
взятия крови и в мазке. При подогревании агглютинация исчезает. Осмотическая
резистентность эритроцитов в большинстве случаев снижена. Количество лейкоцитов
при идиопатических формах подвержено колебаниям в случае острого
гемолитического криза встречается лейкоцитоз со сдвигом влево до миелоцитов.
При хронических формах количество лейкоцитов, близко к норме. Число тромбоцитов
не изменено. СОЭ сильно увеличена. В костном мозге наблюдается резко выраженная
гиперплазия эритроидного ростка. Среди лабораторных признаков повышенного
гемолиза отмечается увеличение содержания непрямого билирубина, повышенная
экскреция стеркобилина с калом.
Диагноз аутоиммунной
гемолитической анемии ставится на основании признаков повышенного гемолиза, с
одной стороны, и выявления фиксированных на поверхности эритроцита антител - с
другой. Основным методом выявления на эритроцитах аутоантител является проба
Кумбса, основанная на преципитации антиглобулиновой сыворотки эритроцитов с
фиксированными на них антителами. Различают прямую и непрямую пробы Кумбса.
Прямая проба выпадает положительной в большинстве случаев аутоиммунной
гемолитической анемии. Отрицательный результат прямой пробы означает отсутствие
антител на поверхности эритроцита и не исключает наличия свободных
циркулирующих антител в плазме. Для выявления свободных антител применяют
непрямую пробу Кумбса.
Средством выбора при
лечении аутоиммунной гемолитической анемии являются глюкокортикоидные гормоны,
которые практически всегда прекращают или уменьшают гемолиз. Необходимым
условием гормональной терапии является достаточная дозировка и длительность. В
острой фазе назначают преднизолон в больших дозах - 60-80 мг/сут (из расчета 1
мг/кг массы) или эквивалентные дозы других глюкокортикоидов. После наступления
ремиссии доза преднизолона постепенно уменьшается. Поддерживающая доза
составляет 5 - 10 мг/сут. Лечение проводится на протяжении 2-3 месяцев, до
исчезновения всех признаков гемолиза и негативации пробы Кумбса. У некоторых
больных эффект оказывают иммунодепрессанты (6-меркаптопурин, азатиоприн,
хлорамбуцил), а также противомалярийные препараты (делагил, резохин). Особенно
выраженный эффект иммунодепрессанты оказывают при аутоиммунной гемолитической
анемии, связанной с холодовыми агглютининами. Доза 6-меркаптопурина и
азатиоприна составляет 100-150 мг/сут, хлорамбуцил назначают в дозе 10-15 мг.
При рецидивирующих формах заболевания и отсутствии эффекта от применения
глюкокортикоидов и иммунодепрессантов показана спленэктомия. Гемотрансфузии у
больных аутоиммунной гемолитической анемией следует проводить только по
жизненным показаниям (резкое падение гемоглобина, сопорозное состояние).
Рекомендуется специально подбирать доноров, чьи эритроциты дают отрицательную
пробу Кумбса.
Гемолитическая анемия с
постоянной гемосидеринурией и пароксизмальной ночной гемоглобинурией (болезнь
Маркиафавы-Микели)
Представляет собой
приобретенную гемолитическую анемию с постоянным внутрисосудистым гемолизом и
выделением с мочой гемосидерина.
Заболевание
рассматривается как результат соматической мутации эритроидных клеток,
вследствие чего вырабатывается патологический клон (семейство) эритроцитов с
повышенной чувствительностью к различным гемолитическим агентам. Интенсивность
гемолиза повышается под влиянием пропердина, комплемента, тромбина, ацидоза.
Характерным
морфологическим признаком заболевания является гемосидероз почек. Гемосидероза
в других органах не наблюдается. В печени отмечаются дистрофические и
некробиотические изменения, связанные с венозными тромбозами и анемией.
Селезенка увеличена, за счет множественных сосудистых тромбозов и развития
периваскулярного склероза.
Жалобы больных сводятся
к слабости, головокружениям, одышке, сердцебиениям. Характерным признаком
являются боли в животе различной локализации и интенсивности, наблюдающиеся,
как правило, в период криза и связанные с капиллярными тромбозами
мезентериальных сосудов. Нередко отмечаются тромбозы периферических сосудов,
чаще в венах верхних и нижних конечностей, а также других сосудов (мозговых,
селезеночных, почечных). В период криза у больных может повышаться температура.
Типичным признаком заболевания является появление мочи черного цвета,
обусловленного выделением с мочой гемосидерина и гемоглобина. Нередко
гемоглобинурия имеет место в ночное время (пароксизмальная ночная
гемоглобинурия). Этот феномен объясняется наступающим во время сна
физиологическим ацидозом, активацией пропердина и других факторов, усиливающих
гемолиз. Гемоглобинурия не является обязательным симптомом заболевания. При
объективном исследовании выявляется бледность кожи с небольшим желтушным
оттенком, умеренное увеличение селезенки и печени.
Анемия в течение
длительного времени носит нормохромный характер. При значительных потерях с
мочой железа в виде гемоглобина и гемосидерина цветовой показатель становится
меньше нормы. Количество ретикулоцитов повышено незначительно. Часто
наблюдается лейкопения и тромбоцитопения. В костном мозге отмечается
гиперплазия эритроидного ростка, сопровождающаяся нередко угнетением
гранулоцитарного и мегакариоцитарного ростков. О возможности болезни
Маркиафавы-Микели следует думать у больных с гемолитической анемией, резистентной
к лечению, сопровождающейся лейко- и тромбоцитопенией без значительного
увеличения селезенки. Важное диагностическое значение имеет микрокопирование
осадка мочи с целью выявления гемосидеринурии. Среди лабораторных тестов в
диагностике болезни Маркиафавы-Микели используются следующие тесты: кислотный
тест Хэма (гемолиз эритроцитов больного в подкисленной человеческой сыворотке),
тест Кросби (усиление гемолиза под влиянием тромбина), сахарозный тест (гемолиз
эритроцитов больных в свежей донорской крови при добавлении сахарозы).
Наиболее эффективным
методом лечения является переливание эритроцитов, предварительно трижды отмытых
физиологическим раствором хлорида натрия. Такие эритроциты переливают раз в 4-5
дней, в количестве 200-400 мл., причем они должны быть перелиты не позднее 48 ч
после взятия. Для профилактики и лечения тромбозов показана антикоагулянтная
терапия. В период гемолитического криза некоторое уменьшение гемолиза
достигается при введении плазмозаменителей, в частности декстрана или полиглюкина
в количестве 500-1000 мл. Глюкокортикоиды и препараты железа при болезни
Маркиафавы-Микели противопоказаны.
Агранулоцитоз.
Агранулоцитоз - синдром,
при котором происходит полное или почти полное исчезновение из периферической
крови гранулоцитов (зернистых лейкоцитов). Чаще всего агранулоцитоз встречается
у взрослых, но он может быть и в детском возрасте.
Различают агранулоцитоз
миелотоксический, то есть возникающий при нарушении образования гранулоцитов в
костном мозге, и иммунный - при ускоренной гибели гранулоцитов под действием
антилейкоцитарных антител.
Нарушение образования
гранулоцитов в костном мозге может иметь место при ионизирующем облучении, при
лечении противоопухолевыми препаратами, под влиянием продуктов
жизнедеятельности грибка типа Fusarium, размножающегося в перезимовавшем зерне.
Антилейкоцитарные
антитела при иммунном агранулоцитозе могут образовываться в процессе лечения
некоторыми лекарственными препаратами: амидопирином, бутадионом,
фенобарбиталом, винбластином, сульфаниламидами, ПАСКом. При иммунном
агранулоцитозе стволовые клетки не страдают.
Для любого
агранулоцитоза характерны общая слабость, лихорадка, гингивит, стоматит,
язвенно-некротические поражения слизистых оболочек полости рта, глотки,
желудочно-кишечного тракта. Возможно увеличение печени, селезенки,
лимфатических узлов, развитие пневмонии, флегмон.
При миелотоксическом
агранулоцитозе, вследствие снижения в крови тромбоцитов, выражен
геморрагический синдром (синяки, кровоточивость десен, носовые, желудочные,
кишечные кровотечения), поражения слизистых оболочек (некрозы, молочница),
полости рта и желудочно-кишечного тракта. В периферической крови уменьшено
количество всех форм лейкоцитов, а также тромбоцитов, может быть анемия.
При иммунном
агранулоцитозе лейкопения носит умеренный характер, но количество гранулоцитов
уменьшено до нуля. Тромбоцитопения отсутствует. В сыворотке крови определяются
антилейкоцитарные антитела.
Среди возможных
осложнений агранулоцитоза - сепсис, пневмонии, прободение кишечника.
Диагноз агранулоцитоза
основывается на клинических проявлениях заболевания, характерной картине
периферической крови, результатах исследования пунктата костного мозга.
Прогноз зависит от
тяжести процесса и индивидуальных особенностей организма. Если причины
агранулоцитоза известны, необходимо их срочно ликвидировать, например, отменить
токсические препараты. Используют кортикостероиды (при иммунном
агранулоцитозе), повторные переливания лейкоцитарной массы, антибиотики,
витамины.
При
язвенно-некротических поражениях слизистых оболочек полости рта проводят
последовательную обработку их раствором перманганата калия (1:5000) и 2 %
раствором перекиси водорода, облепиховым маслом.
ЛИТЕРАТУРА
ОСНОВНАЯ:
Внутренние болезни под
редакцией Ф. И. Комарова. М., Медицина. 1991 г.
Маколкин В. И.,
Овчаренко В. И. Внутренние болезни. М., Медицина. 1994 г.
Внутренние болезни (в
двух томах) под редакцией А. В. Сумарокова. М., Медицина. 1993 г.
Практические навыки
терапевта под редакцией Г. П. Матвейкова. Минск, Вышэйшая школа. 1993 г.
Машковский М. Д.
Лекарственные средства (в двух томах). М., Медицина. 1993 г.
Окороков А. Н. Лечение
болезней внутренних органов: Практическое руководство: в 3 т. Мн., Выш. шк.,
Белмедкнига. 1995-1996 гг.
ДОПОЛНИТЕЛЬНАЯ:
Руководство по
гематологии (в двух томах) / под ред. А. И. Воробьева. М., Медицина 1986 г.
Иванов Е. П. Руководство
по гемостазиологии. Минск, Беларусь. 1991 г.
Файнштейн Ф. Э., Козинец
Г. И., Бахрамов, Хохлова М. П. Болезни системы крови. Ташкент, Медицина. 1987
г.
Окороков А. Н. Лечение
болезней внутренних органов: Практическое руководство: в 3 томах. Т.3 Мн.,
Белмедкнига. 1996 г.
ОСТРЫЕ И ХРОНИЧЕСКИЕ
ЛЕЙКОЗЫ. ПОЛИЦИТЕМИЯ. ЦИТОСТАТИЧЕСКАЯ БОЛЕЗНЬ
ОСНОВНЫЕ ВОПРОСЫ
Основные формы,
клинические синдромы острых лейкозов.
Диагностические
критерии, возможности лечение острых лейкозов.
Цитостатическая болезнь:
этиология, патогенез, клиника, лечение.
Клинические синдромы,
стадии течения, диагностические критерии, возможности лечения хронического
миелолейкоза.
Хронический лимфолейкоз:
клинические синдромы, стадии течения, диагностические синдромы, лечение.
Течение, клиническая
картина, лечение полицитемии.
ОТВЕТЫ НА ВОПРОСЫ
Острый лейкоз.
Острый лейкоз - это
опухоль кроветворной системы, развившаяся из клеток-предшественниц лимфо- или
миелопоэза, патологический клон которых утрачивает способность к
дифференцировке.
Классификация ОЛ. Формы
острого лейкоза:
. Лимфобластный - ОЛЛ
. Миелобластный - ОМЛ
. Монобластный - ОМиЛ
. Миеломонобластный
. Промиелоцитарный
. Эритромиелоз
. Недифференцируемый
Основные клинические
синдромы: Анемический; Инфекционно-токсический; Геморрагический;
Лимфопролиферативный.
Основные клинические
проявления острого лейкоза обусловлены подавлением нормальных ростков
кроветворения в костном мозге, инфильтрацией в лимфоузлы лейкозных клеток,
вторичными нарушениями иммунологического статуса. Указанные синдромы характерны
обычно для развернутой стадии болезни, начало обычно скрытное, симптомы
неспецифичные, нередко заболевание выявляется при случайном или плановом
исследовании крови.
Анемический синдром
проявляется слабостью, сердцебиением, одышкой, бледностью кожи и видимых
слизистых. Для геморрагического синдрома характерны десневые, носовые, маточные
кровотечения, геморрагии на коже и слизистых. Инфекционно-токсический синдром -
закономерное проявление ОЛ. У больных развиваются ангины, часто некротические,
пневмонии, инфекция мочевых путей. Постоянно наблюдается лихорадка. Для
лимфопролиферативного синдрома характерна генерализованная лимфаденопатия,
лимфоузлы увеличиваются умеренно, они плотные, безболезненные. При увеличении
медиастинальных узлов больного беспокоит кашель, одышка; мезентериальных
лимфоузлов - боли в животе. Часто увеличиваются селезенка и печень.
Анализ крови - наиболее
характерным является увеличение числа лейкоцитов (лейкемическая форма), реже
наблюдается их уменьшение (алейкемическая форма), в периферической крови
выявляются бластные клетки, наряду с этим резко уменьшается количество зрелых
гранулоцитов (т. н. лейкемический провал), в ряде случаев бластные элементы в
периферической крови на каких-то этапах заболевания не обнаруживаются. В
развернутой стадии процесса определяется анемия, тромбоцитопения,
гранулоцитопения.
Решающим для диагностики
острого лейкоза является исследование костного мозга. В нем преобладают бластные
клетки. Степень инфильтрации бластными элементами может быть разная - от 10-20
% до тотальной бластной трансформации. Нормальные ростки кроветворения
угнетены.
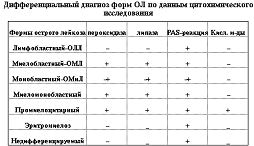
Выделяют различные формы
ОЛ, морфологически они дифференцируются с большим трудом, поэтому бластные
клетки изучаются с помощью гистохимических реакций, которые позволяют в
большинстве случаев точно установить форму ОЛ. Это крайне важно с практической
точки зрения, поскольку программы радикального лечения напрямую зависят от
формы лейкоза.
Основные методы лечения
ОЛ:
Полихимиотерапия.
а). Сочетание различных
препаратов по строго определенной программе-протоколу - в зависимости от формы
ОЛ.
б). Этапы лечения -
индукция ремиссии, консолидация ремиссии, поддерживающая терапия.
в). Профилактика и
лечение нейролейкемии.
г). В процессе жесткой
цитостатической терапии защита больного от инфекции, последствий
геморрагического синдрома.
Трансплантация костного
мозга.
Методы иммунотерапии.
Первый этап лечения ОЛ -
индукция ремиссии. Массивная полихимиотерапия по определенной программе
(протоколу) проводится с целью уничтожения большей части клона опухолевых
клеток. Обычно при этом развивается лекарственная аплазия костного мозга.
Обоснование такой жесткой тактики в том, что чувствительность опухолевых клеток
к цитостатикам более высокая, чем здоровых клеток. Оставшиеся их
"островки" в костном мозге дают рост нормальным ветвям кроветворения.
После достижения ремиссии проводится этап консолидации, основной задачей
которого является еще большее угнетение опухолевых клеток, в идеале их полное
уничтожение. Далее на протяжении нескольких лет проводится поддерживающая
терапия более низкими дозами цитостатических препаратов.
Основной целью
вспомогательного лечения особенно на этапе индукции ремиссии является защита
больного от инфекционных осложнений и лечение геморрагического синдрома. Первая
задача решается путем создания для больных определенного режима, уменьшающего
риск заражения вирусной или бактериальной инфекцией, применения относительно
"новых" антибиотиков широкого спектра действия, противогрибковых
препаратов. Борьба с анемией и тромбоцитопенией проводится путем трансфузий
эритроцитарной и тромбоцитарной взвесей.
Цитостатическая болезнь.
Цитостатическая болезнь
- своеобразное полисиндромное заболевание, возникающее в связи с воздействием
на организм цитостатических факторов и обусловленное гибелью главным образом
делящихся клеток, в первую очередь костного мозга, эпителия пищеварительного
тракта, кожи; нередкое проявление цитостатической болезни - поражение печени.
Этиология: прием
цитостатиков, используемых в лечении опухолей или в качестве
иммунодепрессантов, воздействие ионизирующей радиации (в этом случае говорят о
лучевой болезни).
Патогенез: гибель
больших количеств делящихся клеток с опустошением костного мозга, нарушением
целостности эпителия пищеварительного тракта, выпадением волос, а также
поражение разной степени всех органов и систем. Развивающиеся у больных
агранулоцитоз, тромбоцитопения, язвенно-некротические изменения
желудочно-кишечного тракта могут осложняться вторичными процессами: ангиной,
сепсисом, геморрагиями, прободением кишечника и т. п. Важнейшую роль в
патологическом процессе играют доза цитостатика и "мощность"
воздействия, т. е. количество препарата, принятого в единицу времени (чем выше
разовая доза цитостатика, тем тяжелее поражение). Широкое распространение
цитостатиков приводит к случайным отравлениям ими детей, использованию с
суицидальной целью, употреблению при истерии. Клиническая картина складывается
из ряда последовательно развивающихся синдромов. Вначале появляется отек
слизистой оболочки полости рта, который в дальнейшем может смениться
гиперкератозом (белесоватые трудно снимаемые наложения главным образом на
деснах), вслед за оральным поражением, иногда почти одновременно с ним, в крови
снижается число лейкоцитов, тромбоцитов, ретикулоцитов. В отличие от иммунных
агранулоцитозов гранулоциты, уменьшаясь в числе, не исчезают совсем. На высоте
гранулоцитопении развивается инфекция (ангины, пневмонии, абсцессы на местах
инъекций и т. п.); глубокая тромбоцитопения сопровождается кровотечениями из
носа, желудочно-кишечного тракта, кожными геморрагиями. При отсутствии
кровопотерь на высоте агранулоцитоза выраженной анемии не бывает, она появляется
позже. В костном мозге - опустошение клеточного состава. Поражение
желудочно-кишечного тракта проявляется некротической энтеропатией. Отдельные
системы организма поражаются различными цитостатиками неодинаково. Циклофосфан
вызывает выраженную иммунодепрессию, быстро развивающийся агранулоцитоз
(непродолжительный), общую неглубокую тромбоцитопению, поражение кишечника.
Миелосан, напротив, почти не вызывает иммунодепрессии, почти не поражает
кишечник; агранулоцитоз и тромбоцитопения появляются поздно (через 2 нед после
отравления), но бывают очень глубокими и продолжаются несколько недель.
Рубомицин и адриабластин при передозировке могут вызывать тяжелый миокардит.
Винкристин почти не поражает фанулоцитарный и тромбоцитарный ростки, но
вызывает иммунодепрессию, часто полиневрит. Гепатотропное действие оказывают
преимущественно циклофосфан, 6-меркаптопурин.
Одно из частых
проявлений цитостатической болезни - септицемия: высокая температура, иногда
озноб, бактериемия (патогенная микрофлора) при отсутствии очага инфекции.
Пневмонии отличаются малой выраженностью клинических признаков: может быть
сухой кашель, рентгенологические данные скудные, хрипов мало, они влажные
мелкопузырчатые, иногда крепитирующие. Лечение аналогично таковому при острой
лучевой болезни.
Преднизолон при
цитостатической болезни не показан. Обязательны изоляция больных и соблюдение
условий асептики. Решающую роль играют антибактериальная терапия, переливание
тромбоцитов при тромбоцитопеническом геморрагическом синдроме. При отсутствии
выраженной анемии переливание крови не показано. Инъекционные препараты вводят
только внутривенно.
Прогноз определяется
тяжестью поражения. Установлено, что без повторного введения цитостатических
препаратов болезнь не рецидивирует.
Хронический лимфолейкоз.
Хронический лимфолейкоз
(ХЛЛ) - доброкачественная опухоль кроветворной системы, субстрат которой
составляют преимущественно зрелые лимфоциты. У 95 % больных выявляют развитие
опухолевого клона В-лимфоцитов, у 5 % - Т-лимфоцитов. При любой из этих форм
лимфоциты функционально незрелые и, прежде всего это отражается на состоянии
иммунной системы.
Рутинным представляется
разделение течения заболевания на три стадии - начальную, развернутую и
терминальную. Имеется, кроме того, Международная рабочая классификация хронического
лимфолейкоза, которая позволяет ориентироваться в прогнозе заболевания (см.
таблицу).
Международная рабочая
классификация хронического лимфолейкоза по стадиям
|
Стадия
|
Описание
|
Средний срок выживаемости больных, годы
|
|
А
|
Лимфоцитоз с клинически определяемым поражением не менее трех
групп лимфоузлов; анемия и тромбоцитопения не определяются
|
Более 10
|
|
В
|
Поражение более трех групп лимфоузлов
|
5
|
|
С
|
Анемия или тромбоцитопения независимо от числа групп пораженных
лимфоузлов
|
3
|
Заболевание развивается чаще всего у
людей пожилого возраста. Начало постепенное, медленное, иногда диагноз ставится
случайно после исследования крови. В развернутую стадию можно выделить ряд
синдромов. Основной из них лимфопролиферативный. Сначала лимфоузлы
увеличиваются в 3-4 областях, чаще всего в шейной, подмышечной, паховой, узлы
мягкой или тестоватой консистенции, не спаяны между собой и кожей, подвижные,
безболезненные. Далее могут увеличиваться лимфоузлы в других регионах.
Увеличение медиастинальных узлов может обусловить компрессионный синдром -
одышку, кашель, отеки на шее. Увеличенные мезентериальные лимфоузлы могут
приводить к развитию портальной гипертензии. Часто развивается спленомегалия.
Характерной особенностью клинического течения ХЛЛ является развитие вторичных инфекционных
осложнений вследствие снижения иммунологической толерантности - рецидивирующие
пневмонии, инфекции мочевых путей, абсцессы. Типичным также является развитие
тяжелой аутоиммунной гемолитической анемии.
При исследовании крови выявляется
гиперлейкоцитоз, абсолютный и относительный лимфоцитоз, лимфоциты составляют
80-90 % всех форменных элементов. В миелограмме выявляется увеличение процента
зрелых лимфоцитов вплоть до тотальной метаплазии костного мозга лимфоцитами.
Характерно также снижение содержания g-глобулинов.
Выделяют следующие клинические
варианты ХЛЛ:
Доброкачественная форма, медленное
прогрессирование.
Прогрессирующая форма, быстрое
прогрессирование.
Опухолевая форма - значительное
увеличение лимфоузлов, симптомы сдавления.
Спленомегалическая форма.
Костномозговая форма - лимфоузлы
мало изменены, панцитопения.
Т-клеточная форма, кожные изменения.
Волосатоклеточный лейкоз - в крови
лимфоциты с ворсинчатыми выступами цитоплазмы, спленомегалия, панцитопения
(волосатоклеточный лейкоз в ряде руководств выделяется как отдельная
нозологическая единица).
При ХЛЛ проводится
первично-сдерживающая терапия, направленная на торможение развития клона
опухолевых клеток. Когда впервые ставится диагноз ХЛЛ, проводится наблюдение за
больным. Если количество лейкоцитов не выходит за пределы 30 х 109/л и
сохраняется нормальным абсолютное содержание гранулоцитов, лечение не
назначается. При увеличении числа лейкоцитов назначается хлорбутин (лейкеран),
при резистентности к нему циклофосфан. Костномозговая форма ХЛЛ лечится по
протоколу ВFM-90 (винкристин, метотрексат, 6-меркаптопурин, преднизолон).
Большое значение имеет
симптоматическая терапия у больных ХЛЛ. В связи с часто возникающими
инфекционными осложнениями назначаются антибиотики. При аутоиммунной гемолитической
анемии применяется преднизолон в больших дозах. Больным с признаками сдавления
увеличенными лимфоузлами назначается рентгенотерапия на увеличенные лимфоузлы,
селезенку.
Хронический миелолейкоз.
Хронический миелолейкоз (ХМЛ) -
опухоль кроветворной системы, развивающаяся из клетки-предшественницы
миелопоэза, маркером которой является филадельфийская хромосома. Клетки опухоли
сохраняют способность к дифференцировке.
В течение заболевания выделяют три
стадии: начальную, развернутую и терминальную. В начальной стадии клинические
признаки отсутствуют, и диагноз может быть заподозрен при случайном
исследовании крови. Развернутая стадия характеризуется клиническими признаками,
связанными с лейкемическим процессом. В терминальной стадии состояние больного
прогрессивно ухудшается, важнейшим признаком является развитие толерантности к
проводимой терапии.
Кроме того, в течение
патологического процесса можно выделить моноклоновую стадию, когда существует
один клон опухолевых клеток, и поликлоновую, когда вследствие клеточных мутаций
появляются новые клоны и процесс приобретает характер острого лейкоза.
Клинические признаки заболевания
появляются в развернутой стадии процесса, они обусловлены разрастанием
лейкозной ткани в костном мозге, селезенке, в меньшей степени в печени. Больных
беспокоит слабость, повышенная потливость, субфебрильная температура. Часто
отмечаются боли в левом подреберье, иногда очень сильные, приступообразные.
Боли вызываются спленомегалией и развитием инфарктов селезенки. Объективным
важнейшим симптомом является выраженное увеличение селезенки, она плотная,
временами очень болезненная. Гепатомегалия менее выражена. Геморрагического
синдрома в развернутой стадии практически не бывает, но в терминальной он
проявляется обязательно.
В терминальной стадии опухолевый
процесс распространяется за пределы костного мозга. Поражается кожа, подкожная
клетчатка, в них обнаруживаются лейкозные инфильтраты (лейкемиды).
Лейкемическая инфильтрация нервных корешков вызывает радикулярные боли.
Характерны изменения в
периферической крови и костном мозге. В крови лейкоцитоз, часто
гиперлейкоцитоз, в лейкоцитарной формуле определяются молодые формы нейтрофилов
вплоть до миелоцитов, увеличивается также содержание базофилов и эозинофилов
(базофильно-эозинофильная ассоциация). В костном мозге в развернутой стадии
определяется резкое увеличение гранулоцитарного ростка с преобладанием зрелых
форм. В терминальной стадии начинают преобладать молодые формы нейтрофилов и
появляются бластные клетки. Развивается анемия и тромбоцитопения. В лейкозных
клетках в моноклоновую стадию закономерно определяется филадельфийская
хромосома.
Основным принципом терапии ХМЛ
является первично-сдерживающая терапия. Основной ее задачей является
сдерживание роста клона опухолевых лейкозных клеток. С этой целью используются
препараты миелосан, миелобромол, реже 6-меркаптопурин, циклофосфамид. При
больших размерах селезенки и частых инфарктах показано облучение селезенки и
значительно реже спленэктомия.
Радикальное лечение ХМЛ проводится
путем применения интенсивной химиотерапии или общего облучения с последующей
пересадкой костного мозга.
Эритремия.
Эритремия (болезнь Вакеза,
полицитемия) - хронический доброкачественно текущий лейкоз с преимущественной
пролиферацией эритроидного ростка, повышением количества гемоглобина и
гематокрита. Наряду с эритроидным отмечается пролиферация и других ростков
кроветворения.
В течение заболевания выделяют три
стадии - начальную, развернутую и терминальную.
В клинической картине можно выделить
два синдрома - плеторический и миелопролиферативный. Первый обусловлен
увеличением содержания эритроцитов, тромбоцитов, увеличением вязкости крови. Он
проявляется головными болями, головокружением, повышением артериального
давления. Характерны кожный зуд и эритромелалгии - жгучие приступообразные боли
в кончиках пальцев, вызванные нарушениями микроциркуляции, боли сопровождаются
покраснением кончиков пальцев. Отмечается склонность к тромбозам сосудов -
коронарных, мозговых, периферических с соответствующей клиникой. Объективно выявляется
типичная окраска крови, особенно на лице - красно-цианотичная, отмечается также
краснота слизистых языка, конъюнктив, мягкого неба.
Миелопролиферативный синдром
обусловлен гиперплазией трех ростков кроветворения в костном мозге - отмечается
спленомегалия, гепатомегалия, боли в левом подреберье.
При исследовании крови отмечается
увеличение содержания гемоглобина и эритроцитов, увеличение гематокрита, а
также лейкоцитоз, тромбоцитоз; в лейкоцитарной формуле - нейтрофилез, иногда
незрелые гранулоциты. Содержание эритропоэтина снижено. По указанным выше
параметрам истинная эритремия отличается от симптоматических эритроцитозов,
когда повышается лишь количество эритроцитов и обычно повышается содержание
эритропоэтина.
Исследование костного мозга
(стернальная пункция или трепанобиопсия) - выявляется тотальная трехростковая
гиперплазия с преобладанием эритропоэза.
В начальных стадиях заболевания
рекомендуется использовать кровопускания, которые значительно облегчают
симптомы плеторического синдрома. При присоединении миелопролиферативного
синдрома - панцитоза и спленомегалии - показано назначение цитостатических
препаратов - миелобромола и имифоса. В связи со склонностью к тромбозам
применяются антикоагулянты (гепарин) и антиагреганты (аспирин, трентал, курантил).
ЛИТЕРАТУРА
ОСНОВНАЯ:
Внутренние болезни под редакцией Ф.
И. Комарова. М., Медицина. 1991 г.
Маколкин В. И., Овчаренко В. И.
Внутренние болезни. М., Медицина. 1994 г.
Внутренние болезни (в двух томах)
под редакцией А. В. Сумарокова. М., Медицина. 1993 г.
Практические навыки терапевта под
редакцией Г. П. Матвейкова. Минск, Вышэйшая школа. 1993 г.
Машковский М. Д. Лекарственные
средства (в двух томах). М., Медицина. 1993 г.
ЛИМФОГРАНУЛЕМАТОЗ.
ПАРАПРОТЕИНЕМИЧЕСКИЕ ГЕМОБЛАСТОЗЫ. БОЛЕЗНЬ ВАЛЬДЕНСТРЕМА. МИЕЛОМНАЯ БОЛЕЗНЬ
ОСНОВНЫЕ ВОПРОСЫ
Этиология, патогенез, классификация
лимфогранулематоза.
Клинические варианты, клиническая
картина лимфогранулематоза в зависимости от стадии процесса.
Диагностические критерии,
возможности консервативного лечения лимфогранулематоза.
Патогенез парапротеинемических
гемобластозов.
Классификация, основные клинические
синдромы, диагностические критерии, лечение миеломной болезни.
Болезнь Вальденстрема: клиника,
диагностика, лечение.
ОТВЕТЫ НА ВОПРОСЫ
Лимфогранулематоз.
Лимфогранулематоз (болезнь Ходжкина,
ходжкинская лимфома) - первичное опухолевое заболевание лимфоидной ткани.
Возникает локально в одном из органов лимфоидной системы, в дальнейшем
происходит диссеминация процесса в другие лимфатические узлы лимфогенно и
внутренние органы гематогенно.
Выделяют четыре гистологических
варианты ЛГМ:
Лимфоидное преобладание
Нодулярный склероз
Смешанный клеточный вариант
Лимфоидное истощение
Обязательным гистологическим
признаком ЛГМ является обнаружение гигантских клеток Березовского-Штернберга.
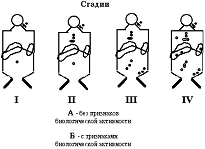
В основе современной
классификации ЛГМ лежит распространенность процесса. Выделяют четыре стадии
процесса (см. рисунок).стадия - локализованная - поражены 1-2 группы
расположенных рядом лимфоузлов.стадия - регионарная - поражены 2-3 несмежные
группы лимфоузлов, но по одну сторону диафрагмы.стадия - генерализованная -
поражение групп лимфоузлов по обе стороны от диафрагмы, селезенка.стадия -
диссеминированная - помимо лимфоузлов поражены внутренние органы - печень,
легкие, плевра и т. д.
Каждая стадия
подразделяется на две подгруппы:
А - отсутствие симптомов
биологической активности.
Б - имеются признаки
биологической активности - лихорадка, кожный зуд, ночные поты, похудание,
лейкоцитоз, измененные острофазовые реакции.
Клинические проявления
ЛГМ многообразны, можно, однако, выделить определенные синдромы.
Основные синдромы:
.Лимфопролиферативный
.Интоксикация
.Лихорадка
.Синдром сдавления
.Кожный зуд
Лимфопролиферативный
синдром является основным в клинике ЛГМ. Примерно у 2/3 больных первым
проявлением заболевания является регионарное увеличение периферических
лимфоузлов, чаще шейных или надключичных. Увеличение может быть значительным,
узлы плотные, спаяны в пакеты между собой, с кожей не спаяны, как правило,
безболезненны, вначале подвижны, а затем по мере роста подвижность их
уменьшается. Нередко рентгенологически выявляется увеличение узлов средостения,
что сочетается иногда с признаками сдавления органов средостения. Более или
менее характерным признаком ЛГМ является лихорадка неправильного типа или
волнообразная. Кожный зуд у больных ЛГМ встречается нечасто, но симптом имеет
большое диагностическое значение, поскольку не сопровождается каким-либо
кожными проявлениями. Признаками интоксикации является ухудшение общего
состояния, ночные поты.
В гемограмме отмечаются
ускорение СОЭ, лейкоцитоз, лимфоцитопения, реже эозинофилия. В протеинограмме
выявляется увеличение a-глобулинов, повышается содержание фибриногена, других
показателей "острой фазы".
Решающим методом
диагностики является биопсия пораженных лимфоузлов и их гистологическое
исследование. Диагноз считается достоверным при обнаружении в биоптатах клеток
Березовского-Штернберга. Одновременно устанавливается гистологический вариант
ЛГМ, что имеет определенное значение для прогноза и выбора метода терапии.

Важнейшим этапом
обследования больного является установление стадии процесса, т. е. оценка
распространенности опухоли. При разработке современной классификации ЛГМ
предложена также унификация диагностических исследований при болезни Ходжкина.
Выделены 4 категории
диагностических процедур:
) обязательные во всех
случаях;
) зависящие от
обнаруженных данных при обязательном обследовании;
) необязательные, но полезные
в качестве дополнительных тестов;
) необходимые только при
определенных клинических ситуациях.
К I категории отнесены
рентгенотомография легких и средостения, прямая контрастная нижняя лимфография;
ко II - рентгенологические и радионуклидные исследования органов с клиническими
признаками поражения. Были приняты также дополнительные рекомендации по
"долечебному" обследованию, которое включает рентгенологическое
исследование грудной клетки и средостения, компьютерную томографию легких, средостения,
а также такие методы как диагностическая и лечебная лапаротомия со
спленэктомией. Основная задача этого исследования - установление поражения
поддиафрагмальных (мезентериальных) лимфоузлов и констатация, таким образом,
III стадии ЛГМ. Одновременно с диагностической целью выполняется спленэктомия,
один из наиболее вероятных и обширных "опухолевых регионов". В
последние годы это исследование в какой-то мере заменяется лапароскопией с
биопсией лимфоузлов брюшной полости.
Общая схема лечения ЛГМ:
IА стадия - радикальная лучевая терапия; IБ, II, III стадии - комбинированная
терапия - полихимиотерапия, лучевая терапия; IV стадия - полихимиотерапия,
лучевая терапия по показаниям (синдром сдавливания).
Основной целью лечения
больных с I-III стадиями является радикальная терапия и излечение, при IV
стадии сдерживающая терапия, поддержание длительной ремиссии.
У больных IA стадией
процесса проводится радикальная лучевая терапия, при которой облучаются
пораженные лимфоузлы и регионы вероятного распространения процесса.
У больных IБ, II и III
стадиями ЛГМ применяют комбинированное лечение - полихимиотерапию и облучение.
Полихимиотерапия проводится комбинациями различных цитостатических препаратов,
например, схема МОПП - эмбихин (мустарген), винкристин (онковин), натулан (прокарбазин),
преднизолон.
При IV стадии проводится
обычно полихимиотерапия, лучевая терапия назначается по специальным показаниям,
например, при синдроме сдавления.
У больных с
изолированным поражением органов показано хирургическое лечение.
Парапротеинемические
гемобластозы.
Парапротеинемические
гемобластозы - особая группа опухолей лимфатической системы, при которых
опухолевые клетки (лимфоциты или плазматические) синтезируют иммуноглобулин.
Поскольку эти лейкозы, как и другие, возникают из одной первоначально
измененной клетки, вся масса опухолевых клеток производит какой-то один
иммуноглобулин, который, даже оставаясь нормальным, оказывается для организма в
целом бесполезным или вредным из-за своей крайней избыточности. Как правило,
синтез остальных иммуноглобулинов снижен; постепенно нарастает иммунологическая
несостоятельность организма. К парапротеинемическим гемобластозам относятся
миеломная болезнь, макроглобулинемия Вальденстрема, болезнь тяжелых цепей. Эти
лейкозы своим клеточным субстратом имеют преимущественно зрелые элементы -
плазмоциты, лимфоциты, поэтому должны относиться к группе хронических лейкозов.
Кроме того, способностью к синтезу однотипного, моноклонового (т. е.
производимого клетками, происходящими из одной первоначально измененной клетки)
иммуноглобулина обладают следующие опухоли кроветворной системы: острый
плазмобластный лейкоз, редкие формы лимфосарком и редкие формы зрелоклеточных
лимфатических внекостномозговых опухолей - лимфоцитом.
Миеломная болезнь.
Миеломная болезнь -
плазмоцитома опухоль системы В-лимфоцитов, которые дифференцируются до
плазматических клеток, вырабатывающих иммуноглобулины. В основе развития
основных клинических и лабораторных признаков, осложнений миеломной болезни
лежат миеломно-клеточная инфильтрация костного мозга и синтез опухолевыми
клетками парапротеина. Кроме того, у больных снижается синтез нормальных
иммуноглобулинов.
Классификация миеломной
болезни:
.Солитарная
костная;
внекостная;
.Множественная
множественно-узловая;
диффузная;
диффузноузловая.
Чаще всего встречается
диффузно-узловая форма, когда имеются отдельные опухолевые узлы и обсеменение
опухолевыми клетками костного мозга. При множественно-узловой форме есть
большое количество узлов, но нет инфильтрации костного мозга. Диффузная форма
характеризуется инфильтрацией костного мозга, печени, селезенки, лимфоузлов.
Солитарные (единичные) миеломы могут развиваться в костях или вне костной
системы, может наблюдаться генерализация патологического процесса.
В клинической картине МБ
можно выделить ряд синдромов:
костный;
белковой патологии;
почечный;
гематологический.
Костный синдром
обусловлен пролиферацией миеломных клеток в костях, чаще всего в плоских -
кости черепа, грудина, а также ребра, позвоночник. Больные жалуются на боли в
костях, при пальпации обнаруживаются костные опухоли, часто возникают переломы.
Рентгенологически у большинства больных с диффузно-узловой и
множественно-узловой миеломой выявляются остеопороз и деструктивные изменения.
Особенно характерны остеолитические круглые очаги в костях черепа. В крови
наблюдается гиперкальциемия.
Инфильтрация миеломными
клетками костного мозга приводит к угнетению нормального кроветворения,
развитию анемии, тромбоцитопении, лейкопении с соответствующими клиническими
проявлениями. У части больных повышается содержание плазматических клеток в
периферической крови. В костном мозге определяется инфильтрация миеломными
клетками.
Почечный синдром
проявляется протеинурией, появлением в моче парапротеина (белка Бенс-Джонса),
большого количества цилиндров - гиалиновых и зернистых. Закономерно развивается
хроническая почечная недостаточность.
Диагноз МБ ставится на
основании ряда диагностических критериев:
. Остеолитические очаги
(череп).
. Обнаружение парапротеинов
в сыворотке крови и моче.
. Наличие миеломных
клеток в костном мозге.
Лечение зависит от формы
миеломной болезни. При множественной миеломе назначается один из
цитостатических препаратов - сарколизин, циклофосфан, натулан, алкеран - в
сочетании с преднизолоном. Проводятся повторные сеансы плазмофереза с целью
элиминации парапротеинов. При признаках сдавления опухолевыми узлами органов
применяется рентгенотерапия.
Больным солитарной
миеломой назначается рентгенотерапия, при генерализации процесса проводится
лечение цитостатическими средствами и глюкокортикоидами.
Лечение обычно начинают
в стационаре, назначая цитостатики - циклофосфан или сарколизин вместе с
преднизолоном и метандростеналолом (неробол) или ретаболилом. Сарколизин
назначают по 10 мг/сут через день или ежедневно, по 200-300 мг. на курс. В
течение всего курса дают преднизолон - 10-20 мг/сут, ретаболил по 50 мг в/в 1
раз в неделю (или неробол по 10-15 мг. ежедневно). После завершения курса
переходят к поддерживающей терапии сарколизином по 10 мг. 1 раз в 5-10 дней.
При почечной недостаточности сарколизин становится крайне опасным, так как он
выводится почками, и нарушение его выведения ведет к резкому повышению
концентрации цитостатика в крови с развитием глубокой панцитопении. Вместо сарколизина
можно использовать циклофосфан по 400 мг. через день внутрь, в/в или в/м (на
курс 8-10 г). В течение всего курса преднизолон и неробол (или ретаболил) дают
в той же дозе, что и в курсе с сарколизином. После окончания курса проводят
поддерживающую терапию (по 400 мг. циклофосфана в день 1 раз в 5-10 дней).
Макроглобулинемия
Вальденстрема.
Макроглобулинемия
Вальденстрема представляет собой костномозговую опухоль, состоящую из
лимфоцитов или лимфоцитов и плазмоцитов и характеризующуюся высокой продукцией
моноклонового макроглобулина - IgM. По гематологическим и клиническим
признакам, особенно в начале болезни, процесс мало отличается от хронического
лимфолейкоза. Однако повышенная продукция крупнодисперсного белка ведет к
развитию синдрома повышенной вязкости. Характерны множественные мелкие
тромбозы, тромбоцитопения, геморрагический синдром.
Диагноз устанавливают на
основании лимфоцитоза в крови, костном мозге, изолированного увеличения фракции
IgM на иммуноэлектрофореграмме. Частый, ноне обязательный, симптом - увеличение
лимфатических узлов, селезенки. Повышенная продукция макроглобулина часто
приводит к развитию синдрома повышенной вязкости: резкая слабость, вялость,
загруженность (вплоть до комы), возможны перемежающаяся глухота и парезы.
Лечение. Цитостатическая
терапия хлорбутином, циклофосфаном в тех же дозах, что при хроническом
лимфолейкозе. При синдроме повышенной вязкости - плазмаферез (удаление плазмы с
заменой ее раствором альбумина и плазмозаменителей или нормальной плазмой).
ЛИТЕРАТУРА
ОСНОВНАЯ:
Внутренние болезни под
редакцией Ф. И. Комарова. М., Медицина. 1991 г.
Маколкин В. И.,
Овчаренко В. И. Внутренние болезни. М., Медицина. 1994 г.
Внутренние болезни (в
двух томах) под редакцией А. В. Сумарокова. М., Медицина. 1993 г.
Практические навыки
терапевта под редакцией Г. П. Матвейкова. Минск, Вышэйшая школа. 1993 г.
Машковский М. Д.
Лекарственные средства (в двух томах). М., Медицина. 1993 г.
Окороков А. Н. Лечение
болезней внутренних органов: Практическое руководство: в 3 т. Мн., Выш. шк.,
Белмедкнига. 1995-1996 гг.
ДОПОЛНИТЕЛЬНАЯ:
Руководство по
гематологии (в двух томах) под ред. А. И. Воробьева. М., Медицина 1986 г.
Иванов Е. П. Руководство
по гемостазиологии. Минск: Беларусь. 1991 г.
Файнштейн Ф. Э., Козинец
Г. И., Бахрамов, Хохлова М. П. Болезни системы крови. Ташкент: Медицина. 1987
г.
Окороков А. Н. Лечение
болезней внутренних органов: Практическое руководство: в 3 томах. Т.3- Мн.,
Белмедкнига. 1996 г.