Использование дифракционных методов для анализа структуры, фракционного состава и равновесных взаимодействий биологических макромолекул
ИСПОЛЬЗОВАНИЕ
ДИФРАКЦИОННЫХ МЕТОДОВ ДЛЯ АНАЛИЗА СТРУКТУРЫ, ФРАКЦИОННОГО СОСТАВА И РАВНОВЕСНых
ВЗАИМОДЕЙСТВИй БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ
Введение
Процессы, связанные с обменом
липидов в организмах, относятся к важнейшим метаболическим процессам. Известно,
что различные типы нарушений липидного обмена сопровождаются изменениями
фракционного и субфракционного состава сывороточных липопротеинов (ЛП) крови
[1-13]. Выявлено участие ЛП в механизмах нарушения липидного обмена,
сопровождающих развитие не только атеросклероза, но и целого ряда других
патологий (диабет, гепатит, панкреатит и др.). Поэтому для диагностики и
профилактики заболеваний людей и животных, а также для оценки эффектов лечений
имеется острая необходимость точно и быстро (экспрессно) определять фракционный
состав липопротеинов в сыворотках крови. Авторами работ [16-20] была
разработана новая методика анализа структуры и фракционного состава ЛП на
основе дифракционного метода МУРР. Методика не требует применения дорогостоящих
реактивов и позволяет относительно быстро определять фракционный состав ЛП в
прямой шкале размеров (радиусов) ЛП частиц и в абсолютных единицах концентраций
(мг/дл). В работах [3, 4, 21] было показано, что кровь здоровых людей также
содержит до 40% так называемых модифицированных липопротеинов. В связи с этим
для диагностики дислипопротеинемий (ДЛП) необходимо измерять концентрации не
только общих, но и модифицированных липопротеинов, причем во всех основных
фракциях и подфракциях липопротеинов.
Для препаративного выделения
модифицированных ЛП из сывороток крови используют полиэтиленгликоли (ПЭГ).
Известно, что растворы полиэтиленгликолей способны осаждать из сывороток крови
агрегированные иммунные глобулины и иммунные комплексы [1-6]. При различных
концентрациях ПЭГ происходит преципитация различающихся по молекулярной массе и
размерам иммунных комплексов. Так, например, низкие концентрации ПЭГ (< 3%)
осаждают комплексы крупных размеров, высокие концентрации (> 6%) вызывают
преципитацию и низкомолекулярных соединений, а 3,5% ПЭГ осаждают наиболее
распространенные «промежуточные» комплексы средних размеров.
Дифракционные методы изучения
строения нано-частиц вещества, основанные, в частности, на рентгеновском или
световом рассеянии, позволяют проводить всесторонние исследования макромолекул
в растворе. При рассеянии под малыми углами можно изучать их общее строение, а
под средними и большими - особенности их внутренней структуры [14, 15].
Благодаря этому данные методы получили весьма широкое распространение. Дифракционные
методы дают информацию о структуре и взаимном распределении рассеивающих масс
(неоднородностей электронной или оптической плотности) - информацию, которую
невозможно получить другими (недифракционными) методами. Эти физические методы
анализа позволяют проводить научные исследования внутренней структуры и
дисперсного состава веществ и материалов различных типов: коллоидные растворы и
гели биополимеров (белки, нуклеиновые кислоты, вирусы, клетки), а также взвеси
органических и неорганических частиц. Исследования и анализы дифракционными
методами проводятся с использованием специальных приборов - дифрактометров [14,
15].
Метод малоуглового рентгеновского
рассеяния (МУРР) позволяет непосредственно определять значения структурных
параметров частиц размером от единиц до нескольких тысяч ангстрем. В этот
диапазон, как известно, попадают все белки, нуклеиновые кислоты,
нуклеопротеиды, липопротеиды и другие макромолекулярные комплексы, а также
малые и средние вирусы. С использованием метода МУРР могут быть получены такие
важные характеристики биополимеров, как молекулярный вес, размеры, объём, форма
частиц, дисперсный состав (распределение по размерам) и целый ряд других
параметров [14].
Метод светорассеяния (СР) отличается
высочайшей чувствительностью, а применение более длинноволнового излучения (по
сравнению с МУРР; отличие может составлять тысячи раз) позволяет определять
структурно-дисперсные характеристики рассеивающих частиц размером от 40 нм до
нескольких микрон и более [15]. Кроме того, существуют и чисто физические
отличия в механизмах взаимодействия излучений с веществом анализируемых частиц:
рассеяние в МУРР происходит на неоднородностях электронной плотности, а в СР -
на неоднородностях оптической плотности, отличающихся показателями преломления.
Поэтому эти два дифракционных метода хорошо дополняют друг друга [14, 15].
Целью настоящей дипломной работы
является изучение равновесных и неравновесных молекулярных взаимодействий
биологических макромолекул (сывороточных белков крови) с полиэтиленгликолями различной
молекулярной массы, включающее следующие задачи:
1. Освоение двух дифракционных
методов анализа (МУРР и СР) и новых методик анализа сывороточных белков крови,
в частности, липопротеинов (общих и модифицированных).
2. Исследование эффектов
молекулярных взаимодействий белков сывороток крови с различными
полиэтиленгликолями в допреципитационных и преципитационных стадиях.
. Математический и
статистический анализ полученных экспериментальных данных.
. Выбор «оптимального»
полиэтиленгликоля (определенной молекулярной массы) и определение его
оптимальной концентрации для препаративного выделения и анализа
модифицированных липопротеинов.
1. Обзор литературы
.1 Физико-химические
свойства полиэтиленгликолей
полиэтиленгликоль
липопротеин кровь сывороточный
Полиэтиленгликоли - полимеры окиси
этилена, используются в качестве растворителей, эмульгаторов, связывающих
элементов, загустителей, структурообразующих компонентов [22]. Их общая
химическая формула: НО - [СН2СН2О -] n. Как правило, ПЭГ
синтезируют с молекулярными массами от 150 до 40000 Да. При молекулярных массах
менее 400 Да ПЭГ находятся в жидкой фазе, а при больших - в порошкообразном
состоянии. ПЭГ в растворе способен связываться с протеином различными
способами, но существуют преобладающие, например, наиболее часто связывание с
белком происходит в азот-содержащих местах или в областях структуры белков,
содержащих имидазольную группу гистидина. Кроме того, химические связи ПЭГ с
лизином и аргинином, например, препятствуют расщеплению модифицированных
молекул трипсином. Одно из важнейших свойств ПЭГ - их высокая гидрофильность
[22]. Высокое содержание атомов водорода в молекуле ПЭГ создает водородные
связи с молекулами воды, что влечет за собой образование «водного облака»
вокруг комплексов «ПЭГ - белок». За счет этого значительно повышается их
гидродинамический радиус.
1.2 Сывороточные белки
крови, их классификация и функции
Сыворотки крови состоят из сложной
смеси белков с разной структурой и функциями [5]. Разделение на фракции белков
методом электрофореза (ЭФ) основано на различной подвижности белков в
разделяющей среде под действием электрического поля. Обычно методом ЭФ выделяют
5-6 основных стандартных фракций сывороточных белков: альбумины и 4-5 типов
глобулинов (альфа-1 (2), бета-1 (2), и гамма-глобулины.
Фракция альфа-глобулинов
включает в себя острофазные белки: альфа1-антитрипсин - ингибитор
многих протеолитических ферментов - трипсина, химотрипсина, плазмина. Они
обладают широким спектром защитных функций. К альфа-глобулинам также относятся
транспортные белки (тироксинсвязывающий глобулин, транкортин, альфа -
липопротеины). Их функции: связывание и транспорт кортизола, тироксина и
обратный транспорт липидов, соответственно.
Фракция бета-глобулинов содержит трансферрин (белок-переносчик железа), гемопексин
(связывает гем, что предотвращает его выведение почками и потерю железа),
компоненты комплемента (участвующие в реакциях иммунитета), бета-липопротеины
(участвуют в прямом транспорте холестерина и фосфолипидов) и часть
иммуноглобулинов.
Фракция гамма-глобулинов состоит из иммуноглобулинов: IgG, IgA, IgM, IgE. Функционально
эти макромолекулы представляющих собой антитела, обеспечивающие гуморальную
иммунную защиту организма от инфекций и чужеродных веществ. Гамма-глобулины
используются в качестве препаратов для профилактики и лечения, главным образом,
инфекционных заболеваний. Препараты из них называют также иммуноглобулинами.
Гамма-глобулины оказывают губительное действие на вирусы, бактерии, спирохеты и
простейшие. Этим определяется их важная роль в предупреждении и лечении ряда
инфекционных заболеваний. При введении гамма-глобулинов искусственно создается
состояние так называемого пассивного иммунитета. Обычно их получают из крови
людей, переболевших определенным заболеванием, или из крови животных, которым
специально вводили соответствующие вакцины. Как правило, гамма-глобулины
образуются (синтезируются) на второй неделе после начала иммунизации или
болезни.
При многих заболеваниях встречается
нарушение «нормального» соотношения концентраций фракций белков плазмы крови
(диспротеинемии). Диспротеинемии при наблюдении в динамике могут
характеризовать стадию заболевания, его длительность, а также эффективность
проводимых лечебных мероприятий.
1.3 Общие и
модифицированные ЛП
Известно, что поступление и вывод из
организма липидов осуществляется с участием липопротеинов (ЛП) крови - сложных
белков, транспортирующих липиды к органам тела и от них в печень [4-6]. В
настоящее время огромен интерес к изучению структуры и функции ЛП крови, а
также к их роли в развитии ряда патологических состояний (дислипопротеинемий
(ДЛП)), таких, как инфаркты, инсульты, артериальная гипертензия, диабет и
многих других. Сегодня ЛП привлекают внимание ученых и медиков-практиков и как
транспортная форма, которая осуществляет перенос не только липидов, но и
витаминов, гормонов, различных ксенобиотиков [1-6].
Липопротеины - это очень
гетерогенный класс соединений [4-6]. Различают 4 основных фракции ЛП крови,
отличающиеся друг от друга соотношением белкового и липидных компонентов,
средней плотностью и размером частиц: хиломикроны (ХМ), липопротеины очень
низкой (ЛПОНП), низкой (ЛПНП) и высокой плотности (ЛПВП). Сывороточные
липопротеины крови представляют собой компактные мицеллообразные структуры -
комплексы с гидрофобным ядром из триглицеридов (ТГ) и этирифицированного
холестерина (ЭХС) и с гидрофильной оболочкой из аполипопротеинов (апол-белки),
фосфолипидов (ФЛ) и свободного (неэтирифицированного) холестерина (НЭХС) [4,
20]. Причем гидрофильная оболочка у ЛП всех классов имеет практически
одинаковую толщину, близкую к 22 А, а размеры гидрофобного ядра варьируют в
широких пределах [16-20]. Также известно, что липопротеины крови имеют
строение, сходное с жидкими кристаллами, но при этом образующие их
компоненты (БК, ТГ, ФЛ, ЭХС и НЭХС) связаны друг с другом нековалентно [6].
Модифицированные ЛП образуются в
организме из нормально синтезированных и секретированных в кровь ЛП. Причиной
модификации обычно является появление свободных радикалов, продуктов
перекисного окисления липидов (ПОЛ), а также некоторых метаболитов [3, 4].
Таким образом, к модифицорованным in vivo ЛП относятся перекисно-модифицированные и гликозилированные ЛП,
аутоиммунные комплексы ЛП-антитело и агрегированные ЛП.
В настоящее время для анализа ЛП
крови и диагностики нарушений липидного обмена применяют ряд физических и
химических методов (ультрацентрифугирование, ЭФ и др.) [6]. В работах [16-20]
был предложен новый подход к анализу фракционно-компонентного состава
сывороточных ЛП крови с использованием метода МУРР. Кроме того, авторами была
предложена единая математическая модель строения частиц сывороточных ЛП крови
человека. Полученные в данных работах [19, 20] результаты свидетельствуют об
эффективности применения метода МУРР для определения фракционно-компонентного
состава общих и модифицированных ЛП непосредственно в цельных плазмах или
сыворотках крови. Новая методика анализа ЛП в сыворотках крови отличается
экспрессностью (0.5 ч на анализ), простотой подготовки образцов для анализов,
использованием всего одного вспомогательного реактива (вещества-контрастера
типа сахарозы), высокой точностью и разрешением вплоть до отдельных субфракций.
Аутоиммунные комплексы
липопротеид-антитело
О наличии циркулирующих в крови
иммунных комплексов, содержащих ЛП в качестве антигена, известно давно, однако
долгое время оставалось неясным, имеют ли эти комплексы какое-либо отношение к
атеросклерозу [3]. Образование циркулирующих в крови иммунных комплексов (ЦИК)
«модифицированный ЛП - антитело» можно рассматривать как проявление защитной
реакции организма, направленной на быстрое удаление из кровотока
модифицированных (т.е. ставших чужеродными) ЛП. Это происходит путем активного
захвата иммунных комплексов купферовскими клетками печени [3, 4].
Перекисно-модифицированные
ЛП
Из всех классов ЛП перекисное
окисление липидов (ПОЛ) затрагивает в первую очередь именно ЛПНП [3, 4]. Легкая
подверженность ЛПНП пероксидации, очевидно, объясняется особенностями их
липидного состава. Основными антиоксидантами этих ЛП являются: α-токоферол, γ-токоферол, β-каротин и убихонон-10.
ПОЛ в частицах ЛПНП - сложный многоступенчатый и еще не до конца выясненный
процесс. Постоянно возникающие в живом организме свободные радикалы O2-, HO2* и НО*
генерируют образование гидроперекисей ненасыщенных ЖК, входящих в состав ФЛ, ТГ
и ЭХС липопротеидов низкой плотности. В окисленных ЛПНП обнаружены в повышенных
количествах 7-кето-холестерин, 7α- и 7 β-гидроксихолестерины. Перекисной модификации подвергаются также
подфракции ЛПОНП, что, несомненно, повышает их атерогенность [4].
Отдельно следует сказать о
перекисной модификации фракции ЛПВП. В опытах in vitro изолированные ЛПВП
также подвергаются окислению, причем при равных концентрациях холестерина в
пробе степень окисления ЛПВП и ЛПНП оказалась практически одинаковой. В
частицах ЛПВП окислению подвергаются ненасыщенные ЖК фосфолипидов и эфиров
холестерина, а также стероидное ядро и боковая цепь ХС. Кроме того, образование
продуктов ПОЛ часто ведет к повреждению апобелков ЛПВП. В первую очередь
повреждаются остатки триптофана, а затем уже тирозина и лизина. Это ведет к
изменению функциональных свойств ЛПВП и, прежде всего, к ослаблению
холестерин-акцепторной функции.
Гликозилированно-модифицированные
ЛП
Гликозилирование - весьма
распространенный тип модификации белков, в ходе которой происходит
неферментативное ковалентное присоединение моносахаридов (преимущественно
глюкозы) к аминогруппам белков [5]. Гликозилированию подвергаются все классы
ЛП, но по объему наибольшая доля падает на ЛПНП и ЛПВП. Гликозилирование ЛП
имеет место и в норме, но особенно активно оно протекает у лиц с повышенным
уровнем глюкозы в крови, в частности у диабетиков. Так, если в норме у человека
гликозилировано 1,3-2% лизиновых остатков ЛПНП, то у диабетиков эта величина
возрастает в 2-3 раза.
Следует особо отметить еще один
важный фактор: в ответ на появление в крови гликозилированных ЛП может
развиться аутоиммунный ответ с образованием антител на эти ЛП. Было показано
[6], что если кроличьи ЛПНП подвергнуть гликозилированию in vitro (блокирование глюкозой
12% e-аминогрупп) и затем вернуть их тому же кролику внутривенно, то в
ответ на введение аутологичных гликозилированных ЛПНП образуются антитела.
1.4 Методы рентгеновской
и оптической дифракции
Рассеяние плоской волны
веществом
Пусть плоская монохроматическая
волна A0exp(ik0r) падает на рассеивающий
центр О, который под действием излучения становится источником
сферической волны (рис. 1). Тогда в точке наблюдения L, результирующая волна имеет вид
[14].
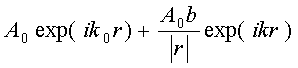 (2.1)
(2.1)
Здесь k0 и k - волновые векторы
падающей и рассеянной волн, |k0|
= |k|= 2π/λ, λ - длина волны, А0
и А0b/|r| - амплитуды этих волн, r - вектор, соединяющий точку L с рассеивающим центром в точке О. Амплитуда рассеянной сферической
волны равна произведению амплитуды падающей волны и коэффициента b/|r|, где значение b определяется
видом падающего излучения и природой рассеивающего центра, находящегося в точке
О. Чем сильнее взаимодействие падающей волны с центром О, тем
больше коэффициент b.
Он имеет размерность длины и носит название длины рассеяния, или
амплитуды рассеяния точечного центра. Рассеяние плоской монохроматической волны
на реальных объектах, состоящих из совокупности ядер и электронов, можно
рассматривать как точечные рассеивающие центры.
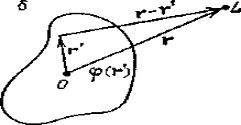
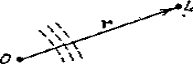
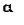
Рис. 1. Рассеяние
плоской волны точечным центром (а) и ограниченной областью, задаваемой
потенциалом φ(r') (б)
Рассеивающую способность
произвольного скопления ядер, электронов при облучении их рентгеновскими лучами
или светом можно характеризовать рассеивающей плотностью φ(r) - скалярным полем, заданным в ограниченной области пространства.
Для рентгеновского рассеяния φ(r) - плотность распределения
заряда, в случае света - это оптическая плотность вещества, зависящая от
показателя преломления. Взаимодействие волны (рентгеновского излучения или
света) с веществом можно представить себе таким образом, что волна
электромагнитного излучения взаимодействует со всеми ядрами, электронами и
валентными оболочками, которые становятся источниками сферических волн.
Суперпозиция этих волн представляет собой первое приближение к реальному
рассеянию. Можно показать, что функция
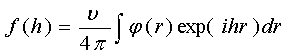 (2.2)
(2.2)
является амплитудой
упругого рассеяния на скалярном поле φ(r). Это - так называемое первое борновское приближение, иными
словами - приближение однократного рассеяния.
Выражение (2.2)
представляет собой интеграл Фурье, т.е. разложение функции f(h) по базисной системе ортогональных функций - экспоненциальных
функций exp(ihr).
Решение обратной задачи - нахождения φ(r) при известной функции f(h) - дается обратным преобразованием [14]
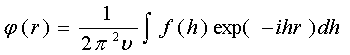 (2.3)
(2.3)
Таким образом,
преобразования Фурье лежат в основе расчетов амплитуд рассеяния по заданной
системе рассеивающих центров и плотности поля рассеяния по заданной амплитуде
рассеяния, если, разумеется, выполнены условия первого борновского приближения.
При определении атомной и молекулярной структуры вещества стараются всегда так
поставить эксперимент, чтобы это приближение (и тем самым взаимные интегральные
фурье-преобразования (2.2) и (2.3) для амплитуды и плотности рассеяния)
выполнялось. Экспериментально определяется не сама амплитуда рассеяния, а
интенсивность I(h), пропорциональная квадрату амплитуды рассеяния:
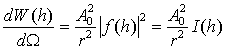 (2.4)
(2.4)
Ω -
телесный угол). Функция I(s) называется интенсивностью рассеяния (название, принятое в
рентгеноструктурном анализе и в светорассеянии). Видно, что размерность этой
функции - квадрат длины. Важной характеристикой объекта является полная
интенсивность (или полное сечение) рассеяния, которая дается интегрированием
(2.4) по всем углам:
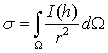 (2.5)
(2.5)
Главной задачей
структурного анализа вещества является восстановление распределения
рассеивающей плотности φ(r) по измеренной функции I(h) [14, 15].
Формула Гинье.
Угловое разрешение
С точностью до h4 имеем разложение интенсивности I(h) в близи точки h
= 0 [14, 15]:
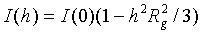 (2.6)
(2.6)
Выражение в скобках в
правой части (2.6) можно рассматривать как первые два члена разложения в ряд
Маклорена функции ехр(-h2R2g/3). Поэтому
с точностью до членов, пропорциональных h4,
для начальной части кривой рассеяния можно записать
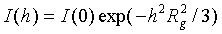 (2.7)
(2.7)
Это - так называемая
формула Гинье, выведенная им еще в 1939 г. [14]. Для установления связи
параметров I(0) и Rg со строением частицы подставим разложение:
sin(hr)/hr = 1 - h2r2/6
+ h4r4/120
- h6r6/5040
+…
в формулу Дебая [14]:
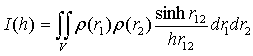
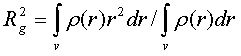 .
.
Это - известное
выражение для радиуса инерции частицы относительно ее центра массы.
Таким образом, начальная
часть кривой рассеяния вне зависимости от конкретного строения частицы
описывается с помощью двух параметров: I(0),
который характеризует общее количество рассеивающей материи, и Rg, который несет информацию о ее
распределении относительно центра массы частицы [14, 15].
Цель дифракционного
эксперимента - это измерение интенсивности рассеяния I(h) при определенных величинах модуля вектора рассеяния h = 4 ∙ π ∙ n ∙ (sin θ)/λ, где n - показатель
преломления окружающей частицу среды [14, 15]. Для исследования структуры
частиц или вообще каких-либо неоднородностей плотности определенного масштаба
нужно иметь возможность вести измерения рассеянного излучения в определенном
интервале значений шкалы h,
А-1. Для дисперсных систем с более крупными размерами частиц надо
использовать меньшие значения h
и наоборот. Поэтому измерения рассеянного излучения необходимо проводить при
таких углах рассеяния 2θ, при которых реально используемые длины волн (λ)
излучения не могут существенно превышать межплоскостные
расстояния: для рентгеновского излучения это 1 ÷ 2 А
[14].
Формирование весьма
узкого пучка первичного излучения, падающего на образец, достигается
коллимационной системой первичного монохроматического пучка (рис. 2).
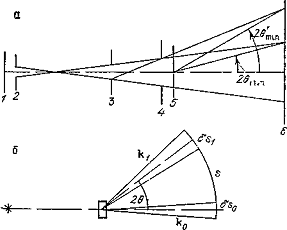 иc. 2. Схема формирования первичного и рассеянного излучения при
малых углах рассеяния в прямом (а) и обратном (б) пространствах: 1 -
источник излучения; 2, 3, 4 - круглые отверстия коллиматора; 5 -
образец; 6 - плоскость приемника излучения
иc. 2. Схема формирования первичного и рассеянного излучения при
малых углах рассеяния в прямом (а) и обратном (б) пространствах: 1 -
источник излучения; 2, 3, 4 - круглые отверстия коллиматора; 5 -
образец; 6 - плоскость приемника излучения
Система двух круговых
диафрагм малого размера, разнесенных на большое расстояние (по сравнению с
размером отверстий), позволяет приблизиться к условиям плоской волны. Величина
проекции первичного пучка в плоскости приемника, а в сочетании с выбранным
расстоянием от образца до детектора и тот наименьший угол 2θmin (соответственно hmin),
начиная с которого ведутся измерения интенсивности рассеянного излучения, и
определяют разрешение конкретной коллимационной системы. Таким образом, верхний
предел размеров неоднородностей, которые могут быть исследованы на данных
установках (дифрактометрах), определяется углом 2θmin, а нижний предел разрешения всегда соответствует величине 2θ
= 180о [14, 15].
2. Описание
экспериментов
.1 Измерение рентгенограмм
рассеяния от анализируемых образцов
Измерения малоугловых рентгенограмм
проводили на дифрактометре фирмы Siemens (Германия) методом пошагового
сканирования с использованием гониометра и рентгеновского сцинтилляционного
детектора [14]. Малоугловые рентгенограммы измеряли в угловом диапазоне: h = 0.013 - 0.22 А-1, где h = 4 ∙ π ∙ sin(Θ)/λ; 2Θ - угол рассеяния. Для измерения рентгеновского рассеяния
использовалась кювета из кварцевого капилляра диаметром 0.65 мм и с толщиной
стенок 0.01 мм, установленная в металлическую оправу. Длина волны используемого
излучения λ = 1.54 А, температура образцов при измерении рентгенограмм 20оС.
Непосредственное измерение рентгенограмм МУРР проведено в.н.с. ГНЦ ВБ «Вектор»
Тузиковым Ф.В., имеющим соответствующие допуски работы с рентгеновским
оборудованием. В рентгенограммы вносились поправки на фоновое рассеяние,
поглощение, коллимацию, проводилось сглаживание. Первичная математическая
обработка экспериментальных данных МУРР и вычисление функций распределения сферических
частиц по размерам выполнялись на ЭВМ PC по алгоритмам, описанным в [14], а
также с использованием процедур оптимизации.
На рис. 3 приведена общая схема
дифрактометров, в частности, малоуглового дифрактометра.
Рис. 3. Общая схема дифрактометров.
1 - источник излучения (рентгеновская трубка, лазерный источник) с
коллиматором; 2 - анализируемый образец; 3 - падающий пучок излучения; 4 -
рассеянное рентгеновское или световое излучение, вызванное образцом 2; 5 -
приемная щель; 6 - рентгеновский или световой детектор (приёмник рассеянного
излучения)
Чтобы исключить рассеяние
рентгеновских лучей другими (кроме ЛП) белками крови, в анализируемые образцы
плазмы предварительно вводили нейтральное (для структуры биополимеров)
рентгеноконтрастное вещество - NaNO3, создавая плотность, равную
средней плотности гидратированных белков. Плотность растворителей в образцах
обеспечивали с помощью формулы [16-20]: m = V ∙ (ρ0 - ρс) ∙ ρк/(ρк - ρ0), где V, ρ0 - объем и требуемая конечная плотность растворителя в образце (в
сыворотке, плазме и контрольном буфере); ρс - исходная плотность
жидкого образца; m, ρк - масса и плотность
используемого сухого вещества-контрастера. Плотность растворителей
контролировали пикнометрически. В сыворотках крови учитывали их разбавление за
счет объема вещества сухого контрастера и вводили соответствующие поправки на
концентрацию.
2.2 Измерение
индикатрисс светорассеяния
Прибор для измерения светорассеяния
от анализируемых образцов (световой дифрактометр) состоял из одного фотодетектора
и 14 лазерных монохроматических источников, установленных по внутреннему
периметру камеры светорассеяния. В центр камеры помещали образец, а управление
установкой и получение значений интенсивности производили при помощи
компьютера. При этом поочередно включались лазерные источники и рассеянное
излучение попадало в фотоприемник (детектор), после чего сигнал с приемника
поступал на фотоэлектронный умножитель, откуда через аналоговый цифровой
преобразователь передавался на компьютер. Индикатриссы светорассеяния измеряли
в угловом диапазоне 2Θ = 33,75 ÷ 67,50 (h = 0.0011 ÷ 0.0022 А-1),
где h = 4 ∙ π ∙ n · sin(Θ)/λ; n - показатель преломления буферной смеси (~1,35). Длина волны
используемого светового излучения λ = 4300 А, температура образцов при измерении индикатрисс 200С.
В индикатриссы вносили поправки на фоновое рассеяние и поглощение излучения
образцом.
Калибровку прибора
проводили для контроля влияния факторов, влияющих на точность измерений
эффектов светорассеяния (состояние чистоты кюветы, аппаратные искажения и
помехи). Для этого регулярно измерялись индикатриссы рассеяния (зависимости
интенсивности рассеяния от угла) для стандартного образца (Daw Latex,
Sigma, полистерин, диаметр частиц 2R
= 0,234 мкм). Известно, что радиус инерции (Rg)
и радиус (R) для однородной сферы связаны, как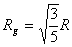 [14].
[14].
Для всех полученных в
работе экспериментальных данных был проведен математический и статистический
анализ. Статистическую обработку результатов проводили методом вариационной
статистики с применением t-критерия
Стьюдента для средних арифметических (результаты считали достоверными при Р
< 0,05).
2.3 Титрование сывороток
крови полиэтиленгликолями
Для титрования и анализа
модифицированных ЛП методом МУРР предварительно в сыворотки и плазмы крови
добавляли растворы ПЭГ до необходимой концентрации, после чего эти смеси
инкубировали при 8оС в течение 18 ч [1, 2]. Осадки отделяли
центрифугированием (центрифуга Т-51, Германия) при 6000 об/мин в течение 30
мин. Для растворения осажденных иммунных комплексов к осадку добавляли
физиологический раствор (pH
7,4) в объеме исходной сыворотки [3]. Окончательную диссоциацию иммунных
комплексов, включающих и модифицированные ЛП, проводили путем добавления сухого
NaNO3, используемого в качестве контрастера.
При титровании сывороток
крови ПЭГ методом светорассеяния пластмассовую или стеклянную цилиндрическую
кювету заполняли буферной смесью (физиологический раствор, 750 мкл, pH 7,4). Далее добавляли 100 мкл сыворотки и тщательно перемешивали,
после чего производили титрование растворами ПЭГ по 5 или 10 мкл вплоть до
достижения запланированных конечных концентраций. При каждой концентрации ПЭГ
производили измерение интенсивностей рассеянного света (по четырем точкам углов
рассеяния). Из полученных данных с использованием специальной программы
вычислялись средние значения радиусов инерции (Rg)
образованных комплексов «ПЭГ - белки», а также значения интенсивностей
светорассеяния в нулевом угле (I(0))
[14, 15].
3. Результаты
.1 Экспериментальные
данные по светорассеянию
На рис. 4 приведена индикатрисса
светорассеяния от стандартного образца в координатах Гинье (ln I(h), h2). Видно, что точки индикатриссы рассеяния хорошо соответствуют
линейному графику и высокой монодисперсности частиц латекса. Значение радиуса
инерции (Rg = 912 ± 15 А), вычисленное из наклона этого графика оказалось
близко к ожидаемому (Rg = 906 А) для данного стандартного образца (частицы
стандартизованного латекса - однородные сферы).
Для изучения особенностей
взаимодействия различных ПЭГ с белками сывороток крови нами были выбраны ПЭГ с
молекулярными массами от 1000 до 20000 Да. Были приготовлены растворы ПЭГ в
физрастворе с максимальными концентрациями (с учетом их растворимости). Для
удобства экспериментов необходимо было привести все ПЭГ к одной объемной
концентрации. Для этого измеряли индикатриссы светорассеяния от каждого из
приготовленных исходных растворов ПЭГ. Как и следовало ожидать, для частиц в
растворе с молекулярными массами от 1 до 20 кДа индикатриссы светорассеяния
практически не отличались от констант (из-за соотношения длины волны света
(4300 А) и размера молекул ПЭГ (20-100 А)). Поскольку известно, что 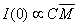 ,
где С, М - концентрация и средняя молекулярная масса рассеивающих частиц,
соответственно, то это позволяет определять необходимые коэффициенты разведения
[15]. На рис. 5 приведены графические зависимости экспериментальных
интенсивностей светорассеяния в нулевой угол (I(0))
до и после приведения их к одной концентрации.
,
где С, М - концентрация и средняя молекулярная масса рассеивающих частиц,
соответственно, то это позволяет определять необходимые коэффициенты разведения
[15]. На рис. 5 приведены графические зависимости экспериментальных
интенсивностей светорассеяния в нулевой угол (I(0))
до и после приведения их к одной концентрации.
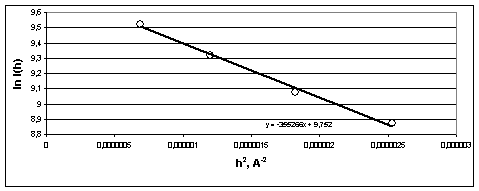
Рис. 4. График Гинье для
стандартного образца (Daw Latex, Sigma, полистерин,
диаметр частиц 2R = 0,234 мкм). 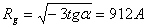 .
.
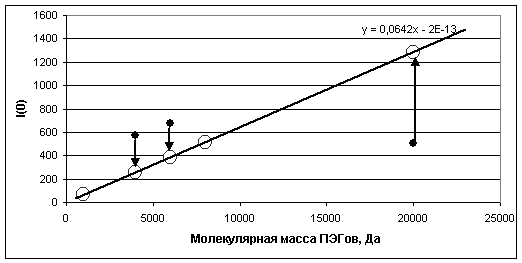
Рис. 5. Зависимость
интенсивностей светорассеяния в нулевом угле (I(0))
для различных ПЭГ в исходном (черные точки) и приведенном состоянии
концентраций (светлые кружочки).
(кроме ПЭГ-20000, у
которого предельная концентрация разведения оказалась существенно ниже, чем у
других ПЭГ). Таким образом, все концентрации используемых ПЭГ были приведены к
концентрации 250 мг/мл, что соответствует примерно 25% объемной и весовой
концентрации.
Таблица 1. Результаты
титрования объединенной сыворотки ПЭГ-6000. Объем исходного буфера V = 750 мкл (метод светорассеяния)
|
Угол светорассея- ния 2θ, град
|
Объемы компонентов смесей, мкл
|
|
Сыворотка
|
ПЭГ-6000
|
|
+100
|
+5
|
+10
|
+15
|
+20
|
+25
|
+30
|
+35
|
+40
|
+45
|
|
Интенсивности светорассеяния, имп/сек
|
|
33,75
|
10841
|
14712
|
16972
|
19996
|
21939
|
25727
|
30153
|
37964
|
42101
|
65158
|
|
45,00
|
9300
|
12149
|
14126
|
16438
|
17703
|
20830
|
24579
|
29853
|
43190
|
53074
|
|
56,25
|
7182
|
8050
|
8644
|
8776
|
9840
|
10928
|
13082
|
15125
|
25112
|
|
67,50
|
6668
|
7064
|
7228
|
7645
|
7670
|
8469
|
9366
|
10832
|
14455
|
20243
|
|
Средние значения параметров
|
|
I(0),
имп/с
|
12812
|
19336
|
23837
|
29466
|
33523
|
40619
|
49267
|
63577
|
73792
|
106617
|
|
Rg,
А
|
863
|
1011
|
1099
|
1168
|
1221
|
1257
|
1293
|
1303
|
1288
|
1285
|
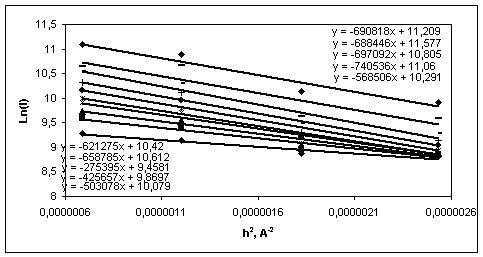
Рис. 6. Графики Гинье
для объединенной сыворотки, титруемой ПЭГ-6000 (метод светорассеяния). Нижние
графики соответствуют меньшим концентрациям ПЭГ-6000, а верхние - большим,
соответственно
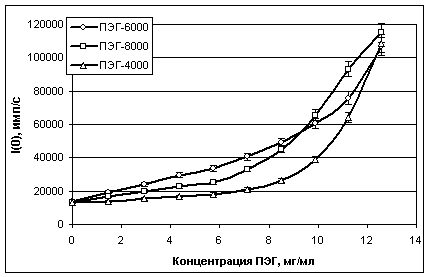
Рис. 7. Значения
интенсивностей светорассеяния (I(0))
от комплексов «ПЭГ-белки», образующихся в объединенной сыворотке крови при
взаимодействии сывороточных белков с различными ПЭГ
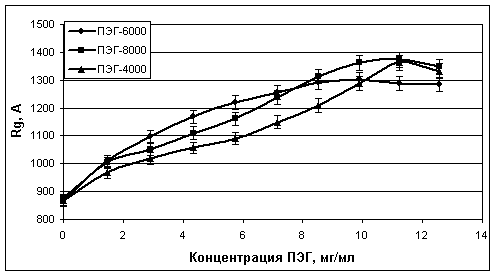
Рис. 8. Средние значения
радиусов инерции (Rg) комплексов
«ПЭГ-белки», образующихся в объединенной сыворотке крови при взаимодействии
сывороточных белков с ПЭГ-4000, ПЭГ-6000 и ПЭГ-8000
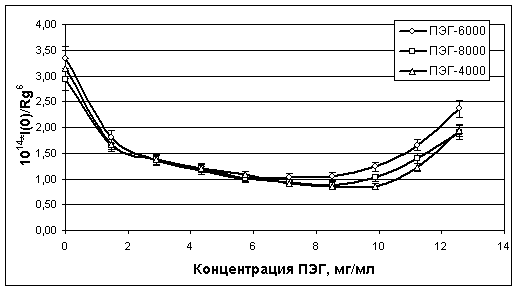
Рис. 9. Значения
параметра 1014*I(0)/Rg6, пропорционального среднему
физическому титру комплексов «ПЭГ-белки», образующихся в объединенной сыворотке
крови при взаимодействии сывороточных белков с ПЭГ различной молекулярной массы
На рис. 7-8 приведены
сводные графики изменения средних значений параметров I(0)
и Rg при титровании объединенной сыворотки (разведение в буфере 1:16)
различными ПЭГ.
Для получения
дополнительной информации о молекулярных механизмах взаимодействия ПЭГ с
сывороточными белками на рис. 9 приведены графики рассчитанных значений
параметра 1014*I(0)/Rg6, пропорционального среднему
значению физического титра комплексов «ПЭГ-белки» в смесях сыворотки крови с
ПЭГ.
3.2 Анализ общих и
модифицированных ЛП методом МУРР
Далее были исследованы
реакции взаимодействия сывороточных белков с различными ПЭГ при концентрациях,
при которых достигается эффект осаждения. Этот эффект и будет использоваться
нами далее для препаративного отделения модифицированных ЛП от общих.
Для анализа общих и
модифицированных ЛП методом МУРР также использовали объединенную сыворотку от
11-ти пациентов с нормолипемией. Подготовку образцов к измерениям, измерения
рентгенограмм МУРР и математическую обработку данных проводили, как описано в
работах [16-21]. В табл. 2 приведены результаты анализа по определению
концентраций фракций и подфракций общих сывороточных ЛП в объединенной
сыворотке крови. Из сравнения со статистическими данными нормолипемии
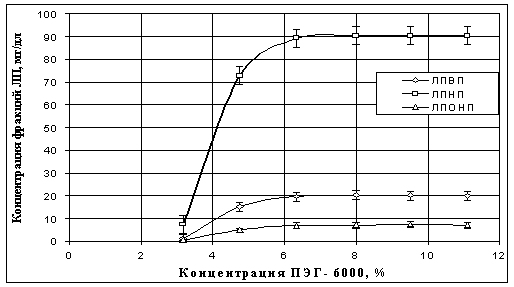
Рис. 10. Зависимость
концентраций основных фракций модифицированных ЛП в преципитатах объединенной
сыворотки (n = 11) от концентрации ПЭГ-6000
Таблица 2. Результаты
анализа по определению спектра общих сывороточных ЛП в объединенной сыворотке
крови пациентов с нормолипемией (n
= 11). Средний возраст пациентов 38 лет
|
Фракции и подфракции ЛП
|
Концентрации ЛП (по холестерину)
|
|
Результаты анализа
|
Нормолипемия, n
= 120 [13]
|
|
мг/дл
|
мМоль/л
|
мг/дл
|
мМоль/л
|
|
ЛПВП3
|
19,6
|
0,51
|
0,25 ¸0,65
|
|
ЛПВП2
|
26,5
|
0,69
|
30 ¸ 50
|
0,75 ¸1,30
|
|
ЛПВП (фракция)
|
46,1
|
1,19
|
40 ¸ 75
|
1,00 ¸ 1,95
|
|
ЛПНП1-3
|
99,9
|
2,59
|
60 ¸ 80
|
1,55 ¸2,10
|
|
ЛППП
|
22,0
|
0,57
|
20 ¸ 30
|
0,50 ¸ 0,75
|
|
ЛПНП (фракция)
|
122,0
|
3,16
|
80 ¸ 110
|
2,10 ¸2,85
|
|
ЛПОНП3-5
|
5,8
|
0,15
|
10 ¸ 15
|
0,25 ¸ 0,40
|
|
ЛПОНП1-2
|
1,2
|
0,03
|
1 ¸ 5
|
0,02 ¸ 0,13
|
|
ЛПОНП (фракция)
|
7,0
|
0,18
|
10 ¸ 20
|
0,25 ¸ 0,50
|
|
Общие концентрации липидов
|
|
Общ ХС
|
175,0
|
4,53
|
150 ¸ 190
|
3,80 ¸ 4,95
|
|
Общ ТГ
|
132,1
|
1,49
|
90 ¸ 150
|
1,02 ¸ 1,70
|
Примечание: ЛПВП3, ЛПВП2 - подфракции ЛП высокой
плотности (ЛПВП); ЛПНП1-3, ЛППП - подфракции ЛП низкой плотности
(ЛПНП); ЛПОНП3-5, ЛПОНП1-2 - подфракции ЛП
очень низкой плотности (ЛПОНП).
|
ЛП ЛП
|
ЛПВП3
|
ЛПВП2
|
ЛПВП
|
ЛПНП1-3
|
ЛППП
|
ЛПНП
|
ЛПОНП2
|
ЛПОНП1
|
ЛПОНП
|
ЛП(Все)
|
|
Общ. ЛП, мг/дл
|
19,0
|
27,1
|
46,1
|
99,9
|
122,0
|
5,8
|
1,2
|
7,0
|
175,1
|
|
Мод. ЛП, мг/дл
|
7,4
|
12,9
|
20,3
|
75,7
|
14,8
|
90,5
|
5,3
|
0,9
|
6,2
|
117,0
|
|
Ст. мод., %
|
38,9
|
47,6
|
44,0
|
75,8
|
67,3
|
74,2
|
91,4
|
75,0
|
88,6
|
66,8
|
Таблица 3. Сравнительные данные о
концентрациях фракций модифицированных ЛП в объединенной сыворотке после
преципитации с различными ПЭГами. Анализ методом МУРР
|
Полиэтиленгликоли (ПЭГ)
|
ЛПВП, мг/дл
|
ЛПНП, мг/дл
|
ЛПОНП, мг/дл
|
Общ. ХС, мг/дл
|
|
Концентрации ЛП по холестерину
|
|
ПЭГ 1000 (42%)
|
19.6 ± 0.9
|
69.9 ± 2.2
|
1.7 ± 0.1
|
91.2 ± 1.6
|
|
ПЭГ 4000 (42%)
|
14.2 ± 0.9
|
91.2 ± 2.5
|
7.9 ± 0.7
|
119.3 ± 2.8
|
|
ПЭГ 6000 (8%)
|
20.3 ± 1.1
|
90.5 ± 2.0
|
7.2 ± 0.8
|
118.0 ± 2.7
|
|
ПЭГ 8000 (16%)
|
20.5 ± 1.1
|
85.6 ± 2.9
|
7.6 ± 0.6
|
113.7 ± 2.5
|
|
Степень модификации ЛП (по преципитации с ПЭГ-6000), %
|
|
ПЭГ 6000
|
44.0
|
74.1
|
100
|
67.4
|
Видно, что полученные результаты
действительно близки к нормальным значениям концентраций ЛП.
В табл. 3 и на рис. 10 приведены
конечные результаты титрования методом МУРР цельной объединенной сыворотки
крови различными ПЭГ при концентрациях, при которых термодинамическое
равновесие смещается в сторону образующихся комплексов и происходит их
осаждение (преципитация).
Было важно определить диапазоны
концентраций ПЭГ, при которых происходит полная преципитация всех основных
фракций модифицированных ЛП.
4.
Обсуждение результатов
Как видно из рис. 7-8, значения
параметров I(0) и размеров (Rg) образующихся комплексов «ПЭГ-белки» в смесях сначала почти
линейно увеличиваются при повышении концентрации ПЭГ до 10 мг/мл (1%), а затем
рост размеров комплексов замедляется и почти полностью прекращается, а значения
I(0),
наоборот, начинает резко возрастать. Также следует отметить, что полученные в
экспериментах кривые титрования объединенной сыворотки различными ПЭГ заметно
отличаются между собой.
Для получения информации о
молекулярных механизмах взаимодействия ПЭГ с сывороточными белками использовали
экспериментальные данные СР, приведенные на рис. 7-8, и рассчитанные из них
значения параметра 1014*I(0)/Rg6, пропорционального
среднему значению физического титра комплексов «ПЭГ-белки» в смесях сыворотки
крови с ПЭГ (см. рис. 9). Действительно, поскольку I(0) ~ n · M2 ~ n · V2, где M и V - средние молекулярные массы и
объемы образующихся комплексов, то отношение I(0)/Rg6 с точностью до
калибровочного коэффициента характеризует значение физического титра комплексов
«ПЭГ-белки» в смесях. Из рис. 9 видно, что после первых же порций ПЭГ в смесях
титр резко падает (это связано с образованием более крупных комплексов из
отдельных сывороточных белков и аутоиммунных комплексов). Далее процесс падения
замедляется, а при концентрациях 10 мг/мл и выше начинается резкое увеличение
титра комплексов но, как видно из рис. 10, размер комплексов при этом остается
почти неизменным. Следует отметить, что в отличие от графиков рис. 7 и 8,
графики физического титра комплексов «ПЭГ-белки» на рис. 9 почти совпадают
между собой. Поскольку представленные на рис. 7-9 экспериментальные данные
соответствуют допреципитационным (равновесным) стадиям взаимодействия
сыворочных белков с ПЭГ, то все они свидетельствуют о сходстве их молекулярных
механизмов взаимодействия.
Как видно из рис. 10, при
концентрациях ПЭГ-6000 в диапазоне 6 ÷ 8% (60 ÷ 80 мг/мл) происходит полная преципитация фракций модифицированных ЛП
в нативной объединенной сыворотке крови и при дальнейшем увеличении
концентрации ПЭГ-6000 эффект преципитации остается неизменным. А вот для других
ПЭГ, а именно, ПЭГ-1000, 4000 и 8000 преципитация фракций модифицированных ЛП
происходит при значительно более высоких концентрациях соответствующих ПЭГ и
при том не полная (см. табл. 3). Для ПЭГ-20000 эксперименты с применением
методов СР и МУРР вообще не удалось провести из-за сильной агрегации этого ПЭГ
с сывороточными белками уже при самых малых концентрациях ПЭГ, в результате
чего также резко повышается вязкость растворов. Поэтому применение именно
ПЭГ-6000 для целей препаративного выделения и анализа модифицированных ЛП
вполне обосновано [1-3]. Кроме того, подтвердились данные, что концентрация
ПЭГ-6000, при которой происходит полное отделение модифицированных ЛП от
немодифицированных, равна 6-8% [1, 2].
В табл. 3 приведены значения степени
модификации фракций ЛП используемой в работе объединенной сыворотки пациентов с
нормолипемией. Степень модификации наименьшей оказалось у фракции ЛПВП (44%), а
наибольшей - у ЛПОНП (~100%) и в целом около 68% ЛП оказались «чужеродными» ЛП.
Такой результат не соответствует ранее полученным данным [3, 4, 21], где только
около 40% ЛП модифицированы у пациентов с нормолипемией. Связано это,
по-видимому, с тем, что в данной работе использовали объединенную сыворотку, в
которой образовалось много дополнительных комплексов ЦИК «ЛП - антитело»,
которые также преципитировали с ПЭГ и привели к завышенным значениям степени
модификации.
Из полученных в работе результатов
видно, что, как и отмечалось в работах [1, 2] при различных концентрациях ПЭГ
происходит образование различающихся по молекулярной массе и размерам иммунных
комплексов. Так, например, низкие концентрации ПЭГ (< 10 мг/мл (1%))
приводят к образованию комплексов крупных размеров, 1-2% ПЭГ осаждают наиболее
распространенные «промежуточные» комплексы средних размеров, а более высокие
концентрации (> 20 мг/мл) вызывают, по-видимому, преципитацию более
низкомолекулярных белковых фракций.
Следует подчеркнуть, что методика
детального анализа фракционно-компонентного состава сывороточных ЛП на основе
метода МУРР появилась совсем недавно [19, 20]. Поэтому проведение данного
исследования является важным этапом дальнейшего развития новых
высокоинформативных методов анализа сывороточных ЛП крови, в частности,
модифицированных ЛП, для научной и практической медицины.
1. Успешное изучение основ
теории и практики использования двух физических (дифракционных) методов анализа
(МУРР и СР) позволило применить эти методы для анализа структуры и фракционного
состава биологических макромолекул (суммарных сывороточных белков крови, общих
и модифицированных ЛП), а также их комплексов.
2. В результате исследования
эффектов равновесных молекулярных взаимодействий суммарных белков, содержащихся
в сыворотках крови, с различными полиэтиленгликолями (ПЭГ-1000, ПЭГ-4000,
ПЭГ-6000, ПЭГ-8000, ПЭГ-20000) в допреципитационном диапазоне концентраций
полиэтиленгликолей (0 ÷ 1,5%) установлено, что механизмы равновесного комплексообразования
ПЭГ-4000, ПЭГ-6000 и ПЭГ-8000 с сывороточными белками очень близки и не зависят
от молекулярной массы полиэтиленгликолей.
. Изучение молекулярных
взаимодействий белков сывороток крови с различными полиэтиленгликолями
(ПЭГ-1000, ПЭГ-4000, ПЭГ-6000, ПЭГ-8000 и ПЭГ-20000) в преципитационном
диапазоне концентраций полиэтиленгликолей 3 ÷ 11% позволило выбрать в качестве оптимального ПЭГ-6000 с
концентрацией 6 ÷ 8% для препаративного выделения и анализа модифицированных ЛП.
. Показано, что
полиэтиленгликоли ПЭГ-4000 и ПЭГ-8000, хотя и дают близкие результаты, но не
удовлетворяют методическим условиям: требуются высокие концентрации
полиэтиленгликолей и происходит неполное отделение модифицированных от общих
ЛП. Полиэтиленгликоли с молекулярными массами 1000 и 20000 Д из-за
концентрационных и гидродинамических эффектов вообще не могут использоваться
для целей препаративного выделения модифицированных ЛП.
Список литературы
1. Канская Н.В., Карпов Р.С. Способ определения модифицированных
липопротеидов крови. А.С. №1720015А1. МКИ G01N 33/92. Приоритет от 25.10.89.
Опубл. 15.03.92 г. Бюлл. №10.
2. Канская Н.В., Карпов Р.С. Способ выявления лиц с фактором
риска ишемической болезни сердца. А.С. №1327007, МКИ G01N 33/564, Приоритет от 26.07.85,
Опубл. 30.07.87 г., Бюлл. №28.
. Карпов Р.С., Канская Н.В., Осипов С.Г. Роль иммунной
системы в развитии гиперлипопротеидемий. Томск: Изд-во Томского Университета,
1990, 165.
. Климов А.Н., Никульчева Н.Г. Обмен липидов и
липопротеидов и его нарушения. Руководство для врачей. М., Харьков, Минск:
Изд-во «Питер», 1999, 505.
. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия
человека. М.: Мир, 1993, 1, 225-298.
. Холодова Ю.Д., Чаяло П.П. Липопротеины крови. Киев:
Наукова думка, 1990, 208.
7. Tardieu A., Mateu L., Sardet C., Weiss B., Luzzati V.,
Aggerbeck L., Scanu A.M. Structure of human serum lipoproteins in solution.
//J. Mol. Biol. 1976. V.101. P.129-153.
. Laggner P., Muller K.W. The structure of serum lipoproteins
as analysed by x-ray small-angle scattering. //Quarterly Rev. of Biophys.,
1978. V.11. №3. P.371-425.
. Mills G.L., Lane P.A., Weech P.K. Laboratory techniques
in biochemistry and molecular biology. A guidebook to lipoprotein technique.
//Elsevier. 1984. V.14. 512p.
. Климов А.Н., Никульчева Н.Г. Липопротеиды,
дислипопротеинемии и атеросклероз. Л: Медицина. 1984. С. 1-168.
11. Gotto A.M., Pownal H.J., Havel R.J. Plasma lipoproteins.
//Methods in Enzimology. 1986. V.128. Part A.P.3-122.
. Bellamy M.F., Nealis A.S., Aitken J.W., Bruckdorfer K.R.,
Perkins S.J. Structural changes in oxidised low-density lipoproteins and of the
effect of the anti-atherosclerotic drug probucol observed by synchrotron X-ray
and neutron solution scattering. //Eur.J. Biochem. 1989. V.183. P.321-329.
. Shen B., Scanu A.M., Kezdy F.J. Structure of human serum
lipoproteins inferred from compositional analysis. //Proc. Nat. Acad. Sci. USA.
1977. V.74. №3. P.837-841.
14. Cвергун Д.И., Фейгин Л.А.
Рентгеновское и нейтронное малоугловое рассеяние. М.: Наука, 1986, 280 с.
. Кантор Ч., Шиммел П. Биофизическая химия. М.: Мир, 1984.
Т.2. С. 309-429.
. Тузиков Ф.В., Тузикова Н.А., Мистюрин Ю.Н. Способ анализа
липопротеидов в плазме крови методом малоуглового рентгеновского рассеяния.
Патент РФ №2099693, МКИ G01N 33/53, Приоритет от 22.12.93 г., Опубл. 20.12.97 г., Бюлл. №35.
. Тузиков Ф.В., Тузикова Н.А., Панин Л.Е., Никитин Ю.П.,
Крылова И.Н. Определение фракционного состава липопротеинов крови методом
малоуглового рентгеновского рассеяния. Биологические мембраны, 1998, 15 (4),
421-433.
. Тузиков Ф.В., Тузикова Н.А., Панин Л.Е., Никитин Ю.П.
Новый метод диагностики нарушений липидного обмена. Вестник РАМН, 1998, 3,
42-47.
. Тузиков Ф.В., Рагино Ю.И., Тузикова Н.А., Иванова М.В., Галимов
Р.В., Никитин Ю.П. Определение фракционного и субфракционного составов
липопротеинов крови методом малоуглового рентгеновского рассеяния. Сравнение с
биохимическим методом. // Вопросы медицинской химии. 2002. Т.48. №1. С. 84-93.
20. Tuzikov F.V., Tuzikova N.A., Galimov R.V., Panin L.E.,
Nevinsky G.A. General model to describe the structure and dynamic balance
between different human serum lipoproteins and its practical application.
//Med. Sci. Monit. 2002. V.8 (6). №6. P.79-88.
21. Сизиков А.Э., Тузиков Ф.В., Тузикова Н.А., Галимов Р.В.,
Коненкова Л.П., Зонова Е.В., Королев М.А., Герцог О.А., Козлов В.А. Особенности
нарушений липидного обмена у больных ревматоидным артритом. // Ревматология.
2004. (в печати).
. http://www.invitro.ru/protein-fractions.htm «Белковые
фракции».