Активные формы кислорода и антиоксидантная система
Санкт-Петербургский государственный
университет
Медицинский факультет
Курсовая работа по биохимии
Активные формы кислорода и
антиоксидантная система
Бойко Анна Юрьевна
курс
Научный руководитель:
Астратенкова И.В.
Санкт-Петербург 2012
Содержание
Введение
Супероксид-анион (радикал)
H2O2 (перекись водорода)
OH (гидроксил, гидроксид - радикалы.)
Гипохлорит-анион
NO-радикал
Механизмы возникновения АФК
Функции АФК
Негативное воздействие АФК
Антиоксидантная система организма, факторы клеточной защиты
Заключение
Список, используемой литературы
Введение
Мы не можем представить свою жизнь без кислорода. До
появления фотосинтезирующих организмов атмосфера практически его не содержала.
С их появлением кислород стал побочным продуктом их жизнедеятельности. Но
сейчас, когда организмы, способные окислять органические соединения при помощи
О2, получили преимущество, мы говорим что кислород - наша жизнь.
Однако вместе с преимуществом кислород принес новую опасность
для организма. Молекулярный кислород, который обладает высокой реакционной
способностью в основном состоянии, способен образовывать высокоактивные формы,
способные убивать живую клетку.
В последние 10-15 лет проблема патогенеза заболеваний сердца,
а также ряда других органов обогатилась раскрытием механизма повреждения
клеточных структур. Основным фактором повреждения оказался кислород - тот самый
кислород, из-за недостатка которого возникает гибель клеток. Выяснилось, что
так называемые активные формы кислорода (АФК), имеющие неспаренный электрон,
обладают биологическим эффектом, который в зависимости от концентрации АФК
может быть регуляторным или токсическим. Соответственно пробудился интерес и к
соединениям, которые в обычных условиях предотвращают токсическое действие АФК
- антиоксидантам. Окислительный стресс играет важную, если не ключевую роль в
патогенезе старения и широкого спектра сердечно-сосудистых заболеваний, в том
числе кардиомиопатии, атеросклероза, ИБС, клапанных поражений и застойной
сердечной недостаточности. Поэтому использование антиоксидантов для терапии и
профилактике процесса старения и сердечных заболеваний выглядит вполне
оправданным. В дальнейшем обзоре будут рассмотрены механизмы возникновения АФК,
механизмы действия, функции и основные способы защиты организма.
Виды супероксидов.
Свободные радикалы - это молекулярные частицы, имеющие
непарный электрон на внешней электронной оболочке и обладающие высокой
реакционной способностью. Их изучение ведется методом ЭПР (спиновые ловушки),
хемилюминесценции и путем применения ингибиторов реакций, в которых участвуют
радикалы определенного типа. Основные радикалы, образующиеся в клетках - это
радикалы кислорода (супероксид и гидроксильный радикал), монооксид азота,
радикалы ненасыщенных жирных кислот, радикалы, образующиеся в окислительно-восстановительных
реакциях (например, убихинол). Радикалы образуются также при действии
ультрафиолетовых лучей и в ходе метаболизма некоторых чужеродных соединений
(ксенобиотиков), в том числе некоторых препаратов, одно время применявшихся в
качестве лекарств.
активная форма кислород антиоксидантный
Супероксид-анион
(радикал)
Ключевой активной формой кислорода является супероксид анион
- радикал (О2-), образующейся при присоединении одного электрона к молекуле
кислорода в основном состоянии. Супероксид радикал сам по себе обладает малой
реакционной способностью. Он может действовать как окислитель (акцептор
электрона), как восстановитель (донор эелектрона). В водной среде может
спонтанно дисмутировать (один атом может выступать в качестве акцептора
эелектрона, а другой в качестве донора).
Время его жизни в биологических субстратах составляет около
10-6 с. Супероксид анион-радикал представляет опасность тем, что способен
повреждать белки, содержащие железо-серные кластеры, такие как аконитаза, сукцинатдегидрогеназа
и НАДН-убихинон оксидоредуктаза.
При кислых значениях рН супероксид анион-радикал может
протонироваться с образованием более реакционноспособного пероксильного
радикала (НО2.), представляющего собой слабую кислоту
H2O2
(перекись водорода)
Присоединение двух электронов к молекуле кислорода или одного
электрона к супероксид-аниону приводит к образованию перекиси водорода, которая
является окислителем умеренной силы. Однако из перекиси водорода может
образовываться гидроксид-радикал (ОН.), который является весьма сильным
окислителем. ОН радикал может образовываться при трехэлектронном восстановлении
кислорода или при взаимодействии перекиси водорода с супероксид радикал -
анионом - реакция Габера-Вейса. В процессе реакции генерируется OH (гидроксил-радикал)
из H2O2 (пероксида водорода) и супероксида (O2−). Реакция может возникать
в клетке и вызывать окислительный стресс. Реакция проходит довольно медленно,
однако катализируется ионами железа. Первая стадия каталитического цикла
включает восстановление Fe3+:
+ + O2− → Fe2+ + O2
Вторая стадия:
Fe2+ + H2O2 → Fe3+ + OH− + OH
Возникновение цепи:
− + H2O2 → OH + HO− + O2
В обычных условиях эта реакция протекает достаточно слабо.
Токсичность перекиси водорода резко возрастает в присутствии металлов
переменной валентности, что объясняется ускорением образования ОН. (Halliwell
and Gutteridge)
OH
(гидроксил, гидроксид - радикалы.)
Гидроксид-радикал практически не участвует в образовании
других АФК, но является важным фактором окислительной модификации многих
клеточных структур. Он может окислять молекулы белков и липидов, особенно
активно атакуя мембранные липиды, которые содержат ненасыщенные двойные связи.
Этот процесс приводит к образованию липидных гидроперекисей и изменению свойств
клеточных мембран. Гидроксид-радикал вызывает разрыв связей в молекуле ДНК, что
может вызывать глубокие повреждения генетического аппарата клеток. Константы
скоростей его взаимодействия с большинством биологически важных молекул близки
к диффузионным.
Вследствие высокой химической активности гидроксид-радикала,
время его жизни в клетке составляет 100 нс, а расстояние, которое он может
пройти от места образования до места взаимодействия с мишенью ~100 нм.
Гипохлорит-анион
Гипохлорит-анион (OCl-), представляющий собой активную форму
хлора и условно относимый к АФК, так как он обладает сходными свойствами
окислителя. В ходе миелопероксидазной реакции Н2О2 ферментативно превращается в
гипохлорит-анион, который является мощным окислителем. Гипохлорит - анион
опасен сам по себе, а также может взаимодействовать с О2. - с образованием
гидроксид-радикала и с перекисью водорода с образованием синглетного кислорода.
радикал
К радикальным компонентам клетки относится NO-радикал,
образуемый ферментом NO-синтаза и участвующий в образовании пероксинитрита при
взаимодействии с супероксид.
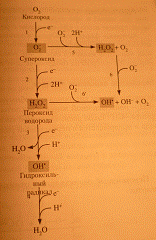
Механизмы
возникновения АФК
Молекулярный кислород в основном своем триплетном состоянии
имеет два неспаренный электрона с одинаково ориентированными спинами,
занимающих самостоятельные внешние орбитали. Каждая из этих орбиталей может
принять ещё один электрон. Полное восстановление О2 в Н2О требует присоединения
четырех электронов. В большинстве случаев в организме восстановление кислорода
происходит поэтапно, с переносом одного электрона на каждом этапе.
При присоединении первого электрона образуется супероксидный
анион 2О-, который имеет на внешней орбитали неспаренный электрон. Такие атомы
называются свободными радикалами. Супероксид, получая ещё одни электрон
превращается в пероксид водорода Н2О2, присоединение третьего приводит к
образованию молекулы воды и гидроксильного радикал ОН. Четвертый электрон
превращает гидроксил в воду.
Таков нормальный механизм обезвреживания кислорода, общий для
всех процессов в организме. Но по некоторым причинам (о них речь пойдет ниже)
может произойти сбой в этой системе (либо запуск определенной программы, такой
как апоптоз), что приведет к нарушению присоединения электрона и как следствие
появление свободный радикалов (АФК). По некоторым оценкам, даже в
физиологически оптимальных условиях примерно 2-5 % проходящих по ЭТЦ электронов
идут на образование супероксидных радикалов. Кроме того, в определенных
условиях (например, при окислении пиридиннуклеотидов и полифенолов) при
физиологическом значении рН некоторые апопластные пероксидазы, проявляя свою
оксидазную функцию, способны к образованию супероксидного анион-радикала.
Установлено, что пероксидаза клеточной поверхности является одним из основных
источников супероксидного радикала при отсечении корней от проростков пшеницы.
Интересно сравнеие образования свободных форм кислорода у
клетках растений и животных. Поскольку растения неподвижны и находятся под
постоянным воздействием меняющихся условий среды, а также осуществляют
оксигенный фотосинтез, в их тканях концентрация молекулярного кислорода
оказывается намного более высокой, чем у других эукариот. Показано, что
концентрация кислорода в митохондриях млекопитающих достигает 0,1 мкМ, в то время
как в митохондриях растительных клеток - более 250 мкМ. При этом, по оценкам
исследователей, примерно 1 % поглощаемого растениями кислорода преобразуется в
его активные формы, что неизбежно связано с неполным пошаговым восстановлением
молекулярного кислорода.
Синглетный кислород (1О2) образуется в хлоропластах в
результате взаимодействия молекулярного кислорода с хлорофиллом, возбужденным
квантом света и находящимся в триплетном состоянии. Энергия, необходимая для
этого перехода, составляет примерно 22 ккал/моль. В результате поглощения
избыточной энергии (что часто имеет место в реальных условиях) происходит
обращение спина одного электрона и формирование синглетного кислорода.
Образование супероксидного анион-радикала (О2-) происходит в фотосистеме I (ФС
I) и II (ФС II) хлоропластов и на комплексах дыхательной цепи в митохондриях, а
также в ряде реакций, протекающих в пероксисомах (при окислении ксантина
ксантиноксидазой). В ФС I появление супероксидного радикала происходит в
реакции Мёллера и связано с работой 4Fe-4S-кластеров, ферредоксина и/или
ферредоксин-НАДФН-редуктазы. Около 10-25% всего нециклического электронного
потока может идти на образование супероксид-радикала. Генерация анион-радикала,
кроме того, возможна на уровне реакционного центра ФС II, предположительно в QА
и QВ сайтах. В митохондриях образование О2 - сопряжено с функционированием
дыхательной электрон-транспортной цепи (ЭТЦ) во внутренней митохондриальной
мембране и захватом молекулярным кислородом электронов с гемов.
Существует ещё несколько механизмов возникновения свободных
радикалов. Например, в процессе функционирования цитохрома Р-450 в микросомах
образуется такой тип АФК как перекись водорода. Принято считать, что ее
образование связано с тем, что в процессе цитохром Р-450-зависимого
окислительного цикла образующийся тройственный комплекс, включающий цитохром
Р-450, субстрат и ион супероксида (оксицитохром Р-450), может, помимо основного
пути превращения - внедрения кислорода в структуру субстрата, - распадаться с
образованием исходного комплекса субстрат-цитохром Р-450 и высвобождением
супероксида (процесс "разобщения") с последующей его дисмутацией, с
образованием перекиси водорода. В присутствии ионов железа перекись водорода в
результате одноэлектронного переноса может восстанавливаться до
гидроксил-радикала - сильнейшего окислителя. Показано также, что высвобождение
железа из ферритина - белка, являющегося основным депо железа в клетке,
происходит в результате образования супероксида при функционировании цитохрома
Р-450
Таким образом, супероксид, образующийся при
"разобщении" на цитохроме Р-450, может быть источником перекиси
водорода и генератором ионов железа из ферритина-компонентов, необходимых для
образования различных активных форм кислорода. Действительно, образование супероксида,
перекиси водорода и гидроксил радикала показано в реконструированных ферментных
системах с использованием различных изоформ цитохрома Р-450.
Кроме того АФК в организме могут образовываться и ходе
реакций самопроизвольного окисления ряда веществ. Одним из важнейших примеров
является окисление гемоглобина в метгемоглобин, при котором образуется
супероксид. При нормальном значении ph и концентрации кислорода стабильной формой
железа является Fe3+. Ион Fe2+ легко окисляется в Fe3+. Однако в молекуле гемоглобина
эта реакция существенно заторможена благодаря белковой части в окружении гема.
И все же с большей скоростью происходит окисление оксигемоглобина кислородом с
образованием метгемоглобина.
Hb (Fe2+) O2=Hb (Fe3+) +O2-
Образующийся супероксид кислорода способен окислять
оксигемоглобин.
Hb (Fe2+) O2+O2 - + 2H+= Hb (Fe3+) +O2+ H2O2
Пероксид водорода - тоже окислитель оксигемоглобина.
Hb (Fe2+) O2+H2O2= Hb (Fe3+) +OHрадикал+OH-
Гидроксильный радикал окисляет гемоглобин.
Hb (Fe2+) +OH= Hb (Fe3+)
Но тем не менее, общепринято, что дыхательная цепь
митохондрий является основным источником АФК в большинстве клеток. Вместе с тем
представляет интерес выяснение, какие именно компоненты дыхательной цепи и в
каких условиях являются основными АФК - генераторами. Исходя из стандартных
редокс-потенциалов окислительно-восстановительных центров различных Комплексов
дыхательной цепи, а также на основе экспериментальных данных были выделены три
основных источника АФК: НАДН - убихинон оксидоредуктаза, сукцинат-убихинон
оксидоредуктаза и убихинол-цитохром с оксидо-редуктаза.
Не существует единого мнения по поводу того, в каких именно
участках дыхательной цепи происходит образование АФК и каков вклад каждого из
них в этот процесс. Теоретически одноэлектронное восстановление кислорода может
происходить в любом из редокс-центров Комплекса I, а также в
высокопотенциальных редокс-центрах Комплексов 2 и 3. По мнению большинства
исследователей, основным АФК-генератором в дыхательной цепи является Комплекс
I. Однако ряд авторов полагает, что Комплекс III вносит по крайней мере такой
же вклад в образование АФК. Существует также мнение, что заметным источником
АФК может служить также Комплекс II. На сегодняшний день признается, что все
три комплекса образуют АФК.
Функции
АФК
В тканях аэробных организмов в процессе метаболизма постоянно
образуются продукты неполного восстановления кислорода. Активные формы
кислорода и радикалы синтез в организме, выполняют не только вредные, но и
множество полезных для клетки функций. Так, образование супероксид-аниона и
гипохлорита клетками иммунной системы используется организмом при защите от
инфекций и других чужеродных факторов. Для некоторых тканей, в частности, для
мозга, характерен повышенный синтез простагландинов, тромбоксанов и лейкотриенов.
Этот процесс требует участия супероксид-аниона, взаимодействующего с другим
компонентом этой системы, арахидоновой кислотой - соединением, высвобождающимся
из мембранных фосфолипидов в ходе индуцируемого АФК перекисного окисления
липидов.
АФК активно участвуют в процессах передачи клеточного
сигнала. Так, например, свободные радикалы, которые образуются в цитозоле
клетки в ответ на стимуляцию факторами роста, участвуют в регуляции
пролиферативного. Имеется много публикаций, свидетельствующих, что активные
формы кислорода стимулируют деление различных типов клеток.
Механизм, по которому активные формы кислорода участвуют в
передаче митотического сигнала, неизвестен. Возможно, что АФК могут
активировать такие ферменты, как митоген-активируемую киназу p38, что, в свою
очередь, приводит к активации транскрипционного фактора HIF-1 и экспрессии
соответствующих генов. Показано, что они включают каскад реакций, которые
передают митотический сигнал при воздействии "физиологических"
агентов, таких как факторы роста: активируют в клетке различные
транскрипционные факторы, но наиболее эффективно - продукт гена c-jun и ядерный
транскрипционный фактор NF-kB. Свободные радикалы обладают активностью,
модулирующей транскрипционные факторы, как NF-kB и активирующий белок-1 (AP-1).
В случае NF-kB показано, что он становится транскрипционно активным после того,
как происходит опосредованная АФК деградация IkB белка, ингибирующего NF-kB.
Также показана роль АФК в качестве вторичных мессенджеров в сигнальных
каскадах, запускаемых такими факторами как TGF-b1, PDGF, ATII, FGF-2 и
эндотелин.
Еще одной мишенью АФК может являться Na/K-АТФаза, белок,
отвечающий за электрогенный транспорт ионов калия и натрия через клеточную
мембрану. В нормальных условиях нейрональная Na/K-АТФаза потребляет от 15% до
40% энергии клетки, направляя ее на поддержание ионных градиентов. Избыточная
активация глутаматных рецепторов и повышение уровня АФК приводит к обратимому
ингибированию фермента. Известно разнонаправленное влияние глутаматных рецепторов
первой и третьей групп на активность Na/K-АТФазы. Так, АФК усиливают
ингибирующее влияние NMDA-рецепторов на активность Na/K-АТФазы, а mGluI
предотвращают ингибирование ее NMDA - рецепторами.
Негативное
воздействие АФК
Выделение АФК считается нормальным процессом и у организма
есть механизмы их обезвреживания. Но когда его количество достигает критической
точки, АФК в силу своей высокой реакционной способности, становится достаточно
опасным соединением, пагубно влияющим на клетку. Например избыточное выделение
АФК может привести к окислительному стрессу.
Окислительный стресс, являющийся следствием дисбаланса про -
и антиоксидантных систем (речь пойдет ниже) клетки и отражающийся в избыточном
образовании в клетке активных форм кислорода, может являться причиной
повреждения различных структур: ДНК, белков и липидов, и может приводить к
клеточной смерти. Окислительный стресс сопровождает многие нейродегенеративные
заболевания, по этой причине АФК принято считать вестниками клеточной смерти.
В норме окислительные процессы регулируются с помощью
антиоксидантной системы. Если равновесие в организме смещается в сторону
окислительных процессов, то это называется окислительным стрессом. А
окислительный стресс связан, например, со старением клеток. Кроме того, накопление
большого количества активных форм кислорода, а также снижение концентрации
клеточного глютатиона (основного антиоксиданта, вырабатываемого нашим
организмом) является хорошо известной распространенной причиной возникновения
острых и хронических дегенеративных заболеваний, таких как, атеросклероз,
диабет, инсульт, болезни Альцгеймера и Паркинсона.
Для того, чтобы выяснить, какую роль молекулярный механизм
уменьшения концентрации глутатиона играет в метаболическом пути гибели клеток,
вызванной оксидативным стрессом, нами были выведены специальные клетки и мыши,
у которых отсутствовала пероксидаза глутатиона 4 (GPx4), один из наиболее
важных глутатион-обуславливающих ферментов. Индуцированная инактивация GPx4
стала причиной массового окисления липидов и, в конечном итоге, клеточной
смерти. Аналогичный фенотип можно наблюдать, если при помощи химического
ингибитора биосинтеза глутатиона удалить внутриклеточный глутатион из клеток
дикого (немутантного) типа.
Таким образом окислительный стресс, являющийся следствием
дисбаланса про- и антиоксидантных систем (речь пойдет ниже) клетки и
отражающийся в избыточном образовании в клетке активных форм кислорода, может
являться причиной повреждения различных структур: ДНК, белков и липидов, и
может приводить к клеточной смерти. Окислительный стресс сопровождает многие
нейродегенеративные заболевания, по этой причине АФК принято считать вестниками
клеточной смерти.
Термином "апоптоз" обозначают программированную
клеточную смерть. Апоптоз может быть индуцирован целым рядом факторов. В целом
процесс "клеточного самоубийства" выглядит следующим образом. Вначале
наблюдается некоторое снижение трансмембранного потенциала в митохондриях,
одновременно с которым отмечается аккумуляция ионов кальция в митохондриальном
матриксе. После этого отмечается повышение концентрации АФК в цитозоле и
последующее открытие митохондриальной поры. Полное открытие поры приводит к
набуханию митохондриального матрикса, разрыву внешней мембраны и выходу в
цитозоль апоптоз-инициирующих факторов, прежде всего цитохрома с и особых
протеаз-каспаз. Следствием чего осуществляется фрагментация ДНК.
С точки зрения защиты клетки от окислительного стресса,
апоптоз можно рассматривать как важную, хотя и крайнюю меру борьбы с
неконтролируемой продукцией АФК. Рассматриваемую цепь событий при развитии
апоптоза можно в этом случае интерпретировать следующим образом: при
возрастании уровня АФК в клетке включается механизм "мягкого"
разобщения в митохондриях, как потенциально основных источников клеточных АФК.
Если после этого снизить уровень продукции АФК не удается, открывается
митохондриальная пора. При этом трансмембранный потенциал падает практически до
нуля, а скорость поглощения кислорода становится максимальной. Таким образом,
преследуются сразу две цели: полная деактивация потенциал - зависимых
митохондриальных источников АФК и по возможности быстрое снижение концентрации
кислорода в клетке. Если же при этом не удается добиться снижения концентрации
АФК в клетке за определенный срок, то происходит выход апоптоз-инициирующих
факторов в цитозоль и клетка устраняется как потенциально опасный компонент
организма.
В дальнейшем были получены прямые указания на то, что
активные формы кислорода обладают промоторными свойствами: введение в культуру
инициированных гамма-облучением или бенз/а/пирен-диолэпоксидом фибробластов
ксантин+ксантиноксидазы (системы, продуцирующей активные формы кислорода)
увеличивало выход трансформированных клонов, а одновременное добавление
каталазы и супероксиддисмутазы предотвращало промоторное действие. Показано
развитие опухоли при перевивке бестимусным мышам линии фибробластов 10Т 1/2,
обработанных активированными нейтрофилами, которые продуцируют активные формы
кислорода, или системой ксантин+ксантиноксидаза. В культуру клеток почек был
встроен под промотор ген уратоксидазы, производящий фермент, окисляющий мочевую
кислоту до аллантоина с образованием Н2О2. При введении в культуру мочевой
кислоты происходила трансформация клеток. Введение животному, инициированному
кожным канцерогеном 7,12-диметилбенз/а/антраценом,
фотосенсибилизатора-дигематопорфирина с последующим ультрафиолетовым облучением
кожи вызывало образование активных форм кислорода и оказывало промоторное действие.
В отсутствие облучения дигематопорфирин промоторными свойствами не обладал.
Одним из показателей образования активных форм кислорода и
вызываемого ими кислородного стресса является появление в среде культивирования
продукта окисления гуанина в молекуле ДНК - 8-гидроксидезоксигуанидина. Это
соединение обнаружено в культуре клеток, а также в печени при действии
различных типов индукторов цитохрома Р-450 (ТХДД, фенобарбитала, пролифераторов
пероксисом). Одновременное с индукторами введение ингибитора функций цитохрома
Р-450, 7,8-бензофлавона, резко уменьшает образование
8-гидроксидезоксигуанидина.
В культуре мутантных клеток с дефектным Ah-рецептором, в
которых индукция цитохрома Р-450 при введении индукторов семейства 1
отсутствует, добавление ТХДД не вызывало появления в культуральной среде
8-гидроксидезоксигуанидина.
Таким образом, приведенные результаты говорят о том, что
окислительный стресс, наблюдаемый при введении индукторов цитохрома Р - 450,
обусловлен функционированием изоформ этого фермента.
Окислительный стресс, связанный с окислением гуанина в
молекуле ДНК, дает основание для предположения, что промоция обусловлена
мутагенным действием активных форм кислорода. Имеется довольно много
публикаций, обсуждающих подобный механизм действия промоторов. Однако
феноменология процесса промоции свидетельствует, что он в отличие от инициации
не связан с наследуемым изменением в геноме клетки. В первую очередь об этом
свидетельствует способность клетки "забыть" воздействие промотора
канцерогенеза после прерывания воздействия, но "помнить" инициацию.
Имеются прямые экспериментальные доказательства,
свидетельствующие о том, что активные формы кислорода участвуют в промоции при
действии индукторов цитохрома Р-450: маннитол-ловушка для ОН-радикалов - и
антиоксиданты уменьшают количество локусов трансформации при промоторном
действии ТХДД. В этой же работе продемонстрировано, что механизм промоторного
действия форболовых эфиров и индукторов цитохрома Р-450 различен: ингибитор ПКС
подавляет промоторное действие форбол-12-миристат-13-ацетата, но не влияет на
промоторное действие ТХДД.
Уже на ранних этапах изучения цитохрома Р-450 было показано,
что при функционировании цитохрома Р-450 как в микросомах, так и в
реконструированной ферментной системе образуется перекись водорода. Принято
считать, что ее образование связано с тем, что в процессе цитохром
Р-450-зависимого окислительного цикла образующийся тройственный комплекс,
включающий цитохром Р-450, субстрат и ион супероксида (оксицитохром Р-450),
может, помимо основного пути превращения - внедрения кислорода в структуру
субстрата, - распадаться с образованием исходного комплекса субстрат-цитохром
Р-450 и высвобождением супероксида (процесс "разобщения") с
последующей его дисмутацией, с образованием перекиси водорода. В присутствии
ионов железа перекись водорода в результате одноэлектронного переноса может
восстанавливаться до гидроксил-радикала - сильнейшего окислителя. Показано
также, что высвобождение железа из ферритина - белка, являющегося основным депо
железа в клетке, происходит в результате образования супероксида при
функционировании цитохрома Р-450.
Таким образом, супероксид, образующийся при
"разобщении" на цитохроме Р-450, одновременно может быть источником
перекиси водорода и генератором ионов железа из ферритина - компонентов,
необходимых для образования различных активных форм кислорода. Действительно,
образование супероксида, перекиси водорода и гидроксил радикала показано в
реконструированных ферментных системах с использованием различных изоформ
цитохрома Р-450. Введение фенобарбитала увеличивало в микросомах печени крыс
NADPH - зависимое образование активных форм кислорода (супероксида + перекиси
водорода), определяемых методом хемилюминесценции. Ингибитор функционирования
цитохрома Р-450 - SKF 525A - почти на 100% подавлял хемилюминесценeцию.
Увеличение перекисного окисления липидов, вызванное образующимися активными
формами кислорода, показано и в микросомах, выделенных из печени животных,
обработанных пролифераторами пероксисом.
Как уже говорилось, гепатопромоция реализуется в результате
двухфакторного действия индукторов цитохрома Р-450: митогенного эффекта и
ингибирования межклеточных коммуникаций, "отключающего"
контролирующее воздействие окружающих клеток.
Антиоксидантная
система организма, факторы клеточной защиты
Высказывается точка зрения о нескольких уровнях защиты клеток
мак-роорганизма от активных форм кислорода, которые могут быть представлены
следующим образом:
- системная защита клеток за счет значительного снижения
напряжения O2 в тканях по сравнению с атмосферным воздухом;
- обеспечивается в процессе четырехэлектронного
восстановления основной массы внутриклеточного O2 при участии цитохромоксидазы
без освобождения свободных радикалов;
- ферментативное удаление образовавшихся супероксидного
анион-радикала и H2O2;
- наличие ловушек свободных радикалов (антиоксидантов);
- ферментативное восстановление гидроперекисей
полиненасыщенных жирных кислот.
Эффекторные компоненты антиоксидантной системы называются
антиоксидантами. Число эндогенных соединений, относимых к антиоксидантам,
постоянно возрастает. Нет единой универсальной классификации антиоксидантов.
Некоторыми авторами предпринята попытка классификации
антиоксидантов с точки зрения их ММ на 2 группы:
группа. Высокомолекулярные соединения - ферменты
антиоксидантной защиты, а также белки, способные связывать ионы Fe и Cu,
являю-щиеся катализаторами свободнорадикальных процессов. Антиоксидантные
ферменты (СОД, церулоплазмин, каталаза, глутатионзависимые ферменты)
обеспечивают комплексную антирадикальную защиту биополимеров. Для
ферментативных антиоксидантов характерны высокая специфичность, строго
определенная органная и клеточная локализация, а также использование в качестве
катализаторов металлов Cu, Fe, Mn, Zn, Se.
К числу белков, обладающих способностью связывать металлы с
переменной валентностью и соответственно обладающих антиоксидантными
свойствами, относят альбумины крови, трансферрин, ферритин, лактоферрин. Многие
из них весьма эффективны в ингибировании свободнорадикаль-ных процессов, но
слабо проникают через мембраны и тканевые барьеры.
группа. Низкомолекулярные антиоксиданты: некоторые
аминокислоты, полиамины, мочевина, мочевая кислота, глутатион, аскорбиновая
кислота, билирубин, токоферол, витамины группы A, K, P.
При этом можно говорить о своеобразных антиоксидантных цепях
переноса электронов, эффективность функционирования которых определяется
работой всех компонентов.
Эффекты антагонизма установлены в действии смеси токоферола с
природными хинонами (убихиноном, филлохиноном). Напротив, фосфолипиды усиливают
активность всех антиоксидантов, независимо от их природы.
Таким образом, рассматривая в общем виде антиоксидантные
системы, следует иметь в виду, что организм располагает ферментативными
системами, ингибирующими ПОЛ на этапе инициации. Так, СОД инактивирует
супероксиданионрадикал, субстратами действия глутатионпероксидазы и каталазы
являются перекись водорода и гидроперекиси липидов.
Действие ферментных антиоксидантов дополняется в целостном
организме естественными антиоксидантами, в частности, витаминами группы Е,
стероидными гормонами, серусодержащими аминокислотами, аскорбиновой кислотой,
витаминами группы A, K и P, убихиноном, пептидами, производными
гаммааминомасляной кислоты, фосфолипидами, продуктами метаболизма эйкозаноидов,
а также тиолами, в частности, эрготионеином, содержащимся в эритроцитах печени,
мозге.
Важную роль в антиоксидантной защите играют карнозин и его
производные. Как известно, карнозин является природным дипептидом, способным
метаболизироваться в организме человека и животных, обладает стабилизирующим
эффектом в отношении pH среды, а также способностью взаимодействия с OH,
супероксиданионрадикалом и гипохлориданионом с последующей их инактивацией.
Карнозин регулирует за счет антиоксидантных свойств поведенческие реакции.
Касаясь особенностей функционирования ферментного звена
антиоксидантной системы следует отметить, что реакции дисмутации
супероксиданионрадикала и разложения H2O2 экзотермичны, а катализирующие эти
реакции СОД и каталаза не нуждаются в кофакторах, что делает их активность не
зависящей от функционирования других клеточных структур. СОД ускоряет
спонтанную реакцию в 200 раз.
Полагают, что уровень активности внутриклеточных
ферментативных антиоксидантных систем генетически детерминирован, причем избыточное
накопление в клетках супероксидного анион-радикала или перекиси водорода
сопровождается депрессией участков генома, ответственного за активность
внутриклеточных ферментативных антиоксидантных систем.
Обнаружено несколько изоэнзимных форм СОД, отличающихся
строением активного центра. У эукариотов Cu-, Zn-содержащая СОД локализуется в
основном в цитозоле эритроцитов, в межмембранном пространстве митохондрий, в
цитоплазме и ядре нервных клеток. Фермент чувствителен к цианиду, представляет
собой металлопротеид с ММ 32000-33000, состоит из двух субъединиц, каждая из
которых связывает 1 атом Cu и 1 атом Zn.СОД локализована в митохондриях печени
и миокарда эукариот, вблизи анионных каналов. Для микроорганизмов характерны
железосодержащий и марганецсодержащий изоферменты. Mn-СОД состоит из 4
субъединиц с ММ 20 000 каждая, механизм действия энзима, вероятно, подобен
действию Cu-, Zn-СОД-фермента, то есть металл в активном центре попеременно
меняет свою валентность: Mn3+, Mn2+. Супероксиддисмутазную активность могут
проявлять комплексы меди с аминокислотами и пептидами, а также многие
медьсодержащие белки.
Описанные выше изоферментные формы СОД являются
внутриклеточными ферментами, в межклеточной жидкости (плазма крови, лимфа,
синовиальная жидкость) они разрушаются в течение 5-10 минут. В то же время
обнаружена экстрацеллюлярная высокомолекулярная форма СОД (ММ 120000 Д), хорошо
связывающаяся гепаринсульфатом гликокаликса эндотелиоцитов, локально защищает
их от свободных радикалов. Экстрацеллюлярная СОД не связывается с лейкоцитами и
эритроцитами, не участвует в регуляции продукции активных форм O2 гранулоцитами
в процессе киллинга.
СОД существенно ускоряет дисмутации супероксиданионрадикала.
Однако, несмотря на высокую специфичность фермента, при определенных условиях
Cu-СОД может взаимодействовать с H2O2 и выступать в качестве прооксиданта.
В последние годы были синтезированы модифицированные
препараты СОД и каталазы, ассоциированные с иммуноглобулинами, сывороточным
альбумином, высокомолекулярными спиртами, в частности, полиэтиленгликолями, что
обеспечивало стабильность ферментов и длительность их циркуляции в крови.
Подобные ассоциированные формы фермента нашли применение в эксперименте при
эндотоксикозе, инфаркте миокарда, региональной ишемии, ожогах кожи, а также при
стрессорных и воспалительных повреждениях тканей.
Церулоплазмин или голубая феррооксидаза - гликопротеид
сыворотки крови, образующийся в печени, катализирует реакцию:
Fe2+ + 4H+ O2 - > 4Fe3+ + H2O
Он способствует окислению полиаминов, полифенолов,
аскорбиновой кислоты, возможно участвует в транспорте меди. Прямая
антиоксидантная функция определяется супероксиддисмутазной и ферриоксидазной
активностью, а непрямые антиоксидантные свойства связаны с окислением Fe2+ и
аскорбината, потенциальных источников супероксидного анион-радикала. Это
основной реактант острой фазы воспаления.
Как указывалось, в процессе дисмутации супероксидного
анион-радикала образуется H2O2, восстанавливаемая до H2O в основном каталазой и
глутатионпероксидазой.
Каталаза - хромопротеид с ММ около 240 000 Д, состоит из 4
субъеди-ниц, имеющих по одной группе гема, локализуется в основном в
пероксисомах, частично - в микросомах и в меньшей мере - в цитозоле. Полагают,
что каталаза не имеет высокого сродства к H2O2 и не может эффективно
обезвреживать это соединение при низких концентрациях, имеющихся в цитозоле. В
пероксисомах, где концентрация H2O2 высока, каталаза активно разрушает ее.
Разложение H2O2 каталазой осуществляется в два
этапа:+-каталаза + 2 H2O2 - > окисленная каталаза + H2O2 - >
Fe3+-каталаза + H2O2 + O2.
При этом в окисленном состоянии каталаза работает как
пероксидаза. Субстратами в пероксидазной реакции могут быть этанол, метанол,
формиат, формальдегид и другие доноры водорода.
Следует отметить, что около 0,5% O2, образующегося в
результате разложения H2O2, возникает в возбужденном синглетном состоянии и
таким образом в процессе разложения перекиси водорода вновь генерируются
активные формы O2.
Активности каталазы и СОД коррелируют между собой, что может
быть связано с переключением потока электронов с одной цепи транспорта на
другую. В этих условиях СОД и каталаза действуют как звенья одной системы
утилизации O2, размещенные в разных участках клетки.
Максимальная концентрация каталазы обнаружена в эритроцитах.
Важнейшей системой инактивации свободных радикалов являются
восстановленный глутатион и комплекс ферментов - глутатионпероксидазы,
глутатионтрансферазы и глутатионредуктазы.
Глутатион синтезируется в печени, откуда транспортируется в
различные органы и ткани, обеспечивает восстановление дисульфидных групп
белков, дигидроаскорбиновой кислоты, с участием глутатион-трансферазы образует
конъюгаты в печени с электрофильными соединениями и последующим выведением их с
мочой.
Инактивация H2O2 в клетках обеспечивается также
глутатионпероксидазой (ГПО), последняя является Se-содержащим ферментом, около
70% ее локализовано в цитоплазме и около 30% - в митохондриях всех клеток
млекопитающих. Глутатион-пероксидаза - белок с ММ 84000-88000, состоит из 4
идентичных субъединиц, каждая из которых включает 1 атом Se.
Глутатионпероксидаза катализирует реакцию восстановления
гидроперекиси с помощью глутатиона, обладает широкой субстратной специфичностью
по отношению к гидроперекисям, но абсолютно специфична к глутатиону. Сродство
глутатионпероксидазы и H2O2 выше, чем у каталазы, поэтому первая более
эффективно работает при низких концентрациях субстрата, в то же время в защите
клеток от окислительного стресса, вызванного высокими концентрациями H2O2,
ключевая роль принадлежит каталазе. Последнее особенно четко продемонстрировано
на эндотелиальных клетках.
В клетках млекопитающих, кроме S-зависимой ГПО, выявлена ГПО
без S с ММ 39000-46000, катализирующая восстановление гидроперекисей
органических соединений в том числе и полиненасыщенных жирных кислот, но ее
эффективность в отношении H2O2 чрезвычайно низка.
Стресс через адренергические рецепторы, цАМФ и протеинкиназу
стимулирует активность ГПО.
Бесселеновая глутатионпероксидаза локализована в
митохондриальных мембранах печени, почек, сердца, в то время как селеновая - в
эритроцитах.
ГПО принадлежит активная роль в защите лизосомальных мембран
от перекисного окисления.
ГПО элиминирует перекиси стеринов и нуклеиновых кислот,
является адаптивным ферментом, активность которого регулируется продуктами
липопероксидации и активными формами O2. Важным компонентом антиоксидантной
системы является глутатионтрансфераза, ингибирующая инициацию ПОЛ и
обезвреживающая токсические метаболиты ПОЛ. Фермент активируется через цАМФ.
Тканевая ГПО, по мнению ряда авторов, представляет собой изоформу
глутатионтрансферазы.
Важную роль в инактивации свободных радикалов отводят
внутриклеточным и внеклеточным ловушкам, обеспечивающим обрыв цепи
свободнорадикального окисления.
Эффективными "перехватчиками" радикалов являются
фенольные антиоксиданты, в частности, простые фенолы, нафтолы и оксипроизводные
других ароматических соединений. В настоящее время выделено несколько тысяч
фенольных соединений, среди которых выраженным антиоксидантным эффектом
обладают витамины Е и К, убихиноны, триптофан и фенилаланин, а также
большинство растительных и животных пигментов, в частности, каротиноиды,
флавоноиды, фенокарбоксильные кислоты. Большое биологическое значение для
человека имеет антиоксидант - токоферол. Он жирорастворим, его основная
локализация - гидрофобный слой биологических мембран; инактивирует главным
образом радикалы жирных кислот.
Фенольные антиоксиданты (ликопен, каротины, билирубин) служат
ингибиторами супероксидного анион-радикала, синглетного кислорода, гидроксильного
радикала.
К одному из самых эффективных антиоксидантов, принимаемых с
пищей можно отнести витамин Е. Недостаток витамина Е способствует деструкции
мембран и экскреции креатина с мочой. Витамин Е - мощный антимутаген, в
физиологических концентрациях является регулятором тканевого дыхания, а
антиоксидантные свойства его проявляются при 10-15-кратном повышении этих доз.
Кроме -токоферола, в клетках содержатся водорастворимые антиоксиданты,
в том числе аскорбат, которые реагируют с более широким спектром свободных
радикалов и поддерживают содержание токоферола.
Витамин Е чаще всего принимается вкупе с витамином С.
Аскорбиновая кислота может выступать в качестве донора и акцептора ионов
водорода благодаря наличию в структуре двух фенольных групп, ее антиоксидантные
свойства характеризуются широким спектром инактивирующего действия на различные
свободные радикалы. Аскорбиновая кислота превосходит другие антиоксиданты
плазмы крови в защите липидов от перекисного окисления.
Обращает на себя внимание тот факт, что в присутствии ионов
Fe или Cu аскорбиновая кислота становится мощным прооксидантом. Антиоксидантные
свойства аскорбиновой кислоты связаны с ее окси-редуктазными переходами. Теряя
атом водорода, аскорбиновая кислота превращается в радикал - монодегидроаскорбиновую
кислоту, проявляющую прооксидантный эффект, потеря еще одного атома H+ приводит
к образованию дегидроаскорбиновой кислоты. При этом участвует фермент,
содержащий медь - аскорбатоксидаза. Известно, что аскорбиновая кислота
восстанавливает продукт окисления токоферола - токофероксид в токоферол.
Витамины P и C также восстанавливаются. Аскорбиновая кислота более стабильна в
присутствии метилметионина, обеспечивающего не только восстановление
дегидроаскорбиновой кислоты, но и полноценность функционирования глутатионового
звена антиоксидантной.
Важная роль в антиоксидантной защите организма отводится
SH-содержащим соединениями к числу которых относятся помимо вышеописанного
трипептида - глутатиона цистеин, цистин и метионин.соединениям отводится
ведущая роль в защите клеток от радикала OH. В связи с коротким периодом жизни
и радиусом диффузии OH. в биологических системах указанное соединение не
подвергается ферментативной инактивации и в то же время может оказать сильное
цитотоксическое и мутагенное действие, последние определяет значимость
SH-содержащих соединений - активных перехватчиков OH. - радикалов. При
различных стрессорных воздействиях, под влиянием эффектов токсических и
ферментативных факторов патогенности различных инфекционных возбудителей, в
частности, чумы, анаэробной газовой инфекции, стрептостафилококковой групп
бактерий, наблюдается обратимая окислительная модификация SH-групп, приводящая
к увеличению дисульфидных групп, что является типовой неспецифической реакцией
организма на действие экстремального раздражителя.
Однако изменение соотношения восстановленных и окисленных
тиогрупп в сторону преобладания последних изменяет состояние проницаемости
клеточных мембран, их адгезивные свойства, приводит к резкому угнетению функции
серусодержащих ферментов или коферментов (липоевой кислоты, коэнзима А,
глутатиона), нарушению работы тиоловых металлопротеидов (цитохром P-450), ряда
гормональных рецепторов и факторов транскрипции.
Заключение
Резюмируя вышеизложенное в целом, следует заключить, что в
целостном макроорганизме находятся в динамическом равновесии системы генерации
свободных радикалов, в частности, свободных форм кислорода, и антирадикальной,
антиоксидантной защиты. Нарушение этого взаимодействия нередко приводит к
дестабилизации биологических мембран, активации процессов липопероксидации,
расстройствам гемостаза, фибринолиза, активации каликреинкининовой системы,
системы комплемента, нарушению васкуляризации, оксигенации и трофики тканей,
потенцированию специфических цитопатогенных эффектов воздействия бактериальных
токсинов. Антиоксиданты блокируют активацию протоонкогенов, нормализуют
иммунный статус. Ослабление антиоксидантной защиты клеток может быть вызвано
недостаточным поступлением в организм неферментных антиоксидантов, в частности,
токоферола. Недостаточное поступление в организм селена может быть одной из
причин нарушения активности селензависимой глутатионпероксидазы, дефицит Cu2+ и
Zn2+ резко снижают активность СОД и резко повышают чувствительность к
оксидантному повреждению.
Следует отметить, что изменения активности антиоксидантных
ферментов зависят от интенсивности образования активных форм кислорода: в
случае умеренного возрастания АФК возникает, как правило активация ферментного
звена антиоксидантной системы, при чрезмерном возрас-тании уровня свободных
радикалов нередко происходит, подавление ферментативного звена радикальной
защиты клеток.
Как известно, в условиях окислительного стресса,
развивающегося при гипоксии, ишемии, гипероксии, действии стрессорных
раздражителей бактериальной природы - эндо-, экзотоксинов, ферментов и токсинов
бактерий, ферментативная защита оказывает менее эффективное по сравнению с
протекторным действием низкомолекулярных антиоксидантов. Последнее обусловлено
быстрой инактивацией конститутивного пула ферментов антиоксидантной системы
свободными радикалами и значительным временем, необходимым для индукции их
синтеза. В связи с этим повышается значимость низкомолекулярных антиоксидантов,
что обусловлено их избыточным содержанием в клетках и биологических жидкостях,
а также достаточно высокой миграционной способностью.
Однако при чрезмерном образовании инициаторов
свободно-радикального окисления может истощиться пул и неферментных
антиоксидантов, которые, выполнив роль ловушки свободных радикалов, превращаются
в неактивные димерные и другие формы.
Таким образом, на уровне целостного организма здоровье
заключается в гармонии и равновесии. Целью данной работы было ознакомится с
природой АФК и возможностями организма от них защитится. Таком образом мы можем
заключить, что опасны как избыток АФК так и их недостаток, с пищей мы должны
получать антиоксидантов не больше и не меньше нашей потребности в них.
Напоследок, для пользы с точки зрения повседневной жизни хотелось бы привести
список продуктов, компоненты которых содержат антиоксиданты:
ПРОДУКЫ/АНТИОКСИДАНТНАЯ СПОСОБНОСТЬ/ГРАММ
Ягоды и фрукты:
Клюква 94.56
Черника (дикорос) 92.60
Чёрная слива 73.39
Слива (тип не указан) 62.39
Черника (культивируемая) 62.20
Маленькая красная фасоль 149.21
Обычная красная фасоль 144.13
Фасоль (цвет не определён) 123.59
Артишоки 94.09
Чёрные бобы 80.40
Орехи:
Пеканы 179.40
Грецкий орех 135.41
Фундук, лесной орех 135.41
Фисташки 79.83
Миндаль 44.54
Специи:
Гвоздика 3144.46
Молотая корица 2675.36
Душицы лист 2001.29
Куркума 1592.77
Сушёная петрушка 743.49
Список,
используемой литературы
1. А.
Ленинджер "Основы биохимии" М., 1985.
2. Северин
Е.С. "Биохимия" М., 2003
. Николаев
А.Я. "Биоорганическая химия" М., 2007
. Эмануэль
Н.М., Лясковская Ю.Н., Торможение процессов окисления жиров, М., 1961.
5. <http://www.rae.ru/ru/publishing/mono07_42.html>
- официальный сайт Российской Академии Естествознания.
. http://humbio.ru/humbio/no-phys/0000dda4.
htm <http://humbio.ru/humbio/no-phys/0000dda4.htm> - База знаний по
биологии человека.
. Лекции:
. 1)"Антиоксидантная
система и пеpекисное окисление липидов у больных с пpедопухолевыми
заболеваниями и pаком молочной железы" - Савина Е.В., Слонимская Е.М.,
Кондакова И.В., Гаpбуков Е. Ю.
2)
Активные формы кислорода и антиоксидантная система - Астратенкова И. В.