Физиологическая роль миелопероксидазы в норме и при патологии
Введение
Миелопероксидаза (MPO)
является одной из самых изученных эндогенных пероксидаз млекопитающих. Основной
функцией МРО в организме является защита от внешней инфекции, однако при ряде
условий она может вызывать повреждение собственных тканей организма в очагах
воспаления [6].
Молекула МРО (М 150 кД) состоит из двух идентичных, соединенных между
собой дисульфидной связью, димеров, каждый из которых содержит
гликозилированную тяжелую α-субъединицу (57 кД) с ковалентно
связанным гемом (протопорфирин IX с ионом железа в центре) и
негликозилированную легкую β-субъединицу (12 кД) [6, 11].
Данный фермент содержится в азурофильных гранулах нейтрофилов (до 5%
сухого веса клетки), а также в моноцитах и некоторых типах тканевых макрофагов
[35].
Биосинтез МРО осуществляется во время дифференциации миелоцитов в костном
мозге и заканчивается ко времени выхода зрелых гранулоцитов и моноцитов в
кровеносное русло. После активации Фк происходит дегрануляция, и МРО
секретируется либо внутрь фагосомы, либо во внеклеточное пространство
(межклеточная жидкость, кровь). При наличии воспаления уровень свободной МРО в
крови повышается. Будучи катионным белком, МРО может связываться с
отрицательно-заряженной клеточной мембраной, в частности эндотелиальной, и при
наличии субстрата может вызывать окислительные повреждения тканей организма в
очагах воспаления.
В клинической практике активность МРО нейтрофилов служит маркером
интенсивности воспалительных процессов, а также является перспективным
диагностическим и прогностическим показателем при ряде заболеваний и
патологических состояний [45].
Повышенный системный уровень МРО (содержание МРО в нейтрофилах и в
кровотоке) ассоциируется с наличием коронарных артериальных заболеваний и может
увеличивать риск развития неблагоприятных кардиологических событий (инфаркт
миокарда, внезапная смерть и др.) у больных с грудной болью и острым коронарным
синдромом. Кроме того, повышенный уровень МPО может способствовать развитию атеросклероза, системных
васкулитов различной этиологии, многих воспалительных процессов хронического
течения [41].
С другой стороны, снижение и исчезновение активности МPО сопровождается падением
резистентности организма к инфекции, что является одним из ведущих факторов
генерации патологического процесса.
Целью данной работы является модификация лабораторного метода для
спектрофотометрического определения спонтанной активности MPO полиморфноядерных гранулоцитов
периферической крови человека и его сравнительная оценка c различными лабораторными методами
определения активности MPO
нейтрофилов.
Для реализации данной цели были поставлены следующие задачи:
1. Модифицировать лабораторный метод определения спонтанной активности MPO нейтрофилов периферической крови
человека с целью проведения всех стадий анализа в растворе для спектофотометрической
оценки результатов
2. Сравнить результаты, полученные с использованием
модифицированного лабораторного метода с результатами, полученными с
применением других методов оценки активности MPO
. Оценить модифицированный лабораторный метод с точки зрения
основных требований, предъявляемых к лабораторным методам определения
активности ферментов в клинических условиях
1. Обзор литературы
.1 Гранулярный состав и продукты секреции
полиморфноядерных гранулоцитов
Нейтрофилы (Нф) - клетки крови миелоидного ряда,
имеющие дольчатое ядро и нейтральную зернистость. Обладают высокой
мобильностью, фагоцитарной активностью и бактерицидным потенциалом. Это
основные эффекторные клетки на ранних этапах инфекционной агрессии. Для Нф
характерны многодольчатое (сегментированное) ядро и диаметр 10-20 мкм [13].

Рисунок 1.1 - Структурная организация полиморфноядерного гранулоцита
Характерной чертой Нф является наличие цитоплазматических гранул (рисунок
1.1). Они были открыты P. Ehrich (1900 г.) после разработки техники
фиксации и окраски клеток, позволившей по характеру ядра и гранул разделить
лейкоциты на Нф, эозинофилы и базофилы. В Нф были выделены два типа гранул:
азурофильные (или первичные) и специфические (или вторичные). Эти два типа
гранул являются доминирующими. Кроме того в них имеются желатинозные (или
третичные) гранулы и секреторные везикулы [28].
После выхода из кровотока Нф, находясь под воздействием стимулов,
выделяют различные секреторные продукты, способные взаимодействовать как с
микроорганизмами, так и с клетками тканей. Факторы секреции нейтрофилов
преимущественно накапливаются в лизосомальных гранулах. Эти гранулы, согласно
их морфологии и содержанию, делятся на азурофильные (первичные) и специфические
(первичные и вторичные). Оба типа гранул (азурофильные и специфические)
содержат протеолитические ферменты, активные по отношению компонентов
интерстициальной ткани.
Азурофильные гранулы в отличие от специфических имеют сильный аффинитет к
основному красителю азуру А. Они содержат матрикс, состоящий из отрицатель
заряженных протеогликанов гепарина и хондроитина сульфата. В гранулах создается
кислый pH. Матрикс прочно связывает катионные
белки и пептиды, в силу чего последние находятся в неактивном состоянии. Существенной
особенностью азурофильных гранул является наличие МPО. Характерная черта азурофильных гранул - отсутствие в них
компонентов NADPH-оксидазной системы и интегрина CD11b/CD18 (CR3), которые имеются в специфических,
желатинозных и секреторных везикулах. Кроме МPО здесь находятся три нейтральные протеиназы (катепсин G, эластаза, протеиназа 3), группа
сериновых протеиназ, бактерицидный белок, повышающий проницаемость (BPI), дефензимы, лизоцим [7, 8].
Дефензины - микробоцидные катионные пептиды с молекулярной массой 3-5 кД
с тремя консервативными дисульфидными мостиками. Дефензимы обладают широким
спектром микробоцидного действия против бактерий, грибов и оболочечных вирусов.
Они встраиваются в клеточные мембраны и вызывают образование множественных пор,
что ведет к нарушению проницаемости клетки [32].
Лизоцим является ферментом мураминидазой, разрушающим β-глюкозидные связи между N-ацетилглюкозамином и N- ацетилмурамовой кислотой
пептидогликана клеточной стенки бактерии. К нему особенно чувствительны грамположительные
бактерии. В азурофильных гранулах находится около 1/3 лизоцима Нф [17].
Матрикс специфических гранул содержит важный бактерецидный фактор -
ненасыщенный лактоферрин. Он связывает железо и медь, необходимые для
размножения бактерий. В количественном отношении лактоферрин является
преобладающим белком этих гранул. Лактоферрин обладает также антигрибковой и
антивирусной активностью. В матриксе специфических гранул находятся
транскобаламин, связывающий цианокобаламин, 2/3 имеющегося в клетке лизоцима,
желатиназа, коллагеназа, сиалидаза, гистаминаза и др. Желатиназа и коллагеназа
способствуют продвижению Нф в органах и тканях [29].
К желатинозным относятся гранулы, содержащие, содержащие желатиназу, но
не содержащие лактоферрин. В гранулах желатиназа так же, как и коллагеназа
специфических гранул, находится в неактивном состоянии. Они становятся
активными при отщеплении N-концевого
пептида протеазами азурофильных гранул или внеклеточными протеазами. Содержимое
желатинозных гранул способствует миграции Нф в воспалительном очаге. Иногда
желатинозные гранулы относятся к вторичным, различая их только по содержанию
лактоферрина. Мембрана секреторных везикул содержит основные поверхностные
рецепторы и ферменты Нф - флавоцитохром b558, рецепторы для комплемента (CR1,CR3), FcγRIII, CD14 (один из главных маркеров лейкоцитов), щелочную фосфотазу,
рецептор для формилпептидов (fMLP-R) и др. Матрикс секреторных везикул
включает только один компонент - сывороточный альбумин, являющийся их маркером
[21, 40].
В покоящемся состоянии гранулы равномерно распределены в цитолизе клетке.
При активации происходит мобилизация гранул, в частности, включение ряда
цитозольных белков в их мембрану. Наиболее быстро мобилизуются секреторные
везикулы и желатинозные гранулы, затем специфические; последними мобилизуются
азурофильные гранулы [33].
Одним из важных следствий активации Нф является процесс дегрануляции,
который может происходить в виде эндоцитоза и экзоцитоза. В первом случае
мембраны гранул сливаются с мембраной фагосомы и их содержимое поступает в
фагосому. Слияние азурофильных и специфических гранул с фагосомой происходит
примерно одновременно. Для функционирования образовавшейся фаголизосомы
необходимо поступление в нее положительно заряженных ионов калия,
нейтрализующих отрицательный заряд протеогликанов азурофильных гранул и
освобождающих тем самым протеазы и положительно заряженные дефензимы. Без
вливания калия гибели микробов в фагосоме не происходит.
Состав вторичных специфических гранул:
· катионные белки (формируют водные
каналы в мембранах, что приводит к лизису клетки)
· щелочная фосфатаза (отщепляет
фосфатные группы от различных субстратов, участвует в трансфосфорилировании)
· фагоцитин (разрушает мембраны)
· лактоферрин (лишает пролиферирующие
бактерии железа и железосодержащих факторов роста)
· белок, связывающий витамин В12
(связывает витамин В12, необходимый для пролиферации бактерий)
· лизоцим (разрушает пептидогликаны
клеточной стенки бактерий)
· коллагеназа (расщепляет коллаген)
· гепараназа, (индуцирующая гидролиз
гепаран сульфата)
· желатиназа, (проявляющую
специфическую активность в отношении коллагена V типа)
Состав первичных специфических гранул:
· миелопероксидаза (катализирует
образование хлорноватистой кислоты, котрая обладает токсическими свойствами для
бактерий и клеток)
· лизоцим (разрушает пептидогликаны
клеточной стенки бактерий)
· катионные белки (формируют водные
каналы в мембранах, что приводит к лизису клетки) [31]
Состав неспецифических (азурофильных) гранул:
· катепсины А, D, Е (расщепляют белки,
разрушают бактерии)
· альфа-фруктозидаза (отщепляет
фруктозу от дисахаридов)
· 5-нуклеотидаза (отщепляет фосфат от
ДНК и РНК)
· бета-галактозидаза (отщепляет
галактозу от ди- и олигосахаридов)
· арилсульфатаза В (отщепляет
сульфатные группы)
· a-маннозидаза (отщепляет маннозу от
ди- и олиго- и полисахаридов)
· N-ацетил - бета- глюкозоаминидаза
(расщепляет ацетилгалактозамины от олигосахаридов)
· бета-глюкоуронидаза (расщепляет
гликозаминогликаны)
· кислая-бета-глицерофосфатаза
(отщепляет фофсат от остатка глицерола)
· кислая фосфатаза (отщепляет фосфаты
от различных субстратов)
· нейтральные протеиназы
· азуроцидин (антибактериальный белок)
· катепсин G (расщепляет белки)
· эластаза (разрушает эластин)
· коллагеназа (разрушает коллаген)
· протеиназа 3 (миелобластин) -
(расщепляет эластин)
· катионные белки (формируют водные
каналы в мембранах, что приводит к лизису клетки) [13, 28].
Катепсин G, эластаза, протеиназа-3 (PR-3) и азуроцидин на основе
гомологичности первичной структуры и проявляемой ими антимикробной активности
объединены в единую структурно-функциональную группу белков, получивших
название серггроцидины (serproci-dins-serine protease cidins). Все они являются
гликопротеинами с молекулярной массой в пределах 25-35 кДа и содержатся в Нф
человека в относительно заметном количестве: катепсин G - 2.5 мг/109 клеток,
эластаза - 1.5, протеиназа-3 - 1.0 мг/109 клеток. Наиболее активным в
антимикробном отношении представителем этой группы белков является катепсин G,
наиболее слабым - эластаза и протеиназа-3 [31].
Катепсин
G - химотрипсиноподобная протеиназа Нф и селезенки
<#"557513.files/image002.gif">

Рисунок 1.2.1 - Структурная организация молекулы миелопероксидазы
Agner
в 1941 году впервые выделил этот фермент из Нф и обнаружил его способность в
присутствии Н2О2 обезвреживать токсины столбняка и дифтерии. Нф обладают
миелопероксидазной системой, которая включает в себя собственно MPO, Н2О2, и окисляемые кофакторы - ионы
хлора, йода и брома [50].
MPO
осуществляет кислородзависимый механизм разрушения микроорганизмов, катализируя
т. о. развитие токсического воздействия на различные микроорганизмы (рисунок
1.2.2) [37].
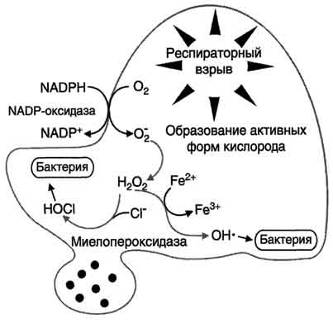
Рисунок 1.2.2 - Кислородзависимый механизм киллинга при фагоцитозе
Активированные Нф продуцируют Н2О2 во время респераторного взрыва в
каскаде активных форм (восстановление метаболитов) кислорода, в числе которых
супероксидный и гидроксильный радикалы, а также синглетный кислород (рисунок
1.2.3). В норме Фк используют перекись водорода для синтеза гипохлорита под
влиянием MPO. Гипохлорит разрушает стенку
бактериальной клетки и тем самым убивает бактерии. Перекись водорода
диффундирует в клетки, но там разрушается в результате активности ферментов
каталазы и глутатионпероксидазы [4].
Рисунок 1.2.3 - Мембраноатакующий комплекс свободных радикалов на
чужеродный объект
MPO
окисляет кофакторы, переводя их в активную форму, при этом генерируются
эффективные микробицидные свойства. Нф в присутствии MPO способны продуцировать гипохлорную кислоту, которая
вместе с Н2О2 выполняет антимикробную функцию, а также играет роль медиатора
воспаления и увеличивает проницаемость сосудистого эндотелия [12].
Механизм микробицидного действия MPO также связан с декарбоксилированием и
дезаминированием аминокислот бактерий, быстрым и обширным подавлением синтеза
бактериальной ДНК. Синглетный кислород нарушает проницаемость клеточных
мембран, инициирует перекисное окисление липидов (ПОЛ) (рисунок 1.2.4) [5].
Рисунок 1.2.4 - Механизм перекисного окисления липидов
Биологическое действие MPO в
значительной мере определяется балансом между эффективностью секреции этого
фермента во внеклеточное пространство на стадии дегрануляции нейтрофилов, с
одной стороны, и его инактивацией и утилизацией в тканях, а также деградацией
окислителей, образующихся в реакциях с участием MPO, с другой стороны. При секреторной дегрануляции или
гибели Нф может проявляться патологическое действие фермента.
В этом случае образующиеся в результате функционирования MPO сильные окислители инициируют
пероксидацию липидов, модификацию белков и нуклеиновых кислот (включая
галогенирование, нитрование, окисление и образование сшивок), вызывая тем самым
повреждение собственных тканей в очагах воспаления (рисунок 1.2.5).
Рисунок 1.2.5 - Пероксидация липидов в сосудистом эндотелие
MPO
может играть решающую роль при атеросклерозе, сердечно-сосудистых,
онкологических, нейродегенеративных заболеваниях, нарушении дыхательной функции
легких, при заболеваниях почек, системных васкулитах, ревматоидном артрите и
др. [30].
Особое внимание отводится роль MPO в развитии сердечно-сосудистых заболеваний, повышенный уровень которой в
крови ассоциирован с наличием коронарных артериальных заболеваний (рисунок
1.2.6). Образующиеся с участием MPO
гипогалоидные кислоты, осуществляют антимикробное действие, но обладая высокой
реакционной способностью, они могут повреждать собственные ткани в очагах
воспалении.
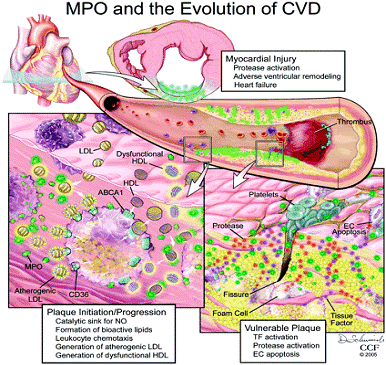
Рисунок
1.2.6 - Роль МPO в развитии сердечно-сосудистой
патологии
MPO
трансформирует липопротеины низкой плотности в «атерогенную» форму, что
способствует развитию ранних атеросклеротических поражений сосудов. За счет
потребления эндогенного NO в качестве субстрата, МРО может участвовать в
развитии дисфункции эндотелия, являющейся одним из ранних изменений атерогенеза
и характеризующейся развитием ненормальной сосудистой реактивности и
экспрессией различных провоспалительных и протромботических факторов (рисунок 1.2.7). Так было показано, что МРО усиливает катаболизм NO во
время ишемии миокарда и реперфузии. Была установлена обратная корреляция между
сывороточным уровнем МРО и потоко-опосредованной дилатацией плечевой артерии
[44, 53].
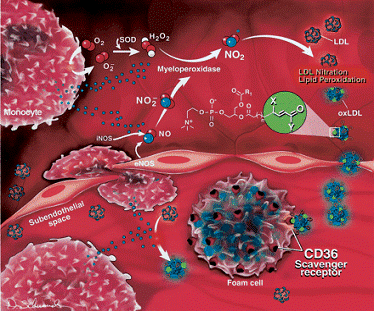
Рисунок
1.2.7 - Участие MPO в иммунопатогенезе атеросклеротических поражений
сусодов
МPO
учавствует также в развитии системных васкулитов. Системный микрососудистый
васкулит (МСВ) характеризуется микроваскулярным воспалением и некрозом и чаще
всего поражает почки и легкие, вызывая быстро прогрессирующий гломерулонефрит и
легочную геморрагию (рисунок
1.2.8). Было показано, что МСВ
ассоциирован с наличием аутоантител к цитоплазматическим, лизосомальным
компонентам нейтрофилов и моноцитов, в частности к МРО. Такие аутоантитела были
названы антинейтрофильными цитоплазматическими аутоантителами (ANCA).
Аутоантитела к МРО были обнаружены у больных с микроскопическим полиангиитом,
аутоиммуным некротизирующим серповидным гломерулонефритом и синдромом
Churg-Strauss. При этом изменения титра аутоантител отражали интенсивность
заболевания [15, 42].
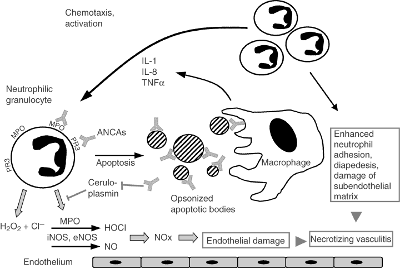
Рисунок 1.2.8 - Иммунопатогенез МСВ
В
опытах in vitro было показано, что ANCA могут активировать TНФa-примированные
Нф, вызывая дегрануляцию, продукцию реактивных окислительных метаболитов,
секрецию провоспалительных цитокинов. Кроме того, ANCA усиливали адгезию Нф к
эндотелиальному монослою. Совместная инкубация ANCA-активированных Нф и
эндотелиальных клеток приводила к лизису эндотелиоцитов [42].
С
другой стороны, у пациентов с дефицитом MPO, как правило
снижается сопротивляемость организма и повышается чувствительность к инфекциям.
Т. к., генерируемые MPO окислители (HOCI, HOBr, свободные
радикалы и др.), являются высокореакционными соединениями; именно им
пренадлежит основная микробицидная функция Нф [47].
.3
Методы оценки ферментативной активности нейтрофилов
Оценка
ферментативной активности Нф используется при оценке иммунного статуса
организма. Ферментативную активность клеток определяют для ферментов:
миелопероксидазы, аденозинтрифосфатазы, кислой фосфатазы, нитро-синего
тетразолия, цитохромоксидазы, лактатдегидрогеназы, сукцинатдегидрогеназы и
катионных белков [27].
)
НСТ-тест. Принцип НСТ-теста состоит в образовании нерастворимых окрашенных
гранул формазана при восстановлении нитросинего тетразолия (НСТ) супероксидным
анион-радикалом, образующимся при активации Фк. Этот тест отражает степень
активизации кислородозависимых механизмов бактерицидной активности Фк, в основе
которых лежит активация НАДФ-Н2-оксидазы и гексозомонофосфатного шунта.
Электроны, освобожденные с НАДФ-Н2, превращают молекулярный кислород в
супер-оксиданион, восстанавливающий нитросиний тетразолий. Различают спонтанный
НСТ-тест с интактными полиморфноядерными лейкоцитами, не подвергавшимися
воздействию стимуляторов, и индуцированный [16, 39].
Выделенная
клеточная взвесь с концентрацией 2×106 кл/мл на основе среды 199, включающей НСТ (nitro blue tetrazolium 0,5
мг/мл), делится на две части и в половину из проб вносится S.aureus в
концентрации 2×107 кл/мл.
Затем взвесь клеток с бактериями и без них разносится по 100 мкл в лунки
плоскодонного 96-луночного планшета по три на каждый образец. После инкубации
при 37°С в течение 45 мин клеточный монослой трижды отмывается теплым раствором
Хенкса без фенолового красного от раствора НСТ и непоглощенных бактерий и
высушивается. Монослой клеток фиксируется в парах формалина в течение 15 мин.
Затем клетки разрушают путем добавления в лунки предварительно разогретого до
83°С диметилсульфамида (DMSO, производство «ICN») по 50 мкл. Оптическая
плотность полученных растворов измеряется на спектрофотометре "Multiscan
Titertek Plus" ("Flow lab.") при длине волны 540 нм [46].
)
Тесты на фиксированных образцах
Определение
активности ферментов проводится на фиксированных образцах, которые
приготовляются следующим образом. Выделенная клеточная взвесь с концентрацией 2×106 кл/мл делится на две части и в половину из проб
вносится S.aureus в концентрации 2×107 кл/мл. Затем взвесь клеток с бактериями и без них разносится по 100
мкл в лунки плоскодонного 96-луночного планшета по три на каждый образец. После
инкубации при 37°С в течение 45 мин клеточный монослой трижды отмывается теплым
раствором Хенкса без фенолового красного от непоглощенных бактерий и
высушивается. Затем фиксируют в парах формалина в течение 15 мин, после чего
исследуют ферментативную активность клеток [49].
)
Определение активности миелопероксидазы
А)
Твердофазный метод
Свежеприготовленный
субстратный раствор (к 10 мл фосфатно-цитратного буфера (рН 5,0) добавляется 4
мг o-phenylenediamine (ICN) и 500 мкл 0,33% перекиси водорода) по 100 мкл
вносится в лунки планшета, содержащие адгезированные на пластик и фиксированные
клетки. Планшет инкубируется при комнатной температуре в течение 10 мин, затем
реакция останавливается добавлением 10% раствора серной кислоты по 100 мкл на
лунку. Оптическая плотность раствора определяется на спектрофотометре
"Multiscan Titertek Plus" ("Flow lab.") при длине волны 492
нм) [38].
Б) Цитохимические методы
Пероксидаза является ферментом - лизосомальной каталазой, катализирующей
в присутствии перекиси водорода окисление различных субстратов. При окислении
ортотолидина или бензидина, используемых в реакциях, образуются интенсивно
окрашенные соединения, в том случае, если в клетке присутствует пероксидаза,
при взаимодействии с которой перекись водорода разрушается с выделением
кислорода, который и окисляет орто-толидин или бензидин, переводя их в
окрашенные соединения (рисунок 1.3). В цитохимических реакциях активность
фермента определяется по окислению хромогенов (бензидина, о-дианизидина и
других) по методу Грэхема-Кнолля или его модификаций [2, 45].
Рисунок 1.3 - Реакция на миелопероксидазу
Метод Грэхема-Кнолля. В присутствии миелопероксидазы бензидин окисляется
перекисью водорода в коричневый оксибензидин.
· Свежие мазки фиксируют 4%
формалиново-спиртовым раствором в течение 30 секунд.
· Обмывают в проточной воде и
высушивают.
· Заливают пероксидазным реактивом на 5
минут.
· Тщательно промывают в проточной воде
и высушивают.
· Докрашивают красителем
Романовского-Гимзы.
· Миелопероксидаза выявляется в
цитоплазме клеток в виде коричневых гранул [20].
В) Спектрофотометрический метод определение активности миелопероксидазы в
клеточном лизате Нф
Содержание MPO в лизате Нф
оценивают количественным спектрофотометрическим методом с использованием 0,04%
раствора ортофенилендиамина (ОФД) на фосфатном буфере с pH 5,0 и добавлением
0,33% раствора перекиси водорода в соотношении 20:1 по объему. Длина волны 495
нм [36].
· Нф помещают дистилированную воду;
получают клеточный лизат.
· Производят титрование лизата
· Добавляют пероксидазный субстрат
· Измеряют оптическую плотность [44].
) Определение активности кислой фосфатазы
В лунки плоскодонного 96-луночного планшета, содержавшего фиксированные
клетки, вносится по 50 мкл раствора паранитрофенилфосфата (ПНФФ-раствор, ICN).
Для его приготовления 0,09 г ПНФФ и 0,31 г NaCl растворялось в 37 мл 1М
натрий-цитратного буфера (рН 5,5). Образцы инкубируются при 37°С в течение 30
мин. Затем добавлением 0,2 М раствора NaOH по 100 мкл на лунку реакция
останавливается. Оптическая плотность раствора измеряется на спектрофотометре
"Multiscan Titertek Plus" ("Flow lab.") при длине волны 405
нм. [51].
) Определение активности цитохромоксидазы
Свежеприготовленный субстратный раствор (к 10 мл 0,1 М ацетатного буфера,
рН 5,5, добавляем 20 мг 3,3*-diaminobenzidine (ICN), 100 мг MnCl2 и 300 мкл
0,33% перекиси водорода) по 100 мкл вносится в лунки планшета, содержащие
фиксированные клетки. Планшет инкубируется при комнатной температуре в течение
10 мин, затем реакция останавливается добавлением 10% раствора серной кислоты
по 100 мкл на лунку. Оптическая плотность определяется на спектрофотометре
"Multiscan Titertek Plus" ("Flow lab.") при длине волны 492
нм [39].
) Определение активности лактатдегидрогеназы
К адгезированным и фиксированным на пластике клеткам добавляется 100 мкл
раствора iodonitrotetrazolium violet (йоднитротетразолий, ЙНТ, производства
ICN) с концентрацией 2 мг/мл. Для этого 20 мг ЙНТ растворяется сначала в 0,5 мл
70° спирта, а затем добавляется 9,5 мл 0,1 М фосфатного буфера (рН 7,2-7,4),
включающего 4 мл 1% раствора MnCl2. Монослой клеток вместе с раствором ЙНТ
инкубируется при 37°С в течение 30 мин, после чего надосадок удаляется,
монослой клеток дважды отмывается раствором Хенкса и высушивается.
Расположенные внутриклеточно гранулы диформазана растворяют 100 мкл
изопропилового спирта, подкисленного 0,04 М HCl, в течение 20 мин. Оптическая
плотность раствора определяется на микроплатном рейдере при длине волны 492 нм
.
) Определение активности сукцинатдегидрогеназы
Определение активности фермента проводится в МТТ-тесте, где в качестве
субстрата используется 3-(4,5-dimethylthiazolyl-2)-2,5-diphenyl tetrazolium
bromide (метилтиазолилтетразолий бромид, МТТ, производства ICN). В лунки к
фиксированным клеткам добавляется по 100 мкл МТТ (2 мг/мл) на основе 0,1 М
фосфатного буфера (рН 7,2-7,4), включающего 4 мл 1% раствора MnCl2. Монослой
клеток вместе с раствором МТТ инкубируется при 37°С в течение 30 мин, после
чего надосадок удаляется, монослой клеток дважды отмывается раствором Хенкса и
высушивается на воздухе. Для подсчета гранул бромида диформазана клетки
разрушаются добавлением 100 мкл изопропилового спирта, подкисленного 0,4 М HCl.
Оптическая плотность определяется на микроплатном рейдере при длине волны 540
нм. Реакции ставятся в триплетах лунок плоскодонного 96-луночного планшета с не
стимулированными и стимулированными клетками. Оптическую плотность раствора
измеряют на микропроцессоре Titertek Multiscan Plus ("Flow lab.") при
соответствующей для каждого фермента длине волны [16].
2. Материалы и методы исследования
.1 Использованные материалы
В работе были использованы следующие реактивы: хлорид натрия NaCl («Пять
океанов», г. Минск, хч), хлорид калия KCl («Пять океанов», г.Минск, хч),
гидрофосфат натрия NaH2PO4 («Пять океанов», г.Минск, хч), глюкоза,
фиколл-урографин («Sigma», Германия, хч), краситель Романовского-Гимзы
(«МиниМед», г.Брянск), уксусная кислота («Лаверна», г. Москва, хч).
В качестве основного буферного раствора использовали 10мМ калий-натрий
фосфатный буфер, содержащий 140мМ NaCl, 10мМ KCl, 10мМ NaH2PO4, 5мМ глюкозы; рН
7,3, а также 0,1М натрий-цитратный буфер, рН 4,5.
.2 Получение полиморфноядерных гранулоцитов из периферической крови
В экспериментах была использована кровь пятнадцати здоровых доноров.
Для получения нейтрофилов к цельной венозной крови добавляли равный объем
рабочего буфера, затем наслаивали на градиент фиколл-урографина (ρ=1,085/1,18)
в соотношении объемов
2:1, центрифугировали 30 минут при 2000 об/мин, после чего отбирали
образовавшийся слой лейкоцитов. К выделенной клеточной суспензии добавляли 10мМ
К,Na-фосфатный буфер. Концентрацию лейкоцитов определяли путем подсчета в
камере Горяева.
кровь
человек гранулярный полиморфноядерный
2.3 Определение активности миелопероксидазы полиморфноядерных гранулоцитов в спонтанном тесте
Непосредственно перед экспериментами готовились разведения клеточной
суспензии нейтрофилов в концентрациях: 100, 200, 300 и 400 тысяч клеток в
пробе.
В качестве субстрата использовали свежеприготовленную смесь следующего
состава: ортофенилендиамин (0,04%), перекись водорода (0,002%) на 0,1М
фосфатно-цитратном буфере (pH=4,5).
.3.1 Определение спонтанной активности миелопероксидазы полиморфноядерных
гранулоцитов с помощью твердофазного метода
Аликвоты клеточной суспензии 100 мкл (в концентрации 100, 200, 300 и 400
тыс. клеток в пробе) помещали в лунки плоскодонного 96-луночного планшета,
инкубировали в течение 60 минут при 37˚С, затем клеточную суспензию
удаляли и лунки трижды промывали рабочим буфером. Затем в каждую лунку вносили
свежеприготовленную субстратную смесь в объеме 200 мкл и инкубировали при 37˚С
15 минут. Остановку реакции производили добавлением 10% серной кислоты.
Результаты оценивали спектрофотометрически при длине волны 492 нм.
.3.2 Определение активности миелопероксидазы в клеточном лизате
полиморфноядерных гранулоцитов
В пробирки для микроанализа вносили 200 мкл суспензии нейтрофилов (в
концентрации 100, 200, 300 и 400 тыс. клеток в пробе), добавляли равный объем
дистиллированной воды и инкубировали при 37˚С в течении 1 часа. Затем в
каждую пробирку вносили свежеприготовленную субстратную смесь и инкубировали
при 37˚С 15 минут. Остановку реакции производили добавлением 10% серной
кислоты, затем центрифугировали 15 мин. при 2000 об/мин.
Результаты оценивали спектрофотометрически при длине волны 492 нм.
При проведении спонтанного теста интактные нейтрофилы вносили в пробирки
для микроанализа в объеме 200 мкл (в концентрации 100, 200, 300 и 400 тыс.
клеток в пробе), затем добавляли 200 мкл субстратной смеси, состоящей из
ортофенилендиамина (0,04%) и 0,002% перекиси водорода в 0.1М фосфатно-цитратном
буфере, pH=4,5. Через 15 мин реакцию останавливали добавлением 200 мкл 10%
серной кислоты., затем пробы центрифугировали 15 мин. при 2000 об/мин.
Результаты оценивались спектрофотометрически при длине волны 492 нм.
.4 Статистическая обработка результатов
Статистическая обработка полученных экспериментальных данных проводилась
с использованием пакета программ Statistica 6.0. Оценка достоверности
полученных результатов, не подчиняющихся закону нормального распределения, проводилась
с использованием непараметрических методов: критерия по Краскелу-Уоллису,
Манна-Уитни, Колмогорова-Смирнова, Вальда-Вольфовица. Различия считали
достоверными при уровне статистической значимости p<0,05. Полученные данные представлены в виде медианы и
25-75 квартилей.
2.5 Оценка модифицированной лабораторной тест-системы посредством ее
сравнения с общепринятым методом определения ферментативной активности
полиморфноядерных гранулоцитов на основе «Референтного теста», в качестве
которого был принят метод определения активности миелопероксидазы с помощью
твердофазного метода
«Референтный метод» - классический эксперимент или вид клинических
исследований, позволяющий свести к минимуму систематичекие ошибки.
3. Результаты и обсуждение
.1
Определение активности миелопероксидазы полиморфноядерных гранулоцитов в тесте
с использованием клеток, иммобилизованных на гидрофобной поверхности
Для определения спонтанной секреции MPO азурофильных гранул полиморфноядерных гранулоцитов
была использована тест-система, достаточно широко используемая в лабораторной
практике, включающая Нф, предварительно иммобилизованные на поверхности
полистирольного планшета с концентрацией клеток в экспериментальной пробе,
равной 100, 200, 300, 400х103 кл/мл, с последующим внесением субстратной смеси,
состоящей из перекиси водорода и ортофенилендиамина в рабочем буфере.
Результаты оценивались спектрофотометрически при длине волны 492 нм.
Высвобождение депонированного фермента в среду инкубации происходит
благодаря феномену «слияния мембран» азурофильных гранул и плазматической
мембраны Нф. Основной эндогенный фактор слияния - ионы Са2+, резко снижающие
гидратационный барьер при интеграции мембран. Ионы Са2+ нейтрализуют
отрицательный поверхностный заряд, непосредственно модифицируя структуру
липидного бислоя и дестабилизируют ее, создавая кальциевые мостики между двумя
контактирующими мембранами, и тем самым индуцируя соединение мембран.
Образование окрашенного продукта пероксидазной реакции, выраженное в единицах
оптической плотности, происходит в результате способности MPO окислять ортофенилендиамин в
присутствии перекиси водорода.
Как видно из представленных результатов (рисунок 3.1) в тестах данной
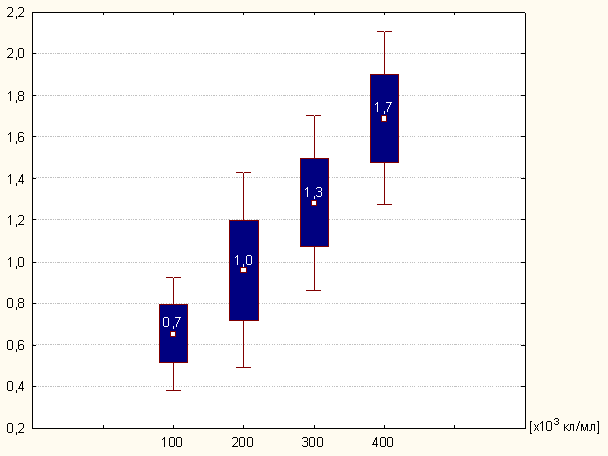
Рисунок 3.1 - Активность миелопероксидазы нейтрофилов периферической
крови в твердофазном спонтанном тесте
Конструкции при использовании выбранных концентраций клеток наблюдается
изменение спонтанной ферментативной активности миелопероксидазы
иммобилизованных клеток для проб, содержащих 100, 200, 300 и 400 тысяч кл/мл
линейного характера. Количество единиц оптической плотности, на которые
происходит увеличение активности фермента в каждой экспериментальной точке,
отражает среднее значение ферментативной активности Нф для всех доноров в
исследуемой выборке.
Таким образом, можно предположить, что данная тест-система носит линейную
зависимость между количеством иммобилизованных клеток и миелопероксидазной
активностью Нф. Общее количество окрашенного продукта пероксидазной реакции,
выраженное в единицах оптической плотности, зависит от концентрации
секретируемой из азурофильных гранул MPO.
Такая зависимость, выраженная в единицах оптической плотности, отражает
хорошую чувствительность и воспроизводимость результатов и позволяет
использовать для анализа количество клеток, равное 200-300х103/мл.
Достоинством твердофазной тест-системы является малое время для
выполнения лабораторного теста и его небольшая трудоемкость, также
количественный спектрофотометрический учет результатов.
К недостаткам данной лабораторной системы можно отнести стадию
иммобилизации клеток на полистироле. Это с одной стороны, уменьшает эффективную
концентрацию клеток на стадии активного взаимодействия MPO с субстратом, с другой стороны, способствует
появлению большей вариабельности получаемых значений для одной
экспериментальной точки, так как адгезивные свойства полиморфноядерных
гранулоцитов у разных доноров могут варьировать в значительных пределах.
.2
Определение активности миелопероксидазы в клеточном лизате полиморфноядерных
гранулоцитов
Для определения общего содержания и общей активности MPO, содержащейся в гранулах
полиморфноядерных гранулоцитов, используется тест оценки пероксидазной
активности лизированных клеток со спектрофотометрической оценкой результатов.
Для этого суспензию выделенных из периферической крови Нф в концентрации
100, 200, 300, 400х103 кл/мл помещают в пробирки для микроанализа, вносят
равный объем дистиллированной воды, затем добавляют субстратную хромогенную
смесь. Перед спектрофотометрией результатов все пробы центрифугируют для
удаления из раствора остатков разрушенных или нелизированных клеток.
Либерация МPO в среду
инкубации происходит в результате нарушения целостности мембран Нф,
сопровождаемое разрушением клеток.
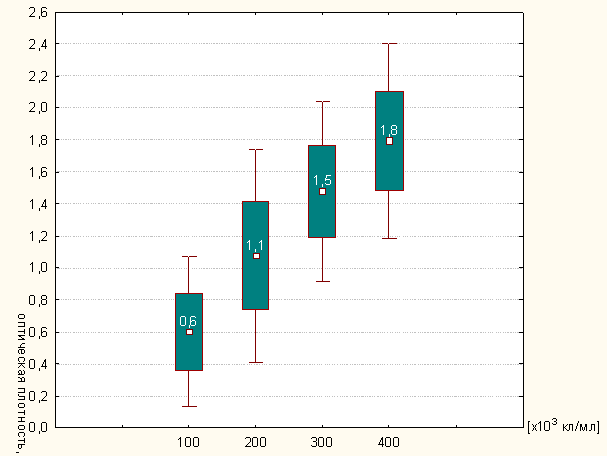
Рисунок 3.2 - Активность миелопероксидазы в клеточном лизате нейтрофилов
периферической крови
Полученные экспериментальные данные (рисунок 3.2) отражают практически
линейный характер зависимости. Это увеличивает степень чувствительности данной
тест-системы, которая допускает использовать в качестве лабораторного метода
оценки спонтанной активности MPO
концентрацию клеток, равную 200х103/мл, что бывает существенно при дефиците
экспериментального материала. При этом следует отметить незначительный разброс
экспериментальных данных для одной концентрации клеток, что позволяет
предположить достаточно хорошую воспроизводимость результатов.
Положительными характеристиками данного метода оценки миелопероксидазной
активности Нф является достаточно высокая чувствительность и воспроизводимость
теста.
К недостаткам следует отнести наличие стадии центрифугирования, что
увеличивает время проведения лабораторного теста, а также невозможность оценить
индуцированную активность MPO
полиморфноядерных гранулоцитов и определить коэффициент стимуляции клеток,
который может быть использован как критерий оценки физиологического статуса
нейтрофильного звена иммунитета.
.3
Определение спонтанной активности миелопероксидазы нейтрофилов в растворе
(модифицированный метод) со спектрофотометрическим учетом результатов
Для определения спонтанной активности MPO, секретируемой из азурофильных гранул в среду
инкубации, была использована модифицированная нами лабораторная тест-система со
спектрофотометрическим учетом результатов.
Для этой цели в полистирольные пробирки для микроанализа, содержащие
свежевыделенную суспензию Нф, в концентрации 100, 200, 300, 400х103 кл/мл
добавляли по 200 мкл субстратной смеси. Пробы инкубировали при +37оС в течение
15 мин, реакцию останавливали добавлением 10% серной кислоты.
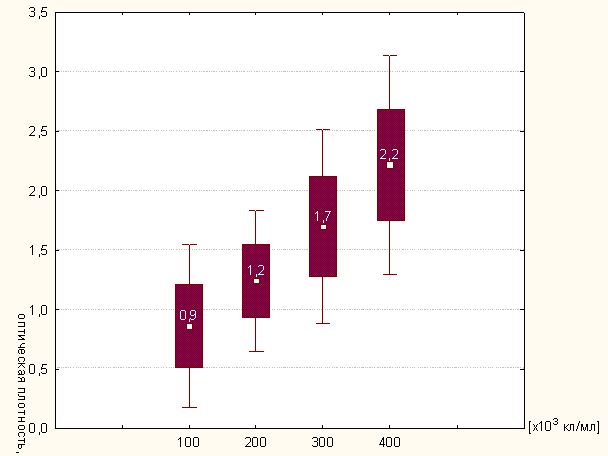
Рисунок 3.3 - Спонтанная активность миелопроксидазы интактных нейтрофилов
в растворе (модифицированный метод)
Как видно из представленных результатов (рисунок 3.3), зависимость между
концентрацией клеток в экспериментальных пробах и ферментативной активностью MPO, высвобождаемой из азурофильных
гранул, носит практически линейный характер и разброс межу отдельными
значениями в каждой экспериментальной точке незначителен. Это позволяет
предположить, что чувствительность данной лабораторной тест-системы достаточно
высока и позволяет использовать ее в качестве лабораторного метода определения пероксидазной активности с нижним пределом
концентрации клеток в пробе, равным 100х103/мл.
Высокие показатели активности MPO, выраженные в единицах оптической плотности, напрямую коррелируют с
концентрацией клеток в пробе. Определение
активности MPO таким методом позволяет оценить
спонтанную секрецию фермента, определяющего уровень биоцидности Нф, интактными
клетками, без разрушения целостности клеток, без использования методов
иммобилизации клеток на твердых носителях (увеличивая тем самым эффективную концентрацию
полиморфноядерных гранулоцитов на этапе взаимодействия MPO c субстратом). Субстратная хромогенная смесь вносится в пробирки для микроанализа
сразу после внесения туда экспериментальной пробы, значительно снижая также
время постановки теста. Таким образом, эксперимент проводится в растворе и
включает только одну стадию центрифугирования проб перед спектрофотометрической
оценкой результатов.
Для сравнительной оценки методов определения спонтанной активности MPO нейтрофилов были использованы
непараметрические методы статистической обработки данных: критерий
Краскела-Уоллиса, Манна-Уитни, Колмогорова-Смирнова, Вальда-Вольфовица.
Анализ полученных результатов показал, что существуют достоверно значимые
различия между уровнем пероксидазной активности Нф, выраженной в единицах
оптической плотности, с применением модифицированного метода и в тесте с
использованием клеток, иммобилизованных на гидрофобной поверхности
(относительно концентрации клеток в пробе 300х103/мл и 400х103/мл) а также
между уровнем активности фермента на основе модифицированного метода и в тесте
с применением лизированных полиморфноядерных гранулоцитов (относительно
концентрации клеток в пробе 100х103/мл и 400х103/мл (см. Приложение А, Б).
Уровень
ферментативной активности Нф в растворе (модифицированный метод) значительно
превышает таковую в отношении клеток, иммобилизованных на гидрофобной
поверхности, и в меньшей степени в отношении клеток в тест-системе,
использующей лизированные Нф. Разница между показателями активности MPO (относительно среднего значения
ферментативной активности в каждой экспериментальной точке для всех доноров в
исследуемой выборке) между методом определения данной активности в растворе на
основе модифицированного метода и при помощи твердофазного носителя в
экспериментальных пробах, содержащих 300х103 кл/мл - 24%, содержащих 400х103
кл/мл - 23 %.
Таким образом, модицированная нами лабораторная тест-система позволяет
спектрофотометрически определять активность MPO, спонтанно либерируемой из азурофильных гранул в
среду инкубации без нарушения целостности клетки; полностью исключает
вероятность удаления части клеток до стадии активного взаимодействия MPO c субстратной хромогенной смесью, значительно увеличивая тем
самым концентрацию секритируемой из азурофильных гранул MPO, характеризующая состветветственный
повышенный уровень активности фермента, выраженной в единицах оптической плотности,
на этапе детекции результатов.
Активность MPO, выявленная с
помощью твердофазного метода, включает стадию иммобилизации на планшете и
напрямую зивисит от адгезивных свойств Нф (тест-система предусматривает
удаление несвязавшихся с твердофазным носителем клеток). И, в отдельных
случаях, недостаточное содержание клеток на стадии теста-анализа,
характеризующее взаимодействия полиморфноядерных гранулоцитов с субстратом,
может значительно снизить показатели ферментативной активности.
Пероксидазная активность Нф, выявленная с помощью лизированных клеток,
индуцированных дистилированной водой, также понижена по сравнению с
мофицированным методом. Разница ферментативной активности между методами
(относительно среднего значения активности фермента в каждой экспериментальной
точке для всех доноров в исследуемой выборке) в отношении концентрации клеток,
равной 100х103/мл, 400х103/мл, составляет 34% и 18% соответственно.
На этом основании можно предположить, что такая процентная разница, может
быть связана с неполной реализацией данной тест-системы (лизису поддверглись не
все клетки, находящиеся в дистилированной воде).
3.4 Сравнительная оценка модифицированной лабораторной тест-системы
определения активности MPO Нф
в растворе с «Референтным методом»
Определение диагностической чувствительности, диагностичекой
специфичности, прогностической ценности положительного результата,
прогностической ценности отрицательного результата (таблица 3.4)
Таблица 3.4 - Сравнительная оценка модифицированной лабораторной
тест-системы определения активности миелопероксидазы в растворе с «Референтным
методом»
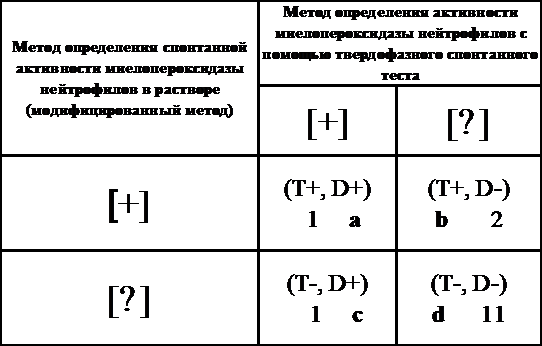
Где
a - число истинноположительных результатов тестов
b - число
ложноположительных результатов тестов
с
- число ложноотрицательных результатов тестов
d - число
истинноотрицательных результатов тестов
Используя
полученные данные, производим расчет операционных характеристик
диагностического теста:
Диагностическая
чувствительность (ДЧ) - количественный показатель способности теста
распознавать диагностически значимые отклонения от нормы; доля лиц истинно
положительных в отношении какого-либо заболевания.
Диагностическая
специфичность (ДС) - количественный показатель способности теста распознавать
результаты, находящихся в пределах нормы; доля лиц истинно отрицательных в
отношении какого-либо заболевания.
Прогностическая ценность положительного результата (ПЦПР) - вероятность
наличия заболевания при положительном результате теста.
Прогностическая ценность отрицательного результата (ПЦОР) - вероятность
наличия заболевания при отрицательном результате теста.
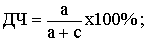
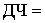 50%
50%
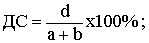
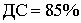
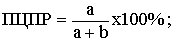
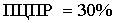
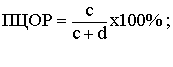
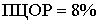
Как
правило, такие полученные показатели обусловлены особенностями исследуемой
выборки в популяции (доноры в выборке клиничеки здоровы).
Таким
образом, важными показателями из произведенных расчетов является ДС и ПЦОР.
ДС,
равная 85%, отражает процентное содержание в исследуемой выборке истинно
отрицательных в отношении отклонений от нормальных показателей ферментативной
активности, выраженной в единицах оптической плотности. Данный показатель
довольно велик и позволяет достаточно точно исключать положительные результаты,
ассоциированные с наличием заболевания.
Показатель
ПЦОР (8%) значительно низкий. Что, в свою очередь, позволяет достаточно точно
исключать ложноположительные результаты, ассоциированные с наличием
заболевания, в здоровой популяции людей.
Таким образом, модифицированная лабораторная тест-ситема оценки
пероксидазной активности Нф, является достаточно чувствительной (позволяющая
использовать для анализа концентрацию клеток, равную 100х103/мл) и
высокоспецифичной (характеризующая высокую специфичность к субстрату, в
качестве которого выступает ортофенилендиамин и перекись водорода). Данная
система может быть использована в качестве лабораторного метода оценки
спонтанной миелопероксидазной секреции, характеризующая уровень биоцидной
активности Нф, также может служить экспериментальной моделью изучения процессов
либерации MPO нейтрофилов при их активации.
Заключение
Таким образом, по результатам проведенных экспериментов можно сделать
следующие выводы:
. Модифицирован лабораторный метод для спектрофотометрического
определения активности миелопероксидазы нейтрофилов периферической крови
человека в растворе
. Определение активности миелопероксидазы с помощью модифицированного
лабораторного метода позволяет оценить как спонтанную, так и индуцированную
секрецию этого фермента, определяющего уровень биоцидности нейтрофила,
интактными клетками, без разрушения целостности клеток, без использования
методов иммобилизации клеток на твердых носителях
. Модифицированный лабораторный метод для спектрофотометрического
определения активности миелопероксидазы нейтрофилов человека в растворе
является высокочувствительным, позволяющий использовать для анализа
концентрацию клеток 100х103/мл, и высокоспецифичным
. Модифицированный лабораторный метод может быть использован как для
оценки миелопероксидазной активности нейтрофилов, находящихся в растворе, так и
служить экспериментальной моделью изучения процессов либерации миелопероксидазы
нейтрофилов при их активации
Список использованных источников
1. Адаменко
Г.П. Кооперативное взаимодействие поли- и мононуклеарных фагоцитов крови
человека: влияние совместного культивирования клеток на их хемилюминесценцию и
секрецию миелопероксидазы / Иммунология. - 1993. - №5. - С. 26-29.
. Асадов
Ч.Д., Нумерова. Л.С., Мирзоева М.Э. Связь между фагоцитарной функцией и
цитохимическими показателями нейтрофилов крови // Лаб. дело. 1999. - №11. - С.
19.
. Магеррамов
А. М. Активные формы кислорода в живых системах. Биология. - 2009. - №4. - C. 56-59.
. Кулинский
В.И. Активные формы кислорода и оксидативная модификация макромолекул //
Соросовский образовательный журнал. - 1998. - №3 - C.19-26.
. Бакуев
М.М., Саидов М.З. Особенности секреции миелопероксидазы и хемилюминесцентного
ответа нейтрофилов человека при контакте со стимуляторами различной природы //
журн. Иммунология. - 1999. - №1.- С. 15-18.
. Бахов Н.И.
Механизмы защиты организма от вирусных инфекций: нейтрофильные лейкоциты / Н.И.
Бахов, Ю.Ф Майчук, А.В Корнев // журн. Успехи современной биологии. - 2000. Т.
120. - №1. - С. 23 - 35.
. Галкин А.А.
Действие активаторов на подвижность нейтрофилов / А.А. Галкин, Е.А Туманов, Е.Н
Тимин // Бюл. эксперим. биологии и медицины. -1999. Т. 124. - №10. - С. 409 -
412.
. Владимиров
Ю.А. Свободные радикалы в биологических системах / Владимиров Ю.А. // Cоросовский образовательный журнал. -
2000. - №2. - C. 154-156.
. Третьякова
И.Е., Метревели Н.Р., Деева З.В., Таймазова М.Т., Езеева А.А., Лолаева Л.Э.
Влияние секреторных продуктов нейтрофилов на локальные процессы, происходящие у
мышей с асептическим воспалением // Успехи современного естествознания. - 2005.
- №3. - С. 45-49.
. Морозов В.
И., Цыпленков Н. В., Кокряков В. Н., Волков К. Н. и др. Выделение и
характеристика миелопероксидазы лейкоцитов перитонеального экссудата //
Биохимия. - 1997. Т. 62. - №6. - С. 729-737.
. Говорова
Н.Ю., Шаронов Б.П., Янковкий О.Ю., Лызлова С.В., Инактивация реактивных форм
кислорода, генерируемых миелопероксидазой Доклады. - 2000. Т. 209. №2 - С.
480-483.
. Гурманчук
И.Е., Канашнова Т.А., Титов Л.П. Фагоцитирующие клетки крови и их функциональные
способности. // Методы изучения фагоцитарной и метаболической активности
полиморфноядерных и мононуклеарных фагоцитирующих клеток. Минск. - 2002. - С .
46-52.
. Гамалей
И.А., Клюбин И.В. Перекись водорода как сигнальная молекула / И.А. Гамалей //
Цитология. - 2000.- № 8(12). - С. 48-51.
. Долгушин
И.И. Взаимодействие нейтрофилов с различными бактериальными агентами / И.И.
Долгушин, Ю.С. Андреева, Е. В Плеханова Журнал микробиологии, эпидемиологии и
иммунологии. - 2008.- №5. - С. 103-105.
. Долгов. В.В.
Лабораторная диагностика / В.В. Долгов. Тверь: Триада - 2005. - С. 227.
. Земсков
В.М. Фагоцитоз: физиологические и молекулярные аспекты / В. М. Земсков // журн.
Успехи современной биологии. 2005. - Вып. 2. - С. 219-234.
. Каноков
А.А., Канукоева М.Ю., Афашаюва М.М. и др. Содержание катионного белка и
активность миелопероксидазы нейтрофильных лейкоцитов у здоровых людей //
Актуальные вопросы инфекционной патологии.- 1993 - С. 229-232.
. Казимирко
В.К. Aнтиоксидантная система и ее
функционирование в организме человека / В.К. Казимирко, В.И. Мальцев //
Медицинские вести. -2009. - №8. - C. 23-34.
. Карпищенко
А.И. Медицинские лабораторные технологии (справочник), «Интермедика». 1999. -
С. 656.
. Клебанов
Г.И., Владимиров Ю.А. Клеточные механизмы прайминга и активации фагоцитов //
журн. Успехи современной биологии. 1999. №5 - С. 462 -475.
. Копьева
Т.Н., Амосова О.М. Полиморфноядерный лейкоцит: роль в развитии острого и
хронического неспецифического воспаления в легких // Терапевт. архив. - 197. -
№3. - С. 142-145.
. Мазуров Д.,
Дамбаева С., Пинегин Б. Оценка внутриклеточного киллинга стафилококка
фагоцитирующими клетками периферической крови // журн. Иммунология. 2000. -
№2.- С. 57-59.
. Мальцева
В.Н., Авхачева Н.В., Сафронова В.Г. Общие закономерности в изменениях
функциональной активности нейтрофилов // журн. Иммунология. -2009. - №2. - С.
111-116.
. Наумова
И.Н., Метаболизм и функциональная активность гранулоцитов в динамике терапии
больных хроническим миелолейкозом. - М. - 2003.
. Плескова С.
Н., Михеева Э. Р., Горшкова Е.Н., Хомутов А.Е. Нарушения ферментативной
активности нейтрофильных гранулоцитов под воздействием наноразмерных
флуорофоров // Вестник Нижегородского университета им. Н. И. Лобачевского. -
2010. - №5 (1). С. 106-109.
. Олиферук
Н.С., Ильинская А.Н., Пинегин Б.В. Оценка фагоцитарной и бактерицидной
активности нейтрофилов, макрофагов и незрелых дендритных клеток // журн.
Иммунология. - 2005. Т. 26. - С. 23-34.
. Пащенков
М.В., Пинегин Б.В. Физиология клеток врожденной иммунной системы // Иммунология.
- 2006. - №6. - С. 364-368.
. Печковский
Д.В., Потапнев М.П. Механизмы фагоцитоза и бактерицидности нейтрофилов
человека. // Здравоохранение Белоруссии. - 1999. - №5. С. 58-96.
. Пикуза
О.И., Маянский А.Н. Клинические перспективы изучения фагоцитоза // Казанский
мед. журнал. - 1999.- №3.- С. 193-196.
. Пинегин
Б.В., Маянских А.Н. Нейтрофилы: структура и функции // журн. Иммунология.-
2007. - №6. - С. 374-382.
. Плеханова.
Е.В. Изучение жизнеспособности нейтрофилов периферической крови после их
взаимодействия с Е. coli. S. aureus. Lactobacillus spp. и Bifidobacterium spp./
Е.В.Плеханова // Материалы IX съезда всероссийского науч.-практ. о-ва
эпидемиологов, микробиологов и паразитологов: в 3-х т. - М.: Санэпидмедиа. -
2007. Т.2 - С. 125.
. Потапнев
М.П. Регуляция процессов фагоцитоза / М.П. Потапнев // Медицинская панорама. -
2003. - №6. - C. 12-18.
. Плехова
Н.Г. Бактерицидная активность фагоцитов// Журн. эпидемиол., микробиол.,
иммунобиол. - 2006. - №6. - С. 89-96.
. Рулева
Н.Ю., Звягинцева М.А., Дугин С.Ф. Миелопероксидаза: биологические функции и
клиническое значение // Современные наукоемкие технологии. - 2007. - №8. - С.
11-14.
. Сагакянц
А.Б., Хаитов Р.М. Некоторые аспекты исторического становления теории фагоцитоза
// журн. Иммунология. - 2008. Т. 29. - С. 10-14.
37. Скулачев
В.П. Кислород в живой клетке: добро и зло / В.П. Скулачев // Соросовский
образовательный журнал. - 1996. -№2. - C. 23-27.
38. Суханова
Т.А. Патохимия клетки // журн. Успехи совр. Биологии. - 2004. №. 40. - С.
82-104.
. Северин Е.С.
Биохимия: Учебник для вузов / Е.С. Северина. - 2003. - C. 770-779.
. Фрейдлин
И.С. Современные представления о фагоцитарной теории // Микробиология. - 2008.
- №5 - С. 4-10.
. Шафран М.Г.
Миелопероксидаза нейтрофильных лейкоцитов // журн. Успехи современной биологии.
- 2001. - Вып. 3. - С. 365-379.
. Ярцев М.Н.,
Яковлева К.П. Иммунная недостаточность: клинико лабораторная оценка иммунитета
журн. Иммунология. - 2005. - №1. - С. 50
. Янковский
О.Ю., Кокряков В.Н, Лызлова С.Н. Физико-химические и кинетические
характеристики миелопероксидазы нейтрофильных лейкоцитов Укр. Биохим журн. -
2001. Т. 51 №5.- С. 492-497.
. Янковский
О.Ю. Токсичность кислорода и биологические системы: эволюционные, экологические
и медико-биологические аспекты / О.Ю. Янковский // Цитология. 2000. - №6. - С.48-59.
.
Allen, R. C. and J. T. Stephens, Jr. 9 February 2010, posting date.
Reduced-oxidized difference spectral analysis and chemiluminescence-based
Scatchard analysis demonstrate selective binding of myeloperoxidase to
microbes. Luminescence.doi: doi: 10.1002/bio.1210.
.
Boyum A. Separation of blood leukocytes, granulocytes and lymphocytes / A.
Boyum // Tissue antigens. - 2004. - №4. - P. 269-274.
.
Burg ND, Pillinger MH. The neutrophil: function and regulation in innate and
humoral immunity. Clin Immunol. - 2001.- P. 7-17.
.
Gerber CE, Kuci S, Zipfel M, Niethammer D, Bruchelt G. Phagocytic activity and
oxidative burst of granulocytes in persons with myeloperoxidase deficiency. Eur
J Clin Chem Clin Biochem. - 1999. - P. 901-908.
. Hallett
MB, Cole C, Dewitt S. Detection and visualization of oxidase activity in
phagocytes. Methods Mol Biol. 2003. - P. 61-67.
.
Klebanoff SJ. Myeloperoxidase: friend and foe. J Leukoc Biol. 2005. - P.
598-625.
51.
Robert L. Baehner, Susanne K. Murrmann. The role of supeoxide anion and
hydrogen peroxide in phagocytosis-assotiated oxidative metabolic reactions //
Immunobiology. - 2008. - Vol 121. - P. 231-252.
52.
Dr. David G. Williams. The Many Benefits of Hydrogen Peroxide // Science.-
2003. - Vol 12. - P. 453-466.
. R.
John Aitken and Shaun D. Roman. Antioxidant Systems and Oxidative Stress in the
Testes // Immunobiology. - 2004. - Vol 35. - P. 556-576.
.
Volkmar Heinrich and Micah Dembo. Mechanics of neutrophil phagocytosis:
experiments and quantitative models // Journal of cell science. - 2006. - Vol
119. - P. 1903-1913.
.
Carlos Rosales. Molecular mechanisms of phagocytosis // Microbes and infection.
- 2005. - P. 15-52.
.
Mc. Cord J. M. Prevention of Neutrophil-Mediated Hepatic Ischemia. Reperfusion
Injury by Superoxide Dismutase and Catalase Derivatives / The journal of
pharmacology. - 1995. - Vol 34. - P. 231-243.
.
Robin C. May. Phagocytosis and the actin cytoskeleton // Journal of cell
science. - 2008. - № 114. - P. 1061-1077.
.
Warren L. Lee. Phagocytosis by neutrophils / Warren L. Lee, Rene E. Harrison
Microbes and infection. - 2003. - Vol 5. - P. 432-465.
Приложение
ВИЗУАЛИЗАЦИЯ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
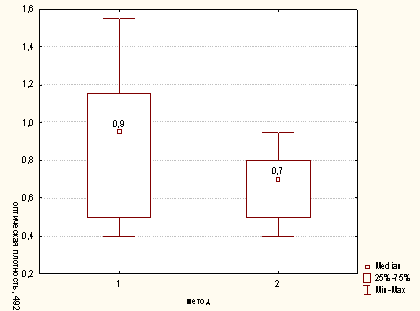
Рисунок
А.1 - Сравнительная характеристика методов опеределения активности
миелопероксидазы нейтрофилов для концентрации клеток в пробе 100х103/мл (1 -
модифицированный метод; 2 - метод определения ферментативной активности Нф,
иммобиллизованных на гидрофобной поверхности)

Рисунок
А.2 - Сравнительная характеристика методов опеределения активности
миелопероксидазы нейтрофилов для концентрации клеток в пробе 200х103/мл (1
-модифицированный метод; 2 - метод определения ферментативной активности Нф,
иммобиллизованных на гидрофобной поверхности)
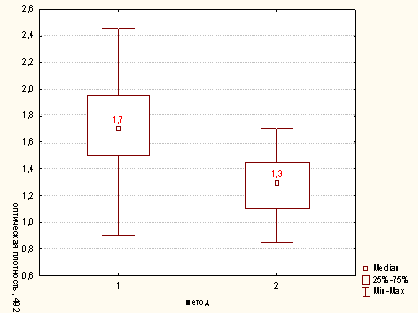
Рисунок
А.3 - Сравнительная характеристика методов опеределения активности
миелопероксидазы нейтрофилов для концентрации клеток в пробе 300х103/мл (1 -
модифицированный метод; 2 - метод определения ферментативной активности Нф
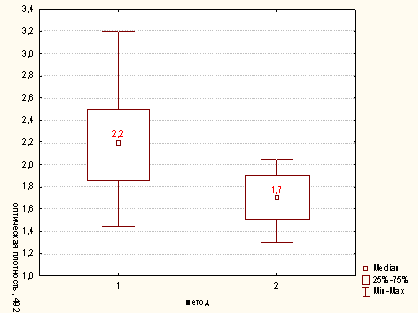
Рисунок
А.4 - Сравнительная характеристика методов опеределения активности
миелопероксидазы нейтрофилов для концентрации клеток в пробе 400х103/мл (1
-модифицированный метод; 2 - метод определения ферментативной активности Нф,
иммобиллизованных на гидрофобной поверхности) p<0,05
Приложение
Б
ВИЗУАЛИЗАЦИЯ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
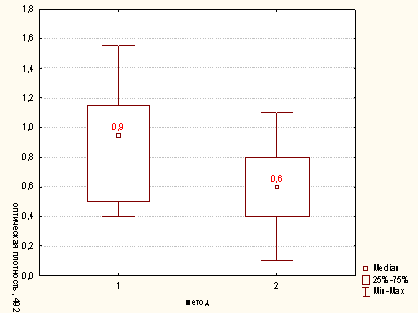
Рисунок Б.1 - Сравнительная характеристика методов опеределения
активности миелопероксидазы нейтрофилов для концентрации клеток в пробе
100х103/мл (1 -модифицированный метод; 2 - метод определения ферментативной
активности лизированных Нф) p<0,05
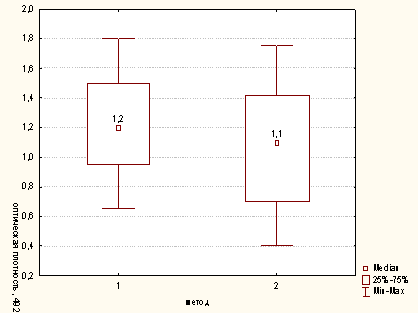
Рисунок Б.2 - Сравнительная характеристика методов опеределения
активности миелопероксидазы для концентрации клеток в пробе 200х103/мл (1 -
модифицированный метод; 2 - метод определения ферментативной активности лизированных
Нф)
Рисунок Б.3 - Сравнительная характеристика методов опеределения
активности миелопероксидазы для концентрации клеток в пробе 300х103/мл (1 -
модифицированный метод; 2 - метод определения ферментативной активности
лизированных Нф)
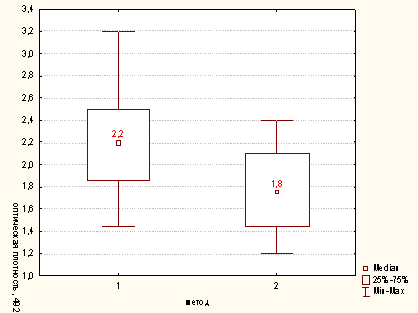
Рисунок Б.4 - Сравнительная характеристика методов опеределения
активности миелопероксидазы для концентрации клеток в пробе 400х103/мл (1-
модифицированный метод; 2 - метод определения ферментативной активности
лизированных Нф) p<0,05