Диагностика и лечение бесплодия
Оглавление
Введение
Классификация
Эндокринное женское бесплодие
Гипоталамо-гипофизарная
недостаточность
Гиперпролактинемия
Яичниковая недостаточность
Синдром поликистозных яичников
Гипотиреоз
Эндометриоз
Трубно-перитонеальное бесплодие
Маточный фактор
Иммунологическое бесплодие
Мужское бесплодие
Вспомогательные репродуктивные
технологии
Заключение
Литература
Приложение
Введение
Бесплодие (инфертильность, sterilitas - лат.)
определяется, как неспособность зачать ребенка при регулярной половой жизни без
контрацепции в течение 12 месяцев при условии детородного возраста партнеров.
Бесплодие - это не болезнь, а дисфункциональное состояние, обусловленное рядом
заболеваний, при которых наступление беременности становится невозможным.
Бесплодие это одна из наиболее важных и сложных
современных медико-социальных проблем. По данным ВОЗ от бесплодия во всем мире
страдает 60 - 80 млн. пар. Поэтому проблема диагностики и лечения бесплодия
является крайне актуальной в акушерско-гинекологической практике. Согласно данным
последних исследований в Европе бесплодны около 10% супружеских пар, в США до
15%, в Канаде 17%, в Австралии 15,4%, в России 17,5%, в Беларуси 15%.
Наблюдается тенденция к росту этих цифр. В последние годы имеет место ухудшение
показателей репродуктивного здоровья как мужчин, так и женщин. На состояние
репродуктивной системы оказывают негативное влияние ухудшение экологической
ситуации и вредные условия труда, широкое распространение инфекций,
передаваемых половым путем, ранние аборты.
В Беларуси на фоне снижения рождаемости,
увеличения смертности, сокращения численности населения трудоспособного
возраста, ухудшения здоровья населения и его старения проблема бесплодия
приобретает также большое социальное значение. Демографическая ситуация в РБ на
данный момент характеризуется отрицательным приростом населения. В этой
ситуации особенно важно, чтобы каждая женщина имела возможность получить
желанную беременность. Кроме того, проблема бесплодия в браке часто приводит к
разводам, конфликтам, снижает социальную адаптацию и самореализацию.
В последние годы диагностике и лечению бесплодия
уделяется много внимания, однако, несмотря на достижения медицины в этой
области, остается много нерешенных вопросов. В 5% случаев причину бесплодия так
и не удается установить. Малоэффективны операции по восстановлению проходимости
маточных труб. Результативность таких передовых методов, как ЭКО, в среднем
составляет 25 - 40%. Таким образом, с учетом всех медицинских, социальных и
психологических аспектов, проблему бесплодия можно отнести к основным проблемам
в современной медицине.
Целью данного реферата было систематизировать
данные о причинах инфертильности, методах их диагностики, основных этапах и
способах лечения, осветить современные тенденции в тактике ведения бесплодного
брака, новейшие методы лечения, роль вспомогательных репродуктивных технологий
и их эффективность.
Классификация
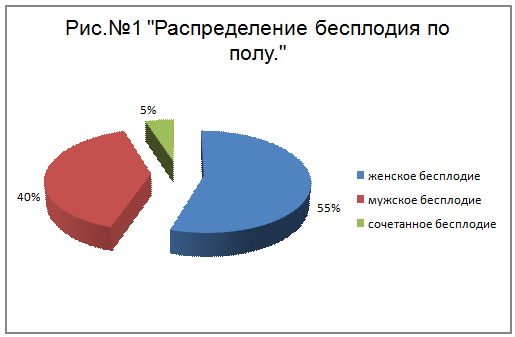
Различают женское и мужское бесплодие. Когда
имеет место сочетание женского и мужского факторов бесплодия, применяют термин
«сочетанное бесплодие». По статистике 40 - 60% случаев бесплодия обусловлены
нарушениями репродуктивной функции женщины, 5 - 6% - мужчины, 27 - 48% -
нарушениями у обоих супругов, в 5% случаев выявить причину бесплодия не удается
[3].
Кроме того бесплодие подразделяют на первичное и
вторичное, абсолютное и относительное. Первичное бесплодие - это отсутствие
бесплодия от начала половой жизни. Вторичное бесплодие - это бесплодие при
наличии в анамнезе у женщины одной или нескольких беременностей (роды, аборты,
внематочные беременности).
Абсолютное бесплодие - это бесплодие, связанное
с необратимыми патологическими изменениями в половых органах, исключающими
возможность зачатия (при врожденном отсутствии внутренних половых органов или
их хирургическом удалении). Относительное бесплодие - женщина и мужчина
способны иметь детей каждый по отдельности, но при длительной совместной жизни
их брак бесплоден.
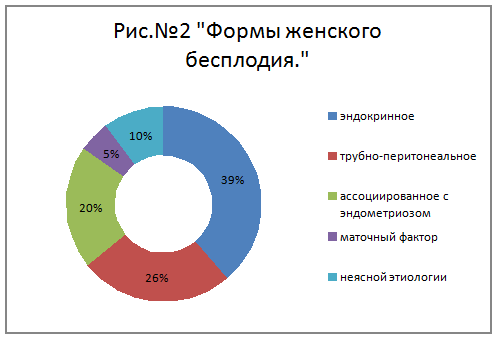
Выделяет несколько форм женского бесплодия:
· эндокринное, связанное с нарушением
овуляции (35-40%)
· трубно-перитонеальное (20-30%)
· бесплодие, ассоциированное с
эндометриозом (15-20%)
· маточный
фактор (5%)
· иммунологические причины (2%);
· бесплодие неясного генеза (5-15%)
[4].
Эндокринное женское бесплодие
Эндокринное женское бесплодие - это нарушение
репродуктивной функции женщины, вызванное отсутствием в яичниках нормального
фолликулогенеза и овуляции.
В структуре бесплодного брака эндокринное
женское бесплодие занимает значительную часть - 30-40%.
Несмотря на разнообразие клинических и
лабораторных проявлений, эндокринное женское бесплодие всегда связано с
нарушением процесса овуляции: ановуляция, недостаточность лютеиновой фазы,
синдром лютеинизации неовулирующего фолликула. При ановуляции не происходит
созревание и разрыв фолликула с выходом яйцеклетки. Причины этого нарушения
очень разнообрзны.
При недостаточности лютеиновой фазы имеет место
гипофункция желтого тела, снижением уровня прогестерона в плазме крови,
недостаточная секреторная трансформация эпителияи, и как следствие, нарушение
имплантации эмбриона. Причинами недостаточности лютеиновой фазы могут быть
гиперпролактинемия, гиперандрогения, гипотиреоз, хронические воспалительные
заболевания органов малого таза, эндометриоз.
При лютеинизации неовулировавшего фолликула
происходит преждевременная лютеинизация преовуляторного фолликула без его
овуляции. Причины доконца не выяснены.
Механизм формирования этих патологических
состояний - это нарушение реализации прямых и обратных связей в системе
гипоталамус-гипофиз-яичники. Причинами могут быть повреждения репродуктивной
системы на различных уровнях, а т.ж. нарушение фукции других эндокринных желез.
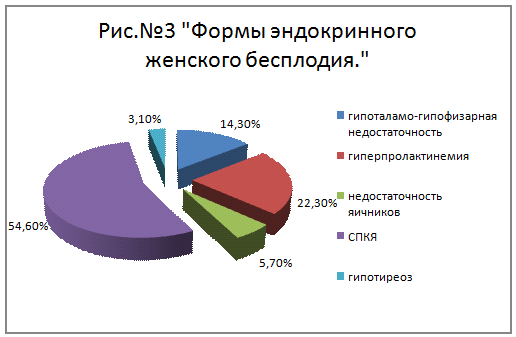
Выделяют следующие клинико-патогенетические формы эндокринного (ановуляторного)
бесплодия у женщин:
· гипоталамо-гипофизарная
недостаточность (14,3%)
· гиперпролактинемия
(22,3%)
· недостаточность
яичников (5,7%)
· синдром
поликистозных яичников
центрального генеза (37,2%)
надпочечникового генеза (11,3%)
яичникового генеза (6,1%)
· гипотиреоз (3,1%) [
Для выявления ановуляции используют следующие
методы:
v Эхография - позволяет выявить отсутствие
доминантного фолликула на 11-16-ый день менструального цикла или отсутствие
желтого тела на 19-23-ий день менструального цикла.
v Гормональные исследования - определение уровня
прогестерона на 18-23 день цикла, выявление предовуляторного пика ЛГ на
11-16-ый день менструального цикла.
v Измерение базальной температуры и натяжения
шеечной слизи (сейчас применяется реже из-за большой вероятности ошибки и
наличия более достоверных методов).
Диагностика недостаточности лютеиновой фазы основана
на выявлении укорочения II фазы цикла (менее 10 сут.), снижения амплитуды
колебаний базальной температуры в промежутке между I и II фазами цикла менее
чем на 0,3°С, уменьшения уровня прогестерона в фазу расцвета желтого тела,
неполноценности фазы секреции эндометрия.
Для дифференциальной диагностики проводится
подробное гормональное исследование, а так же широкий спектр дополнительных
исследований. С учетом формы бесплодия проводится лечение, которое как правило
состоит из трех этапов:
§ Подготовка к индукции овуляции. На этом этапе
проводится коррекция эндокринных нарушений, подготовка эндометрия
§ Контролируемая индукция овуляции
§ Гормональная поддержка лютеиновой фазы
индуцированного цикла.
Препараты схемы и дозы выбирают в зависимости от
формы поражения. При отсутствии положительного результата решается вопрос об
использовании вспомогательных репродуктивных технологий. Далее детально будет
рассмотрена каждая форма бесплодия, ее диагностика и лечение.
Гипоталамо-гипофизарная недостаточность
Гипоталамо-гипофизарная недостаточность (ГГН) -
это заболевание в основе которого лежит недостаточность гонадотропной функции,
сопровождающаяся задержкой полового развития центрального генеза, дефицитом
эстрогенов. Она встречается у 15-20 женщин с аменореей. Среди форм вторичной
аменореи частота психогенной аменореи составляет около 10%, аменореи при
снижении массы тела от 10 до 12%. Частота синдрома Каллмана - 1 на 50 тыс.
женщин [1].
По этиологическому фактору различают врожденную
и приобретенную ГГН. По уровню повреждения различают гипоталамическую и
гипофизарную формы. По степени тяжести различают легкую, средней тяжести и
тяжелую формы.
Врожденный гипогонадизм обусловлен генетическими
причинами - мутациями генов гонадотропинов ЛГ и ФСГ, рецептора гонадотропин -
рилизинг гормона. Наиболее распространенный пример данной патологии - синдром
Каллмана - гипогонадотропный гипогонадизм, сочетающийся с аносмией.
Приобретенная недостаточность гонадотропинов
является следствием внешних воздействий и может быть обратима. Сюда относятся
аменорея при анорексии, при снижении массы тела, аменорея физических нагрузок,
психогенная аменорея, синдром Шихана.
Вследствие недостаточности
гипоталамо-гипофизарной системы развивается вторичная недостаточность яичников,
что приводит к дефициту эстрагенов и ановуляции. При этом яичники интактны, как
и органы-мишени.
Ведущий симптом - аменорея, которая может быть
первичной (65%) или вторичной (35%) (после 2-5 спонтанных менструаций).
Эстагенная недостаточность обуславливает особенности фенотипа: евнухоидальное
телосложение, вторичные половые признаки недоразвиты, оволосение в подмышечных
впадинах и на лобке скудное, молочные железы гипопластичны. При
гинекологическом исследовании выявляется гипоплазия наружных и внутренних
половых органов. Матка уменьшена в размерах, яичники не определяются. Кроме
того, такие женщины склонны к сердечно-сосудистой патологии, остеопорозу,
атрофическим изменением слизистых, психоэмоциональным и вегетососудистым
изменениям из-за недостатка эстрагенов. Основным методом диагностики является
исследование концентрации гонадотропинов и эстрадиола в плазме крови.
Отмечается их снижение. Проба с кломифеном отрицательная, циклическая
гормональная проба положительная. На УЗИ органов малого таза гипоплазия матки и
яичников. Таким пациенткам показана консультация генетика.
Для дифференциального диагноза между
гипоталомической и гипофизарной недостаточностью проводят пробы с
гонадолиберином. Если в ответ на введение агониста гонадолиберина отмечается
увеличение концентрации ЛГ и ФСГ в три раза и более то можно сделать вывод, что
имеется поражение гипоталамуса.
Лечение проводится в два этапа:
· первый этап - подготовительная
терапия
На первом этапе проводится заместительная
циклическая гормонотерапия в течение 3-12 месяцев для формирования женского
фенотипа, увеличения размеров матки, роста эндометрия. На втором этапе
проводится индукция овуляции с помощью экзогенных гонадотропинов (человеческий
менопаузальный гадотропин 225-300 МЕ в/м один раз в сутки либо фоллитропин-бета
300МЕ + лютропин-альфа 150 МЕ/сут. под контролем УЗИ, затем человеческий
хорионический гонадотропин 10000 ЕД однократно). При повреждении гипоталамуса
можно использовать гонадолиберины (с 3-5-го дня пульсирующие введения гонадорелин
ацетата 20-30 суток).
Восстановление спонтанного менструального цикла
и репродуктивной функции при врожденной ГГН маловероятно. При приобретенной ГГН
возможно наступление спонтанных беременностей после завершения индуцированной
беременности. Эффективность лечения при правильно поставленном диагнозе
достигает 80-90%.
Гиперпролактинемия
Гиперпролактинемия - состояние,
характеризующееся повышенным содержанием пролактина (ПРЛ) в плазме крови.
При обследовании пациенток, обратившихся по
поводу бесплодия, гиперпролактинемия выявляется в 18-20% случаев, а при
эндокринных нарушениях менструального цикла и эндокринном бесплодии - в 40%
[2].
Синдром гиперпролактинемии, или синдром
персистирующей галактореи-аменореи, у женщин - это сочетание гиперпролактинемии
с нарушениями менструального цикла, галактореей и бесплодием [2]. Впервые в
литературе клиническая форма синдрома аменореи-галактореи описана более 100 лет
назад, однако причина этого состояния была выяснена только в начале 70-х годов,
когда впервые в чистом виде был выделен гормон передней доли гипофиза - ПРЛ.
Выделяют физиологическую гиперпролактинемию (при
беременности и лактации), фармакологическую (при приеме нейролептиков,
антидепрессантов, противорвотных, гипотензивных средств, оральных контрацептивов,
наркотических средств) и патологическую гиперпролактинемию. Патологическая
гиперпролактинемия может быть первичная, вследствие патологии гипоталамуса и
гипофиза, вторичная, при патологии другого органа, и идиопатическая или
функциональная.
Первичная патологическая гиперпролактинемия
возникает при заболеваниях и/или опухолях гипоталамуса и гипофиза, синдроме
пустого турецкого седла, синдроме перерезки ножки гипофиза. Частота
органической гиперпролактинемии при нарушении секреции ПРЛ колеблется от 60 до 75%
[12]. Эту группу составляют пациентки с пролактинсекретирующими аденомами
гипофиза (микропролактиномы менее 1 см и макропролактиномы более 1 см), которые
являются наиболее частой патологией среди всех доброкачественных опухолей
гипофиза. В основном пролактиномы локализуются в латеральных отделах передней
доли гипофиза. Так называемые нефункционирующие аденомы гипофиза
диагностируются в 19-27% случаев.
Вторичная патологическая гиперпролактинемия
возникает у больных с первичным гипо- и гипертиреозом, при синдроме
поликистозных яичников (СПКЯ), недостаточности коры надпочечников, врожденной
дисфункции коры надпочечников, циррозе печени, сахарном диабете, хронической
почечной недостаточности, гормонально-активных опухолях яичников, продуцирующих
эстрогены.
Гиперпролактинемия в сочетании с гипотиреозом,
объясняется снижением уровня тиреоидных гормонов, увеличением уровня
тиролиберина и повышением чувствительности лактотрофов к его стимулирующему
воздействию.
Считают, что у 11-30% женщин с СПКЯ увеличение
секреции ПРЛ может быть связано с гиперпродукцией эстрогенов, а у остальных
пациенток возникает как самостоятельное эндокринное нарушение.
Нарушение секреции и метаболизма андрогенов
выявляют у 32-40% больных с повышенным уровнем ПРЛ.
Наиболее частыми клиническими параметрами
гиперпролактинемии являются:
• нарушение менструального цикла по типу
олигоменореи, первичной или вторичной аменореи (62-74%);
• галакторея различной степени (30-80%);
• бесплодие.
Кроме того, при опухолевом генезе заболевания
имеет место объемный процесс в области перекреста зрительного нерва с
соответствующей симптоматикой.
Установлена коррелятивная зависимость между
уровнем ПРЛ и характером нарушения менструального цикла. Достоверно более
высокий уровень ПРЛ диагностируется при аменорее по сравнению с олигоменореей и
регулярным менструальным циклом. Оценка функционального состояния яичников
указывает на то, что у подавляющего большинства больных (84%) нарушение
менструального цикла сопровождается хронической ановуляцией. У остальных 16% диагностируется
недостаточность лютеиновой фазы (НЛФ), в основном это пациентки с олигоменореей
или сохраненным ритмом менструаций [ ]. Для большинства пациенток характерно
своевременное начало менархе и период регулярных менструаций. Чаще всего начало
заболевания связывают с началом половой жизни, стрессом, родами, абортами,
самопроизвольными выкидышами. Первичное бесплодие имеет место у 70% пациенток.
Вторым характерным клиническим признаком
гиперпролактинемии является галакторея различной степени, которая нередко
является первым симптомом будущего заболевания. Так, у 18% больных галакторея
появляется за несколько лет до нарушения цикла, у 56% - одновременно с
нарушением цикла и у 26% пациенток - спустя несколько лет после нарушения
менструального цикла и обращения в клинику. Различают галакторею:степени -
выделение молозива из сосков при пальпации каплями,степени - выделение молозива
из сосков при пальпации струей,степени - спонтанное постоянное выделение
молозива из сосков.
У части женщин имеют место гиперандрогения,
избыточное оволосение, метаболические нарушения. Длительная гипофункция
яичников при гиперпролактинемии сопровождается снижением эстрогенной
насыщенности и соответствующим системным нарушениям.
Диагноз заболевания ставится после определения
достоверно повышенного уровня ПРЛ в плазме крови ( более 550 мМЕ/л или 25
нг/мл) при нескольких исследованиях. Анализ базальной концентрации ПРЛ в плазме
крови косвенно позволяет предположить причину заболевания. Уровень ПРЛ менее
1500 мМЕ/л наиболее характерен для группы больных с функциональной
гиперпролактинемией. Содержание ПРЛ 1500-4000 мМЕ/л наиболее часто
диагностируется при микропролактиномах, кистах гипофиза и «пустом турецком
седле». Уровень ПРЛ более 4000-5000 мМЕ/л характерен для пациенток с макропролактиномами
гипофиза [12].
Уровень ПРЛ 1000-1500 мМЕ/л в основном
выявляется у больных с регулярным ритмом менструаций и бывает обусловлен
психогенными факторами, приемом фармакологических препаратов, наличием
гипотиреоза, CПКЯ, различными гинекологическими заболеваниями (эндометриоз,
хронические воспалительные заболевания органов малого таза, доброкачественные
опухоли матки и придатков).
Гормональный скрининг наряду с определением
базального уровня ПРЛ включает в себя оценку уровней тиреотропного гормона, Т4
своб., антител к тиреоглобулину, гонадотропных гормонов (ЛГ, ФСГ), Э2, Т, К,
ДГА/ДГАС. Большое значение уже на этапе гормонального обследования имеет оценка
функционального состояния щитовидной железы с целью исключения первичного и
вторичного гипотиреоза. Пациентки с нарушением функции щитовидной железы
нуждаются в консультации эндокринолога с целью дообследования и назначения
заместительной терапии тиреоидными гормонами.
Проводится рентгенологическое обследования
черепа и турецкого седла. Основной задачей этого этапа является уточнение
характера и степени выраженности изменений в гипоталамо-гипофизарной области,
приводящих к гиперпродукции ПРЛ, а также подтверждения или исключения
опухолевого (органического) генеза заболевания. С этой целью проводят рентгенографию
черепа (краниографию), компьютерную или магнитно-резонансную томографию.
Краниография дает возможность оценить размеры,
конфигурацию и особенности турецкого седла, а также решить ряд
дифференциально-диагностических задач. Диагностическими признаками макроаденомы
гипофиза являются увеличение размеров турецкого седла, расширение входа в
турецкое седло, истончение и укорочение клиновидных отростков, углубление дна,
выпрямление, разрушение спинки седла. По краниограмме можно не только
диагностировать аденомы гипофиза, но и определить характер и направление роста
опухоли (супра-, инфра-, пара- и ретроселлярное). Увеличение турецкого седла
без деструктивных изменений в его стенках может быть обусловлено так называемым
пустым турецким седлом.
Компьютерная и магнитно-резонансная томографии
головного мозга являются современными методами диагностики патологии
гипоталамо-гипофизарной области, в частности микроаденом гипофиза. Методы
позволяют получить сведения о конфигурации костей черепа, размерах любого интраселлярного
образования, а также определить распространенность экстраселлярного поражения,
поскольку эти методы обладают способностью дифференцировать по плотности мягкие
ткани.
Исследование глазного дна и полей зрения на
белую и цветные метки проводят всем больным с гиперпролактинемией для уточнения
состояния оптико-хиазмальной области. Опухоли, распространяющиеся за пределы
турецкого седла вверх (супраселлярно), могут сдавливать перекрест зрительных
нервов, вызывая битемпоральную гемианопсию. Полная битемпоральная гемианопсия
встречается редко.
Оценка функционального состояния
гипоталамо-гипофизарной области при гиперпролактинемии проводится с целью
изучения резервных возможностей аденогипофиза, а также уточнения генеза данного
патологического состояния.
Консультация нейрохирурга необходима всем
пациенткам с макро- или микропролактиномой гипоталамо-гипофизарной области с
целью определения показаний к оперативному лечению и обсуждения вопроса о
возможности медикаментозной терапии. В результате комплексного, поэтапного
клинико-лабораторного обследования представляется возможным определить причины
возникновения гиперпролактинемии и выявить различные нарушения
гипоталамо-гипофизарной области, в структуре которых у женщин репродуктивного
возраста ведущее место занимают микро- и макропролактиномы гипофиза.
Функциональная, или идиопатическая,
гиперпролактинемия характеризуется незначительным увеличением уровня ПРЛ,
нередко неуточненной этиологии. Диагноз функциональной гиперпролактинемии
ставится после исключения органической патологии гипофиза. Для клинической
картины заболевания при функциональной гиперпролактинемии характерно наличие
олигоменореи на фоне ановуляции/НЛФ или регулярного ритма менструаций с НЛФ.
Методы лечения больных с гиперпролактинемией
зависят от формы заболевания (органическая или функциональная) и заключаются в
удалении пролактиномы и/или подавлении секреции ПРЛ, что приводит к
восстановлению менструальной и репродуктивной функции.
Существует три основных метода лечения:
хирургический, лучевой и медикаментозный. Оперативное лечение проводится в
нейрохорургическом стационаре, это удаление опухолей гипофиза трансфеноидальным
доступом. Показаниями к хирургическому лечению являются:
· при макроаденоме - сдавление
зрительного перекреста опухолью, кровоизлияние в опухоль, ликворея, прорастание
в сфеноидальный синус;
· при микроаденоме - четкие границы
опухоли (по данным КТ и МРТ), отказ пациентки от медикаментозного лечения,
аденомы, рефрактерные к лечению высокими дозами агонистов допамина, непереносимость
агонистов допамина.
Лучевое лечение проводят пи неполном удалении
опухоли при операции, противопоказаниях и отказе от оперативного лечения,
неэффективности и непереносимости медикаментозной терапии. Положительный эффект
после лечения развивается в течение 12 - 30 мес. При лучевой терапии облучение
опухоли менее травматично, но и менее надежно по сравнению с хирургическими
методами. Осложнениями лучевой терапии являются: нарушения со стороны полей
зрения, паралич глазодвигательных мышц, развитие пангипопитуитаризма в течение
ряда лет с момента облучения. Уровень ПРЛ в плазме крови в результате этих
методов лечения нормализуется и сохраняется в течение нескольких лет, однако
восстановление менструальной и репродуктивной функции происходит не у всех больных.
Медикаментозное лечение проводят препаратами
бромокриптина. Бромкриптин (парлодел) и его аналоги подавляют секрецию ПРЛ
посредством стимуляции рецепторов ДА, не влияя на нормальные уровни других
гипофизарных гормонов и оказывая непосредственное влияние на опухолевые клетки
гипофиза. С целью снижения побочных реакций прием парлодела начинают с 1/4
таблетки в сутки, увеличивая дозу постепенно в течение 5-10 дней до 1 таблетки.
У пациенток с функциональной гиперпролактинемией суточная доза парлодела, как
правило, не превышает 5 мг (1-2 таблетки), а продолжительность лечения - 6 мес.
При микропролактиномах суточная доза препарата составляет 5-10 мг (2-4
таблетки), при макропролактиномах - 10-12,5 мг (4-5 таблеток). Терапия
проводится по непрерывной схеме [2].
У части больных отмечается резистентность к
бромокриптину. В этих случаях применяют препарат хинаголида либо препарат
каберголина. Каберголин в 2 раза эффективнее бромокриптина, имеет
пролонгированное действие, побочные эффекты выражены меньше.
Длительност лечения составляет от 6 мес. до 2
лет. На фоне медикаментозной терапии контроль за снижением уровня ПРЛ должен
проводиться ежемесячно: на 5-7-й день при восстановлении менструального цикла
или 1 раз в 30 дней при отсутствии менструаций. Динамическое исследование ПРЛ
позволяет подобрать дозу препарата и определить сроки лечения. Отсутствие
самостоятельных менструаций на фоне медикаментозного лечения свидетельствует о
сохранении повышенного уровня ПРЛ и не является показанием для дополнительного
назначения гестагенов, эстроген-гестагенных препаратов с целью ускорения
восстановления менструального цикла.
Частота восстановления овуляции и репродуктивной
функции у пациенток с гиперпролактинемией на фоне терапии агонистами дофамина
составляет 86 и 79% соответственно.
Дополнительное гормональное лечение,
направленное на регуляцию цикла (прогестагены) или стимуляцию овуляции (кломид,
клостильбегит, препараты ЧМГ/ЧХГ), по общепринятым схемам проводится в том
случае, когда на фоне нормального уровня пролактина менструальные циклы
продолжают оставаться ановуляторными. Наболее часто эту группу составляют
пациентки с гиперпролактинемией и СПКЯ. При наличии повышенного уровня
пролактина и регулярном ритме менструаций лечение бесплодия надо начинать не с
коррекции гиперпролактинемии, а с устранения основной причины бесплодия,
которая выявляется при применении комплексного клинико-лабораторного
исследования.
Яичниковая недостаточность
Яичниковая недостаточность (гипергонадотропная
аменорея) - это форма эндокринного бесплодия, характеризующаяся первичным
повреждением яичников, заключающемся в отсутствии фолликулярного аппарата или
нарушении его способности адекватно реагировать на стимуляцию гонадотропинами.
Выделяют следующие формы яичниковой
недостаточности:
· синдром истощения яичников;
· синдром резистентных яичников;
· дисгенезия гонад.
Синдром преждевременного истощения яичников и
синдром резистентности яичников встречается у 10% женщин с аменореей [2].
Дисгенезия гонад встречается в 1 случае на 10-12 тыс. новорожденных.
Для типичная форма дисгенезии гонад, или синдром
Шерешевского - Тернера характерен кариотип 45-Х. Клиническая картина
характеризуется специфическим внешним видом («фенотип Шерешевского - Тернера»),
низким ростом - не более 150 см., диспластичным телосложением: короткая шея с
низкой линией роста волос, кожные складки от сосцевидных отростков до
акромиальных, микрогнатия и высокое небо, низко расположенные ушные раковины,
вальгусная деформация локтевых и коленных суставов. Кроме того, могут быть
аномалия прикуса, косоглазие, щитовидная грудная клетка. У 38 % больных
встречаются аномалии почек и мочеточников, у 16 % - пороки развития
сердечнососудистой системы. Половое оволосение отсутствует, молочные железы не
развиты, матка резко гипопластична, т.е. имеется выраженный генитальный
инфантилизм. По данным УЗИ размеры гонад в виде соединительнотканных тяжей
составляют 1-1,5 см в длину и 0,3-0,5 см в ширину. При гистологическом
исследовании - элементы стромы, примордиальные фолликулы и ооциты отсутствуют.
Диагностика не представляет трудности в связи с
типичным внешним видом пациенток. Диагноз подтверждается данными УЗИ,
гормональными исследованиями, для которых характерно резкое повышение уровня
гонадотропинов, особенно фолликулостимулирующего гормона (ФСГ), уровень
которого соответствует ранней постменопаузе. Генетическое обследование включает
определение полового хроматина в буккальных мазках и кариотипа, при котором
выявляется соответственно отсутствие полового хроматина и типичный кариотип -
45-Х.
Стертая форма дисгенезии гонад характеризуется
вариабельностью клинических проявлений. Кариотип имеет мозаичный характер, чаще
45-Х/46-ХХ. Помимо мозаичного кариотипа, могут быть другие варианты хромосомных
аберраций, такие как делеция длинного или короткого плеча Х-хромосомы (Хс-,
Хр-), изохромосомы по длинному плечу X (Хс), по короткому плечу X (Хр),
сбалансированные транслокации между Х-хромосомой и аутосомой. Клиническая
картина зависит от процентного соотношения нормального и аберрантного клона
клеток. Чем выше процент клона клеток с кариотипом 45-Х, тем больше больные по
внешнему виду и клинической картине похожи на пациенток с синдромом
Шерешевского - Тернера. Соответственно при превалировании нормального клона с
кариотипом 46-ХХ клиническая картина может характеризоваться нормальным
морфотипом, спонтанным развитием вторичных половых признаков и даже
спорадическими самостоятельными менструациями. Но всегда имеет место
генитальный инфантилизм, повышенный уровень гонадотропинов и на УЗИ признаки
дисгенетичных гонад.
Чистая форма дисгенезии гонад характеризуется
кариотип 46-ХХ или 46-XY (синдром Свайера). Эта форма наиболее редкая, ее
частота - 1 на 100 тыс. новорожденных. Клиническая картина имеет особенности:
внешний вид характеризуется нормальным ростом, соматические дисплазии
отсутствуют, морфотип может быть евнухоидным или интерсексуальным, с умеренно
выраженным гирсутизмом (при синдроме Свайера), вторичные половые признаки не
развиты на фоне выраженного генитального инфантилизма. Гонады - в виде
соединительнотканных тяжей, а при синдроме Свайера - с элементами тестикул,
которые могут приобретать злокачественный характер. Описаны больные с чистой
формой дисгенезии гонад при кариотипе 46-ХХ. Причины возникновения этой формы
до конца не известны. Описание семейных случаев заболевания свидетельствует о
наследственной природе заболевания.
Диагностика основывается: на данных клинической
картины, в которой основным выступает выраженный половой инфантилизм;
эхоскопических признаках дисгенетичных гонад; высоких уровнях гонадотропинов;
определении кариотипа и отсутствия полового хроматина. Лапароскопия с биопсией
гонад подтверждает диагноз.
Синдром резистентных яичников возникает у женщин
в возрасте до 36 лет, (иногда через 6 - 10 лет после менархе), характеризуется
вторичной аменореей, макро- и микроскопически неизмененными яичниками и
повышенным уровнем гонадотропинов. Частота СРЯ составляет примерно 5 % среди
всех форм аменореи. Предполагают, что его развитие связано с дефектами
рецепторного аппарата фолликулов. Возможно, резистентность к гонадотропинам
объясняется нарушенной структурой ФСГ или патологией рецепторов гонадотропинов
в яичниках. Однако большинство исследователей считают причиной аутоиммунные
процессы. Так, обнаружены антиовариальные антитела в крови этих женщин, а также
частое сочетание с аутоиммунными заболеваниями [1].
Синдром истощенных яичников характеризуется
вторичной аменореей с вегетососудистыми нарушениями у женщин в возрасте в
среднем до 38 лет, имевших в прошлом нормальную менструальную и генеративную
функцию. Частота СИЯ в популяции составляет до 2 %, а в структуре вторичной
аменореи до 5-6% [1]. Одной из причин являются хромосомные аномалии, в
частности наличие трех Х-хромосом. Установлено, что различные неблагоприятные
факторы как в антенатальном, так и в постнатальном периоде (радиация,
химические вещества, тератогенные лекарственные препараты, вирус гриппа,
краснухи, паротита) могут привести к повреждению гонад и замещению их
соединительной тканью. Возможно, имеет место ускоренный, по сравнению с
физиологическим, апоптоз ооцитов в яичниках. Вероятно, на фоне неполноценного
генома любые экзогенные воздействия (инфекционные заболевания, интоксикации,
стрессы, хирургические вмешательства, химиотерапия) могут способствовать
развитию синдрома истощения яичников. Яичники уменьшаютса в размерах,
фолликулярный аппарат на УЗИ не определяется.
Основным клиническим симптомом яичниковой
недостаточности любой формы является гипергонадотропная аменорея (первичная при
дисгенезии гонад и вторичная при синдроме истощенных и резистентных яичников).
Диагноз яичниковой недостаточности
устанавливается на основании результатов гормонального исследования. Характерен
высокий уровень гонадотропных гормонов, особенно ФСГ (> 20 МЕ/л),
гипоэстрогении (< 100 пмоль/л). При яичниковой недостаточности проба с
гестагенами отрицательная, циклическая гормональная проба положительная. На УЗИ
органов малого таза отмечается гипоплазия матки, тонкий эндометрий, при
дисгенезии гонад яичники в виде тяжей, при истощении яичников - гипоплазия
яичников, отсутствие фолликулярного аппарата, при резистентных яичниках
фолликулярный аппарат сохранен. Цитогенетическое исследование проводят при
подозрении на дисгенезию гонад.
Стимуляция овуляции для лечения бесплодия не
показана. Проводится заместительная гормональная терапия. Для достижения
беременности производится перенос оплодотворенной донорской яйцеклетки в
полость матки с последующей заместительной терапией эстрогенами и гестагенами
до 12 недель.
Синдром поликистозных яичников
Синдром поликистозных яичников - это
мультифакторная гетерогенная патология, характеризующаяся нарушением
менструального цикла, хронической ановуляцией, гиперандрогенией, кистозными
изменениями яичников и бесплодием.
Частота СПКЯ среди женщин репродуктивного
возраста составляет 8 - 15%, среди женщин с эндокринным бесплодием - до 60%,
среди всех причин бесплодия до 20% [8].
Различают СПКЯ центрального, надпочечникового и
яичникового генеза.
Этиология и патогенез СПКЯ до конца не ясны.
СПКЯ является многофакторной патологией, возможно, генетически
детерминированной, в патогенезе которой действуют центральные механизмы
регуляции гонадотропной функции гипофиза с пубертатного периода, местные
яичниковые факторы, экстраовариальные эндокринные и метаболические нарушения,
определяющие клиническую симптоматику и морфологические изменения яичников.
Провоцирующими факторами, которые приводят к реализации генетического дефекта,
могут быть стресс, хронические инфекции, интоксикации, ожирение.
При центральной форме ведущим звеном патогенеза
является нарушение ритма выделения гонадотропинрелизинг гормона, и как
следствие, нарушение секреции ЛГ и ФСГ. Так же большое значение имеет
инсулинорезистентность и гиперинсулинемия. Дисфункция коры надпочечников также
способствует нарушению гипоталамо-гипофизарно-яичниковой системы. В результате
нарушается фолликулогенез и стероидогенез в яичниках. Происходит рост множества
фолликулов, находящихся на разной стадии развития, часть их подвергается
атрезии, часть лютеинизируется, капсула яичника утолщается.
Клинические проявления весьма вариабельны,
наиболее постоянные симптомы - нарушения менструального цикла, гиперандрогения,
хроническая ановуляция, бесплодие. Нарушения менструального цикла, как правило,
возникают с менархе, носят характер олигоменореи или аменореи первичной или
вторичной. Бесплодие первичное. У 30 - 50% больных наблюдается ожирение, а так
же различные симптомы вирилизации: гирсутизм, жирная себорея, угревая сыпь. На
УЗИ яичники увеличены в размерах, с большим количеством фолликулов от 2 до 9
мм, капсула утолщена. При гормональном исследовании наблюдается повышение
уровня ЛГ при нормальном ФСГ, а так же повышение уровня свободного
тестостерона, ДГЭА, андростендиона. Кроме того из-за постоянного монотонного
влиянии эстрогенов и сниженного уровня прогестерона в 40 - 50% в эндометрии
наблюдаются гиперпластические процессы [8].
Диагностика основывается на клинической картине,
результатах УЗИ и гормонального исследования. При наличии ожирения первый этап
терапии - нормализация массы тела при помощи диеты и физической нагрузки, а так
же с помощью таких препаратов, как метформин. При наличии высоких уровней ЛГ
проводится десенситизация гипоталам-гипофизарной системы до полного подавления
функции яичников. Для этого используют агонисты гонадолиберина (бусерелин 0,2%
2мг интраназально начиная с 21 или 2 дня менструального цикла 1-3 месяца). При
надпочечниковой форме СПКЯ применяют дексаметазон по 0,25 мг в сутки в течение
3 месяцев. Стимуляция овуляции кломифеном начинается с 5-го по 9-й день менструального
цикла по 50 мг в день. При отсутствии овуляции дозу кломифена можно увеличивать
в каждом последующем цикле на 50 мг, достигая 200 мг в день. Однако многие
клиницисты считают, что если нет эффекта при назначении 100-150 мг, то
дальнейшее увеличение дозы кломифена не целесообразно. При отсутствии овуляции
при максимальной дозе в течение 3-х мес пациентку можно считать резистентной к
кломифену. При наличие доминантного фолликула не менее 18 мм, толщины
эндометрия не менее 8-10 мм. рекомендуется введение овуляторной дозы 7500-10
000 человеческого хорионического гонадотропина после чего овуляция отмечается
через 36-48 часов. Для снижения антиэстрогенного эффекта кломифена
рекумендуется назначать эстрогены. При недостаточности лютеиновой фазы
рекомендуется назначить гестагены во вторую фазу цикла с 16 по 25 день [9].
При резистентности к кломифену назначают
гонадотропные препараты - прямые стимуляторы овуляции. Используется
менопаузальный человеческий гонадотропин (пергонал, хумигон и др.). В последние
годы разработан высокоочищенный препарат ФСГ (метродин) для стимуляции овуляции
у женщин с высоким ЛГ. Перспективным является клиническое применение
рекомбинантного ФСГ, полученного путем генной инженерии.
Частота индукции овуляции при лечении кломифеном
составляет примерно 60-65%, наступление беременности в 32-35%, частота
многоплодной беременности, в основном двойней, составляет 5-6%, риск
внематочной беременности и самопроизвольных выкидышей не выше, чем в популяции.
При стимуляции овуляции гонадотропинами частота
наступления беременности повышается до 60%, риск многоплодной беременности
составляет 10-25%, внематочной от 2,5 до 6%, самопроизвольные выкидыши в
циклах, закончившихся беременностью, достигают 12-30 [9].
В качестве хирургической стимуляции овуляции
используется клиновидная резекция яичников. В последние годы интерес к
хирургическому лечению возрос в связи с внедрением операционной лапароскопии,
преимуществами которой являются минимальное инвазивное вмешательство и снижение
риска спайкообразования. Кроме того, преимуществами лапароскопической резекции
являются: отсутствие риска гиперстимуляции, наступления многоплодной
беременности и возможность ликвидации часто сопутствующего перитонеального
фактора бесплодия. Патофизиологические механизмы клиновидной резекции в
стимуляции овуляции основаны на уменьшении объема стероидпродуцирующей стромы
яичников, в результате чего нормализуется чувствительность гипофиза к ГнРГ и
восстанавливаются гипоталамо-гипофизарно-яичниковые связи.
Помимо клиновидной резекции, при лапароскопии
можно производить каутеризацию яичников при помощи различных энергий (термо-,
электро-, лазерной), которая основана на разрушении стромы точечным электродом.
Операция менее травматичная и длительная по сравнению с клиновидной резекцией.
Большинство клиницистов отмечают рецидив ПКЯ и
клинической симптоматики примерно через 5 лет. Поэтому после беременности и
родов необходима профилактика рецидива СПКЯ, что важно, учитывая риск развития
гиперпластических процессов эндометрия. С этой целью наиболее целесообразно
назначение комбинированных оральных контрацептивов (КОК), предпочтительнее
монофазных (марвелон, фемоден, диане, мерсилон и др.). При плохой переносимости
КОК, что бывает при избыточной массе тела, можно рекомендовать гестагены во
вторую фазу цикла: дюфастон 20 мг с 16 по 25 день цикла,
медроксипрогестеронацетат (МПА) по 10-20 мг с 16 по 25 день цикла или 17-ОПК
12,5% в/м на 16 и 21 день цикла по 125-250 мг.
Гипотиреоз
Гипотиреоз - это клинический синдром, который
обусловлен стойким дефицитом гормонов щитовидной железы в организме. У женщин,
страдающих бесплодием гипотиреоз выявляется в 10-34% случаев [2].
Патогенетически выделяют первичный
(тиреогенный), вторичный (гипофизарный), третичный (гипоталамический) и
тканевой (транспортный, периферический). Вторичный и третичный гипотиреоз
объеденяют под названием центральный, но развивается в результате дефицита
тиреотропных гормонов.
По степени тяжести выделяют:
. Субклинический - концентрация ТТГ в
крови повышена, Т4 свободного в пределах нормы. Симптомов как правило нет.
. Манифестный - концентрация ТТГ
повышена, Т4 свободного снижена, есть умеренные клинические проявления.. Компенсированный. Декомпенсированный
. Осложненный - развернутая клиническая
картина, тяжелые осложнения (полисерозит, сердечная недостаточность,
креатинизм, микседема).При гипотиреозе наиболее частыми формами расстройств
репродуктивной функции являются гипоменструальный синдром, аменорея,
ановуляторные, дисфункциональные маточные кровотечения и бесплодие.
Причинами гипотиреоза чаще всего является
аутоиммунный тиреоидит, реже операции на щитовидной железе и терапия
радиоактивным йодом.
Дефицит тиреоидных гормонов приводит к изменению
процессов синтеза, транспорта, метаболизма и переферических эффектов половых
гормонов. Длительный дефицит тиреоидных гормонов приводит к развитию вторичной
гиперпролактинемии. Синдром гиперпролактинемического гипогонадизма при первичном
гипотиреозе носит название синдрома Ван-Вика-Хеннеса-Росса и проявляется
олигоменореей или аменореей, галактореей, хронической ановуляцией, вторичным
поликистозом яичников. Также может развиваться вторичная аденома гипофиза [2].
Диагноз устанавливается на основании клинических
признаков гипотиреоза и результатов исследования функции щитовидной железы.
Исследование сывороточных уровней ТТГ, ТЗ, Т4, свободных фракций ТЗ, Т4,
тиреоглобулина, антител к ТПО и ТГ.
Лечение проводится препаратами левотироксина.
При компенсации функции щитовидной железы, если беременность не наступила
самостоятельно, проводится стимуляция овуляции кломифеном, гонадотропинами,
агонистами гонадотропин-рилизинг-гормона.
Эндометриоз
Среди фертильных женщин эндометриоз диагностируют
примерно у 6-7%, тогда как среди пациенток, страдающих бесплодием, его частота
может достигать 20-48% [3].
К вероятным причинам инфертильности при
эндометриозе можно отнести следующие:
• трубное бесплодие: органическое - при
нарушении анатомии маточных труб, вызванном эндометриозным процессом;
функциональное - из-за воздействий на маточные трубы медиаторов воспаления и
цитокинов, образующихся в очагах эндометриоидных гетеротопий, а также на фоне
гормонального дисбаланса (постоянной относительной гиперэстрогении в сочетании
с прогестероновой недостаточностью во 2й фазе цикла), сопровождающего
эндометриоз;
• перитонеальное бесплодие - на фоне
эндометриоза возникает при спаечном процессе в малом тазу под влиянием тех же
причин (локальное воспаление в области эндометриоидных гетеротопий), что и
органическое трубное бесплодие;
• эндокринное бесплодие (ановуляция, НЛФ,
синдром лютеинизации неовулировавшего фолликула на фоне неадекватное
функционирования оси «гипоталамус-гипофиз-яичники») - обусловливается сопровождающим
эндометриоз дисбалансом женских половых стероидов (абсолютным или относительным
повышением эстрогенов) и потенцированием образования пролактина, нарушающих
гонадотропиновую регуляцию функции яичников;
• иммунные реакции, вызывающие угнетение процесса
имплантации бластоцисты в эндометрий или поражение сперматозоидов
активированными макрофагами.
Повышенный уровень эстрогенов при эндометриозе
может провоцировать гиперпролактинемию, наблюдаемую у отдельных больных. Кроме
того, бесплодию при эндометриозе в определённой степени способствует и
нарушение половой функции из-за выраженной диспареунии, затрудняющей регулярную
половую жизнь и/или обеспечение полноценного полового акта.
В зависимости от локализации эндометриоидных
гетеротопий выделяют:
• генитальный эндометриоз;
• экстрагенитальный эндометриоз.
Эндометриоз яичников, маточной трубы, тазовой
брюшины, ректовагинальной перегородки и влагалища относят к наружному, а
эндометриоз матки (аденомиоз) ― к
внутреннему. Экстрагенитальный эндометриоз топографически не связан с половыми
органами и может поражать любые органы и ткани. Внедрение эндохирургических
методов диагностики и лечения позволило выявить так называемые малые формы
наружного генитального эндометриоза, когда диаметр очага не превышает 5 мм, но
рубцовые изменения брюшины могут иметь место.
В настоящее время используется следующая
классификация аденомиоза (внутреннего эндометриоза) диффузной формы (В.И.
Кулаков, Л.В. Адамян, 1998):
• стадия I ― патологический
процесс ограничен слизистой оболочкой тела матки;
• стадия II ― переход
патологического процесса на мышечные слои;
• стадия III ― распространение
патологического процесса на всю толщу мышечной стенки матки до её серозного
покрова;
• стадия IV ― вовлечение
в патологический процесс, помимо матки, париетальной брюшины малого таза и
соседних органов.
Современный подход к лечению бесплодия при
наружном генитальном эндометриозе состоит в первоначальной попытке
восстановления естественной фертильности с использованием средств
(хирургических и/или гормональных), применяемых для лечения собственно самого
эндометриоза и его осложнений (анемии, болевого синдрома). При этом также
предусматривают устранение сопутствующей патологии, сопровождающей эндометриоз
(например, овуляторных нарушений, перитонеальных спаек и др.). При
сохраняющемся в течение 1-2 лет бесплодии на фоне такой терапии рекомендуют
переходить к лечению с использованием ЭКО. Инфертильным пациенткам старше 38
лет процедуру ЭКО следует назначать сразу же, причём независимо от формы и
тяжести эндометриозного процесса. Как безальтернативный метод преодоления
бесплодия ЭКО исходно рекомендуют инфертильным пациенткам с аденомиозом,
ретроцервикальным эндометриозом и перитонеальным эндометриозом IV степени. В
основном для оперативных вмешательств используют лапароскопию, но при тяжёлых
формах эндометриоза применяют и лапаротомический доступ.
При наличии у пациентки с бесплодием
эндометриоидных (шоколадных) кист яичников выполняют экономные операции,
ставящие задачей удаление кистозных образований с минимальным повреждением
здоровых тканей яичников.
При наружном генитальном (перитонеальном)
эндометриозе I-II степени достаточно интраоперационной диатермогоагуляции
очагов эндометриоза без последующей гормональной терапии. При наружном
генитальном эндометриозе III степени после хирургической коррекции
(лапароскопическим или лапаротомическим доступом) показано применение
гормональной терапии на протяжении не более 3 мес. и у пациенток не старше 38
лет. Гормональную терапию проводят агонистами ГнРГ или даназолом. Препараты
агонистов ГнРГ используют в количестве не более 3 инъекций. Даназол назначают в
дозе 40 мг/сут в непрерывном режиме не более 3 мес. После выполненного
хирургического лечения перитонеального эндометриоза возможно восстановление
естественной фертильности в течение 1-2 лет. В этом периоде целесообразно
проведение контролируемой индукции овуляции для повышения частоты овуляторных
циклов. В случае отсутствия беременности в указанные сроки необходимо направить
пациентку на программу ЭКО.
При сочетании у больных бесплодием наружного
(перитонеального) и внутреннего эндометриоза тактика ведения пациенток для
достижения спонтанной беременности такова же, как и при наличии у них только
наружного генитального эндометриоза. При неэффективности такого лечения
пациенток направляют на ЭКО. При бесплодии, связанном только с аденомиозом,
больным изначально рекомендуют ЭКО, поскольку при внутреннем эндометриозе
восстановление естественной фертильности с помощью гормонального или
эндохирургического лечения представляется бесперспективным [11].
Трубно-перитонеальное бесплодие
женский мужской бесплодие
Трубно-перитонеальное бесплодие - это отсутствие
беременности, обусловленное нарушением проходимости маточных труб и спаечным
процессом в малом тазу. При этом преобладает трубный фактор, а перитонеальная
форма встречается реже.
Основными причинами поражения маточных труб и
развития спаечного процесса являются:
· пренесенные воспалительные
заболевания органов малого таза (ИППП). Наибольшая роль принадлежит гонококкам
и хламидиям, а также анаэробно-аэробным микробным ассоциациям и вирусным
инфекциям.
· Внутриматочные манипуляции
(внутриматочная контрацепция, искусственные аборты, диагностические
выскабливания, гидротубации маточных труб и др.)
· Перенесенные ранее оперативные
вмешательства на органах малого таза и брюшной полости
В патогенезе бесплодия при воспалительных
заболеваниях придатков матки ведущую роль играют функциональные нарушения
кинетики и обструкция маточных труб, а также нарушения иммунного статуса и
процесса овуляции. Функциональные нарушения кинетики маточных труб могут быть
обусловлены воспалительной инфильтрацией стенок труб и атрофией реснитчатого
эпителия слизистой оболочки. Ключевым моментом является образование
гидросальпинкса за счет усиленной продукции слизи. Вследствие сдавления
эпителия происходят некротические изменения, которые в первую очередь
охватывают цилиарный эпителий, происходит децилиация эпителия и нарушение
транспортной функции труб. Обструкция маточных труб возникает в результате рубцовых
склеротических изменений при разрушении инфекцией трубного эпителия. После
однократного эпизода сальпингита обструкция маточных труб выявляется у 11-13%
больных, двукратного - у 23-36%, троекратного и более - у 54-75% пациенток [5].
Существует следующая классификация спаечного
процесса (Hulka и соавт.,
1987г.):
стадия - спайки минимальные, труба проходима,
складчатость сохранена;
стадия - более 50% яичника свободна. Окклюзия
дистального отдела, складчатость сохранена;
стадия - свободно менее 50% поверхности яичника,
окклюзия дистального отдела трубы, складчатость разрушена;
стадия - поверхность яичника не видна,
гидросальпингс (сактосальпингс), складчатость разрушена.
Диагностика включает обследование на генитальные
инфекции, УЗИ органов малого таза (можно определить гидросальпингс большого
размера). Для определения проходимости маточных труб используется:
Ø Гистеросальпингография - контрастное
изображение полости матки и маточных труб с помощью рентгенографии. В процессе
исследования может наблюдаться рефлекторный спазм устьев маточных труб.
Диагностическая ценность 60-70%. Противопоказаниями являются острые и подострые
воспалительные заболевания органов малого таза, общие инфекционные заболевания,
беременность. Проводится это исследование в лютеиновую фазу цикла.
Ø Контрастная
эхогистеросальпингоскопия оценка состояния полости матки и проходимости
маточных труб с применением анэхогенных и гиперэхогенных контрастов под
контролем УЗИ. Диагностическая ценность 80%.
Ø Кимографическая пертубация
проводится в первую фазу цикла при помощи специального аппарата. В качестве
вводимыхгазов используются углекислый газ, кислород, воздух. Оценка результатов
проводится по показанию давления манометров, количеству введенного воздуха,
результатам аускультации брюшины, появлению френикус-симптома. Метод дает
представление о проходимости и сократительной способности маточных труб, однако
из-за низкой специфичности малоприменим.
Ø Лапароскопия позволяет получить
точную визуальную оценку состояния органов малого таза, распространенности
спаечного процесса.
Ø Трансвагинальная эндоскопия
(гидролапароскопия) проводится путем пункции заднего свода в условиях
гидрофлотации. Менее агрессивный метод, чем лапароскопия, доступ через задний
свод позволяет наиболее полно обследовать область придатков.
Консервативное лечение с применением
противовоспалительной, противоспаечной терапии, гидротубации маточных труб не
перспективно. Альтернативой является лапароскопическая микрохирургия, однако ее
эффективность достигает не более 10-45%в зависимости от выраженности спаечного
процесса. Проводится разделение спаек, восстановление проходимости маточных
труб и восстановление нормальной анатомии органов малого таза. Различают
следующие разновидности операций:
· Сальпингоовариолизис - рассечение
спаек, прикрывающих маточную трубу и яичник и изолирующих их друг от друга
· Фимбриолизис - проводится при фимозе
фимбрий, представляет собой разделение фимбрий в месте их склеивания
· Сальпингостомия - производится при
непроходимости маточной тубы в ампулярном отделе
· Сальпингонеостомия - проводится при
восстановлении проходимости маточной трубы в ампулярном отделе при его полной
деструкции
· Тубэктомия - проводится при
гидросальпингсе, заключается в удалении бесперспективной в отношении
восстановления функции маточной трубы.
Эффективность лечения при 1-2 степени
выраженности спаечного процесса 40-45%, при 3-ей - 15-20%, при 4-ой - не более
10%. Повторные оперативные вмешательства малоэффективны. В случае неудачи
рекомендуется применение ВРТ [10].
Маточный фактор
Кроме уже рассмотренных выше эндокринных
нарушений и трубно-перитонеальных изменений к бесплодию также могут приводить
следующие факторы:
o шеечный фактор - анатомические или
функциональные изменения шейки матки, препятствующие движению сперматозоидов
или приводящие к их гибели (эндоцервицит, эрозия шейки матки, полипы
цервикального канала, стеноз наружного зева);
o маточный фактор - пороки развития
матки (перегородка полости матки, гипоплазия матки и др.), патологические
состояния эндометрия (хронический эндометрит, синехии и полипы в полости
матки), новообразования матки (фибромиомы).
Патологические состоянии шейки матки и
цервикального канала редко бывают основной причиной бесплодия, чаще они
сочетаются с другой патологией. Однако при наличии бесплодия и отсутствии
другой патологии это может быть единственной причиной. При эндоцервицитах
происходит изменение состава шеечной слизи и ее pH,
нарушается проникновение сперматозоидов в полость матки. В этом случае при
наличии проводится соответствующее противовоспалительное лечение с учетом
этиологии возбудителя по результатам ПЦР-обследования на ИППП. Полип
цервикального канал подлежит удалению. Стеноз наружного зева может развиться
после выскабливания цервикального канала, электрокоагуляции эрозии шейки матки,
конизации шейки матки. Для устранения этого фактора производят внутриматочную
инсеминацию [3].
Бесплодие может быть вызвано различными пороками
развития матки и внутриматочными синехии. Внутриматочные синехии - патология,
которая связана с полным или частичным сращением полости матки ( болезнь
Ашермана). Синехии возникают после эндометрита, выскабливаний слизистой полости
матки или консервативной миомэктомии. С лечебной целью проводится
гистероскопическое разделение сенехий с последующей установкой внутриматочной
спирали и приемом КОК в течение 3-6 месяцев.
Иммунологическое бесплодие
Иммунологическое бесплодие обусловлено
образованием антител к сперматозоидам, которые возникают как у мужчин, так и у
женщин. Известно около 40 антигенов эякулята мужчин, к которым образуются
антитела. Антиспермальные антитела образуются в шейке матки, реже в эндометрии
или маточных трубах. Шейка матки является основным звеном локального
иммунитета, в ней образуются иммуноглобулины класса А, кроме того,
иммуноглобулины классов, М G которые абсорбируются из плазмы. Концентрация
иммуноглобулинов меняется на протяжении менструального цикла, отмечено их
уменьшение в период овуляции [7].
Для диагностики иммунологического бесплодия
проводится посткоитальный тест, который основан на оценке число и подвижность
сперматозоидов в цервикальной слизи. Пипеткой производится забор цервикальной
слизи спустя 2,5 часа после полового контакта. В норме обнаруживается 10-20
сперматозоидов в поле зрения, если это число меньше, то можно говорить о
иммунологическом бесплодии. При склеивании сперматозоидов антителами под
микроскопом можно наблюдать вместо поступательного движения колебание и
подрагивание. В качестве лечения используется метод десенсибилизации
лимфоцитами мужа (донора) либо внутриматочная инсеминация.
Мужское бесплодие
Так как в процессе зачатия участвуют двое, при
наличии бесплодия необходимо исключить мужской фактор бесплодия. Кроме того
необходимо помнить, что в 5-10% случаев имеет место сочетанное бесплодие.
· Варикоцеле
· Инфекционно-воспалительные
заболевания половых органов
· Патозооспермия неустановленной этиологии
· Изолированные нарушения продукции
семенной жидкости
· Иммунологическое бесплодие
· Врожденные аномалии развития
(крипторхизм, монорхизм, гипоспадия, эписпадия и др.)
· Системные заболевания (туберкулез,
цирроз печени, ХПН, хронические заболевания дыхательных путей, сахарный диабет,
эпид. паротит, протекавший с выраженным орхитом)
· Хирургические вмешательства поп
поводу паховой грыжи, гидроцеле, стриктуры мочеиспускательного канала, операции
на мочевом пузыре, симпатэктомии и др.
· Лучевая, химио- и гормонотерапии,
применение транквилизаторов, антигипертензивных средств и др.
· Сексуальные и эякуляторные нарушения
· Обструктивная азооспермия
· Некрозооспермия
· Эндокринные нарушения (первичный и
вторичный гипогонадизм, гиперпролактинемия, тестостерон-дефицитные состояния)
· Хромасомная патология
[4]
Кроме того способствуют нарушению фертильности
курение, злоупотребление алкоголем, профессиональные вредности, тепловой
фактор, травма органов мошонки, алиментарный фактор, психологические нарушения.
По механизму нарушения различают:
§ Секреторное бесплодие - недостаточность
секреторной функции половых желез
§ Экскреторное бесплодие - нарушение транспорта
сперматозоидов по семявыносящим путям
§ Иммунологическое бесплодие
§ Относительное бесплодие
Диагностика включает сбор анамнеза, объективное
обследование, спермограмму, определение антиспермальных антител, оценку
акросомальной реакции сперматозоидов, обследование на наличие ИППП,
гормональный скрининг, медико-генетическое консультирование.
Нормальными показателями спермограммы считаются:
v Объем - 2-5 мл
v pH - 7.2-8
v Вязкость - до 2 см
v Время разжижения - до 60 мин
v Количество сперматозоидов - не менее 20 млн/мл
v Общее количество сперматозоидов - не менее 60
млн
v Подвижность сперматозоидов:
Быстрое поступательное движение (А или 4) -
более 25%
Поступательное движение (А + В или 3,4) - более
50%
v Морфология: нормальные сперматозоиды - 30%-70%
(по данным разных авторов)
v Агглютинация - отсутствует
v Лейкоциты - не более 10 млн. в мл
v Клетки спермиогенеза - не более 4% от общего
количества
v Клетки эпителия - единичные
v Эритроциты - отсутствуют
Подвижность сперматозоидов оценивают и
классифицируют по следующим критериям:
Характеристика движения сперматозоидов (ВОЗ,
1992 г.)
ü A - быстрое прогрессивное движение.
ü B - медленное линейное и нелинейное
прогрессивное движение.
ü C - колебательное или движение на
месте.
ü D - сперматозоиды не подвижны.
Характеристика движения сперматозоидов(AUA, 1997
г.)
ü 0 - отсутствие движения.
ü 1 - вялое движение на месте.
ü 2 - медленное извилистое движение.
ü 3 - умеренное прогрессивное
движение.
ü 4 - выраженное прогрессивное
движение.
Для обозначения патологии спермы используются
следующие термины:
Ø Нормозооспермия - нормальные
показатели сепрмы
Ø Олигозооспермия - концентрация
сперматозоидов менее 20 млн. в мл
Ø Тератозооспермия - нормальных форм
сперматозоидов менее 30% при нормальном общем количестве и доле подвижных форм
Ø Астенозооспермия - подвижность
сперматозиодов менее 25% категории A
или менее 50% категории A+В
при нормальных показателях количества и морфологии
Ø Олигоастенотератозооспермия -
сочетание трех указанных выше нарушений
Ø Азооспермия - сперматозоиды в сперме
отутствуют
Ø Аспермия - отсутствие спермы как
таковой
Лечение мужского бесплодия может включать в себя
консервативные методы (противовоспалительное лечение, гормональная коррекция,
лечение сексуальных расстройств), хирургические (при варикоцеле, крипторхизме,
обструктивных нарушениях). А при безуспешном консервативном лечении применяются
альтернативные методы (ИКСИ, ИСМ, ИСД).
Вспомогательные репродуктивные технологии
В настоящее к термину вспомогательные
репродуктивные технологии (ВРТ) относятся экстракорпоральное оплодотворение
(ЭКО), перенос эмбрионов (ПЭ), перенос женских и мужских гамет в маточные трубы
под лапароскопическим и ультразвуковым контролем (ГИФТ), перенос зигот в
маточные трубы (ЗИФТ), ЭКО с использованием донорских гамет и эмбрионов, ЭКО с
применением микроманипуляций (интрацитоплазматическая инъекция сперматозоидов -
ИКСИ или введение сперматозоидов под zona
pellucida) [4].
С помощью программы ВТР возможно лечение
большинства больных, страдающих тяжелыми формами бесплодия практически любой
этиологии. Однако существует ряд противопоказаний к включению в программу ВТР.
К ним относится наличие тяжелых экстрагенитальных заболеваний, при которых
вынашивание беременности противопоказано, наличии психических заболеваний,
высоком риске генетически наследуемых заболеваний у потомства. Программа ВТР
предусматривает предварительное обследование супружеской пары и определение
показаний, выбор оптимального метода ВТР с учетом имеющейся патологии,
предимплантационную генетическую диагностику, ведение бременности и родов с
минимальными репродуктивными потерями.
Сама процедура ЭКО включает в себя стимуляцию
суперовуляции для забора достаточного количества преовуляторных фолликулов,
оплодотворение яйцеклетки вне организма и перенос эмбриона. Стимуляция
суперовуляции может проводиться с помощью кломифена или экзогенных
гонадотропинов (пергонал, хумегон, метродин). Для повышения эффективности в
схему стимуляциивключают агонисты гонадолиберинов (трипторелин, бусерелин,
госерелин). В процессе оплодотворения яйцеклетки при наличии мужского бесплодия
используется метод ИКСИ. Эта методика позволяет иметь потомство мужчинам с
тяжелыми формами олиго-, астено-, терато- и даже азооспермии.
Наиболее грозным осложнением стимуляции
суперовуляции является развитие синдрома гиперстимуляции яичников (СГЯ). Для
предотвращения тяжелых форм этого осложнения возможна криоконсервация эмбрионов
с последующим переносом их в следующем нестимулированном цикле. Методика
криоконсервации эмбрионов используется также в программе донации эмбрионов.
При получении беременности дальнейшее наблюдение
и лечение направлено на снижение возможных репродуктивных потерь. Одной из
методик улучшения исхода для многоплодной беременности является метод редукции
эмбриона с помощью введения кардиотоксических средств эмбриону
трансабдоминальным или трансвагинальным путем под контролем УЗИ.
Программы донации и суррогатного материнства
используются для женщин, у которых невозможно получение собственных ооцитов или
отсутствует матка. Первый в мире ребенок родился от суррогатной матери в 1989г.
в Великобритании, с тех пор эта программа начала широко применяться во многих
странах.
Эффективность программ ВТР в настоящее время
15-45%.
Заключение
Несмотря на большие успехи медицины в лечении
бесплодия, эта проблема по-прежнему имеет много нерешенных вопросов.
В связи с ухудшающимся репродуктивным здоровьем все
больше пар сталкиваются с этой проблемой. Поведенческий фактор тоже играет
большую роль. Первую беременность женщины все чаще планируют после 30-35 лет,
что резко снижает шансы на благоприятный исход лечения. Широкое распространение
ИППП приводит к хроническим воспалительным заболеваниям органов малого таза,
которые впоследствии осложняются трубно-перитонеальным бесплодием у женщин и
нарушением сперматогенеза у мужчин. Крайне негативно сказываются на
репродуктивном здоровье аборты, которые приводят к хроническим эндометритам,
синехиям в полости матки. Поэтому в качестве профилактики таких тяжелых
негативных последствий необходимо своевременное лечение воспалительных
заболеваний органов малого таза, использование адекватных методов контрацепции.
Для успешного лечения бесплодия большое значение имеет правильная и быстрая
диагностика, а также своевременное направление пар на ЭКО. Затягивание процесса
обследования и лечения снижает вероятность успеха.
Все большее распространение приобретают
вспомогательные репродуктивные технологии, однако при включении пациентов в
программы вспомогательных репродуктивных технологий не стоит забывать, что
возникновение патологических состояний репродуктивной системы часто обусловлено
хромосомными, генными мутациями и наличием наследственной предрасположенности к
заболеванию. Генетические мутации родителей, приводящие к нарушению репродукции
и невозможности зачатия ребенка естественным путем, при применении программ ВРТ
могут передаваться будущему потомству. Так некоторые авторы отмечают повышение
уровня пороков развития в среднем в 2,5 раза у мальчиков, рожденных в программе
ИКСИ, по сравнению с девочками, и связывают это с тем, что в программе ИКСИ
возникают хромосомные мутации de novo. Таким образом, пациенты с тяжелыми формами
бесплодия, нуждающиеся в лечении методами ВРТ, требуют к себе повышенной
генетической настороженности. Кроме того, появляется информация о том, что дети
рожденные в результате программ ЭКО, впоследствии чаще имеют патологию иммунной
и эндокринной системы, сами сталкиваются с бесплодием.
Литература
1. «Аменорея»,
Манухин И.Б., Геворкян М.А., Тумилович Л.Т., Акушерство, гинекология и
репродуктология, №5, 2009
. «Гинекологическая
эндокринология», Серов В.Н., Прилепская В.Н., Овсянникова Т.В., Москва, 2008
. «Гинекология»,
Савельева Г.М., Бреусенко В.Г., Москва, 2007
. «Гинекология»,
Серов В.Н., Кира Е.Ф., Москва, 2008
. «Инфекционная
патология нижнего отдела половых путей женщины и бесплодие», Рудакова Е.Б.,
Семенченко С.И., Панова О.Ю., Кучинская Н.В., Гинекология, №3, 2004
. «Комплексное
гинетическое обследование мужчин: программы ИКСИ», Глинкина Ж.И., Гинекология
№4, 2006
. «Неоперативная
гинекология», Сметник В.П., Тумилович Л.Г., Санкт-Питербург, 1995
. «Синдром
поликистозных яичников: клиника, диагностика, лечение», Манушарова .А.,
Черкезова Э.И., Лечащий врач, №4, 2010
. «Синдром
поликистозных яичников: современные возможности гормональной терапии»,
Доброхотова Ю.Э., Джобаева Э.М., Филатова Л.А., Герасимович М.Ю., Гинекология,
№1, 2007
. «Структура
женского бесплодия и прогноз восстановления репродуктивной функции при
использовании современных эндоскопических методов», Кулаков В.И., Маргиани
Ф.А., Назаренко Т.А., Акушерство и гинекология, №3, 2001
. «Экстракорпоральное
оплодотворение в лечении бесплодия, обусловленного генитальным эндометриозом»,
Смольникова В.Ю., Гинекология, №2, 2004
. «Эндокринное
бесплодие у женщин при гиперпролактинемии», Овсянникова Т.В., Гинекология, №6,
2004
Приложение