Преимущества от внедрения системы ХАССП
Содержание
Введение
Глава I. Анализ работы склада
1.1 Хранение товаров на складах Национальной
Логистической Компании
1.2 Проблемы, возникающие при хранении лекарственных
средств
1.3 Документы, регламентирующие хранение лекарственных
средств
1.4 Системы управления безопасностью продуктов питания
ХАССП
1.5 Описание работы аптечного склада
1.6 Требования к аптечным оптовым складам
Глава II. Выявление и квалиметрический анализ опасных
факторов
2.1 Опасные факторы, влияющие на качество лекарственных
средств при хранении
2.2 Квалиметрический анализ
2.2.1 Ранжирование опасных факторов методом попарных
сравнений
2.2.2 Мероприятия по улучшению
2.2.3 Ранжирование мероприятий методом нессиметричных
матриц
2.3 Формирование окончательного списка мероприятий на
основе анализа диаграмм Парето
Глава III. Разработка стандарта. СТО "Организация
хранения лекарственных средств на оптовом аптечном складе"
3.1 Место стандарта организации в иерархии нормативной
документации СМК
3.2 СТО "Организация хранения лекарственных средств
на оптовом аптечном складе"
Глава IV. Расчёт экономической эффективности от
внедрения системы управления безопасностью лекарственных средств ХАССП на
стадии "хранение"
4.1 Проблема фальсификации лекарственных средств
4.2 Поддельные и некачественные лекарственные средства
убивают
4.3 Расчёт экономической эффективности от внедрения
системы ХАССП
Глава V. Анализ производственной и экологической
безопасности на рабочем месте оператора складской программы
5.1 Краткое описание склада и рабочего места оператора
складской программы
5.2 Физические факторы обитаемости на аптечном складе
5.3 Расчет искусственного освещения рабочего места
оператора складской программы
Заключение
Список литературы
Введение
Медикаменты - товар, напрямую влияющий на здоровье человека,
поэтому вопросы качества в данной области имеют первостепенное значение.
Качество лекарственных средств в первую очередь зависит от
разработки, испытаний и изготовления лекарственных средств, от качества
исходного сырья, вспомогательных, упаковочных, маркировочных материалов, а так
же от того, в каких условиях они хранились, перед тем как попасть в руки
потребителя.
Одной их существующих проблем является соблюдение сроков
годности лекарственных средств, надлежащих условий хранения и транспортировки
потребителю, что напрямую зависит от организации хранения и логистических
операций на складе.
Для решения этой проблемы представляется целесообразным
использование Системы управления безопасностью продуктов питания. Это ХАССП (HACCP - Hazard Analysis Critical Control - система анализа рисков
в критических контрольных точках).
В дипломе рассматриваются: преимущества от внедрения системы
ХАССП, описывается методика формирования группы ХАССП, технологическая схема
обращения лекарственных средств в период их хранения на оптовом аптечном
складе, обосновываются опасные факторы хранения, приводятся методики и
результаты их ранжирования методами анализа иерархий и парных сравнений.
Определяются критические контрольные точки, для измерения
опасных факторов, их номинальные значения и предельные отклонения, места их
расположения.
Обосновывается необходимость сертифицированной системы
качества ХАССП, приводится перечень исходных данных для ее сертификации.
В дипломе также приводится методика разработки руководства по
логистическим операциям оптового аптечного склада с учетом требований
приведенной системы.
Глава
I. Анализ работы склада
1.1 Хранение товаров на складах Национальной Логистической
Компании
Национальная Логистическая Компания - это современные
складские комплексы, ориентированные на предоставление высокотехнологичных
услуг по хранению и обработке грузов.
Складские помещения Национальной Логистической Компании
оснащены высококлассным оборудованием немецкого производства, а
автоматизированная система складского учета позволяет обеспечивать высокую
динамику обработки грузов на всех этапах логистической цепочки - от приема
груза на склад до его отгрузки. Помимо этого, система позволяет отслеживать
хранящиеся товары по ряду параметров (дате приема на склад, сроку реализации,
товаровладельцу), что позволяет сделать процесс хранения эффективным и легко
контролируемым [1].
Богатый опыт, накопленный компанией на рынке складских,
таможенных и транспортных услуг, служит гарантией высокого качества
предоставляемых услуг, их комплексности и ориентации на удовлетворение
логистических потребностей клиента.
Национальная логистическая компания признана "Лучшим
складским оператором-2003". В 2004 году компания успешно сертифицировалась
по ISO 9001: 2000.
На терминалах Национальной Логистической Компании
предусмотрены склады стеллажного, напольного и мелкоячеистого хранения,
специализированные фармацевтические склады и офисные помещения открытой
планировки. Наличие склада временного хранения, таможенного склада и
таможенного поста позволит максимально эффективно обрабатывать грузопоток,
поступающий в Москву из Северной Европы.
лекарственное средство хранение безопасность
Национальная Логистическая Компания предлагает следующий
спектр услуг по хранению [1]:
· Хранение на складе временного хранения
(таможенный склад) и свободном складе как обычных, так и акцизных маркируемых
товаров.
· Хранение товаров, требующих определенных
температурных условий.
· Погрузочно-разгрузочные работы.
· Сортировка и комплектация заказов.
· Обработка товара по специальным
требованиям заказчика.
· Круглосуточная обработка груза.
· Предоставление необходимых отчетов о
движении грузов на складе.
Фармацевтическое направление Национальной Логистической
Компании предлагает следующие услуги:
· Предоставление складских
площадей отвечающих всем требованиям предъявляемых Министерством
Здравоохранения Российской Федерации к фармацевтическим складам и
лицензирование данных площадей от имени арендатора.
· Предоставление
лицензированных фармацевтических складов в аренду.
· Для клиентов, не имеющих
юридического лица в России: лицензирование контракта на ввоз медикаментов в
Россию, завоз товара, таможенная очистка, отгрузка по требованию клиента.
· Предоставление в аренду
таможенных складов и склады временного хранения специально оборудованных для
работы с лекарственными средствами.
· Таможенная очистка
ввозимых лекарственных средств. В настоящее время терминал соответствует самым
строгим стандартам работы с лекарственными средствами.
· Доставка лекарственных
средств из-за границы и транспортировка по территории России.
· Кредитование
фармацевтических предприятий под залог товаров находящихся на хранении.
Услугами Национальной Логистической Компании на сегодняшний
день пользуются как лидеры в производстве лекарственных средств: "ГлаксоСмитКляйм",
"Никомед", "Балканфарма", "Бутс Хэлскэр",
"Бристол Майерс Сквибб", так и лидеры дистрибьюции, например
"Морон" [1].
1.2 Проблемы, возникающие при хранении лекарственных средств
Медикаменты - товар, напрямую воздействующий на здоровье,
поэтому вопросы управления качеством имеют для данного вида продукции
первостепенное значение. Одной из существующих проблем в сфере оборота
лекарственных средств является соблюдение сроков годности, надлежащих условий
хранения и транспортировки потребителю, что напрямую зависит от организации
хранения и логистических операций на складе.
Логистические процессы наравне с производственными процессами
также должны строго регламентироваться, так как:
· Во-первых, в процессе распределения
продукции (из-за несоблюдения технологий хранения, транспортировки, продления
сроков годности) возможна потеря качества лекарственных препаратов. В
результате, это может принести вред пациентам, воспользовавшимся этими
лекарственными средствами.
· Во-вторых, неэффективно функционирующая
цепь поставок приводит к увеличению цены готовой продукции. Современный
фармацевтический рынок таков, что успешно конкурировать на нём могут только те
компании-производители, которые предлагают высококачественные лекарственные
средства по доступным ценам. Таким образом, логистическая составляющая цены
приобретает особое значение.
· В-третьих, во многих случаях неразвитость
системы предоставления пациентам услуг по доставке необходимой медицинской
продукции в стационары (например, для оперативного лечения), отсутствие
возможности делать заказы на редкие препараты, материалы из удалённых регионов
является препятствием для получения необходимого лечения пациентами. Таким
образом, низкий уровень сервиса приносит вред имиджу компаний производителей.
Эти причины и определяют необходимость контроля прохождения
лекарственных средств по всей цепи поставок, начиная с этапа производства и
заканчивая этапом доставки готовой продукции пациентам. Дополнительным эффектом
контроля цепи поставок является отслеживание появления в цепи контрафактной или
некачественной продукции. Каждый пациент, держа в руках коробку с лекарством,
должен иметь возможность при помощи информационной системы понять: контрафакт
это или нет. Для этого необходимы данные о производителе, сроке годности, всех
посредниках, участвующих в процессе распределения медицинской продукции. Если
было употреблено некачественное лекарство, то, как понять, кто несёт
ответственность: производитель или дистрибьютор. Среди главных проблем
возникающих в системах распределения ЛС специалисты по логистике фармацевтики
выделяют следующие [2]:
· изменение качества (загрязнение, порча,
изменение свойств) ЛС во время транспортировки;
· неопределённости в учёте партийности
(смешение производственных лотов у дистрибьюторов, неоднородность партий);
· нарушение технологии хранения и
грузопереработки дистрибьюторами;
· недостаточная прозрачность движения
продукции и данных;
· рост объёмов контрафактной продукции;
· большое число посредников;
· неопределённости в учёте данных о дате
производства и сертификации.
Специфика фармацевтического рынка определяется следующими
факторами:
· широкий ассортимент продукции медицинского
назначения и лекарственных средств;
· специфика требований по технологии
перевозок для различных групп лекарственных средств;
· специфика требований по технологии
хранения лекарственных средств;
· различные способы складской обработки
лекарственных средств,
· трудности с получением сертификатов,
лицензий и других разрешительных документов;
· ограниченная заменяемость лекарственных
средств;
· недопустимость продления срока годности;
· длительные сроки поставки продукции;
· необходимость контроля качества при
закупках;
· наличие на рынке большого количества
контрафактной продукции;
· проблема невозможности возврата продукции
медицинского назначения;
· планирование оптимальных потребностей в
лекарственных средствах;
· необходимость подготовки квалифицированных
специалистов;
· необходимость наличия специальной
информационной среды, системы учёта и кодификации, позволяющих обеспечить
прослеживаемость движения ЛС и данных;
· отсутствие системы выполнения срочных
штучных заказов на поставку лекарственных средств из других регионов по
доступным для пациентов ценам.
1.3 Документы, регламентирующие хранение лекарственных средств
Существуют основные требования, которые необходимо выполнять
при разработке, производстве, проведении испытаний, хранении лекарственных
средств и их транспортировке. Эти требования регламентируются рядом нормативных
документов:
· Стандарт ОСТ 42-510-98 "Правила
организации производства и контроля качества лекарственных средств (GMP)".
· Стандарт ОСТ 42-505-96 "Продукция
медицинской промышленности. Технологический регламент производства. Содержание,
порядок разработки, согласования и утверждения".
· ОСТ 91500.05.0005-2002 "Правила
оптовой торговли лекарственными средствами. Основные положения".
· ГОСТ Р ИСО 14644-1 "Чистые помещения
и связанные с ними контролируемые среды. Часть 1. Классификация чистоты воздуха".
· ГОСТ Р ИСО 14644-2-2001 "Чистые
помещения и связанные с ними контролируемые среды. Часть 2. Требования к
контролю и мониторингу для подтверждения постоянного соответствия ГОСТ Р ИСО
14644-1-2000".
· ГОСТ Р ИСО 14644-3 "Чистые помещения
и связанные с ними контролируемые среды. Часть 3. Методы испытаний".
· ГОСТ Р ИСО 14644-4 "Чистые помещения
и связанные с ними контролируемые среды. Часть 4. Проектирование, строительство
и ввод в эксплуатацию".
· "Инструкции по санитарному режиму
аптечных организаций" (утверждена приказом Минздрава РФ от 21.10.97. №
309).
· Федеральный Закон № 86-ФЗ "О
лекарственных средствах" от 22.06.98г.
· "Инструкция по организации хранения в
аптечных учреждениях различных групп лекарственных средств и изделий
медицинского назначения", утв. приказом Минздрава РФ от 13.11.1996 г. №
377;
· "Инструкция по санитарному режиму
аптечных организаций", утв. приказом Минздрава РФ от 21.09.1997 г. № 309;
· ГОСТ 17768-90 "Средства
лекарственные. Упаковка, маркировка. Транспортирование и хранение".
Современная система торговли медпрепаратами в России
предусматривает трехступенчатую систему контроля: крупнооптовый аптечный склад
- мелкооптовый аптечный склад - аптека. На каждом из этих этапов медпрепарат
должен проверяться на соответствие партии сертификатам изготовителя и
соответствия, а также необходим контроль исполнения технологических стандартов
(GDP) по транспортировке и системе хранения ЛС.
В основе достижения стабильного качества препаратов и
создания сервисной системы должны лежать чётко выстроенные стратегии четко
выработанной цепи поставок. Это позволит достигнуть прослеживаемости движения
лекарственных средств на всех этапах поставок и экономической эффективности
всей системы распределения. Соблюдение стандартов технологий хранения и транспортировки
предотвратит изменение качества лекарственных средств. Наличие современных
информационных систем даст возможность контролировать этапы прохождения
лекарственных средств по всей цепи поставок. В итоге все перечисленные факты
обеспечат дополнительное конкурентное преимущество производителям лекарственных
средств.
В соответствие приказом Минздрава и Минэкономики о введении в
действие стандарта отрасли ОСТ 42-510-98 "Правила организации производства
и контроля качества лекарственных средств" (GMP) выдача фармацевтическим
компаниям лицензий на производство, хранение и распространение продукции
осуществляются лишь в случае соответствия стандарту GMP в его российском
варианте [3].
Идеология стандарта GMP (GxP) основана на утверждении: "качество
не может быть добавлено в лекарственный продукт путем испытаний: оно должно
создаваться (быть встроено) в процессе производства". Для
подтверждения соответствия требованиям стандарта GMP проводиться верификация
бизнес-процессов, от которых зависит качество лекарственных препаратов. Таким
образом, законодательно закрепляется необходимость документального
подтверждения соответствия оборудования, условий производства, технологического
процесса, качества полуфабрикатов и готового продукта действующим регламентам
нормативной продукции.
Кроме производственных процессов стандарт GxP сосредотачивает
своё внимание и на процессе распределения лекарственных средств (хранение,
транспортировка, упаковка, учёт). Требования к системам логистики (таким как
склад, транспортировка, информационное обеспечение и. т.д.) перечислены также в
стандарте GxP в части относящейся к регламентированию оптовой торговли и
дистрибуции лекарственных средств, GDP. В законодательстве РФ аналогичные номы
частично изложены в Приказе Минздрава РФ от 15 марта 2002 г. N 80 "Об
утверждении Отраслевого стандарта "Правила оптовой торговли лекарственными
средствами. Основные положения." [3]. Таким образом, можно констатировать,
что основная идея всей совокупности стандартов GxP заключается в том чтобы,
выстроить прозрачную (аудируемую) систему цепи всех бизнес процессов и этапов
прохождения лекарственных средств от производителя к пациенту. При этом
данная система должна отвечать требованию поддержания качества, безопасности и
эффективности медпрепаратов на всех операционных этапах и соответствовать
критерию затраты/прибыль для достижения конкурентного преимущества на рынке.
Внедрение современных технологических стандартов качества в
системах распределения ЛС продиктовано необходимостью сохранения здоровья
пациентов. Это возможно, если цепи поставок будут построены с учётом всех
факторов специфичных для фармацевтической индустрии. Контроль качества не
должен ограничиваться только производством. Речь идёт о контроле всех
операционных процессов, начиная с производства и заканчивая выпиской рецептов
врачом пациенту. Практика "хорошего" производства и соответствие
фармацевтическим логистическим стандартам цепей поставок (процессов
транспортировки и хранения) являются ключом к доведению качественной готовой продукции
до пациентов.
Правила GMP представляют собой систему требований,
рекомендаций и мер, выполнение которых призвано помочь фармацевтическому
предприятию организовать выпуск качественной продукции.
Исходя из специфики жизненного цикла ЛС и принимая во
внимание вышесказанное, можно уточнить: обеспечение качества включает не только
GMP, но и GLP (Надлежащая лабораторная практика), GCP (Надлежащая клиническая
практика), GDP (Надлежащая дистрибьюторская практика), GPP (Надлежащая аптечная
практика).
Однако правила GMP не содержат метода определения того, какой
из процессов является критическим. Такой метод содержит система ХАССП. Целью
данной дипломной работы является разработка системы управления безопасностью
лекарственных средств на стадии хранения с использованием принципов и методик
ХАССП.
1.4 Системы управления безопасностью продуктов питания ХАССП
НАССР (Hazard Analysis and Critical Control Points) - признанная в мире
система анализа рисков и управление критическими контрольными точками. Целью
системы ХАССП является обеспечение безопасности продуктов питания для
потребителей путем контроля над факторами риска в течение полного цикла
производства и транспортировки.
Требование о внедрении системы НАССР на предприятиях пищевой
отрасли закреплено законодательно. В России в 2001 году был введен в действие
стандарт ГОСТ Р 51705.1-2001.
Система анализа риска в критических контрольных точках была
разработана в США около 30 лет назад с целью обеспечения гарантированного
производства качественных и безопасных продуктов питания для космических
полетов американских астронавтов. До середины 80-х годов она была засекречена и
использовалась только компанией Пилсбури - изготовителем указанных продуктов
[4]. Однако надежность и эффективность применения системы ХАССП оказалась настолько
высока, что правительство США приняло решение сделать ее достоянием всей
американской пищевой промышленности под девизом "от фермы до столовой
вилки" (from farm to fork). В 90-е годы она активно внедрялась сначала в
США, а затем и в других странах. В последнее время Администрация по пищевым и
лекарственным продуктам США (US Food and Drug Administration) выступила с
инициативой распространить систему ХАССП на фармацевтическую промышленность и
сделать ее неотъемлемой частью современной надлежащей производственной практики
(c GMP).
Система ХАССП базируется на семи основных принципах:
выявление опасных факторов:
· определение критических контрольных точек;
· определение критических допусков
измеряемых параметров;
· создание системы мониторинга;
· разработка системы корректирующих
действий;
· разработка процедуры проверок (валидации и
верификации);
· создание системы документации.
Главным достоинством системы ХАССП является наличие надежного
метода определения критических контрольных точек. Под критической контрольной
точкой понимается любой этап жизни продукции, от производства сырья до
получения готовой продукции, ее хранения, транспортировки, реализации и
применения. Процесс определения критических контрольных точек максимально
формализован с помощью так называемого дерева решений - системы вопросов и
ответов, позволяющих исключить ошибки при проведении этого процесса.
Определение критических контрольных точек является важнейшим из семи
вышеперечисленных принципов.
Второй принцип ХАССП содержит в себе процесс принятия
решений. Применение остальных принципов ХАССП основано на этих принятых
решениях. Именно в наличии метода принятия решений состоит главное отличие
системы ХАССП от стандартов серии ИСО 9000 и Правил GMP.
Американский опыт показывает, что внедрение системы ХАССП
дает следующие преимущества [4]:
· повышение эффективности
работы за счет достижения лучших результатов при затрате меньших ресурсов;
· концентрацию внимания и
ресурсов предприятия на главном - критических контрольных точках;
· не только выявление
критических процессов, но и управление ими;
· достижение результата за
счет предупредительных мер, а не запоздалых действий;
· своевременное получение
информации об отклонении процесса и возвращение его в нормативные пределы;
· гарантированный выпуск
качественной и безопасной продукции;
· наличие
документированного доказательства этому;
· экономическую выгоду, как
за счет экономии ресурсов, так и за счет снижения доли забракованной продукции.
Преимущества Системы управления безопасностью продуктов
питания следующие:
· дает потребителям уверенность, что
продукты производятся в соответствии с правилами гигиены и безопасности;
· демонстрирует намерение изготовителя
предпринимать необходимые предупреждающие меры и внимательно следить за
гигиеной при производстве продуктов;
· уменьшается число проверок со стороны
партнеров-потребителей (аудиты второй стороны), а следовательно снижаются
затраты времени и средств;
· снижаются потери, связанные с отзывом
продукции с рынка, растет прибыль;
· сокращаются расходы благодаря улучшению
взаимоотношений с надзорными органами;
· мониторинг за продукцией ведется в режиме
реального времени;
· способствует международной торговле;
· поддерживается Всемирная система
безопасности продуктов питания;
· гармонизируются международные и
национальные требования пищевой безопасности, правила санитарии и
фитосанитарии.
В настоящее время не существует международного стандарта для
Системы управления безопасностью продуктов питания на основе ХАССП. В разных
странах разработаны национальные стандарты, содержащие требования к подобной
системе. Международный стандарт ИСО 22000 "Системы управления
безопасностью продуктов питания. Требования" будет предположительно
опубликован в 2005 году. Его проект был издан в марте 2003 года. ИСО 22000
описывает самодостаточную систему управления безопасностью продуктов питания, в
то же время структура документа позволяет легко интегрировать эту систему с
системами менеджмента качества и охраны окружающей среды.
Наиболее распространенными в Европе являются следующие
действующие национальные стандарты:
голландский стандарт "Требования для Системы управления
безопасностью продуктов питания на основе НАССР" (сентябрь 2002 г.,
Голландский национальный комитет экспертов НАССР);
датский стандарт DS 3027: 2002 "Управление безопасностью
продуктов питания на основе НАССР. Требования к системам управления для
компаний, производящих пищевые продукты, и их поставщиков";
стандарт Британского консорциума розничной торговли (BRC)"Технический
стандарт и протоколы для компаний, поставляющих розничные продукты торговых
марок" (апрель 2002 г.).
В России принят стандарт ГОСТ Р 5.1.705.1-2001
"Управление качеством пищевых продуктов на основе принципов ХАССП. Общие
требования".
Очень важно, что в странах Европейского союза, США и Канаде
внедрение и применение метода ХАССП в пищевой промышленности и сертификация
систем ХАССП являются обязательными.
Рекомендуемые области применения ХАССП: практически любое
производство, имеющее отношение к продуктам питания, может разработать и
внедрить Систему управления безопасностью продуктов питания ХАССП. Например:
· первичное производство (животноводство и
растениеводство);
· производство кормов для животных;
· переработка сырья;
· изготовление продуктов питания;
· их транспортировка, доставка и хранение;
· производство упаковочных материалов;
· производство химических добавок;
· общественное питание;
· розничная торговля и т.д.
Российские фармацевтические предприятия обязаны в ближайшие
годы перейти к работе в соответствии с правилами GMP. Одновременное внедрение в
практику предприятий стандартов серии ИСО 9000 и системы ХАССП позволяет
сделать этот переход более эффективным - достичь лучших результатов в области
качества с меньшими затратами имеющихся ресурсов. В Российском
научно-исследовательском центре чрезвычайных ситуаций (РосНИЦ ЧС) создан отдел
анализа риска в критических контрольных точках (ХАССП) для решения и
предотвращения проблем, возникающих в условиях природных и техногенных
катастроф. Специалисты РосНИЦ ЧС наладили плодотворное сотрудничество с Органом
по сертификации систем менеджмента качества Ростест Москва и Центром GMP ГНЦА
для эффективного внедрения стандартов серии ИСО 9000 и принципов ХАССП в
практику российских фармацевтических предприятий, при их переходе на работу в
соответствии с правилами GMP.
1.5
Описание работы аптечного склада
Аптечный склад находится внутри складского терминала и
является его частью. Склад разделен на несколько боксов (каждый бокс
предназначен для определенного Клиента). В каждом боксе есть следующие
помещения:
· зона основного хранения (при комнатной
температуре);
· прохладная комната (темп. +12+15);
· холодильник (+2+8);
· приемочно-распаковочная комната (товар
принимается, осматривается, пересчитывается и подготавливается для
транспортировки в необходимую зону хранения);
· зона экспедиции (сюда помещается
подобранный для отгрузки товар, он так же осматривается, пересчитывается).
Непосредственно у входа в аптеку над потолком расположены
электроуловители для летающих насекомых. По периметру каждого бокса
распределены ловушки для грызунов. Так же по периметру зоны основного хранения
распределены термогигрометры (для учета температурно-влажностного режима). По
термогигрометру находится в прохладной зоне, холодильнике,
приемчно-распаковочной и зоне экспедиции.
Основные подпроцессы, выполняемые персоналом на аптечном
складе при работе с лекарственными средствами следующие:
· При приёмке товара: разгрузка транспортного
средства, осмотр и пересчёт товара, оформление документов, подготовка товара к
перемещению на места хранения, перемещение по зонам хранения;
· При отгрузке товара: осмотр и регистрация
прибывшего под загрузку транспортного средства, перемещение товара в зону
отгрузки, проверка подобранного заказа, загрузка товара в транспортное
средство, оформление отгрузочных документов.
· При комплектации заказа: принятие "заявки на
перевозку груза", оформление листа комиссионирования, подбор заказа,
проверка заказа, перемещение в зону экспедиции.
· При хранении: уборка помещений,
поддержание чистоты на поддонах с продукцией, проверка
температурно-влажностного режима, участие в инвентаризациях.
Технологическую схему обращения лекарственных средств на
складе можно посмотреть на Рис.1.5.1.
1.6
Требования к аптечным оптовым складам
Из нормативных документов, перечисленных в разделе 1.3., были
выделены основные требования к оптовым аптечным складам, при невыполнении
которых существует угроза безопасности хранения лекарственных средств, то есть
в руки конечного потребителя могут попасть некачественные товары.
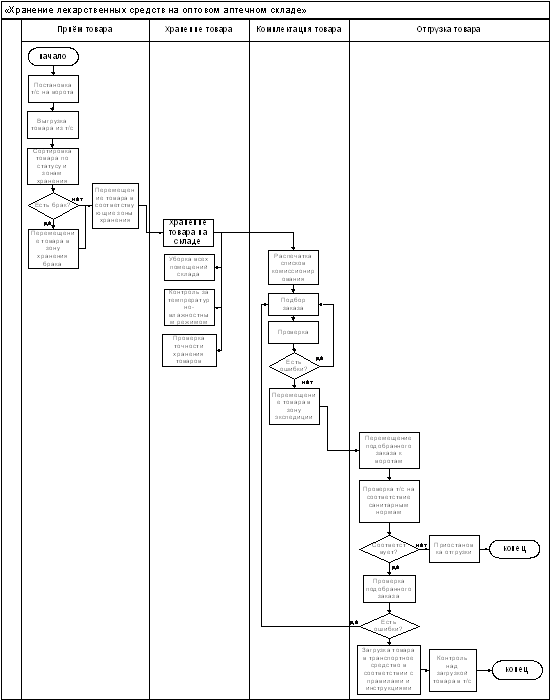
Рис.1.5.1 Технологическая схема обращения лекарственных средств на
оптовом аптечном складе.
А. Требования к помещениям склада.
· быть просторными для проведения
растаривания и обеспечения хранения;
· обеспечивать надёжную защиту от хищений и
загрязнения/заражения;
· быть с освещенностью, достаточной для
создания нормальных условий труда;
· содержаться в соответствии с правилами
санитарного режима (не допускается разведение цветов, скопление мусора,
появление грызунов /насекомых);
· иметь отдельные помещения для хранения
дезинфицирующих, моющих средств, материалов и инвентаря для проведения уборки;
· функционировать при определенной
температуре и влажности (периодичность проверки не реже 1 раза в сутки, должны
вестись записи в журналах);
· быть обеспечены необходимым количеством
стеллажей, поддонов, шкафов.
· включать зоны: приёмки и основного
хранения, которые отделены друг от друга, помещения для лекарственных средств,
требующих особых условий хранения, экспедиционную.
Б. При приёме готовой продукции.
· Защита поступающих лекарственных средств от
воздействия атмосферных осадков, пыли, солнечного облучения, механических
повреждений;
· лекарственные средства, требующие особых
условий хранения, идентифицируются и хранятся в установленном порядке;
· бракованные лекарственные средства
помещаются в специальную зону;
· возвращенная продукция принимается только
в карантинную зону.
В. Хранение готовой продукции.
· должно осуществляться таким образом, чтобы
свести к минимуму возможность снижения риска ухудшения качества;
· должно обеспечиваться в надлежащих
условиях;
· хранение лекарственных средств без
разрешения на реализацию, должно проводиться в условиях, установленных
производителем (готовая продукция ставится на "карантин");
· бракованная продукция должна маркироваться
соответствующим образом и храниться в специальной зоне;
· хранение должно проводится в зависимости
от физических и физико-химических свойств, способа применения,
фармакологической группы, агрегатным состоянием, с учетом сроков годности;
· осуществление сплошного визуального
контроля при хранении за состоянием тары и внешними изменениями лекарственных
средств (не реже 1 раза в месяц);
· проведение мероприятий по борьбе с
грызунами, насекомыми;
· укладка товаров на поддоны не должна
превышать 1,5 метра.
Г. Отпуск готовой продукции/транспортировка.
· запрещается отпуск лекарственных средств,
пришедших в негодность и являющихся незаконными копиями;
· транспортная тара должна защищать
лекарственные средства от воздействия атмосферных осадков, пыли, солнечного
облучения, механических повреждений;
· в закрытых транспортных
средствах/контейнерах, с учётом правил перевозки грузов, действующих на
соответствующем виде транспорта;
· с учётом требований, указанных в
документации на конкретные виды лекарственных средств.
Д. Требования к персоналу.
· должен принимать участие в занятиях по
темам, связанным с вопросами личной гигиены, производственной санитарии,
техники безопасности;
· должен носить спец. одежду и обувь;
· должен быть обучен надлежащему выполнению
технологических инструкций.
Прием бракованной продукции как годной является одним
из самых значимых опасных факторов. Бракованной продукцией считают:
· Лекарственные средства с истекшим сроком
годности;
· Лекарственные средства в поврежденных
индивидуальных упаковках
· Этикетки на индивидуальных упаковках
лекарственных средств не имеют аннотации на русском языке или их не возможно
идентифицировать;
Возвращенный товар не зависимо от внешнего вида и документов,
сопровождающий его, изначально принимается в зону "карантин", так мы
не знаем, в каких условиях товар хранился и где он был, пока не поступил к нам.
Лекарственные средства без сертификата или с фальшивым
сертификатом так же должны быть помещены в зону "карантин". Отпуск
товаров из зон "карантин" и "брак" разрешена только по
письменному распоряжению Клиента.
Если при приёмке брак пропущен, то он будет храниться вместе
с годным товаром, а отсюда возможно несколько нежелательных последствий.
Во-первых, возможно заражение годного товара в результате воздействия на него
ингредиентов некачественно товара (из-за разгерметизации индивидуальной упаковки).
Во-вторых, это отгрузка бракованного товара в магазины розничной торговли и,
как следствие, попадание в руки конечного потребителя некачественного товара.
В-третьих, заражение персонала из-за воздействия на него ингредиентов
некачественного товара (из разгерметизации индивидуальной упаковки). Здесь так
же необходимо учитывать индивидуальные свойства каждого лекарственного
средства. Например, противоопухолевые препараты могут быть очень токсичны и
опасны при разгерметизации индивидуальных упаковок и разливах.
В двух последних случаях очевидна угроза здоровью и жизни
людей.
Выгрузка лекарственных средств из транспортного средства так
же может привести к нежелательным последствиям. Во-первых, прием товара на
нестандартных поддонах (грязные, мокрые, сломанные поддоны, поддоны
с торчащими гвоздями или пропущенными досками) или укладка на такие поддоны уже
на складе может привести к заражению или повреждению товара, а следовательно, к
появлению дополнительного брака, который может быть пропущен в зону хранения
годной продукции или появления брака уже в зоне хранения годной продукции.
Во-вторых, выгрузка лекарственных средств без учета требований к транспортной
маркировке так же может привести к повреждению товара, а, следовательно, к
появлению брака. В третьих, осуществления разгрузочных работ
неквалифицированным персоналом или с помощью неисправной техники так же может
привести к повреждению товара.