|
Тип концентрата
|
Содержание компонентов, %
|
|
Cu
|
Pb
|
Zn
|
Fe
|
S
|
SiO2
|
Al2O3
|
CaO
|
|
Медный
|
18,5-36,5
|
0-0,05
|
0-1,1
|
7,1-31,6
|
16,6-35,5
|
5,5-24,8
|
2,1-7,8
|
0,1-2,4
|
|
Медно-цинковый 1
|
13,6-16,1
|
0-0,8
|
5,4-8,3
|
28,7-31,7
|
0,7-1,1
|
0,7-3,4
|
0,1
|
|
Медный, никель-содержащий
|
24,7
|
1,8
Ni
|
-
|
34,9
|
32,6
|
1,7
|
1,5
|
0,7
|
1.2 Физико-химические
свойства
Кристаллическая решетка
металлической меди кубическая гранецентрированная. Плотность 8,92 г./см3,
температура плавления 1083,4°C, температура кипения 2567°C. Медь среди всех
других металлов обладает одной из самых высоких теплопроводностей и одним из
самых низких электрических сопротивлений.
В сухой атмосфере медь практически
не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого
газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3.
Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в
составе поверхностной пленки на металлической меди обычно имеются и сернистые
соединения меди. Такая пленка, возникающая с течением времени на изделиях из
меди и ее сплавов, называется патиной. Патина предохраняет металл от
дальнейшего разрушения. Для создания на художественных предметах «налета
старины» на них наносят слой меди, который затем специально патинируется.
При нагревании на воздухе медь
тускнеет и, в конце концов чернеет из-за образования на поверхности оксидного
слоя. Сначала образуется оксид Cu2O, затем - оксид CuO.
При сплавлении меди с серой
образуется нерастворимый в воде сульфид Cu2S. Сульфид меди (II) CuS
выпадает в осадок, например, при пропускании сероводорода через раствор соли
меди (II):
2S + CuSO4 = CuS + H2SO4 (1)
водородом, азотом, графитом,
кремнием медь не реагирует. При контакте с водородом медь становится хрупкой
(так называемая «водородная болезнь» меди) из-за растворения водорода в этом
металле.
В присутствии окислителей, прежде
всего кислорода, медь может реагировать с соляной кислотой и разбавленной
серной кислотой, но водород при этом не выделяется:
2Cu + 4HCl + O2
= 2CuCl2 + 2H2O (2)
С азотной кислотой различных
концентраций медь реагирует довольно активно, при этом образуется нитрат меди
(II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой
реакция меди протекает так:
3Cu + 8HNO3 =
3Cu(NO3)2 + 2NO + 4H2O (3)
С концентрированной серной кислотой
медь реагирует при сильном нагревании:
Cu + 2H2SO4
= CuSO4 + SO2+ 2H2O (4)
Практическое значение имеет
способность меди реагировать с растворами солей железа (III), причем медь
переходит в раствор, а железо (III) восстанавливается до железа (II):
FeCl3 + Cu = CuCl2
+ 2FeCl2 (5)
Этот процесс травления меди хлоридом
железа (III) используют, в частности, при необходимости удалить в определенных
местах слой напыленной на пластмассу меди.
Ионы меди Cu2+ легко
образуют комплексы с аммиаком, например, состава [Cu(NH3)]2+.
При пропускании через аммиачные растворы солей меди ацетилена С2Н2
в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
Гидроксид меди Cu(OH)2
характеризуется преобладанием основных свойств. Он реагирует с кислотами с
образованием соли и воды, например:
Сu(OH)2 + 2HNO3 = Cu(NO3)2
+ 2H2O (6)
Но Сu(OH)2 реагирует и с
концентрированными растворами щелочей, при этом образуются соответствующие
купраты, например:
Сu(OH)2 + 2NaOH = Na2[Cu(OH)4] (7)
[4]
1.3 Применение
Перечисленные выше характерные
свойства меди обуславливают многочисленные области ее применения. Основными
потребителями меди и ее соединений являются:
) электротехника и электроника (провода,
кабели, обмотки электродвигателей, детали радиоэлектроники и др.);
) машиностроение (теплообменники,
опреснительные установки и др.);
) транспорт (детали и узлы
железнодорожных вагонов, автомобилей, самолетов, морских и речных судов и др.);
) магнитогидродинамические
генераторы;
) ракетная техника;
) строительные материалы (кровельные
листы, детали декоративных архитектурных украшений);
) химическая промышленность
(производство солей, красок и др.);
) изделия и приборы бытового
назначения;
) сельское хозяйство (для защиты
растений от болезней и вредителей, например медный купорос CuSO4∙5H2O) [3]
2. Технологическая часть
.1 Методы получения
Переработку медного сырья можно
проводить с использованием как пиро-, так и гидрометаллургических процессов .
В основном переработку ведут с использованием пирометаллургических способов.
2.1.1
Пирометаллургическая технология
К числу пирометаллургических
процессов, применяемых при производстве меди, относятся окислительный обжиг,
различные виды плавок (на штейн, восстановительные, рафинировочные),
конвертирование штейнов и в ряде случаев возгоночные процессы. Типичными
гидрометаллургическими процессами являются выщелачивание, очистка растворов от
примесей, осаждение металлов из растворов (цементация, электролиз и др.), а
также электролитическое рафинирование.
Наиболее распространенная технология
предусматривает (рисунок 1) обязательное использование следующих
металлургических процессов: плавка на штейн, конвертирование медного штейна,
огневое и электролитическое рафинирование меди. В ряде случаев перед плавкой на
штейн проводят предварительный окислительный обжиг сульфидного сырья.
Медный концентрат после обогащения
имеет следующий состав: 18,5-36,5% Cu; 0-0,05% Pb; 0-1,1% Zn; 7,1-31,6% Fe; 16,6-35,5% S; 5,5-24,8% SiO2; 2,1-7,2% Al2O3; 0,1-2,4% CaO.
Далее этот концентрат поступает на
окислительный обжиг, основным назначением которого являются частичное окисление
сульфида железа и перевод последнего в оксидную форму для того, чтобы при
последующей плавке огарка больше железа перешло в шлак.
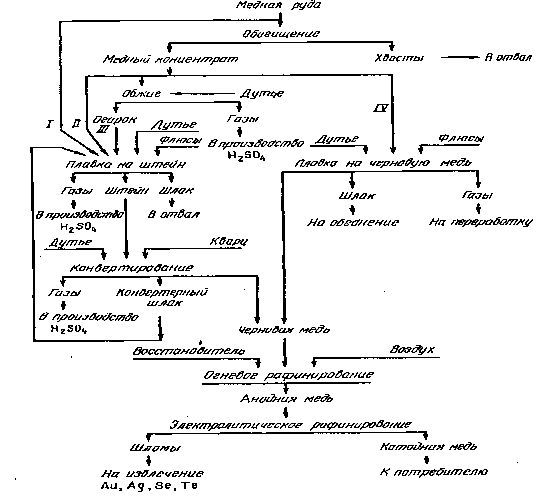
Рисунок 1. Принципиальная
технологическая схема пирометаллургии меди: I-IV - варианты переработки
исходного сырья на черновую медь
Окисление сульфидов при обжиге
осуществляется при повышенных температурах (700-900оС). Необходимая
для процесса обжига теплота получается за счет экзотермических реакций
окисления сульфидов:
2FeS + 3,502
= Fe203 + 2S02 + 92100 кДж (8)
FeS + 5,502 =
Fe203 + 4S02 + 165500 кДж (9)
2CuFeS2 + 602 = Fe203 + Cu20 + 4S02 (10)
Продуктами окислительного обжига
медных концентратов являются огарок (17-30% Cu; 25-50% Fe; 12-18% S; 16-20% O2), пыль и газы.
Получающиеся при обжиге газы
содержат 6-12% SO2, что позволяет до 70%
серы исходного концентрата использовать для производства серной кислоты.
Обжиг в настоящее время проводится в
печах кипящего слоя. [5]
Далее огарок отправляется на плавку
на штейн.
Плавку на штейн медных руд и
концентратов - основной технологический процесс - можно проводить любым видом
рудных плавок. В современной металлургии меди для ее осуществления используют
отражательные, рудотермические (электрические) и шахтные печи, а также
автогенные процессы нескольких разновидностей.
Процесс отражательной плавки
предназначен для плавки мелкодисперсного материала (флотационный концентрат,
цементационная медь, окалина, огарки, пыль) или оборотных расплавов.
Удельный вес отражательной плавки в
связи с развитием автогенных процессов снижается. В настоящее время доля меди,
полученная с ее использованием, составляет 40-50%.
Электроплавка отличается источником
энергии для осуществления физико-химических превращений. Температура
поддерживается за счет тепла, получаемого путем преобразования электрической
энергии в тепловую. Используют дуговые электропечи, печи сопротивления и
индукционные.
Шахтную плавку в металлургии
используют для переработки кусковых материалов (20-100 мм) в производстве меди
и некоторых других металлов.
Шахтная печь представляет собой
агрегат с вертикальным рабочим пространством, в которой сверху загружают шихту
и топливо, а снизу через специальные отверстия вдувают воздух. Шихта по мере
расплавления опускается вниз, а на её место загружают новые порции. Жидкие
продукты плавки непрерывно стекают во внутренний горн печи и далее выпускаются
в отстойный горн.
В последние годы все большее
развитие получают автогенные процессы, осуществляемые за счет тепла от
окисления сульфидов при использовании подогретого дутья или дутья, обогащенного
кислородом. В этих процессах, являющихся окислительными плавками, в одной операции
совмещаются процессы обжига и плавки на штейн.
Процессы переработки сульфидного
сырья в агрегатах автогенной плавки, принято подразделять на две группы:
факельные и в расплаве. К первой категории, получивших наиболее широкую
известность относятся: взвешенная плавка и кислородно - факельная плавка; ко
второй - плавка Ванюкова; совмещенная плавка шихты и конвертирование штейнов в
одном агрегате; факельно-барботажная плавка; кислородно-взвешенная циклонная
электротермическая плавка, а также многие другие автогенные процессы.
После этого штейн отправляют на
конвертирование.
Процесс
конвертирования состоит из двух периодов: в первом периоде осуществляется
окисление и ошлакование сернистого железа и большинства примесей, во втором -
окисляется полусернистая медь и происходит образование металлической меди.
Первый период
конвертирования заключается в продувке воздуха через расплавленный штейн в
присутствии кварцевого флюса. Основная суммарная реакция имеет вид:
2FeS +
3O2 + SiO2 = 2FeO∙SiO2 + 2SO2
+ 234кДж (11)
В зависимости от
содержания меди в штейне первый период конвертирования продолжается от 5 до 20
ч. Из-за высокой экзотермичности реакций конвертирования температура в
конвертере возрастает (на 2-3° за минуту продувки). Для поддержания температуры
в оптимальных пределах (1180-1250°С) в конвертер загружают холодные добавки
(медьсодержащие материалы). По окончании последней продувки из конвертера
сливают конвертерный шлак, после чего начинается второй период конвертирования.
Конвертерные шлаки
первого периода конвертирования содержат 23-27% SiO2; 1,5-3,0% Сu, остальное - окислы железа, в том числе, магнетит (до 20-25%).
Обычно конвертерные шлаки перерабатывают в отражательных печах или направляют
на обеднение (в электропечах, флотацией).
Второй период
состоит в продувке полусернистой меди (белого штейна) до получения черновой
меди. Черновая медь в конвертере образуется благодаря протеканию следующих
реакций:
2Cu2S
+ 3O2 = 2Cu2O + 2SO2 + 186 кДж (12)
Cu2O
+ Cu2S = 6Cu + SO2 - 30кДж (13)
Воздух вдувают в расплав
полусернистой меди до полного ее окисления. Конец операции определяют по
пробам. Полученная черновая медь содержит значительное количество примесей (до
4%) и направляется на огневое рафинирование. [5]
Огневое рафинирование проводят с
целью удаления части примесей, обладающих по сравнению с медью повышенным
сродством к кислороду. Такие примеси в отличие от благородных металлов, которые
в этой стадии рафинирования практически не удаляются, часто называют
неблагородными. Огневому рафинированию подвергают расплавленную медь.
Процесс огневого рафинирования меди
состоит из следующих основных операций: загрузки, расплавления твердой меди и
разогрева расплава, окисления примесей, съема шлака, раскисления (дразнения)
меди и разливки меди в анодные слитки. Продолжительность процесса рафинирования
зависит от многих факторов (состава черновой меди, вместимости печи, тепловой
нагрузки, производительности загрузочных и разливочных устройств) и колеблется
от 12 до 32 ч.
Процессы окисления меди ведут при
1150-1170°С. Увеличение температуры хотя и ускоряет процесс, но одновременно
ведёт к повышенному насыщению расплавленной ванны Cu2O, что удлиняет стадию раскисления и
увеличивает расход дорогостоящих восстановителей.
В настоящее время для огневого
рафинирования черновой меди в основном применяют стационарные отражательные
печи и наклоняющиеся печи конвертерного типа. [3]
Металлическая медь после огневого
рафинирования содержит ряд примесей (As, Sb, Se, Ni, Co, Fe). Кроме того, при рафинировании в анодную медь переходят золото,
серебро и металлы платиновой группы, содержащиеся в черновой меди.
Электролитическое
рафинирование меди применяют для получения меди высокой чистоты, обладающей
повышенной электропроводностью и пластичностью. При этом благородные металлы, а
также редкие элементы, такие, как селен и теллур, переходят в шлам.
Процесс
электролитического рафинирования заключается в растворении анода под действием
электрического тока и осаждении меди в виде чистого металла на катоде.
Аноды и катоды
помещают в электролизные ванны, располагая электроды в ваннах вертикально,
параллельно друг другу. Все аноды соединяются с положительным, а катоды с отрицательным
полюсами источника постоянного тока. В ванны подают электролит в виде раствора
сернокислой меди, содержащего свободную серную кислоту.
На медном аноде
возможны следующие электрохимические реакции:
Cu = Cu2+
+ 2e E = +0,346 B= Cu+ + e E = +0,51 B+ = Cu2+ + e E = +0,17 B (14)
На катоде выделение
меди идет в основном за счет разряда ионов двухвалентной меди:
Cu2+ + 2e = Cu
(15)
Одним из важных
показателей качества процесса электролитического рафинирования меди является
выход по току. Чем выше этот показатель, тем ниже расход электроэнергии и выше
производительность электролитных ванн.
В настоящее время
для получения высокого выхода по току и низкого расхода электроэнергии при
электролитическом рафинировании меди на практике электролиз проводят при
температуре электролита 55-60°С, плотности тока 225-300 А/м2,
содержании в электролите 40-50 г./л меди, 120-200 г./л свободной серной
кислоты, расстоянии между центрами одноименных электродов 105-115 мм.
При этом можно
получить катодную медь чистотой 99,99%. [5]
2.1.2
Гидрометаллургическая технология
Гидрометаллургический метод
переработки медных руд и концентратов, осуществляемый в промышленности в
различных технологических вариантах, включает следующие основные операции:
) подготовку руды (концентрата) к
выщелачиванию;
) выщелачивание рудного сырья;
) осаждение извлекаемого металла из
раствора в металлическом состоянии или в виде химического соединения.
Иногда осаждению металла из раствора
предшествует очистка раствора от примесей.
Подготовка рудного сырья к
гидрометаллургической переработке в зависимости от вида исходного материала,
его свойств и требований процесса выщелачивания может включать дробление и
измельчение (только руды), окислительный, сульфатизирующий или
восстановительный обжиг.
Выщелачиванием называют процесс
растворения ценных извлекаемых металлов из массы твердого материала в жидком
растворителе - воде, растворах кислот и т.д. Выщелачивание рудных материалов
проводят просачиванием раствора через слой руды или концентрата, в чанах с механическим
или воздушным перемешиванием или в автоклавах при повышенных температурах (до
300°С) и давлениях.
Для осаждения металлов из растворов
после выщелачивания могут быть применены следующие методы:
. Цементация - осаждение
извлекаемого металла из раствора другим, более электроотрицательным металлом.
Этот метод применяют для выделения меди из бедных растворов железом, цинком и
т.д. Процесс цементации при использований железа описывается реакцией
CuSO4 + Fe = Сu + FeSO4 (16)
или в ионной форме:
Сu2+ + Fe = Сu
+ Fe
(17)
. Электролиз с нерастворимыми
анодами (обычно свинцовыми). В этом процессе, проводимом с использованием
постоянного тока, катодная и анодная электрохимические реакции описываются
следующими уравнениями:
на катоде Сu2+ + 2е = Сu0
(18)
на аноде Н2O - 2е = 0,5O2
+ 2Н+ (19)
3. Восстановление металла из
химических соединений водородом при повышенном давлении (в автоклавах).
Примером служит реакция
CuSO4 + Н2 = Сu + H2SO4 (20)
В случае осаждения металлов из
растворов в виде солей и гидроксидов применяют кристаллизацию путем выпаривания
раствора, гидролитическое осаждение и другие методы. [3]
3. Специальная часть
3.1 Общая характеристика
автогенных процессов плавки
медь пирометаллургия рафинирование
плавка
Автогенными процессами плавки
считают процессы, протекающие без затрат тепла извне, за счет тепла,
выделяющегося при окислении сульфидов шихты. Плавке в автогенном режиме
подвергается железосодержащее сульфидное сырье.
В условиях плавки большая часть
сульфидов шихты диссоциирует с выделением элементарной серы, которая в основном
взаимодействует с кислородом дутья по реакции:
S + O2 = SO2 (21)
Выделяющегося по реакции тепла не
хватает для расплавления шихты. Основная доля тепла в автогенных процессах
выделяется при окислении сульфида железа - (FeS).
Максимально возможное количество
тепла, которое может выделиться при плавке на штейн сульфидного сырья
определяется его составом, прежде всего содержанием в нем сульфидов железа. Для
медного и медно-цинкового сырья автогенный режим наступает при содержании
30-35% S, 27-30% Fe, для медно-никелевого сырья - при 28-30% S, 30-35% Fe.
Сульфидные медно-никелевые руды на
90% представлены пирротиновыми рудами. Высокое содержание пирротина в продуктах
обогащения сульфидных руд обеспечивает условия автогенности процессов плавки.
[6]
3.1.2 Плавление шихты и
окисление сульфидов при плавке
Процесс плавления шихты,
представляющей собой смесь оксидов, металлов и сульфидов, сопровождается
химическими взаимодействиями между составляющими шихты и газовой фазой, а также
взаимным растворением компонентов, образованием легкоплавких эвтектических
сплавов. Основные реакции плавки в основном сводятся к реакциям окисления,
восстановления, обменного взаимодействия и шлакования.
При взвешенной плавке большое
развитие получают реакции окисления (8-10) и обменного взаимодействия.
В любом процессе плавки всегда можно
выделить составляющие его элементарные стадии. При плавке сульфидных материалов
наибольшее значение имеют следующие стадии: 1) нагрев шихты и диссоциация
химических соединений; 2) окисление сульфидов, взаимодействие оксидов и
сульфидов; 3) расплавление легкоплавких составляющих с образованием первичных
оксидно-сульфидных расплавов; 4) растворение тугоплавких составляющих шихты в
первичных расплавах; 5) разделение продуктов плавки.
При плавке во взвешенном состоянии
окисление сульфидов протекает с высокой скоростью, в то время как процесс
шлакообразования не получает развития. При этом неизбежно переокисление железа
до магнетита по реакции:
FeO + 0,5O2 = Fe3O4 (22)
В условиях окислительных процессов
плавки сульфидного сырья при повышении концентрации сернистого газа возможно
протекание реакций окисления сернистого железа:
FeS + 0,5O2 =
FeO + 3/4S2 (23)
FeS + 2SO2 =
Fe3O4 + 2,5S2 (24)
В зависимости от условий
(температуры, парциального давления серы, кислорода и сернистого ангидрида в
системе) возможно и обратное протекание этих реакций.
Содержание магнетита в окислительной
зоне зависит от соотношения скоростей образования магнетита и его
восстановления сульфидами и металлической фазой. Наибольшее влияние на полноту
и скорость восстановления магнетита сульфидами оказывает температура,
активность FeS в штейне и шлаке, содержания SiO2 в расплаве:
3Fe3O4
+ FeS + 5SiO2 = 5FeO∙SiO2 + SO2 (25)
Ведение процесса автогенной плавки
при более высоких температурах (>1300ОС), повышение активности
сернистого железа и содержания SiO2 в шлаке сдвигает
равновесие реакции вправо. Из практики известно, что с ростом содержания меди в
штейне, а следовательно, с уменьшение активности сернистого железа растет
содержание магнетита в шлаке и потери меди со шлаками.
Для снижения содержания магнетита и
потерь меди желательно повышать содержание SiO2 в шлаках до 35-36%.
В автогенных процессах плавки
взаимодействие кислорода дутья с шихтой протекает преимущественно либо в
газовом пространстве печи, либо в барботируемом расплаве. [6]
3.1.3 Термодинамика
реакций окисления сульфидов при плавке
В общем виде окисление сульфидов
кислородом газовой фазы может быть выражено следующими основными уравнениями:
О конечном результате окисления
сульфидов можно судить по убыли энергии Гиббса реакций.
Сульфиды металлов могут окисляться в
зависимости от температуры по различным схемам: при низких температурах - до
сульфатов, при температурах обжига (700-800ОС) - до оксидов. При
более высоких температурах окисление сульфидов может приводить также к
образованию металла.
Термическая нестойкость сложных
сульфидов приводит к тому, что в условиях окислительной атмосферы процессы
окисления сводятся в основном к окислению простых сульфидов в соответствии с
реакцией (26).
Оценка вероятности и преимущественно
окисления тех или иных сульфидов может быть сделана на основе данных
термодинамического анализа реакций окисления.
В ходе плавки устанавливается
следующий порядок окисления сульфидов: сначала будут окисляться сульфиды
железа, цинка и кобальта, а затем сульфиды свинца, никеля и меди. Такой порядок
окисления справедлив для отдельных сульфидов и в основном сохраняется как при
окислении твердых, так и расплавленных сульфидов.
Указанный порядок окисления
сохраняется и при совместном окислении, хотя это не исключает полного окисления
сульфидов всех металлов. [6]
3.2 Автогенные процессы
плавки во взвешенном состоянии
.2.1 Плавка во
взвешенном состоянии на кислородном дутье
Автогенный процесс плавки
сульфидного сырья с использованием в качестве дутья технологического кислорода
называют кислородно-взвешенной (факельной) плавкой (КВП или КФП). Этот вид
плавки применяют в настоящее время только на двух заводах в мире - в Канаде на
заводе «Коппер-Клиф» и на Алмалыкском ГМК.
Отличительной особенностью плавки во
взвешенном состоянии на кислородном дутье является использование для ее
осуществления печей с горизонтальным факелом. Возможность использования в этом
виде плавки печей с горизонтальным рабочим пространством обусловлена высокой
скоростью окисления сульфидов в чистом кислороде и относительно низкой
скоростью газовых потоков в печи вследствие небольшого объема образующихся
технологических газов.
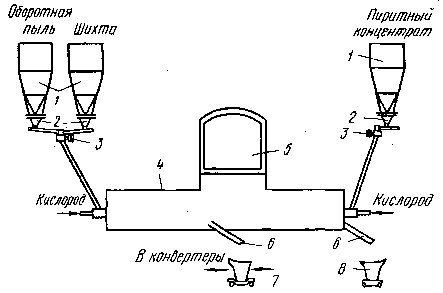
Рисунок 2 - Схема комплекса
кислородно-взвешенной плавки: 1 - шихтовые бункера; 2 - питатели; 3 -
расходомеры; 4 - печь; 5 - газоход; 6 - выпускные желоба; 7 - штейновый ковш; 8
- шлаковоз
Печь для плавки во взвешенном
состоянии на кислородном дутье (96-98% O2) представляет собой агрегат типа
отражательной печи с горелками на обоих торцах печи и центральным отводом газов.
Предварительно высушенная до содержания влаги менее 0,5% шихта (сульфидный
концентрат вместе с мелким кварцевым флюсом) подается в струю кислорода
горелками, установленными на одной из торцевых стен печи. Штейн отстаивается
под слоем шлака, а в шлаковом расплаве протекают реакции взаимодействия
сульфидов с оксидами и шлакообразования.
На противоположной стороне печи
установлены горелки для факельного сжигания в кислороде пирротинового или
пиритного концентрата. В этом факеле образуются капли бедного по содержанию
меди сульфидного расплава, служащего для промывки шлака перед выпуском с целью
его обеднения.
Штейн по мере накопления
периодически выпускают через шпур, расположенный на одной из боковых стен печи.
Выпуск шлака осуществляют со стороны обеднительного торца. Отходящие газы,
содержащие около 80% SO2, направляют в
химическое производство.
При сжигании сульфидов в чистом
кислороде в факеле развиваются высокие температуры (1550-1600°С), причем если
содержание серы в концентрате превышает 26-28%, то количество теплоты,
выделяющейся при сжигании сульфидов, оказывается в избытке. Если эту теплоту не
отнимать, то печь будет перегреваться, а температура отходящих газов
возрастать. Для того чтобы убрать избыточную теплоту и защитить стены и свод от
разрушения, кладку печи необходимо охлаждать. С этой целью через каждые два
ряда кирпичей устанавливают закладные медные кессоны, охлаждаемые водой.
Окисление сульфидов при КВП
протекает при высокой температуре. Поскольку основная масса теплоты выделяется
на поверхности сульфидных частиц, их температура существенно выше, чем средняя
температура печи и факела. Прямые замеры температуры частиц отсутствуют, однако
можно предполагать, что она превышает 1600-1700°С. При такой высокой
температуре большинство частиц перерабатываемой шихты плавится.
Нерасплавленными остаются только наиболее тугоплавкие оксиды: SiO2, CaO и частицы флюсов.
Характерной особенностью окисления
сульфидов при КВП является образование значительных количеств высшего оксида
железа (Fе3О4). Условия восстановления магнетита в
ванне печи КВП недостаточно благоприятны. Необходима избыточная энергия для
преодоления энергетического барьера, связанного с образованием новой фазы
(газообразной). Процесс разрушения магнетита фактически полностью зависит от
скорости молекулярной диффузии. Поэтому остаточное содержание магнетита в
шлаках КВП достигает 15-24%. Это обусловливает повышенную растворимость
сульфидов в шлаках и снижает межфазное натяжение на границе шлака со штейном.
Газы, выходящие из печи, имеют
высокую температуру (>1300°С) и обязательно должны направляться в
котлы-утилизаторы. Трудности, которые в этом случае возникают, связаны с
высоким содержанием в газах SO2 и большой их
запыленностью. С повышением содержания в газах сернистого ангидрида увеличивается
опасность конденсации паров серной кислоты, которая вызывает быструю коррозию
всех охлаждающих элементов котла. Во избежание этого температура труб и других
охлаждающих элементов должна быть выше точки росы. Наиболее эффективно теплота
отходящих газов используется при установке котлов-утилизаторов туннельного
типа, работающих по принципу испарительного охлаждения. Такие котлы
обеспечивают получение пара давлением 7-8 МПа.
Кислородно-взвешенная плавка
является значительным шагом вперед в совершенствовании технологии переработки
сульфидного медного сырья по сравнению с отражательной плавкой и плавкой в
электрических печах. Ее важнейшие достоинства - использование теплоты от
окисления сульфидов для процессов плавления и теплоты отходящих газов на
получение пара. При КВП в одном аппарате совмещаются процессы обжига и
плавления, большая часть серы выделяется в одном агрегате, что приводит к
повышению извлечения серы и уменьшению степени загрязнения атмосферы.
Применение чистого технологического кислорода или дутья, обогащенного
кислородом, обеспечивает получение газов с высоким содержанием SO2, что удешевляет их переработку на элементарную серу или серную
кислоту.
Наряду с достоинствами КВП этот
процесс имеет ряд принципиальных недостатков. Важнейшими из них являются:
сложная и дорогая подготовка шихты к плавке, высокое содержание меди в
отвальных шлаках, высокий пылеунос шихты, недостаточная комплексность
использования сырья.
Технико-экономические показатели
плавки во взвешенном состоянии на кислородном дутье приведены в таблице 3.
Таблица 3 - Технико-экономические
показатели кислородно-взвешенной плавки. [3]
|
Показатели
|
КВП
|
|
Завод Коппер-Клиф
|
АГМК
|
|
Производительность печи, т шихты/сут
|
1500
|
1200
|
|
Удельный проплав т/м2∙сут
|
12,8
|
10
|
|
Содержание в концентрате, % меди серы
|
30 31,5
|
18,5 35,5
|
|
Извлечение меди в штейн, %
|
96
|
95
|
|
Содержание меди в штейне, %
|
45
|
40
|
|
Содержание в шлаке, % меди SiO2
железа Fe3O4
|
0,75 28-32 37 10
|
0,9-1 33-35 41 11
|
|
Энергетические затраты в перерасчете на условное топливо, кг/т
шихты
|
42
|
22
|
|
Десульфуризация, %
|
50-55
|
70-75
|
|
Содержание SO2 в
газах, %
|
80
|
70-75
|
|
Выход газов, м3/т шихты
|
120-140
|
|
Расход технологического кислорода, м3/т шихты
|
150
|
220
|
3.2.2 Плавка во
взвешенном состоянии на подогретом дутье
Плавка во взвешенном состоянии на
подогретом дутье была почти одновременно с КВП осуществлена в промышленном
масштабе финской фирмы «Оутокумпу» на заводе «Харьявалта». В первоначальном
варианте для плавки применяли воздушное дутье, подогретое до 400-500°С.
Финскую плавку на сегодня можно
считать самым распространенным в промышленности и наиболее технологически и
аппаратурно отработанным автогенным процессом плавки сульфидных концентратов.
Все заводы, применяющие этот вид
плавки, включая завод «Харьявалта», используют в настоящее время дутье, обогащенное
кислородом до 30-40%. Температура нагрева обогащенного дутья на различных
заводах колеблется от 200 до 1000°С.
Конструкция печи для плавки во
взвешенном состоянии на подогретом дутье достаточно сложна - она сочетает в
себе две вертикальные шахты (плавильную и газоход-аптейк) и горизонтальную
камеру-отстойник (рисунок 3).
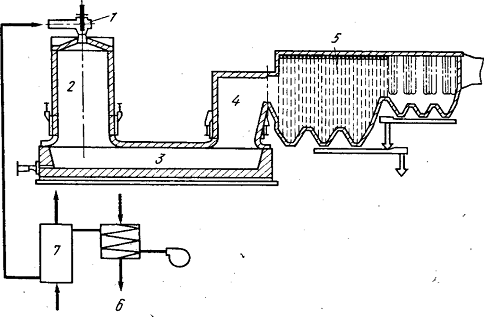
Рисунок 3 - Печь для плавки во
взвешенном состоянии с топливным и паровым воздухонагревателями завода
«Харьявалта»: 1 - горелка; 2 - реакционная камера; 3 - отстойная ванна; 4 -
аптейк; 5 - котел-утилизатор; 6 - паровой воздухоподогреватель; 7 - топливный
воздухоподогреватель
Вся печь финской плавки выполнена в
виде кладки из магнезитового кирпича. Футеровка плавильной шахты и аптейка
заключена в металлические кожухи из листовой стали. В кладку всех элементов
печи заложено большое количество водоохлаждаемых элементов, что позволяет
значительно удлинить срок службы агрегата. Аптейк непосредственно сочленен с
котлом-утилизатором туннельного типа. В боковой стене отстойной камеры
установлены две медные водоохлаждаемые плиты с отверстиями для выпуска шлака, а
в передней торцевой стене - чугунные шпуры для выпуска штейна.
Процесс начинается с прогревания
частиц, которое при малых их размерах протекает достаточно быстро. Когда
температура частицы достигнет 550-650°С, начинают интенсивно протекать реакции
диссоциации высших сульфидов - пирита и халькопирита, идущие с поглощением
теплоты. Бурно протекающие эндотермические реакции препятствуют прогреву частиц
и, пока не удалится избыточная сера, температура частицы существенно не
повысится. Горит на этой стадии только элементарная сера. После практически
полного завершения диссоциации высших сульфидов начинается быстрое окисление
низших сульфидов. Температура материала при этом быстро возрастает, достигая в
зависимости от содержания серы в концентрате, кислорода в дутье и температуры
дутья 1300-1500°С.
Окисление сульфидов сопровождается
образованием больших количеств магнетита, особенно в поверхностных слоях частиц.
Переокисление железа до магнетита зависит также от степени десульфуризации при
плавке. С возрастанием степени десульфуризации и получением более богатых
штейнов все большая часть железа переводится в форму магнетита.
Управление степенью десульфуризации
достигается изменением соотношения между количеством подаваемого с дутьем
кислорода и количеством вдуваемого концентрата.
При плавке во взвешенном состоянии
на подогретом дутье успешно решены вопросы тепловой энергетики и использования
газовой серы.
Процесс характеризуется хорошим
использованием теплоты от горения сульфидов. Отходящие газы печей завода
«Харьявалта» направляют в котлы-утилизаторы туннельного типа для получения
энергетического пара давлением 7 МПа и далее в рекуператоры (до 1971 г.) или в
автономные воздухонагреватели.
Электроэнергия, вырабатываемая за
счет пара, не только покрывает потребности завода, включая затраты на получение
кислорода, но и позволяет передавать ее избыток в государственную
энергетическую систему Финляндии. Пример завода «Харьявалта» убедительно
свидетельствует о том, что правильная организация автогенного процесса дает
возможность полностью осуществлять всю технологию за счет энергии, получающейся
при сжигание сульфидов.
В замыкании энергетического баланса
важную роль играет содержание кислорода в дутье. Энергетический баланс успешно
замыкается при оптимальной концентрации кислорода в дутье 35-40%, что и принято
в настоящее время на заводе «Харьявалта». Температура подогрева дутья снижена с
400-500 (воздушное дутье) до 200°С.
Практически полное использование
кислорода на процесс горения сульфидов позволяет получать богатые по содержанию
SO2 газы. При воздушном
дутье оно составляет 13%, а с увеличением содержания кислорода в дутье до
30-40% возрастает до 18-20%.
Основными достоинствами процесса
являются использование тепла сжигания сульфидов и высокое извлечение серы в
газы, богатые по содержанию SO2. Главнейшие недостатки
процесса: низкая удельная производительность, высокое содержание ценных
компонентов в шлаках, необходимость глубокой сушки исходной шихты и связанный с
этим большой пылеунос, недостаточная комплексность использования сырья.
Основные технико-экономические
показатели взвешенной плавки с использованием подогретого дутья приведены в
таблице 4.
Таблица 4 - Основные
технико-экономические показатели взвешенной плавки с подогревом дутья
|
Показатель
|
«Харьявалта»
|
|
Производительность печи, т/сут
|
900
|
|
Удельный проплав т/м2∙сут
|
11,9
|
|
Содержание О2 в дутье, %
|
35-40
|
|
Температура дутья, ОС
|
200
|
|
Содержание меди, % в штейне в шлаке (после обеднения)
|
60 0,85
|
|
Содержание SO2 в
газах, %
|
18-20
|
|
Пылеунос
|
8-10
|
|
Метод обеднения шлака
|
Флотация
|
Вместе с тем кивцэтный процесс
сохраняет и ряд недостатков, важнейшими из которых являются необходимость
глубокой сушки материала и низкая суммарная удельная производительность по
сравнению с автогенными процессами в расплаве. Кроме того, отсутствуют
освоенные плавильные агрегаты большой мощности.
Заключение
Переход на автогенную плавку
сульфидного сырья можно назвать наиболее значительным достижением XX века в
области практической пирометаллургии, поскольку автогенные процессы, как
никакие другие в этой области, отвечают современным требованиям по энергоресурсосбережению
и экологической безопасности производства.
Список литературы
1. http://www.chem-astu.ru/misc/0001/14.html
2. http://www.metalresearch.ru/page47.html
. Ванюков А.В., Уткин Н.И. Комплексная переработка медного
и никелевого сырья - Челябинск: Металлургия, 1988. 432 с.
. http://dic.academic.ru/dic.nsf/es/35532/медь
. Бледнов Б.П., Спектор О.В., Колмаков А.А. Металлургия
меди и никеля: Методические указания к лабораторным работам для студентов
металлургических специальностей - Красноярск: ГАЦМиЗ, 2002. 48 с.
. Б.П. Бледнов. Автогенные процессы в металлургии меди и
никеля - Красноярск: ГАЦМиЗ, 1997. 88 с.