Влияние электролита различного состава на удельный расход образцов обожженных анодов при электролитическом получении алюминия
Содержание
Введение
. Специальная часть
.1 Литературный обзор
.1.1 Основные механизмы
потерь анода
.1.2 Факторы, влияющие на
удельный расход анода при электролизе
.1.3 Как предсказать расход
анода
.1.4 Методы определения
удельного расхода анода при электролизе
.2 Техническое описание
экспериментальной установки и методика работы на ней
.2.1 Подготовка оборудования
к эксперименту по расходу анода
.2.2 Проведение эксперимента
.2.3 Обработка полученных
экспериментальных данных
.3 Результаты экспериментов
. Безопасность
жизнедеятельности
.1 Анализ условий проведения
эксперимента
.1.1 Перечень потенциально
опасных и вредных факторов
.1.2 Физико-химическая и
токсикологическая характеристика веществ
.1.3 Характеристика помещения
для проведения работ
.2 Мероприятия по защите от
выявленных опасных и вредных факторов
.2.1 Технические и
организационные мероприятия
.2.2 Электробезопасность
.2.3 Противопожарные меры
безопасности
. Смета затрат на проведение
научно-исследовательской работы
.1 Экономическое обоснование
научно-исследовательской работы
.2 Сетевая модель
научно-исследовательской работы
.3 Смета затрат
.3.1 Стоимость оборудования и
материалов
.3.2 Заработная плата
исполнителей
.3.3 Отчисления на социальное
страхование
.3.4 Амортизация оборудования
.3.5 Энергетические затраты
.3.6 Накладные расходы
.3.7 Составление сметы затрат
Список используемой
литературы
Введение
При электролитическом получении алюминия происходит непрерывный расход
угольных анодов, доля стоимости которых в себестоимости алюминия составляет
15-17 % от общей структуры затрат.
Как известно, теоретический расход углерода при электролизе алюминия
составляет 334 кг/т Al. На сегодняшний
день лучшие показатели по расходу анода достигнуты на зарубежных предприятиях.
Эти показатели имеют следующие значения: для электролизеров с обожженными
анодами составляют 390 кг/т Al, а
для электролизеров с анодами Содерберга с боковым и верхним токоподводом - 430
и 493 кг/т Al соответственно, что значительно
превосходит теоретический расход углерода анода. На КрАЗе для электролизеров с
верхним токоподводом расход углерода еще выше и составляет 530 кг/т Al, что означает и более высокую долю
стоимости анодов в себестоимости алюминия по сравнению с зарубежными аналогами.
Установлено, что повышение расхода анода на 1 кг /т Al приводит к увеличению стоимости
производства алюминия примерно на 2 US$/т Al. Таким образом, по сравнению с
лучшими зарубежными показателями стоимость 1 тонны алюминия на КрАЗе выше на
(530 - 493) · 2 = 74 US$
или примерно на 2050 рублей, только за счет более высокого расхода анода. Такие
высокие затраты обуславливают необходимость поиска эффективных путей снижения
удельного расхода угольных анодов.
Одним из путей решения этой проблемы на мой взгляд является исследование
влияния на расход анода различных характеристик и условий, в которых происходит
электрохимический процесс, и затем подбор свойств анода и установление таких
параметров электролиза, которые бы приводили к снижению расхода анода без
ухудшения других технико-экономических показателей.
К основным факторам, влияющим на расход анода, можно отнести его
плотность, прочность, реакционную способность, газопроницаемость, содержание
примесей, состав электролита и др. На сегодняшний день для изучения влияния
перечисленных факторов на удельный расход углерода используют два способа.
Первый способ заключается в наблюдении за параметрами работы промышленных
электролизеров, а затем на основе полученных статистических данных делается
анализ, позволяющий выявить влияние различных промышленных факторов и свойств
анода на его расход. Недостатком данного способа является длительность
исследования (от 6 месяцев и более) и трудность оценки влияния конкретного
фактора на показатели работы электролизера (в данном случае на удельный расход
углерода), в силу того, что алюминиевый электролизер представляет собой
довольно сложную систему, на состояние которой влияют очень многие факторы и
условия.
Второй способ заключается в испытании образцов, изготовленных в
лабораторных условиях, с помощью стандартных методов анализа, включающих в себя
изучение реакционной способности в токе СО2 и воздуха. Недостатком
этого способа является то, что используемые методы анализа не включают тесты на
электрохимическую активность анода, т.е. на удельный расход анода
непосредственно при электролизе в криолитоглиноземном расплаве. Поэтому на
данные, полученные указанным образом, нельзя опираться при прогнозировании
расхода анода.
Недостатки обоих способов послужили причиной создания универсального
способа прогнозирования удельного расхода анода, который совмещает в себе как
быстроту проводимых исследований, так и имитацию основных процессов,
происходящих в промышленной ванне.
Целью данной дипломной работы является исследование влияния электролита
различного состава на удельный расход образцов обожженных анодов при
электролитическом получении алюминия.
Исследование образцов анодных блоков на данной экспериментальной
установке даст возможность определить, в какой степени удельный расход углерода
зависит от свойств исходного сырья, рецептуры и технологии приготовления
обожженных анодов.
Испытание на экспериментальном комплексе достаточно большого количества
анодных образцов с различными свойствами, изменяющимися в широком диапазоне,
дает возможность в дальнейшем вывести математическое уравнение для расчета
удельного расхода обожженного анода. Это уравнение позволит прогнозировать
эффективность или убытки при использования анодов различного качества.
Помимо этого, экспериментальная установка позволяет определить
зависимость расхода углерода не только от качества анодов, но и от свойств и
состава используемого электролита, а это в еще большей степени подтверждает
необходимость проведения данной научно-исследовательской работы.
1. Специальная часть
.1 Литературный обзор
.1.1 Основные механизмы потерь анода
Угольные аноды, используемые в ваннах Эру-Холла, могут быть монолитными
телами, которые обжигаются теплом, образованным в ванне (аноды Содерберга), или
состоять из нескольких угольных блоков, обожженных вне ванны (обожженные
аноды). Практически все производители алюминия в последнее время перешли или
переходят на использование технологии обожженных анодов. Однако используемое
сырье и механизмы расхода обожженных анодов подобны таковым для анодов
Содерберга.
На рис. 1.1 представлена структура расхода анода:
Рисунок 1.1 - Структура расхода анода
Стоимость анодов составляет 15-17 % от себестоимости алюминия, поэтому
снижение потерь углерода особенно важно. На сегодняшний день большинство
зарубежных заводов для производства алюминия используют электролизеры с
обожженными анодами, для которых расход углерода составляет 0,4-0,45 кг С/кг
Al, в то время как на российских заводах превалируют самообжигающиеся аноды,
расход которых больше, чем обожженных и зачастую превышает 0,5 кг С/кг Al [1].
На практике анод расходуется по электрохимическим, химическим и
механическим процессам. Рассмотрим в отдельности каждый из них.
Электрохимический расход анода
Большая часть анода расходуется непосредственно на электролитический
процесс. Во время электролиза из растворенного в криолите глинозема атомы
кислорода разряжаются на поверхности анода и реагируют с горячим углеродом с
образованием первичного продукта СО2, который покидает окрестность
электрода в виде газовых пузырей. Электролитический процесс может быть
представлен реакцией:
Al2O3(раств) + 3C(анод)= 4Al(ж) +3CO2(газ)
(970 oC) (1.1)
Также вероятно, что первичным продуктом может также быть СО согласно
реакции:
2O3(раств)
+ 3C(анод)= 2Al(ж) + 3CO(газ) (970 oC)
(1.2)
Если реакция (1.2) происходит, то в этом случае анод расходуется вдвое
быстрее, чем по реакции (1.1). Однако первичное образование СО происходит
только при очень низкой плотности тока (0,1-0,3 А/см2). При
плотностях тока применяемых в промышленности (0,6-1,3 А/см2)
преобладает первичное образование газа СО2.
Реакция с диоксидом углерода
Образование газа СО возможно за счёт взаимодействия между диоксидом
углерода и углеродом (реакция Будуара), представляется реакцией:
2(газ) + C(анод)=2CO(газ) (1.3)
Эта реакция может иметь место на поверхности анода ниже уровня
электролита, в порах анода и на частицах углерода в расплаве. Скорость этой
реакции удваивается при повышении температуры на каждые 40 ºС выше 800 ºС.
Гидравлическое давление электролита в сочетании с пористой природой
анодов приводит к проникновению электрохимически образованного СО2
внутрь анода. Там он взаимодействует в основном с коксом из связующего и более
пористым коксом (если анод плохо прокален).
Термодинамическая вероятность реакции Будуара наступает при температурах
выше 700 ºС: ΔGо = -171,642 - 0,1737Т кДж/моль. При температуре выше
930 оС равновесие реакции (1.3) полностью сдвинуто вправо и ее
скорость примерно удваивается от 960 оС к 1000 оС.
Первичное выделение газа СО2 в процессе электролиза и
температура процесса около 970 оС означают, что реакция (1.3) может
происходить на аноде в электролизере. Однако, утверждается, что во время
электролиза анодная поверхность, контактирующая с электролитом, защищена от
этих химических атак, хотя механизм защиты не ясен. Тем не менее анод - это
пористая структура и электролитически образующийся СО2 может
заполнять объем электрода через поверхность анод-электролит, где будет
происходить реакция Будуара (1.3). Исследования показали, что реакция (1.3)
хорошо происходит внутри анода на расстоянии 5-10 см от подошвы.[2] Реакция
вносит значительный вклад в превышение расхода: по приближенным расчетам из-за
образования СО по реакции (1.3) увеличение перерасхода составляет 2-10 % (9-45
кг/т Al) от общего расхода, а для анодов
Содерберга этот вклад может быть выше, чем на 10 % (50 кг/т Al). На рис. 1.2 представлена схема
процессов, связанных с расходом углерода. [2]
Горение на воздухе
Реакция «воздушного горения» происходит на верхних и не- защищенных
сторонах анода. Горячая поверхность электрода контактирует с окружающим
воздухом с образованием газообразных оксидов углерода по реакциям (1.4) и
(1.5):
С(анод) + О2(газ)=СО2(газ) (1.4)
С(анод) + О2(газ)=2СО(газ)(1.5)
Температура на верхней поверхности обожженных анодов может колебаться от
200 до 700оС, точная температура зависит от положения анода и
состояния ванны.
Отношение первичных продуктов реакций (1.4) и (1.5) СО/СО2
очень резко возрастает с увеличением температуры. Было рассчитано, что
равновесное соотношение СО/СО2 при 400оС около 0,2, а при
550оС превышает 1. Это говорит о том, что реакция (1.4) преобладает
при низких температурах, а вероятность реакции (1.5) в большей мере возрастает
при высоких температурах.
Примерные величины вклада реакции горения на воздухе к общему расходу
анода находятся в пределах 8 - 15 и 4-5 % на электролизерах с обожженными
анодами и Содерберга соответственно.[2]
Обратные реакции
Электрохимически образованный СО2 может также реагировать с
восстановленными частичками металла в электролите:
Al(раств) + 3CO2(газ) = 2Al2O3(раств)
+ 3C(пена) (1.6)
Al(раств) + 3CO2(газ) = 2Al2O3(раств)
+ 3CO(газ) (1.7)
Na(раств) + 3CO2(газ) = 3Na2O(раств)
+ 3CO(газ) (1.8)
Эти реакции не приводят к первичному расходу углерода, но они будут
увеличивать расход анода на тонну производимого алюминия, так как реакции
(1.6-1.8) расходуют металл, полученный электролитическим путем.
Типичный электролитический процесс включает в себя от 75 до 90 % общего
расхода анода. Около 12 % от этого расхода приходится на потерю тока с металлом
по реакциям (1.6-1.8). В табл. 1.1 представлены количественные показатели
влияния выхода по току на дополнительный расход углерода за счёт реакции 1.8.
[2]
Таблица 1.1 - Влияние выхода по току на дополнительный расход углерода
|
Выход по току, %
|
100
|
98
|
96
|
94
|
92
|
90
|
88
|
86
|
|
Расход углерода, кг/т Al
|
334
|
340
|
347
|
353
|
360
|
367
|
373
|
380
|
Пенообразование
Пенообразование - это физические потери частиц углерода с поверхности
анода.
Различная реакционная способность кокса-связующего и кокса-наполнителя
ведёт к избирательному окислению кокса-связующего.
В результате селективного окисления связи вещества связующего будут
разрушены и в этот момент частицы отделяются от анода. Турбулентное воздействие
анодных газов в пространстве расплав - анод будет способствовать отрыву
слабосвязанных частиц с большей скоростью, чем если бы они отрывались под
действием своего собственного веса. Этот механизм потерь называется
пенообразованием и характеризуется отрывом частиц, которые уже не потребляются
электрохимически и всплывают на поверхность электролита. Угольная пена
образуется преимущественно за счёт окисления кокса из связующего по реакции
Будуара, так как температура обжига этого кокса составляет 960-1000 оС,
тогда как температура обжига кокса-наполнителя - около 1250 оС.
Масса СО2, поступающая внутрь тела анода и «уничтожающая» кокс из
связующего, зависит от объема, распределения и диаметра пор.
На рис.1.2 схематически представлен механизм селективного горения. [1]
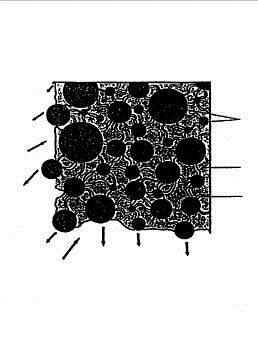
Рисунок 1.2 - Механизм селективного горения анода
Масса пены, производимая анодом, точно не известна, однако, установлено:
) скорость реакции выгорания кокса из связующего зависит от наличия
ингибиторов или катализаторов окисления по реакции Будуара. Такими веществами в
анодной массе являются:
ингибиторы (бор, фосфор);
катализаторы (железо, ванадий, натрий, кальций и др.);
) скорость реакции выгорания кокса из связующего зависит от доли
поверхности анода, доступной для фильтрации СО2 внутрь анода. В свою
очередь, чем хуже смачивается анод электролитом, тем больше эта доля. Она
увеличивается при введении в расплав фторидов лития, кальция и магния, а также
с уменьшением концентрации глинозема;
) избирательность окисления кокса из связующего зависит от анодной
плотности тока. Чем больше плотность тока (в промышленном диапазоне), тем
равномерней расходуется анод и тем меньше выход пены. Можно полагать, что при
малой смачиваемости анода электролитом плотность тока будет больше, а расход -
меньше;
) частицы углерода на подошве анода достаточно слабо связаны с матрицей,
в результате чего повышение скорости движения электролита и даже металла
«сбивает» угольные частицы, переводя их в электролит;
) угольная пена образуется не только за счет отделения крупинок
наполнителя после окисления кокса из связующего, но и путем производства внутри
электролита по реакции:
Al(раст.) + 3CO(раст.) = Al2O3(раст.) + 3С(т) (1.9)
В результате чего получается в основном мелкодисперсный углерод;
) угольная пена поступает в электролит как «валовый» продукт при
взаимодействии бортов анода с кислородом воздуха (выше уровня электролита), а
также ниже уровня электролита при селективном окислении растворенными в
расплаве кислородом воздуха и углекислым газом (плотность тока вдоль бортов
анода много меньше, чем на подошве, и здесь сильнее выражена селективность
окисления);
) рост температуры электролиза (и анода) повышает скорость реакции
селективного окисления и, следовательно, пенообразования;
) необоснованно завышенная плотность тока в аноде увеличивает термические
напряжения в композитном материале анода, приводя к развитию термических
напряжений, растрескиванию анода и повышению пенообразования, как показал опыт
Братского алюминиевого завода;
) сернистые коксы имеют большую окисляемость и осыпаемость. При
увеличении содержания серы на 1% расход анода увеличивается на 1,2%;
) повышение зольности анодной массы на 0,1% приводит к увеличению расхода
анода на 2,5-3%;
) при увеличении доли мелких фракций в аноде расход углерода
увеличивается на 2,5% на каждые 10% увеличения доли мелких фракций. [3]
На рис. 1.3 представлена схема процессов, связанных с расходом углерода.
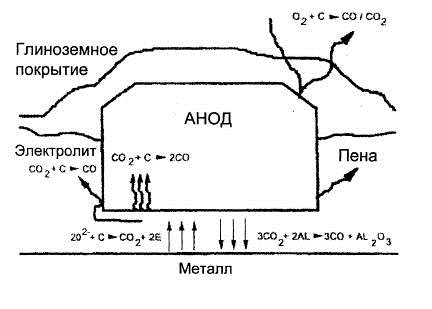
Рисунок 1.3 - Схема процессов, связанных с расходом углерода
Механизм этих потерь по реакции окисления (1.9) носит электрохимическую и
химическую природу. Приближенно пенообразование составляет порядка 1-10 % от
общего расхода анода.
Пенообразование приводит к нарушению технологии за
счет:
) увеличения себестоимости производства за счет
повышения расхода углерода;
2) уменьшения выхода по току за счет изолирующего эффекта, который
повышает температуру ванны;
3) увеличения числа анодных эффектов за счет
уменьшения скорости питанием глиноземом;
) увеличения трудозатрат за счет съёма угольной пены;
5) увеличения стоимости передела, поскольку электролит теряется при
снятии пены.
Расход промышленных анодов - это комплексный процесс, состоящий из
нескольких механизмов, действующих в различных зонах. Такая комплексность
усложняет разделение вкладов каждого механизма в общий расход. В табл. 1.2
представлены данные, отражающие примерный расход обожженного и
самообжигающегося анода при верхнем токоподводе по различным механизмам [3].
Таблица 1.2-Статьи расхода углерода
|
Механизм расхода
|
Расход анода, % масс.
|
|
Обожженные аноды
|
Верхний токоподвод
|
|
Основная реакция
|
66 - 76
|
58 - 66
|
|
Избыточный расход при
окислении кислородом воздуха
|
8 - 15
|
4 - 5
|
|
Реакция Будуара
|
5 - 6
|
7 - 8
|
|
Не прореагировавшая
(«товарная») пена
|
0,3
|
3 - 4
|
|
Окисление металла
|
7 - 8
|
8 - 10
|
|
Пиролиз и испарение
|
0,2
|
10 - 12
|
|
Реакция анода с примесями
(сера и металлы), потери с огарками
|
3,5 - 4,5
|
2 - 3
|
|
Расход анода (нетто): кг С/
кг Al
|
0,40 - 0,45
|
0,50 - 0,55
|
1.1.2 Факторы, влияющие на удельный расход анода при
электролизе
Влияние качества анодов на их расход при электролизе
Длительная работа алюминиевых электролизеров и высокие
технико-экономические показатели процесса электролиза во многом определяются
качеством углеродистых анодов и их расходом при электролизе.
К требованиям, предъявляемым к качеству обожженных анодов, относят ряд
характеристик, значения которых зависят от свойств углеродистого сырья, а также
от технологии изготовления «зеленых» и обожженных анодов.
В табл. 1.3 представлены показатели качества обожженных анодов по данным
действующих технических условий ТУ 48-5-148-84 «Блоки анодные обожженные для
алюминиевых электролизеров», типичные свойства анодов фирмы «R&D Carbon Ltd» и некоторые характеристики промышленных образцов
анодов отечественных (САЗ, НЭЗ) заводов.
Таблица 1.3-Показатели качества обожженных анодов [4-6]
|
Показатель
|
ТУ 48-5-148-84
|
САЗ
|
НЭЗ
|
R&D Carbon Alverke
|
|
АБ-0
|
АБ-1
|
|
|
Швейцария
|
ФРГ
|
|
Истинная плотность, не
менее, г/см3
|
2,05
|
2,03
|
2,05
|
2,07
|
2,05-2,10
|
2,08
|
|
Удельное
электросопротивление, не более, мкОм∙м (Ом∙мм2/м)
|
60
|
65
|
57
|
58
|
50-60
|
57
|
|
Реакционная способность в
СО2:
|
|
|
окисляемость, не более,
мг/(см2∙ч)
|
85
|
90
|
70
|
67
|
-
|
-
|
|
остаток, %
|
-
|
-
|
-
|
-
|
84-95
|
92
|
|
осыпаемость, не более,
мг/(см2∙ч)
|
45
|
50
|
11
|
15
|
-
|
-
|
|
Зольность, не более, %
|
0,6
|
0,9
|
0,53
|
0,84
|
-
|
-
|
|
Содержание примесей, %:
|
|
|
S
|
-
|
-
|
-
|
-
|
0,5-3,2
|
1,03
|
|
Fe
|
|
0,100
|
0,150
|
0,100
|
100-50 ppm
|
300 ppm
|
|
Si
|
|
0,090
|
0,060
|
0,047
|
50-300
|
207
|
|
V
|
|
0,013
|
0,021
|
0,012
|
30-320
|
66
|
Одним из основных факторов, влияющих на качество обожженных анодов,
являются свойства углеродистого сырья, используемого для изготовления анодов.
Многочисленными исследованиями отечественных и зарубежных ученых установлено
влияние свойств сырья нефтяного прокаленного кокса-наполнителя и
пека-связующего на качество анодной массы и обожженных анодов, а также
разработаны требования к углеродистому сырью, которые обеспечивают высокое
качество анодной продукции [4-10].
В табл. 1.4 представлены требования к прокаленному нефтяному коксу для
изготовления обожженных анодов.
Таблица 1.4-Требования к качеству прокаленного нефтяного кокса
|
Показатель
|
Россия
|
RD Carbon (Швейцария)
|
Кайзер Алюминиум (США)
|
Петрококс (Япония)
|
Пешине КХД
|
|
|
|
|
|
Франция
|
Германия
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Действительная плотность,
г/см3
|
2,04-2,09
|
2,05-2,10
|
2,06-2,08
|
2,06-2,09
|
2,05
|
2,05-2,09
|
|
Насыпная плотность, г/см3
|
0,78-0,86
|
0,78-0,84
|
0,80-0,82
|
0,78-0,87
|
-
|
0,84-0,94
|
|
Удельное
электро-сопротивление, мкОм∙м
|
490-630
|
460-540
|
-
|
-
|
-
|
-
|
|
Реакционная способность в
СО2,%
|
-
|
3-15
|
-
|
-
|
-
|
-
|
|
Коэффициент термического
расширения, 10-6/К
|
-
|
3-5
|
-
|
-
|
-
|
-
|
|
Содержание золы, не более,
%
|
0,7
|
0,4
|
0,4
|
0,5
|
0,7
|
0,8
|
|
Содержание серы, не более,
%
|
1,5
|
0,5-3,5
|
1,7
|
0,3-1,2
|
1,5
|
2,5
|
|
Содержание микро-примесей, ppm:
|
|
|
Fe
|
800
|
50-400
|
500
|
250
|
-
|
200
|
|
Si
|
800
|
50-250
|
400
|
450
|
-
|
900
|
|
V
|
150
|
30-350
|
250
|
200
|
150
|
250
|
|
Na
|
-
|
30-120
|
-
|
-
|
-
|
-
|
Как видно из табл. 1.4, все производители регламентируют значения
плотности (действительной и насыпной) в примерно одинаковых пределах DИ = 2,05÷2,09 г/см3 и DH =
0,78÷0,84 г/см3.
В этих пределах обеспечиваются достаточная плотность и прочность анодов, а
также их реакционная стойкость. На рис. 1.4 показано влияние истинной
(действительной) плотности на окисляемость и осыпаемость анодов в токе СО2,
которое заметно увеличивается при снижении DИ менее 2,05 г/см3 и увеличении выше 2,10 г/см3
[7].
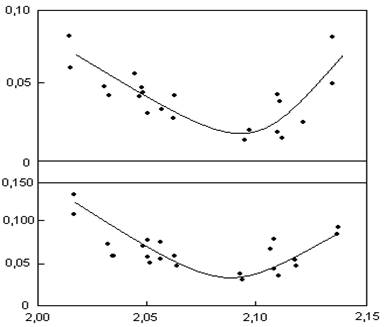

Рисунок 1.4-Зависимость окисляемости ОК и осыпаемости ОС анодов в токе СО2
от истинной плотности кокса DИ [9]
Влияние примесей в аноде на их удельный расход при электролизе
Высокое содержание золы в коксах, а также микропримесей в золе не только
влияет на сортность алюминия, но и оказывает каталитическое воздействие при
окислении углерода. На рис. 1.5 приведена зависимость расхода анода при
электролизе от содержания золы в нем.

Рисунок 1.5 - Зависимость расхода анода Рa при электролизе от содержания золы в коксе З
Практически все примеси содержащиеся в золе, кроме Si и Al, ускоряют процессы окисления и увеличивают расход анода при
электролизе. В табл. 1.5 представлены данные по влиянию различных примесей на
реакции горения углерода. [2]
Таблица 1.5-Влияние примесей на реакции горения углерода
|
Примесь
|
Влияние на окисление на
воздухе
|
Влияние на окисление в СО2
|
|
Si
|
К, у
|
П-И, в
|
|
Fe
|
К, у-в
|
К, с
|
|
V
|
К, с
|
К, у-в
|
|
Ni
|
К, у-в
|
К, у
|
|
Na, щелочные соли
|
К, с
|
К, с
|
|
S
|
К-П, в
|
И-П, в
|
|
Ca
|
К, в
|
К, у-с
|
|
Pb
|
К, с
|
К, в
|
|
Cu
|
К, с
|
К-П, в
|
|
Zn
|
К, в
|
П
|
|
Cr
|
К, у-в
|
П
|
|
Ti
|
К, в
|
П
|
|
AlF3
|
И
|
И
|
|
Al
|
К, у-в
|
К, в
|
|
B
|
И
|
И
|
|
P
|
И
|
И
|
|
К - катализатор, И -
ингибитор, П - пассивен, с - сильный, у - умеренный, в-вялый
|
Высокое содержание ванадия, натрия, никеля, серы в коксе наиболее сильно
сказывается на чувствительности анода к окислению на воздухе и в токе СО2.
Влияние плотности тока на удельный расход анодов
Анодная плотность тока напрямую связана со спецификой анодного расхода.
Установлено, что увеличение плотности тока отражается в уменьшении расхода
анода, хотя упоминается и обратная зависимость. Различия в расходе в
зависимости от плотности тока могут быть связаны со степенью протекания каждой
из двух предложенных реакций (1.1, 1.2). [2]
На рис. 1.6 представлена зависимость расхода анода от плотности тока
различных исследователей
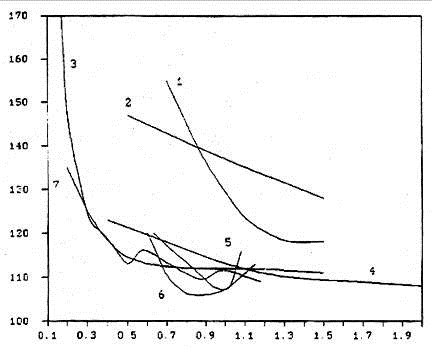
Рисунок 1.6 - Зависимости расхода углерода от анодной плотности тока,
взятые из литературных данных: 1 - Ветюков с сотр. [14]; 2 - Ведерников и
Ветюков [15]; 3 - Barat с сотр.
[16]; 4 - Ветюков и Ведерников [17]; 5 - Ревазян [21]; 6 - Смородинов с сотр.
[22]; 7 -Hume с сотр. [19].
Ветюков и др. [14] исследовали зависимость общего расхода углерода от
анодной плотности тока. Они предположили, что газифицировавшийся углерод был
равен теоретическому расходу, т.е. 0,112 г/(А-ч). Угольная пена была определена
посредством дробления твёрдого электролита после эксперимента и выжигания
угольной пены при 700 °С. Это могло завысить результаты, так как при такой
температуре может уже достаточно интенсивно испаряться твердый электролит.
Плотность тока при проведении экспериментов изменялась в диапазоне 0,7-1,5 А/см2.
Авторы [14] выяснили, что получается 0,0309 г пены/(А-ч) при анодной плотности
тока 1,0 А/см2, т.е. осыпаемость составила 27 %. Ведерников и
Ветюков [15], Barat с сотр. [16], Ветюков и Ведерников
[17] и Hume с сотр. [18] также изучали влияние
анодной плотности тока на расход анода, используя различные анодные материалы.
В целом было определено, что увеличение плотности тока приводит к уменьшению
расхода углерода, исключая Ревазяна, Смородинова и Коробова, которые нашли
минимум в расходе анода при 0,98-1 А/см2 для промышленных
электролизёров. Зависимость такого типа может быть объяснена следующим образом:
при низкой плотности тока происходит неравномерное окисление анода, что
объясняется различиями в реакционной способности гетерогенной поверхности
анода, так что некоторые зоны расходуются намного быстрее, чем другие, более
пассивные участки. Это приводит к физическому разрушению анода. Значит, низкая
плотность тока увеличивает тенденцию пенообразования. Пенообразование приводит
к более высокой скорости расхода анода и всегда вероятно образование СО при
очень низких плотностях тока. Как только плотность тока увеличивается,
пассивные участки анода становятся активными, и начинается более равномерный
расход анода. При дальнейшем увеличении плотности тока (выше минимального
расхода) на аноде становится высокой термическая нагрузка и в игру вступают
другие силы, такие как горение на воздухе боковых сторон и из-за этого расход
будет расти.
На рис. 1.7 показана зависимость расхода обожжённых анодов двух типов от
плотности тока [19]
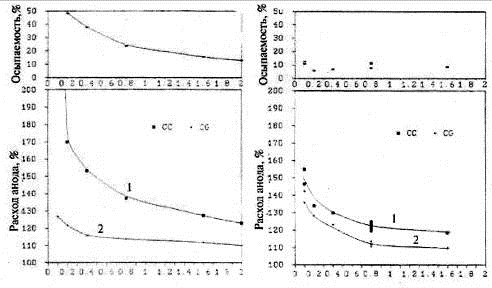
Рисунок 1.7 - Зависимость расхода углерода от плотности тока для
материалов обожжённых анодов: а) анод А, б) анод В. 1 - общий расход анода
(СС); 2 - газифицировавшийся углерод (CG)
На нем изображено различное поведение анодов, особенно при низких
плотностях тока. Использованные два анода изготавливались из одного и того же
пека, но из разных нефтяных коксов. Кокс анода В имел более высокое содержание
примеси натрия, чем анод А (103 ррm Na и 61 ppm Na соответственно).
Влияние температуры на расход анода
Увеличение температуры электролиза на каждые 10 оС приводит к
увеличению расхода примерно на 2 %, эти результаты были подтверждены заводскими
испытаниями [2]. Увеличение расхода может быть частично связано с
неоднородностью электрохимического окисления и частично с увеличением окисления
в токе СО2. Для реакции (1.7 - 1.8) было обнаружено, что небольшое
увеличение температуры анода (на 50оС) оказывает огромное влияние на
скорость окисления, так что скорости горения слабо - и высоко - активных
частичек анода становятся одинаковыми.
Это значит, что температура поверхности анода играет главную роль в
окислении анода на воздухе. На лабораторных испытаниях образцов анодов на
реакцию Будуара продемонстрировано, что увеличение температуры от 950 до 1000 оС
приводит к примерно увеличению скорости на 50 % реакции с СО2. [2]
Влияние солевых добавок в электролите на расход анода при получении
алюминия
При промышленных испытаниях различных режимов электролиза было замечено,
что расход анода зависит от состава электролита. На этот факт обратили внимание
исследователи [11-13].
В данной работе представлены результаты промышленных
исследований влияния добавок в электролит NaCl, MgF2 и CaF2, а также криолитового отношения на расход анода при
электролизе.
Исследование влияния состава электролита на расход
анода проводили на четырех однотипных электролизерах с одинаковым сроком службы
(2 года ±3 месяца).
Из полученных данных (рис. 1.8, 1.9) следует, что
увеличение криолитового отношения и введение в электролит NaCl ведут к некоторому снижению расхода
анодной массы. Введение в электролит фторидов магния и кальция приводит к
увеличению расхода анодной массы. Полученные промышленные данные подтверждают
результаты лабораторных исследований [13].
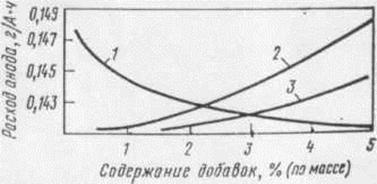
Рисунок 1.8-Зависимость расхода анода от содержания
солевых добавок электролите: 1 - NaCl; 2 - MgF2; 3 - CaF2
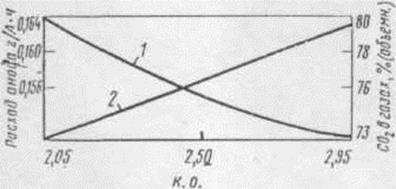
Рисунок 1.9-Влияние криолитового отношения электролита
(1) и содержания СО2 в анодных газах (2) на расход анода
Данные о влиянии состава электролита на расход анода
качественно подтверждаются результатами анализа анодных газов (рис. 1.9, 1.10).
При увеличении криолитового отношения электролита и введении NaCl содержание СО2 в анодных
газах возрастает, добавки фторидов кальция и магния действуют в противоположном
отношении. Позднее было замечено, что существует параллелизм между влиянием
добавок на расход анода и межфазным натяжением на границе электролит - анод. С
учетом этого вырисовывается следующий механизм влияния состава электролита на
расход анода.
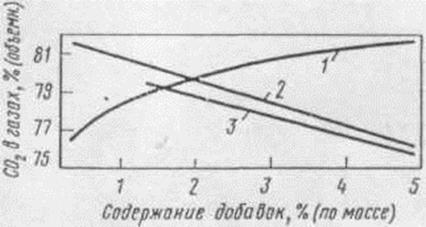
Рисунок 1.10-Влияние солевых добавок на содержание СО2
в анодных газах: 1 - NaCl; 2 - MgF2; 3 - CaF2
Образующийся при распаде углерод-кислородных
комплексов газ, состоящий из СО и СО2, собирается в относительно
крупные пузырьки и выделяется из-под анода. Однако часть газа остается в
многочисленных углублениях, имеющихся на подошве анода, где образование
пузырьков газа меньше. Наличие разрозненных газовых включений на подошве анода
приводит к неравномерному его сгоранию. Быстрее сгорают незащищенные газом
участки. Если анод хуже смачивается электролитом, то он лучше смачивается
газом. В этом случае пузырьки газа в углублениях удерживаются и неравномерность
сгорания анода усиливается. В случае хорошего смачивания анода электролитом
последний вытесняет газовые пузырьки из углублений, и анод горит равномернее.
Таким образом, добавки в электролит, уменьшающие межфазное натяжение,
способствуют более равномерному сгоранию анода и уменьшению расхода углерода. К
таким добавкам относятся хлориды и фториды щелочных металлов.
Добавки фторидов алюминия, кальция и магния, увеличивающие межфазное
натяжение на границе электролит - анод, вызывают неравномерное сгорание анода и
повышенный расход углерода. Для уменьшения расхода анода необходимо повышение
криолитового отношения до 2,90-2,95 при содержании в электролите 2,5-4,0 % NaCl
(по массе) [13].
В течение многих последующих лет исследования влияния солевых добавок в
электролит на удельный расход анода не проводились.
1.1.3 Как предсказать расход анода
Как известно, теоретический расход углерода при электролизе алюминия,
согласно основной реакции процесса, составляет 333,87 кг/т Al. На практике расход углерода в
электролизерах с обожженными анодами (ОА) примерно составляет 0,39 кг С/кг Al [23], что значительно превосходит
теоретический расход углерода анода.
Усилия многих компаний направлены на дальнейшее снижение практического
расхода углерода и, чтобы добиться в этом направлении хороших результатов,
необходимо узнать, как и в какой мере, тот или иной технологический фактор
влияет на расход анода, а затем на основе полученных знаний попытаться вывести
соответствующую математическую формулу.
В производстве ОА накоплен значительный объем данных о влиянии
эксплуатационных характеристик анода на его расход. В частности, установлено,
что повышение температуры электролита на 10°С дает увеличение удельного расхода
анода на 12 кг, а повышение CRR на
10 % увеличивает его удельный расход на 17 кг. Подобные зависимости определены
и для других показателей ОА. Это позволило специалистам R&D Carbon на основе широкомасштабной промышленной проверки
предложить формулу для расчета удельного расхода ОА в зависимости от их
карбоксиреактивности и других эксплуатационных характеристик и основных
технологических параметров [22]:
NC = C + 334/CE + 1,2(BT - 960) - 1,7CRR + 9,3AP + 8TC -
1,5ARR(1.10)
где NC - удельный расход углерода «нетто»
для ОА, кг/т Al (400-500);
С - фактор конструкции электролизера (270-310);
- теоретический расход углерода, кг/тAl;
СЕ - выход по току, % (75-90);
ВТ - температура электролита, °С (945-980);
CRR -
остаток от горения в СО2, % (75-90);
AP -
газопроницаемость, нПм (0,5-6,0);
TC -
теплопроводность, Вт/(м∙К) (3,0-6,0);
ARR -
реакционная способность на воздухе, % (60-90).
Правая часть этого эмпирического уравнения представляет собой сумму безразмерных
значений контролируемых технологических параметров и эксплуатационных
характеристик ОА, определяемых экспериментальным путем по специальной программе
(Test shedule) [24]. Исключением является показатель C (Cell Factor), который характеризует уровень технологии и техники
и, можно сказать, является постоянной величиной для конкретного типа
электролизера или завода. Этот показатель нельзя измерить или определить
экспериментально. Поэтому авторы предлагают вначале набрать статистический
материал по всем показателям правой части уравнения и расходу анода (как
минимум за год), а затем рассчитать C при помощи уравнения (1.11):
C = NC - 334/CE - 1,2(BT - 960) + 1,7CRR - 9,3AP - 8TC +
1,5ARR (1.11)
Получив таким образом значение С и используя текущие показатели
стандартной схемы контроля качества обожженных анодов и технологии электролиза,
по формуле (1.10) рассчитывается расход ОА, что дает возможность
спрогнозировать эффективность или убытки от использования анодов того или иного
качества. В табл. 1.6 представлены расчеты, выполненные согласно представленной
формуле. Аналогичные расчеты выполнены также для одного и того же типа
электролизера, но при использовании анодов стандартного и низкого качества
(табл. 1.7). [24]
Таблица 1.6-Данные для расчета удельного расхода углерода на
электролизерах различных конструкций
|
Электролизер
|
С
|
СЕ, %
|
ВТ, °С
|
CRR, %
|
АР, нП∙м
|
ТС, Вт/(м∙К)
|
ARR, %
|
NC (расчет), кг/т Al
|
NC (факт), кг/т Al
|
|
80 кА
|
303
|
91
|
970
|
82
|
0,8
|
3,8
|
76
|
466
|
462
|
|
100 кА
|
290
|
88
|
965
|
88
|
1,2
|
4,3
|
78
|
454
|
451
|
|
180 кА с точечным АПГ
|
275
|
94
|
960
|
92
|
1,5
|
4,2
|
82
|
399
|
401
|
Таблица 1.7-Данные для расчета удельного расхода углерода при
использовании различных анодов
|
Электролизер
|
С
|
СЕ, %
|
ВТ, °С
|
CRR, %
|
АР, нПм
|
ТС, Вт/(м∙К)
|
ARR, %
|
NC (расчет), кг/т Al
|
NC (факт), кг/т Al
|
|
Аноды стандартного качества
|
288
|
91
|
962
|
92
|
1,2
|
4,5
|
82
|
424
|
421
|
|
Аноды нестандартного
качества
|
288
|
87
|
974
|
87
|
2,0
|
4,0
|
69
|
488
|
492
|
Из табл. 1.6 - 1.7 следует, что фактические и расчетные данные расхода ОА
отличаются незначительно. Это свидетельствует о достаточной точности расчетных
данных.
1.1.4 Методы определения удельного расхода анода при
электролизе
Для того чтобы определить удельный расход анода при электролизе в
криолитоглиноземных расплавах, различными исследователями были разработаны
лабораторные ячейки на силу тока 30, 40, 100 А и более, с помощью которых
проводилось определение удельного расхода углерода, пересчитанного на 1А-ч или
в процентах к теоретическому.
Одним из самых известных методов является метод фирмы Алкан (метод
Холлингсхеда) [23,24].
Образцы анода помещаются в электролит, находящийся в графитовом тигле, и
проводится электролиз в течение некоторого времени (от 2 до 6 часов). Потеря
веса анода определяется с учетом электролита, проникшего в анод. Серьезным
недостатком такого электролитического теста является то, что невозможно
отличить газифицировавшийся углерод (в форме СО2 и СО) и углерод,
перешедший в пену. Пена распределена по электролиту, в основном по поверхности
расплава, и трудно собрать ее для анализа. Часть пены взаимодействует с СО2
с образованием СО: СО2 + С(пена) = 2СО.Если воздух
попадает в ячейку (как в тесте Холлингсхеда), часть пены сгорает.
Так как напрямую пенообразование определить практически невозможно, метод
был улучшен с целью его определения косвенным способом [25, 26]. Была
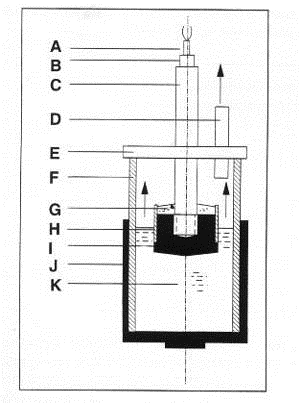
использована закрытая установка (рис. 1.11), и весь анодный газ собирался и
анализировался. Общий расход углерода определялся обычным способом
(взвешиванием), а количество углерода, перешедшее в пену, находилось как
разница между общим расходом анода и газифицировавшимся углеродом.
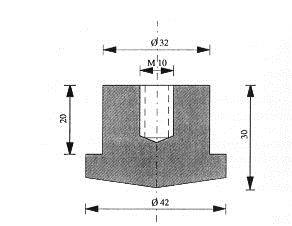
Рисунок 1.12 - Образец угольного анода для проведения эксперимента
Стенки графитового тигля были закрыты алундовой трубкой с внутренним
диаметром 60 мм. Сверху ячейка закрывалась алундовым диском с необходимыми
отверстиями. Газ-наполнитель (азот) подавался в печь снизу и вытеснял газ,
полученный на аноде, через специальное отверстие для выхода газа на линию
адсорбции. Образцы анодов (рис. 1.12) имели слегка коническую рабочую
поверхность для более быстрого удаления газа. Бока анода закрывались алундовой
трубкой, а сверху образец засыпался порошком глинозема, чтобы предотвратить
реакцию между углеродом и СО2 на этих участках. Собранная ячейка
помещалась в вертикальную печь. Термопара Pt-Pt10%Rh, помещенная внутрь анода,
использовалась для контроля температуры электролиза.
Диаметр рабочей поверхности анода был подобран таким образом, чтобы
плотность тока соответствовала промышленным (для того времени -0,79 А/см2).
В ячейку подавался постоянный ток 13А в течение трех часов. К концу опыта
плотность тока повышалась примерно до 0,92 А/см2 вследствие
уменьшения рабочей поверхности образца. Температура электролита поддерживалась
в пределах 982,5 ± 2,5 оС. Межполюсное расстояние (видимо,
начальное, так как оно изменялось по мере сгорания анода и повышения уровня
металла) было 35 мм. Электролит для опыта наплавлялся заранее, чтобы обеспечить
полное растворение составляющих и гомогенизацию. В него добавлялся глинозем в
избыточном количестве (10 % масс.), дополнительным же ресурсом глинозема
являлись защитные алундовые трубки.
Перед началом каждого опыта шахта печи тщательно очищалась и наполнялась
азотом. В течение опыта скорость подачи азота поддерживалась постоянной (200 см3/мин).
Доступ газа в линию адсорбции открывался за несколько минут до начала
электролиза и закрывался только через 20 минут после отключения тока, что
позволяло собрать весь полученный на аноде газ. Затем анод доставался из
расплава, а печь открывалась для охлаждения. Защитная трубка на аноде осторожно
разбивалась. Анод взвешивался, а затем сжигался на воздухе в течение 24 часов
при температуре 600 оС. Это делалось для определения содержания в
нем электролита. Остаток от сжигания взвешивался и вычитался от первоначально
полученной массы. Расход углерода подсчитывался как потеря в весе образца до и
после опыта и представлялся в виде процентов от теоретического значения.
Адсорбция анодного газа происходила после очистки его от пыли, водяного
пара и других газообразных примесей (HF, SiF4). Сначала осаждался СО2, в то время, как
СО адсорбировался в отдельной колбе, будучи перед этим окисленным до СО2,
путем пропускания его через гранулированный оксид меди, нагретый до 550 оС.
По увеличению веса двух адсорбционных колб определялось количество кислорода и
углерода в осажденном газе.
Усложнение конструкции экспериментальной установки повысило сложность и
стоимость теста, но, с другой стороны, позволило получить намного больше
информации. В связи с этим в настоящее время для проведения опытов по изучению
расхода анода электролитическим методом используются разновидности
рассмотренной выше установки.
В работах [17, 27] описываются исследования расхода углерода с
использованием подобной электролитической ячейки (рис. 1.13).
Главным отличием ячейки данной конструкции является то, что стальной
анододержатель выполнен большего диаметра, и внутри него располагается
термопара в алундовом кожухе, в то время как в ранее рассмотренной установке,
наоборот, стальной токоподвод закрывался алундовой трубкой. Если увеличение
диаметра токоподвода улучшит токораспределение в аноде, то его разрушение,
вызванное взаимодействием с парами электролита, и осыпание могут
непредсказуемым образом отразиться на результатах опыта. Межполюсное расстояние
увеличено до 5 см, чтобы условия электролиза были более стабильны.
В работе [27] обосновывается необходимость сжигать образцы при
температуре не выше 600 0С для определения содержания в них
электролита, а не при 700 0С, как этого требует стандарт ISO 8005-1984(E). Автором было обнаружено [18], что при температурах выше
600 0С возможно испарение некоторой части электролита, и это вносит
ошибку в вычисление количества израсходованного углерода.
Также здесь особо отмечается важность предварительной подготовки
электролита.
После навески необходимых количеств компонентов электролита, смесь
расплавлялась в тигле при температуре свыше 980 оС и выдерживалась
два часа, после чего расплав вынимался из печи вместе с тиглем и помещался в
железный или медный контейнер. Когда электролит остывал, его дробили до
крупности ≈ 20 мм или мельче, затем в щековой дробилке материал
измельчался до крупности -4 мм. Электролит хорошо перемешивался и до опыта
хранился в сухом месте.
Предварительная подготовка электролита необходима по двум причинам.
Во-первых, порошкообразные химические вещества занимают слишком много места, и
смесь их не может быть загружена в экспериментальную ячейку за один раз.
Во-вторых, химикаты содержат очень небольшое количество влаги, которого все же
достаточно, чтобы внести ошибку, так как влага может оседать в колбах для
адсорбции СО2, кроме того, она вызовет коррозию стальных частей
установки. По этой же причине все материалы, использованные для создания
ячейки, были предварительно высушены: они в течение 3 часов находились в печи
при температуре 140 0С.
Помимо адсорбции, для определения состава отходящих газов использовался
СО/СО2-газоанализатор (BINOS 100, Rosemount, Germany), в более ранних работах упоминаний об использовании
газоанализаторов нет. Вместо азота в качестве газа-вытеснителя использовался
аргон (скорость подачи 150 см3/мин). Для улавливания СО2
в адсорбционных колбах использовался аскарит («ascarite II») - химический реактив, содержащий NaOH.
Схема линии газовой адсорбции, использовавшаяся в работах [17, 27],
представлена на рисунке 1.14
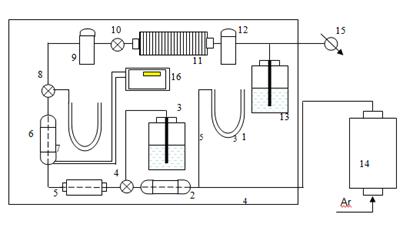

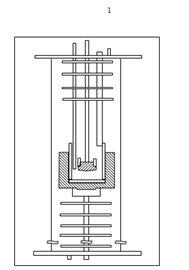
Рисунок 1.15-Схема электролитической ячейки
Ячейка находилась в центре печи, установленная на прикрепленном к
токоотводу держателе (1). Графитовый тигель был покрыт пастой из TiB2.
На дно графитового тигля помещался медный катод (2) для создания Cu-Al сплава с
низкой активностью алюминия в расплаве. Были применены аноды нового дизайна,
так как исследовалось влияние анодной плотности тока на выход по току: новые
образцы имели такой же диаметр (42 мм), но нижняя часть с этим диаметром была
выше (16 мм вместо 10 мм), и это позволило проводить электролиз на анодной
плотности тока 0,3 - 0,45 А/см2 при силе тока 10 А. Межполюсное
расстояние было снижено до 40 мм, видимо, благодаря использованию медного
катода.
Так как эксперименты продолжались в течение 12 часов, электролит
подпитывался глиноземом через специальный питатель (3).
Вдоль печи располагались диски (4), предотвращающие возникновение
значительных потоков воздуха в ячейке, чтобы анодные газы были более
концентрированы.
Еще одним отличием этой конструкции от ранее рассмотренных является то,
что термопара (5) находилась в расплаве, а не в аноде. Такое расположение
термопары позволяло получать более точные данные о температуре электролита в
данный момент.
В работах [29, 30] где не исследовался расход анода, но требования к
оборудованию были примерно те же, использовалась электролитическая ячейка,
представленная на рисунках 1.16 и 1.17.
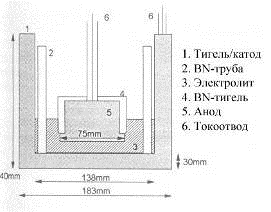
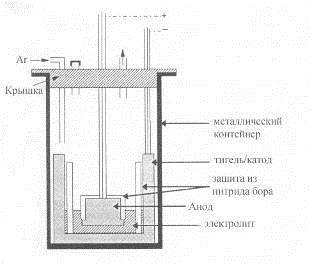
Главное отличие приведенной схемы аппаратурного оформления опытов в том,
что ток от катода отводится сверху. Вместо алундовой трубки для защиты стенок
графитового тигля использована труба из нитрида бора. Верх и бока анодного
образца закрыты перевернутым тиглем из нитрида бора с отверстием в днище для
анодного токоподвода.
Конструкция лабораторного электролизера на силу тока 380 А представлена
на рис. 1.18 [31]. Нагрев и поддержание температуры ячейки проводятся за счет
джоулева тепла, образующегося при прохождении тока через коксовую засыпку; ток
подводится за счет боковых токосъемных щек.
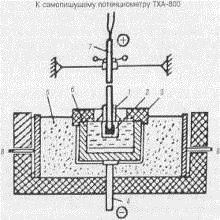
Рисунок 1.18-Лабораторный электролизер, диаметр 100 мм, высота 100 мм
(380 А): 1 - глиноземная засыпка; 2 - анод; 3
- шамотное кольцо; 4 - токоподводящая шина из жаростойкой стали; 5 - коксовая
засыпка; 6 - графитовый стакан; 7 - токоподводящий анододержатель; 8 -
токоподвод к криптолу
В отличие от ранее применявшихся лабораторных ячеек электролизер на 380 А
имеет существенные преимущества. Сравнительно большой анод (~1000 г), а также
значительное количество электричества, проходящее через электролизер за один
опыт (в пределах 2200 А∙ч), позволяют достичь расхода анода 300-320 г
против 15-20 г в ячейке на 30-35 А. При этом анод расходуется на глубину до 2
диаметров максимального зерна. Открытая ячейка и увеличенное расстояние от
анода до боковой стенки графитового стакана обеспечивают сгорание угольной
пены, исключают замыкание анода с катодом через пену и связанное с этим
искажение результатов опыта. Расход углерода на электролиз рассчитывается после
извлечения анода из ячейки с учетом пропитки его электролитом (по приросту
зольности). Остаток анода взвешивается, определяется потеря массы углерода и
пересчитывается на 1 А∙ч.
Известен также метод контроля электрохимической устойчивости анодов
электролизом в растворе щелочи [18]. В качестве анода используется
цилиндрический образец (диаметр 30 и высота 40 мм), а катодом служит стальное
кольцо из коррозионностойкой стали, погруженное в электролит. Образец на
стальном анододержателе размещается в центре кольца. Продолжительность
электролиза 6 ч, сила тока 8,5 А, электролит - 4Н щелочь NaOH. Впервые этот метод применен Т.
Ватанабе (Япония) для оценки качества различных видов связующего материала в
анодной массе.
Следует подчеркнуть исключительную простоту этого метода и высокую
степень воспроизводимости результатов. Причем, кроме удельного расхода
углерода, можно рассчитать и селективность окисления при электролизе. В связи с
этим, была сделана попытка установить корреляцию между удельным расходом
углерода при электролизе в криолитоглиноземном расплаве в лабораторном
электролизере (см. рис. 1.18) и удельным расходом при электролизе в растворе
щелочи. Полученные данные (рис. 1.19) свидетельствуют о высоком уровне
корреляционной зависимости (r=
0,90) результатов анализа для этих методов. К сожалению, метод электролиза в
растворе щелочи незаслуженно забыт и не нашел отражения при разработке
стандартных систем контроля качества анодов [18].
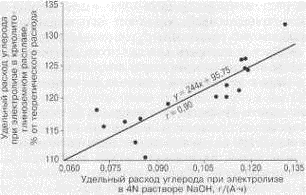
Рисунок 1.19-Корреляция удельного расхода углерода при электролизе в
криолитоглиноземном расплаве от удельного расхода при электролизе в растворе
щелочи
1.2 Техническое описание экспериментальной установки и
методика работы на ней
электролит алюминий анод обожженый
Исследования по влиянию состава электролита на
удельный расход анода проводились на установке, структурная схема которой
представлена на рис. 1.20.
Основными узлами данной установки являются печь сопротивления (5) с
помещенной в неё герметично закрытой электролитической ячейкой (4).
Печь сопротивления (5) служит для нагревания электролита до плавления и
дальнейшего поддержания температуры на постоянном уровне 960 оС, с
помощью регулятора. Поддержание температуры на строго определенном уровне
обусловлено следующими факторами:
необходимость получения результатов по расходу углерода при определенной
температуре;
наиболее точное соответствие условиям в промышленных электролизерах;
обеспечение такого перегрева электролита, при котором он имеет
достаточную жидкотекучесть и небольшое давление насыщенного пара.
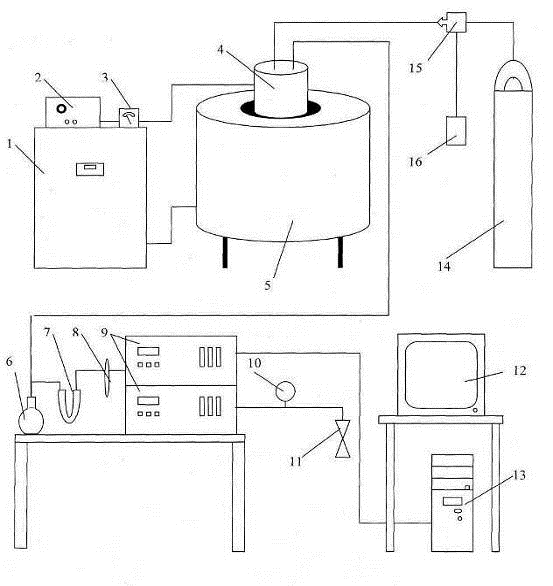
Рисунок 1.20-Общий вид
установки: 1- блок управления с регулятором МИНИТЕРМ 400.31; 2-источник
постоянного тока; 3-амперметр; 4-ячейка; 5-печь; 6-сосуд Дрекселя с раствором
хлорида кадмия; 7-U-образная трубка
с хлоридом кальция; 8-термометр; 9-газоанализаторы КЕДР-М 32 (СО) и КЕДР-М 30
(СО2); 10-манометр;11-водоструйный насос; 12-монитор; 13-компьютер;
14-баллон с аргоном; 15-регулятор расхода газа «El-Flow»; 16-блок
управления регулятором расхода газа.
Для выполнения данных условий печь сопротивления подключена к устройству
высокоточного контроля и регулирования температуры - регулятор
микропроцессорный “МИНИТЕРМ 400.31” (1), который позволяет автоматически
регулировать технологические параметры работы печи (рис 1.21).


Рисунок 1.21 - Звенья экспериментальной установки: а) - блок управления с
регулятором МИНИТЕРМ 400.31; б) - печь сопротивления
В ходе электролиза продолжительностью около 12 часов, выделяющиеся
анодные газы вытесняются аргоном из ячейки и поступают в газовую линию.
Подача аргона осуществляется с помощью регулятора расхода газа «El-Flow» (16), который соединен с баллоном аргона (14)
резиновым шлангом.
Скорость потока аргона, подаваемого в ячейку, регулируется при помощи
блока управления регулятором расхода газа (16) (рис. 1.22). Погрешность
регулятора расхода газа составляет +/- 0,5 %.


Рисунок 1.22 - Регулятор расхода газа «El-Flow»: 1 - блок
управления регулятором расхода газа; 2 - регулятор расхода газа
Использование аргона объясняется двумя причинами:
) аргон - является инертным газом, и при подаче его в ячейку не
происходит горение анода на воздухе;
) это тяжёлый газ и при подаче его в электролитическую ячейку происходит
вытеснение газов, выделяющихся в процессе электролиза, в дальнейшем поступающих
в газовую линию и затем в газоанализаторы.
Газоанализаторы КЕДР М 32 (9), КЕДР М 30 (10) служат для определения
количество газов СО, и СО2 выделяющихся в процессе электролиза (рис.
1.23).

Рисунок 1.23 - Газоанализатор КЕДР М 32 (СО), КЕДР М 30 (СО2)
Газоанализаторы соединены с компьютером (13), который фиксирует значения,
выдаваемые газоанализаторами, и выводит их на монитор (12) в виде графиков и
таблиц значений (рис. 1.24). Погрешность газоанализатора КЕДР М 32, КЕДР М 30
составляет +/- 4 %. Общая погрешность экспериментальной установки составляет 5
%.
Рисунок 1.24- Графики зависимости концентрации СО и СО2, %
об. от времени, выводимые на экран монитора
Газовая линия состоит из сосуда Дрекселя с хлоридом кадмия (6),
соединённого с U-образной
кварцевой трубкой с хлоридом кальция (7).
Хлорид кадмия необходим для улавливания фторидов, выделяющихся в процессе
электролиза, для предотвращения разрушения стеклянных трубок, и кюветы в
газоанализаторе фторидами, а хлорид кальция необходим для улавливание влаги из
газов, которые поступают в газоанализаторы, т.к наличие влаги в
газоанализаторах приводит к погрешностям в показаниях.
Шланг от U-образной трубки
подсоединяется к входу верхнего газоанализатора (9), его выход соединяется с
входом нижнего газоанализатора (9), при этом в газопровод у входа к верхнему
газоанализатору подсоединяется термометр (8) для измерения температуры
отходящих газов. Выход нижнего газоанализатора подсоединяется к водоструйному
насосу (11), создающему в линии необходимое разрежение, равное 0,025 кгс/см2.
Для контроля разряжения между водоструйным насосом и газоанализаторами
подсоединяется манометр (10).
С помощью источника постоянного тока (2) и
подсоединенного к нему амперметра (класс точности 2,5) (3), который измеряет
значение силы тока, устанавливается требуемая сила тока, при которой проводится
процесс электролиза.
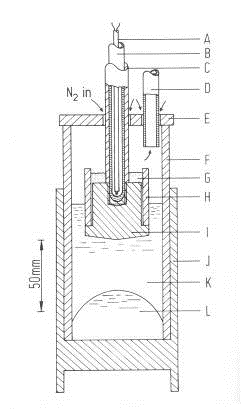
Электролитическая ячейка (рис. 1.25) состоит из корундового
корпуса, закрытого сверху металлической крышкой с отверстием в центре и
приваренными металлическими трубками по бокам. Внутрь ячейки через центральное
отверстие в крышке помещается стальной токоподвод с закрепленным на конце
образцом анода. Образец анода с боков защищен от сгорания корундовым чехлом, а
сверху засыпан слоем глинозема. Данная анодная конструкция помещается в
графитовый стакан. Главным требованием к электролитической ячейке является ее
полная герметичность.
Образец анода (D=40 мм, l=50
мм) взвешивается и накручивается на заранее очищенный стальной токоподвод (l=700 мм). Затем на анод надевается
чехол, представляющий собой корундовую трубку (l=40 мм). Сверху образец засыпается глиноземом. Контроль
температуры в ячейке осуществляется с помощью хромель-алюмелевой термопары,
помещенной в электролит между ячейкой и графитовым стаканом.

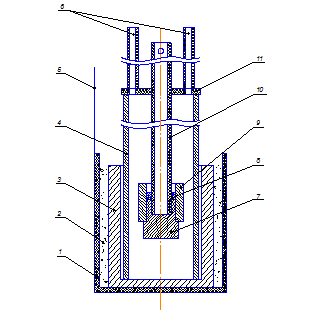
Рисунок 1.25 - Электролитическая ячейка: а) - схема: 1- стакан из
нержавеющей стали; 2- засыпка из графитовой крошки; 3- графитовый стакан; 4-
корундовый корпус; 5- стальной токоотвод; 6- металлические трубки; 7- образец
анода; 8- засыпка из глинозёма; 9- корундовый чехол; 10- стальной токоподвод;
11- металлическая крышка; б) - фотография
После полного остывания производится взвешивание
анодного остатка, затем он дожигается при температуре 600 °С.
На основании полученных данных рассчитывается общее
количество израсходованного анодного образца, количество газифицировавшегося
углерода и количество углерода в пене.
1.2.1 Подготовка оборудования к эксперименту по расходу анода
При подготовке к выполнению измерений проводят следующие работы:
) сборка электролитической ячейки;
) подготовка к работе газовой линии;
) подготовка установки к эксперименту.
Сборка электролитической ячейки
Главным требованием к электролитической ячейке является ее полная
герметичность, что достигается использованием для скрепления деталей
высокотемпературной клеящей мастики. Так как время полного высыхания мастики составляет
24 часа, монтаж ячейки рекомендуется производить за 2-3 дня до проведения
эксперимента, что дает возможность нанести мастику в несколько слоев и хорошо
ее просушить. Многослойное нанесение мастики снизит возможность разрушения
места склейки при воздействии высокой температуры во время опыта и
разгерметизации ячейки.
Корундовый корпус ячейки рекомендуется делать сборным из двух трубок, так
как такое соединение лучше выдерживает высокую температуру, в то время как
соединение трубка-стальная крышка будет находиться над шахтой печи в
низкотемпературной зоне.
Образец анода взвешивается и накручивается на заранее очищенный стальной
токоподвод. Затем на анод надевается чехол, представляющий собой корундовую
трубку. Сверху образец засыпается глиноземом, при этом нет необходимости делать
толстый слой глинозема, так как он быстро пропитывается парами электролита,
затвердевает и создает хорошую защиту от выгорания углерода.
Для того чтобы выставить нужное МПР, на ровную поверхность ставится
цилиндр из любого твердого материала, имеющий диаметр немного меньше
внутреннего диаметра ячейки и высоту - 4 см, равную межполюсному расстоянию. На
цилиндр устанавливается анод с токоподводом и накрывается сверху корпусом
ячейки так, чтобы токоподвод попал в центральное отверстие крышки корпуса.
Данную операцию надо проводить особенно осторожно, так как крышка от удара о
стальной штырь может отвалиться. После установки токоподвода, он приклеивается
к крышке на мастику. Следует обратить особое внимание на строго вертикальное расположение
анодного устройства.
Подготовка к работе газовой линии
В сосуд Дрекселя наливается дистиллированная вода объемом 300 мл, в
которой затем растворяется 40-50г хлорида кадмия. Сильно концентрированным
раствор хлорида кадмия делать не рекомендуется, так как при этом возможно
образование кристаллов внутри трубки, которые ее забивают и в дальнейшем
препятствуют выходу анодных газов. Раствор служит для улавливания фторидов,
сернистого газа и взвешенных примесей.
Улавливание фторидов необходимо для предотвращения разрушения стеклянных
трубок газоанализатора фторидами.
После сосуда Дрекселя в газовую линию подключается U-образная трубка, заполненная
хлоридом кальция для поглощения влаги. При этом U-образная трубка плотно закрывается резиновыми пробками с трубками.
Шланг от U-образной трубки
подсоединяется к входу верхнего газоанализатора, его выход соединяется с входом
нижнего газоанализатора.
Газоанализаторы необходимо включать не позднее, чем за 30 минут до начала
проведения эксперимента, чтобы дать им прогреться.
Подготовка установки к эксперименту
Включается печь. На блоке управления с регулятором МИНИТЕРМ 400.31
задается требуемая температура в печи. Внутрь шахты помещается шамотный кирпич,
на который устанавливается стальной стакан с токоотводом. Внутри стального
стакана находится графитовый стакан. После помещения стального стакана в шахту
печи, сверху на него кладется шамотная «пробка», имеющая посередине отверстие
для установки электролитической ячейки и контрольной термопары. К отверстию в
токоотводе при помощи болта с шайбой прикручивается электрический провод.
Внутрь графитового стакана с помощью длинной кварцевой трубки насыпается
растолченный электролит, после чего отверстие в шамотной «пробке» закрывается
шамотным кирпичом, а шахта сверху - каолиновой ватой. Это делается для
минимизации неизбежных потерь тепла при нагреве печи.
К анодному токоподводу присоединяется электрический провод от источника
постоянного тока, на трубки металлической крышки надеваются газопроводные
шланги. К шлангу, идущему от баллона с аргоном, подключается
расходомер-регулятор газового потока «El-Flow». В местах контактов прикрепляются
зажимы-«крокодилы» вольтметра, после чего установка готова к работе.
1.2.2 Проведение эксперимента
При расплавлении электролита на дно графитового стакана устанавливается
электролитическая ячейка. Перед установкой ячейки непосредственно в электролит
необходимо выдержать ее некоторое время при высокой температуре над расплавом,
чтобы дать возможность прогреться. В противном случае возможно растрескивание
корундового корпуса ячейки. Рядом с ячейкой в расплав помещается
хромель-алюмелевая термопара в корундовом кожухе, подключенная к блоку
управления с регулятором - МИНИТЕРМ 400.31. Щель между шамотной «пробкой» и
корпусом ячейки лучше утеплить каолиновой ватой, чтобы уменьшить тепловую
нагрузку на место склейки и общие потери тепла из шахты.
Перед началом эксперимента включается водоструйный насос, при этом напор
воды увеличиваем до тех пор, пока стрелка на манометре не остановится на
отметке 0,025 кгс/см2.
Вся система продувается аргоном. Для этого на пульте управления «El-Flow» выставляется скорость потока аргона, соответствующая
расходу газа 200 мл/мин.
Рекомендуется подачу аргона начинать до установки ячейки, что
предотвратит сгорание углерода анода при высокой температуре.
На компьютере запускается программа «LabVIEW», которая осуществляет автоматическую запись таких
данных, как время электролиза, концентрацию СО, СО2 и отношение СО к
СО2. Также во время работы программы осуществляется непрерывное
построение концентрационных графиков газов СО и СО2 во времени.
Частоту регистрации данных можно выбрать любую, в наших экспериментах мы
взяли 15 секунд.
Подача тока осуществляется при помощи источника постоянного тока, при
этом на подключенном в электрическую цепь амперметре выставляется необходимая
сила тока. На начальном этапе возможно повышенное напряжение на ячейке, которое
постепенно падает в течение нескольких минут, ток при этом выравнивается.
Электролиз проводится в течение 12 часов. После проведения эксперимента
прекращается подача тока, а вся система продувается аргоном до достижения в
системе концентрации СО и СО2 близких к нулю. Шланги и электрический
провод от ячейки отсоединяются, сама ячейка вынимается из печи и
устанавливается в пожаробезопасном месте на шамотный кирпич. Из шахты
вынимается шамотная «пробка». Стальной стакан достается из шахты, расплав из
него сливается в металлическую изложницу, которую рекомендуется перед этим
прогреть (например, поставив на металлический стакан, пока он еще находится в
печи). Печь отключается.
После полного остывания производится взвешивание анода. Как правило, анод
извлекается из ячейки только после полной ее разборки.
Образец снимается с токоподвода над листом бумаги и взвешивается вместе с
осыпавшимся на лист материалом.
После взвешивания анод помещается в керамический тигель и сжигается при
температуре 600 оС в течение 12 и более часов (пока не сгорит весь
углерод). Для ускорения дожигания анода его необходимо раздробить в
металлической ступке. При большей температуре дожига, 700оС и более,
возможно испарение части солей, находящихся на аноде, что вносит ошибку в
результаты эксперимента.
1.2.3 Обработка полученных экспериментальных данных
Перед
началом опыта образец анода взвешивается, и начальная масса анода 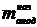 заносится в компьютер.
заносится в компьютер.
Начальная
масса углерода 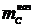 , г, содержащегося в аноде, находится по формуле:
, г, содержащегося в аноде, находится по формуле:
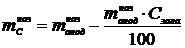 ,
г,(1.10)
,
г,(1.10)
Где Сзола - содержание золы в
аноде, % масс.
Во время проведения опыта значения концентрации СО2, ССО2,
%об., и концентрации СО, ССО, %об., записываются программой в
отдельный файл, который по завершению опыта преобразуется в файл MS Excel, что позволяет обрабатывать содержащиеся в нем
данные, представленные таблицей
|
Время
|
Время электролиза
|
Температура
|
СО
|
СО2
|
СО/СО2
|
|
[мин]
|
[мин]
|
[oC]
|
[%]
|
[%]
|
[%/%]
|
После
завершения опыта анод снимается с анододержателя и взвешивается вместе с
налипшей солью, глиноземной засыпкой и корундовым кольцом, если последнее
нельзя осторожно удалить. Это масса загрязненного анода - 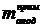 , г. Затем анод помещается в керамический тигель и
выдерживается в открытой печи до полного сгорания углерода при температуре 600 оС.
Масса полученного остатка
, г. Затем анод помещается в керамический тигель и
выдерживается в открытой печи до полного сгорания углерода при температуре 600 оС.
Масса полученного остатка 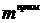 вычитается из
вычитается из 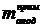 , чтобы
найти конечную массу углерода анода
, чтобы
найти конечную массу углерода анода 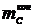 , г.
Убыль массы углерода анода
, г.
Убыль массы углерода анода 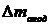 , г,
находится из разности
, г,
находится из разности 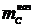 и
и 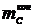 .
.
Общий
объем газа, проходящий через газоанализаторы за время между измерениями
(которое устанавливается в программе «СО.vi» и по
умолчанию равно 1 мин), определяется по формуле:
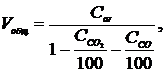 (1.12)
(1.12)
Где Сar
- удельный расход аргона, л/мин.
Объем
газа СО2, прошедший через газоанализаторы за время между
измерениями, находится по формуле:
 .(1.13)
.(1.13)
Объем
газа СО, прошедший через газоанализаторы за время между измерениями, находится
по формуле:
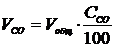 .(1.14)
.(1.14)
Масса
газа СО2 этого объема равна
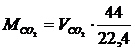 .(1.15)
.(1.15)
Масса
газа СО этого объема равна
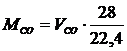 .(1.16)
.(1.16)
Количество
углерода, перешедшего в СО2, 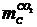 находится
по формуле:
находится
по формуле:
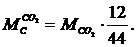 (1.17)
(1.17)
Количество
углерода, перешедшего в СО, 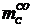 находится
по формуле:
находится
по формуле:
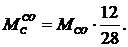 (1.18)
(1.18)
Общее
количество газифицировавшегося углерода 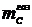 , г,
находится как сумма
, г,
находится как сумма 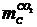 и
и 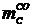 .
.
Масса
образовавшейся пены 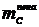 находится по формуле:
находится по формуле:
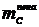 =
= 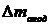 -
- 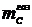 ,
г.(1.19)
,
г.(1.19)
Теоретический
расход углерода находится по формуле:
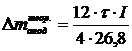 ,
г,(1.20)
,
г,(1.20)
где - время проведения электролиза, час;
- время проведения электролиза, час;
I - сила тока
электролиза, А.
Для
удобства дальнейших вычислений находится практический расход в процентах от
теоретического 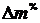 , %:
, %:
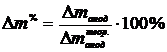 .(1.21)
.(1.21)
Общий
расход углерода на 1 т алюминия находится по формуле:
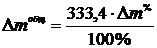 ,
кг.(1.22)
,
кг.(1.22)
Масса
газифицировавшегося углерода на 1 т алюминия 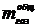 :
:
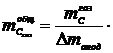
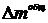 ,
кг.(1.23)
,
кг.(1.23)
Масса
полученной пены на 1 т алюминия 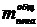 :
:
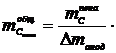
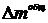 , кг.
(1.24)
, кг.
(1.24)
1.3 Результаты экспериментов
В ходе научно-исследовательской работы было проведено 7 опытов,
исследованы образцы обожженных анодов Новочеркасского электродного завода
(опыты 1-6) и экспериментальные аноды с добавлением графита (опыт 7),
физико-химические свойства этих анодов приведены в табл. 1.8
Таблица 1.8 - Физико-химические свойства анодных образцов
|
Производитель
|
Экспериментальные аноды с
добавлением графита
|
ОАО «НЭЗ»
|
|
Действительная плотность,
г/см3
|
2,045
|
2,05
|
|
Кажущаяся плотность, г/см3
|
1,647
|
1,63
|
|
Прочность на сжатие, МПа
|
481,7
|
40,9
|
|
Удельное
электросопротивление, мкОм*м
|
54
|
55,0
|
|
Окисляемость, мг
|
24,7
|
|
Осыпаемость, мг
|
3,3
|
10,0
|
|
Содержание золы, %
|
0,3
|
0,39
|
|
S, %
|
0,89
|
1,49
|
|
Fe, %
|
0,026
|
0,06
|
|
Si, %
|
0,054
|
0,07
|
|
V, %
|
0,011
|
0,018
|
|
Na, %
|
0,017
|
0,033
|
Исследование удельного расхода анода проводилось при постоянной плотности
тока 1,2 А/см2, температуре электролиза 9600С, межполюсным
расстоянием равным 4 см в электролите различного состава, масса которого
составляла 700 г. Время проведения эксперимента составляло 11-12 часов. Данные
о составе электролита представлены в табл. 1.9.
Таблица 1.9 - Состав электролитов при проведении исследований
|
№ опыта
|
Содержание добавок в
электролит, % масс.
|
КО
|
|
AlF3 изб
|
CaF2
|
LiF
|
MgF2
|
KF
|
Al2O3
|
|
|
1
|
3,9
|
5,0
|
2,1
|
-
|
4,7
|
8,4
|
2,65
|
|
2
|
4,17
|
5,0
|
2,1
|
0,5
|
-
|
7,76
|
2,67
|
|
3
|
10,08
|
5,0
|
2,1
|
0,5
|
4,7
|
8,3
|
2,2
|
|
4
|
5,9
|
5,0
|
2,1
|
0,5
|
4,7
|
8,5
|
2,5
|
|
5
|
7,9
|
5,0
|
2,1
|
0,5
|
4,7
|
8,4
|
2,35
|
|
6
|
4,0
|
5,0
|
2,1
|
0,5
|
2,1
|
8,2
|
2,65
|
|
7
|
9,3
|
6,0
|
-
|
-
|
-
|
8,25
|
2,3
|
По результатам исследований получены данные по расходу анодов, которые
представлены в табл. 1.10
Таблица 1.10 - Данные по электрохимическому расходу анода
|
№ опыта
|
Время электролиза, ч
|
Общий расход углерода, %
|
Общий расход углерода, кг/т
Al
|
Углерод газифицировав
шийся, кг/т Al
|
Углерод в электролите, кг/т
Al
|
|
1
|
11,92
|
107
|
356
|
352
|
4
|
|
2
|
7,75
|
133
|
445
|
383
|
62
|
|
3
|
11,77
|
127
|
422
|
376
|
43
|
|
4
|
11,37
|
117
|
389
|
368
|
21
|
|
5
|
10
|
132
|
439
|
393
|
46
|
|
6
|
3,53
|
117
|
391
|
367
|
24
|
|
7
|
11,43
|
140
|
467
|
396
|
71
|
На рис. 1.26-1.39 представлены графики изменения зависимости концентрации
СО и СО2, % (об.), от времени по проведенным опытам с
различными составами электролитов.
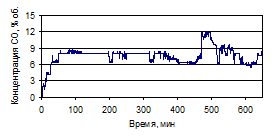
Рисунок 1.26 - График зависимости СО от времени, по результатам опыта № 1
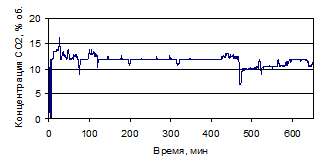
Рисунок 1.27 - График зависимости СО2 от времени, по
результатам опыта № 1
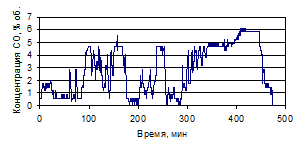
Рисунок 1.28 - График зависимости СО от времени, по результатам опыта № 2
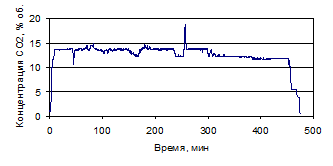
Рисунок 1.29 - График зависимости СО2 от времени, по
результатам опыта № 2
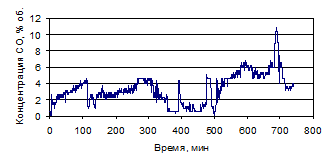
Рисунок 1.30 - График зависимости СО от времени, по результатам опыта № 3
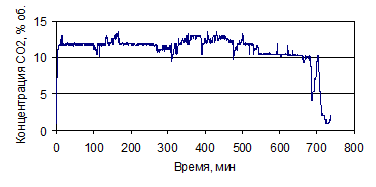
Рисунок 1.31 - График зависимости СО2 от времени, по
результатам опыта № 3
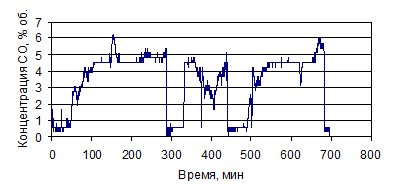
Рисунок 1.32 - График зависимости СО от времени, по результатам опыта № 4
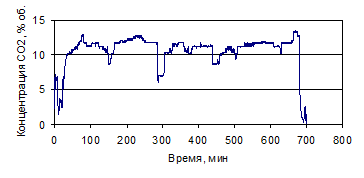
Рисунок 1.33 - График зависимости СО2 от времени, по
результатам опыта № 4
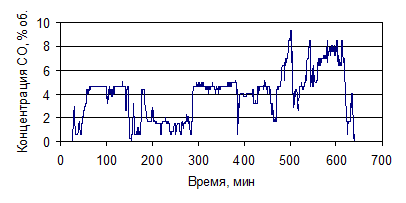
Рисунок 1.34 - График зависимости СО от времени, по результатам опыта № 5
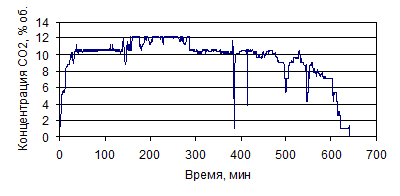
Рисунок 1.35 - График зависимости СО2 от времени, по
результатам опыта № 5
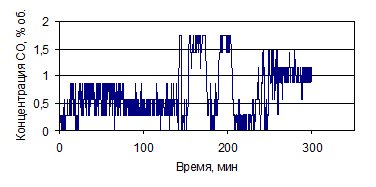
Рисунок 1.36 - График зависимости СО от времени, по результатам опыта № 6
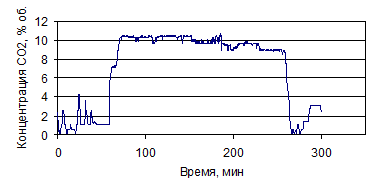
Рисунок 1.37 - График зависимости СО2 от времени, по
результатам опыта № 6
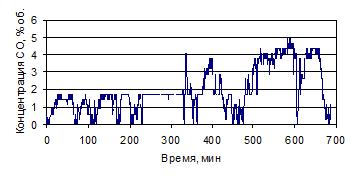
Рисунок 1.38 - График зависимости СО от времени, по результатам опыта № 7
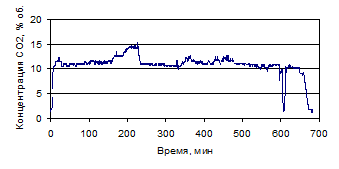
Рисунок 1.39 - График зависимости СО2 от времени, по
результатам опыта № 7
Из представленных графиков видно, что с течением времени концентрация
газа СО2 уменьшается, а концентрация газа СО увеличивается. Это
объясняется тем, что реакция Будуара протекает преимущественно на пористой
поверхности, а со временем анод становится более газопроницаемым и пористым,
что способствует проникновению СО2 в тело анода.
На основе данных по результатам опытов 1 - 6, представленных в табл. 1.10
видно, что максимальный расход для образцов анода НЭЗ достигается при снижении
криолитового отношения и содержания добавки KF в электролите. С увеличением криолитового отношения до 2,67,
при постоянном содержании KF
4,7% масс, происходит уменьшение расхода анода. Минимальный расход образца
анода был достигнут в опыте № 1 при криолитовом отношении 2,65. При последующем
снижении криолитового отношения и содержании добавок в электролите, за
исключением CaF2, наблюдалось повышение расхода анода.
Аналогичный опыт был проведен и с образцом анода с добавлением графита,
данные по опыту 7 (табл. 1.10). По полученным опытным данным видно, что данный
образец анода имеет самый высокий показатель по расходу.
На рис. 1.40-1.42 представлены графики зависимости содержания углерода в
электролите, количество газифицировавшегося углерода и общего расхода анода в
зависимости от состава электролита для анодов.
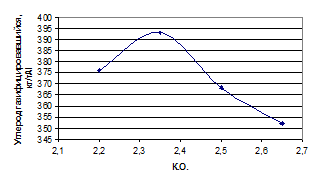
Рисунок 1.40 - График зависимости газифицировавшегося углерода от
криолитового отношения
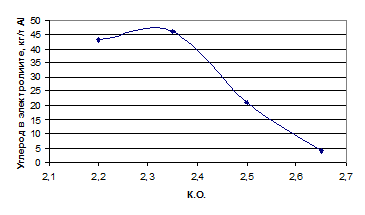
Рисунок 1.41 - График зависимости содержания углерода в электролите от
криолитового отношения
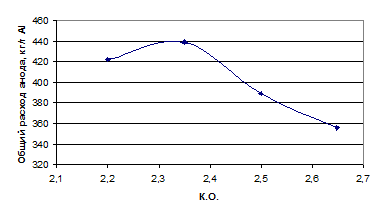
Рисунок 1.42 - График зависимости общего расхода анода от криолитового
отношения
Из рис. 1.42 видно, что минимум в расходе анода достигается при
криолитовом отношении 2,65.
Исследователи Ветюков [12] и Двинин [13] в своих работах установили
тенденцию снижения расхода анода при увеличении криолитового отношения
электролита. Так, при криолитовом отношении, равном 2,5, расход анода составил
приблизительно 460 кг/т Al.
Зависимость увеличения расхода анода при низком криолитовом отношении
объясняется тем, что образующийся газ, состоящий из СО и СО2,
собирается в пузырьки и выделяется из-под анода. Велика вероятность того, что
часть газа остается в многочисленных углублениях, имеющихся на подошве анода,
где образование пузырьков газа меньше. Наличие разрозненных газовых включений
на подошве анода приводит к неравномерному его сгоранию. Быстрее сгорают
незащищенные газом участки. Если анод хуже смачивается электролитом, то он
лучше смачивается газом. В этом случае пузырьки газа в углублениях удерживаются
и неравномерность сгорания анода усиливается. В случае хорошего смачивания
анода электролитом последний вытесняет газовые пузырьки из углублений, и анод
горит равномернее. Таким образом, увеличение криолитового отношения ведет к
уменьшению межфазного натяжения, что способствует снижению расхода углерода.
По результатам опытов, проведенных в лабораторных условиях, на
электролитической ячейке установлена зависимость снижения расхода анода при
увеличении криолитового отношения электролита, минимальное значение расхода
анода было при к.о. равным 2,65. Понижение криолитового отношения (добавка
избытка AlF3) приводит к увеличению межфазного натяжения на
границе электролит - анод, что вызывает неравномерное сгорание анода и
повышенный расход углерода.
На рис. 1.43-1.45 представлены зависимости расхода анода от содержания
добавки фторида калия в электролите
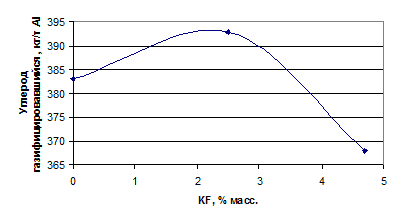
Рисунок 1.43 - График зависимости газифицировавшегося углерода от
содержания KF в электролите
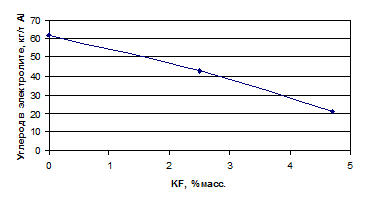
Рисунок 1.44 - График зависимости содержания углерода в электролите от
содержания KF в электролите
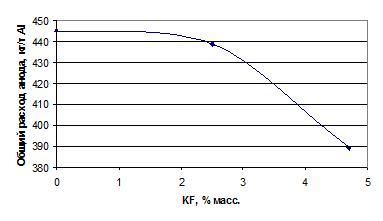
Рисунок 1.45 - График зависимости общего расхода анода от содержания KF в электролите
Наряду с этим в исследованиях в качестве добавки в электролит применялся KF. Из приведенных выше графиков видно,
что увеличение содержания добавки KF (до 4,7% масс.) в электролите приводит к снижению расхода анода. Данное
соединение не рассматривалось ранее в качестве добавки к электролиту в
исследованиях, проводимых различными авторами, возможно, потому что при
контакте с углеродом проникает в его структуру и вызывает расширение, гораздо
большее, чем при проникновении NaF,
что является очень опасным для катодных блоков электролизера.
По данным исследований с помощью регрессионного анализа (приложение Ms Excel) были получены значения коэффициентов, при
подстановке которых в уравнение, изменяя состав электролита, можно достаточно
точно спрогнозировать расход анода при проведении дальнейших лабораторных
исследований. Коэффициент множественной корреляции составил 0,91. Ошибка прогноза
составляет 10 (+/-2) кг С/т Al.
(1.25)
где Р - удельный расход углерода, кг С/т Al;
CMgF2
- содержание MgF2 в электролите, % масс.;
CKF - содержание KF в
электролите, % масс.;
CAl2O3 -
содержание Al2O3 в электролите, % масс.;
CR -
криолитовое отношение электролита.
На рис. 1.46 представлено наглядное сравнение показателей расхода
образцов анода, использовавшихся в исследованиях
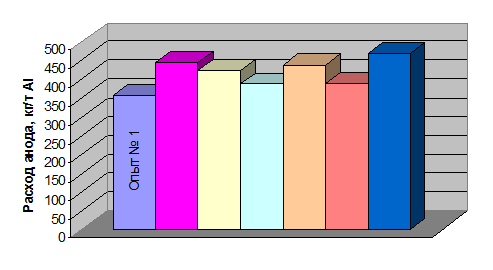
Рисунок 1.46 - Показатели расхода образцов анода по результатам
проведенных опытов
Из рис. 1.46 видно, что у образцов анода предоставленных ОАО «НЭЗ» по
сравнению с экспериментальными образцами анодов с добавлением графита
крупностью 2-4 мм, расход имеет меньшую величину. В связи с тем, что зерна
графита обладают меньшей реакционной способностью по сравнению с
коксом-связующими и коксом-наполнителем, по мере протекания эксперимента анод
выгорел на глубину зерна-наполнителя (графита), что в конце концов привело к выходу графита в пену. При визуальном
осмотре образцов анодов с добавлением графита было выявлено, что частицы
графита механически слабо связаны с телом анода, а также неравномерно
распределены в объёме анода, что также могло быть причиной повышенного
пенообразования за счет более быстрого отделения графита в электролит. В качестве
рекомендации нужно отметить то, что при изготовлении анодов было бы лучше
добавлять графит мелкой фракции. Это приведет к увеличению электропроводности.
Мелкая фракция обладает большей реакционной способностью, а значит, анод в
большей степени будет расходоваться на электрохимическую реакцию, что снизит
выход углерода в пену.
По итогам проведения экспериментов наблюдается, что образцы анодов ОАО
«НЭЗ» имеют меньший расход при протекании электролиза в различных по составу
электролитах, минимальное значение составляет 356 кг/т Al. Низкий расход для данных образцов можно объяснить как
качеством применяемого сырья (монококс, высокотемпературный пек), так и более
совершенной технологией приготовления анодов (смешение, вибропрессование,
обжиг). Также можно добавить то, что этот завод является профилирующим в
области производства углеродных изделий.
Так как аноды ОАО «НЭЗ» показали себя с лучшей стороны, то необходимо
более детальное изучение технологии производства и качества применяемого сырья
для этих анодов. Изучение применяемых составов электролитов также может
привести к снижению расхода анода при производстве алюминия.
В качестве завершения хочется добавить то, что если мы смогли в
лабораторных условиях понизить расход анода, следовательно, аналогичного результата
можно достичь и в промышленности, но для этого необходимо провести
дополнительные исследования. Но следует сделать поправку на то, что при
проведении исследований электролиз шел в атмосфере аргона, следовательно, нами
не учитывалась статья горения углерода на воздухе.
Несмотря на то, что увеличение криолитового отношения и процентного
содержания KF в электролите благоприятно
сказывается на расходе анода, то есть снижает его. Это еще не означает прямого
промышленного внедрения полученных результатов, так как при высоком криолитовом
отношении возрастают потери металла, что соответственно ведет к снижению выхода
по току; и содержание KF в
электролите приводит к набуханию катодных блоков. На настоящий момент прибыль
получаемая при работе электролизных ванн на низком КО, сполна покрывает все
остальные расходы.
2. Безопасность жизнедеятельности
Выполнение требований охраны труда и техники безопасности при проведении
научно-исследовательской работы является важнейшим фактором. Как правило,
научно-исследовательская работа связана с рядом опасных и вредных факторов:
наличием вредных веществ, электрического тока, высоких температур, теплового
излучения и т.д. При работе с оборудованием для исследований и при проведении
подготовительных операций возможны повреждения (травмы) и отравления организма.
Для предотвращения нарушений техники безопасности и охраны труда необходимо
проанализировать условия проведения исследовательской работы.
2.1 Анализ условий проведения эксперимента
2.1.1 Перечень потенциально опасных и вредных факторов
Разработка и опробование экспериментальной установки для определения
удельного расхода углерода при электролизе криолит-глиноземного расплава
проводились в лаборатории кафедры "Металлургии легких металлов и
производство глинозема". Установка собиралась из приобретаемого и
имеющегося на кафедре оборудования и материалов. В работе использовались
образцы анодов, предоставленные ОАО «САЗ» и «НЭЗ».
Расплав, в котором проводится электролиз, состоит из фторида алюминия,
фторида магния, фторида кальция, фторида натрия, фторида лития и глинозема.
В таблице 2.1 приведены опасные и вредные факторы при проведении
научно-исследовательской работы.
Таблица 2.1-Перечень опасных и вредных факторов
|
Операция технологического
процесса
|
Оборудование
|
Опасные факторы
|
Вредные факторы
|
|
|
Электроток
|
Нагретые тела
|
Тепловое излучение
|
Пыль
|
Шум
|
|
1. Приготовление
электролита
|
Аналитические весы
|
-
|
-
|
-
|
+
|
-
|
|
2. Работа экспериментальной
установки
|
Газоулавливающая линия,
печь сопротивления, электрохимическая ячейка
|
+
|
+
|
+
|
-
|
-
|
|
3. Работа вспомогательного
оборудования
|
Вытяжка, компьютер,
амперметр, газоанализаторы
|
+
|
-
|
-
|
-
|
+
|
|
4. Дожиг образца анода
|
Печь сопротивления, вытяжка
|
+
|
+
|
+
|
-
|
+
|
2.1.2 Физико-химическая и токсикологическая характеристика
веществ
Для работы были использованы следующие вещества: фториды алюминия,
кальция, лития и натрия, оксид алюминия, хлорид кальция. В ходе проведения
опытов образуются новые вещества: криолит, фторид водорода, оксид и диоксид
углерода. Рассмотрим влияние этих соединений на организм человека.
Фторид алюминия (AlF3) -
компонент электролита, представляет собой порошок белого или розоватого цвета,
содержащий около 64,5 % F.
Слабо растворим в воде, при нагревании возгоняется, не переходя в жидкое
состояние.
Фторид кальция (CaF2) -
корректирующая добавка к электролиту, бесцветное кристаллическое вещество с
содержанием 46 % F, практически
нерастворимое в воде. Изменяет состав крови, оказывает негативное воздействие
на белковые вещества в организме. При остром отравлении действует на
центральную нервную систему и желудочно-кишечный тракт; на дыхательные пути не
действует.
Фторид лития (LiF) - одна из
наиболее эффективных добавок к электролиту, снижающая температуру его
плавления. Представляет собой белый порошок, слабо растворимый в воде, содержит
около 73 % F. При длительном воздействии на
человека даже в малых концентрациях может вызвать флюороз.
Фторид натрия (NaF) -
компонент электролита. Очень гигроскопичный белый порошок и поэтому
поставляется в герметичных упаковках. Относится к ядовитым веществам, сильно
токсичен, поражает центральную нервную систему, противоплазматический яд. При
попадании в организм даже в количестве 16 мг он вызывает тошноту, а доза
>0,25 г может привести к тяжелому отравлению.
Фторид магния (MgF2) - добавка
к электролиту, представляющая собой кристаллический порошок, плохо растворимый
в воде. Токсичность MgF2 и ПДК аналогичны LiF.
Фториды натрия и алюминия образуют комплексное соединение - криолит (Na3AlF6) - один из основных компонентов электролита. По
внешнему виду - мелкокристаллический белый или сероватый порошок, комкающийся
при сжатии. Ухудшает состав крови. При попадании внутрь организма вызывает
тошноту, а при больших дозах возможно тяжелое отравление. При систематическом
вдыхании пыли криолита могут возникнуть острые или хронические заболевания
костей и зубов.
Все фториды в присутствии влаги способны гидрализоваться с образованием
фторида водорода (HF), который
сильно раздражает дыхательные пути, действует на кожу, вызывая ожоги.
Действие фторидов на организм человека характеризуется изменением в
костной системе.
Глинозем (Al2O3) - основное сырье для производства алюминия. Это
однородный, высоко абразивный мелкокристаллический порошок белого цвета, с
высокими тепло- и электроизоляционными свойствами, не растворяется в воде.
Примесями являются оксиды кремния, железа и некоторых щелочных металлов. От
продолжительности контакта с пылью глинозема возможны поражения дыхательных
путей и изменения в легких - алюминиевый пневмокониоз, фиброз и эмфизема
легких.
Диоксид углерода (СО2) - основной компонент анодных газов при
электролизе - бесцветный газ, практически без запаха с кисловатым вкусом,
тяжелее воздуха, при наличии кислорода он действует как наркотик, при
отсутствии его как удушающий газ, раздражает кожу и слизистые оболочки, в
относительно малых концентрациях возбуждает дыхательный центр, в очень больших
угнетает его. В случае острых отравлений наблюдается головная боль, шум в ушах,
сердцебиение, головокружение, обмороки, повышается кровяное давление.
Хронических заболеваний газ не вызывает.
Оксид углерода (СО) - образуется в местах, где создаются условия для
неполного сгорания углерод содержащих веществ. Это бесцветный газ, без вкуса и
почти без запаха, чрезвычайно ядовит, не обладает раздражающими свойствами, в
смеси с воздухом в определенных пропорциях может взрываться. Газ обладает
способностью вытеснять кислород из окиси гемоглобина в крови с образованием
карбоксигемоглобина, при этом кровь неспособна переносить необходимое
количество кислорода из легких к тканям, в результате чего наступает удушье.
При хроническом отравлении появляются мышечная слабость, быстрая утомляемость,
одышка, головные и невралгические боли, расстройство сна,
раздражительность.[31]
Хлорид кальция (CaCl2) - твердое
высокогигроскопичное вещество, хорошо растворимое в воде. У работающих с
препаратом возникают трещины на коже рук.[32]
В табл. 1.2 приведены предельно-допустимые концентрации веществ в воздухе
рабочей зоны, согласно ГОСТ 12.1.005-96 Общие санитарно-гигиенические
требования к воздуху рабочей зоны.
Таблица 2.2-Предельно допустимые концентрации веществ [31-33]
|
Наименование вещества
|
Величина ПДКр.з.,
мг/м3
|
|
Пыль фторида алюминия Пыль
фторида натрия Пыль криолита Фторид водорода Пыль глинозема Диоксид углерода
Оксид углерода Хлорид кальция
|
1,0 1,0 1,0 0,5 6,0 Не
предусмотрен 20 2,5
|
2.1.3 Характеристика помещения для проведения работ
Санитарно-гигиеническая характеристика
● Микроклимат
Понятие "метеорологические условия" включает: температура,
скорость движения и относительная влажность воздуха. Длительное воздействие
неблагоприятных метеорологических условий на человека приводит к ухудшению
самочувствия, снижению производительности труда.
Между организмом человека и внешней средой происходят непрерывные
процессы теплового обмена. При этом независимо от температуры окружающей среды
температура тела человека сохраняется на уровне 36,5 - 37°С. Установлено, что
предел возможности температур, при которых организм человека сохраняет
жизнеспособность, относительно невелик. Смерть наступает при повышений
температуры тела до 43°С и при падении ниже 25 - 27°С. Поэтому, температуру в
рабочем помещении необходимо поддерживать на уровне, при котором человек
чувствовал бы себя комфортно, т.е. не перегревался и не переохлаждался.
Влажность воздуха оказывает значительное влияние на теплообмен между
организмом человека и окружающей средой. Повышенная влажность является
неблагоприятным фактором, как в условиях жары, так и при низких температурах.
Подвижность воздуха усиливает теплоотдачу организма, потому что увеличивается
скорость испарения влаги с поверхности кожи человека.
Метеорологические условия воздушной среды в лаборатории приведены в табл.
1.3
Таблица 2.3-Метеорологические условия
|
Условия
|
Величина
|
Норматив
|
Оценка
|
|
Температура воздуха, оС
|
22 - 25
|
20 - 22
|
допустимо
|
|
Относительная влажность, %
|
40
|
30 - 60
|
норма
|
|
Скорость движения воздуха,
м/с
|
0,1
|
0,2
|
допустимо
|
Из таблицы видно, что помещение, в котором проводилась данная
исследовательская работа, соответствует требованиям, необходимым для
нормального проведения опытов.
● Освещение
Лаборатория представляет собой комнату площадью 28 м2.
Освещение является естественным боковым, осуществляется через два окна общей
площадью 8 м2. Высота помещения 3,2 м.
Для оценки качества естественного освещения необходимо расчетное значение
коэффициента естественной освещенности (еР) сравнить с
нормированным, определяемым с учетом характера зрительной работы, системы
освещения, района расположения здания на территории России.
Красноярск расположен во II
поясе светового климата и нормы освещенности при искусственном освещении
составляют 200 лк, а коэффициент естественного освещения составляет еIIн = 1,5 %, коэффициент светового климата m = 0,9, согласно СНиП 23-05-95 Нормы
естественного и искусственного освещения.
Нормированное значение коэффициента естественной освещенности
определяется по формуле (2.1) [34]:
(2.1)
еР при боковом освещении определяется по формуле (2.2) [34]:
(2.2)
гдеS0 - площадь световых проемов, м2; Sn - площадь пола помещения, м2;
η0 - световая характеристика световых проемов (η0 = 9 [34]); τ0 - общий коэффициент светопропускания (τ0 = 0,5 [34]); r1 - коэффициент, учитывающий влияние отражательного света при
боковом освещении (r1 = 2 [34]); кз.д -
коэффициент, учитывающий затемнение окон противостоящими зданиями (кз.д.
= 1,4 [34]); кз. - коэффициент запаса (кз. = 1,3 [34]).
ер > ен (1,74>1,35), следовательно, в
лаборатории обеспечена необходимая освещенность.
В вечернее время естественного освещения недостаточно, поэтому
дополнительно применяется искусственное освещение в виде ламп накаливания
мощностью 100 Вт.
Фактическая освещенность определяется по формуле (2.3):
(2.3)
где Е - искусственная освещенность, лк; F - мощность одной лампы, Вт; S - площадь комнаты, м2; n - коэффициент световой отдачи = 18; k - коэффициент запаса для лабораторного помещения = 1,2; N - количество ламп, шт.
Таблица 2.4-Оценка освещенности
|
Условия
|
Величина
|
Нормативы
|
Оценка
|
|
Естественное освещение, %
|
1,74
|
1,35
|
норма
|
|
Искусственное освещение, %
|
214,29
|
200
|
норма
|
Из таблицы видно, что освещение помещения позволяет выполнять
исследовательскую работу с достаточной точностью.
Противопожарная характеристика помещения
Согласно СНиП 21-01-97 Классификация зданий по степени огнестойкости,
конструктивной и функциональной пожарной опасности, лабораторное помещение, в
котором проводилась исследовательская работа, относится к категории
"Г".[35] Эта категория характеризуется как "производства,
имеющие несгораемые вещества и материалы в горячем, раскаленном или
расплавленном состоянии, процесс обработки которых сопровождается выделением
лучистой теплоты, искр и пламени".
Так как здание выполнено из несгораемого материала, то помещение
относится ко II степени огнестойкости, согласно СНиП
21-01-97. Но помещение относится к категории повышенной опасности, потому что
имеется токопроводящий железобетонный пол.
2.2 Мероприятия по защите от выявленных опасных и вредных
факторов
2.2.1 Технические и организационные мероприятия
При работе с печью опасным фактором является нагретые поверхности.
Действие этого фактора предотвращается хорошей теплоизоляцией печи. В
результате применения экранов из шамотного кирпича температура наружных
поверхностей печи не превышает 40 оС, что исключает опасность ожога
и уменьшает тепловое излучение.
При приготовлении электролита вредным фактором является пыль. Для
предотвращения загрязнения воздуха пылью в лаборатории имеется искусственная
вытяжка. Для предупреждения попадания пыли в организм человека необходимо
использовать индивидуальные средства защиты. В лаборатории имеются респираторы,
халаты, пластиковые щитки, различные держатели.
2.2.2 Электробезопасность
Поражения электрическим током возникают при прикосновении к токоведущим
элементам оборудования. Для предотвращения этого все электроприборы находятся в
изолирующих корпусах. Все металлические части электроприборов заземлены.
В лаборатории предусмотрены следующие мероприятия по защите от поражения
электрическим током:
● для подачи питания на печь применяется медный провод, помещенный
в изолирующую оболочку;
● контакты нагревателей печи с токоведущими проводами закрыто
кожухами;
● все питание отключается одним рубильником, в котором имеются
плавкие предохранители;
● предупреждающие надписи и таблички на установках.
.2.3 Противопожарные меры безопасности
Они делятся на организационные и технические. Организационные меры в себя
включают:
) противопожарный инструктаж и занятия по пожарной безопасности;
) создание комиссии, которая выявляет нарушения в лабораториях, из-за
которых могут возникнуть пожарные ситуации.
Технические мероприятия заключаются в использовании средств тушения
пожаров. Всем известно, что применять воду для тушения электроустановок
категорически запрещается. Поэтому в лабораториях, где имеются такие установки,
обязательно должны быть в наличии огнетушители типа ОУ-2, в которых рабочим
веществом является двуокись углерода.
В лаборатории, также, имеются пожарные щиты, снабженные необходимым
инвентарем, песок, расположенный в специальных ящиках. Кроме того, в
лаборатории установлены специальные датчики, реагирующие на значительное
повышение температуры.
3. Смета затрат на проведение научно-исследовательской работы
3.1 Экономическое обоснование научно-исследовательской работы
Испытание образцов анодных блоков на разработанной экспериментальной
установке дает возможность оценить удельный расход углерода в зависимости от
состава электролита. Таким образом, мы можем с помощью лабораторного
исследования без существенных затрат узнать, как изменение состава электролита
скажется на общем расходе анода.
Исследование на данном комплексе достаточно большого количества
электролитов различного состава, изменяющегося в большом интервале, дает
возможность в дальнейшем вывести математическое уравнение для расчета удельного
расхода обожженного анода. Это уравнение позволит прогнозировать эффективность
или убытки при использования электролитов с различным содержанием
корректирующих добавок.
Исследование удельного расхода углерода на экспериментальной установке
позволяют определить меру влияния различных свойств электролита на расход
обожженного анода, исходя из этого, мы будем знать какие добавки к электролиту
способствуют уменьшению удельного расхода анода.
Стоит отметить, что доля стоимости анодов в себестоимости алюминия
составляет, в зависимости от стоимости сырья, 15-17%, а иногда и более.
Повышение расхода анода на 1 кг С/т Al приводит к увеличению стоимости производства алюминия примерно на 2US$/т Al.[36] Если рассмотреть типичное зарубежное предприятие,
производящее 250000 т Al/год,
то дополнительные затраты составят 500000 US$/год.[36] Все это свидетельствует о высокой эффективности
проведения данной научной работы для прогнозирования влияния состава
электролита на экономику работы алюминиевых электролизеров.
3.2 Сетевая модель научно-исследовательской работы
Одним из методов планирования является сетевое планирование. При
разработке различных научно-исследовательских работ, строительстве и
реконструкции цехов, проведении ремонтных работ и т.д. возникает необходимость
планирования, координации и сочетания действий для достижения поставленных
целей в заданные сроки. Процесс управления значительно облегчается, если
управляемую систему представить в виде модели. К таким моделям относятся сетевые
графики, которые являются графическим отображением плана.
Основными элементами сетевого графика являются работа, событие, путь.
Система сетевого планирования основана на графическом изображении, в виде
сетевой модели, определенного комплекса работ. Для составления сетевой модели
необходимо проследить последовательность работ при выполнении дипломной работы
(см. табл. 3.1).
Таблица 3.1-Перечень работ при разработке экспериментальной установки
|
Код Работ
|
Наименование работы
|
Код события
|
Наименование события
|
tmin
|
tmax
|
tож
|
σ2tож
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
1-2
|
Получение задания
|
2
|
Задание получено
|
1
|
1
|
1
|
0
|
|
2-3
|
Ознакомление с предстоящей
работой и составление плана
|
3
|
Ознакомились с работой и
составили план
|
1
|
1
|
1
|
0
|
|
3-4
|
Составление сетевой модели
|
4
|
Модель составлена
|
1
|
2
|
1,4
|
0,03
|
|
4-5
|
Прохождение инструктажа по
ТБ и изучение лаборатории
|
5
|
Инструктаж пройден,
лаборатория изучена
|
1
|
1
|
1
|
0
|
|
5-6
|
Разработка проекта
установки
|
6
|
Проект готов
|
2
|
3
|
2,4
|
0,03
|
|
6-7
|
Изучение и подбор
литературы
|
7
|
Литература подобрана
|
20
|
22
|
20,8
|
0,11
|
|
7-8
|
Оформление раздела
”Литературный обзор”
|
8
|
Оформление закончено
|
12
|
15
|
13,2
|
0,11
|
|
8-9
|
Оформление раздела ”БЖД”
|
9
|
Раздел оформлен
|
4
|
6
|
4,8
|
0,11
|
|
9-10
|
Оформление раздела
”Экономическая часть”
|
10
|
Раздел оформлен
|
5
|
9
|
6,6
|
0,44
|
|
6-11
|
Освобождение места в лаборатории
под установку
|
11
|
Место под установку в
лаборатории освобождено
|
2
|
3
|
2,4
|
0,03
|
|
11-12
|
Сборка газовой линии
|
12
|
Газовая линия собрана
|
24
|
27
|
25,2
|
0,25
|
|
12-13
|
Сборка электрохимической
ячейки
|
13
|
Ячейка собрана
|
5
|
7
|
5,8
|
0,11
|
|
11-14
|
Сборка печи
|
14
|
Печь собрана
|
20
|
23
|
21,2
|
0,25
|
|
14-15
|
Сборка шкафа управления
|
15
|
Шкаф собран
|
7
|
9
|
7,8
|
0,11
|
|
13-16
|
Полная сборка установки
|
16
|
Установка собрана
|
4
|
6
|
4,8
|
0,11
|
|
16-17
|
Оформление раздела
”Экспериментальная часть”
|
17
|
Оформление закончено
|
4
|
8
|
5,6
|
0,44
|
|
17-18
|
Проведение эксперимента по
исследованию удельного расхода углерода
|
18
|
Эксперимент закончен
|
7
|
10
|
8,2
|
0,25
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
18-19
|
Обработка и анализ
полученных данных
|
19
|
Данные обработаны
|
6
|
8
|
6,8
|
0,11
|
|
19-20
|
Оформление пояснительной
записки
|
20
|
Записка оформлена
|
8
|
12
|
9,6
|
0,44
|
|
20-21
|
Оформление графической
части
|
21
|
Графическая часть оформлена
|
6
|
8
|
6,8
|
0,11
|
|
21-22
|
Подготовка к защите
|
22
|
Подготовка завершена
|
6
|
8
|
6,8
|
0,11
|
|
22-23
|
Защита дипломной работы
|
23
|
Дипломная работа защищена
|
1
|
1
|
1
|
0
|
В этой таблице:
tmin и tmax - продолжительность работы при наиболее благоприятных и
неблагоприятных условиях соответственно, дней;
tож - предположительное (ожидаемое)
время выполнения работы, определяется по формуле:
tож = (3∙ tmin + 2∙ tmax)/5;(3.1)
- σtож - среднеквадратическое отклонение, определяется по формуле:
σtож = ( tmax - tmin)/6;(3.2)
- σ2tож - дисперсия, характеризует меру разброса точек ожидаемого
времени вдоль кривой, определяется по формуле:
σ2tож = [( tmax - tmin)/6]2.(3.3)
На основании таблицы 1 составляем сетевую модель, рисунок 1. Из сетевой
модели видно, что в перечень работ по разработке установки для определения
удельного расхода углерода в зависимости от состава электролита, входит
фиктивное время. Фиктивное время означает, что без совершения предыдущего
события не может быть сделано следующее событие.
Из сетевой модели определяем возможные пути совершения работы:
τ1 = (1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20,
21, 22, 23) = 66,8 дня;
τ2 = (1, 2, 3, 4, 5, 6, 11, 12, 13, 16,
17, 18, 19, 20, 21, 22, 23) = 89,8 дня;
τ3 = (1, 2, 3, 4, 5, 6, 11, 14, 15, 16,
17, 18, 19, 20, 21, 22, 23) = 83 дня;
τкритическое =
τ2 = 89,8 дня.
Аргумент нормальной функции распределения вероятностей для критического
пути определяется по формуле:
(3.4)
где
τд - директивный
срок выполнения работы, дней; τк - ожидаемый срок свершения события, дней; n -
число работ критического пути; σ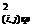 -
дисперсия работы (i, j), лежащей на критическом пути.
-
дисперсия работы (i, j), лежащей на критическом пути.
Используя таблицу значений функции нормального распределения, определяем
вероятность совершения завершающего события в заданный срок (90 дней): Р(х)
= 0,532.
Так как Р(х) больше 0,35, но меньше 0,65, то данный сетевой
график не требует оптимизации [37].
Таблица 3.2-Расчет параметров сетевого графика [38]
|
Код работ
|
Продолжительность, tij, дней
|
Раннее начало, tр.н.
|
Раннее окончание, tр.о.
|
Позднее начало, tп.н.
|
Позднее окончание, tп.о.
|
Полный резерв времени, Rn(i,j)
|
Частный резерв времени, rij
|
|
1-2
|
1
|
0
|
1
|
0
|
1
|
0
|
0
|
|
2-3
|
1
|
1
|
2
|
1
|
2
|
0
|
0
|
|
3-4
|
1,4
|
2
|
3,4
|
2
|
3,4
|
0
|
0
|
|
4-5
|
1
|
3,4
|
4,4
|
3,4
|
4,4
|
0
|
0
|
|
5-6
|
2,4
|
4,4
|
6,8
|
4,4
|
6,8
|
0
|
0
|
|
6-7
|
20,8
|
6,8
|
27,6
|
29,8
|
50,6
|
23
|
0
|
|
6-11
|
2,4
|
6,8
|
9,2
|
6,8
|
9,2
|
0
|
0
|
|
7-8
|
13,2
|
27,6
|
40,8
|
50,6
|
63,8
|
23
|
0
|
|
8-9
|
4,8
|
40,8
|
45,6
|
63,8
|
68,6
|
23
|
0
|
|
9-10
|
6,6
|
45,6
|
52,2
|
68,6
|
75,2
|
23
|
0
|
|
10-20
|
0
|
52,2
|
52,2
|
75,2
|
75,2
|
23
|
23
|
|
11-12
|
25,2
|
9,2
|
34,4
|
9,2
|
34,4
|
0
|
0
|
|
11-14
|
21,2
|
9,2
|
30,4
|
16
|
37,2
|
6,8
|
0
|
|
12-13
|
5,8
|
34,4
|
40,2
|
34,4
|
40,2
|
0
|
0
|
|
13-16
|
4,8
|
40,2
|
45
|
40,2
|
45
|
0
|
0
|
|
14-15
|
7,8
|
30,4
|
38,2
|
37,2
|
45
|
6,8
|
0
|
|
15-16
|
0
|
38,2
|
45
|
45
|
6,8
|
6,8
|
|
16-17
|
5,6
|
45
|
50,6
|
45
|
50,6
|
0
|
0
|
|
17-18
|
8,2
|
50,6
|
58,8
|
50,6
|
58,8
|
0
|
0
|
|
18-19
|
6,8
|
58,8
|
65,6
|
58,8
|
65,6
|
0
|
0
|
|
19-20
|
9,6
|
65,6
|
75,2
|
65,6
|
75,2
|
0
|
0
|
|
20-21
|
6,8
|
75,2
|
82
|
75,2
|
82
|
0
|
0
|
|
21-22
|
6,8
|
82
|
88,8
|
82
|
88,8
|
0
|
0
|
|
22-23
|
1
|
88,8
|
89,8
|
88,8
|
89,8
|
0
|
0
|
3.3 Смета затрат
Смета затрат составляется по следующим статьям:
. Стоимость материалов.
. Стоимость оборудования.
. Заработная плата исполнителей.
. Отчисления на социальное страхование.
. Амортизация основного оборудования.
. Стоимость электроэнергии.
. Накладные расходы.
3.3.1 Стоимость оборудования и материалов
К оборудованию отнесем приборы, из которых была сконструирована
экспериментальная установка, а к материалам - реактивы и изделия для проведения
опытов на данной установке. Стоимость оборудования и материалов приведена в
табл. 3.3 и 3.4.
Таблица 3.3-Стоимость материалов
|
Материал
|
Количество
|
Цена
|
Стоимость, руб.
|
|
Хлорид кадмия
|
1 кг
|
60 руб./кг
|
60
|
|
Фторид натрия
|
4 кг
|
80 руб./кг
|
320
|
|
Фторид алюминия
|
3 кг
|
85 руб./кг
|
255
|
|
Фторид лития
|
1 кг
|
90 руб./кг
|
90
|
|
Фторид кальция
|
1 кг
|
65 руб./кг
|
65
|
|
Фторид магния
|
1 кг
|
70 руб./кг
|
70
|
|
Глинозем
|
2 кг
|
15 руб./кг
|
30
|
|
Мастика жаростойкая
|
5 кг
|
97 руб./уп.
|
97
|
|
Кирпич шамотный
|
40 шт.
|
30 руб./шт.
|
1200
|
|
Сталь листовая
|
50 кг
|
70 руб./кг
|
3500
|
|
Вата минеральная
|
4 шт.
|
150 руб./шт.
|
600
|
|
Трубки кварцевые
|
5 кг
|
960 руб./кг
|
4800
|
|
Трубки резиновые
|
1,5 кг
|
126 руб./кг
|
189
|
|
Трубки алундовые
|
2,5кг
|
480 руб./кг
|
1200
|
|
Пробки резиновые
|
25 шт.
|
20 руб./шт.
|
500
|
|
Сверла алмазные
|
8 шт.
|
55,5 руб./шт.
|
444
|
|
Стакан алундовый
|
18 шт.
|
800 руб./шт.
|
14400
|
|
Стакан графитовый
|
9 шт.
|
1000 руб./шт.
|
9000
|
|
Стакан стальной
|
9 шт.
|
150 руб./шт.
|
1350
|
|
Колба
|
2 шт.
|
160 руб./шт.
|
320
|
|
Проволока для изготовления
термопар
|
54 м
|
20 руб./м
|
1080
|
|
ИТОГО:
|
|
|
38583
|
Таблица 3.4-Стоимость оборудования
|
Материал
|
Количество
|
Цена
|
Стоимость, руб.
|
|
Амперметр
|
1 шт.
|
1000 руб./шт.
|
1000
|
|
Манометр
|
1 шт.
|
1000 руб./шт.
|
1000
|
|
Термометр электронный
|
1 шт.
|
1500 руб./шт.
|
1500
|
|
ИТОГО:
|
|
|
3500
|
3.3.2 Заработная плата исполнителей
Заработанную плату основных исполнителей определяем в зависимости от
времени занятости по теме и зарплаты (стипендии). К основным исполнителям
относятся научный руководитель, консультанты по экономике и безопасности
жизнедеятельности, ассистент научного руководителя, специалист по
конструированию печей и дипломник. При этом время консультаций руководителя
дипломной работы принимаем равным 20 ч, консультантов по экономической части и
охране труда - 4 ч, ассистента научного руководителя - 108 ч. Годовой фонд
времени работы руководителя и консультантов равен 1540 ч. Таким образом,
величину затрат на заработную плату руководителя и консультантов рассчитывают
по формуле:
(3.5)
где Змес - зарплата руководителя, консультантов в месяц, руб.;
Тк - время консультирования, ч.
Тогда заработная плата составит:
· научного руководителя:
· консультанта по экономике:
· консультанта по охране труда:
· лаборанта кафедры МЛМиПГ за четыре месяца::
· аспиранта кафедры МЛМиПГ за четыре месяца:
· стипендия дипломника за четыре месяца:
Общая заработная плата задействованного персонала составит:
3.3.3 Отчисления на социальное страхование
Отчисления на социальное страхование составляют 26,2 % от общего фонда
заработной платы:
3.3.4 Амортизация оборудования
Оборудование стоимостью менее 10 тыс. рублей амортизации не подлежит.
Таблица 3.5-Амортизация оборудования
|
Наименование оборудования
|
Количество
|
Стоимость, руб./шт.
|
Норма амортизации, %
|
Общая сумма, руб.
|
|
Печь сопротивления
|
1
|
35000
|
6
|
1458
|
|
Компьютер
|
1
|
12000
|
10
|
300
|
|
Газоанализатор КЕДР-М 32
(СО)
|
1
|
50000
|
7
|
1785
|
|
Газоанализатор КЕДР-М 30
(СО2)
|
1
|
50000
|
7
|
1785
|
|
Блок управления с
регулятором „МИНИТЕРМ 400.31”
|
1
|
35000
|
7
|
1250
|
|
Регулятор расхода газа „El-Flow”
|
1
|
100000
|
7
|
4166
|
|
Источник тока
|
1
|
25000
|
7
|
893
|
|
Вытяжка
|
1
|
20000
|
10
|
500
|
|
ИТОГО:
|
|
|
|
12137
|
.3.5 Энергетические затраты
Стоимость затраченной электроэнергии определяется по формуле:
(3.6)
где Ц - цена за один кВт электроэнергии, руб.; n - количество используемого оборудования; N - мощность оборудования, кВт; τ
- время работы
оборудования, ч; Км - коэффициент использования оборудования по
мощности.[39]
Тогда стоимость электроэнергии на технологические цели составит:
· для печи сопротивления под электрохимическую ячейку:
· для регулятора расхода газа:
· для источника тока:
· для газоанализаторов:
· для компьютера:
Общая стоимость затраченной электроэнергии составит:
.3.6 Накладные расходы
Накладные расходы составляют 25% от общих затрат:
3.3.7 Составление сметы затрат
Таблица 3.6-Смета затрат на проведение научной работы
|
Элементы затрат
|
Сумма, руб.
|
|
1. Материалы
|
38583
|
|
2. Не амортизируемое
оборудование
|
3500
|
|
3. Технологическая
электроэнергия
|
889,9
|
|
4. Заработная плата
исполнителей
|
49015,01
|
|
5. Единый социальный налог
|
12841,93
|
|
6. Амортизация оборудования
|
12137
|
|
7. Накладные расходы
|
29241,71
|
|
ИТОГО
|
146208,6
|
Таким образом, можно отметить, что исследование влияние состава
электролита на удельный расход анода на экспериментальной установке дает
возможность подобрать оптимальный состав электролита, при котором расход анода
будет минимальным.
В данном разделе была построена сетевая модель графическим способом, а
также представлен расчет в виде таблицы, в которой отражены продолжительность
выполнения работ, полный и частный резервы времени. Критическое время
выполнения научно-исследовательской работы составило 90 дней. Суммарные
затраты, в которых отражены стоимость материалов и оборудования, необходимых
для выполнения работы, заработная плата исполнителей и другие расходы
составляют 146208,6 рублей.
При использовании полученных данных на промышленных электролизерах можно
улучшить технико-экономические показатели электролиза, а также снизить
себестоимость товарного алюминия, но для этого необходимы дополнительные
научные исследования и сведения о технико-экономических показателях данного
объекта.
Список используемой литературы
1. Хьюм Ш.М. Реакционная способность анода. Второе издание / Пер. с англ.
проф. Полякова П.В. - Красноярск: Изд-во “Кларетианум”, 2003.-460с.
2. G.I. Houston
and Oye, Trondheim, Consumption of carbon.- Light Metals. 1985.-р.
435-453.
3. Поляков П.В., Савинов В.И., Бузунов В.Ю., Соколов А.Е. Пена в
алюминиевом электролизере.- ТЭВ БрАЗа, 2001,№ 3,-с. 24-28.
. Колодин Э.А., Свердлин В.А., Свобода Р.В. Производство обожженных
анодов алюминиевых электролизеров. - М.: Металлургия, 1980. - 84 с.
5. Свердлин
В. А., Янко Э. А. Аноды алюминиевых электролизеров. Цветная металлургия. 1991. №7. - с. 28-32.
.
Anodes for the aluminum industry. R&D Carbon Ltd. A. O. Box 157, Sierre,
Switzerland, 1995. - р. 395.
7. Никитин В.
Я. Отчет ВАМИ, - Л.: ВАМИ, 1978. - 241 с.
. Заливной В.
И. Исследование влияния серы в анодной массе на процесс электролитического
получения алюминия. - Л.: Наука, 1981. - 32 с.
9.
Rhedey P. Light Metals. 1986. - р. 569-574.
10. Привалов
В. Е., Степаненко М. А. Каменноугольный пек. - М.: Металлургия, 1981. - 208 с.
11.
Hollinshed E.A, Braunwarth V.A. Extractive Metallurgy of Aluminium, v. 2, 1962,
- p. 25-28.
12. Ветюков M.M., Щербаков В.А. - Известия ВУЗов. Цветная металлургия. 1966,
№ 4, - с. 43-46.
. Двинин
Ю.И., Койнов П.А., Кузнецов С.И., Щербаков В.А. - Известия ВУЗов. Цветная
металлургия, 1973, №2, - с. 93-97.
. Ветюков
М.М., Исламова Р.Г., Чувиляев Р.Г. Расход углерода при электролитическом
получении алюминия. - Известия ВУЗов. Цветная металлургия, 1962, №3. - с.
80-88.
. Ведерников
Г.Ф., Ветюков М.М. Исследование взаимосвязи между окисляемостью и
электрохимическим поведением анода при электролитическом получении алюминия. -
Известия ВУЗов. Цветная металлургия, 1966, 9(6). - с. 63-67.
.
Barat P., Brault Т., Saget J. New hypothesis
on electrolysis mechanisms. - Light Metals, 1974, Vol. 1. - p. 19-36.
17. Ветюков
М.М., Ведерников Г.Ф. Исследование расхода анода и анодного перенапряжения при
электролитическом получении алюминия. - Труды ЛПИ, 1970, №340. - с. 45-50.
. Янко Э. А.
Аноды алюминиевых электролизеров. - M.: Издательский дом «Руда и металлы», 2001. - 670 с.
19.
Hume S.M. Anode Reactivity. Influence on Raw Material properties. R&D
Carbon LTD. Sierre, Switzerland, 1993. - p. 687-692.
. Ветюков М.М., Исламова Р.Г., Чувиляев Р.Г. Расход
углерода при электролитическом получении алюминия. - Известия ВУЗов. Цветная
металлургия. 1962, №3. - с. 80-88.
. Ревазян А.
Расход анодного углерода в промышленном алюминиевом электролизёре. - Цветные
металлы, 1960, №3. - с. 58.
. Смородинов
А.Н., Коробов М.А. Взаимосвязь между расходом анодной массы и геометрическими
размерами алюминиевых электролизеров. - Цветные металлы, 1970, № 9. - с.27-31.
23.
Hollingshead, E. A., Braunwarth, V. A., Laboratory investigation of carbon
anode consumption in the electrolytic production of aluminium, Extractive
Metallurgy of Aluminium, Vol. 2, 31 - 50. Ed. G. Gerard. Interscience, 1963.
.
Hollingshead, E. A. and Rhedey, P., Laboratory evaluation of binders for carbon
anodes, International Meeting on Anode Problems in Aluminium Electrolysis.
.
Muftogly, T., Thonstad, J. and Oye, H. A., A laboratory study of the anode
carbon consumption during aluminium electrolysis, Light metals, 1986, - p. 557.
.
Muftogly, T. and Oye, H. A., Reactivity and electrolytic consumption of anode
carbon with various additives, Light metals, 1987, - p. 471.
.
Kuang Z., Thonstad J. T. Effect of baking temperature and anode current density
on anode carbon consumption. Light metals, - p. 667.
.
Hives J., Rolseth S., Gudbrandsen H. Carbon consumption and current efficiency
studies in a laboratory aluminium cell using the oxygen balance method. Light
metals, 2000, - p. 385.
.
Welch B.J. Sulphur and fluorine containing anode gases produced during normal
electrolysis and approaching an anode effect. Light metals, 1996, - p. 311.
.
Mark M., Dorreen R. Current efficiency studies in a laboratory aluminium cell
using the oxygen balance method. Light Metals,
1998, - p. 483.
. Деев П. З.
Техника безопасности в производстве алюминия. - М.: Металлургия, 1978. - 239 с.
. Лазарева
Н.В., Гадаскиной И.Д. Вредные вещества в промышленности. Справочник для
химиков, инженеров и врачей. Изд. седьмое пер. и доп. В трех томах. Том третий.
Неорганические и элементоорганические соединения. Л.: Химия, 1977. - 608 с.
. ГОСТ
12.1.005 - 96 Общие санитарно-гигиенические требования к воздуху рабочей зоны.
- Введ. 1997-07-01. - М.: изд-во стандартов, 1997. IV, 23 с.
. Богданова
Э. В., Степанов А. Г., Зернова Т. Н. Безопасность жизнедеятельности в дипломном
проектировании: Методические указания по выполнению раздела «Безопасность
жизнедеятельности в дипломных проектах для студентов металлургических
специальностей очной и заочной форм обучения». КИЦМ, - Красноярск, 1994, - 32
с.
. Белов С.В.,
Ильницкая А.В., Козьяков А.Ф. и др. Безопасность жизнедеятельности. Учебник для
вузов. Под общ. ред. Белова С.В. - М.: Высш. шк., 1999. - 448 с.: ил.
36.
Keller F., Mannweiler U., Knall E.. Constructing and operating anode plants:
what top management needs to know. Anodes for the aluminium industry.
. Цецаркина
С. И. Расчет вероятностного сетевого графика и его оптимизация: Методические
указания по курсу «Организация, планирование и управление предприятием».
Красноярск: КИЦМ. 1989. - 28 с.
. Цецаркина
С.И. Расчет детерминированного сетевого графика. Красноярск: КИЦМ. 1989. - 44
с.
. Мандричко
Т.М., Смирнов М.А. Организация и планирование металлургических цехов в цветной
металлургии: Методические указания к дипломному и курсовому проектированию.
Красноярск: ГАЦМиЗ. 2002. - 48 с.