Строение и основные свойства ароматических гетероциклов
Государственное
образовательное учреждение
высшего
профессионального образования
«Челябинский
Государственный Университет»
Кафедра
химической технологии и вычислительной химии
Реферат
на
тему:
«Строение
и основные свойства ароматических гетероциклов»
Выполнила:
студентка группы Х-403
Аскарова Жанна
Челябинск,
2011
Гетероциклическими называют соединения с
замкнутой цепью, содержащей, помимо атомов углерода, атомы других элементов.
Любой атом, способный образовать, по крайней мере, две ковалентные связи, может
участвовать в образовании кольца. Элементы, которые участвуют вместе с
углеродом в образовании цикла, называют гетероатомами. Наиболее хорошо
изученными и широко распространенными являются циклические соединения
кислорода, серы и азота.
Гетероциклы могут содержать три, четыре, пять,
шесть и большее число атомов в цикле. Также как и карбоциклические соединения,
пяти и шестичленные гетероциклы наиболее устойчивы. Число возможных
гетероциклических систем очень велико за счет большого числа вариантов
взаимного расположения гетероатомов в цикле и существованию гетероциклов с
конденсированными ядрами.
Гетероциклические соединения широко
распространены в природе - это витамины, алкалоиды, пигменты, компоненты ДНК и
РНК, ферментов и многие другие.
Ароматические гетероциклы представляют собой
плоские циклические системы, содержащие вместо одного или нескольких атомов
углерода атомы кислорода, серы, азота. Ароматическими их называют вследствие
того, что они удовлетворяют всем критериям, присущим любой ароматической
системе, а именно:
• система является циклической;
• цикл является плоским;
• имеется сопряжение по всему циклу, то есть
возможность беспрепятственной делокализации любого из p-электронов по всей
системе, благодаря наличию негибридизованных р-орбиталей;
• число делокализованных p-электронов,
участвующих в сопряжении, отвечает, согласно правилу Хюккеля, проявлению
ароматических свойств, а именно, равно 4n+2, где n - любое натуральное число,
включая 0.
Среди ароматических гетероциклических соединений
наиболее широко распространены и, соответственно, представляют наибольший
интерес 5- и 6-членные гетероциклы, имеющие в своем составе азот, серу и
кислород, а также эти же системы, конденсированные с бензольным кольцом.
К простейшим пятичленным ароматическим
гетероциклам с одним гетероатомом относятся фуран тиофен и пиррол:
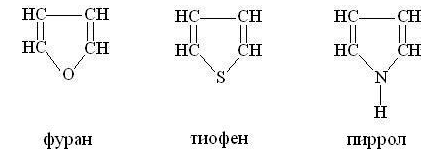
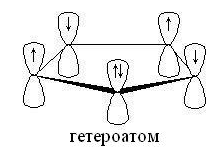
В их молекулах шесть p-электронов (четыре
электрона двух -связей и два электрона гетероатома, не затраченных на
образование связей) образуют кольцевую сопряженную систему. Так как цикл
плоский, то выполняется правило Хюккеля и соединение приобретает ароматический
характер. На рисунке показано расположение p-орбиталей в молекулах этих
гетероциклов:
Реакционная способность
гетероциклический атом углерод
нуклеофильность
Особенности реакционной способности
гетероциклических соединений по сравнению с их карбоциклическими аналогами
обуславливаются именно такими гетерозаместителями. В качестве гетероатомов чаще
всего выступают элементы второго периода (N, O) и S, реже - Se, P, Si и др.
элементы. Как и в случае карбоциклических соединений, наиболее специфические
свойства гетероциклических соединений проявляют ароматические гетероциклические
соединения (гетероароматические соединения). В отличие от атомов углерода
карбоциклических ароматических соединений, гетероатомы могут отдавать в
ароматическую систему не только один (гетероатомы пиридинового типа), но и два
(гетероатомы пиррольного типа) электрона. Гетероатомы пиррольного типа обычно
входят в состав пятичленных циклов (пиррол, фуран, тиофен). В одном гетероцикле
могут сочетаться оба типа гетероатомов (имидазол, оксазол). Особенности
реакционной способности гетероароматических соединений определяются распределением
электронной плотнности в цикле, которая, в свою очередь, зависит от типов
гетероатомов и их электроотрицательности.
Нуклеофильность
Так, для пятичленных гетероциклов с одним
гетероатомом (пиррольный тип), ароматический секстет электронов распределяется
по пяти атомам цикла как, что ведёт к высокой нуклеофильности этих соединений.
Для них характерны реакции электрофильного замещения, они весьма легко
протонируются по пиридиновому азоту (предпочтительно, см. далее) или углероду
цикла, галогенируются и сульфируются в мягких условиях. Реакционная способность
при электрофильном замещении убывает в ряду пиррол > фуран > селенофен
> тиофен > бензол.
Введение гетероатомов пиридинового типа в
пятичленные гетероциклы ведёт к снижению электронной плотности, нуклеофильности,
и, соответственно, реакционной способности в реакциях электрофильного
замещения, то есть эффект аналогичен влиянию электроноакцепторных заместителей
для производных бензола. Азолы реагируют с электрофилами подобно пирролам с
одним или несколькими электроноакцепторными заместителями в кольце, а для
оксазолов и тиазолов становится возможным лишь при наличии активирующих
заместителей с +M-эффектом (амино- и гидроксигруппы).
Для шестичленных гетероциклов (пиридиновый тип)
пониженная по сравнению с бензолом электронная плотность ведёт с пониженной
нуклеофильности этих соединений: реакции электрофильного замещения идут в
жёстких условиях. Так, пиридин сульфируется олеумом при 220-270 °C.
Нуклеофильность гетероатомов
Для азотсодержащих гетероциклических соединений
с азотом пиридинового типа п-электронная плотность максимальна именно на атоме
азота. В качестве иллюстрации можно привести расчётную п-электронную плотность
для пиридина:
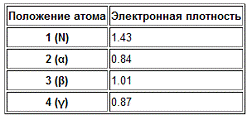
Соответственно, атаки электрофилов в этом случае
направляются на пиридиновый атом азота. В качестве электрофилов могут выступать
разнообразные алкилирующие и ацилирующие агенты (реакция кватернизиции с
образованием соответствующих четвертичных солей) и пероксикислоты (с
образованием N-оксидов).
Атом азота пиррольного типа значительно менее
нуклеофилен - алкилирование N-замещенных имидазолов идёт преимущественно по
азоту пиридинового типа, однако, при депротонировании незамещённого пиррольного
азота направление замещения обращается. Так, 4-нитроимидазол при метилировании
в нейтральных условиях даёт в основном 1-метил-5-нитроимидазол, а в щелочных
растворах (где субстратом является его депротонированная форма) главным
продуктом реакции оказывается 1-метил-4-нитроимидазол.
Такое повышение нуклеофильности азота
пиррольного типа при депротонировании типично для всех гетероароматических
соединений, однако направление атаки электрофила зависит от степени диссоциации
образующегося аниона: если индолил- и пирролилмагнийгалогениды щелочных металлов
реагируют в основном по атому азота. Подтверждением влияния диссоциации
комплекса N-анион - металл на направление реакции является обращения
направления электрофильной атаки при реакции индолилмагнийгалогенидов с
метилйодидом в ГМФТА вследствие промотируемой растворителем диссоциации
магниевого комплекса.
Электрофильность
Электрофильность гетероароматических соединений
растёт при падении п-электронной плотности, то есть при увеличении числа
гетероатомов и, при их равном числе, выше для шестичленных, по сравнению с
пятичленными, гетероциклами. Так, для пирролов и индолов реакции нуклеофильного
замещения атипичны, пиридин и бензимидазол аминируются амидом натрия, а
1,3,5-триазин быстро гидролизуется до формиата аммония уже в водном растворе.
Реакционная способность заместителей
и боковых цепей
Реакционная способность неароматических
гетероциклических близка к таковой их ациклических аналогов с поправкой на
стерические эффекты.
В случае гетероароматических соединений на
реакционную способность боковых цепей существенно влияют мезомерные эффекты.
Кислотность метиленовых водородов в 2- и 4-замещённых пиридинах существенно
повышена: так, альдольная конденсация 2-метилпиридина (α-пиколина)
с формальдегидом с образованием 2-этоксиэтил-2-пиридина с последующей его
дегидратацией служит промышленным методом синтеза 2-винилпиридина. Этот
раздел не завершён.
Номенклатура
В химии гетероциклические соединения в силу
исторических причин широко применяются тривиальные названия; так, например, при
именовании пяти- и шестичленных соединений, содержащих 1 или 2 гетероатома N, O
или S в подавляющем большинстве случаев используются тривиальные названия.
Систематическая номенклатура гетероциклических
соединений строится по правилам, предложенным Ганчем и Видманом
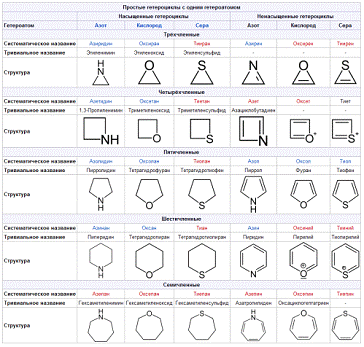
Гетероциклические соединения
Общие физические и химические свойства
Фуран, тиофен и пиррол - бесцветные жидкости,
практически нерастворимые в воде. Температура их кипения значительно выше, чем
у соответствующих им по числу углеродных атомов соединений жирного ряда -
эфиров, сульфидов и аминов, а дипольные моменты ниже.
Химические свойства пятичленных гетероциклов
определяются присутствием двойных связей, ароматического цикла и гетероатомов.
Для фурана, тиофена и пиррола характерны следующие реакции:
) кислотно-основные превращения с участием
гетероатома
) реакции присоединения
) реакции замещения
) реакции расширения цикла
) реакции замены гетероатома
Кислотно-основные превращения
Кислотно-основные превращения гетероциклов
определяют возможность и условия проведения всех других реакций с их участием.
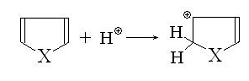
В кислой среде фуран и пиррол легко
протонируются в -положение, утрачивая при этом ароматичность вследстивии
разрушения сопряженной системы:
Образующийся карбкатион обладает несколькими
резонансными структурами:
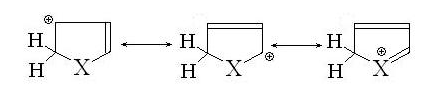
В результате происходит или разрыв цикла, или
полимеризация образовавшегося замещенного диена.
Фуран расщепляется концентрированной серной
кислотой, хлоридом алюминия уже на хололу, с другими минеральными кислотами при
нагревании. С разбавленной соляной кислотой фуран образует бурый осадок. С
метанолом, насыщенным НСI, он образует ацеталь янтарного альдегида:
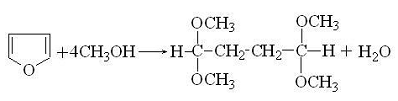
Так же реагирует с концентрированными кислотами
и пиррол, образуя окрашенный полимер.
Фуран и пиррол, как и многие их производные,
проявляют ацидофобные свойства. Это резко ограничивает возможность проведения
различных реакций. Тиофен в отличие от фурана и пиррола в кислой среде не
утрачивает ароматических свойств.
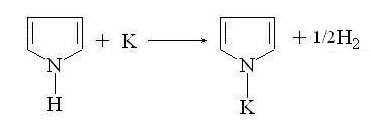
Фуран и тиофен устойчивы к действию щелочей и
щелочных металлов. Пиррол является очень слабой кислотой, более слабой, чем
фенол. Он реагирует с калием с выделением водород и образованием соли пиррола -
пирролкалия:
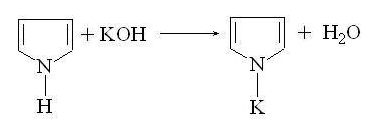
Пирролкалий может быть получен сплавлением
пиррола с КОН:
Реакции пятичленных гетероциклов
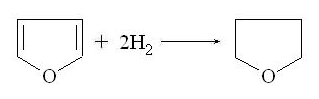
Присоединение водорода к тиофену происходит при
0,2-0,4 МПа и комнатной температуре в присутствии палладиевого катализатора с
образованием тетрагидротиофена (тиофана):
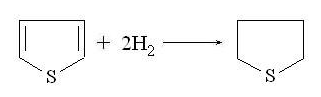
Гидрирование тиофена на никелевом катализаторе
приводит к образованию н-бутана (десульфирование):
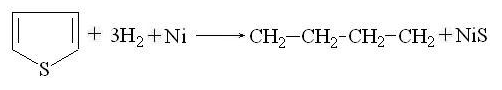
Пиррол, в отличии от фурана и тиофена, пиррол
можно прогидрировать водородом в момент выделения, например при действии цинка
и уксусной кислоты. При этом реакция протекает как 1,4-присоединение к диенам,
водород присоединяется в 2,5-положения пиррола и образуется пирролин -
2,5-дигидропиррол:
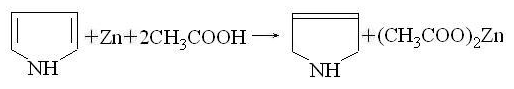
При гидрировании пиррола на платиновом
катализаторе образуется пирролидин:
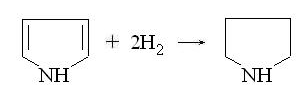
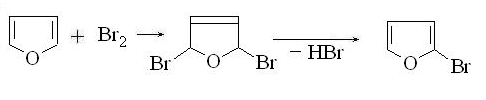
2. Присоединение галогенов. При низкой
температуре галогены присоединяются к фурану в 2,5-положения. Продукты
присоединения легко теряют молекулу галогенводорода и переходят в
2-галогенфураны:
. Диеновый синтез. Фуран вступает в реакцию
диенового синтеза как обычный диен. Например, реакция с диенофилом - малеиновым
ангидридом:
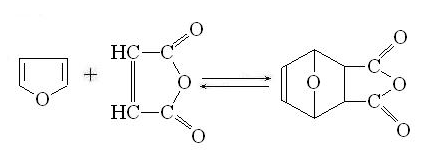
Пиррол в этих условиях образует продукт
присоединения по двойной С-С связи малеинового ангидрида:
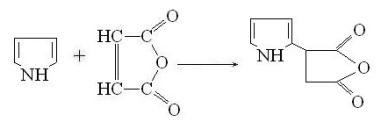
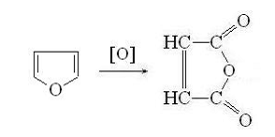
. Окисление. В условиях, исключающих раскрытие
кольца, в нейтральной или слабощелочной среде, фуран окисляется в малеиновый
ангидрид:
пиррол - в имид малеиновой кислоты:
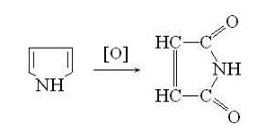
Тиофен окисляется значительно труднее.
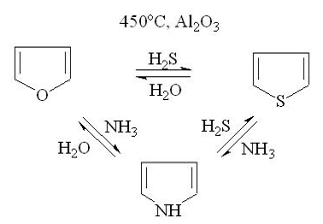
. Замещение гетероатома. Фуран, тиофен и пиррол
могут переходить друг в друга (реакция Юрьева). Реакция протекает с небольшими
выходами при 450оС, катализатор - оксид алюминия:
. Озонолиз. Фуран и пиррол легко подвергаются
озонолизу, образуя при этом глиоксаль:
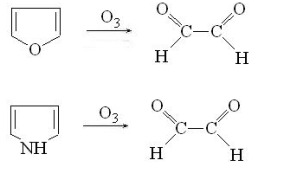
Реакции электрофильного замещения в
фуране, тиофене и пирроле
Фуран, тиофен и пиррол вступают в характерные
для ароматических соединений реакции электрофильного замещения легче, чем
бензол. Замещение во всех случаях происходит в первую очередь в - положение и
только если это положение занято - в -положение. Мета-ориентирующие группы,
такие, как нитро-, карбонильная, сульфогруппа, находящиеся в одном из
-положений, не препятствуют вхождению следующего заместителя во второе
-положение. Если оба - положения заняты, замещение происходит в одно издвух
-положеннй в зависимости от характера заместителей в -положении.
При выборе условий для проведения реакций
электрофильного замещения необходимо учитывать ацидофобность фурана и пиррола.
При введении в фурановое или пиррольное кольцо электроноакцепторных
заместителей ацидофобные свойства значительно ослабляются и такие соединения
можно вводить в реакции электрофильного замещения в обычных условиях. Это
относится, например, к фуран- и пирролкарбоновым кислотам, карбонильным
соединениям и т. д.
. Галогенирование. Галогенирование фурана,
тиофена и пиррола приводит сначала к образованию 2-, затем 2,5-замещенных.
Возможно замещение и всех атомов водорода. Хлорирование обычно осуществляется с
помощью хлористого сульфурила, бромирование - комплексом брома с диоксаном.
. Нитрование. Нитрование азотной кислотой
возможно только для тиофена в мягких условиях. В случае фурана и пиррола
нитрование проводят ацетилнитратом при низкой температуре, например:
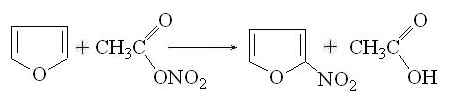
. Сульфирование. Тиофен легко сульфируется
серной кислотой, легче, чем бензол. Фуран и пиррол можно сульфировать
комплексом SO3 с пиридином в пиридине.
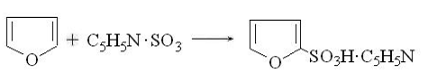
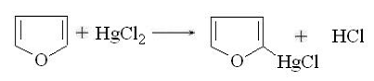
. Реакции с хлорной ртутью. Для всех пятичленных
гетероциклов характерна реакция с HgCl2 с замещением водорода в -положении,
например:
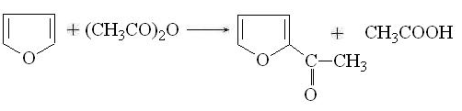
. Ацилирование. Ацилирование фурана в пиррола
осуществляется ангидридами кислот под влиянием мягко действующих катализаторов,
например, хлорида цинка или хлорида олова (IV). Ацилирование тиофена возможно
не только ангидридами, но и хлорангидридами кислот в присутствии хлорида
алюминия. Во всех случаях замещение идет -положение:
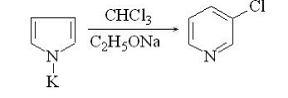
. Расширение цикла. Для пятичленных гетероциклов
значительно легче, чем в ароматическом ряду, идут реакции с расширением цикла.
Пиррольное кольцо превращается в пиридиновое кольцо при реакции пирролкалия с
хлороформом в присутствии этилата натрия.
Биологическое значение
Гетероциклические соединения широко
распространены в живой природе и играют важное значение в химии природных
соединений и биохимии. Функции, выполняемые этими соединениями весьма широки -
от структурообразующих полимеров (производные целлюлозы и других циклических
полисахаридов) до коферментов и алкалоидов.
Производство и применение
Некоторые гетероциклические соединения получают
из каменноугольной смолы (пиридин, хинолин, акридин и пр.) и при переработке
растительного сырья (фурфурол). Многие природные и синтетические
гетероциклические соединения - ценные красители (индиго), лекарственные
вещества (хинин, морфин, акрихин, пирамидон).