Характеристика процесса смачивания
Оглавление
Введение
. Общая характеристика процесса
смачивания
.1 Основной закон смачивания
.2 Адгезия, когезия и теплота
смачивания
.3 Измерение краевого угла
.Влияние различных факторов на
процесс смачивания. Гистерезис смачивания
.1 Влияние шероховатости на процесс
смачивания
.2 Влияние гетерогенности на процесс
смачивания
.Влияние смачивания на промышленные
и природные процессы
.Управление смачиванием
.Поверхностно-активные вещества
(ПАВ). Общие сведения о ПАВ
. Классификация ПАВ
.1 Анионактивные ПАВ
.2 Катионактивные ПАВ
.3 Неионогенные ПАВ
.4 Амфотерные (амфолитные) ПАВ
.Влияние ПАВ на смачивание. Эффекты
обогащения и обеднения области вблизи линии смачивания поверхностно-активными
веществами
Заключение
Список использованной литературы
Введение
Смачивание очень широко распространено в
природе, технике, сельском хозяйстве, повседневном быту и играет важную, а
иногда определяющую роль в протекании многих природных и технологических
процессов. Для оптимального управления такими процессами необходимо выяснение
законов смачивания.
Первые научные исследования и наблюдения,
связанные с анализом смачивания, относятся, по-видимому, к XVII веку: в 1665
году Гук в своей книге «Микрография» описал некоторые капиллярные явления. В
частности, Гук обнаружил, что вода протекает через маленькие отверстия только
под действием дополнительного давления, а расплавленный свинец образует
шарообразные капли. В 1718 году был установлен первый количественный закон в
области капиллярных явлений: Жюрен экспериментально показал, что высота подъема
смачивающей жидкости в капиллярной трубке обратно пропорциональна ее диаметру.
Отсюда следует, что произведение высоты подъема данной жидкости на диаметр
капилляра представляет постоянную величину (капиллярная постоянная). В течение
долгого времени капиллярную постоянную использовали очень широко для описания
различных поверхностных явлений, например, ее применял Д. И. Менделеев для
определения критической температуры.
Экспериментальное изучение капиллярного подъема
выявило связь между смачиванием стенок капиллярной трубки и формой поверхности
жидкости в капилляре: при смачивании образуется вогнутый мениск, а в отсутствие
смачивания - выпуклый мениск. Эти наблюдения стимулировали изучение формы
поверхности жидкости вблизи поверхности твердого тела. В середине XVIII века
Сег-нер описал форму капли несмачивающей жидкости на горизонтальной твердой
поверхности.
Важнейший шаг в теоретическом изучении
смачивания был сделан в 1804 году. Юнг показал, что форма капли на твердой
поверхности определяется соотношением сил молекулярного притяжения между
молекулами жидкости и твердого тела и взаимным притяжением молекул жидкости.
Вместе с тем Юнг ввел фундаментальное для явления смачивания представление о
краевом угле как количественной характеристике смачивания. Юнг показал, что
равновесный краевой угол представляет постоянную величину для каждой данной
системы твердое тело - жидкость - среда и вывел уравнение для расчета краевого
угла.
Почти одновременно с Юнгом (в 1805 году) Лаплас
развил общую теорию капиллярных явлений и вывел уравнение для расчета кривизны
поверхности жидкости в капиллярах. Лаплас показал, что это искривление,
которое, в свою очередь, зависит от характера смачивания твердой поверхности, и
создает дополнительное давление, вызывающее подъем смачивающей жидкости в
капилляре. Работы Юнга и Лапласа являются классическими в учении о смачивании и
широко используются и в наши дни. В основе этих работ лежит использование
принципов механики и гидростатики. Важные результаты в этом направлении получили
Гаусс и Пуассон (первая половина XIX века).
Новый этап в изучении смачивания, как и других
поверхностных явлений, связан с развитием термодинамики. В 1878 году Гиббс
вывел уравнение, которое устанавливает зависимость равновесного краевого угла
от поверхностных натяжений на границах раздела фаз, участвующих в смачивании.
Это соотношение получил ранее Юнг, но термодинамический метод дал более строгое
и общее обоснование этого закона. Вместе с тем термодинамический подход выявил
многие принципиальные пути управления смачиванием, и в первую очередь -
использование адсорбции на поверхностях раздела фаз.
Следующий этап исследований смачивания,
продолжающийся и поныне, можно охарактеризовать как физико-химический. В начале
XX века Гурвич и Лэнгмюр экспериментально показали огромное влияние адсорбции
поверхностно-активных веществ на смачивание.
В 30-х годах ряд принципиально важных
результатов получил академик П. А. Ребиндер. Он выявил влияние многих факторов
на проявление гистерезиса смачивания и предложил классификацию основных форм
гистерезиса. П. А. Ребиндер ввел в химию представления об избирательном
смачивании твердых тел жидкостями различной полярности, что позволило с помощью
измерения краевых углов в условиях избирательного смачивания или сравнения теплот
смачивания полярной и неполярной жидкостями классифицировать поверхности
твердых тел как гидрофильные и гидрофобные. Ребиндер установил правило
уравнивания полярностей, на основе которого можно прогнозировать адсорбцию
веществ на границах раздела фаз и ориентацию молекул в адсорбционных монослоях.
Эти работы положили начало научному обоснованию использования
поверхностно-активных веществ для управления смачиванием, что получило широкое
промышленное применение в промышленных процессах (во флотации, в очистке
материалов от загрязнений, технологии моющего действия и т. д.). [3]
1. Общая характеристика процесса смачивания
Смачивание - поверхностное явление
<#"518753.files/image001.gif"> <#"518753.files/image002.gif"> между касательной АВ к искривленной
поверхности жидкости и смоченной поверхностью АА (рис.2).
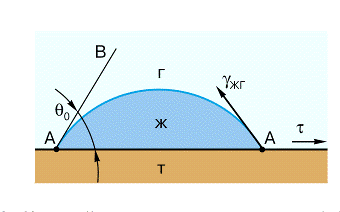
рис.2. Краевой угол  капли
жидкости (ж) на твердой поверхности (т), третья фаза - газ(г)
капли
жидкости (ж) на твердой поверхности (т), третья фаза - газ(г)
Граничный контур (периметр основания
капли) называется линией трехфазного контакта (ЛТК). Этот термин подчеркивает,
что в смачивании участвуют три фазы 1) твердое тело, 2) смачивающая жидкость,
3)фаза -“предшественник” , которая находилась в контакте с твердой поверхностью
до подвода жидкости. Далее будет рассматриваться случай газовой фазы. Однако
это может быть и другая жидкость, которая не смешивается с первой.
Центральное положение теории
Юнга-Лапласа: краевой угол определяется конкуренцией двух сил, действующих на
ЛТК. Одна сила - это притяжение молекул жидкости к ближайшим молекулам жидкости
на поверхности капли. В расчете на единицу длины ЛТК это сила поверхностного
натяжения жидкости 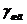 ( в мН/м).
( в мН/м).
Другая сила создается притяжением
тех же молекул ЛТК к ближайшим молекулам на поверхности твердое тело-газ. Эта
сила направлена вдоль поверхности твердого тела во внешнюю сторону от ЛТК. Юнг
назвал ее силой адгезии 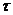 ( в мН/м) (adhesion-прилипание).
Равновесный краевой угол
( в мН/м) (adhesion-прилипание).
Равновесный краевой угол  0 находят из
условия механического равновесия на ЛТК.
0 находят из
условия механического равновесия на ЛТК.
Фундаментальный закон смачивания в
формулировке Юнга имеет вид
 0=
0=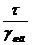 , (1)
, (1)
По словам Максвелла, “методы
рассуждения Юнга всегда корректны и весьма изящны, но очень затруднительны
из-за педантичного игнорирования математических символов”.
В более общей форме равновесный
краевой угол определяется термодинамически (Гиббс, 1878 год) из условия
минимальности свободной поверхностной энергии Fn трехфазной
системы твердое тело-жидкость-газ. В случае капли:
=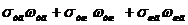 , (2)
, (2)
где  ( в м2 )-площади контакта фаз
твердое тело-газ, твердое тело-жидкость, жидкость - газ,
( в м2 )-площади контакта фаз
твердое тело-газ, твердое тело-жидкость, жидкость - газ, 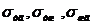 ( в мДж/м2
)-удельные свободные энергии этих поверхностей. Для жидкостей численные
значения поверхностного натяжения и поверхностной энергии совпадают, то есть |
( в мДж/м2
)-удельные свободные энергии этих поверхностей. Для жидкостей численные
значения поверхностного натяжения и поверхностной энергии совпадают, то есть |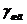 |=|
|=| жг|.
жг|.
Из условия Fn = min следует
сos 0 = (
0 = ( тг -
тг -  тж)/
тж)/  жг, (3)
жг, (3)
Это уравнение представляет
современную формулировку основного закона смачивания.[3]
Измеряя величину угла  0, оценивают
лиофильность и лиофобность поверхностей по отношению к различным жидкостям.
Различают три случая контактного взаимодействия жидкостей с поверхностью
твердых тел: 1) несмачивание, когда 90° <
0, оценивают
лиофильность и лиофобность поверхностей по отношению к различным жидкостям.
Различают три случая контактного взаимодействия жидкостей с поверхностью
твердых тел: 1) несмачивание, когда 90° < 0 < 180° (например, ртуть на
стекле, вода на парафине): 2) ограниченное смачивание, когда 0° <
0 < 180° (например, ртуть на
стекле, вода на парафине): 2) ограниченное смачивание, когда 0° <  0 < 90°
(например, вода на оксидах металлов); 3) полное смачивание, когда капля
растекается в тонкую пленку (ртуть на свинце). В первом случае поверхность по
отношению к данной жидкости лиофобна (от греч. -
0 < 90°
(например, вода на оксидах металлов); 3) полное смачивание, когда капля
растекается в тонкую пленку (ртуть на свинце). В первом случае поверхность по
отношению к данной жидкости лиофобна (от греч. - 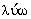 +
+ 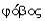 - страх - боящаяся растворения), а
во втором - лиофильна (от греч. -
- страх - боящаяся растворения), а
во втором - лиофильна (от греч. - 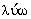 - разбираю на части +
- разбираю на части + 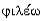 - люблю -
любящая растворение).
- люблю -
любящая растворение).
.2 Адгезия, когезия и теплота
смачивания
Явления смачивания и растекания
тесно связаны с действие сил когезии и адгезии.
Когезия (от лат. cohaesus -
связанный, сцепленный) - сцепление частей одного и того же однородного тела
(жидкого или твердого). Обусловлена химической связью между составляющими тело
частицами (атомами, ионами) и межмолекулярным взаимодействием.
Адгезия (прилипание) - это
молекулярное притяжение между поверхностями двух соприкасающихся разнородных
твердых или жидких фаз. Адгезия является причиной склеивания двух разных
веществ за счет действия физических или химических межмолекулярных сил.
Количественно когезию и адгезию
характерезуют величиной работы когезии
Wк и работы адгезии Wа.
Работа адгезии равна работе, которую
необходимо затратить для удаления жидкости с единицы поверхности твердого тела,
и определяется по формуле:
=  тг +
тг + жг -
жг - тж (уравнение Дюпре) (4)
тж (уравнение Дюпре) (4)
Работа когезии определяется по
формуле:
Wk= 2 ж (5)
ж (5)
Уравнение Дюпре самостоятельно почти
не используется для расчета работы адгезии из-за трудности определения
поверхностного натяжения твердых тел на границе с газом (воздухом) и жидкостью.
Удобную для расчета этой величины форму имеет соотношение, получаемое в
результате сочетания уравнения Дюпре с законом Юнга. Если разность  жг -
жг - тж в
уравнении Дюпре заменить ее выражением из закона Юнга
тж в
уравнении Дюпре заменить ее выражением из закона Юнга  жг -
жг - тж =
тж = тг cos
тг cos 
Получим Wa= тг +
тг + тг cos
тг cos  =
= тг (1+cos
тг (1+cos  ) илиа /
) илиа / тг = l+ сos
тг = l+ сos  (6)
(6)
Уравнение (6) называют уравнением
Дюпре - Юнга; оно связывает работу адгезии с краевым углом и позволяет
рассчитать работу адгезии, если известны поверхностное натяжение жидкости и краевой
угол. Обе эти величины можно сравнительно легко определить экспериментально.
[3]
Из уравнения (6) четко видно
различие между явлениями адгезии и смачивания. Разделив обе части уравнения на
2, получим:
Wа/Wк=(1+ cos )/2 (7)
)/2 (7)
Так как смачивание количественно
характеризуется косинусом краевого угла, то в соответствии с уравнением (7) оно
определяется отношением работы адгезии к работе когезии для смачивающей
жидкости.
Принципиальное различие между
поверхностными явлениями адгезии и смачивания состоит в том, что смачивание
имеет место при наличии трех сопряженных фаз.
Из уравнения (7) можно сделать
следующие выводы: 1) при = 0 cos=l, Wа=1/2WK,т.е. работа адгезии равна работе
когезии смачивающей жидкости; 2) при =90° cos = 0, Wа=Wк, т.е. работа адгезии в
два раза меньше работы коге-зии смачивающей жидкости; 3) при =1800 cos=-1, Wа =
0, такое состояние на практике не реализуется, поскольку некоторая адгезия
всегда существует, поэтому полного несмачивания в реальных системах также быть
не может. Например, одно из самых больших значений краевого угла при смачивании
водой наблюдается на поверхности фторопласта, соответственно для этой системы
характерна и наименьшая адгезия. Учитывая, что краевой угол равен 108, = 72,0
мДж/м2(при 25°С), из уравнения (6) получим работу адгезии, равную 50,3 мДж/м2
(cos 108° = -0,31).
Большое практическое значение имеет
информация, которую дают уравнение (7). Из него следует, что для увеличения
смачивания надо увеличить работу адгезии или уменьшить работу когезии
(поверхностное натяжение) жидкости, например, введением ПАВ, изменением
температуры. Лучше смачивает та жидкость, которая имеет меньшее поверхностное
натяжение или работу когезии. Органические жидкости характеризуются низкими
поверхностными натяжениями и поэтому смачивают большинство поверхностей разной
природы. Так, углеводороды, для которых =17-28 мДж/м2, смачивают почти все
известные твердые тела. Вода смачивает только полярные вещества, а ртуть плохо
смачивает или не смачивает большинство (особенно неметаллических) тел.
Адгезия в значительной степени
определяется природой функциональных групп молекул контактирующих веществ.
Например, близкие значения работы адгезии к воде имеют соединения с одинаковыми
функциональными группами (в двухфазных системах жидкость - жидкость),
изовалериановая (94,6 мДж/м) и гептиловая (94,8 мДж/м2) кислоты, бензол, толуол
(66,6 мДж/м2). Это свидетельствует об ориентировании молекул в поверхностном
слое при адгезии. На границе раздела фаз в сторону воды обращены гидрофильные
группы указанных соединений, и они почти полностью обеспечивают адгезию к воде.
Разность между работой адгезии к воде и работой когезии контактирующей с ней
жидкости может служить мерой полярности и гидрофильности последней. Например,
для неполярных гексана и толуола эта разность соответственно равна 3,3 и 6,8
мДж/м2, а для таких полярных соединений, как октиловый спирт и гептиловая
кислота, соответственно 36,8 н 38,2 мДж/м2.
Поскольку смачивание сопровождается
уменьшением поверхностной энергии, в процессе смачивания выделяется тепло.
Тепловой эффект, сопровождающий соприкосновение
<#"518753.files/image002.gif">н ( или наступающим краевым углом).
Возможен и другой порядок измерений.
Сначала образец помещают в жидкость, то есть принудительно смачивают всю
твердую поверхность, потом к пластинке подводят пузырек газа. Под его действием
жидкость оттекает(отступает) с ранее смоченной поверхности. Поэтому угол,
измеренный в момент начала течения жидкости, называется углом оттекания  от ( или
отступающим углом). Обычно
от ( или
отступающим углом). Обычно  н>
н> от . Последнее явление можно
наблюдать, когда капли дождя стекают по оконному стеклу, при этом капли как бы
задерживаются и снизу образуют гораздо больший краевой угол, чем сверху.
Различие краевых углов при натекании и оттекании называется порядковым
гистерезисом. Термин “порядковый” подчеркивает важность последовательности
контакта поверхности твердого тела с двумя другими фазами, участвующими в
смачивании
от . Последнее явление можно
наблюдать, когда капли дождя стекают по оконному стеклу, при этом капли как бы
задерживаются и снизу образуют гораздо больший краевой угол, чем сверху.
Различие краевых углов при натекании и оттекании называется порядковым
гистерезисом. Термин “порядковый” подчеркивает важность последовательности
контакта поверхности твердого тела с двумя другими фазами, участвующими в
смачивании
Первые исследования порядкового
гистерезиса выполнил в 30-х годах академик П.А. Ребиндер. Он предложил первое
объяснение причин его возникновения. Суть идеи - на ЛТК помимо адгезионного
притяжения и поверхностного натяжения действует третья сила 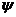 (в мН/м),
сходная с трением. Тем самым мениску в непосредственной близости от ЛТК
приписываются механические свойства твердого тела.
(в мН/м),
сходная с трением. Тем самым мениску в непосредственной близости от ЛТК
приписываются механические свойства твердого тела.
При натекании на сухую поверхность
сопротивление может иметь одно значение (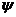 н ), при оттекании с ранее смоченной
площади - другое (
н ), при оттекании с ранее смоченной
площади - другое (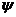 от ). Обычно
от ). Обычно
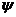 н>
н>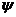 от.
от.
С учетом силы трения условие
механического равновесия на ЛТК принимает вид
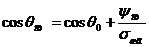 .
.
Опыты В.С.Веселовского и В.Н.Перцова
(1936 год) установили, что 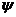 включает статическое трение(его
надо преодолеть для начала движения ЛТК) и динамическое трение при скольжении
ЛТК. Динамическое сопротивление на 25-30% меньше статического. Сила трения
возникает при перемещении ЛТК перпендикулярно самой ЛТК и составляет несколько
мН/м. При движении вдоль ЛТК
включает статическое трение(его
надо преодолеть для начала движения ЛТК) и динамическое трение при скольжении
ЛТК. Динамическое сопротивление на 25-30% меньше статического. Сила трения
возникает при перемещении ЛТК перпендикулярно самой ЛТК и составляет несколько
мН/м. При движении вдоль ЛТК 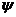 =0.
=0.
Ребиндер указал главные источники силы трения на
ЛТК- шероховатость и гетерогенность твердой поверхности. Эти представления
стали основой теории порядкового гистерезиса. [1]
2.Влияние различных факторов на процесс смачивания.
Гистерезис смачивания
.1 Влияние шероховатости на процесс смачивания
При выводе закона смачивания поверхность
твердого тела считается идеально гладкой. На самом деле реальные поверхности
имеют достаточно сложный микрорельеф с выступами и впадинами различной формы и
размера. Шероховатость влияет на кравевые углы по двум причинам. Одна из них -
термодинамическая. Неровности увеличивают реальную поверхность по сравнению с
идеально гладкой. Отношение этих площадей называется коэффициентом шероховатости
К (К>1). Вторая причина - кинетическая. Поясним ее на простом элементе
шероховатости -канавке с сечением в форме равнобедренного треугольника глубиной
z. (рис.3)
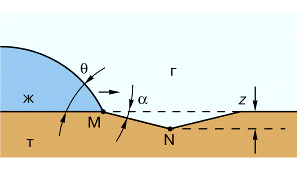
рис.3 Остановка контура растекающейся капли (ж)
у излома MN на твердой
поверхности (т)
Влияние канавки зависит от ее ориентации по
отношению к направлению растекания. Вдоль канавки жидкость растекается
беспрепятственно, при перпендикулярной ориентации канавка может остановить
процесс растекания.
Пусть жидкость натекает на твердую
поверхность в направлении х (рис.3). Термодинамическое условие
самопроизвольного растекания заключается в том, что свободная поверхностная
энергия Fн должна
уменьшаться: dFн / dx<0. Этому
соответствует неперерывное уменьшение краевого угла капли: 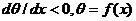 - так
называемый динамический краевой угол. Для гладкой поверхности это условие
выполняется на всем пути. При наличии излома ситуация осложняется, так как при
затекании жидкости в канавку ее поверхность увеличивается сильнее, чем при
перемещении ЛТК по гладкой поверхности (пунктир на рис.). Сила поверхностного
натяжения действует по отношению к новому направлению растекания MN под углом (
- так
называемый динамический краевой угол. Для гладкой поверхности это условие
выполняется на всем пути. При наличии излома ситуация осложняется, так как при
затекании жидкости в канавку ее поверхность увеличивается сильнее, чем при
перемещении ЛТК по гладкой поверхности (пунктир на рис.). Сила поверхностного
натяжения действует по отношению к новому направлению растекания MN под углом ( -
-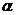 ). Используя
закон (3), можно найти условие перетекания:
). Используя
закон (3), можно найти условие перетекания:  >(
>( 0+
0+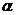 ). При
). При  <(
<( 0+
0+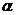 ) канавка
представляет барьер, перейти который ЛТК может только при внешних воздействиях
(например, при вибрациях) или при достаточно сильных флуктуациях вблизи ЛТК.
) канавка
представляет барьер, перейти который ЛТК может только при внешних воздействиях
(например, при вибрациях) или при достаточно сильных флуктуациях вблизи ЛТК.
Отсюда краевой угол натекания:
 н=
н= 0+
0+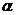 (10)
(10)
Аналогичным способом найдем, что при
оттекании
 от =
от = 0 -
0 -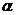 (11)
(11)
Эта простая схема качественно
объясняет влияние шероховатости. Переход к реальной твердой поверхности очень
сложен. Поэтому следующий шаг теории гистерезиса заключался в изучении
смачивания поверхностей с регулярным микрорельефом. Основные модели - система
параллельных канавок, сетка взаимно перпендикулярных канавок, концентрично
расположенные канавки и выступы синусоидального профиля. Приближенные формулы
показывают, что гистерезисные углы зависят не только от термодинамических
параметров в уравнении (3), но и от нескольких других. Наиболее важные из них-
высота гребней и глубина впадин, наклон шероховатостей (угол 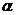 ),
расстояние между элементами шероховатости, объем капли.
),
расстояние между элементами шероховатости, объем капли.
Другой подход - анализ растекания по
поверхности со случайным распределением шероховатостей. Теория строится на
модели малых флуктуаций (Де Жен, 1985 год). Шероховатости рассматриваются как
флуктуации относительно “нулевого” уровня - идеально гладкой поверхности. Этот
метод позволяет решить несколько важных задач. Одна из них - расчет
энергетического барьера, при поперечном движении ЛТК. Предполагается, что
шероховатости искривляют ЛТК, а степень искривления описывается законом
упругости Гука.
Результаты расчетов подтвердили
сильное влияние профиля шероховатостей и их размеров. Существенно, что гладкие
неровности могут задерживать ЛТК, если их размер z>zкр.
Приближенно zкр
оценивается в несколько микрометров. Поэтому при гладком рельефе гистерезис
могут вызвать только достаточно крупные неровности. Однако изломы даже очень
малых размеров могут вызвать остановку ЛТК и порядковый гистерезис. Дляних
более важный параметр - крутизна излома (угол 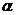 на рис.3).
на рис.3).
Недавно был сделан новый
принципиальный шаг. Для расчета гистерезиса краевых углов были использованы
методы фрактальной геометрии. Уже первые результаты оказались весьма
перспективными, так как углы натекания и оттекания удается представить в
функции одного параметра - фрактальной размерности поверхности твердого тела.
[1]
.2 Влияние гетерогенности на процесс
смачивания
Гетерогенные (неоднородные) твердые
поверхности состоят из участков с различной поверхностной энергией  тг. Гетерогенность
вызывают две причины- различия в кристаллической структуре и химическом
составе.
тг. Гетерогенность
вызывают две причины- различия в кристаллической структуре и химическом
составе.
Структурные неоднородности
характерны для поликристаллических материалов. Поверхностный слой содержит
много мелких зерен (монокристаллов), произвольно ориентированных по отношению
друг к другу. Поэтому наружная поверхность представляет хаотическую мозаику
различных кристаллографических граней с разными значениями поверхностных
энергий  тг и
тг и  тж.
тж.
Химическая неоднородность
поверхности присуща композитам и многофазным сплавам. Теория смачивания
гетерогенных поверхностей разработана для бинарной подложки, состоящей из
участков двух типов I и II. Их
поверхностные энергии обозначим  тг' ,
тг' , тж' и
тж' и  тг '' ,
тг '' , тж'' ; доли
участков I и II обозначим
тж'' ; доли
участков I и II обозначим 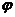 1 и
1 и 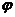 2 (
2 (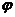 1+
1+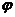 1=1). Для
очень малых неоднородностей (меньше 10 нм) в закон Юнга(3) можно вводить
усредненные значения энергий
1=1). Для
очень малых неоднородностей (меньше 10 нм) в закон Юнга(3) можно вводить
усредненные значения энергий  тг и
тг и  тж, которые рассчитываются из
аддитивных вкладов участков I и II:
тж, которые рассчитываются из
аддитивных вкладов участков I и II:
 тг =
тг = 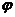 1
1 тг' +
тг' + 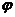 2
2 тг'' ,(12)
тг'' ,(12)
 тж =
тж = 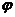 1
1 тж' +
тж' + 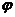 2
2 тж'' .
тж'' .
После подстановки в (3) получаем
уравнение равновесного угла  для бинарной твердой поверхности:
для бинарной твердой поверхности:
cos =
= 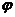 1 cos
1 cos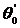 +
+ 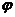 2cos
2cos 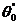 , (13)
, (13)
где 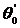 и
и 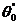 - равновесные углы данной жидкости
на однородных поверхностях I и II.
- равновесные углы данной жидкости
на однородных поверхностях I и II.
При большом размере участков I и II (начиная
примерно с 0,1 мкм) они вызывают гистерезис краевых углов и уравнение (13) для
них неприменимо. Поясним это положение на следующей модели. Пусть бинарная
поверхность - это набор параллельных длинных полос одинаковой ширины,
расположенных перпендикулярно направлению растекания. Пусть материал I
\смачивается данной жидкостью лучше, чем материал II (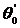 <
<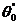 ).
Конкретный пример -полоски парафина на стеклянной пластине в контакте с водой.
).
Конкретный пример -полоски парафина на стеклянной пластине в контакте с водой.
При растекании по такой поверхности ЛТК
должна совершать переходы с одной полосы на другую. При указанных условиях
переход границы в направлении II→I
термодинамически возможен при любом значении динамического краевого угла  >
>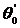 . Перекание
жидкости через границу в обратном направлении I→ II возможно
только при условии
. Перекание
жидкости через границу в обратном направлении I→ II возможно
только при условии 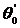 >
>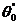 . Если же
. Если же  <
<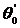 , растекание
прекращается и на ЛТК возникает метастабильное равновесие с краевым углом
, растекание
прекращается и на ЛТК возникает метастабильное равновесие с краевым углом  н=
н=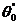 .
.
При отекании жидкости с поверхности,
включающей серию параллельных полос, метастабильное равновесие на ЛТК
достигается при пересечении границы в направлении II→I, поэтому  от>
от>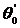 . Таким
образом, кинетические причины приводят к гистерезису краевых углов натекания и
оттекания.
. Таким
образом, кинетические причины приводят к гистерезису краевых углов натекания и
оттекания.
Реальные поверхности гораздо
сложнее, и для них необходимо учитывать дополнительные факторы. Во-первых, это
взаимное расположение отдельных “островков”. Например, если “островки” плохо
смачиваемого материала II расположены в среднем далеко
друг от друга, жидкость может беспрепятственно протекать между ними и угол
натекания
 н можно оценить по уравнению (13).
Во-вторых, высота энергетического барьера на границе участков зависит от их
ширины y. Если
полосы достаточно узки (y<a), то
флуктуации могут обеспечить переброс жидкости через полосу II на
отдельных узких участках ЛТК. Здесь
н можно оценить по уравнению (13).
Во-вторых, высота энергетического барьера на границе участков зависит от их
ширины y. Если
полосы достаточно узки (y<a), то
флуктуации могут обеспечить переброс жидкости через полосу II на
отдельных узких участках ЛТК. Здесь 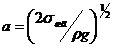 - капиллярная длина жидкости,
- капиллярная длина жидкости, 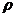 - ее
плотность, g - ускорение
свободного падения. Для воды а=3,8 мм.
- ее
плотность, g - ускорение
свободного падения. Для воды а=3,8 мм.
Для расчета высоты барьеров и
краевых углов натекания и оттекания на неоднородных поверхностях используются
варианты регулярной гетерогенности: параллельные полоски двух типов,
концентричное расположение колец, хаотическое расположение квадратов и др.
В качестве примера на рис. 4
приведены результаты расчетов краевых углов для модели концентричных колец
(Р.Джонсон, Р. Деттр, 1964 год).

рис.4 Расчетные зависимости краевых
углов натекания(1) и отекания(3) от доли 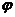 1 хорошо смачиваемых участков(
кривая 2 рассчитана по уравнению(13))
1 хорошо смачиваемых участков(
кривая 2 рассчитана по уравнению(13))
При этом было принято 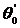 =0º (полное
смачивание),
=0º (полное
смачивание), 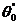 =120º (как при
контакте воды с тефлоном). Углы натекания
=120º (как при
контакте воды с тефлоном). Углы натекания  н (кривая 1) начинают резко расти в
области малых вкраплений плохо смачиваемого материала. Поэтому
н (кривая 1) начинают резко расти в
области малых вкраплений плохо смачиваемого материала. Поэтому  н →
н → 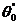 .Напротив,
краевые углы оттекания
.Напротив,
краевые углы оттекания  от
чувствительны к вкраплению смачиваемых островков 1 и
от
чувствительны к вкраплению смачиваемых островков 1 и  от→
от→ 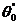 .
Зависимость краевых углов от площадей участков I и II типа
представляет типичную гистерезисную петлю.
.
Зависимость краевых углов от площадей участков I и II типа
представляет типичную гистерезисную петлю.
Высокая чувствительность краевых
углов к примесям требует очень тщательной очистки твердой поверхности.
Например, малейшее загрязнение золота и платины органическими веществами
препятствует их смачиванию водой (чистая поверхность этих металлов смачивается
водой полностью). Вместе с тем сильная зависимость краевых углов от состава
позволяет использовать их измерения для исследования поверхности твердых тел.
Сейчас этот метод успешно применяется во многих экспериментальных исследованиях
(например, в материаловедении). Часто измерения краевых углов ведут к цели
быстрее, чем некоторые другие методы. [1]
3.Влияние смачивания на промышленные
и природные процессы
Смачивание имеет большое значение
для успешного проведения ряда важнейших технологических процессов. Например, в
текстильной технологии хорошее смачивание волокна или тканей является важным
условием для крашения, беления, расшлихтовки, пропитки, стирки и т.д.
Смачивание соответствующими жидкостями металлов и неметаллических тел ускоряет
и облегчает их механическую обработку ( резание, сверление, шлифовку, полировку).
[3] Пайка возможна только в том случае, если припой смачивает соединяемые
детали. Это происходит, если силы притяжения между атомами припоя и металла
больше, чем между атомами внутри самого припоя. Если капля припоя не смачивает
поверхность, то она не способна затекать в узкие зазоры между соединяемыми
материалами. При наличии загрязнений соединяемых поверхностей адгезия припоя
ухудшается и могут образовываться несмачиваемые зоны, что снижает качество
пайки. Бурение нефтяных скважин в горных породах также облегчается, если
применять специальные бурильные растворы, содержащие смачиватели. На явлениях
избирательного смачивания основано обогащение руд - флотация. Смачивание имеет
огромное значение и в процессах реставрационно-профилактической обработки фильмовых
материалов водными растворами, особенно если эти процессы должны протекать в
течение короткого времени. [12]
Смачивание влияет также на степень
перегрева и переохлаждения при фазовых переходах
<#"518753.files/image010.gif">тг и  тж, , а
также поверхностного натяжения
<#"518753.files/image010.gif">жг.
Физический метод основан на электрической поляризации
<#"518753.files/image010.gif">тж.
Предварительная выдержка образцов данного твердого материала в растворе ПАВ
приводит к образованию на его поверхности адсорбционных слоев, которые могут
частично или полностью "экранировать" ее. Такое модифицирующее
действие позволяет качественно менять характер контактного взаимодействия
жидкости <#"518753.files/image010.gif">тж и
тж, , а
также поверхностного натяжения
<#"518753.files/image010.gif">жг.
Физический метод основан на электрической поляризации
<#"518753.files/image010.gif">тж.
Предварительная выдержка образцов данного твердого материала в растворе ПАВ
приводит к образованию на его поверхности адсорбционных слоев, которые могут
частично или полностью "экранировать" ее. Такое модифицирующее
действие позволяет качественно менять характер контактного взаимодействия
жидкости <#"518753.files/image010.gif">тж и  ж, а
смачивание соответственно возрастает.
ж, а
смачивание соответственно возрастает.
Обычно молекулы смачивателей
дифильны, что характерно для всякого поверхностно-активного вещества, и
адсорбируются на поверхности воды, ориентируясь углеводородными цепями наружу в
воздух, благодаря чему на поверхности воды создается как бы пленка углеводорода.
Этим и объясняется понижение поверхностного натяжения раствора и повышение
смачивающей способности до значений, соответствующих поверхностным натяжениям
органических неполярных жидкостей.
Интересным свойством монослоев
поверхностно-активных веществ является их способность переходить из раствора на
твердую поверхность и образовывать на этой поверхности полимолекулярные слои.
Это свойство было обнаружено еще Блоджетт на следующем опыте.
В мономолекулярный плотно
упакованный слой молекул поверхностно-активного вещества, образованный на
поверхности воды, осторожно вводят в вертикальном положении стеклянную
пластинку. При погружении этой пластинки гидрофильная поверхность ее
покрывается мономолекулярным слоем поверхностно-активного вещества, причем полярная
часть молекул вещества будет обращена к полярной поверхности стекла и
поверхность пластинки, таким образом, станет гидрофобной. После этого пластинку
вместе с адсорбированным на ней слоем поверхностно-активного вещества осторожно
извлекают из раствора. При этом на пластинке, уже адсорбировавшей
мономолекулярный слой поверхностно-активного вещества, адсорбируется второй
слой того же вещества, причем неполярные радикалы молекул этого слоя обращены к
неполярным радикалам первого слоя, т.е. по направлению к пластинке. В
результате на поверхности пластинки образуется бимолекулярный слой молекул,
обращенных друг к другу неполярными радикалами, а поверхность пластинки станет
снова гидрофильной. Неоднократно повторяя эту операцию, можно перенести на
пластинку значительное число слоев поверхностно-активного вещества, делая
поочередно поверхность пластинки то гидрофобной, то гидрофильной. [2]
5.Поверхностно-активные вещества
(ПАВ). Общие сведения о ПАВ
Поверхностно-активные вещества -
вещества, адсорбция которых из жидкости на поверхности раздела с другой фазой
(жидкой, твердой или газообразной) приводит к значительному понижению
поверхностного натяжения. В наиболее общем и важном с практической точки зрения
случае адсорбирующиеся молекулы (ионы) ПАВ имеют дифильное строение, т. е.
состоят из полярной группы и неполярного углеводородного радикала (дифильные
молекулы). Поверхностной активностью в отношении неполярной фазы (газ,
углеводородная жидкость, неполярная поверхность твердого тела) обладает
углеводородный радикал, который выталкивается из полярной среды. В водном
растворе ПАВ на границе с воздухом образуется адсорбционный мономолекулярный
слой <#"518753.files/image028.gif"> (14)
где 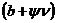 -сродство (свободная энергия
взаимодействия) неполярной части молекулы ПАВ к углеводородной жидкости
(b-безразмерный параметр, зависящий от природы ПАВ),
-сродство (свободная энергия
взаимодействия) неполярной части молекулы ПАВ к углеводородной жидкости
(b-безразмерный параметр, зависящий от природы ПАВ),
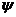 -свободная энергия взаимодействия в
расчете на одну группу CH2, v-число групп CH2 в углеводородном
радикале,сродство полярной группы к воде.
-свободная энергия взаимодействия в
расчете на одну группу CH2, v-число групп CH2 в углеводородном
радикале,сродство полярной группы к воде.
Для коллоидных ПАВ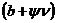 >bm или
>bm или 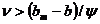 ,
,
где индексы m соответствуют
минимальным значениям сродства, при котором начинают проявляться коллоидные
свойства ПАВ. Минимальное число углеродных атомов в радикале для разных видов
коллоидных ПАВ лежит в пределах 8-12, т.е. коллоидные ПАВ имеют достаточно
большой углеводородный радикал. Вместе с тем коллоидные ПАВ должны обладать и
истинной растворимостью в воде, т.е. полярность гидрофильной группы также
должна быть достаточно высокой. Этому соответствует условие:
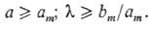 (15)
(15)
В начале 60-х гг. 20 века Д. Девисом
была разработана шкала ГЛБ со значениями от О до 40. ПАВ с липофильными
свойствами имеют низкие значения ГЛБ, с гидрофильными-высокие. Каждой группе
атомов, входящей в молекулу ПАВ, приписывается групповое число. При сложении
этих чисел получают ГЛБ по формуле:
ГЛБ = гидрофильных групповых чисел + 4-
гидрофильных групповых чисел + 4- 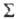 гидрофобных
групповых чисел + 7. (16)
гидрофобных
групповых чисел + 7. (16)
Хотя понятие о ГЛБ является достаточно
формальным, оно позволяет определять области применения ПАВ. Так, для
образования эмульсий вода/масло ГЛБ лежит в пределах 3-6, эмульсий масло/во
да-8-16, для смачивателей-7-9, для моющих средств-13-15.
Поверхностная активность ПАВ,
относящихся к разным группам, определяется по-разному. Для истинно растворимых
ПАВ она равна максимальному значению производной
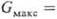
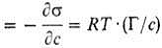 (17)
(17)
и измеряется по начальному участку
изотермы адсорбции s(c)при с 0 (Г-число молей ПАВ,
адсорбированных единицей поверхности, R-газовая постоянная, T-абсолютная .
температура). Для коллоидных ПАВ поверхностная активность Gмин = (s0 -
sмин)/смин, где s0 - поверхностное натяжение чистого р-рителя, sМИH-наименьшее
(постоянное) значение s, а смин-соответствующая этому значению концентрация
ПАВ. Дальнейшее введение в р-р ПАВ приводит к увеличению числа мицелл, а
концентрация молекулярно-диспергированного ПАВ остается постоянной. Величина
смин- критическая концентрация мицеллообразования (KKM). Она определяется как
концентрация ПАВ, при которой в растворе возникает большое число мицелл,
находящихся в термодинамическом равновесии с молекулами (ионами), и резко
изменяются свойства раствора (электропроводность, поверхностное натяжение,
вязкость, светорассеяние и т.д.). [5]
0 (Г-число молей ПАВ,
адсорбированных единицей поверхности, R-газовая постоянная, T-абсолютная .
температура). Для коллоидных ПАВ поверхностная активность Gмин = (s0 -
sмин)/смин, где s0 - поверхностное натяжение чистого р-рителя, sМИH-наименьшее
(постоянное) значение s, а смин-соответствующая этому значению концентрация
ПАВ. Дальнейшее введение в р-р ПАВ приводит к увеличению числа мицелл, а
концентрация молекулярно-диспергированного ПАВ остается постоянной. Величина
смин- критическая концентрация мицеллообразования (KKM). Она определяется как
концентрация ПАВ, при которой в растворе возникает большое число мицелл,
находящихся в термодинамическом равновесии с молекулами (ионами), и резко
изменяются свойства раствора (электропроводность, поверхностное натяжение,
вязкость, светорассеяние и т.д.). [5]
6. Классификация ПАВ
В данной работе описывается классификация,
принятая на III Международном конгрессе по ПАВ и рекомендованная Международной
организацией по стандартизации (ISO)в 1960. Она основана на химической природе
молекул и включает четыре основных класса ПАВ: анионактивные, катионактивные,
неионогенные и амфотерные. Иногда выделяют также высокомолекулярные
(полимерные), перфторированные и кремнийорганические ПАВ, однако по химической
природе молекул эти ПАВ могут быть отнесены к одному из вышеперечисленных
классов.
.1 Анионактивные ПАВ
Анионактивные ПАВ содержат в молекуле одну или
нескольких полярных групп и диссоциируют в водном растворе с образованием
длинноцепочечных анионов, определяющих их поверхностную активность. Это группы:
COOH(M), OSO2OH(M), SO3H(M), где M-металл (одно-, двух- или трехвалентный).
Гидрофобная часть молекулы обычно представлена предельными или непредельными
алифатическими цепями или алкилароматическими радикалами. Выделяют 6 групп
анионактивных ПАВ.
1) Производные карбоновых кислот
(мыла <#"518753.files/image038.gif"> (18)
Азотсодержащие соединения можно
разделить на следующие основные группы:
) амины и их соли RNR'R: · HX;
) моно- и бисчетвертичные аммониевые
соединения алифатической структуры [RNR'R:R''']+ X-, [RR'2N-R:-NR'2R]2+2Х-,
соединения со смешанной алифатической и ароматической структурой [RR'2
NC6H4NR'2 R]2 + 2Х- ;
) четвертичные аммониевые соединения
с различными функциональными группами в гидрофобной цепи;
) моно- и бисчетвертичные аммониевые
соединения с атомом азота в гетероциклическом кольце. Последняя группа
объединяет сотни ПАВ, имеющих промышленное значение. Важнейшие из них -
соединения пиридина, хинолина, фталазина, бензимидазола, бензотиазола,
бензотриазола, производные пирролидина, имидазола, пиперидина, морфолина,
пиперазина,бензоксазина и другие;
) оксиды аминов RR'R:N+O- (начато
промышленное производство);
) полимерные ПАВ (19).
 (19)
(19)
Катионактивные ПАВ меньше снижают
поверхностное натяжение, чем анионактивные, но они могут взаимодействовать
химически с поверхностью адсорбента, например с клеточными белками бактерий,
обусловливая бактерицидное действие. Взаимодействия полярных групп катионактивных
ПАВ с гидроксильными группами волокон целлюлозы приводит к гидрофобизации
волокон и импрегнированию тканей.
.3 Неионогенные ПАВ
Неионогенные ПАВ не диссоциируют в
воде на ионы. Их растворимость обусловлена наличием в молекулах гидрофильных
эфирных и гидроксильных групп, чаще всего по-лиэтиленгликолевой цепи.
По-видимому, при растворении образуются гидраты вследствие образования
водородной связи между кислородными атомами полиэтиленгликолевого остатка и
молекулами воды. Вследствие разрыва водородной связи при повышении температуры
растворимость неионогенных ПАВ уменьшается, поэтому для них точка помутнения
-верхний температурный предел мицеллообразования- является важным показателем.
Mногие соединения., содержащие подвижной атом H (кислоты, спирты, фенолы,
амины), реагируя с этиленоксидом, образуют неионогенные ПАВ RO (C2H4O)n H.
Полярность одной оксиэтиленовой группы значительно меньше полярности любой
кислотной группы в анионактивных ПАВ. Поэтому для придания молекуле требуемой
гидро-фильности и значения ГЛБ в зависимости от гидрофобного радикала требуется
от 7 до 50 оксиэтиленовых групп. Характерная особенность неионогенных ПАВ -
жидкое состояние и малое пенообразование в водных растворах.
Неионогенные ПАВ разделяют на
группы, различающиеся строением гидрофобной части молекулы, в зависимости от
того, какие вещества послужили основой получения полигли-колевых эфиров. На
основе спиртов получают оксиэтилированные спирты RO(C2H4O)nH; на основе
карбоновых кислот - оксиэтилированные жирные кислоты <#"518753.files/image040.gif"> (20)
Отдельную группу составляют
проксанолы <#"518753.files/image041.gif"> (21)
Алкилацетиленгликоли служат основой
получения ПАВ типа H(OC2H4)n-OCR'R:C CCR'R''O (C2H4O)nH; эфиры фосфорной
кислоты-типа (RO)2P(O)O(C2H4O)nH; эфиры пентаэритрита типа:
CCR'R''O (C2H4O)nH; эфиры фосфорной
кислоты-типа (RO)2P(O)O(C2H4O)nH; эфиры пентаэритрита типа:
 (22)
(22)
Неионогенными ПАВ являются продукты
конденсации гликозидов с жирными спиртами, карбоновыми кислотами и
этиленоксидом. Выделяют также ПАВ группы сорбиталей
<#"518753.files/image044.gif"> (23)
Отдельную группу составляют
кремнийорганические ПАВ, например (CH3)3Si [OSi (CH3)2]n-(CH2)3O(C2H4O)mH.
Получение неионогенных ПАВ в
большинстве случаев основано на реакции присоединения этиленоксида при
повышении температуры под давлением в присутствии катализаторов (0,1-0,5%
CH3ONa, KOH или NaOH). При этом получается среднестатическое содержание
полимергомологов, в которых молекулярно-массовое распределение описывается
функцией Пуассона. Индивидуальные вещества получают присоединением к
алкоголятам полигалогензамещенных полиэтиленгликолей. Коллоидно-химические
свойства ПАВ этого класса изменяются в широких пределах в зависимости от длины
гидрофильной полигликолевой цепи и длины цепи гидрофобной части таким образом, что
различные представители одного гомологического ряда могут быть хорошими
смачивателями и эмульгаторами. Поверхностное натяжение гомологов
оксиэтилированных алкилфенолов и первичных спиртов при постоянном содержании
этиленоксидных групп уменьшается в соответствии с правилом Траубе, т. е. с
каждой дополнительной группой CH2 поверхностное натяжение снижается. В
оптимальном варианте оно может достигать (28-30)· 10-3 Н/м при критической
концентрации мицеллообразования. Мицеллярная масса весьма велика; для твинов,
напр., она достигает 1800. Неионогенные ПАВ менее чувствительны к солям,
обусловливающим жесткость воды, чем анионактивные и катионактивные ПАВ.
Смачивающая способность неионогенных ПАВ зависит от структуры; оптимальной
смачивающей способностью обладает ПАВ разветвленного строения:
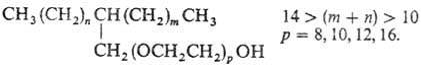 (24)
(24)
Оксиэтилированные спирты C10-C18 с n
от 4 до 9и плюроники образуют самопроизвольные микроэмульсии масло/вода и
вода/масло. Неионогенные ПАВ хорошо совмещаются с другими ПАВ и часто
включаются в рецептуры моющих средств
<#"518753.files/image046.gif">RN+(CH3)2CH2CH2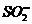 ,
RC6H4CH2N+(CH3)2CH2CH2
,
RC6H4CH2N+(CH3)2CH2CH2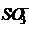 RN+(CH3)2CH2CH(OH)CH2OP
RN+(CH3)2CH2CH(OH)CH2OP ; в)
амидобетаины RCONH(CH2)3 N+(CH3)2COO- ; г) оксиэтилированные бетаины
RN+[(C2H4O)pH][(C2H4O)gH]CH2COO-; д) другие цвиттер-ионные ПАВ.
; в)
амидобетаины RCONH(CH2)3 N+(CH3)2COO- ; г) оксиэтилированные бетаины
RN+[(C2H4O)pH][(C2H4O)gH]CH2COO-; д) другие цвиттер-ионные ПАВ.
) Производные алкилимидазолинов, в
молекулах которых анионные и катионные группы имеют примерно одинаковые
константы ионизации, где R-алкил C7-C17, R'-H, Na, CH2COOM (M-металл). По
структуре и методам синтеза выделяют бетаиновые ПАВ, включающие карбокси-, сульфо-,
сульфат- или сульфоэфировую группу [ф-ла IX; R' = (CH2)nCOO-, (CH2)3 ,
CH2CH(OH)CH2
,
CH2CH(OH)CH2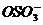 ] и прочие
("небетаиновые") имидазолиновые ПАВ [ R' = CH2COONa, (СН2)2 N
(CH2COOH)2, (СН2)2 N= =CHC6H4SO3H, (CH2)2 OSO3H]. Сбалансированность
ионизированных групп обеспечивает этим соединениям хорошие коллоидно-химические
и санитарно-гигиенические свойства.
] и прочие
("небетаиновые") имидазолиновые ПАВ [ R' = CH2COONa, (СН2)2 N
(CH2COOH)2, (СН2)2 N= =CHC6H4SO3H, (CH2)2 OSO3H]. Сбалансированность
ионизированных групп обеспечивает этим соединениям хорошие коллоидно-химические
и санитарно-гигиенические свойства.
) Алкиламиноалкансульфонаты и
сульфаты (AAAC1 и AAAC2 соотв.). Анионно-ориентированные вещества легко
переходят в цвиттер-ионную форму, что позволяет выделять их в чистом виде.
Константа ионизации кислотной группы гораздо больше, чем основной, поэтому их
применяют в щелочной среде. Однако в случае нескольких основных групп и при
наличии рядом с кислотной группой др. гидрофильных групп эти вещества по
свойствам и областям применения сходны с амфолитными ПАВ и обладают
бактерицидным действием. В зависимости от констант ионизации можно выделить соли
AAAC1 RN(R')-R:-SO3M, AAAC2 RN(R')-R: - OSO3M, производные ароматических
аминосульфокислот RR'N-Ar-SO3M, аминосульфонаты с атомом N в гетероциклах ;
аминофосфаты, аминофосфонаты и другие аминосоединения: соединения типа
RR'R:P(O)(OH)2, RR'R''OP(O)(OH)2, где R и R'-длинный и короткий углеводородные
радикалы, R:-короткий двухвалентный радикал; соединения RN(CH2CH2SO3Na)2. Их
отличие-хорошая способность диспергировать кальциевые мыла и устойчивость к
солям жесткости воды.
) Полимерные амфолитные ПАВ: природные
(белки, нуклеиновые кислоты и т.п.); модифицированные природные (олигомерные
гидролизаты белков, сульфатированный хитин); продукты ступенчатой конденсации
аминов, формальдегида, альбумина, жирных кислот; производные целлюлозы,
полученные введением карбоксильных и диэтаноламиноэтильных групп;
синтетические, в молекулах которых сочетаются структурные особенности всех
приведенных выше групп амфотерных ПАВ . [6]
7.Влияние ПАВ на смачивание. Эффекты обогащения
и обеднения области вблизи линии смачивания поверхностно-активными веществами
Влияние ПАВ на смачивание связано с
их адсорбцией на границах раздела фаз. Согласно современным представлениям, на
значения краевого угла влияют в основном изменения поверхностного натяжения в
достаточно узкой области в непосредственной близости от линии трехфазного
контакта (ЛТК). Поскольку ЛТК обладает избыточной энергией (линейным
натяжением), адсорбция ПАВ в этой области может отличаться от адсорбции на
межфазных поверхностях вдали от ЛТК. Особый интерес для изучения адсорбции ПАВ
вблизи ЛТК представляет область очень малых концентраций (С), для которой
поверхностное натяжение растворов 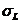 практически такое же, как у чистой
жидкости(воды). Поэтому зависимость краевых углов θ = f(C) в этой
области будет определяться только адсорбцией ПАВ на твердой поверхности.
практически такое же, как у чистой
жидкости(воды). Поэтому зависимость краевых углов θ = f(C) в этой
области будет определяться только адсорбцией ПАВ на твердой поверхности.
Рассмотрим влияние ПАВ на
капиллярный подъем водных растворов. В эксперименте были использованы катионные
ПАВ - цетилтриметиламмоний бромид (СТАВ) и цетилпиридиний хлорид (СРС),
неионогенное ПАВ Тритон Х-100, анионное - додецилсульфат натрия (SDS). Все ПАВ
фирмы “Serva”, чистота более 99%. Было изучено также влияние водонерастворимых
ПАВ -стеариновой кислоты (SA) и пентадециламина (РА) (чистота 98%). В работе
использовали дистиллированную воду (электропроводность 2·10-5 Ом-1 см-1).
Концентрацию растворов (С) водорастворимых ПАВ меняли от 10-10 до 10-2 М.
Cтеклянные капилляры средним радиусом 0,35 мм очищали по стандартной методике
[9], очищенные капилляры практически полностью смачиваются водой (cos θа = 0,98).
Выбор ПАВ разной природы был связан с тем, что их взаимодействие со стеклом
различно, а следовательно, и адсорбция ПАВ на твердой поверхности должна быть
разной. Поэтому можно было ожидать, что в изучаемых системах адсорбция ПАВ
вблизи ЛТК будет также различаться.
Краевые углы θ растворов
водорастворимых ПАВ находили по измерениям высоты капиллярного поднятия h =
f(C) с последующим расчетом по уравнению Жюрена:
сos θ = (∆ρ ghr)·2σ, (25)
где σ - поверхностное
натяжение раствора, ∆ρ - разность значений плотности жидкости
и газа, r - радиус капилляра, g - ускорение силы тяжести
Для определения углов натекания θа капилляр
устанавливали вертикально, его нижний торец приводили в соприкосновение с
горизонтальной поверхностью жидкости в кювете. Далее с помощью катетометра КМ-6
измеряли высоту подъема hа и рассчитывали угол θа по
уравнению (25).
Для определения углов оттекания θr по
окончании капиллярного подъема нижнюю часть капилляра погружали в воду примерно
на 2 см, а затем снова вынимали из воды, при этом часть жидкости вытекала из
капилляра. Далее измеряли высоту столбика жидкости hr и рассчитывали θr по
уравнению (25). Каждая точка соответствует среднему значению результатов шести
измерений. Среднеквадратичная ошибка в определении cos θ не превышала
5%.
Для создания на поверхности воды
пленок водонерастворимых ПАВ их сначала растворяли в бензоле (концентрация
растворов 8,37·10-5М). С помощью дозирующего шприца наносили на поверхность
воды в чашке Петри бензольный раствор ПАВ объемом от 0,01 до 0,1 мл и
дожидались испарения бензола. Методом пластины Вильгельми измеряли
поверхностное натяжение пленки. Далее изучали в этой же системе капиллярный
подъем в условиях натекания и оттекания. По окончании подъема на высоту h по
параметрам смачивающего мениска (величины а и r на рис. 5) рассчитывали краевой
угол θ
= 90-2 arctg
(a/r).

рис. 5. Схема эксперимента для изучения
капиллярного поднятия
По значениям высоты h рассчитывали поверхностное
натяжение в мениске
σ* = (ρghr)/(2cos
θ).
Точность определения σ* составляла
1,7 мН/м. Сопоставление расчетных величин σ* со
значениями поверхностного натяжения, измеренными методом Вильгельми, позволяет
судить об изменении концентрации ПАВ на поверхности раствор-воздух в процессе
капиллярного поднятия. Для изучения концентрирования ПАВ вблизи ЛТК применяли
метод авторадиографии. Были получены следующие результаты.
. Для катионных ПАВ уже в области очень малых
концентраций С обнаружено заметное уменьшение высоты подъема hа при натекании
(рис. 6).
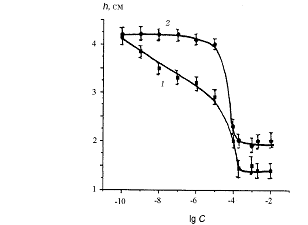
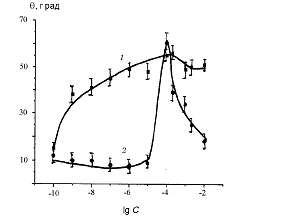
Рис. 6. Зависимость высоты капиллярного поднятия
(а) и краевых углов (б) от концентрации водных растворов СТАВ:
- натекание, 2 - оттекание
При С = 10-9 М для СТАВ и 10-8 М для СРС
наблюдаются заметные отличия высот при натекании и оттекании. Уменьшение высоты
hа однозначно указывает на уменьшение величины произведения σ·сos
θa
(см. уравнение (25)). В свою очередь, поверхностное натяжение раствора может
меняться за счет адсорбции ПАВ на границе раствор-воз-
дух, а краевой угол - за счет изменения этого
натяжения и адсорбции поверхностно-активных катионов на отрицательно заряженной
поверхности стекло-раствор, частичной гидрофобизации межфазной поверхности.
Поверхностное натяжение σL начинает
уменьшаться при С > 10-8 М. Для оценки максимальной адсорбции можно
допустить, что на границе стекло-раствор адсорбируется все количество ПАВ,
имеющееся в растворе. Легко показать, что при С = 10-9 М адсорбированные ионы
займут около 0,01% поверхности. Долю гидрофобных участков можно рассчитать по
уравнению Кассье :
cos θ = (1 - x) сos θ1
+ x cos
θ2,
(26)
где (θ1
= 0о - краевой угол на гидрофильных участках,
θ2 = 105о - краевой
угол на гидрофобных участках,
х - доля гидрофобных участков на поверхности).
Для раствора СТАВ С = 10-9 М (θ
=38о
)·х = 18%.
Для обеспечения такой гидрофобизации всей
смоченной поверхности твердого тела ПАВ в системе недостаточно (различие в
приведенных выше оценках составляет четыре десятичных порядка). Следовательно,
увеличение краевых углов можно объяснить только концентрированием катионного
ПАВ в непосредственной близости от ЛТК.
Для проверки этого вывода был применен метод
авторадиографии с использованием СТАВ, меченного тритием [10]. Для получения
авторадиограмм стеклянную пластину помещали в кювету и осторожно наливали в нее
раствор меченного СТАВ определенной концентрации так, чтобы раствор наполовину
смочил пластину. Затем с помощью бюретки удаляли раствор, высушивали пластину и
получали авторадиограмму распределения меченного СТАВ. Метод авторадиографии
показывает (на качественном уровне), что в области малых С = 2,2·10-8 М
действительно происходит концентрирование вблизи ЛТК (рис. 7, а).


Рис. 7. Авторадиограммы, полученные при
модифицировании стекла растворами СТАВ, меченного тритием, при С (М): а -
2,2·10-8 , б - 1,1·10-5М
Области почернения на авторадиограмме,
соответствующие наибольшей концентрации СТАВ, приходятся именно на ЛТК, а также
на ребра пластины и на крайне неоднородные “островки” на поверхности пластины.
При повышении концентрации СТАВ наблюдается более равномерное распределение ПАВ
по смоченной поверхности, а различия в адсорбции ПАВ на поверхности стекла и
вблизи ЛТК сглаживаются (рис. 7, б).
Механизм процесса столь быстрого обогащения
мениска катионным ПАВ (процесс капиллярного поднятия длится десятые доли
секунды) остается пока не ясным. Несомненным является определяющая роль в эффекте
концентрирования электростатических взаимодействий ПАВ - твердое тело. Можно
предположить, что наиболее быстрым способом перемещения ПАВ в мениск будет
диффузия катионов по поверхности раствор-воздух в сторону ЛТК.
Следует отметить, что такой большой гистерезис
смачивания в области малых концентраций С в системах катионное ПАВ-стекло
получен только методом капиллярного поднятия. Изучение смачивания в такой же
системе методами сидящей капли и пластины Вильгельми [11] показало, что
гистерезис смачивания убывает в ряду: капиллярное поднятие > пластина
Вильгельми > cидящая капля.
. Влияние неионогенного ПАВ Тритона Х-100 на
высоту капиллярного поднятия практически соответствует изменению поверхностного
натяжения раствора при малых значениях углов (θа
< 10 град, θr= 0). Гистерезис
смачивания мал, он наблюдается в области больших значений С (10-5-10-4 М).
Гистерезис можно объяснить образованием адсорбционного слоя ПАВ неоднородной
структуры на границе стекло-раствор.
. Концентрационные зависимости h(C) для растворов
SDS коррелируют с изотермой поверхностного натяжения. Гистерезис смачивания
отсутствует, θa
= θr
= 0.
. В случае пленок водонерастворимого ПАВ
(стеариновой кислоты) реализуется случай полного смачивания. При натекании
расчетные поверхностные натяжения σ* практически
совпадают (в пределах указанной выше ошибки определения) с величинами
поверхностного натяжения, измеренными методом Вильгельми (таблица). При
оттекании величины σ* близки к
поверхностному натяжению чистой воды. По-видимому, при отступлении мениска все
ПАВ остаются на твердой поверхности.
. При капиллярном поднятии воды с пленками РА
происходит резкое обеднение поверхности раствор-воздух поверхностно-активным
веществом. При этом краевые углы заметно растут, что свидетельствует о
гидрофобизации твердой поверхности. Следует отметить, что смачивание стекла
растворами алкиламинов (в области малых рН, когда растворимость в воде
алкиламинов возрастает) аналогично смачиванию растворами катионных ПАВ: и в
тех, и в других системах наблюдается значительный рост краевых углов [6]. Это
становится возможным при адсорбции ПАВ на твердой поверхности. Поскольку
водонерастворимого РА в системе мало (только поверхностная пленка),
по-видимому, происходит адсорбция РА в достаточно узкой области вблизи ЛТК. Этот
результат согласуется с данными о концентрировании катионного ПАВ у ЛТК при
капиллярном поднятии разбавленных растворов. При опускании капиллярного
“столбика” вниз также, как и в случае SA, в мениске остается чистая вода.
Таким образом, для растворов катионных ПАВ малых
концентраций, а также для пленок РА в условиях натекания, происходит
концентрирование ПАВ вблизи ЛТК. Для растворов неионогенного Тритон Х-100 и
анионного SDS, а также для пленок SA в условиях натекания не выявлены заметные
отличия в адсорбции ПАВ на межфазных поверхностях вблизи и вдали от ЛТК. При
изучении капиллярного поднятия в системах с пленками РА или SA в условиях
оттекания наблюдается обеднение межфазной поверхности раствор-воздух
поверхностно-активным веществом.
Заключение
Несмотря на весьма давнюю (более 150 лет)
историю исследований, интерес к изучению законов смачивания непрерывно растет.
Важнейшим стимулом здесь, как и в других областях современной науки, являются
потребности практики. Изучается влияние различных процессов (адсорбции на
различных границах раздела фаз, испарения) и факторов (строения индивидуальных
и смешанных адсорбционных слоев ПАВ и химически привитых модификаторов) на
смачивание и капиллярное течение. Благодаря развитию новых теоретических
представлений и методов экспериментальных исследований сведения о
закономерностях смачивания твердых тел значительно расширились и углубились.
Процессу смачивания почти всегда сопутствует
гистерезис краевых углов. При внешней простоте гистерезиса его изучение
достаточно сложно, так как различие краевых углов могут вызывать разные причины
и часто они действуют одновременно. Основными причинами возникновения
гистерезиса являются шероховатость и гетерогенность поверхности. Закономерности
гистерезиса смачивания используются во многих технологиях. Примеры -
флотационное обогащение руд, нефтедобыча, отмывание загрязнений. Измерения
гистерезисных углов дают ценную информацию о поверхностных свойствах твердых
тел, полимерных и белковых гелей и студней.
Процесс смачивания можно регулировать.
Наиболее универсальный метод регулирования смачивания состоит в использовании
поверхностно-активных веществ <http://www.xumuk.ru/encyklopedia/721.html>
(ПАВ). Метод позволяет качественно менять характер контактного взаимодействия
жидкости <http://www.xumuk.ru/encyklopedia/1545.html> с твердым телом
<http://www.xumuk.ru/encyklopedia/2/4324.html>. С его помощью возможно
гидрофобизировать гидрофильные материалы или, напротив, гидрофилизировать
гидрофобные подложки.
Смачивание очень широко распространено
в природе, технике, сельском хозяйстве, повседневном быту и играет важную, а
иногда определяющую роль в протекании многих природных и технологических
процессов. По замечанию лауреата Нобелевской премии 1991 года П.Ж.де Жена,
"несмотря на исключительную важность, эти процессы (смачивание и
растекание) до сих пор недостаточно поняты. Что касается теории, то лишь через
180 лет после пионерских работ Юнга и Лапласа (1804-1805 годы) некоторые
фундаментальные проблемы капиллярности начинают решаться".
Список использованной литературы
Книги
.
Ребиндер П.А. Избранные труды. Поверхностные явления в дисперсных системах.
Физико-химическая механика дисперсных систем. М., 1979.
.Воюцкий
С.С. Курс коллоидной химии. М.:Химия ,1975.
.Сумм
Б.Д., Горюнов Ю.В. Физико-химические основы смачивания и растекания. М.:Химия,
1976
.
Зимон А.Д. Адгезия жидкости и смачивание.-М.: Химия,1974.
.
Волков В.А. Поверхностно-активные вещества. Синтез и свойства. -М.1989
.
Абрамзон А.А. Поверхностно-активные вещества. Свойства и применение, 2 изд.,
Л., 1981
.
Таубман А.Б., Маркина З.Н.Физико-химические основы применения
поверхностно-активных веществ, Ташкент, 1977
Журналы
.
Пентин В.Ю., Деньщикова Г.И., Сумм Б.Д. Коллоидный журнал, 1992. 54
.Соболева
О.А., Сумм Б.Д. Коллоидный журнал 1996. 58. №2.С. 244.
.
Сумм Б.Д., Соболева О.А., Должикова В.Д. Коллоидный журнал 1998. 60. С. 650.
12.
Наука и жизнь, №2, 2005 <http://www.nkj.ru/archive/2005/2/>