Использование полимеров для лечения заболеваний опорно-двигательной системы
ВВЕДЕНИЕ
Использование в клинике последних медицинских
достижений для лечения травм и заболеваний опорно-двигательной системы
существенно повышает качество жизни пациентов, дает им возможность обходиться
без гипсовой иммобилизации и значительно сокращать сроки реабилитации, а также
сроки пребывания в стационаре.
Новые медицинские технологии, применяемые в
настоящее время, обеспечивают высочайший уровень оказания
травматолого-ортопедической помощи пациентам, не уступающий современным
европейским и американским медицинским центрам.
Применяются современные
высокотехнологичные методы остеосинтеза
<#"517059.files/image001.gif">
Экспериментальные исследования, проведённые на
собаках, показали, что при замещении дефектов губчатой кости пористым
углеродным материалом уже через три месяца формируется прочный
костно-углеродный блок (рис. 1). Ни в одном случае не наблюдалось отторжения
имплантата, что подтверждает инертность углерода и согласуется с данными других
исследователей. В клинической практике пористый углерод использован более чем в
100 операциях, сопровождавшихся дефектами кости различной природы, чаще при
переломах мыщелков большеберцовой кости.
Для сравнения приведены примеры замещения
опухолей мыщелков бедренной кости хроносом и пористым углеродом.
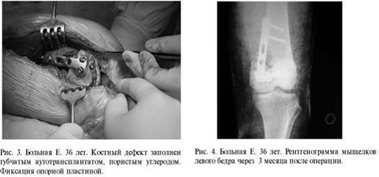
Больная Е. 36 лет. Диагноз: перелом медиального
мыщелка правой бедренной кости. На рентгенограмме определялся крупный дефект
медиального мыщелка бедра с внутрисуставным переломом оставшейся кости (рис. 2).
Во время операции: дефект губчатой кости
захватывал весь медиальный и половину латерального мыщелка бедра, заполнен
сгустками крови. Со стороны сустава сохранялась тонкая костная пластинка.
Наружный кортикальный слой мыщелка бедра отсутствовал. Субхондраль-но в дефект
уложен губчатый аутотрансплантат, взятый из гребня подвздошной кости (рис. 3).
Основной дефект замещен пористым углеродом, а снаружи на место кортикальной
пластинки также уложен губчатый аутотрансплантат. Дополнительно с учётом
перелома субхондраль-ной пластинки выполнена фиксация опорной пластиной. При
гистологическом исследовании патологических клеток не обнаружено, диагноз:
солитарная костная киста. Через 3 месяца наступила консолидация перелома (рис.
4). На контрольном осмотре через год у пациентки жалоб не было: ходит с полной
нагрузкой, разгибание и сгибание в коленном суставе - 100%. На рентгенограмме
прослеживается обычная костная ткань. Через 3 года: признаков рецидива опухоли
нет (рис. 5). Женщина работает, жалобы отсутствуют, от удаления опорной
пластины отказывается.
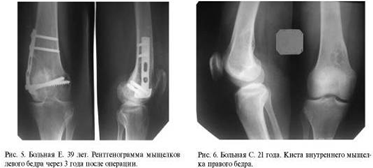
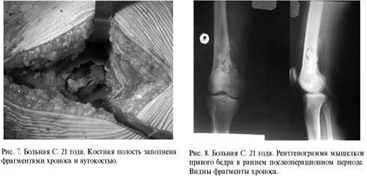
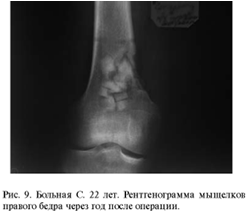
Сравнение замещения дефектов губчатой кости
хроносом и пористым углеродом показало, что после имплантации хроноса через год
рентгенологически определяются фрагменты имплантированного материала, т. е. его
перестройка к этому времени не заканчивается. При использовании пористого
углерода определить материал на рентгенограммах крайне сложно. Положительным
качеством пористого углерода является возможность врастания в него сосудов и
костной ткани, следовательно, - восстановления питания субхондраль-ной зоны
кости и самого хряща.
Таким образом, пористый ячеистый углерод может
быть использован для замещения крупных дефектов губчатой костной ткани
различной этиологии как альтернатива другим материалам. Для окончательных
выводов и требуется проведение дополнительных исследований.
Глава 2. ПРИМЕНЕНИЕ
КОМПОЗИТА «ЛитАр» В СЛУЧАЕ ЗАМЕДЛЕННОЙ КОНСОЛИДАЦИИ ПЕРЕЛОМА И ЛОЖНОГО СУСТАВА
Разработка заменителей костной ткани
представляет собой объективную необходимость, которая революционизирует
развитие человечества подобно огню и глиняной керамической утвари, знаменуя
собой радикальное улучшение качества и продолжительности жизни.
Другая революция произошла уже в наши дни в
области использования керамики в медицинских целях. Это инновационное
применение специально спроектированных керамических материалов для замены и
лечения больных или поврежденных частей тела [12].
Освоение керамических изделий в медицинской
практике спровоцировало появление термина «биокерамика» и подведение под это
понятие любых неорганических малорастворимых соединений (фосфатов кальция)
также применяемых в медицине для протезирования костных дефектов.
Тем не менее, под керамикой понимаются «... материалы,
изготавливаемые соответствующей обработкой разнообразных минеральных композиций
с последующим обжигом отформованного и высушенного полуфабриката» [4]. С точки
зре-
ния химии никакой биокерамики не существует [4].
Термин «биокерамика» есть продукт нестрогого (или невежественного) отношения к
химической терминологии в смежных сферах научной деятельности (биологической
или медицинской). Применение материала в области биологии не делает его
биологичным: закрывая золотыми коронками зубы, мы не называем его «биозолото».
Керамические изделия применяются для
протезирования дефектов кости из-за двух свойств этого материала: химической
инертности и высокой прочности. Но именно из-за этих свойств кость не может
врасти в имплантат, поэтому пограничная зона дефекта заполняется волокнистой
соединительной тканью, которая капсулирует инородное тело. Другой недостаток
керамики: повышенная хрупкость, что приводит к микротрещинам и последующему
разрушению керамического протеза.
Малорастворимые фосфаты кальция, такие как средний
фосфат или трикальций фосфат (Ca3(PO4)2);
кислый фосфат или октафосфат кальция (Ca4H(PO4)3);
гидроксоапатит, или гидрокси-дапатит, или гидроксиапатит - прямой перевод с
английского hydroxyapatite
(Ca5(OH)(PO4)3
или Ca10(OH)2(PO4)6)
[7] тем более никак не могут называться биокерамикой, т.к. не получаются выше
упомянутой для керамики процедурой.
Однако именно малорастворимые фосфаты кальция
отдельно или в разных сочетаниях наиболее широко используются в современной
имплантологии для обеспечения репаративной регенерации в костных дефектах [1].
Репаративная регенерация костной ткани является
многоэтапным процессом. От момента повреждения кости до завершения репарации,
т.е. до образования морфологически зрелой костной ткани, заполняющей костный
дефект, и полноценного восстановления функции кости, проходит достаточно много
времени. При этом наблюдаются общие закономерности развития репаративного
процесса, а специфические особенности зависят от условий, в которых он
протекает, и от потенций остеогенных клеточных элементов [3].
Отсутствие консолидации костных отломков -
довольно часто встречающийся случай как при операционном, так и консервативном
лечении. Известно, что последствием может быть замедленная консолидация костных
отломков или ложный сустав, образующийся в области дефекта.
Наиболее важными фактами эффективного лечения
ложного сустава являются интенсификация ангиогенеза и микроциркуляции в зоне
регенерации. Течение и завершение репаративной регенерации во многом
определяются условиями протекания регенераторного процесса и, прежде всего -
трофическим обеспечением, которое в свою очередь зависит от степени
кровоснабжения зоны регенерации. Факторы, влияющие на кровоснабжение можно
разделить на две группы: первая - стимуляторы ангиогенеза, вторая - стимуляторы
кровотока (например, применение гипергравитации [2]). Как отмечалось выше,
стимуляторами ангиогенеза и остеогенеза являются факторы роста. Для усиления
развития сосудистого русла в области больших диафизарных дефектов применялись
адреналовый экстракт надпочечников, антиоксиданты. При этом развитие
сосудистого русла способствовало более активному течению регенераторного
процесса. Локальную гиперемию в области поврежденной кости и интенсификацию
микроциркуляции вызывали с помощью индуктотермии, УВЧ-терапии, ультразвука,
электростимуляции, постоянного и переменного магнитных полей, лазерного
излучения и т.д. [1].
Из названных выше способов интенсификации
репаративной регенерации костной ткани с целью замещения дефекта сегодня
наиболее широко используется костная аллопластика. Однако процесс замещения
чужеродной кости собственной протекает медленно, а антигенные свойства
аллогенной ткани небезразличны для организма
реципиента, возможны отторжения, поздние
нагноения и переломы в области бывшего дефекта [8, 10]. При этом необходимо
отметить невозможность (а в случае измельчения - трудность) инъекционного ее
введения.
Поиск альтернативных методов привел к разработке
биоматериалов, способных перестраиваться (биодеградировать) в натуральную
(натив-ную: в смысле полноценную) костную ткань. Иногда таким материалам
приписывают остеокондуктивные и/или остеоиндуктивные свойства (термины впервые
примененные в стоматологии), что кажется недостаточно корректным из-за
негостированности этих понятий. Подобные материалы чаще всего состоят из
нескольких компонентов и могут содержать как остеогенные
клетки-предшественники, так и остеоиндуктивные и остеокондуктивные (в смысле
биологически активные) компоненты костного матрикса (органической полимерной
матрицы кости). Экспериментальные и клинические исследования по использованию
подобного рода биокомпозиционных материалов подтвердили их
конкурентоспособность с алло- и аутокостью [5].
В последние годы в челюстно-лицевой хирургии, а
в последующем и в травматологии - ортопедии - для лечения костной патологии
стали применять препараты на основе гидроксидапатита и коллагена, такие как
«Колапол», «Коллапан», «Ли-тАр», «Оссакол», «Остеоматрикс», «ОСТИМ-100» и
другие. Искусственный гидроксидапатит, содержащийся в композиционных материалах,
по химическому составу идентичен основной минеральной составляющей костной
ткани, в результате чего он широко используется при замещении дефектов костной
ткани. Гидроксидапатит и материалы на его основе, способны резорбироваться и
утилизироваться организмом, стимулировать ре-паративные процессы в костной
ткани [1].
Одним из названных материалов на основе
гидроксидапатита является композит «ЛитАр», способный обеспечивать ангиогенез в
зоне его введения в области дефекта, активизируя для этого имеющиеся в организме
стволовые клетки, зафиксированные авторами статьи [6] и осторожно названными
«береговыми», так как на момент публикации цитируемой работы полной уверенности
в том, что на морфопрепаратах читаются стволовые клетки, не было.
Тем не менее, именно это обстоятельство
определило приоритет применения биодеградирующе-го композитного материала
«ЛитАр»* для лечения замедленной консолидации и ложного сустава.
«ЛитАр» состоит из полимерной органической
основы (белковой, коллагеновой или полисахаридной, альгинатной), которая
имитирует матрицу костной ткани, часто называемую непонятным словом «матрикс»,
а также солевого компонента, который представлен гидроксо- или
гидроксофтор-апатитом (содержание фторид-иона не превышает нормы,
рекомендованные ВОЗ). Кристаллы соли нанометрических размеров формируются
(выращиваются) на полимерных волокнах в ходе приготовления материала. Композит
«ЛитАр» получается пористым на 70 %, что обеспечивает его быструю
васкуляризацию. По данным биопсии, взятой у лабораторных животных (у собак
биопсия бралась под калипсоловым наркозом, без эвтаназии животных) время
биодеградации составляет 12-15 дней. Далее в области введения материала
образуется мягкотканевая структура (соединительная ткань), которая далее
оссифицируется только в тот тип костной ткани (плоская кость черепа, трубчатая
кость с кортикальным и губчатым слоем), который должен находиться в месте
дефекта в случае нормальной анатомической топографии. Если дефект был заполнен
«ЛитАр» в области хряща, то образуется хрящ [9]. Материал применяется в
клинической практике с 1994 г. (Клиника травматологии, ортопедии и
экстремальной хирургии Самарского государственного медицинского университета).

Одна из интересных особенностей композита
«ЛитАр» - возможность его инъекционного введения, что позволяет обеспечивать
сращение костных отломков в случае замедленной консолидации или ложного
сустава, не прибегая к интраоперационному его введению.
ПРИМЕРЫ КЛИНИЧЕСКОГО ПРИМЕНЕНИЯ МАТЕРИАЛА
«ЛИТАР»
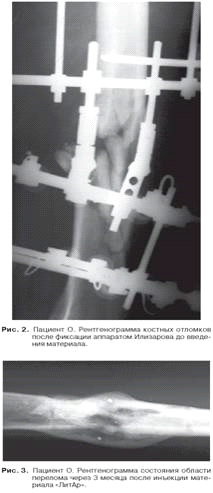
Пациент О., 27 лет. Многооскольчатый открытый
огнестрельный перелом левой бедренной кости (рис. 1). Внеочаговый остеосинтез
по Илиза-рову проведен за 9 месяцев до поступления в нашу клинику в госпитале
другого города (рис. 2).
Под рентгенологическим контролем инъекционно
введена (3-кратно с интервалом в 12-15 дней) суспензия материала «ЛитАр». Через
2,5 месяца после последнего введения аппарат Или-зарова был снят, через 3
месяца пациент О. был выписан из клиники (рис. 3).
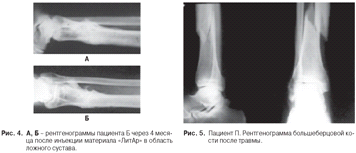
Пациент Б., 28 лет. Послеоперационный
остеомиелит правой большеберцовой кости, формирующийся ложный сустав. В область
ложного сустава сделана инъекция «ЛитАр». Через 4 месяца произошла надежная
консолидация костных отломков (рис. 4 а, б).
Пациент П., 43 лет. Косой перелом в диафизарной
части левой большеберцовой кости (рис. 5).
Пациенту П. был проведен чрескостный остеосинтез
по Илизарову. Иммобилизация в аппарате в течение трех месяцев. Из-за развития
воспаления в области спиц аппарат был снят. Иммобилизация гипсом. Развился
ложный сустав (рис. 6).
Через 9 месяцев после снятия аппарата Илизарова
был введен материал «ЛитАр» в область несращения (ложного сустава) инъекционно
под рентгенологическим контролем. Через 4 месяца наблюдалась консолидация
костных отломков
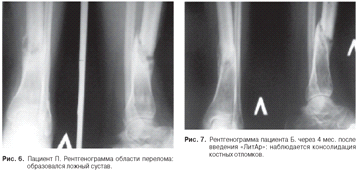
(рис. 7). Полная консолидация наступила через 6
месяцев.
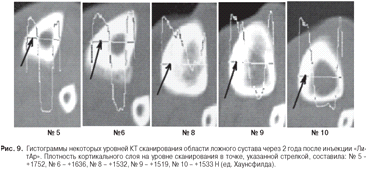
Через 2 года после инъекции материала «ЛитАр»
была проведена компьютерная томография области перелома большеберцовой кости
пациента П. (рис. 8). Денситометрия зоны (области) ложного сустава на всей ее
протяженности (по сканам КТ) показала восстановление плотности ткани в
интервале от +1533 до +1752 Н, что соответствовало плотности кортикального слоя
полноценной трубчатой кости. Качественно-количественные характеристики
сканирования приводятся на гистограммах (№№ 5 - 10); точки, в которых
проводилось измерение оптической плотности, указаны стрелками (рис. 9).
Методика инъекционного применения
коллаген-апатитового материала «ЛитАр» с целью ускорения оссификации костного
регенерата или ложного сустава перелом сустав кость
антисептик
Механически измельченная пластина композита
растирается в стерильной фарфоровой ступке с периодическим добавлением
небольших порций (по 0,5-1 мл) 0,9% раствора хлорида натрия до получения
однородной желеобразной суспензии. Полученная таким образом смесь набирается в
шприц. Шприц фиксируется в оригинальное устройство для введения гелеобразных
веществ [11]. Устройство представляет из себя приводной механизм, выполненный в
виде соединенных посредством втулки бранш с резьбовыми концами и установленного
во втулке резьбового толкателя с рукояткой. Причем, на концах бранш с
возможностью смещения закреплены фиксирующие пластины с отверстиями под корпус
и шток поршня шприца. Упорная планка шприца размещена между пластинами. Шток
поршня контактирует с толкателем (рис. 10).
Пункция ложного сустава проводилась иглой
диаметром 2,8 мм, причем конец иглы должен попасть в соединительно-тканную прослойку
между костями (предварительно необходимо перфорировать ее в нескольких точках в
направлении к костным отломкам), составляющими ложный сустав или в вяло
оссифицирующийся регенерат. Взвесь «ЛитАр» в изотоническом растворе хлорида
натрия вводилась медленно с помощью предложенного нами устройства [12]. Его
применение позволило ввести гелеобразную взвесь без особых усилий. Контроль
правильности попадания осуществлялся рентгенологически. В ряде случаев
рентгенографию делали до введения материала. Правильность попадания определяли
положением иглы. Другой группе больных перед введением в готовую взвесь
добавляли водорастворимое контрастное вещество. В ряде случаев потребовалось
повторное введение материала с интервалом 12- 15 дней. После введения материала
делали рентгенографию. Иммобилизация осуществлялась либо гипсом, либо аппаратом
чрескостной фиксации по Илизарову. Контроль оссификации ложного сустава или
костного регенерата осуществлялся рентгенологически каждые 30 дней,
сцинтиграфически, сонографически, компьютерной томографией.
Инъекционно материал «ЛитАр» применялся у 12
пациентов с поражением бедренной, 15 - большеберцовой, 5 - плечевой костей.
Глава 3.
СВЕРХЭЛАСТИЧНЫЕ МАТЕРИАЛЫ С ПАМЯТЬЮ ФОРМЫ В МЕДИЦИНЕ
Применение металлов и сплавов в качестве имплантируемых
в организм материалов имеет давнюю историю. Еще в 2500 году до нашей эры в
Финикии использовали для лечения зубов металлические конструкции. В Древнем
Риме большое распространение получили искусственные металлические зубы, а
металлическая проволока применялась для фиксации костных отломков. Вплоть до
конца XVIII века использовались в основном чистые металлы: золото, серебро,
медь. В XIX столетии в
связи с улучшением технологии выплавки металлов и сплавов распространение
получили имплантаты из высококачественных сталей.
В 1925 году впервые в качестве фиксатора
использована нержавеющая сталь. Однако внимание травматологов-ортопедов привлек
хромокобальтовый сплав, который в дальнейшем получил более широкое
распространение, чем нержавеющая сталь, вследствие своей биоэнертности [23,
10]. 50-е годы XX
столетия ознаменовались применением тантала и титана в качестве имплантатов
различного назначения. Тантал является биоэнертным материалом, но широкого
распространения не получил из-за большого удельного веса и недостаточной
жесткости. В настоящее время его применение ограничено использованием тонкой
проволоки. В отличие от тантала титан имеет лучшие физико-механические свойства
и характеризуется биологической совместимостью с тканями организма. В 70-е годы
появились примеры использования нового класса материалов - сплавов с памятью
формы, которые принципиально изменяются от упомянутых выше металлических
медицинских материалов тем, что они удовлетворяют требованиям высокой прочности
и пластичности, упругости и жесткости, гибкости и эластичности, износостойкости
и вязкости. Основой сплавов является соединение титана и никеля. В
высокотемпературном состоянии сплавы достаточно пластичны, и им можно придать
необходимую геометрическую форму. При охлаждении до 5-7°С конструкция
становится эластичной и ее можно деформировать без значительных усилий руками.
При нагревании в организме до 36°С конструкция стремится восстановить свою
исходную форму и при этом обеспечивает надежную фиксацию и равномерную
компрессию костных отломков [8, 28, 29,19]).
Наряду с высокими параметрами эффекта памяти
формы сплавы на основе никелида титана отличаются практически полной
инертностью в организме человека, что позволяет широко использовать их в
качестве имплантатов [14]. Титан открыт В. Грегором (Англия) в 1791 г. и назван
в честь титанов, сыновей богини Геи. Титан - это легкий, плавкий и прочный
металл. Химически стоек, благодаря наличию защитной пленки. Природные ресурсы
титана в несколько раз превышают природные ресурсы меди, никеля, олова, свинца,
хрома, марганца, молибдена, вольфрама, ртути, висмута, золота и платины вместе
взятых. Среди конструкционных материалов титан по наличию природных ресурсов
занимает четвертое место, уступая только алюминию, железу и магнию. А среди
элементов земной коры он занимает 9-е место [2]. В свободном виде титан в
природе не встречается, а обычно находится в форме устойчивых оксидных
соединений. Основные титановые минералы - рутил, анатаз, брукит, которые
содержат титан в форме диоксида титана. В рамках «Международной программы по
химической безопасности» и программы «Критерии здоровья окружающей среды», с
поддержкой «Фонда окружающей среды» Всемирная Организация Здравоохранения
выпустила ряд документов о влиянии некоторых загрязнителей на окружающую среду
и человека. Один из этих документов посвящен влиянию титана на человека и
окружающую среду (World
Health Organization.
Geneva, 1982). В нем, в
частности что титан не является необходимым элементом для жизни человека или
животных и плохо поглощается растениями. Титан и его различные соединения
широко используются в медицине без каких-либо неблагоприятных влияний.
Содержание титана в организме человека составляет 9 мг. Соединения титана и
титан плохо поглощаются организмом, хотя со временем он может накапливаться в
легких, где обнаружены его самые высокие концентрации, 2,4 мг. Титан был найден
и в лимфатических узлах, почках и печени, куда он попадает через кровь. В
костной ткани содержится менее 1 мг/кг. Установлено, что допускается ежедневное
потребление около 300 мкг титана [2].
Нет данных о том, что титан является
канцерогенным или мутагенным веществом для человека. В целом считается, что
титан и его соединения являются биологически инертными веществами, хотя пока
нет количественной оценки или дозовой зависимости для какого-либо влияния,
связанного с воздействием титана или его соединений на человеческий организм. В
различных областях медицины широко используются имплантаты, изготовленные из
металлов, керамики, углерода, полимеров, способные выполнять в живом организме
определенную функцию. Титан используется в медицине при изготовлении
инструментов, применяется в качестве биосовместимого материала при производстве
имплантатов в ортопедии, челюстно-лицевой хирургии, нейрохирургии и т. д. [24].
Имплантация в ткани человека искусственных материалов -это одна из проблем
медицины и техники. Традиционные металлические материалы не обладают
эластичностью, характерной для тканей живого организма. США, Германия, Канада,
Англия, Китай, Япония и Индия проявляют большой интерес российским разработкам
в области создания и применения сплавов никеля и титана эквиатомного состава (TiNi),
проявляющих эффекты памяти формы и сверхэластичные свойства, подобные свойствам
тканей организма [5, 7].
Основным достоинством никелидтитановых
имплантатов является пластичность и способность восстановления первоначальной
формы при смене температурного режима [5]. Однако любой металл - инородный
материал для организма, в связи с чем, имплантат будет вызывать реакцию его
тканей. Степень выраженности этой реакции является одной из основных
характеристик любого имплантируемого материала. Сплав никеля и титана имеет
преимущества, так как на его поверхности образуется защитная оксидная пленка,
значительно повышающая степень его биологической инертности [5, 18] и
коррозионной стойкости. Оксидная пленка (диоксид титана) самопроизвольно
формируется в кислородосодержащей атмосфере за несколько минут, достигая
толщины от 10 до 100 нм, представляет собой стойкое керамическое соединение, на
котором могут отлагаться плазменные белки, органический и минерализованный
матрикс кости [23]. Приживаемость никелид-титановых конструкций связана с
взаимодействием их с тканями. В опытах на животных показано, что между
контактирующей тканью и никелид-титановым имплантатом имеется связь:
соединительная ткань прорастает в поры металлоконструкции, постепенно заполняя
их и повторяя рельеф, обеспечивая механическую фиксацию на межфазной границе.
При увеличении времени пребывания никелида титана в организме наблюдается уплотнение
тканевых структур в порах и вокруг имплантата [17, 5].
Для изучения тканевой совместимости с материалом
сплава проводились экспериментальные исследования на лабораторных животных
(крысы) после имплантации пористого никелида титана под кожу. Обследование
животных велось по следующим показателям: определение в периферической крови
количества лейкоцитов, эритроцитов, содержания гемоглобина, белковых фракций
сыворотки крови, а также активность АЛТ и АСТ. При этом не выявлено
существенного отличия перечисленных показателей, функционального состояния
систем и органов опытных и контрольных животных. Не имели достоверных отличий и
весовые коэффициенты внутренних органов (печени, сердца, селезенки, почек и
надпочечников) животных.
Изучение реакции биологических тканей на
имплантацию штифтов из сплава на основе никеля и титана с помощью
гистологического метода показало: в сроки 2-5 сут. вокруг штифтов -
асептическая воспалительная реакция с выраженной пролиферацией
фибробластических элементов на фоне серозной экссудации и лейкогистиоцитарной
инфильтрации тканевых элементов. К 10-м сут вокруг штифтов определялись широкая
зона клеточкой пролиферации с преобладанием фибробластических элементов и
активный ангиоматоз. Уже в эти сроки наблюдения отмечался интенсивный фибриллогенез.
В непосредственной близости к чужеродному телу выявлялись беспорядочно
ориентированные проколлагеновые и тонкие коллагеновые волокна. К 15-м сут.
процессы фибриллогенеза выдвигались на передний план, вокруг имплантатов
определялась широкая зона циркулярно-ориентированных коллагеновых волокон.
Наряду с этим по-прежнему сохранялись участки равномерно выраженного
ангиоматоза, а местами - различной плотности круглоклеточные инфильтраты.
Отмечались проявления отека, гиперемии, в ряде случаев - лейкогистиоцитарная
инфильтрация.
На 20-30-е сут капсула вокруг имплантата
представлена широкой зоной коллагена. Сосудистая система редуцирована и
представлена отдельными мелкими кровеносными сосудами. На 30-е сутки
определяется пучковость коллагеновых фибрилл. Дальнейшая эволюция капсулы идет
по пути утончения. Через 36 мес капсула представлена мощными пучками
коллагеновых волокон, но толщина ее заметно уменьшена. Круглоклеточные
пролифераты отсутствовали, окружающие ткани полностью восстанавливали строение.
Через 9-12 мес. процесс редукции в капсуле завершился. Резко сокращалось
количество клеточных элементов. Капсула определялась в виде тонкой полоски,
уплотненного оксифильного вещества, в котором наблюдались скудные количества
фиброцитов и тонкие атрофичные пучки коллагеновых волокон. В эксперименте не
выявлено выраженного местного и общетоксического действия материала сплава,
функциональное и структурное состояние жизненно важных органов опытных животных
не имели существенной разницы в сравнении с контролем.
Биосовместимость пористых материалов на основе
никелида титана позволяет им длительно функционировать в организме не
отторгаясь, при этом обеспечивать стабильную регенерацию клеток и создавать
надежную фиксацию с тканями организма. Никелид титановый сплав имплантировали в
разные ткани организма экспериментальным животным - в бедро и челюсти в виде
штифтов и дисков, пористые пластины - для выполнения пластики миокарда,
специальные конструкции для замещения костной ткани сломанных тел позвонков,
для костной пластики средней и верхней зон лица, замещения дефектов длинных
трубчатых костей, при реконструктивных операциях на ухе, для формирования
культи глазного яблока и лечения глауком и др. В результате различных по
показаниям операций никелид титановые имплантаты прилегали к кости,
надкостнице, мышцам, сухожилиям, сосудам, нервным стволам, подкожной клетчатке
и др. На определенные сроки образцы извлекали из организма и проводили
детальные рентгенологические, морфологические, микроструктурные и
рентгеноспектральные исследования [5]. Реакция тканей, выявленная при
микроскопическом исследовании, сводилась к образованию тонкой капсулы вокруг
имплантата, причем на шовный материал (шелк) она была более выраженной.
Результаты данного и других исследований свидетельствуют о высокой степени
биологической инертности сплава никеля и титана [18, 21]. Далее более подробно
показан процесс остеоинтеграции. Остеоинтеграция - это прямая, структурная и
функциональная связь между живой тканью кости и поверхностью имплантата. При сформированности
этой связи на рентгеновском снимке видна безраздельная связь кости и имплантата
без промежуточного соединительного слоя [9, 23]. От костной ткани, окружающей
снаружи имплантат, отрываются остеобласты и с помощью тканевой жидкости
(капиллярный эффект) проникают в его пористую структуру. Внутри пор
остеообразующие клетки останавливаются в углублениях, прилипают к поверхности
сплава и дают начало образованию кости. Эта новообразованная кость заполняет
поры и, выходя из них, соединяется друг с другом, идет на встречу к костной
ткани, окружающей имплантат. В то же время, с наружной поверхности имплантата
костная ткань прорастает в пористую структуру. Эти два костных потока идут
навстречу друг другу и соединяются. Строение тканей в порах и вокруг имплантата
становится полностью идентичным. Реакция костной ткани на внедрение пористого
никелида титана ически трансабдоминально. Результаты хирургического лечения
изучены в сроки от 3 до 24 месяцев. Оценивали динамику болевого синдрома по
визуально-аналоговой шкале, индекс Освестри. О формировании межтелового блока
после выполнения спондилодеза судили по рентгенологическим, МРТ- и КТ-данным.
Рентгенологические исследования включали измерение высоты межтелового
промежутка и флексионно-экстензионной разницы сегментарного угла. Результаты.
Функциональные результаты лечения через 18-20 мес. после операции оценены как
хорошие и удовлетворительные в 94,1 % случаев. Рентгенологические исследования
не выявили ни одного случая разрушения межтеловых имплантатов и миграции их в
тела позвонков. Миграция имплантатов по межтеловому промежутку произошла в
четырех наблюдениях (0,9 %). Рентгенографически и КТ-графически подтверждены
остеоинтегративные свойства никелида титана: отмечено обрастание имплантатов
костной тканью споследующим формированием межтелового костно-металлического
блока. В 94,8 % случаев оперированные позвоночные сегменты были стабильны, что
соответствует литературным данным об эффективности применения других видов
межтеловых имплантатов. Заключение. Имплантаты из пористого никелида титана
могут быть успешно использованы для различных видов межтелового спондилодеза.
Никелид титана обеспечивает формирование межтелового костно-металлического
блока без использования аутокости, что упрощает операцию и уменьшает ее
травматичность.
Актуальность проблемы дегенеративных заболеваний
позвоночника обусловлена как неоднозначной трактовкой сути этой патологии, так
и противоречивыми подходами к ее лечению. Однако, несмотря на многообразие форм
дегенеративных поражений позвоночного столба, наиболее частыми причинами их
клинических проявлений, определяющих показания к хирургическому лечению,
являются сегментарная нестабильность и компрессия нервно-сосудистых образований
позвоночного канала. Сегментарная нестабильность может вызывать локальную
поясничную, псевдорадикулярную и радикулярную боль, а также быть причиной
развития неврологического дефицита. Широко применяемые и во многих случаях
весьма эффективные декомпрессивные операции могут вызвать или усилить
нестабильность [8, 11, 19, 24, 25]. Для устранения различных состояний, которые
могут быть обусловлены дегенеративными изменениями позвоночника, нередко
необходимы стабилизирующие операции, поэтому с позиций патогенеза хирургическое
лечение дегенеративных поражений позвоночника должно быть направлено не только
на декомпрессию нервно-сосудистых образований позвоночного канала, но и на
стабилизацию пораженного позвоночного сегмента.
В настоящее время существует множество методик
спондилодеза: передний [10, 14, 37], задний [22, 26, 27], задний межтеловой [9,
12, 16, 34], лапароскопический [35, 42] и другие. Межтеловой спондилодез
является одним из наиболее распространенных способов стабилизации позвоночника.
На протяжении многих лет единственным материалом, используемым с пластической
целью при выполнении спондилодеза, оставалась аутокость. Однако медленная
перестройка костного трансплантата с формированием межтелового блока требует
соблюдения длительного постельного режима в послеоперационном периоде.
Неизбежный для пациента физический, психологический и социальный дискомфорт, а
также слишком большая продолжительность госпитального и амбулаторного лечения
намного снижают достоинства аутокостной пластики и ставят под сомнение
адекватность длительного и непростого лечения его результатам [15, 18, 22, 29,
36, 39].
В настоящее время для выполнения межтелового
спондилодеза в качестве пластического материала, помимо аутокости, используется
аллокость, деминерализованный костный матрикс, биологически активные полимеры,
углеродистые материалы, пористая керамика, металлоимплантаты. Аллокость -
материал, длительно перестраивающийся, иммунологически активный, требующий
особенно тщательной стерилизации и консервации. Рассасывающиеся материалы по
своим механическим свойствам уступают костной ткани. Что касается углеродистых
материалов и пористой керамики, то основным их недостатком является хрупкость,
отсутствие эластичности, присущей костной ткани. Как показал анализ отдаленных
результатов, стабилизирующий эффект пористой керамики сохраняется в течение 3-4
мес. после операции. В последующем в связи с резорбцией кости на границе с
имплантатом возникает подвижность и формируется неоартроз, а расклинивающий
эффект имплантата теряется из-за его протрузии в губчатую кость тел позвонков
[6, 7]. Справедливости ради следует отметить, что не все авторы, применявшие
керамику, указывают на такого рода осложнения [2-4].
Зарубежными фирмами для межтелового спондилодеза
разработаны и выпускаются разнообразные имп-лантаты, изготавливаемые из титана
и полимерных материалов [28, 30-33, 40, 41]. Однако в любом случае эти
материалы представляют собой инородное тело, неспособное интегрироваться с
тканями организма, и могут быть использованы только в сочетании с костью.
С этих позиций представляет несомненный интерес
никелид тита-
на, который обладает рядом уникальных свойств.
Пористость материала, подобная пористости губчатой кости, и его высокая
биосовместимость обеспечивают прорастание фиброзной и костной ткани в имплантат
и его фиксацию к костному ложу. Благодаря сверхэластичности никелида титана и
его близким к костной ткани деформационным характеристикам, сохраняется
постоянный контакт имплантата с костным ложем при изменении механических
нагрузок на позвоночник [1, 5, 13, 17, 20, 21, 23, 38].
Целью исследования явилась оценка эффективности
применения межтеловых имплантатов из пористого никелида титана для различных
видов декомпрессивно-стабилизирующих операций при дегенеративных поражениях
поясничного отдела позвоночника.
Материал и методы
В период с 1998 по 2004 г. 459 пациентов с
дегенеративными поражениями поясничного отдела позвоночника оперированы с
применением межтеловых имплантатов из пористого никелида титана. Среди
пациентов было 262 (57 %) мужчины и 197 (43 %) женщин в возрасте от 28 до 67
лет (М = 48,6). В предоперационном периоде проводились общеклиническое,
неврологическое и рентгенологическое обследования (в ряде случаев МГ), МРТ, КТ.
Критерием отбора пациентов для хирургического
лечения служило наличие резистентных к консервативному лечению корешковых и рефлекторных
болей и боли в пояснице с наличием неврологического дефицита или без него.
Задний поясничный межтеловой спондилодез можно
схематично разделить на следующие этапы: 1 - хирургический доступ, 2 -
декомпресвание ложа для имплантатов в межте-ловом пространстве, 4 - введение
имплантатов в межтеловое пространство, 5 - ушивание операционной раны.
Ламинэктомия с удалением остистых и суставных
отростков для выполнения заднего межтелового спондилодеза является, на наш
взгляд, не всегда обоснованной. Резекция этих структур должна выполняться в
объеме, необходимом для полноценной декомпрессии нервно-сосудистых образований
позвоночного канала и достаточном для введения имплантатов в межтеловое
пространство. На основании своего опыта считаем, что для выполнения заднего
межтелового спондилодеза, при отсутствии показаний к экстенсивной декомпрессии,
вполне достаточно проведения расширенной двухсторонней интерламинэктомии с
экономной резекцией краев дужек и медиальных суставных отростков. Эту задачу
упрощает предложенная нами методика формирования канала для введения имплантатов.
Суть методики в том, что резекцию краев дужек и суставных отростков для
формирования канала, через который вводится имплантат, осуществляют
фрезой-ри-мером через боковой вырез в защитном рукаве-направителе (рис. 2).
Задний межтеловой спондилодез выполнялся не
только как самостоятельный способ стабилизации позвоночника, но также и в
сочетании с транспедикулярной фиксацией. Сочетание межтелового спондилодеза с
транспедикулярной фиксаций применяли при относительно сохранной высоте
пораженного межпозвонкового диска и при наличии дегенеративного спондилолистеза
(рис. 3).
В 362 случаях задний межтеловой спондилодез был
выполнен двумя им-плантатами из пористого никелида титана и в 23 случаях -
одним (при сочетании с транспедикулярной фиксацией).
Передний поясничный межтеловой спондилодез
выполняли по традиционной методике из забрюшинного доступа. С помощью долота и
кюреток удаляли межпозвонковый диск с гиалиновыми пластинками, сохраняя при
этом целостность кортикальной кости. Имплантат располагали в межтеловом промежутке
так, чтобы его передняя поверхность заходила за передний край тел позвонков, а
задняя - не достигала дорсальных отделов тел и не выступала в просвет
позвоночного канала. Размеры имплантата подбирали таким образом, чтобы его
высота была на 3-4 мм больше высоты межтелового промежутка, что позволяло
добиться эффекта расклинивания.
Следует отметить, что пористый никелид титана
легко обрабатывается при помощи долота или костных щипцов. Это позволяет при
необходимости осуществлять дополнительное интраоперационное моделирование
имплантата для придания ему нестандартных формы и размеров.
Оперированных укладывали в постель без
какой-либо наружной иммобилизации и после снятия швов с кожной раны на
девятые-десятые сутки переводили в вертикальное положение. В течение трех-шести
последующих месяцев осуществляли наружную фиксацию поясничного отдела
позвоночника полужестким корсетом.
Трансабдоминальный лапароскопический
пояснично-крестцовый спондилодез выполнен нами в 1999 г. впервые в России . Для
эндоскопических трансабдоминальных операций пояснично-крестцовый отдел
позвоночника является анатомически наиболее привлекательным: межпозвонковый
диск L5-S1
доступен для лапароскопических манипуляций между подвздошными сосудами ниже их
бифуркации.
Операцию начинали с пункции брюшной полости и
создания СО2 пневмоперитонеума. Внутрибрюшное давление газа при миорелаксации
поддерживали на уровне 10-14 mm
Hg в течение всей
операции. Для выполнения дискэктомии и межтелового спондилодеза использовали
четыре эндоскопических порта: в субумбиликальной области, в правой и левой
гипогастральных областях диаметром по 11 мм и по средней линии над симфизом
диаметром 22 мм.
В положении Тренделенбурга, с опущенным на
15-20° головным концом операционного стола, смещали тонкий кишечник в надчревную
область, а сигмовидную кишку отводили влево. Брюшину над диском L5-S1
рассекали продольным разрезом между подвздошными сосудами дистальнее их
бифуркации. Расположенную под брюшиной жировую клетчатку расслаивали тупфером,
используя для гемостаза биполярную коагуляцию. Срединную сакральную артерию и
сопровождающую ее вену клипировали и пересекали. После обнажения
межпозвонкового диска иссекали переднюю часть фиброзного кольца и через
образовавшееся окно выполняли дискэктомию с тщательным удалением гиалиновых
пластинок. Дистракцию позвоночного сегмента осуществляли с помощью специальных
шаблонов-дистракторов, последовательно вводимых в межтеловой промежуток. Затем
шаблоны заменялись имплантатами соответствующего размера, которые фиксировали
позвоночный сегмент в в сроки 24 мес. после операции и более. Оценивали
динамику болевого синдрома по визуально-аналоговой шкале (ВАШ), заполняемой
самим пациентом, а также по индексу Освестри.
О формировании межтелового блока после
выполнения спондилодеза судили на основании рентгенологических, МРТ- и
КТ-данных. Рентгенологические исследования включали измерение высоты передних и
задних отделов межтелового промежутка до операции и после ее выполнения, а
также определение флексионно-экстензионной разницы сегментарного угла на уровне
хирургического вмешательства. Изменение величины сегментарного угла в положении
флексии и экстензии менее чем на 5° расценивалось как подтверждение стабильного
состояния позвоночного сегмента и формирования межтелового блока.
Результаты
Ни у одного из пациентов не отмечено усиления
болевого синдрома после хирургического вмешательства. В большинстве случаев
боль регрессировала в первые дни после операции, что свидетельствовало об
адекватной декомпрессии нервно-сосудистых образований и стабилизации
позвоночного сегмента. Для оценки нарушений функциональной дееспособности
определяли индекс Освестри по шкале от 0 до 100 %. Значения индекса от 0 до 20
% означают минимальные нарушения, от 21 до 40 % - умеренные, от 41 до 60 %-
тяжелые, от 61 до 80 % - инвалидизирующие; значения от 81 до 100 %
свидетельствуют о нарушениях, приковывающих к постели, или о преувеличении
жалоб. Динамика индекса Освестри после проведения хирургического лечения
представлена в табл. 3.
Функциональные результаты проведенного хирургического
лечения оценивались с учетом степени восстановления физической и социальной
активности пациентов. Критерии оценки результатов лечения были следующими:
хороший результат: полное или почти полное
возвращение к прежнему (до начала или последнего обострения болезни) уровню
социальной и физической активности, возможно ограничение больших физических
нагрузок;
удовлетворительный результат: бытовая и
социальная активность восстановлены не полностью, возможны только небольшие
физические нагрузки;
неудовлетворительный результат: отсутствие
эффекта от операции или ухудшение.
В большинстве случаев через 18-24 мес. после
операции отмечено полное или частичное восстановление функциональной
активности, что позволило рассматривать результаты лечения как хорошие и
удовлетворительные (табл. 4).
Рентгенологические исследования ни в одном из
случаев не выявили разрушения имплантатов и признаков резорбции костной ткани
вокруг них, а также миграции имплантатов в тела позвонков. По
рентгенологическим данным, после выполнения заднего межтелового спондилодеза
флексионно-экстензионная разница
сегментарного угла на уровне вмешательства лишь
в 6 из 102 исследованных случаев (5,2 %) превысила 5°. В остальных наблюдениях
(94,8 %) средняя амплитуда сегментарного угла при флексии и экстензии была
менее 5° и составила в среднем 2,4°. После выполнения переднего забрюшинного
межтелового спондилодеза флексионно-экстензионная амплитуда сегментарного угла
превышала 5° в одном случае из 32 (3,1 %), а после эндоскопического трансабдоминального
спондилодеза - в одном случае из 20 (5 %).
Данные рентгенологического и КТ исследований,
проведенных в сроки от шести месяцев до двух лет, свидетельствовали об
остеоинтеграции имплантатов с формированием межтелового костно-металлического
блока (рис. 6, 7).
Осложнения. Возникшие осложнения разделены на
две группы: связанные с применением имплантатов и обусловленные другими
причинами. Осложнения, не связанные с использованием имплантатов, были обычными
для выполнявшихся видов хирургических вмешательств (табл. 5).
После выполнения заднего межтелового
спондилодеза у двух пациентов развилось нагноение подкожной гематомы, не
распространявшееся глубже апоневроза; кожные раны зажили вторичным натяжением,
удаления имплантатов не потребовалось. Повреждения твердой мозговой оболочки не
осложнили течение послеоперационного периода, потребности в реоперации не
возникло.
Послеоперационные парезы и нарушения
чувствительности в нижних конечностях были связаны, как правило, с нарушением
функции спинномозговых корешков L5
Б Однако на фоне проводившейся восстановительной терапии отмечено полное или
частичное восстановление силы и чувствительности. У одного пациента после
декомпрессивно-стабилизирую-щей операции с транспедикулярной фиксацией и задним
межтеловым спондилодезом L3-L4-L5,
выполненными в связи с дегенеративным стенония сила в нижних конечностях
восстановилась до чегырех баллов.

В результате выполнения переднего межтелового
спондилодеза из забрюшинного доступа в одном случае образовалась подкожная
серома. После ее опорожнения и перевязок произошло заживление раны, удаления
имплантата не потребовалось.
В одном случае возник парез бедренного нерва на
стороне хирургического доступа к позвоночнику и межпозвонковому диску,
обусловленный повреждением нервного ствола в толще паравертебральных мышц.
При выполнении эндоскопического
трансабдоминального пояснично-крестцового спондилодеза в одном случае была
повреждена левая подвздошная вена, что потребовало наложения сосудистого шва. У
одного пациента возникла ретроградная эякуляция, которая регрессировала в
течение трех месяцев.
Миграция имплантатов отмечена в четырех
наблюдениях (0,9 % от общего числа оперированных): в трех - после выполнения
заднего межтелового спондилодеза и в одном - после эндоскопического
трансабдоминального. У двух пациентов, оперированных по поводу дегенеративного
спондилолистеза, смещение им-плантатов произошло после выполнения межтелового
спондилодеза без дополнительной транспедикулярной фиксации. В трех случаях
потребовалась реоперация;в одном случае миграция имплантатов после заднего
межтелового спондилодеза была бессимптомной, через два года после спондилодеза
пациент чувствовал себя практически здоровым.
Сегментарная нестабильность и сужение
позвоночного канала являются основой формирования разнообразных клинических
синдромов при дегенеративных поражениях позвоночника. В этой связи
хирургическое лечение дегенеративной патологии позвоночного столба направлено,
главным образом, на декомпрессию нервно-сосудистых образований позвоночника и
его стабилизацию. К настоящему времени разработано множество способов
стабилизации позвоночника, но, несмотря на это, основным из них по-прежнему
остается межтеловой спондилодез. Использование для выполнения межтелового
спондилодеза разнообразных конструкций позволило улучшить результаты лечения и
намного сократить его сроки. Однако применяемые имплантаты, изготавливаемые из
различных материалов, в том числе из титана, по своей структуре и механическим
свойствам резко отличаются от живой ткани, что диктует необходимость
дополнительного использования аутокости. В этой связи заслуживает внимания
пористый никелид титана, обладающий остеоинтегративными свойствами.
Проведенное исследование было направлено на
оценку эффективности использования имплантатов из пористого никелида титана для
межтелового спондилодеза при хирургическом лечении различных форм дегенеративных
поражений поясничного отдела позвоночника. В зависимости от
клинико-морфологических особенностей патологии выполняли стабилизирующие и
декомпрессивно-стабилизирующие операции: передний межтеловой спондилодез,
задний межтеловой спондилодез, эндоскопический пояснично-крестцовый
спондилодез.
Непосредственные результаты хирургических
вмешательств зависели от правильного выбора хирургической тактики и
адекватности хирургического вмешательства, направленного на декомпрессию
нервно-сосудистых образований и стабилизацию позвоночника. Существуют различные
мнения об исключительных достоинствах тех или иных хирургических технологий и
хирургических доступов к позвоночнику. На наш взгляд, выбор способа
хирургического лечения должен быть дифференцированным и основываться на
клинических и патоморфологических особенностях конкретного случая. При наличии
дегенеративного стеноза позвоночного канала, мигрировавшей секвестрированной
грыжи, а также спондилолистеза, когда помимо межтеловой фиксации была нужна и
транспедикулярная, мы отдавали предпочтение декомпрессивно-стабилизирующим
операциям из заднего доступа.
Динамика клинической симптоматики у
оперированных больных была положительной: отмечался значительный регресс
болевого синдрома (ВАШ) и нарушений функциональной дееспособности (индекс
Освестри); ни у одного из оперированных не было усиления болей после операции.
Функциональные результаты лечения через 18-20 мес. после операции оценены как
хорошие и удовлетворительные в 94,1 % случаев.
Глава 6. ПОЛИМЕРНЫЕ
КОРОНОЭЛЕКТРЕТЫ: ТРАДИЦИОННЫЕ И НОВЫЕ ТЕХНОЛОГИИ И ОБЛАСТИ ПРИМЕНЕНИЯ
Области применения полимерных электретов
Электретом называют диэлектрик, длительное время
сохраняющий поляризованное состояние после снятия внешнего воздействия, которое
привело к поляризации (или заряжению) этого диэлектрика, и создающий в
окружающем пространстве квазипостоянное электрическое поле. Электреты способны
создавать постоянные электрические поля без дополнительных источников питания и
высоковольтных преобразователей, являясь аналогом аккумуляторов электрических
зарядов, что, несомненно, находит отклик прикладного характера.
Существует несколько традиционных областей
применения электретов. Они применяются в качестве элементов:
преобразователей механических, тепловых,
акустических, оптических, радиационных и др. сигналов в электрические (в
импульсы тока), запоминающих устройств, электродвигателей, генераторов и т.д.;
фильтров и мембран;
противокоррозионных конструкций;
узлов трения;
систем герметизации;
медицинских аппликаторов, антитромбогенных
имплантантов
и т. д.
Наибольшее распространение электреты получили в
производстве преобразующих устройств, являющихся элементами систем
автоматического управления и обработки данных. Они служат для превращения
сигналов, поступающих на вход системы, в сигналы той же или другой физической
природы, более удобные для обработки, передачи, измерения или регистрации
информации. По природе входных сигналов различают механические, акустические,
электрические, оптические, тепловые и радиационные электретные преобразователи.
Электреты могут применяться и в качестве своеобразных аккумуляторов
электрической энергии. Нагревание электрета, например в аварийной ситуации,
может дать ток ТСД, достаточный для питания радиопередатчика. В качестве
кратковременного электрического источника используют полимерные пьезоэлектрики.
С помощью многослойных пьезоэлектрических элементов можно получить высокую
отдачу энергии с единицы площади, что бывает необходимо в системах зажигания, и
т.п.
Процессы создания или, наоборот, нейтрализации
электретного состояния нашли широкое использование в электрофотографии,
например, ксерографии, электростатической записи информации, электретной
дозиметрии (о поглощенной дозе ионизирующего излучения судят по спаду
поверхностного электрического заряда электрета).
Действие электретных фильтров основано на
улавливании аэрозольных частиц с помощью механических и электрических сил. Если
частицы заряжены, то они притягиваются к электретному элементу фильтра
кулоновскими силами. На нейтральных диэлектрических частицах в неоднородном
поле электрета наводится заряд. Электрическое удерживание частиц весьма
эффективно даже при недостаточной прочности механического удержания, т. о.
диаметр частиц может быть значительно меньше диаметра ячеек фильтроэле-мента.
По виду электретного элемента различают два
основных типа электретных фильтров - с конструкционными электретными деталями и
с волокнистыми электретными материалами. Типичный пример первых - электретные
водяные распылители для осаждения пыли. Водяную пыль разбрызгивают с помощью
электретных форсунок. Капли воды, контактируя с электретным элементом форсунки,
приобретают заряд и более эффективно поглощают заряженные частицы пыли.
Приоритет в создании электретных волокнистых фильтров принадлежит И.В.
Петрянову. Разработанные им волокнистые электретные фильтры представляют собой
слой заряженных тонких полимерных волокон, нанесенных на тканевую подложку или
нетканое основание из скрепленных между собой более толстых полимерных волокон.
Интересно, что электретные фильтры эффективны не
только для очистки воздуха и различных газов от твердых частиц (пыли). Известны
примеры использования электретных фильтров воздуха от жидких аэрозольных
включений и жидких сред от механических примесей, биозагрязнений и т.п.
В последнее время появились данные об
использовании электретных композитов в узлах машин для решения проблем защиты
металлов от коррозии, повышения герметичности соединений и улучшения
триботехнических характеристик узлов трения.
Установлено, что термоэлектретные покрытия, у
которых с подложкой контактирует поверхность, имеющая отрицательный заряд,
отслаиваются медленнее, а «разблогара-живание» (отслаивание, сопровождающееся
смещением электродного потенциала металла в область отрицательных значений)
металла подложки у них значительно меньше, чем у неэлектретных покрытий.
Использование электретных материалов в узлах
трения позволяет регулировать процессы, сопровождающие трение и имеющие
электрическую природу: накопление зарядов, электродные реакции, прохождение
тока и т. д. Установлено, что, поддерживая заданный оптимальный потенциал,
можно управлять трением и изнашиванием металлов в металлополимерных узлах.
Примеров эффективного использования поляризационного состояния полимера для
снижения коррозионно-механического износа деталей узла трения является опора
скольжения, содержащая вал и металлополимерный вкладыш в виде трех коаксиальных
втулок. При поляризации полимерного элемента вкладыша, вызывающейсмещение
электродного потенциала вала в область пассивного состояния, наблюдается резкое
(в 5 - 6 раз) снижение коррозионно-механического износа вала.
Электретные элементы уплотнений являются
компактным и технологически простым средством регулирования параметров
герметизации. Широкое распространение в машиностроении получила герметизация
соединений деталей машин с помощью полимерных покрытий. Они используются как
самостоятельный герметизирующий элемент или как средство повышения
герметичности контактных уплотнений. Напряжения сдвига, возникающие при монтаже
соединений, способствуют перераспределению полимерного материала в
микрозазорах, обеспечивая высокую степень герметичности и жесткость. К примеру,
разработан способ резьбового соединения стальных деталей путем поляризации слоя
полимерного материала в процессе монтажа уплотнительного узла.
Полимерные покрытия и прослойки помимо своего
основного назначения по обеспечению герметичности соединения могут выполнять
дополнительную функцию по контролю контактного давления. При этом функции
элементов тензодатчика - чувствительного элемента и электродов - выполняют
детали самого герметизируемого соединения: уп-лотнительные прокладки (или
покрытия) и металлические детали сопряжения. Во многих случаях для такого
совмещения функций не требуется никакого изменения конструкции соединения.
Помимо вышеупомянутых традиционных областей
применения, электретный эффект нашел неожиданное применение в медицине. Речь
идет, прежде всего, об электретных имплантантах, стимулирующих рост и
восстановление костной ткани, применение которых имеет почти 20-летнюю историю.
Долгое время считалось, что электретов, в отличие от ферромагнетиков, в природе
не существует. Однако оказалось, что многие ткани живого организма находятся в
электретном состоянии, т.е. являются биоэлектретами. Потенциал, создаваемый
биоэлектретами, называют Z-потенциалом.
Внутренние стенки кровеносных сосудов, лейкоциты, эритроциты и другие элементы
крови обладают отрицательным зарядом; в связи с этим существует предположение,
что именно благодаря наличию заряда кровь легко проходит по тончайшим
капиллярам, несмотря на ее высокий молекулярный вес.
При болезни, повреждении сосудов или по иной
причине Z-потенциал
исчезает, кровь сворачивается и образуется ее сгусток - тромб, поэтому во
многих случаях необходима замена сосудов на искусственные. Технология
использования в хирургии подобных имплантантов - искусственных кровеносных
сосудов - сопряжена с проблемой повышенной свертываемости крови в этих сосудах,
поскольку имплантанты не обладают Z-потенциалом.
Электретирование внутренней поверхности искусственных сосудов исключает
образование агрегатов частиц крови и, как результат, снижает вероятность
возникновения тромбоза.
Еще одним направлением применения электретов в
медицине является использование электретных деталей эндопротезов суставов,
улучшающих их биосовместимость с живыми тканями человеческого организма и
уменьшающих их изнашиваемость. Действие подобных электретных элементов
заключается в формировании в эндопротезе Z-потенциала,
необходимого для нормального функционирования прооперированной области
организма.
Применение электретных покрытий позволяет
направленно влиять на процессы репаративного остеосинтеза при лечении больных с
травматическими повреждениями костей лицевого черепа, а также при дентальной
имплантации. Так, существует методика имплантирования на место перелома
титановой пластины-фиксатора, на поверхность которой нанесена пленка электрета.
В результате этого производится не только механическая фиксация костных
отломков, но и воздействие электрического поля электретного покрытия на
травмированную кость. Это приводит к сокращению сроков сращивания костей в 2 -
2,5 раза без послеоперационных осложнений.
Для усиления репаративных процессов при лечении
дефектов кожных покровов, нейротрофических язвах, термических поражениях служит
электретный аппликатор, представляющий собой упругую титановую основу, на
которую нанесена био - и химически инертная электретная пленка пятиокиси
тантала, создающая в непосредственной близости у поверхности аппликатора слабое
квазистационарное поле.
Электреты используются и в макромолекулярных
терапевтических системах (МТС) для обеспечения доставки лекарственных веществ в
определенном количестве в конкретную пораженную область организма. В этом
случае электретный заряд регулирует высвобождение молекул лекарственного
вещества.
Можно привести и другой пример позитивного
влияния электрических полей малой напряженности на человека. Методы лечения,
основанные на дозированном воздействии на организм человека электрического
тока, электрического и электромагнитного полей, называют электролечением. Сюда
относят, например, франклинизацию, УВЧ-терапию, электроанелгезию
(электропунктуру) - методы, напрямую использующие электрические поля различных
характеристик. На основе электретных полимерных пленок изготавливаются аппликаторы,
снимающие боль различных органов человека.
Электреты нашли применение и в другой области
медицины - для упаковки стерильных медицинских инструментов. Электрическое поле
электрета дает дополнительную гарантию защиты упакованных предметов от
обсеменения болезнетворными бактериями и вирусами.
В биотехнологии электреты используются в
качестве эффективного средства воздействия на микроорганизмы. Например,
применение электретных фильтров-мембран для эффективного разделения, очистки и
концентрирования биологических продуктов (переработка молока, получение
очищенных фракций крови и лекарств), позволяет избежать фазовых переходов,
изменения рН и температуры фильтруемых продуктов при протекании этих процессов.
Полимерные волокнистые материалы с иммобилизованными микроорганизмами
применяются для производства биофильтров при глубокой биоутилизации сточных
вод.
Известны примеры применения электретов и в
биоэлектронике. Замена традиционных полупроводников органическими молекулами
или их группами дает возможность создания миниатюрных электронных устройств.
Например, для получения изолирующих и пассивирующих покрытий толщиной 2,5 -
50,0 нм в полупроводниковых структурах используются пленки Ленгмюра-Блоджет.
Другое перспективное направление биоэлектроники - миниатюрные биосенсоры на
основе электретов, позволяющие обнаружить малые концентрации химических веществ
в различных средах, что с успехом применяется медицине, инженерной экологии,
химической и пищевой промышленности и др.
Учитывая литературные данные о том, что электрические
поля могут подавлять рост и развитие микроорганизмов, было высказано
предположение, что упаковка, созданная на основе электретов, может
способствовать увеличению срока хранения различных пищевых продуктов, и что
подобную упаковку также можно назвать активной.
Проведенные исследования на ряде молочных
продуктов, фруктах и овощах, мясе и хлебобулочных изделиях позволяют
утверждать, что электрическое поле разработанной активной упаковки позволяет
увеличить срок хранения, сохранить органолептические ифизические характеристики
различных продуктов питания. Полученные данные свидетельствуют о негативном
влиянии электрических полей упаковки на микроорганизмы, содержащиеся в
продуктах питания и являющихся основной причиной их порчи. Кроме того, активные
электретные материалы могу влиять на равновесие коллоидных систем, какими
являются многие пищевые продукты, например, молочные. Подобная упаковка
позволяет исключить из цикла производства консерванты. Недорогой процесс
изготовления электретной «активной» упаковки, вкупе с ощутимым экономическим
эффектом и возможностью рекламирования с точки зрения безопасности
использования делают подобный материал довольно конкурентоспособным на рынке
упаковочных материалов.
Технологии получения полимерных короноэлектретов
Полимеры, как основной материал для создания
электретов, во многих случаях не обладают необходимыми механическими,
теплофизическими и другими свойствами, необходимыми для их практического
применения. В то же время жизнь требует материалы с новыми свойствами. Поэтому
для получения электретных материалов с заданными свойствами целесообразно
применять композиции, состоящие из полимерного связующего и наполнителей
различной природы. При наполнении полимеров дисперсными наполнителями в
композиционных материалах возникают новые структурные элементы, способные
служить ловушками носителей зарядов, что обуславливает изменение электретных
характеристик диэлектриков.
Метод коронного разряда на сегодняшний день
является наиболее распространенным в производстве полимерных электретов.
Преимуществами коронной электризации являются простота аппаратуры, довольно
высокая скорость процесса и равномерное распределение зарядов по поверхности. В
основе метода поляризации диэлектриков с помощью коронного разряда лежит
перенос носителей заряда из области электрического разряда в воздушном
(газовом) зазоре на поверхность диэлектрика и фиксирование их на энергетических
поверхностных и объемных ловушках. Поверхностными ловушками могут служить
химически активные примеси, специфические поверхностные дефекты, вызванные
процессами окисления, адсорбированные молекулы, различия в порядке расположения
молекул на поверхности и в объеме. Возникновение объемных ловушек может быть
связано также с наличием примесей, дефектов мономерных единиц, нерегулярностей
в цепях и несовершенств кристаллических образований. Ловушками также могут
служить граница раздела фаз и свободный объем полимера.
Дешевизна и распространенность ряда
крупнотоннажных полимеров (полиэтилена, полипропилена, полистирола и др.)
делает их очень перспективными материалами для получения короноэлектретов. Не
случайно, большое количество работ по изучению электретного эффекта в
диэлектриках посвящено этим полимерам.
Полученные данные свидетельствуют о том, что
добавление сегнетоэлектрических наполнителей ведет к росту значений электретных
характеристик полиэтилена, но только до определенной степени наполнения, после
чего наблюдается их снижение (рис. 1).
Однако для некоторых полимерных композиций было
выявлено, что при определенных температурах предварительного нагрева перед
электретированием Тпол применение сегнетоэлектрика позволяет на порядок
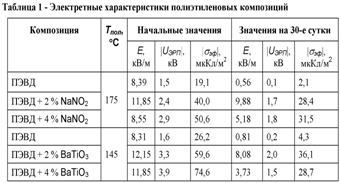
повысить значения электретных характеристик полимера (табл. 1). Данный эффект
был связан с особенностями поведения сегнетоэлектриков в точке Кюри. Если перед
электретированием сегнетоэлектрик находится в параэлектрической фазе, а полимер
- в вязко-текучем состоянии, то процесс перехода наполнителя в
сегнетоэлектрическую фазу осуществляется при охлаждении полимерной матрицы в
короне. При этом полимер затвердевает и фиксирует, «замораживает» доменные
кристаллы сегнетоэлектрика в ориентированном состоянии - наблюдается
существенное повышение электретных характеристик композиций. Этот факт
проявляется, в частности, для композиций ПЭВД с NaNO2
и с Ва-ТЮэ, которые имеют точку Кюри выше температуры плавления полиэтилена
(165 и 133 °С соответственно).
При электретировании в коронном разряде
композиционных пленок и пластинок на основе полиэтилена и дисперсных сегнетоэлектриков
при предварительном прогреве до температуры ниже плавления полимера (например,
90 °С), зависимости иЭРП от содержания различных сегнетоэлектриков имеют
похожий вид и не зависят от температуры Кюри применяемых наполнителей (рис. 1).
Это указывает на то, что сегнетоэлектрики не поляризуются и их влияние на
электретные характеристики ПЭВД аналогично влиянию обычных дисперсных
наполнителей. Значит, повысить электретные свойства полимеров можно вве-дением
обычных порошкообразных наполнителей. Действительно, повышение содержания в
композиционном материале дисперсного наполнителя сначала увеличивает, а затем
снижает значения электретные характеристики полимеров. Для различных полимеров
и разных типов наполнителя общий ход зависимости электретной разности потенциалов
Uspn и других
электретных характеристик композиций от содержания наполнителя сохраняется
(рис. 2-5).
Повышение электретной разности потенциалов и
других электретных характеристик полимерных композиций при введении малого
количества (до 4 об. %) наполнителя можно объяснить рядом факторов.
Во-первых, при наполнении полимеров твердыми
дисперсными наполнителями возникают новые структурные отклонения в полимерной
матрице, способные служить ловушками носителей зарядов: граница раздела фаз,
разрыхленный адсорбционный слой полимера вблизи поверхности наполнителя.
Наполнение полимеров приводит к изменениям в характеристиках надмолекулярного
структурообразования (размер, форма, тип распределения по размерам) и в
плотности упаковки, так как твердые высокодисперсные наполнители могут служить
зародышеобразователями кристаллов и причиной появления их несовершенств.
Наполнители оказывают значительное влияние на подвижность различных
кинетических единиц полимера и на спектр времен его релаксации. В присутствии
наполнителей в полиэтилене образуются карбоксильные, карбонильные, пероксидные
и гидропероксидные группы, возникающие в первую очередь на границе раздела
полимера с поверхностью наполнителя. Кроме того, вследствие протекания
механохимической деструкции при смешении компонентов композиции, появляются
свободные радикалы, также способные служить энергетическими ловушками зарядов.
Во-вторых, в гетерогенных системах наблюдается
эффект Максвелла-Вагнера - поляризация на границе раздела фаз, обусловленная
разностью электропроводности двух компонентов системы.
В-третьих, вследствие адсорбции макромолекул
полимеров на твердой поверхности дисперсных наполнителей снижается их
подвижность, что значительно уменьшает скорость релаксационных процессов.
О роли границы раздела фаз в проявлении
полимерными композиционными материалами электретных свойств говорит влияние на
них удельной поверхности используемых наполнителей: чем выше значения Syd,
тем сильнее и стабильнее проявляется электретный эффект.
Снижение электретных характеристик композиций
при введении большего количества наполнителя (рис. 1-5) связано со следующими
причинами. Во-первых, при окислении полимеров в поле коронного разряда
появляются полярные группы, формирующие гетерозаряд. Во-вторых, уменьшение
электретных характеристик полимерных композиций может быть объяснено простым
снижением в них количества электретируемого компонента, т. е. полимера.
Для ряда наполнителей характерно придание
полимерам (при больших степенях наполнения) антистатических или даже электропроводящих
свойств. Электропроводность композиций определяющим образом влияет на скорость
спада их электретного заряда. Например, порог перколяции, то есть концентрация
технического углерода, при котором композиция начинает проводить электрический
ток, для саженаполненного полиэтилена составляет, в зависимости от марки, от 9
до 14 об. %. Композиции с концентрацией технического углерода выше этого
значения не электретируются в коронном разряде.
Таким образом, на основе крупнотоннажных
полимеров возможно создание электретных материалов с ярко выраженным
электретным эффектом, что достигается введением в них 2-6 об. % дисперсного
наполнителя.
Вышеуказанные объяснения подтверждаются с
помощью данных термостимулированной деполяризации (ТСД) полимерных и композиционных
электретов. При изучении спектров ТСД впервые было обнаружено появление при
наполнении полимеров новых уровней захвата инжектированных носителей зарядов
(рис. 6-9).
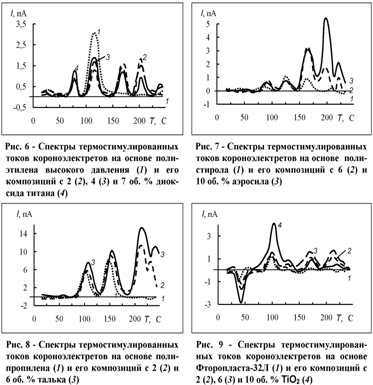
Наряду с пиками, характерными для ненаполненных полимеров
(например, полиэтилена - при ~80 °С и -110 °С), на спектрах ТСД наблюдаются
новые пики (для полиэтилена - два пика при -165 °С и -200 °С). Энергии
активации процесса релаксации заряда, соответствующих новым пикам в полимерных
композициях, в 2-3 раза больше, чем энергия активации релаксации заряда в
ненаполненных полимерах. Чем больше наполнителя, тем больше интенсивность пиков
на кривых ТСД (рис. 6, 7), что вполне ожидаемо, поскольку с ростом наполнения
увеличивается площадь границы раздела фаз полимер - наполнитель.
Появление новых пиков ТСД характерно для всех
исследуемых композиционных короноэлектретов (рис. 8, 9).
С позиции обнаруженных закономерностей
интересными представляются данные изучения композиционных электретов на основе
полиэтилена и сегнетоэлектрических наполнителей (рис. 10). Если композиции
перед электретированием в коронном разряде нагревались до 90 °С, то на спектрах
токов ТСД после пиков, характерных для ПЭВД наблюдался положительный пик при
температуре ~145 °С (рис. 10, кр. 1, 3). Если же предварительный нагрев
осуществлялся до 145 °С, то на спектрах токов ТСД наблюдалось появление
отрицательных пиков при температуре ~140 °С (рис. 10, кр. 2, 4).
При термообработке ненаполенных полимеров, не
обладающих высокотемпературными уровнями захвата инжектированных носителей
зарядов, релаксация заряда происходит полностью. В то же время, величины Uspn
и Оэ<р композиционных электретов до нулевых значений не спадают, что
подтверждает сделанное предположение.
Приведенные данные позволяют предположить
возможность получения электретных изделий непосредственно из электретных пленок
и пластинок вакуум-, пневмоформованием, штампованием - обычными методами
переработки пластмасс.
7. антисептики нового
поколения. фармакология катапола и родственных соединений
Известно, что более 50% заболеваний человека
вызывается живыми возбудителями - бактериями, риккетсиями, спирохетами,
простейшими, хламидиями, вирусами и др. [9, 13]. Для борьбы с ними используются
многочисленные лекарственные вещества, которые могут препятствовать размножению
возбудителя (бактериостатический тип действия), либо вызывать его гибель
(бактерицидный тип действия). Часто одно и то же вещество в различных
концентрациях может оказывать разное действие: в низких - бактериостатическое,
в высоких - бактерицидное. Многочисленные противомикробные и
противопаразитарные средства целесообразно делить на следующие группы:
дезинфицирующие;
антисептические;
химиотерапевтические.
Все три группы препаратов имеют весьма важное
значение, поскольку в медицинской практике необходимо повседневно соблюдать
правила дезинфекции различных предметов, помещений и т. д., правила асептики и
антисептики, а также нормы и правила лечения химиотерапевтическими препаратами.
Остановимся более подробно на первых двух группах средств - дезинфицирующих и
антисептических.
Первые научные попытки использования различных
средств, обладающих антисептическими свойствами (хлорная известь, соли тяжелых
металлов, этиловый спирт), с целью борьбы с гнойными осложнениями были сделаны
в первой половине XIX века. Следует упомянуть несколько имен исследователей,
внесших крупный вклад в данную проблему. Это наши соотечественники А. П.
Нелюбин, И. В. Буяльский, Н. И. Пирогов, венгр И. Земельвейс, англичанин Дж.
Листер.
Дезинфицирующие средства - это препараты,
предназначенные для уничтожения микроорганизмов во внешней среде. Эти средства
используются для обеззараживания предметов, помещений, средств транспорта,
выделений и одежды больных, а также здоровых людей (носителей), которые могут
быть источником инфекции. Препараты должны обладать мощным противомикробным и
противопаразитарным действием, но при этом не повреждать предметы и не
представлять опасности для людей, соприкасающихся с этими веществами при
правильном с ними обращении. Антисептики - средства, используемые для
воздействия на патогенные микроорганизмы на поверхности тела человека (кожа,
слизистые), в естественных полостях, ранах и соприкасающимися с ними тканях.
Они обладают сильным противомикробным действием, не должны оказывать раздражающего
или повреждающего влияния на ткани, задерживать процессы регенерации. Эти
средства также не должны резорбироваться в значительных количествах.
Провести резкую границу между антисептиками и
дезинфицирующими веществами не всегда возможно, поскольку многие вещества в
определенных концентрациях используют как антисептики, а в более высоких
концентрациях - с целью дезинфекции.
Химиотерапевтические средства предназначены для
подавления жизнедеятельности или -уничтожения возбудителей в тканях и средах организма
человека. Лечебный эффект этих средств обусловлен преимущественно их
воздействием на микробы после их резорбции (всасывания), но многие препараты
могут использоваться местно. Химиотерапевтические средства должны обладать
низкой токсичностью, хорошо проникать через биологические барьеры в
инфицированные ткани и среды, не оказывать негативного влияния на функции
печени, почек, другие органы, а также иммунитет. Фармакокинетика препаратов
должна обеспечивать поддержание терапевтических концентраций в местах
локализации паразитов достаточно долгое время (несколько часов).
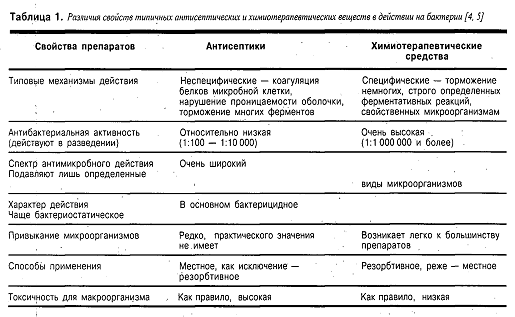
Различия в действии антисептиков и
химиотерапевтических средств суммированы в таблице 1.
Препараты, относящиеся к дезинфицирующим и
антисептическим средствам, подразделяются на несколько групп (табл. 2).
Галогенсодержащие препараты подразделяются на
две большие подгруппы - хлорсодержащие и йодсодержащие. Рассмотрим более
подробно механизм действия хлорсодержащих веществ (хлорная известь, хлорамин Б,
аквасепт). В водных растворах эти вещества образуют хлорноватистую кислоту
(НСЮ);. Дальнейшее ее превращение зависит от рН среды. При кислой и нейтральной
реакции хлорноватистая кислота распадается с освобождением атомарного кислорода
и хлора. Атомарный кислород взаимодействует с белками микробной стенки и
окисляет их - коагулирует белки, вследствие чего развивается гибель
микроорганизмов. Хлор вступает в реакцию с аминогруппами белков, замещает в них
водород; нарушается образование водородных связей между полипептидными цепями,
следствие чего -j- гибель
микроорганизмов. В щелочной среде хлорноватистая кислота диссоциирует с
образованием |ипохлоридного иона СЮ", который является окислителем.
Гипохлоридный ион обладает меньшей активностью, чем атомарный кислород и хлор.
! Показания к применению:
i - обработка рук,
слизистых оболочек (0,25-0,5% хлорамин Б);
лечение/и обработка инфицированных ран
(1,5-2%.хлорамин Б); •
, - дезинфекция неметаллических инструментов
(1-2%|раствор хлорамина Б);
дезинфекция предметов ухода и выделений больных
при инфекционных заболеваниях (1 -5% хлорамин Б);
- обеззараживание воды (пантоцид, аквасепт).

Катапол обладает широким спектром антимикробного
действия, проявляет бактерицидную активность в отношении стафилококков,
стрептококков, грамотрицательных бактерий (кишечной и синегнойной палочек,
протея, клибсиеллы и др.), анаэробных бактерий, грибов и плесеней. Препарат
действует на штаммы бактерий, устойчивых к антибиотикам и другим химиотерапевтическим
препаратам; усиливает действие различных антибиотиков при совместном
применении; подавляет ферменты патогенности бактерий (плазмокоагулазу и
гиалуронидазу стафилококков). При комбинированном использовании с
окситетрациклином катапол разрушает клеточную стенку и цитоплазматическую
мембрану E.coli.
Использование низких предлитических концентраций (0,0001%) препарата позволяет
существенно повысить чувствительность антибиотикоустойчивых штаммов бактерий к
тетрациклину, стрептомицину, пенициллину, эритромицину. При более высоких
концентрациях резко возрастает проницаемость мембран клеток бактерий (табл. 3).
В связи с этим его применение является
актуальным для профилактики внутрибольничных инфекций. В этом смысле весьма
насущной является системная профилактика контаминации рук и слизистых оболочек
у медицинского персонала с использованием современных антисептиков. Была
изучена возможность использования катапола в качестве моюще-дезинфицирующего
средства личной гигиены, для дезинфекции помещений и в качестве антибактериального
импрегнанта нательного белья. 2%-ным водным раствором катапола
пропитывалисалфетки из хлопчатобумажной ткани. Последние испытатели
использовали для мытья рук и в общем душе путем смачивания дозированным
количеством воды: для мытья рук.- 300 мл, для общего душа - 10 л. Препарат
обладал удовлетворительными моющим свойством в отношении как кожи, так и
волосистых частей тела. Явлений раздражения кожи при непрерывном длительном
применении (3 мес) препарата илисенсибилизации, а также каких-либо признаков
отрицательного воздействия на организм не выявлено. Использование 0,1%-ного
раствора катапола в имитате морской воды в качестве моюще-дезинфицирующего
средства для 20 испытателей в течении 3 нед обеспечивало хороший моющий эффект
и надежную дезинфекцию кожи. При этом не отмечали отрицательного воздействия на
кожу, слизистые оболочки и организм человека в целом [1]. Для борьбы с
носительством стафилококка предложено использование антисептиков на основе
четвертичных аммониевых оснований.
Известно, что наряду с полной
антибиотикорези-стентностью госпитальные штаммы возбудителей внутри'больничной
инфекции обладают значительной устойчивостью к воздействию внешних факторов, в
том числе и дезинфектантам. Так, возбудитель сальмонеллеза Salmonella
typhimurium нечувствителен к
рекомендуемым для текущей дезинфекции концентрациям рабочих растворов
хлорсодержащих де-зинфектантов (0,5-1%), а погибает при воздействии не Metjee
3%-ного раствора хлорамина и 5%-ной перекиси водорода при экспозиции не менее
30 мин. Таким [образом, очевидно, что пересмотр рутинной комплектации
дезинфицирующих средств является не только актуальным, но и своевременным [1].
Заключение
Эффективность лечения сложных
посттравматических, огнестрельных переломов с замедленной консолидацией и длительно
существующих ложных суставов с использованием коллагенапатитового композита
«ЛитАр» открывает новое направление в развитии травматологии, ортопедии и
восстановительной медицины - этап использования биодеградируемых композитов.
Дальнейшие исследования воздействия материала
«ЛитАр» на поведение стволовых клеток организма пациента открывают перспективы
использования этого композита как универсального имплантата: для опорных
(кость, хрящ) и тканей паренхиматозных органов.
. Биодеградируемые композиционные материалы
имеют ряд существенных преимуществ в сравнении с биокерамикой и аллокостью
(способность резорбироваться и утилизироваться организмом, стимулировать
репаративные процессы).
. Композит «ЛитАр», активизируя имеющиеся в
организме стволовые клетки способен обеспечивать ангиогенез в зоне его введения
и ускоренную оссификацию в области дефекта.
. Инъекционное введение композита «ЛитАр»
позволяет обеспечивать сращение костных отломков в случае замедленной
консолидации перелома или ложного сустава, не прибегая к операции.
Все большее применение в травматологии находят
полимерные корноэлектреты. Электреты способны создавать постоянные
электрические поля без дополнительных источников питания и высоковольтных
преобразователей, являясь аналогом аккумуляторов электрических зарядов, что,
несомненно, находит отклик прикладного характера.
Широкое развитие получили работы по созданию
полимеров для внутреннего протезирования суставов, участков костей, сухожильных
и мышечных связок. Имеется положительный опыт применения полиэтилена высокого и
низкого давления, полиметилметакрилата и поликарбоната для изготовления
протезов коленных и бедренных суставов. Установлена целесообразность применения
комбинированных протезов, в которых наряду с металлическими деталями используют
части из полиолефинов. Полимеры с низким коэффициентом трения можно наносить на
поверхность металлических протезов суставов для улучшения их функциональных
свойств. Для замены сухожилий и связок применяют лавсановые ленты. Закрытие
дефектов черепа осуществляют с помощью пастообразных, отверждающихся без
нагревания композиций, на основе акриловых полимеров и сополимеров.
Актуальная проблема травматологии - создание
различных соединительных элементов (штифтов, скоб) из биосовместимых полимеров.
Это позволит отказаться от операций по извлечению этих элементов после
завершения регенерации костных тканей. Важной задачей является также разработка
клеевых композиций, обеспечивающих высокую прочность склеивания костных тканей.