Сорбция и ее виды
Государственное образовательное учреждение высшего
профессионального образования
СЕВЕРО-ЗАПАДНЫЙ ГОСУДАРСТВЕННЫЙ ЗАОЧНЫЙ ТЕХНИЧЕСКИЙ
УНИВЕРТИТЕТ
РЕферат
Выполнила
студентка
V курса
Ранцева
И.Ф.
Факультет:
ИПиСОБ
Специальность:
280202.65
Проверил
Денисов
Санкт-Петербург
2010
Определение cорбции
и ее виды
Сорбция - (от лат . sorbeo - поглощаю),
поглощение твердым телом или жидкостью какого-либо вещества из окружающей
среды. Основные разновидности сорбции - адсорбция, абсорбция, хемосорбция. Поглощающее
тело называется сорбентом, поглощаемое - сорбтивом (сорбатом). Важнейшие
твердые сорбенты, способные к регенерации и применяемые в технике, - активные
угли, силикагель, цеолиты, иониты. Сорбция в гидрометаллургии - поглощение
ценных компонентов (U, Au, Mo) из растворов или пульп при выщелачивании руд и
концентратов.
Различают поглощение всем объемом жидкого
сорбента (абсорбция), а также твердого тела или расплава (окклюзия) и
поверхностным слоем сорбента (адсорбция). Сорбция, обусловленная взаимодействием
химического типа между поверхностью твердого сорбента и сорбатом, называется
хемосорбцией. При сорбции паров твердыми веществами часто происходит
капиллярная конденсация. Обычно протекает одновременно несколько сорбционных
процессов.
Сорбция относится к действию абсорбции или
адсорбции:
· Абсорбция - объёмное слияние двух
веществ, находящихся в разных агрегатных состояниях (напр. жидкости,
абсорбирующиеся твёрдыми телами или газами, газы, абсорбирующиеся жидкостями и
т.д.).
· Адсорбция - физическое сцепление
ионов и молекул на поверхности тела другого состояния (напр. реагенты
адсорбируются к целой поверхности катализатора).
Обратный процесс выделения называют десорбцией.
Абсорбция
Абсорбция в химии
<#"513108.files/image001.gif">
Уравнение равновесияя в таком случае:
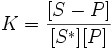 ,
,
где K - константа равновесия, [S − P] и
[S*] - доли поверхности адсорбента, занятые и незанятые адсорбатом, а [P] -
концентрация адсорбтива.
Количественно процесс физической
мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием
адсорбата можно пренебречь, описывается уравнением Ленгмюра:
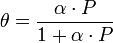 ,
,
где θ
- доля площади поверхности адсорбента, занятая адсорбатом,
α - адсорбционный
коэффициент Ленгмюра, а P - концентрация адсорбтива.
Поскольку [S − P] = θ
и, соответственно, [S * ] = 1 − θ,
уравнение адсорбционного равновесия может быть записано следующим образом:
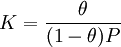
Уравнение Ленгмюра является одной из форм
уравнения изотермы адсорбции. Под уравнением изотермы адсорбции (чаще применяют
сокращённый термин - изотерма адсорбции) понимают зависимость равновесной
величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре
(T=const). Концентрация адсорбтива для случая адсорбции из жидкости выражается,
как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции
из растворов, пользуются относительной величиной: С/Сs, где С - концентрация,
Сs - предельная концентрация (концентрация насыщения) адсорбтива при данной
температуре. В случае адсорбции из газовой фазы концентрация может быть
выражена в единицах абсолютного давления, либо, что особенно типично для
адсорбции паров, в относительных единицах: P/Ps, где P - давление пара, -
давление насыщенных паров этого вещества. Саму величину адсорбции можно
выразить также в единицах концентрации (отношение числа молекул адсорбата к
общему числу молекул на границе раздела фаз). Для адсорбции на твёрдых
адсорбентах, особенно при рассмотрении практических задач, используют отношение
массы или количества поглощённого вещества к массе адсорбента, например мг/г
или ммоль/г.
Адсорбция происходит на границе раздела
следующих фаз:
● твёрдое тело - газ;
● твёрдое тело - раствор;
● раствор - газ.
адсорбция
абсорбция хемосорбция поглощение
Хемосорбция
При химической сорбции (хемосорбции) между
сорбентом и сорбатом возникает химическое взаимодействие, в результате чего
между ними образуется третье вещество, рис.2.
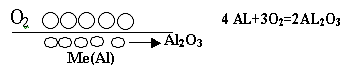
Химическая сорбция намного прочнее физической,
десорбция самопроизвольно практически не происходит.
Ещё одно отличие между физической и химической
сорбцией заключается в том, что при повышении температуры физическая сорбция
уменьшается, а химическая увеличивается.
Значение адсорбции
Адсорбция - всеобщее и повсеместное явление,
имеющее место всегда и везде, где есть поверхность раздела между фазами.
Наибольшее практическое значение имеет адсорбция поверхностно-активных веществ
и адсорбция примесей из газа либо жидкости специальными высокоэффективными
адсорбентами. В качестве адсорбентов могут выступать разнообразные материалы с
высокой удельной поверхностью: пористый углерод (наиболее распространённая
форма - активированный уголь), силикагели, цеолиты а также некоторые другие
группы природных минералов и синтетических веществ.
Адсорбция (особенно хемосорбция) имеет также
важное значение в гетерогенном катализе.
Список используемой литературы
1. Фролов
Ю. Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. М.:
Химия, 1989. 464с.
2. Кельцев
Н. В. Основы адсорбционной техники. М.: Химия, 1984. 592с.
. «Грег
С., Синг К.» Адсорбция, удельная поверхность, пористость. М.: Мир, 1984.310с.
. Трепнел
Б. Хемосорбция. - М. : Изд-во иностр. лит-ры, 1958 - 326 с.
. Введение
в физику поверхности: Пер. с англ. / Оура Кендзиро, Лифшиц В.Г., Саранин А.А.,
Зотов А.В., Катаяма М. - М. Наука, 2006. - 490 с.