Трансдермальные терапевтические системы
Кубанский
государственный медицинский университет
Кафедра
фармации
Курсовая
работа по фармацевтической технологии
Трансдермальные
терапевтические системы
Выполнила
студентка 5 курса
фармацевтического
факультета
группа
на базе высшего образования
Гурова
Елена Вячеславовна
Проверил
кфн, ст преподаватель
кафедры
фармации КГМУ Е.Б. Никифорова
Краснодар
год
Содержание
Введение
Глава
1. Достоинства и недостатки трансдермального пути введения
Глава
2. Механизм проникновения лекарственных веществ через кожу
Глава
3. Строение трансдермальных терапевтических систем
Глава
4. Технология и способы приготовления трансдермальных терапевтических систем
Глава
5. Потенциальные технологии усовершенствования трансдермальных терапевтических
систем
5.1
Усовершенствование химических составляющих трансдермальных систем
.2
Усовершенствование биохимических составляющих трансдермальных систем
.3
Усовершенствование физических свойств
Заключение
Список
литературы
Введение
трансдермальный лекарство кожа
Анализ имеющихся в литературе сведений о роли
лекарственной формы в современной фармакотерапии свидетельствует о том, что
успешно подобранные лекарственные формы позволяют максимально использовать
действие лекарственных средств при минимальных побочных эффектах [5]. Наиболее
предпочтительными в настоящее время являются интраназальный и трансдермальный
пути введения лекарственных средств.
Трансдермальная терапевтическая система (ТТС) -
это дозированная мягкая лекарственная форма для наружного применения в виде
пластырей или плёнок. ТТС - это системы с контролируемым высвобождением,
которые способны непрерывно атравматично подавать в организм ЛС, со скоростью,
создающей в кровотоке постоянный уровень концентрации ЛС, близкий к
минимальному терапевтическому уровню. По своей структуре трансдермальная
терапевтическая система представляет собой пластырь. Пригодность лекарственного
вещества для использования в форме ТТС определяется несколькими факторами,
основным из которых являются его физико-химические свойства, обеспечивающие
способность проникать через кожу в терапевтических дозах [8].
Трансдермальные терапевтические системы являются
альтернативой парентеральному и пероральному введению лекарственных средств. По
сравнению с пероральным приемом трансдермальное введение обеспечивает более
быстрое действие препарата и помогает избежать проблем, связанных со снижением
его активности в результате первого пассажа желудочного метаболизма. Мало того,
при таком введении появляется возможность снизить частоту назначения лекарства,
уменьшить необходимые дозы и при этом избежать колебаний его концентрации в
крови, а при развитии нежелательных реакций - немедленно прекратить лечение
[5]. Для некоторых лекарств трансдермальная доставка является единственным
способом введения.
Несмотря на все преимущества трансдермальных
пластырей, обеспечивающих необходимый эффект путем проникновения действующего
вещества через неповрежденную кожу, в России таких лекарственных форм очень
мало, в основном, их производят во Франции, Германии, Японии, Швеции [8].
Глава 1. Достоинства и недостатки
трансдермального пути введения
Трансдермальная доставка лекарств имеет
несколько преимуществ [12]:
. В сравнении с пероральным приемом
трансдермальное введение обеспечивает более быстрое действие препарата, избежание
эффекта инактивации или снижения активности лекарства в результате первого
пассажа и желудочного метаболизма, а также связанные с этим неблагоприятные
реакции.
. Поддержание постоянной концентрации препарата
в крови, без колебаний концентрации и связанных с этим неблагоприятных реакций.
. Снижение частоты назначения за счет доставки
необходимой дозы препарата в более продолжительный период времени:
А) Сведение к минимуму или полное устранение
местных побочных эффектов
Б) Сведение к минимуму или полное устранение
системных побочных эффектов
В) Получение меньшего эффекта потенцирования или
ослабления фармакологического действия препарата при длительном применении
Г) Сведение к минимуму кумулятивного эффекта при
длительном применении
. Возможность немедленно прекратить лечение.
. Улучшение комплаентности пациентов (легкий
способ применения препарата).
. Экономичность (целенаправленное использование
лекарственных субстанций позволяет снизить необходимое их количество в 100
(иногда- в 1000 раз) при сохранении эффекта, что делает лечение дешевле, а
уникальные препараты - доступнее).
Вместе с тем, существуют и ограничения в
применении трансдермальных терапевтических систем:
. Возможно раздражение или контактная
сенсибилизация кожи, причиной которых является неблагоприятное взаимодействие
активных или неактивных компонентов системы с кожей.
. Необходимо больше времени для начала действия
лекарственного препарата по сравнению с инъекционными формами.
. Только небольшой процент лекарственных веществ
может проникнуть в кожу из пластыря. Это означает, что лишнее количество
лекарственного вещества должно быть изготовлено и введено в систему, что
приводит к увеличению стоимости системы.
. Трансдермальная система доставки лекарственных
препаратов может быть использована только для достаточно сильнодействующих
лекарств, требующих небольших доз, и для веществ, обладающих определенными
физико-химическими свойствами, для проникновения в кожу в терапевтически
эффективном виде. Однако, несмотря на все эти ограничения, использование
трансдермальных систем считается чрезвычайно перспективным.
Глава 2. Механизм проникновения лекарственных
веществ через кожу
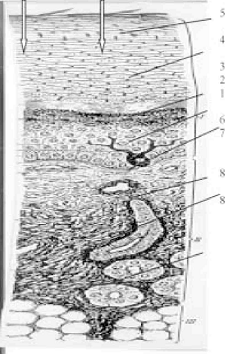
Рис. 1. Схема строения кожи. I - эпидермис; II -
дерма; III - подкожная основа; 1 - базальный слой эпидермиса; 2 -шиповатый
слой; 3 -зернистый слой; 4 - блестящий слой; 5 - роговой слой; 6 - базальтовая
мембрана; 7 - сосочковый слой; 8 - сетчатый слой.
Механизм проникновения экзогенных веществ через
кожу является сложным, многообразным процессом, который связан со сложным
морфологическим строением кожи (рис.1). Кожа (cutus) является
полифункциональным мембранным образованием. И в настоящее время уже нет
сомнений, что она весьма доступна к действию лекарственных средств и позволяет
использовать комбинированное воздействие на различные участки тела больного
[1,2,7]. Лекарственные вещества проникают в организм через кератиновый слой
кожи путем абсорбции, частично через волосяные фолликулы и сальные железы,
растворяясь в воде и жирах, подвергаясь при этом сложным физико-химическим
изменениям. Неповрежденный кератиновый слой выступает в роли депо, из которого
лекарственные препараты проникают глубже в кожу [ 7].
Таким образом, основным путем проникновения в
кожу экзогенных продуктов является роговой слой. Через волосяные фолликулы,
протоки сальных и потовых желез, что составляет менее 1% поверхности кожи,
проходит от 0,01% до 0,1% от веществ, проходящих через роговой слой [1].
Установлено, что через неповрежденную кожу
проникают: кислота борная, железа хлорид, натрия хлорид, калия сульфат, кальция
хлорид, йод, кортикостероиды, эфирные масла, касторовое, подсолнечное масла,
витамины, алкалоиды растительного происхождения, синтетические антисептики,
анальгетики, антигистамины, фенол, резорцин и ряд других химических веществ
[7]. Динитрохлорбензол проникает в кожу трансэпидермально и трансфолликулярно.
Роговой слой кожи не проницаем для солей никеля, меди, а кобальт проникает
через все ее слои. Среди благородных металлов самую высокую проникающую
способность показал родий; ниже она была у палладия и самая низкая - у платины
[7].
Существует множество факторов, изменяющих
физико-химическое состояние кожного покрова и влияющих на его проницаемость для
различных веществ:
· состояние водно-липидной пленки
кожи;
· генетические и гормональные отличия;
· характер контактирующих веществ;
· использование пенетраторов
(ускорителейвсасывания);
· клеточная поверхность и реакция
клетки;
· внешние факторы (УФ -облучение,
климатические условия и др.);
· механическое повреждение кожи [7].
С учетом указанных факторов, в настоящее время
введение лекарственных веществ через кожу и слизистую используется для
оказания, как местного, так и резорбтивного воздействия в различных отраслях
медицины: дерматологии, стоматологии, офтальмологии, гинекологии, кардиологии и
др.
Для увеличения степени проникновения
лекарственных веществ через кожу в последнее время изучаются различные факторы:
аппликации нефти, мазута и УФ-облучения, применение диметилсульфоксида в
сочетании с сосудорасширяющими средствами, модификация (в частности,
стероидов), высокая степень липофильности лекарственных веществ является
идеальным для их проникновения в верхние ороговевшие слои кожи.
В состав ТТС могут быть введены вещества,
которые отвечают следующим требованиям [9]:
· хорошая проницаемость через кожу
(т.е молекула вещества должна иметь сродство и к гидрофобному роговому слою, и
к гидрофильной дерме),
· нейтральность молекул (т.к. заряд
может препятствовать ее продвижению через гидрофобную среду),
· достаточная растворимость в
гидрофобной и гидрофильной среде,
· молекулярная масса не должна
превышать 500 Дальтон,
· высокая эффективность в небольших
дозах,
· хорошая совместимость с кожей,
Таким образом, все ТТС, работают по принципу
пассивной диффузии. Биологически активные соежинения проникают через кожу или
слизистую оболочку благодаря градиенту концентрации по обе стороны
полупроницаемой мембраны, в качестве которой, в данном случае, выступает кожа
(или слизистая).
Глава 3. Строение трансдермальных
терапевтических систем
Трансдермальные терапевтические системы - это
дозированная лекарственная форма, представляющая собой небольшого размера
пленку диаметром 1,8 см и площадью 2,5 см2. Приклеивается она, как правило, за
ухом [12]. ТТС в основном выпускаются в форме пластырей, соответственно они
должны отвечать параметрам, характерным для пластырей. Они должны обладать
хорошей липкостью, плотно прилегать к коже и не раздражать ее. В составе
трансдермальных терапевтических систем есть основа и лекарственное вещество.
Согласно характеристике данной в зарубежных
фармакопеях, ТТС, как правило, состоят из следующих основных компонентов [8]:
· Полимерный матрикс/Резервуар
активных веществ. Полимеры являются основой пэтча, именно они контролируют
процесс высвобождения активных ингредиентов. В настоящий момент используются
натуральные полимеры (производные целлюлозы, хитозан и т.д.) и синтетические
полимеры (полиакрилат, полипропилен и т.д.)
· Активные вещества - в зависимости от
поставленной задачи могут быть разнообразными. Так в антицеллюлитных системах
используется L-карнитин и кофеин, для достижения противоотечного эффекта
экстракты водорослей и растений, для повышения упругости кожи и омолаживающих
эффектов эластин, аминокислотные и пептидные комплексы.
· Энхансеры - повышают проходимость
рогового слоя, взаимодействуя со структурными компонентами эпидермиса
(протеинами, липидами)
· Адгезивный слой - обеспечивает
тесный контакт между трансдермальной системой и поверхностью кожи. Он должен
хорошо прилипать и держаться, но при этом легко сниматься, не причиняя травмы
коже. Для этой цели широко используют полиакрилаты и силикон.
· Ламинат - должен обладать высокой
гибкостью, пропускать кислород и не мешать испарению влаги. Из материалов
предпочтительны винил, полиэтилен и полиэстер.
· Защитный слой - удаляется
непосредственно перед нанесением трансдермального пэтча на кожу.
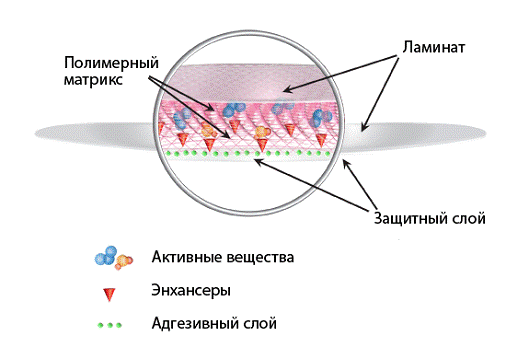
Рис. 2. Схема строения трансдермальных
транспортных систем ТТС делят на две группы: матричные и мембранные [12].
Мембранные ТТС состоят из непроницаемой
подложки, резервуара с лекарственным веществом, мембраны, регулирующей
высвобождение лекарственного средства и адгезивного (клейкого) слоя.
Лекарственное вещество находится в резервуаре в виде суспензии в жидкости или
геле. Резервуар располагается между непроницаемой подложкой и мембраной из
пористой полимерной фольги, которая определяет скорость высвобождения
лекарственного вещества.
. Системы, ограниченные мембраной.
В системах этого типа резервуар лекарственного
вещества заключен в плоскую камеру, произведенную из непроницаемой для вещества
подложки и полимерной мембраны, ограничивающей скорость высвобождения. Молекулы
вещества могут проникать только через эту полимерную мембрану, которая может
быть микропористой или сплошной. На внешней поверхности мембраны может быть
нанесен тонкий слой гипоаллергенного адгезивного полимера, совместимого с
лекарственным веществом (например, силиконовый или полиакриловый клей), для
обеспечения плотного контакта системы с кожей. Скорость высвобождения лекарственного
вещества из подобной системы может быть подстроена путем изменения состава
полимера, коэффициента проницаемости и толщины ограничивающей скорость
высвобождения мембраны и адгезива (рис. 3). Примерами трансдермальных
терапевтических систем служат нитроглицерин содержащие трансдермальные
терапевтические системы, такие как Transderm-Nitro (Ciba), скополамин
содержащие трансдермальные терапевтические системы, такие как Transderm-Scop
(Ciba), клонидинсодержащие трансдермальные терапевтические системы, такие как
Catapres (Boehringer Ingelheim) [13].
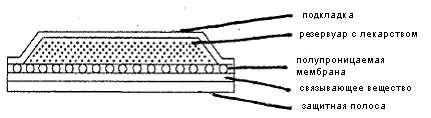
Рис. 3. ТТС, ограниченная мембраной
В матричных ТТС лекарственное вещество
помещается в матрицу, состоящую из геля или полимерной пленки. Высвобождение
лекарственного вещества из такой системы определяется его диффузией из
материала матрицы.
. Адгезивные системы, контролируемые диффузией.
В этом случае резервуар лекарственного вещества
формируется путем прямого диспергирования лекарственного вещества в адгезивном
полимере и его последующего распределения путем отливки по плоскому листу
непроницаемой для лекарственного вещества подложки. Для производства адгезивной
системы высвобождения лекарственного вещества, контролируемой диффузией, на
поверхность подложки наносятся слои не содержащего лекарственного вещества,
ограничивающего скорость высвобождения адгезивного полимера постоянной толщины.
Примерами трансдермальных терапевтических систем такого типа служат
нитроглицеринсодержащие трансдермальные терапевтические системы, такие как
Deponit (Pharma-Shwartz) и содержащие изосорбида динитрат трансдермальные
терапевтические системы, такие как лента Frandol (Toaeiyo). ТТС Deponit,
матричная система, выполненная в виде полимерной пленки из полиизобутилена и
смолистого вещества, которая нанесена на фольгу-подложку. Матрица состоит из
7-ми слоев. Каждый слой содержит различную концентрацию нитроглицерина,
адсорбированного на лактозе, что позволяет поддерживать активную концентрацию в
крови длительное время.
. Системы дисперсионного типа с наполнителем.
В системах такого типа резервуар лекарственного
вещества формируется путем приготовления гомогенной взвеси лекарственных
веществ в гидрофильном или липофильном полимерном наполнителе. После этого
полимер, содержащий лекарственное вещество, выплавляют в форме диска с
определенной площадью поверхности и толщиной, который затем наклеивается на
закупоривающую пластину в камере, сделанной из непроницаемого для
лекарственного вещества материала. Адгезивный полимер распределяется по
окружности, образуя клейкую полосу на диске с медикаментом. Примерами таких
трансдермальных терапевтических систем служат нитроглицеринсодержащие
трансдермальные терапевтические системы, такие как Nitro-Dur (Key
Pharmaceuticals. (рис. 4)
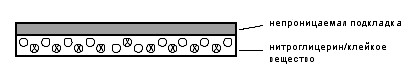
Рис. 4. ТТС Nitro-Dur
В системе Nitro-Dur нитроглицерин адсорбирован
на лактозе и диспергировн в гидрогеле, состоящем из воды, глицерина, ПВС и ПВП.
.Микрорезервуарные системы.
В системах такого типа резервуар лекарственного
вещества формируется путем приготовления суспензии частиц лекарственного
вещества в растворе водорастворимого полимера, а затем приготовления гомогенной
взвеси в липофильном полимере с использованием высокой силы механического
перемешивания, в результате чего формируется большое количество не подверженных
выщелачиванию микроскопических сферических резервуаров лекарственного вещества.
Термодинамически нестабильная взвесь быстро стабилизируется путем немедленного
сшивания полимера на месте, в результате чего формируется полимерный диск с
лекарственным веществом, который имеет постоянную площадь поверхности и
фиксированную толщину. В полученной трансдермальной терапевтической системе
диск с медикаментом находится в центре и окружен клейкой полосой. Примерами
таких трансдермальных терапевтических систем служат нитроглицеринсодержащие
трансдермальные терапевтические системы, такие как Nitrodisc (Searle). ТТС
Nitrodisc характеризуется большим количеством микровключений из смеси
нитроглицерина и лактозы в водном растворе ПЭГ-400. Размер включений составляет
от 10 до 200 мкм. Они запрессованы в матрицу из полимерного
кремнийорганического соединения.
В середине 90-х годов были разработаны ТТС
принципиально нового типа действия. Так, ТТС американской фирмы Drug Delivery
Systems, названной “Powerpatch”. Система представляет собой пластырь, площадью
70 см2, содержит два, изолированных друг от друга резервуара для действующего
вещества. Один из резервуаров присоединен к катоду, а другой - к аноду. При
нанесении системы на кожу под действием электрического тока происходит
высвобождение лекарственного вещества. В этом случае повышается биодоступность
лекарственной формы, так как электроток повышает проницаемость ороговевшего
слоя кожи [2].
Специалистами фирмы Thera Tech (США) и Ciba
Corporation разработана система трансдермальной доставки лекарственных веществ,
не обладающих способностью проникать через кожу. Эта система представляет собой
многокамерную конструкцию, в которой резервуар с лекарственным веществом
отделен от активатора перегородкой, не проницаемой для обоих компонентов. Система
активизируется непосредственно потребителем посредством нажатия на эту
перегородку, которая разрушается. В результате этого лекарственное вещество
смешивается с активатором, превращаясь в активную форму, способную проникать
через кожу [2].
В отечественной фармакопее отсутствуют как
общая, так и частные статьи на ТТС, что весьма затрудняет исследования в этом
актуальном для фармации и медицины направлении. ТТС перспективны в онкологии, а
также для лечения астмы, при контрацепции, для гормонозависимой терапии, для
местной и даже общей анестезии. Отечественные трансдермальные системы
представлены на фармацевтическом рынке России такими фирмами как
«Биотехнология», «Алтай федеральный центр НПЦ», НПЦ «Лекбиотех» и то всего с
одним наименованием каждая. Зарубежные трансдермальные терапевтические системы,
в свою очередь, представлены такими фирмами как «Schwarz Pharma», «Janssen
Pharmaceutica N.V.», «Schering», «Rhone-Poulenc Rorer», «SmithKline Beecham
Consumer Healthcare», «Ciba-Geigy», «Searle», «Schering-Plough», «Rugby»,
«Novartis Pharma Services», «Grunenthal» и др. с достаточно широким
ассортиментом трансдермальных пластырей, приносящих им огромный коммерческий
успех [13].
Глава 4. Технология и способы приготовления
трансдермальных терапевтических систем
Технология получения ТТС различных типов
осуществляется с учетом оценки органолептических, структурно-механических
показателей систем, а также параметров высвобождения действующих веществ из
полученных при различных технологических условиях ТТС [5].
В качестве подложки, на которой крепится вся
система, используются ткани, бумага, полимерные пленки, металлизированные
покрытия, т. е, вещества, непроницаемые для лекарственных веществ и воды.
Резервуар, т. е. слой, в котором находится действующее вещество, состоит из
носителя, в качестве которого используют различные полимерные материалы. В
качестве веществ, способствующих растворению лекарственных веществ, применяют
этанол, воду очищенную, диметилсульфоксид, метиловый эфир этиленгликоля,
глицеринмоноолеат или церинтриолеат [8].
В качестве мембран применяют различные
полимерные пленки, способствующие дозированному выходу лекарственного вещества
из резервуара и ткани, полученные из полипропилена, сополимера
этиленавинилацетата, блоксополимеров, силиконовые смолы и др, например,
диализная мембрана из синтетически модифицированной целлюлозы. Они применяются
с лекарственными веществами, проникающими через кожу в общий кровоток.
Лекарственные вещества диффундирует через оболочку, эпидерму и, естественно,
через кожу в кровяное русло. Таким образом, лекарственное вещество поступает
постепенно, уменьшается его побочное действие.
В качестве промоторов пенетрации, способствующих
проникновению активных лекарственных средств или других биологически активных
веществ через кожу, используется высокодисперсный диоксид кремния,
предпочтительно в форме Aerosil®200 и/или Aerosil®972. Такой пластырь может
быть выполнен в виде матриксной системы или мембранной системы с резервуаром.
Содержание высокодисперсного диоксида кремния в адгезивном слое пластыря может
составлять 0,1-10 мас.%, предпочтительно 2-5%. Дополнительно используют этанол
(преимущественно) или олеиновую кислоту (5-10%); также могут быть использованы
и другие известные ускорители пенетрации: 1,2-пропандиол, полиэтиленгликоль,
ненасыщенные и насыщенные жирные кислоты, их эфиры и соли, сульфоксиды и прочие
соединения (Заявка США №2004/0086552, А61К 9/70, 2004 г.) [6].
Биологически активные агенты в такой ТТС могут
быть разнообразными лекарственными средствами, применяемыми для лечения
сердечно-сосудистых заболеваний, для заместительной гормональной терапии, для
лечения эпилепсии, болезни Паркинсона, болевых симптомов, расстройств памяти,
никотиновой зависимости и других заболеваний. Пригодными биологически активными
агентами могут быть, например, антихолинергические и антигистаминные средства,
нейролептики, антидепрессанты, анальгетики, симпатомиметики, антикоагулянты,
кардиоваскулярные препараты и прочие лекарственные средства.
Однако использование высокодисперсного диоксида
кремния (аэросила) может привести к неблагоприятным последствиям, связанным с
обезвоживанием (высушиванием) кожи. Кроме того, установленная способность
аэросила ускорять чрескожное проникновение лекарственных средств дополняется
использованием известных промоторов пенетрации, например этанола, который также
может оказывать и побочное отрицательное воздействие на кожу, что существенно
ограничивает широкий спектр специфической активности ТТС [6].
Так же используется водорастворимое биологически
активное кремнийорганическое соединение формулы
[-Si(СН3)2-O-СН2-СН(ОН)-СН2-O-]n, где n>1 (Патент Франции №2160293, А61К
27/00, С07F 7/00, 1973 г.), полученное при нагревании глицерина с
диметилдиэтоксисиланом или гексаметилдисилазаном с последующей ректификацией.
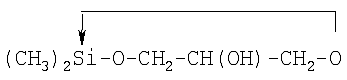
Образующийся первоначально циклический продукт
спонтанно полимеризуется при хранении, превращаясь в
поли(диметил-1,1'-сила-1-диокса-2,6-гексанол-4). Это соединение нетоксично и
обладает рядом терапевтических свойств: стимулирует формирование соединительной
ткани, проявляет противовоспалительную, регенерирующую и протекторную
активность, способно проникать через кожу и способствует трансдермальной
проводимости лекарственных средств. Однако в качестве недостатков можно отметить
возможность полимеризационных превращений при хранении, а также
гидролитического расщепления и последующей конденсации с образованием
неактивных силоксановых полимеров (М.Г.Воронков, В.П.Милешкевич,
Ю.А.Южелевский. Силоксановая связь. Новосибирск: Наука, 1976, 413 с.), что
снижает терапевтическую эффективность ТТС.
Применяются также глицераты кремния, обладающие
транскутанной проводимостью медикаментозных средств, и глицерогидрогели на их
основе состава Si(С3Н7O3)4·x С3Н8О3·у Н2O, (Патент РФ № 2255939, С07F 7/04,
А61К 47/30, 2005 г.). Глицераты кремния получают взаимодействием
тетраэтоксисилана с избытком глицерина в присутствии катализатора -
тетрабутоксититана; глицерогидрогели образуются при взаимодействии глицератов
кремния с водными растворами электролитов. Полученные соединения нетоксичны,
проявляют высокую пенетрирующую активность, обладают местным антимикробным
действием различной степени выраженности и могут быть использованы как в виде
самостоятельных средств для местного применения, так и в качестве
физиологически активной основы трансдермальных терапевтических систем с
возможным широким спектром применения в медицине. Однако невысокое содержание
кремния в составе средства, особенно в гидрогелях, недостаточно для проявления
выраженного самостоятельного лечебного эффекта. Введение метильных групп в
молекулярную структуру глицератов кремния положительно сказывается как на
транскутанной активности соединений, так и на активизации их ранозаживляющего и
регенерирующего действия, так как приводит к увеличению количественного
содержания кремния и, кроме того, замедлять процессы гидролиза и связывания
кремния в неактивную дисперсную фазу (при образовании гидрогелей). Введение
метильных групп, кроме того, повышает липофильность молекулы, что способствует
трансмембранному переносу кремния через билипидный слой клеточных мембран, т.е.
усиливает транскутанную активность (Патент США № 6211393, С07F 7/18, A61К
31/695, 2001 г.) [6].
Макромолекулярные терапевтические системы
являются своеобразной лекарственной формой пролонгированного действия. В основе
их функционирования лежат относительно невысокие скорости диффузии [5, 9]. Для
решения проблемы пролонгации действия лекарственного вещества использованы 2
подхода. Первый заключается в том, что уменьшение диффузии низкомолекулярного
лекарственного вещества достигается путём химического связывания его с
макромолекулой носителя. В этом случае увеличение времени лечебного воздействия
на организм лекарственного вещества определяется медленной диффузией макромолекулы
и связанных с ней молекул лекарственного вещества. Второй подход -
регулирование диффузии активного вещества путём включения в полимерную
полупроницаемую оболочку, который широко принят в области создания препаратов
продлённого действия [9].
Примером состава основы, используемой для
получения матриксных ТТС является желатиновая основа следующего состава
(табл.1).
Таблица 1. Состав желатиновой основы матриксной
ТТС на 100 г.
|
Раствор
желатина 10%, г
|
59,9
|
|
Глицерин,
г
|
5,0
|
|
ДМСО,
г
|
10,0
|
|
Спирт
этиловый 70%, г
|
25,0
|
|
Нипагин,
г
|
0,033
|
|
Нипазол,
г
|
0,014
|
Технологические схемы приготовления матриксных
ТТС на желатиновой основе и на основе полиакриламидного геля, а также
ТТС-диализных капсул на основе полимерной полупроницаемой мембраны представлены
на рис. 5 и 6 и соответственно/


Рис 5. Технологические схемы приготовления ТТС
со свободными (а) и липосомными (б) формами лекарственных веществ на
желатиновой основе.
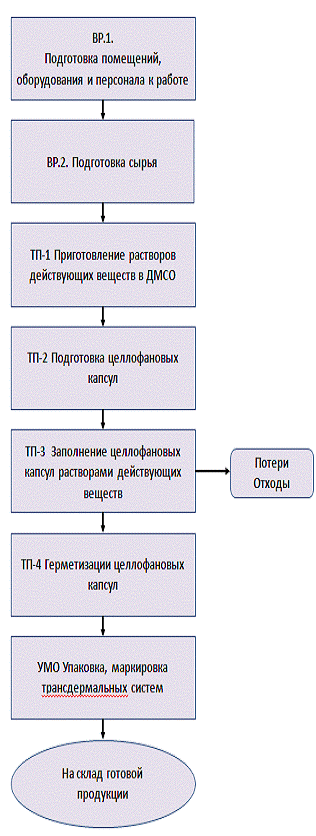

Рис. 6. Технологические схемы приготовления ТТС
на основе ПААГ (а) и резервуарных ТТС на основе полимерной полупроницаемой
мембраны (б).
Совершенно новая технология изготовления
трансдермальных пластырей предложена компаниями «Hewlett-Packard» и ирландским
производителем медицинского оборудования «Crospon» [8]. Разработанный ими
трансдермальный пластырь оснащен микроиглами, проникающими в верхний слой кожи
(аналогичная технология используется в картриджах струйных принтеров).
Использование этой технологии существенно уменьшает дискомфорт, по сравнению с
традиционными подкожными иглами, позволяет расширить спектр вводимых чрескожно
фармацевтических и биологических препаратов, отчасти решает проблему утилизации
использованных металлических игл. Пластырь позволяет вводить лекарство в
верхний слой кожи пациента и точно контролировать дозировку и время введения.
Кроме того, он содержит информацию о том, какие лекарства и в каких дозах были
получены пациентом ранее, об активационных механизмах и внутренних механизмах
предотвращения негативных последствий взаимодействия различных лекарств. В
настоящее время ряд фармкомпаний на основе этой технологии разрабатывают
пластыри для вакцинации.
Глава 5. Потенциальные технологии
усовершенствования трансдермальных терапевтических систем
Доставка лекарств через кожу подчинена
существенным взаимосвязям, которые ограничивают общее применение этой
технологии. Сегодня исследуется много подходов, чтобы преодолеть барьерные
свойства кожи и улучшить возможности применения трансдермальных терапевтических
систем. Чтобы достичь нового уровня, необходимо разработать технологии,
посредством которых проницаемость лекарственного средства могла бы стать
обратимой, предсказуемой и контролируемой. Усилия по усовершенствованию
технологий делятся на три категории: химические, биохимические и физические
[12].
.1 Усовершенствование химических составляющих
трансдермальных систем
Химическое усовершенствование трансдермальных
систем доставки лекарственного средства ведет к использованию внешних
химических субстанций, для того чтобы помочь лекарствам проникнуть через кожный
барьер, путем разрушения упорядоченной структуры межклеточного жирового слоя.
Эта модификация ведет к улучшению текучести этого слоя и растворимости
лекарства в роговом слое. Многочисленные химические соединения использовались
или оценивались по их способности расширить проникновение молекул
лекарственного средства сквозь кожу. Они расположены следующим образом: от многоатомных
спиртов до жирных кислот и сложных эфиров жирных кислот к терпенам. Несмотря на
перспективы химических веществ, усиливающих проникновение молекул лекарств
через кожу, лишь немногие из них использовались в коммерческих трансдермальных
системах доставки, главным образом из-за затрат, связанных с регулирующими
регистрационными требованиями (доказательство увеличения проникающей
способности; исследования их краткосрочной и долгосрочной безопасности и
токсичности).
Фармкомпании достигают все большего понимания
механизмов действия химических "веществ-усилителей" и их
продолжительных и кратковременных эффектов, эти средства будут шире
использоваться, потому что они позволяют обеспечить наилегчайший путь
усовершенствования трансдермальных систем [12].
.2 Усовершенствование биохимических составляющих
трансдермальных систем
Еще один вариант - использование везикул жира,
сохраняющих лекарственные средства (подобно липосомам), которые могут проникать
сквозь кожу и самостоятельно депонироваться в роговом слое. Там они могут
действовать как системы с контролируемым высвобождением.
Исследовательские усилия по расширению
эффективности жировых везикул все еще находятся на ранних стадиях изучения.
Однако многие парентеральные системы, использующие жировые везикулы, уже много
лет применяются на практике. Такие везикулы были хорошо изучены, и значительная
информация относительно их безопасности, токсичности и способности к
биологическому распаду уже доступна. Если молекула лекарственного средства была
просто инкапсулирована, без изменения физических или химических свойств, то при
регистрации таких трансдермальных форм потребуется меньше формальностей.
Следовательно, этот подход расширения применения является многообещающим.
.3 Усовершенствование физических свойств
При физическом усовершенствовании трансдермальных
систем доставки лекарственных средств внешние стимулы или сила, используемая
для проведения лекарственного средства через кожу, особенно через самый
наружный слой. Внешние силы производят обратимые физические изменения в
пределах рогового слоя. Используются три подхода: ионофорез, сонофорез и
электрофорез. Эти подходы могут позволять трансдермальным системам доставлять
большие ионные молекулы пептидов или белков, которые не могут быть доставлены
пассивной диффузией сквозь кожу. К тому же уровень доставки хорошо
контролируется величиной и продолжительностью внешних стимулов. Наконец, как и
в случае с парентеральными препаратами, начало действия лекарства очень быстрое
из-за относительно короткого времени, необходимого для того, чтобы лекарство
попало в кровь. Быстрое начало действия очень важно для терапии раковых болей,
диабета и других состояний [12].
Ионофорез - использование внешнего
электрического тока для того, чтобы транспортировать заряженную молекулу сквозь
кожу. В этом процессе, который уже известен более ста лет, ионная молекула
несет заряд через мембрану кожного барьера, чтобы замкнуть цепь. В настоящее
время проводится много исследований, изучающих использование этой методики для
доставки больших молекул лекарственных средств или наркотиков, для купирования
раковой боли.
Сонофорез использует ультразвуковые волны для
того, чтобы разорвать роговой слой и вызвать раскрытие пор, что облегчает
транспорт лекарственных молекул. Хотя возможность такого подхода была доказана,
системы доставки лекарственного средства, использующие сонофорез, все еще
находятся на ранней стадии развития, а коммерческое использование не ожидается
в ближайшем будущем.
Электрофорез использует высоковольтный
миллисекундный импульс для создания транзитных путей сквозь роговой слой, чтобы
облегчить проникновение больших молекул лекарственного средства. Возможность
применения этого подхода была доказана. Однако методы доставки лекарственного
средства, использующие эту технологию, все еще находятся на ранней стадии
развития, а огромное количество проблем с безопасностью еще не разрешены, т.к.
электрофорез использует высоковольтный внешний импульс, который может вызывать
длительное повреждение кожи.
Заключение
Несмотря на тесную физико-химическую
взаимозависимость, трансдермальная доставка лекарственного средства имеет
большие перспективы как альтернатива перорального и внутривенного назначения.
Возможность управляемо ввести определенное количество лекарственного средства в
течение продолжительного периода времени сделает привлекательными
трансдермальные системы для пациентов, страдающих от хронических состояний,
особенно для терапии хронических болей у инкурабельных онкологических больных,
а также для лечения астмы. Кроме того, эти системы могут использоваться для
гормонозаместительной терапии и контрацепции. В силу того, что трансдермальная
доставка является простой в назначении, этот подход будет особенно
привлекательным для пожилых пациентов, где комплаентность является одной из
важных проблем. В области гормонозаместительной терапии и контрацепции
разработчики лекарственных средств пытаются использовать новые трансдермальные
системы доставки для введения нескольких гормонов одновременно, следовательно,
уменьшая неблагоприятные реакции, появляющиеся при введении только эстрогена
[13].
Усовершенствование технологий даст возможность
увеличить разнообразие препаратов, которые могут быть доставлены
трансдермально, особенно для больших и ионизированных молекул
биотехнологических лекарственных средств, которые в настоящее время могут быть
введены только через болезненные инъекционные процедуры/
Список использованной литературы
1. Амирова
И. А., Ахмедов И. А. Проницаемость кожи после контакта с нефтью и мазутом.
Вестник дерматологии и венерологии.- 1996, №1. - С. 46 - 47.
. Варпаховская
И. Новые системы доставки лекарственных средств (обзор). //Ремедиум.- 1997- № 9
. -С. 62 - 70.
. Васильев
А.Е. Трансдермальные терапевтические системы доставки лекарственных веществ
(обзор) А.Е. Васильев, И.И. Краснюк, С. Равикумар // Хим. - фармац. журнал. -
2001. - Т 35,№ 11. - С. 29 - 42.
. Васильев
А.Е., КраснюкИ.И., Равикумар С, Максименко О. О. Трансдермальные
терапевтические системы с индометацином. // Хим. - фарм. ж. - 2001.-Т. 35,№10.
-С. 51 - 52.
. Васильев
А.Е., КраснюкИ.И., Равикумар С, Тохмахчи В.Н. Трансдермальные терапевтические
системы доставки лекарственных веществ (обзор). // Хим. - фарм. ж. - 2001.- Т.
35, № 11. - С. 29 - 42.
. Друзь
Е.А. (Морина Е.А.), Фельдман Н.Б., Луценко С.В. Трансдермальные терапевтические
системы с растительными биофлавоноидами. Сборник материалов конгресса - XVII
Российский национальный конгресс «Человек и лекарство», Москва, 12-16 апреля
2010 г. М. ЗАО РИЦ «Человек и лекарство». - 2010. - С. 608.
. Колпаков
Ф.М. Проницаемость кожи.-М.: Медицина, 1973.-207 с.
. Мизина
П.Г., Быков В.А., Настина Ю.И., Фоменко Е.А. Введение лекарственных веществ
через кожу - достижения и перспективы (обзор) ВЕСТНИК ВГУ. Серия: Химия.
Биология. Фармация. 2004 с. 176 - 183
. Современные
аспекты использования вспомогательных веществ в технологии лекарственных
препаратов. /Багирова В.Л., Демина КБ., Девяткина И.А. идр. //Фарматека.-
1998.-№6.- С. 34-36.
. Трансдермальные
лекарственные формы. Обзорная информация: Лекарственные средства.- Экономика,
технология и перспективы получения.- М., 1989.-Вып.12. - 41с.
. ФилимонковаН.Н,
Кунгуров Н.В. Применение различных форм адвантана (метилпреднизоло-на
ацепоната) в комплексной терапии больных псориазом. // Вестник дерматологии и
венерологии.-2002, №2. - С. 49 - 50.
. Чуешов
В.И. Промышленная технология лекарств. Т 2 - Х.: МТК - Книга; Издательство
НФАУ, 2002. - 716 с.
13. <http://rufarma.ru/>