Свойства и области применения кальцинированной соды
«Белорусский
государственный технологический университет»
Кафедра
технологии производства минеральных удобрений
Специальность
1-25-01-07 Экономика и управление на предприятии
Специализация1-25-01-07-24
Экономика и управление на предприятиях химического комплекса
КОНТРОЛЬНАЯ
РАБОТА
«Технология
и оборудование производства минеральных удобрений и солей»
Выполнил студентка Асадулина К.В.
Руководитель ассист. Солонников
Минск 2011
1. Общие сведения
Сода
- общее название технических натриевых солей угольной кислоты
<#"511933.files/image001.gif">
Рисунок 1.1 - Области применения кальцинированной соды и содовых
продуктов
4. Аммиачный способ получения кальцинированной соды (метод Сольве)
Аммиачный способ получения соды был предложен еще в 1838-1840 английскими
инженерами-химиками Г.Грей-Дьюаром и Д.Хеммингом. Они пропускали через воду
газообразные аммиак NH3 и диоксид углерода CO2, которые
при взаимодействии дают раствор гидрокарбоната аммония NH4HCO3:
NH3 + CO2 + H2O = NH4HCO3,
а затем добавляли к этому раствору хлорид натрия NaCl, чтобы выделить
малорастворимый на холоде гидрокарбонат натрия NaHCO3:
NH4HCO3 + NaCl =
NaHCO3 + NH4Cl
Гидрокарбонат натрия отфильтровывали и нагреванием превращали в соду:
2 NaHCO3 = Na2 CO3 + CO2 + H2 O
Диоксид углерода CO2, необходимый для проведения процесса,
получали из карбоната кальция СаСО3 - мела или известняка - при
прокаливании:
CaCO3 = CaO + CO2,
а оксид кальция CaO, который при этом получался, после обработки водой
давал гидроксид кальция Ca ( OH)2 :
CaO + H2 O = Ca(OH)2,
необходимый для получения аммиака NH3 из хлорида аммония NH4
Cl:
2 NH4 Cl + Ca(OH)2 = 2 NH3 + CaCl2 + 2 H2
O
Таким образом, аммиак все время находился в обращении и не расходовался,
отходом производства оставался только хлорид кальция CaCl2 (схема представлена
на рисунке 1.2).
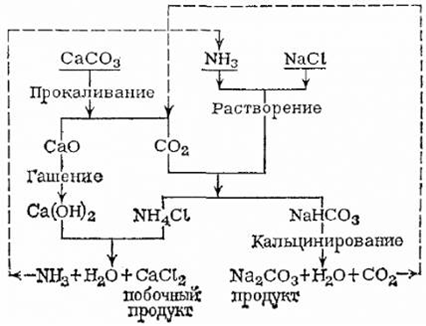
Рисунок 1.2 - Схема аммиачного способа получения кальцинированной соды по
методу Сольве.
Эрнест Сольве не внес принципиальных новшеств в химическую основу
содового процесса английских инженеров, он только технологически оформил
производство, однако, это тоже непросто. В частности, он применил здесь
аппараты колонного типа, которые позволили вести процесс непрерывно и достичь
высокого выхода продукта.
Преимущества аммиачного метода состояли в получении более чистой соды,
меньшем загрязнении окружающей среды и экономии топлива (поскольку температура
здесь ниже).
Первыми в мире заводами, использующими аммиачный способ получения соды,
стали бельгийский завод в Куйе, построенный по проекту самого Сольве в 1865, и
Камско-Содовый завод Лихачева в России, который начал работать в 1868.
Российский завод был создан полковником Иваном Лихачевым в его имении на берегу
реки Камы в Казанской губернии. Лихачев добывал аммиак NH3 путем сухой
перегонки отходов, которые ему поставляли почти двести кожевенных мастерских со
всей округи. Диоксид углерода СО2 получали прокаливанием известняка, найденного
поблизости. Завод просуществовал недолго и уже через четыре года был закрыт
из-за нерентабельности: сильно подорожали и кожевенные отходы, и поваренная
соль NaCl.
. Практическое задание
кальцинированный
сода суперфосфат химический
Составить материальный баланс процесса получения двойного суперфосфата на
1 т фосфорита, если в производстве используется 30-% -ная (Р2О5) фосфорная
кислота, степень разложения фосфорита составила 88%. Исходный фосфорит содержит
84 % фторапатита, 9% - карбоната кальция, 7% - нерастворимый остаток.
Решение.
Производительность по фосфориту 1 000 кг/час
Сырье:
. фосфорит (в %):
Са5 (Ро4)3F - 84%
CaCo3
- 9%
Нерастворимый остаток - 7%
.Кислота фосфорная
Р2О5 - 30 %
Н2О - 70 %
Степень разложения фосфорита (в %) - 88
Материальный расчет разложения.
Процесс разложения фосфорита фосфорной кислотой протекает по следующему
химическому уравнению:
Уравнения
Ввиду того что этим уравнением не учитывается взаимодействие с фосфорной
кислотой примесей, содержащихся в фосфорите, составляется следующее уравнение:
Уравнение
Количество фосфорита (по компонентам):
Са5(РО4)F - 840 кг
СаСО3 - 90 кг
Нерастворимый остаток - 70 кг
Итого: 1 000 кг
Производим расчет по уравнения реакций.
По уравнения (1):
Из 840 кг Са5(РО4)3F
образуется Са(Н2РО4)2*Н2О
*5*252*0,88/504=1848 кг
и НF
*20*0,88/504=29,3 кг,
расходуется Н3РО4
*7*98*0,88/504=1006 кг
и Н2О
*5*18*0,88/504=132 кг.
По уравнению (2):
Для 90 кг СаСО3 требуется Н3РО4:
*2*98/100=163,7 кг
при этом образуется Са(Н2РО4)2*Н2О
*252/100 = 226,8 кг
и СО2
Рассчитываем количество Н3РО4 по компонентам:
Общее необходимое количество кислоты:
,1+163,7=1169,8
Тогда по компонентам получаем:
Р2О5 1169,8*30/100=350,9
Н2О 1169,8*70/100=818,9
Составляем материальный баланс:
|
Приход
|
Расход
|
|
статья
|
кг/ч
|
статья
|
кг/ч
|
|
Са3(РО4)2
|
840
|
Са(Н2РО4)2*Н2О
|
1848+226,8
|
|
СаСО3
|
90
|
Нерастворимый остаток
|
55,43
|
|
Нерастворимый остаток
|
70
|
СО2
|
39,6
|
|
Р2О5
|
350,9
|
|
|
|
Н2О
|
818,9
|
|
|
|
Всего
|
2169,83
|
Всего
|
2169,83
|