Синтез галогенорганических соединений. Реакция галоформного расщепления
ФЕДЕРАЛЬНОЕ
АГЕНТСТВО ПО ОБРАЗОВАНИЮ
СТАВРОПОЛЬСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Медико-биолого-химический
факультет
кафедра
органической
физической и
фармацевтической химии
КУРСОВАЯ
РАБОТА
Тема: «Синтез
галогенорганических соединений.
Реакция галоформного
расщепления»
Выполнила студентка 3 курса МБХФ отд. «Химия»
Шульга Алёна Александровна
Ставрополь
2009 г.
Содержание
Введение. Теоретическая часть
.1 Галогенпроизводные
углеводородов
1.2 Галогенпроизводные типа C(sp3) -X
1.2.1 Классификация и
номенклатура
.2.2 Методы получения
.2.3 Галогенметилирование аренов
.2.4 Методы
получения алкилгалогенидов
.3 Галогенпроизводные
типа C(sp2) - X
.3.1 Классификация
и номенклатура
.3.2 Методы
получения
.3.2.1
Галогеналкенов
1.3.2.2
Галогенаренов
1.3.2.3
Аллилгалогенидов
1.4 Галогенпроизводные типа C(sp)-Х.
Галониевые соединения
.4.1 Методы получения
1.4.2 Галониевые соединения
.5 Галогенкарбонильные
соединения
1.5.1 Галогенкарбоновые
кислоты. Методы получения
1.5.2
Ацилгалогениды. Методы получения
1.6 Галоформная реакция. Экспериментальная часть
Заключение
Список
используемой литературы
Введение
Цель: провести подбор и проанализировать литературу по теме «Синтез
галогенорганических соединений. Реакция галоформного расщепления»;
Синтезировать: йодоформ;
Структура: содержание, введение, две части - экспериментальная и
теоретическая, заключение, список используемой литературы.
В основе синтеза галогенорганических соединений лежат реакции с участием
галогена, в результате которых получаются всевозможные соединения с различной
структурой УВ скелета, разным количеством атомов галогена и соответственно
различными физическими и химическими свойствами.
Если при галогенирования кетонов образуется α-галогенкетон, то прочие водородные
атомы при данном углероде более кислый характер и удаляются гораздо быстрее,
чем первый водород. Такую последовательность превращений называют галоформной
реакцией, т.к. в результате ее образуется хлороформ, бромоформ или йодоформ в
зависимости от галогена, используемого при галогенировании.
I. Теоретическая часть
.1 Галогенпроизводные углеводородов
Наиболее простыми производными углеводородов являются галогенпроизводные,
в которых один или более атомов водорода в углеводороде замещены атомами
галогенов (F, CI, Br, I).
Число галогенпроизводных очень велико. Это определяется разнообразием
самих углеводородов, расположением атомов галогена, числом и типом атомов
галогена. В основе классификации галогенпроизводных углеводородов лежит не
принадлежность углеводорода к тому или иному классу, а тип атома углерода, с
которым связан атом галогена. В каждой группе можно выделить подгруппы в
зависимости от строения углеводородного остатка, природы галогена и числа
атомов галогена. В основу этой классификации положена гибридизация углеродного
атома (sp3, sp2 и sp) или, иначе говоря, пространственное расположение
заместителей у этого углеродного атома (тетраэдрический, тригональный,
дигональный).
I. Галогенпроизводные со связью C(sp3)-галоген:
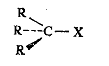
(X=F, CI, Br, I).
II. Галогенпроизводные со связью С(sp2)-галоген:
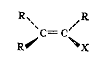
III.
Галогенпроизводные со связью C(sp)-галоген:
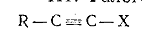
Эти группы галогенпроизводных значительно различаются по физическим и
особенно химическим свойствам, поэтому такая классификация вполне оправдана. В
классе галогенпроизводных углеводородов рассмотрим также специальные их
производные - галониевые соединения [R-Х+-R]Y-.
.2 Галогенпроизводные типа C(sp3) -X
.2.1 Классификация и номенклатура
К галогенпроизводным углеводородов со связью C(sp3)-X (тетраэдричеекнй углерод -
галоген) принадлежат:
а) галогеналканы CnH2n+1X; CnH2n+2-m; X=F, CI, Br, I;
б) пергалогеналканы CnH2n+2;
в) галогенциклоалканы;
г) галогеналкены с атомом галогена в заместителе у этиленовой связи; 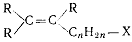
д) галогеналкины с атомом галогена в заместителе у ацетиленовой связи; R -С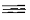 С- CnH2n- X;
С- CnH2n- X;
е) галогенарены с атомом галогена в боковой цепи, Аг - CnH2n - X; Аг
- CnH2n+1-mXm
В основе названия галогенуглеводорода лежит название самой длинной
неразветвленной цепи. Атомы углерода нумеруют таким образом, чтобы меньший
локант получил заместитель, который в названии пишется первым, а сами
заместители перечисляются в порядке алфавита.
Цепь углеродных атомов в алкенах и алкинах нумеруют так, чтобы меньшие
локанты получили атомы углерода кратной связи:
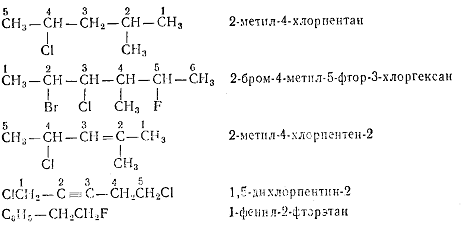
Для некоторых простейших галогенпроизводных углеводородов сохраняются
также названия, в основе которых лежит название углеводородного остатка:
СН3Сl
метилхлорид
CH3J метилиодид
С2Н5Вг этилбромид
СН2С12 метиленхлорид
С6Н5СН2С1 бензилхлорид
Для некоторых галогенпроизводных сохраняются тривиальные названия:
СНСl3 хлороформ
СНВг3 бромоформ
CHI3 йодоформ
Для названия полностью галогенированных углеводородов используется
префикс пер-: C2F6 перфторэтан
С3С13 перхлопрпан
Для соединения СС14 применяется название тетрахлорид углерода
или четыреххлористый углерод.
1.2.2 Методы получения
Галогенпроизводные углеводородов получают прямым галогенированием
углеводородов, присоединением галогенов или галогенводородов к алкенам и
алкинам, замещением кислородсодержащих или других групп на галоген.
) Прямое галогенирование. Таким методом можно получить фтор-, хлор- и
бромуглеводороды. Прямое иодирование алканов неизвестно. Методы являются
промышленными.
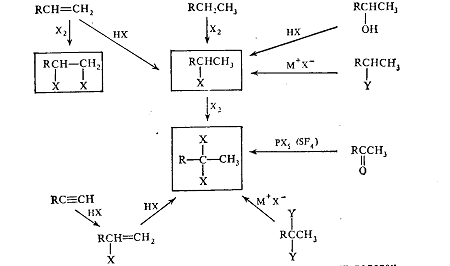
Рис.1. Генетическая связь между углеводородами, их галогенпроизводными и
кислородсодержащими соединениями.
а) Фторирование. Фтор с алканами реагирует очень энергично, даже с
взрывом, так как в реакции выделяется много теплоты (большая энергия
образования связи С-F). Поэтому для
фторирования алканов необходимы специальные условия: разбавление фтора азотом,
специальная конструкция реакторов с медными сетками для эффективного отвода
теплоты реакции.
В качестве переносчиков фтора используют фториды металлов (CoF2, AgF, MnF2). Под
действием фтора образуются CoF3, AgF2, MnF4, которые
фторируют алканы. Так получают перфторалканы:
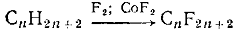
Реакция протекает по свободнорадикальному механизму.
б) Хлорирование. Алканы реагируют с хлором под действием УФ-облучения или
температуры, которые инициируют образование свободных радикалов. Эквимолярная
смесь метана и хлора при УФ-облучении может взрываться. Поэтому хлорирование
осуществляют в избытке алкана в реакторах с УФ-лампами. Реакция протекает по
свободнорадикальному механизму. Хлорирование алканов происходит постепенно:
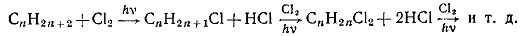
Наиболее легко замещается водородный атом у третичного атома углерода,
труднее - у вторичного атома. При хлорировании алкенов хлор обычно
присоединяется к двойной связи. Только при 400 - 600°С осуществляется аллильное
хлорирование. Хлорирование алкиларенов при нагревании и освещении приводит к
хлоралкиларенам.
в) Бромирование. Прямое бромирование для простейших алканов (метан, этан)
малохарактерно. В принципе бромирование возможно при нагревании и интенсивном
облучении УФ-светом. Для гексана, гептана и других алканов возможно
бромирование при кипячении и освещении:
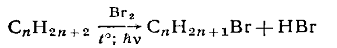
Замещенные алкены подвергаются аллильному бромированию при взаимодействии
со специальными бромирующими реагентами в присутствии инициаторов - свободных
радикалов.
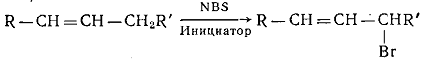
Бромирование алкиларенов при нагревании и освещении приводит к
образованию бромалкиларенов с атомами брома в боковой цепи.
) Реакции присоединения к алкенам и алкинам.
В реакциях присоединения галогеноводородов и галогенов получают различные
галогенпроизводные углеводородов:
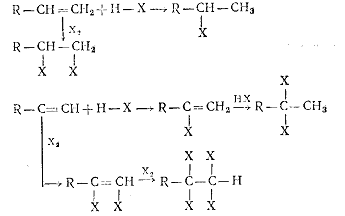
Реакции идут хорошо, если X=Сl, Вг или I. Если X2=J2, скорость реакции уменьшается. Присоединение фтора связано с
выделением большого количества теплоты, поэтому процесс трудно управляем.
Присоединение HF в обычных условиях не дает хороших
результатов. По-видимому, это связано с малой нуклеофильностыо иона HF2-, который обычно образуется в растворах HF. При использовании безводной HF наблюдаются лучшие выходы.
) Реакции замещения.
Используя различные галогенсодержащие реагенты, можно замещать галогеном
атом кислорода в альдегидах, кетонах, группу -ОН в карбоновых кислотах и
спиртах.
а) Получение галогенпроизводных из спиртов. Замещение гидроксильной
группы на атом галогена в спиртах происходит под действием галогеноводородов
или галогенидов фосфора и серы:

К эффективным реагентам относятся РС15, РOCl3, РСl3, РВг3, РВг5, РI3, SOCl2. Очень
эффективным реагентом фторирования является SF4:
RCH2OH + SF4 2RCH2F + SО3 + 2HF
б) Получение галогенпроизводных из альдегидов и кетонов. Эта реакция
осуществляется при действии РС15, РВг5 или SF4 при нагревании:
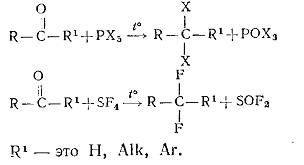
в) Получение галогенпроизводных из карбоновых кислот. Карбоновые кислоты
под действием РС15 превращаются в хлорангидриды (ацилхлориды), которые
только при нагревании под давлением дают трихлорпроизводные:
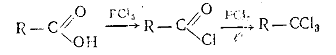
При нагревании карбоновых кислот с SF4 под давлением образуются трифторпроизводные:
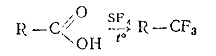
г) Взаимное замещение атомов галогена в галогенпроизводных. При
взаимодействии галогенпроизводных с галогенидами металлов один атом галогена
замещается на другой:
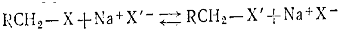
Реакция обратима и при изменении концентраций галогенид-ионов может быть
направлена в сторону RCH2X или RCH2X’. Практически реакция применяется для получения иод- и
фторпроизводных. В последнем случае используют фториды сурьмы. Наиболее часто
применяют смесь SbF3 и SbCl5.
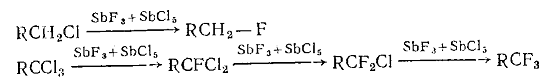
.2.3 Галогенметилирование аренов. При обработке аренов формальдегидом
и галогеноводородом в присутствии катализаторов (А1С13, ZnCl2) получаются галогенметиларены:
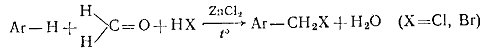
Реакция галогенметилирования является еще одним примером электрофильного
замещения у углеродного атома арена. Электрофильным реагентом в этой реакции
является гидроксиметилкатион:
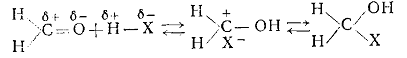
1.2.4 Методы получения алкилгалогенидов
1. Спирты + галогеноводороды;
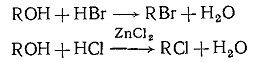
Порядок реакционной способности: третичный> >вторичный>
первичный; при получении хлоридов необходимо применение ZnCl2 в качестве катализатора; обычно сопровождается
перегруппировкой.
. Спирты + галогениды фосфора;
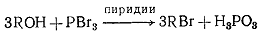
Легче всего протекает с первичными ROH; пиридин (слабое азотистое основание) поддерживает
кислотность низкой, что позволяет уменьшить степень перегруппировки
. Спирты + тионилхлорид;
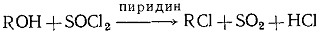
. Серебряная соль карбоновой кислоты + галоген; (реакция Хунсдиккера).
Свободнорадикальная реакция.
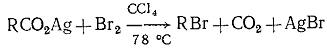
1.3 Галогенпроизводные типа C(sp2) - X
.3.1 Классификация и номенклатура
К галогенпроизводным со связью C(sp2)-X (тригональный углерод - галоген) принадлежат:
1) галогеналкены с атомом галогена у углерода двойной связи
(винилгалогениды):
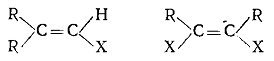
А. Винилгалогениды
2) Галогеналкадиены:
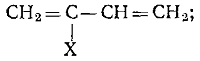
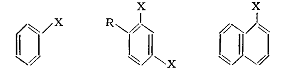
1.3.2 Методы получения
Для получения галогеналкенов и галогенаренов применяют заметно
отличающиеся друг от друга методы.
1.3.2.1 Галогеналкены получают двумя основными реакциями:
а)отщеплением галогеноводородов от 1,2-дигалогеналканов. Это достигается
действием щелочи или термически над катализатором: наиболее доступным из
винилгалогенидов является хлористый винил, который можно получить рядом
способов:
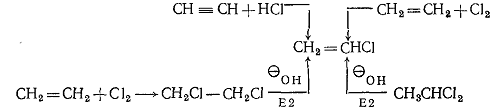
По-видимому, самый удобный способ получения хлористого винила основан на
высокотемпературном хлорировании этилена. Характерной особенностью химического
поведения винилгалогенидов является их инертность в реакциях SN1 и SN2. Так, хлористый винил даже при
длительном нагревании с раствором нитрата серебра в этаноле не образует хлорида
серебра, не реагирует с йодистым калием и при действии едкого натра лишь очень
медленно образует ацетилен по реакции Е2. Для галогенацетиленов типа RC=C-Сl характерна такая же инертность в реакциях Sn1 и Sn2.
б) присоединением галогеноводородов к алкинам:
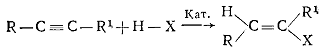
1.3.2.2 Галогенарены получают прямым галогенированием аренов или замещением
других групп галогеном:
а) Прямое галогенирование является главным методом получения галогенаренов
(за исключением фтораренов). Хлорирование происходит очень легко при
взаимодействии арена с хлором в присутствии небольших количеств катализатора (Fe, FeCl3, другие кислоты Льюиса). При хлорировании бензола получают хлорбензол,
дихлорбензол, трихлорбензол:
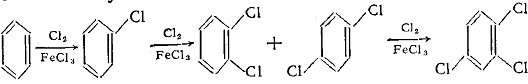
Легко хлорируются толуол, ксилолы, бифенил, нафталин. Бромирование аренов
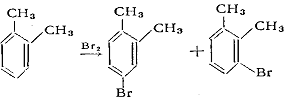
происходит труднее, чем хлорирование, и катализируеся Fe, FeBr3, иодом:
Иодирование аренов требует специальных условий. Иод с аренами
непосредственно не реагирует, только образует слабые комплексы с переносом
заряда, так как имеет меньшее сродство к электрону, чем бром и хлор.
Иодирование аренов осуществляют в присутствии окислителей (НIO3, HNO3+H2SO4, Н2О2 и др.). Окислители превращают
иод в катион I+, который является более сильным электрофильным
реагентом:
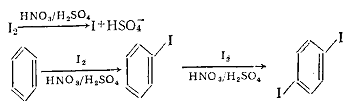
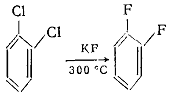
б) Замещение других групп галогеном. Этот метод применяется главным
образом для получения фтораренов. Известны реакции замещения хлора на фтор
действием KF при высокой температуре под
давлением:
Для получения галогенаренов используют арендиазониевые соли:
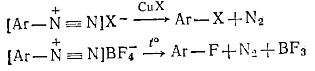
.3.2.3 Аллилгалогениды
Хлористый аллил получают в промышленном масштабе путем хлорирования
пропилена при 400 °С. В этих
условиях 1,2-дихлорпропан образуется лишь в незначительном количестве.
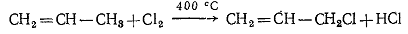
Хлористый аллил является промежуточным соединением при промышленном
синтезе глицерина (1,2,3-триоксипропана) из пропилена:
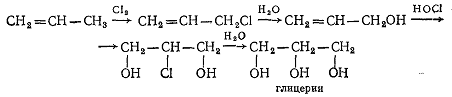
Общий метод получения аллилгалогенидов заключается в присоединении
галогеноводородных кислот к сопряженным диенам, в результате чего обычно
образуется смесь продуктов 1,2- и 1,4-присоединения.
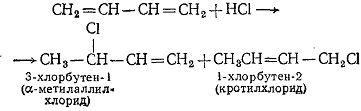
1.4 Галогенпроизводные типа C(sp)-Х. Галониевые соединения
К соединениям типа C(sp)-X принадлежат галогенацетилены,
дигалогенацетилены и галогеналкины:
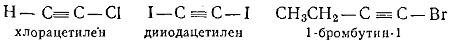
.4.1 Методы получения
Галогеналкины получают реакцией непосредственного галогенирования и
реакциями отщепления.
а) Прямое галогенирование.
Галогенировать можно ацетилен и монозамещенные ацетилены галогеном в
щелочной среде. Предполагается, что галогенируется ацетиленид-ион:
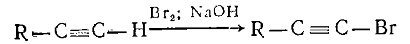
б) Реакции отщепления.
Исходными продуктами служат дигалогеналкены и тригалогеналкены или
тетрагалогеналканы, которые при действии крепкой щелочи отщепляют галогеноводород:
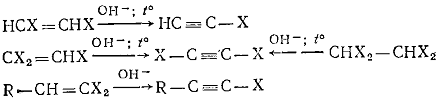
1.4.2 Галониевые соединения
При координации неподеленной электронной пары атома галогена с
карбокатионом могут образоваться соли галония (хлорония, бромония, иодония):
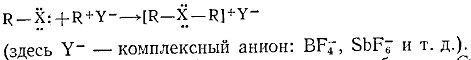
Соли хлорония и бромония очень нестабильны. Стабильность в значительной
степени определяется природой того углеродного атома, с которым связан атом
галогена. Относительно более стабильны соли галония, имеющие связь C(sp2)
соли диарилгалония.
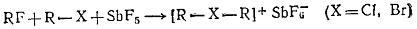
Соли иодония - наиболее стабильные из всех соединений галония.
Диалкилиодониевые соли получают при низких температурах:
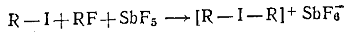
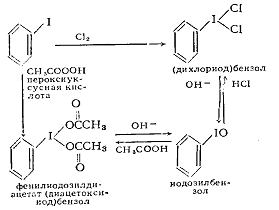
Наиболее изученными солями галония являются соли диарилиодония. Они
стабильны до температуры 200 °С. Соли диарилиодония получают специальными
методами иодонирования аренов соединениями I(III). Для этой цели пригодны арилиодозилсоединения
ArIY2, триацилаты иода I(OOCR)3
и иодозилсоли IO+Y-. Арилиодозилсоединения получают при окислении иодаренов
сильными окислителями (С]2, Н2О2,
пероксикислотами):
Соли диарилиодония используют в органическом синтезе для введения
арильной группы (арилирование).
.5 Галогенкарбонильные соединения
.5.1 Галогенкарбоновые кислоты. Методы получения
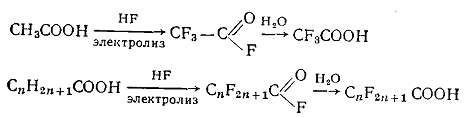
а) α-Галогенкарбоновые кислоты получают галогенированием
карбоновых кислот галогеном (кроме иода). Фторирование ведет к
перфторкарбоновым кислотам. В промышленности это осуществляется
электрохимически в растворе жидкого HF. Продуктами реакции являются ацилфториды:
Хлорирование карбоновых кислот происходит при нагревании и освещении
реакционной смеси. При хлорировании уксусной кислоты образуются все три
возможных продукта:
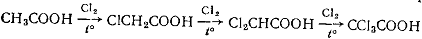
Хлорирование других карбоновых кислот (пропионовой, масляной и др.) дает
не только α-, но также β- и γ- замещенные хлоркарбоновые кислоты.
Преимущественно в α-положение кислоты хлорируются в присутствии РС13.
Бромирование карбоновых кислот идет в присутствии красного фосфора (или
РВг3). Продуктами реакции являются бромиды α- бромкарбоновых кислот. В этой
реакции вначале образуются ацилбромиды, которые затем легко бромируются:
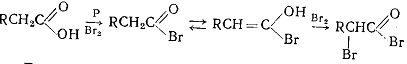
Реакции бромирования и хлорирования карбоновых кислот в присутствии
красного фосфора открыли и исследовали К. Хелль (1881), Я. Фольгард (1887), Н.
Д. Зелинский (1887). α -Фтор- и α -иодкарбоновые кислоты получают
реакцией нуклеофильного замещения атомов хлора или брома:
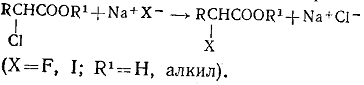

б) γ -Галогенкарбоновые кислоты получают из α,β-ненасыщенных карбоновых кислот:
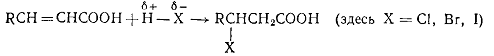
в) γ-, δ-, ε- и ω- Галогенкарбоновые кислоты имеют
свои специфические методы получения. В лаборатории их можно получить из
соответствующих гидроксикислот. Галогенкарбоновые кислоты Сl(СН2СН2)nСООН получают из 1,1,1
ω -тетрахлоралканов, которые, получают
реакцией теломеризации:
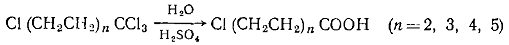
При взаимодействии карбоновых кислот или их солей с галогенидами серы (SOCl2, SО2C12) и фосфора (РС13,
РОС13, РС15, РВг6) или фосгеном СОС12
образуются ацилгалогениды:
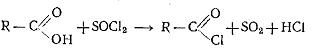
Так получают хлориды и бромиды. Иодиды получают из ацилхлоридов реакцией
замещения хлора на иод. Аналогично получают ацилфториды. Фториды
перфторкарбоновых кислот образуются при электрохимическом фторировании кислот.
Простейший ацилхлорид - формилхлорид HCOCl - разлагается на СО и НСl,
формилфторид HCOF более стабилен.
Для получения α-галогенкарбонильных соединений
главным образом используют прямое галогенирование карбонильных соединений, реже
- окисление галогеналканолов:
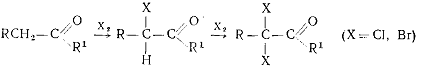
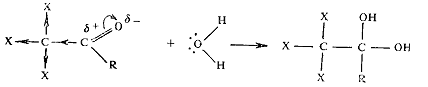
Карбонильная группа дает обычные реакции, если им не мешают реакции по
связи С-галоген. В полигалогенкарбонильных соединениях карбонильная группа
обладает большой электрофильностью и способна присоединять воду с образованием
устойчивых гидратов:
В щелочной среде легко происходит гидролитическое расщепление связи С-С и
образуются тригалогенметаны (галоформы):
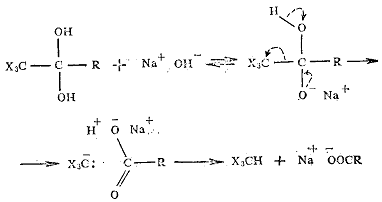
Механизм этого «галоформного» расщепления, по-видимому, подобен
расщеплению β-дикарбонильных соединений.
.6 Галоформная реакция
При галогенирования кетонов, индуцируемому основанием, а именно: если
образуется α-галогенкетон, то прочие водородные атомы при данном углероде
приобретают вследствие электроноакцепторного действия галогена более кислый
характер и удаляются гораздо быстрее, чем первый водород.
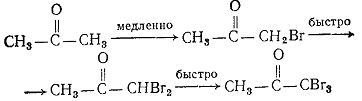
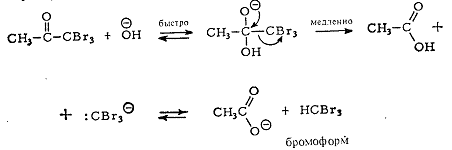
Таким образом, если стремятся получить монобромкетон, то реакцию следует
проводить в присутствии кислого, а не основного катализатора. Катализируемое
основаниями галогенирование метилкетонов осложняется также тем, что образующийся
тригалогенкетон легко атакуется основанием, что приводит к расщеплению
углерод-углеродной связи.
Такую последовательность превращений часто называют галоформной реакцией,
поскольку в результате ее образуется хлороформ, бромоформ или йодоформ в зависимости
от галогена, используемого при галогенировании. Галоформная реакция служит
удобной качественной пробой на присутствие метилкетонов, особенно в случае
иодирования, так как йодоформ представляет собой чрезвычайно малорастворимое
твердое вещество ярко-желтого цвета. Реакция оказывается также удобной для
синтеза карбоновых кислот в том случае, когда метилкетон более доступен, чем
соответствующая кислота.
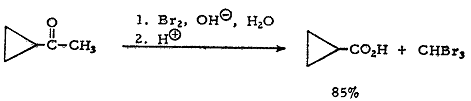
Галоформная реакция происходит быстро и поэтому может быть в некоторых
случаях использована для получения ненасыщенных кислот из ненасыщенных кетонов,
причем этот синтез не осложняется сколько-нибудь существенно присоединением
галогена по двойной связи.
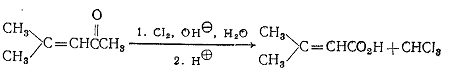
II. Экспериментальная часть
Йодоформ
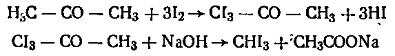
Реакция протекает по следующей схеме:
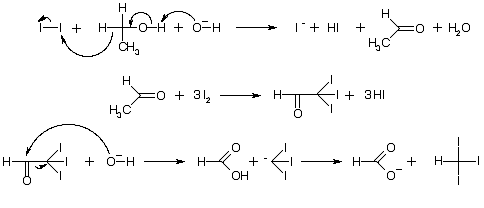
Исходные вещества:
1. ацетон- 4 г (5 мл);
2. иод -2 г;
. иодид калия - 4 г;
. гидроксид натрия (калия), 10%-ный раствор.
Посуда и оборудование: стакан или колба вместимостью 100-150 мл; воронка
капельная, воронка Бюхнера, колба Бунзена.
В стакан помещают 4 г иодида калия, приливают 7,5 мл дистиллированной
воды и после растворения соли добавляют 2 г иода. К полученному раствору
приливают 17,5 мл воды. Затем в реакционную массу вводят 5 мл ацетона и при
перемешивании по каплям добавляют из капельной воронки 10%-ный раствор
гидроксида натрия до исчезновения красноватой окраски раствора
(≈ 4,5 мл). Йодоформ, который при этом выпадает в виде желтого
кристаллического осадка, через 30 мин отфильтровывают на воронке Бюхнера,
промывают небольшим количеством воды и высушивают на воздухе.
Масса получившегося вещества (по методике): 0,93 г - 90% от теоретич.
Масса получившегося вещества (практическое): 0,9 г - 87% от теоретич.
Йодоформ (трииодметан) - желтое кристаллическое вещество с сильным
характерным запахом, практически нерастворимое в воде. Трудно растворим в
спирте, хорошо растворяется в эфире, хлороформе.
|
Общие Систематическое
наименование - Иодоформ Химическая формула - СHI3 Отн. молек.
Масса - 393.73 а.е.м. Молярная масса - 393.73 г/моль Физические свойства
Плотность - 4,008 г/см³
Растворимость в воде - 0.1 г/л г/100 мл
Термические свойства Температура плавления - 123 °C Температура кипения - 217
°C
|
Йодоформ был открыт в 1822 г. Серулла; точный состав йодоформа определен
в 1834 г. Дюма. Серулла получил йодоформ при действии йода на этиловый спирт в
присутствии едких и углекислых щелочей. Йодоформ, в медицинской практике
пользуется широким применением, преимущественно как наружное средство, вместо
йода, вследствие свойства его не вызывать местного воспаления; менее ядовит
сравнительно с йодом. Но так как йодоформ всасывается легко и быстро, то и
относительно небольшие дозы его могут уже вызвать смертельное отравление.
Первые симптомы отравления йодоформом сказываются потерей аппетита и ощущением
неприятного вкуса. Симптомы тяжелого отравления йодоформом, наблюдавшиеся,
между прочим, при впрыскивании йодоформного эфира в холодные гнойники,
выражаются галлюцинациями (йодоформный бред), беспамятством, задержанием мочи,
исступлением и, наконец, смертью от паралича мозга. Часто находили также острое
ожирение сердца. Врачебное достоинство йодоформа главным образом
обусловливается его антисептическим действием на раны и язвы без всяких явлений
раздражения тканей, его болеутоляющим побочным действием и способностью
всасывать продукты выделения. Антисептическое действие йодоформа
обусловливается постепенным, но беспрерывным освобождением из него йода; оно
наступает не так быстро и непосредственно, как после употребления карболовой
кислоты и других антисептических средств, но зато и не так скоро исчезает, как
после них. Повязка с йодоформом может в течение весьма продолжительного времени
оставаться асептической. Чрезвычайно важно для хирургической практики и
удобства применения его при лечении ран (в форме порошка для присыпок,
растворов, мазей, марли и т. д.). Антибактериальное действие самого йодоформа оспаривается.
Он сам содержит бактерии в виде примеси и потому рекомендуют применять в
хирургии так называемый обеспложенный йодоформ (промытый раствором сулемы или
карболовой кислоты, обработанный углекислым газом и сохраняемый в герметически
запаянных стеклянных трубках). Внутреннее употребление йодоформ крайне
ограничено, так как ему не свойственны специфические целебные свойства.
Уничтожают запах йодоформа несколькими каплями бергамотного, анисового,
мятного, эвкалиптового или укропного масла, хотя вообще должно прибавлять
крайне незначительные количества масла, так как оно действует на свободный йод.
Для уменьшения запаха рекомендуют еще перуанский бальзам. Различные предметы
можно, кажется, освободить от запаха йодоформа, натирая их терпентинным маслом
и затем, по истечении полуминуты, обмывая мылом.
Заключение
· Проведен анализ литературы по теме «Синтез
галогенорганических соединений. Реакция галоформного расщепления».
· Проведен синтез йодоформа, рассчитан выход продукта
относительно теоретического и измерена температура плавления.
Расчет синтеза
|
Название, формула.
|
Характеристика исходных
веществ
|
Количество исходных веществ
|
|
Молярная масса
|
Физ. свойства
|
const
|
По методике
|
По ур-ю реакции
|
Избыток, моль
|
|
|
|
|
|
|
|
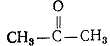
Ацетон
г/мольАцетон
является бесцветной жидкостью, обладающей сильным и резким характерным запахом.
Хорошо растворяется в воде.T пл°CТ кип
°C%
концПоказ. прелом.млг
Избыток
|
0,019
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-95
|
56
|
-
|
0,8125
|
2,5
|
2
|
|
|
|
КОН Гидроксид калия
|
56 г/моль
|
Твердое вещество, белого
цвета, хорошо растворимо в воде.
|
-
|
-
|
1,09
|
2,5
|
-
|
1
|
недостаток
|
|
I2 Йод
|
254 г/моль
|
Темные кристаллы
|
114
|
185
|
-
|
-
|
-
|
2
|
3
|
-
|
|
KI Иодид калия
|
294
|
Твердое вещество
|
-
|
-
|
-
|
-
|
-
|
2
|
-
|
-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Характеристика основного и побочного продукта
|
Название, формула
|
Молярная масса г/моль
|
Физ св-ва
|
const
|
Растворимость
|
OX/ Red
|
Отделение
|
|
|
|
Т кип
|
Т пл
|
|
|
|
|
CHI3 Йодоформ
|
394
|
Жёлтые кристаллы со
специфическим запахом
|
217°С
|
123°С
|
Практически нерастворимое в
воде вещество. Трудно растворим в спирте, хорошо растворяется в эфире,
хлороформе.
|
нейтральный
|
Выпадает в в виде осадка,
который через 30 мин отфильтровывают, промывают и высушивают на воздухе.
|
|
|
|
|
|
|
|
|
|
|
|
Константа и выход полученного вещества
|
Название
|
|
Молек. масса
|
Т пл
|
Физ св-ва
|
г
|
От теоретич, %
|
Теоретич, г
|
|
CHI3 Йодоформ
|
|
394
|
119°С
|
Желтые кристаллы, со
специфическим запахом йода
|
0,9
|
87
|
1,03
|
галогенпроизводный углеводород йодоформ
Список используемой литературы
1. Тюкавина
Н.А. Органическая химия: Учебник-2 изд., переработанное и дополненное - М.:
Медицина, 1998. - 134-137с.;
. Нейланд
О.Я. Органическая химия: Учебник для хим. спец. вузов.- М; Высш. шк., 1990. -
218-248 с.,567-607с.;
. Гитис
С.С., Глаз А.И., Иванов А.В. Практикум по органической химии: Учеб. пособие для
вузов.-М.: Высш. шк.,
1991.-147с.;
. Электронный
справочник терминов и основных реакций по органической химии.- Ставрополь: СГУ,
2005 г;
5. www.wikipedia.ru
<http://www.wikipedia.ru>
6. www.krugosvet.ru
<http://www.krugosvet.ru>