Синтез циклогексанона
мИнИстерство
оБРАЗОВАНИЯ И науки украИнЫ
харЬкОвский
нацИональнЫй унИверситет
имени В.Н. Каразина
Кафедра химической технологии
КУРСОВАЯ РАБОТА НА ТЕМУ:
СИНТЕЗ
ЦИКЛОГЕКСАНОНА (РАСЧЕТЫ)
Исполнитель: студент
Группы Х -124
Твердохлеб И. И.
Руководитель: доцент, к.х.н.
Васьковский Е. В.
ХАРЬКОВ 2010
Содержание
Введение
1. Расчет расходных коэффициентов
2. Расчет материального баланса
2.1 Расчет теоретического материального баланса
2.2 Расчет практического материального баланса
3. Расчет теплового баланса
3.1 Расчет приходной части теплового баланса
3.2 Расчет расходной части теплового баланса
4.Термодинамический анализ основной реакции
5. Расчет константы равновесия и равновесного состава
реагирующих веществ
6. Эмпирический расчет теплот сгорания и образования веществ
6.1 Расчет по Коновалову
6.2 Расчет по Карашу
6.3 Расчет по энергиям связи
7. Кинетически расчет
7.1 Определение порядка реакции
7.2 Определение энергии активации
8. Расчет основного аппарата
8.1 Сравнительный расчет идеальных реакторов различного типа
8.2 Расчет реальных реакторов с учетом функции распределения
времени пребывания
8.3 Расчет в произвольной системе реакторов идеального смешения
и идеального вытеснения
9. Технологическая схема синтеза и ее описание
10. Схема основного аппарата
11. Выводы
Список использованной литературы
Введение
Способы получения
1. Получение циклогексанона при
окислении циклогексана.
СН2 СО
/ \ / \
Н2С
СН2 +0,5О2 Н2С СН2
 | | | |
| | | |
Н2С
СН2 Н2С СН2
\ / \ /
СН2
СН2
Циклогексан содержится в
нефти, и его можно извлекать из легких нефтяных фракции экстрактивной
перегонкой, фракционной кристаллизацией и т.п. На практике циклогексан
преимущественно получают каталитическим гидрированием бензола. Это объясняют
трудностями, связанными с выделением чистого циклогексана из нефтяного сырья.
Окисление циклогексана
можно осуществлять как в паровой, так и в жидкой фазе – некаталитическим путем
или в присутствии катализатора.
Главным первичным
продуктом окисления является гидроперекись циклогексила:
СН2 СН2
/ \ / \
Н2С
СН2 +0,5О2 Н2С СН – ООН
 | | | |
| | | |
Н2С
СН2 Н2С СН2
\ / \ /
СН2
СН2
Каталитическое окисление
циклогексана проводится в жидкой фазе воздухом или техническим кислородом при
повышенном давлении и температуре. Катализаторами являются поливалентные
металлы, например кобальт или медь в виде солей. Суммарный выход циклогексанола
и циклогексанона достигает 85 %.
Наряду с циклогексанолом
и циклогексаноном образуюся продукты более глубокого окисления, главным образом
дикарбоновые кислоты (адипиновая, глутаровая и янтарная кислоты).
2. Дегидрирование (окисление)
циклогексанола.
Циклогексанол тоже можно
перевести в циклогексанон окислением или дегидрированием.
Циклогексанон получают из
циклогексанола окислением (окислительным дегидрированием)
СНОН СО
/ \ / \
Н2С
СН2 +0,5О2 Н2С СН2
 | | | |
| | | |
Н2С
СН2 Н2С СН2
\ / \ /
СНОН СН2
или дегидрированием:
СНОН СО
/ \ / \
Н2С
СН2 Н2С СН2
 | | | |
| | | |
Н2С
СН2 –Н2 Н2С СН2
\ / \ /
СНОН СН2
Процесс дегидрирования
циклогексанола достаточно хорошо освоен в промышленности.
Его проводят при 450 –
4600С над катализатором (оцинкованное железо). Кроме дегидрирования,
при этом протекает побочная реакция дегидратации циклогексанола с образованием
циклогексена
СНОН СН
/ \ / \\
Н2С
СН2 Н2С СН2
 | | | |
| | | |
Н2С
СН2 –Н2О Н2С СН2
\ / \ /
СНОН СН2
а также происходит
частичное расщепление молекулы циклогексанола с выделением углерода, водорода и
воды.
На этом способе снован
первый из осуществленных в промышленности методов синтеза циклогексанона – из
фенола с предварительном гидрированием его в циклогеканол:
ОH
ОH О
| | ||


 + 3Н2
+ 3Н2


– Н2
3.
Из анилина через
циклогексиламин:
NH2 NH2 NH2 О
 |
| || ||
|
| || ||



 + 3N2 +
Н2О
+ 3N2 +
Н2О



– Н2 –
NH3
Ввиду меньшего числа
стадий и потребности в дополнительных реагентах заслуживает предпочтение метод
получения циклогексанона окислением циклогексана.
Физические и химические свойства
Циклогексанон (или кетогексаметилен
или пимелинкетон) – это бесцветная жидкость, молекулярная масса 98,15;
плотность 0,94; температура плавления – 450 С; температура кипения
1560 С. Растворим в воде (2,431), этаноле, эфире.
Для циклогексанона
(представителя кетонов) характерны реакции присоединения.
1. Реакции восстановления.
а. гидрирование в паровой
фазе (использование молекулярного водорода)
О ОН
|| |

 Ni, Co
Ni, Co
 + Н2
+ Н2
Pt, Pd
б. восстановление в присутствии
амальгамы цинка
О
||

 Н+, Zn, Hg
Н+, Zn, Hg

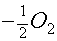
2. Нуклеофильное присоединение
а. взаимодействие с аммиаком:
О NН
|| |


 + NН3 + Н2О
+ NН3 + Н2О
б. реакция с гидроксиламином
(применяется для количественного определения кетонов):
О N – ОН
|| ||


 + NН2ОН + Н2О
+ NН2ОН + Н2О
в. реакция с гидразином:
О N – NН2
|| ||


 + Н2N – NН2 + Н2О
+ Н2N – NН2 + Н2О
г. реакция с PCl5:
СО
CCl2
/ \ /
\
Н2С СН2
Н2С СН2
 |
| + PCl5
| | + POCl3
|
| + PCl5
| | + POCl3
Н2С СН2
Н2С СН2
\ /
\ /
СН2 СН2
3. Реакции с расширением цикла
а. реакция взаимодействия с
диазометаном:
СО
CО
/ \ /
\
Н2С СН2
Н2С СН2
 |
| + СН2NН2 | | + N2
|
| + СН2NН2 | | + N2
Н2С СН2
Н2С СН2
\ /
| |
СН2 Н2С
– СН2
Применение
Циклогексанон используют
для производства капрлактама – исходного вещества для получения синтетического
волокна капрон:
ОH
NОH
| ||
 перегруппировка
Бекмана
перегруппировка
Бекмана



 N NН
N NН
/ \\ / \\
 Н2С С ОН Н2С С = О
Н2С С ОН Н2С С = О
|
| | |

 Н2С СН2 Н2С
СН2
Н2С СН2 Н2С
СН2
|
| | |

 Н2С СН2
Н2С СН2
Н2С СН2
Н2С СН2
При энергичном окислении
циклогексанона образуется адипиновая кислота, которую используют для получения
синтетического волокна нейлона.
Вывод: Циклогексанон – это циклический
кетон. Весьма реакционноспосоден. Применим для производства волокон.
Таблица 1. Данные материального
баланса
|
Производительность реактора П, т/год
|
9700
|
|
Число дней работы реактора в году, n
|
332
|
|
Технологический выход продукта f, %
|
96
|
|
Молярное соотношение исходных реагентов, А : В
|
1 : 2
|
|
Степень превращения ХА, %
|
85
|
|
Селективность основной реакции Ф, %
|
98
|
|
Состав исходного реагента А, % масс.:
|
С6Н12 
|
91
|
|
примесь С6Н6
|
9,0
|
|
Состав исходного реагента В, % масс.:
|
О2
|
21
|
|
примесь N2
|
79
|
Реакции синтеза:
Основная реакция
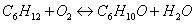
Побочная реакция
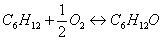
1. Расчет расходных коэффициентов
Это параметры,
характеризующие расход различных видов сырья на единицу полученной продукции. Различают
теоретические и практические расходные коэффициенты. Теоретические расходные
коэффициенты учитывают расход исходящего сырья с учетом стехиометрии реакции.
Практические расходные коэффициенты учитывают селективность процесса, выход
продукта, степень превращения (и рассчитываются на базе теоретических). Задание:
Рассчитать теоретические и практические расходные коэффициенты для
реагентов по основной реакции на 1 тонну целевого продукта.
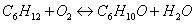
Найдем молярные массы
веществ участвующих в реакциях:
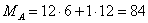
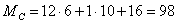
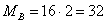
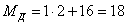
1.1 Рассчитаем теоретические
расчетные расходные коэффициенты
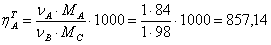
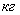
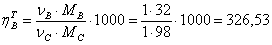
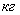
1.2 Рассчитаем практические расходные
коэффициенты для циклогексана
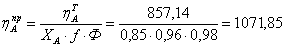
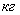
1.3 Рассчитаем практические расходные
коэффициенты для циклогексана в смеси с бензолом
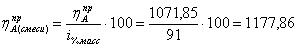
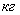
1.4 Рассчитаем практические расходные
коэффициенты для примеси (бензол)
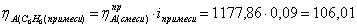
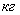
1.5 Исходя из мольного соотношения
исходных реагентов, рассчитаем практические расходные коэффициенты для кислорода
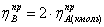
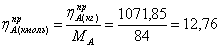
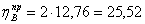
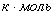
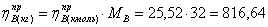
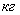
Рассчитаем практические
расходные коэффициенты для кислорода в смеси с азотом:
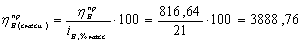
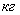
Рассчитаем практические
расходные коэффициенты для примеси (азот):
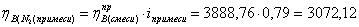
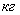
Вывод: Таким образом, для получения 1 т
циклогексанона необходимо взять 857,14 кг циклогексана и 326,53 кг кислорода,
но с учетом состава вещества, а также технико-экономических показателей
практические расходные коэффициенты составляют:
по циклогексану – 1177,86
кг
по кислороду – 3888,76
кг.
II. Расчет материального баланса
Составление
материального баланса – основное звено в оценке технико-экономической
эффективности химического процесса.
На основании данных материального баланса определяют основные
технико-экономические показатели, такие как выход, селективность, степень
превращения, расходные коэффициенты. Данные материального баланса используются
при составлении энергетического или теплового баланса, при термодинамических и
кинетических расчетах, расчетах реакторов.
Материальный баланс
химико-технологического процесса – это вещественное выражение закона сохранения
вещества, левую часть которого составляет масса всех вступивших в реакцию
веществ (приход), а правую – масса полученных продуктов (расход) и
производственные потери.
2.1 Расчет теоретического
материального баланса
Задание: Рассчитать на основании вышеприведенных данных
материальный баланс реакции получения циклогексанона:
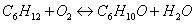
Молярные массы веществ
участвующих в реакциях:
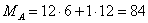
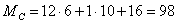
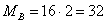
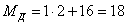
Рассчитаем количество циклогесканона в кмолях:
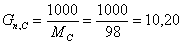
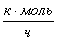
Рассчитаем количество кмоль/час циклогексана, необходимого для получения 10,20
кмоль/час циклогексанона:
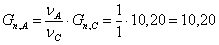
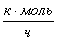
Рассчитаем количество кмоль/час кислорода, необходимого для получения 10,20
кмоль/час циклогексанона:
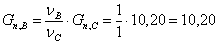
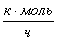
Рассчитаем количество образовавшейся воды:
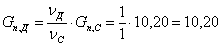
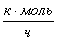
Результаты расчетов сводим в таблицу:
Таблица 2.
Теоретический материальный баланс
|
Приход
|
Расход
|
|
вещество
|
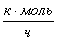
|
% мольн.
|
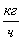
|
% масс.
|
вещество
|
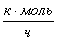
|
% мольн.
|
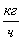
|
% масс.
|
|
С6Н12
|
10,20
|
50
|
856,8
|
72,4
|
С6Н10О
|
10,20
|
50
|
999,6
|
84,5
|
|
О2
|
10,20
|
50
|
326,4
|
27,6
|
Н2О
|
10,20
|
50
|
183,6
|
15,5
|
|
Итого:
|
20,40
|
100
|
1183,2
|
100
|
Итого:
|
20,40
|
100
|
1183,2
|
100
|
Вывод: Таким образом, в результате расчета установили, что при
получении 1 тонны циклогексанона необходимо взять 856,8 кг циклогексана и 326,4
кг кислорода. При этом выделяется 183,6 кг воды.
2.2.
Расчет практического материального баланса
Задание: Составить практический материальный баланс для
получения циклогексанона:
Основная реакция
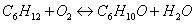
Побочная реакция
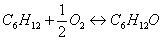
Молярные массы веществ
участвующих в реакциях:
– основная реакция
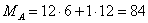
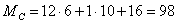
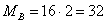
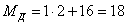
– побочная реакция – примеси
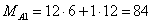
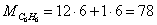
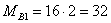
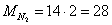
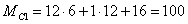
Переведем годовую производительность реактора, выраженную в единицах
массового потока, в единицу мольного потока:
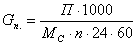
где П - массовая
производительность реактора, т/год;
Gn - мольная производительность,  ;
;
n - число дней работы реактора в
году;
M - молекулярная масса целевого
продукта – циклогексанона;
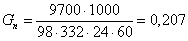

где 1000, 24,
60 – переводные коэффициенты.
Производительность
с учетом технологического выхода продукта:
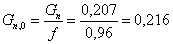

Рассчитаем
приходную часть материального баланса
Количество циклогексана, требуемого
для получения 0,216  циклогексанона:
циклогексанона:
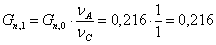

Количество циклогексана,
требуемого для получения 0,216  циклогексанона с
учетом селективности:
циклогексанона с
учетом селективности:
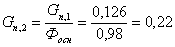

Количество
циклогексана, необходимого для получения циклогексанона с учетом степени
превращения:
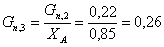

Количество циклогексана,
пошедшее на побочную реакцию:
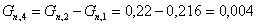

Количество непрореагировавшего циклогексана:
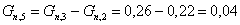

Количество циклогексана, с учетом
состава прореагировавшей смеси:
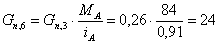
Количество примесей, поступающих с
оксидом углерода:
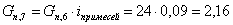
Количество кислорода,
поступающего с циклогексаном, с учетом мольного соотношения:
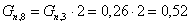

Количество кислорода, с учетом
состава:
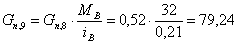
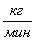
Количество примесей, поступающих с кислородом:
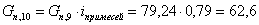
Количество кислорода, пошедшее на основную
реакцию:
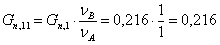

Количество кислорода, пошедшее на
побочную реакцию:
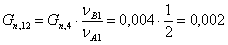

Количество непрореагировавшего кислорода:
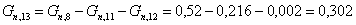

Рассчитаем расходную
часть материального баланса
Количество циклогексанона,
образовавшегося в ходе реакции:
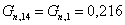

Количество воды:
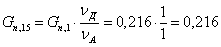

Количество циклогексанона, образовавшегося в ходе побочной
реакции:
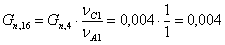

Результаты расчетов сводим в таблицу:
Таблица 3. Практический материальный
баланс
|
Приход
|
Расход
|
|
Вещество
|

|
%
|
|
%
массов.
|
Вещество
|

|
% мольн
|
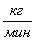
|
% массов.
|
|
С6Н12
|
0,26
|
8,54
|
21,84
|
21,15
|
С6Н10О
|
0,216
|
7,10
|
21,17
|
20,50
|
|
О2
|
0,52
|
17,08
|
16,64
|
16,11
|
Н2О
|
0,216
|
7,10
|
3,89
|
3,77
|
|
С6Н6
|
0,028
|
0,92
|
2,184
|
2,12
|
С6Н12О
|
0,004
|
0,13
|
0,4
|
0,39
|
|
N2
|
2,236
|
73,46
|
62,60
|
60,62
|
С6Н12 непр.
|
0,04
|
1,31
|
3,36
|
3,25
|
|
|
|
|
|
О2 непр.
|
0,302
|
9,93
|
9,66
|
9,355
|
|
|
|
|
|
С6Н6
|
0,028
|
0,92
|
2,184
|
2,115
|
|
|
|
|
|
N2
|
2,24
|
73,51
|
62,60
|
60,62
|
|
Итого:
|
3,044
|
100
|
103,264
|
100
|
Итого:
|
3,042
|
100
|
103,264
|
100
|
Вывод: Таким образом, в результате расчета
практического материального баланса установили что для получения 21,17 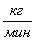 циклогексанона необходимо взять 21,84
циклогексанона необходимо взять 21,84 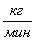 циклогексана и 16,64
циклогексана и 16,64 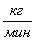 кислорода. Это соотношение с учетом
заданных технико-экономических показателей, а также состава исходного сырья и
молярного соотношения исходных реагентов. Полученные данные будут далее
использованы при расчете теплового баланса.
кислорода. Это соотношение с учетом
заданных технико-экономических показателей, а также состава исходного сырья и
молярного соотношения исходных реагентов. Полученные данные будут далее
использованы при расчете теплового баланса.
III. Расчет теплового баланса
Цель теплового баланса –
определение количества тепла, которое необходимо подвести (или отвести) из зоны
реакции для поддержания постоянной температуры, т.е. определить тепловую
нагрузку на реактор.
Тепловой баланс
составляется для стадии синтеза при изотермическом режиме процесса.
Тепловой баланс
рассчитывается по данным материального баланса с учетом тепловых эффектов
(экзо- и эндотермических) химических реакций и фазовых превращений (испарение,
конденсация, плавление, кристаллизация, возгонка), происходящих в реакторе,
подвода тепла с исходными реагентами и отвода тепла с продуктами реакции
тепловых потерь.
Тепловой баланс
составляется на основе закона сохранения энергии, в соответствии с которым: 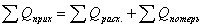 . Левая часть уравнения составляет тепло
всех входящих потоков в реактор, а правая – тепло выходящих потоков из реактора
и энергетических потерь.
. Левая часть уравнения составляет тепло
всех входящих потоков в реактор, а правая – тепло выходящих потоков из реактора
и энергетических потерь.
Задание: Рассчитать на основании данных
материального баланса и вышеприведенных данных тепловой баланс реакции получения
циклогексанона.
Дано:
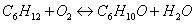
Таблица 4. Данные теплового баланса
|
Температура исходных компонентов
|
170º С
|
443 К
|
|
Температура продуктов реакции
|
360º С
|
633 К
|
|
Тепловые потери от прихода тепла
|
9%
|
0,08
|
Таблица 5. Данные
материального баланса и термодинамические свойства веществ – участников реакции
Вещество
|

|
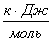
|
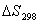
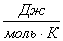
|
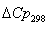
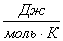
|
Ср = f(Т)
|
а
|
в*103
|
c*106
|
c’*10-5
|
|
Приход
|
|
С6Н12
|
0,26
|
-123,1
|
298,2
|
106,3
|
51,72
|
598,8
|
-230,0
|
–
|
|
О2
|
0,52
|
0
|
205,04
|
29,37
|
31,46
|
3,39
|
–
|
-3,77
|
|
С6Н6
|
0,028
|
49,04
|
173,2
|
136,1
|
59,5
|
255,02
|
–
|
–
|
|
N2
|
2,236
|
0
|
191,489
|
29,12
|
27,88
|
4,27
|
–
|
–
|
|
Расход
|
|
С6Н10О
|
0,216
|
-198
|
296
|
–
|
3,08
|
565
|
300
|
–
|
|
Н2О
|
0,216
|
-241,81
|
188,72
|
33,61
|
30,00
|
10,71
|
–
|
0,33
|
|
С6Н12О
|
0,004
|
-294,97
|
–
|
244,2
|
-13,26
|
721,9
|
-408,9
|
–
|
|
С6Н12
|
0,04
|
-123,1
|
298,2
|
106,3
|
51,72
|
598,8
|
-230,0
|
–
|
|
О2
|
0,302
|
0
|
205,04
|
29,37
|
31,46
|
3,39
|
–
|
-3,77
|
|
С6Н6
|
0,028
|
49,04
|
173,2
|
136,1
|
59,5
|
255,02
|
–
|
–
|
|
N2
|
2,236
|
0
|
191,489
|
29,12
|
27,88
|
4,27
|
–
|
–
|
3.1 Рассчитаем приходную часть
теплового баланса
Определим
количество тепла, поступающее в реактор с исходными реагентами:
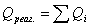
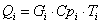
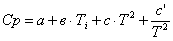

где Срi – изобарные теплоемкости исходных реагентов;
Gi – мольный поток i-того реагента;
Тi – температура исходных реагентов;
а) рассчитаем для циклогексана:
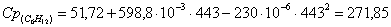
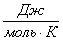
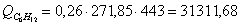

б) рассчитаем для кислорода:
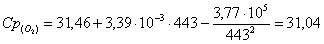
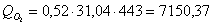

в) рассчитаем для бензола:
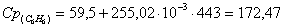
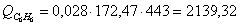

г) рассчитаем для азота:
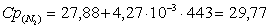
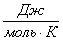
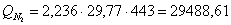

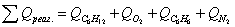
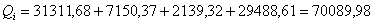
 .
.
Определим количество
тепла, которое выделяется или поглощается в результате химической реакции:
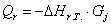
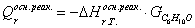
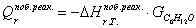
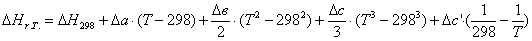
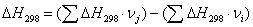
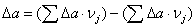
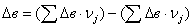
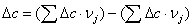
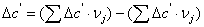
а) для основной реакции:
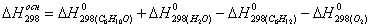
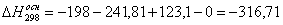
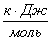
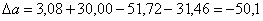
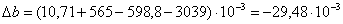
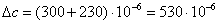
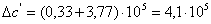
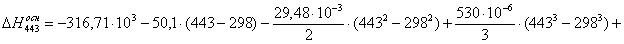
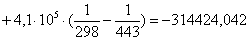
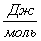
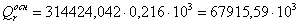
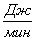 или 67915,59
или 67915,59
б) для побочной реакции:
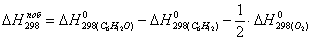
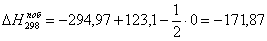
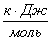
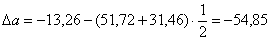
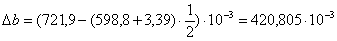
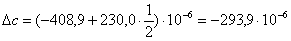
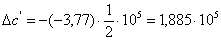
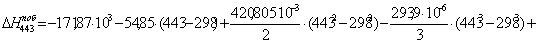
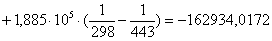
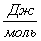
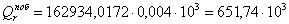
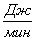 или 651,74
или 651,74
Так
как тепло поглощается во всех реакциях (основной и побочной), получаем:
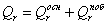 ;
; 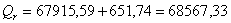

Так как 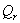 >0, то реакция экзотермическая и
данное значение ставим в приход теплового баланса.
>0, то реакция экзотермическая и
данное значение ставим в приход теплового баланса.
3.2 Рассчитаем расходную часть
теплового баланса
Определим
количество тепла, которое выходит из реактора с продуктами реакции:
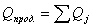 ;
;
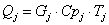 ;
;
где Срj – изобарные теплоемкости исходных реагентов;
Gj – мольный поток j-того реагента;
Тj – температура исходных реагентов.
а) рассчитаем для циклогексанона:
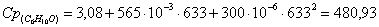
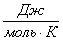
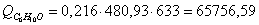

б) рассчитаем для воды:
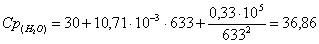
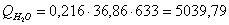

в) рассчитаем для циклогексанола:
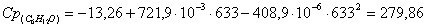
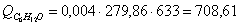

г) рассчитаем для непрореагировавшего
циклогексана:
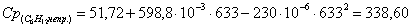
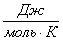
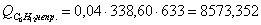

д) рассчитаем для непрореагировавшего
кислорода:
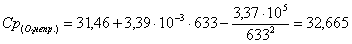
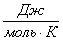
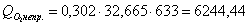

е) рассчитаем для бензола:
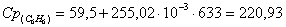
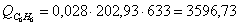

ж) рассчитаем для азота:
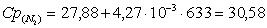
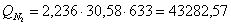

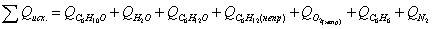
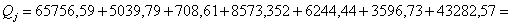
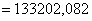

Определим количество
тепла, расходуемое на нагревание исходных реагентов до температуры химической реакции:
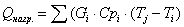 ;
;
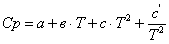
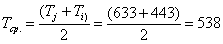
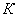
а) рассчитаем для циклогексана:
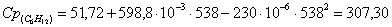
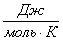
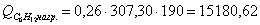

б) рассчитаем для кислорода:
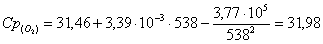
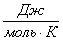
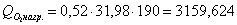

в) рассчитаем для бензола:
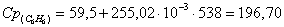
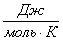
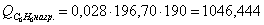

г) рассчитаем для азота:
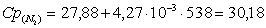
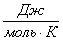

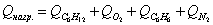
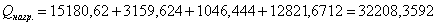
 .
.
Определим тепловые потери
в ходе реакции:
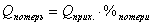
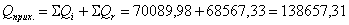

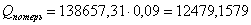
 .
.
Определим тепловую
нагрузку на реактор:
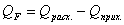
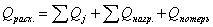
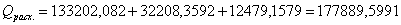

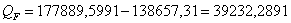

Так как QF > 0, тепло надо нужно подводить,
это значение ставиться в приход теплового баланса.
Полученные данные сводим
в таблицу теплового баланса:
Таблица
6. Тепловой баланс
|
Приход
|
Расход
|
|
Тепловой поток
|

|
%
|
Тепловой поток
|

|
%
|
|
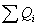
|
70089,98
|
39,40
|
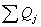
|
133202,082
|
74,88
|
|
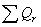
|
68567,33
|
22,05
|
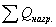
|
32208,3592
|
18,10
|
|
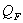
|
39232,2891
|
38,55
|
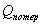
|
12479,1579
|
7,02
|
|
Итого:
|
100
|
Итого:
|
177889,5991
|
100
|
Определим поверхность
теплообмена:
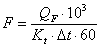
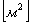
Вывод: Таким образом, в результате
проведенного расчета теплового баланса установили что данная реакция экзотермическая
(т.к. 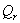 >0) идет с выделением тепла. Для
поддержания заданной температуры тепло необходимо подводить в количестве QF=39232,2891
>0) идет с выделением тепла. Для
поддержания заданной температуры тепло необходимо подводить в количестве QF=39232,2891  .
Процент подводимого тепла невысокий, значит мы можем предположить что
температура для данного процесса выбрана оптимальная.
.
Процент подводимого тепла невысокий, значит мы можем предположить что
температура для данного процесса выбрана оптимальная.
Проведя расчеты теплового
баланса также мы определили количество тепла, расходуемое на нагревание
исходных реагентов до температуры реакции 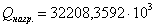
 ; количество тепла на входе в реактор
; количество тепла на входе в реактор 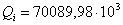
 ;
количество тепла на выходе из реактора
;
количество тепла на выходе из реактора 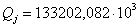
 ; тепловые потери
; тепловые потери 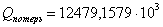
 ;
поверхность теплообмена
;
поверхность теплообмена 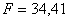
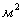 .
.
IV. Термодинамический анализ основной реакции
При проектировании
технологических процессов важное место занимают термодинамические расчеты
химических реакций.
Цель термодинамического
анализа заключается в определении принципиальной возможности проведения
химической реакции в данных условиях, в выборе условий проведения процесса.
Задание: Для основной реакции необходимо рассчитать константу
равновесия по термодинамическим данным (тепловой эффект реакции, изменение
энтропии, свободную энергию Гиббса (изобарно-изотермический потенциал)).
Дано:
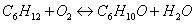
Таблица 7. Термодинамические
свойства веществ – участников реакции
|
Вещество
|
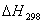
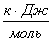
|
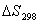
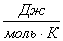
|
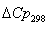
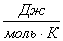
|
Ср = f(Т)
|
|
а
|
в*103
|
c*106
|
c’*10-5
|
|
С6Н12
|
-123,1
|
298,2
|
106,3
|
51,72
|
598,8
|
-230,0
|
–
|
|
О2
|
0
|
205,04
|
29,37
|
31,46
|
3,39
|
–
|
-3,77
|
|
С6Н10О
|
-198
|
296
|
–
|
3,08
|
565
|
300
|
–
|
|
Н2О
|
-241,81
|
188,72
|
33,61
|
30,00
|
10,71
|
–
|
0,33
|
Таблица 8. Данные термодинамического
расчета
|
Т, ºС
|
40
|
90
|
140
|
190
|
240
|
290
|
340
|
390
|
440
|
490
|
540
|
|
К
|
313
|
363
|
413
|
463
|
513
|
563
|
613
|
663
|
713
|
763
|
813
|
Рассчитаем
тепловой эффект реакции при атмосферном давлении в заданном температурном
интервале.
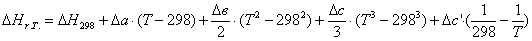
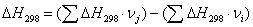
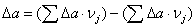
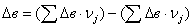
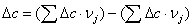
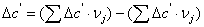
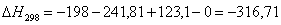
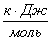
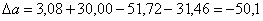
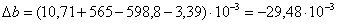
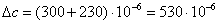
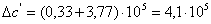
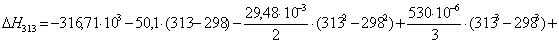
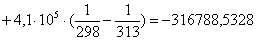
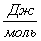
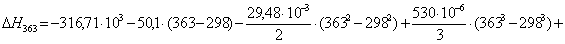
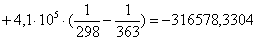
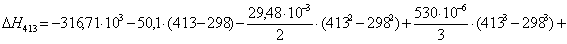
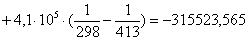
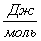
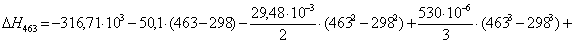
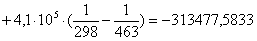
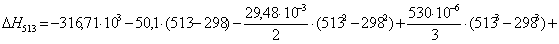
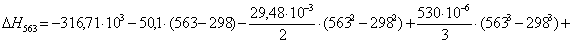
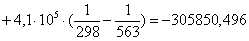
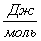
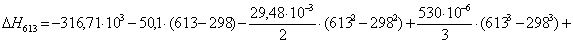
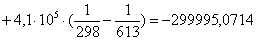
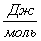
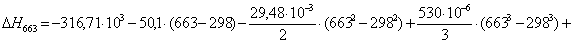
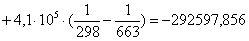
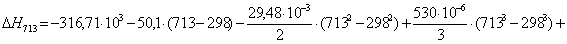
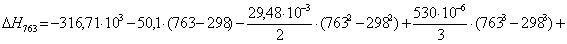
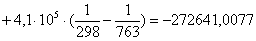
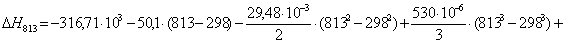
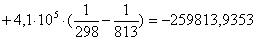
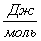
Рассчитаем изменение
энтропии при атмосферном давлении в заданном температурном интервале:
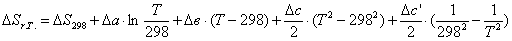
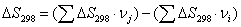
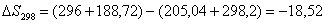
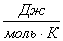
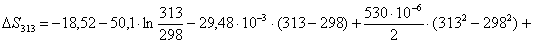
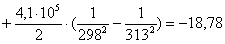
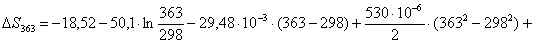
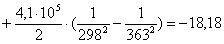
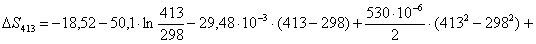
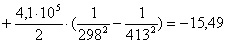
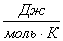
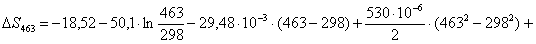
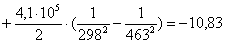
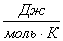
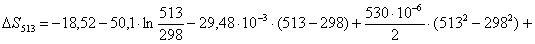
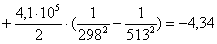
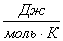
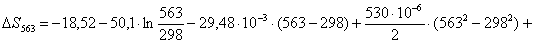
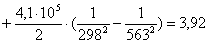
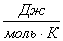
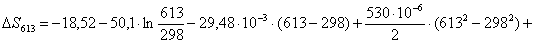
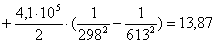
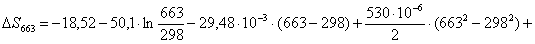
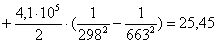
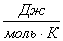
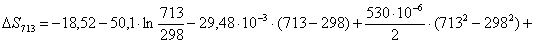
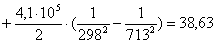
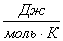
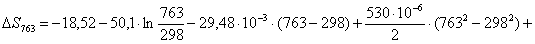
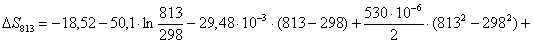
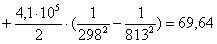
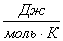
Рассчитаем изменение
изобарно-изотермического потенциала (энергии Гиббса) в заданном температурном
интервале:
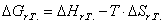
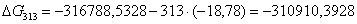
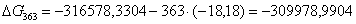
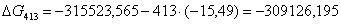
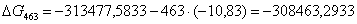
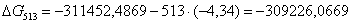
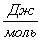
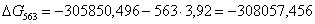
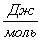
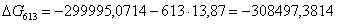
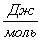
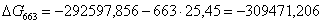
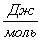
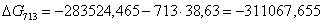
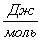
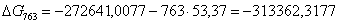
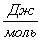
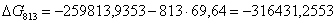
Рассчитаем логарифм
константы равновесия в заданном температурном интервале используя уравнение
изотермы Вант-Гоффа:
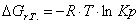
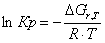
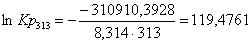
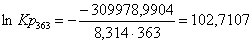
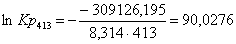
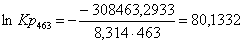
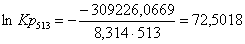
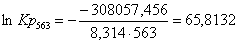
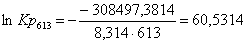
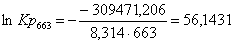
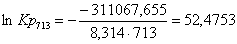
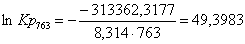
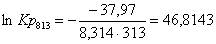
Рассчитаем константы
равновесия в заданном температурном интервале:
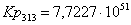
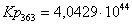
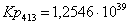
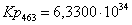
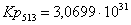
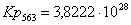
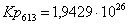
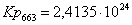
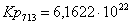
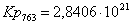
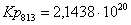
Полученные данные сведем
в таблицу:
Таблица 9. Зависимость термодинамических
функций от температуры
|
Т,
К
|
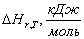
|
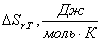
|
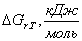
|
ln Kp
|
Кр
|
|
313
|
-316788,5328
|
-18,78
|
-310910,3928
|
119,4761
|
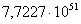
|
|
363
|
-316578,3304
|
-18,18
|
-309978,9904
|
102,7107
|
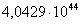
|
|
413
|
-315523,5650
|
-15,49
|
-309126,1950
|
90,0276
|
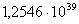
|
|
463
|
-313477,5833
|
-10,83
|
-308463,2933
|
80,1332
|
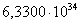
|
|
513
|
-311452,4869
|
-4,34
|
-309226,0669
|
72,5018
|
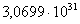
|
|
563
|
-305850,4960
|
3,92
|
-308057,4560
|
65,8132
|
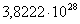
|
|
613
|
-299995,0714
|
13,87
|
-308497,3814
|
60,5314
|
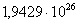
|
|
663
|
-292597,8560
|
25,45
|
-309471,2060
|
56,1431
|
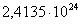
|
|
713
|
-283524,4650
|
38,63
|
-311067,6550
|
52,4753
|
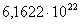
|
|
763
|
-272641,0077
|
53,37
|
-313362,3177
|
49,3983
|
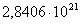
|
|
813
|
-259813,9353
|
69,64
|
-316431,2553
|
46,8143
|
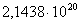
|
4.7.
На основании полученных данных построим графики:
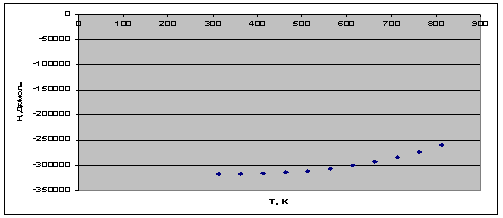
Рис. 1. Зависимость теплового эффекта реакции от температуры.
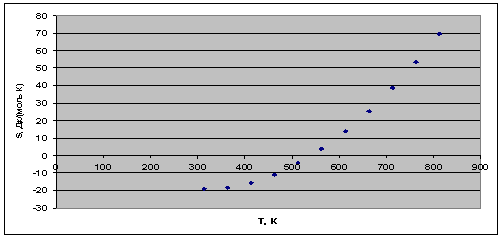
Рис. 2. Зависимость энтропии реакции
от температуры.
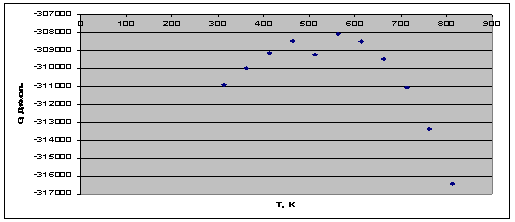
Рис. 3. Зависимость энергии Гиббса от температуры.
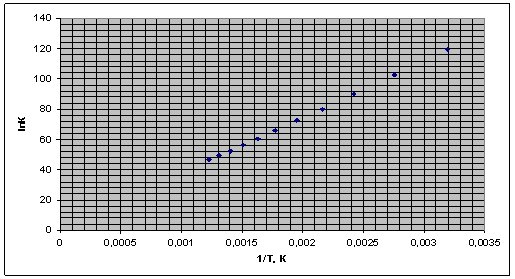
Рис. 4. Зависимость логарифма константы равновесия от
обратной температуры.
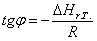
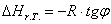
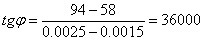
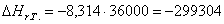
613 – -299995,0714
х– -299304
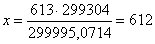 К
К
Выводы: Рассчитав термодинамические величины,
получили:
1) Реакция является
экзотермической на всем температурном интервале, т.к. 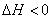 .
.
2) Для проведения
процесса оптимальной считается температура 3390С (612 К).
3) С
увеличением температуры изменение энтропии в ходе процесса увеличивается.
4) На
всем температурном интервале 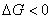 , следовательно,
реакция идет самопроизвольно.
, следовательно,
реакция идет самопроизвольно.
5) Кр>>1,
следовательно, реакция смещена в прямом направлении (в сторону образования
продуктов), т.к. Кр больше 1020 реакция является необратимой.
V. Расчет константы равновесия
и равновесного состава реагирующих веществ
Для количественной оценки
интенсивности работы различных аппаратов и для технологического расчета
производственных процессов используют константу скорости процесса.
Скорость процесса
определяет производительность аппарата.
Константа скорости
химической реакции представляет собой сложную величину, которая зависит не
только от химических свойств реагирующих веществ, но и от их физических
характеристик, конструкции аппарата, гидродинамических условий проведения
процесса, диффузии реагирующих веществ и продуктов реакции.
Задание: По основной реакции и вычисленной
константе равновесия в заданном температурном интервале рассчитать равновесный
состав реакционной массы.
Дано:
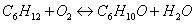
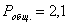
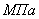
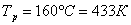
Рассчитаем константы
равновесия в заданном температурном интервале используя уравнение изотермы
Вант-Гоффа:
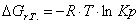
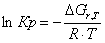
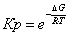
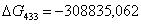
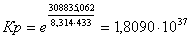
Выразим константы
уравнения через парциальные давления:
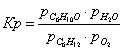
Выразим парциальные
давления веществ, участвующих в реакции, через мольные дли вещества:
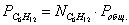
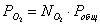
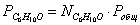
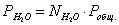
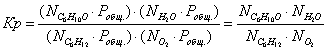
Чтобы найти мольные доли
веществ составим таблицу молей веществ в состоянии равновесия:
Таблица 10. Мольные доли веществ в
состоянии равновесия
|
|
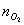
|
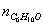
|
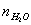
|
|
Исходная смесь
|
0,26
|
0,52
|
–
|
–
|
|
Образовалось
|
–
|
–
|
х
|
х
|
|
Израсходовалось
|
х
|
х
|
–
|
–
|
|
Осталось в состоянии равновесия
|
0,26-х
|
0,52-х
|
х
|
х
|
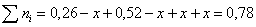
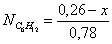
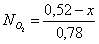
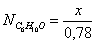
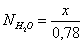
Полученные значения
мольных долей подставляем в уравнение константы равновесия:
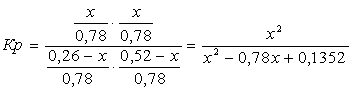
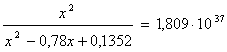
х=0,26
Отсюда находим значение
мольных долей:
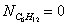
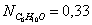
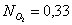
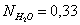
Вывод: Таким образом, в ходе проведенных
расчетов установили, что в момент равновесия мольная доля вещества составляет 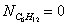 (т.е. циклогексан полностью
израсходовался),
(т.е. циклогексан полностью
израсходовался), 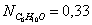 ,
, 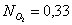 ,
, 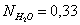 . Из этих данных видно, что равновесие
смешено в сторону прямой реакции, и практически полностью израсходованы
вещества.
. Из этих данных видно, что равновесие
смешено в сторону прямой реакции, и практически полностью израсходованы
вещества.
VI. Эмпирический расчет теплот сгорания
и образования веществ
Задание: Данный пункт рассчитываем для веществ участников
основной реакции. Из данных материального баланса выбрать три органических
вещества и рассчитать теплоты сгорания по Коновалову и Карашу и определить
наиболее точный метод расчета для конкретного вещества. Для этих же веществ
рассчитать теплоты образования по энергиям связи. Дано:
Основная реакция
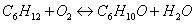
Побочная реакция
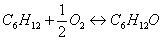
6.1 Определим теплоты сгорания
веществ находящихся в газообразном состоянии по уравнению Коновалова
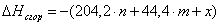
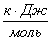
а) для С6Н12
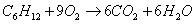
n=18
m=6
x=0 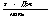
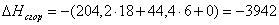
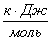 или
или 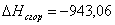
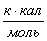
б) для С6Н10О
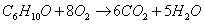
n=16
m=5
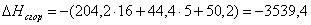
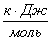 или
или 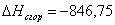
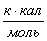
в) для С6Н12О
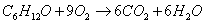
n=18
m=6
x=50,2 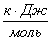
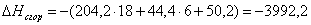
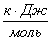 или
или 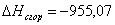
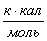
г) для С6Н6
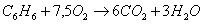
n=15
m=3
x=100,41 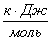
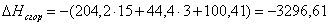
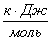 или
или 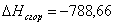
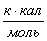
Результаты расчетов сводим в таблицу:
Таблица 11. Результаты расчета теплот
сгорания по Коновалову
|
Вещество
|
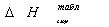
|
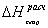
|

|
|
С6Н12
|
-944,79
|
-943,06
|
0,2
|
|
С6Н10О
|
|
-846,75
|
|
|
С6Н12О
|
-890,70
|
-955,07
|
7
|
|
С6Н6
|
-789,08
|
-788,66
|
0,05
|
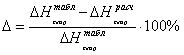
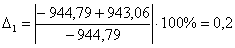
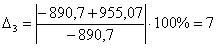
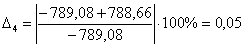
6.2 Определим теплоты сгорания
веществ находящихся в жидком состоянии по уравнению Караша
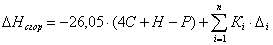
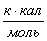
а) для С6Н12
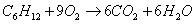
С=6
Н=12
Р=0
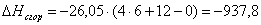
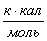
б) для С6Н10О
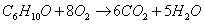
С=6
Н=10
Р=1
 = –
6,5
= –
6,5
в) для С6Н12О
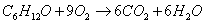
С=6
Н=12
Р=1
 = – 13
= – 13
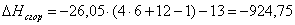
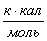
г) для С6Н6
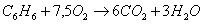
С=6
Н=6
Р=0
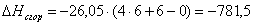
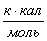
Результаты расчетов сводим в таблицу:
Таблица 12. Результаты расчета теплот
сгорания по Карашу
|
Вещество
|
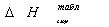
|
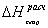
|

|
|
С6Н12
|
-944,79
|
-937,80
|
0,7
|
|
С6Н10О
|
|
-866,15
|
|
|
С6Н12О
|
-890,70
|
-924,75
|
3,8
|
|
С6Н6
|
-789,08
|
-781,50
|
0,9
|
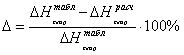
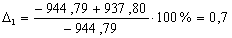
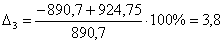
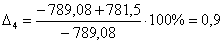
6.3 Определение теплоты образования
веществ при стандартных условиях в газообразном состоянии по энергиям связи
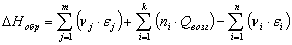
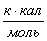
Qвоз (С)=125 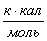
а) для С6Н12
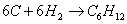
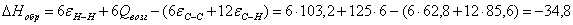
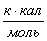
б) для С6Н10О
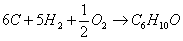
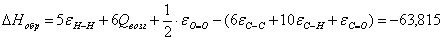
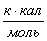
в) для С6Н12О
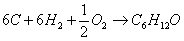
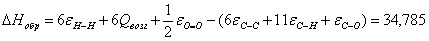
г) для С6Н6
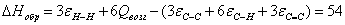
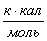
Результаты расчетов сводим в таблицу:
Таблица 13. Результаты
расчета теплот образования по энергиям связи
|
Вещество
|
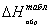
|
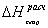
|

|
|
С6Н12
|
-29,43
|
-34,8
|
18
|
|
С6Н10О
|
|
-63,815
|
|
|
С6Н12О
|
-83,45
|
34,785
|
141
|
|
С6Н6
|
-19,82
|
54
|
172
|
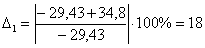
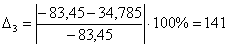
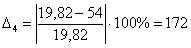
Вывод: Таким образом, в ходе проведенных
расчетов установили что из проведенных методов более точным методом расчета
теплот сгорания является определение теплот сгорания веществ находящихся в газообразном
состоянии по уравнению Коновалова.
Так как в данном методе
для молекул имеющих несколько связей одного и того же типов все связи считать
равнозначными, и определенные таким образом величины энергии связи представляют
собой некоторые средние значения и не соответствуют величинам энергий, которые
необходимо затратить на то чтобы оторвать от молекулы данный атом.
VII. Кинетически расчет
Кинетическими уравнениями
обычно называют уравнения, выражающие зависимость скорости реакции от различных
макроскопических параметров системы. Кинетические уравнения реакций, протекающих
в изобарно-изотермических условиях, содержат лишь концентрации компонентов
системы и некоторые константы – константы скорости и порядки реакции
относительно отдельных компонентов системы.
Для элементарных реакций
порядок обычно совпадает с молекулярностью. Молекулярность реакции равна числу
молекул соответствующего исходного компонента, участвующему в элементарном акте
химического взаимодействия.
Упорядоченная
совокупность элементарных актов химической и физической природы некоторой
химической реакции составляет механизм химической реакции, или кинетическую
модель процесса. Исследование механизма химических реакций в существенной мере
основано на детальном исследовании кинетики реакций.
Задание: Определить порядок реакции
аналитическим и графическим методами, величину энергии активации
графически-аналитическим методом и составить полное кинетическое уравнение.
Дано:
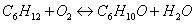
Таблица 15. Исходные данные
|
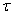
|
0
|
0,52
|
1,10
|
1,73
|
2,44
|
3,24
|
4,16
|
5,23
|
6,52
|
8,16
|
|
СА,0
|
0,1
|
0,091
|
0,083
|
0,075
|
0,067
|
0,059
|
0,051
|
0,043
|
0,035
|
0,027
|
Таблица 16. Исходные данные
|
Температура, К
|
713
|
753
|
793
|
833
|
|
Константа, с-1
|
3,17.10-2
|
6,73.10-2
|
0,132
|
0,243
|
7.1 Определении порядка реакции и
энергии активации
Порядок реакции, определяемый
аналитическим методом.
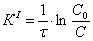
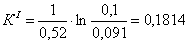
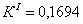
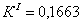
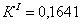
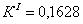
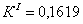
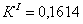
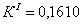
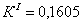
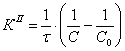
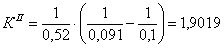
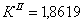
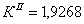
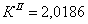
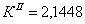
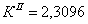
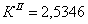
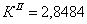
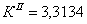
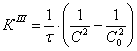
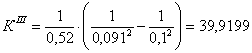
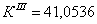
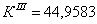
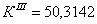
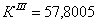
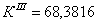
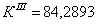
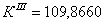
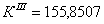
По полученным данным делаем вывод,
что реакция первого порядка
Порядок реакции,
определяемый графическим методом. Построим графическую зависимость С=f (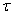 ):
):
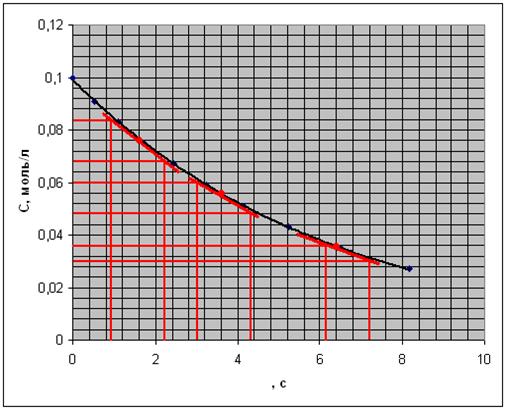
Рис. 5. Зависимость концентрации от
времени.
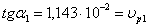
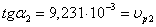
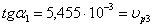
Построим график зависимости ln(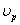 )=f(lnC)
)=f(lnC)
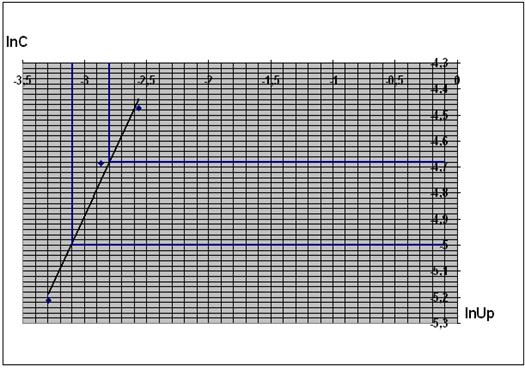
Рис. 6. Зависимость
логарифма концентрации от логарифма скорости реакции.
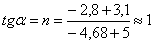
7.2 Определение энергии активации
графически-аналитическим методом
Определение энергии активации
аналитическим методом.
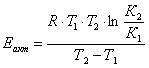
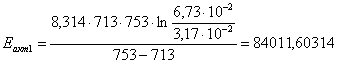
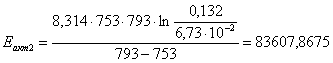
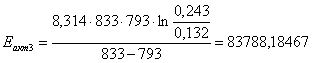
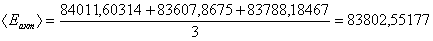
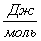
Определение энергии активации
графическим методом.
Таблица 17. Исходные данные
|
lnК
|
-3,4514
|
-2,6986
|
-2,0249
|
-1,4147
|
|
1/Т
|
1,4025.10-3
|
1,3280.10-3
|
1,2610.10-3
|
1,2005.10-3
|
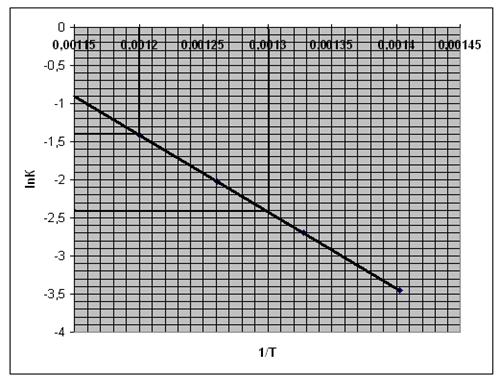
Рис. 7. Зависимость логарифма концентрации от обратной температуры.
По графику определяем
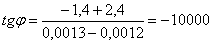 lnА0=0,9 А0=-0,11
lnА0=0,9 А0=-0,11
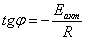
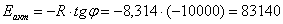
Определим погрешность:
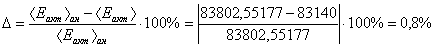
Запишем кинетическую модель для
данной реакции:
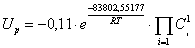
Вывод: В результате проведенных
аналитических и графических расчетов установили что реакция первого порядка.
Порядок совпадает с молекулярностью. Еакт= 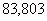
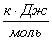 .Данной
реакции соответствует следующая кинетическая модель:
.Данной
реакции соответствует следующая кинетическая модель:
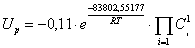
VIII. Расчет основного аппарата
Задачу кинетического
расчета составляет либо расчет времени реакции или объема реактора, выходных
параметров потока реактантов. Для кинетического расчета необходимо знать:
1) кинетическое уравнение реакции в
интегральной и дифференциальной форме для заданной температуры;
2) тип реактора, в котором
предполагается осуществить реакцию.
Общие решения указанных
задач возможно проводить для реакторов РИС-Н, РИВ, К-РИС-Н.
Выбор типа реактора для
проведения той или иной реакции влияет на ее интенсивность и селективность. При
выборе оптимального типа реактора необходимо учитывать все кинетические
особенности и механизм реакции, факторы теплопередачи, затраты материалов и
т.д.
8.1 Сравнительный расчет идеальных
реакторов различного типа
Задание: Использую проектное уравнение
рассчитать и сравнить объемы РИС-Н и РИВ. Определить интенсивность реакторов.
При заданном числе реакторов одинакового объема, используя графический метод
рассчитать объем реактора РИС-Н при последовательном соединении (каскад
реакторов), а также их общий объем.
Сравнить объемы РИВ,
РИС-Н и К-РИС-Н и сделать вывод об их интенсивности.
Дано:
Таблица 18. Исходные данные
|
1
|
Объемный расход реагента А
|
GV,A0 м3/час
|
4,2
|
|
2
|
Объемный расход реагента В
|
GV,В0 м3/час
|
2,8
|
|
3
|
Степень превращения
|
ХА
|
0,7
|
|
4
|
Молярное соотношение реагентов
|
А:В
|
1:1,1
|
|
5
|
Начальная концентрация реагента А в исходном потоке
|
СA,0 моль/л
|
2,5
|
|
6
|
Константа скорости
|
К мин-1
|
4,2
|
|
7
|
Число реакторов в каскаде
|
m
|
3
|
|
8
|
Уравнение скорости
|
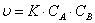
|
Рассчитаем объем РИС-Н
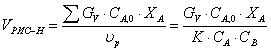
А:В=1:1,1 => СВ=1,1.
СА
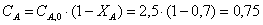
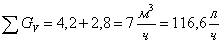
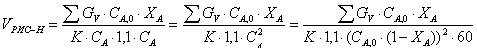
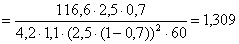 л
л
8.1.2. Рассчитаем объем РИВ
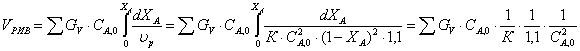
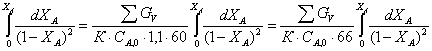
Сделаем замену:
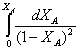
1–ХА=t
-dXA=dt 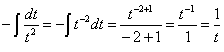 =>
=>
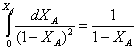
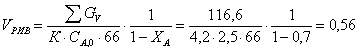 л
л
Рассчитаем объем К-РИС-Н
ХА=0,7 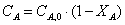
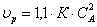
ХА1=0,1 СА1=2,25 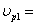 23,4
23,4
ХА2=0,2 СА2=2 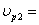 18,5
18,5
ХА3=0,3 СА3=1,75 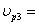 14,1
14,1
ХА4=0,4 СА4=1,5 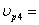 10,4
10,4
ХА5=0,5 СА5=1,25 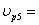 7,2
7,2
ХА6=0,6 СА6=1 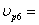 4,6
4,6
ХА7=0,7 СА6=0,75 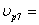 2,6
2,6
Строим графическую зависимость 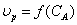
При m=3 получим:
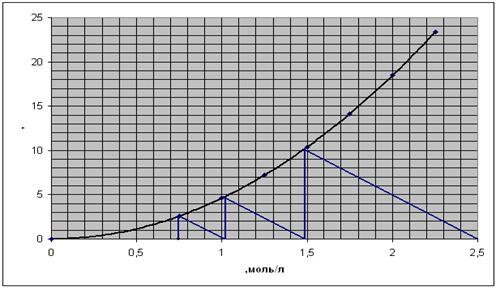
Рис. 8. Зависимость скорости реакции
от концентрации.
По графику найдем среднее
время пребывания реагентов в первом реакторе:
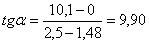
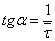
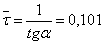 минут или 6,06 секунд
минут или 6,06 секунд
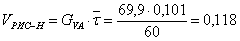 л
л
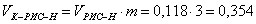 л
л
Рассчитаем интенсивность этих
реакторов для их сравнения
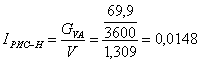 сек-1
сек-1
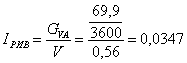 сек-1
сек-1
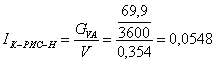 сек-1
сек-1
Вывод: Таким образом в ходе проведенных
расчетов установили что минимальный объем имеет реактор К-РИС-Н (0,354 литра).
Интенсивность реактора К-РИС-Н выше.
8.2 Расчет реальных реакторов с
учетом функции распределения времени пребывания
Задание: С учетом функции распределения
частиц по времени пребывания рассчитать среднюю конечную концентрацию СА
и среднюю степень превращения ХА.
Дано:
Таблица 19. Исходные данные
|
1
|
Константа скорости
|
К с-1
|
0,072
|
|
2
|
Порядок реакции
|
n
|
1
|
|
3
|
Изменение плотности реакционной смеси
|
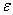
|
-0,1362
|
Таблица 20. Исходные данные
|
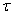 , с , с
|
8
|
22
|
29
|
36
|
43
|
50
|
57
|
64
|
72
|
78
|
85
|
92
|
99
|
106
|
|
Си
|
5
|
16
|
23
|
38
|
48
|
62
|
75
|
90
|
105
|
93
|
75
|
63
|
51
|
38
|
23
|
СА,0=0,105
Характеристическое
уравнение, определяющее концентрацию реагента в элементарном объеме в зависимости
от порядка реакции имеет вид для реакции первого порядка:
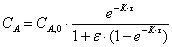
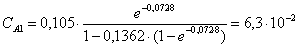
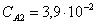
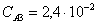
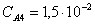
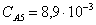
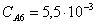
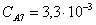
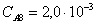
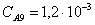
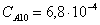
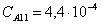
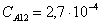
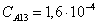
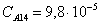
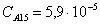
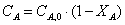
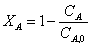
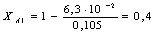
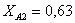
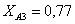
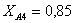
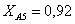
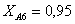
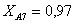
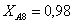
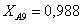
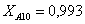
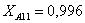
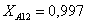
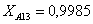
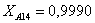
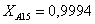
Рассчитаем среднюю степень превращения
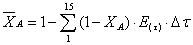
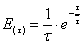
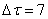
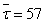
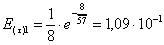
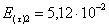
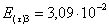
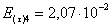
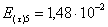
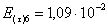
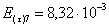
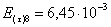
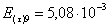
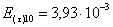
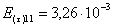
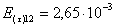
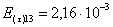
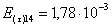
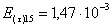
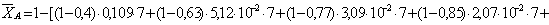
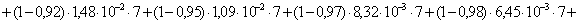
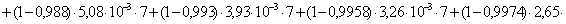
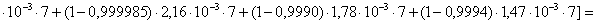
=1–0,67=0,33
Найдем конечную среднюю концентрацию:
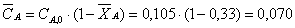
Вывод: Таким образом в ходе проведенных
расчетов установили что средняя степень превращения и средняя конечная
концентрация отличаются от мгновенных значений
8.3 Расчет в произвольной системе
реакторов идеального смешения и идеального вытеснения
Реакторы идеального смешения
периодического действия РИСП и РИВ относятся к интегральным реакторам, а РИС-Н
к дифференциальным.
В интегральных идет
непрерывное изменение параметров по длине реактора или по времени.
В дифференциальных
реакторах происходит скачкообразное изменение параметров по объему реактора, а
параметры по времени остаются постоянными.
Последовательное
соединение РИВ используется для повышения интенсивности процесса и повышения
производительности.
Эти расчеты можно
использовать для расчета размеров реакторов.
Параллельное соединение
РИВ используют для увеличения мощности производства. Важным условием
параллельной схемы является одинаковый состав реакционной массы в потоках.
Задание: Определить производительность по
продукту реакции при заданной схеме соединения реакторов РИС-Н, РИВ. Установить
какая из схем соединений является наиболее эффективной.
Дано:
Таблица 21. Исходные
данные
|
1
|
GА,0 кмоль/с
|
0,0012
|
|
2
|
Константа скорости К, с-1
|
0,0018
|
|
3
|
СА,0 кмоль/м3
|
2,3
|
|
4
|
СВ,0 кмоль/м3
|
1,5
|
|
5
|
V1РИВ, м3
|
2,5
|
|
6
|
V2РИС-Н, м3
|
4
|
|
7
|
Уравнение реакции
|
А+2В=С
|
Рассмотрим параллельную
схему соединения РИС-Н и РИВ
СА,1=СА,2=СА,n
Материальный баланс для
РИС-Н имеет вид:
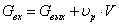
Это уравнение по реагенту
А запишется в виде:
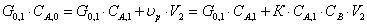
Текущая концентрация
реагента В с учетом стехиометрии равна:
СВ=СВ,0
– 2(СА,0 – СА,1)
Т.к. СА,1=СА
=>
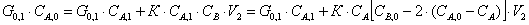
Выразим из полученного уравнения G0,1 через реагент А:
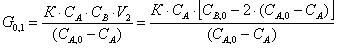
Т.к. время пребывания реагента А в
РИС-Н равно:
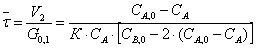
Время пребывания в РИВ рассчитываем
по уравнению:
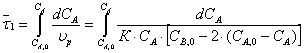
После интегрирования данного
уравнения получаем:
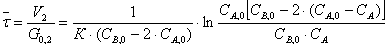
Выразим отсюда G0,2:
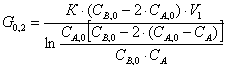
G1=G0,1+G0,2
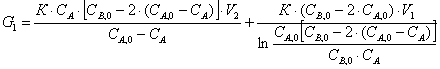 (1)
(1)
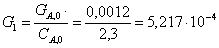
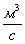
Подставим это значение в уравнение
(1) и выразим СА:
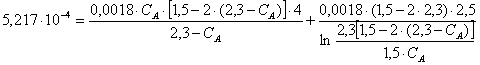
Отсюда СА=1,550000000001
или 1,55 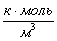
Производительность по
веществу С.
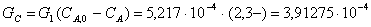
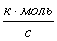
Рассмотрим последовательное
соединение РИС-Н и РИВ
Запишем уравнение материального
баланса для РИС-Н:
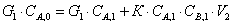
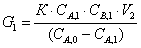
Так как СВ=СВ,0
– 2(СА,0 – СА,1)
где СА,1 – концентрация на
выходе из первого реактора.
Время пребывания в РИС-Н равно
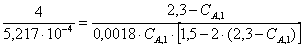
Найдем из этого выражения СА,1
СА,1=1,567 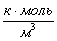
Время пребывания в РИВ рассчитываем
по уравнению:
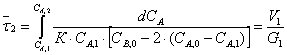
Проинтегрировав получим:
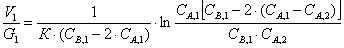
где СВ,1=СВ,0
– 2(СА,0 – СА,1)= 0,034 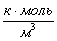
Отсюда находим СА,2= 1,5500000000001
или 1,55 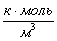
СВ,1=СВ,0 – 2(СА,0
– СА,1)=
0,034 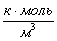
Производительность:
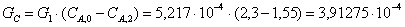
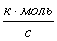
Вывод: при анализе различных схем соединения
реакторов видно что максимальная производительность при заданных условиях
получается при параллельном соединении РИВ и РИС-Н.
IХ. Технологическая схема синтеза и ее
описание
Рис. 9. Схема производства
циклогексанона:
1 – насос; 2 –
циркуляционная газодувка; 3 – фильтр; 4, 5 – подогреватели; 6 – испаритель; 7 –
перегреватель паров; 8 – контактный аппарат; 9 – топка; 10 – конденсатор; 11 –
гидравлический затвор; 12 – сепаратор; 13 – воздуходувка; Д.В. – дроссельный
вентиль.
Контактный аппарат для
производства циклогексанона:
1 – контактные трубки; 2
– корпус; 3 – футеровка; 4 – экранирующие перегородки; 5 – сальник; 6 –
термопара.
Циклогексанол-ректификат
(99,9%-ный) под обычным давлением азота 0,1-0,15 ат. нагревается через фильтр 3
в подогреватель 4 типа «труба в трубе», где нагревается до 100-1100
С. Далее в испарительно-перегревательной системе, состоящей из трубчатых
аппаратов 5, 6, 7, происходит испарение циклогексанола и перегрев его паров до
430-4500 С. Перегретые пары циклогексанола поступают в трубы
контактного аппарата 8, заполненные катализатором (Z-образные пластинки толщиной 0,2-0,4 мм). По выходе из
контактного аппарата продукты реакции поступают в конденсатор 10 и далее – в
сепаратор 12, где конденсат (циклогексанон-сырец) отделяется от водорода.
Циклогексанон-сырец имеет
примерно следующий состав (в %):
Циклогексанон 80-81
Продукты уплотнения 1-1,1
Циклогексанол 17-18 Вода 0,2-0,3
Циклогексен 0,5-0,6
Циклогексанон-сырец
подвергают ректификации, а водород очищают в угольном адсорбере (на схеме не
показан) от паров органических веществ и используют для гидрирования фенола в
циклогексанол.
Для обогрева контактной
системы в нижней части топки 9 сжигают газ (метан), при горении которого
развивается высокая температура.
Практически температура в
топке не превышает 1000-11000 С. Однако при такой температуре
возможен перегрев катализатора и разложение продуктов реакции. Поэтому в
верхней части топки топочные газы смешивают с газами, возвращаемыми из борова
печи, с таким расчетом, чтобы температура газа была выше 500-5500 С.
Газ, имеющий такую температуру, проходит в межтрубном пространстве контактного
аппарата прямотоком к парам циклогексанола, движущимся по трубкам с
катализатором. Противоток в данном случае недопустим, так как при этом наиболее
горячие топочные газы соприкасались бы с парами образовавшегося циклогексанона,
вызывая его разложение. Особенностью конструкции контактного аппарата (рис. 10)
является наличие в его межтрубном пространстве трех концентрических экранных перегородок,
благодаря которым достигается равномерный обогрев контактных трубок. Трубки
привариваются к трубным решеткам; благодаря установке в нижней части аппарата
специального сальникового устройства трубки при разогревании могут свободно
удлиняться. Чтобы предотвратить каталитическое действие железа, которое может
вызывать расщепление циклогексанола и усиленное сажеобразование, крышки и
контактные трубки изнутри покрывают медью.
Топочные газы, выходящие
из контактного аппарата при 430-4800 С, используются для обогрева
испарительно-перегревательной системы (аппараты 5, 6 и 7 рис. 9). Далее часть
топочных газов, имеющих температуру 340-3600 С, выпускают в
атмосферу, а остальной газ ротационной газодувкой 2 подают на смешение с
продуктами сгорания топливного газа в верхнюю часть топки 9.
При рассмотренном способе
обогрева контактной системы достигается повышенный тепловой коэффициент
полезного действия установки.
Выводы
1. Циклогексанон – бесцветная жидкость.
Является циклическим кетоном для которого характерны реакции присоединения.
Получают циклогексанон окислением циклогексана, дегидрировании циклогексанола,
из анилина через циклогексиламин. Но ввиду меньшего числа стадий и потребности
в дополнительных реагентах заслуживает предпочтение метод получения
циклогексанона окислением циклогексана.
2. Для получения 1 т циклогексанона
необходимо взять 857,14 кг циклогексана и 326,53 кг кислорода.
3. Данные материального баланса
(полученные в третьем пункте)
Таблица 2.
Теоретический материальный баланс
|
Приход
|
Расход
|
|
вещество
|
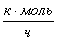
|
% мольн.
|
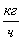
|
% масс.
|
вещество
|
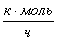
|
% мольн.
|
|
% масс.
|
|
С6Н12
|
10,20
|
50
|
856,8
|
72,4
|
С6Н10О
|
10,20
|
50
|
999,6
|
84,5
|
|
О2
|
10,20
|
50
|
326,4
|
27,6
|
Н2О
|
10,20
|
50
|
183,6
|
15,5
|
|
Итого:
|
20,40
|
100
|
1183,2
|
100
|
Итого:
|
20,40
|
100
|
1183,2
|
100
|
Таблица 3. Практический материальный
баланс
|
Приход
|
Расход
|
|
Вещество
|

|
%
мольн
|
|
%
массов.
|
Вещество
|

|
% мольн
|
|
% массов.
|
|
С6Н12
|
0,26
|
8,54
|
21,84
|
21,15
|
С6Н10О
|
0,216
|
7,10
|
21,17
|
20,50
|
|
О2
|
0,52
|
17,08
|
16,64
|
16,11
|
Н2О
|
0,216
|
7,10
|
3,89
|
3,77
|
|
С6Н6
|
0,028
|
0,92
|
2,184
|
2,12
|
С6Н12О
|
0,004
|
0,13
|
0,4
|
0,39
|
|
N2
|
2,236
|
73,46
|
62,60
|
60,62
|
С6Н12 непр.
|
0,04
|
1,31
|
3,36
|
3,25
|
|
|
|
|
|
О2 непр.
|
0,302
|
9,93
|
9,66
|
9,355
|
|
|
|
|
|
С6Н6
|
0,028
|
0,92
|
2,184
|
2,115
|
|
|
|
|
|
N2
|
2,24
|
73,51
|
62,60
|
60,62
|
|
Итого:
|
3,044
|
100
|
103,264
|
100
|
Итого:
|
3,042
|
100
|
103,264
|
100
|
Эти данные мы
использовали при составлении энергетического (теплового) баланса, при
термодинамических и кинетических расчетах, расчетах реакторов.
4. В ходе расчета теплового баланса мы
установили что реакция является экзотермическая (т.к. 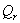 >0)
идет с выделением тепла. Для поддержания заданной температуры тепло необходимо
подводить.
>0)
идет с выделением тепла. Для поддержания заданной температуры тепло необходимо
подводить.
Таблица
6. Тепловой баланс
|
Приход
|
Расход
|
|
Тепловой поток
|

|
%
|
Тепловой поток
|

|
%
|
|
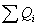
|
70089,98
|
39,40
|
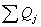
|
133202,082
|
74,88
|
|
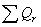
|
68567,33
|
22,05
|
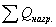
|
32208,3592
|
18,10
|
|
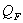
|
38,55
|
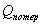
|
12479,1579
|
7,02
|
|
Итого:
|
177889,5991
|
100
|
Итого:
|
177889,5991
|
100
|
5. При термодинамическом анализе мы
выбрали условия проведения процесса, т.е. На всем температурном интервале
реакция является экзотермической (идет с выделение тепла). Реакция необратимая
и идет самопроизвольно.
6. В ходе расчета константы равновесия и
равновесного состава реагирующих веществ мы установили, что вещества
практически полностью израсходованы в процессе данной реакции.
7. В ходе расчет теплот сгорания и
образования мы установили, что вещества участвующие и образующиеся в ходе
данной реакции находятся в газообразном состоянии.
8. В ходе кинетических расчетов мы
установили, что реакция получения циклогексанона является первого порядка и
совпадает с молекулярностью. Кинетическая модель имеет вид:
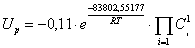
9. В ходе расчетов основного аппарата мы
выбрали каскад реакторов идеального смешения непрерывного действия, состоящий
из трех реакторов, с объемом равным 0,354 литров и интенсивностью 0,0548 сек-1.
10. В ходе данной работы была рассмотрена технологическая
схема получения циклогексанона из циклогексанола окислением. Выход при этом
циклогексанона составляет 80-81 %.
Список литературы
1. Бутов Г.М., Красильников К.Ф., Корчагина Т.К., Попов Ю.В.,
Саад К.Р. Сборник задач к практическим занятиям по курсу «Основы инженерной
химии». Учебное пособие. – Волгоград.: 2000. – 94 с.
2. Жиряков В.Г. Органическая химия. 6-е изд., стереотипное.
М.: Химия, 1977. – 408 с.
3. Лебедев Н.Н., Монаков М.Н., Швец В.Ф. Теория химических
процессов основного органического и нефтехимического синтеза. М.: Химия, 1984.
– 372 с.
4. Лекции и практикум по «Общей химической технологии», 2006
г.
5. Потапов В.М., Татаринчик С.Н. Органическая химия: Учебник
для техникумов. – 3-е изд., перераб. – М.: Химия, 1980. – 464 с.