Тяжелые металлы в донных отложениях
СПИСОК
ИСПОЛНИТЕЛЕЙ
Руководитель темы к.т.н., Зам. генерального директора
ЗАО «ДАР/ВОДГЕО» Кузьмин В.В.
подпись, дата
Ответственный исполнитель _________________ к.т.н., ведущий научный
специалист ЗАО «ДАР/ВОДГЕО» Болдырев К.А.
РЕФЕРАТ
Отчет 281, 1 ч., 43 рисунка, 40 таблиц, 270 источников литературы.
Методология экспериментального и натурного изучения процессов аккумуляции
и выноса тяжелых металлов в донных отложениях водохранилищ и озер. (отчет по
первому этапу) по базовому проекту 12фцп-М5-04 «Создание методологии
экспериментального и натурного изучения процессов аккумуляции и выноса тяжелых
металлов в донных отложениях» 21-НИОКР/3-10-2012.
Объектом исследования являлись тяжелые металлы в донных отложениях
водохранилищ и озер.
Цель работы - разработка методологии экспериментального и натурного
изучения аккумуляции и выноса тяжелых металлов в донных отложениях водохранилищ
и озер (1 этап).
В процессе работы были детально исследованы особенности
гидрогеохимического и гидродинамического поведения тяжелых металлов в донных
отложениях водных объектов (водохранилищ и озер).
В результате исследования были выполнены:
· анализ зарубежных и российских норм, критериев и методик
оценки загрязненности донных отложений и даны предложения по разработке
отечественных норм;
· обзор имеющихся моделей прогноза массопереноса тяжелых
металлов во внутриводоемных процессах.
На основе результатов комплексного химического анализа компонентного
состава донных отложений выделены основные классы загрязняющих компонентов и их
гидрогеохимические особенности;
На основании обзора моделей определены основные факторы эмиссии тяжелых
металлов (параметры моделей), даны оценки зависимостей содержания тяжелых
металлов в донных отложениях и поровой воде от свойств водных объектов.
Рассмотрены принципы классификации и типизации донных отложений с
использованием комплексных показателей.
Приведены результаты экспериментальных исследований процессов аккумуляции
в донных отложениях и выноса из них тяжелых металлов.
Степень внедрения - выполненные исследования являются первым
(промежуточным) этапом и будут использованы в рамках базового проекта
12фцп-М5-04 «Создание методологии экспериментального и натурного изучения
процессов аккумуляции и выноса тяжелых металлов в донных отложениях»
21-НИОКР/3-10-2012.
Ключевые слова: донные отложения, загрязняющие вещества, тяжелые металлы,
осадки, озера, водохранилища, геохимическое моделирование, самоочищение
водоемов.
СОДЕРЖАНИЕ
СПИСОК ИСПОЛНИТЕЛЕЙ
РЕФЕРАТ
Термины и ОПРЕДЕЛЕНИЯ
ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
ВВЕДЕНИЕ
. АНАЛИЗ КОМПОНЕНТНОГО СОСТАВА И ВЫДЕЛЕНИЕ КЛАССОВ
ОСНОВНЫХ ЗАГРЯЗНЯЮЩИХ ВЕЩЕСТВ ДОННЫХ ОТЛОЖЕНИЙ
.1 ТЯЖЕЛЫЕ МЕТАЛЛЫ В ДОННЫХ ОТЛОЖЕНИЯХ ВОДОЕМОВ И
ВОДОТОКОВ
.2 КЛАССИФИКАЦИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ В СОСТАВЕ ДОННЫХ
ОТЛОЖЕНИЙ
. ГЕОХИМИЧЕСКОЕ МОДЕЛИРОВАНИЕ ПОВЕДЕНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ В
ВОДНЫХ СИСТЕМАХ
.1 ОПИСАНИЕ ОСНОВНЫХ ГЕОХИМИЧЕСКИХ ПРОЦЕССОВ В ВОДНОЙ ФАЗЕ
.1.1 Представление процессов растворения и осаждения в
гидрогеохимических моделях
.1.2 Учет термодинамической активности растворенных веществ в
гидрогеохимических моделях
.1.2 Процессы адсорбции и десорбции на неорганическом
веществе в гидрогеохимических моделях
.1.3 Учет комплексообразования тяжелых металлов на
органическом веществе в гидрогеохимических моделях
.1.4 Учет процессов ионного обмена в гидрогеохимических
моделях
.1.5 Учет окислительно-восстановительных процессов в
гидрогеохимических моделях
.1.6 Учет кинетики геохимических процессов
.2 ПРИМЕНЕНИЕ ГИДРОХИМИЧЕСКИХ МОДЕЛЕЙ В ЗАДАЧАХ ОЦЕНКИ
МИГРАЦИИ ТЯЖЕЛЫХ МЕТАЛЛОВ
. ОПИСАНИЕ ОСНОВ ФИЗИЧЕСКОГО ПЕРЕНОСА ТЯЖЕЛЫХ МЕТАЛЛОВ В
ДОННЫХ ОТЛОЖЕНИЯХ
.1 ПЕРЕНОС РАСТВОРЕННЫХ МЕТАЛЛОВ В ПРОТОЧНЫХ И НЕПРОТОЧНЫХ
ВОДОЕМАХ
.1.1 Движение водной массы как физическая основа
конвективного переноса тяжелых металлов. Уравнения движения водной массы
.1.2 Энергетические уравнения осредненного и пульсационного
движения водной массы
.1.3 Анализ обменных процессов в водном потоке и на его
границах для обоснования методики экспериментальных и натурных исследований
переноса тяжелых металлов
.2 УЧЕТ ГИДРОДИНАМИЧЕСКИХ ХАРАКТЕРИСТИК МЕЛКОДИСПЕРСНЫХ
ВЗВЕСЕЙ ТЕХНОГЕННОГО ПРОИСХОЖДЕНИЯ, СОДЕРЖАЩИХ ТЯЖЕЛЫЕ МЕТАЛЛЫ, ПРИ
КОНВЕКТИВНОМ ПЕРЕНОСЕ
.2.1 Факторы, определяющие скорость осаждения мелкодисперсных
частиц техногенного происхождения, содержащих тяжелые металлы
.2.2 Мелкодисперсные взвеси техногенного происхождения и их
роль в процессе загрязнения водных объектов и вторичном загрязнении воды
.2.3 Анализ динамических эффектов в зонах контакта жидкости с
твердыми частицами водонасыщенных донных отложений
.3 ПЕРЕНОС ТЯЖЁЛЫХ МЕТАЛЛОВ В СОСТАВЕ ВЗВЕШЕННЫХ ЧАСТИЦ В
ПРОТОЧНЫХ И НЕПРОТОЧНЫХ ВОДОЁМАХ
.3.1 Влияние сил сцепления между частицами мелкодисперсной
взвеси на хлопьеобразование и структурирование водного потока
.3.2 Модель осаждения мелкодисперсной взвеси, содержащей
тяжелые металлы, в условиях турбулентности
.3.3 Условия возникновения и разрушения придонного
стратифицированного слоя, содержащего тяжелые металлы
.3.4 Распределение частиц мелкой взвеси, содержащей тяжелые
металлы, в объеме движущейся водной массы
.4 РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ ПРОЦЕССОВ
АККУМУЛЯЦИИ ДОННЫХ ОТЛОЖЕНИЯХ И ВЫНОСА ИЗ НИХ ТЯЖЕЛЫХ МЕТАЛЛОВ
.4.1 Результаты экспериментальных исследований влияния
гранулометрического состава донных отложений на обменные процессы
.4.2 Диффузия соединений тяжелых металлов из загрязненных
донных отложений в воду
.4.3 Массообменный процесс при смешении притока примеси со
спутным водным потоком
. ОЦЕНКА ВЛИЯНИЯ ОСНОВНЫХ ФАКТОРОВ НА КОНЦЕНТРАЦИИ ТЯЖЕЛЫХ
МЕТАЛЛОВ В ПОРОВОЙ ВОДЕ ДОННЫХ ОТЛОЖЕНИЯХ И В ТВЕРДОЙ ФАЗЕ
.1 ВЛИЯНИЕ КИСЛОТНОСТИ НА КОНЦЕНТРАЦИИ РАЗЛИЧНЫХ ФОРМ
МЕТАЛЛОВ В ПОРОВОЙ ВОДЕ ДОННЫХ ОТЛОЖЕНИЙ
.2 ВЛИЯНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ УСЛОВИЙ НА
КОНЦЕНТРАЦИИ РАЗЛИЧНЫХ ФОРМ МЕТАЛЛОВ В ПОРОВОЙ ВОДЕ ДОННЫХ ОТЛОЖЕНИЙ
.3 ВЛИЯНИЕ ГРАНУЛОМЕТРИЧЕСКОГО СОСТАВА
.4 Влияние содержания общего азота
.5 Влияние содержания общего фосфора
.6 Влияние общего содержания серы
.7 Влияние содержания органических веществ
.8 Влияние общего солесодержания
АНАЛИЗ ЗАРУБЕЖНЫХ И РОССИЙСКИХ МЕТОДОВ ОЦЕНКИ ЗАГРЯЗНЕННОСТИ
ДОННЫХ ОТЛОЖЕНИЙ
.1 Оценка загрязненности водной среды
.2 Оценка загрязненности почв
5.3 Оценка загрязненности ДОННЫХ
ОТЛОЖЕНИЙ
ЗАКЛЮЧЕНИЕ
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Термины и ОПРЕДЕЛЕНИЯ
Водохранилище - искусственный водоём, образованный обычно в долине реки
водоподпорными сооружениями для регулирования ее стока и дальнейшего
использования в народном хозяйстве.
Озеро - природный водоём в углублениях суши (котловинах), заполненные в
пределах озёрной чаши (озёрного ложа) разнородными водными массами и не имеющие
одностороннего уклона.
Донные отложения - это донные наносы и твердые частицы, образовавшиеся и
осевшие на дно водного объекта в результате внутриводоемных физико-химических и
биохимических процессов, происходящих с веществами как естественного, так и
техногенного происхождения [ГОСТ 17.1.5.01.-80; ИСО 5667-1].
Поровая вода - вода, содержащаяся в равновесии с твердыми и
адсорбционными фазами донных отложений.
Тяжелые металлы - металлы, удельный вес которых больше 5 г/см3.
Ионный обмен - процесс, при котором ионы, ассоциированные на поверхности
твердого вещества, переходят в раствор, замещаясь на поверхности веществами,
переходящими из раствора.
Ёмкость катионного обмена - суммарная способность минералов удерживать
катионы, выраженная в мг-экв./100г породы.
ОБОЗНАЧЕНИЯ И
СОКРАЩЕНИЯ
ЕКО - Ёмкость катионного обмена почвогрунтов и донных
отложений
ДЭС - Двойной электрический слой - Ионная сила раствора
РОВ - Растворенное органическое вещество
ОВ - Органическое вещество
ПВ - Поровая вода донных отложений
ПВ-ДО - Система донные отложения - поровая вода
ВВ - Взвешенные вещества
ФК - Фульвиновые кислоты
ГК - Гуминовые кислоты
Еh - Окислительно-восстановительный потенциал среды, В
рН - Уровень кислотности среды
ВВЕДЕНИЕ
Оценка допустимого антропогенного воздействия в водных объектах
предполагает не только определение концентраций и формы нахождения токсичных
элементов в водной толще, но и содержание загрязняющих веществ в донных
отложениях поверхностных водоёмов.
Донные отложения, образующиеся в результате отложения и седиментации взвешенного
в воде неорганического и органического материала, играют значительную роль в
формировании химического состава поверхностных водоемов.
Особенностью донных отложений, как показателя состояния водного объекта,
является то, что они являются последним звеном поступления веществ в водоемы и
водотоки, в силу чего интегрируют геохимические особенности водосборных
площадей, техногенных сбросов и водных объектов.
Являясь сложной многокомпонентной системой, донные отложения в
зависимости от условий, сложившихся в водоеме, могут служить либо источником
поступления химических соединений из донных отложений в толщу воды, либо их
аккумулятором.
К числу приоритетных загрязняющих веществ донных отложений относятся
тяжелые металлы, отличающиеся максимальной аккумуляционной способностью и
высокой токсичностью.
Так, в отличие от органических загрязняющих веществ в той или иной
степени подверженных хемо-биодеградации, тяжелые металлы лишь
перераспределяются в различных элементах водного объекта, аккумулируясь в
различных компонентах экосистем, в том числе - в гидробионтах.
Несмотря на то, что в России предусмотрен контроль состава донных
отложений водных систем в рамках Единой Государственной системы мониторинга за
состоянием окружающей среды, он вряд ли может быть эффективным при отсутствии
четких критериев опасности содержания тяжелых металлов в составе донных
отложений.
При этом следует отметить недостаточную разработанность вопросов,
связанных с ролью донных отложений в процессах самоочищения/загрязнения водных
объектов.
В настоящее время формируются понятийный аппарат и модели, позволяющие
увязывать предельно допустимые нагрузки загрязняющих веществ донных отложений
на водные объекты, связанные с миграционной способностью тяжелых металлов в
зависимости от емкостных, сорбционных свойств донных отложений,
гидрохимическими свойствами водной среды и самих поллютантов.
Подвижность и изменчивость химического состава донных отложений и их
потенциальная опасность для водной экосистемы во многом определяется
распределением соединений химических элементов в гранулометрическом спектре
донных отложений, их минералогическим составом, окислительно-восстановительным
и кислотно-щелочным режимами водных объектов, содержанием элементов,
лимитирующих интенсивность биологических процессов.
Следует признать, что разработка методологии, позволяющей определить
критерии качества донных отложений по содержанию тяжелых металлов, которые
могли бы войти в единую систему нормативов для включения их в стратегию охраны
водных и биологических ресурсов в настоящее время находится на начальной стадии
исследований.
В мировой практике используются нормативы содержания тяжелых металлов в
донных отложениях с применением разных критериев: фоновые концентрации,
интервальные оценки (либо предельные уровни) соответствующего негативного
воздействия на гидробионтов, равновесное распределение загрязняющего вещества в
системе поровая вода-донные отложения.
В Российской Федерации подобные работы находятся в начальной стадии,
можно отметить лишь единичные попытки разработки экологических нормативов
содержания индивидуальных соединений в донных отложениях с использованием
геохимического и токсикологического подходов.
Разработка обоснованных критериев качества донных отложений по содержанию
в них тяжелых металлов требует наличия методологии экспериментального и
натурного изучения аккумуляции и выноса тяжелых металлов в донных отложениях.
Это, в свою очередь, приводит к необходимости рассмотрения поведения
тяжелых металлов в различных элементах водных объектов, их подвижности в
различных фазовых состояниях и формах, доступности и токсичности тяжелых
металлов.
При этом следует учитывать интенсивность и направленность
физико-химических и биологических процессов, происходящих на границах раздела
вода водоема - взвешенные вещества - донные отложения.
Целью данного этапа работы являлась разработка методологии
экспериментального и натурного изучения процессов аккумуляции и выноса тяжелых
металлов в донных отложений водохранилищ и озер.
Основными задачами исследований являлись.
. Анализ зарубежных и российских норм, критериев и методик оценки
загрязненности донных отложений;
. Обзор имеющихся моделей прогноза массопереноса (трансформации,
количественного содержания) тяжелых металлов во внутриводоемных процессах;
. Выделение основные классов загрязняющих компонентов на основе
результатов комплексного химического анализа компонентного состава наиболее
типичных донных отложений.
. Оценка влияния основных факторов - гранулометрического состава донных
отложений, содержания в них органических веществ, содержания общего азота,
фосфора, серы, растворенного кислорода, рН и Eh среды на концентрации различных
форм металлов в поровой воде донных отложений и в твердой фазе.
. Определение основных факторов эмиссии тяжелых металлов в зависимости от
геохимических, физико-химических и гидродинамических свойств водных объектов.
. Обзор экспериментальных исследований процессов аккумуляции в донных
отложениях и выноса из них тяжелых металлов.
. Разработка Методологии экспериментального и натурного изучения
процессов аккумуляции и выноса тяжелых металлов в донных отложениях
водохранилищ и озер.
В процессе исследований был выполнен анализ компонентного состава тяжелых
металлов в донных отложениях водоемов и водотоков с выделением основных классов
по их токсичности, биодоступности, подвижности и комплексу основных
биогеохимических показателей, выполнен обзор гидрогеохимических особенностей
тяжелых метталов в системе донные отложения - поровая вода - водный объект.
Были рассмотрены основные принципы геохимического моделирования поведения
тяжелых металлов в водных объектах, дано описание основных геохимических
процессов, включая процессы:
· растворения и осаждения;
· адсорбции и десорбции;
· комплексообразования тяжелых металлов на органическом
веществе;
· ионного обмена;
· окислительно-восстановительных процессов;
· кинетики
гидрогеохимических процессов.
На базе созданной гидрогеохимической модели конвективно-диффузионного
переноса рассмотрено применение метдодов гидрогеохимического моделирования в
задачах оценки миграции тяжелых металлов.
Выполнена оценка влияния основных факторов на концентрацию тяжелых
металлов в поровой воде донных отложений.
В число основных факторов были включены такие свойства водной среды и
донных отложений, как:
· кислотно-щелочные и окислительно-восстановительные условия
водных объектов;
· содержание
общего азота и фосфора;
· содержание
органических веществ;
· общего
содержания серы;
· общего
солесодержания;
· содержание
оксидов металлов;
· содержание
органических соединений;
· влияние гранулометрического
состава.
Учитывая, что значительная часть тяжелых металлов переносится в водных
объектах в виде взвешенных веществ, отдельная глава отчета была посвящена
описанию основ физического (гидродинамического переноса) тяжелых металлов.
При
этом были рассмотрены результаты экспериментальных исследований процессов
выноса тяжелых металлов из донных отложений, результаты экспериментальных
исследований влияния гранулометрического состава донных отложений на обменные
процессы, экспериментальные исследования диффузии соединений тяжелых металлов
из загрязненных донных отложений.
Был
выполнен анализ зарубежных и отечественных методов оценки загрязненности донных
отложений и рассмотрены основные существующие критерии их классификации по
содержанию тяжелых металлов.
Выполненные
исследования послужили основой для разработки Методологии экспериментального и
натурного изучения процессов аккумуляции и выноса тяжелых металлов в донных
отложениях водохранилищ и озер в рамках 1-го этапа исследований.
1.
АНАЛИЗ КОМПОНЕНТНОГО СОСТАВА И ВЫДЕЛЕНИЕ КЛАССОВ ОСНОВНЫХ ЗАГРЯЗНЯЮЩИХ ВЕЩЕСТВ
ДОННЫХ ОТЛОЖЕНИЙ
1.1 ТЯЖЕЛЫЕ
МЕТАЛЛЫ В ДОННЫХ ОТЛОЖЕНИЯХ ВОДОЕМОВ И ВОДОТОКОВ
Из всех классов неорганических соединений, поступающих в биосферу в
результате человеческой деятельности, наибольшее внимание привлекают тяжелые
металлы.
В их число, согласно решению Целевой группы по выбросам Европейской
экономической комиссии ООН, включены Pb, Cd, Hg, Ni, Со, Cr, Сu, Zn, Sb а также
As и Se (формально и Se и As - неметаллы).
Некоторые из перечисленных элементов необходимы живым организмам,
поскольку входят в состав простетических групп важных биомолекул.
Многие комплексы металлов с органическими лигандами близки по своим
характеристикам (геометрическому размеру, распределению зарядов в молекуле и
др.) к обычным субстратам (аминокислотам, гормонам, нейромедиаторам) и поэтому
могут связываться с соответствующими рецепторами. Например, образуемый
метилртутью и аминокислотой цистеином комплекс имитирует незаменимую
аминокислоту метионин, участвующую в синтезе адреналина и холина.
Другой важный механизм токсического действия заключается в замене
необходимых металлов в металлсодержащих комплексах, приводящей к потере
последними биологической активности.
Однако потребность в них невелика и поступление избыточных количеств
металлов в организмы приводит к тяжелой интоксикации.
Многие тяжёлые металлы (Hg, Cd, Pb) способны проявлять высокую
токсичность даже в следовых количествах. По общей чувствительности к ним живых
организмов металлы можно расположить в ряд: Hg > Сu > Zn > Ni > Pb
> Cd > Cr > Sn > Fe > Mn.
Поступление тяжелых металлов в окружающую среду происходит как в
результате естественных процессов (образование аномально обогащенного
элементами морского и вулканического аэрозоля, выветривание почв и горных пород
и т.п.), так и в результате антропогенных выбросов.
Степень экологического воздействия тяжелых металлов определяется, в
первую очередь, формами их нахождения.
После поступления в окружающую среду они подвергаются различным
превращениям с изменением валентности и растворимости. Например,
металлургические предприятия, тепло- и электростанции выбрасывают тяжелые
металлы преимущественно в нерастворимой форме, однако в ходе атмосферного
переноса происходит постепенное их выщелачивание из минеральной
(алюмосиликатной) матрицы аэрозольных частиц и переход в ионную,
водорастворимую форму.
Такая форма обусловлена присутствием в атмосфере сильных кислот и их
предшественников, постепенно накапливавшихся в водной фазе аэрозольных частиц.
Основными антропогенными источниками тяжелых металлов служат:
· различные топливные установки;
· автотранспорт;
· предприятия черной и цветной металлургии;
· горнодобывающие предприятия;
· гальванические производства.
В настоящий момент антропогенные потоки значительного ряда тяжелых
металлов превалируют над естественными источниками и составляют более 90%
общего поступления этих элементов в атмосферу.
Остановимся подробнее на поведении выбранного ряда индивидуальных тяжелых
металлов в водной экосистеме, характерной для донных отложений поверхностных
объектов.
ЖЕЛЕЗО
В поверхностной воде содержание растворенного Fe, как правило, невелико.
Основные особенности, определяющие распределение Fe:
· малая подвижность соединений Fe(III) и высокая для Fe (II),
а, следовательно, влияние на осаждение и миграцию ионов Fe
окислительно-восстановительных и щёлочно-кислотных реакций среды, при этом
наблюдается и транспорт Fe в виде коллоидов, взвесей, а так же в виде
сорбированных форм на природных коллоидах и взвесях;
· образование растворимых комплексов с органическими
комплексонами (главным образом для Fe (III)), что повышает его концентрацию в
водной фазе;
· восстановление соединений Fe (III) в восстановительной
обстановке до хорошо растворимых форм Fe (II) химическим или микробиологическим
путём, при этом Fe (II) в зависимости от величины
окислительно-восстановительного потенциала (Eh = 50ч250 мВ) хорошо мигрирует в
кислых водах и ограничено в околонейтральных и основных средах.
На рисунке 1.1 представлены основные формы Fe в восстановительной (Fe
(II)) и в окислительной обстановке (Fe (III)).
|
Fe (II)
|
Fe(III)
|
|
Ионы
|
|
Fe+2, FeOH+, Fe(OH)20,
FeCO3
|
Fe+3, FeOH+2, Fe(OH)2+,
Fe(OH)30
|
|
Минеральные фазы
|
|
Fe(OH)2(тв) FeS(тв) FeCO3
(тв)
|
FeOOH(тв) Fe(OH)3(ам)
Fe3O4(III, II) (тв) Fe2O3(тв)
|
Рисунок 1.1 Основные формы Fe в окислительной и восстановительной
обстановках
Оксигидроксидные фазы Fe растворяются со скоростями, сравнимыми с
карбонатами и слоистыми алюмосиликатами. Растворение оксигидроксидов Fe (III) в
присутствии микроорганизмов и ОВ наблюдается после исчерпания окислителей в
ряду O2 - NO3- - MnO2.
В водах озер и водохранилищ по сравнению с реками содержание
растворенного Fe значительно выше.
Концентрация его подвержена заметным сезонным колебаниям. Это обусловлено
воздействием комплекса физико-химических, биохимических и гидрологических
факторов, таких как рН, Еh воды, содержание растворенного кислорода, двуокиси
углерода, сероводорода, органических, в том числе гумусовых веществ, микрофлора
водоема, замедление стока, интенсивность грунтового питания и др.
Так, многолетние исследования Днепровских водохранилищ показали, что
максимальное количество Fераств., обнаруживается в них, как правило, в
зимне-весенний период.
Одним из наиболее характерных показателей, позволяющих получить
представление о формах существования Fe в этих водоемах, является соотношение
Fераств./Fевзв.
В зимне-весенний период оно составляет не менее 1,35-2,00, а летом и
осенью не превышает 0,4-0,5, т. е. в эти сезоны взвешенные формы Fe доминируют
над растворенными, следовательно, именно летом и осенью происходит активное
накопление Fe в донных отложениях.
Для вод озер и водохранилищ характерно также проявление вертикальной
стратификации в содержании Fe. Причина этого заключается в том, что в придонных
слоях воды озер и водохранилищ происходит интенсивное восстановление окисленных
форм Fe, причем процесс восстановления не является чисто химическим, так как
теснейшим образом связан с деятельностью донной микрофлоры в целом, создающей в
окружающей среде, особенно в иловых отложениях, пониженный
окислительно-восстановительный потенциал.
Механизм круговорота Fe в природных водах тесным образом связан с формами
его нахождения в иловых (поровых) водах донных отложений. Во многих работах
было показано, что Fe в них обнаруживается в основном (50-100%) в
закомплексованном состоянии, причем комплексы представлены, как правило,
высокомолекулярными соединениями.
Можно полагать, что в условиях природных вод связывание Fe в фульватные и
гуматные комплексы происходит, в основном, в процессе длительного
взаимодействия в донных отложениях и в иловых водах, когда формируется
структура гумусовых веществ и происходит их укрупнение.
В результате ионы Fe оказываются связанными в некоторые «замкнутые»
органические макроциклы, весьма устойчивые кинетически, и не диссоциирующие в
течение длительного времени.
МАРГАНЕЦ
В поверхностных водах средней полосы Российской Федерации концентрация
растворённого Mn составляет величину, как правило, до 0,05 мг/дм3, а в донных
отложениях - сотни миллиграммов в кг.. В поверхностных водах преобладает
свободный ион марганца Mn+2 c малыми долями (гидро)карбонатных, сульфатных и
хлоридных комплексов и в составе органических комплексных соединений (например,
гумино- и фульвиновокислых) или в виде высокодисперсной взвеси минеральных фаз,
коллоидов и суспензий. В условиях донных отложений Mn может образовывать
сульфидные минеральные фазы, а так же оксигидрокисдные фазы.
Основными источниками поступления его в поверхностные воды являются
железомарганцевые руды и некоторые другие минералы, содержащие Mn, сточные воды
марганцевых обогатительных фабрик, металлургических заводов, предприятий
химической промышленности, шахтные воды и т. п. Значительные количества Mn
поступают в процессе отмирания и разложения гидробионтов, в особенности сине-зеленых
и диатомовых водорослей, а также высших водных растений.принадлежит к числу
важных питательных элементов для растений и животных. Степень окисления Mn
зависит главным образом от окислительно-восстановительного потенциала среды и
концентрации водородных ионов.
Обнаружено, что снижение растворенного кислорода является главной
причиной появления Mn в придонных слоях воды. Значительную роль в этом процессе
играет также кислотность водной среды - снижение рН благоприятствует
высвобождению Mn из донных отложений.
Специальными лабораторными опытами установлена антибатная зависимость
между концентрацией Mn в воде и величиной рН, рисунок 1.2.
Механизм поступления Mn из донных отложений включает десорбцию его из
поверхности оксидов, восстановление последних, а также растворение карбонатов и
сульфидов.
Исследование форм Fe и Mn в воде оз. Эри показало, что высвобождение Mn
из донных отложений наблюдается, если степень кислородного насыщения менее 50
%.
Большая часть Mn в воде оз. Эри обусловлена поступлением его из поровых
вод донных отложений. Это вполне возможно, поскольку концентрация Mn в иловых
водах достаточно высокая (от 0,7 до 7,2 мг/л). В отличие от Fe, Mn содержится
во взвешенных веществах воды оз. Эри в относительно больших количествах, чем в
донных отложений.
В водах гиполимниона соотношение Мnраств./Мnвзв. изменяется от <1,0 до
2,0.
Считается, что в иловых водах Mn представлен преимущественно
незакомплексованными ионами Мn2+, которые поступают в воды гиполимниона и в
условиях дефицита кислорода способны определенное время существовать в них. При
этом повторное осаждение ионов Мn2+ протекает медленнее, чем поступление их из
донных отложений.
Количество взвешенного Mn в водохранилищах изменяется по сезонам. Как
правило, максимальное содержание его отмечено в летне-осенний период, а
минимальное в зимний период. Максимум содержания Мnвзв. совпадает с максимумом
биомассы фитопланктона.
Скорость поступления Mn из иловых вод в значительной мере определяется
формами его существования в них.
Наибольшая скорость диффузии характерна для незакомплексованных ионов
Мn2+ и низкомолекулярных его соединений. В то же время экспериментальным и
расчетным путем было показано, что Mn слабо связывается в комплексы в условиях
иловых вод донных отложений.
Так, в поровых анаэробных водах обнаружено лишь 10 % Mn, связанного в
комплексные соединения с растворенными органическим веществом. При общем
содержании Mn в поровых водах, равном 0,06-1,0 мг/л, доля закомплексованного
металла не превышает 0,2-3 %.
Поскольку Mn в поровых водах находится главным образом в виде свободных
ионов, а также в связи с очень большим градиентом концентрации его между
поровыми и водами водоема, следует ожидать достаточно высокой скорости диффузии
ионов Мn вместе с карбонатным и гидрокарбонатным его комплексами. Однако
диффузия Mn в придонных слоях лимитируется окислительными условиями и
повышением рН в толще воды, контактирующей с донными отложениями.
Таким образом, в поверхностных пресных водах состояние Mn определяется
совокупностью различных факторов, таких как окислительно-восстановительная
обстановка в водоеме, рН среды, наличие комплексообразующих веществ,
интенсивность процессов адсорбции на взвешенных частицах и др.
Как правило, Mn (II) способен накапливаться в водной среде в основном за
счет снижения Еh и рН и, в отличие от других микроэлементов, для него
характерны невысокие показатели степени закомплексованности. Способность Mn
(II) к окислению, а также широко развитые процессы адсорбции способствуют его
накоплению в донных отложениях. Процессы окисления-восстановления различных
соединений Mn не являются чисто физико-химическими; значительная роль в них
принадлежит микроорганизмам. В условиях определенной
окислительно-восстановительной обстановки (снижение Еh и рН среды) Mn способен
сохраняться в толще воды, что особенно четко проявляется в зонах гиполимниона
озер.
Доля взвешенной формы миграции Mn в речных водах достигает более 90%.
В водах озер и водохранилищ процент взвешенных форм Mn снижается
вследствие их осаждения в условиях замедленного стока. Благодаря этому
значительные количества Mn способны накапливаться в донных отложениях водоемов,
которые могут выступать в определенных условиях источником вторичного
загрязнения.
При этом, весьма существенное значение имеют формы существования Mn в иловых
водах, определяющие интенсивность молекулярной диффузии. Как правило, в иловых
водах содержатся значительные количества растворенного Mn, основную часть
которого составляют незакомплексованные ионы (не менее 90 %).
Вследствие высоких градиентов концентраций и отсутствия комплексов с
большой молекулярной массой, для Mn характерна высокая скорость молекулярной
диффузии в граничный слой между донными отложениями и придонной водой.
МЕДЬ
Содержание Cu в земной коре сравнительно невелико - примерно в тысячу раз
по массе меньше, чем алюминия, в шестьсот раз меньше, чем Fe.
Считается, что устойчивость растворимых медьгуминовых комплексов выше в
нейтральной и щелочной области рН.
При этом отмечена высокая стабильность растворимых комплексов Cu с ГК и
ФК.
Опыты по изучению комплексообразующей способности отдельных отличающихся
между собой по молекулярной массе фракций гуминовых кислот показывают, что
максимальные количества Cu связываются в основном низкомолекулярными фракциями.
Аналогичное явление характерно и для органического вещества эстуариевых
вод, где показано, что фракция с молекулярной массой < 1000 обладает
наибольшей комплексообразующей способностью по отношению к Cu.
Получены также количественные данные, характеризующие
комплексообразование Cu с органическим веществом - продуктами метаболизма
фитопланктона. Они указывают на то, что в большинстве случаев образующиеся
комплексы обладают высокой стабильностью. Среди них особо устойчивы соединения
Cu с сидерофорами, которые уступают лишь аналогичным комплексам Fe.
Характерной особенностью поведения растворенной Cu в водных системах
является высокая степень ее закомплексованности с органическим веществом, часто
превышающая 90 % валового ее содержания. При оценке доли незакомплексованной Cu
в зависимости от константы образования органических комплексных соединений при
различных значениях рН среды было выявлено, что при рН = 6 и рН = 7 влияние
комплексообразования с органическим веществом незначительно, когда lgKoбp. <
4. Для lgKoбp. > 5 реакция комплексообразования становится доминирующей, а
доля свободной Cu резко снижается.
При рН = 8.0, наиболее характерном для поверхностных пресных вод, процент
незакомплексованной Cu еще ниже, так как в этих условиях, по всей вероятности,
имеет место связывание Cu в комплексы как с неорганическими, так и с лигандами
ОВ.
Большой вклад в адсорбционные процессы микроэлементов в природных водах
вносят гидроксиды Fe, Mn, алюминия.
Особенно высокое сорбционное сродство у двуокиси Mn выражено по отношению
к ионам Сu+2 в интервале рН от 2.0 до 8.0 избирательность поглощения ионов
металлов аморфной МnО2 определяется следующим рядом: Сu > Сo > Mn > Zn
> Ni.
Как и для других микроэлементов, для Cu существование взвешенных форм в
ощутимых количествах наблюдается в речных водах, они выносят в среднем около 85
% Cu в составе взвесей.
В воде Волги Cu мигрирует главным образом в растворенном состоянии
(84-95%). Низкое содержание Cu во взвешенных веществах обусловлено,
по-видимому, невысоким ее содержанием в почвообразующих породах и почвенном покрове
бассейна р. Волги.
В водоемах замедленного стока (водохранилища, озера) роль взвешенной
формы в миграции Cu резко снижается и обнаруживается она, как правило, в
растворенном состоянии.
Об этом свидетельствуют многочисленные результаты исследований распределения
Cu между основными формами ее существования в водах водохранилищ и озер.
В последнее время значительное внимание многих исследователей привлекают
формы существования металлов в поровых водах донных отложений.
Это весьма важно с точки зрения познания механизма и путей круговорота
микроэлементов в экосистемах водоемов. Донные отложения обладают высокой
поглотительной способностью по отношению к микроэлементам и, по существу,
являются одним из главных факторов самоочищения водных объектов от соединений
тяжелых металлов.
Однако в определенных условиях они могут выступать в качестве источника
вторичного загрязнения.
Следует отметить то обстоятельство, что с точки зрения процессов
массопереноса разные соединения одного и того же элемента имеют различные
коэффициенты диффузии, и поэтому вторичное влияние поровых вод донных отложений
до некоторой степени будет зависеть от форм нахождения в них химических
элементов.
Скорость молекулярной диффузии определяется такими важными показателями,
как градиент концентраций и коэффициент диффузии, который пропорционален
молекулярной массе диффундирующего вещества. Из этого следует, что скорость
диффузии незакомплексованных ионов металлов и их низкомолекулярных комплексов
выше, чем высокомолекулярных комплексных соединений, например гуматных или
фульватных.
Немногочисленные результаты работ по изучению форм нахождения Cu в
поровых водах донные отложения водоемов и почвенных растворах указывают на то,
что доминирующей ее формой являются комплексные соединения с органическим
веществом, доля которых нередко составляет не менее 98% валового содержания.
Потенциальными комплексообразователями считаются вещества гумусовой
природы. Одни авторы отдают предпочтение комплексообразованию с ФК, другие же
считают, что связывание Cu происходит вследствие присутствия ГК.
Получены интересные данные по формам нахождения Cu в поровых водах донных
отложений Иваньковского водохранилища.
И хотя это расчетные данные, основанные на ряде допущений, они
показывают, что примерно 99% Cu находится в закомплексованном состоянии и лишь
менее 1% составляют свободные ионы Cu. С учетом этого авторы пришли к выводу,
что скорость молекулярной диффузии Cu является очень низкой, поскольку
фульватные и гуматные комплексы, достигающие 90%, имеют низкие коэффициенты
диффузии. Экспериментальное изучение изменения концентрации тяжелых металлов,
включая Cu, в воде при различном времени контакта осадка с водой
свидетельствует о низкой скорости перехода тяжелых металлов в воду, а Cu в этих
условиях практически не поступала из осадка, хотя ее содержание в донных
отложениях составляло 6,2-48,3 мг/кг сухого грунта.
Характерной особенностью поведения Cu в природных водах является ее ярко
выраженная способность сорбироваться взвешенными веществами путем адсорбции на
поверхности гидроксидов металлов (Fе, Аl, Мn), ионного обмена с глинистыми
минералами, а также взаимодействия с гумусовыми и, возможно, с другими
высокомолекулярными соединениями на поверхности взвешенных частиц.
Высокая степень закомплексованности Cu свойственна также для поровых вод
донных отложений, причем потенциальными лигандами здесь выступают гумусовые
вещества.
Существование высокомолекулярных комплексов Cu в поровых водах, а также
сравнительно невысокие градиенты концентрации Cu между поровыми и поверхностными
пресными водами позволяют считать вторичное загрязнение водных объектов
соединениями Cu маловероятным.
ЦИНК
Цинк принадлежит к числу широко распространенных в природе элементов. Zn,
как и многие другие микроэлементы, переносится речными водами преимущественно
во взвешенном состоянии. Доля взвешенной формы Zn от общей его концентрации в
речных водах гидросферы колеблется в широком диапазоне, составляя в среднем
около 88.8 %. Сопоставление количества Zn, переносимого главнейшими реками
России в виде взвешенных веществ и находящегося в растворе, показывает, что
отношение Znвзв./Znраств совершенно различно для равнинных и горных рек.
Растворенная форма Zn имеет большое значение для равнинных рек, особенно
для р. Волги. Около 70 % Zn в составе взвешенных веществ находится в связанном
с гидроксидами Fe и Mn состоянии.
Силикатно-обломочная (кристаллическая) форма также является одной из
основных во взвеси рек, однако доля Zn, связанного с указанной формой,
составляет лишь 28 %.
В наибольших количествах Zn поглощается мелкодисперсной фракцией взвесей
(< 0,001 мм). Так, в составе последней содержится 50,5-64,2 % валового
содержания взвешенного Zn.является халькофильным элементом и чаще всего
встречается в виде сульфидов. В условиях донных отложений металл существует
только в степени окисления +2. Zn характеризуется высокой миграционной
способностью, реагирует с ионами CO3-2, SiO32-, PO43- , а так же образует
весьма прочные комплексы с органическими веществами. Zn в условиях донных
отложений в растворенном виде существует в основном в виде свободного иона
форме c минорными долями хлоридных, гидроксидных и карбонатных комлексов,
концентрируется в присутствии растворенных сульфидов в донных отложениях в виде
сульфидов. В присутствии органических веществ наблюдается образование прочных
комплексов с ионами Zn. Большая часть Zn мигрирует с глинистыми частицами,
частицами оксигидроксидов Fe и Mn, а так же на коллоидных частицах органических
веществ, которые энергично ее адсорбируют.
Величина сорбции ионов Zn+2 природными взвешенными веществами и донными
отложениями находится в пределах от 30 до 60 мг/г сорбента. Высокой
адсорбционной емкостью к Zn(II) и другим микроэлементам обладают донные
отложения водоемов, что было установлено путем лабораторных экспериментов на
примере донных отложений р. Маас.
Однако, если 90%-ная адсорбция Cu наблюдается при рН=6,0, то для Zn она
сдвинута в более щелочную область и достигается при рН=8,0. Из растворов с
концентрацией Zn+2 0,05-1,00 мг/л уже через сутки более 90 % Zn удаляется
окисленными осадками и около 20 % - восстановленными.
При изучении сорбционных свойств суспензий гумусовых веществ по отношению
к микроэлементам, включая Zn (II) было установлено преобладание химического
аспекта сорбции по сравнению со слабой физической адсорбцией.
По степени прочности образующихся связей между ионами металла и
взвешенными частицами Zn занимает третье место после Pb и Cu. Ощутимый вклад в
адсорбционные процессы тяжелых металлов, в том числе и Zn, вносит органический
детрит, что было установлено опытами по исследованию адсорбции Zn+2, Сu+2 и
Рb+2 взвешенным органическим веществом водорослевой суспензии.
Последнее в особенности может быть характерным для водоемов с высокой
биопродуктивностью.
В водоемах с зарегулированным стоком при переходе от речного режима
осаждается 30-40 % Zn+2взв..
В водохранилищах Днепровского каскада подавляющая часть Zn находится в
составе взвесей. Некоторые авторы указывают на характерную для Zn вертикальную
стратификацию в воде озер и водохранилищ. При этом, как и в случае Mn, в
придонных слоях озер концентрация Zn намного больше таковой в поверхностном
слое воды.
Данные о дифференциации различных форм Zn в иловых водах донных отложений
водоемов носят весьма ограниченный характер. В иловых водах морских донных
отложениях содержание растворенного Zn весьма низкое и не превышает 5-20 мкг/л.
При этом практически весь Zn (II) находится в закомплексованном состоянии.
Результаты определения Zn (II) в иловых водах донных отложений
Иваньковского водохранилища указывают на весьма высокое его содержание в
последних - от 0,26 до 2,0 мг/л (в среднем 0,69 мг/л). По сравнению со средним
содержанием Zn в речной воде концентрация его в иловых водах увеличивается
примерно в 20 раз.
При этом расчетные данные показывают, что на долю свободного (незакомплексованного)
Zn приходится 77,5 - 88,1 %.
Закомплексованные формы представлены в основном фульватными и гуматными
комплексами и составляют 11,2 - 20,7 % валового содержания. Ввиду среднего
значения градиента концентрации (в сопоставлении с таковыми для Fe, Mn и Cu) и
довольно значительного содержания высокомолекулярных комплексов Zn с гумусовыми
веществами скорость молекулярной диффузии у Zn должна быть меньше, чем у Fe и
Mn, и значительно больше, чем у Cu.
Это подтверждают также результаты изучения обмена химическими
компонентами между донными отложениями и водой. Из донных отложений,
находящихся в умеренно окислительной обстановке (Еh донных отложений и вод
изменяется от +150 до - 550 мВ), в воду может переходить до 30 мкг Zn (II)/100
г отложений.
Соответствующие показатели для Cu и Mn равны соответственно 5 мкг/100 г и
100 мкг/100 г.
Подавляющая часть Zn (II) переносится речными водами во взвешенном
состоянии, хотя в некоторых реках доминирующее положение занимают растворенные
формы. В значительной мере это определяется количеством взвешенных частиц и их
природой. Для Zn весьма характерны сорбционные процессы на глинистых частицах,
гидроксидах Fe, Mn, алюминия, силикатных минералах и т.п.
Что касается форм существования Zn в иловых водах донных отложений, то на
этот счет трудно дать однозначный ответ, поскольку одни авторы считают, что он
полностью закомплексован, а по данным других авторов - доминируют свободные
ионы.
С учетом последнего предполагается, что скорость молекулярной диффузии Zn
из донных отложений в толщу воды должна быть промежуточной по сравнению с
таковой для Fe, Mn и Cu.
РТУТЬ
Ртуть обнаруживается в природе главным образом в рассеянном состоянии.
Ртуть является весьма опасным загрязняющим элементом природных вод. В
поверхностные воды соединения Hg попадают в результате выщелачивания горных
пород, разложения водных организмов, накапливающих ртуть, вследствие
вулканической деятельности и др.
Значительное количество Hg поступает в водные объекты в связи с
хозяйственной деятельностью человека. Сточные воды промышленных предприятий и
сельского хозяйства представляют собой потенциальную угрозу загрязнения
водоемов ртутьсодержащими веществами.
Содержание Hg в поверхностных пресных водах колеблется в довольно широких
пределах: от 0,0001 до 2,8 мкг/л (в среднем около 0,1 мкг/л).
Широкое использование Hg и ее соединений вызывает необходимость глубокого
и разностороннего изучения токсических свойств этого металла.
Токсическое действие Hg и многих ее соединений обусловлено главным
образом блокированием функциональных (преимущественно сульфгидрильных) групп
тканевых белков, в результате чего группы теряют свои реакционные свойства.,
как и Cd и Zn, относится к группе непереходных металлов. В соединениях ртуть
проявляет степень окисления +2. Кроме того, для Hg характерны соединения, в
которых степень ее окисления равна +1.
Ионы Hg+2 образуют большое количество комплексных соединений с
координационным числом 2, 3, 4, 5, 6 и 8.
Во всех комплексных соединениях образующиеся связи «Hg (II) -лиганд»
имеют ковалентный характер и обладают весьма высокой прочностью. Наиболее
устойчивы комплексы с лигандами, содержащими атомы галогенов, N, P, S, C.
Показано, что основные количества Hg накапливаются в донных отложениях за
счет быстрой адсорбции последними, а также взвешенными частицами с последующим
их осаждением. Характерна очень высокая прочность связывания соединений Hg (II)
донными отложениями.
В условиях донных отложений Hg может находиться в степенях окисления +2 и
0, существование Hg в степени окисления +1 заметно лишь при рН менее 5. Важной
геохимической особенностью Hg является то, что в ряду других халькофильных
элементов она характеризуется самым высоким потенциалом ионизации. Это
определяет такие свойства Hg, как способность восстанавливаться в условиях донных
отложений до атомарной формы, значительную химическую стойкость к кислороду и
кислотам. Иногда может происходить образование монометилртути.
В зоне гипергенеза сульфидные минеральные фазы, например, киноварь, HgS,
растворимы в воде даже при отсутствии сильных окислителей. Металл легко
сорбируется глинами, гидрооксидами Fe и Mn, глинистыми сланцами и углями.
Отмечается, что ртуть образует одни из наиболее прочных комплексных соединений
большинством лигандов природных вод.
Обнаружено, что Hg не экстрагируется соляной кислотой, однако легко
экстрагируется при действии NaOH, что указывает на исключительно сильную
ковалентную связь ее с гуминовыми кислотами, ГК, донных отложений. Введение в
раствор фульвиновых кислот, ФК, практически не увеличивает десорбцию Hg (II).
При исследовании кинетики адсорбции и десорбции различных соединений Hg
(II) донными отложениями показано, что при постоянном значении рН (7.0)
величину адсорбции Hg определяют концентрация хлоридов, состав донного грунта и
степень его загрязнения.
Обнаружено, что десорбция неорганической Hg (II) является незначительной
для большинства исследованных песков, глин и ОВ. Соотношение десорбции к
адсорбции Hg (II) в течение 24 ч. составляет 1:10 (для песков) и 1:100 (для
глин); для ОВ десорбция не наблюдается.
Определенный вклад в процесс поглощения Hg (II) и других металлов донными
отложениями водоемов вносит сульфид-ионы.
Наиболее интенсивная адсорбция Hg (II) отмечена в донных отложениях с
содержанием 1-10 % ОВ. Среднее значение концентрации Hg для грунтов с
содержанием ОВ >1,0% составляет 0,11 мг/кг, тогда как при ОВ < 0,5% Hg в
грунтах содержатся в среднем 0,04 мг/кг. В пробах с максимальным содержащем ОВ
(до 20%) концентрация Hg может достигать 1,5 мг/кг.
Поглощение Hg (II) донными отложениями в значительной степени зависит от
концентрации хлорид-ионов. Установлено, что с ростом концентрации ионов Сl
адсорбция неорганических соединений Hg имеет тенденцию к уменьшению. Это же
подтверждают результаты исследования соосаждение Hg (II) на гидроксиде Fe (III)
в отсутствие и в присутствии галогенид-ионов.
Адсорбированная донными отложениями Hg очень сильно удерживается
последними за счет образования ковалентных связей с различными их
составляющими.
Липофильная и персистентная диметилртуть накапливается в тканях
организмов низших трофических уровней и передается по пищевой цепочке: если в
планктоне ее содержание составляет примерно 0,01 мкг/г, то в мышечной ткани
хищных рыб оно достигает 0,5-1,5, а у птиц-рыболовов - 3-14 мкг/г.
"Время жизни" Hg в тканях рыб очень велико (400-1000 сут), т.е.
она выводится из организма медленно.
СВИНЕЦпринадлежит к числу малораспространенных элементов. Растворение
свинецсодержащих минералов является одним из источников поступления Pb в
поверхностные воды.
Одним из серьезных источников загрязнения поверхностных вод соединениями
Pb является сжигание углей, а также вынос в водоемы со сточными водами
рудообогатительных фабрик, металлургических предприятий, химических производств
и шахт.
Содержание Pb в незагрязненных поверхностных водах колеблется от десятых
долей до нескольких микрограммов в 1 л. В речных водах оно бывает несколько
большим за счет его миграции в составе взвешенных частиц.
В последние годы значительное внимание уделяется исследованию процессов
превращения минеральных форм металлов в органические (алкилирование).
Неорганические соединения Pb, подобно Hg, в донных отложениях водоемов
подвергался метилированию с участием микроорганизмов.
Мобилизация Pb из донных отложений посредством процессов метилирования
представляет серьезную опасность для водной биоты.
Наиболее важную роль в миграции Pb в поверхностных пресных водах играют
взвешенные формы. В речных водах количество последних весьма часто достигает
98,8 %. Характерно, что и в озерных водах содержание Рbвзв. часто намного
превышает концентрации растворенных форм Pb.
Как в случае других тяжелых металлов, подавляющая часть взвешенного Pb
находится во фракции с наименьшими размерами частиц (менее 0,001 мм). Аморфные
гидроксиды Fe и Mn, входящие в состав речной взвеси, адсорбируют 34,4 - 72,5 %
Рbвзв..
Существенный вклад в адсорбционные процессы вносит органическое вещество,
ОВ, входящее в состав взвешенных частиц.
Несмотря на достаточно выраженные комплексообразующие свойства и
способность существовать в воде в растворенном состоянии, подавляющая часть Pb
(II) в поверхностных пресных водах обнаруживается в составе взвесей.
Для речных вод эта величина достигает 90-98 %. Довольно высокой она
остается и для вод озер и водохранилищ. Этому способствует в значительной мере
высокое сродство ионов Рb к природным адсорбентам.
Особенно легко они поглощаются гидроксидами металлов, а также глинистыми
частицами. Наличие комплексообразователей, включая высокомолекулярные
органические вещества естественного происхождения, во многих случаях
благоприятствует адсорбции, Pb (II) на взвешенных частицах природных вод.
Наибольшие количества взвешенного Pb обнаруживаются во фракции с наименьшими
размерами частиц. ФК благоприятствуют адсорбции ионов Pb на глинистых частицах
в основном в слабокислой среде (рН=3,0 - 6,0).
При более высоких значениях рН среды вследствие образования устойчивых
растворенных комплексов процесс адсорбции значительно подавляется.
Слабая подвижность Pb в донных отложениях обусловлена низким его
содержанием в иловых растворах последних. В то же время метилирование
соединений Pb в донных отложениях может способствовать усилению поступления
более растворимых продуктов метилирования в водную толщу, что представляет
серьезную опасность для биоты.
В природных системах Pb может существовать, как в свободной ионной форме,
так и в виде гидролизованных или закомплексованных форм. Расчеты
формообразования показывают, что при рН больших 7, растворенный Pb существует в
основном в виде карбонатных комплексов [Pb(CO3)0 и Pb(CO3)2-].
Важными факторами, контролирующими распределение форм Pb, являются - рН,
типы и концентрации комплексующих лигандов, основные катионные составляющие,
величины констант стабильности водных комплексов Pb-лиганд.
Значительное количество исследований и расчетов показывают, что при
окислительных условиях зависимость от рН и концентраций лигандов, чистых фаз
твердых соединений Pb, таких, как PbCO3, Pb3(OH)2(CO3)2, PbSO4, Pb5(PO4)3Cl,
Pb4SO4(CO3)2(OH)2, могут контролировать концентрацию Pb в воде. При
восстановительных условиях галенит (PbS) может регулировать концентрацию
растворенного Pb.
Концентрация Pb в некоторых природных системах контролируется твердыми
растворами, такими, как: барит [Ba(1-x)PbxSO4)], апатит [Ca(1-x)Pbx(PO4)3OH],
кальцит(Ca(1-x)PbxCO3) и сульфиды Fe (Fe(1-x)PbxS).
Как известно, Pb сорбируется на поверхности оксидов, глин, гидроксидов,
оксигидроксидов и органических веществ.
В отсутствии отдельной фазы Pb его природная концентрация будет
контролироваться реакциями адсорбции-десорбции. Данные по адсорбции показывают,
что у Pb очень высокое сорбционное сродство для донных отложений, сравнительно
с большим количеством других первых переходных металлов. Исследования сорбции
Pb показывают, что его адсорбция сильно зависит от рН и значений емкости
катионного обмена, ЕКО.
НИКЕЛЬ
В незагрязненных и слабозагрязненных поверхностных пресных водах
концентрация Ni колеблется обычно от 0,8 до 10,0 мкг/л. Некоторыми
исследователями представлен более широкий интервал колебаний его содержания. В
загрязненных водоемах этот показатель составляет несколько десятков и более
микрограммов в 1 л.
Особенно высокие концентрации никеля характерны для вод и озер в местах
залегания никельсодержащих горных пород, сульфидных месторождений. Одним из
наиболее серьезных источников загрязнения Ni являются сточные воды цехов
никелирования, заводов синтетического каучука, никелевых обогатительных
фабрик.относится к канцерогенным элементам.
Наиболее распространены соединения никеля, в которых он находится в
степени окисления +2. Наиболее прочные комплексные соединения Ni (II)
образуются с лигандами, содержащими донорные атомы азота.
Необходимо отметить, что даже в северных реках в переносе никеля
существенна роль взвешенных веществ. В частности, для вод рек Оби и Енисея
количество Niвзв. достигает 60,5-86,7 %.
Роль взвешенных форм в миграции значительно уменьшается в водоемах
замедленного стока (озера, водохранилища).
В водах волжских водохранилищ взвешенные формы Ni составляют 23,5-58,6 %.
Весьма существенную роль в содержании Ni (II) во взвешенных формах играют
мелкозернистые глинистые частицы (пелитовая фракция взвесей). Активными
адсорбентами Ni (II) являются также гидроксиды Fe, Mn, Al. Они способны
связывать в среднем около 30 % Ni.
Результаты исследования фазового состояния некоторых металлов, в том
числе никеля Ni (II), во взвесях рек бассейна Японского моря показали, что
половина Niвзв. находится в кристаллической силикатной форме. Среди других
подвижных форм 21,6 % составляет связанная с раскристаллизованными гидроксидами
Fe и Mn.
Благодаря адсорбционным процессам Ni, как и многие другие тяжелые
металлы, способен накапливаться в донных отложениях водоемов. Имеющиеся в
литературных источниках данные указывают на то, что в поровых водах донных
отложений Ni (II) связан в комплексы с высокомолекулярными гумусовыми
соединениями, причем степень закомплексованности достигает 40-80 % Niраств.
В условиях поверхностных водных систем никель находится только в
двухвалентном состоянии. Доминантным в данных условиях является
незакомплексованная форма Ni+2, с минорными примесями незаряженной формы NiCO3
и иона NiCl+. Элемент обладает способностью образовывать прочные комплексы с
ионами органических кислот, особенно ФК и ГК.
Никелю присущи сидерофильные и халькофильные свойства. Металл может
замещать Fe (II) и Mn (II) в их минеральных фазах.
В растворенном состоянии в условиях поверхностных вод никель находится в
виде незакомплексованного иона, с минорными долями бикарбоната Ni(HCO3)2, а так
же хлоридных комплексов.
Поэтому можно полагать, что в этих условиях никель характеризуется
средней подвижностью, в отличие от Fe (III) и Mn (II), обладающих высокой
подвижностью, или Cu (II) как слабоподвижного элемента.
Таким образом, в ряду тяжелых металлов Ni характеризуется как металл со
средними комплексообразующими свойствами. Среди различных по молекулярной массе
комплексных соединений Ni максимальные количества последнего обнаружены в
низкомолекулярных фракциях органических веществ, что является общей
закономерностью для большинства двухзарядных катионов металлов. Подавляющая
часть переносится речными водами во взвешенном состоянии.
Возможность вторичного загрязнения водоемов соединениями Ni (II) тесным
образом связана с формами его существования в иловых водах. Если принять, что
степень связывания ионов Ni (II) в комплексы с гумусовыми веществами составляет
в среднем 50 %, то поступление его из донных отложений в толщу воды будет
характеризоваться средней скоростью молекулярной диффузии.
КАДМИЙ- типичный рассеянный элемент. Одним из источников его поступления
в воду являются процессы выщелачивания из полиметаллических и медных руд, а
также из почв. Значительные количества Cd вносятся в поверхностные воды в
результате хозяйственной деятельности.
В незагрязненных и слабозагрязненных речных водах концентрация Cd составляет
0,01-0,1 мкг в 1 л. В загрязненных же водах содержание кадмия может достигать
десятков микрограммов в 1 л.
По своей токсичности Cd аналогичен Hg и As. Менее растворимые его
соединения действуют в первую очередь на дыхательные пути и желудочно-кишечный
тракт, а более растворимые после всасывания в кровь поражают центральную
нервную систему, вызывают дегенеративные изменения во внутренних органах и
нарушают фосфорно-кальциевый обмен.относится к группе d-элементов. Для Cd
характерна степень окисления +2. Металл образует довольно устойчивые комплексы
с соединениями, с содержащими в качестве донорных атомы N и S.
Адсорбция Cd гуминовыми кислотами в значительной степени возрастает с
ростом рН. Cd менее прочно связывается суспензией ГК, чем Cu или Pb. Для Cd
характерно весьма интенсивное его поглощение гидроксидами металлов. При этом
гидроксид Mn (IV) обладает более сильными адсорбционными свойствами по
отношению к ионам Cd+2, чем гидроксид Fe (III). Следует подчеркнуть, однако,
что сродство ионов Cd+2 к гидроксидам металлов выражено в меньшей степени, чем
Pb (II), Cu (II), Zn (II) и Ni (II).в условиях поверхностных водоемов
присутствует только в степени окисления +2. Доминантным в данных условиях
является незакомплексованная форма Cd+2, с минорными примесями незаряженной
формы CdCO3 и иона CdCl+. Элемент обладает способностью образовывать прочные
комплексы с ионами органических кислот, особенно фульвиного и гуминового ряда.
Среди основных процессов, контролирующих распределение данного металла между
водной фазой донных отложений и донными отложениями является адсорбция как по
механизму ионного обмена на глинистых и песчаных частицах донных отложений, так
и адсорбция по другим механизмам на поверхности адсорбционных минеральных фаз
донных отложений, особенно оксигидроксидных, и органических веществ.
Несмотря на то что металл сам по себе не находится только в степени
окисления +2, распределение его между донными отложениями и ПВ критически
зависит от окислительно-восстановительного состояния системы, т.к. его переход
в раствор возможен вследствие растворения сорбционных фаз донных отложений.
Среди потенциально возможных механизмов фиксирования донными отложениями кадмия
возможно образование твердых минеральных фаз фосфата и карбоната кадмия.
Существенный вклад в процессы адсорбции Cd, как и других металлов, вносит
сестон озерных вод, что показано на примере оз. Мичиган.
Отмечена положительная корреляция между сезонными максимумами
концентраций взвешенного Cd и периодами летних и осенних вспышек «цветения»
фитопланктона.
Вопрос о подвижности Cd в донных отложениях водоемов мало изучен, а
имеющиеся в литературных источниках данные о возможности его поступления из
донных отложений в толщу воды не позволяют получить однозначного ответа.
Таким образом, формы существования Cd в поверхностных пресных водах
определяются совокупностью ряда факторов, а также химическими свойствами
элемента. Среди растворенных форм в большинстве случаев доминируют свободные
(незакомплексованные) ионы, составляющие не менее 50 % валового содержания. По
сравнению с другими тяжелыми металлами (Hg, Cu, Pb, Zn и др.) Cd менее активно
вступает в реакции комплексообразования. Прочность его гуматных и фульватных
комплексов намного уступает таковой комплексов перечисленных металлов с
гумусовыми веществами.
Для Cd, в отличие от Mn, Pb, Zn, Ni и других, менее характерны взвешенные
формы миграции, на долю которых в мировом речном стоке приходится в среднем
около 65 %.
Для многих речных и озерных вод этот показатель еще ниже и редко
превышает 25-35 % валового содержания. Слабое связывание Cd взвешенными
частицами природных вод является, по всей вероятности, одной из причин его
миграции, в основном, в растворенном состоянии. Не исключено, что под действием
сильных комплексообразователей, как естественного характера, так и
антропогенного происхождения кадмий способен десорбироваться из взвешенных
частиц и донных отложений и переходить в толщу воды, что представляет
определенную угрозу для жизнедеятельности водных организмов.
КОБАЛЬТ
Концентрации Co в природных водах характеризуются относительно невысокими
показателями. Так, содержание Со в незагрязненных пресных водах колеблется в
пределах 0,04-8,0 мкг/л.
Для некоторых речных и озерных вод обнаружен более широкий диапазон
концентраций этих металлов.
Однако в последние годы в условиях интенсивного применения этих металлов
в промышленности и сельском хозяйстве особенно опасным источником их
поступления становятся сточные воды металлургических, металлообрабатывающих,
нефтеперерабатывающих, химических производств и др.
Кобальт относится к числу биологически активных металлов и всегда
содержится в организме животных и в растениях. В небольших количествах он
оказывает стимулирующее влияние на важнейшие физиологические процессы
жизнедеятельности последних (интенсивность фотосинтеза, дыхание, водный обмен).
Вместе с тем повышенные концентрации соединений кобальта являются
токсичными.
Наиболее распространены соединения кобальта со степенью окисления +2.
Кроме того, известны соединения, в которых Co проявляет степень окисления +3.
Фазовый анализ гранулометрических фракций взвеси рек Ганга и Брахмапутры
показал, что для Со подвижная и инертная (силикатно-обломочная) формы
распределены примерно поровну.
Экспериментальные исследования процессов адсорбции кобальта и хрома на
различных адсорбентах весьма немногочисленны.
Адсорбция ионов Со+2 имеет много общего с таковой других двухзарядных
катионов.
Таким образом, в поведении кобальта и хрома в водных растворах можно
отметить как общие, так и отличительные закономерности. Формы существования Co
(II) во многом сходны с таковыми для других двухзарядных катионов металлов.
Среди растворенных его форм примерно половина Со находится в свободном
(незакомплексованном) состоянии.
Наиболее детально изучено комплексоообразование ионов Со+2 с гумусовыми
веществами.
Связывание Co донными отложениями водоемов характеризуется достаточно
высокой прочностью, что обусловливает низкую их подвижность.
ХРОМ
Хром в условиях водоемов и донных отложений обнаруживается в степени
окисления +3,в концентрации в диапазоне 0,1-0,0 мкг/л. Cr (III) имеет тенденцию
к осаждению, формируя растворимые катионные формы, немобилен при умеренных
основных или кислых условиях, относительно мало токсичен.
В условиях системы вода - донные отложения хром существует в основном в
виде Cr3+ при рН ниже 3.5.
С
увеличением рН гидролиз Cr3+ приводит к образованию следующих форм - . При
высоких концентрациях хрома при 25°С могут медленно
образовываться полиядерные комплексы, типа .
Большинство
контролирующих растворимость твердых соединений Cr (III) в природе являются -
Cr(OH)3 или соединения соосаждения Cr (III) с гидроксидами Fe.
Фазовый анализ гранулометрических фракций взвеси рек Ганга и Брахмапутры
показал, что для Со и Сr подвижная и инертная (силикатно-обломочная) формы
распределены примерно поровну. Значительная часть (~57 %) взвешенного хрома в
воде рек бассейна Японского моря мигрирует также в форме, не связанной с
кристаллической структурой силикатных минералов, причем около половины
подвижной формы (28 %) приходится на раскристаллизованные гидроксиды, а
остальное ее количество составляют органическая и связанная с аморфными
гидроксидами Fe и Mn формы хрома (в среднем 16,8 и 8,8 % соответственно). В
случае хрома наибольшим сродством к твердой фазе обладает Сr (III).
Что же касается хрома, то этот металл находится преимущественно в виде
прочных кислородсодержащих анионных форм, в которых он проявляют высшую степень
окисления. По-видимому, это одна из причин его слабого комплексообразования с
другими лигандами природных вод
Связывание Сr донными отложениями водоемов характеризуется достаточно
высокой прочностью, что обусловливает низкую их подвижность.
Висмут
Висмут является последним членом подгруппы мышьяка. Относится к
халькофильным элементам. Ближайшие геохимические аналоги висмута - сурьма и Pb.
Характеризуется переменной валентностью, в природных условиях преобладает Bi3+.
Высокое сродство к сере, способность существовать в свободном состоянии и
склонность к образованию основных солей определяют важнейшие формы нахождения
висмута в природе.
Металл в водной фазе присутствует в виде хлоркомплексов (BiCl2+, BiCl0) и
гидрооксокомплексов (Bi(OH)03, Bi(OH)-12). При экзогенных процессах первичные
сульфидные соединения висмута окисляются (образуются оксидные и карбонатные
соединения). Висмут в том или ином количестве в виде изоморфной примеси входит
в состав некоторых сульфидов, а также образует самостоятельные минеральные
фазы.
В природных водах висмут мигрирует преимущественно в коллоидной форме,
доля которой в подземных водах значительно ниже, чем в поверхностных водах.
Основными растворенными формами являются HBi(OH)40, Н3Вi(ОН)6, соотношение
которых меняется с повышением рН и солености воды.
Сурьма
Сурьма является халькофильным элементом, с одной стороны, в природных
соединениях имеет свойства металла, образуя антимонит, а с другой стороны, ей
свойственны черты металлоида, проявляющиеся в образовании различных
сульфосолей. В этих минеральных фазах четко проявляется изоморфизм сурьмы,
мышьяка, висмута и др.
В экзогенных условиях первичные сульфидные минералы подвергаются
окислению, возникающий при этом сульфат сурьмы очень неустойчив, быстро
гидролизуется и переходит в оксиды и гидрооксиды. В условиях донных отложений
возможно образование сульфидных и оксидных минеральных фаз сурьмы.
Мышьяк
Мышьяк в условиях водоемов и донных отложений обнаруживается в степени
окисления - +3 и +5. As (+5) имеет, сравнительно с As (III), большую тенденцию
к адсорбционному осаждению на оксигидроксидах Fe и Mn. и менее токсичен,
сравнительно с As (III). К попаданию As в растворенное состояние в основном
приводят два процесса: окислительное растворение пирита и восстановительное
растворение оксигидроксидных минеральных поверхностей Fe. Eh-pH диаграмма
распределения мышьяка приведена на рисунке 1.3. В общем случае элемент является
химическим аналогом фосфора, однако образованием минеральных фаз мышьяка в
донных отложениях можно пренебречь.
1.2 КЛАССИФИКАЦИЯ
ТЯЖЕЛЫХ МЕТАЛЛОВ В СОСТАВЕ ДОННЫХ ОТЛОЖЕНИЙ
В основу одной из классификаций тяжелых металлов положена их токсичность.
Отрицательный эффект взаимодействия токсичных металлов с биологически
активными макромолекулами связан следующими процессами:
· вытеснением необходимых для биологических организмов металлов
из их активных мест токсичными металлами;
· связыванием части макромолекулы, необходимой для нормальной
жизнедеятельности организма;
· сшиванием с образованием биологических агрегатов, вредных для
организма.
Тяжелые металлы могут быть как нетоксичными, малотоксичными, так и
проявлять в водных экосистемах среднюю и высокую токсичность.
Для оценки токсичности металлов успешно используют их ранжирование,
основанное на принципах координационной химии.
Токсичными для водных организмов, как правило, являются металлы,
относящиеся к классу B (халькофильные, т.е. имеющие высокое сродство к
неметаллам 6 группы периодической таблицы).
К ним относятся металлы, присутствующие в природных сульфидах в виде
катионов Ag, Hg, Cu, Pb, Cd, Bi, Zn, Sb, и неметаллы, присутствующие в виде
анионов S, Se, Te, As.
Халькофильными свойствами обладает также ряд элементов, относимых
одновременно к нескольким группам - Mo, Pd, Au, Ga, In, Tl, Ge, Co и др. по
шкале комплексных соединений.
Среди этого класса наибольшей токсичностью обладают металлы, имеющие
наибольший ионный радиус и наиболее высокую степень поляризации и сродства к
сульфид-ионам, наименее низкую степень окисления и электроотрицательность.
Пользуясь приведенными критериями, в целом, ряд токсичности для
халькофильных металлов можно представить как: Hg (II) > Cu (II) > Pb (II)
> Cd (II) > Cr (III) > Zn (II) > Ni (II).
Токсичность тяжелых металлов часто определяется их классом опасности,
Таблица 1.1.
Ряд исследователей считает, что дополнительным фактором, определяющим
степень токсикологического воздействия тяжелых металлов на водные организмы,
является биодоступность тяжелых металлов.
Более того, токсикологический эффект проявляется лишь в том случае, если
тяжелые металлы для них доступны независимо от уровня содержания этих металлов
в водных экосистемах.
Таблица 1.1. Классы опасности химических загрязняющих веществ
|
Классы опасности
|
Химическое загрязняющее
вещество
|
|
1
|
As, Cd, Hg, Se, Pb, Zn
|
|
2
|
Co, Ni, Mo, Cu, Sb, Cr.
|
|
3
|
V, W, Mn
|
Ниже, в Таблице 1.2 представлена классификация тяжелых металлов по
степени их токсичности и биодоступности в водных экосистемах.
Подвижность тяжелых металлов в водных объектах варьируется от очень
низкой до очень высокой.
Таблица 1.2. Классификация тяжелых металлов по степени их токсичности и
биодоступности в водных экосистемах.
|
Нетоксичные
|
Низкотоксичные
|
Средне- и высокотоксичные
|
|
Висмут
|
Гадолиний*
|
Актиний*
|
|
Железо
|
Галлий*
|
Ванадий
|
|
Марганец
|
Германий
|
Вольфрам*
|
|
Молибден
|
Гольмий*
|
Гафний*
|
|
Диспрозий*
|
Индий*
|
|
Европий*
|
Иридий*
|
|
Золото*
|
Кадмий
|
|
Иттербий*
|
Кобальт
|
|
Неодим*
|
Мышьяк**
|
|
Олово*
|
Медь
|
|
Празеодим*
|
Никель
|
|
Прометий*
|
Ниобий*
|
|
Рений*
|
Осмий*
|
|
Родий*
|
Палладий*
|
|
Самарий*
|
Платина*
|
|
Тербий*
|
Полоний*
|
|
Тулий*
|
Ртуть
|
|
Церий*
|
Рутений*
|
|
Эрбий*
|
Серебро*
|
|
|
Свинец
|
|
|
Сурьма
|
|
|
Таллий*
|
|
|
Тантал*
|
|
|
Торий
|
|
|
Хром
|
|
|
Цинк
|
|
|
Цирконий*
|
|
|
Уран
|
|
* - редкие тяжелые металлы
и маловстречающиеся в значимых концентрациях в растворенном виде; ** - мышьяк
относится к неметаллам, однако традиционно его при определении включают в
группу тяжелых металлов.
|
В общем случае подвижность элементов снижается с увеличением ионного
радиуса и заряда иона, рисунок 1.4.
Концепция подвижности тяжелых металлов в системе поровая вода - донные
отложения сводится к оценке потока различных форм тяжелых металлов из одной
среды данной системы в другую под действием физико-химических процессов и
факторов, усиливающих или ингибирующих этот направленный поток.
К факторам, усиливающим поток поступления тяжелых металлов из донных
отложений в придонный слой воды, можно отнести не только свойства самих донных
отложений, но и уменьшение pH системы, изменение окислительно-восстановительных
условий, увеличение концентрации органических и неорганических
комплексообразователей, а также микробиологические процессы трансформации
соединений тяжелых металлов (например, биохимические процессы метилирования).
Для растворенных элементов характерна также миграция в коллоидной форме и
в форме высокомолекулярных комплексных соединений, как правило, растворимых. По
мнению А.И. Перельмана, образование комплексов с органическими соединениями,
которые образует большинство металлов, способствует повышению растворимости
большинства металлов.
В Таблице 1.3 приведена классификация тяжелых металлов по их подвижности
в зависимости от окислительно-восстановительных и кислотно-основных свойств
системы вода - донные отложения.
Наиболее полной в настоящее время представляется биогеохимическая
классификация тяжелых металлов, выполненная по целому ряду параметров, таких,
как время жизни, биохимическая активность, токсичность, канцерогенность,
обогащение аэрозолей, минеральная форма распространения, органическая форма
распространения, подвижность, тенденция к биоконцентрированию, эффективность
накопления, комплексообразующая способность, склонность к гидролизу,
растворимость, биохимическая активность.
Таблица 1.3 Зависимость подвижности тяжелых металлов от изменения
кислотно-щелочных и окислительно-восстановительных условий.
|
№ п/п
|
Подвижность
|
Окислительно-восстановительные
условия
|
Кислотно-основные условия
|
|
|
Восстановительные
|
Окислительные
|
Нейтрально-щелочные
|
Кислые
|
|
1
|
Очень низкая
|
Cr, Mo, V, U, Hg, Cu, Cd,
Pb
|
Cr, Fe, Mn
|
Cr, Hg, Cu
|
|
|
2
|
Низкая
|
Ni, Zn, Co, Fe
|
Pb
|
Pb, Fe, Zn, Cd
|
Fe(III)
|
|
3
|
Средняя
|
Mn
|
Co, Ni, Hg, Cu
|
Mn
|
Pb, Cu, Cr, V
|
|
4
|
Высокая
|
|
|
|
Mn, Cr, Zn, Cd, Hg
|
|
5
|
Очень высока
|
|
|
Mo, V, U
|
|
Классификация тяжелых металлов по их биогеохимическим свойствам
представлена в Таблице 1.4.
Таблица 1.4 Классификация тяжелых металлов по их биогеохимическим
свойствам В - высокий, У - умеренный и Н - низкий уровень проявления свойства
металла.
|
Свойство
|
Cd
|
Co
|
Cu
|
Hg
|
Ni
|
Pb
|
Zn
|
|
Биохимическая активность
|
В
|
в
|
в
|
в
|
в
|
в
|
в
|
|
Токсичность
|
В
|
У
|
У
|
в
|
У
|
в
|
У
|
|
Канцерогенность
|
-
|
в
|
-
|
-
|
в
|
-
|
-
|
|
Обогащение аэрозолей
|
в
|
н
|
в
|
в
|
н
|
в
|
в
|
|
Минеральная форма
распространения
|
в
|
в
|
н
|
в
|
н
|
в
|
н
|
|
Органическая форма
распространения
|
в
|
в
|
в
|
в
|
в
|
в
|
в
|
|
Подвижность
|
в
|
н
|
У
|
в
|
н
|
в
|
У
|
|
Тенденция к
биоконцентрированию
|
в
|
в
|
У
|
в
|
в
|
в
|
У
|
|
Эффективность накопления
|
в
|
У
|
в
|
в
|
У
|
в
|
в
|
|
Комплексообразующая
способность
|
У
|
н
|
в
|
У
|
н
|
н
|
в
|
|
Склонность к гидролизу
|
У
|
н
|
в
|
У
|
-
|
У
|
в
|
|
Растворимость
|
в
|
н
|
в
|
в
|
-
|
в
|
в
|
|
Время жизни
|
н
|
в
|
в
|
н
|
-
|
н
|
в
|
2.
ГЕОХИМИЧЕСКОЕ МОДЕЛИРОВАНИЕ ПОВЕДЕНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ В ВОДНЫХ СИСТЕМАХ
Повышение качества прогнозов миграции загрязняющих веществ требует
понимания и отражения в моделях геохимических процессов, определяющих поведение
веществ в сложной мультикомпонентной, многофазной среде, их взаимодействия с
другими компонентами.
В большинстве случаев поровый раствор является сложной смесью веществ,
взаимодействующих между собой в растворе, на активных участках твердой фазы,
испытывающих фазовые переходы и т.п., что не может найти адекватного отражения
иными методами, чем численное моделирование с использованием гидрогеохимических
компьютерных моделей.
К настоящему времени прикладная экология и, в частности, гидрогеоэкология
получили уникальный инструмент для описания сложных гидрохимических систем -
компьютерные технологии, предназначенные для моделирования форм веществ в
водном растворе, оценки изменения состава раствора с учетом фазовых
взаимодействий, расчета баланса масс и транспорта растворенных веществ в
пористой среде.
В большинстве случаев поровый раствор является сложной смесью веществ,
взаимодействующих между собой в растворе, на активных участках твердой фазы,
испытывающих фазовые переходы и т.п., что не может найти адекватного отражения
иными методами, чем численное моделирование с использованием гидрогеохимических
компьютерных моделей.
К настоящему времени прикладная экология и, в частности, гидрогеоэкология
получили уникальный инструмент для описания сложных гидрохимических систем -
компьютерные технологии, предназначенные для моделирования форм веществ в
водном растворе, оценки изменения состава раствора с учетом фазовых
взаимодействий, расчета баланса масс и транспорта растворенных веществ в
пористой среде.
Анализ учета различных геохимических процессов выделить следующие классы
гидрогеохимических моделей:
· модели расчета форм веществ в водном растворе;
· модели оценки изменения состава раствора;
· модели баланса масс;
· модели транспорта веществ.
Модели расчета форм веществ в водном растворе предназначены для оценки
распределения элементов в растворе в виде различных растворенных форм и
комплексов на основе обработки термодинамических данных и определения
насыщенности раствора относительно твердой и газовой фазы.
Современные программные пакеты расчета форм веществ имеют встроенные
термодинамические базы данных, использование которых требует известной
осторожности и предварительного анализа.
Результатом расчетов является количественная оценка содержания веществ в
ионной форме, в виде основных неорганических и органических комплексов, в виде
твердой фазы.
Как правило, модели дают хорошие результаты при оценке форм
макрокомпонентов. Вместе с тем, при оценке форм микрокомпонентов в растворе
имеются определенные трудности, связанные с тем, что термодинамические данные
для трассовых компонентов не обеспечивают полноты и качества, как для
макрокомпонентов. Наиболее полными пакетами для оценки форм компонентов в
растворе являются WATEQF и WATEQ4F.
Наиболее распространенные модели рассматривают растворы с концентрацией
веществ, не превышающей концентрацию морской воды (до 35 г/л) при
соответствующей ионной силе раствора. Для более концентрированных вод требуется
применение специализированных программ.
Модели для оценки изменения состава раствора (mass-transfer models или
МТ-модели) позволяют выполнить прогноз состава раствора, в результате различных
процессов, таких, как смешивание вод различного состава, испарение, изменение
температуры и давления среды, растворения - осаждения, ионного обмена, сорбции,
газирования и дегазации раствора. МТ-модели чаще всего используются для анализа
поведения загрязняющих веществ, оценки реакций и процессов, определяющих
равновесие изучаемой геохимической водной системы.
Эти модели также предусматривают встроенные процедуры для определения
основных форм веществ в водном растворе.
Определенным недостатком МТ-моделей является то, что они не принимают во
внимание изменения массы твердых растворов и несколько ограничены в решении
задач изменения состава раствора при ионном обмене и сорбции веществ. Ряд
геохимических пакетов моделирования, таких, как EQ3/6, Geochemist’s Workbench
включают препроцессоры, позволяющие определять константы скорости реакций и
кинетику процессов.
Другие модели, такие, как MINTEQA2 не содержат этих опций, вместе с тем
они являются исключительно полезными для многих практических приложений.
К моделям МТ - типа также относятся SOLMNEQ.88, MINEQL+MINTEQ(4.00).
МВ-модели используются для моделирования конечных изменений массы
реактантов и продуктов реакций в водах. Используя данные о начальных и конечных
составах минеральных фаз, представленных в рассматриваемой геохимической
системе, эти модели позволяют количественно определить процессы растворения
(осаждения) веществ так, чтобы выходной раствор соответствовал наблюдаемым
изменениям в составе воды.
МВ-модели не рассматривают вопросы термодинамического равновесия или
кинетических реакций, базируясь исключительно на on mass-transfer анализе
изменения массы веществ. Большинство из этих моделей, такие, как NETPATH,
содержат препроцессоры, позволяющие рассчитать насыщенность или индекс
насыщенности (SI) для каждого из веществ базы данных. Эта процедура основана на
оценке вероятности осаждения веществ с индексом насыщенности SI > 0 и
растворения веществ с индексом насыщенности менее 0.
Обычно в результате расчетов пользователю предлагается ряд наиболее
вероятных вариантов поведения системы, из которых он на основе представлений о
процессе выбирает наиболее реалистичный вариант. В модели этого типа, как
правило, включены данные относительно изотопного состава для большинства типов
вод и минералов, что позволяет исключить появление маловероятных растворов.
Главным преимуществом этих моделей является помощь в идентификации и
количественном описании наиболее важных геохимических процессов, контролирующих
химизм воды.
Геохимические модели транспорта используются для моделирования
гидродинамического конвективного и диффузионного переноса растворенных веществ
в пористой среде с учетом изменения состава раствора вследствие основных
гидрохимических процессов.
В настоящее время основным ограничением моделей является допущение об
установившемся характере фильтрации одномерного потока в гомогенной пористой
среде при относительно простых граничных условиях.
Это допущение приводит к необходимости существенной предварительной
схематизации сложных природных условий. Тем не менее, эти модели весьма полезны
при изучении процессов поведения веществ в природных водных системах, оценке
загрязнения поровых вод, оценке переноса веществ в пористых средах с учетом
основных взаимодействий между жидкой и твердой фазой, разработке стратегий
реабилитации загрязненных водных объектов.
Программами этого типа являются CHMTRNS, PHREEQM-2d и PHREEQC.
Некоторые примеры применения этих пакетов для моделирования процессов
массопереноса с учетом гидрохимических процессов приведены в работе.
При моделировании одновременно используются гидродинамическая и
геохимическая модели.
С учетом того, что, кроме гидрохимических, модели используют также и
гидродинамические характеристики среды, они представляют более мощный и
реалистичный аппарат для исследования процессов миграции веществ в реальных
средах.
При этом нужно иметь в виду, что эти модели предъявляют дополнительные
требования к оценке адекватности. Должны быть проанализированы, во-первых,
возможности модели отражать реальные процессы и, во-вторых, полнота и
достоверность используемых термодинамических и гидродинамических данных.
Термодинамические базы данных, используемые в дальнейшем при моделировании
миграции тяжелых металлов, представлены в Приложении I.
Этот тип моделей в настоящее время является мощным инструментом для
понимания поведения гидрохимических систем, выявления недостатков наших знаний
относительно процессов, а, также идентификации типов данных, необходимых для
повышения точности прогнозов.
Геохимическое поведение веществ определяется их внутренними свойствами и
взаимодействием с другими веществами водной системы.
Основными процессами, определяющими геохимическое поведение веществ,
являются:
· процессы растворения и осаждения;
· изменение активности и концентрации веществ;
· ионный обмен;
· процессы адсорбции и десорбции;
· окислительно-восстановительные процессы;
· процессы комплексообразования.
.1 ОПИСАНИЕ
ОСНОВНЫХ ГЕОХИМИЧЕСКИХ ПРОЦЕССОВ В ВОДНОЙ ФАЗЕ
2.1.1 Представление процессов растворения и осаждения в
гидрогеохимических моделях
В гидрогеохимических моделях процессы осаждения-растворения компонентов
раствора описываются законом действующих масс, стандартная форма которого имеет
следующий вид.
aA + bB=cC+dD
Распределение веществ контролируется константой равновесия реакции:
Здесь:
-
термодинамическая константа равновесия, A, B, C, и D - активности веществ;,
b,c, d - соответствующие стехиометрические коэффициенты.
При
условии, что константа равновесия для реакции известна, распределение форм
веществ, участвующих в реакции, рассчитано.
Константа
равновесия может быть рассчитана из термодинамических данных, используя
следующее отношение:
где:
-
стандартная свободная энергия Гиббса реакции;- газовая постоянная;-температура
( Kо),-натуральный логарифм константы равновесия.
В общем случае подземные воды находятся в стандартных условиях, не
превышающих значение 25°С и
1 атм. В то время, как изменение давления не сильно влияет на значение константы
действующих масс, изменение температуры очень важно. Изменение константы
действующих масс в зависимости от температуры обычно рассчитывается с помощью
уравнения Вант Гоффа:
Здесь
энтальпия реакции, которая имеет отрицательное значение для экзотермических
реакций и положительное значение для эндотермических реакций. Расчет и
определение стандартного состояния аналогично . При 25°С значение энтальпии реакции, , рассчитывается из значений энтальпии
формирования, , которые перечисляются в термодинамических таблицах. Значение
очень слабо изменяется в зависимости от температуры и в интервале нескольких
десятков градусов может считаться константой.
В
этом случае уравнение (2.13) может быть записано как:
В
альтернативном случае, когда выражается изменение К в зависимости от
температуры, экспериментальные данные для различных температур преобразуются в
полиномиальную функцию.
Расчеты,
основанные на законе действующих масс, являются основой при определении баланса
форм веществ в основных геохимических программах, например, WATEQ, PHREEQE,
SOLMINEQ, EQ 3/6.
Степень
достижения компонентами или минералами термодинамического равновесия
характеризуется понятием степень насыщения Q.
Степень
насыщения является отношением ионной активности продуктов реакции ( IAP) к константе
обмена реакции ():
При
условии, что Q (степень насыщения) < 1, раствор является ненасыщенным; при Q
= 1, растворенная и осажденная фазы находятся в равновесии; в случае, когда Q
> 1, раствор пересыщен.
Уровень
насыщения описывается индексом насыщения (SI), который представляет собой
десятичный логарифм от степени насыщения:
При
SI < 0, раствор является ненасыщенным; при SI = 0, раствор находится в
равновесии с твердой фазой; при SI > 0, раствор пересыщен.
Степень
насыщения Q и индекс насыщения SI представляют информацию о состоянии раствора
относительно твердой фазы.
Если
раствор ненасыщен, прогнозируется растворение соответствующей твердой фазы. При
условии, что раствор пересыщен, наиболее вероятной будет реакция осаждения
растворенных веществ из раствора. Практически все геохимические программные
пакеты используют индекс SI для анализа прогнозируемого соотношения твердой и
растворенной фазы.
Выше
были рассмотрены условия, отвечающие нахождению веществ в водоносном пласте в
виде чистых фаз. Расчеты твердых растворов базируются на теоретических
положениях, изложенных в работах.
Для
определения равновесие между водной фазой и твердым раствором используются
гетерогенные уравнения закона действующих масс.
В
отличие от чистых твердых фаз, активность твердой фазы твердых растворов не
равна единице.
Активность
компонентов определяется как:
где:
- молярная доля компонента р в твердом растворе;
-
коэффициент активности.
Молекулярная
доля компонента рассчитывается по формуле:
Здесь
Nss - количество компонентов в твердом растворе.
Для идеального раствора коэффициенты активности, по определению, равны 1.
Для двухкомпонентного неидеального твердого раствора коэффициенты
активности определяется по уравнениям Гуггенгейма:
Здесь:и
- коэффициенты активности компонентов, и - безразмерные параметры Гуггенгейма.
Коэффициенты
Гуггенгейма рассчитываются из уравнений:
где
- g0 и g1 - избыток свободной энергии раствора (кДж/моль).
В общем случае уравнение равновесия твердого раствора имеет вид:
Здесь
- константа равновесия компонента р, - стехиометрический коэффициент основной
формы m в реакции растворения компонента р в твердом растворе ss.
Частная
растворимость компонента твердого раствора определяется из выражения:
2.1.2 Учет термодинамической активности растворенных веществ в
гидрогеохимических моделях
Термодинамическая активность представляет количество веществ системы,
способных вступать в реакцию в отличие от общей концентрации веществ в
растворе.
Для описания электростатических условий в растворе в зависимости от
концентрации веществ вводится понятие ионной силы.
Выражение для ионной силы определяется на основе электростатической
теории Дебая-Хюккеля из выражения:
Здесь:-ионная сила раствора;- молярность i-го вещества;заряд i-го
вещества.
Соотношение активности растворенного вещества с его концентрацией
определяется выражением:
Здесь
Ai -активность i-го вещества, - коэффициент активности i-го вещества, mi -
мольная концентрация вещества.
Для
определения коэффициента активности веществ чаще всего применяется
аппроксимация:
Здесь:,
B -константы, характеризующие зависимость растворимости веществ от температуры
и давления;
-
эффективный диаметр i-го вещества в растворе;- заряд вещества.
Разница
между значениями активности и концентрации возрастает с возрастанием ионной
силы раствора и заряда иона. Все применяемые геохимические модели включают в
себя процедуру коррекции активности веществ, как общую часть модели.
Кроме
эффекта ионной силы, на активность веществ существенно влияет способность
веществ к образованию комплексов в растворе.
2.1.3 Процессы адсорбции и десорбции на неорганическом веществе в
гидрогеохимических моделях
Процессы сорбции играют важную роль в контроле миграции трассовых
элементов в водоносных горизонтах, являясь, по-видимому, важнейшим механизмом,
влияющим на движение загрязнения в природных водных системах.
В настоящее время разработан ряд фундаментальных теорий, основанных на
учете электростатических моделей при описании процессов сорбции ионов на
сорбирующей поверхности.
Одна из этих моделей предполагает, что сорбция является следствием
неполноты или замещения ионов внутри кристаллической решетки, следствием чего
является появление заряда частиц на сорбирующей поверхности. Этот заряд
нейтрализуется избыточной концентрацией ионов противоположного заряда, привлекаемых
к поверхности из окружающего раствора.
Заряженная поверхность является фиксированным слоем, а противоионы
образуют мобильный слой. Совместно они образуют ДЭС.
Другой причиной появления избыточного заряда на поверхности твердой фазы
осаждение на ней, в результате специальных химических сил, заряд которых
приводит к появлению заряда поверхности.
На практике, в особенности для проведения аналитических расчетов, чаще
всего используются эмпирические зависимости для количественного описания
процессов сорбции: линейной сорбции/десорбции, изотермы Фрейндлиха, Лэнгмюра и
др.
Модель равновесной линейной сорбции самая простая и, наверное, наиболее
используемая, в основном в аналитическом моделировании. Модель линейной сорбции
неадекватно описывает системы с несколькими поверхностями.
Изотерма Фрейндлиха отличается от линейной, показателем степени при
значении концентрации растворенного вещества:
Интервал значений показателя степени - от 0,7 до 1,8 (в основном он
меньше единицы и близок к ней). Введение степенной зависимости позволяет учесть
искривление изотермы в области повышенных концентраций.
Изотерма Лэнгмюра разработана специально для описания адсорбции при
фиксированном числе сорбционных участков (ограниченной емкости сорбента).
Балансовое уравнение имеет вид:
Здесь
- количество вакантных сорбционных участков породы. Выражение для константы
равновесия имеет вид:
Для некоторых нелинейных распределений, которые неадекватно описываются
моделями Френдлиха и Лэнгмюра, может быть использована нелинейная модель Тота:
Здесь
- параметр, учитывающий гетерогенность системы.
Для этих веществ, в целом ряде случаев, коэффициенты распределения могут
быть рассчитаны на основе рассмотрения механизма ионного обмена катионов.
Коэффициент линейной сорбции, с учетом ионного обмена растворенных
веществ, может быть определен из выражения:
Здесь:
- заряд иона мигрирующего металла ;
-активность
металла в растворе;
-
активность металла на твердой фазе.
2.1.4 Учет комплексообразования тяжелых металлов на органическом
веществе в гидрогеохимических моделях
Адсорбция играет определяющую роль в транспорте растворенных веществ с
природными водами, в первую очередь для катионов тяжелых металлов.
В природных системах основные микроэлементы и многие макрокомпоненты
образуют устойчивые комплексы. Комплексообразование может существенно
увеличивать концентрацию веществ в растворе в сравнении с расчетной
растворимость, без учета агентов комплексации. Кроме того, комплексообразование
оказывает существенное влияние на ионную силу раствора и активность веществ,
что ведет к растворению и транспорту гораздо большего количества растворенных
веществ, чем это прогнозируется без учета комплексообразования.
Комплексообразование влияет на поведение растворенных веществ различными
способами. Наиболее важным является то, что комплексообразование имеет огромное
влияние на токсичность и биологическую активность элементов.
Форма нахождения вещества в растворе зачастую имеет более важное значение
для токсичности, чем общая концентрация веществ.
Металлы, такие, как Cu, Pb, Cd и Hg, которые весьма токсичны в форме
свободных ионов, менее токсичны при тех же концентрациях когда они представлены
в виде комплексов.
Биоактивность элементов также является функцией форм вещества в растворе,
как и способность сорбироваться. Простые, незакомплексованные ионные формы
элементов обычно существенно лучше сорбируются твердой фазой, в сравнении с
комплексными.
Свободные ионы и комплексы, которые относительно слабо сорбируются
донными отложениями, способны к длительному переносу в растворенной форме.
Легко адсорбируемые на поверхности частиц могут переносится с взвешенными
веществами с поверхностным стоком, аккумулируясь, затем в наносах.
Если химические условия изменяются в течение транспорта или после
складирования наносов (например, изменение редокс-условий после захоронения в
осадке), элементы могут освобождаться, при этом в токсичной форме,
взаимодействуя на биоту и другие компоненты водных объектов.
В настоящее время вопросы образования неорганических комплексов в
природных водах изучены достаточно полно, разработаны соответствующие
термодинамические базы данных, позволяющие количественно описывать эти процессы
с точностью, достаточной для выполнения гидрогеохимических прогнозов.
Современные модели взаимодействия металлов с органическим веществом, в
первую очередь - с ГК могут быть сгруппированы на основании двух главных
особенностей:
· способа представления смеси лигандов (органическое вещество)
в растворе;
· способа учета электростатического взаимодействия между
растворенными ионами и лигандами.
При гидрогеохимическом моделировании обычно используются два основных
метода учета смеси лигандов в растворе.
В модели дискретных лигандов (так же называемой мультилигандной моделью
или моделью N-лигандов) выбирается некоторое фиксированное количество лигандов,
комбинированное поведение которых представляет поведение смеси вещества
гуминовых кислот.
В качестве альтернативы для описания процесса могут быть выбраны реальные
лиганды.
В последнем случае, выбор реальных лигандов может быть основан на
определении функциональных групп, содержащихся в органическом веществе и оценке
констант равновесия этих групп с катионами, участвующими в образовании
комплексов.
Стехиометрия реакции катион-лиганд, в общем случае, может быть отличной
от 1:1.
Небольшое число лигандов в дискретном представлении органическое вещество
предоставляет четкий каркас для представления реакций образования комплексов -
каждый лиганд определяется, как компонент, и реакции комплексообразования между
каждым компонентом лиганда и интересующим металлом определяются в форме закона
действующих масс .
В частности, при стехиометрии металл-лиганд 1:1 реакции для связывания
органического вещества с протоном и ионом металла могут быть представлены в
виде:
+Li ↔HLi
и+ Li↔MLi
Выражение закона масс для упомянутых выше реакций поддается прямому
использованию в модели видообразования:
[HLi]=KHLi [H][Li]
и
[MLi]=KMLi[M][Li]
В скобках представлены активности веществ. Лигандом при этом могут
являться, как Li, так и комплексы HLi и МLi. Выбор лигандов диктует форму реакции,
так, если в качестве лигандом является HLi, реакция имеет вид:
+ HLi ↔ H + MLi
Модель, предложенная в использует четыре площадки лигандов с
фиксированными значениями lgKH 4, 6, 8 и 10. Соответствующие концентрации
лигандов в смеси и значений lgK для металлов находятся на основе сопоставления
данных титрования с расчетными данными.
Следует отметить, что, несмотря на то, при записи уравнения использованы
термины термодинамических констант равновесия и активностей компонентов,
константы равновесия, полученные из экспериментальных данных, не являются
истинными термодинамическими константами.
Дискретная и непрерывная модели распределения исходят из тождества между
активностью и концентрацией лигандов в растворе или рассматривая реакцию, как
реакцию поверхностного комплексообразования с учетом представлений об
электростатическом взаимодействии на поверхности органического вещества.
Для более адекватного описания комплексообразования металлов в
присутствие органического вещества, все чаще используются различного рода
модели, учитывающие электростатическое взаимодействие между протонами и
металлами на поверхности органического вещества.
Модель дискретных лигандов, описывающая комплексообразование металлов с
учетом электростатического взаимодействия на поверхности гуминовых веществ.
Представление состава гуминовых органических соединений основано на
выделении карбоксильных и фенольных кислых групп, диссоциирующих по следующей
схеме:
Здесь L представляет органическую молекулу.
Константа
внутренней диссоциации с учетом электростатической коррекции определяется, как:
Здесь:-
постоянная Фарадея;- универсальная газовая постоянная;-абсолютная температура;
Yo - потенциал на
поверхности ОВ;- “относительное содержание геля ” в органическом соединении.
Значение
параметра «gf» отражает долю органического вещества, агрегированного в
гелеподобную структуру. Электростатическая коррекция на поверхности учитывается
только для этой части органического вещества.
Специальные
исследования ФК и ГК показал, что значение «gf» варьирует в интервале между
0,45 и 1, в среднем составляя 0,78.
Известные
модели комплексообразования с учетом электростатического взаимодействия на
поверхности органического вещества используют приближение о дискретном
представлении участков образования металлорганических комплексов.
Выделяются
участки (доли по отношению к общему количеству органического вещества различной
кислотной силы, каждому из которых отвечают свое значение . Как правило,
принимается, что участки более сильной связи учитывают реакции карбоксильных
кислотных групп, в то время, как участки со слабыми связями представляют
сравнительно более слабые фенольные кислоты.
Исследования,
показывают, в частности, что для ФК число участков со слабыми и сильными
связями составляло соответственно 23 % и 77%. Для ГК число участков со слабыми
связями составляло 67% от общего числа обменных участков.
При
дискретном представлении, участки слабой (тип В) и сильной связи (тип А) в свою
очередь разбиваются на дополнительные участки с различными константами
протонирования/депротонирования, для представления которых используются,
например следующие зависимости:
Здесь
- , - коэффициенты, учитывающие распределение lgKi.
В случае образования монодентатных комплексов, металл связывает один
участок органического соединения.
При этом имеет место следующая реакция (для двухвалентного металла):
В формуле (2.22) Yd
-потенциал внешней d-поверхности, который может быть определен с
использованием, например 1рК-модели.
Аналогично
реакциям протонирования, ОВ может быть представлено дискретными участками с
различной силой по отношению к металлам. Это, как правило, учитывается
введением поправочного параметра , что дает следующую форму записи, при
представлении органического вещества четырьмя участками с различным сродством к
металлу:
,
x = 0, 1, 2, 3
При условии, что металл занимает более одного участка поверхности
органического вещества, реакция принимает вид (для двухвалентного металла):
,
x = 0, 1, 2, 3
Здесь
- концентрация органического вещества, - удельная площадь поверхности органического
вещества (моль2г-1), -мольная плотность участков комплексообразования на
поверхности (моль/м2).
Множитель
дает возможность скорректировать константы образования комплексов с учетом
координационных связей.
Как
уже отмечалось, в настоящее время нет единой теории расчета активности
органических соединений.
Одним
из распространенных подходов является использование выражений следующего вида:
Здесь:
-определяемая
активность -го ОВ;
-
коэффициент активности для неорганических веществ такого же заряда, рассчитывается
с использованием стандартного выражения Дэвис;
[X-]
- равновесная концентрация растворенного органического вещества;
[X]tot
- общая концентрация органического вещества.
Учет
отрицательного заряда внутри геля осуществляется введение мнимого компонента .
Связь
между единичным зарядом и экранирующим катионом описывается следующей реакцией:
Константа
для большинства одновалентных катионов может быть принята равной 100,8, с
увеличением заряда катионов, величина возрастает. Противоионы, связанные на
поверхности геля, занимают только часть поверхности. Остальные противоионы
(привлеченные оставшимся зарядами) могут быть представлены и в виде полностью
растворенных и как граница органического вещетсва (в этом случае они теряют
водную активность).
Исследования
допускают, что остаточные противоионы полностью растворяются. Для гуминовых
веществ в твердой фазе, вместе с тем допускается, что избыток зарядов
поверхности полностью нейтрализуется привлекаемыми противоионами.
В альтернативных моделях, для описания поведения смеси органического
вещества в растворе используется непрерывные статистические или математические
функции распределения.
Фундамент для разработки моделей лигандов с непрерывными функциями
распределения констант кислотно-основной диссоциации был заложен в работе.
В модели нормального распределения предполагается, что количество
обменных участков лиганда является функцией нормального от логарифма константы
равновесия реакции комплексообразования между лигандом и металлом.
Это позволяет представить зависимость между количеством различных
обменных участков и соответствующих им констант равновесия в следующем виде:
Здесь:
-
суммарная концентрация органического вещества,
-общая
концентрация -го органического вещества смеси,
-
константа равновесия реакции комплексообразования между -м лигандом и ионом
металла,
и
- соответственно среднее значение и стандартное отклонение lg Ki.
В
предположении, что все участки комплексообразования одинаково доступны для всех
конкурирующих реагентов, выражения для реакций протонирования и образования
комплексов металлов имеют следующий вид:
H
+ Li ↔ Hli, ,+ Li ↔ Mli, ,
где:
γ - обозначает коэффициенты активности;
выражения в квадратных скобках - концентрацию веществ, заряд ионов
пропущен для простоты записи.
Важным допущением рассматриваемой модели, введенным в работе, является
то, что отношении равновесных констант KMLi/KHLi - является константа для
любого i-го лиганда. Это означает, что стандартное отклонение σ
для связывающихся
протонов такое же, как и для ионов металлов.
Для реакции комплексообразования с одним металлом, полная концентрация
i-го лиганда в смеси органического вещества составляет:
TLi = [Li]+[HLi] +[MLi]
Доля i-х протонированных лигандов равна:
Подставляя в выражение действующих масс, которое соответствует реакциям
уравнений (2.31) и (2.32) правую часть уравнения (2.34) и умножая обе части на
TLi, получим выражение для концентрации протонированного i-того лиганда:
где ГHL и ГML - представляет отношении коэффициентов активностей для
реакций протонирования и комплексообразования металлов, данных в уравнении
(2.32) и (2.32), соответственно.
При допущении стехиометрии 1:1 между лигандами и катионами, получаем
следующее выражение для определения концентрации i-того лиганда,
взаимодействующего с катионом:
Для получения полной концентрации органических комплексов металлов [ML],
необходимо просуммировать уравнение (2.37) по всем i-м лигандам:
Аналогичное выражение позволяет определить общую концентрацию
протонированных лигандов [HL].
Уравнение (2.38) может быть обобщено до выражения суммарной концентрации
[ML] любых комплексов катион-лиганд в системе, включающей конкурирующее
комплексообразование N катионов (M1, M2, .., MN ).
Концентрация комплексов катион - лиганд [M1L] составляет:
Другими важнейшими геохимическими процессами, в значительной мере
определяющими транспорт загрязняющих веществ в водоносных горизонтах, являются
процессы сорбции и ионного обмена.
2.1.5 Учет процессов ионного обмена в гидрогеохимических моделях
Ионный обмен действует, как временный буфер в ситуации неустановившегося
режима, который является результатом загрязнения, подкисления или вытеснения
природных вод загрязненными водами.
Эти процессы стремятся нивелировать изменения в составе вод и, с другой
стороны, способны в значительной степени изменять концентрацию катионов в
растворе (процесс, известный, как ионная хроматография).
Значительное число минералов, включая цеолиты, глинистые минералы, оксиды
и гидроксиды металлов, а, также, коллоиды и природные органические вещества
принимают участие в ионном обмене с раствором.
В Таблице 2.2. приведены значения емкости катионного обмена для наиболее
распространенных минералов с высокими сорбционными свойствами.
В принципе все твердые поверхности в донных отложениях могут выступать в
качестве адсорбентов. Однако в большей степени способность частиц адсорбировать
ионы раствора связана с глинистой фракцией донных отложений (размер частиц
<2 мкм), зернами породы, «одетыми» в органические вещества с оксидами и
гидрооксидами Fe. Адсорбционная емкость связана, таким образом, с содержанием
глинистой фракции (<2 мкм), глинистых минералов, органические вещества (%С)
и содержания оксидов и гидроксидов.
Таблица 2.2 Емкость катионного обмена некоторых минералов
|
ЕКО, мг-экв/100г
|
|
Каолинит
|
3-15
|
|
Смектиты
|
80-150
|
|
Галлоизит
|
5-10
|
|
Монтмориллонит
|
80-120
|
|
Вермикулит
|
100-200
|
|
Глауконит
|
5-40
|
|
Иллит
|
20-50
|
|
Хлорит
|
10-40
|
|
Аллофан
|
До 100
|
|
Гётит и гематит
|
До 100
|
|
ОВ (С)
|
150-400 (при рН=8)
|
Это получило отражение в эмпирических зависимостях, используемых для
расчета величины ЕКО, например:
Здесь:
и - процентное содержание глинистых частиц и органические вещества в
сорбирующем веществе.
Классический
пример ионного обмена в результате действия электростатических сил
демонстрируют глинистые минералы.
Дефицит
положительных зарядов глинистых минералов связан с замещением ионов в решетке
алюмосиликатов, входящих в состав глин и может быть легко рассчитан, исходя из
структурной формулы минерала.
Значение
рН, при котором заряд минерала равен нулю, получил название Точка Нулевого Заряда
(ТНЗ) или рНТНЗ.
Значения
рНТНЗ для ряда глинистых минералов и окислов приведены в Таблице 2.3.
Таблица 2.3 Значения рНТНЗ глинистых минералов, оксидов и гидроксидов.
|
минералы
|
рНТНЗ
|
|
Каолинит
|
4,6
|
|
Монтмориллонит
|
<2,5
|
|
Корунд 9,1
|
|
|
8,5
|
|
|
5,0
|
|
|
Гематит 8,5
|
|
|
Гётит 7,3
|
|
|
8,5
|
|
|
Бирнессит 2,2
|
|
|
Рутил 5,8
|
|
|
Кварц 2,9
|
|
|
Кальцит 9,5
|
|
|
Гидроапатит 7,6
|
|
Для описания процессов ионного обмена используется закон действующих
масс, в котором константа обмена выражается через активности катионов в растворе
и в твердой фазе.
Теория Дебая-Хюкеля предлагает простую модель соотношения концентраций и
активностей для катионов в растворе. Единой теории для определения активностей
катионов на поверхности твердой фазы в настоящее время нет.
Активность адсорбированных катионов принимается пропорциональной
эквивалентной доле адсорбированных на обменных участках катионов, которая может
определяться как по отношению к сумме катионов, способных к обмену, так и по
отношению к количеству участков на твердой фазе, способных к обмену.
В том случае, если эквивалентные доли рассчитываются, как отношение
сорбировавшихся катионов к общей сумме катионов, способных к обмену, закон
действующих масс записывается, согласно условию Гейнса-Томаса и, для обмена
одновалентного и двухвалентного катионов, имеет вид:
Здесь:
и , - соответственно, одновалентный и двухвалентный катион, участвующих в
обмене, - обменный участок твердой фазы.
Коэффициент
обмена Гейнса-Томаса может быть определен соотношением:
Здесь
- эквивалентная фракция ионов i-го вещества в твердой фазе:
В
том случае, если является мольной фракцией ионов i-го вещества в твердой фазе,
получаем соотношение, известное, как условие:
-
суммарная мольная емкость катионов, способных к обмену.
В том случае, если активности адсорбированных ионов принимаются
пропорциональными числу обменных участков, занятых этими ионами, закон
действующих масс принимает вид, по Гапону:
И, соответственно:
Условие
Гапона позволяет легко рассчитать количество способных к обмену катионов Na+,
замещающего в сорбирующих веществах Ca+2 и Mg+2. Однако, уравнение Гапона плохо
применимо при обмене многовалентных и, особенно, гетеровалентных катионов. В
этом случае предпочтительнее использовать условие Гейнса-Томаса или Ванслоу. В
частности, эксперимент по вымыванию катионообменных комплексов Са и Mg
раствором SrCl2 показал, что форма записи закона действующих масс Гейнса-Томаса
значительно лучше описывает экспериментальные данные, рисунки 2.1 и 2.2.Рисунок
2.1. Вымывание ионов Ca2+ при фильтрации раствора SrCl2
Следует отметить, что с уменьшением концентрации раствора различия в
результатах, полученных с использованием этих условий, уменьшаются.
На рисунке 2.3 приведено сопоставление результатов расчета интенсивности
кальциево-натриевого обмена для растворов различной концентрации с
использованием формы записи Гейнса-Томаса, Ванслоу и Гапона. Из представленных
графиков видно, что если при однонормальном растворе различия в результатах при
различных формах выражения эквивалентных доль весьма существенны, то для менее концентрированного
раствора (0,01 N) результаты расчетов практически совпадают.
Константы
обмена катионов не являются, строго говоря, термодинамическими. Это величины,
показывающие активность катионов друг относительно друга. В известных базах
данных чаще всего приводятся константы обмена катионов относительно Na или
Ca.Рисунок 2.2. Вымывание ионов Mg 2+ при фильтрации раствора SrCl2
В
Таблице 2.4 приведены значения коэффициентов обмена основных катионов по
отношению к Na.
Таблица
2.4 Значения коэффициентов обмена катионов по отношению к
|
|
|
Ион Ион Ион
|
|
|
|
|
|
|
1,2 (0,95-1,2)0,5
(0,4-0,6)0,6 (0,5-0,9)
|
|
|
|
|
|
|
0,20 (0,15-0,25)0,40
(0,3-0,6)
|
|
|
|
|
|
|
0,25 (0,2-0,3)0,35
(0,3-0,6)
|
|
|
|
|
|
|
0,100,35 (0,3-0,5)
|
|
|
|
|
|
|
0,080,55
|
|
|
|
|
|
|
|
0,6
|
|
|
|
|
|
0,6
|
|
|
|
|
|
0,5
|
|
|
|
|
|
0,5
|
|
|
|
|
|
0,4 (0,3-0,6)
|
|
|
|
|
|
0,4 (0,3-0,6)
|
|
|
|
|
|
0,3
|
|
|
|
В настоящее время ионный обмен определен, как один из основных механизм,
определяющий содержание большинства тяжелых металлов в природных водах.
Таким образом, способность катионов к обмену существенно влияет на состав
природных вод.
2.1.6 Учет окислительно-восстановительных процессов в
гидрогеохимических моделях
Многие химические вещества весьма чувствительны к изменению
окислительно-восстановительных условий и кислотности среды. Изменение этих
условий в значительной степени контролируют концентрации веществ, их формы и
способность к миграции с природными водами.
Количественно эти условия характеризуются такими показателями, как редокс
- потенциал Eh и водородный показатель pH. Не менее важным показателем, при
количественном описании химических реакций в водном растворе, является I, в
которой протекают реакции.
Целый ряд элементов может существовать более, чем в одном окисленном
состоянии. Наиболее часто встречаемыми в реакциях окисления являются такие
элементы, как кислород, водород , углерод, сульфат и азот.
Эти элементы обычно определяют протекание окислительно-восстановительных
реакций в природных системах.
Два других элемента - Fe и Mn, хотя и менее активны, также являются
главными веществами в реакциях окисления-восстановления в природных системах.
Поведение многих микроэлементов, значимых в силу их высокой токсичности, также
зависит от редокс-условий системы вода-ДО.
Общая форма полуреакции восстановления имеет вид:
Нормируемая относительно полуреакции водорода, разница потенциалов
полуреакций может быть количественно выражена. Потенциалы могут быть рассчитаны
из термодинамических данных на основе ур. Нернста:
Здесь:- окислитено-восстановительный потенциал;- стандартный потенциал
реакции;-газовая постоянная;-абсолютная температура реакции.
Выражение (2.95) представляет собой форму реакции Нерста, наиболее часто
используемую в геохимических расчетах.
Другой путь выразить окислительно-восстановительные условия среды
является использование переменной pE:
При построении диаграмм, показывающих редокс-чувствительность различных
элементом могут быть использованы как Eh, так и pE среды. Например, диаграмма
Eh-pH, представленная на рисунке 2.4 отражает стабильные реакции в системе Mn,
кислород, вода (Mn-O2-H2O) при t = 25°C и атмосферном давлении. При добавлении
в систему углерода и сульфата, появляются стабильные поля (MnCO3) и (MnS),
которые сужают поле (Mn(OH)2). При этом, ион Mn (Mn2+) остается доминирующим
растворенным веществом в растворе, оксид Mn является доминантной формой твердой
фазы на большей части интервалов Eh-pH, встречающихся в природных условиях.
Окислительно-восстановительные
процессы являются доминирующими при биологическом разложении ОВ. Биологические
реакции разложения - окислительно-восстановительные реакции, которые включают в
себя перенос электронов от ОВ к акцепторам электронов. Кислород является
акцептором электронов в аэробной среде (для аэробного метаболизма), тогда как
нитрат, трехвалентное Fe и углекислый газ служат акцепторами электронов в
анаэробных условиях.Рисунок 2.4. Диаграмма Eh-pH в системе Mn-O2-H2O
При наличии органического субстрата и растворенного кислорода способность
микроорганизмов к аэробному метаболизму преобладает над анаэробными формами.
Тем не менее, растворенный кислород быстро расходуется в загрязненной зоне,
превращая эти площади в бескислородные (с низким содержанием кислорода) зоны.
В таких условиях анаэробные бактерии начинают использовать другие
акцепторы электронов для усваивания (метаболизма) растворенного углеводорода.
Специальные исследования показывают, что редокс процессы, связанные с
различными акцепторами электронов, при биохимическом разложении ОВ идут
параллельно.
Так, в области относительно низких концентраций кислорода, одновременно с
аэробным окислением органики идет процесс восстановления нитратов, имеющий
сходный энергетический потенциал с реакцией окисления. Факультативные аэробы,
например, могут работать и как восстановители (восстановление нитратов) если
кислород присутствует в низких концентрациях. Также, отмечая близость
окислительно-восстановительных потенциалов сульфата и углекислоты (-220 мВ и
-240 мВ соответственно), можно ожидать, что восстановление сульфата и
образование метана могут происходить одновременно.
2.1.7 Учет кинетики геохимических процессов
Равновесная термодинамика является очень полезным инструментом для
прогнозирования направления протекания геохимических реакций и состояния в
установившемся режиме. Однако не все явления в водоносных пластах могут
объясняться химией равновесий.
Основным недостатком геохимической равновесной модели заключается в том,
что минералы, органические вещества и другие реагенты, зачастую, не достигают
термодинамического равновесия в течение модельного периода.
Кинетика процесса описывает скорость протекания реакций, позволяет
оценить факторы, лимитирующие скорость протекания реакций и время, необходимое
для достижения геохимического равновесия.
Одним из наиболее распространенных выражений для описания скорости
реакции минерала или любого твердого вещества является:
Где:
- удельная скорость реакции (моль/м2/с);
-
начальная площадь твердого вещества (м2);
-
количество раствора (кг воды);
-
начальное количество твердого вещества;
-
текущее количество твердого вещества;
-
фактор, учитывающий изменение условий в процессе растворения, а также
селективность растворения и старение раствора. Для однородных растворяющихся
сфер и кубов .
При
недостатке данных, позволяющих непосредственно определить удельную скорость
реакции , в условиях, близких к равновесным, кинетика процесса растворения
минеральной фазы может быть описана следующим выражением:
где
- эмпирическая константа.
Это
уравнение скорости получено из теории переходного состояния, в которой
коэффициент связан со стехиометрией реакции образования переходных комплексов.
Для
многих реакций можно принимать=1.
Данный тип кинетики реакции подходит для легко растворимых соединений -
карбонатов, фосфатов, гипса, флюорита и т.д.
Другие формы записи выражений для определения скорости реакций основаны
на экспериментальных данных и детальных измерениях скорости процессов при
варьировании концентраций влияющих на скорость изменения водных форм.
Одним из способов оценки влияния процессов на кинетику реакций системы
является сопоставление скорости изменения твердой фазы со скоростью
молекулярной диффузии веществ в растворе, как наиболее медленного транспортного
механизма.
Так, выражение для установившейся диффузии через кристаллы сферической
формы имеет вид:
Здесь:
- коэффициент молекулярной диффузии вещества в воде;
-
количество кристаллов в объеме породы;
-
радиус кристаллов;
-
равновесная концентрация;
-концентрация
вещества в растворе.
Скорость
изменения количества вещества в растворе может быть определена, как:
При
условии, что имеет место отношение , скорость растворения/осаждения вещества
лимитируются скоростью протекания процессов на поверхности твердой фазы. В
противном случае, скорость протекания процесса ограничена скоростью переноса
веществ в пористой среде.
Рассмотренные
выше определяющие гидрохимические процессы легли в основу разработанных
гидрогеохимических моделей на базе специализированного пакета PHREEQC 2.
При этом совместно решались уравнения гидродинамического конвективного и
диффузионного переноса и уравнения, описывающие геохимическое поведение растворенных
веществ в пористых средах: растворения/осаждения, изменения активности и
концентрации веществ, ионного обмена, адсорбции/десорбции, поверхностного
комплексообразования, окисления/восстановления.
2.2
ПРИМЕНЕНИЕ ГИДРОХИМИЧЕСКИХ МОДЕЛЕЙ В ЗАДАЧАХ ОЦЕНКИ МИГРАЦИИ ТЯЖЕЛЫХ МЕТАЛЛОВ
Работы посвящены численному моделированию поведения тяжелых металлов (Сu,
Zn и Cd) в природных водах, находящихся в контакте с минеральными сорбционными
фазами. Предложены новые модели ионного обмена на поверхности глинистых минералов,
на основе которых создана термодинамическая модель системы " тяжелые
металлы - макрокомпоненты раствора - растворенные органическое вещество (ГК и
ФК) - твердый гумус - глинистые минералы - оксиды трехвалентного Fe.
Поскольку большая часть тяжелых металлов в водных объектах находится в
связанном состоянии с органическими или неорганическими лигандами, то донные
отложения водных объектов теоретически могут сорбировать как ионы металлов, так
и их комплексные соединения с растворёнными органическими и неорганическими
веществами. Таким образом, теоретически сорбироваться может не только ион
металла, но и другие растворённые формы тяжелых металлов, как например
комплексы металлов с одним или несколькими лигандами, чаще органическими,
большую часть из которых представляют гумусовые вещества. Сродство тяжелых
металлов органическим молекулам является результатом связи между заряженным
ионом и противоположно заряженной координационной группой (карбоксильная или
гидроксильная) в сочетании с присутствием ароматических фрагментов, что в
целом, обуславливает их высокую реакционную способность по отношению к ионам
тяжёлых металлов.
Тип сорбции (физический или химический) будет зависеть от формы
нахождения металла (ионная или комплексная). При сорбции иона металла будет
происходить химическое взаимодействие с функциональными группами гуминовых
кислот, составляющих основу природных илов, с образованием прочных хелатных
связей, что свидетельствует о химическом типе сорбции.
Модель гетерогенных взаимодействий в системе донные отложения - поровая
вода донных отложений, разработанная в работах, описывает поведение тяжелых
металлов (Сu, Zn и Рb), и может быть использована не только для расчета
состояния системы, но и для прогноза изменения под действием внешних факторов, в
том числе антропогенных. Система донные отложения - поровая вода
рассматривалась как многокомпонентная гетерогенная система, включающая водный
раствор, индивидуальные твердые фазы и фазы-сорбенты переменного состава.
Представление осадков без потери качества было упрощено до трех сорбирующих фаз
переменного состава:
· глинистые минералы (Мс):
· гидроксиды Fe (Fh);
· ОВ (От), которое рассматривалось как неразрушимые
квазиэлементы по методике.
Для сорбента Мс заряд активного центра был принят равным 1, для сорбентов
Fh и От - 2. В составе водного раствора учтено присутствие двух органических
комплексообразователей - гуминовых кислот и фульвокислот.
В работах предложена следующая методика моделирования взаимодействия
«донные отложения - тяжелые металлы»:
· учет органических комплексов с ФК и ГК в растворе и трех
сорбирующих фаз (глинистые минералы, ОВ и гидроксиды Fe);
· задание валового состава системы
· для сорбирующих фаз - по результатам анализа форм нахождения
тяжелых металлов в осадках, химического и гранулометрического анализов;
· использование модели не для расчета состояния системы, а для
прогноза изменения под действием внешних факторов, в том числе антропогенных.
Модель работ была модифицирована в работе О.А. Липатниковой, в которой
изменен способ задания количества сорбентов. Если количество глинистого
сорбента (Мс) было рассчитано исходя из емкости катионного обмена 20
мг-экв./100г, измеренной для исследуемых донных отложений, и доли частиц <
0,01 мм, для расчета концентрации оксидного железистого сорбента (Fh)
использовались результаты вытяжек гидроксиламином, концентрация ОВ(От) была
оценена, исходя из допущений, что молекулярная масса ОВ равна 4000 и среднего
содержания ОВ в донных отложениях, то в работе концентрации Са, Mg, Na и К в
вытяжках измерены аналитически, что позволило более точно рассчитать емкости
сорбционных фаз. Термодинамическое моделирование проводилось в программном
пакете HCh for Windows, v. 4.3, в которой в качестве критерия равновесия
используется минимум свободной энергии Гиббса системы.
Пожалуй, наиболее развитая и комплексная модель распределения тяжелых
металлов между различными фазами водного объекта приведена в работе. Для
исследования равновесия процесса сорбции тяжелых металлов органических веществ
илов в был использован метод построения изотерм.
При математической обработке кинетических кривых, полученных в ходе
эксперимента, в работе были найдены значения констант скорости процесса сорбции
металлов илистыми частицами донных отложений при различных температурах.
Результаты экспериментов показывают, что при повышении скорости течения воды
скорость сорбции металлов илистыми частицами донными отложениями возрастает.
Так, при переходе от статических условий к скорости течения 1 см/с и к скорости
течения 2 см/с константы скорости возрастают в 0,2 - 0,3 раза. Этот факт
доказывает, что скорость сорбции зависит от скорости диффузии вещества к
поверхности раздела фаз. Таким образом, гидродинамический фактор, не являясь,
по существу, фактором самоочищения, может способствовать ускорению процесса
самоочищения водных объектов от соединений тяжелых металлов.
Растворённые в природной воде органическое вещество способствует
десорбции тяжелых металлов из донных отложений, так как образуют устойчивые
металлорганические комплексы. Повышение концентрации POB приводит к увеличению
содержания растворимых форм металлов в водных объектах. Увеличение содержания
растворенного органического вещества в воде происходит в осенний период, когда
образуется большое количество растворенного органического вещества в результате
отмирания фитопланктона и высшей водной растительности. Повышение концентрации
тяжелых металлов происходит и в результате поступления в воду органических
веществ антропогенного происхождения.
Процесс десорбции тяжелых металлов за счёт комплексообразования с
органическими лигандами, являясь гетерогенным процессом, включает в себя
несколькo стадий:
· подвод лиганда к поверхности сорбента;
· диффузия лиганда в поровом пространстве (внутренняя
диффузия); непосредственно комплексообразование;
· внутренняя диффузия образовавшихся комплексов; отвод
комплексов в пространство раствора.
При моделировании природных систем путем расчета равновесного состояния
предполагается, что рассматриваемые процессы успевают достигнуть равновесного
состояния быстрее, чем произойдет изменение внешних параметров состояния и
баланса масс. Для каждого объекта моделирования требуется подтверждение этого
условия либо разбиение задачи на серию подзадач для постоянных значений внешних
параметров и баланса масс. В реальной природной системе ДО-ПВ баланс масс
реагирующих компонентов зависит от скоростей химических реакций, протекающих в
системе.
В рамках выполнения Этапа 1 данной работы, авторами была разработана
гидрогеохимическая модель диффузионно-конвективного переноса в системе: «донные
отложения - поровая вода- донные отложения -вода водоема».
В основу разработанной модели было положено уравнение
конвективно-диффузионного переноса вида:
где:- концентрация в воде (моль/кг воды);- время (с);- скорость водяного
потока (в поре) (м/с);- расстояние (м);- гидродинамический коэффициент
дисперсии [м2/с, DL=De+αLv, De - коэффициент диффузии, αL -дисперсность (м) ];- концентрация
в твердой фазе (выраженная моль/кг воды в порах);
Член
определяет конвективный транспорт;
член
определяет дисперсный транспорт;
-
изменение концентрации в твердой фазе вследствие гидрогеохимических реакций
неконсервативных веществ (q в тех же единицах, что и C).
Уравнение
учитывает процессы одномерного транспорта, включая: диффузию, конвекцию,
конвекцию и дисперсию.
Термодинамические данные для растворенных веществ, газовых и минеральных
фаз
Модель предполагала катионный обмен на основе условия Гейнса-Томаса.
Реакции катионного обмена и константы обмена.
Константы реакций образования комплексов с органическим лигандами были
приняты согласно базе данных.
Для описания сорбции металлов на поверхности оксидов и гидроксидов
металлов была использована модель двойного диффузного слоя.
Одной из наиболее распространенных подобных задач, вследствие широкой
распространенности Fe и Mn в донных отложениях, является моделирование миграции
этих катионов с учетом процессов окисления/восстановления.
Рассмотрим миграцию двухвалентного Fe через породы с высоким содержанием
оксида Mn.
Разработанная гидрохимическая модель описывала линейный ток раствора
двухвалентного Fe через колонку, заполненную песком с высоким содержанием
оксида Mn (бирнессита).
Содержание Mn в исходном, вытесняемом растворе соответствовало
равновесному твердой фазе диоксида Mn при атмосферном давлении (РО2 - 0,2
атм.).
Емкость катионного обмена пород определена величиной ЕКО = 50 мг-экв/л.
Содержание бирнессита составляло 0,01 моль на 1 литр порового раствора. Составы
исходного и входящего растворов приведены в Таблице 2.5. Первоначально в
системе оксид Fe отсутствует.
Таблица 2.5 Состав модельного раствора
|
Ед. изм.
|
Показатель
|
|
Сa
|
Mg
|
Cl
|
Fe2+
|
SO4-2
|
pH
|
|
Исходный раствор
|
|
ммоль/л
|
0,1
|
0,02
|
0,24
|
0
|
0
|
7
|
|
мг/л
|
4
|
0,486
|
8,52
|
0
|
0
|
|
|
Входящий раствор
|
|
ммоль/л
|
0
|
0
|
0
|
5
|
5
|
7
|
|
мг/л
|
0
|
0
|
0
|
280
|
480
|
|
Термодинамические данные для растворенных веществ, газовых и минеральных
фаз.
Для описания основных геохимических процессов использовалось допущение о
мгновенном достижении геохимического равновесия в процессе всех реакций.
Реакции катионного обмена и константы обмена были приняты и для основных
катионов имели вид:
X- = X- lgk
=0,0+2 + 2X- = CaX2 lgk
=0,8+2 + 2X- = MgX2 lgk
=0,6+2 + 2X- = FeX2 lgk
=0,44+2 + 2X- = MnX2 lgk
=0,52
Окислительно-восстановительные условия системы определяются реакцией
восстановительного равновесия бирнессита:
MnO2 + 4H+ + 2e- =Mn+2 + 2H2O= 43,601
При этом Fe (II) окисляется бирнесситом:
+2 = Fe+3 + e-= -13,02
Суммарная реакция окисления Fe имеет вид:
+ 4H+ + Fe+2 =Mn+2 + 2H2O + 2 Fe+3=
17,561
Результатом реакции является выпадение образующегося иона Fe+3 в
результате гидролиза в виде аморфного гидроксида Fe:
Fe+3 + 3 H2O =Fe(OH)3 + 3 H+=-4.891
В процессе моделирования через колонку пропускалось 10 объемов порового
раствора. Сульфат-ион, как консервативный элемент использовался для верификации
действительной скорости тока в колонке и гидродинамической дисперсии.
Результаты моделирования представлены на рисунке 2.5.
Результаты модельных исследований позволяют сделать заключение о том, что
растворение MnO2 существенно замедляет распространение растворенного Fe с
фильтрующимися водами. При прохождении через колонку до 5.5 объемов порового
раствора практически все количество поступившего с входящим раствором Fe
находится в твердой фазе - преимущественно в виде гидроксида Fe(OH)3. При этом
вымывание образующегося Mn2+ замедляется, вследствие катионного обмена, при
котором магний и кальций вытесняются с участков обменного комплекса.
Сопоставление модельных и экспериментальных данных показывает высокую
адекватность разработанной модели и целесообразность применения
гидрохимического моделирования для решения подобных задач.
Анализ геохимических свойств основных тяжелых металлов показал, что их
разделение между жидкой фазой природных вод и твердой фазой донных отложений
определяется следующими основными факторами:
· осаждением металлов с образованием твердой минеральной фазы,
в том числе - твердых растворов;
· процессами образования неорганических воднорастворимых
комплексов в широком диапазоне pH;
· катионным обменом на сорбционных участках глинистых
минералов;
· образованием комплексов на поверхностях оксидов и гидроксидов
металлов;
· рН среды;
· процессами образования органических комплексов;
· концентрацией металла и составом водного раствора.
На основе этих положений была разработана геохимическая модель миграции тяжелых
металлов с использованием специализированного пакета PHREEQC.
Влияние процессов осаждения на миграционные свойства металлов были
смоделированы для природных сульфатно-хлоридных натриево-кальциевых вод, состав
которых приведен в Таблице 2.6.
Таблица 2.6 Состав вод, используемый при моделировании процессов миграции
Pb
|
Размерность
|
Cl
|
SO4
|
HCO3
|
Ca
|
Mg
|
Na+K
|
Pb
|
F
|
Ni
|
Mn
|
|
Мг/л
|
490
|
365
|
195
|
272
|
95
|
140
|
0,01
|
0,76
|
0,04
|
0,95
|
|
Ммоль/л
|
18.8
|
2,5
|
3,68
|
6,8
|
3,9
|
6,1
|
0,000048
|
0,04
|
0,0007
|
0,017
|
Предполагалось, что сорбция металлов идет на двух участках. Первый тип
участков учитывал процессы катионного обмена на твердой фазе и относился
преимущественно к сорбционным участкам глинистых частиц породы. Второй тип
участков был введен для описания специфической адсорбции металлов на оксидах
металлов, идущей преимущественно, как процессы образования поверхностных
комплексов.
При моделировании было принято, что оксиды металлов представлены
преимущественно ферригидритом. Термодинамические данные для поверхностного
комплексообразования на ферригидрите. Анализируя многочисленные данные по
сорбции катионов на оксидах Fe что для адекватного описания процессов сорбции
целесообразно использовать два типа участков адсорбции. Было обоснованно, что
адсорбция ионов металлов происходит на небольшом количестве участков с высоким
их сродством к адсорбируемым металлам (т.н. участки «strong») и значительном
количестве участков низкого сродства (участки «weak»). При этом для описания
реакций на участках обоих типов используется один тип стехиометрии
поверхностного комплекса: ≡FeO-Me+.
Это допущение было в дальнейшем подтверждено кристаллографическими
анализами различных оксидов Fe.
Наилучшим приближением для плотности общего числа активных, способных к
сорбции участков ≡Fe-OH считается величина 0,2 моль/моль Fe. При этом
плотность участков высокого сродства с катионами может быть оценена величиной
0,005 моль/моль Fe.
Оксиды Fe имеют высокую энергию кристаллизации и быстро переходят в
мелкие кристаллы и имеют высокую площадь удельной поверхности, часто >100
м2/г на которой располагаются функциональные группы ≡Fe-OH.
Площадь удельной поверхности ферригидрита варьирует от 100 м2/г до 700
м2/г. Теоретически возможный верхний предел оценен в работе как 840 м2/г и
базируется допущении диаметра частиц 2-нм и плотности 3.57 г/см3. Вместе с тем,
после выполненных обзоров литературных данных выбрали значение 600 м2/г, как
лучшую оценку площади удельной поверхности ферригидрита.
Для перевода грамм ферригидрита на литр раствора в моли Fe на литр
раствора при стехиометрии Fe2O3·H2O 89 г ферригидрита содержит один моль Fe.
Исходя из этого, в модели были приняты следующие значения для оксида Fe:
· площадь удельной поверхности - 600 м2/г;
· плотность активных участков - 2,31 участок/нм2;
· доля участков с сильным сродством - 0,0244 от общего
количества активных участков.
При исследовании влияния процессов осаждения на сорбцию Pb мольная
концентрация участков катионного обмена варьировала от 1 ммоль/л до 10 ммоль/л.
Массовая концентрация Fe2O3·H2O, реагирующего с раствором изменялась от 0,1 г/л
до 2,5 г/л.
В процессе моделирования концентрация Pb в растворе изменялась от 0,01 до
10 мг/л.
Модельные исследования показали, что при значительном превышении
количества активных участков над количеством ионов металлов, эффект осаждения
практически не влияет на геохимическое поведение Pb в данном растворе.
Так, при количестве участков катионного обмена 10ммоль/л и массовой
концентрация Fe2O3·H2O 2,5 г/л, в адсорбированной форме находится от 98,0 до
98,8 % Pb. В том случае, когда количество сорбционных участков сопоставимо с
количеством ионов металлов в растворе, с увеличением концентрации Pb в
растворе, процессы осаждения начинают играть заметную роль, рисунок 2.6.
Высокое сродства катионов Pb к адсорбционным участкам оксидов металлов
обуславливает существенное влияние содержание оксидов в породе на сорбцию Pb.
Разработанная модель была использована для оценки сорбционных свойств донных
отложений, содержащих оксиды Fe (Fe2O3·H2O). Так же, как и в предыдущем
модельном эксперименте предполагалось, что адсорбция ионов идет на участках
двух типов.
Первый тип участков учитывал процессы катионного обмена на твердой фазе и
относился преимущественно к сорбционным участкам глинистых частиц породы.
Мольная концентрация этих участков не менялась в течение моделирования и
составляла 10 ммоль/л порового раствора.
Второй тип участков был введен для описания специфической адсорбции ионов
на активных участках Fe2O3·H2O, концентрация феррогидрита в процессе
эксперимента варьировала от 0,5 г/л до 5 г/л порового раствора.
Результаты моделирования для Pb приведены на рисунке 2.7.
Проведенные исследования подтвердили положение о преимущественной сорбции
Pb на оксидах металлов. При концентрации Fe2O3·H2O в сорбирующих породах от 3
г/л и более основной формой была адсорбированная на оксиде Fe. При более низком
сродстве катионов с активными сорбционными группами оксида Fe, сорбция катионов
идет преимущественно на глинистых минералах, что показывает график
распределения форм никеля от содержания Fe2O3·H2O, рисунок 2.8.
Как видно из результатов моделирования, для металла с низким сродством по
отношению к оксидам металлов (Ni), от 55 до 60 % от общего содержания Ni
сорбируется по схеме катионного обмена на активных участках глин. Заметная
сорбция никеля на активных участках Fe2O3·H2O (20% и более) начинается при
содержании оксида Fe 4 г/л и более.
Разработанная модель позволила оценить влияние на адсорбцию тяжелых
металлов рН раствора.
При
проведении модельного эксперимента исходный раствор титровался соляной
кислотой, чем достигалось изменения рН раствора.Рисунок 2.7. Зависимость
распределения форм Pb от содержания Fe2O3·H2O
Так
же, как и в предыдущем модельном эксперименте учитывалось, что адсорбция ионов
идет на участках двух типов. Мольная концентрация участков первого типа
(катионного обмена) составляла 10 ммоль/л. Участки второго типа были
представлены Fe2O3·H2O, массовая концентрация ферригидрита составляла 2,5 г/л.
Результаты модельных исследований представлены на рисунке 2.9.Рисунок 2.9.
Зависимость адсорбции катионов от pH раствора
Полученные
результаты хорошо соотносятся с данными экспериментов по определению сорбции
катионов на оксидах металлов. Эти эксперименты показывают, что изменение
адсорбированного Pb от 10-15% до 95-100% происходит в интервале изменения рН от
2 до 4 единиц, рисунок 2.10.Рисунок 2.10. Экспериментальные зависимости
адсорбции Pb от pH раствора
В мультикомпонентных водных системах различные катионы могут конкурировать
один с другим за адсорбционные участки.
Принципиально, такая конкуренция неявно учитывается в моделях
поверхностного образования комплексов:
· во-первых, различием внутренних констант равновесия;
· во-вторых, изменением сил электростатического притяжения
вследствие адсорбции других заряженных веществ.
Некоторые исследователи сравнивали экспериментальные данные относительно
сорбции ионов в мультикомпонентных системах с расчетными, полученными для
однокомпонентных систем.
Вероятно, лучшее из этих исследований было представлено в работе, при
изучении конкурентной адсорбции Сu, Zn и Pb с использованием модели постоянной
емкости. Были сопоставлены экспериментальные и прогнозные данные по сорбции
протонов в мульти-компонентной среде. При этом было установлено, что имеется
весьма удовлетворительное сходство для сорбции в однокомпонентных системах и
сорбции в растворе, содержащем пару металлов.
В работе представили результаты расчетов в системах, где все три металла
присутствуют в эквимолярных концентрациях и общее количество ионов металлов
соответствует числу сорбционных участков. Эти расчеты показали, что сдвиг
кривой сорбции в направлении более высокого значения pH (в сравнении с
однокомпонентными системами) особенно отчетлив для наиболее слабого металла - Zn.
При значительном превышении количества активных участков над количеством
ионов металлов, эффект конкуренции нивелируется.
Эффект конкуренции был показан при моделировании сорбции Pb в присутствии
катионов Cu и Zn.
Концентрация Pb в растворе составляла 5 мг/л, т.е. 0,024 ммоль/л.
Концентрация Cu в растворе варьировала от 0,25 мг/л (0,003925 ммоль/л) до 3.0
г/л (0,0471 ммоль/л). Концентрация Zn изменялась от 0,003825 ммоль/л до 0,0459
ммоль/л.
Мольная концентрация участков катионного обмена была принята равной 1
ммоль/л.
Массовая концентрация Fe2O3·H2O была принята равной 0,1 г/л, т.е. мольная
концентрация участков со слабым сродством была равна 0,339 ммоль/л, участков с
сильным сродством - 0,0082 ммоль/л.
Таким образом, моделировались условия превышения количества активных
участков над количеством ионов металлов.
Результаты моделирования приведены на рисунках 2.11, 2.12.
Приведенные расчеты показывают, что эффект конкурирования катионов Pb и
Сu, имеющих сходные значения констант обмена на активных участках и близкие
константы равновесия в реакциях поверхностного комплексообразования, отмечается
при весьма значительных (для природных вод) концентрациях катионов.
Сорбционные свойства Zn незначительны в сравнении со свинцом в силу чего
эффект от конкуренции катионов слабо выражен, даже при значительных
концентрациях Zn в растворе.
Выполненные исследования позволяют сделать вывод о том, что разработанная
модель адекватно описывает основные геохимические процессы, определяющие
миграцию основных тяжелых металлов, и может быть рекомендована для прогноза
концентраций в поровой воде и твердой фазе донных отложений.
3. ОПИСАНИЕ
ОСНОВ ФИЗИЧЕСКОГО ПЕРЕНОСА ТЯЖЕЛЫХ МЕТАЛЛОВ В ДОННЫХ ОТЛОЖЕНИЯХ
Озёра и водохранилища - важнейшие объекты водного хозяйства РФ. На
территории России - свыше двух миллионов озёр суммарной площадью более 350 тыс.
кмІ. Общие запасы озёрных вод достигают 26 тыс. кмІ. Бо́льшая часть озёр имеет ледниковое
происхождение.
Крупнейшие озёра Европейской части России (расположенные в основном на её
северо-западе) - Ладожское и Онежское (площадью 17 680 и 9720 кмІ
соответственно); Чудско-Псковское озеро на границе с Эстонией (3550 кмІ);
Ильмень (около 1000 кмІ, площадь меняется в зависимости от уровня воды), а
также Топозеро, Выгозеро и другие, расположенные в Карелии.
Крупнейшее озеро Сибири и России - Байкал - является и самым глубоким в
мире; в Байкале содержится 85 % пресной озёрной воды России и 22 % мировых
запасов пресной воды. Длина озера - 636 км, средняя ширина - 48 км; общая
площадь - 31,7 тыс. кмІ; наибольшая глубина - 1620 м (большой глубиной
отличается также Телецкое озеро (325 м) на Алтае и Хантайское озеро (520 м) в
Предтаймырье).
Подавляющее большинство российских озёр относится к сравнительно
небольшим; многочисленны озёра на северо-западе Европейской части России
(особенно в Карелии) и на Западно-Сибирской равнине. Среди озёр преобладают
пресные, но имеются и солёные. Перечень крупнейших озёр России приведён в табл.
3.1.
Таблица 3.1. Перечень крупнейших озёр России
|
Название озера
|
Площадь кмІ
|
Глубина макс., м
|
Бассейн реки (вытекает)
|
Регионы России, другие
страны
|
|
Байкал
|
31722
|
1637
|
Ангара - Енисей
|
Иркутская область, Бурятия
|
|
Ладожское озеро
|
17700
|
230
|
Нева
|
Ленинградская область,
Карелия
|
|
Онежское озеро
|
9690
|
127
|
Свирь
|
Ленинградская область,
Карелия, Вологодская область
|
|
Таймыр
|
4560
|
26
|
Таймыра
|
Красноярский край
|
|
Ханка
|
4190
|
11
|
Сунгача - Уссури
|
Россия (Приморский край),
Китай
|
|
Псковско-Чудское озеро
|
3555
|
15
|
Нарва
|
Россия (Псковская область),
Эстония
|
|
Чаны
|
2000
|
7
|
бессточное
|
Новосибирская область
|
|
Выгозеро (Выгозерское
вдхр.)
|
1250
|
40
|
Выг
|
Карелия
|
|
Белое озеро
|
1125
|
33
|
Шексна (Волга)
|
Вологодская область
|
|
Топозеро (Кумское
водохранилище)
|
986
|
56
|
Ковда
|
Карелия
|
|
Ильмень
|
982
|
10
|
Волхов
|
Новгородская область
|
|
Имандра
|
876
|
67
|
Нива
|
Мурманская область
|
|
Хантайское озеро
|
822
|
520
|
Делимакит - Енисей
|
Красноярский край
|
|
Сегозеро (Сегозерское
вдхр.)
|
815
|
97
|
Сегежа
|
Карелия
|
|
Пясино
|
735
|
10
|
Пясина
|
Красноярский край
|
|
Кулундинское озеро
|
728
|
4
|
Кулунда
|
Алтайский край
|
|
Пяозеро (Кумское
водохранилище)
|
659
|
49
|
Ковда
|
Карелия
|
|
Нерпичье
|
552
|
12
|
Озёрная
|
Камчатский край
|
Среди водохранилищ России (около 120 тыс.) имеют объём более 100 млн мі.
Крупнейшее по площади водохранилище Европейской части России - Рыбинское.
Значительные по объему водохранилища созданы в Волжско - Камском каскаде. эти
водохранилища имеют относительно небольшую ширину и весьма значительную длину -
160-320 км. В Сибири крупные водохранилища располагаются в верхнем течении
Енисея (Шушенское, Красноярское), на его главном притоке Ангаре (Братское
водохранилище длиной 550 км, одно из самых больших в мире) и на реке Вилюй,
левом притоке Лены (Вилюйское). На северо-западе России в водохранилища
преобразованы некоторые естественные озёра. Перечень крупнейших по площади
водохранилищ России представлен в табл. 3.2.
Таблица 3.2. Перечень крупнейших по площади водохранилищ Российской
Федерации
|
Название
|
Площадь, км2
|
Глубина макс., м
|
Объём, км3
|
Река
|
Регион
|
|
Куйбышевское (Самарское)
водохранилище
|
6500
|
29
|
58.0
|
Волга
|
Самарская область,
Ульяновская область, Татарстан
|
|
Братское водохранилище
|
5470
|
150
|
169.0
|
Ангара
|
Иркутская область
|
|
Рыбинское водохранилище
|
4580
|
25-30
|
25.5
|
Волга
|
Ярославская область,
Вологодская область, Тверская область
|
|
Волгоградское водохранилище
|
3117
|
|
31,5
|
Волга
|
Волгоградская область,
Саратовская область
|
|
Цимлянское водохранилище
|
2700
|
|
23,9
|
Дон
|
Ростовская область,
Волгоградская область
|
|
Зейское водохранилище
|
2419
|
|
68,4
|
Зея
|
Амурская область
|
|
Вилюйское водохранилище
|
2360
|
70
|
40,4
|
Вилюй
|
Якутия (Саха)
|
|
Чебоксарское водохранилище
|
2190
|
21
|
4,6
|
Волга
|
Чувашия, Марий Эл
|
|
Красноярское водохранилище
|
2000
|
105
|
73,3
|
Енисей
|
Красноярский край, Хакасия
|
|
Камское водохранилище
|
1910
|
30
|
12,2
|
Кама
|
Пермский край
|
|
Кумское водохранилище
|
1910
|
56
|
9,8
|
Ковда, Топозеро, Пяозеро
|
Карелия
|
|
Усть-Илимское водохранилище
|
1873
|
91
|
59,4
|
Ангара
|
Иркутская область
|
|
Саратовское водохранилище
|
1831
|
25
|
12,9
|
Волга
|
Саратовская область,
Самарская область, Ульяновская область
|
|
Горьковское водохранилище
|
1590
|
22
|
8,7
|
Волга
|
Нижегородская область,
Костромская область, Ивановская область, Ярославская область
|
|
Усть-Хантайское водохранилище
|
1561
|
|
24,5
|
Хантайка
|
Красноярский край
|
|
Выгозерское водохранилище
|
1250
|
40
|
6,5
|
Выг
|
Карелия
|
|
Воткинское водохранилище
|
1120
|
28
|
9,4
|
Кама
|
Удмуртия, Пермский край
|
|
Новосибирское водохранилище
|
1082
|
25
|
8,8
|
Обь
|
Новосибирская область,
Алтайский край
|
|
Нижнекамское водохранилище
|
1080
|
20
|
2,9
|
Кама
|
Татарстан, Башкортостан,
Удмуртия
|
|
Верхнетуломское
водохранилище
|
745
|
|
11,5
|
Тулома
|
Мурманская область
|
|
Бурейское водохранилище
|
740
|
|
20,9
|
Бурея
|
Амурская область,
Хабаровский край
|
|
Саяно-Шушенское
водохранилище
|
621
|
220
|
31,3
|
Енисей
|
Красноярский край, Хакасия,
Тыва
|
|
Курейское водохранилище
|
558
|
|
10,0
|
Курейка
|
Красноярский край
|
|
Серебрянское водохранилище
|
556
|
|
4,2
|
Воронья
|
Мурманская область
|
Водохранилища являются водными объектами, искусственно созданными на
крупных водотоках, чаще всего на расширениях речных русел и в пределах
пониженных пойменных территорий. Водохранилища создаются для комплексного
использования в целях водоснабжения городов и населенных пунктов,
гидроэнергетики, полива сельскохозяйственных угодий, водного транспорта,
используются для рыборазведения и рекреации населения. Крупные водохранилища
осуществляют сезонное регулирование водного стока: наполняются в весенний
период и постепенно срабатываются в остальные периоды года. Малые водохранилища
осуществляют регулирование стока в течение более коротких промежутков времени.
Русловые водохранилища обладают достаточной проточностью, связанной с
прохождением расходов летней и зимней межени, а также санитарными попусками -
сбросами значительных расходов для водообеспечения населенных пунктов,
расположенных ниже водохранилищ, для нужд рыбного хозяйства и поддержания
устойчивого экологического состояния водного объекта в целом. Сооружение
водохранилищ приводит к срезке пиков половодий, поскольку за счет этого
производится заполнение водохранилищ. Расширение поперечных сечений водотоков в
зонах русловых водохранилищ, увеличение глубин при одновременном уменьшении
естественного водного стока приводит к уменьшению скоростей течения. При этом
интенсифицируются процессы накопления осадков, особенно в прибрежных
мелководьях. По данным натурных измерений скорости течения в придонных слоях
водохранилищ не превышают 3 - 5 см/с, в поверхностных слоях скорости могут
достигать 10 - 15 см/с в результате ветрового воздействия. При таких малых
скоростях течения уровень турбулентности может быть крайне малым, и процессы
массообмена между водными массами и донными отложениями будут носить
молекулярный характер при некотором влиянии конвекции на массоперенос. Влияние
конвекции требует специального исследования в натурных условиях, особенно в
зоне динамического контакта водной массы со слоем отложений, содержащих тяжелые
металлы.
Присутствие тяжелых металлов в донных отложениях озер и водохранилищ в
основном связано с воздействием факторов урбанизации, что приводит к
существенному превышению концентраций тяжелых металлов над фоновыми уровнями
для водотоков в их естественном состоянии, которые в настоящее время
исследованы недостаточно.
Следует отметить, что многие водохранилища создавались для водоснабжения
развивающихся центров урбанизации, находятся на территориях, подверженных
интенсивному техногенному и антропогенному влиянию и должны рассматриваться с
учетом всех присущих им особенностей.
Накопление тяжелых металлов в водохранилищах и озерах, находящихся за
пределами урбанизированных территорий, будет определяться характером
хозяйственного использования водосборных площадей и атмосферными осадками,
содержащими загрязнения техногенного происхождения.
3.1 ПЕРЕНОС
РАСТВОРЕННЫХ МЕТАЛЛОВ В ПРОТОЧНЫХ И НЕПРОТОЧНЫХ ВОДОЕМАХ
Массоперенос растворимых соединений тяжелых металлов в водных объектах
может осуществляться молекулярной диффузией в отсутствии движения водной массы,
либо конвективным механизмом при движении водной массы.
Расчет молекулярной диффузии выполняется на основании 1-го закона Фика,
содержащего коэффициент молекулярной диффузии Dм:
Для
определения коэффициентов диффузии и потока примеси предложены различные
модели, учитывающие физические свойства водной массы и диффундирующего вещества:
· Модель пограничного диффузионного слоя. Диффузионным
пограничным слоем считается тонкий слой жидкости, прилегающий к поверхности
раздела взаимодействующих сред, в котором проявляется молекулярная диффузия и
происходит резкое изменение концентрации диффундирующего вещества. Толщина
пограничного диффузионного слоя зависит от коэффициента молекулярной диффузии,
вязкости жидкости и относительной скорости течения, которая считается малой, не
приводящей к возникновению турбулентности.
· Модель Хигби проницания и обновления поверхности раздела.
Моделью предполагается кратковременность контакта фаз и неустановившийся
характер процесса диффузии, обусловленный обновлением поверхности контакта.
Основой модели является зависимость коэффициента массоотдачи от коэффициента
молекулярной диффузии и времени в степени Ѕ.
· Модель массопередачи с учетом явлений адсорбции. Является
важной для случая массопереноса соединений тяжелых металлов, адсорбированных на
частицах мелкой взвеси. В этой модели процесс переноса вещества разделен на две
стадии: быстрый массоперенос в условиях высокой скорости адсорбции и медленный
массоперенос, когда скорость адсорбции мала.
· Модель процессов массопереноса на основе учета межфазной
турбулентности. Эта модель описывает массоперенос при высокой относительной
скорости движения рассматриваемых фаз, при которой в зоне их смешения возникает
турбулентность, что учитывается с помощью фактора гидродинамического состояния.
Конвективный перенос растворенных веществ в водной массе определяется
гидродинамическими факторами и зависит от степени консервативности примеси и
расположения источников поступления примеси в водоем. Движение воды в проточных
и непроточных водоемах определяется сложным комплексом факторов, которые
включают влияние транзитного расхода, ветроволновые явления, баротропные
явления, поступление отводимых сточных вод, естественный поверхностный дождевой
и талый сток, грунтовое питание, атмосферные осадки.
В связи со сложной конфигурацией границ водоема и большим количеством
влияющих факторов характеристики возникающих в нем течений могут быть
установлены либо натурными измерениями, либо на основе математического
моделирования с использованием уравнений движения.
3.1.1 Движение водной массы как физическая основа конвективного
переноса тяжелых металлов. Уравнения движения водной массы
Скорости движения воды в водоемах, как правило, невелики, поэтому в
отдельных частях водоема движение может носить как ламинарный, так и
турбулентный характер. Универсальной системой уравнений, которая может быть
использована в качестве методической основы для моделирования течений в
водоемах и водохранилищах является система уравнений Навье-Стокса:
(3.1)
где
X, Y, Z - проекции ускорения действующей силы; x, y, z - координаты; n - коэффициент кинематической вязкости; r - плотность;
ux, uy, uz - проекции скорости на координатные оси; p - давление; t - время.
Уравнения
Навье-Стокса дополняются уравнением неразрывности:
(3.2)
Для
моделирования турбулентных течений чаще применяются уравнения Рейнольдса,
которые могут быть получены из уравнений Навье-Стокса и при выраженной
проточности записываются для двумерного течения в виде:
(3.3)
Для
трехмерного течения система уравнений дополняется аналогичным уравнением для
поперечной координаты.
С
учетом известных правил осреднения уравнения преобразуются к следующему виду:
(3.4)
Вычитая последнее уравнение системы (3.4) из последнего уравнения
системы, получим уравнение неразрывности пульсационного движения:
. (3.5)
Умножая
выражение (3.5) на и, осредняя, находим:
. (3.6)
Суммируя соотношение (3.6) с левой частью первого уравнения системы
(3.4), получаем:
(3.7)
С учетом соотношений
и
,
для
первого уравнения и аналогичных соотношений для второго уравнения преобразуем
систему уравнений (3.4) к виду:
(3.8)
Систему уравнений (3.8) обычно называют системой уравнений Рейнольдса для
плоского потока. По сравнению с исходными уравнениями Навье-Стокса в уравнениях
Рейнольдса имеются добавочные слагаемые, которые представляют собой нормальные
и касательные напряжения, связанные с пульсационным движением.
Среднее за интервал времени Т количество движения, переносимое вдоль оси
z:
. (3.9)
Аналогично для пульсаций скорости, нормальных к площадке,
. (3.10)
Согласно теореме импульсов, количество движения, определяемое
соотношением (3.9), равно касательному напряжению, взятому с обратным знаком.
Аналогично соотношение (3.10) представляет собой напряжение, нормальное к
площадке, также взятые с обратным знаком. Таким образом, в уравнения Рейнольдса
(3.8) по сравнению с уравнениями Навье-Стокса входят дополнительно производные
от нормальных и касательных напряжений.
Сравним
турбулентные касательные напряжения с вязкими напряжениями. Считая градиент
скорости по порядку величин близким к (где U - средняя скорость потока; Н -
его глубина), найдем вязкие касательные напряжения:
.
Принимая
пульсационные скорости по порядку величин близкими к 0,1U, получим турбулентные
касательные напряжения:
.
Таким
образом:
.
Поскольку
для турбулентного течения числа Рейнольдса >> 102, турбулентные
касательные напряжения в основной толще потока значительно превосходят вязкие
касательные напряжения.
Для
плавно изменяющихся течений величина значительно меньше , поэтому нормальными
напряжениями в первом уравнении системы (3.4) можно пренебречь. Во втором
уравнении можно пренебречь производной касательных напряжений по продольному
направлению х. В рамках приближений, принятых в теории пограничного слоя
система уравнений Рейнольдса для стационарного течения упрощается и принимает
следующий вид:
(3.11)
Приведенные выше уравнения Навье-Стокса и уравнения Рейнольдса составляют
научно-методическую базу для моделирования течений и процессов переноса
растворенных соединений тяжелых металлов в озерах и водохранилищах.
3.1.2 Энергетические уравнения осредненного и пульсационного
движения водной массы
Известно, что система уравнений Рейнольдса является незамкнутой.
Некоторые необходимые дополнительные соотношения между пульсационными
характеристиками могут быть установлены с использованием уравнения энергии.
Уравнения полной энергии могут быть получены умножением уравнений Навье-Стокса
на мгновенные значения соответствующих компонент скорости. Для этого все три
уравнения Навье-Стокса удобно записать в обобщенном виде:
, (3.12)
где каждый из индексов i и j последовательно равняется х, у и z.
Уравнение неразрывности при такой записи принимает вид:
. (3.13)
Уравнения Рейнольдса (3.8) при этом записываются следующим образом:
. (3.14)
Теперь
умножим уравнение Навье-Стокса (3.12) на мгновенную скорость :
. (3.15)
Учитывая, что:
,
с
использованием уравнения неразрывности (3.13), находим:
. (3.16)
Слагаемое,
содержащее вязкость в выражении (3.15), удобно представить с использованием
условия неразрывности в виде:
(3.17)
Подставляя соотношения (3.16) и (3.17) в выражение (3.15), получим баланс
полной энергии потока:
(3.18)
где:
I - изменение удельной кинетической энергии по времени;- изменение
кинетической энергии по координатам, которое можно представить как удельную
работу полного динамического напора в единицу времени;и IV - работа
массовых сил и сил давления;- работа вязких напряжений;
VI - диссипация полной энергии в тепло.
Мгновенную скорость и давление в виде суммы осредненных и пульсационных
величин и выполняя операцию осреднения для всех слагаемых уравнения (3.18),
запишем:
(3.19)
Умножая
уравнение Рейнольдса (3.14) на , запишем уравнение энергии осредненного
движения в виде:
. (3.20)
Выполняя преобразования, аналогичные тем, которые выполнялись выше для
уравнений Навье-Стокса, получаем:
Вычитая
уравнения (3.21) из соотношения (3.19), получим уравнение энергии
пульсационного движения:
(3.22)
Уравнение (3.22) является балансовым уравнением пульсационного движения,
учитывающим изменение энергии пульсационного движения по трем координатным
осям.
В уравнении (3.22):и II - изменение удельной кинетической энергии
турбулентности:
,
где:
;
III - изменение энергии, затрачиваемой осредненным течением на работу
против турбулентных касательных напряжений;- перенос кинетической энергии
турбулентности пульсационным движением;- суммарные потери энергии
турбулентности за счет работы по переносу жидкости через область переменного
давления;- работа вязких напряжений сдвига;- диссипация энергии
турбулентности.
Уравнение баланса пульсационной энергии для плоского равномерного
квазистационарного потока упрощается и приводится к виду:
.
(3.23)
Из
этого уравнения видно, что в зоне больших градиентов скорости вблизи граничной
поверхности генерация турбулентности происходит наиболее интенсивно. С
удалением от твердой границы в общий баланс турбулентной энергии существенный
вклад вносит энергия, привнесенная из области, близкой к граничной поверхности.
В основной толще потока, согласно И.О. Хинце, генерация энергии турбулентных
пульсаций оказывается близкой к ее диссипации. Для этой зоны уравнение
турбулентной энергии упрощается к виду:
. (3.24)
Уравнения энергии позволяют получить дополнительные связи между
параметрами турбулентности.
Однако система уравнений О. Рейнольдса, вместе с уравнением баланса
пульсационной энергии остается незамкнутой. Для решения используются различные
гипотезы о связи осредненных скоростей с турбулентными характеристиками
течения, что требует детального исследования осредненных скоростей и
турбулентности течений в водных объектах.
3.1.3 Анализ обменных процессов в водном потоке и на его границах
для обоснования методики экспериментальных и натурных исследований переноса
тяжелых металлов
Обменные процессы между донными отложениями и водной массой являются
процессами диффузионными, поэтому для их анализа и описания может быть
использована достаточно разработанная теория диффузии.
Загрязненные грунты в донных отложениях представляют собой водонасыщенную
пористую среду. Эта среда содержит в виде загрязнений различные химические
соединения органические и неорганические: соли, нефтепродукты, соединения
металлов и пр. Поскольку мельчайшие частицы грунта (илистые и пылеватые
фракции) обладают большой удельной поверхностью, различные химические соединения
оказываются связанными именно с мельчайшими фракциями грунтов. После
седиментации на дно многие из этих химических соединений растворяются в воде,
содержащейся в порах. В связи с тем, что в донных отложениях содержится
значительное количество примесей, а объем воды в порах сравнительно невелик,
можно ожидать, что концентрация раствора в поровом пространстве будет
достаточно высокой. При сквозной пористости осуществляется диффузия этих
растворов в воду, где концентрация примесей меньше. В общем случае диффузия
примесей осуществляется вследствие действия двух различных механизмов. При
различной концентрации примесей в воде и в «грунтовом» (поровом) растворе
возникает молекулярная диффузия. При фильтрационном движении воды вещества
«грунтового» раствора увлекаются водой и переносятся вместе с ней. Совокупность
этих процессов принято называть конвективной диффузией вещества.
Нарушение равновесия и возникновение диффузионных потоков обуславливается
наличием переменной от точки к точке концентрации С. Величина диффузионного
потока, определяющего диффузионный расход через единицу площади, равна:
,
где:
Dм - коэффициент молекулярной диффузии;
С
- концентрация раствора.
В
общем случае коэффициент молекулярной диффузии зависит от концентрации раствора
С и температуры, однако, если концентрация мала, например, по сравнению с
предельной концентрацией насыщения, обычно считают, что Dм не зависит от
концентрации. При этом диффузионный поток пропорционален градиенту концентрации
и направлен в сторону меньшей концентрации. Если в грунтовых растворах
концентрация примесей больше, чем в воде, возникает диффузионный поток
грунт-вода и происходит вторичное загрязнение воды. Если концентрация примесей
больше в воде, например, в местах сбросов сильно загрязненных вод или в аварийных
ситуациях, возникает диффузионный поток вода-грунт. Если кроме молекулярной
диффузии осуществляется течение чрез границу раздела вода-грунт. Например, при
наличии фильтрации, диффузионный поток будет зависеть также от скорости течения
u:
,
где
Сu - конвективная составляющая диффузионного потока.
Общее
уравнение конвективной диффузии получают из баланса потока, входящего в
произвольный объем и выходящего из него с использованием известной формулы
Остроградского-Гаусса.
В
операторной форме уравнение имеет вид:
В
декартовой системе координат общее уравнение конвективной диффузии записывается
следующим образом:
(3.25)
С
математической точки зрения уравнение конвективной диффузии является
дифференциальным уравнением второго порядка с переменными коэффициентами. Это
уравнение может быть преобразовано к безразмерному виду:
,
где:-
характерный линейный размер (толщина диффузионного слоя, на котором происходит
основное изменение концентрации);- характерная скорость движения.
Вводя
безразмерные координаты ; ; и безразмерные скорости ; ; , а также безразмерную
концентрацию ,
где
c0 - постоянная концентрация, например, в поровом пространстве в толще донного
грунта.
С
учетом этих обозначений запишем уравнение диффузии в виде:
(3.26)
где
- безразмерное число Пекле.
Второе
слагаемое в левой части уравнения характеризует конвективный перенос вещества
вследствие движения жидкости. Правая часть - молекулярную диффузию. Число Пекле
в уравнении характеризует соотношение между процессами конвективной и молекулярной
диффузии и является диффузионным аналогом числа Рейнольдса для течения
жидкости. Если число Пекле мало, например, вследствие малости скоростей
движения, то левая часть уравнения диффузии будет иметь старший порядок малости
по сравнению с первой частью. Это означает, что распределение концентраций
будет зависеть только от молекулярной диффузии. Отношение числа Пекле к числу
Рейнольдса:
называют
числом Прандтля, которое равно отношению кинематической вязкости к коэффициенту
молекулярной диффузии. При значении числа Pr ≈ 1 имеет место подобие
между переносом вещества и переносом импульса. Подставляя для воды n ≈ 10-2 см2/с и Dм ≈ 10-5 см2/с находим, что число Pr ≈
103. Это позволяет считать, что даже при малых скоростях течения конвективный
перенос растворенного вещества происходит значительно более интенсивно, чем
перенос молекулярный. Пренебрегая вследствие малости правой частью
диффузионного уравнения (3.25), получаем:
(3.27)
Следуя
В.Г. Левичу, произведем оценку членов в уравнении (3.25). С использованием
уравнения неразрывности после преобразований находим, что для течения в
пограничном слое толщина диффузионного слоя δд:
,
(3.28)
где
δ
- толщина пограничного слоя.
При
Pr≈103 толщина диффузионного слоя составляет всего лишь 1/10 от толщины
пограничного слоя. Учитывая, что концентрация примеси изменяется лишь в
пределах диффузионного слоя, плотность диффузионного потока представим в виде:
,
где:
Сн - концентрация примеси в поровом растворе;
Св
- концентрация примеси в воде.
Это
соотношение по форме совпадает с известным числом Нернста.
В
условиях стационарной диффузии, которая имеет место при сохранении градиента
концентраций, уравнение конвективной диффузии упрощается и принимает следующий
вид:
Как
известно, уравнение потока импульса записывается аналогично:
,
где
μ
- динамическая вязкость жидкости.
Правые
части этих двух уравнений представляют собой производные потоков молекулярной
диффузии и потока импульса соответственно. Поток импульса, переносимого
молекулярным трением, равен силе трения на единице граничной поверхности, т.е.
касательному напряжению t:
Порядок
величины касательного напряжения можно оценить как:
,
где:
- средняя скорость потока;
δ - толщина пограничного слоя.
Диффузионный
поток:
,
где:
DС - перепад концентраций;
δ - толщина диффузионного слоя.
Учитывая
аналогию между процессами переноса вещества и импульса, а также приведенное
выше соотношение (3.28) между толщинами диффузионного и динамического слоев
смешения, можно записать, что:
(3.29)
Соотношение
(3.29) позволяет сделать важный вывод о том, что ход обменных процессов между
загрязненными донными грунтами будет существенным образом зависеть от
характеристик течения.
Поскольку
, соотношение (3.29) представим в виде:
,
(3.30)
где
λ
- коэффициент гидравлического
сопротивления.
Выражение
(3.30) позволяет прогнозировать, что в условиях постоянного градиента
концентраций между загрязненным грунтом и водой увеличение скорости течения
приводит к резкому возрастанию интенсивности обменных процессов. Кроме того,
изменение коэффициента гидравлического сопротивления λ, например, в результате производства локальных выемок
грунта из русла может также привести к существенному увеличению диффузионного
потока загрязнений из грунта в воду.
Полученные
соотношения требуют дополнительной проверки в условиях приближенных к натурным.
.2 УЧЕТ
ГИДРОДИНАМИЧЕСКИХ ХАРАКТЕРИСТИК МЕЛКОДИСПЕРСНЫХ ВЗВЕСЕЙ ТЕХНОГЕННОГО
ПРОИСХОЖДЕНИЯ, СОДЕРЖАЩИХ ТЯЖЕЛЫЕ МЕТАЛЛЫ, ПРИ КОНВЕКТИВНОМ ПЕРЕНОСЕ
3.2.1 Факторы, определяющие скорость осаждения мелкодисперсных
частиц техногенного происхождения, содержащих тяжелые металлы
Соединения тяжелых металлов могут адсорбироваться мелкодисперсными
взвесями и переноситься вмести с ней, либо присутствовать в водных объектах в
качестве частиц техногенного происхождения, содержащих соединения тяжелых
металлов. В последнем случае частицы техногенного происхождения могут иметь
специфическую форму, механический состав и плотность, существенно отличающиеся
от характеристик частиц естественного происхождения. Эти факторы влияют на
скорость осаждения взвешенных частиц, которая является характерным параметром
при рассмотрении процессов переноса и осаждения взвесей в водных объектах.
В составе наносов, поступающих в водные объекты с урбанизированных территорий,
доля наносов техногенного происхождения нарастает, что связано с загрязнением
поверхностного стока продуктами износа автомобильных шин и асфальтовых
покрытий, сопровождающимся попаданием в сток различных нефтепродуктов; твердыми
осадками из дымовых выбросов ТЭЦ и промпредприятий, которые смываются
поверхностным стоком и, в конце концов, оказываются в водоеме. Существенная
доля техногенных взвесей поступает с технологическими сточными водами
промпредприятий и во многих случаях дополняется поступлением из недостаточно
очищенных хозяйственно-бытовых сточных вод. Экспедиционные исследования,
выполненные МГСУ на водных объектах Центрального региона России, показали, что
в составе русловых отложений доля наносов техногенного происхождения нарастает
и в пределах урбанизированных территорий достигает 40ч80%.
Техногенные взвеси поступают в водные объекты в пределах городов,
населенных пунктов из ливневой канализации, водовыпусков промпредприятий,
системы водоотведения очистных сооружений, а также с неорганизованным
поверхностным стоком. При этом наиболее крупные частицы взвеси (обычно
песчаные) осаждаются вблизи устьевых участков водовыпусков, в то время как
мелкодисперсные взвеси осаждаются медленно и в течение длительного времени
находятся в водоеме во взвешенном состоянии, участвуя в химических и
микробиологических процессах, влияющих на качество воды.
Анализ взвесей техногенного происхождения в поверхностном стоке, показал,
что в составе взвесей присутствуют частицы различной крупности и формы с сильно
различающейся плотностью и шероховатостью поверхности.
Для шарообразных частиц скорость осаждения w определяется зависимостью:
,
(3.31)
где: ρ, ρт - плотность воды и частицы;ш - диаметр шарообразной
частицы;- коэффициент сопротивления, зависящий от формы частицы и числа
Рейнольдса .
При ReS > 103 в зоне
автомодельности для шарообразных частиц СDa = 0,44.
С учетом решения Стокса,
справедливого при малых числах Рейнольдса, аппроксимационная зависимость для
частиц шарообразной формы имеет вид:
, (3.32)
где первое слагаемое характеризует вклад сопротивления трения.
Для учета влияния формы частицы на ее сопротивление используется параметр
формы f, характеризующий отношение площади поверхности частицы к поверхности
шара, эквивалентного частице по объему:
. (3.33)
Для
частиц естественного и техногенного происхождения величина f изменяется в
достаточно широких пределах:
· окатанные без резких выступов (глина, песок, шамот,
алюмосиликат, свинцовый блеск), f £ 1,2;
· острозернистые, продолговатые (неокатанный песок, антрацит,
искусственный графит), 1,2 < f £ 1,5;
· частицы с резко выраженной продолговатой формой (кокс,
сланец, угольная пыль), 1,5 < f £ 4.
Можно предположить, что при одинаковом весе сопротивление трения частицы
будет увеличиваться с ростом f, и при малых числах Рейнольдса коэффициент
сопротивления частицы произвольной формы можно приближенно определить как:
(3.34)
В
зоне автомодельности по числу Re влияние формы частицы предлагается учитывать
коэффициентом формы:
,
(3.35)
где
Сsa - коэффициент сопротивления реальной (не шарообразной) частицы в зоне
автомодельности.
Анализ
опытных данных разных авторов показал, что связь между величинами f и kф
выражается зависимостью:
(3.36)
Рассматривая
второе слагаемое под радикалом в зависимости (3.32) как комплекс, отражающий
влияние сопротивления трения и сопротивления формы, можно предположить, что с
учетом установленных связей для частиц произвольной формы формула (3.32) может
быть записана в виде:
.
(3.37)
Результаты
исследований сопротивления модельных цилиндрических тел различного диаметра и
длины (рисунок 3.1) показали, что для мелкодисперсных наносов в зависимости
(3.37) преобладает роль первого слагаемого, а при значениях становится
заметной роль второго слагаемого.
Рисунок
3.1. Коэффициент сопротивления несферических частиц взвеси, содержащих тяжелых
металлов, по данным разных авторов.
Следует
отметить, что химический состав исследованных частиц взвеси ограничен, поэтому
предложенная зависимость требует дополнительной проверки. В качестве
методической основы при планировании экспериментов, их выполнении и обобщении
результатов следует использовать (3.37), отражающую основные факторы, влияющие
на коэффициент сопротивления и скорость осаждения частиц.
3.2.2 Мелкодисперсные взвеси техногенного происхождения и их роль в
процессе загрязнения водных объектов и вторичном загрязнении воды
Одним из важнейших факторов, существенно влияющих на прогрессирующую
деградацию водных объектов, является качественное изменение твердого стока,
поступающего с водосборной территории в водные объекты. Эти изменения связаны в
основном с большим количеством мелкодисперсных взвесей техногенного
происхождения, которые вследствие своей чрезвычайно развитой удельной
поверхности способны адсорбировать из воды различные вещества, в том числе
соединения тяжелых металлов.
Как показывают данные исследований ДО в пределах городского бьефа р.
Москвы, являющегося русловым водохранилищем Перервинского гидроузла, доля
мелкодисперсных взвесей (d < 0,1 мм) в их составе изменяется от 40% до 90% и
возрастает по длине водотока. Основным источником мелкодисперсных взвесей
являются поверхностные ливневой и талый стоки с городских территорий, в которых
мелкодисперсные взвеси содержат в своем составе значительное количество
органических и химических загрязняющих веществ. Поступление их в водные объекты
приводит к ухудшению качества воды и формированию загрязненных донных
отложений.
Часть мелкодисперсных взвесей поступает в водные объекты с неочищенными
или частично очищенными производственными сточными водами. Обладая свободной
поверхностной энергией, частицы мелкодисперсной взвеси способны извлекать из
воды различные загрязняющие примеси, т. е. участвовать в процессе самоочищения.
Наблюдения за состоянием дна водных объектов ниже центров урбанизации
позволяют обнаружить характерные признаки его загрязненности на расстоянии в
10-15 км ниже города.
Растворимые в воде вещества по мере поступления в водный объект либо
существуют в виде раствора, либо сорбируются мелкодисперсными взвесями.
Сорбирующая способность мелкой взвеси объясняется, прежде всего, чрезвычайно
развитой их поверхностью. Так, 1 см3 взвеси, измельченной до частиц крупностью
в 10-3 мм, имеет поверхность 6 м2. Существенную роль в процессе сорбции играет
"мозаичная" структура поверхности, неоднородность ее физических и
химических свойств. И.Д. Родзиллер отмечает, что мелкодисперсная взвесь
минерального происхождения может обеспечивать удаление из воды диссоциирующих
электролитов, веществ, находящихся в ионном состоянии, молекул органических
веществ. Как считает В.Т. Каплин, кинетика сорбционного процесса может быть
описана уравнением первого порядка:
, (3.38)
интегрирование которого дает
с
= , (3.39)
где с0 - концентрация загрязняющего вещества в начальный момент времени t
= 0 до контакта воды с сорбирующими частицами;
kc - коэффициент сорбции, зависящий от удельной поверхности сорбента,
способности вещества к сорбции, от скорости обратного перехода с поверхности
сорбента в воду.
Весьма важным обстоятельством является зависимость коэффициента сорбции
от концентрации мелкодисперсной взвеси см:
,
(3.40)
тогда
,
(3.41)
откуда
. (3.42)
Значение kс определяется экспериментально на основе репрезентативных
данных, охватывающих широкий спектр химических соединений, включая тяжелые
металлы.
Таким образом, кинетика процесса сорбции будет существенно изменяться по
мере седиментации взвеси, все более отклоняясь от уравнения первого порядка.
И.Д. Родзиллер считает, что "сорбционное извлечение веществ из воды
является ее очисткой от этих веществ, но не обезвреживанием самого водоема.
Здесь наблюдается перемещение вещества (из растворенного в воде состояния) на
поверхность сорбирующих частиц и вместе с ними на дно водоема".
Консервативные вещества аккумулируются на поверхности дна и под действием
руслового процесса перемешиваются с донными грунтами, загрязняя грунтовый слой
значительной толщины, достигающей 1 м и более.
Неконсервативные вещества, сорбированные взвесями, трансформируются в
процессе разнообразных химических и микробиологических превращений. В
результате таких превращений могут образовываться более опасные продукты, чем
исходные реагирующие вещества. При этом концентрации вновь образующихся
растворимых и легкоподвижных продуктов распада в грунте оказываются значительно
выше концентраций этих веществ в воде. Таким образом, в донных отложениях
создаются источники вторичного загрязнения воды продуктами распада. Вторичное
загрязнение воды происходит также вследствие нарушения сложившегося равновесия
между концентрацией неконсервативных примесей в воде и в поровой воде донных
грунтов. Такое нарушение равновесия может быть следствием гидрологической
ситуации (паводок), либо следствием прекращения сбросов загрязненных стоков,
либо изменением показателя рН, влияющего на степень подвижности соединений
тяжелых металлов. Вторичное загрязнение может заметно ухудшать качество речной
воды в течение длительных периодов времени.
В связи с указанным выше значительным влиянием мелкодисперсных взвесей на
загрязнение водоемов и качество воды, детальные исследования процессов
взаимодействия частиц, особенностей их осаждения и консолидации, а также размыв
и транспортирование их водными потоками составляют основу для прогнозирования
гидроэкологических процессов и разработки инженерных мероприятий по
регулированию водного режима и очистки водоемов на урбанизированных
территориях.
3.2.3 Анализ динамических эффектов в зонах контакта жидкости с
твердыми частицами водонасыщенных донных отложений
Загрязнения, поступающие в водоток, адсорбируются наиболее мелкими
частицами с развитой удельной поверхностью. Поэтому динамика мелкой взвеси в
проблеме охраны водной среды представляет особый интерес. Решение вопросов
формирования и размыва донных отложений, образованных осевшими мелкодисперсными
взвесями, должно основываться на более глубоком понимании динамических эффектов
в зоне контакта жидкости с поверхностью частиц.
Эти эффекты приводят к возникновению сил сцепления, которые в некоторых
случаях могут оказывать существенное влияние на устойчивость мелкодисперсных
грунтов к размыву.
Физико-химическое взаимодействие молекул воды с твердой частицей приводит
к возникновению особенностей в свойствах воды и в характере сил, действующих
между частицами. С современной точки зрения, вокруг твердой частицы (например,
двуокиси кремния SiО2, из которой состоит песок) образуется ДЭС, образующихся
вследствие ионизации твердого вещества и выделения иона водорода из молекул
воды, рисунок 3.2.
Рисунок 3.2. Ионная оболочка взвешенной частицы; 1 - плотносвязанная
вода; 2 - рыхлосвязанная вода; 3 - избыточные ионы водорода.
Диполи молекул воды в диффузном слое и связанные силами притяжения с
частицей находятся в так называемой "потенциальной яме". Для того,
чтобы поднять энергию молекулы связанной воды от уровня "потенциальной
ямы" до уровня энергии молекул свободной воды, необходимо произвести
работу против сил сцепления. Силы сцепления при малой крупности взвеси
становятся соизмеримыми с весом частицы.
Рассмотрим соотношение сил тяжести и сил сцепления для частиц
шарообразной формы.
Проблема учета сил сцепления в механике водонасыщенных грунтов была
впервые поставлена членом-корреспондентом АН СССР Б.В. Дерягиным. Дальнейшее
развитие представлений о силах сцепления показало, что эти силы зависят от физических
свойств взаимодействующих тел, их размеров, температуры и существенно
изменяются в зависимости от расстояния между взаимодействующими телами. Е.М.
Лифшицем была создана теория взаимного молекулярного притяжения тел в вакууме
или в газе, согласно которой энергия притяжения двух пластин:
(3.43)
и сила притяжения:
, (3.44)
где: N - число молекул в единице объема взаимодействующих пластин;
l - расстояние между пластинами.
Теория Е.М. Лифшица была подтверждена качественно и количественно
изящными экспериментами Б.В. Дерягина и И.И. Абрикосовой с кварцевыми стеклами
на воздухе, которые показали, что силы молекулярного притяжения остаются
заметными на расстояниях до 0,5·10-6 м, уменьшаясь с увеличением расстояния в
соответствии с теорией Е.М. Лифшица.
Несмотря на очевидные достижения физической и коллоидной химии, строгая
теория взаимного притяжения частиц в воде до настоящего времени еще не создана.
Более того, нет даже объяснения известному факту возникновения сил сцепления
между частицами в водной среде. Действительно, если две одинаковые частицы
окружены одинаково заряженными ионными оболочками, представляется очевидным,
что они будут лишь отталкиваться. Именно таким взаимодействием ионных оболочек
принято объяснять устойчивость коллоидных систем. Возникновение сил сцепления
между частицами, которое приводит к коагуляции коллоидных систем, связывается с
разрушением двойного электрического слоя вокруг частиц. Разрушение этого слоя
может достигаться под влиянием температуры, механических факторов и в особенности
под воздействием электролитов. По мере изучения двойного электрического слоя
Б.В. Дерягиным и Л.Д. Ландау была создана более общая физическая теория
коагуляции, согласно которой слипание частиц может происходить как вследствие
нейтрализации заряда, так и вследствие сжатия двойного электрического слоя под
действием избытка противоионов до толщины, при которой энергетический барьер
исчезает и частицы слипаются. Однако эти теории не дают объяснения тому, как
возникают силы сцепления между частицами водонасыщенного грунта при отсутствии
добавок электролита. Тем не менее, экспериментальные исследования, выполненные
Ц.Е. Мирцхулава с использованием метода шариковой пробы, указывают на
существование заметных сил сцепления в водонасыщенных песчаных грунтах:
,
Н/м2, (3.45)
где d - диаметр частиц, м.
Предпринятые теоретические оценки в десятки раз расходятся с опытными
значениями сцепления, что указывает на несовершенство расчетных моделей
взаимодействия частиц и вызывает недоверие к обоснованности имеющихся
экспериментальных зависимостей.
Возникновение сил сцепления между частицами при отсутствии электролита
рассмотрим на основе следующей предлагаемой схемы взаимодействия частиц с
двойным электрическим слоем. Схему взаимодействия рассмотрим на примере песчаных
частиц в воде. Принято считать, что молекулы воды вступают в реакцию с
веществом частицы, образуя кремниевую кислоту, которая диссоциирует на
отрицательно заряженные ионы SiO3-2, связанные с частицей, и положительно
заряженные ионы Н+, которые остаются в воде. Поскольку концентрация ионов ОН-
во всех точках рассматриваемой области ниже по сравнению с концентрацией ионов
Н+, то все ионы ОН- будут находиться в связанном состоянии Н+ - ОН-, образуя
диполи воды, ориентированные определенным образом.
Силы отталкивания при дальнейшем сближении вновь сменяются силами
притяжения, поскольку обильно насыщенные ионами Н+ слои вблизи каждой частицы
объединяются в зоне сближения и оказываются в зоне эффективного воздействия
больших отрицательных электрических зарядов самих твердых частиц.
При любом взаимном положении частиц значение и характер силового
взаимодействия будут определяться параметрами электрического поля в окрестности
частиц.
Проиллюстрируем возникновение сил взаимного притяжения в электрически
нейтральной системе из двух отрицательных точечных зарядов и обобщенного
положительного заряда между ними в рамках простой схемы, приведенной на рисунке
3.3. Используя закон Кулона, найдем, что сила отталкивания F0 между
отрицательными зарядами равна:
. (3.46)
Сила притяжения:
. (3.47)
Сила притяжения в этом случае оказывается в восемь раз больше сил
отталкивания. Качественная идентичность этой схемы со схемой взаимодействия
двух частиц, окруженных слоем противоионов, очевидна.
Рисунок 3.3 Схема сил взаимного притяжения в электрически нейтральной
системе из двух отрицательных точечных зарядов и обобщенного положительного
заряда между ними.
Учитывая приемлемый характер количественных оценок, полученных по схеме
взаимодействия диполя с точечным зарядом, используем ее для вычисления сил
сцепления, действующих в водонасыщенном мелкозернистом песчаном грунте. Расчеты
выполним при следующих предположениях.
. Упаковка частиц гексагональная; у поверхностной частицы сила сцепления
формируется в зоне шести "пятен взаимодействия".
. Очертание твердых поверхностей в зоне "пятен взаимодействия"
условно принимается в виде "шар - плоскость".
. Площадь пятна взаимодействия ограничивается, исходя из предельного
зазора dпр = 1,5·10-6 м, установленного
расчетом и проверенного экспериментально.
В отличие от "пятен контакта", которые представляют собой зоны,
заполненные жестко связанной водой, не передающей давления, "пятнами
взаимодействия" будем называть области жидкости вблизи точек контакта по
скелету грунта, в которых действуют силы сцепления между твердыми поверхностями
и жидкостью, заполняющей зазор.
Расчет силы сцепления, действующей между частицами в одном "пятне
взаимодействия", через зазор, заполненный жидкостью, выполним с
использованием известного соотношения для удельной силы, действующей на единицу
заряженной поверхности:
, (3.48)
где:
l = 0,39·10-10 м - плечо диполя;
е = 0,6·10-19 - элементарный заряд;
К
= ;
=
10-20 м2 - элементарная площадка на твердой поверхности, имеющая заряд 2е.
Поскольку
при раздвижке частиц зазор d увеличивается, удельная сила F1
будет уменьшаться. Вычислим среднее значение силы F1 при изменении зазора от
некоторого d до dпр (рисунок 3.4). Зазор d будем характеризовать расстоянием от оси 0-0 до поверхности частицы:
. (3.49)
Рисунок 3.4. К вычислению среднего значения силы F1 при изменении зазора
от некоторого d до dпр.
Интегрируя по площади "пятна взаимодействия", определим силу
сцепления, действующую между частицами в пределах "пятна
взаимодействия":
(3.50)
где:т и dт -
соответственно радиус "пятна контакта" и соответствующая ему
наибольшая толщина слоя плотно связанной воды;в и dпр - соответственно радиус
"пятна взаимодействия" и соответствующая ему толщина слоя связанной
воды.
Учитывая,
что d = (см. рисунок 3.4), найдем значения J1 и J2:
; (3.51)
. (3.52)
Подставляя вычисленные значения интегралов, получаем:
. (3.53)
Учитывая
малость величины , запишем:
. (3.54)
Учитывая,
что при гексагональной упаковке суммарная сила сцепления , и относя действующую
силу сцепления к 1,25pR2 (площади миделя частицы, увеличенной на 25% с целью
учета пористости), получаем следующее выражение для напряжения сцепления в
мелкозернистом водонасыщенном песчаном грунте:
. (3.55)
Принимая
и выражая rт через dт по соотношению , получаем:
(3.56)
Зависимость для sсц,
полученная на основе расчета электродинамического взаимодействия частиц
водонасыщенного грунта, может быть использована для инженерных расчетов и
напряжения сцепления. Принимая К = 37·10-19 Н·м, dпр = 1,5·10-6 м, dт = 50·10-10 м:
,
Н/м3, (3.57)
где R - гидравлический радиус, м.
Или
иначе sсц = 5·10-3 Н/м2.
Это
соотношение в точности совпадает с экспериментальной зависимостью Ц.Е.
Мирцхулава.
Сопоставим
напряжение сцепления sсц с напряжением sт, возникающим в
результате воздействия силы тяжести на частицы грунта. Величину sс определяем следующим образом:
. (3.58)
Тогда:
. (3.59)
Это соотношение показывает, что силы сцепления соизмеримы с силой тяжести
при диаметре частиц, меньших 7.7·10-4 м, что следует учитывать при расчетах
устойчивости мелкозернистых грунтов к размыву.
3.3 ПЕРЕНОС
ТЯЖЁЛЫХ МЕТАЛЛОВ В СОСТАВЕ ВЗВЕШЕННЫХ ЧАСТИЦ В ПРОТОЧНЫХ И НЕПРОТОЧНЫХ ВОДОЁМАХ
3.3.1 Влияние сил сцепления между частицами мелкодисперсной взвеси
на хлопьеобразование и структурирование водного потока
Техногенные и антропогенные факторы, связанные с урбанизацией территории,
приводят к резкому увеличению объемов мелкодисперсных взвесей, поступающих в
водные объекты. Вопрос о механизме осаждения мелкодисперсной взвеси в научной
литературе освещен недостаточно. Отмечается интересный факт (не нашедший
объяснения), что предельное насыщение потока наносами весьма различается при
подаче взвеси извне и при насыщении взвесью за счет размыва дна.
Транспортирующую способность потока, переносящего мелкую взвесь, можно определить,
опираясь на качественные физические особенности такого потока. Одной из таких
особенностей является образование структурированного течения, когда поток в
своей массе движется как единое целое.
С увеличением концентрации частиц мелкой взвеси расстояние между
частицами уменьшается и может стать менее dпр = (1 ч 2) ∙ 10-6 м, что приведет к возникновению сил
притяжения между частицами. Легко найти, что расстояние dт между частицами, равномерно
распределенными в объеме, равно:
dт = . (3.60)
Приравнивая dт =
dпр, можно установить концентрацию сх,
при которой для данного диаметра частиц d будут возникать силы притяжения между
ними, приводящие к хлопьеобразованию и затем к структурированию неподвижной
водогрунтовой смеси. (На структурирование движущейся жидкости, содержащей
мелкую взвесь, будут влиять дополнительные факторы.) На рисунке 3.5 приведены
результаты расчета концентрации хлопьеобразования для частиц различной
крупности в условиях гексагонального распределения частиц в объеме.
Представленные данные показывают, что хлопьеобразование и, возможно,
структурирование водогрунтовой смеси может происходить лишь при весьма высоких
концентрациях с > 0,3ч0,5. Опытные данные по искусственному насыщению потока
мелкой взвесью показывают, что обычно смакс ≈ 0,01, следовательно,
условие хлопьеобразования не может служить основой для определения
транспортирующей способности потока по мелкой взвеси.
Рисунок 3.5. Условие хлопьеобразования и перехода к структурированию
водогрунтовой смеси; 1 - расчет по зависимости (3.29); 2 - зона
хлопьеобразования.
Водогрунтовая смесь, содержащая мелкодисперсные наносы с урбанизированных
территорий, по своим физико-механическим характеристикам приближается к илам
городских очистных сооружений, транспортирование которых по трубам позволяет
обнаружить особенности, присущие бингамовским жидкостям. Обработка данных
позволила установить, что начальное напряжение сдвига tн зависит от концентрации взвеси: tн = 100 н/м2.
При
движении по трубопроводу водогрунтовая смесь начинает вести себя как
структурированная жидкость при уменьшении скорости течения ниже некоторого
предела Vп. Структурированным течением захватывается прежде центральная область
потока с малыми касательными напряжениями. Опыты показывают, что потери напора
при переходе к структурированному течению лишь незначительно превышают напор
начальной подвижки смеси. Учитывая это, запишем: rсм ≤
100с. Принимая rсм = 1500 кг/м3 в условиях структурированного течения,
найдем:
, (3.61)
либо:
,
где
l - коэффициент гидравлического сопротивления.
При расчете по этому соотношению при λ = 0,02 получаются значения Vп,
близкие к результатам измерений в трубах.
Сопоставление концентраций, определенных по соотношению (3.2), с
измеренными предельными концентрациями в опытах С.Х. Абальянца показывает, что
насыщенность потока наносами, приводящая к структурированию, в опытах Абальянца
не достигалась и в среднем была в 2-3 раза меньше.
3.3.2 Модель осаждения мелкодисперсной взвеси, содержащей тяжелые
металлы, в условиях турбулентности
Прогнозирование возможности осаждения частиц мелкой взвеси сопоставлением
гидравлической крупности w с вертикальной пульсационной составляющей скорости
приводит к неверному выводу о том, что осаждение мелкодисперсных частиц в
турбулентном речном потоке даже при весьма малых скоростях течения невозможно.
Однако исследования гранулометрии донных отложений показывают, что частицы
мелкой взвеси составляют значительную долю в общем составе донных отложений,
часто превышающую 50% по весу.
Главная особенность процесса осаждения мелкой взвеси связана с тем, что
размер частиц этого класса меньше толщины вязкого подслоя dвп. Поэтому на заключительную фазу
процесса осаждения определяющее влияние оказывают характеристики течения в
пределах вязкого подслоя.
Вторая особенность состоит в том, что турбулентная диффузия перестает
играть роль фактора, поддерживающего равновесную концентрацию взвеси, и
приобретает роль механизма, поставляющего взвешенные наносы к верхней границе
вязкого подслоя, т. е. способствует осаждению.
Третья особенность заключается в проявлении поверхностных когезионных
сил, возникающих при сближении мелких оседающих частиц с донным грунтом на
расстояние, меньшее dпр
= (1ч2)μ.
Эти силы сцепления
затрудняют повторное взвешивание частиц.
Рассмотрим
схему осаждения частиц мелкой взвеси, предполагая, что турбулентные пульсации
скорости обеспечивают перемешивание частиц мелкой взвеси по всей области
течения (>>W) за исключением вязкого подслоя (рисунок 3.6). При этом
осаждение мелких частиц со скоростью W будет происходить лишь в пределах
вязкого подслоя толщиной dвп. На верхнюю границу подслоя частицы приносятся из
основной толщи потока действием механизма турбулентного обмена. На единицу
площади дна в единицу времени осаждается количество взвеси, равное cw (с -
концентрация взвеси на верхней границе вязкого подслоя). Баланс наносов для
отсека всего потока над единичной площадкой можно представить уравнением:
hdc = - cwdt, (3.62)
где h - глубина потока.
Рисунок 3.6. Схема к расчету осаждения частиц мелкой взвеси.
Решение этого уравнения с учетом начального условия (t = 0, с = с0)
запишется в виде:
. (3.63)
Это уравнение показывает, что осаждение происходит более интенсивно в
зонах потока с меньшей глубиной, что соответствует данным натурных измерений,
указывающим на то, что в прибрежных зонах накопление наносов происходит более
интенсивно. Рассматривая процесс осаждения мелкой взвеси на участке водотока
ниже створа с начальной концентрацией взвеси с0 и принимая остаточное
содержание мелкой взвеси с = 0,05с0, найдем из полученного соотношения, что
соответствующее значение wt/h = 3. Отсюда время осаждения мелкой взвеси равно
Т0 = 3h/w. Расстояние, на котором происходит осаждение мелкой взвеси, равно L0
= T0V, или:
. (3.64)
Выражая V через u* и λ, получаем:
. (3.65)
При
среднем значении = 0,2 имеем:
. (3.66)
Так, например, для частиц крупностью d = 0,01 мм в потоке глубиной h = 3
м и скоростью u = 0,1 м/с время осаждения равно 105 с, а расстояние, на котором
происходит осаждение, составляет 10 км. Натурные исследования, выполненные
лабораторией охраны водной среды МГСУ на реках Волге, Оке, Москве и других,
показали, что загрязненность русла ниже города, поверхностный сток которого
вносит в реку значительное количество загрязненных мелких взвесей,
прослеживается на расстоянии 10-15 км ниже города.
На процесс осаждения мелкой взвеси может оказывать влияние
нестационарность вязкого подслоя. Мощные восходящие токи, возникающие при
разрушении вязкого подслоя, препятствуют падению частиц в этих зонах. Однако
условие неразрывности пульсационного движения определяет поступление в зону
выброса масс жидкости, насыщенных взвесью, которая, казалось бы, должна снова
вноситься в поток восходящими токами. Однако часть мелкой взвеси может
осаждаться и в зоне восходящих токов вследствие проявления когезионных сил
между частицами взвеси и частицами донного грунта при их сближении на
расстояние z < dпр.
Таким образом, придонный слой dпр может активно поглощать из потока мелкие частицы, приближающиеся ко
дну ближе, чем на 2μ.
Интенсивность осаждения частиц в рассматриваемых областях дна
определяется, главным образом, интенсивностью поступления частиц в эти области,
т. е. "поглощение" происходит достаточно быстро. Оценку осаждения
взвеси в зоне восходящих токов произведем, предполагая, что условие
неразрывности пульсационного движения обеспечивается действием как продольных,
так и поперечных пульсаций скорости, создающих пульсационное течение,
компенсирующее "выброс" жидкости из придонной области при разрушении
вязкого подслоя. Учитывая это, примем для оценки средний стандарт пульсаций u′
= u*. Поскольку продольный размер зоны взмыва близок к макромасштабу
вертикальных пульсаций, близкому к h/2, время восстановления мутности в зоне
взмыва будет равно:
tр
= .
Предполагая, что турбулентный массообмен между слоями потока
осуществляется в основном крупными вихревыми структурами, сравним время
восстановления мутности с периодом цепочки крупных вихрей Тс, определяемым по
Гришанину в виде:
Тс
= ,
тогда:
. (3.66)
При среднем значении λ, близком к 0,03, отношение t/Тс ≈
1. Это означает, что за полный период смены турбулентной "обстановки"
на рассматриваемом участке произойдет лишь однократное осаждение взвеси из слоя
dпр = 2μ. Если диаметр частиц взвеси d > 2μ,
осаждение произойдет из
слоя, равного диаметру частиц d. В этом случае интенсивность осаждения взвеси в
зоне восходящих токов и разрушенного вязкого подслоя равна cd/Тс (с -
концентрация взвеси в потоке). Так как в зоне существования вязкого подслоя
интенсивность осаждения взвеси cw, то соотношение интенсивностей осаждения
взвеси в рассматриваемых двух зонах оказывается следующим:
. (3.67)
Это соотношение показывает, что при среднем значении λ = 0,03ч0,04, w ≈ u* и h/d
>> 10 осаждение взвеси на участке восходящих токов можно не учитывать и корректировку
приведенного расчета осаждения взвеси можно не производить.
3.3.3 Условия возникновения и разрушения придонного
стратифицированного слоя, содержащего тяжелые металлы
В тех случаях, когда в водный объект поступает большое количество
мелкодисперсных наносов техногенного происхождения, либо образовавшихся,
например, за счет эрозии почв, стока с городской территории и т. п., поведение
их в водоеме может иметь существенные отличия от поведения наносов
естественного происхождения.
Одно из важнейших отличительных свойств внерусловых наносов заключается в
том, что они поступают в поток извне, и на их размыв поток не должен
затрачивать никакой дополнительной энергии. В этих условиях, согласно данным
Н.А. Михайловой, поток может обладать значительно большей транспортирующей
способностью. Эти особенности внерусловых наносов могут в некоторых случаях
привести к возникновению стратификации (расслоения) в придонной части. При
малых скоростях течения и невысоком уровне турбулентности наносы будут
сосредотачиваться в ограниченной по вертикали области потока вблизи дна, тогда
как содержание наносов в поверхностных слоях будет минимальным. При достаточно
высокой концентрации взвешенные наносы, в свою очередь, будут воздействовать на
турбулентные характеристики потока, уровень турбулентности начнет снижаться,
произойдет дальнейшее увеличение местной концентрации наносов. Таким образом,
этот процесс в конечном итоге приведет к образованию малоподвижного слоя
жидкости повышенной плотности, отделенного от основного потока границей
раздела, т. е. произойдет расслоение потока.
Таким образом, важной физической особенностью потоков, несущих мелкую
взвесь, является их стратификация с образованием границы раздела и
возникновение так называемого придонного мутьевого слоя.
Именно в придонном мутьевом слое мелкодисперсная взвесь техногенного
происхождения в течение длительных периодов времени взаимодействует с водой,
отдавая ей в большей или меньшей степени примеси, в том числе тяжелых металлов,
адсорбированные на поверхности мелких частиц. Именно в придонном мутьевом слое
завершаются седиментационные процессы, приводящие к загрязнению и деградации
водоема. В пределах придонного мутьевого слоя оказывается зона активного
потребления кислорода, извлекаемого из воды. Здесь же размещается и кормовая
база и зона преобладающего существования рыбы и других гидробионтов, которая
оказывается в большей мере, чем основной поток, насыщена твердыми частицами и
диффундирующими в водную массу вредными загрязняющими примесями. В связи с этим
для предотвращения экологической деградации и поддержания водотока в устойчивом
экологическом состоянии необходимо удалять придонный мутьевой слой, что требует
анализа гидравлических условий, позволяющих это выполнить.
Используя подход, развитый Ф.Г. Майрановским, рассмотрим плотностной
(стратифицированный) поток, состоящий из двух жидкостей разной плотности с
границей раздела между ними. Условие устойчивости такого потока может быть
получено из уравнения баланса энергии:
, (3.68)
где:
-
скорость изменения кинетической энергии турбулентности;
-
количество работы, переходящей в кинетическую энергию
турбулентных
пульсаций (диссипативный член);
-
работа сил плавучести;
s - коэффициент,
учитывающий диффузию турбулентной энергии (согласно экспериментам Вебстлера, s ≈ 0,3).
Из уравнения (3.68) непосредственно следует, что:
. (3.69)
Таким
образом, течение устойчиво, то есть возмущение на поверхности раздела не
возрастает со временем ( < 0), если:
, (3.70)
где
Ri = - число Ричардсона.
Число Ричардсона можно связать с так называемым плотностным числом Фруда,
что может быть выполнено, однако, только при известном распределении скоростей
и плотностей в придонном мутьевом слое.
Согласно
оценкам Ричардсона и Прандтля, турбулентность должна затухать при значении
числа Ri = < 1; впоследствии Дж. Тейлор получил в качестве предела
устойчивости условие Ri ≤ Pr, где Pr - турбулентное число Прандтля,
равное отношению коэффициентов турбулентной вязкости и турбулентной диффузии. В
отличие от однородной жидкости, где Pr постоянно и равно примерно 0,7, в
стратифицированном потоке Pr является функцией числа Ричардсона.
Различными
исследователями приводятся другие числовые значения критического числа
Ричардсона. Дж. Тейлор и С. Гольдштейн, впервые применившие для расчета
устойчивости плотностного потока метод малых возмущений, получили в качестве
предела устойчивости Ri = 1/4.
Основываясь
на теории пограничного слоя Толлмина и принимая профиль скорости Блазиуса, Г.
Шлихтинг получил, что при Ri ≥ 1/24 пограничный слой с расслоением плотности
остается устойчивым, причем градиент скорости, входящий в Ri, берется у стенки.
Т.
Эллисон и Дж. Тернер провели изучение движения плотностного потока в наклонной
трубе; исходя из условия, что при Ri > Riкр перемешивание между обеими
жидкостями ничтожно, было найдено экспериментально:
кр
= ,
где:
Н - общая глубина жидкости в трубе;
a - угол наклона трубы к горизонту.
В результате обработки экспериментов по моделированию плотностных потоков
К.Я. Кинд определила устойчивость поверхности раздела двух жидкостей:
Fr
= .
Анализ критериев устойчивости, предлагаемых различными авторами,
показывает, что все они содержат либо число Ричардсона, либо плотностное число
Фруда.
Необходимо отметить, что критерий устойчивости в последней форме
удовлетворяет опытным данным по устойчивости плотностного потока с химической и
температурной стратификацией. Однако до настоящего времени остается
невыясненным вопрос о количественном совпадении условий устойчивости
плотностного потока при механической и др. стратификациях. Как показывают
специальные исследования, некоторое влияние на значение критерия устойчивости
может оказать вязкость более тяжелого слоя. При одной и той же относительной
разности плотностей ∆r/r течение тем более устойчиво, чем
больше разность вязкостей обоих слоев. Как показывают данные экспериментов
Кейлегана, даже при изменении вязкости нижнего слоя на 30% скорость начала
перемешивания между слоями меняется всего на 10%. Таким образом, хотя и имеются
некоторые данные, показывающие возможность замены одного вида стратификации
другим, необходимо дальнейшее исследование для выявления погрешностей,
связанных с такой заменой.
Устойчивость стратифицированного потока на наклонной плоскости
рассматривалась в работе Т.В. Као. В результате численного решения уравнения
Навье-Стокса были получены выражения для критической глубины двухслойного
потока и параметра относительной устойчивости, равного отношению критической
глубины двухслойного потока к критической глубине однородного потока при одном
и том же уклоне.
Многие авторы связывают критерии устойчивости с характеристиками
волнового движения на границе раздела двух сред; Л.Ж. Тисон, в частности,
записывает этот критерий стабильности в виде:
, (3.71)
где: λ - длина волны на поверхности раздела.
Неустойчивость при движении обоих слоев в одном направлении со скоростями
u1 и u2 по Ламбу соответствует условию:
. (3.72)
Анализ устойчивости границы раздела с использованием метода малых
возмущений позволяет в качестве критерия устойчивости принять число Ричардсона
или плотностное число Фруда:
,
где:
∆r = rсм - r - разность между плотностью потока, несущего взвесь,
и плотностью чистой воды;
hв - масштаб возмущений на границе раздела;- скорость обтекания
"внешним" потоком границы раздела;
С - константа.
В связи с отсутствием общепринятого подхода к решению вопроса об
устойчивости плотностного потока предлагается следующая физическая модель,
позволяющая количественно определить условие устойчивости границы раздела
мутьевого слоя с основным потоком и предельную насыщенность потока мелкой
взвесью.
При рассмотрении стратифицированных течений в водоемах масштаб возмущений
hв обычно отождествляют с глубиной h, в качестве скорости V0 принимают среднюю
скорость потока V. В связи с произвольностью этих допущений критическое
значение числа Ричардсона оказывается непостоянным, а изменяется в достаточно
широких пределах.
При рассмотрении мутьевого слоя, медленно движущегося вблизи дна,
источником возмущений границы раздела является турбулентность. Как известно,
масштаб этих возмущений пропорционален глубине потока. Если в качестве
источника возмущений рассматривать пульсацию давления на границе раздела,
вызывающую ее искажение и местный подъем на некоторую высоту (рисунок 3.7),
условие предельного равновесия границы раздела можно записать в виде:
р′ = (rсм
- r)g hв = ∆rg hв.
Учитывая, что вертикальные пульсационные перемещения "ощущают"
присутствие границы на расстоянии 0,2h от нее, примем hв = 0,2h. Поскольку
стратификация возникает вблизи дна, в качестве возмущающего импульса примем максимум
пульсаций донного давления, равный утроенному значению стандарта:
р′
= 3(3r) = 9r.Рисунок 3.7 Схема к расчету
устойчивости границы раздела; 1 - придонный мутьевой слой; 2 - слой чистой
воды; 3 - граница раздела;
4 - изменение плотности.
Тогда
условие существования границы раздела запишется в виде:
.
Из
этого условия может быть найдено предельное значение ∆r/r, приводящее к возникновению стратификации и
образованию придонного мутьевого слоя:
(∆r/r)макс > 45i. (3.73)
Выражение (3.73) показывает, что предельное насыщение потока мелкой
взвесью определяется его гидравлическим уклоном. Переходя от ∆r/r к весовой концентрации взвеси св при rт = 2650 кг/м3, получаем условие
разрушения мутьевого слоя:
св макс < 7,5∙104i. (3.74)
Полученные выше условия существования и разрушения придонного мутьевого
слоя должны быть проверены данными лабораторных и натурных измерений.
3.3.4 Распределение частиц мелкой взвеси, содержащей тяжелые
металлы, в объеме движущейся водной массы
Для прогнозирования экологического состояния водоема и исключения
негативных последствий неконтролируемого распространения загрязнений необходимо
знать поведение мелкой взвеси не только в придонном мутьевом слое, но и во всей
толще водной массы.
Особенности процесса взвешивания и перемещения частиц мелкой взвеси
водным потоком связаны с проявлениями поверхностных эффектов, характерных для
частиц с малой гидравлической крупностью.
При малой гидравлической крупности частицы легко вовлекаются в
турбулентное движение водных масс, и их движение обычно рассматривается на
основе диффузионной теории переноса. Для одномерной задачи уравнение переноса
приводится к виду:
, (3.75)
где:
e - коэффициент турбулентного перемешивания для взвесенесущего потока;
с - объемная концентрация взвеси.
Интегрирование уравнения (3.16) выполнялось В.М. Маккавеевым, М.А.
Великановым и Х. Раузом при различных гипотезах относительно коэффициента
турбулентного перемешивания. Как было установлено Раузом, e в условиях мелкой взвеси не зависит
от концентрации с и не отличается от коэффициента турбулентного перемешивания e для потока чистой воды.
С использованием степенного профиля скорости:
выражение
для e может быть записано следующим образом:
e = . (3.76)
Используя
связь между максимальной и средней скоростью и учитывая выражение:
,
получим:
. (3.77)
Расчеты
по выражению (3.77) при k = 0,4 и n = 0,9 дают значения e, весьма точно согласующиеся с результатами измерений Никурадзе как при
малых, так и при больших числах Рейнольдса. Заметим, что принимая в выражении
(3.77) n = 0, получим выражение для e, совпадающее с тем,
которое было использовано ранее Великановым и Раузом при решении этой задачи.
Первое
интегрирование уравнения (3.75) дает:
. (3.78)
Учитывая, что в уравнении (3.78) левая часть представляет для рассматриваемого
случая полный баланс массы, проходящей через единичную площадку в вертикальном
направлении, константа С1 может быть принята равной нулю. Подставляя e в виде (3.77), запишем:
.
Интеграл
уравнения имеет вид:
, (3.79)
где h = z/h.
Интегрирование этого выражения при изменяющемся параметре n можно
произвести разложением в ряд знаменателя под знаком интеграла. Для оценки
уточнения, даваемого учетом n, выполним интегрирование для более простого
случая n = 1/4 (что соответствует практически наибольшему возможному значению λ ≈ 0,065), при этом получаем:
. (3.80)
Постоянную интегрирования с определим из условия h = 0, с = с0, тогда:
. (3.81)
При сопоставлении результатов расчета по полученному соотношению (3.81) с
известным профилем концентрации Великанова-Рауза:
, (3.82)
(рисунок 3.8) обнаруживаются существенные расхождения, требующие
экспериментальной проверки для условий расчета (λ ≈ 0,065). При меньших
значениях λ расхождения уменьшатся, но все же остаются заметными.
Распределение
концентрации, вычисленное по соотношению (3.81), при граничном условии h0 = 0,05С = с0, отличается от распределения (3.82) значительно меньше,
что указывает на весьма существенное влияние условия на нижней границе. Это
распределение хорошо согласуется с профилем А.В. Караушева в основной толще
потока, за исключением поверхностных слоев, где расхождения остаются
заметными.Рисунок 3.8. Расчетные профили концентраций при =1; 1 - расчет по
зависимости (3.81); 2 - расчет по зависимости (3.80) при h0 = 0; 3 - расчет по зависимости (3.82) при h0 = 0,05; 4 - расчет по Караушеву.
Неравномерность
распределения взвеси по глубине потока можно характеризовать отношением средней
концентрации к с0. Интегрируя наиболее простой профиль (3.82) с применением
разложения в ряд подынтегрального выражения, найдем, оставляя первый ряд
разложения, что:
. (3.83)
Сопоставление расчета по зависимости (3.83) с данными измерений в
русловом водохранилище р. Москве в паводок (рисунок 3.9) показывает приемлемую
сходимость.Рисунок 3.9. Неравномерность распределения взвеси в речном потоке по
вертикали; 1 - данные измерений Re = 4,34·106; 2- данные измерений Re =
5.85·106; 3 - расчет по зависимости (3.63) при k = 0,4; 4 - расчет по зависимости (3.83) при k = 0,38.
Приведенные выше расчетные модели и экспериментальные результаты
позволяют прогнозировать перенос тяжелых металлов в составе взвешенных частиц в
проточных и непроточных водоемах. Для такого прогнозирования должны быть
известны гидравлические характеристики течения в водном объекте, которые могут
быть получены путем экспериментальных и натурных исследований, основанных на
изложенной методологии.
.4 РЕЗУЛЬТАТЫ
ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ ПРОЦЕССОВ АККУМУЛЯЦИИ ДО И ВЫНОСА ИЗ НИХ ТЯЖЕЛЫХ
МЕТАЛЛОВ
3.4.1 Результаты экспериментальных исследований влияния
гранулометрического состава донных отложений на обменные процессы
Экспериментальное исследование обменных процессов между загрязненным
грунтом и водой в условиях покоящейся жидкости производились согласно описанной
выше методике при фиксированных объемах загрязненного грунта и воды. В этих
условиях диффузионные явления приводят к увеличению концентрации загрязняющих
примесей в воде при одновременном уменьшении концентрации загрязнений в грунте.
Диффузионный расход j пропорционален градиенту концентраций и площади контакта
S:
(3.84)
Это
соотношение называется обычно уравнением Нернста. При выполнении лабораторных
экспериментов в связи с ограниченностью использованных объемов грунта и воды
градиент концентрации изменяется как вследствие выравнивания концентраций (Св→Сн),
так и вследствие нарастания толщины диффузионного слоя δд. Поэтому диффузионный поток не остается постоянным
во времени, а медленно затухает и прекращается полностью при выравнивании
концентраций примеси в поровом пространстве и в воде над грунтом. Таким
образом, обменный процесс между загрязненным грунтом и водой в условиях
эксперимента являлся процессом нестационарным. Результаты экспериментального
исследования концентрации примесей в слое воды, находящейся в покое над загрязненным
песчаным грунтом при различной крупности песка приведены на рисунке 3.10.
Анализ данных показывает, что действительно процесс диффузии протекает
нестационарно, постепенно ослабевает во времени и прекращается по истечении 200
часов после начала опыта. Результаты исследований (рисунок 3.10) показывают,
что крупность песка, изменявшаяся почти в 5 раз, не оказывает влияния на
протекание обменного процесса. Этот результат связан, по-видимому, с тем, что
площадь контакта S, входящая в приведенное выше уравнение диффузионного
расхода, остается при изменении d неизменной. Известно, что при форме частиц
близкой к шарообразной и плотной их упаковке, суммарная площадь поперечного
сечения пор не зависит от крупности частиц. Таким образом, этот результат эксперимента,
важный для практических расчетов, согласуется с приведенным выше уравнением
Нернста.
Рисунок
3.10. Результаты экспериментального исследования концентрации примесей в слое
воды, находящейся в покое над загрязненным песчаным грунтом при различной
крупности песка, Ск=757 мг/л.
Исследование
распределения концентраций по глубине покоящегося слоя жидкости (рисунок 3.11)
показало, что в пределах этого слоя концентрация изменяется от максимальной
вблизи границы раздела до минимальной на верхней границе диффузионного слоя.
Распределение концентрации в воде удовлетворительно аппроксимируется следующей
зависимостью:
(3.85)
где:
Ср
- концентрация на границе раздела ДО - вода;- интеграл ошибок (табулирован).
Рисунок
3.11. Исследование распределения концентраций по глубине покоящегося слоя
жидкости.
Сопоставление
экспериментальных данных с расчетом по приведенной зависимости дано на рисунке
3.12. Экспериментальные данные показали также, что толщина диффузионного слоя dд не остается постоянной, а нарастает со временем (рисунок 3.13).
Поэтому использовать приведенное выше уравнение Нернста для расчета изменения
концентрации в условиях эксперимента не представляется возможным, даже если
считать, что коэффициент диффузии Dм остается постоянным. В этом уравнении
оказываются изменяющимися во времени как перепад концентраций Сн - Св, так и
толщина диффузионного слоя δд. Таким
образом, можно представить, что уравнение Нернста в этом случае справедливо
лишь для некоторого мгновенного состояния t во времени:
(3.86)
Соотношение
(4.3) определяет расход примеси через границу раздела в данный момент времени
t. Поскольку, как указывалось, эксперимент производился в условиях
ограниченного объема при анализе процесса диффузии дополнительно к соотношению
(4.3) может быть использовано следующее балансовое соотношение:
, (3.87)
где
Wв и Wн - объем жидкости выше и ниже границы раздела соответственно;н0 -
начальная концентрация загрязняющей примеси в поровом пространстве грунта (по
условиям эксперимента величина известная).
Вследствие
переноса вещества из порового раствора концентрация примеси в воде над грунтом
возрастает:
(3.88)
Концентрация
загрязнений в нижнем слое уменьшается:
(3.89)
Рисунок
3.12. Сопоставление экспериментальных данных с расчетом.
При
этом актуальный перепад концентраций равен:
или:
, (3.90)
где
;
DС0 - начальный
перепад концентраций.
Согласно
(3.86) имеем:
(3.91)
Изменение
толщины диффузионного слоя во времени δД примем согласно экспериментальным данным (рисунок 3.13) в виде:
,
(3.92)
где:
h - толщина слоя воды над загрязненным грунтом;
-
толщина слоя, отвечающая конечной концентрации Ск;
Т
- полный период диффузионного процесса (до выравнивания концентраций);- время
от начала процесса.
С
учетом (3.91) и (3.92) соотношение (3.90) запишется в виде:
Вынося
величины, не зависящие от t из-под знака интеграла, получаем:
,
где
,
или:
, (3.93)
.
Рисунок
3.13. Изменение толщины диффузионного слоя во времени δД. 1 - расчет по зависимости (3.92)
Дифференцируя
соотношение (3.93), получаем:
(3.94)
Дифференциальное
уравнение (3.94) с разделяющимися переменными:
Интегрируя,
получаем:
Постоянную
интегрирования С найдем из начальных условий:
при t=0; .
Для
условий опыта С0 = 0, тогда постоянная интегрирования . Потенцируя, получаем:
(3.95)
или:
(3.96)
Подставляя
в (3.96) выражение для из (3.87), получим:
Преобразуя
это соотношение, получаем:
Учитывая,
что - концентрация раствора после завершения процесса диффузии, имеем
окончательно:
(3.97)
Выражение
(3.97) показывает, что при t= 0; Св(t) = 0; при t → 1; Св → Ск если 2К2≈3,5.
Это
позволяет определить полное время протекания процесса диффузии:
(3.98)
Выражение
(3.98) показывает, что полное время протекания процесса T существенно зависит
от соотношения объемов загрязненной и чистой воды, от толщины слоя воды над
загрязненным грунтом, а также от пористости границы раздела S. Анализ
соотношения (3.98) показывает, что для условий эксперимента полное время
протекания процесса диффузии достигает 700 часов (около 30 суток). За этот
промежуток времени произойдет полное выравнивание концентрации по всему объему.
3.4.2 Диффузия соединений тяжелых металлов из загрязненных донных
отложений в воду
Степень загрязненности донных отложений соединениями тяжелых металлов
может существенным образом влиять на качество воды, особенно в условиях,
приводящих к активации массообменных процессов из отложений в водную массу.
Интенсивность миграционных процессов, ухудшающих качество воды и приводящих к
ее вторичному загрязнению, зависит также от физико-механических свойств донных
отложений и процессов превращения веществ в отложениях, ход которых
определяется химическими и микробиологическими факторами. Исследование этих процессов
и их последствий необходимо для решения вопроса об очистке водотоков и
утилизации донных отложений. В этом случае является важным вопрос о диффузии
тяжелых металлов из загрязненных донных отложений в воду и ухудшении ее
качественных показателей.
Донные отложения в водотоках представляют собой водонасыщенное пористое
тело, сформировавшееся в результате накопления последовательно осаждающихся на
дно частиц различного происхождения, состава и размера. Донные отложения
ограничены сверху поверхностью раздела с водной толщей, а снизу коренными
породами ложа водотока. Донные отложения включают твердые частицы, образующие
скелет пористого тела с неупорядоченной структурой, а также воду, заполняющую
поровое пространство. При этом структура отложений чрезвычайно сложна: наряду с
непористыми минеральными частицами здесь же находятся органические остатки
водной растительности, скопления микроорганизмов и продукты их
жизнедеятельности, а также сообщества водорослей.
Геометрия порового пространства отложений, в котором находятся водные
растворы химических элементов, определяется разнообразием форм и размеров
частиц, а также хаотическим характером размещения элементов структуры скелета
грунта. Отдельные поры связаны между собой поровыми каналами.
Доннные отложения водотоков возможно рассматривать как открытую
неравновесную физико-химическую систему, которая образована совокупностью
некоторого множества твердых и жидких фаз. Жидкая фаза представляет собой
водный раствор, заполняющий поровое пространство отложений. Состав раствора
может изменяться при переходе от одной точки пространства к другой и его
возможно рассматривать как некоторую совокупность жидких фаз.
Поровый раствор связан генетически с водой, захватываемой донными
отложениями в ходе их формирования. При взаимодействии водного раствора с
множеством минеральных фаз, а также при распаде органического вещества
происходит его обогащение одними компонентами и уменьшение концентрации других.
В результате этого в толще отложений и на границе вода - дно возникают градиенты
концентраций химических компонентов, что определяет возможность массообменных
потоков.
Химические процессы в донных отложениях сочетаются с физико-химическими
явлениями, биохимическими, биологическими процессами и сопровождаются
молекулярной диффузией в поровых растворах. Следует подчеркнуть, что
молекулярная диффузия играет ведущую роль в перераспределении растворенного
вещества в толще отложений и в массообмене через границу раздела вода- донные
отложения. В случае, когда концентрация химических элементов в воде меньше, чем
в порах донных отложениях, диффузионный процесс направлен из отложений в воду.
Массоперенос растворенных веществ в донных отложениях происходит в ионной форме
под действием градиента концентраций и описывается дифференциальным уравнением
в частных производных:
, (3.99)
где С - концентрация диффундирующего вещества в единицах массы на единицу
объема пористого осадка;- время процесса;э - эффективный коэффициент диффузии
растворенного вещества в донных отложениях, который выражается следующим
образом:
, (3.100)
Здесь: D - коэффициент молекулярной диффузии вещества;
р - пористость донных отложений;
a - коэффициент извилистости (извилистость) поровых каналов;- координата,
направленная от поверхности границы раздела «вода-донные отложения» в
грунт;(z,t) - функция, описывающая совокупное действие источников (или стоков)
- химических реакций, физико-химических и биологических процессов, влекущих за
собой изменение во времени концентрации рассматриваемого вещества.
Если принять, что источник описывается функцией:
, (3.101)
где К - константа превращения вещества, тогда уравнение (3.99) представим
в виде:
(3.102)
Рассмотрим решение данного уравнения при следующих условиях:
начальное условие:
, (3.103)
граничное условие:
, (3.104)
где hг - толщина донных отложений;
Сг - концентрация вещества в грунте.
Решением уравнения является выражение:
(3.105)
позволяющее определить изменение концентрации загрязняющих веществ по
глубине ДО.
Количество загрязняющего вещества m, поступающего из донных отложений
через поверхность раздела "поровая вода-донные отложения» F за время t,
определяются законом Фика:
(3.106)
Интегрированием
выражения (3.105) по z получим массу вещества, вышедшего в воду из загрязненных
донных отложений конечной толщины hг при наличии источника в виде:
(3.107)
Следует
подчеркнуть, что при отсутствии «источника» дополнительного поступления
загрязняющего вещества в донные отложения, т.е. при К=0 и концентрации вещества
в воде Св=0, будем иметь выражение:
, (3.108)
которое
позволяет оценить поступление вещества в водоток при условии, что диффузионный
фронт переноса вещества не дошел до нижней границы отложений.
Таким
образом, при известных константе превращения вещества, эффективном коэффициенте
диффузии и концентрациях вещества в воде и донных отложениях, можно рассчитать
распределение вещества по глубине (выражение (3.105) и количество вещества,
поступающее из отложений в воду выражение(3.107).
Значение
эффективного коэффициента молекулярной диффузии конкретного вещества в донных
отложениях водоема определяется рядом параметров, которые из-за сложности
строения реальных донных отложений и отсутствия надежной теории учесть не
представляется возможным. Поэтому определяются эмпирические зависимости между
значениями эффективного коэффициента диффузии и пористости с использованием
некоторых коэффициентов, неявно связанных со структурой реальных отложений. Так
А. Лерман и ряд других авторов, предлагают использовать для расчетов следующую
формулу:
,
(3.109)
которая
не имеет строгого физического смысла, однако, она проста и с удовлетворительной
точностью позволяет оценить коэффициент Dэ.
Для
расчета массы вещества, вышедшего из загрязненных донных отложений и прогноза
качества воды были проведены лабораторные исследования по диффузии модельного
вещества по глубине мелкого песчаного грунта.
Исследования
распределения концентрации модельного загрязняющего вещества - хлорного натрия
по глубине грунта (a=0,22 мм) проводились кондуктометрическим методом с
использованием датчиков с электродами из нержавеющей стали. Измерения
проводились как одиночным датчиком, так и блоком, состоящим из четырех
датчиков. Сущность метода основана на зависимости электропроводности раствора
от его концентрации. Поскольку электрическое сопротивление раствора зависит от
его температуры, предварительно определялся температурный коэффициент,
позволяющий привести экспериментальные данные к одной температуре.
Градуировка
измерительных датчиков проводилась следующим образом: измерялось фоновое
сопротивление воды без добавления модельного вещества, затем приготавливался
водный раствор известной концентрации и измерялись его сопротивление и
температура. Это позволило получить зависимость концентрации модельного
вещества от электрического сопротивления раствора в виде:
,
(3.110)
где
С - концентрация модельного вещества, мг/см3.
На
рисунке 3.14 представлены экспериментальные данные по электропроводности
раствора в зависимости от концентрации вещества в растворе и в грунте.
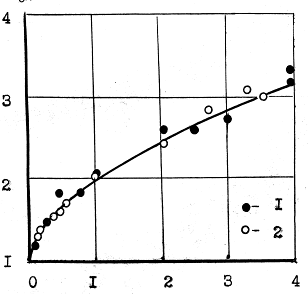
Рисунок
3.14. Экспериментальные данные по электропроводности раствора; 1 - грунт; 2 -
вода.
Эксперименты
по определению коэффициента молекулярной диффузии в грунте - основного
параметра диффузионного процесса проводились на установке, представляющей собой
две цилиндрические стеклянные емкости, соединенные между собой цилиндром
диаметром 30 мм и длиной 15 мм, заполненным модельным грунтом. Емкости
размещались вертикально. Эксперименты проводились в следующей последовательности:
цилиндры устанавливались вертикально, через цилиндр для грунта проводилось
заполнение водным раствором известной концентрации нижней емкости, затем
насыпался грунт, поровое пространство которого также заполнялось раствором.
После этого заполнялся чистой водой верхний цилиндр установки. Через
определенные интервалы времени фиксировались температура и изменение
электрического сопротивления раствора в верхней емкости. По известным
концентрациям растворов и их объемам определялась масса вещества в диффузионном
процессе. Все это позволяло по известному соотношению:
, (3.111)
где:э
- эффективный коэффициент молекулярной диффузии в модельном грунте;- масса
вещества, продиффундировавшая через грунт высотой Dl, пористостью р;
DC - градиент
концентраций вещества за интервал времени Dt;- площадь
поверхности контакта модельного грунта со свободным раствором.
Анализ
опытных данных и расчеты позволили определить средний коэффициент эффективной
молекулярной диффузии в грунте, который равен 0,48 см2/сут (при р=0,4).
Экспериментальные
исследования по изменению концентрации модельного вещества по глубине грунта
под действием молекулярной диффузии проводились на установке, представляющей из
себя цилиндрическую емкость с блоком датчиков, находящихся в грунте. Над
грунтом размещался свободный водный раствор, в котором также измерялось
изменение концентрации загрязняющего вещества. Раствор над грунтом
перемешивался для равномерного распределения модельного вещества по всему
объему и имитации непрерывности его отвода потоком от границы раздела «поровая
вода-донные отложения». Габаритные размеры опытной установки следующие: высота
170 мм, диаметр 150 мм, высота грунта 88 мм. В грунте размещался блок датчиков,
расстояние между электродами которого по вертикали равно 20 мм. Подготовка
установки к производству измерений осуществлялась в следующей
последовательности. Емкость наполнялась водным раствором с известной
концентрацией вещества, затем устанавливался блок датчиков, после этого
насыпался и выравнивался грунт. раствор наливался в количестве достаточном для
заполнения порового пространства грунта. Чистый раствор в емкость подавался
малыми порциями, чтобы не происходило перемещение грунта. После заполнения
установки до определенного объема производилось перемешивание воды и
выполнялись измерения.
В
результате уведенных экспериментов подучены данные по распределению
концентрации модельного загрязняющего вещества по глубине грунта, которые
представлены на рисунке 3.15.
Анализ
результатов показывает, что в начальный момент времени, когда имеется
значительный градиент концентрации вещества между грунтом и водой, происходит
его интенсивный вынос. Поскольку скорость процесса массопереноса конечна, то по
мере движения фронта диффузии в толщу грунта в процесс включаются все новые и
новые слои. К слою грунта, находящемуся на глубине 20 мм, процесс диффузии
приходит за 3 часа, к слою на глубине 40 мм - примерно за 30 часов и, наконец,
к слою на глубине 60 мм - за 90 часов. Процесс массопереноса заканчивается,
когда выравниваются концентрации в свободном водном растворе и в поровых
каналах грунта.
Рисунок
3.15. Распределение концентрации примеси по глубине грунта и в водной массе; 1
- в воде над грунтом; 2 - в грунте (на границе грунт - вода) z=0; 3 - в грунте
z=2 см; 4 - в грунте z=4 см; 5 - в грунте z=6 см.
Полученные
данные дозволяют проверить формулу (3.100) для определения основного параметра
диффузионного процесса - эффективного коэффициента молекулярной диффузии в ДО
Dэ:
(3.112)
Так
для исследованного модельного грунта пористостью 0,4 при извилистости a = 1,2, коэффициенте молекулярной диффузии для свободного раствора D =
1,28 см2/сут при t = 18°С будет иметь:
см2/сут
В
нашем же случае экспериментально установлено значение Dэ=0,48 см2/сут при
t=20°С.
Таким
образом, используя выражение (3.112), можно рассчитать эффективные коэффициенты
молекулярной диффузии для следующих веществ в ДО, имеющих пористость р = 0,5 и a = 1.2:
· CuSO4
см2/сут;
· Ni(NO3)2
см2/сут;
· CoCl2
см2/сут;
· CdSO4
см2/сут;
· LiCl
см2/сут;
· Pb(NO3)2
см2/сут;
· Zn(CH3COO)2
см2/сут;
Анализ опытных данных показывает, что коэффициент молекулярной диффузии
растворенного вещества Dэ в донные отложения уменьшается примерно в три раза по
сравнению с коэффициентом молекулярной диффузии того же вещества в свободном
водном растворе.
Массообмен между водой и проницаемыми донными отложениями связан с
выносом загрязняющих веществ с помощью механизма молекулярной диффузии или
фильтрационным потоком сквозь поровые каналы. Поступление веществ из ДО в воду
приводит к ее вторичному загрязнению.
Анализ полученных экспериментальных данных, а также данных других авторов
показал, что ионы тяжклых металлов, попадая в поток в растворенном виде со
сточными водами, адсорбируются на взвешенных частицах и выпадают в осадок,
образуя малорастворимые соединения. Одним из условий, способствующим процессам
осаждения тяжелых металлов в виде гидроксидов является значение рН водной
среды. Так Pb и кобальт при изменении рН от 7,5 до 9,5 может быть практически
неподвижен, а Zn, Cu и Cd слабоподвижны, в то же время молибден и ванадий
подвижны. Однако водородный показатель не единственный, а один из многих
показателей, влияющих на диффузионные процессы в донных отложениях. При этом,
подвижность металла может зависеть не только от его валентности, но и от вида
соединений, окислительно-восстановительного потенциала и других факторов.
Независимо от химических факторов, значительную роль в массопереносе вещества
играют фильтрационные потоки. В общем случае при наличии фильтрационного
течения, по направлению совпадающего с открытым потоком, перенос вещества в
грунте описывается уравнением:
,
(3.113)
донный отложение металл загрязнение
где:ф
- фильтрационная скорость потока;
-
коэффициент дисперсии (диффузии) вещества в грунте;
-
конвективная составляющая переноса.
Коэффициент
дисперсии представляют в виде:
,
(3.114)
где:
b - эмпирический коэффициент, зависящий от размера
частиц грунта;- показатель степени.
Исследования
конвективной диффузии в однородных песках позволили представить коэффициент в
зависимости от скорости фильтрации uф и проницаемости грунта К в виде:
,
(3.115)
где
A, m1 - эмпирические коэффициенты.
фильтрационный
поток, проходя через толщу грунта, позволяет в течение суток обновить поровой
раствор донных отложений толщиной 1м, сложенных из песка с глинистыми частицами
при скорости фильтрации uф=1 м/сут. При этом следует учитывать, что
лимитирующим процессом вторичного загрязнения воды является молекулярная диффузия
в донных отложениях.
Качество
воды может измениться за счет ее вторичного загрязнения веществами из донных
отложений в условиях, когда проведены мероприятия по прекращению поступления
недостаточно очищенных сточных вод от промпредприятий, объектов сельского
хозяйства и поверхностного стока с урбанизированных территорий, и концентрация
загрязняющего вещества в воде стала меньше, чем в отложениях.
Выполним
оценочный расчет количества загрязняющего вещества, поступившего из придонных
отложений в городском бьефе р. Москвы.
Исходные
данные для расчета следующие: протяженность загрязненного участка водотока
составляет lз=40 км, средняя ширина поверхности загрязненных отложений b=60 м,
ширина водотока В=150 м, глубина потока hcp=3 м, средняя скорость потока u=0,2
м/с, толщина отложений hз=1,5 м. Концентрация вещества (ионов Cu) в грунте
Сг=0,23 мг/л при ПДК=1 мг/л, концентрация в воде Св=0, т.е. имеется
максимальный градиент концентрации загрязняющего вещества. Коэффициент
молекулярной диффузии D=2×10-6 м2/час, пористость отложений р=0,5, извилистость
поровых каналов a=1.2, коэффициент распада загрязняющего вещества в
отложениях К = 0,24 сут-1.
Решение:
1. Определяем время прохождения потоком загрязненного участка русла
реки:
часа.
.
Рассчитывается площадь поверхности загрязненного грунта, через которую идет
массоперенос:
м2.
.
Вычисляется масса примеси, поступившая в воду водотока, по зависимости:
г
Такое
количество загрязняющего вещества выйдет из загрязненных ДО за время равное
55.6 час в воду при максимальном градиенте концентрации вещества (Св=0).
.
Определяется концентрация примеси в воде водотока в конце загрязненного
участка:
г/м3.
3.4.3 Массообменный процесс при смешении притока примеси со спутным
водным потоком
Как известно, турбулентные пульсации скорости определяют рассеяние
примесей в водном потоке. В одномерное уравнение переноса:
(3.116)
входит
коэффициент турбулентной диффузии, который определяется стандартом пульсаций
скорости и лагранжевым масштабом турбулентности.
Анализ
турбулентных пульсаций в водных потоках позволил определить коэффициент
турбулентной диффузии, зависящий от стандарта пульсаций скорости и лагранжевого
масштаба турбулентности:
(3.117)
Полученная
зависимость для коэффициента турбулентной диффузии сводится к выражению:
(3.118)
где
- коэффициент, учитывающий соотношение между глубиной потока и Лагранжевым
масштабом турбулентности. Значение , полученное на основании выполненных
экспериментов и оценок, оказалось близким к 0,12.
С
использованием полученных результатов выполнен расчет смешения вод притока
примеси с основным водным потоком (рисунок 3.16) в рамках плановой задачи, при
которой предполагается, что концентрация консервативных примесей по глубине
потока может приниматься постоянной. При этом уравнение переноса примесей может
быть записано в следующем виде:
(3.119)
где ,
- компоненты вектора скорости в продольном и поперечном направлении
соответственно.
При
расчете смешения потоков с неравномерным распределением скоростей по ширине
потока, связанным с изменением глубины h в основном русле целесообразно ввести
коэффициент дисперсии, учитывающий как турбулентную диффузию, так и
конвективный перенос:
(3.120)
Уравнения
(3.119) и (3.120) показывают, что процесс смешения двух потоков в общем случае
существенно зависит от пространственности течения. Введение коэффициента
дисперсии позволяет использовать в данной расчетной модели упрощенное
двумерное уравнение диффузии.Рисунок 3.16. Смешение вод притока с основным
потоком.
Далее
в рассматриваемом расчете будем предполагать, что в зоне слияния двух потоков
движение происходит в русле при v=0 с постоянной глубиной h и неизменяющейся по
сечению скоростью . При впадении приток оттесняется основным потоком в
прибрежную зону, где сохраняется концентрация примесей, характерная для притока
(см. рисунок 3.16). В результате турбулентного перемешивания по обе стороны от
границы раздела двух потоков образуется зона смешения, в пределах которой
происходит изменение концентрации примесей.
При
этом процесс смешения для указанных выше условий характеризуется следующим
упрощенным уравнением переноса, полученным из (3.119) при :
(3.121)
Граничные
условия для поставленной задачи (см. рисунок 3.16) запишем в виде:
Используя граничные условия, получаем из (3.121) после преобразований, с
учетом того, что:
(3.123)
где
- коэффициент, учитывающий соотношение между глубиной потока и лагранжевым
масштабом, близкий к 0,12:
(3.124)
При
постоянных и h по длине потока решение уравнения (3.124), при граничных
условиях (3.122) имеет вид:
(3.125)
где
- интеграл вероятности для данного аргумента x (функция нечетная,
табулирована).
Изменение
концентрации примеси в пределах зоны смешения двух потоков рассчитанное по
полученной зависимости (3.125) представлено на рисунке 3.17.
Рисунок
3.17. Изменение концентрации примеси в пределах зоны смешения двух потоков.
С
учетом граничных условий (3.122) из решения (3.125) следует, что ширина зоны
смешения может быть найдена как:
(3.126)
Данное
выражение может быть преобразовано к безразмерному виду при следующим образом:
(3.127)
График
изменения ширины зоны смешения двух потоков построенный по выражению (3.127)
как , при приведен на рисунке 3.18.Рисунок 3.18. Изменение ширины зоны
смешения двух потоков.
Расчеты
показывают, что при средних значениях коэффициента λ, ширина зоны смешения двух потоков при удалении от
водовыпуска на расстояние до 1000h может достигать (30-40)h. Эти результаты
согласуются с данными наблюдений по смешению вод р.Яузы с р.Москвой, которое
завершается на расстоянии около 4 км, которое близко к расстоянию от устья
р.Яузы равному 1300h.
4. ОЦЕНКА
ВЛИЯНИЯ ОСНОВНЫХ ФАКТОРОВ НА КОНЦЕНТРАЦИИ ТЯЖЕЛЫХ МЕТАЛЛОВ В ПОРОВОЙ ВОДЕ ДО И
В ТВЕРДОЙ ФАЗЕ
В донных отложениях тяжелые металлы присутствуют в составе порового
раствора (также в виде ионов и комплексов) и в основном - в твердой фазе-
адсорбированные вещества.
Тяжелые металлы, накапливающиеся в донных отложениях в результате
процессов адсорбции и седиментации, не выводятся из биогеохимического цикла
миграции. В результате комплекса постседиментационных процессов, которые
условно подразделяются на абиотические и биотические, возможна активная
ремобилизация металлов, которая приводит к угрозе вторичного загрязнения
водного объекта. Такие условия могут сложиться:
· при понижении рН, что может быть связано с прогрессирующим
загрязнением соединениями серы;
· при понижении обеспечения кислородом придонных слоев водных
масс, в застойных зонах, а также вследствие эвтрофирования;
· при росте поступлений естественных и некоторых синтетических
оранических веществах.
По мере накопления донных отложений происходит их частичное обезвоживание
и разложение значительной доли органических веществ, что сопровождается
миграцией некоторой части тяжелых металлов в поверхностный слой осадков, более
обогащенный водой и органическими веществами.
Выход тяжелых металлов из донных отложений может осуществляться в новых
более токсичных формах, представляя угрозу для жизнедеятельности гидробионтов и
ухудшая качество воды.
Рассмотрим процессы, приводящие к вторичному загрязнению водных объектов
соединениями тяжёлых металлов.
В литературе отмечается, что при прочих равных условиях распределение
тяжелых металлов между ДО и поровой водой зависит от их фракционного состава,
содержания органических веществ, оксидов Fe и Mn, биогенных элементов в составе
донных отложений.
При этом решающую роль на формы нахождения и уровень содержания металлов
оказывают pH водной среды, сульфат-сульфидное равновесие (которое, в свою очередь,
определяется окислительно-восстановительными условиями), содержание азота и
фософора.
4.1 ВЛИЯНИЕ
КИСЛОТНОСТИ НА КОНЦЕНТРАЦИИ РАЗЛИЧНЫХ ФОРМ МЕТАЛЛОВ В ПОРОВОЙ ВОДЕ ДОННЫХ
ОТЛОЖЕНИЙ
После поступления в водную фазу поверхностного водоема растворенные формы
тяжелых металлов в зависимости от физико-химических условий среды могут
образовывать разнообразные неорганические и органические соединения и принимать
различные степени окисления.
Существующий в водном потоке спектр соединений тяжелых металлов для каждого
конкретного поверхностного водоёма определяется возможностью прохождения в нем
процессов гидролиза, полимеризации ионов, а также комплексообразования с
неорганическими и органическими веществами природных вод. В свою очередь
перечисленные процессы контролируются значениями pH и Eh водной среды.
Гидролиз является одним из наиболее важных процессов, определяющих форму
нахождения металла в природных водах. Многие из попадающих в водный объект
соединений тяжелых металлов, гидролизуясь, взаимодействуя с другими ионами,
могут образовывать нерастворимые гидроксиды, фосфаты, сульфиды в интервале pH
природных вод.
Величина pH поверхностных вод обычно варьирует в пределах 6,5 - 8,5, а
изменение окислительно-восстановительного потенциала относительно водородного
электрода сравнения (Eh) - в интервале (+300) - (+550) мВ.
Таким образом, в своем большинстве воды поверхностных водоемов имеют
слабощелочную реакцию, а, существование окислительных условий обуславливает
нахождение в них металлов с переменной валентностью в высоких степенях
окисления и органических веществ.
Зная значения pH, при котором происходит осаждение того или иного металла
из водных растворов в виде гидрооксида, можно прогнозировать тенденцию его
поведения при попадании в речную экосистему.
Так, данные табл. 4.1 показывают, что такие, часто присутствующие в
составе природных вод металлы, как Fe (III), в отсутствии
комплексообразователей могут находиться в воде поверхностных водоёмов в виде
нерастворимых гидроксосоединений даже при существенном подкислении реки кислыми
сточными водами.
Таблица 4.1 Зависимость подвижности тяжелых металлов от изменения
кислотно-щелочных и окислительно-восстановительных условий
|
Подвижность
|
Окислительно-восстановительные
условия
|
Кислотно-основные условия
|
|
Восстановительные
|
Окислительные
|
Нейтрально-щелочные
|
Кислые
|
|
Очень низкая
|
Cr, Mo, V, U, Hg, Cu, Cd,
Pb
|
Cr, Fe, Mn
|
Cr, Hg, Cu
|
|
|
Низкая
|
Ni, Zn, Co, Fe
|
Pb
|
Pb, Fe, Zn, Cd
|
Fe(III)
|
|
Средняя
|
Mn
|
Co, Ni, Hg, Cu
|
Mn
|
Pb, Cu, Cr, V
|
|
Высокая
|
|
|
|
Mn, Cr, Zn, Cd, Hg
|
|
Очень высокая
|
|
|
Mo, V, U
|
|
Отсюда можно сделать вывод, что в отсутствии комплексообразователей,
содержание растворенных форм Fe в водных объектах, будет определяться
произведением растворимости (ПР) их гидроксидов.
Для других тяжелых металлов соотношение растворенных и адсорбированных
форм зависит от реально существующих в водном объекте кислотно-щелочных
условий.
Уже незначительное изменение pH в интервале 6,5-8,5 может привести к
переходу ряда металлов в раствор или наоборот их сорбции в виде нерастворимых
гидрооксидов на поверхности ВВ. При этом транспортируемые водным потоком
взвешенные вещества выступают в качестве естественного коллектора, который
дополнительно способствует выведению тяжелых металлов из раствора.
Растворенные формы тяжелых металлов в отсутствии комплексообразователей
могут находиться в природных водах в виде гидратированных катионов или, в
случае переходных металлов и металлоидов (например, Al, As, Bi, Si, Sb и др.),
входить в состав гидратированных анионов. В зависимости от формы нахождения
(катионная или анионная) концентрация металлов в растворе при варьировании pH
может изменяться по-разному, рисунок 4.1.Рисунок 4.1 Зависимость адсорбции
катионных (В) и анионных (А) форм металлов от рН.
В водных экосистемах с уменьшением pH среды происходит десорбция
катионных форм металлов с поверхности твердых частиц взвешенных веществ или
донных отложений и поступление их в воду. При увеличении pH до определенной
величины растворенные катионные формы металлов адсорбируются на твердых
частицах взвеси или осаждаются в их составе. При дальнейшем увеличении pH за
счет образования гидроксокомплексов растворимость металлов может вновь
возрастать (рисунок 4.1, кривая B). Однако такие высокие pH, при которых
растворимость катионных форм металлов может начать вновь расти, в
незагрязненных и умеренно загрязненных водных экосистемах обычно не
достигаются.
В отличие от катионных форм растворимость анионных форм металлов имеет
противоположно направленную зависимость от изменения pH среды (рисунок 4.1,
кривая А) - при увеличении pH происходит увеличение растворимости, а в кислой
среде анионные формы металлов активно сорбируются или осаждаются в составе
взвесей.
Определяющее влияние на взаимодействие тяжелых металлов с компонентным
составом донных отложений оказывает значение pH условий. Типичные кривые
адсорбции тяжелых металлов на неорганической составляющей донных отложений
(например, на гидроксиде Fe) могут возрастать от 0 до 100% при возрастании pH
на 1 - 2 единицы.
Так, изотермы адсорбции ионов Fe (II) и Mn (II) на оксигидроксидах Fe и
Mn приведены на рисунках 4.2 и 4.3 соответственно.
Подкисление воды может инициировать перевод врастворенное состояние
катионов, адсорбцию анионов на твердых частицах донных отложений (или
взвешеннных частицах), повышение окислительно-восстановительного потенциала
системы, эрозию и вымывание оксидных форм металлов с поверхности частиц
твердого вещества и частичное растворение карбонатных пород, входящих в состав
донных отложений (или взвешенных частиц).
Оценку буферности водных экосистем к снижению pH (подкислению) проводят с
помощью потенциометрического титрования пробы воды с суспензированными в ней
частицами ВВ. Типичная схема кривой титрования системы «вода-донные отложения»
представлена на рисунке 4.4.
Горизонтальные участки AB, CD, EF кривой титрования,
выраженные в единицах объема титранта, сильной кислоты, характеризуют собой
емкостный фактор системы, тогда как вертикальные участки BC и DE отражают
интенсивность изменения значений pH при достижении предельного уровня емкости,
когда буферная способность системы к изменению внешних условий уже
исчерпана.Рисунок 4.2 Изотермы адсорбции ионов Fe (II) на оксигидроксидах Fe.
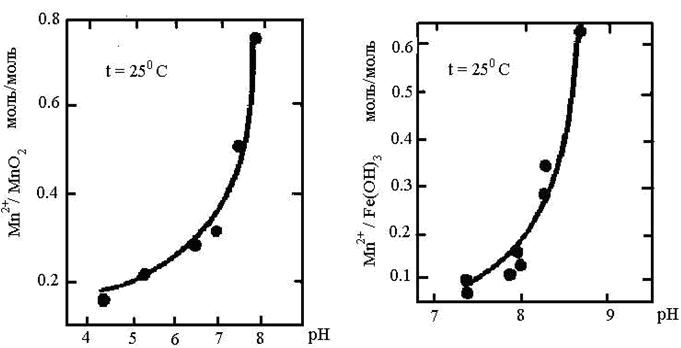
Рисунок 4.3 Изотермы сорбции ионов Mn на оксигидроксидах Fe и Mn.Рисунок
4.4. Схема емкостно-буферирующей зависимости системы ДО-ПВ от рН.
Так, на участке AB добавление кислоты приводит к замене ионов кальция на
ионы водорода в CaCO3, что приводит к переходу в раствор ионов Са+2. До тех
пор, пока СаСО3 присутствует в составе взвешенных частиц и донных отложений,
при добавлении кислоты значение pH остается неизмененным.
Между точками B и C обменные центры СаСО3 глинистых минералов взвешенного
вещества и донные отложения полностью исчерпаны, и дальнейшее добавление
кислоты понижает значение pH до тех пор, пока не начинается процесс растворения
частиц гидкроксида Al (участок CD). Благодаря избытку Al, буферная способность
глинистых материалов сопротивляться процессу подкисления системы довольно
высока, что отражается в значительной протяженности участка CD.
Когда резерв гидроксида Al будет исчерпан, pH системы вновь понижается до
тех пор, пока растворение гидроксида Fe не начнет противостоять дальнейшему его
понижению (участок EF).
Из всей совокупности компонентов минеральной составляющей донных
отложений (карбонатные породы, алюмосиликаты и гидроксид Fe с примесью
гидроксида и оксида Mn) наиболее хорошим сорбентом металлов являются гидроксиды
Mn и Fe.
Осаждение металлов на их поверхности происходит как за счет сорбции, так
и соосаждения.
Оксиды металлов устойчивы к воздействию кислот. До весьма низких значений
pH (рН= 3-4) они могут выступать в роли сорбентов, в то время как другие
минеральные составляющие донного осадка уже исчерпывают свою сорбционную
способность.
Степень влияния гидроксидов Fe и Mn на сорбцию металлов проявляется
значительно больше, чем следовало бы ожидать исходя из их весового вклада в
составе частиц донных отложений.
Это связано со способностью данных природных сорбентов покрывать тонким
слоем поверхность других частиц твердого осадка, что значительно увеличивает их
удельную рабочую сорбционную площадь.
.2 ВЛИЯНИЕ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ УСЛОВИЙ НА КОНЦЕНТРАЦИИ РАЗЛИЧНЫХ ФОРМ МЕТАЛЛОВ
В ПОРОВОЙ ВОДЕ ДО
Окислительно-восстановительные процессы, протекающие при диагенезе донных
отложений, обуславливают перераспределение химических элементов, поступающих со
взвешенным веществом в процессе седиментации. Это, в первую очередь, касается
элементов с переменной валентностью, таких как C, N, O, S, H, Fe, Mn.
Окислительно-восстановительная буферность системы может быть оценена
посредством измерения ее окислительно-восстановительной емкости, которая
определяется всей совокупностью протекающих в различных фазах этой гетерогенной
системы окислительно-восстановительных процессов.
Основные окислительно-восстановительные реакции, которые могут протекать
в системе «донные отложения - поверхностные вещества - придонный слой воды»,
приведены в Таблице 4.2.
Основной вклад в окислительную способность донных отложений вносят
гидроксид Fe (III), ОВ (способное к восстановлению) и, в меньшей степени, оксид
Mn (IV).
Таблица 4.2 Окислительно-восстановительные реакции в системе
«доннные отложения- поверхностные вещества - придонный слой воды»
|
Реакция
|
Фаза
|
|
O2 + 4H+ + 4e- 2
H2OПридонный слой воды
|
|
|
NO3- + 6 H+ + 5e- 1/2 N2 +
3 H2OПридонный слой воды
|
|
|
NO3- + 10 H+ + 8e- NH4+ + 3
H2OПридонный слой воды
|
|
|
MnO2 + 4 H+ + 4e-Mn+2 + 2
H2OДО
|
|
|
Fe(OH)3 +3H+ +e- Fe+2 + 3
H2OДО
|
|
|
SO4-2 + 9H+ + 8e-HS- + 4
H2OПВ + ДО
|
|
|
CH2O +4H+ + 4e- CH4 + H2OПВ
+ ДО
|
|
|
4[O2] + 5[NO3-]+ 2
[Mn(IV)]+[Fe(III)]+8[SO4-2]+4[окисленный C]
|
|
8[NH4+]+2[Mn(II)]+[Fe(II)]+8[S-2]+4[восстановленный
C]
|
Основными акцепторами электронов, определяющими восстановительную
способность донные отложения, являются азот, сера, органический углерод и
кислород. Соотношение составляющих редокс-пары определяет буферность системы к
изменению окислительно-восстановительных условий при внешнем воздействии.
Изменение окислительно-восстановительных условий имеет два основных
следствия:
· происходит изменение степеней окисления тяжелых металлов;
· изменяются их формы нахождения и распределение их в
системе»поверхностные вещества-донные отложения».
По окислительно-восстановительным условиям полный вертикальный профиль
донных отложенини й можно разделить на три основные зоны:
· окислительную (аэробную);
· переходно-восстановительную (умеренно-анаэробную);
· восстановительную (анаэробную).
Верхний окисленный слой осадка характеризуется наличием растворенного
кислорода и высокими значениями окислительно-восстановительного потенциала.
В этом слое при участии аэробной микрофлоры трансформируется до 90 - 95%
ОВ. Этот слой обогащен тяжелыми металлами с переменной валентностью, в первую
очередь Mn и Fe, за счет диффузии из нижних слоев донных отложений их хорошо
растворимых восстановленных форм. Обогащение окисленного слоя осадка данными
переходными металлами происходит за счет их преобразования в окисленном слое
донных отложений в малорастворимые соединения, которые выпадают в осадок и тем
самым способствуют дальнейшей их диффузии из нижних слоев.
В переходно-восстановительной зоне по мере уменьшения растворенного
кислорода происходят различные биохимические процессы: нитратредукция,
железоредукция, марганецредукция с участием соответствующих анаэробных
организмов. Величина Eh в этой зоне варьирует от +100 до -100 мВ относительно
хлорсеребряного электрода сравнения.
В восстановительной зоне, где растворенный кислород отсутствует,
преобладают процессы сульфатредукции и метаногенеза. Величины
окислительно-восстановительного потенциала относительно хлорсеребряного
электрода сравнения для этих процессов составляют от -100 до -200 мВ и <
-200 мВ, соответственно.
По всей глубине залегания донные отложения протекание восстановительных
реакций (за исключением процессов восстановления Mn и Fe) невозможно без
участия микроорганизмов.
Поэтому, параллельно зональной смене химических восстановительных
реакций, в донных отложениях происходит последовательная замена одних штаммов
микроорганизмов другими. Так, аэробные гетеротрофы сменяются денитрификаторами,
затем, последовательно заменяя друг друга, появляются ферментеры,
сульфатредуцирующие и метанредуцирующие бактерии.
Движущей силой всей последовательности восстановительных реакций,
протекающих в толще донных отложений, является процесс биохимического
разложения органических веществ с помощью перечисленных выше
нефотосинтезирующих организмов, в результате которого эти нефотосинтезирующие
организмы получают необходимую для процессов метаболизма энергию.
Схематическая диаграмма биогеохимических процессов в системе «вода-донные
отложения» приведена на рисунке 4.5.
В зависимости от количества органических веществ и скорости его распада
интенсивность протекания восстановительных процессов в донных отложениях может
меняться в широких пределах.
При интенсивно протекающих восстановительных процессах в толще осадка
верхний окислительный слой обычно мал и составляет около 1 см. При сравнительно
низком содержании органических веществ восстановительные процессы развиваются
слабо, и окисленный слой может иметь значительную мощность - вплоть до всей
глубины залегания донных отложений.
Со сменой окислительно-восстановительной зональности в донных отложениях
происходит закономерное изменение форм нахождения металлов. При этом влияние
окислительно-восстановительных условий донных отложений на формы нахождения в
них тяжелых металлов имеет одинаковый характер для природных вод любого типа,
независимо от их химического состава или гидрологического режима.
В окислительном горизонте концентрируются металлы, связанные в соединения
с органическими веществами или входящие в состав аморфных гидроксидов Fe и Mn.
В умеренно восстановленных условиях (Eh = -57 ч+138 мВ) некоторые тяжелые
металлы могут присутствовать в виде карбонатов.
В восстановительных горизонтах, где активно протекают процессы
сульфатредукции, накапливаются сульфидные формы металлов.
Наиболее активным, непосредственно участвующим в обменных процессах с
поровыми и придонными водами является верхний (0-10 см) слой донных отложений.
В зависимости от гидрологического сезона в нем могут преобладать либо
окислительные, либо восстановительные условия, которые, в свою очередь,
определяют формы нахождения тяжелых металлов, а, следовательно, и их
биодоступность для бентосных организмов.
Окислительные условия преобладают в зимне-весеннее время года, когда
понижение температуры воды способствует повышению содержания растворенного
кислорода и замедлению биохимических процессов окисления органических веществ.
В летне-осеннее время при повышении температуры воды за счет понижения
концентрации растворенного кислорода и его интенсивного расходования на
биохимические процессы в поверхностном слое донных отложений могут
устанавливаться восстановительные условия. Смена окислительно-восстановительных
условий влечет за собой либо образование в поверхностном слое донных отложений
сероводорода за счет сульфатредукции, либо его окисление до сульфата.
Это внутригодовое подвижное равновесие противоположно направленных
процессов образования сероводорода и его окисления получило название
сульфат-сульфидного равновесия.
Следствием сульфат-сульфидного равновесия являются сезонные изменения
содержания тяжелых метталов в поверхностном слое донных отложений - накопление
в виде нерастворимых сульфидов при анаэробных условиях летне-осеннего сезона и
высвобождение в поровую воду при их окислении в зимне-весеннее время года.
Илы, отложившиеся на дно в периоды с наличием растворенного кислорода в
придонном слое воды, имеют светлую окраску.
При дефиците кислорода в иле образуются сульфидные соединения, придающие
ему черный цвет.
Состав и строение илов изменяется бактериями и донными животными,
происходит биохимическая минерализация органических веществ с выделением в
поровый раствор донных отложений минеральных форм биогенных элементов (азота,
фосфора, Fe, серы), а в анаэробных условиях - и озерных газов (метан, водород,
аммиак, сероводород).
Вследствие диффузии химических веществ из илового раствора в придонный
слой воды, а также биотурбации верхнего слоя донных отложений организмами
зообентоса, постепенно меняется химический состав водной массы в гиполимнионе.
При полном вертикальном перемешивании вод в водоеме попадающие в
фотический слой биогенные вещества становятся причиной особенно сильных вспышек
цветения водоема.
С течением времени органические отложения в более глубоких слоях
минерализуется вследствие выгнивания органических веществ, образуются
сапропелиты глинистые, кремнеземистые, известковые, переходящие в озерный мел,
и железистые.
Рисунок 4.5 Схематическая диаграмма биогеохимических процессов в системе
вода-ДО.
- фотосинтез, 2 - окислительный метаболизм, 3 - денитрификация, 4 -
марганецредукция, 5 - железоредукция, 6 - сульфатредукция, 7 - метаногенез.
При участии железобактерий образуются железистые конкреции
преимущественно шарообразной формы (в Карелии известно более 150 рудоносных
озер). Известковые отложения образуются в озерах с жесткой водой в результате
кристаллизации и биоседиментации СаСО3.
4.3 ВЛИЯНИЕ
ГРАНУЛОМЕТРИЧЕСКОГО СОСТАВА
Взвешенные вещества и донные отложения водоёмов и водотоков - чрезвычайно
сложная сорбционная система, поскольку включает в себя большое количество
минеральных и органических соединений, способных сорбировать ионы и соединения
тяжелых металлов.
При прочих равных условиях процесс сорбции металлов на природных
сорбентах определяется физико-химическими свойствами взвешенных везеств (или
донных отложений), где наиболее важное значение имеют дисперсность частиц.
Одним из наиболее важных параметров, влияющих на адсорбционную
способность донных отложений относительно ионов тяжелых металлов, являются
размеры частиц, определяющие площадь удельной поверхности частиц. Так,
корреляционный анализ связи концентраций тяжелых металлов с размерами частиц
донных отложений р. Белая показал, что коэффициенты корреляции имеют
положительные значения для частиц < 0,25 мм.
Хорошо адсорбируются: Fe (r = 0,99), Cu (r = 0,69), Zn (r = 0,93), Mn (r
= 0,45), что означает что частицы ила и глинистых веществ - основной
коагулирующий и осаждающий материал для этих тяжелых металлов.
Гранулометрический состав, характеризующий степень дисперсности осадков,
служит надежным индикатором среды осадконакопления и поэтому изучения его во
многом способствует проведению ландшафтно-динамического районирования.
По размеру слагающих частиц донных отложений делятся на несколько типов.
При описании донных отложений озер используют преимущественно классификацию
осадков Н.М. Страхова, водохранилищ - классификацию осадков М.В. Кленовой,
Таблица 4.3.
Таблица 4.3 Классификации осадков в водоемах
|
по М. В. Кленовой
|
по Н. М. Страхову
|
|
ДО
|
Количество частиц
размером< 0,01 мм, %
|
Тип отложений терригенных
осадков
|
Ср. диаметр частиц, мм
|
|
Песок
|
< 5
|
Пески
|
> 0,1
|
|
Илистый песок
|
5-10
|
Крупноалевритовые илы
|
0,1-0,05
|
|
Песчанистый ил
|
10-30
|
Мелкоалевритовые илы
|
0,05-0,01
|
|
Ил
|
30-50
|
Глинистые илы
|
< 0,01
|
|
Глинистый ил
|
> 50
|
|
|
Помимо терригенных алевритовых илов и глинистых илов в классификации
Н.М.Страхова выделяются осадки хемогенные: карбонатные, кремнистые и биогенные,
обогащенные органические вещества (если в химическом составе осадков содержится
соответственно СаСО3, SiО2 и ОВ 10% и более).
Крупность донных отложений благодаря их трансседиментации убывает от
берегов к центральной части озера или водохранилища: галечниково-песчаные, нередко
с валунами, на глубине 2-3 м сменяются илисто-песчаными и ракушечником, а в
профундали залегают илы.
Эта зональность озерных отложений может нарушаться местными условиями
осадконакопления. По мере заиления водоема рельеф его ложа выравнивается из-за сползания
полужидкого верхнего слоя ила в донные понижения.
Распределение тяжелых металлов в системе вода - взвешенные вещества
определяется процессами сорбции (десорбции), контролирующими массообмен между
компонентами этой системы. Поверхностная адсорбция тяжелых металлов в
значительной степени зависит от гранулометрического и композиционного состава
донных отложений.
Многими авторами было показано, что на содержание тяжелых металлов в
донных отложених и взвешенных веществах решающее значение оказывает дисперсность
последних. Как правило, содержание металлов в различных гранулометрических
фракциях донных отложений и взвешенных веществ увеличивается с уменьшением
размера фракций. Эту закономерность объясняют увеличением удельной площади
поверхности частиц с уменьшением размера фракций. Тем самым удельное увеличение
в составе взвешенных веществ реки мелких фракций будет способствовать выведению
тяжелых металлов из водного раствора и увеличению их сорбции на поверхности
материала взвеси.
Наибольшую опасность, с точки зрения переноса, представляют донные
отложения с размером частиц < 0,25 мм.
При изменении гидродинамических условий они могут вовлекаться в поток
воды и транспортироваться, в виде взвешенных частиц, на значительные
расстояния.
Влияние композиционного состава взвешенных частиц (донных отложений ) на
извлечение тяжелых металлов из водного раствора определяется его влиянием на
глубину протекания сорбционных процессов. Повышенная, относительно карбонатов и
алюмосиликатов, способность гидроксидов Fe и Mn сорбировать на себе другие
металлы является важным фактором, определяющим переход тяжелых металлов из
растворенных форм во взвешенные или осажденные в теле донных отложений.
Удельная концентрация гидроксида Fe в составе взвешенныхчастмц и донных
отложений может изменяться в широких пределах и достигать достаточно высоких
значений: 0,3-3,5% для донных отложений и 2-10% для взвесей.
Соответственно, в зависимости от концентрации Fe, в широких пределах
могут изменяться и концентрации других, адсорбированных на оксидах Fe,
металлов.
Например, было показано, что при аэробных условиях в донных отложениях
Средней и Нижней Оби, распределение As, Cd, Co, Hg, Mn, Pb и Zn между мелкой и
крупной фракциями контролируется содержанием в них Fe.
При этом, обычно наблюдаемая обратная корреляция между гранулометрическим
составом донных отложений и концентрацией металлов может быть нарушена.
Повышенные содержания металлов на крупной фракции донных отложений авторы
объясняют их объемной абсорбцией в рыхлой, с развитой, как у губки,
поверхностью структуре Fe(OH)3, которая тонким слоем может покрывать
поверхность крупных фракций твердого осадка.
4.4 Влияние содержания общего азота
Важным моментом в функционировании любой водной системы является
присутствие в ней азота. Азот служат одной из основных причин эвтрофирования
водоемов.
Биогенная нагрузка и процессы эвтрофирования связаны с количественными
характеристиками потоков биогенных веществ (в первую очередь фосфора и азота),
которые изменяются под влиянием хозяйственной деятельности. Основными
составляющими приходной части баланса азота в водохранилищах являются
поступления от размыва пород береговой зоны, вынос с земель
сельскохозяйственного назначения, поступление в составе речного стока и из
вышерасположенного водоема, с промышленными и хозяйственно-бытовыми стоками,
сбрасываемыми непосредственно в водохранилища, с атмосферными осадками,
выпадающими на зеркало водохранилищ.
По данным основной вклад в окислительную способность донных отложений
вносят гидроксид Fe (III), органические вещества (способное к восстановлению)
и, в меньшей степени, оксид Mn (IV). Основными акцепторами электронов,
определяющими восстановительную способность донных отложений, являются азот,
сера, органический углерод и кислород.
При этом все компоненты, определяющие окислительную способность системы
(см. Таблицу 4.2), имеют свою редокс-пару из компонентов, определяющих ее
восстановительную способность. Соотношение составляющих редокс-пары определяет
буферность системы к изменению окислительно-восстановительных условий при
внешнем воздействии.
Описанные тенденции подтверждает и типизация мелководных участков по
проточности. Ее снижение или отсутствие создает особые условия, при которых
преобладает нестойкое, преимущественно автохтонное органические вещества.
При этом, уменьшение соотношения N:P на закрытых участках мелководий
свидетельствует об усилении эвтрофирующего эффекта, определяющую роль в котором
играет фосфор.
Комплекс специальных экспериментов, проведенных на некоторых озерах
Канады с искусственными добавками азота и фосфора убедительно доказал
определяющую роль этих элементов в процессе эвтрофирования. В настоящее время
среди лимнологов нет сомнений, что в большей части водных экосистем
лимитирующим элементом является либо фосфор, либо азот.
4.5 Влияние содержания общего фосфора
Важным моментом в функционировании любой водной системы является
присутствие в ней фосфора.
Фосфор во внутиводоёмных процессах присутствует в основном в виде солей
ортофосфорной кислоты, которые, как правило, труднорастворимы, что ограничивает
его водную миграцию.
Из водной фазы фосфор легко осаждается и входит в состав
труднорастворимых минеральных фаз с металлами, включая тяжелые металлы, или
захватывается организмами, использующими его в качестве питательного элемента.
Фосфор служит одной из основных причин наряду с азотом эвтрофирования
водоемов.
Исследования показали, что фитопланктон, как живой, так и отмерший,
активно способствует переходу тяжелых металлов из ионных форм в связанные,
значительно понижая токсичность этих металлов.
Необходимо отметить, что высокая самоочистительная способность хорошо
проявляется в слабоэвтрофных, т.е. остающихся сбалансированным в
продукционно-деструкционном и трофическом отношении водоемах. При потере
устойчивости экосистемы на стадии гипертрофии ее способность к самоочищению
резко снижается.
Биогенная нагрузка и процессы эвтрофирования связаны с количественными
характеристиками потоков биогенных веществ (в первую очередь фосфора и азота),
которые изменяются под влиянием хозяйственной деятельности. Так, например, в
водохранилищах Ангарского каскада основными составляющими приходной части
баланса фосфора являются поступления от размыва пород береговой зоны, вынос с
земель сельскохозяйственного назначения, поступление в составе речного стока и
из вышерасположенного водоема, с промышленными и хозяйственно-бытовыми стоками,
сбрасываемыми непосредственно в водохранилища, с атмосферными осадками,
выпадающими на зеркало водохранилищ.
В связывают процесс накопления тяжелых металлов в донные отложения
внутренних водоемов, рек и каналов с достаточно высоким содержанием
фосфат-ионов в водах, которые, связывая тяжелые металлы в труднорастворимые
соединения, приводят к их переходу в донные отложения.
Физико-химические показатели поверхностного слоя донных отложений успешно
применяются и для оценки процессов эвтрофирования водоемов. Результаты
исследований свидетельствуют о том, что в условиях олиготрофных озер
Северо-Запада России значения рН осадков составляют от 5,8 до 7,0, Еh от +10 до
+350 мВ.
Для зон эвтрофирования рН изменяются от 6,6 до 7,8, а Еh -250-+25 до мВ.
Как известно, окислительные условия и нейтрально-слабокислая среда в осадках на
границе вода - грунт обусловливают формирование окисных и гидроокисных
комплексов металлов.
В свою очередь, подобные комплексы обладают высокой сорбционной
способностью по отношению к ортофосфатам. Окислительный слой препятствует
возврату фосфора в водные массы озера.
Однако в зимний период, когда большая часть озера покрыта льдом, на
границе «вода- донные отложения» может возникнуть дефицит кислорода, что
приведет к разрушению сорбционного барьера и произойдет возврат фосфора и
подвижных форм металлов в водную массу.
Поэтому процессы поступления химических элементов из донных осадков в
водные массы наиболее интенсивно будут проявляться в конце зимнего периода,
когда содержание кислорода в поверхностном слое осадков минимальное.
Непосредственно в осадке донных отложений фосфор, например, может,
во-первых, стимулировать биологические процессы.
Во-вторых, в результате процессов растворения и десорбции адсорбированных
молекул адсорбционным материалом донных отложений или же вытеснением ионов
фосфорной кислоты сульфидами из минеральных фаз вернуться обратно в воду и
ускорить процессы эвтрофикации водного бассейна.
Часть фосфора, поступившего в донные отложения совместно с ОВ, при
деструкции последнего может перейти в подвижное состояние. При этом какая-то
часть фосфора отлагается в виде минералов группы вивианита и виде пленок вокруг
обломочных зерен. Другая часть подвижного фосфора вследствие процессов
концентрационной диффузии и конвективного переноса возвращается в водную массу
озера.
Режим фосфора как биогенного элемента тесно связан с интенсивностью
биохимических процессов в озерах. Это касается главным образом эвтрофных озер,
так как в олиготрофных содержание биогенных элементов незначительно.
Источники поступления фосфора многообразны: часть его соединений вносится
в водную толщу из организмов при их посмертном распаде, значительная доля
поступает в водоем при выветривании пород, эрозии дна и хозяйственной
деятельности человека. Загрязнению вод фосфором и связанному с этим явлением
эвтрофированию водоема способствует применение на водосборах фосфорных
удобрений.
Основная часть органического фосфора донных отложений представлена
фосфопротеинами. Бактериальный фосфор может представлять свыше 20% от общего
фосфора илистых отложений. В этом случае сезонная динамика бактериальной
биомассы отложений может быть одним из регуляторов круговорота фосфора на дне
водоема. Поглощение фосфора донными отложеними может доходить до 75 % его
седиментации.
Основная часть фосфора сорбируется глинистой и металлогидроксидной
составляющей донных отложений. Равновесие между сорбированным и растворенным
минеральным фосфором в донных отложениях определяется их сорбционной емкостью.
Для фосфатов большую роль играют окислительно-восстановительные условия среды -
в анаэробных условиях большая доля фосфатов находится в растворе по сравнению с
аэробной.
Некоторыми авторами указывается на то, что образование нерастворимых
фосфатов тяжелых металлов в окислительных условиях речных вод и их последующая
сорбция на взвешенном веществе, является причиной дополнительного перевода
тяжелых металлов из растворенных форм во взвешенные.
Вследствие того, что концентрация растворенного неорганического фосфора,
находящегося в водной фазе преимущественно в виде ионов H2PO4- и HPO42-, может
изменяться в широких пределах - от 0,01 до 0,20 мг/л, в широких пределах может
сказываться его влияние на процесс дополнительной сорбции металлов в виде их
нерастворимых фосфатов на взвешенном веществе реки.
На интенсивность сорбции фосфатов существенное влияние оказывает рН
среды. В условиях нейтральной и слабокислой реакции донных отложений озер
фосфор прочно фиксируется, причем в анаэробных условиях профундали его
поступление обычно на порядок выше, чем в хорошо аэрируемых отложениях
мелководий. В восстановительных условиях профундали озер, при выпадении
сульфидных соединений Fe фосфаты переходят в раствор, обусловливая увеличение содержания
фосфат-инов в придонном слое воды.
Кроме того, при восстановлении трехвалентного Fe происходит освобождение
фосфатов, адсорбированных гидратами окиси Fe. Бактериальный распад органических
веществ в отсутствии кислорода также сопровождается выделением фосфатов в
придонный слой.
Эвтрофирование поверхностных вод вызывает дефицит O2, и в водной толще у
дна происходит восстановление и образование растворенных форм Fe и Mn, которые
поднимаются до слоев, обогащенных O2, где окисляются и переходят в нерастворенную
форму, и опять осаждаются на дно.
На распределение подвижных форм фосфора в донных отложениях оказывает
влияние множество одновременно действующих факторов:
· кислотно-щелочные и оксислительно-восстановительные условия;
· направленность процессов фосфорного обмена между
поверхностными слоями седиментов и водой;
· бионакопление и биотурбация водными организмами и др.
Ремобилизации фосфора из донных отложений и активному вовлечению в водную
миграцию способствует кислая реакция среды осадков, при которой апатитовый
фосфор переходит из твердой фазы в раствор.
Ионы d-переходных элементов (Fe, Сu, Zn, Мn, Ni, Со, V, Сr, Мо и др.),
проявляют высокую способность к реакциям гидролиза и комплексообразования с
ионами фосфорной кислоты, с которыми центральный ион металла легко образует
донорно-акцепторные связи. Ионы Hg+2 образуют большое количество комплексных
соединений с координационным числом 2, 3, 4, 5, 6 и 8. Во всех комплексных
соединениях образующиеся связи Hg (II)-лиганд» имеют ковалентный характер и обладают
весьма высокой прочностью. Наиболее устойчивы комплексы с лигандами,
содержащими атомы галогенов, азота, фосфора, серы, углерода.
Суммируя результаты многочисленных исследований эвтрофирования природных
вод, можно прийти к выводу, что в озерах приоритет отдается фосфору - по
современным оценкам в более чем 80% исследованных водоемов первичное
продуцирование лимитируется этим элементом.
4.6 Влияние общего содержания серы
В литературе отмечается, что существенную роль на формы нахождения и
уровень содержания металлов оказывают pH среды и сульфат-сульфидное равновесие,
которое, в свою очередь, определяется окислительно-восстановительными условиями
донных отложений.
Окислительно-восстановительные процессы, протекающие при диагенезе донных
отложений, обуславливают перераспределение химических элементов, поступающих со
взвешенным веществом в процессе седиментации. Это, в первую очередь, касается
элементов с переменной валентностью, таких как C, N, O, S, H, Fe, Mn.
Способность водных экосистем противостоять изменению
окислительно-восстановительных условий определяется наличием и соотношением в
системе окислителей и восстановителей. Окислительно-восстановительная буферность
в системе «поровая вода- донные отложения» может быть оценена посредством
измерения ее окислительно-восстановительной емкости, которая определяется всей
совокупностью протекающих в различных фазах этой гетерогенной системы
окислительно-восстановительных реакций. Отмечается, что
окислительно-восстановительная буферность системы "поровая вода - донные
отложения " поверхностных водоёмов намного ниже буферности аналогичной
системы порода (почва) - поровая вода подземных вод, болот и почв.
Присутствие серы в материале донных отложений является критически важным
параметром для раcпределения тяжелых металлов в системе «донные отложения
-поровая вода». Накоплению тяжелых металлов в донных отложениях пресноводных
водоемов способствует образование их малорастворимых соединений. Необходимо
указать, что сульфиды (MeS) тяжелых металлов обладают, как правило, наименьшей
растворимостью среди минеральных фаз.
В силу этого, в ряду биохимических процессов, протекающих в донных
отложений, особое значение для тяжелых металлов приобретают те, конечным
продуктом которых является образование сульфид-ионов. В донных отложений
поверхностных водоёмов таким процессом является сульфатредукция.
В целом схема сульфатредукции и образования малорастворимых сульфидов
сводится к следующему - при анаэробных условиях сульфатредуцирующие бактерии,
используя сульфат-ионы, в качестве акцепторов электронов восстанавливают их до
сульфид-ионов, которые осаждают присутствующие в поровой воде донных отложений
ионы тяжелых металлов в донных отложениях в виде прочных малорастворимых
сульфидов.
Схематическая диаграмма образования сульфидов металлов в природных донных
отложений представлена на рисунке 4.6.
Общее уравнение сульфатредукции имеет вид:
(СН2О)106(NH3)16(H3PO4) + 106 H+ + 53 SO42- → 106 CO2 + 16 NH3+ +
53 ΣH2S + H3PO4 + 106 H2O
Первый член левой части уравнения отражает соотношения между наиболее
распространенными химическими элементами в совокупном живом веществе донных
отложений.
В более упрощенном виде уравнение сульфатредукции может быть представлено
в следующей форме:
СН2О + SO42- → 2 CO2 +
S-2 + 2 H2OРисунок 4.6
Схема образования сульфидов тяжелых металлов в донных осадках
Сульфатвосстанавливающие бактерии получают энергию в процессе анаэробного
дыхания, при котором акцепторами электронов служат SO42-, SO32-, S2O32- или S0,
восстанавливаемые до сульфидных форм - H2S, HS-, S2-.
Если в качестве доноров электронов выступают различные органические
соединения: лактат, пируват, малат, фумерат или спирты (этанол, бутанол,
пропанол), то говорят о гетеротрофной сульфатредукции, если молекулярный
водород - об автотрофной. Необходимо указать, что возможность использования ФК
и ГК сульфатредуцирующими бактериями зачастую ограничена: они достаточны сложны
для переработки ферментными системами клеток.
Изучение процессов сульфатредукции в водах различной степени трофности,
солености, обогащенности сульфатами показало, что сульфатредуцирующие бактерии
широко распространены и сосредоточены, в основном, в поверхностном слое донных
отложений, а также на взвешенных частицах или на содержащимся в донных
отложений сульфиде Fe.
Жизнедеятельность сульфатредуцирующих бактерий зависит от ряда факторов:
концентрации растворенного орагнического вещества, наличия сульфат-ионов, рН и
Eh среды. Сульфатредуцирующие бактерии развиваются в широком интервале рН
(4,1-9,9), Eh (-400-115 мВ), температуры (+2-80°С) и солености воды (0-260 г/л). При температурах 5 -
10°С основная часть сульфидов образуется
из серосодержащих органических веществ, тогда как восстановление сульфатов доминирует
при температурах выше 20°С.
Вопрос о том, какой фактор определяет интенсивность процессов
сульфатредукции - содержание SO42- или органическое вещество - остается до сих
пор открытым. Большинство исследователей признает доминирующую роль оргнических
веществ. Так, в работах показано, что в пресных водах интенсивность
сульфатредукции зависит не столько от концентрации растворенных сульфат-ионов,
сколько от их наличия вообще, так как уже при их содержании 30 мкмоль/л процесс
протекает с максимальной скоростью. В пресных водоемах и реках, где содержание
SO42- колеблется от 20 - 50 мг/л и ниже, процесс сульфатредукции может сильно
интенсифицироваться сбросом биогенных веществ промышленного и бытового
происхождения. В указывалось, что со временем концентрация неорганического
фосфора была выше в 2-3.5 раза в осадках, содержащих сульфаты, что приводило к
образованию сульфидов и вытеснению фосфора в раствор.
Существование в поверхностном слое донных отложений внутригодового
изменения окислительно-восстановительных условий влечет за собой смещение в ту
или другую сторону сульфат-сульфидного равновесия. В свою очередь, эти смещения
сульфат-сульфидного равновесия, связанные с трансформацией форм серы
посредством сульфатредукции при анаэробных и окисления при аэробных условиях,
определяют внутригодовые колебания концентрации тяжелых металлов в
поверхностном слое донных отложений и их круговорот в системе «донные
отложения-поровая вода - придонный водный слой».
Внутригодовые изменения концентрации тяжелых металллов в поверхностном
слое донных отложений сводятся к накоплению металлов в виде нерастворимых
сульфидов при анаэробных условиях летне-осеннего сезона и высвобождению в
поровую воду при их окислении в зимне-весеннее время года.
Образование связи между ионами металлов и сульфид-ионами в донных
отложений происходит в соответствии с химическими законами. В равновесной
системе «донные отложения-порорвая вода» происходит поступенчатое осаждение
сульфидов металлов.
Первыми в донных отложениях осаждаются ионы металлов, имеющие наиболее
низкие произведения растворимости MeS, а последними - ионы металлов, имеющие
наиболее высокое значение произведения растворимости.
Отсюда, последовательность осаждения металлов из порового раствора при
смене в слое донных отложений окислительных условий на восстановительные можно
представить в виде убывающего ряда р-функции произведения растворимости их
сульфидов (рПР = -lg ПР):
Ag2S (49,2) > Сu2S (47,6) > Hg2S (47,0) > CdS (27,8) > PbS
(27,2) > >ZnS (23,8) > CoS (20,4) > FeS (17,2) > MnS (9,6).
В обратной последовательности эти металлы будут поступать в поровый
раствор при смене восстановительных условий на окислительные.
Для оценки, какие из присутствующих в донных отложениях металлов на
определяемый момент времени связаны в виде MeS, используется один из четырех
критериев качества «донные отложения - критерии подвижности сульфидов».
Рассмотрим условие:
>
1,
где:
(мкмоль/г)
- сумма сульфидных форм (S2-, HS-);
(мкмоль/г)
- сумма тяжелых металлов в донных отложениях, имеющих ПР сульфидов меньше или
равное ПР сульфида Mn, MnS, или Fe, FeS.
Если
условие выполняется, то все тяжелые металлы в анализируемом слое ДО, включая Fe
и Mn, полностью связаны в сульфиды - MeS.
Если
это условие не выполняется, то с учетом ряда рПР сульфидов рассчитывается,
какие металлы и в каком количестве могут быть связаны с другими лигандами.
При
этом многие исследователи считают, что биодоступность тяжелых металлов в
водоеме напрямую связана с их подвижностью и контролируется процессами,
происхо-дящими в системе «донные отложения - поровая вода».
Биодоступность
является определяющим фактором токсикологического воздействия тяжелых металлов
на водные организмы: токсикологический эффект проявляется лишь в том случае,
если тяжелых металлов для них доступны независимо от уровня содержания этих
металлов в водных экосистема.
Интенсивность
обменного процесса металлов между донными отложеними и поровой водой в наиболее
активном поверхностном слое донных отложений определяется сульфат-сульфидным
равновесием.
В
анаэробных (восстановительных) условиях регулятором подвижности металлов в
донных отложениях выступает сульфидная фракция, так как произведение
растворимости (ПР) MeS значительно ниже, чем ПР других форм нахождения
металлов, таких как гидроксиды, карбонаты, фосфаты или гуматы.
На
основе модельных и натурных экспериментов было показано, что MeS в донных
отложениях является регулирующим фактором в накоплении тяжелых металлов
гидробионтами - аккумуляция тяжелых металлов донными организмами тем ниже, чем
выше содержание S-2 в ДО.
Это
объясняется тем, что при анаэробных условиях вследствие образования
нерастворимых сульфидов концентрация металлов в поровых водах значительно
снижается, и они становятся менее доступными для бентосных организмов.
Таким
образом, подход малой подвижности тяжелых металлов в случае их наличия в виде
сульфидов в донных отложениях широко принят в мире в качестве руководящего
стандарта, например, принят ЕРА.
В
работе изучалось влияния сульфидной фракции донных отложений на процессы
накопления и перераспределения тяжелых металлов в системе «донные
отложения-поровая вода» в поверхностных водах бассейна р. Обь.
Объектами
исследований были выбраны поверхностные воды бассейна р. Обь с различным типом
минерализации. В качестве вод малой минерализации изучались Чемальское
водохранилище и озеро Ая; вод средней минерализации - реки Обь и Барнаулка; вод
повышенной минерализации - водные объекты Кулундинской зоны.
Сделанные
авторами статьи расчеты показывают, что, независимо от величины минерализации,
для донных отложений с анаэробными условиями (озера Ая, Кулундинское, Кучук; р.
Кулунда, Кучук) условие критерия легкоподвижных сульфидов выполняется.
Это
указывает на присутствие в водах элементов Cu, Pb, Cd и Zn в донных отложениях
в виде сульфидов.
Об
образовании сульфидов металлов в донных отложениях свидетельствуют высокие
значения коэффициентов корреляции между концентрациями тяжелых металлов и
сульфид-ионами, Таблица 4.4.
В
качестве меры подвижности тяжелых металлов в донных отложениях может
использоваться коэффициент накопления металлов в поровых водах (Кпв).
Его
расчет проводился по формуле:
Кпв = Спв/Сдо х 100 (%),
где:
Спв - концентрации тяжелых металлов в поровых водах (мкг/г);
Сдо - концентрации тяжелых металлов в донных отложениях (мкг/г).
Таблица 4.4 Коэффициенты корреляции между содержанием тяжелых
металлов и растворенного сульфида в донных отложениях.
|
№ п/п
|
Водный объект
|
Коэффициент корреляции
|
|
|
Cu
|
Pb
|
Cd
|
Zn
|
|
1
|
о. Ая
|
0,99
|
0,75
|
0,96
|
0,68
|
|
2
|
Чемал. вдхр
|
0,17
|
0,18
|
0,10
|
0,01
|
|
3
|
о. Кулундинское
|
0,90
|
0,98
|
0,99
|
0,61
|
|
4
|
о. Кучук
|
0,96
|
0,92
|
0,98
|
0,99
|
|
5
|
р. Барнаулка
|
0,71
|
0,69
|
0,77
|
0,61
|
|
6
|
р. Обь
|
0,26
|
0,24
|
0,02
|
0,05
|
Для донных отложений с восстановительными условиями (оз. Ая и р.
Барнаулка) увеличение содержания тяжелых мкталлов в поровых водах согласовалась
с величинами ПР сульфидов металлов. Так, наибольшая растворимость ZnS
обеспечивает максимальное накопление Zn в поровых водах, малая растворимость
сульфида Cu - минимальное.
В отличие от донных отложений, залегающих в анаэробных условиях, в
окисленных донных отложений Чемальского водохранилища и рек Обь и Барнаулка
подвижность тяжелых металлов контролируется другими связующими фракциями.
Влияние сульфидной фракции донных отложений на подвижность тяжелых
металлов хорошо прослеживается на примере р. Барнаулка, рисунок 4.7.
Видно, что при увеличении концентраций сульфид-ионов значения
коэффициентов накопления невелики, и, наоборот, при снижении концентраций S2- -
значения коэффициентов накопления резко возрастают.
Таким образом, влияние содержания общей серы на распределение тяжелых
металлов между поровой водой донных отложений и твердой фазой донных отложений
можно охарактеризовать следующим образом:
. Для ДО с анаэробными условиями, независимо от степени минерализации
воды, процессы накопления и подвижность тяжелые металлы контролирует сульфидная
фракция донных отложений. Образование сульфидов металлов в донных отложениях
ограничивает подвижность металлов и обуславливает их минимальное поступление в
поровый раствор.
. Для ДО с аэробными условиями залегания накопление тяжелых металлов и их
подвижность контролируется содержанием других компонентов: гидроксидов,
органических веществ.
Необходимо указать, что не смотря на то, что по мнению большинства
исследователей, считающих, что сульфидная фракция донных отложений контролирует
подвижности тяжелых металлов при анаэробных условиях, решение этой прикладной
для геохимии, но фундаментальной для водной экологии проблемы сталкивается с
принципиальными трудностями, связанными с так называемым сульфидным парадоксом.
Впервые о "сульфидном парадоксе" сообщалось в работе, где аномально
высокие концентрации тяжелых металлов были обнаружены в иловых водах
восстановленных донных отложений. Авторы предложили два варианта объяснений
этого факта: существование неизвестной твердой фазы или образование комплексов
металлов с растворенным органическим веществом. В работе при изучении динамики
тяжелых веществ в сезонных изменениях окисленного слоя донных отложениях также
были выявлены аномально высокие концентрации металлов над сульфидным осадком;
расчеты показали, что наблюдаемые концентрации превосходили теоретические для
Zn в 3 раза, для Pb и Cd в 6 раз, для Cu в 14 раз. Авторы предложили иную
гипотезу: повышенные концентрации металлов связаны с крайне малой скоростью
образования твердой фазы сульфидов в донных отложениях при низких температурах.
Рисунок 4.7 Измерение коэффициентов накопления тяжелых металлов - Cu, Cd,
Pb.
А) Изменение коэффициентов накопления Cu в ПВ ДО р. Барнаулка в
зависимости от содержания сульфида.
Б) Изменение коэффициентов накопления Pb в ПВ ДО р. Барнаулка в
зависимости от содержания сульфида.
В) Изменение коэффициентов накопления Cd в ПВ ДО р. Барнаулка в
зависимости от содержания сульфида.
По обобщенным литературным данным, доминирующими в составе пресноводных
донных отложений, в порядке убывания являются: оксидные ≈ органические
> карбонатные > обменные.
Однако представленная последовательность распространенности форм
нахождения металлов справедлива только для донных отложений с окислительными
условиями.
В летне-осенний период года, за счет понижения концентрации растворенного
кислорода и его интенсивного расходования на биохимические процессы в
поверхностном слое донных отложений, окислительные условия могут смениться на
восстановительные.
В этом случае вследствие изменения сульфат-сульфидного равновесия
доминирующими формами нахождения тяжелых металлов в составе донных отложений
будут сульфидные формы.
Следствием сезонной изменчивости форм нахождения тяжелых металлов в
составе донных отложений является сезонная изменчивость их биодоступности,
которая определяется уровнем содержания металлов в поровом растворе.
Так, если при анаэробных условиях (Eh = -150 мВ) из донных отложений в
поровый раствор может перейти только около 2% Cd, а в умеренно
восстановительных условиях (Eh +50 мВ) - около 20%, то при окислительных
условиях (Eh = +500 мВ) в поровый раствор переходит уже около 64% данного
металла .
Таким образом, в одном и том же месте реки, при смене анаэробных условий
донных отложений на аэробные, биодоступность Cd может возрасти более чем в 30
раз.
4.7 Влияние содержания органических веществ
В работе отмечается, что органические соединения естественного
происхождения оказывают большое влияние на сорбционные характеристики донных
отложений. Растворённые в воде органические вещества могут как ингибировать
(ФК), так и ускорять (ГК) процесс адсорбции металлов минеральной взвесью.
Существует мнение, что глины вообще не следует ставить в один ряд с
перечисленными ранее природными сорбентами, поскольку в водоёме они являются только
субстратами. покрытыми оксидами металлов или органические вещества.
Важным классом природных сорбентов являются органические вещества
взвешенных веществ и донных отложений. Взвешенные вещества и донных отложений
водоёмов замедленного стока, особенно высокопродуктивных, содержат значительные
количества органических веществ разного состава и свойств, способных
сорбировать металлы и удерживать их в осадках. Органическое вещество являются
одним из главных факторов, контролирующих сорбцию тяжелых веществ донными
отложениями. Об этом свидетельствует фракционный анализ донных отложений, а
также высокая корреляционная связь между концентрациями тяжелых металлов и
органических веществ в донных отложениях. Необходимо также отметить, что
растворенное органическое вещество, взаимодействуя с ионами тяжелых металлов,
определяют состав сосуществующих форм элементов в природных водах и во многом
контролируют процессы межфазового распределения и фракционирования тяжелых
металлов.
Среди органических веществ взвешенных веществ и донных отложений
наибольшую роль в связывании металлов играют гуминовые кислоты (ГК) - продукт
неполного распада органических остатков. Механизм образования комплексов ГК с
металлами предполагает участие в этом процессе кислотных функциональных групп,
находящихся на границе раздела «осадок - вода» и хелатирующих ионы металлов.
Количественно и качественно установлено, что гумусовые вещества содержат
следующие функциональные группы: аминогруппы -NH2, амидные -CO-NH2 , спиртовые
-СН2-ОН, альдегидные -СНО, карбоксильные -СООН, кетонные -СО-, метоксильные
-ОСН3, фенольные -С4Н5-ОН, хинонные, гидрохинонные.
Гумусовые вещества являются полиэлектролитами, включающими карбоксильные,
фенольные и другие функциональные группы, связанные с углеродным каркасом из
ароматических и алифатических остатков. Причем, соотношения между ГК и ФК в
растворённом органическом веществе, как правило, 3:7.
Карбоксильные группы гумусовых кислот могут связывать металлы в виде
структур, отображенных на рисунке 4.8.
Для оргнических веществ природного и техногенного происхождения, а также
продуцируемых микроорганизмами - аминокислот, белков, нуклеиновых кислот,
ферментов, гидроксамовых кислот характерно образование с тяжелыми металлами
соединений с участием амидных и аминных групп:
К самоочищению природных вод от соединений тяжелых металлов может
приводить также и процесс комплексообразования последних с гуминовыми и ФК с
образованием нерастворимых комплексных соединений. Причём осадок образуется
только при достижении определённых величин соотношения между концентрациями
металла и гуминовой или ФК. С помощью метода ЯМР показано, что с ФК Cu, в
отличие от Mn, образует прочные внутрисферные комплексы.
В работе приведены результаты исследования сорбции ионов Cu и Zn
природным илом в статических и динамических условиях. Сорбция Cu природными ДО
при рН=7,0-7,2 происходит в соответствии с изотермой Лэнгмюра и описывается
уравнением Фрейндлиха с коэффициентами К = 6,3 и 1/n = 0,93. Для Zn К = 4,57,
1/n = 0,9. Установлено наличие прямой зависимости между величиной проточности и
количеством поглощённой меди (r = + 0,84).
Ряд, в который располагаются металлы по степени их связывания с ГК,
совпадает с рядом произведений растворимости соответствующих гидроксидов. Чем
ниже произведение растворимости, тем больше металла переходит в осадок вместе с
гуминовыми кислотами.
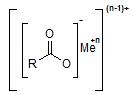
Рисунок 4.8 Схемы взаимодействия ионов металлов с карбоксильными
сорбционными участками ОВ и с азотистыми группами.
Эти данные подтверждают, что в образовании нерастворимых металл-гумусовых
осадков большую (если не основную) роль играют явления адсорбции и коагуляции.
Это подтверждается и расчетом "эквивалентных масс", которые,
особенно в реакциях с Fe (Ш), оказывается слишком низкими.
Массовое отношение C:Fe в Fe-гуматных соединениях достигает 4:1, а в
Fe-фульватных - 2:1, что соответствует атомным отношениям 19:1 и 9:1, то есть
один атом Fe приходится на 19 или 9 атомов углерода.
Состав органоминеральных соединений определяется количеством
функциональных групп и величиной рН водной фазы: при увеличении рН в реакции
взаимодействия вовлекается большее число кислотных групп, а продуктами
взаимодействия все в большей мере становятся гидроксокомплексы или основные
соли. В результате доля металла в составе соединения до начала образования
гидроксидов должна повышаться.
Тяжелые металлы могут быть включены также в состав полифункциональных
сорбентов, в качестве которых выступают взвеси и коллоиды.
Некоторые металлы активно адсорбируются на взвешенных в воде частицах:
концентрация ионов Hg (II) в них могут быть в 105 раз больше, чем в воде.
Поскольку взвеси и коллоидные гидроксиды Fe и Mn (у-MnOOH) часто покрыты
гумусовыми веществами, то в отношении тяжелых металлов имеет место и физическая
и химическая сорбция .
В водной среде процессы комплексообразования выступают в качестве
процессов, конкурирующих гидролизу и осаждению металла в составе взвесей. Если
гидролиз приводит, как правило, к образованию малорастворимых соединений -
гидрооксидов металлов и их основных солей, то комплексообразование, напротив, -
к связыванию ионов металлов в растворимые соединения и удерживанию их в водной
толще речного потока.
Многие металлы при связывании их в прочные комплексные соединения
перестают осаждаться ионами, обычно образующими с ними трудно растворимые
соединения.
Классическими примерами такого рода конкуренции являются переход и
удерживание в растворе ионов алюминия в присутствии ионов фтора и ионов серебра
в присутствии NH3 из осадков, в которых они находились в виде нерастворимых
соединений Al(OH)3 и AgCl.
В природных поверхностных водах, содержащих разнообразные неорганические
и органические растворенные вещества, самой природой созданы условия для
формирования комплексных соединений металлов.
Основными неорганическими комплексообразователями тяжелых металлов в
поверхностных водах являются ионы OH-, HCO3- и Cl-, а также встречающиеся в
муниципальных стоках F-, NH3, SCN-.
Из органических комплексообразователей металлов, в первую очередь,
выделяют алифатические, ароматические и аминокислоты, входящие в состав
растворимых органических веществ природного происхождения - ФК.
Кроме того, выделяют встречающиеся в муниципальных стоках растворимые
органические кислоты - карболовую, бензойную, уксусную, глутаминовую, фталевую,
салициловую и винную.
Многими исследователями отмечается, что в пресноводных системах основным
комплексообразователем тяжелых металлов выступает растворенное органическое
вещество.
Влияние растворенных органических комплексообразователей заключается в
следующем:
· в увеличении растворимости металлов при связывании их в
комплекс;
· в изменении распределения между окисленными и
восстановленными формами;
· в “смягчении” токсичности вследствие уменьшения доступности
металлов для живых организмов;
· во влиянии на способность металлов сорбироваться взвешенными
веществами;
· во влиянии на прочность металлсодержащих коллоидов.
В незагрязненных слабоминерализованных речных водах наиболее часто
встречающимися растворенными формами тяжелых металлов являются:
· Me+naq.;
· MeL (где лигандом L является растворенное органическое
вещество);
· гидроксокомплексы типа Me(OH)n-1, Me(OH)2n-2, Me(OH)3n-3;
· карбонаты MeCO3n-2 и гидрокарбонаты Me(HCO3)n-1.
При этом на количественное соотношение этих форм металлов в воде водоема
оказывает pH воды и концентрация растворенного органического вещества.
Логарифмы констант устойчивостей комплексных соединений Fe типа Fe-ФК (ФК
- фульфат-ион) при рН 3-7 для Fe (II) составляют 4-5, а для Fe (III) 7-9.
Выполненный в работе расчет распределения форм Fe с учетом
комплексообразования с ФК показал, что в высокоцветных водах до 100% Fe(III)
или до 90% Fe (II) связаны в фульватные и гидроксофульватные комплексные
соединения.
При этом отмечается увеличение концентраций Fe (III) в воде с ростом
содержаний ФК и уменьшением рН среды.
Реакции комплексообразования ионов Fe (II, III) с ФК, а также диссоциации
ФК. приведены в Табл. 4.5.
Примером влияния ФК на процесс осаждения Fe является окисление раствора,
содержащего Fe (II) в присутствии различных количеств ФК. Характеристики
исходного раствора: рН-7, Т- 6°С, SO4-2 -10 мг/дм3, Cl- - 20 мг/дм3, Fe(II) - 10 мг/дм3, Na+ - 23
мг/дм3, Са+2 - 40 мг/дм3, CO3-2(сумм.) - 200 мг/дм3. Содержание ФК варьировало
от 0 до 10 мг/дм3. Результаты моделирования отображены на рисунке 4.9.
Таблица 4.5 Реакции комплексообразования ФК с ионами Fe.
|
Реакция
|
lgk
|
|
Fe+2 + ФК-2 → FeФК
|
4,7
|
|
Fe+2 + 2 ФК-2 →
Fe(ФК)2-2
|
8
|
|
Fe+3 + ФК-2 → FeФК+
|
7,1
|
|
Fe+3 + 2 ФК-2 →
Fe(ФК)2-
|
12,5
|
|
Fe+3 + ФК-2 + OH- →
FeФК(OH)
|
20,1
|
|
Fe+3 + ФК-2 + 2OH- →
FeФК(OH)2-
|
30,5
|
|
H+ + ФК-2 → HФК-
|
4,27
|
В присутствии ионов ФК наблюдается повышенное содержание Fe в растворе в
виде комплексов иона Fe+3 с ФК, причем, содержание выше ПДК будет наблюдаться
при содержании ФК уже 5 мг/дм3.
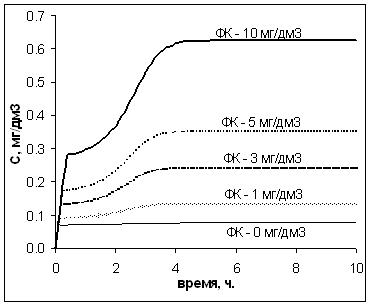
Рисунок 4.9 Влияние ФК на процесс окисления Fe (II).
4.8 Влияние общего солесодержания
Минерализация раствора влияет непосредственно на активность реагирующих
ионов, вследствие того, что активности ионов зависят от ионной силы раствора, I
(уравнение 2.16).
Концентрация растворенных форм тяжелых металлов в поверхностных водах
аридной зоны существенно выше, чем в водах с низкой минерализацией воды. По
мнению большинства исследователей увеличение содержания растворенных форм
металлов по мере повышения солености обусловлено образованием прочных
комплексных соединений с минеральной составляющей вод, что приводит к
удерживанию металлов в водной толще и активизации процессов десорбции их
подвижных форм с поверхности частиц взвешенных веществ и донных отложений.
Удерживанию тяжелых металлов в водной толще способствует также ослабление их
сорбционного обмена со щелочноземельными металлами в составе взвешенных
веществ. При этом отмечается, что увеличение в составе растворенных форм
металлов доли ионных и неорганических форм связано с активизацией процессов
диссоциации органических комплексов металлов, которые обычно преобладают в
составе растворенных форм в слабоминерализованных водах.
Доминирующая роль минеральной составляющей вод в образовании комплексных
соединений с тяжелыми металлами выявлена в природных рассолах.
Для примера в Таблице 4.6 приведены количественные соотношения форм
нахождения тяжелых металлов в водах различной минерализации. Представленные
данные хорошо отражают влияние величины минерализации воды на перераспределение
форм нахождения тяжелых металлов. В водах слабой минерализации основными
формами нахождения металлов являются ионная форма, гидроксокомплексы.
Таблица 4.6 Распределение форм тяжелых металов в водах разной
минерализации.
|
№ п/п
|
Форма
|
Тяжелые металлы
|
|
|
Mn
|
Pb
|
Cu
|
Fe
|
Zn
|
|
Минерализация 150 мг/л
|
|
1
|
Me+2 Me(OH)+ Me(OH)2
|
93
|
65,3
|
3,8
|
86,4
|
-
|
|
2
|
MeSO4
|
0,32
|
0,65
|
0,02
|
0,26
|
-
|
|
3
|
MeHCO3
|
3,43
|
2,25
|
1,8
|
5,31
|
|
|
4
|
Me(HCO3)2
|
0,02
|
0,01
|
0,02
|
0,04
|
|
|
5
|
MeCO3
|
0,16
|
0,10
|
1,7
|
0,59
|
|
|
6
|
MeCl+
|
0,03
|
0,70
|
-
|
0,05
|
|
|
7
|
MeФК
|
3,16
|
31,2
|
60,9
|
7,34
|
|
|
Минерализация 2300 мг/л
|
|
8
|
Me+2, Me(OH)+, Me(OH)2
|
67,8
|
42,1
|
16,9
|
|
-
|
|
9
|
MeSO4
|
22
|
39,1
|
6,43
|
|
-
|
|
10
|
MeHCO3
|
6,54
|
3,74
|
19,9
|
|
|
|
11
|
Me(HCO3)2
|
0,10
|
0,06
|
2,38
|
|
|
|
12
|
MeCO3
|
0,66
|
0,38
|
42,5
|
|
|
|
13
|
MeCl+
|
0,08
|
1,89
|
0,05
|
|
|
|
Минерализация 616000 мг/л
|
|
14
|
Me+2
|
3
|
0
|
0,8
|
1,5
|
0,7
|
|
15
|
MeCl+
|
39,8
|
5,2
|
25,6
|
40,4
|
27,1
|
|
16
|
MeCl2
|
57,2
|
94,8
|
73
|
58
|
72,1
|
. АНАЛИЗ
ЗАРУБЕЖНЫХ И РОССИЙСКИХ МЕТОДОВ ОЦЕНКИ ЗАГРЯЗНЕННОСТИ ДОННЫХ ОТЛОЖЕНИЙ
Одним из наиболее распространенных способов выявления
степени загрязнения среды в Российской Федерации, как и в большинстве
зарубежных стран, является определение количественных значений содержания
загрязняющих веществ в рассматриваемой среде. Нормирование загрязняющих веществ
в природных экосистемах базируется на санитарно-гигиенических принципах и
нормах приоритетности защиты человека, в связи, с чем введено понятие
предельно-допустимой концентрации (ПДК), которая должна устанавливаться с
учетом безопасности для окружающей среды и здоровья человека. По существу ПДК
является пороговой величиной, превышение которой может привести к необратимым
изменениям.
До настоящего времени применение для определения
количественных значений качества донных отложений проводиться либо с
использованием соответствующих критериев для воды, либо ПДК загрязняющих
веществ в почве.
Рассмотрим нормы, критерии и методики оценки
загрязненности водных объектов.
5.1 Оценка загрязненности
водной среды
Уровень (степень) химического загрязнения воды определяется абсолютными
концентрациями загрязняющих (токсичных) веществ (или токсикантов, поллютантов)
в оцениваемом водном объекте.
Концентрации загрязняющих веществ определяют интенсивность их воздействия
на человека и объекты живой природы.
При химическом загрязнении основным агентом загрязнения водного объекта
является то или иное химическое вещество.
Помимо этого в водном объекте выделяются иные виды загрязнений:
· физическое (в водной среде - это обычно тепловое
воздействие);
· биологическое (в том числе, бактериальное);
· радиоактивное (этот особый вид образуется за счет совокупного
действия физических и химических агентов).
По источнику происхождения загрязнение может быть природным и
техногенным.
Принято считать, что наиболее опасные последствия для человека и
окружающей среды связаны с загрязнением водных объектов.
Под загрязнением понимается привнесение в среду или возникновение в ней
новых, обычно не характерных для нее физических, химических или биологических
агентов или превышение естественного среднемноголетнего уровня их концентрации.
По источнику происхождения загрязнение может быть: природным и
техногенным.
Уровень (степень) химического загрязнения воды определяется абсолютными
концентрациями загрязняющих (токсичных) веществ в оцениваемом водном объекте.
Концентрации загрязняющих веществ определяют интенсивность их воздействия
на человека и объекты живой природы (животные и растения).
Исходя из особенностей воздействия химического вещества на человека и
живые организмы было разработано понятие предельно допустимой концентрации
(ПДК).
Кроме ПДК в качестве критерия оценки загрязнения используется также
ориентировочный допустимый уровень (ОДУ) - временный гигиенический норматив,
разрабатываемый на основе расчетных и экспресс - экспериментальных методов
прогноза
ПДК и ОДУ являются наиболее важными показателями, на основе которого
производится экологическая оценка действующих и проектируемых хозяйственных,
коммунальных и иных объектов.
Наряду с ПДК (ОДУ) в экологической оценке качества воды участвуют еще два
показателя:
· класс опасности;
· лимитирующий показатель вредности (ЛПВ).
Классы опасности выделены на основе показателей, характеризующих
различную степень опасности для человека химических соединений, загрязняющих
воду - токсичности, аккумулятивности, способности вызвать различного рода
негативные эффекты, лимитирующего показателя вредности.
Применительно к поверхностным водам не существует одинакового унитарного
понимания термина предельно допустимой концентрации, что связано с
многообразием использования воды, Таблица 5.1.
Таблица 5.1 Принципы определения различных ПДК в воде
|
Водохозяйственное
|
Санитарно-гигиеническое
|
Рыбохозяйственное
|
|
Предельно допустимая
концентрация (ПДК) веществ в воде - концентрация веществ в воде, выше которой
вода непригодна для одного или нескольких видов водопользования.
|
Предельно допустимая
концентрация (ПДК) - максимальная концентрация вещества в воде, в которой
вещество при ежедневном поступлении в организм в течение всей жизни не
оказывает прямого или опосредованного влияния на здоровье населения в
настоящем и последующих по калениях, а также не ухудшает гигиенические
условия водопользования
|
Предельно допустимая
концентрация) вещества в воде рыбохозяйственного водного объекта-
экспериментально установленный рыбохозяйственный норматив максимально
допустимого содержания загрязняющего вещества в воде водного объекта, при
котором в нем не возникают последствия, снижающие его рыбохозяйственную
ценность
|
Наряду с ПДК (ОДУ) в экологической оценке качества воды участвуют еще два
показателя: класс опасности и лимитирующий показатель вредности (ЛПВ). По
классу опасности выделяются:
· 1 класс - чрезвычайно опасные элементы - Hg;
· 2 класс - высокоопасные - Pb, Cd;
· 3 класс - опасные -As, Cu, Co, Ni, Cr, Zn;
· 4 класс - умеренно опасные.
Лимитирующий показатель вредности (ЛПВ) - признак, характеризующий
токсические действие вещества в воде. Выделяют следующие ЛПВ:
· санитарно-токсикологический;
· органолептический (запах, мутность, окраска);
· общесанитарный (для рыбохозяйственных нормативов).
При обнаружении в питьевой воде нескольких веществ, относящихся к первому
и второму классам опасности и нормируемых по санитарно-токсикологическому ЛПВ,
сумма отношений обнаруженных в воде концентраций каждого из них к величине его
ПДК не должна превышать единицу:
Исходя из общего, присущего для приведенных выше определений ПДК ясно,
что экологическая оценка качества воды должна сообразоваться прежде всего с
целями водопользования, Таблица 5.2- 5.3.
В настоящее время в нашей стране существует более двух десятков различных
документов (ГОСТ, СанПиН и др.), регламентирующих содержания в воде различных
веществ с различных позиций пользования водными объектами.
Таблица 5.2 Предельно допустимые концентрации тяжелых металлов в водных
объектах
|
Тяжелые металлы
|
Водные объекты
хозяйственно-питьевого и культурно- бытового назначения
|
Водные объекты
рыбохозяйственного назначения
|
|
ЛПВ
|
ПДК
|
ЛПВ
|
ПДК
|
|
Fe
|
Органолептический
|
0,5
|
-
|
-
|
|
Cu
|
Органолептический
|
1,0
|
-
|
|
As
|
Санитарно-токсикологический
|
0,05
|
токсикологический
|
0,05
|
|
Ni
|
Санитарно-токсикологический
|
0,1
|
токсикологический
|
0,01
|
|
Hg
|
Общесанитарный
|
0,05
|
-
|
-
|
|
Pb
|
Общесанитарный
|
0,1
|
общесанитарный
|
0,1
|
|
Zn
|
Общесанитарный
|
1,0
|
токсикологический
|
0,1
|
Таблица 5.3 Предельно допустимые концентрации (ПДК) некоторых веществ в
воде с различными целями водопользования
|
Тяжелые металлы
|
Едини. измер.
|
Централизованные источники
питьевого водоснабжения
|
Питьевая вода расфасованная
в емкости
|
Рыбохозяйственные нормы
|
|
|
ПДК хозяйственно-питьевое
|
ЛВП
|
Класс опасности
|
|
|
|
Feсумм.
|
мг/ дм3
|
0,3
|
ОРГ
|
3
|
0,3
|
0,005 0,00001
|
|
Hg
|
|
0,0005
|
СТ
|
1
|
|
|
|
Cd
|
|
0,001
|
СТ
|
2
|
|
0,005
|
|
Mn
|
|
0,1
|
ОРГ
|
3
|
0,05
|
0,01
|
|
Cu
|
|
1
|
ОРГ
|
3
|
1
|
0,001
|
|
Mo
|
|
0,25
|
СТ
|
2
|
|
0,0012
|
При оценке экологической оценки качества воды
используют КПДК − коэффициент концентрации по ПДК и коэффициент концентрации,
который используется для экологической оценки качества почв.
КПДК − коэффициент концентрации по ПДК - это
отношение содержания i-го элемента в водном объекте Сi к величине его ПДКi:
Ю.Е. Сает и др. для оценки загрязнения поверхностных
вод используют показатель Кс.
Кс - коэффициент концентрации - отношение содержания
элемента в исследуемом объекте Ci к его фоновому содержанию в соответствующем
компоненте окружающей среды Сфi:
Коэффициент концентрации показывает интенсивность
накопления элемента в воде по отношению к природному фону.
В работе обобщены критерии загрязнения поверхностных
вод КПДК и Кс по уровням загрязнения.
В Таблицах 5.4 - 5.5 представлены критерии загрязнения
поверхностных вод КПДК и Кс, связанные с уровнями загрязнения и экологической
обстановкой территории.
Таблица 5.4 Критерии оценки загрязнения поверхностных вод питьевого
назначения
|
Экологическая обстановка
|
Уровень загрязнения
природных сред
|
Уровень загрязнения
|
Токсичные элементы
|
|
|
|
Кс
|
КПДК
|
|
|
|
|
Класс опасности
|
|
|
|
|
1, 2
|
3
|
3, 4
|
|
Относительно
удовлетворительная
|
Допустимый
|
Минимальный
|
< 4
|
< 1
|
< 1
|
< 1
|
|
Напряженная
|
Умеренно опасный
|
Низкий (слабый)
|
4-8
|
1-1,5
|
1-2,5
|
1-5
|
|
Критическая
|
Опасный
|
Средний
|
8-16
|
1,5-2
|
2,5-5
|
5-10
|
|
Чрезвычайная
|
Высоко опасный
|
Высокий (сильный)
|
16-32
|
2-3
|
5-10
|
10-15
|
|
Экологического бедствия
|
Чрезвычайно опасный
|
Очень высокий (очень
сильный)
|
> 32
|
> 3
|
>10
|
> 15
|
Другой известной комплексной оценкой, используемой преимущественно в
системе Гидрометеослужбы, является индекс загрязнения воды (ИЗВ). Как правило,
рассчитывается по шести-семи гидрохимическим показателям:
ИЗВ = ∑ (С1-6/ ПДК1-6)/6,
где: Сi /ПДКi- относительная (нормированная) среднегодовая концентрация
i-го вещества;
- строго лимитируемое количество показателей - концентрация растворенного
кислорода, водородный показатель pH и БПК5, а так же загрязнители, имеющие
наибольшие относительные среднегодовые концентрации.
В Таблице 5.6 представлены классы воды в зависимости от индекса
загрязнения воды.
Таблица 5.5 Критерии оценки загрязнения поверхностных вод
хозяйственно-бытового назначения
|
Экологическая обстановка
|
Уровень загрязнения
природных сред
|
Уровень Загрязнения
|
Токсичные элементы
|
|
|
|
Кс
|
КПДК
|
|
|
|
|
Класс опасности
|
|
|
|
|
1, 2
|
3, 4
|
|
Относительно
удовлетворительная
|
Допустимый
|
Минимальный
|
< 4
|
< 1
|
< 1
|
|
Напряженная
|
Умеренно опасный
|
Низкий (слабый)
|
4-8
|
1-2.5
|
1-25
|
|
Критическая
|
Опасный
|
Средний
|
8-16
|
2.5-5
|
25-50
|
|
Чрезвычайная
|
Высоко опасный
|
Высокий (сильный)
|
16-32
|
5-10
|
50-100
|
|
Экологического бедствия
|
Чрезвычайно опасный
|
Очень высокий (очень
сильный)
|
> 32
|
> 10
|
> 100
|
Таблица 5.6 Зависимость классов воды от индекса
загрязнения воды
|
Класс качества воды
|
Текстовое описание класса
|
Величина ИЗВ качества воды
|
|
I
|
Очень чистая
|
ИЗВ ≤ 0,3
|
|
II
|
Чистая
|
0,3 < ИЗВ < 1
|
|
III
|
Умеренно загрязненная
|
1 < ИЗВ < 2,5
|
|
IV
|
Загрязненная
|
2,5 < ИЗВ < 4
|
|
V
|
Грязная
|
4 < ИЗВ < 6
|
|
VI
|
Очень грязная
|
6 < ИЗВ < 10
|
|
VII
|
Чрезвычайно грязная
|
10< ИЗВ
|
.2 Оценка загрязненности почв
В результате техногенной нагрузки в почву
непосредственно или опосредованно попадает огромное количество загрязняющих веществ,
что существенно меняет ее химический состав.
Чаще всего нормирование почв преследует три цели:
агрономическую, санитарно-гигиеническую и почвенно-экологическую.
Гигиенисты предлагают оценивать ПДК, исходя из 4
показателей вредности:
· транслокационного;
· миграционного водного;
· миграционного воздушного;
· общесанитарного.
Обычно экологической мерой оценки состояния почв
служат ПДК нормируемых компонентов, определяемые в зависимости от типа почв,
Таблица 5.7.
Дополнительно к ПДК для оценки состояния почв
используется 6 лимитирующих показателей вредности по шести показателям:
· органолептический;
· общесанитарный;
· транслокационный или фитоаккумуляционный;
· миграционно-водный;
· миграционно-воздушный;
· токсикологический.
Таблица 5.7. Предельно допустимые концентрации, (ПДК)
химических веществ в почве и критерии замены для почвогрунтов
|
Тяжелые металлы
|
Стандарты загрязняющих
тяжелых металлов, мг/кг
|
|
ФРГ
|
Нидерланды
|
Финляндия
|
РФ
|
Москва
|
|
As
|
25-140
|
29-50
|
50-100
|
2-10
|
> 15,2
|
|
Pb
|
200-2000
|
85-600
|
200-750
|
32-130
|
> 192
|
|
Cd
|
10-60
|
0,8-20
|
10-20
|
0,5-2.0
|
> 3,4
|
|
Cr
|
200-1000
|
100-800
|
200-300
|
|
|
|
Ni
|
70-900
|
35-500
|
100-150
|
20-80
|
> 110
|
|
Hg
|
10-80
|
0,3-10
|
2-5
|
2,1
|
> 3,7
|
|
Zn
|
|
140-3000
|
250-400
|
55-220
|
> 290
|
|
Cu
|
|
36-500
|
150-200
|
33-132
|
> 163
|
|
Co
|
|
20-300
|
100-250
|
|
|
Оценка степени опасности загрязнения почвы химическими
веществами проводится по каждому веществу с учетом следующих общих
закономерностей.
. Принимается, что опасность загрязнения тем выше, чем
больше фактическое содержание компонентов загрязнения почвы превышает ПДК, что
может быть выражено коэффициентом К0 − коэффициент опасности:
2. Опасность тем выше, чем выше класс опасности
контролируемого вещества, его растворимость в воде и подвижность в почве, а
также, чем больше мощность загрязненного слоя:
. Опасность тем больше, чем меньше буферная
способность почвы, которая зависит от механического состава, содержания
органических веществ, кислотности почвы.
Чем ниже содержание гуминового вещества, рН почвы и
легче механический состав, тем опаснее ее загрязнение химическими веществами.
При загрязнении почвы одним веществом неорганической
природы оценка степени загрязнения проводится в соответствии с Таблицей 5.8 с
учетом класса опасности компонента загрязнения, его ПДК и максимального
значения допустимого уровня содержания элемента (Кmax) по одному из четырех
показателей вредности.
Таблица 5.8 Категории загрязнения почвы неорганическими веществами
|
Содержание в почве, мг/ кг
|
Класс опасности вещества
|
|
1
|
2
|
3
|
|
Очень сильная
|
Сильная
|
|
> Кmax
|
Очень
|
Сильная
|
Средняя
|
|
От ПДК до Кmax
|
Сильная
|
|
|
|
От двух фоновых значений до
ПДК
|
Слабая
|
При полиэлементном загрязнении оценка степени
опасности загрязнения почвы допускается по наиболее токсичному элементу с
максимальным содержанием в почве.
Специфической особенность ПДК (ОДК) для почв, является
установление нормативов в трех формах концентраций элементов: в валовых формах,
в подвижных формах и в водорастворимых формах, 5.9.
Валовые формы показывают суммарную концентрацию
элемента в почве, их правомерно сравнивать с кларками почв.
Подвижные формы элементов характеризуют концентрации
элементов, растворяющихся в специальном буферном растворе.
Таблица 5.9 Предельно допустимые концентрации химических элементов в
почве, мг/кг
|
Показатель
|
ПДК
|
Класс опасности
|
Лимитирующий показатель
вредности
|
|
Валовые формы
|
|
V+Mn
|
100+1000
|
3
|
Обшесанитарный
|
|
As
|
2
|
1
|
Транслокационный
|
|
Hg
|
2,1
|
1
|
Транслокашюнный
|
|
Pb
|
32
|
1
|
Обшесанитарный
|
|
Sb
|
4,5
|
2
|
Миграционно-воздушный
|
|
Подвижные формы
|
|
Co
|
5
|
2
|
Обшесанитарный
|
|
Сu
|
3
|
2
|
Общесанитарный
|
|
Ni
|
4
|
2
|
Общесанитарный
|
|
Pb
|
6
|
2
|
Общесанитарный
|
|
Zn
|
23
|
1
|
Транслокационный
|
|
Cr
|
6
|
6
|
Обшесанитарный
|
Водорастворимые формы показывают концентрации
элементов, растворяющихся в воде.
ПДК подвижных и водорастворимых форм элементов нельзя
сравнивать с кларками валовых форм, так как концентрации подвижных форм, как
правило, значительно ниже валовых кларков.
Это связано с тем, что в почвах элемент присутствует
как в подвижных соединениях, допускающих его водную миграцию, так и в
минералах, устойчивых к растворяющему действию воды и почвенных растворов.
Многие авторы отмечают, что современное положение с
нормированием тяжелых металлов в почвах нельзя назвать удовлетворительным из-за
недостаточной разработанности их принципов и, как следствие этого, слабой
обоснованности рекомендованных нормативов.
Очевидно поэтому ПДК тяжелых металлов для почв,
разработанные в разных странах, значительно отличаются друг от друга.
При этом нормативы для подвижных форм тяжелых металлов
разработаны менее всего.
Важнейшим моментом в охране окружающей среды и одной
из экологических характеристик тяжелых металлов является знание их нормального
(фонового) содержания в почвах и параметры его возможного техногенного
изменения, что позволяет осуществлять контроль за состоянием почвенного
покрова, определять темпы и степень загрязнения его тяжелых металлов.
В настоящее время нет единого взгляда на определение
фонового содержания тяжелых металлов в почве.
Чаще всего под фоновыми подразумеваются уровни
содержания тяжелых металлов в почвах на значительном удалении от их техногенных
источников.
Существует также мнение, что за настоящий
"чистый" (естественный) фон следует принимать те концентрации тяжелых
металлов, которыми характеризовались почвы до начала научно-технической
революции.
В распоряжении экологов и геохимиков таких данных
очень немного, поэтому за фоновое содержание тяжелых металлов в почве принимают
средние статистические данные о содержании тех или иных элементов в различных
типах почв и почвенных регионах, исключая данные по техногенно загрязненным
почвам.
Наметилось два основных подхода к определению фоновых
уровней загрязняющих веществ в ландшафтах.
Первый (метод кларков) - заключается в подсчете
средних содержаний химических элементов в отдельных компонентах природной
среды, Таблица 5.10.
Таблица 5.10 Фоновые концентрации химических элементов в почве, мг/кг
|
Элемент
|
Класс опасности
|
Фоновые содержания
элементов в дерново-подзолистых почвах
|
Среднее содержание в
почве/литосфере
|
|
|
Для средней полосы России
|
Московский регион
|
Санкт- Петербург
|
|
|
Zn
|
1
|
28-45
|
50
|
43-73
|
50-85
|
|
As
|
1
|
1,5-2,2
|
6,6
|
2,62
|
5-1,7
|
|
Cd
|
1
|
0,05-0,12
|
0,3
|
0,17
|
0,5-0,13
|
|
Pb
|
1
|
6-15
|
26
|
17-21
|
10-16
|
|
Hg
|
1
|
0,05-0,1
|
0,15
|
0,03
|
0,01-0,083
|
|
Cu
|
2
|
8-15
|
27
|
18-23
|
20-47
|
|
Co
|
2
|
3-10
|
7.2
|
4.6-5.3
|
10-18
|
|
Ni
|
2
|
6-20
|
20
|
19-24
|
40-58
|
|
Cr
|
2
|
|
46
|
13-34
|
200-83
|
|
Mn
|
3
|
|
600-1260
|
119-471
|
850-1000
|
Другой подход состоит в исследовании конкретного
распределения химических элементов в почвах и других элементах ландшафта. При
этом выявляются не столько уровни содержания, сколько типы распределения
элементов в зависимости от условий миграции и аккумуляции их в ландшафтах, а
для оценки фонового распределения элементов предложено понятие "фоновая
геохимическая структура", которая характеризуется рядом геохимических
коэффициентов: коэффициенты радиальной и латеральной дифференциации,
биологического поглощения.
Вопрос о том, какие данные привлекать для получения
средних значений содержания элементов в почве, достаточно сложен и не всегда
однозначно понимается разными исследователями. Именно поэтому многочисленные
данные разных исследователей являются несравнимыми в силу различий в подходах к
определению сред них фоновых значений
Чаще всего, говоря о фоновых или нормальных значениях
содержания тяжелых металлов, подразумевают их содержание в верхнем
корнеобитаемом слое почвы (0-10, 0-20 см).
Многими исследователями установлено, что тяжелые
металлы преимущественно аккумулируются именно в нем, и коррелируют с
содержанием органических веществ, взаимодействуя с ним. В процессе
почвообразования происходит постепенное освобождение тяжелыъ металлов в профиле
почвы из почвообразующих пород, постоянно идут процессы их водной миграции.
Кроме того на поверхность почвы выпадают компоненты атмосферного загрязнения в
связи с ближним и дальним переносом загрязняющих веществ. Последнее
обстоятельство невозможно исключить в эпоху техногенеза, так как тяжелые
металлы с компонентами дальнего переноса поллютантов также участвуют в
формировании их фонового содержания.
При оценке среды с действующими источниками
загрязнения используют: коэффициент концентрации химического вещества Кс и
суммарный показатель загрязнения Zс.
Коэффициент концентрации Ксi представляет отношение
фактического содержания определяемого i -го вещества в почве Сi к кларку почв,
либо к региональному фону этого элемента Сфi :
Коэффициент концентрации Zс показывает интенсивность
накопления элемента в воде по отношению к природному фону.
Суммарный показатель загрязнения (Zс) является
комплексной оценкой загрязнения.
Численно он равен сумме коэффициентов концентраций N
химических элементов загрязнителей:
Ориентировочная оценочная шкала опасности загрязнения
почв по суммарному показателю загрязнения (Zc) представлена в Таблице 5.11.
Таблица 5.11 Ориентировочная оценочная шкала опасности
загрязнения почв по суммарному показателю загрязнения (Zc)
|
Категории загрязнения почв
|
Величина Zc
|
Изменения показателей здоровья
населения в очагах загрязнения
|
|
Допустимая
|
Менее 16
|
Наиболее низкий уровень
заболеваемости детей и минимальная частота встречаемости функциональных
отклонений
|
|
Умеренно опасная
|
16 - 32
|
Увеличение общей
заболеваемости
|
|
Опасная
|
32 - 128
|
Увеличение общей
заболеваемости, числа часто болеющих детей, детей с хроническими
заболеваниями, нарушениями функционального сердечно-сосудистой системы
|
|
Чрезвычайно опасная
|
Более 128
|
Увеличение заболеваемости
детского населения, нарушение репродуктивной функции женщин (увеличение
токсикозов беременности, числа преждевременных родов, мертворождаемости,
гипотрофии новорожденных)
|
5.3 Оценка загрязненности
ДОННЫХ ОТЛОЖЕНИЙ
Для ДО, которые являются своеобразной депонирующей
средой, характерна способность накапливать вместе с химическими элементами
информацию об экологическом состоянии всей водосборной площади, отражая ее
состоянием и виды производств на ее территории.
Темпы и объемы формирования донных отложений, а также
уровень загрязненности их слоев различны на всем протяжении существования
водного объекта, что позволяет, как проследить воздействие изменяющейся
техногенной нагрузки на речные экосистемы во времени, так и изменение тех
естественных процессов, которые протекают в ней.
Поэтому, в ряде стран донные отложения используют как
основной индикатор экологического состояния водного объекта, отображающий
уровень техногенного воздействия на речные экосистемы.
К наиболее опасным загрязняющим веществам относятся
соединения тяжелых металлов и различные соединения углеводородов.
Необходимость нормирования содержания загрязняющих
веществ в донных отложениях обусловлено тем, что сильно загрязненные донные
отложения оказывают серьезное отрицательное влияние на состояние воды водоемов
и водотоков.
Загрязнения, поступающие в водные объекты, являются
источниками «первичного загрязнения», которые накапливаясь в больших
концентрациях в сильно загрязненных донных отложений, могут, в свою очередь,
послужить источником «вторичного» загрязнения водных объектов, вызывая тем
самым ухудшение качества воды.
Это является важным обстоятельством, обусловливающим
необходимость включение донных отложений в состав основных объектов
экологических и эколого-геохимических исследований и использование их для
оценки экологического состояния водных систем.
В настоящее время оценка экологического состояние
водных объектов определяется, как правило, исходя из совокупности различных
показателей воды (а именно ее пригодностью для конкретных видов
водопользования), без учета состояния донных отложений и возможности вторичного
загрязнения воды. Проведение исследований донных отложений является
обязательным лишь при эпизодическом геолого-экологическом картографировании
территорий.
При этом, в Водном кодексе Российской Федерации дно
водоемов считается одной из составных частей поверхностных водных объектов.
Несмотря на то, что контроль состава донных отложений водных систем является
обязательным (в рамках Единой Государственной системы мониторинга за состоянием
окружающей среды), в государственные, региональные и объектные программы
экологического мониторинга речных систем и промышленных объектов этот вид
исследований, как правило, не включается.
Следует отметить, что мониторинг донных отложений вряд
ли может быть эффективным при отсутствии нормативов содержания загрязняющих
веществ в составе донных отложений, как среды депонирования загрязняющих
веществ, представляющей существенную угрозу для водной экосистемы.
Оценка степени воздействия донных отложений на
экологическое состояние водных объектов представляет определенные
методологические трудности.
Это связано с тем, что с одной стороны ПДК для донных
отложений отсутствуют, а с другой стороны, донные отложения, хотя близки по
вещественному составу к почвам, но они не являются почвой как объектом
землепользования.
Согласно Водному кодексу Российской Федерации
поверхностные водные объекты состоят из поверхностных вод и покрытых ими земель
в пределах береговой линии.
Таким образом, донные отложения являются неотъемлемой
частью водных объектов, имея отличное от воды фазовое состояние и иные
механизмы воздействия на водные экосистем.
Существующие в литературе подходы к экологическому
нормированию содержания загрязняющих веществ в донных отложениях, как правило,
руководствуются целью, на которую они ориентированы: охрана здоровья человека,
сохранение дикой природы, восстановление и оздоровление загрязненных участков,
а также масштабом воздействия (национальные, региональные нормативы или
локальные, привязанные к одному конкретному месту, например, выпуску очистных
сооружений).
Разработаны некоторые региональные нормативы
содержания ряда токсикантов в донных отложениях различных пресноводных водоемов
мира с применением разных критериев: фоновые концентрации; интервалы (либо
предельные уровни) соответствующего негативного воздействия на гидробионтов ;
равновесное распределение загрязняющего вещества.
В России подобные работы находятся в начальной стадии,
можно отметить лишь единичные попытки разработки экологических нормативов
содержания индивидуальных соединений в донных отложениях с использованием
геохимического и токсикологического подходов.
В целом следует признать отсутствие единых подходов,
позволяющих устанавливать нормативы качества донных отложений, которые могли бы
войти в единую систему нормативов для включения их в стратегию охраны водных и
биологических ресурсов в региональном масштабе.
В связи с этим одной из чрезвычайно актуальных задач в
области экологического нормирования является поиск подходов к установлению
стандартов качества донных отложений как важного фактора риска для водной
экосистемы и включению их в стратегию управления качеством природных вод.
Наиболее распространенный подход заключается в
сравнении полученных массовых концентраций тяжелых металлов со значением
величин кларка, фоновыми концентрациями, официально установленными допустимыми
уровнями или с другими ранее полученными натурными данными.
Мерой уровня загрязненности в этом методе служит
коэффициент обогащения (К0), показывающий во сколько раз содержание тяжелых
металлов в донных отложениях (или взвешенных веществах) превышает их кларковые
или фоновые значения.
Здесь следует отметить, что по коэффициенту обогащения
оценить уровень загрязненности донных отложений можно чисто условно, так как не
существует нормативно определенных значений К0, а приводимые в литературе
значения величин фоновых концентраций различными авторами рассчитываются и
трактуются по-разному.
В качестве ориентировочных значений можно
пользоваться, например, фоновыми содержаниями тяжелых металлов в донных
отложениях и объектах осадочного генезиса, не подверженных антропогенному
загрязнению, Таблица 5.12.
Наиболее часто используемым на практике методом оценки
качества донных отложений является метод последовательного химического
экстрагирования.
Таблица 5.12 Фоновые содержания тяжелых металлов
(мкг/г) в донных отложениях и объектах осадочного генезиса, не подверженных
антропогенному загрязнению
|
Исследуемые объекты
|
Тяжелые металлы
|
|
Cd
|
Cu
|
Cr
|
Fe*
|
Mn*
|
Ni
|
Pb
|
Zn
|
|
Кларки литосферы
|
0,13
|
47
|
83
|
46,5
|
1,10
|
58
|
16
|
83
|
|
Пресноводные ДО
|
0,35
|
43
|
96
|
43,5
|
0,75
|
55
|
28
|
110
|
|
ДО
|
0,10
|
53
|
24
|
-
|
-
|
23
|
10
|
79
|
|
Сланцы
|
0,35
|
45
|
90
|
45,0
|
0,85
|
68
|
20
|
95
|
|
* - Данные приведены в мг/г
|
Впервые этот метод был предложен для анализа морских
донных отложениях.
В его основу положена способность различных реагентов
извлекать из пробы донных отложений либо определенные формы металлов, либо
металлы, связанные с конкретными фазами донных отложений.
Например, известно, что уксусная кислота способна
извлекать из пробы донных отложений только карбонаты металлов, тогда как ацетат
аммония с pH 7 только их адсорбированные формы.
После проведения серии последовательных экстракций,
полученные экстракты анализируют раздельно и по преобладанию тех или иных форм
тяжелых металлов в пробе делают выводы об их подвижности и потенциальной опасности
для экосистемы в целом.
К настоящему времени предложено несколько методик
последовательного химического экстрагирования, включающих от двух до девяти
последовательных ступеней экстракции. Среди них наиболее распространенной
является методика, основанная на количественном определении пяти форм
нахождения металла:
· легкообменной;
· карбонатной;
· оксидной, входящей в состав гидрооксидов Fe и Mn;
· органической;
· остаточной, входящей в кристаллическую алюмосиликатную
решетку.
В США для некоторых тяжелых металлов утверждена
сравнительная шкала критерия оценки загрязненности донных отложений:
незагрязненные, умеренно загрязненные и сильно загрязненные, Таблица 5.13.
Агентство по охране окружающей среды США (EPA) в начале 90-х гг.
разработало и предложило для оценки качества природных донных отложений
критерий качества донных отложений (SQC - Sediment Quality Criteria). Введение
SQC преследовало две цели: во-первых, иметь возможность оценивать безопасность
донных отложений и, во-вторых, прогнозировать потенциальные нагрузки на них без
наступления неблагоприятных последствий для всей экосистемы в целом.
Таблица 5.13 Классификация донных отложений природных
вод, мкг/г
|
Донные отложения
|
Cd
|
Cr
|
Cu
|
Pb
|
Hg
|
|
Незагрязненные
|
-
|
<25
|
<25
|
<40
|
<1
|
|
Умеренно загрязненные
|
-
|
25-70
|
40-60
|
-
|
|
|
Сильно загрязненные
|
>6
|
>75
|
>50
|
>60
|
>1
|
Теория критериев качества донных отложений базируется на расчете четырех
основных параметров:
. Расчет количества легкоподвижные сульфиды (или просто сульфидный
параметр);
. Определение содержания тяжелых металлов в поровой воде донных
отложений;
. Расчет количества легкоподвижные сульфиды и органического вещества, а
так же количеств тяжелых металлов, находящихся в виде сульфидов и сорбированных
на органические вещества донных отложений;
. Минимальное разделение.
Смысл 1-го (сульфидного) критерия заключается в том, что донные отложения
классифицируются как нетоксичные лишь в том случае, если содержащиеся в них
тяжелые вещества присутствуют в сульфидной форме. Для расчета данного критерия
сравнивают сумму молярных концентраций тяжелые вещества (ΣMe), имеющих значение произведения
растворимости (ПР) меньше, чем у Fe и Mn, с молярной концентрацией
легкоподвижных сульфидов (ΣS2-). Выполнение условия: Σ
S2- > ΣMe - указывает на то, что все металлы
связаны в донных отложениях в виде прочных комплексов MeS.
Если наблюдается противоположное неравенство: ΣS2- < ΣМе, то это указывает на то, что часть
металлов в донных отложениях находится либо в ионной форме, либо они связаны в
комплексы с другими лигандами, например, с органическими веществами. В этом
случае прогноз токсичности донных отложений проверяется расчетом 2, 3 и 4-го
критериев.
Суть 2-го критерия заключается в том, что донные отложения считаются
нетоксичными, если концентрации тяжелых металлов в поровой воде не превышают
допустимых значений для воды (т. е. ПДК). Для этого сравнивают суммы
концентраций тяжелых в поровых водах с суммой ПДК для всех металлов. В случае
их превышения донных отложений классифицируются как токсичные.
Объединенный, 3-й критерий, легкоподвижных сульфидов и органических
веществ основывается на том, что дополнительной связующей фазой для тяжелых
металлов в донных отложений, чаще всего, выступает органичеческое вещество.
Суть этого критерия сводится к следующему: донные отложения считаются
нетоксичными, если сумма металлов в поровой воде за вычетом суммы металлов,
связанных орагникой донных отложений, меньше, чем сумма ПДК в воде всех
присутствующих металлов. Расчет критерия проводится по аналогии с критерием
поровой воды. Разница заключается в учете доли тяжелых металлов, связанных с
органически веществом. Этот критерий используют в случае нарушения предыдущего
критерия.
Критерий минимального разделения применим только для донных отложений, не
содержащих сульфиды, и, по сути, аналогичен вышеприведенному критерию.
На основе этих критериев можно рассчитывать формы нахождения металлов,
прогнозировать их поступление в поровой воде и, что наиболее важно,
прогнозировать биодоступность тяжелых металлов для водной флоры и фауны.
Агентством по охране окружающей среды США (EPA) предложен, кроме того,
следующий подход оценки качества донных отложений.
На основе статистической обработки данных о влиянии донных отложений
различной степени загрязненности на экологическое состояние водных объектов
предложены два предельных значения концентраций тяжелых металлов в донных
отложениях: пороговое, минимально допустимое содержание - (TEC) и максимально
допустимое содержание - (PEC). В таблицах 5.14-5.15 представлены
рекомендованные в работе значения ТЕС и РЕС, так называемые, согласованные
значения. Так же в представленных таблицах указаны значения следующих
параметров:
· TEL - возможный уровень воздействия, представляет собой
концентрацию загрязняющего вещества, ниже которой отрицательное влияние
наблюдается достаточно редко;
· LEL - минимальный уровень влияния, согласно этому критерию
отложения рассматриваются как чистые или минимально загрязненные, не ожидается
влияния на донные организмы ниже этого уровня;
· МЕТ - порог минимального влияния, согласно этому критерию
отложения рассматриваются как чистые или минимально загрязненные, не ожидается
влияния на донные организмы ниже этого уровня;
· ERL - уровень низкого влияния, представляет собой
концентрацию загрязняющего вещества, ниже которой отрицательное влияние
наблюдается только достаточно редко;
· TEL-HA28 - пороговый уровень влияния для амфиподы Hyalella
Azteka, представляет собой концентрацию загрязняющего вещества, ниже которой
отрицательное влияние на амфиподы Hyalella Azteka во время 28 суточного теста наблюдается
достаточно редко;
· PEL - пороговый уровень влияния, представляет собой
концентрацию загрязняющего вещества, выше которой отрицательное влияние
наблюдается часто;
· SEL - уровень серьезного влияния, при этой концентрации
загрязняющего вещества донных отложений рассматриваются как сильно
загрязненные, ожидается неблагоприятное влияние на большинство донных
организмов при достижении этой концентрации;
· TЕТ - предел токсического влияния, при этой концентрации
загрязняющего вещества донных отложений рассматриваются как сильно
загрязненные, ожидается неблагоприятное влияние на большинство донных
организмов при достижении этой концентрации;
· ERМ - средняя медиана влияния, представляет собой
концентрацию загрязняющего вещества, выше которой отрицательное влияние
наблюдается часто;
· РEL-HA28 - максимально допустимый уровень влияния для
амфиподы Hyalella Azteka, представляет собой концентрацию загрязняющего
вещества, выше которой отрицательное влияние на амфиподы Hyalella Azteka во
время 28 суточного теста наблюдается часто.
Таблица 5.14 Нормативы качества донных отложений для тяжелых металлов в
пресноводных системах на основе ТЕС
|
Тяжелый металл
|
Минимально допустимое
содержание (ТЕС)
|
|
TEL
|
LEL
|
MET
|
ERL
|
TEL-HA28
|
Согласованное TEC
|
|
As
|
5,9
|
6
|
7
|
33
|
11
|
9,79
|
|
Cd
|
0,596
|
0,6
|
0,9
|
5
|
0,58
|
0,99
|
|
Cr
|
37,3
|
26
|
55
|
80
|
36
|
43,4
|
|
Cu
|
35,7
|
16
|
28
|
70
|
28
|
31,6
|
|
Pb
|
35
|
31
|
42
|
35
|
37
|
35,8
|
|
Hg
|
0,174
|
0,2
|
0,2
|
0,15
|
-
|
0,18
|
|
Ni
|
18
|
16
|
35
|
30
|
20
|
22,7
|
|
Zn
|
123
|
120
|
150
|
120
|
98
|
121
|
Таблица 5.15 Нормативы качества донных отложений для тяжлых металлов в
пресноводных системах на основе РЕС
|
Тяжелый металл
|
Максимально допустимое
содержание (РЕL)
|
|
PEL
|
SEL
|
TET
|
ERM
|
PEL-HA28
|
Согласованное PEL
|
|
As
|
17
|
33
|
17
|
85
|
48
|
33
|
|
Cd
|
3,53
|
10
|
3
|
9
|
3,2
|
4,98
|
|
Cr
|
90
|
110
|
100
|
145
|
120
|
111
|
|
Cu
|
197
|
110
|
86
|
390
|
100
|
149
|
|
Pb
|
91,3
|
250
|
170
|
110
|
82
|
128
|
|
Hg
|
0,486
|
2
|
1
|
1,3
|
-
|
1,06
|
|
Ni
|
36
|
75
|
61
|
50
|
33
|
48,6
|
315
|
820
|
540
|
270
|
540
|
459
|
Для оценки поликомпонентного загрязнения было предложено использовать
суммарное значение превышения норматива РЕС. Для этого суммируют все
математически значимые величины частного от деления на РЕС и делят на
количество использованных в расчете веществ.
При оценке токсикологической опасности донных отложений руководствуются
тем, что в интервале < 0,1-0,5 пробы не будут токсичны и при значениях,
превышающих 0,5, 1,0 и 1,5, ожидать токсичность можно с большой долей
вероятности.
В Таблице 5.16 представлены нормативы загрязнения донных отложений ряда
стран, полученные с учетом взаимосвязи между токсичностью донных отложений и
концентрациями в них тяжелых отложений.
При этом для 20 веществ из 28 была отмечена прямая зависимость между
концентрацией и токсичностью на бентосных организмах.
В Европе широко применяется метод оценки степени
загрязнения донных отложений тяжелыми металлами на основе расчета
геоаккумуляции. Для оценки уровня загрязненности донных отложений вычисляются
индексы геоаккумуляции:
,)
где:
С - измеренная (валовая) концентрация элемента в донных отложениях
(наиболее часто используют фракции менее 0,02 мм, как обладающие наибольшей
сорбционной емкостью);
Cф - геохимическая фоновая концентрация элемента с учетом региональных
особенностей рассеивания элемента;
.5 - коэффициент учета вариаций природных концентраций элемента.
Оценка уровня загрязнения донных отложений тяжелыми металлами по Мюллеру
образуют простую систему классов геоаккумуляции, которая позволяет
математическим путем определить классификационные показатели оценки
экологического состояния донных отложений и «локализовать» места формирования
донных отложений с максимальными концентрациями загрязняющих веществ, Таблица
5.17.
Таблица 5.16 Нормативы содержания тяжелыми металлами в донных отложений
пресноводных систем
|
Тяжелые металлы
|
Используемые в США
нормативы
|
Принятые в Голландии
нормативы
|
Принятые в Бельгии
нормативы
|
Предлагаемые Даувальтером
(РФ) нормативы (на основе изучения ДО озер северной Фенноскандии)
|
|
ТЕС (США)
|
РЕС (США)
|
Фоновые концентрации (США)
|
|
|
|
|
Содержание тяжелых металлов
(мг/кг сухого вещества)
|
|
As
|
9,79
|
33
|
2,2-21
|
29
|
11
|
|
|
Cd
|
0,99
|
4,98
|
0,1-0,5
|
0,8
|
0,38
|
1,5
|
|
Cr
|
43,4
|
111
|
20-100
|
100
|
17
|
|
|
Cu
|
31,6
|
149
|
10-53
|
36
|
8
|
30
|
|
Hg
|
35,8
|
128
|
9-35
|
85
|
14
|
500
|
|
Pb
|
0,18
|
1,06
|
0,01-008
|
0,3
|
0,05
|
|
|
Ni
|
22,7
|
48,6
|
12-51
|
35
|
11
|
200
|
|
Zn
|
121
|
459
|
33-140
|
140
|
67
|
200
|
|
|
|
|
|
|
|
|
|
|
|
Еще одной методикой, основанной на фоновых концентрациях, является
принятый в Санкт-Петербурге «Региональный норматив и критерии загрязненности
донных отложений, извлекаемых из водных объектов при проведении
дноуглубительных работ для решения вопросов их дальнейшего использования (намыв
территорий, сброс в водные объекты, складирование в специально оборудованные
отвалы с выполнением комплекса защитных мероприятий)».
Таблица 5.17. Оценка уровня загрязнения донных отложений тяжелыми
металлами (по Мюллеру)
Значение
индекса геоаккумуляции, Классы
геоаккумуляции
|
(игео-классы)Уровень
загрязненности донных отложений (ДО) тяжелыми металлами
|
|
|
|
>0
|
0
|
Практически незагрязненные
ДО
|
|
> 0-1
|
1
|
Незагрязненные до умеренно
загрязненного ДО
|
|
> 1-2
|
2
|
Умеренно загрязненные ДО
|
|
> 2-3
|
3
|
Средне загрязненные ДО
|
|
> 3-4
|
4
|
Сильно загрязненные ДО
|
|
> 4-5
|
5
|
Сильно загрязненные до
чрезмерной загрязненности ДО
|
|
> 5
|
6
|
Чрезмерно загрязненные ДО
|
Критерии для тяжелых металлов (к которым в данной методике отнесен и As)
в стандартных донных отложениях приведены таблице 5.18.
Таблица 5.18 Критерии загрязнения стандартных донных отложений по
концентрациям загрязняющих веществ в мг/кг сухого веса
|
Тяжелые металлы
|
Целевой уровень
|
Предельный уровень
|
Проверочный уровень
|
Требующий вмешательства
уровень
|
|
As
|
29
|
55
|
55
|
55
|
|
Cd
|
0,8
|
2
|
7,5
|
12
|
|
Cr
|
100
|
380
|
380
|
380
|
|
Cu
|
35
|
35
|
90
|
190
|
|
Hg
|
0,3
|
0,5
|
1,6
|
10
|
|
Pb
|
85
|
530
|
530
|
530
|
|
Ni
|
35
|
35
|
45
|
210
|
|
Zn
|
140
|
480
|
720
|
720
|
Степень опасности концентраций загрязняющих веществ
зависит от типа донных отложений.
Стандартные отложения имеют следующий состав: 10% содержания органическое
вещество и 25% содержания глинистой фракции (частицы диаметром < 2 мкм).
Оценка загрязненности донных отложений, отличающихся от стандартных (с
содержанием глинистой фракции более 25% и содержанием органических веществ до
30%) предложено производить по критериям, приведенным в Таблице 5.19.
Для пересчета концентраций загрязняющих веществ в
нестандартных донных отложений на концентрации их в стандартных донных
отложений авторы методики используется следующее выражение:
Здесь:
-
исправленная концентрация;
-
измеренная концентрация;
-
поправочный коэффициент для приведения концентрации a, b и c - константы,
зависящие от металлов, Таблица 5.20.
Таблица 5.19 Критерии загрязнения нестандартных донных отложений
|
Тяжелые металлы
|
Целевой уровень (не
загрязненный), мг/кг сухого веса
|
Уровень вмешательства
(опасно загрязненные отложения), мг/кг сухого веса
|
|
As
|
37
|
70,2
|
|
Cd
|
1,2
|
18,4
|
|
Cr
|
100
|
380
|
|
Cu
|
46,6
|
253
|
|
Hg
|
0,3
|
11,1
|
|
Pb
|
105
|
655
|
|
Ni
|
35
|
210
|
|
Zn
|
170
|
874
|
Таблица 5.20 Поправочные коэффициенты пересчета содержания тяжелых
металлов и мышьяка.
|
Тяжелые металлы
|
а
|
b
|
c
|
|
As
|
15
|
0,4
|
0,4
|
|
Cd
|
0,4
|
0,07
|
0,021
|
|
Cr
|
50
|
2
|
0
|
|
Cu
|
15
|
0,6
|
0,6
|
|
Hg
|
0,2
|
0,0034
|
0,0017
|
|
Pb
|
50
|
1
|
1
|
|
Zn
|
50
|
3
|
1,5
|
В целом следует признать отсутствие широко применяемых
подходов, позволяющих устанавливать нормативы качества донных отложений,
которые могли бы войти в единую систему нормативов для включения их в стратегию
охраны водных и биологических ресурсов в региональном масштабе.
В связи с этим одной из чрезвычайно актуальных задач в
области экологического нормирования является поиск подходов к установлению
стандартов качества донных отложений как важного фактора риска для водной
экосистемы и включению их в стратегию управления качеством природных вод.
Таким образом, глобальным недостатком Российского
водного законодательства является то, что основные базовые стратегии сохранения
и улучшения качества природных водоемов содержат лишь стандарты качества водной
среды и не включают единых стандартов качества донных отложений. Вместе с тем
необходимо отметить, что именно донные отложения, благодаря их способности
аккумулировать многие органические и неорганические соединения, могут быть
фактором риска для всей водной экосистемы. Возможно вторичное загрязнение
водной среды в результате процессов, приводящих к перераспределению
содержащихся в донных отложениях загрязняющих веществ и нарушению баланса,
сложившегося в системе «вода - донные отложения», а также неблагоприятное
воздействие на плотность и разнообразие бентосного сообщества, определяющего
эффективность процессов самоочищения.
В связи с этим, одной из чрезвычайно актуальных задач
в области экологического нормирования является поиск подходов к установлению
стандартов качества донных отложений как важного фактора риска для водной
экосистемы и включению их в стратегию управления качеством природных вод.
В основу методологии экспериментального и натурного
изучения процессов аккумуляции и выноса тяжелых металлов в донных отложениях
водохранилищ и озер для определении стандартов качества донных отложений может
быть положен следующий принцип: концентрации тяжелых металлов в донных
отложениях не должны превышать значений, представляющих угрозу для
поверхностных и подземных вод с учетом категории их использования или быть
причиной острых или хронических эффектов для биотической компоненты экосистемы
водоемов.
Для оценки степени опасности тяжелых металлов с точки
зрения безопасности поверхностных вод наиболее перспективным является оценка
максимальной миграционной емкости тяжелых металлов отложений.
Максимальная миграционная емкость может быть
охарактеризована суммарным количеством тяжелых металлов, способным к выносу из
донных отложений в подвижных формах при наиболее неблагоприятных возможных
условиях.
Порядок оценки максимальной миграционной емкости может
быть представлен в следующем виде.
Выполняется анализ основных форм тяжелых металлов в
донных отложениях.
Выполняется оценка основных параметров донных
отложений, определяющих емкость их катионного обмена - содержание органического
вещества, глинистых веществ, оксидов железа и марганца.
Определяется общее содержание трудно растворимых солей
тяжелых металлов.
На основании мониторинга качества воды в водоеме
определяются граничные значения показателей, определяющих миграционную
активность донных отложений - содержание растворенного кислорода, рН,
содержание азота и фосфора, серы и др.
На основании гидрогеохимических расчетов определяется
количество тяжелых металлов в адсобированной фазе и в поровом растворе в
наиболее неблагопрятных условиях.
Исходя из модели смешивания рассчитываются
концентрации тяжелых металлов в воде водоема при наиболее неблагоприятных
возможных условиях и сравниваются с ПДК, установленном для водоема с учетом его
водохозяйственных характеристик.
На основании гидравлических расчетов оценивается
способность миграции адсорбированных на взвешенных частицах отложений в
результате ветрового или волнового их взмучивания.
В том случае, если определенные таким образом
концентрации тяжелых металлов не превышают допустимых значений ПДК, состояние
донных отложений может считаться безопасным.
Определение влияния тяжелых металлов донных отложений
на биотические компоненты экосистемы водоемов наиболее корректно выполнять с
использованием методов биотестирования и биоиндикации.
Биоиндикация - качественная оценка параметров среды обитания и ее
отдельных характеристик по состоянию биоты в природных условиях (Биоиндикация и
биомониторинг..., 1991). Понятие биоиндикация, включающее условия сравнения
результатов, применяется исключительно для зависящей от времени оценки
антропогенных или испытывающих антропогенное влияние факторов среды на основе
изменения количественных характеристик биологических объектов и систем.
Организмы или сообщества организмов, жизненные функции которых так тесно
кореллируют с определенными факторами среды, что могут применяться для их
оценки, и называются биоиндикаторами.
Биоиндикация в узком смысле занимается изучением влияния антропогенных
или антропогенно модифицированных факторов среды. При этом речь идет
преимущественно не об оценке присутствия концентрации или интенсивности
какого-либо параметра-среды, а о реакции биологических систем, т.е.
рассматривается биологическое воздействие факторов среды. Если физические и
химические методы дают количественные и качественные характеристики фактора, но
позволяют лишь косвенно судить о его биологическом действии, то с помощью
биоиндикации можно получить информацию о биологических последствиях и сделать
лишь косвенные выводы об особенностях самого фактора.
Опасность антропогенных факторов состоит, прежде всего, в том, что
биологические системы различного уровня (организмы, популяции, биоценозы)
недостаточно адаптированы к ним. Антропогенные факторы столь разнообразны и
создаются с такой скоростью, что биологические системы часто не успевают
активизировать соответствующие адаптационные процессы. Многие антропогенные факторы
среды потому и становятся опасными для биоты, что они радикально отличаются по
величине, интенсивности, продолжительности и моменту воздействия от той обычно
существующей в природе норме, к которой адаптированы биологические системы. В
результате они часто влияют на диапазон толерантности, что нередко приводит к
превышению допустимой нагрузки на организмы и распаду биологических систем.
Гидробиологические методы позволяют получить данные, характеризующие
отклик водных биоценозов на антропогенное воздействие, который формируется за
достаточно длительный промежуток времени. Сложилось устойчивое мнение, что
индикация состояния экосистемы в каждый конкретный момент времени не дает
возможности судить об отклике на антропогенное воздействие вследствие известной
"консервативности" гидробиологических показателей, формирования
адаптации» к загрязнению, естественных колебаний и цикличности процессов
развития водных организмов и популяций. Однако биота на своем уровне несет в
себе всю информацию о водном объекте и только отсутствие соответствующих
методов и квалификации исследователей препятствует ее получению.
Центральным методом биоиндикационных исследований является
сапробиологический анализ. Метод получил широкое распространение во всем мире,
рекомендован комиссией СЭВ в качестве стандартных методов оценки состояния
водных объектов, подверженных антропогенному влиянию. Уже известно множество
вариантов этого метода (Унифицированные методы..., 1966; Макрушин, 1974, 1978;
Кутикова, 1970, 1976, 1984), он разрабатывается широко в настоящее время
(Методы биоиндикации ..., 1987, 1989 и др.). В то же время он подвергается и
критике (Методы биоиндикации..., 1989; Кренева, 1993). Главный минус
сапробиологического метода в том, что он учитывает загрязнение только органическим
веществом, которое подвергается бактериальной деструкции и включается в
круговорот веществ данного водного объекта. Другие отрицательные моменты
изложены А.В. Абакумовым в работе (Руководство..., 1983). Тем не менее,
значение этого метода трудно переоценить. В действительности система олиго-,
мезо-, полисапробных водоемов вскрывает соотношение в них трофического
потенциала, как ведущего фактора среды, по присутствию разно резистентных к
нему показательных организмов (соответственно олиго-, мезо- и полисапробов).
Подчеркивая всю важность биоиндикационных методов исследования, следует
подчеркнуть, что такой подход требует объективного разделения и точного
описания двух одновременно действующих процессов, вызывающих отклонение
индикационного признака от нормы. Во-первых, результат действия антропогенных
факторов, во-вторых, следствие случайного отклонения от нормы в результате
действия принципиально неформализируемых факторов (Алексеев, 1997, цит.по
Гелашвили и др. 1999). Кроме того, такой важный показатель любого биоценоза,
как видовой состав, не дает ее оценки на момент исследования, поскольку
является итоговой характеристикой всей суммы воздействия на сообщество за
некоторый промежуток времени.
Биотестирование токсичности донных отложений проводится с целью интегральной
оценки их токсического загрязнения, обусловленного присутствием совокупности
токсичных химических (загрязняющих) веществ.
Биотестирование токсичности донных отложений используют для решения
следующих задач (Р 52.24.635-2002):
оценки токсичности (выявления, наличия и степени-токсичности) пробы
донных отложений;
оценки уровня токсического загрязнения донных отложений водного объекта,
выделения участков накопления токсичных загрязняющих веществ в донных
отложениях и оценки влияния источников загрязнения на основе донных отложений;
оценки уровня токсического загрязнения экосистемы водного объекта по
результатам биотестирования донных отложений и воды.
Биотестирование (биологическое тестирование) - это совокупность приемов
получения информации об их токсичности, используемых в водной токсикологии.
Биотестирование дает характеристику интегральной токсичности проб природной
воды и донных отложений конкретного водного объекта. С помощью биотестирования
оценивают интегральную токсичность комплекса веществ, присутствующих в водной
среде и проявляющих или не проявляющих свои эффекты в зависимости от формы их
нахождения, соотношений, взаимовлияний и ряда условий среды.
Биотестирование является основным методом при разработке нормативов ПДК
химических веществ (биотестирование токсичности индивидуальных химических
веществ) и, в конечном итоге, при оценке их опасности для окружающей среды и
здоровья населения. Таким образом, оценка уровня загрязнения по результатам
химического анализа, т.е. интерпретация результатов с точки зрения опасности
для окружающей среды, также в значительной степени опирается на данные
биотестирования.
Метод биотестирования, будучи биологическим, по сути, близок, по смыслу
получаемых данных к методам химического анализа вод: как химические методы, они
отражают характеристику воздействия на водные биоценозы (Бакаева, Хоружая и
др., 2006).
Основой биотестирования является выбор чувствительных тест-организмов,
удобных для лабораторного культивирования, достаточно репрезентативных,
отражающих некоторые специфические особенности не только данного вида, но и
большой группы гидробионтов, входящих в тот или иной биоценоз. Для
биотестирования используют лабораторные культуры гидробионтов и выделенные из
природных водных объектов. Использование последних дает возможность прогноза
влияния токсического загрязнения на гидробионтов конкретного водного объекта.
Тест-показатель подбирают с учетом их биологической значимости.
Существует два подхода к набору тест-организмов (Никаноров и др., 2000):
) система биотестирования должна содержать широкий набор организмов,
представляющих все трофические уровни водной экосистемы;
) набор методик должен быть минимальным, тест-организмы должны быть
простыми, удобными в работе и достаточно чувствительны к контролируемым загрязняющим
веществам.
Для токсикологической оценки загрязнения пресноводных экосистем на основе
биотестирования водной среды в рамках системы мониторинга ПВС Росгидромета
рекомендовано использовать шесть видов тест-объектов: дафний, цериодафний,
водорослей, простейших, коловраток, рыб (Р 52.24.566-94; Р52.24.662-2004; Р
52.24.690-2006).
Для оценки уровня токсического загрязнения донных отложений целесообразно
использовать биотесты на представителях донных биоценозов - зообентосе.
Бентосные организмы, как группа, являются наилучшими индикаторами токсичности
донных отложений из-за их прямого контакта с твердыми частицами осадка и из-за
высокой чувствительности жизненных циклов многих видов (Chironomus, Tubifex,
Hyalella, Gammarus, Hexagenid) к токсичности осадка. Их близкий контакт с
донными отложениями, промежуточными и поверхностными слоями воды за длительные
периоды жизненного цикла данных видов увеличивает вероятность проявления
неблагоприятных эффектов в присутствии загрязнённых осадков.
Лучше всего использовать природные популяции данного водоема: личинок
водных насекомых (комаров, стрекоз, жуков, эфемерид), а так же ручейников,
бентических ракообразных (водного ослика, бокоплавов, гаммарусов), отловленных
на незагрязненных участках водного объекта. Наиболее массовыми видами
зообентоса в большинстве озер, прудов, равнинных рек являются личинки водных
насекомых - комаров (хирономиды). Личинки хирономид включены в перечень
тест-объектов, рекомендуемых для разработки нормативов ПДК.
О наличии токсичности судят по проявлениям негативных эффектов, которые
считаются показателями токсичности. Среди показателей токсичности выделяют
общебиологические, биохимические, химические, биофизические и т.д. Показателем
токсичности является тест-реакция, изменения которой регистрируют в ходе
токсикологического эксперимента.
В результате биотестирования проб на основе регистрации показателей
токсичности делают оценку токсичности по критериям, установленным для каждого
биотеста. Результаты биотестирования опытной пробы с исследуемого участка
сравнивают с контрольной - заведомо нетоксичной пробой и по разнице в контроле
и в опыте судят о наличии токсичности. При этом эффекты воздействия делят на
острые и хронические. Их обозначают как острое и хроническое токсическое
действие или как острую и хроническую токсичность (ОТД и ХТД соответственно).
Эти термины и используют для выражения результатов биотестирования.
Принцип биотестирования донных отложений заключается в одновременном
проведении токсикологического эксперимента на пробе с исследуемого участка
водного объекта (опытной) и пробе с фонового участка (контрольной) и
последующем установлении различий между результатами.
В зависимости от постановленных задач биотестирование донных отложений
проводят (Р 52.24.635-2002; Р 52.24.690-2006):
на материале пробы, не подвергавшейся какой-либо обработке
(необработанной пробе) - для- анализа токсичности, обусловленной всей
совокупностью присутствующих в пробе загрязняющих веществ и их метаболитов
(общей токсичности);
на водной вытяжке донных отложений - для анализа токсичности
водорастворимых загрязняющих веществ.
Оценка токсичности пробы является экспертной. Ее делают, используя
результаты регистрации показателей острого и хронического токсического действия
(соответственно ОТД и ХТД). Оценка проводится специалистом с учетом
закономерностей реагирования, особенностей жизнедеятельности использованных
тест-объектов.
При использовании набора биотестов общую оценку токсичности донных
отложений выводят исходя из следующего принципа: если хотя бы в одном из
биотестов проба донных отложений оказывала токсическое действие, её считают
токсичной (результаты различных биотестов могут не совпадать вследствие
различий в чувствительности тест-объектов к токсическому воздействию).
Оценку уровня токсического загрязнения донных отложений водного объекта в
целом проводят на основе результатов биотестирования проб, отобранных на разных
его участках. По наличию токсичности в различных пробах донных отложений судят
о расположении участков накопления токсичных загрязняющих веществ в водном
объекте, зонах влияния источников загрязнения.
Для оценки уровня токсического загрязнения донных отложений водного
объекта рекомендуется использовать таблицу 8, разработанную на основе данных
научных исследований.
Оценку уровня токсического загрязнения экосистемы водного объекта
проводят на основе результатов биотестирования проб донных отложений, проб воды
из придонных слоев и проб воды водной толщи. При этом в токсикологических
экспериментах используют одни и те же биотесты (РД 52.24.566-94).
Таблица 5.21. Оценка уровня токсического загрязнения донных отложений
водного объекта (РД 52.24.566-94)
|
Тип и характер донных
отложений
|
Участки водного объекта,
где в пробах обнаружена токсичность
|
Уровень токсического
загрязнения
|
|
Ил преимущественно
мелкодетритный
|
На отдельных участках
|
Умеренно загрязненные
|
|
Ил мелко и крупнодетритный
|
На значительной части
участков
|
Загрязненные
|
|
Ил всех типов, илистый
песок
|
На всех участках
|
Грязные
|
|
Донные отложения всех
типов, поверхность камней, гравия, гальки
|
То же
|
Очень грязные
|
ЗАКЛЮЧЕНИЕ
Донные отложения, образующиеся в результате отложения
и седиментации взвешенного в воде неорганического и органического материала,
играют значительную роль в формировании химического состава водоемов.
В зависимости от условий, сложившихся в водоеме,
донные отложения могут служить либо источником поступления химических
соединений из донных отложений в толщу воды, либо аккумулировать вещества в
толще осадка, играя существенную роль в процессе самоочищения водного объекта.
К числу приоритетных загрязняющих веществ донных
отложений относятся тяжелые металлы, отличающиеся максимальной аккумуляционной
способностью и высокой токсичностью.
Разработка обоснованных критериев качества донных
отложений по содержанию в них тяжелых металлов требует наличия методологии
экспериментального и натурного изучения аккумуляции и выноса тяжелых металлов в
донных отложениях.
Это, в свою очередь, приводит к необходимости
рассмотрения поведения тяжелых металлов в различных элементах водных объектов,
их подвижности в различных фазовых состояниях и формах, доступности и
токсичности тяжелых металлов.
Основными геохимическими процессами определяющими
миграционную активность тяжелых металлов в системе «донные отложения - поровые
воды» являются процессы: растворения и осаждения; адсорбции и десорбции;
комплексообразования тяжелых металлов на органическом веществе; ионного обмена;
окислительно-восстановительные процессы.
Наиболее полно эти процессы могут быть учтены при
использовании, в качестве прогнозных инструментов, методов термодинамического
гидрогеохимического моделирования.
К
основным факторами водной среды, определяющим содержание тяжелых металлов в
поровой воде и донных отложениях могут быть отнесены: кислотно-щелочные и
окислительно-восстановительные условия водных объектов; содержание общего
азота, фосфора, органических веществ, серы, оксидов металлов, органических
соединений, общее солесодержание.
Кроме
того, на распределение тяжелых металлов между фазами существенную роль играет
гранулометрический состав отложений.
Анализ
зарубежных и отечественных методов оценки загрязненности донных отложений
показывает отсутствуют унифицированных подходов к оценке качества и
загрязненности донных отложений, которые могли бы составить единую систему
нормативов для включения их в стратегию охраны водных и биологических ресурсов.
Значительная
часть тяжелых металлов переносится в водных объектах в виде взвешенных веществ.
Формирование
донных отложений происходит, в основном, за счет седиментационных процессов. В
ходе этих процессов загрязняющие примеси из водной массы адсорбируются и,
осаждаясь, формируют донные отложения. Обратные процессы имеют место при
взмучивании донных отложений, разрушении придонного стратифицированного слоя и
последующей транспортировке мелкодисперсных взвесей водным потоком.
Интенсивность
переноса - осаждения мелкодисперсных взвесей определяется скоростью потока,
крупностью и удельным весом частиц, отношением, отношением, силами сцепления
между частицами мелкодисперсной взвеси, гидродинамическими свойствами водоемов.
Процессы
ремобилизации тяжелых металлов из донных отложений во многом лимитируются
интенсивностью диффузионного выноса поровой воды из донных отложений.
Интенсивность
диффузионного выноса определяется разностью концентраций, характеристиками
порового пространства, свойствами тяжелых металлов, формой их нахождения в
поровой воде в силу чего процессы комплексообразования существенно снижает
диффузионную подвижность тяжелых металлов.
Оценка влияния основных факторов на распределение тяжелых металлов между
жидкой и твердой фазами показала, что увеличение кислотности растворов (в
подавляющем большинстве случаев) приводит к увеличению подвижности тяжелых
металлов.
Изменение обстановки с окислительной на восстановительную, приводит к растворению
оксидов железа и марганца, интенсифицирует переход в раствор тяжелых металлов,
ранее адсорбированных этими оксидами. В тоже время, в анаэробных условиях
интенсифицируются процессы снижения подвижности металлов, вследствие
образования слаборастворимых сульфидов тяжелых металлов.
Органическое вещество, помимо того, что во многом определяет
окислительно-восстановительные условия, являются прекрасным сорбентом.
Кроме того, органические вещества, взаимодействуя с ионами металлов в
составе растворов, определяют формы нахождения элементов в природных водах и во
многом контролируют процессы межфазового распределения и токсичности тяжелых
металлов. Образование прочных органических комплексов существенно снижает
подвижность и токсичность тяжелых металлов. В тоже время, высокое содержание
фульвокислот приводит к увеличению растворимости металлов в результате
комплексообразования.
Влияние азота и фосфора на распределение тяжелых металлов между донными
отложениями и водной фазой следующее.
С одной стороны, эти элементы служат одной из основных причин
эвтрофирования водоемов, что интенсифицирует переход в раствор железа, марганца
и тяжелых металлов, десорбирующихся при восстановлении железа и марганца.
С другой стороны подвижность металлов связывается неорганическими
прочными фосфатными комплексами.
Минерализация раствора влияет непосредственно на активность реагирующих
ионов и приводит к увеличению содержания растворенных форм тяжелых металлов по
мере повышения солености, что обусловлено образованием неорганических
комплексных соединений тяжелых металлов.
Анализ зарубежных и отечественных методов оценки
загрязненности донных отложений показывает отсутствуют унифицированных подходов
к оценке качества и загрязненности донных отложений, которые могли бы составить
единую систему нормативов для включения их в стратегию охраны водных и
биологических ресурсов.
В связи с этим одной из весьма актуальных задач в
области экологического нормирования является поиск подходов к установлению
стандартов качества отложений.
Выполненные исследования являются надежной научно-методической основой
разработанной Методологии экспериментального и натурного изучения процессов
аккумуляции и выноса тяжелых металлов в донных отложениях водохранилищ и озер.
СПИСОК
ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
2. .
Stone, A.T. Reactions of extracellular organic ligands with dissolved metal
ions and mineral surfaces, In: J.F. Banfield, K.H. Nealson, ed.
Geomicrobiology: Interactions between Microbes and Minerals, Washington, -
D.C.: Mineralogical Society of America, -1997, -С. 309-344.
. .
Cornell, R.M., Schwertmann, U. The Iron Oxides: Structure, Properties,
Reactions, Occurrence, and Uses, New York: VCH, 573 -С., 1996.
. .
Гаррелс, Р.М., Крайст, Ч.Л. Растворы, минералы, равновесия, 400 -С., М.: Мир,
1968.
. . Крайнов
С.Р., Швец В.М. Геохимия подземных вод хозяйственно-питьевого назначения. 237
-С., М.: Недра, 1987.
. .
Денисова, А.И. Донные отложения водохранилищ и их влияние на качество воды /
А.И. Денисова, Е.П. Нахшина, Б.И. Новиков и др. - Киев: Наукова думка, - 1987.
- 16с.
. .
Кузнецов, С.И. Микрофлора озер и ее геохимическая деятельность / С.И. Кузнецов.
- Л.: Наука, 1970. - 440 с.
. .
Nissenbaum, A. Organic matter-metal interactions in recent sediments: the role
of humic substances. / A. Nissenbaum, D.J. Swaine // Geochim. Cosmochim. Acta.
- 1976 - 40с., N7.-P. 809-816.
. .
Линник, Л.П. Формы миграции металлов в пресных поверхностных водах / Л.П.
Линник, Б.И. Набиванец. - Л.: Гидрометеоиздат, 1986. - 270 с.
. .
Chapman, P. Ecotoxicology of metals in aquatic sediments: binding and release,
bioavailability, risk assessment, and remediation / P. Chapman, F. Wang, C.
Janssen et al. // Canadian Journal of Fisheries and Aquatic Sciences: - 1998. -
V.55. -N.IO. - P.2221.
. .
Ершова, Е.Ю. Тяжелые металлы в ДО Куйбышевского водохранилища / Е.Ю. Ершова,
Е.В. Венецианов, А.Г. Кочарян, Е.К. Вульфсо - Водные ресурсы, - 1996. -Т.23.
-№1. - С.59-65.
. .
Delfino, J.J. Variation of manganese dissolved oxygen and related chemical
parameters in the bottom waters of lake Mendota / J.J. Delfmo, G. F. Lee. //
Wisconsin. - Water Res.-1971.-5 N12.-P. 1207-1217.
. .
Murray, J. W. The interaction of metal ions at the manganese dioxide-solution
interface./ J. W. Murray // Geochim. Cosmochim. Acta. - 1975 - 39. - N 3. - P.
505-519.
. .
Коновалов, Г.С. Содержание и режим микроэлементов в воде и во взвешенных
веществах в бассейне р. Волги / Г.С. Коновалов, А.А. Иванова - Гидрохим.
Материалы, 1972.-T.53.-C.60-70.
. .
Озол, А.А. Раскрывая тайны геохимических процессов / А.А. Озол - Научный
Татарстан, - 1998. - С. 20-26.
. .
Озол, А.А. Что таит в себе геохимический состав почв / А.А. Озол, Е.А.
Беговатов, С.С. Мухарамова - Научный Татарстан, - 1999. - С.57-64.
. .
Нахшина, Е.П. Микроэлементы в водохранилищах Днепра / Е.П. Нахшина. - Киев:
Наукова думка, - 1983. - 160 с.
. .
Красинцева, В.В. Процессы миграции и формы нахождения химических элементов в
поровых водах донных отложений в Иваньковском водохранилище / В.В. Красинцева,
Д.В. Гричук, Г.И. Романова, А.И. Кадукин - Геохимия, - 1982. - № 9. -
С.1342-1354.
. .
Лубченко, И.Ю. Миграция элементов в речных водах / И.Ю. Лубченко, И.В. Белова -
Литология и полезные ископаемые, - 1973. - № 2. - С. 23-29.
. .
Stortelder, P.B.M. Hazard assessment and monitoring of discharges to water:
concepts and trends. / P.B.M. Stortelder, С van der Guchte // European Water
Pollution Control. - 1995. -V.5.-N0.5.
. .
Ramamoorthy, S. Mercury soфtion and desorption characteristics of some Ottawa
River sedimentd. / S. Ramamoorthy, B.R. Rust // Can. Joum. Earth. Sci. - 1976.
- 13.- N 4. - P. 530-536.
. .
Исидоров, В.А. Введение в курс химической экотоксикологии / В.А. Исидоров. -
СПб.: С-П. гос. ун-т, 1997. - 88с.
. .
Руководство по химическому анализу поверхностных вод суши. - Л.: Гидрометиздат,
1977.-541 с.
. . Ревич,
Б.А. Загрязнение окружающей среды и здоровье населения / Б.А. Ревич - М.: Изд.
МНЭПУ, - 2001. - 265 с.
. .
Чудаева, В.А. Фазовое состояние элементов во взвесях некоторых рек бассейна
Японского моря / В.А. Чудаева, В.В. Гордеев, Л.С. Фомин - Геохимия, - 1982. - №
4. - С. 585-596.
. .
Elderfield, H. Metal-organic associations in interstitial water of Narragansett
bay sediments. / H. Elderfield - Amer. Jour. Sci., 1981. - 281. - N9. - P.
1184-1196.
. .
Гордеев, В.В. Формы металлов во взвеси Ганга-Брахмапутры / В.В. Гордеев, А.Ю.
Митропольский, О.В. Туркина - Геохимия, - 1983. -№ 10. - С. 1461-1467.
. .
Sposito, G. Trace metals in contaminated waters // Environ. Sci. Technology. -
1981. - Vol. 15, № 4. - P. 396 - 403.
. .
Wood, J.M. Biological cycles for toxic elements in the environment // Science.
- 1974. - Vol. 183. - P. 1049 - 1052.
. .
Plant, J.A. Raiswell R., Principles of environmental geochemistry // Applied
environmental geochemistry / Ed. I. Thornton. - London: Academic Press, - 1983.
- P. 1 - 39.
. .
Воронов, В. В. Мутагенные контаминанты окружающей среды / В. В. Воронов, Р. А.
Сидоров // Вестник новых медицинских технологий. - 1999. - № 2. - Т. VI. - С.
134 -142.
. .
Plummer, L.N., Jones, B.F. Truesdell A.H., WATEQF-A FORTRAN IV version of
WATEQ, A computer program for calculating chemical equilibrium of natural
waters: U.S. Geological Survey Water- Resources Investigations Report 76-13,
(Revised 1984), - 1976.-61 p.
. .
Ball, J.W., Nordstrom, D.K. User's manual for WATEQ4F, with revised
thermodynamic data base and test cases for calculating speciation of major,
trace, and redox elements in natural waters: U.S. Geological Survey Open-File
Report 91,-1991.-183, 193 p.
. .
Wolery, T.J. EQ3/6, A software package for geochemical modeling of aqueous
systems-Package overview and installation guide (ver. 7.0) UCRL-MA- 110662 pt
1: Lawrence Livermore National Laboratory, - 1992.-41 p.
. .
Bethke, C.M. The geochemist's workbench, version 2.0, A user's guide to Rxn,
Act2, Tact, React, and Gtplot hydrogeology program: Urbana, Ill., University
Illinois, - 1991.-218 p.
. .
Allison, J.D. Brown D.S., Novo-Gradac K.J., A geochemical assessment database
and test cases for environmental systems, version 3.0, User's manual: U.S.
Environmental Protection Agency Report EPA/600/3-91/-21, - 1991.- 82-83р.
. .
Kharaka, Y.K., Gunter, W.D., Aggarwal, P.K., Perkins, E.H., DeBraal, J.D.
SOLMINEQ.88-A computer program for geochemical modeling of water-rock
interactions: U.S. Geological Survey Water-Resources Investigations Report
88-4227, - 1988.-420 p.
. .
Schecher, W.D., McAvoy, D.C., 1991, MINEQL+. A chemical equilibrium program for
personal computers, User's manual ver. 2.1: Edgewater, Md., Environmental
Research Software, 39 p.
. .
Plummer, L.N., Prestemon, E.C., and Parkhurst, D.L., 1992, An interactive code
(NETPATH) for modeling NET geochemical reactions along a flow PATH: U.S.
Geological Survey Water-Resources Investigations Report 91-4078, 227 p.
. .
Noorishad, J., Carnahan, C.L., Benson L.V. A temperature-dependent
non-equilibrium reactive transport code: Earth Sciences Division, Lawrence
Berkeley Laboratory, - 1987.-231 p.
. .
Nienhuis, P. Appelo, C.A.J., Willemsen, G., User guide PHREEQM-2D-A
multicomponent mass transport model, ver. 2.01 (5/94): Amhem, The Netherlands,
IT Technology, - 1994.
. .
Parkhurst, D.L. User's guide to PHREEQC-A computer program for speciation,
reaction-path, adjective-transport, and inverse geochemical calculations: U.S.
Geological Survey Water-Resources Investigations Report 95-4227, - 1995.-143 p.
. .
Appelo, C.A.J., Postma, D., 1993, Geochemistry, groundwater, and pollution:
Rotterdam, The Netherlands, A.A. Balkema, 536 p.
. .
Truesdell, A.H., Jones, B.F. WATEQ -, A computer program for calculating
chemical equilibria of natural waters: Journal Research, U.S. Geological
Survey, v. 2, - 1993.- 233-248 р.
. .
Parkhurst, D.L., Thorstensen, D.C., Plummer, L.N. PHREEQE-A computer program
for geochemical calculations: U.S.Geological Survey Water-Resources
Investigations 80-96 (revised 1990), - 1980.-195 p.
. .
Glynn, P.D. Modeling solid-solution reactions in low-temperature aqueous
systems, in Bassett, R.L. and Melchior, D.eds., Chemical modeling in aqueous
systems II: Washington D.C., American Chemical Society Symposium Series 416,
Chapt. 6, - 1990.- 74-86 р.
. .
Glynn, P.D. MBSSAS: A code for the computation of Margules parameters and
equilibrium relations in binary solid-solution aqueous-solution systems:
Computers and Geosciences, v. 17, no. 7, - 1991.- 907-966 р.
. .
Glynn, P.D. Parkhurst D.L., Modeling non-ideal solid-solution aqueous-solution
reactions in mass-transfer computer codes, in Kharaka, Y.K., Maest, A.S. eds.,
Proceedings of the 7th International Symposium onWater-Rock Interaction: Park
City, Utah, July 13-18, 1992, Balkema, Rotterdam, - 1992.- 175-179 р.
. .
Glynn, P.D. Reardon E.J., Plummer L.N., Busenberg, Eurybiades, Reaction paths
and equilibrium end-points in solid solution aqueous-solution systems:
Geochimica et Cosmochimica Acta, v. 54, - 1990.- 267-282 р.
. .
Lewis, G.N. Randall, M., Thermodynamics: New York, McGraw-Hill, - 1923.- 653 p.
. .
Berner, R.A. Principles of chemical sedimentology: New York, McGraw-Hill, Inc.,
- 1971.-240 p.
. .
Van Olphen, H. An introduction to clay colloid chemistry (2nd ed.): New York.
Wiley-Interscience, - 1977.- 318 p.
. .
Miller, CT, Weber, Jr WJ. Sorption of hydrophobic organic pollutants in
saturated soil systems. J. Contam Hydrol - v. 54, 1986. - 243-261р.
. .
Weber, Jr WJ, Miller, CT. Modeling the sorption of hydrophobic contaminants by
aquifer materials--I: Rates and equilibria. Water Res - 1988. - 22(4) - 457-464
р.
. .
Grathwohl, P, Reinhard, M., Desorption of trichloroethylene in aquifer
material: Rate limitation at the grain scale. Environ. Sci.Technol., -
1993;27(12):2360-2366 р.
. .
Freundlich, H. Of the adsorption of gases. Section II. Kinetics and energetics
of gas adsorption. J Am Chem Soc - 1931.- 195-201 р.
. .
Miller, CT, Christakos, G, Imhoff, PT, McBride, JF, Pedit, JA Trangenstein
JA.,Multiphase flow and transport modeling in heterogeneous porous media:
Challenges and approaches. Adv Water Resour 1998;21(2) - 77-120.
. .
Morel, F.M., Hering, J.G. Principles and applications of aquatic chemistry.-
New York: John Wiley & Sons, - 1993.- 588 p.
. .
Mantoura, R. F. C. and Riley, J. P. The analytical concentration of humic
substances from natural waters. Anal. Chem. Acta - 1975.-76, 97-106 .
. .
Buffle, J., Greter, F. L., Haerdi, W.; Anal. Chem Measurements of complexation
properties. of humic and fulvic acids in natural waters with lead and copper
ion-selective electrodes, - 1977.- 49, 216-222.
. .
Dzombak, D.A., W. Fish and F.M.M. Morel Humate-metal interactions. I. Discrete
ligand and continuous distribution models. Environ. Sci. Technol., - 1986.-
20,669-675.
. .
Cabaniss, S.E. & Shuman M.S. Copper binding by dissolved organic matter. I.
Suwannee river fulvic acid equilibria. Geochimica et Cosmochimica Acta, -
1988.-52, 195-200.
. .
Bresnahan, W.T., Grant, C.L., Weber, J.H. Stability constants for the
complexation of copper(II) ions with water and soil fulvic acids measured by an
ion selective electrode. Anal. Chem. - 1978.- 50, 1675-1679.
. .
Stumm, W., Morgan, J.J. Aquatic Chemistry, Wiley-Interscience, New York -
1970.- 563с.
. .
Bartschat, B.M., Cabaniss, S.E., Morel, F.M.M., An oligoelectrolyte model for
cation binding by humic substances. Environ Sci Technol, - 1992.- 26, 284-294
р.
. .
Fish, W., D.A. Dzombak, Morel, F.M.M., Metal-humate interactions. 2.
Application and comparison of models. Environmental Science and Technology -
1986.- 20, 676-683 р.
. .
John, C., Westall, John D., Jones, Gary, D., Turner, John, M. Zachara
"Models for Association of Metal Ions with Heterogeneous Environmental
Sorbents: I. Complexation of Co (II) by Leonardite Humic Acid as a Function of
pH and NaClO4 Concentration," Environ. Sci. Technol., - 1995.- 29,
951-959.
. .
Westall, J., H. Hohl "Comparison of Models for the Oxide-Solution
Interface," Adv. Coll. Interfac. Sci., 12,- 1980.- 265-294.
. .
Dzombak, D.A., Morel, F.M.M. Surface complexation modeling--Hydrous ferric
oxide: New York, John Wiley, - 1990.- 393 p.
. .
Gustafsson, J.P. Modeling the acid-base properties and metal complexation of
humic substances with the Stockholm Humic Model. J. Colloid Interface Sci. -
2001.- 244, 102-112.
. .
Gustafsson, J.P. van Schaik J.W.J. Cation binding in a mor layer: batch
experiments and modelling. European Journal of Soil Science - 2003.- 54,
295-310.
. .
Tipping,E. WHAM - A chemical equilibrium model and computer code for waters,
sediments and soils incorporating a discrete site/electrostatic model of
ion-binding by humic substances. Computers Geosciences - 1994.- 20, 973-1023.
. .
Venema, P., Hiemstra, T., Van Riemsdijk, W.H. Comparison of different site
binding models for cation sorption: description of pH dependency, salt
dependency and cation-proton exchange. J. Colloid Interface Sci. - 1996.- 181,
45-59.
. .
Hiemstra, T., van Riemsdijk, W.H. A surface structural approach to ion
adsorption: The charge distribution (CD) model. J. Colloid Interface Sci. -
1996.- 179, 488-508.
. .
Gamble, D.S. Titration curves of fulvic acid: the analytical. chemistry of a
weak acid polyelectrolyte. Can. J. Chem. - 1970.- 48, 2662-2669.
. .
Posner, A.M. Titration curves of humic acid. Proc. of the 8th Int. Congress on Soil
Science,. Part II., Bucharest, Romania.- 1964.
. .
Perdue, EM, Lytle, C.R. Distribution model for binding of protons and metal
ions by humic substances. Environ. Sci. Technol. - 1983.- 17,654-660.
. .
Shuman, M.S., B.J. Collins, P.J. Fitzgerald and Olson, D.L. Distribution of
stability constants and dissociation rate constants among binding sites on
estuarine copper-organic complexes: Rotated disk electrode studies and an
affinity spectrum analysis of ion-selective electrode and photometric data. In:
Aquatic and Terrestrial Humic Materials (R.F. Christman and E.T. Gjessing,
eds.), Ann Arbor Science, Ann Arbor, MI, - 1983.- 349-370 р.
. .
Dobbs, J.C., Susetyo, W., Carreira, L.A., Azarraga, L.V. Competitive binding of
protons and metal ions in humic substances by lanthanide ion probe
spectroscopy. Anal. Chem, - 1989.- 61,1519-1524.
. .
Scheffer, F., Schachtschabel, R, Lehrbuch der Bodenkunde. Enke, Stuttgart, 448
p.
. .
Breeuwsma, A., Wosten, J.H.M., Vieeshouwer, J.J., Van Slobbe, A.M. and Bouma,
J. Derivation of land qualities to assess environmental problems from soil
surveys. Soi7 Sci. Soc. Am. J. - 1986.- 50, 186-190.
. .
Parks, G.A. Surface energy and adsorption at mineral-water interfaces: an
introduction. In M.F. Hochella, Jr. and A.F. White (eds). Mineral-water
interface geochemistry. Reviews in Mineralogy 23, Mineral. Soc. Am., - 1990.-
133-175.
. .
Stumm, W., Morgan, J.J. Aquatic chemistry. 2nd ed. Wiley & Sons, New York,
- 1981.- 780 p.
. .
Davis, J.A., Kent, D.B. Surface complexation modeling in aqueous geochemistry.
In M.F. Hochella, Jr. and A.F. White (eds). Mineral-water interface
geochemistry. Reviews in Mineralogy 23, Mineral. Soc. Am., - 1990.- 177-260.
. .
Gaines, G.L., Thomas, H.C. Adsorption studies on clay minerals. II. A
formulation of the thermodynamics of exchange adsorption. J. Chem. Phys. -
1953.- 21,714-718.
. .
Vanselow, A.R Equilibria of the base-exchange reactions of bentonites,
pemnutites, soil colloids and zeolites. Soil Sci. - 1932.- 33, 95-113.
. .
Гапон, Е.Н. К теории обменной адсорбции в почвах.-Журнал общей химии, т.З -
вып.2, - 1933.-144-163 с.
. .
Bruggenwert, M.G.M, Kamphorst, A. Survey of experimental information on cation
exchange in soil systems. In G. H. Bolt (ed.), Soil Chemistry, B.
Physico-chemical models. Elsevier, Amsterdam, - 1982.- 141-203.
. .
Shelton, L.R. Field guide for collecting and processing stream-water samples
for the National Water-Quality Assessment Program: U.S. Geological Survey
Open-File Report - 1995.- 94-455, 42 p.
. .
Bricker, O.P. Some stability relations in the system Mn-O2-H2O at 25°C and one
atmosphere total pressure: American Mineralogist, v 50, - 1965. - 1296-1354.
. .
Snoeyink, V. L., Jenkins, D Water Chemistry. John Wiley and Sons, Inc., New
York, - 1980.
. .
Aagaard, P. and Helgeson, H.C. Thermodynamic and kinetic constraints on
reaction rates among minerals and aqueous solutions-I. theoretical
considerations. American Journal of Science, v. 282, -1982.- 237-285 р.
. .
Delany, J.M. Puigdomenech I., Wolery T.J., Precipitation kinetics option for
the EQ6 geochemical reaction path code. Lawrence Livermore National Laboratory,
University of California, Livermore, - 1986.- 44 p.
. .
Parkhurst, D.L., Appelo, C.A.J. User’s guide to PHREEQC (VERSION 2) - a
computer program for speciation, batch-reaction, one-dimensional transport, and
inverse geochemical calculations, Denver, Colorado, 1999.
. .
Пивоваров, С.А., Лакштанов, Л.З. Адсорбция кадмия на гематите. // Геохимия. №
10. - 2003.- 1105-1120 с.
. .
Пивоваров, С.А. Физико-химическое моделирование поведения тяжелых металлов (Си,
Zn, Cd) в природных водах: комплексы в растворе, адсорбция, ионный обмен,
транспортные явления. Авт. дисс. канд.хим. наук. М.: МГУ 2003.- 22 с.
. .
Соколова, О.В., Шестакова, Т.В., Гричук, Д.В., Шваров, Ю.В. Термодинамическое
моделирование форм нахождения тяжелых металлов в системе вода - донные
отложения при автотранспортном загрязнении. // Вест. Моск. Ун-та. Сер. 4:
Геология. № 3. - 2006.- 36-45.
. . Соколова,
О.В. Экспериментальное исследование и термодинамическое моделирование миграции
тяжелых металлов в системе "вода - донные отложения" в зоне
антропогенного воздействия. Автореф. канд. дисс. М., - 2008.
. .
Методы геохимического моделирования и прогнозирования в гидрогеологии. / Под
ред. С.Р.Крайнова. - М.: Недра, 1988. - 254 с.
. .
Липатникова, О.А. Экспериментальное исследование и термодинамическое
моделирование форм нахождения микроэлементов в ДО Иваньковского водохранилища.
Диссертация на соискание степени кандидата геолого-минералогических наук.
Москва, - 2011.- 130 с.
. .
Шваров, Ю.В. HCh: новые возможности термодинамического моделирования
геохимических систем, предоставляемые Windows // Геохимия. № 8. -
2008.-898-903.
. .
Беззапонная О.В. Прогноз содержания соединений тяжелых металлов в поверхностных
водных объектах : Диссертация на соискание степени кандидата технических наук.
Екатеринбург, -2004, -162 c.
. .
Nordstrom, D.K., Plummer, L.N., Langmuir, Donald, Busenberg, Eurybiades, May,
H.M., Jones, B.F., and Parkhurst, D.L. Revised chemical equilibrium data for
major water-mineral reactions and their limitations, in Bassett, R.L. and
Melchior, D. eds., Chemical modeling in aqueous systems II: Washington D.C.,
American Chemical Society Symposium Series 416, Chapt, - 1999.- 31, 398-413 р.
. .
Stumm, W., Huang, C., Jenkins, S. Specific chemical interaction affecting the
stability of dispersed systems. Croatica Chemica Acta, Vol. - 1970 - 42,
223-245 р.
. .
Stumm, W. The inner-sphere surface complex, A key to understanding surface
reactivity. In: Huang, C., O.Melia, C. & Morgan, J. (Eds.) Aquatic
chemistry, Interfacial and Interspecies Processes. Washington DC: American
Chemical Society. (Advances in chemistry series, Vol. 244), - 1995.- 1-32 р.
. .
Stumm, W. Chemistry of the solid-water interface, Processes at the
mineral-water and particle-water interface in natural system. New York: John
Wiley & Sons. -1992.- 428 p.
. .
Hayes, K., Katz, L. Application of X-ray absorption spectroscopy for surface
complexation modeling of metal ion sorption. In: Brady, P. (Ed.) Physics and
chemistry of mineral surfaces. Boca Raton, FL: CRC Press. - 1996.- 147-223 р.
. .
Palmqvist, U., Ahlberg, E., Lovgren, L., Sjoberg, S. Competitive metal ion
adsorption in goethite systems using in situ voltammetric methods and
potentiometry. Journal of Colloid and Interface Science, Vol. 218, - 1999. -
388-396 р.
. .
Кременецкий, В.В. Волновые бароклинные плотностные течения в водохранилище //
Тр. V конф. Динамика и термика рек, водохранилищ и прибрежной зоны морей. М.:
-1999. - 54-56 с.
. .
Кафаров, В.В. Основы массопередачи. М.: Высшая школа, - 1979.- 438 с.
. .
Хинце, И.О. Турбулентность. М.: Физматгиз, - 1963. - 680 с.
. .
Левич, В.Г. Физико-химическая гидромеханика. М.: Физматгиз, - 1959.- 700 с.
. .
Маркова, И.М., Боровков, В.С. Характеристики русловых отложений и геоэкология
водотоков на урбанизированной территории. // Матер. третьей междунар. (VIII
традиционной) науч.-практ. конф. молодых ученых, аспирантов и докторантов
«Строительство - формирование среды жизнедеятельности». М.: Изд-во МГСУ, -
2005. - 68-72 с.
. .
Шлихтинг, Г. Теория пограничного слоя. М.: Наука, - 1969. - 742 с.
. .
Боровков, В.С., Майрановский, Ф.Г. Аэрогидродинамика систем вентиляции и кондиционирования
воздуха. М.: Стройиздат, 1978. 115 с.
. .
Горбис, З.Р. Теплообмен и гидромеханика дисперсных сквозных потоков. М.:
Энергия, - 1970. - 399 с.
. .
Романков, П.Г., Курочкина, М.И. Гидромеханические процессы в химической
технологии. Л.: Химия, - 1974. - 286 с.
. .
Романовский, В.В. Изучение скорости осаждения крупных наносов. // Тр. ГГИ. -
вып. 132. - 1966.- 90-109 с.
. .
Проскуряков, А.К. К вопросу о двух теориях переноса взвешенных наносов //
Проблемы русловых процессов. Л.: Гидрометеоиздат, - 1953, - 43-51 с.
. Самолюбов,
Б.И. Диффузия полидисперсной взвеси, энерго- и теплообмен под влиянием
вихреволновых структур в плотностном течении // Гидрофизич. процессы в реках,
водохранилищах и окраинных морях. М.: - 1989.- 180-197 с.
. .
Туницкий, Н.Н. Диффузия и случайные процессы. Новосибирск: Наука, -1970. - 116
с.
. .
Франкель, Ф.И. К теории движения взвешенных наносов // ДАН СССР, т. 92, № 2, -
1953.
. .
Левин, Б.М., Дровянникова, В.И., Зажурило, Т.И. Исследование процессов
осаждения мелкодисперсных суспензий в условиях малых концентраций // Сб. трудов
МИИТ, - 1963. - № 176.
. .
Родзиллер, И.Д. Прогноз качества воды водоемов-приемников сточных вод. М.:
Стройиздат, - 1984. -262 с.
. .
Каплин В.Т., Семенченко Л.В., Иванов Е.Г. Распад фенольной смеси в природной
воде (моделирование) // Гидротехнические материалы, 1968, т. 46, 199-203 с.
. .
Дерягин, Б.В. Адгезия твердых тел. // М.: Наука, - 1973.
. .
Воюцкий, С.С. Курс коллоидной химии. // М.: Химия, - 1964.
. .
Дерягин, Б.В. Поверхностные явления и свойства грунтов и глин // Изв. АН СССР;
ОТН, - 1937. - № 6, 39.
. .
Лившиц, Е.М. Теория молекулярных сил притяжения между твердыми телами // Журнал
эксперимент. и теоретич. физики, - 1955. - т. 29, 94-110 с.
. .
Дерягин Б.В., Абрикосова И.И., Лифшиц Е.М. Молекулярное притяжение
конденсированных сил // Успехи физ. наук, 1958, 64. 493-528 с.
. .
Дерягин Б.В., Ландау Л.Д. Теория устойчивости сильно заряженных лиофобных золей
и слипания сильнозаряженных частиц в растворах электролитов // Журнал
эксперимент. и теоретич. физики, 1945, т. 15, 663 с.
. .
Мирцхулава, Ц.Е. Размыв русел и методика оценки их устойчивости. М.: Колос, -
1967. - 177 с.
. .
Цытович, Н.А. Механика грунтов. М.: Высшая школа, - 1979. - 272 с.
. .
Замарин, Е.А. Транспортирующая способность открытых потоков. М.: Стройиздат, -
1948. - 77 с.
. .
Абальянц, С.Х. Устойчивые и переходные режимы в искусственных руслах. Л.:
Гидрометеоиздат, - 1981.- 238 с.
. .
Россинский, К.И., Дебольский, В.К. Речные наносы. М.: Наука, - 1980. - 214 с.
. .
Егиазаров, И.В. К решению задачи о транспорте несвязных наносов (любых фракций)
с учетом влияния их концентрации в слое придонной мутности // Изв. АН СССР,
ОТН, - 1959. -№ 5.
. .
Егиазаров, И.В. Обобщенное уравнение транспорта несвязных наносов, коэффициент
сопротивления размываемого русла и неразмывающая скорость // Труды III Всесоюз.
гидрол. съезда. Л.: Гидрометеоиздат, - 1957.
. .
Евилевич, А.З. Расчет и проектирование илопроводов. М.: Изд. МКХ РСФСР, - 1962.
- 114 с.
. .
Караушев, А.В. Проблемы динамики естественных водных потоков. Л.:
Гидрометеоиздат, - 1960. - 391 с.
. Шамов,
Г.И. Речные наносы. Л.: Гидрометеоиздат, - 1954. - 345 с.
. .
Гришанин, К.В. Динамика русловых потоков. Л.: Гидрометеоиздат, - 1979. - 211 с.
. .
Бодряшкин, Я.В. Гидравлические параметры при начале подвижки песчаных наносов
// Метеорология и гидрология, - 1957. - № 10.
. .
Леви, И.И. Динамика русловых потоков. М.-Л., - 1957. - 224 с.
. .
Михайлова, Н.А. Перенос твердых частиц турбулентными потоками воды. Л.:
Гидрометеоиздат, - 1966. - 232 с.
. .
Бреховских, В.Ф., Вишневская, Г.Н., Мордасов, М.А. О влиянии бентосных
организмов на величины размывающих скоростей связных грунтов // Гидрофизич.
процессы в реках, в-щах и окраинных морях. М.: Наука, - 1989. -19-28 с.
. .
Суйкова, Н.В., Маркова, И.М., Боровков, В.С. Консолидация водонасыщенных
мелкодисперсных взвесей и их транспортирование водными потоками //
Водоснабжение и санитарная техника, - 2007. - № 11, -49-53 с.
. .
Майрановский, Ф.Г., Альтшуль, Ю.А. О закономерностях движения воды с малыми
концентрациями мелких взвесей // Тр. МИСИ им. В.В. Куйбышева, - 1972. - сб.
№89.
. .
Маккавеев, В.М. Вопросы турбулентности и движения наносов // Труды ГГИ, Вып.
100. Л.: Гидрометеоиздат, - 1963.
. .
Штеренлихт, Д.В. Гидравлика. М.: - 1984. - 639 с.
. .
Тернер, Дж. Эффект плавучести в жидкостях. М.: Мир, - 1977. - 429 с.
. .
Самолюбов, Б.И., Решетников, А.Б. Профиль концентрации взвеси в придонном слое
суспензионного течения // Динамика и термика рек, в-щ, внутренних и окраинных
морей, 4-я конф.: Тез. докл. Т. 1. М., - 1994. - 315-317 с.
. .
Лятхер, В.М. Турбулентность в гидросооружениях. М.: Энергия, - 1968. - 408 с.
. .
Великанов, М.А. Динамика русловых потоков. Т. 1. М.: Гостехиздат, - 1954. - 323
с.
. .
Рауз, Х. Механика жидкости для инженеров-гидротехников. М.: Стройиздат, - 1967.
- 390 с.
. .
Проблемы турбулентности / Под ред. М.А. Великанова и Н.Т. Швейковского. М.-Л.:
ОНТИ НКТП СССР, - 1936. - 332 с.
. .
Земцов, В.М., Гидравлика. М: изд-во Ассоциации строительных вузов, 2007, 350 с.
. .
Бронштейн, И.Н., Семендяев, К.А. Справочник по математике. - М.: Наука, - 1964.
. .
Хосровянц, И.Л. Научные основы инструментария диагностико-прогностических
расчетов качества воды в водных объектах. - М.: Альянс, - 2006. - 192 с.
. .
Спиридонов В. Н. Гидравлические характеристики открытого потока в проницаемом
русле. Автореф. диссертации на соискание уч. степени канд. техн. наук. М.,
1986. - 20 с.
. .
Справочник по гидрохимии. Под ред. Никанорова А.М. Л.: Гидрометеоиздат, 1989,
-391 с.
. .
Козлова, Н.М. Загрязнение и самоочищение р. Москвы. сб. Охрана водной среды. -
М.: Московский рабочий, - 1978. - 97-105 с.
. .
Трифонов, К.И., Девисилов, В.А. Физико-химические процессы в техносфере. - М.:
ФОРУМ-ИНФРА-М, - 2007. -239 с.
. .
Лыков, А.В. Тепломассообмен. - М.: Энергия, - 1978. - 480 с.
. .
Кочарян, А. Г., Веницианов, Е. В. и др. Сезонные изменения форм нахождения
тяжелых металлов в водах и ДО Куйбышевского водохранилища // Водные ресурсы. Т.
30. № 4. - 2003. - 443-451 с.
. .
Белоконь, В.Н., Басс, Я. И. Содержание тяжелых металлов, органических веществ и
соединений биогенных элементов в ДО Дуная // Вод. ресурсы, Т. 20. - 1993. - 469
- 478 с.
. .
Vikesland, P.J., Valentine, R.L. Iron oxide surface-catalyzed oxidation of
ferrous iron by monochloramine: implications of oxide type and carbonate on
reactivity// Environmental Science and Technology, T. 36, - 2002. - 512-519 р.
. .
Stumm W., Morgan J.J. Aquatic Chemistry, New York: Wiley, 1022 -С., 1996.
. .
Вышемирский, В.С. Органическое вещество в Мировом океане. - Новосибирск: Изд-во
НГУ, - 1986. - 73 - 89 с.
. .
Reddy, K.R., Feijtel, T.C., Patric, W.H. Effect of soil redox conditions on
microbial oxidation of organic matter // The role of organic matter in modern
agriculture. - 1986. - 66 - 71 р.
. .
Sutherland, R.A. Bed sediment-associated trace metals in an urban stream, Oahu,
Hawaii // Environmantal geology, Vol. 39, № 6. - 2000. - 611 - 627 р.
. .
Salomons, W. Biogeodynamics of pollutants in soils and sediments / Eds
Stigliani. - Berlin: Springer-Verlag, - 1995. - 353 p.
. .
Calmano, W., Ahfl, W., Forstner, U. Exchange of heavy metals between sediment
components and water // Metal Speciation in the Environment / Eds. J.A.C.
Broecart, S. Gucer and F. Adams. - Berlin: Springer-Verlag, - 1990. - 503 - 522
р.
. .
EPA 823-D-96-002. U.S. Environmental Protection Agency. The national sediment
quality survey. A report to Congress on the extent and severity of sediment
contamination in surface waters of the United States. Office of Water. -
Washington, DC, - 1996.
. .
Meyer, J.S., Davidson, W., Sundby, B. The effects of variable redox
potentials, pH, and light on bioavailability in dynamic water-sediment
environments // Bioavailability - physical, chemical, and biological
interactions / Eds. J. Hamelink, P.F. Lan-drum, H.L. Bergman, W.H. Benson. -
Boca Roton: Lewis Publ., - 1993. - 155 - 170 р.
. .
Сиротюк, Э.А., Тах, И.П., Тороян, Р.А. Формы нахождения тяжёлых металлов и их
распределение по абиотическим компонентам экосистемы реки Белая
Северо-Западного Кавказа Международный научно-практический семинар, Майкоп, 12
- 15 мая - 2009.
. .
Усенков, С. М. Гранулометрия поверхностных донных отложений Ладожского озера //
Вестник С.-Петербург. Ун-та. - Сер. 7. - Вып. 3 (№21). - 1993. - 48-57 с.
. .
Усенков, С. М. Особенности современного седиментогенеза в Ладожском озере /
Литология и полезные ископаемые, - №1. - 2003. - 15-26 с.
. Кленова,
М.В. Классификация современных морских осадков - Известия АН СССР, серия
геологическая, - №3. - 1954. - 52-62 с.
. .
Страхов Н.М., Бродская Н.Г., Князева Л.М. и др. Образование осадков в
современных водоемах. Изд-во АН СССР, 1954.
. .
Папина, Т.С., Третьякова, Е.И., Эйрих, А.Н. Факторы, влияющие на распределение
тяжелых металлов по абиотическим компонентам водных экосистем Средней и Нижней
Оби // Там же, - № 7. - 1999. - 553 - 564 с.
. .
Чекренев Сергей Александрович. Исследование донных отложений поверхностных
водоемов и обезвреживание их от тяжелых металлов: диссертация на соискание
степени кандидата химических наук.- Санкт-Петербург, 2002.- 151 с.
. Кольцов,
А. Б. Некоторые особенности природных и антропогенных изменений современных
осадков малых озер Карелии и Прибалтики//Материалы 4-й научной конференции
аспирантов и молодых ученых. - М.: Сер. Геология, - 1978. - 34-36 с.
. .
Драбкова, В.Г., Сорокин, И.Н. Озеро и его водосбор - единая природная система.
- Л.: Наука , - 1979. - 195 с.
. .
Ладожское озеро - прошлое, настоящее, будущее. - СПб.: Наука, - 2002.-327 с.
. .
Жукова, Т.В., Мартынова, М.В., Жуков, Э.П. Донные отложения в экосистеме
Нарочанских озер. 3. Формы фосфора // Водные ресурсы, - №32.- 1991. - 90-102 с.
. .
Gnandi, K., Tobschal, H.J. The pollution of marine sediments by trace elements
in the coastal region of Togo caused by dumping of cadmium-rich phosphorite
tailing into the sea // Environmental Geology, - 1999. - Vol. 38, № 1. - 13 -
24 р.
. .
Huang, P.M., Liaw, W.K. Distribution and fractionation of arsenic in selected
fresh water lake sediments // Internationale Revue der Gesamten Hydrobiologia,
- 1978. - Vol. 63. - 533 -543 р.
. .
Heron, G., Christensen, T.H., Tjell, J.Ch. Oxidation capacity of aquifer
sediments // Environ. Sci. Technol, - 1993. - Vol. 28. - 153 - 158 р.
. .
Barcelona, M., Holm, T.H. Oxidation-reduction capacities of aquifer solids //
Environ. Sci. Technol, - 1991. - Vol. 25. - 1565 - 1572 р.
. .
Bourg, A.C.M., Loch, J.P.G. Mobilization of heavy metals as affected by pH and
redox conditions // Biogeodynamics of pollutants in soils and sediments / Eds.
W. Salomons and W.M. Stigliani. - Berlin: Springer-Verlag, - 1995. - 87 - 102
р.
. .
Salоmons, W., Forstner, U. Metals in the Hygrocycle. - Berlin: Springer-Verlag,
N.Y.: Heidelberg, - 1984. - 89 - 98 р.
. .
Goldhaber, M.B., Kaplan, I.R. The sulfur cycle in the sea // Marine Chemistry /
Ed. by E.D. Goldberg. - N.Y.: John Wiley & Sons, - 1974. - Vol. 5. - 569 -
655 р.
. .
Горленко, В.М., Вайнштейн, М.Б., Качалкин, В.И. Микробиология оз. Могильное //
Реликтовое озеро Могильное. - Л.: Наука, - 1976. - 188 - 197 с.
. .
Jorgensen, B.B. A comparison of methods for the quantification of bacterial
sulfate reduction in coastal marine sediments // Geomicrobial. J., - 1978. -
Vol. 1, № 1. - 11 - 64 р.
. .
Баас-Бекинг, Л.Т.М., Каплан, И.Ф., Мур, Д. Пределы колебаний рН и
окислительно-восстановительных потенциалов природной среды // Геохимия
литогенеза. - М.: Изд-во иностр. лит., - 1963. - 11 - 84 с.
. .
Nedwell, D.B., Floodgate, G.D. Temperature induced changes in the formation of
sulfide in marine sediment // Mar. Biolog. - 1972. - Vol. 14, № 1. - 18 - 24 р.
. .
Smith, R.L., Klug, M. J. Reduction of sulfur compounds in the sediments of a
eutrophilic lake basin // Appl. Environ. Microbiol, - 1981. - Vol. 41, № 5. -
1230 - 1237 р.
. .
Parkin, T.B., Brock, T.D. Photosynthetic bacterial production and carbon mineralization
in a meromicitic lake // Arch. Hydrobiol, - 1981. - Vol. 91, № 3. - 366 - 382
р.
. .
Roden, E.E., Edmonds, J.W. Phosphate mobilization in iron-rich anaerobic
sediments: microbial Fe (III) reduction versus iron-sulfide formation. Arch.
Hydrobiol., - 1997. - 139(3), - 347-378 р.
. .
Berry, W.J., Hansen, D.J., Mahony, J.D. et al. Predicting the toxicity of
metal-spiked laboratory sediments using acid-volatile sulfide and interstitial
water normalization // Environ. Toxicol. Chem. - 1996. - Vol. 15, № 12. - 2067
- 2079 р.
. .
Третьякова, Е.И., Папина, Т.С. Особенности распределения тяжелых металлов по
компонентам водоемов различной минерализации // Химия в интересах устойчивого
развития, - 2000. - № 8. - 429 - 438 с.
. .
Ankley, G.T., Di Toro, D.M., Hansen, D.J. Technical basis and proposal for
deriving sediment quality criteria for metals // Environ. Toxicol. Chem, -
1996. - Vol. 15, № 12. - 2056 - 2066 р.
. .
DeWitt, T.H., Swartz, R.C., Hansen, D.J. et al. Bioavailability and chronic
toxicity of cadmium in sadiment to the estuarine amphipod, Leptocheirus
plumulosus // Environ. Toxicol. Chem, - 1996. - Vol. 15. - 2095 - 2101 р.
. .
Hansen. D.J., Mahony, J.D., Berry, W.J. et al. Chronic effect of cadmium in
sediments on colonization by benthic marine organisms: An evaluation of the
role of interstitial cadmium and acid-volatile sulfide in biological
availability // Environ. Toxicol. Chem, - 1996. - Vol. 15. - 2126 - 2137 р.
. .
EPA-SAB-EPEC-95-020. U.S. Environmental Protection Agency. In SAB report:
Review of the agencies approach for developing sediment criteria for five
metals. Office of Water. - Washington, DC. - 1995.
. .
Третьякова, Е.И., Папина, Т.С., Эйрих, А.Н. Влияние сульфидной фракции на
поведение тяжелых металлов в ДО. - Ползуновский вестник, - 2008. - № 1-2,
144-147 с.
. .
Мельничук, В.И. Круговорот серы и связывание тяжелых металлов в ДО //
Антропогенное перераспределение органического вещества в биосфере. - СПб.:
Наука, - 1993. - 104 - 108 с.
. .
Presley, B.T., Kaplan, I.R. // Geochim. Cosmochim. Acta. - 1972. - Vol. 32. -
1037 -1048 р.
. .
Morfett, K., Davison, W., Hamilton-Taylor, T. // Environ. Geol. Water Sci. -
1988. - Vol. 11, № 1. - 107 - 114 р.
. .
Gambrell, R.P., Reddy, N., Sundbuy, B. et al. Early diagenesis of cadmium and
cobalt in sediments of Laurentian Trough // Geochim. Cosmochim. Acta. - 1983. -
Vol. 50. - 741 -747 р.
. .
Silva, J. Study of the complexation of Cu (II) by fulvic acids extracted from a
sewage sludge and its compost / J. Silva, A. Machado, M. Pinto // Fresenius
anal. Chem., - 1997. - Vol.357. - 950 - 957 р.
. .
Royer, G.B. The roles of natural organic matter in chemical and microbial
reduction of ferric ion / Gu. B. Royer, R.W. Burgos // Sci. Total Environ. -
Vol. 307.- 167 -178 р.
. .
Wasserman, J. Cu and Fe associated with humic acids in sediments of a tropical
coastal lagoon / J. Wasserman, F. Oliveira, M. Bidarra // Org. Geochem. - Vol.
28. - 813 - 822 р.
. .
Косов, В.И., Иванов, Г.Н., Левинский, В.В., Ежов, Е.В. Концентрации тяжёлых
металлов в ДО верхней Волги // Водные ресурсы, - 2001. - т. 28, №4. - 448 - 453
с.
. .
Орлов, Д.С. Химия почв [Текст] - 2-е издание, переработанное и дополненное /
Д.С. Орлов - М.: МГУ, - 1992. - 400 с.
. .
Белицина, Г.Д. Почва и почвообразование [Текст] / Г.Д. Белицина, В.Д.
Васильевская, Л.А. Гришина - М.: Высшая школа, - 1988. - 400 с.
. .
Тейт, Р. Органическое вещество почвы [Текст] / Р. Тейт - М.: Мир, - 1991.-399
с.
. .
Hart, B.T. Trace metal complexing capacity of natural water: a review
[Text]/B.T. Hart // Environ. Technol. Lett. - 1981. - Vol.2. - №1. - p. 95 -
110.
. .
Kosakowska, A. Effect of amino acids on the toxicity of heavy metals to
phytoplankton / A. Kosakowska, L. Falkowski, Lewandowska I. //Bull. Environ.
Contam. Toxicol, - 1988. - Vol.40. - 532 - 538 р.
. .
Благой, Ю.П. Металлокомплексы нуклеиновых кислот в растворах / Ю.П. Благой,
В.Л. Галкин, Г.О. Гладченко, С.В. Корнилова, В.А. Сорокин А.Г. Шкорбатов -
Киев.: Наукова думка, - 1991. - 270 с.
. .
Павленко, Е.С., Ерёменко, В.Я. Комплексные соединения тяжёлых металлов с
фульвокислотами // Гидрохимические материалы. - Л.: Гидрометеоиздат. - 1975. -
т. LXII. - 174 - 176 с.
. .
Денисова, A.M., Нахшина, Е.П., Новиков, Б.И., Рябов, А.К. Донные отложения
водохранилищ и их влияние на качество воды, - Киев: Наукова думка, - 1987. -
163 с.
. .
Орлов, Д.С. О природе и механизмах образования металлгумусовых комплексов /
Д.С. Орлов, О.И. Минько, В.В. Демин, В.Г. Сальников, Н.Б. Измайлова //
Почвоведение. - 1988. - №9. - 43 - 52 с.
. .
Варшал, Г.М., Кощеева, И.Я., Сироткина, И.С. и др. Изучение органических
веществ поверхностных вод и их взаимодействия с ионами тяжелых металлов//
Геохимия, - 1979. - T. 4. - 598-607 с.
. .
Болдырев, К.А. Моделирование процессов внутрипластовой очистки подземных вод от
железа и Mn// Водоснабжение, водоотведение, гидротехника и инженерная
гидрогеология, - Вып. 12. - 2011.
. .
Крайнов, С.Р., Швец, В.М. Гидрогеохимия. - М.: Недра, - 1992. - 92-134 с.
. . ГН
2.1.5.689-98. Предельно допустимые концентрации (ПДК) химических веществ в воде
водных объектов хозяйственно-питьевого и культурно-бытового водопользования.
Москва. 1998.
. . ГН
2.1.7.2041-06. Предельно допустимые концентрации (ПДК) химических веществ в
почве. Введен с 23 января 2006 года N 1 (Гигиенические нормативы), Москва,
2006.
. .
Качество вод. Термины и определения. [Текст]: ГОСТ 27065-86. введ. 01.01.1987.
. .
СанПиН 2.1.5.980-00. Гигиенические требования к охране поверхностных вод.
Взамен СанПиН 4630-88. Введен с 1 января 2001 г. Москва, 2001.-(Санитарные
правила и нормы).
. .
Сает, Ю.Е., Ревич, Б.А., Янин, Е.П. Геохимия окружающей среды - М.: Недра, -
1990, .-335 с.
. .
Гуляева, Н.Г. Методические рекомендации по эколого-геохимической оценке
территорий при проведении многоцелевого геохимического картирования масштабов
1:1000000 и 1:200000 - М.: ИМГРЭ, - 2002. - 70 с.
. .
Головин, А.А., Морозова, И.А., Трефилова, Н.Я., Гуляева, Н.Г. Учет и оценка
природных ресурсов и экологического состояния территорий функционального
использования - М.: ИМГРЭ, - 1996.
. .
Израэль Ю.А. Экология и контроль состояния природной среды и пути их решения.
Л.: Гидрометеоиздат, 1984-560 с..
. .
Методические рекомендации по проведению полевых и лабораторных исследований
почв и растений при контроле загрязнения окружающей среды металлами / Под ред.
Н.Г.Зырина и С.Г.Малахова - М.: Гидрометеоиздат, - 1982.
. .
Экспериментальная экология / Под ред. В.И.Вефели М.: Наука, 1991, -248 с.
. .
Охрана природы. Почвы. Классификация химических веществ для контроля
загрязнения [Текст] : ГОСТ 17.4.1.02-83. введ с 01.01.85.
. .
Методические указания по оценке степени опасности загрязнения почвы химическими
веществами № 4266-87. Утв. МЗ СССР 13.03.87.
. .
Обзор загрязнения окружающей природной среды в Российской Федерации за 1997 год
- Минприроды: «Зеленый мир». - № 20. Специальный выпуск, - 1998.
. .
Persaud, D.R., Jaagumagi, D.R., Hayton, A. Guidelines for the protection and
management of aquatic sediment quality in Ontario. Ontario Ministry of the
Environment and Energy. Ontario, - 1993. - 24 p.
. .
Long, E.R., Morgan, L.G. The potential for biological effects of
sediment-sorbed contaminants tested in the National Status and Trends Program.
NOAA Technical Memorandum NOS OMA 52, National Oceanic and Atmospheric
Administration, Seattle, WA, - 1991. - 175 p. - 1 appendices.
. .
Ingersoll, C.G., Haverland, P.S., Brunson, E.L., Canfield, T.J., Dwyer, F.J.,
Henke, C.E., Kemble, N.E., Mount, D.R., Fox, R.G. Calculation and evaluation of
sediment effect concentrations for the amphipod Hyalella azteca and the midge
Chironomus riparius. J Great Lakes Res, - 1996. - 22, 602-623 р.
. .
Cubbage, J, Batts, D, Briedenbach, S Creation and analysis of freshwater
sediment quality values in Washington State. Environmental Investigations and
Laboratory Services Program, Washington Department of Ecology, Olympia, WA, -
1997.
. . Di
Toro, D.M., Zarb, C.S., Hansen, D.J., Berry, W.J., Swartz, R.C., Cowan, C.E.,
Pavlou, S.P., Allen, H.E., Thomas, N.A., Paquin, P.R. Technical basis for
establishing sediment quality criteria for non-ionic organic chemicals using
equilibrium partitioning. Environ Toxicol Chem, - 1991. - 10,1541-1583 р.
. .
NYSDEC (New York State Department of Environmental Conservation) (1994)
Technical guidance for screening contaminated sediments. Division of Fish and Wildlife,
Division of Marine Resources, Albany, NY, - 1994. - 36 p.
. .
EPA (United States Environmental Protection Agency) The incidence and severity
of sediment contamination in surface waters of the United States. Volume 1:
National sediment quality survey. EPA 823-R-97-006, Office of Science and
Technology, Washington, DC, - 1997.
. .
Бреховских, В.Ф., Волкова, З.В., Колесниченко, H.H. Проблемы качества
поверхностных вод в бассейне Северной Двины - М.: Наука, - 2003. - 233 с.
. .
Даувальтер, В.А. Оценка экологического состояния поверхностных вод Европейской
Субарктики по результатам исследования донных отложений / В.А. Даувальтер //
Тезисы докладов VIII Гидробиологического общества РАН, - 2001.-Т.2, - 121 с.
. .
Петрова, И.В. Экспериментальное исследование влияния загрязненного дизельным
топливом ила на гидрохимический режим и бентос (на примере Asellus aquaticus).
JI.: Изв. ГосНИОРХ, - 1981. - Вып. 173. - 102-107 с.
. .
Петрова, И.В. Способ расчета наибольших недействующих концентраций загрязняющих
веществ для донных отложений. Влияние биологически активных веществ на
гидробионтов / И.В. Петрова // Сборник научных трудов, - 1988. - Вып. - 287. -
79-87 с.
. .
Степанова, Н.Ю. Экологические критерии нормирования нагрузки на водоем в
условиях его загрязнения возвратными водами: Автореф. дисс. . канд. биол. наук.
/ Н.Ю. Степанова. - Каз. гос. ун-т.: Казань, - 1999. - 22 с.
. .
Томилина, И.И., Комов, В.Т. Донные отложения как объект токсикологических
исследований (обзор). Биология внутренних вод, - 2002. - №2. - 20-26 с.
. .
Петрухин, В.А., Буриева, Л.В., Папенко, Л.А. и др. Фоновое содержание
микроэлементов в природных средах (по мировым данным). Сообщение 5 //
Мониторинг фонового загрязнения природных сред, - Л.: Гидрометеоиздат, - 1989.
- Вып. 5. - 4 - 30 с.
. .
Виноградов, А.П. Введение в геохимию океана, - М.: Наука, - 1967. - 190 с.
. .
Goldberg, E., Arrhenius, G. Chemistry of Pacific pelagic sediments // Geochim.
Cosmochim.Acta, - 1958. - Vol.13. - 153 - 212 р.
. .
Hirst, D., Nicholls, G. Techniques in sedimentary geochemistry. 1. Separation
of the detrital and nondetrital fractions of limestones // J. Sediment. Petrol,
- 1958. - Vol. 28. - 468 - 481 р.
. .
Diks, D., Allen, H. Correlation of copper distribution in a freshwater-sediment
system to bioavailability // Bull. of Environmental Contamination and
Toxicology, - 1983. - Vol. 30. - 37 - 43 р.
. .
Horowitz, A.J. A primer on trace metal-sediment chemistry - Alexandria, - 1985.
- 67 p. -(U.S. Geological Survey water-supply paper 2277).
. .
Luoma, S., Bryan, G. A statistical assessment of the form of trace metals in
oxidized estuarinesediments employing chemical extractants // Sci. Total
Environ, - 1981. - Vol. 17. - 165 -196 р.
. .
Villaescusa, C.J.A., Gutierrez, G.E.A., Flores, М.G. Heavy metals in
geochemical sediment fractions of the border region between Baja California,
Mexico, and California, USA - Ciencias Marinas, - 1997. - Vol. 23, № 1. - 43 -
70 р.
. .
Stone, M., Droppo, I.G. Distribution of lead, copper and zinc in
size-fractionated river bed sediment in two agricultural catchments of southern
Ontario, Canada // Environ. Pollut, - 1996.- Vol. 93, № 3. - 353 - 362 р.
. .
Tessier, A., Campbell, H.G., Bisson, M. Sequential extraction procedure for the
speciationof particulate trace metals // Anal. Chem, - 1979. - Vol. 51. - 844 -
851 р.
. .
Contaminants in the Mississippi River, 1987-1992 / Ed. by R.H. Meade. - Denver,
- (U.S. Geological Survey; Circular 1133), - 1996. - 140 р.
. .
EPA (United States Environmental Protection Agency) Calculation and evaluation
of sediment effect concentrations for the amphipod Hyalella azteca and the
midge Chironomus riparius. EPA 905-R96-008, Great Lakes National Program
Office, Region V, Chicago, IL, - 1996..
. . US
EPA (United States Environmental Protection Agency) Assessment of sediment in
the Indiana Harbor area of concern. EPA 905-R96-009, Great Lakes National
Program Office, Region V, Chicago, IL, - 1996.
. .
MacDonald, D.D. Development and Evaluation of Consensus-Based Quality
Guidelines for Freshwater Ecosystem / D.D. MacDonald, C.G. Ingersoll, T.A.
Berger // Arch. Environ. Contam. Toxicol, - 2000. - V.39. - 20 р.
. .
Smith, S.L., MacDonald, D.D., Keenleyside, K.A., Ingersoll, C.G., Field, J.A.
Preliming evaluation of sediment quality assessment values for freshwater
ecosystems. J Great Lakes Res 22624-638, - 1996.
. .
EC, MENVIQ (Environment Canada and Ministere de l’Environement du Quebec)
Interim criteria foe quality assessment of St. Lawrence River Sediment.
Environment Canada, Ottawa, - 1992.
. .
Нормы и критерии оценки загрязненности донных отложений в водных объектах
Санкт-Петербурга [Текст]: РД ОАО "Ленморниипроект". Санкт-Петербурга,
1996.