Проект виробництва таблеток 'Парацетамол'
ЗМІСТ
ВСТУП
.
ЛІТЕРАТУРНИЙ ОГЛЯД
.1
Проблема лікування болю та шляхи її вирішення
.2
Історична довідка
.3
Механізм дії анальгетиків
.4
Механізм біологічної активності парацетамолу
.5
Методи синтезу та аналіз парацетамолу
.6
Клінічні дослідження
.7
Парацетамол на ринку України
.
ТЕХНОЛОГІЧНА ЧАСТИНА
.1
Характеристика готової продукції
.2
Схема виробництва і технологічний процес
.3
Блок-схема технологічного процесу виробництва таблеток «Парацетамол 325 мг»
.4
Характеристика сировиннни, матеріалів та напівпродуктів
2.5 Опис стадій технологічного процесу
.6
Методики технологічного контролю
.7
Матеріальний баланс
.8
Вибір основного обладнання
.
ОХОРОНА НАВКОЛИШНЬОГО СЕРЕДОВИЩА
СПИСОК
ЛІТЕРАТУРИ
ДОДАТОК
ВСТУП
Біль є одній з основних причин звернення людей по медичну
допомогу. В даний час найпоширеніший і раціональніший метод попередження і
купірування болю - фармакологічний, тому анальгетики є найбільш часто вживаними
лікарськими препаратами.
Серед широкого спектру болезаспокійливих засобів найбільшого поширення
набули анальгетики-антипіретики у формі пігулок. Найчастіше використовують
лікарські препарати, основним компонентом яких є парацетамол
(параацетамінофенол). Парацетамол, що увійшов до медичної практики завдяки
дослідженням Meringx (1893), включений ВООЗ в перелік життєво важливих
лікарських засобів. Парацетамол відноситься до ненаркотичних анальгетиків
центральної дії і має, окрім болезаспокійливої, виражену жарознижуючу дію.
Тисячі фармацевтичних фірм в десятках країн світу виготовляють парацетамол під сотнями
найрізноманітніших назв і в найрізноманітніших формах: капсулах, сиропах,
свічках, краплях, еліксирах, пігулках простих, пігулках жувальних і пігулках
“шипучих”, розчинах для прийому всередину і для ін'єкцій (уколів). З'явилося
безліч парацетамолвмісних комбінованих лікарських форм, зокрема в поєднаннях з
ацетилсаліциловою кислотою
<#"906481.files/image001.gif">
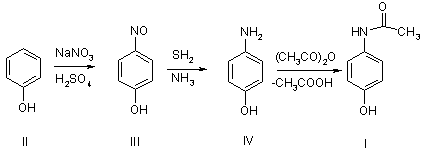
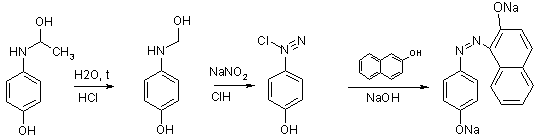
Вихідним продуктом синтезу парацетамолу служить фенол (ІІ). Фенол
нітрозують натрію нітритом у кислому середовищі. Утворений п-нітрозофенол (ІІІ)
відновлюють сірководнем в амоніачному середовищі до п-амінофенолу (ІV), який ацетилюють до парацетамолу (I) [8]:
Білий або білий з кремоватим або рожевим відтінком кристалічний порошок
без запаху. M. в. 151, 17
Важко розчинний у воді, легко розчинимо в 95% спирті, розчинний в
ацетоні і розчинах їдких лугів, практично не розчиняється в ефірі.
Температура плавлення 168-172° (в межах 3°) [9].
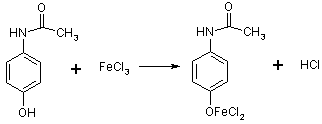
Якісний аналіз. Існує декілька методів якісного аналізу
препарату [10]:
1. Реакція з FeCl3 -
утворюється синьо-фіолетове забарвлення:
2. При нагріванні з К2Сг2О7
у присутності кислоти утворюється індофенол синьо-фіолетового кольору:
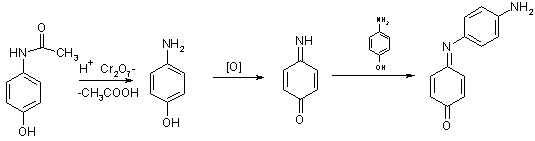
3. Наявність у молекулі фенольного
гідроксилу зумовлює реакцію парацетамолу із солями діазонію - утворюється
азобарвник червоного кольору:
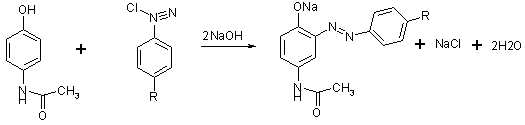
. Після кислотного гідролізу, під час
якого звільняється первинна ароматична аміногрупа, лікарська речовина дає
реакцію діазотування з наступним азосполученням:
Кількісний аналіз. Для кількісного визначення препарату
використовують метод нітритометрії (після гідролізу лікарської речовини).
Аналіз проводять прямим титруванням з використанням індикатору -
йодидкрохмального папірця:
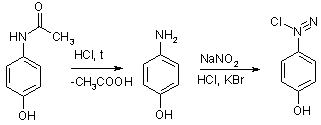
Точку еквівалентності визначають за
посинінням йодидкрохмального папірця від надлишкової краплі титранту:
NaNO2 + 4HCl I2
+ 2NO +KCl + 2NaCl + H2O
Паралельно проводять контрольний
дослід [10].
1.6 Клінічні
дослідження
Хоча парацетамол використовується в якості лікарського засобу
протягом багатьох десятиліть, нові клінічні дослідження продовжують проводити
по всьому світу.
Останні дослідження говорять про те, что парацетамол є не
таким безпечним для використання, як досі вважалось.
Згідно з результатами дослідження, опублікованими в журналі American Journal
of Epidemiology [11], тривале використання нестероїдних протизапальних
засобів і парацетамолу підвищує ризик втрати слуху.
Про те, що між прийомом цих лікарських засобів і зниженням
слуху існує зв'язок, було відомо і раніше. Однак не проводилися дослідження з вивчення залежності появи
проблем зі слухом від тривалості лікування.
Автори роботи вивчили дані, які були отримані в ході великого дослідження
здоров'я медичних сестер за участю 55850 тисяч жінок. Вони проаналізували
інформацію про жінок, які приймали
знеболюючі препарати і зверталися
зі скаргами на втрату слуху.
Виявилося, що більш тривалий прийом НПЗЗ (більше шести років) підвищує
ризик розвитку проблем зі слухом на 10% в порівнянні з використанням цих
препаратів менш одного року. При використанні парацетамолу більше шести років
ймовірність розвитку втрати слуху збільшувалася на 9%. Тривалий регулярний
прийом аспірину не був пов'язаний з ризиком розвитку проблем зі слухом у
учасниць.
З огляду на широку поширеність застосування НПЗЗ і парацетамолу, це може
бути важливим модифікуючим фактором
розвитку проблем зі слухом.
Провівши масштабне дослідження аналгетиків, що призначаються
при остеоартрозі, інші вчені виявили, що парацетамол не відповідає стандартам
мінімальної клінічної ефективності в зменшенні болю або поліпшенні фізичної
функції у пацієнтів з остеоартрозом колінних і тазостегнових суглобів [12]. І
хоча парацетамол виявився по ефективності трохи потужнішим, ніж плацебо,
дослідники роблять висновок, що сам по собі парацетамол в будь-якій дозі не має
ніякого значення в лікуванні пацієнтів з остеоартрозом.
У всьому світі 9, 6% чоловіків і 18% жінок у віці старше 60 років
страждають на остеоартроз. Підрахунки показують, що 26, 9 мільйона дорослих у
США і 8750000 у Великобританії мають це захворювання. Артроз є провідною
причиною болю у літніх людей. Хвороба може призвести до погіршення фізичної
активності, що, в свою чергу, збільшує ризик ожиріння, серцево-судинних
захворювань, діабету і загального погіршення стану здоров'я у пацієнтів.
Доктор наук Sven Trelleіз Бернського університету в Швейцарії і його
колеги об'єднали дані 74 рандомізованих досліджень, опублікованих в період з
1980 по 2015 роки, в яких були дані 58556 пацієнтів з остеоартрозом, і в своєму
дослідженні (шляхом мета-аналізу) порівняли ефективність 22 різних медичних
препаратів і плацебо в купірування інтенсивності болю і поліпшення фізичної
активності. 22 препарату були представлені різними дозами парацетамолу і сім'ю
представниками класу НПЗП.
Парацетамол і нестероїдні протизапальні засоби, як правило, є засобами
першої лінії для лікування від легкого до помірного ступеня болю при
остеоартрозі, але парацетамол частіше використовується в довгостроковій
перспективі через серцево-судинних і шлунково-кишкових побічних ефектів,
пов'язаних з довгостроковим використанням НПЗП.
Аналіз показав, що всі 22 препарату, незалежно від дози, викликають
зменшення симптомів болю в порівнянні з плацебо. Хоча деякі дози парацетамолу
мали незначний вплив на поліпшення фізичної функції і зменшення болю, ефект
його був лише трохи краще, ніж ефект плацебо, і не досягав мінімального
клінічно значимої різниці (-0, 17 проти необхідних -0, 37). Для порівняння,
диклофенак в максимальній добовій дозі 150 мг / добу був найбільш ефективний
для лікування болю і фізичної непрацездатності при остеоартрозі (-0, 57), і
перевершував по ефективності максимальні дози часто використовуваних НПЗП,
включаючи ібупрофен, напроксен і целекоксиб.
За словами доктора Trelle, нестероїдні протизапальні засоби, як правило,
використовуються тільки для лікування короткострокових епізодів болю при
остеоартрозі, тому що побічні ефекти, як вважають, переважують вигоди при
використанні їх протягом більш тривалого терміну. Через це парацетамол часто
прописують для купірування болю замість НПЗП. Проте, результати дослідження
свідчать про те, що парацетамол в будь-якій дозі не ефективний в купірування
болю при остеоартрозі, а певні НПЗП ефективні і можуть бути використані курсами
без застосування парацетамолу.
Тривалість спостереження в більшості включених в аналіз досліджень була 3
місяці або менше, і автори визнають, що може виявитися необхідним виключення і
інших досліджень, які розглядали б процес більш тривалий час. Незважаючи на те,
що загальне число пацієнтів, включених в аналіз, було великим, кількість
індивідуальних досліджень, які б вивчали вплив індивідуальних доз, все ще
знаходиться на низькому рівні.
Інші клінічні дослідження визначили чи підсилює парацетамол
токсичну дію аспірину на слизову оболонку шлунково-кишкового тракту [13]. Метою
дослідження було вивчити вплив парацетамолу на токсичний ефект аспірину щодо
слизової оболонки шлунка і дванадцятипалої кишки, так як парацетамол широко
застосовують для симптоматичного лікування остеоартриту, а аспірин - для
профілактики серцево-судинних результатів.
У проспективному, подвійному сліпому, рандомізованому
дослідженні 60 здорових дорослих людей (18-75 років), у яких не було виявлено
зміни слизової оболонки шлунка і дванадцятипалої кишки при початковій
гастроскопії, отримували внутрішньо парацетамол 400 мг / добу (n = 21), аспірин 325 мг / добу (n = 19) або парацетамол 4000 мг / сут
і аспірин 325 мг / добу (n = 20). Через 7 днів повторювали
гастроскопію. Частота шлункових виразок достовірно не відрізнялася у хворих,
які отримували парацетамол (0/21, 0%) аспірин (3/19, 16%) або обидва препарати
(2/20, 10%). Проте, частота ерозій і виразок при комбінованої терапії (16/20,
80%) була вищою, ніж при лікуванні одним аспірином (8/19, 42%, P <0.001) або
парацетамолом (3/21, 14%, P <0.01). Середнє число виразок або ерозій на
пацієнта при лікуванні аспірином і парацетамолом також було вище, ніж при
застосуванні одного парацетамолу (7.9 vs. 0.7, P <0.01). Таким чином, поєднання
аспірину і парацетамолу супроводжувалося збільшенням частоти розвитку
ендоскопічних виразок і ерозій в порівнянні з монотерапією двома препаратами.
Наступні клінічні дослідження виявили, що часте застосування дітьми парацетамолу
може спровокувати розвиток астми в майбутньому [14]. Автори роботи відзначили також,
чим частіше діти приймають препарат, тим більше виражені симптоми захворювання.
В ході дослідження вчені опитали батьків понад 20 тисяч дітей віком від
шести до семи років і від тринадцяти до чотирнадцяти років. Опитування мало на
меті з'ясувати, чи були зафіксовані у дітей симптоми астми, а також з якою
періодичністю вони отримували парацетамол протягом попереднього року і в
дитячому віці. Виявилося, що у учасників, що входять в молодшу вікову групу,
які приймали препарат як мінімум один раз на місяць, ризик розвитку симптомів
астми зростав в 5 разів у порівнянні з тими дітьми, що не отримували лікарський
засіб. Діти 13-14 років, які брали парацетамол протягом попереднього року, на
40% частіше страждали астмою, якщо ж вони отримували препарат приблизно раз на
місяць, ризик розвитку захворювання збільшувався в 2, 5 рази.
На думку вчених, причина такої закономірності криється в тому, що
парацетамол може зменшувати рівень глутатіону в легенів і крові, а це
призводить до пошкодження легеневої тканини. Глутатіон є антиоксидант, який
захищає клітину від токсичних агентів.
Парацетамол є найбільш популярним болезаспокійливим і жарознижуючим
засобом. За даними The Daily Mail, близько 85% британських дітей в перші
півроку життя отримують даний лікарський засіб. У світлі отриманих даних,
автори роботи рекомендують батькам по можливості уникати призначення дітям у
віці до 12 років препарати з вмістом парацетамолу. Крім того, що препарат може
провокувати розвиток астми, останнім часом також з'явилися відомості про те, що
він також може призводити до розвитку гострої печінкової недостатності та
алергічних шкірних реакцій.
1.7 Парацетамол
на ринку України
Конкуренція на вітчизняному ринку препаратів парацетамолу у формі
таблеток (капсул, капає) досить висока. Всього в Україні зареєстровано 24
лікарських засоби, активною речовиною яких є парацетамол (без урахування
комбінованих препаратів).
За кількістю найменувань співвідношення препаратів українських і зарубіжних
виробників парацетамолу, представлених на ринку, становить приблизно 40:60 на
користь іноземних компаній. При цьому існує ще одна особливість, яка в значній
мірі визначає характер і рівень конкуренції. Всі фармацевтичні підприємства
України виробляють парацетамол в формі таблеток 200 мг. У той же час іноземні
виробники пропонують на ринку цей препарат головним чином у формі таблеток і
капсул по 500 мг.
Різниця цін на препарати парацетамолу, пропоновані українськими
заводами-виробниками, мінімальна. Препарати парацетамолу вітчизняного виробництва:
ПАРАЦЕТАМОЛ, Борщагівський ХФЗ (Україна, Київ)
ПАРАЦЕТАМОЛ, "Галичфарм" (Україна, Львів)
ПАРАЦЕТАМОЛ, Луганський ХФЗ (Україна, Луганськ)
ПАРАЦЕТАМОЛ, "Магік" (Україна, Харків)
ПАРАЦЕТАМОЛ, "Фармак" (Україна, Київ)
ПАРАЦЕТАМОЛ-ДАРНИЦЯ, "ФФ" Дарниця "(Україна, Київ)
ТАБЛЕТКИ парацетамолу 0, 2 г, "Лубнифарм" (Україна, Лубни)
ТАБЛЕТКИ парацетамолу 0, 2 г, "Монфарм" (Україна, Монастирище)
Ситуація в сегменті ринку препаратів парацетамолу іноземних фармацевтичних компаній не така
однозначна. Поряд з очевидними ціновими лідерами - Тайленола ( «McNeil», США),
ПАНАДОЛ і ПАНАДОЛ СОЛЮБЛ («SmithKline Beecham», Великобританія), САНІДОЛ (
«Sanofi-Synthelabo», Франція), еффералган ( «Laboratoires UPSA», Франція) та
ін. тут присутня група лікарських засобів середньої цінової категорії, а також
кілька недорогих препаратів, вироблених в Азії. Препарати парацетамолу іноземного
виробництва:
ДОЛОМОЛ, "Hikma" (Йорданія)
ЛЕКАДОЛ, "Lek" (Словенія)
ДИТЯЧИЙ Тайленола (фруктовий), "McNeil" (США) *
Тайленола, "McNeil" (США)
Мексален, "Merckle" (Німеччина)
ПАНАДОЛ, "SmithKline Beecham" (Великобританія)
ПАНАДОЛ СОЛЮБЛ, "SmithKline Beecham" (Великобританія)
МЕДІПІРІН, "Slovakofarma" (Словацька Республіка)
ПАРАЦЕТАМОЛ, "Cadila Healthcare" (Індія)
ПАРАЦЕТАМОЛ-Риво (РІВАЛГІЛ), "Rivopharm" (Швейцарія-Нідерланди)
САНІДОЛ (парацетамол), "Sanofi" (Франція)
Цетана, "Eipico" (Єгипет)
Еффералган "Laboratoires UPSA" (Франція)
Еффералган "Laboratoires UPSA" (Франція) **
Медіани цін на препарати парацетамолу зарубіжного виробництва в таблетках
500 мг, дол. США
* Таблетки жувальні 80 мг, ** капсули 500 мг.
В цілому можна констатувати, що український ринок препаратів парацетамолу
підрозділяється на три цінові категорії. Перераховані вище торгові
марки-«бестселери» відносяться до верхньої цінової категорії. До середньої можна віднести ЛЕКАДОЛ «Lek»,
Словенія, МЕДІПІРІН «Slovakofarma» і ін. і
ПАРАЦЕТАМОЛ виробництва харківського підприємства «Магік». У нижній ціновій
категорії знаходиться продукція українських та білоруського заводів.
2. ТЕХНОЛОГІЧНА ЧАСТИНА
.1. Характеристика готової продукції
Таблетки "Парацетамол 325"
Tabulettae
"Paracetamolum 325 mg"
Якість таблеток відповідає вимогам АНД ВАТ «Концерн Ст і
рол».
Реєстраційний
номер П.02.03 / 05854 згідно Наказу Міздрава України № 38 від 03.02.03 р
Таблиця 2.1 - Склад на одну таблетку
|
Склад на одну таблетку
|
г
|
%
|
|
Парацетамолу 90% для
прямого пресування, в перерахунку на парацетамол (АНД ВАТ «Концерн Стирол»
фірми "Rhodia Inc. », США)
|
0, 325
|
90%
|
|
м аса однієї таблетки
|
0, 361
|
100, 00
|
Зберігання. У сухому, захищеному від світла місці.
Термін придатності 5 років
Жарознижувальну, болезаспокійливу і протизапальну засіб.
.2 Схема виробництва і технологічний процес
Хімічних і біологічних перетворень при виробництві таблеток
"Парацетамол 325 мг" немає, тому хімічна та біологічна схема не
наводиться.
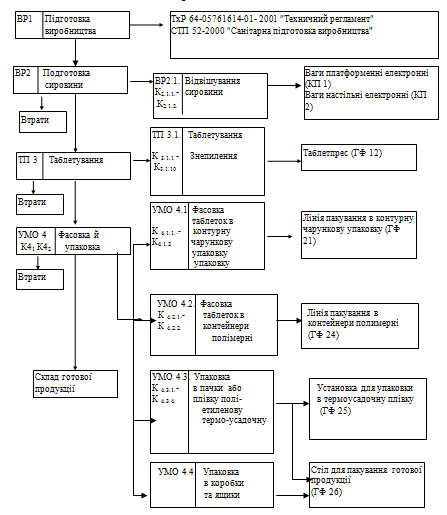
2.3 Блок-схема технологічного процесу виробництва таблеток «Парацетамол 325 мг»
2.4 Характеристика сировиннни, матеріалів та напівпродуктів
Таблиця 2.2 - Характеристика сировиннни, матеріалів та
напівпродуктів
|
Наймену- вання
|
Категорія і № НТД, згідно з
якою перевіряють необхідні
показники
|
Показники НТД, обов'язкові
для перевірки
|
Примітки
|
|
1
|
2
|
3
|
4
|
|
1. Основна сировина:
|
|
Парацетамол 90% для прямого
пресування, фірми "Rhodia Inc. », США
|
АНД ВАТ «Концерн Стірол»
|
Представляє
собою суміш порошка і гранул білого кольору, без запаху. Розмір
частин. Тотожність. Вміст 4-хлорацетаніліда. Вміст
4-амінофенола. Вміст вологи. Важкі метали. Залишкові кількості
органічних розчинників (спирти не більше 1, 0% і ізопропіловий не більше 0,
5%). Кількісний вміст парацетамола. Мікробіологічна чистота.
|
Діюча речовина
|
|
2. Матеріали
|
|
Вата медична
гігроскопічна
|
ГОСТ 5556-81
|
згідно НТД
|
Пакувальний матеріал
|
|
Листок-вкладиш
|
ОСТ 64-7-382-84
|
Зовнішній вигляд.
Відповідність тексту затвердженому зразку.
|
Інформаційний матеріал
|
|
Картон для споживчої тари
|
ГОСТ 7933-89
|
Зовнішній вигляд. Щільність
не менш 350 г / м2 (за паспортом пропостачальника)
|
Пакувальний матеріал
|
|
Стрічка клейова
|
ГОСТ 18251-87
|
Зовнішній вигляд. Якість клеєвої
поверхні. Маса клеєвого шару на 1м 2 (по паспорту постачальника)
|
Пакувальний матеріал
|
|
Мішки поліетиленові
|
ГОСТ 19360-74 ГОСТ
19360-74
|
Зовнішній вигляд. Ширина 48
см. Довжина 152см. Товщина 0, 005 см. Микробиологічна
чистота. Зовнішній вигляд. Ширина 96 см. Довжина 88 см. Товщина 0, 005 см.
Микробиологічна чистота.
|
Пакувальний
матеріал Пакувальний матеріал
|
|
Плівка поливінілхлорідна
марки ЕП-73 або виробництва фірми "ТВР", Словення
|
ГОСТ 25250-88
|
Зовнішній вигляд. Товщина
0, 2 мм. Ширина (174 ± 1) мм.
|
Пакувальний матеріал
|
|
Плівка термоусадочна
поліетиленова
|
ГОСТ 25951-83
|
Зовнішній вигляд.
маркування
|
Пакувальний матеріал
|
|
Фольга алюмініева друкована
лакована або фольга алюмініева лакована друкована фармацевтичнавиробництва фірми
"Alupak", Словения
|
ГОСТ 745-79 або
документація фірми - поста в ника
|
Зовнішній вигляд. Товщина
0, 0185-0, 0215 мм. Ширина (174 ± 1) мм. Максимальний радіус бабіни 300 мм.
Радіус серцевини бабіни 76 мм. Гігієнічний висновок №
5.06.03./1987 від 4.11.98 р
|
Пакувальний матеріал
|
|
Етикетка для групової тари
|
ГОСТ 17768-90
|
Зовнішній вигляд. Чіткість
зобр аження
|
Інформаційний матеріал
|
|
Етикетка самоклеюча
|
ТУ У 24639445. 001-99
|
Зовнішній вигляд.
Маркування. Відповідність тексту АНД ВАТ «Концерн Стирол»
|
Інформаційний матеріал
|
|
Ящики з гофрокартону
|
ГОСТ 1351-91
|
Зовнішній вигляд.
|
Пакувальний матеріал
|
|
3. Допоміжне сировину
|
|
Вода очищена
|
ФС 42-2619-89
|
Безбарвна, прозора рідина
без запаху і смаку. Повинна відповідати мікробіологічним, органолептичесним
показниками. рН 5, 0 - 7, 0.
|
|
|
Вода питна
|
ГОСТ 2874-82
|
Органолептичні показники. Мікробіологічна
чистота
|
Для технологічних
потреб.
|
|
Водню перекис
|
ГОСТ 177-88
|
Зовнішній вигляд. Масова
частка перекису водню.
|
Дезинфікуючий засіб
|
|
Мікробак-форте
|
МВ № 0048-96 Р № П08.01 /
03472 від 15.08.01 р
|
Зовнішній вигляд.
маркування
|
Дезинфікуючий засіб
|
|
Гембар
|
ТУ У 21643506.001-97 МВ №
0069-96 Р № 0055 від 8.05.01 р
|
Зовнішній вигляд.
маркування
|
Дезинфікуючий засіб
|
|
Стериллиум Німеччина
|
НТД фірми ін провиробниками
Р № 548 від 06.06.95 р
|
Зовнішній вигляд.
маркування
|
Для оброблення
рук
|
|
Спирт етил провий ректифікат
|
ГОСТ 5962-67
|
Зовнішній вигляд,
кольоровість, % Вміст етанолу. Мікробіологічна чистота.
|
Дезинфікуючий засіб
|
|
Хлорамін Б
|
ТУ 6-01-4689387-16-89
|
Маркування. Зовнішній
вигляд. Дата виготовлення. Вміст активного хлору.
|
Дезинфікуючий засіб
|
|
4. напівпродуктів
|
|
Таблетки «Парацетамол 325
мг» нерозфасовані
|
Методики № 7-11
|
Зовнішній вигляд.. Діаметр
таблетки 10, 32 ± 0, 3 мм, висота 4, 5-4, 9 мм. Середня маса (0, 3610 ± 0,
01805 г). Стираність - не більше 1%. Розчинення. Распадаємість -
до 15 хвилин. Зміст діючої речовини повинен бути від 0, 309 до 0, 341г.
|
|
|
|
|
|
|
|
|
|
|
.5 Опис стадій технологічного процесу
Таблиця 2.3 - Опис стадій
технологічного процесу
|
номер стадії
|
Опис процесу
|
Показ-ники
|
|
1
|
2
|
3
|
|
ВР 1
|
ПІДГОТОВКА ВИРОБНИЦТВА
|
|
|
Класифікація приміщень за вмістом
мікроорганизмів в повітрі, приготування дез. розчинів, підготовка
виробничих приміщень, обладнання та інвентарю, технологічного одягу і персоналу, противопаразитарний контроль, підготовка вентиляційного повітря
проводиться відповідно до Тхр 64-05761614-01-2001, СТП 52-2000 «Санітарна
підготовка виробництва»
|
|
|
Перед початком виробництва
кожної серії продукції, що випускається начальник ділянки
привласнює серії відповідний номер, який включає записи в журналі реєстрації серій,
місяць і рік виробництва, виписує протокол серії - «Основний документ з
виробництва» в АСУП «Batch Master », замовлення на таблетування і
замовлення на пакування даної серії продукції. Протокол
серії затверджує зам. директора компанії за якістю
|
|
|
Сировина і допоміжні
матеріали зберігаються на складах, розміщуються на піддонах, стелажах по
наіменуванням, маркам, вибухопожежонебезпечним
властивостям відповідно до вимог Правил пожежної безпеки в Україні, затв. 14.06.95 р
начальником управління державної пожежної охорони МВС України і Методичних рекомендацій,
згідно наказу МОЗ № 502 від 14.12.2001 р. Кожна партія
сировини (основного і допоміжного) і пакувальних матеріалів перед
використанням у виробництві підлягає вхідному контролю на відповідність нормативно-технічної док. Вхідний контроль
проводиться відповідно до КД 64У-2-95, його здійснює відділ контролю (ОКК).
Відбір проб проводять в спеціально відведеному приміщенні, обладнанному
приточно-витяжною вентиляцією і з застосуванням засобів індивідуального
захисту. Транспортування сировини і допоміжних речовин, без первинної
упаковки, виробляють в закритих ємностях.
|
|
|
ВР 2.
|
ПІДГОТОВКА СИРОВИНИ
|
|
|
Зважування компонентів
виробляють в окремому приміщенні при включеній припливно-витяжній вентиляції
і місцевих витяжних системах, з використанням засобів індивідуального захисту згідно із
законодавством Украіни з СТП 65-2000«Спеціальний одяг та інші засоби
індивідуального захисту».
|
|
|
К2.1.1.
|
Отримати зі складу
сировину, підготовлену відповідно з виробничим завданням,
перевірити найменування коду, № лота, маси сировини з виробничим завданням,
чистоту тари і піддону, отримати дозвіл ОКК на використання
сировини
|
Наявність зеленої картки
«Придатний до виробництва»
|
|
Перевірити чистоту
приміщення та обладнання
|
Картка «Виробництво» з записом «Чиста кімната»
|
|
Записати показання приладу
різниці тисків і підпору повітря з коридору в приміщення зваження.
|
|
|
Занести до журналу
температуру і вологість повітря
|
t 19-20 о С. відно-сна вологість 40-60%
|
|
Передати сировину на
чистому піддоні з тамбура в вагову кімнату для розтарування і відважування
|
|
|
Ідентифікувати приміщення
карткою з вказаним найменуванням продукту, що виробляється,
коду, дати і підпису аппаратчика
|
Картка «Виробництво»
з записом «Парацетамол 325 мг»
|
|
Одягти засоби
індивідуального захисту.
|
|
|
Підготувати необхідну
кількість пластикових бочок і пластикових відер (С 3), помістити в кожий
збірник по два поліетиленових вкладиша
|
|
|
К2.1.2
|
Відважити на платформних
електронних вагах (КП 1) в пакет поліетиленовий і помістити в пластикові
бочки (С 5): Парацетамол 90%
|
347, 60 кг
|
|
Загерметизувати бочки і
відра з відваженим компонентом, закрутивши кожен поліетиленовий
вкладиш, закрити кришкою з затискним обручем.
|
|
|
Для кожного збірника в
кишеньку для етикеток вкласти картку «Виробництво» із зазначенням найменування
компонента, його коду, номера серії, порядкового номера збірника, маси (нетто
і брутто) компонента, загальної кількості збірок данної серії, дати
і підпису апаратника.
|
|
|
Бочки та відра з відваженим
компонентом установити на піддон і за допомогою ручної візки перенести на
склад зберігання сумішей, де вони хранятся не більше 3 тижнів в сухому,
захищеному від світла місці
|
|
|
Залишки сировини здати на
склад зберігання сировини.
|
|
|
Заповнити протокол
виготовлення серії.
|
|
|
Очистити приміщення та
обладнання згідно із законодавством України СТП
52-2000 «Санітарна підготовка виробництва»
|
|
|
Заповнити журнал
експлуатації обладнання та внесенням повних і точних даних по вироблених
роботах.
|
|
|
Отримати висновок
інспектора ОКК про якість прибирання приміщення і обладнання. Ідентифікувати приміщення
зважування карткою «Виробництво» із записом «Чиста кімната», датою і підписом
майстра зміни і інспектора ОКК
|
Картка Виробництво» із записом «Чиста кімната»
|
|
ТП 3. Таблетування і
знепилення
|
|
Таблетування виробляють в
окремому приміщенні при включеній припливно витяжній
вентиляції і місцевих витяжних системах, із застосуванням засобів
індивідуального захисту.
|
|
|
К 3.1.1.
|
Отримати дозвіл ОКК на
експлуатацію обладнання і використання маси для таблетувания
|
Наявність штампа ОКК «Допускається»
|
|
Перевірити чистоту
приміщень і обладнання участка
пресування
|
Картка «Виробництво» із записом «Чиста кімната»
|
|
Записати показання приладу
різниці тисків і підпору повітря з коридору в приміщення.
|
|
|
Занести до журналу
температуру і відносну вологість повітря
|
t 19-20 о С, відносна вологість повітря 40-60%
|
|
Ідентифікувати приміщення
карткою з вказанням
найменування виробленого продукту, коду
і номера
серії, дати і підпису оператора
|
Картка «Виробництво»
з записом «Парацетамол 325 мг»
|
|
Перевезти масу для
таблетування зі складу зберігання сумішей в приміщення компресії, згідно
виробничого завдання (в міру вироблення)
|
|
|
Перевірити комплектність
таблеткового преса, продути вакуумним вентиляторним пристроєм для
обезпилювання таблеток
|
Пуансони діаметром 10, 32
мм з маркуванням «Р», «325» і ризкою
|
|
Експлуатацію таблеткового
преса виробляти згідно із законодавством України
|
|
|
Надіти респіратор і
рукавички
|
|
|
Завантажити масу в бункер
таблеткового преса (ГФ 12) за допомогою аутофіла
|
|
|
К3.1.2. К3.1.3. К3.1.4.
К3.1.5.
|
Провести пробне
таблетування, відрегулювати зовнішній вигляд, середню масу, стираємість
геометричні параметри таблеток
|
Таблетки білого кольору, з двоопуклою поверхнею, з
рискою і маркуванням «Р», «325». 0, 3610г ± 5% не більше 1% не менше 75% від
0, 309 до 0, 341 г
|
|
Пресувати таблетки
«Парацетамол 325 мг» на роторно-поршневому таблетковому пресі (ГФ 12)
|
|
|
номер стадії
|
Опис процесу
|
Показники
|
|
К3.1.2. К3.1.6 К3.1.7
К3.1.8 К3.1.9
|
Відбір проб для контролю в
процесі таблетування: - кожні 20 хв для визначення зовнішнього вигляду -
кожні 20 хвилин для визначення середньої маси таблеток - кожні 2 години для
визначення стіраємості - 1 раз в зміну для проведення тесту «Розчинення» - 1 раз в зміну для випробування
кількісного вмісту парацетамолу в таблетці
|
Таблетки білого кольору, з двоопуклою поверхнею, з
рискою і маркуванням «Р», «325». 0, 3610г ± 5% не більше 1% не менше 75% від
0, 309 до 0, 341 г
|
|
Внести результати контролю
в протокол виготовлення серії
|
|
|
К3.1.10.
|
Зібрати кондиційні таблетки
в таровані пластикові відра (С 14) з двома поліетиленовими вкладишами (не
більше 15 кг в кожне), зважити на терезах платформних електронних (КП 1)
|
345, 34 кг
|
|
Зібрати некондиційні
таблетки в таровані пластикові відра з двома поліетиленовими вкладишами (С
15), зважити на терезах платформних електронних (КП 1)
|
|
|
Загерметизувати відра з
таблетками, закрутивши кожен поліетиленовий вкладиш, закрити кришкою з
засувками.
|
|
|
Для кожного відра в
кишеньку для етикеток вкласти картку «Виробництво» із зазначенням
найменування напівпродукту, номера серії, порядкового номера відра, маси
(нетто і брутто) напівпродукту, загальної кількості відер даної серії, дати і
підпису оператора
|
|
|
номер стадії
|
Опис процесу
|
Показники
|
|
Відра з таблетками
кондиційним встановити на піддон і за допомогою ручної візки транспортувати
на склад зберігання продукції «ангро», де вони зберігаються в сухому,
захищеному від світла місці не більше 3 тижнів.
|
|
|
Відра з таблетками
некондиційними ідентифікувати карткою «Виробництво» із зазначенням
«некондиційні таблетки», найменування, номера лота, порядкового номера відра,
маси (нетто) відходу, загальної кількості відер даної серії, дати і підпису
оператора; встановити на піддон і за допомогою ручної візки транспортувати на
склад сумішей і некондиційних таблеток
|
|
|
Заповнити протокол
виготовлення серії
|
|
|
Очистити приміщення та
обладнання відповідно до ТхР 64-05761614-01-2001 і СТП 52-2000 «Санітарна
підготовка виробництва»
|
|
|
Заповнити журнал
експлуатації обладнання та приміщення
|
|
|
Записати показання приладу
різниці тисків і підпору повітря з коридору в приміщення компресії.
|
|
|
Отримати висновок
інспектора ОКК про якість прибирання приміщення і обладнання. Ідентифікувати
приміщення зважування карткою «Виробництво» із записом «Чиста кімната», датою
і підписом начальника ділянки
|
Картка «Виробництво"
із записом «Чиста кімната»
|
|
УМО 4. ФАСУВАННЯ Й ПАКУВАННЯ
|
|
К4.1.
|
Отримати зі складу
пакувальний матеріал, підготовлений відповідно до виробничого завдання,
перевірити відповідність коду, номера серії, кількості матеріалу з виробничим
завданням, отримати дозвіл ОКК на використання отриманого пакувального
матеріалу
|
Наявність штампа ОКК
«Пропускається»
|
|
К4.2.
|
Отримати дозвіл ОКК на
фасовку таблеток даної серії
|
Наявність штампа ОКК
«Пропускається»
|
|
Перевірити чистоту
приміщення та обладнання ділянки упаковки
|
Наявність підпису відповідального
за чистоту лінії упаковки
|
|
дентифікувати приміщення
карткою із зазначенням найменування упаковуваного продукту, дати і підпису
оператора
|
Картка «Виробництво» із
записом «Парацетамол 325 мг
|
|
Перевезти таблетки зі
складу зберігання продукції «ангро» в приміщення упаковки, згідно виробничого
завдання
|
|
|
Записати на дошці
найменування упаковуваного продукту, код, номер серії, серію, термін
придатності, реєстраційний номер, відповідно до даних, зазначених в
завданні на упаковку таблеток
|
Таблетки
«Парацетамол 325 мг», код, № серії, серія, термін придатності, реєстраційний
№
|
|
УМО 4.1 Фасовка таблеток в
контурні чарункові упаковки
|
|
Укомплектувати лінію упаковки в контурну чарункову
упаковку (ГФ 21) плівкою полівінілхлоридної і фольгою алюмінієвої друкованою
лакованою
|
Плівка
полівінілхлоридна марки ЕП-73 по ГОСТ 25250-88 або імпорт. вир. фірми «ТВР»,
Словенія, фольга алюмінієва друкована лакована по ГОСТ 745-79
|
|
номер стадії
|
Опис процесу
|
Показники
|
|
Перевірити
настройку лінії упаковки (ГФ 21). Перевірити відповідність цифр на кодує
пристрої фасувального апарату номеру серії препарату, відповідність пакувального матеріалу регламентному
|
|
|
Встановити рулон з фольгою алюмінієвої на автомат
|
Товщина (0, 0185-0, 0215)
мм Ширина (174 ± 1) мм
|
|
Встановити рулон з
полівінілхлоридної плівкою на автомат, зробити пробне формування
|
Товщина 0, 14 мм, ширина
174 мм
|
|
Одягти засоби
індивідуального захисту
|
|
|
Завантажити, вручну,
таблетки з пластикових відер (С 14) в бункер швидкісного підйомника,
наповнюючи його в міру вироблення
|
|
|
Розфасувати таблетки
«Парацетамол 325 мг» в контурні чарункові упаковки
|
по 6 або 12 таблеток
|
|
Температура склеювання
плівки і фольги
|
150 ° С
|
|
К4.1.1 К4.1.2. К4.1.3
|
Відбір проб для контролю в
процесі фасування: -кожні 30 хвилин для контролю кількості таблеток в одній
упаковці - кожні 30 хвилин для контролю чіткості нанесення маркування, серії
та терміну придатності - кожні 2 години для випробування герметичності
блістерів
|
Проба з 10 упаковок Проба з
4 упаковок Проба з 10 упаковок
|
|
УМО 4.2. Фасовка таблеток в
полімерні контейнери
|
|
номер стадії
|
Опис процесу
|
Показники
|
|
Укомплектувати лінію
упаковки в контейнери (ГФ 24) контейнерами полімерними для лікарських
засобів, кришками, волокном синтетичним, етикетками самоклеючими, на Штамповому шифраторі
виставити номер серії, термін придатності, реєстраційний номер
|
Контейнер полімерний для
лек. коштів по ТУ У 6-05761614.007-97 або ТУ У 23455985-001-97 вата мед.
гігроскопічна по ГОСТ 5556-81 Етикетка самоклеюча по ТУ У 24639445.001-99
|
|
Провести настройку лінії
упаковки (ГФ 24), задати на контролюючому пристрої кількість таблеток,
фасованих в контейнер
|
|
|
Надіти респіратор і
рукавички!
|
|
|
Завантажити вручну таблетки
«Парацетамол 325 мг» з відер в бункер швидкісного підйомника, наповнюючи його
в міру вироблення (подача таблеток на фасовку автоматизована)
|
|
|
Розфасувати таблетки
«Парацетамол 325 мг» в контейнери полімерні ємністю 75 мл
|
|
|
К4.2.1 -. К4.2.2.
|
Відбір проб для контролю в
процесі фасування: - кожні 30 хвилин для контролю кількості таблеток в одній
упаковці - чіткості нанесення маркування, серії, терміну придатності,
реєстраційного номера
|
Проба з 10 упаковок Проба з
10 упаковок
|
|
УМО 4.3. Упаковка в пачки
або плівку поліетиленову термоусадочну
|
|
К4.3.1.
|
Упакувати вручну на столі
для упаковки готової продукції (ГФ 26) контейнер разом з листком-вкладишем в
пачку
|
Контейнер разом з
листком-вкладишем у пачці з картону для споживчої тари по ГОСТ 7933-89
|
|
К4.3.2.
|
Упакувати контейнери в
плівку поліетиленову термоусадочну на апараті для пакування в термоусадочну
плівку (ГФ 25)
|
|
К4.3.3.
|
Упакувати вручну на столі
для упаковки готової продукції (ГФ 26) контурну чарункову упаковку з
інструкцією із застосування в пачку
|
№ 6 або № 12 в пачку з
листком-вкладишем
|
|
К4.3.4.
|
Контроль комплектності
упаковки в пачки; правильність і чіткість нанесення маркування, кодування,
серії, терміну придатності, реєстраційного номера
|
Чітко нанесений текст
маркування
|
|
УМО 4.4. Упаковка в коробки
або ящики
|
|
Упакувати, вручну, на столі
для упаковки готової продукції (ГФ 26) пачки в коробки або ящики, наклеїти
етикетки для групової тари, маніпуляційні знаки, склеїти коробки або ящики
стрічкою клейовою.
|
|
|
Упакувати, вручну, на столі
для упаковки готової продукції (ГФ 26) контейнери в плівці поліетиленовій
термоусадочній в коробки або ящики, наклеїти етикетки для групової
тари, маніпуляційні знаки, обклеїти коробки або ящики стрічкою клейовою
|
|
|
К4.4.1.
|
Контроль комплектності
груповиї упаковки.
|
|
|
Заповнити протокол
виготовлення серії
|
|
|
Упаковану продукцію
встановити на пластикові палети, ідентифікувати карткою «Карантин» із
зазначенням найменування продукту, коду, серії, терміну придатності і
транспортувати на склад готової продукції разом з протоколом виготовлення
серії
|
|
|
Провести повну очистку та
дезинфекцію обладнання і всієї ділянки при завершенні виробництва серії
відповідно до Тхр 64-05761614- 01-2001 та СТП 52-2000 «Санітарна підготовка
виробництва»
|
|
|
Заповнити журнал
експлуатації обладнання та приміщення
|
|
|
Отримати висновок інспектора
ОКК про якість прибирання приміщення і обладнання
|
Наявність підпису
відповідального за чистоту ділянки
|
|
Контролер ОТК відбирає
середню пробу від серії готової продукції на відповідність її вимогам АНД
|
|
|
Після видачі ОКК
позитивного результату аналізу готової продукції формується досьє на серію,
заст. директора компанії за якістю виписує дозвіл на відвантаження продукції,
інспектор технологічного процесу змінює картку «Карантин» на упакованій
продукції на картку «Пропущено», зав.складом отримує право на відвантаження
готової продукції споживачам
|
|
|
Після закінчення
технологічного процесу картки "Виробництво" від всіх операцій
прикладають до протоколу виготовлення серії і разом з архівними зразками
продукції, що виготовляється, передають в ОКК для зберігання не менше 5 років.
|
|
|
|
|
|
Таблиця 2.4
- Матеріальний баланс технологічного
процесу
|
Найменування
|
Вміст основної
речовини
|
Витрачено і отримано
|
|
|
маса, кг
|
Обєм, л
|
Кількість, штук
|
|
|
Загальна
|
Осн. речовини
|
Кг / моль
|
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Витрачено на стадії ВР 2 ПІДГОТОВКА
СИРОВИНИ
|
|
Напівпродуктів: Парацетамол 90%
|
90, 00
|
347, 60
|
312, 84
|
|
|
|
|
Разом:
|
|
347, 60
|
312, 84
|
|
|
|
|
Отримано на стадії ВР 2
ПІДГОТОВКА СИРОВИНИ
|
|
Напівпродуктів:
|
|
|
|
|
|
|
|
Парацетамол 90%
|
90, 00
|
347, 07
|
312, 37
|
|
|
|
|
Втрат механічних
|
|
0, 52
|
0, 47
|
|
|
|
|
Разом:
|
|
347, 60
|
312, 84
|
|
|
|
|
Витрачено на стадії ТП 3
таблетуванні і знепилювання
|
|
напівпродуктів: Парацетамол
90%
|
90, 00
|
347, 07
|
312, 37
|
|
|
|
|
Разом:
|
|
347, 07
|
312, 37
|
|
|
|
|
Отримано на стадії ТП 3.
таблетуванні і знепилювання
|
|
напівпродуктів: Маси для
таблетована про вання
|
90, 00
|
345, 34
|
310, 81
|
|
|
956618
|
|
Некондиційні
таблетки
|
|
1, 74
|
1, 56
|
|
|
|
|
Разом:
|
|
347, 07
|
312, 37
|
|
|
|
|
Витрачено на стадії УМО 4.
ФАСОВКА І УПАКОВКА
|
|
напівпродуктів: Таблеток
«парацетамол 325 мг» нефасованних
|
90, 00
|
345, 34
|
310, 81
|
|
|
|
|
Контурна безкоміркова
упаковка
|
|
|
|
|
|
79718
|
|
Пачки
|
|
|
|
|
|
79718
|
|
Інструкції
|
|
|
|
|
|
79718
|
|
Коробки
|
|
|
|
|
|
79718
|
|
Стрічка клейова
|
|
|
|
|
|
79718
|
|
Разом:
|
90, 00
|
345, 34
|
310, 81
|
|
|
79718
|
|
Отримано на стадії УМО 4.
ФАСОВКА І УПАКОВКА
|
|
Готових продукції: Таблеток
«Парацетамол 325 мг розфасованих і упакованих
|
90, 00
|
343, 61
|
309, 25
|
|
|
79319 уп.№ 12
|
|
Втрати:
|
|
|
|
|
|
|
|
Таблетки
Парацетамол
|
|
1, 73
|
1, 55
|
|
|
|
|
Контурна безкоміркова
упаковка
|
|
|
|
|
|
399
|
|
Пачки
|
|
|
|
|
|
399
|
|
Інструкції
|
|
|
|
|
|
399
|
|
Коробки
|
|
|
|
|
|
399
|
|
Стрічка клейова
|
|
|
|
|
|
399
|
|
Разом:
|
90, 00
|
345, 34
|
310, 81
|
|
|
79718
|
Таблиця 2.5 - Матеріальний баланс серії
|
витрачено
|
отримано
|
|
Найменування сировини та
напівпродуктів
|
кількість кг
|
Найменування кінцевого
продукту, відходів і втрат
|
кількість
|
|
1
|
2
|
3
|
4
|
|
сировини
|
|
готового продукту
|
|
|
Парацетамол 90%
|
347, 60
|
«Таблеток« Парацетамол 325
мг », розфасованих та упакованих
|
343, 61
|
|
|
№6
|
|
|
|
№12
|
79319 уп
|
|
|
№30
|
|
|
|
втрати
|
3, 99
|
|
РАЗОМ:
|
347, 60
|
РАЗОМ:
|
347, 60
|
2.6 Методики технологічного контролю
МЕТОДИКА № 1.
Визначення
маси компонентів.
Проміжну тару для сировини з двома поліетиленовими вкладишами,
встановлюють на ваги платформні електронні, визначають масу тари за показаннями
на екрані дисплея, виводять ваги на "нуль" натисканням клавіші
обнулення.
Сировину з складської тари совком
перевантажують в проміжну тару. Масу "нетто" компонента, що
зважується, визначають за показниками на екрані
дисплея.
Контролюють відповідність маси відважені компонентів з виробничим
завданням.
Для герметизації сировини закручують кожен поліетиленовий вкладиш, бочки
закривають кришками з затискними обручами і замками. До кожної бочки в
кишеньку для етикеток вкладають карточку "Виробництво" із зазначенням
найменування компонента, його коду, номера лота, порядкового номера бочки, маси
компонента в ньому, загальною кількістю
збірників даного лота, дати заповнення, терміну придатності компонента, підписа апаратника.
МЕТОДИКА № 2
Визначення
маси компонентів.
Проміжну тару для сировини з двома поліетиленовими вкладишами,
встановлюють на ваги настільні електронні, визначають масу тари за показаннями
на екрані дисплея, виводять ваги на "нуль" натисканням клавіші
обнулення.
Сировина з складської тари совком перевантажують в проміжну тару. Масу
"нетто", що зважується компонента визначають за показниками на екрані
дисплея.
Контролюють відповідність маси відважені компонентів виробничим завданням.
Для герметизації сировини закручують кожен поліетиленовий вкладиш, відра
кришками з засувками. До кожного відру в кишеньку для етикеток вкладають картку
"Виробництво" із зазначенням найменування компонента, його коду,
номера лота, порядкового номера відра, маси компонента в ньому, загальної
кількості збірок даного лота, дати заповнення, терміну придатності компонента,
підпису апаратника.
МЕТОДИКА № 3
Порядок відбору проб
Підставою для відбору проби на аналіз є повідомлення, направлене начальником виробничої дільниці в
ОКК. Інспектор технологічного процесу після отримання повідомлення відбирає
пробу відповідно до інструкції з відбору проб.
Відбір проб виконується в приміщенні для змішування, яке знаходиться у
виробничій зоні. Пробу відбирають з першого, среднього і останнього контейнерів.
Для відбору проб застосовують: зонд для відбору проб; банки місткістю 50, 100 см3 пробки або кришки для
банок; пакети з поліетіленової
плівки по ГОСТ 10354-82; ваги аналітичні.
Перед відбором проби поверхню зонда для відбору проб в місці контакту з
продуктом ретельно очищають і протирають 76% спиртом. Зонд вводять желобком
вниз, потім повертають на 180 ° і виводять назовні. Проба відбирається з 3-х
точок: верхнього, середнього і нижнього шарів продукту не менше, ніж з 3-х
контейнерів.
Пробу поміщають в чисту суху банку і передають на аналіз в
контрольно-аналітичну лабораторію.
МЕТОДИКА № 4 - Оцінка зовнішньго вигляду і визначення геометричних параметрів таблеток
При налаштуванні таблеткового преса і кожні 20 хвилин роботи преса.
Відбирають пробу з 20 обезпиленних таблеток і контролюють
візуально колір, форму таблеток, рівномірність поверхні, наявність можливих
дефектів:
нерівномірність поверхні;
різниця форми нижньої і верхньої поверхні таблетки; тріщини,
сколи, розшарування; нечітко сформовані края, наявність кромки по краю таблетки
(зайвий виступ більше 10% від таблетки).
При контролі готової продукції в ній не повинно бути більше 1%
дефективних таблеток (сумарно по всіх дефектів).
При налаштуванні таблеткового преса, відбирають пробу з 20 таблеток і
визначають геометричні параметри (діаметр і висоту) кожної таблетки повіреним
мікрометром ручним з точністю до 0, 01 мм.
Діаметри таблеток повинні бути в межах значень, регламентованих НТД: (10,
32 ± 0, 3) мм.
Висоти таблеток повинні бути в межах значень, регламентованих НТД: (4, 5
- 4, 9) мм.
МЕТОДИКА № 5 - Визначення середньої маси таблеток
Порядок відбору проб.
Відбір проб для визначення середньої маси таблеток для лабораторії проводить інспектор технологічного процесу
кожні 2 години роботи таблеткового
преса. Для визначення відбирають пробу з 120 таблеток.
Пробу поміщають в чисту суху банку з добре пригнаною пробкою і кришкою, оформляють етикеткою із
зазначенням назви препарату, коду, номеру лота, дати відбору проби, прізвища особи, яка відібрала пробу і
передають на аналіз в контрольно-аналітичну лабораторію.
Кожні 20 хвилин роботи таблеткового преса оператор відбирає пробу з 20
таблеток для визначення середньої маси в умовах таблеткового участку.
Середню масу таблеток визначають зважуванням 20 таблеток з точністью до 0, 001 г на вагах аналітичних
електронних і визначають зважуванням порізно 20 таблеток з точністю до 0, 001
г. Відхилення в масі окремих таблеток допускається в межах ± 5% від середньої
маси таблеток.
МЕТОДИКА № 6 - Визначення
стираємості.
Порядок
відбору
Відбір проб для визначення міцності таблеток на стирання для
лабораторії виробляє інспектор технологічного процесу кожні 2 години роботи
таблеткового преса. Для визначення відбирають пробу з 10 таблеток.
Пробу поміщають в чисту суху банку з пробкою або кришкою,
оформляють етикеткою із зазначенням назви препарату, коду, номера лота, дати
відбору проби, прізвища особи, яка відібрала пробу і передають на аналіз в контрольно-аналітичну
лабораторію.
Кожні 2 години роботи таблеткового преса оператор відбирає
пробу з 10 таблеток для визначення міцності таблеток на стирання в умовах
таблеткового ділянки.
Проведення визначення.
Визначення міцності таблеток на стирання виробляється на
приладі фірми "Vankel", Канада.
таблеток, знепиленних і зважених на вагах аналітичних
електронних з точністю до 0, 001 г, поміщають в барабан приладу, закривають
кришку і включають прилад на 5 хвилин, по витікання встановленого часу прилад
відключається автоматично.
Таблетки вивантажують, знепилюють і зважують на терезах
аналітичних електронних з точністю до 0, 001 г.
Міцність таблеток на стирання (П), у відсотках обчислюють за
формулою:
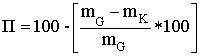
де mG - маса таблеток до випробування;, - маса таблеток після
випробування
Примітка: Форма таблеток в процесі випробування змінюватися
не повинна.
МЕТОДИКА № 7 - Тест розчинення
Від кожної серії відбирають пробу з 5 таблеток. Випробування
проводять на приладі типу "Прилад з ковшиком". Середа розчинення -
вода, обсяг середовища розчинення - 1000 мл, швидкість обертання кошику - 100
об / хв, час розчинення - 45 хв.
Для випробування в кошик поміщають 1 таблетку. Через 45 хв
відбирають 25 мл з центру судини для розчинення, фільтрують через паперовий
фільтр, відкидаючи перші 10 мл фільтрату.
мл фільтрату поміщають в мірну колбу місткістю 100 мл,
додають 10 мл 0, 1 М розчину натрію гідроксиду, доводять об'єм розчину водою до
мітки і перемішують.
Вимірюють оптичну щільність отриманого розчину на
спектрофотометрі при довжині хвилі 257 нм, в кюветі з товщиною шару 10 мм,
використовуючи як розчин порівняння 0, 01 М розчину натрію гідроксиду.
Паралельно вимірюють оптичну щільність розчину робочого
стандартного зразка (РСО) парацетамолу, приготованого для визначення
кількісного вмісту.
Вміст парацетамолу (Х1), який перейшов в розчин, у відсотках
від вмісту, зазначеному у пункті "Склад на одну таблетку», обчислюють за
формулою:
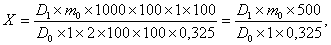
де: D1 - оптична щільність досліджуваного розчину;- оптична
щільність розчину РСО парацетамолу;- маса навішення РСО парацетамолу, в грамах;
, 325 - вміст парацетамолу в одній таблетці, в грамах.
Зміст парацетамолу, який перейшов в розчин через 45 хвилин,
має бути не менше 75% від кількості, що входить до складу однієї таблетки.
МЕТОДИКА № 8 - Кількісне визначення
Парацетамол у таблетках
Близько 0, 067 г (точна наважка) порошку розтертих таблеток
поміщають в мірну колбу місткістю 100 мл, додають 50 мл 0, 1 М розчину натрію
гідроксиду, струшують протягом 10 хв, доводять об'єм розчину 0, 1 М розчином
натрію гідроксиду до мітки, перемішують і фільтрують через паперовий фільтр,
відкидаючи перші порції фільтрату.
мл отриманого фільтрату поміщають в мірну колбу місткістю 100
мл, додають 9 мл 0, 1 М розчину натрію гідроксиду, струшують, доводять об'єм
розчину водою до мітки і перемішують.
Вимірюють оптичну щільність отриманого розчину на
спектрофотометрі при довжині хвилі 257 нм, в кюветі з товщиною шару 10 мм,
використовуючи як розчин порівняння 0, 01 М розчин натрію гідроксиду.
Паралельно вимірюють оптичну щільність розчину РСО
парацетамолу.
Вміст парацетамолу (Х2) в одній таблетці в грамах обчислюють
за формулою:
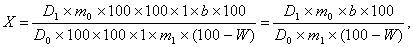
де: D1 - оптична щільність досліджуваного розчину;- оптична
щільність розчину РСО парацетамолу;- маса навішення РСО парацетамолу, в
грамах;- маса навішення препарату, в грамах;- вміст води в препараті, в
процентах;- середня маса таблетки, в грамах.
Вміст С8Н9NO2 (парацетамолу) має бути від 0, 309 до 0, 341 г,
вважаючи на середню масу однієї таблетки.
Примітка. Приготування розчину РСО парацетамолу. Близько 0,
06 г (точна наважка) парацетамолу (ВФС 42У-127-505-97) або стандартного зразка
ацетамінофену (Ф.США 23 вид., С. 1654) поміщають в мірну колбу місткістю 100
мл, додають 50 мл 0, 1 М розчину натрію гідроксиду, струшують до повного
розчинення, доводять об'єм розчину 0, 1 М розчином натрію гідроксиду до мітки і
перемішують.
Термін придатності розчину 1 доба.
мл отриманого розчину поміщають в мірну колбу місткістю 100
мл, додають 9 мл 0, 1 М розчину натрію гідроксиду, доводять об'єм розчину водою
до мітки і перемішують.
Розчин використовують свіжоприготовленим.
МЕТОДИКА № 9 - Випробування герметичності контурних
чарункових упаковок
Для проведення випробувань кожні 2 години роботи пакувальної
лінії відбирають пробу з 4 блістерів.
Упаковки поміщають в ексикатор з дистильованою водою,
підфарбованою метиленовим синім, накривають металевими гратами і закривають
кришкою. Ексикатор з'єднують гнучким шлангом з вакуумним насосом, відкривають
кран в ексикаторі і включають насос. Відсмоктування повітря з ексикатора
виробляють протягом 2 хвилин. Потім вимикають насос, перекривають кран в
ексикаторі і від'єднують шланг. Відкривають кран в ексикаторі для вирівнювання
тиску, виймають упаковки і візуально оцінюють стан таблеток в упаковці.
Таблетки в упаковках по закінченні випробувань повинні
зберігати первинний зовнішній вигляд, що свідчить про герметичності упаковок.
Наявність в упаковках таблеток з блакитним фарбуванням означає, що упаковки не
герметичні.
.7 Матеріальний баланс
Матеріальний розрахунок виконується з метою виявлення необхідної
кількості сировини для забезпечення заданої потужності, визначення кількості
допоміжних матеріалів (матеріалів для проведення підготовчих стадій,
забезпечення вимог GMP, пакувального
матеріалу). За значеннями матеріальних розрахунків проводиться підбір
устаткування цеху, проектування очисних споруд та переробки промислових
відходів.
Першим етапом технологічного розрахунку є складання матеріального
балансу. Матеріальний баланс - лінійне співвідношення між кількістю вхідної
сировини, матеріалів, напівпродуктів і проміжної продукції, використаних у
виробництві, і кількістю фактично отриманої готової продукції, побічних
продуктів, відходів або викидів і втрат, тобто порівняння теоретично можливого
і практично отриманого виходу готової продукції.
Приведене рівняння називається рівнянням матеріального балансу.
Розрахунки матеріальних балансів при проектуванні хіміко-технологічних
схем виконуються для:
визначення витрати сировини;
визначення кількостей потоків відходів, що підлягають утилізації;
визначення навантаження на окремі апарати і матеріальні лінії, необхідні
для розрахунку їх геометричних розмірів;
визначення кількостей і складів потоків, необхідних для теплових
розрахунків окремих апаратів.
Для автоматизації розрахунку матеріальних балансів хіміко-технологічних
схем, що мають настільки різноманітні по фізичному і хімічному змісту
технологічні операції, при реалізації даної програми запропонована методика
формалізації технологічних операцій: їх заміна формальними операціями з
потоками - змішування двох потоків в один, розподіл потоку на два й операції
хімічних перетворень.
Розрахунок операції з потоками вимагає визначених вихідних даних: повинні
бути відомі масові витрати одного з потоків, процентний вміст компонентів у
цьому і ще одному потоці, умова розрахунку операції, що зв'язує параметри, які
необхідно знайти з відомими.
Крім того, матеріальний баланс цілком розкриває сутність змін
матеріальних потоків на кожній стадії виробництва і показує всі етапи
виробничого процесу.
Для розрахунку матеріального балансу використовують: матеріальний баланс
діючого підприємства, технологічну схему діючого підприємства, опис
технологічної схеми, фізико-хімічні основи процесу, характеристику вихідної
сировини, продуктів (фізичні та хімічні властивості, склад сировини),
характеристику твердих та рідинних відходів, газових викидів та інші матеріали,
які отримали з літературного огляду.
В основі всіх матеріальних розрахунків лежить схема матеріальних потоків.
Вона відбиває співвідношення мас потоків у кожному з апаратів або інші
параметри, які використовують в подальших розрахунках. Для автоматизації
розрахунків, а також їх спрощення та створення електронної моделі матеріального
балансу технологічну схему перетворюють до вузлової схеми. Суть такого
перетворення полягає в заміні технологічних операцій формальними операціями з
потоками - змішанням двох потоків в один, розподіл потоку на два, операції фізичних
і хімічних перетворень. При складанні операторної схеми використовуємо дані
технологічного регламенту.
Матеріальні розрахунки потрібно виконувати по стадіям. Вони повинні бути
чіткими, короткими з принциповими й конкретними поясненнями, що роблять
зрозумілими постановку окремих задач та питань і їх рішення. З іншого боку,
потрібно обходити зайві, непотрібні та очевидних пояснень та їх повторення.
Розрахунки виконуються у програмі Excel для створення математичної моделі та забезпечення її
функціонування та використання діючим виробництвом для визначення усіх
необхідних значень при потребі зміни потужності чи запровадження нового
виробництва.
Операторна схема виробництва таблеток парацетамолу
представлена на рис. 3.2.
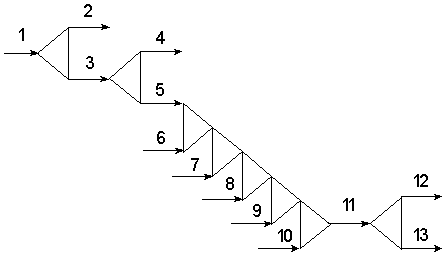
Рис. 2.2 - Операторна схема виробництва таблеток
«Парацетамол-Дарниця»
Визначаємо необхідну продуктивність серії виробництва
таблеток парацетамолу
Таблиця 2.5 - Розрахунок потужності цеху
|
Календарний фонд
часу
|
днів
|
365
|
|
Кількість вихідних
днів
|
днів
|
104
|
|
Кількість святкових
днів
|
днів
|
9
|
|
Кількість
планово-ремонтних днів
|
днів
|
25
|
|
Кількість робочих днів на
рік
|
днів
|
227
|
|
Тривалість однієї зміни
|
годин
|
8
|
|
Тривалість одного циклу
|
годин
|
8
|
|
Кількість серій на добу
|
|
1
|
|
Кількість серій на рік
|
|
227
|
|
Потужність цеху на рік
|
кг/рік
|
78000
|
|
упак/рік
|
18005540
|
|
Потужність цеху за серію
|
упак/серію
|
79319
|
|
кг/серію
|
343, 61
|
В табл. 2.6 наведені вихідні дані для розрахунку математичної
моделі матеріального балансу, результати розрахунків математичної моделі
представлені у табл. 2.7
Таблиця 2.6 - Вихідні дані для розрахунку математичної моделі
матеріального балансу
|
№п/п
|
Найменування потоку
|
Одиниці виміру
|
Хар-ка потоку
|
Співвідн.
|
|
|
|
|
потоків
|
|
1
|
Таблеточна маса зі
складу
|
|
|
|
|
Парацетамол (основна речовина)
|
%
|
90, 00%
|
|
|
Волога
|
%
|
2, 80%
|
|
|
Домішки
|
%
|
1, 20%
|
|
|
Допоміжні речовини
|
%
|
6, 00%
|
|
|
2
|
Втрати при відважуванні
|
|
0, 15%
|
від п 1
|
|
3
|
Таблеточна маса на
таблетування
|
|
|
п1 - п2
|
|
4
|
Некондиційні таблетки
|
|
0, 50%
|
від п3
|
|
5
|
Кондиційні таблетки на
пакування
|
|
|
п3- п4
|
|
маса таблетки
|
кг
|
0, 000361
|
|
|
6
|
Первинне пакування -
блістери
|
|
|
|
|
кількість таблеток в
блістері
|
шт
|
12
|
|
|
7
|
Пачки
|
|
|
|
|
кількість блістерів в 1
пачкі
|
шт
|
1
|
|
|
8
|
Інструкції в пачки
|
|
|
|
|
кількість інструкцій в 1
пачкі
|
шт
|
1
|
|
|
9
|
Коробки
|
|
|
|
|
кількість пачок в 1 ящику
|
шт
|
100
|
|
|
10
|
Стрічка клейова
|
|
|
|
|
кількість на ящик
|
м
|
1, 0
|
|
|
11
|
Запакована продукція
|
|
|
|
|
12
|
Втрати в процесі фасування
та пакув
|
від п11
|
|
13
|
Продукція на склад
|
|
99, 95%
|
від п11
|
Таблиця 2.7 - Розрахунок матеріального балансу
|
Речовина
|
Од.вим
|
1
|
2
|
3
|
4
|
5
|
|
Парацетамол
|
кг/опер
|
312, 84
|
0, 47
|
312, 37
|
1, 56
|
310, 81
|
|
%
|
90, 00%
|
90, 00%
|
90, 00%
|
90, 00%
|
90, 00%
|
|
Волога
|
кг/опер
|
9, 73
|
0, 01
|
9, 72
|
0, 05
|
9, 67
|
|
%
|
2, 80%
|
2, 80%
|
2, 80%
|
2, 80%
|
2, 80%
|
|
Домішки
|
кг/опер
|
4, 17
|
0, 01
|
4, 16
|
0, 02
|
4, 14
|
|
%
|
1, 20%
|
1, 20%
|
1, 20%
|
1, 20%
|
1, 20%
|
|
Допоміжні речовини
|
кг/опер
|
20, 86
|
0, 03
|
20, 82
|
0, 10
|
20, 72
|
|
%
|
6, 00%
|
6, 00%
|
6, 00%
|
6, 00%
|
6, 00%
|
|
Таблетки
|
шт/опер
|
|
|
|
4807
|
956618
|
|
Контурна безкоміркова
упаковка
|
шт/опер
|
|
|
|
|
|
|
Пачки
|
шт/опер
|
|
|
|
|
|
|
Інструкції
|
шт/опер
|
|
|
|
|
|
|
Коробки
|
шт/опер
|
|
|
|
|
|
|
Стрічка клейова
|
м/опер
|
|
|
|
|
|
|
Всього
|
кг/опер
|
347, 60
|
0, 52
|
347, 07
|
1, 74
|
345, 34
|
|
%
|
100, 00%
|
100, 00%
|
100, 00%
|
100, 00%
|
100, 00%
|
|
шт/опер
|
|
|
|
4807
|
956618
|
|
Речовина
|
Од.вим
|
6
|
7
|
8
|
9
|
10
|
|
Парацетамол
|
кг/опер
|
|
|
|
|
|
|
%
|
|
|
|
|
|
|
Волога
|
кг/опер
|
|
|
|
|
|
|
%
|
|
|
|
|
|
|
Домішки
|
кг/опер
|
|
|
|
|
|
|
%
|
|
|
|
|
|
|
Допоміжні речовини
|
кг/опер
|
|
|
|
|
|
|
%
|
|
|
|
|
|
|
Таблетки
|
шт/опер
|
|
|
|
|
|
|
Контурна безкоміркова
упаковка
|
шт/опер
|
79718
|
|
|
|
|
|
Пачки
|
шт/опер
|
|
79718
|
|
|
|
|
Інструкції
|
шт/опер
|
|
|
79718
|
|
|
|
Коробки
|
шт/опер
|
|
|
|
79718
|
|
|
Стрічка клейова
|
м/опер
|
|
|
|
|
79718
|
|
Всього
|
кг/опер
|
|
|
|
|
|
|
%
|
|
|
|
|
|
|
шт/опер
|
|
|
|
|
|
|
Речовина
|
Од.вим
|
11
|
12
|
13
|
|
|
Парацетамол
|
кг/опер
|
310, 81
|
1, 55
|
309, 25
|
|
|
%
|
90, 00%
|
90, 00%
|
90, 00%
|
|
|
Волога
|
кг/опер
|
9, 67
|
0, 05
|
9, 62
|
|
|
%
|
2, 80%
|
2, 80%
|
2, 80%
|
|
|
Домішки
|
кг/опер
|
4, 14
|
0, 02
|
4, 12
|
|
|
%
|
1, 20%
|
1, 20%
|
1, 20%
|
|
|
Допоміжні речовини
|
кг/опер
|
20, 72
|
0, 10
|
20, 62
|
|
|
%
|
6, 00%
|
6, 00%
|
6, 00%
|
|
|
Таблетки
|
шт/опер
|
956618
|
4783
|
951835
|
|
|
Контурна безкоміркова
упаковка
|
шт/опер
|
79718
|
399
|
79319
|
|
|
Пачки
|
шт/опер
|
79718
|
399
|
79319
|
|
|
Інструкції
|
шт/опер
|
79718
|
399
|
79319
|
|
|
Коробки
|
шт/опер
|
79718
|
399
|
79319
|
|
|
Стрічка клейова
|
м/опер
|
79718
|
399
|
79319
|
|
|
Всього
|
кг/опер
|
345, 34
|
1, 73
|
343, 61
|
|
|
%
|
100, 00%
|
100, 00%
|
100, 00%
|
|
|
шт/опер
|
79718
|
399
|
79319
|
|
|
|
|
|
|
|
|
|
|
|
|
2.8 Вибір основного обладнання
На основі регламенту на виробництво таблеток «Парацетамол»,
даних матеріального балансу і літератури вибираємо роторний прес РТМ
41-МЗ-00-00 (ПМ-1). Виробник: з-д технологічного обладнання, м. Маріуполь.
Продуктивність 54-230 тис. табл./год., діаметр пресованих таблеток, мм: 4-16,
20. Зусилля пресування максимальне, кН-100. Кількість пар пресінструмента, шт.
41. Максимальна глибина заповнення матриць, мм - 17, споживча потужність не
більше 4 кВт. Габаритні розміри, мм: 1050x1020x1775. Маса машини, кг- не більше
2000. Завантаження вручну, розвантаження. Технологічний цикл таблетування
складається з ряду послідовних операцій: заповнення матриць таблетуємим
матеріалом (об'ємний метод дозування), власне пресування, виштовхування і
скидання таблеток. Операції виконуються послідовно, автоматично.
Пуансони верхні і нижні ковзають по тих, що направляють
(капірам) і проходять між пресуючими роликами, що чинять на них одночасний
тиск. Тиск наростає і убуває поступово, що приводить до рівномірного і м'якого
пресування таблетки зверху і знизу. Залежно від типу такі машини можуть бути
забезпечені однією або двома нерухомими завантажувальними воронками. У
завантажувальні воронки може бути встановлена мішалка.
Простежимо за рухом однієї матриці. Нижній пуансон опустився
в точно обумовлене положення. Верхній пуансон в цей час знаходиться в самому
верхньому положенні, оскільки матричний отвір підійшов під воронку (операція
завантаження). Як тільки матриця (із заповненим кублом) пройшла воронку разом з
обертанням столешніци, починається поступове опускання верхнього пуансона.
Досягнувши протилежної сторони, він відразу ж потрапляє під пресуючий вал.
Одночасно на нижній пуансон чинить тиск інший вал (операція пресування). Після
проходу між валами верхній пуансон починає підніматися. Нижній пуансон також
декілька підводиться і виштовхує пігулку з матриці. За допомогою ножа
(шкрябання) таблетка скидається із столешніци - операція виштовхування пігулки.
Такий рух послідовно здійснюють всі прес-інструменти (матриця
і пара пуансонів). Для того, щоб забезпечити пуансонам належний рух, до
рукояток (званими повзунами), прикріплені ролики, за допомогою яких вони
повзуть (котяться) по верхніх і нижнім капірам (направляючим).
3. ОХОРОНА НАВКОЛИШНЬОГО СЕРЕДОВИЩА
Хімічно та біологічно активні речовини, що використовуються у
виробництві таблеток «Парацетамол», а також матеріали природного та хімічного
походження мають різне функціональне призначення та є складовими частинами
миючих та дезинфікуючих розчинів, компонентами вихідної сировини та
напівпродуктів лікарської форми, матеріалами тари та упаковки.
Втрати у виробництві - тверді; рідкі, пилоподібні промислові
відходи та їх якісні та кількісні характеристики приведені в Додатку 1 табл.
1-3.
Вміст специфічних речовин в вентиляційних викидах та стічних
водах зумовлені регламентованими втратами.
Враховуючи вологе прибирання в приміщенні, герметичність
обладнання, фактична величина забруднення в вентиляційних викидах від
виробництва лікарської форми через малу їх кількість в факельному викиді
вентиляційної установки, визначалося розрахунковим методом з урахуванням відсоткового
вмісту компонентів за ОНС-86.
Тверді відходи (табл. 3) представлені відходами некондиційної
порошкоподібної таблеткової маси, а також відходами пакувальних матеріалів, що
утворюються на стадії пакування готової продукції.
парацетамол анальгетик
таблетка лікування
СПИСОК ЛІТЕРАТУРИ
1.Машковский
М. Д. Лекарственные средства: В 2т. Т. 1. - 14 изд., перераб., испр. и доп.
[Текст] / Машковский М. Д. - М.: ООО “Издательство НОВАЯ ВОЛНА”: Издатель Дивов
С. Б., 2002. - 540 с.
.Аржанов.
Н.П. Ранние триумфы органического синтеза: несколько несложных ААА-вариаций для
ароматической струны. [Текст] / Аржанов. Н.П. // Провизор, 1999, №21. - c. 23-29.
.Машковский
М.Д. Лекарства ХХ века. [Текст] / Машковский М.Д. - М.: Медицина, 1998. - 270 с
.Фармакологія:
Підручник [Текст] / І.С. Чекман, Н. О. Горчакова та ін. - К.:Вища шк.., 2001-
598 с.
.Запруднов
А.М. Парацетамолсодержащие препараты в педиатрической практике. Рос. вестн.
перинатол. и педиат. [Текст] / Запруднов А.М., Харитонова Л.А. - 1999, 3, c 44-8.
.Комаровский
Е.О. Тактика выбора лекарственной формы парацетамола в педиатрической практике.
[Текст] / Комаровский Е.О. // “Medicus Amicus”, №1. -
2003.
.Фрейдлин
И.С. Некоторые проявления иммунотропной активности панадола. [Текст] / Фрейдлин
И.С., Назаров П.Г., Огурцов Р.П., Полевщиков А.В. // Клин фармакология и
терапия. - 1996. - 5, c.
42-46
.Мелентьева
Г.А. Фармацевтическая химия. [Текст] / Мелентьева Г.А., Антонова Л.А. - М.:
Медицина, 1993, 234 c.
.Государственная
фармакопея СССР. Изд. Х. [Текст] - М.:Медицина -1968, 765 c.
.Фармацевтична
хімія: Навч. посіб. для студ. вищ. фармац. навч. закл. і фармац. ф-тів вищ.
мед. навч. закл. III-IV рівнів акредитації [Текст] /П. О.
Безуглий, І. В. Українець, С. Г. Таран та ін.; За заг. ред. П. О. Безуглого.- X.: Вид-во НФАУ; Золоті сторінки,
2002.- 448 с.
11.Lin
M. Duration of Analgesic Use and Risk of Hearing Loss in Women Brian [Text] /
M. Lin, Sharon G. Curhan, Molin Wang // American Journal of Epidemiology. -
Vol. 4, 2016, p. 19-29.
.Eavey,
R. Paracetamol as a risk factor for allergic disorders [Text] / Roland Eavey,
Konstantina M. Stankovic, and Gary C. Curhan // The Lancet. - Vol. 373, N.
9658. - 2009, p. 95-184.
.Boike
J. R. Does concomitant use of paracetamol potentiate the gastroduodenal mucosal
injury associated with aspirin? A prospective, randomised, pilot study. [Text]
/ Boike J.R., Kao R., Meyer D., Markle B., Rosenberg J., Niebruegge J., Stein
A.C., Berkes J., Goldstein J. // Aliment Pharmacol Ther. - 2012. - 36(4), p.
391-397.
.Gonzalez-Barcala,
F. J. Exposure to paracetamol and asthma symptoms [Text] / F. J.
Gonzalez-Barcala, S. Pertega, T. Perez Castro, M. Sampedro, J. Sanchez Lastres,
M. San Jose Gonzalez, L. Bamonde, L. Garnelo, L. Valdes // Eur J Public Health.
- 2013. - 23 (4), p. 706-710.
ДОДАТОК
Таблиця 1 - Викиди в атмосферу
|
Найменування викиду
|
Найме-нування
джерела виділення (стадії, апарати, венти-ляційні установки
|
Кількість викидів
на одиницю продукції (кг на кг)
|
Періо-дичність
викиду год./добу
|
Джерела викиду та
параметри газоповітряної суміші
|
Нормативні вимоги
до викиду
|
Фактичні величини викидів
|
|
|
|
|
Кіл-сть джерел
|
Висо-та, м
|
Діа-метр, м
|
Об'єм-ні вит-рати,
м3/с
|
Тем- пера- тура, °С
|
Найменування
показників припустимих викидів (ГДВ, ГДК, ВСВ)
|
Одиниця
вимі-рювання
|
Величина нормативу
|
|
|
Пил та пари
дезинфікуючих речовин, в т.ч.:
|
ДР1.
|
|
0, 5
|
2
|
24, 5
|
0, 4
|
0, 49
|
26
|
|
|
|
|
|
Пари хлораміну
|
|
Сліди
|
|
|
|
|
|
|
ГДК
|
мг/м3
|
0, 3
|
Не виявлено
|
|
Пари спирту
етилового
|
|
0, 000038
|
|
|
|
|
|
|
ГДК
|
мг/м3
|
5, 0
|
0, 00003
|
|
Пари перекису водню
|
|
Сліди
|
|
|
|
|
|
|
ГДК
|
мг/м3
|
0, 02
|
Не виявлено
|
|
Пари озону
|
|
Сліди
|
|
|
|
|
|
|
ГДК
|
мг/м3
|
0, 03
|
Не виявлено
|
|
Пари дегміну
|
|
Сліди
|
|
|
|
|
|
|
ГДК
|
мг/м3
|
Не дослід-жено
|
Не виявлено
|
|
Пил сульфанолу
|
|
Сліди
|
|
|
|
|
|
|
ОБУВ
|
мг/м3
|
0, 03
|
Не виявлено
|
|
Пил миючого засобу
|
|
Сліди
|
|
|
|
|
|
|
ОБУВ
|
мг/м3
|
0, 03
|
Не виявлено
|
|
Пил лікарських
речовин, в т.ч.:
|
ДР2, ТП3, ТП4, УМО5
|
|
14
|
2
|
24, 5
|
0, 4
|
0, 49
|
26
|
|
|
|
|
|
Парацетамол
|
|
3, 99
|
|
|
|
|
|
|
ОБУВ
|
мг/м3
|
0, 01
|
0, 0023
|
Таблиця 2 - Стічні води
|
Найменування стоку,
відділення, апарат
|
Куди скидається
|
Кількість стоків,
м3/добу
|
Періодичність
викиду
|
Характеристика
викиду
|
Примітка
|
|
|
|
|
Склад викиду, мл/л
(по компонентам)
|
Припустима
кількість шкідливих речовин, що скидається (кг/добу)
|
|
|
Стічні води після миття тари, обладнання,
після санітарної обробки обладнання, приміщень
|
В міську каналізацію
|
5, 0
|
Щоденно по ході технологічного процесу
|
рН = 6, 9
|
рН 6, 5-8, 5
|
Норми узгоджені з правилами прийому стічних
вод в міську каналізацію
|
|
|
|
|
Температура 22 °С
|
не більше 40 °С
|
|
|
|
|
|
Запах гнилі 1 бал
|
не більше 2 балів
|
|
|
|
|
|
Кольоровість 25°
|
не більше 1:10, 1:16
|
|
|
|
|
|
(межа розведення 1:10, 1:16)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нітрати 0, 4 мг/л
|
|
|
|
|
|
СМЗ 0, 02 мг/л
|
не більше 2 мг/л
|
|
|
|
|
|
Аміак 0, 57 мг/л
|
не більше 2 мг/л
|
|
|
|
|
|
Хлориди 34, 8 мг/л
|
не більше 350 мг/л
|
|
|
|
|
|
Залізо 0, 7 мг/л
Каламуть 108 мг/л Сухий залишок 218 мг/л
|
не більше 2, 5 мг/л
не більше 500 мг/л не більше 10000
мг/л
|
|
|
|
|
|
Сульфати 37, 9 мг/л
|
не більше 400 мг/л
|
|
|
|
|
|
ХПК 2 14, 3 мг/л
|
не більше 800 мг/л
|
|
|
|
|
|
ЕПК 6, 9 мг/л
|
не більше 500 мг/л
|
|
|
|
|
|
Хлорамін відсутній
|
|
|
|
|
|
|
СПАВ 0, 9 мг/л
|
не більше 20 мг/л
|
|
|
|
|
|
Парацетамол 6, 1 мг/л
|
|
|
Таблиця 3 - Тверді та рідкі відходи
|
Найменування
відходу, відділення, апарату
|
Куди складається,
транспортна тара
|
Кількість відходів,
кг/добу
|
Періодичність
утворення
|
Характеристика
відходів
|
Примітка
|
|
|
|
|
Хімічний склад,
вологість, %
|
Фізичні показники,
щільність, кг/м3
|
|
|
Механічні втрати
від усіх стадій виробництва
|
Накопичувач
виробничих відходів
|
0, 014
|
14
|
Таблеткова маса,
містить інгредієнти лікарської форми
|
Порошкоподібні
речовини з різними розмірами часток 2-2,
5 мм
|
У відвал
|
|
Відходи паперу та
картону
|
Накопичувач
виробничих відходів
|
1, 4
|
14
|
|
Папір та картон
різних розмірів
|
Після пресування в
брикети підлягає здачі у вторсировину
|
|
Відходи плівки ПВХ
та фольги
|
Накопичувач
виробничих відходів
|
0, 7
|
14
|
|
Тверда речовина
|
У відвал
|
|
Відходи паперу з
поліетиленовим покриттям
|
Накопичувач
виробничих відходів
|
0, 5
|
14
|
|
Тверда речовина
|
У відвал
|