Основные принципы картирования генов МФЗ
Введение
Ранняя диагностика и своевременная профилактика различных
заболеваний являются одной из наиболее актуальных проблем современной медицины.
Самую многочисленную и разнообразную группу болезней, к которым, несомненно,
относятся и гипертензивные нарушения при беременности, рассматриваемые в данной
работе, составляют многофакторные заболевания (МФЗ). К такого рода нарушениям
относится более 90% всей соматопатологии человека обуславливающей высокий темп
роста заболеваемости, смертности и инвалидизации трудоспособного населения в
современных популяциях [25]. До настоящего времени, несмотря на высокий уровень
медицинских технологий, мир ежегодно теряет 500 000 женщин, которые умирают от
причин, связанных с беременностью и родами [51]. Вместе с тем успехи молекулярной
биологии, генетики позволяют сегодня с принципиально новых позиций оценивать
причины осложнений беременности и вносить коррективы в тактику оказания помощи
женщинам, ждущим ребенка.
Одной из самых актуальных проблем современного акушерства
ввиду широкой распространенности, сложности этиопатогенеза, отсутствия ранних и
достоверных диагностических критериев, действенных мер профилактики и лечения,
а также высокого показателя материнской и перинатальной заболеваемости и
смертности, больших экономических затрат на проведение интенсивной терапии и
реанимации пациенток является гестоз. Гестоз занимает лидирующие позиции в
патологии беременности, на это указывают следующие статистические данные:
гестоз встречается у 6-8% беременных в развитых странах, а в развивающихся эта
цифра доходит до 20%. В развивающихся странах гестоз является причиной 40%
смертей беременных и 70% случаев мертворождений или выкидышей. В нашей стране
частота гестоза составляет 11,0-16,0%, кроме того, данная патологиязанимает 3-е
место в структуре летальности беременных[4].Перинатальная смертность при
гестозах колеблется в пределах 10,0-30,0%, перинатальная заболеваемость -
46,3-78,0%[47, 3].Высокая частота материнской и перинатальной заболеваемости и
смертности обуславливается отсутствием точных знаний о патогенезе заболевания,
достоверных диагностических критериев и неоценённостью тяжести заболевания, что
ведёт к неадекватной терапии и различным осложнениям при гестозах [65, 12]. У
20% новорожденных от матерей, перенсших гестоз регистрируются нарушения
психоэмоционального и физического развития, значительно возрастает частота
детской заболеваемости.
Этиология гестоза до настоящего времени остаётся неясной.
Накопленные к настоящему времени знания указывают на то, что развитие гестоза определяется
многими факторами, в том числе и генетической предрасположенностью (до 80%). В
настоящий момент предложено более 50 генов-кандидатов гестоза, это гены,
ответственные за формирование сосудистого тонуса, тромбообразующих факторов,
учавствующих в оксидативном стрессе и функционировании эндотелия. Несмотря на
видимые успехи по изучению молекулярных механизмов гестоза следует отметить что
результаты, полученные разными исследователями при изучении генетической
предрасположенности к гестозу, зачастую противоречивы для разных межэтнических
групп. Некоторые авторы в качестве основной причины такого рода противоречий
рассматривают вариабельность структуры наследственной компоненты гестоза между
различными популяционными выборками, формирующуюся в результатае
демографической истории конкретной популяции [9]
Таким образом, в настоящее время сохраняется актуальность
изучения генов предрасположенности к гестозу с учётом этнической
принадлежности.
Целью настоящей работы анализ ассоциации tagSNPs гена лептина (LEP) и гена рецептора
активина А второго типа (ACVR2A) с развитием гестоза в популяциях различного
этнического происхождения.
Исходя из цели были поставлены следующие задачи:
1) Провести анализ ассоциаций генотипов и аллелей
исследованных полиморфизмов с гестозом в популяциях русских и якутов.
) Оценить ассоциации исследованных tagSNPs генов LEP и ACVR2A
с развитием отдельных клинических форм гесоза в русской и якутской популяциях.
3) Провести анализ частот гаплотипов генов LEP и ACVR2A в исследованных группах
русских и якутов.
Работа выполнена в лаборатории эволюционной генетики НИИ
медицинской генетики ТНЦ СО РАМН.
1. Обзор литературы
1.1 Основные принципы картирования генов МФЗ
гаплотип гесоз якутский полиморфизм
Изучение наследственной предрасположенности
к многофакторным заболеваниям крайне важно для их диагностики и терапии. В
течение последних десятилетий поиск генов-кандидатов осуществляется двумя
способами - анализом ассоциаций и анализом сцепления[7]. Большую практическую
ценность представляет исследование полиморфных маркеров в генах-кандидатах,
продукты которых вовлечены в патогенез многофакторного заболевания [24].
Первый заключается в сканировании генома с
помощью большого набора микросателлитных или однонуклеотидных полиморфных
маркеров и в анализе сцепления без изначальной «привязки» к какому-то
конкретному региону, суть второго подхода состоит в том, что анализ сцепления
проводится в определенном участке, где расположены известные гены-кандидаты
заболевания или признака. Оба подхода имеют преимущества и недостатки, и
наиболее точные результаты, по-видимому, можно получить при их совместном
использовании.
Большую практическую ценность представляет
исследование полиморфных маркеров в генах-кандидатах, продукты которых
вовлечены в патогенез многофакторного заболевания. Анализ сцепления основан на
определении вероятности совместного наследования фенотипического признака
(заболевания) и исследуемого маркера в семье. При этом исследуют совместную
сегрегацию генов при передаче от родителей к потомкам в ряду поколений [24].
При использовании метода идентичных по
происхождению аллелей (IBD, identical by descent) информацию о сцеплении
получают в результате анализа наследования маркеров в парах больных
родственников без предварительного выбора типа наследования и других
характеристик. Данный подход заключается в оценке того, насколько чаще по
сравнению со случайной сегрегацией пара больных родственников (чаще всего для
анализа используют сибсовые пары) наследует один и тот же аллель. Анализ
сцепления может проводиться с исследованием как ядерных (оба сибса больны), так
и простых (один сибс болен, а один здоров) семей. При этом оцениваются шансы
(вероятности) за и против сцепления в данной семье. Количественным показателем
сцепления является логарифм соотношения шансов (правдоподобия) за и против
сцепления - лод-балл (от английского «logarithm of odds ratio»). Сцепление
считается подтвержденным, если лод-балл превысит значение 3.0 (т.е. вероятность
совместного наследования признака и маркера в 1000 раз больше, нежели
вероятность их раздельного наследования). Если ни на одной из
проанализированных семей не обнаруживается статистически значимое сцепление,
лод-балл рассчитывают, используя суммарные данные для нескольких семей. При
этом необходим тщательный отбор семей из общей группы по фенотипическим
признакам, позволяющих объединить их в одну подгруппу [24]. Также активно
используют мультилокусный анализ сцепления, при котором рассчитывается
соотношение вероятностей для каждого интервала между двумя соседними из
десятков и сотен полиморфных маркеров, распределенных по всему геному.
Интервалы, для которых значения лод-балла превышают 3.0, считают наиболее
вероятными областями локализации гена, ассоциированного с конкретной патологией
[24].
Наряду с анализом сцепления, при
использовании которого необходимы полные семьи с двумя сибсами, в методе
неравновесной передачи аллелей (TDT, transmission disequilibrium test) могут
использоваться семьи с единственным потомком. Этот метод основан на анализе
частот передачи аллелей полиморфных маркеров, расположенных в интересующей
исследователя области генома, от гетерозиготных по данному маркеру родителей к
больному потомку. Для сравнения используют аналогичные гетерозиготные семьи, но
со здоровым потомком [137].
К сожалению, несмотря на преобладание в
литературе в течение ряда лет работ, использующих данный метод, для многих
заболеваний его результаты были редко воспроизводимы в независимых
исследованиях [120]. Точность локализации локуса сцепления не превышает
нескольких млн. п.н. и, как правило, требуются работы по более точному
картированию с использованием однонуклеотидных полиморфизмов и блоков
неравновесия по сцеплению [87, 100].
Подход «ген-кандидат» позволяет
сфокусироваться на одном или нескольких вариантах в области гена, продукт
которого вероятно вовлечен в развитие патологии. Обычно исследование проводится
на группах из нескольких сотен больных и здоровых индивидах или семьях. В
первом случае проводят анализ распределения аллелей и генотипов исследуемого
генетического маркера в выборке из неродственных здоровых лиц (популяционный
контроль) и в группе больных (группа «случай») с тем, чтобы выявить значимые
различия в частоте генетического маркера (аллеля). Генетический маркер
считается ассоциированным с болезнью, если его частота среди больных значимо
выше, нежели в контрольной выборке. Наличие ассоциации либо свидетельствует о
прямой связи между исследованным локусом и наследственной патологией, либо в
основе ассоциации может лежать неравновесное сцепление между маркерным локусом
и локусом, обуславливающим развитие болезни, если эти локусы расположены
достаточно близко друг от друга
Ассоциация может оказаться мнимой за счет
негомогенности популяции, малочисленности выборок, некорректности критериев
отбора при формировании выборок больных и здоровых индивидов или неправильных
представлений об этиопатогенезе заболевания. Нежелательных эффектов, связанных
с этнической неоднородностью популяции, можно избежать, проводя анализ
ассоциации в гомогенных изолированных популяциях. Группы сравнения должны быть
правильно подобраны и хорошо охарактеризованы клинически и биохимически.
Необходимо, чтобы они были гомогенны по негенетическим факторам риска [24].
1.2 Феномен неравновесия
по сцеплению в геноме человека и стратегия картирования генов МФЗ с помощью tagSNP
Прогресс технологии генотипирования и разработка современных
статистических методов предоставили новые возможности для изучения роли
вариабельности генома в развитии мультифакториальных заболеваний человека
(МФЗ). На сегодняшний день одними из наиболее продуктивных стратегий
картирования МФЗ являются исследования с использованием крупномасштабных карт
SNPs и гаплотипов. Наиболее частым типом генетической изменчивости являются
«снипы» (от англ. SNP - single nucleotide polymorphism). SNPs - однонуклеотидные
замены в ДНК, для которых в популяции существуют различные варианты сиквенса
(аллели), причем редкий аллель встречается с частотой не менее 1% (рис. 1а).
Согласно недавним оценкам, в тотальной популяции человека более 10 миллионов SNPs (то есть, в среднем один
вариант на 300 п.о.), которые составляют 90% генетической вариабельности в
популяции. Остальные 10% межиндивидуальных отличий приходятся на огромное
количество редких вариантов [24].
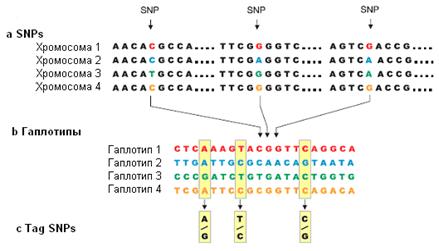
Рисунок 1. SNPs, гаплотипы и tagSNPs
а, SNPs. Показаны небольшие участки ДНК
нескольких регионов хромосом различных людей. Каждый SNP имеет два возможных
аллеля. b, Гаплотипы. Гаплотип состоит из определенной комбинации
аллелей близлежащих 20 SNPs. Три SNPs, изображенные на панели а показаны стрелками.
Генотипирование только 3 tagSNPs (выделены прямоугольниками) из 20 исследованных
SNPs достаточно, чтобы идентифицировать однозначно все четыре представленных
гаплотипа [136]
Практически каждый вариабельный сайт можно рассматривать в
качестве результата единственного мутационного события с очень низкой частотой
мутирования (10-8 на сайт на поколение) относительно числа поколений
со времени наименее древнего общего предка (MRCA) анатомически
современного человека (порядка 104 поколений). Вследствие этого,
каждый новый аллель изначально ассоциирован с другими аллелями, составляющими
уже существующий хромосомный регион, на фоне которого этот аллель возник.
Определенный набор аллелей наблюдаемый на одной хромосоме, или части хромосомы,
назван гаплотипом (рис. 1b). Новые гаплотипы формируются посредством новых
мутаций, или рекомбинации, когда материнская и отцовская хромосомы обмениваются
соответствующими сегментами ДНК, вследствие чего образуется хромосома, являющаяся
мозаиком двух родительских гаплотипов [140].
Совместное наследование аллелей в гаплотипе на популяционном
уровне проявляется как неравновесие по сцеплению (LD). Два аллеля различных
локусов находятся в неравновесии по сцеплению, когда частота состоящего из них
гаплотипа значимо отличается от частоты, ожидаемой при случайной сегрегации.
Поскольку вероятность рекомбинации между двумя SNPs увеличивается
пропорционально расстоянию между ними, то в целом с увеличением расстояния
между маркерами сцепление ослабевает. Многими эмпирическими исследованиями
продемонстрировано прочное LD и высоко значимые ассоциации между соседними SNPs
в геноме человека. Вероятно, это обусловлено тем, что многие хромосомные
регионы представлены только несколькими гаплотипами, которые и определяют
большую часть их генетической вариабельности в популяции. Вследствие того, что
степень взаимосвязи между близлежащими маркерами специфична в различных
участках генома, выявление структуры LD в геноме человека имеет важное практическое значение:
генотипирование только нескольких, тщательно подобранных SNPs (так называемых «tagSNPs») достаточно для
идентификации каждого из распространенных гаплотипов в исследуемой области
(рис. 1c).
Оценки паттернов LD, проведенные на примере нескольких участков
генома показали, что блоки LD охватывают от 25 до 75% проанализированных
участков. При этом доля последовательностей, находящихся в блоках LD,
минимальна у африканцев, а европейцы и азиаты характеризуются большей степенью
«блочности» неравновесия по сцеплению [91, 14]. Такая же закономерность
наблюдается и в размере неравновесных блоков - средний размер блока LD у
африканцев составляет около 22 т. п.н., а у европейцев и азиатов - около 44 т.
п.н. [91].
С точки зрения картирования генов предрасположенности к
широко распространенным болезням, блочная структура LD в геноме человека
означает возможность существенной редукции сил и средств как на полногеномное
картирование, так и на ассоциативные исследования. Генотипирование небольшого
количества tag SNP в определенном участке генома может быть достаточно для
получения информации обо всем блоке. Компьютерные модели и эмпирические данные
показывают, что для получения большей части генетической вариабельности,
представленной 10 миллионами SNP по всему геному, может быть достаточно 200 -
500 тысяч tag SNP [136].
1.3 Успехи и достижения международного проекта HapMap
Международный проект HapMap был создан и стартовал в
2002 году усилиями многих стран с целью каталогизировать индивидуальные
генетические особенности людей. 31 го мая 2005 года Международный консорциум
HapMap опубликовал самый полный на сегодня каталог вариаций человеческого
генома. Всего было собрано 269 образцов ДНК у четырех групп населения. Первая
группа (обозначаемая YRI) включала 90 жителей Нигерии, принадлежащих к племени
Йоруба, вторая (CEU) - 90 жителей американского штата Юта. В обоих случаях
образцы брали у 30 семейных групп: мать, отец, ребенок. Еще две группы были
отобраны уже не столь систематически: 45 образцов (CHB) взяли у пекинских китайцев
и 44 - у японцев в Токио (JPT). Эти две группы в исследовании часто объединяют
в одну: CHB + JPT. Ни один из этих наборов, конечно, не является
репрезентативной выборкой для соответствующего этноса. Поэтому авторы статьи в
журнале «Nature» рекомендуют во избежание недоразумений обозначать подборки
образцов аббревиатурами, а не национальностями. Все эти образцы прошли
секвенирование, то есть были определены последовательности нуклеотидов,
составляющие молекулы ДНК. А затем началось самое интересное - сравнение и
отождествление участков ДНК из разных образцов и выявление различий. В
некоторых случаях различия могут быть довольно крупными - например, с места на
место может «переехать» целый фрагмент генетического кода (такие фрагменты
называют траспозонами). Однако это случается относительно редко. Большинство же
мутаций представляют собой задмену одного нуклеотида другим, инсерции или
делеции лишнего нуклеотида. Это так называемые однонуклеотидные полиморфизмы
(single nucleotide polymorphism, SNP). Именно на них и сосредоточились в первую
очередь исследователи. Хотя, на первый взгляд, задача кажется простой, в
действительности надежно выявить однонуклеотидные полиморфизмы довольно трудно.
Ведь по каждому из них нужно быть до конца уверенным, что это не ошибка при
расшифровке ДНК. Поэтому после выявления каждый кандидат в SNP должен пройти
соответствующую проверку (генотипирование). Но самое лучшее подтверждение - это
выявление SNP в двух разных геномах (повторяемость). На момент начала проекта в
октябре 2002 года в различных свободно доступных базах данных имелась
информация об 1,7 млн SNP в человеческом геноме. Однако про большинство из них
не было известно, насколько надежны данные и сколь широко встречается данная
мутация. На момент публикации статьи в «Nature» число кандидатов в SNP выросло
до 9,2 млн, из которых 3,6 млн были обнаружены по крайней мере в двух разных
образцах, а 2,4 млн подверглись независимой проверке.
Из других любопытных цифр можно упомянуть следующие:
Средняя плотность SNP - 1 мутация на 279 нуклеотидов (речь
идет не об одном образце, а обо всех известных на сегодня SNP). В некоторых
участках генома частота мутаций в 10 раз выше средней. Некоторые SNP
встречаются в разных вариантах во всех исследованных группах, но есть такие,
которые в некоторой группе встречаются только в одном варианте. Так, у YRI
полиморфизм имеется по 85% SNP, у CEU - по 79%, у CHB + JPT - по 75% всех
проверенных SNP. Скорость возникновения случайных мутаций - 10-8 на
один нуклеотид за поколение. То есть каждый ребенок имеет в среднем около 30
однонуклеотидных различий со своими родителями. А для того, чтобы точечные
мутации привели к различию геномов на 1%, две популяции должны развиваться
изолировано примерно миллион поколений. Впрочем, механизмы эволюции не исчерпываются
точечными мутациями[136].
Международный консорциум HapMap опубликовал карту вариаций
генома человека третьего поколения 2-го сентября 2010 года. Эта карты была
дополнена данными о семи основных группах населения, таким образом, общее
количество обследованных в данном проекте популяционных выборок составило
одиннадцать. Это, как считают разработчики, поможет исследователям
интерпретировать текущее исследования генома, направленные на нахождение общих
полиморфных вариантов генов, связанных со сложными заболеваниями.
Несмотря на то, что на 99,9% ДНК одинакова у всех людей,
оставшаяся ее часть отвечает практически за все наследственные заболевания. Как
надеются исследователи, их работа приведет к появлению новых диагностических
методик и лекарственных препаратов, разработанных с учетом индивидуальных
генетических особенностей. [136].
1.4 Классификация, эпидемиология
патофизиологических механизмов и краткая характеристика гестоза
Согласно одному из распостранённых определений, гестоз
представляет собой синдром полиорганной недостаточности, возникающей при
беременности, в основе которого лежат увеличение проницаемиости сосудистой
стенки и других мембран и свяязанные с этим волемические и гемодинамические
нарушения[10]. Наиболее типичной является триада симптомов; отеки,
протеинурия, артериальная гипертензия Однако степень выраженности их у
разных больных различна. Возможно сочетание двух симптомов из трех
классических. Все чаще встречаются атипичные формы гестоза (моносимптомный
гестоз, бессудорожная эклампсическая кома).
Классификация. В настоящее время нет единой
классификации гестоза. За рубежом большинство акушеров-гинекологов
придерживаются понятий «гипертензия при беременности», «преэклампсия»,
«эклампсия».
Российская классификация гестоза (2005 г., форум «Мать и
дитя»)
По клинической форме:
· Чистый - развивается у соматически не
отягощенных пациенток.
· Сочетанный - возникает на фоне артериальной
гипертензии, заболеваний почек, печени, нейроэндокринной системы и др.
· Неклассифицированный - отсутствие достаточной
информации для диагноза.
По степени тяжести:
· Легкой степени - длительность течения 1-2
недели. Требует лечения.
· Средней тяжести - длительность течения 3-4
недели. Необходимо лечение и решение вопроса о возможности пролонгирования
беременности.
· Тяжелой степени (прогрессирующий) - длительность
течения более 4 недель. Требует быстрого и бережного родоразрешения.
· Преэклампсия (наличие неврологической
симптоматики) - критическое состояние, требующее проведения неотложных
мероприятий с немедленной госпитализацией и родоразрешением.
Диагностика гестоза основана на оценке
анамнестических данных, жалобах пациентки, результатах клинического
объектиивного исследования и лабораторных данных. Для уточнения ситуации и
объективной оценки состояния пациентки необходимо оценить: свертывающие
свойства крови, общий анализ крови, биохимические показатели крови, общий и
биохимический анализ мочи, соотношение потребляемой и выделяемой жидкости,
величину артериального давления, изменение массы тела в динамике,
концентрационную функцию почек, состоянием глазного дна. Целесообразно
проводить ульразвуковое исследование. Определить состояние маточно
плацентарного и плодовоплацентарного кровотока с помощью допплерометрии.
Необходимы дополнительные консультации терапевта, нефролога, невропатолога,
окулиста [7, 8, 10].
На сегодняшний день существует множество теорий развития
гестоза. Согласно данным мировой литературы, в изучении проблемы гестоза на
современном этапе выделяют четыре основных этиологических фактора развития
данного осложнения беременности [11]: генетическая предрасположенность,
плацентарная ишемия, окислительный стресс и иммунологическая дизадаптация.
Однако, по мнению большинства ученых, при гестозе чаще всего имеет место
сочетание этих факторов, что в конечном итоге приводит к нарушению функций и
повреждению эндотелия, а далее к развитию системного воспалительного ответа [4,
14, 24, 29, 44, 45, 46, 47, 49, 63, 67,].
Теория нарушения инвазии трофобласта в спиральные
артерии с развитием гипоперфузии плаценты
При нарушении трансформации спиральных артерии в
маточно-плацентарные сохраняется высокорезистентный маточно-плацентарный
кровоток со снижением плацентарной перфузии, что приводит к повышению
активности окислительных процессов, продукции активных форм кислорода в
плаценте и поступлению в кровоток матери факторов, вызывающих клинические
проявления гестоза [1, 2, 11, 70, 102, 109, 114]. Причины нарушения инвазии
цитотрофобласта кроются, скорее всего, в изменении иммунологического
взаимодействия в системе мать-плацента-плод [18]. Невозможность реализации
клетками вневорсинчатого трофобласта своих инвазивных свойств (трансформация в
«псевдоэндотелий» спиральных сосудов) связана с нарушением их взаимодействия с
клетками иммунной системы матери (децидуальными, лейкоцитами,
клетками-киллерами). С ранних сроков беременности клетки-киллеры накапливаются
в эндометрии в большом количестве, а ближе к середине беременности полностью
исчезают, что совпадает со второй волной инвазии цитотрофобласта [97, 101]. Эти
клетки влияют и на инвазивные свойства трофобласта, и на сосудистые изменения в
плацентарном ложе в связи с продукцией цитокинов и ростовых факторов,
участвующих в процессах ангиогенеза (VEGF, P1GF, ангиопоетин-П) [75, 77,
84].
Иммунологическая теория
Согласно данной теории гестоз рассматривается как болезнь,
вызванная нарушением имплантации плодного яйца. В организме беременной
фетоплацентарный комплекс является своего рода аллотрансплантантом. Развитие
гестоза своего рода реакция отторжения аллотрансплантанта, что влечет за собой
комплекс иммунологических реакций с появлением аутоантител, цитокинов (TNF-a,
IL-6), протеолитических энзимов, активацией свободно-радикального
окисления и дисфункции эндотелия [3, 19, 26, 31, 32, 37, 42, 50, 51, 53, 55,
58, 59].
Теория генетической детерминированности гестоза
В настоящее время вероятность генетической природы гестоза
считают вполне возможной, о чём свидетельствует повышенная частота гестоза
среди родственниц больных. Гестоз достоверно чаще возникает у женщин, матери которых
в своё время также перенесли это осложнение. Существует полигенная теория,
основанная на предположении о дефекте нескольких генов (сочетаний генов),
контролирующих особенности развития сердечнососудистой системы (метаболизм
сосудистой стенки, определяющий ответ на регулирующие воздействия), или же
группы генов, ответственных за особенности функционирования систем регуляции
кровообращения, в том числе и АД [43]. Всё большее количество публикаций в
последние годы посвящено роли различных генетических дефектов в этиологии
гестоза. К ним относятся изменения 7q23 - гена ангиотензин-превращающего
фермента, NOS3 и NOS2 - генов NO-синтетазы, АТ2Р1 -
гена рецептора ангиотензина II, системы антигенов гистосовместимости (HLA)
[43], Доказанным этиологическим фактором развития и прогрессирования гестоза
являются тромбофилические состояния - антифосфолипидный синдром, мутация
Лейдена, дефицит антитромбина III, протеина С, протеина S [28, 35, 74]. К
несомненным факторам риска развития гестоза относятся экстрагенитальная
патология (гипертоническая болезнь, заболевания почек, ЦНС, эндокринной системы
и т.д.), гормональные нарушения и инфекции [7, 8, 9, 15, 23, 27, 36]. Эти
факторы имеют большое значение для прогнозирования гестоза, но не являются
абсолютно достоверными в отношении развития таких его осложнений, как эклампсия
[30, 33, 34, 42].
Часть исследователей рассматривают патогенез гестоза с
позиций теории генерализованной внутрисосудистой воспалительной реакции. По их
мнению, эндотелиальная дисфункция является одним из компонентов более сложного
нарушения работы клеток сосудистого русла. Системная воспалительная реакция,
возникающая в организме матери в ответ на беременность, резко усиливается и
перерастает в мультисистемную дисфункцию, характерную для гестоза [29, 38, 40,
48, 57, 64, 65, 82].
Воспалительная теория
Одним из последних направлений в понимании механизма развития
гестоза явилась так называемая «воспалительная теория», согласно которой гестоз
рассматривается в рамках системного воспалительного ответа [7, 21]. По данным,
приведённым В.Н. Серовым и С.А. Маркиным (2002), в развитии гестоза имеют
большое значение интерлейкины, как ранние маркеры воспалительного ответа.
Авторы указывают, что «превышение концентрации интерлейкинов до 36-50% в
процессе беременности пропорционально нарастанию тяжести заболевания». При
преэклампсии синдром системного воспалительного ответа переходит в последнюю,
третью стадию, характеризующуюся генерализацией медиаторных реакций и развитием
полиорганной недостаточности[21]
К сожалению, ни одна из предложенных теорий полностью не
объясняет механизм развития гестоза и не определяет значимые факторы для
прогрессирования его развития.
.5
Генетические основы гестоза
Семейный анализ сцепления
Для гестоза полный геномный поиск (Genom-wide linkage studies) был проведен для пяти
популяций на материале мультиплексных семей, собранном в Исландии, Австралии /
Новой Зеландии, Норвегии, Финляндии и Дании [112, 113, 128]. Результаты всех
этих независимых исследований свидетельствуют о существовании нескольких
локусов, обеспечивающих восприимчивость к гестозу и расположенных на различных
хромосомах, т.е. подтверждают гипотезу о полигенном наследовании (рис. 2).
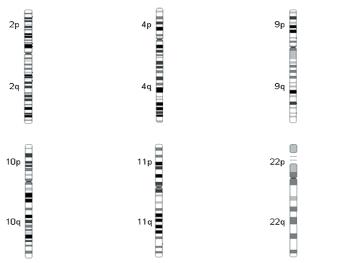
Рисунок 2. Хромосомные локусы, ассоциированные с гестозом [Sally Chappel
and Linda Morgan, 2006]
Полногеномный анализ преэклапсии позволил выделить
определённые участки хромосом, содержащие в себе множество генов, которые вошли
в список предполагаемых «генов-кандидатов» 2p13, 65 2p25 и 9p13.66 предполагаемая
связь была обнаружена и в других локусах на хромосомах 2q, 9p, 10q, 11q и 22q
[* 67,68].
Установлено, что среди дочерей женщин с преэклампсией частота
гестоза в восемь раз выше, чем в нормальной популяции [17]. P. Magnin et al.
(1971) проанализировали родословные 222 пациенток с токсикозами второй половины
беременности, не имевших до ее наступления ни одного из симптомов позднего
гестоза. Контролем служили родословные 222 женщин с нормально протекающей
беременностью. При этом учитывались неоднократно выявляемая протеинурия, отеки,
аномальное увеличение массы тела, повышение АД [166].
Среди отцов и матерей пробандов с гестозами беременности
отмечены различные заболевания сердечно-сосудистой системы (ГБ, инсульт,
инфаркт миокарда, внезапная смерть), которые были зарегистрированы у 59
человек, тогда как в контрольной группе - только у 12. По мнению авторов,
полученные данные противоречат точке зрения о том, что токсикозы являются чисто
функциональными заболеваниями, целиком обусловленными беременностью, и подтверждают
мнение о их наследственной предрасположенности.
В 1980 г. L. Chesley опубликовал обобщенные результаты
исследования гипертензивных состояний в течение беременности, используя данные
литературы и собственные сведения. Автор пришел к выводу о семейном характере
эклампсии с предположительно моногенно-рецессивным типом наследования и
независимости эклампсии от хронической артериальной гипертензии любой
длительности. Он подчеркнул наличие частых ошибочных диагнозов эклампсии под
маской латентной артериальной гипертензии, острых и хронических почечных
заболеваний, ГБ [119].
D.M. Jenkins et al. (1978), C.W. Redman et al. (1978) обнаружили в
популяции необычные типы распределения антигенов системы HLA у супругов. По их
мнению, рецессивные гены, тесно сцепленные с локусом HLA, могут быть причиной
специфической иммунной реакции материнского организма, создающей
предрасположенность к возникновению тяжелых форм токсикозов. Необходимо
отметить, что если взять во внимание только «семейный» физиологический фон предрасположенности,
то токсикозы должны были бы встречаться в популяциях и повторяться в семьях
намного чаще. Поэтому при наличии обобщающих генетических факторов
наследственной предрасположенности к токсикозам должно учитываться
иммунологическое взаимодействие между матерью и плодом [118].. Kilpatrick et
al. обследовали 56 первородящих с протеинурической формой преэклампсии, которые
имели сестер. При первых родах осложнение беременности более часто встречалось
у сестер (11,3%), чем у матерей (2,1%) участниц исследования. Частота HLA-DR4
была значительно более высокой у сестер женщин с нормальным АД в течение
беременности (18,5%). Авторы пришли к выводу о существовании ассоциации между
наличием антигена HLA-DR4 и преэклампсией [113].. Wilton et al. исследовали
ассоциацию эклампсии / преэклампсии с антигеном HLA Taql digests в десяти
родословных с множественными случаями данного осложнения беременности и
установили ее отсутствие [121]. Впоследствии точка зрения о генетической
этиологии гестоза была экспериментально подтверждена в 2001-2003 гг. канадскими
и российскими учеными. Так, В.Е. Радзинский и соавт., обследовав 49 женщин с
гестозом и их новорожденных, а также 50 женщин с физиологическим течением
беременности на носительство гена гликопротеина церулоплазмина-3 (CPIII),
установили высокую генетическую детерминацию изолированных и сочетанных
гестозов при совпадении генотипов матери и плода (33 из 35 случаев
соответственно), сопровождающихся синдромом задержки развития плода. При
различных генотипах матери и плода вероятность гестоза резко снижалась, а
синдром задержки развития плода возникал как следствие декомпенсированной
плацентарной недостаточности [142].
Норвежские ученые с 1967 г. проводили широкомасштабное
исследование с целью проверки гипотезы о том, что склонность к развитию
преэклампсии передается по наследству как по женской, так и по мужской линии
(через плод, беременность которым осложняется преэклампсией) [124]. В период
времени до 2003 г. у 238 617 женщин, рожденных в Норвегии после 1967 г., родилось
438 597 детей (исключая множественные беременности), а у 158 340 женщин,
рожденных в тот же промежуток времени, родилось 286 945 детей. Женщины,
рожденные от беременности, осложненной преэклампсией, имели в два раза
повышенный риск развития преэклампсии. Наследственная связь влияла и на тяжесть
преэклампсии. В семьях женщин и мужчин, рожденных от беременных с осложненной
преэклампсией, гораздо чаще наблюдалось это осложнение гестации тяжелой степени
(отношение шансов [OR] 3,0 для дочерей (95% доверительный интервал [Cl]: 2,4-3,7) и 1,9 для
сыновей (95% Cl: 1,4-2,5). Сестры, рожденных от женщин с преэклампсией, также
имели повышенную вероятность развития этого осложнения. По сравнению с
беременными без семейного анамнеза преэклампсии ОШ у них составило 2,0 (95% Cl: 1,7-2,3). Авторы
показали выраженную связь риска развития преэклампсии с семейным анамнезом как
со стороны матери, так и со стороны отца..B. Maqnussek et al. обследовали 66
140 из 94 194 (70,2%) женщин в возрасте старше 20 лет, включенных в период с
1995 по 1997 г. в исследование по оценке состояния здоровья и прогностической
значимости факторов риска сердечно-сосудистых заболеваний в отношении развития
преэклампсии. Почти двукратное повышение риска развития данного осложнения
имело место в случае положительного семейного анамнеза (у родственников первой
линии) по ишемической болезни сердца [123]. Таким образом, проведённые семейные
исследования указывают на несомненно важную роль наследственной
предрасположенности в развитии гестоза.
Полногеномный анализ ассоциаций
Полногеномный анализ ассоциаций tagSNPs с преэклампсией
GWAS (Genom-wide association study) - полногеномный анализ
ассоциаций позволяет выявить множество общих генетических последовательностей у
разных людей, а так же установить связь с определённым заболеванием. GWAS как
правило направлены на исследование ассоциаций между однонуклеотидными
полиморфизмами (SNPs) и предрасположенностью к какой-либо болезни. В этих
исследованиях обычно сравнивают ДНК взятую у людей, принадлежащих одной из двух
групп: к контрольной либо к группе больных людей. Этот метод позволяет выявить
«гены-кандидаты» по факту повышения частоты SNPs в группе больных людей,
в сравнении с контрольной группой. Полногеномные исследования идентифицируют
SNPs и другие варианты ДНК (CNV, повторв и др.), которые связаны с заболеванием,
но часто не способны ответить на вопрос какие гены из полученного списка
«генов-кандидатов» действительно влияют на развитие болезни[95].
В полногеномном анализе ассоциаций генов
предрасположенности к преэклампсии, проведённом гуппой учёных из из Америки,
Англии, Австралии и Финляндии, под руководством Matthew P. Johnson были получены
убедительные доказательства в пользу локализации очага «генов-кандидатов» на
хромосоме 2q14.2. Данное исследование проводилось в 3 популяционных когортах:
австралийцев, норвежцев и финнов. Данные предварительных исследований - анализа
транскрипционных профилей, не показали вовлечёности полиморфных вариантов генов
(SNP) в этиопатогенез
преэклампсии. Причины, по которым были получены такие результаты, авторы
связали с генетической гетерогенностью, экологическими и возрастными эффектами,
эпистатическими взаимодействиями и статистическими ошибками [118, 132, 92]. В
этом контексте, примечательно, что в проведённом в австралийских семьях этой
группой учёных исследовании, авторы сообщили о вероятной причастности гена ACVR2A [88, 112,113] и гена ERAP2 [100] к риску развития
предварительной эклампсии (рис. 3). Полученные результаты не удалось
воспроизвести в норвежской группе. В случае с ACVR2A и ERAP2 Matthew P. Johnson со своей группой,
впоследствии, смогли продемонстрировать ассоциацию с предварительной эклампсией
в норвежской когорте, используюя более расширенный набор SNPs этих генов [128, 100].
Эти данные могут быть совместимыми с существованием редких вариантов рисковых
аллелей, которые указывают на различия в структуре неравновесия в
австралийской, норвежской и финской группах.
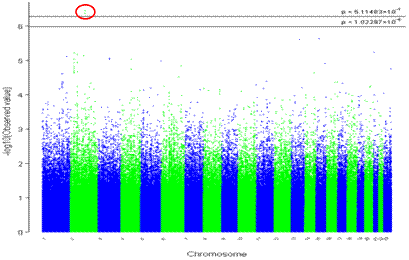
Рисунок 3. Распределение SNPs всего генома в
австралийской когорте (р < 5,114×10-7 - 1,022×10-6)
Помимо данных о наличии очага генов предрасположенности к
преэклампсии в локусе 2q14.2, был найден ещё один позиционный ген-кандидат INHBB,
эти данные подтвердиди причастность активина, ингибина и других членов суперсемейства
TGF-b к риску развития преэклампсии [123, 116, 90, 141].Факт биологической
связи INHBB и ACVR2A говорит о том, что позиционное клонирование в
акстралийских семьях, а затем и в группе австралийцев, не имеющих родственных
связей, позволило выявит гены, которые определяют ключевой путь,
восприимчивости к предварительная эклампсия.
Таким образом, на сегодняшний день полногеномные исследования
генов-кандидатов гестоза являются глобальной стратегией в познании генетической
предрасположенности к гестозу и раскрывают многие неясные аспекты
патофизиологии гестоза.
Исследование транскриптома при преэклампсии
Одним из активно разрабатываемых направлений с применением
технологии микрочипов является исследование транскрипционных профилей при
сложных заболеваниях. В этой связи плацента вызывает большой интерес как орган,
продуцирующий широкий спектр биологически активных молекул, участвующих в
развитии гестоза. Технология микрочипов позволяет одновременно отслеживать
экспрессию десятков тысяч генов, создавая молекулярный портрет клетки [156].
Множество исследований плацентарных генов при преэклампсии позволило
идентифицировать гены-кандидаты развития данного заболевания. В последние годы
около 20 независимых исследований были направлены на изучение экспресии плацентарных
генов при преэклампсии. Шесть из них осуществлялись методом анализа
экспрессионных профилей. Большинство исследований не показало статистически
значимых повышений уровня экспресии предпологаемых генов-кандидатов, кроме
уровня экспресии гена LEP и FLT1. В одной из недавних работ была изучена
избирательная экспрессия плацентарных генов у беременных с преэклампсией и
женщин с неосложненным течением беременности [117]. На основе сравнительного
анализа транскриптомных профилей плацентарных генов была подобрана панель из
213 генов, в таблице 1 представлены некоторые из них. Кроме того было
экспериментально установлено что экспрессия гена LEP в 40 раз
выше и в наибольшей степени коррелирует с тяжелым течением гестоза. При
сравнении плацентарных генов между рано и поздно начавшейся преэклампсией (до
34 недель) были выявлены 168 генов оксидативного стресса, воспаления и
эндотелиальной дисфункции, возникших в ранние сроки. Анализ профилей
экспрессии, полученных с помощью биочипов, был подтвержден определением уровня
экспрессии методом ПЦР в реальном времени, количественным определением
хорионического гонадотропина в моче и гистопатологическим исследованием
плаценты.
Таблица 1.
Дифференциально-экспрессирующиеся гены по данным полногеномных исследований
экспресии генов плацентарной ткани женщин с физиологической беременностью и
пациенток с преэклампсией*
|
Ген
|
Продукт гена
(белок)
|
Популяция
|
F C
|
Автор
|
|
LEP
|
Лептин
|
Норвегия
|
40,0
|
Sitras 2009
|
|
|
Венгрия
|
108,9
|
T. Varkonyi 2011
|
|
|
Япония
|
10,9
|
Haruki Mishizava 2011
|
|
|
Корея
|
4,4
|
Gui Se Ra Lee 2010
|
|
|
США
|
5,5
|
Daniel A.
|
|
FLT
|
Рецептор
сосудисто-эндотелиального фактора роста
|
США
|
2,8
|
Daniel
A.
|
|
|
Япония
|
2,4
|
Haruki
Mishizava 2011
|
|
|
Корея
|
3,2
|
Gui
Se Ra Lee 2010
|
|
|
Швеция
|
2,4
|
M.
Centlow 2011
|
|
|
Норвегия
|
2,6
|
Sitras
2009
|
|
PAPPA2
|
Ассоциированный
с беременностью плазменный белок А 2 типа
|
Норвегия
|
2,9
|
Sitras 2009, Mari LOSED 2011
|
|
|
Япония
|
2,6
|
Haruki
Mishizava 2011
|
|
|
Венгрия
|
4,9
|
T. Varkonyi
2011
|
|
PCDH
|
Протокадхерин
|
США
|
2.7
|
Daniel A.
|
|
|
Норвегия
|
2,0
|
Sitras 2009
|
|
VEGF
|
Фактор роста
сосудистого эндотелия
|
Корея
|
2,9
|
Gui
Se Ra Lee 2010
|
|
|
Норвегия
|
|
Mari
LOSED 2011
|
|
INHA
|
Ингибин альфа
|
Швеция
|
2,3
|
M.
Centlow 2011
|
|
|
США
|
1,9
|
Daniel
A.
|
|
|
Норвегия
|
3,0
|
Sitras
2009
|
|
HEXB
|
Гексоминидаза В
|
США
|
1,6
|
Daniel
A.
|
|
|
Япония
|
|
Haruki Mishizava 2011
|
|
|
Норвегия
|
|
Mari
LOSED 2011
|
|
LDHA
|
Лактодегидрогеназа
|
Норвегия
|
|
Mari
LOSED 2011
|
|
|
Корея
|
2,1
|
Gui
Se Ra Lee 2010
|
|
CGB
|
Гонадотропин
хориона
|
Венгрия
|
10,2
|
T.
Varkonyi 2011
|
|
TMEM100
|
Трансмембранный
белок 100
|
Япония
|
4,7
|
Haruki
Mishizava 2011
|
|
TMEM8
|
Трансмембранный
белок 8
|
Норвегия
|
5,0
|
Sitras
2009
|
|
CGB1,
2, 5, 7
|
Гонадотропин
хориона1, 2, 5, 7
|
Япония
|
4,4-4,7
|
Haruki
Mishizava 2011
|
|
CGB CYP
|
Гонадотропин
хориона Цитохром Р450
|
Норвегия
|
3,5
|
Sitras
2009, Mari LOSED 2011
|
|
|
Норвегия
|
3,0
|
Sitras
2009, Mari LOSED 2011
|
|
|
США
|
2,26
|
Daniel
A.
|
|
CGB1,
2, 5, 7
|
Гонадотропин
хориона1, 2, 5, 7
|
Швеция
|
3,3
|
K.
Ionus 2011
|
|
|
Корея
|
2,0
|
Gui
Se Ra Lee 2010
|
|
OSM
|
Онкостатин М
|
Норвегия
|
|
Mari
LOSED 2011
|
|
|
Корея
|
3,5
|
Gui
Se Ra Lee2010
|
*Примечание: В таблице представлены ДЭГ
статистически значимо ассоциированные с риском ПЭ по данным нескольких
исследований.
По мнею S. Founs, альтернативой
ассоциативным исследованиям, нацеленным на изучение причин возникновения МФЗ,
должны стать иследования дифференциальной экспресии генов в здоровых и
поражённых заболеванием тканях[138].
Таким образом, развитие технологии
микрочипов существенно расширило область молекулярных исследований до анализа
целого генома и транскриптома (совокупность всех транскриптов в клетке).
Технология микрочипов используется для расшифровки сложных механизмов
возникновения гестоза, выявления генов предрасположенности к гестозу.
Применение микрочипов в комбинации с другими подходами должно привести к
разработке и созданию диагностических тестов, в том числе и на основе
технологии микрочипов.
Гены кандидаты гестоза
Согласно современным исследованиям
последних лет, генетическая компонента гестоза может составлять 50%. Изучение
генетических маркеров, ассоциированных с развитием гестоза, - важнейшая задача
для понимания патогенеза, лечения и профилактики заболевания [Демин, 2007]. В
соответствии со сложной патофизиологией гестоза список генов-кандидатов,
предрасполагающих к гестозу, огромен. Некоторые гены-кандидаты гестоза
приведены в таблице 2. Среди генов - кандидатов, выделяются прежде всего гены,
ответственные за формирование сосудистого тонуса, тромбообразующих факторов,
участвующих в оксидативном стрессе и функционировании эндотелия.
Таблица 2. Гены-кандидаты риска развития преэклампсии
|
Ген
|
RefSNP
|
Замена
|
Диагноз
|
RA/PA
|
Популяция
|
Ссылка
|
|
ACE
|
rs1799752
|
I/D
|
Гестационная
гипертензия
|
D/D
|
азиаты
европеоиды
|
Мета-анализ
78,79
|
|
rs1799752
|
I/D
|
Преэклампсия
|
D/D
|
европеоиды
|
Мета-анализ 109
|
|
rs1799752
|
I/D
|
Преэклампсия
|
D
|
европеоиды
|
129
|
|
AGT
|
rs699
|
M235T
|
Преэклампсия
|
TT
|
европеоиды
|
Мета-анализ 145
|
|
rs699
|
M235T
|
Преэклампсия
|
TT
|
европеоиды
|
Мета-анализ 109
|
|
eNOS
|
rs1799983
|
G894T
|
Преэклампсия
|
T
|
европеоиды
|
Мета-анализ 79
|
|
FV
|
rs6025
|
G1691A
|
Бесплодие у
женщин, неудачные попытки ЭКО
|
AG
|
европеоиды
|
Мета-анализ 85
|
|
rs6025
|
G1691A
|
Венозный
тромбоэмболизм у женщин, принимающих ОК
|
AG
|
европеоиды
|
Мета-анализ 144
|
|
rs6025
|
G1691A
|
Невынашивание
беременности
|
AG
|
|
Мета-анализ 86
|
|
rs6025
|
G1691A
|
Невынашивание
беременности
|
AG
|
|
127
|
|
rs6025
|
G1691A
|
Привычное
невынашивание беременности
|
AG
|
|
Мета-анализ 86
|
|
rs6025
|
G1691A
|
Преэклампсия
|
AG
|
|
127
|
|
rs6025
|
G1691A
|
Невынашивание
беременности
|
AG
|
|
127
|
|
rs6025
|
G1691A
|
Привычное
невынашивание беременности
|
AG
|
|
Мета-анализ 86.
|
|
rs6025
|
G1691A
|
Преэклампсия
|
AG
|
|
Мета-анализ 86
|
|
rs6025
|
G1691A
|
Задержка
внутриутробного развития плода
|
AG
|
|
Мета-анализ 86
|
|
(TNF) - alpha
|
|
G-308A
|
Преэклампсия с
задержкой внутриутробного развития плода
|
А
|
европеоиды
|
Мета-анализ 110
|
|
IL-10
|
|
G1082A
|
ПНБ
|
-1082 G/G
|
|
Мета-анализ 81,
82
|
|
|
G1082A
|
Преэклампсия
|
АА
|
0.16 европеоиды
|
86
|
|
|
-1082
G/A
|
Преэклампсия
|
AA
|
турки
|
139
|
|
IL-1B
|
-31T
|
|
Мета-анализ 74
|
|
IFN-gamma
|
|
|
ПНБ
|
+874
T/T
|
|
Мета-анализ 86
|
|
VEGF
|
|
С+813Т
|
Преждевременные
роды
|
С
|
0.233
европеоиды
|
70
|
|
VEGFA
|
3’UTR
|
+936C/T
|
Преэклампсия
|
+936T
|
корейцы
|
131
|
|
LEPR
|
|
G1019A
|
|
G
|
0.15
монголоиды
|
94
|
|
|
A223G
|
|
A
|
0.19
монголоиды
|
|
|
LEP
|
|
−2548
G/A
|
Преэклампсия
|
AA
|
Европеоиды (Шри-Ланка)
|
134
|
|
|
−2548
G/A
|
Гестационный
сахарный диабет
|
AA
|
Чехи
|
138
|
|
MMP-9
|
|
-1562C>T
|
Гипертонические
расстройства беременности
|
TT
|
Бразильцы
|
119
|
|
TGFB1
|
|
869T>C
|
Преэклампсия
|
TC/CC
|
Корейцы
|
103
|
|
GNB3
|
|
C825T
|
Преэклампсия
|
Т
|
Европеоиды
Негроиды
|
135
|
|
HLA-G
|
3’UTR
|
|
Преэклампсия
|
-14
bp/-14 bp
|
китайцы
|
69
|
|
HLA-G
|
rs66554220
|
|
Преэклампсия
|
(G)/
+14 BP
|
|
105
|
|
PAPP-A
|
|
Cys327Cys
|
|
TT
|
европеоиды
|
115
|
|
MTHFR
|
rs1801133
|
C677T(A222V)
|
Преэклампсия
|
T
|
|
Мета-анализ 104
|
|
rs1801133
|
C677T
(A222V)
|
Преэклампсия
|
TT
|
|
Мета-анализ
147.
|
|
PAI-1
|
rs1799889
|
-675
4G/5G
|
Преэклампсия
|
4G
|
|
Мета-анализ 143
|
|
rs1799889
|
-675
4G/5G
|
Преэклампсия
|
4G
|
европеоиды
|
102
|
|
NR1H2
(LXRbeta)
|
rs2695121
|
|
Преэклампсия
|
CC
|
европеоиды
|
114
|
|
EDN1
|
|
G5665T
|
Преэклампсия
Повышенное АД
|
TT
|
Индианки
|
69
|
|
|
Lys198Asn
|
Повышенное
АД
|
ТТ
|
Австралийцы
|
71
|
|
GSTP1
|
|
A313G
|
Прееэклампсия
|
313G
|
Мексика Метисы
майя
|
77
|
Более 130 работ были проведены по исследованию поиска
генов-кандидатов гестоза. В настоящий момент предложено больше 50 генов-кандидатов
гестоза. Это гены, которые являются кодирующими элементами системы
ренин-ангиотензин-альдостероновой системы, участвующие в регуляции кровяного
давления: инсерционно-делеционный полиморфизм гена ангиотензинпревращающего
фермента (АСЕ); А1166С полиморфизм гена рецептора I типа ангиотензина II; ангиотензиногена;
полиморфизм гена эндотелиальной синтазы (еNOS); полиморфизм гена
цитокина, фактора некроза опухолей (TNF-a). Гены, системы
свертывания крови: лейденовская мутация (FV), протромбин (фактор II) и
метилентетрагидрофолатредуктаза. Следует признать, что аллельные варианты
частоты и частоты мутантных генотипов исследованных генов у больных с гестозом
отличаются от таковых у здоровых беременных. При этом ассоциации различных
полиморфизмов с гестозом выражены в разной степени.
Принимая во внимание сложность и
многообразиепвтофизиологических процессов, определяющих развитие клинического
симптомокомплекса при гестозе, и противоречивость результатов исследований,
объективно смоделировать всю генную сеть этого заболевания пока не
представляется возможным.
1.6 Ген рецептора
активина 2 типа А (ACVR2A), полиморфизмы этого гена и ассоциация с
осложнениями беременности
Клеточный сигнальный белок активин А - член суперсемейства
сигнальных белков, таких как TGF-b (рис. 4). Роль этих белков была описана в различных
клеточных процессах, необходимых для осуществления репродуктивной функции,
включая регулирование пролиферации клеток, дифференциацию и апоптоз [99, 89].
Также данные различных исследований указывают на то, что активин А вовлечен в
патогенез воспалительных заболеваний и атерогенез. Активин А играет важную роль
в регуляции функционирования эндотелия и влияет на эндоваскулярную ответную
реакцию матери [97,76,].Рецепторы активина 1 и 2 типов работают как
трансмембранные белковые рецепторы. Активин А связывается сначала с ACVR2A, а после этого вступает
в реакцию с фосфорилатами ACVR1. Рецепторы активина экспрессируются
эндометрием, плацентарной тканью, сосудисто-эндотелиальными клетками и
трофобластом с самого начала беременности [122, 130].

Рисунок 4. Структура рецептора активина 2 типа A [Ensembl]
Рецептор активина 2 типа - продукт экспрессии гена ACVR2A, локализованного на
2q22.3 хромосоме и состоящего из 10 экзонов и 9 интронов и общей протяжённостью
86,3 тпн. (рис. 5). В настоящее время известно 1124 SNPs в этом гене[75]. GWLS в семьях из Австралии,
Новой Зеландии, и Исландии позволили установить локус, отвечающий за развитие
преэклампсии, на хромосоме 2q22-23 [112, 113, 68]. Таким образом ACVR2A был описан как
предпологаемый ген кандидат. Также в нескольких исследованиях было установлено,
что преэклампсия связана с повышением уровня активина в сыворотке крови матери.
Исходя из этих данных было выдвинуто предположение, что дисбаланс экспрессии ACVR2A может влиять на
концентрацию активина и следовательно на такие процессы как инвазия трофобласта
и ремодернизация спиральных артерий [112, 113, 88]. Дисбаланс экспрессии
рецептора, а именно, снижение экспрессии ACVR2A может вызвать повышение
урованя активина в сыворотке крови. Гипотетически, именно этот механизм
приводит к нарушению работы иммунной системы, а следовательно к разбалансировке
работы противовоспалительного звена[133]. Мутации в гене ACVR2A ассоциированы с преэклампсией,
феохромоцитомой и различными онкологическими заболеваниями: рак толстой,
ободочнойи прямой кишки, рак яичника, поджелудочной железы.
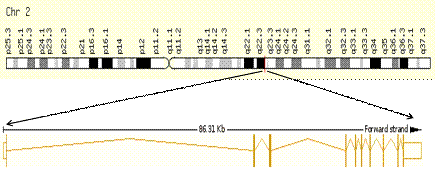
Рисунок 5. Структура и локализация гена ACR2A [PubMed]
Мета-анализ результатов пяти полногеномных
исследований дал скромные доказательства связи нескольких локусов гена ACVR2A с развитием
преэклампсии, но стоит отметить, что недостаточные данные стали основой для
убедительных результатов. Ассоциация между риском развития преэклампсии и
генами-кандидатами на позиции 2q22-23, выявленными в GWLS, были изучены далее в
норвежской, австралийской и новозеландской группах. Рецептор активина II типа A
(ACVR2A) был идентифицирован как главный кандидат на позиции этого
локуса. ACVR2A является ключевым рецептором клеточной сигнализации,
белок активин - важным регулятором человеческой беременности. Циклическое
повышение уровня активина при преэклампсии позволяет использовать его в
качестве потенциального маркера этого заболевания. Значимая корреляция с
преэклампсией была обнаружена в четырёх SNPs гена ACVR2A. В
исследовании 1100 норвежских женщин с преэклампсией и 2200 женщин с
физиологической беременностью ассоциацию полиморфизмов гена ACVR2A с
развитием заболевания и нарушением функционирования активина однозначно
установить не удалось. Тем не менее, было доказано отсутствие связи
полиморфизмов гена ACVR2A с преэклампсией в исследовании 74 семей из
Австралии и Новой Зеландии, в которых женщины страдали преэклампсией [73]. В
связи с тем, что активин является одним из важнейших факторов влияющих на
течение беременности, ген ACVR2A по-прежнему остается одним из
приоритетных для дальнейших исследований.
1.7 Гормон лептин и роль полиморфных вариантов
гена LEP в развитии многофакторных заболеваний
Лептин - гормон (белок 16 кДа),
регулирующий энергитический обмен, оказывающий анорексигенное действие (рис. 6).
Секретируется адипоцитами, клетками жировой ткани. Этот гормон участвует в
регуляции энергетического обмена организма и массы тела. Лептин часто называют
гормоном насыщения. Считается, что он действует на гипоталамус, блокируя синтез
и высвобождение нейропептида Y, вызывающего чувство голода. Врожденная
недостаточностъ лептина у грызунов и у человека приводит к развитию тяжёлой
формы ожирения[111].
Не так давно была выдвинута гипотеза об
участии лептина в адаптации организма к голоданию. При этом учитываются
основные функции лептина - снижение расхода энергии за счет уменьшения синтеза
гормонов щитовидной железы и теплообразования, мобилизация энергетических
ресурсов за счет повышенной продукции глюкокортикоидов и подавления
репродуктивной функции. Концентрация лептина играет роль физиологического
сигнала о достаточности энергетических ресурсов организма для выполнения
репродуктивной функции и влияет на выработку стероидных гормонов в яичниках. В
период полового созревания происходит повышение концентрации лептина в крови.
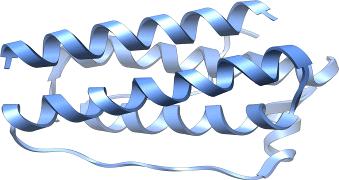
Рисунок 6. Структура лептина [Ensembl]
Ген лептина (LEP) человека локализуется на 7q31.3 хромосоме и
состоит из 3 экзонов и 2 интронов, причём первый экзон не кодирующий, и
кодируется 4,5 тпн мРНК (рис. 7). В гене LEP на сегодняшний день
известно 381 функционально значимых SNP[dbNCBI]. Ген экспрессируется в белой жировой ткани,
желудке, плаценте и в молочной железе. Секретирующийся жировой тканью лептин
поступает в кровообращение в основном в ночное время. Ген играет важную роль в
регулировании массы тела, стимулирует расход энергии. Мутации гена LEP изменяют секрецию
гормона лептина, что вызывает наследственное ожирение. Мутации в гене лептина
ассоциированы не только с ожирением, но и с такими заболеваниями как вторичный
гипотериоз, сахарный диабет 2 типа, атеросклероз, гипертония, бесплодие,
сердечно-сосудистые заболевания в семейном анамнезе, заболевания позвоночника,
ишемия и поликистоз яичников.
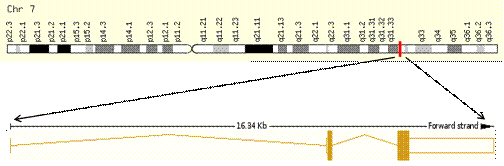
Рисунок 7. Структура и локализация гена LEP [PubMed]
У женщин содержание лептина в сыворотке крови на 40% больше,
чем у мужчин. Эти различия отражают резистентность к липостатическому действию
лептина и могут быть обусловлены содержанием половых гормонов, так как
тестостерон в большей степени, чем эстрогены, снижает секрецию лептина.
Многочисленными исследованиями было показано, что достаточный уровень лептина
является пермиссивным фактором для полового созревания и поддержания
репродукции [8].
Установлено, что лептин стимулирует активацию
симпатоадреналовой системы, а катехоламины, в свою очередь, подавляют продукцию
лептина, однако при развитии метаболического синдрома эти взаимодействия
нарушаются и повышенный уровень лептина в сочетании с хронической
гиперактивацией нейрогуморальных систем способствует возникновению артериальной
гипертензии [11].
У человека лептин синтезируется также в плаценте в количестве
не меньшем, а может быть, даже большем, чем в жировой ткани [23]. По
молекулярной массе, заряду и иммунологической активности плацентарный лептин не
отличается от лептина жировой ткани и является продуктом экспрессии того же
гена. Высказываются различные предположения о возможной физиологической роли
плацентарного лептина в регуляции репродуктивной функции человека, что дает
возможность объяснить корреляцию между уровнем лептина и гестозом. Лептин
участвует в регуляции сложных механизмов, определяющих энергозатраты, аппетит,
рост плода и его развитие. У беременных концентрации лептина в 3-4 раза выше,
чем у небеременных. Концентрации лептина в крови беременных и крови из пуповины
значительно выше у женщин с гестозом, чем у здоровых беременных, вне зависимости
от индекса массы тела и срока беременности. Существует тесная зависимость между
концентрацией лептина и клиническими признаками гестоза [24]. Как и при
ожирении, у женщин с гестозом отмечаются нарушение толерантности к глюкозе,
резистентность к инсулину и гиперлипидемия. Это объясняет причину того, что
ожирение является фактором риска развития гестоза.
2. Материалы и методы
.1 Клиническая характеристика обследованных
пациенток
Всего были обследованы 657 беременных женщин из двух
популяций: якуты (г. Якутск) N = 340 и русские (г. Томск) N = 317. Группа с гестозом
включала 367 пациенток, из них: 210 женщин имели этническую принадлежность к
якутам, а 157 - к русским. Контрольная группа была представлена 290 женщинами с
физиологически протекавшей беременностью и родами, из них 130 женщин
принадлежат к этнической группе якутов, а 160 - к этнической группе русских.
Группа пациенток с гестозом была неоднородной как по степени тяжести гестоза,
так и по наличию ранее предшествовавших и сопутствующих фоновых заболеваний.
«Чистый» гестоз не был отмечен ни у одной пациентки с осложненным течением
беременности из якутской популяции, у всех пациенток диагностировали сочетанный
гестоз различной степени тяжести на фоне экстрагенитальных заболеваний. Среди
беременных женщин из популяции русских диагноз «чистый» гестоз был поставлен
23%, а сочетнанный -77% пациенток.
Диагноз гестоз устанавливался при условии наличия не менее
двух клинических проявлений в следующих сочетаниях: повышение артериального
давления (АД) и отеки, отеки и протеинурия, сопровождающая повышением АД, а
также классической триады симптомов - отеки, гипертензия, протеинурия.
2.2 Молекулярно-генетические методы исследования
Выделение ДНК из лейкоцитов венозной крови
Выделение ДНК проводили стандартным методом с использованием
фенол-хлороформной очистки [98, 120]. К 0.7 мл крови, стабилизированной ЭДТА
(0,1 мл 0,5М раствора ЭДТА на 1 мл крови), в эппендорф добавляли 0,8 мл 1× SSC и сильно центрифугировали в течение 2 минут при
12000-13000 об/мин, после чего осторожно сливали супернатант. К осадку
добавляли 1,4 мл 1× SSC и сильно встряхивали,
чтобы разбить осадок, после чего снова центрифугировали при 12000-13000 об/мин.
в течение 2 минут. После центрифугирования супернатант сливали и последнюю
каплю снимали фильтровальной бумагой. К осадку добавляли 270 мкл 0,2М натрия
ацетата (рН 7,0), тщательно и долго перемешивали, встряхивали до полной
гомогенизации на протяжении 6-10 минут. К содержимому добавляли 30 мкл SDS, перемешивали и
оставляли на 1 час в термостате при температуре 37°С, периодически перемешивая.
Затем добавляли фенол-хлороформ (в соотношении 1:1) в равном объеме (примерно
300 мкл) и плавно перемешивали в течение 8-10 минут, после чего
центрифугировали при 13000 об/мин 8 минут. После центрифугирования водную фазу
(осторожно, не захватывая интерфазу) переносили в чистую пробирку эппендорф. К
супернатанту в чистой пробирке эппендорф добавляли 1 мл 96% этилового спирта
комнатной температуры, затем встряхивали для осаждения ДНК, после этого вращали
пробирки для накручивания ДНК саму на себя. Затем центрифугировали в течение 2
минут при 12000 об/мин, чтобы комочек ДНК прилип ко дну пробирки, после чего
осторожно сливали спирт. На следующем этапе добавляли 1 мл 70% этилового
спирта, перемешивали, после чего центрифугировали при аналогичных условиях,
затем спирт сливали. ДНК подсушивали на воздухе в течение 5-10 минут, добавляли
50 мкл деонизованной воды и оставляли на ночь для полного растворения ДНК.
Выделенную ДНК замораживали и хранили при -20°С до проведения эксперимента
Генотипирование генетических маркеров
В данной работе исследовано 9 полиморфных вариантов 2
кандидатных генов подверженности к гестозу: рецептора активина 2 типа (ACVR2A) и лептина (LEP). В таблице 3
представлена характеристика изученных полиморфных вариантов в генах (рис 8, 9).
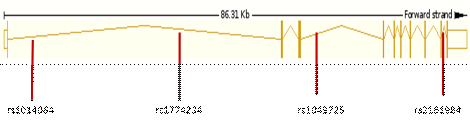
Рисунок 8. Локализация изученных полиморфизмов в гене ACVR2A
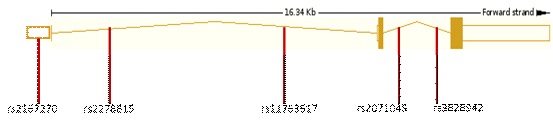
Рисунок 9. Локализация изученных полиморфизмов в гене LEP
Таблица 3. Характеристика исследованных полиморфизмов
генов-кандидатов
|
Ген и его
локализация на хромосоме
|
SNPs
|
Замена
|
Предковый
аллель
|
Локализация в
гене (по данным базы NSBI)
|
|
LEP 7q31.3
|
rs2278815
|
A/G
|
G
|
1 Интрон
|
|
rs3828942
|
A/G
|
G
|
2 Интрон
|
|
rs2167270
|
A/G
|
G
|
5'-UTR
|
|
rs11763517
|
C/T
|
T
|
1 Интрон
|
|
rs2071045
|
C/T
|
T
|
2 Интрон
|
|
ACVR2A
2q22.3
|
rs1014064
|
A/G
|
A
|
1 Интрон
|
|
rs1774234
|
A/C
|
A
|
1 Интрон
|
|
rs1049725
|
C/G
|
C
|
3 Интрон
|
|
rs2161984
|
A/G
|
G
|
9 Интрон
|
Генотипирование rs2278815, rs3828942, rs2167270 и rs11763517 гена LEP осуществляли с помощью
амплификации соответствующих участков генома методом полимеразной цепной
реакции (ПЦР) и анализа полиморфизма длин рестрикционных фрагментов (ПДРФ).
Генотипирование проводили на амплификаторе Applied Biosystems (США). ПЦР проводили в
объёме 15 мкл в микроцентрифужной пробирке типа «Эппендорф» со следующими компонентами
реакции: ДНК (2 нг), дезоксирибонуклеозидтрифосфаты в эквивалентных
концентрациях 2 мМ, термостабильная ДНК-Taq-полимераза (0,8 е.а.),
праймеры (прямой и обратный), буфер, содержащий сульфат аммония, MgCl2 (25 мМ), деионизованная
вода. Реакция амплификации включает несколько стадий: на первом этапе
происходит денатурация молекулы ДНК, далее отжиг праймеров, при котором они
гибридизуются с комплементарными последовательностями на разных цепях, после
чего следует элонгация - этап основного синтеза ДНК. В результате 30 и более
циклов наблюдается экспоненциальное увеличение числа копий специфического
фрагмента ДНК [Щелкунов]. ПЦР проводили по схеме: начальная денатурация - 94°С
(5 мин), затем 42 циклa амплификации в следующих условиях: денатурация - 94°С (40
с), отжиг - 60°С (40 с), элонгация - 72°С (40 с), после чего пробы инкубировали
3 мин при температуре 72°С. Структура праймеров, температура отжига,
эндонуклеазы рестрикции и размеры фрагментов исследованных полиморфных
вариантов генов описаны в таблице 4.
Продукты амплификации и рестрикции анализировались с помощью
электрофореза в 2%, 3% агарозном геле и в 6%, 8% полиакриламидном геле,
окрашенном бромистым этидием (рис. 10-13). Искомые бенды визуализировали в
ультрафиолетовом трансиллюминаторе.
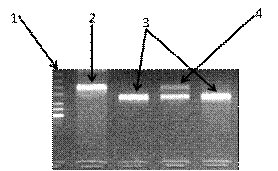
Рисунок 10. Электрофореграмма разделения фрагментов ДНК
амплифицированного участка rs2278815 гена LEP в 3% агарозном геле: 1 -
маркер молекулярного веса pUC19/Msp I; 2 - гомозигота (AA); 3 - гомозигота (GG); 4 - гетерозигота
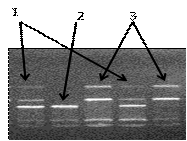
Рисунок 11. Электрофореграмма разделения фрагментов ДНК
амплифицированного участка rs3828942 гена LEP в 3% агарозном геле: 1 -
гетерозигота; 2 - гомозигота (GG); 3 - гомозигота (AA)
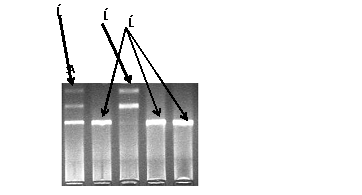
Рисунок 12. Электрофореграмма разделения фрагментов ДНК
амплифицированного участка rs2167270 гена LEP в 3% агарозном геле: 1 -
гетерозигота; 2 - гомозигота (AA); 3 - гомозигота (GG)
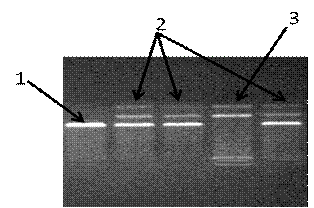
Рисунок 13. Электорофореграмма разделения фрагментов ДНК
амплифицированного участка rs11763517 гена LEP в 3% агарозном геле: 1 -
гомозигота (TT); 2 - гомозигота (CC); 3 - гетерозигота
Таблица 4. Структура праймеров, температура отжига,
эндонуклеазы рестрикции и размеры фрагментов исследованных полиморфных
вариантов генов
|
№
|
Локус
|
Последовательность
праймеров
|
Температура
отжига
|
Эндонуклеазы
рестрикции
|
Температура
рестрикции
|
Длина
фрагментов ДНК на электрофорезе
|
|
1
|
rs2278815
|
F:
5'-ATTCGCAGAGCTGAGATGC-3' R:
5'-CCCCCACCTCTACTCATCCT-3'
|
60˚С
|
Bst4CI
|
55˚С
|
Аллель А (209 и
49 п.о.) и аллель G (258 п.о.)
|
|
2
|
rs3828942
|
F: 5'-TCTTCAGCAGAGGCCATGTA-3' R: 5'-GCCAGTGTCTGGTCCATCTT-3'
|
60˚С
|
RsaI
|
37˚С
|
Аллель A (127 и
246 п.о.) и аллель G (373 п.о.)
|
|
3
|
rs2167270
|
F:
5'-GGAGCTGGCGCTAGAAATG-3' R: 5'-CAGCTCCCGGTAACCTTCT-3'
|
60˚С
|
Bst4CI
|
60˚С
|
Аллель A (189 и
110 п.о.) и аллель G (299 п.о.)
|
|
4
|
rs11763517
|
F:
5'-TCTTCAGCAGAGGCCATGTA-3' R: 5'-GCCAGTGTCTGGTCCATCTT-3'
|
60˚С
|
SmlI
|
55˚С
|
Аллель С (228 и
131 п.о.) и аллель Т (373 п.о.)
|
Геноипирование rs2071045 гена LEP, rs1014064, rs1774234, rs1049725 и rs2161984 гена ACVR2A осуществляли методом Real Time-PCR, воспроизводимым с
помощью линейных разрушаемых проб TaqMan Genotyping Assay от Applied Biosystems. В данном подходе
олигонуклеотид, комплементарный продукту ПЦР, метят флоурофором и гасителем
флуоресценции (возможно использование как концевого, так и внутреннего мечения
олигонуклеотида). В отсутствие мишени флоурофор и гаситель сближены и
флуоресценция подавлена (обычно по механизму флуоресцентно-резонансного
переноса энергии). При накоплении соответствующего продукта реакции, проба
гибридизируется на ампликон, что ведет к её разрушению за счёт 5' -
эндонуклеазной активности Taq-полимеразы (рис. 14) (Holland et al., 1991; Livak, 2003). Интенсивность
сигнала возрастает с каждым циклом ПЦР пропорционально накоплению ампликонов (Holland et al., 1991; Happich et al., 2000). В данном походе
принципиально использование полимеразы с хорошо выраженной 5' - эндонуклеазной
активностью[44].
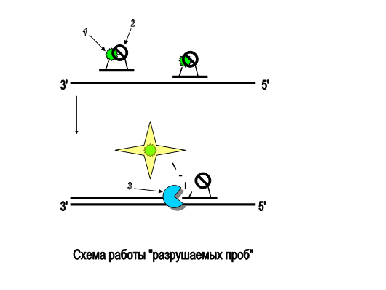
Рисунок 14. Схема работы «разрушаемых проб»: Пробы несут
флуорофор (1) и гаситель флуоресценции (2). Пока проба находится в растворе, за
счёт близкого расположения, гаситель эффективно поглощает энергию флуорофора. В
случае гибридизации со спецефическим продуктом реакции проба разрушается за
счёт 5' - эндонуклеазной активности полимеразы (3), что ведёт к разобщению
флоурофора и гасителя и возрастанию флоуресценции [44]. Таким образом,
увеличение флуоресценции будет прямо пропорционально количеству наработанного
ПЦР-продукта
Для постановки TaqMan проб для исследуемых локусов готовили ПЦР смесь
следующего состава (с расчётом на один образец ДНК=20 нг): готовая смесь для Real Time-PCR «Master Mix», включающая в состав
дезоксирибонуклеозидтрифосфаты, термостабильную ДНК-Taq-полимеразу, буфер,
содержащий сульфат аммония и MgCl2; флюоресцентные праймеры, меченные FAM и HEX; деионизированная вода.
Реакция проходила в амплификаторе «BIORAD», включала в себя следующие стадии: начальная
денатурация в течении 10 минут при температуре 95°С, затем протекала
денатурария при 92°С в течении 15 секунд и элонгация при 60°С в течении 1
минуты (40 циклов). Продукты амплификации визуализировались с помощью программы
«Biorad CSF Manager» и выглядели в виде
схемы (рис. 15).
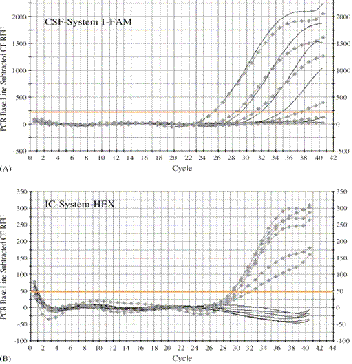
Рисунок 15. Схема результатов Real Time-PCR
2.3 Методы статистической обработки результатов
Статистическая обработка результатов исследования проводилась
с помощью пакета статистических программ «Statistica 6.0». Различие двух
сравниваемых величин считалось статистически значимым с надежностью р >
0,95, если вероятность их тождества оказывалась меньше 5%.
Соответствие распределения частот аллелей и генотипов по
исследованным генам равновесию Харди-Вайнберга проверяли по критерию c2 [17]:
c2= å (Nф - Nт)2/
Nф,
где Nт - теоретически ожидаемая численность генотиповф -
фактическая численность генотипов= m (m-1)/2, где m - число аллелей
Для сравнения частот аллелей у больных с контролем и с
популяционной выборкой проводили попарное сравнение выборок.
c2= N1N2(p1-p2)
2/Np(1-p),
где p =(p1N1+p2N2)/N
- средневзвешенная частота аллеля,
и N1 и N2 - численность аллелей в
сравниваемых выборках,
р1 и р2 - частоты аллелей в этих же
выборках.
В исследуемых группах для полиморфных вариантов вычисляли
отношение шансов (OR) и доверительные интервалы (Cl) для отношения шансов
(95% Cl).
Частоты гаплотипов определялись с помощью EM-алгоритма. LD между парами SNPs оценивалось с помощью коэффициента
D`, предложенного Левонтином и коэффициента корреляции r2 Пирсона.
Коэффициент D` Левонтина рассчитывают по формуле:
D’ = D / |D|max [1; -1],
где Dij = hij - piqj - коэффициент
неравновесия, hij - оценка частоты гаметы АiВj в популяции, pi и qj - оценки частот аллелей
Аi и Вj соответственно.
Коэффициент корреляции r2 Пирсона рассчитывают по
формуле:
r2 = D2 / piqipjqj
3. Результаты и обсуждения
Одной из актуальных проблем современного акушерства является
проблема гестоза [5]. Показатели материнской смертности в мировой практике
весьма стабильны на протяжении последних лет: ежегодно в мире погибает более
полумиллиона женщин от причин, связанных с беременностью и в её структуре 12%
приходится на гестоз. В мировой литературе ежегодно публикуется более 1500
научных работ, посвящённых различным аспектам этиологии, патогенеза,
профилактики и лечения этого грозного осложнения беременности, однако эти
вопросы всё ещё далеки от разрешения. Кроме того, полученные в этих работах
данные зачастую противоречивы и требуют уточнения на большем клиническом
материале [2, 4]. Для России эта проблема чрезвычайно актуальна, поскольку
отмечается постоянный рост частоты гестоза в популяциях беременных женщин - до
16%, а тяжёлых форм гестоза (преэклампсия, эклампсия) до 1%. При том, что в
нашей стране рождаемость резко снизилась, показатель материнской смертности
остаётся высоким (в среднем 50 на 100000 рожднных живими) [10]. Гестоз чаще
наблюдается у первородящих, особенно среди беременных моложе 18 и старше 30 лет.
Особенностью повторных беременностей и родов у женщин, перенесших гестоз,
является частое его повторение (61,8%) [21].
Не смотря на многочисленные исследования, вопросы этиологии и
патогенеза гестоза всё ещё далеки от окончательного решения. По существующим
представлениям гестоз является типичным многофакторным заболеванием, что
обуславливает необходимость изучения генетической компоненты, играющей важную
роль в генезе этого заболевания.
Нами были изучены однонуклеотидные полиморфизмы rs2278815, rs3828942, rs2167270 и rs11763517 и rs2071045 гена
LEP, rs1014064, rs1774234,
rs1049725 и rs2161984 гена ACVR2A, представляющие интерес в связи со значительно
повышенной экспрессией (ген LEP), а так же с результатами GWLS в плацентраной ткани при
преэклампсии (ген-кандидат на локусе 2q22-23 второй хромосрмы - ген ACVR2A) для данного
исследования был выбран ген ACVR2A [128, 96, 100].
3.1 Анализ распределения частот генотипов и
аллелей tagSNPs генов LEP и ACVR2A в изученных
популяционных выборках
Распределение частот аллелей и генотипов, а также
соответствие распределения генотипов равновесию Харди-Вайнберга, полученные в
данном исследовании, представлены в таблице 3. Как видно распределение частот
генотипов в контрольных выборках соответствовало равновесию Харди-Вайнберга, за
исключением распределения частот генотипов по rs2278815 (LEP) в популяции якутов,
возможными причинами отклонения от равновесия Харди-Вайнберга могут быть
сцепление этого SNP с функционально значимым полиморфизмом гена LEP, или демографические процессы
в популяции (эффект основателя, дрейф генов и др.).
Таблица 5. Распределение частот генотипов и аллелей по
исследованным полиморфизмам генов LEP и ACVR2A в изученных популяциях
|
Исследуемые
полиморфизмы (гены)
|
Исследуемые
популяции
|
|
Якуты
|
Русские
|
|
Гестоз N=219
|
Контроль N=130
|
OR
(95% доверительный
интервал)
|
Уровень
значимости р для критерия   с поправкой Йейтса,*Гестоз N=157Контроль N=160OR (95%
доверительный интервал)Уровень значимости р для критерия χ^2
с поправкой Йейтса,* с поправкой Йейтса,*Гестоз N=157Контроль N=160OR (95%
доверительный интервал)Уровень значимости р для критерия χ^2
с поправкой Йейтса,*
|
|
|
|
|
|
Rs
2167270 (LEP)
|
Частоты
генотипов, %
|
AA
|
4,2
|
10,8
|
OR= 0,99 Cl: 0,64 - 1,54
|
χ2=6,95 р=0,03
|
16,8
|
8,8
|
OR= 0,86 Cl: 0,62 - 1,18
|
χ2=5,56 p=0,06
|
|
|
AG
|
36,6
|
28,5
|
|
|
37,4
|
35,6
|
|
|
|
|
GG
|
59,3
|
60,8
|
|
|
45,8
|
55,6
|
|
|
|
Частота аллеля, %
|
A
|
22,5
|
25,5
|
|
χ2=0,59 р=0,44
|
35,5
|
26,6
|
|
χ2=5,86 p=0,02
|
|
Р**
|
χ2=0,32 р=0,57
|
χ2=0,0 р=1,0
|
|
|
χ2=2,35 р=0,13
|
χ2=0,62 р=0,43
|
|
|
|
Rs 2278815 (LEP)
|
Частоты
генотипов, %
|
AA
|
44,1
|
55,7
|
OR= 1,34 Cl: 0,95 - 1,88
|
χ2=4,54 p=0,1
|
29,2
|
28,8
|
OR=1,02 Cl: 0,75 - 1,40
|
χ2=0,15 p=0,93
|
|
|
AG
|
40,8
|
30,3
|
|
|
46,1
|
48,1
|
|
|
|
|
GG
|
15,0
|
13,9
|
|
|
24,7
|
23,1
|
|
|
|
Частота аллеля, %
|
G
|
35,4
|
29,1
|
|
χ2=2,82 p=0,09
|
47,7
|
47,2
|
|
χ2=0,02 p=0,89
|
|
Р**
|
χ2=1,10 p=0,29
|
χ2=4,13 р=0,04
|
|
|
χ2=0,47 p=0,49
|
χ2=0,08 p=0,78
|
|
|
|
Rs 11763517 (LEP)
|
Частоты генотипов, %
|
4,0
|
2,4
|
OR= 0,99 Cl: 0,64 - 1,54
|
χ2=0,94 p=0,62
|
26,2
|
17,0
|
OR= 0,86 Cl: 0,62 - 1,18
|
χ2=5,02 p=0,08
|
|
|
СТ
|
22,9
|
26,0
|
|
|
40,7
|
51,6
|
|
|
|
|
TT
|
73,1
|
71,7
|
|
|
33,1
|
31,4
|
|
|
|
Частота аллеля, %
|
T
|
84,6
|
84,6
|
|
χ2=0 p=0,98
|
53,4
|
57,2
|
|
χ2=0,88 p=0,35
|
|
Р**
|
χ2=1,09 p=0,3
|
χ2=0 p=1
|
|
|
χ2=2,55 p=0,11
|
χ2=0,21 p=0,56
|
|
|
|
Rs
2071045 (LEP)
|
Частоты генотипов, %
|
СС
|
41,7
|
33,3
|
OR=0,83 Cl: 0,60 - 1,14
|
χ2=2,48 p=0,29
|
2,0
|
5,2
|
OR=1,21 Cl: 0,82 - 1,79
|
χ2=2,30 p=0,32
|
|
|
CT
|
42,6
|
50,4
|
|
|
35,1
|
35,1
|
|
|
|
|
TT
|
15,7
|
16,3
|
|
|
62,9
|
59,7
|
|
|
|
Частота аллеля, %
|
T
|
37,0
|
41,5
|
|
χ2=1,33 p=0,25
|
80,5
|
77,3
|
|
χ2=0,93 p=0,33
|
|
Р**
|
χ2=0,71 p=0,4
|
χ2=0,07 p=0,8
|
|
|
χ2=1,41 p=0,24
|
χ2=0 p=1
|
|
|
|
Rs
3828942 (LEP)
|
Частоты генотипов, %
|
AA
|
57,1
|
56,3
|
OR=1,03 Cl: 0,71 - 1,49
|
χ2=0,98 p=0,61
|
27,0
|
21,4
|
OR=0,68 Cl: 1,08 - 2,03
|
χ2=8,88 p=0,01
|
|
|
AG
|
38,7
|
41,4
|
|
|
58,6
|
50,3
|
|
|
|
|
GG
|
4,2
|
2,3
|
|
|
14,5
|
28,3
|
|
|
|
Частота аллеля,
%
|
G
|
23,6
|
23,0
|
|
χ2=0,03 p=0,87
|
43,8
|
53,5
|
|
χ2=5,86 p=0,02
|
|
Р**
|
χ2=0,69 p=0,41
|
χ2=2,36 p=0,12
|
|
|
χ2=, 712 p=0,1
|
χ2=0 p=0,96
|
|
|
|
Rs
1014064 (ACVR2A)
|
Частоты
генотипов, %
|
AA
|
39,4
|
36,2
|
OR=0,87 Cl: 0,63 - 1,20
|
χ2=0,92 p=0,63
|
37,7
|
45,0
|
OR=1,27 Cl: 0.91 - 1,77
|
χ2=1,85 p=0,4
|
|
|
AG
|
49,1
|
48,8
|
|
|
45,0
|
41,6
|
|
|
|
|
GG
|
11,5
|
15,0
|
|
|
17,2
|
13,4
|
|
|
|
Частота аллеля,
%
|
G
|
36,1
|
39,4
|
|
χ2=0,73 p=0,39
|
39,7
|
34,2
|
|
χ2=1,95 p=0,16
|
|
Р**
|
χ2=0,4 p=0,53
|
χ2=0,04 p=0,84
|
|
|
χ2=0,23 p=0,63
|
χ2=0 p=1
|
|
|
|
Rs
17742342 (ACVR2A)
|
Частоты
генотипов, %
|
AA
|
92,1
|
89,2
|
OR=0,72 Cl: 0,35 - 1,49
|
χ2=0,84 p=0,66
|
66,0
|
75,0
|
OR=1,50 Cl: 0,96 - 2,33
|
χ2=4,58 p=0,1
|
|
|
AC
|
7,9
|
10,8
|
|
|
32,7
|
25,0
|
|
|
|
|
CC
|
0
|
0
|
|
|
1,3
|
0
|
|
|
|
Частота аллеля,
%
|
C
|
3,9
|
5,4
|
|
χ2=0,80 p=0,37
|
17,6
|
12,5
|
|
χ2=3,25 p=0,07
|
|
Р**
|
χ2=0,03 p=0,53
|
χ2=0,03 p=0,86
|
|
|
χ2=1,70 p=0,19
|
χ2=3,37 p=0,48
|
|
|
|
Rs
2161984 (ACVR2A)
|
Частоты
генотипов, %
|
AA
|
11,6
|
14,3
|
OR= 0,84 Cl: 0,61 - 1,16
|
χ2=1,14 p=0,57
|
15,3
|
12,8
|
OR= 1,18 Cl: 0,84 - 1,65
|
χ2=0,88 p=0,64
|
|
|
AG
|
46,5
|
49,2
|
|
|
44,0
|
41,6
|
|
|
|
|
GG
|
41,9
|
36,5
|
|
|
40,7
|
45,6
|
|
|
|
Частота аллеля,
%
|
A
|
34,9
|
61,1
|
|
χ2=1,10 p=0,29
|
37,3
|
33,6
|
|
χ2=0,93 p=0,33
|
|
Р**
|
χ2=0,05 p=0,83
|
χ2=0,07 p=0,79
|
|
|
χ2=0,24 p=0,62
|
χ2=0,27 p=0,61
|
|
|
|
Rs
10497025 (ACVR2A)
|
Частоты
генотипов, %
|
CC
|
85,9
|
85,2
|
OR= 1,06 Cl: 0,59 - 1,90
|
χ2=1,31 p=0,52
|
51,3
|
57,2
|
OR=1,25 Cl: 0,87 - 1,78
|
χ2=1,35 p=0,51
|
|
|
CG
|
11,7
|
13,9
|
|
|
38,7
|
35,5
|
|
|
|
|
GG
|
2,3
|
0,8
|
|
|
10,0
|
7,2
|
|
|
|
Частота аллеля,
%
|
G
|
8,2
|
7,8
|
|
χ2=0,04 p=0,84
|
29,3
|
25,0
|
|
χ2=1,43 p=0,23
|
|
Р**
|
χ2=3,57 p=0,06
|
χ2=0,02 p=0,88
|
|
|
χ2=0,30 р=0,58
|
χ2=0,13 р=0,72
|
|
|
Примечание: N - количество индивидов
в группе. * - значение критерия 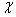 2 с
поправкой Йейтса и уровень значимости р получены при сравнении частот аллелей
или генотипов контрольной группы и группы больных гестозом. ** - соответствие
распределению Харди-Вайнберга. Жирным шрифтом выделены статистически значимые
различия (р<0,05)
2 с
поправкой Йейтса и уровень значимости р получены при сравнении частот аллелей
или генотипов контрольной группы и группы больных гестозом. ** - соответствие
распределению Харди-Вайнберга. Жирным шрифтом выделены статистически значимые
различия (р<0,05)
При сравнительном анализе частот аллелей и генотипов по
изученным полиморфизмам генов LEP и ACVR2A между больными гестозом
и контрольной группы были установлены статистически значимые отличия в
популяции русских по SNP rs3828942 (LEP). В контрольной группе
отмечалось повышение частоты генотипа GG (OR=0,43; Cl: 0,24-0,76) и аллеля G (OR=0,68; Cl: 1,08 - 2,03) по
сравнению с этими показателями у пациенток с гестозом (рис. 16). Таким образом,
можно сделать вывод, что аллель G, и генотип GG имеют протективный эффект. Интересным является
тот факт, что аллель G является предковым. Также была обнаружена тенденция к
ассоциации с гестозом полиморфизма rs2167270 гена LEP: было установлено статистически
значимое повышение частоты аллелля A (OR=2,10; Cl: 1,05 - 4,20) в группе больных, по сравнению с
контрольной группой и тенденция к ассоциации с генотипом АА (χ2=5,56; p=0,06) (рис. 17).
При сравнении исследованных групп в популяция якутов по всем
полиморфизмам генов LEP и ACVR2A значимых отличий между
группой больных и контрольной выборкой не найдено.
Рисунок 16. Распределение частот аллелей и генотипов rs3828942 (LEP) у больных гестозом и в контрольной группе в популяции русских
Примечание: * отмечены статистически значимые отличия
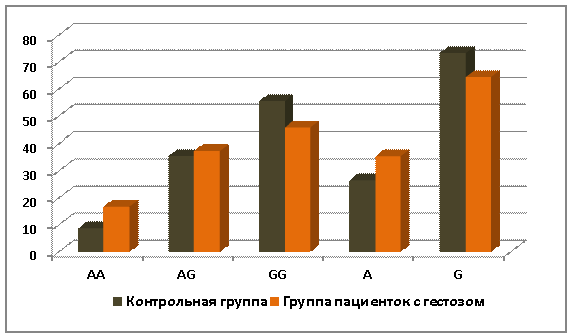
Рисунок 17 - Распределение частот аллелей и генотипов rs2167270 (LEP) у больных гестозом и в контрольной группе в популяции руских.
Примечание: * отмечены статистически значимые отличия, ->
отмечены тенденции к ассоциации
В настоящее время ведутся активные исследования различных
генов-кандидатов гестоза, а так же полиморфных вариантов генов, влияющих на
развитие сопутсвующих гестозу осложнений, в том числе и изученных в данной
работе полиморфных вариантов генов LEP и ACVR2A. Например, учёными из
Шри-Ланки была установлена ассоциация между артериальной гипертензией,
развивающейся на фоне преэклампсии и носительством генотипа АА по полиморфизму
-2548G/A [134]. Учёными из Чехии проводилось исследование на наличие связи
между развитием гестационного сахарного диабета и тем же полиморфизмом, в ходе
которого подтвердилось предположение о возможной ассоциации[138]. В то же
время, другая работа чешских исследователей не показывает наличия связи между
носительством мутантного генотипа по тому же полиморфизму и развитием
преэклампсии [75]. Исследование немецких учёных продемонстрировало отсутствие
связи между гипертензивными растройствами при преэклапсии и микросателлитными
полиморфизмами (TTTC) в гене LEP [142].К аналогичным выводам пришли и учёные из
семмельвейского университета (Венгрия, г. Будапешт) [117].
Учёными из г. Хельсинки в 2011 году было проведено и
сследование ассоциации rs1424954 гена ACVR2A cриском развития
преэклампсии у женщин из финляндии. В ходе исследования не удалось выявить
предпологаемую ассоциацию, что авторы объяснили наличием большого колличества SNPs в данном гене, и
необходимостью более детальных иследований[107]. Группой учёных из Австралии,
изучавшими ассоциацию с преэклампсией полиморфизмов rs13430086, rs10497025, LF004, LF013 и
LF020 гена рецептора активина 2 типа А, также не было получено статистических
данных в пользу данной ассоциации [88]. Норвежскими учёными в 2009 году была
проведена масштабная работа (общий объём выборки составил 65 000 жителей Норвегии)
по анализу ассоциаций SNPs rs1014064, rs17742134, rs1424941, rs2161983,
rs3768687 и rs3764955 гена ACVR2A. Итогом работы стало установление ассоциации
между риском развития преэклампсии и носительством мутантных аллелей rs1424941,
rs1014064, rs2161983 и rs3768687 [128].
Таким образом помимо GWLS, зарубежными авторами
была показана ассоциация некоторых полиморфизмов гена ACVR2A с риском развития
преэклампсии, а так же были установлены статистически значимые отличия между
контрольными выборками и группами пациенток с осложнениями беременности по
некоторым SNPs гена LEP, что ещё раз подтверждает необходимость
дальнейших исследований этих генов, в качестве кандидатных при различных
нарушениях беременности.
3.2 Анализ ассоциаций изученных tagSNPs генов LEP и ACVR2A с развитием отдельных
клинических форм гестоза
В настоящей работе также был проведён сравнительный анализ
частот генотипов и аллелей полиморфизмов генов LEP и ACVR2A
междеу контрольными группами и группами пациенток с гестозом различной степени
тяжести в популяциях русских и якутов. Результаты приведены в таблицах 6 и 7.
Таблица 6. Распределение частот генотипов и аллелей по
исследованным полиморфизмам генов LEP и ACVR2A в популяции русских
|
Исследуемые
полиморфизмы (гены)
|
Гестоз тяжёлый N=86
|
Гестоз лёгкой и
средней степени тяжести N=74
|
Контроль N=160
|
|
Rs
2167270 (LEP)
|
Частоты
генотипов, %
|
AA
|
17,2
|
16,2
|
8,8
|
|
|
AG
|
46,0
|
26,5
|
35,6
|
|
|
GG
|
36,8
|
57,4
|
55,6
|
|
Частота аллеля, %
|
A
|
40,2
|
29,4
|
26,6
|
|
Уровень
значимости р для критерия χ^2 с поправкой Йейтса,*
|
Для генотипов
|
χ2=9,08 р=0,01
|
χ2=3,64 р=0,016
|
|
|
|
Для аллелей
|
χ2=9,87 p=0,002
|
χ2=0,39 p=0,53
|
|
|
Rs 2278815 (LEP)
|
Частоты
генотипов, %
|
AA
|
20,9
|
39,7
|
28,8
|
|
|
AG
|
51,2
|
39,7
|
48,1
|
|
|
GG
|
27,9
|
20,6
|
23,1
|
|
Частота аллеля, %
|
G
|
53,5
|
40,4
|
47,2
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=1,94
с поправкой Йейтса,*Для генотиповχ2=1,94
p=0,38χ2=2,67
|
p=0,26
|
|
|
|
|
|
|
|
Для
аллелей
|
χ2=1,78 p=0,18
|
χ2=1,75 p=0,12
|
|
|
Rs 11763517 (LEP)
|
Частоты генотипов, %
|
СС
|
29,9
|
19,7
|
17,0
|
|
|
CT
|
37,7
|
45,5
|
51,6
|
|
|
TT
|
32,5
|
34,8
|
31,4
|
|
Частота аллеля, %
|
T
|
51,3
|
57,6
|
57,2
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=6,22
с поправкой Йейтса,*Для генотиповχ2=6,22
p=0,004χ2=0,71
|
p=0,7
|
|
|
|
|
|
|
|
Для
аллелей
|
χ2=1,48 p=0,22
|
χ2=0,0 p=0,95
|
|
|
Rs
2071045 (LEP)
|
Частоты генотипов, %
|
СС
|
2,4
|
1,5
|
5,2
|
|
|
CT
|
37,6
|
32,4
|
35,1
|
|
|
TT
|
60,2
|
66,2
|
59,7
|
|
Частота аллеля, %
|
T
|
78,9
|
82,4
|
77,3
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=1,07
с поправкой Йейтса,*Для генотиповχ2=1,07
p=0,58χ2=2,03
|
p=0,36
|
|
|
|
|
|
|
|
Для
аллелей
|
χ2=0,17 p=0,68
|
χ2=1,46 p=0,23
|
|
|
Rs
3828942 (LEP)
|
AA
|
28,4
|
23,9
|
21,4
|
|
|
AG
|
49,4
|
70,1
|
50,3
|
|
|
GG
|
21,2
|
6,0
|
28,3
|
|
Частота аллеля,
%
|
G
|
45,9
|
41,0
|
53,5
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=2,57
с поправкой Йейтса,*Для генотиповχ2=2,57
p=0,28χ2=14,28
|
p=0,0008
|
|
|
|
|
|
|
|
Для аллелей
|
χ2=2,54 p=0,11
|
χ2=5,81 p=0,002
|
|
|
Rs
1014064 (ACVR2A)
|
Частоты
генотипов, %
|
AA
|
37,3
|
38,2
|
45,0
|
|
|
AG
|
47,0
|
42,6
|
41,6
|
|
|
GG
|
15,7
|
19,1
|
13,4
|
|
Частота аллеля,
%
|
G
|
39,2
|
40,4
|
34,2
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=1,27
с поправкой Йейтса,*Для генотиповχ2=1,27
p=0,53χ2=1,5
|
p=0,47
|
|
|
|
|
|
|
|
Для аллелей
|
χ2=1,12 p=0,29
|
χ2=1,56 p=0,21
|
|
|
Rs
17742342 (ACVR2A)
|
Частоты
генотипов, %
|
AA
|
59,8
|
75,0
|
75,0
|
|
|
AC
|
39,1
|
25,0
|
25,0
|
|
|
CC
|
1,1
|
0,0
|
0
|
|
Частота аллеля,
%
|
C
|
20,7
|
12,5
|
12,5
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=7,45
с поправкой Йейтса,*Для генотиповχ2=7,45
p=0,02χ2=0,0
|
p=1
|
|
|
|
|
|
|
|
Для аллелей
|
χ2=5,81 p=0,02
|
χ2=0,0 p=1
|
|
|
Rs
2161984 (ACVR2A)
|
Частоты
генотипов, %
|
AA
|
11,9
|
19,7
|
12,8
|
|
|
AG
|
48,8
|
37,9
|
41,6
|
|
|
GG
|
39,3
|
42,4
|
45,6
|
|
Частота аллеля,
%
|
A
|
36,3
|
38,6
|
33,6
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=1,16
с поправкой Йейтса,*Для генотиповχ2=1,16
p=0,56χ2=1,75
|
p=0,42
|
|
|
|
|
|
|
|
Для аллелей
|
χ2=0,36 p=0,55
|
χ2=1,04 p=0,31
|
|
|
Rs
10497025 (ACVR2A)
|
Частоты
генотипов, %
|
CC
|
50,0
|
53,0
|
57,2
|
|
|
CG
|
41,7
|
34,8
|
35,5
|
|
|
GG
|
8,3
|
12,1
|
7,2
|
|
Частота аллеля,
%
|
G
|
19,2
|
29,5
|
25,0
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=1,14=0,56χ2=1,41
с поправкой Йейтса,*Для генотиповχ2=1,14=0,56χ2=1,41
|
p=0,49
|
|
|
|
|
|
|
|
Для аллелей
|
χ2=0,96 p=0,33
|
χ2=0,98 p=0,32
|
|
Примечание: N - количество индивидов в группе. * - значение
критерия 2 с поправкой Йейтса и уровень значимости р получены при сравнении
частот аллелей или генотипов контрольной группы и группы больных гестозом.
Жирным шрифтом выделены статистически значимые различия (р<0,05).
Таблица 7. Распределение частот генотипов и аллелей по
исследованным полиморфизмам генов LEP и ACVR2A в популяции якутов
|
Исследуемые
полиморфизмы (гены)
|
Гестоз тяжёлый N=95
|
Гестоз лёгкой и
средней степени тяжести N=115
|
Контроль N=130
|
|
Rs
2167270 (LEP)
|
Частоты
генотипов, %
|
AA
|
6,2
|
10,8
|
10,8
|
|
|
AG
|
36,7
|
28,5
|
28,5
|
|
|
GG
|
57,2
|
60,7
|
60,8
|
|
Частота аллеля, %
|
A
|
24,5
|
28,0
|
25,5
|
|
Уровень
значимости р для критерия χ^2 с поправкой Йейтса,*
|
Для генотипов
|
χ2=0,02
р=0,9
|
χ2=7,33
р=0,03
|
|
|
|
Для аллелей
|
χ2=2,69
p=0,26
|
χ2=1,25
p=0,26
|
|
|
Rs 2278815 (LEP)
|
Частоты
генотипов, %
|
AA
|
38,9
|
48,3
|
55,7
|
|
|
AG
|
43,2
|
39,0
|
30,3
|
|
|
GG
|
17,9
|
12,7
|
13,9
|
|
Частота аллеля, %
|
G
|
39,5
|
32,2
|
29,1
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=6,09
с поправкой Йейтса,*Для генотиповχ2=6,09
p=0,05χ2=2,0
|
p=0,37
|
|
|
|
|
|
|
|
Для
аллелей
|
χ2=5,15
p=0,02
|
χ2=0,54
p=0,46
|
|
|
Rs 11763517 (LEP)
|
Частоты генотипов, %
|
СС
|
5,9
|
2,6
|
17,0
|
|
|
CT
|
18,8
|
25,9
|
51,6
|
|
|
TT
|
75,3
|
71,5
|
31,4
|
|
Частота аллеля, %
|
T
|
84,7
|
84,5
|
57,2
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=2,89
с поправкой Йейтса,*Для генотиповχ2=2,89
p=0,24χ2=0,01
|
p=0,99
|
|
|
|
|
|
|
|
Для
аллелей
|
χ2=0,0
p=0,99
|
χ2=0,0 p=0,95
|
|
|
Rs
2071045 (LEP)
|
Частоты генотипов, %
|
СС
|
44,8
|
39,3
|
5,2
|
|
|
CT
|
37,9
|
46,2
|
35,1
|
|
|
TT
|
17,2
|
14,5
|
59,7
|
|
Частота аллеля, %
|
T
|
36,2
|
37,6
|
77,3
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=3,62
с поправкой Йейтса,*Для генотиповχ2=3,62
p=0,16χ2=0,96
|
p= 0,62
|
|
|
|
|
|
|
|
Для
аллелей
|
χ2=1,21
p=0,27
|
χ2=1,46 p=0,23
|
|
|
Rs
3828942 (LEP)
|
Частоты генотипов, %
|
AA
|
57,3
|
56,9
|
21,4
|
|
|
AG
|
38,5
|
38,8
|
50,3
|
|
|
GG
|
4,2
|
4,3
|
28,3
|
|
Частота аллеля,
%
|
G
|
23,4
|
23,7
|
53,5
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=0,71
с поправкой Йейтса,*Для генотиповχ2=0,71
p=0,7χ2=0,83
|
p=0,66
|
|
|
|
|
|
|
|
Для аллелей
|
χ2=0,01
p=0,92
|
χ2=0,03
p=0,86
|
|
|
Rs
1014064 (ACVR2A)
|
Частоты
генотипов, %
|
AA
|
37,5
|
40,8
|
45,0
|
|
|
AG
|
50,0
|
48,3
|
41,6
|
|
|
GG
|
12,5
|
10,8
|
13,4
|
|
Частота аллеля,
%
|
G
|
37,0
|
35,0
|
34,2
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=0,14
с поправкой Йейтса,*Для генотиповχ2=0,14
p=0,93χ2=0,91
|
p=0,63
|
|
|
|
|
|
|
|
Для аллелей
|
χ2=0,1
p=0,75
|
χ2=0,84
p=0,36
|
|
|
Rs
17742342 (ACVR2A)
|
Частоты
генотипов, %
|
AA
|
90,3
|
93,3
|
75,0
|
|
|
AC
|
9,7
|
6,7
|
25,0
|
|
|
CC
|
0,0
|
0,0
|
0
|
|
Частота аллеля,
%
|
C
|
4,8
|
3,4
|
12,5
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=0,33
с поправкой Йейтса,*Для генотиповχ2=0,33
p=0,85χ2=2,04
|
p=0,36
|
|
|
|
|
|
|
|
Для аллелей
|
χ2=0,31 p=0,58
|
χ2=1,94 p=0,37
|
|
|
Rs
2161984 (ACVR2A)
|
Частоты
генотипов, %
|
AA
|
14,0
|
10,2
|
12,8
|
|
|
AG
|
47,3
|
46,6
|
41,6
|
|
|
GG
|
38,7
|
43,2
|
45,6
|
|
Частота аллеля,
%
|
A
|
37,6
|
33,5
|
33,6
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=0,28
с поправкой Йейтса,*Для генотиповχ2=0,28
p=0,87χ2=1,97
|
p=0,37
|
|
|
|
|
|
|
|
Для аллелей
|
χ2=0,17 p=0,68
|
χ2=1,88 p=0,17
|
|
|
Rs
10497025 (ACVR2A)
|
Частоты
генотипов, %
|
CC
|
88,0
|
84,5
|
57,2
|
|
|
CG
|
12,0
|
11,2
|
35,5
|
|
|
GG
|
0
|
4,3
|
7,2
|
|
Частота аллеля,
%
|
G
|
6,0
|
9,9
|
25,0
|
Уровень значимости р для критерия 
 с поправкой Йейтса,*Для генотиповχ2=1,59=0,45χ2=3,29
с поправкой Йейтса,*Для генотиповχ2=1,59=0,45χ2=3,29
|
p=0,19
|
|
|
|
|
|
|
|
Для аллелей
|
χ2=0,12 p=0,73
|
|
Примечание: N - количество индивидов в
группе. * - значение критерия 2 с поправкой Йейтса и уровень значимости р
получены при сравнении частот аллелей или генотипов контрольной группы и группы
больных гестозом. Жирным шрифтом выделены статистически значимые различия
(р<0,05)
При сравнительном анализе частот аллелей и
генотипов по изученным полиморфизмам генов LEP и ACVR2A между больными гестозом
разной степени тяжести и контрольной группы были установлены статистически
значимые отличия в популяции русских по полиморфизмам rs3828942, rs2167270 гена LEP (рис. 18, 19) и rs17742342 гена ACVR2A (рис. 20). Показано, что
носительство предкового аллеля G (OR=0,61; Cl: 0,40 - 0,91) и варианта GG (OR=0,16; Cl: 0,06 -
0,47) обладает протективным эффектом относительно гестоза лёгкой и средней
степени тяжести, а алель А (OR=2,17; Cl: 0,99 - 4,74) и генотип АА (OR=1,86; Cl: 1,26 - 2,75) rs2167270 (LEP), а так же аллель С (OR=5,57; Cl: 0,22 - 138,12) и
генотип СС (OR=1,83; Cl: 1,11 - 2,99) rs17742342 (ACVR2A) значительно повышают
риск развития гестоза тяжёлой формы.
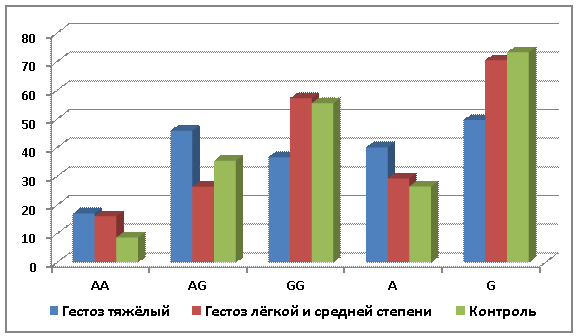
Рисунок 18. Распределение частот аллелей и генотипов rs3828942 (LEP) у пациенток с лёгкой и средней степени тяжести гестозом и у
женщин с физиологической беременностью из популяции русских.
Примечание: * отмечены статистически значимые отличия
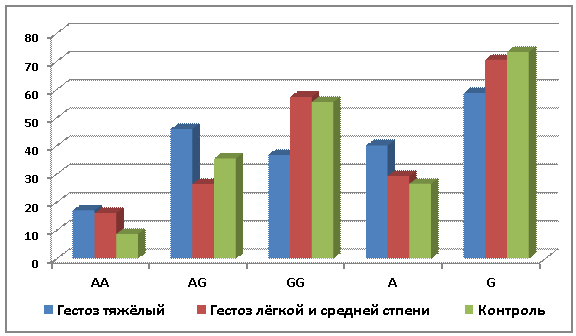
Рисунок 19. Распределение частот аллелей и генотипов rs2167270 (LEP) у пациенток с тяжёлой формой, лёгкой и средней степени тяжести
гестозом и у женщин с физиологической беременностью из популяции русских
Лептин циркулирует в крови в виде свободного гормона или в
связанном состоянии, в основном с экстрацеллюлярной частью растворимого
рецептора лептина (LEPR). Рецепторы лептина присутствуют не только в
гипоталамусе, но и в периферических органах и тканях (жировой печени, скелетной
мускулатуре, поджелудочной железе, яичниках, предстательной железе, плаценте,
почках, легких). Показано, что точечные мутации в гене рецептора к лептину
приводят к нарушению сплайсинга и блокируют экспрессию длинной формы рецептора
[148]. При такой мутации рецептора нарушается проведение гормонального сигнала.
Единичная точечная замена (полиморфизм Gln223Arg) гена LEPR приводит к
аминокислотной замене и, как следствие, к изменению функциональных особенностей
рецептора [122]. В работе J. Rigo и др. оценивали связь полиморфизма LEPR
Gln223Arg у женщин с диагнозом «преэклампсия» [122].
GWLS в семьях из Австралии, Новой Зеландии, и Исландии позволили
установить локус, отвечающий за развитие преэклампсии, на хромосоме 2q22-23 [112,
113, 68].Таким образом ACVR2A был описан как предпологаемый ген
кандидат. Также в нескольких исследованиях было установлено, что преэклампсия
связана с повышением уровня активина в сыворотке крови матери. Исходя из этих
данных было выдвинуто предположение, что дисбаланс экспрессии ACVR2A может влиять на концентрацию активина и следовательно на такие
процессы как инвазия трофобласта и ремодернизация спиральных артерий [88, 112,
113]. Дисбаланс экспрессии рецептора, а именно, снижение экспрессии ACVR2A может вызвать повышение урованя активина в сыворотке крови.
Гипотетически, именно этот механизм приводит к нарушению работы иммунной
системы, а следовательно к разбалансировке работы противовоспалительного
звена[133].
3.3 Анализ распределения частот гаплотипов генов LEP и ACVR2A в
исследованных группах
В настоящей работе был проведёнанализ совместного наследования
аллелей в гаплотипе в популяциях русских и якутов. В даннх популяциях было
обнаружено всего 5 гаплотипов гена LEP
(табл. 8), их количество было равным в обеих популяциях и 16 гаплотипов гена АСVR2A (табл. 9), наибольшее их количество наблюдалось в популяции
якутов. При анализе распределения гаплотипов гена LEP между пациенками с
гестозом и контрольной группой статистически значимых отличий не было выявлено
ни в популяции русских, ни в популяции якутов (рис. 21). Анализ распределения
гаплотипов гена АСVR2A между пациенками с гестозом и контрольной
группой, также не выявил статистически значимых отличий в изученных популяциях
(рис. 22).
Таблица 8. Распределение частот гаплотипов гена ACVR2A в исследованных группах
|
№
|
Гаплотипы ACVR2A
|
Частоты
гаплотипов в исследуемых группах (%)
|
|
|
Русские
|
Якуты
|
|
|
Контроль
|
Гестоз
|
Гестоз*
|
Гестоз**
|
Контроль
|
Гестоз
|
Гестоз*
|
Гестоз**
|
|
1
|
AAGC
|
53
|
45
|
48
|
44
|
55
|
58
|
59
|
58
|
|
2
|
GAAC
|
9
|
9
|
10
|
9
|
32
|
29
|
28
|
30
|
|
3
|
GAAG
|
25
|
28
|
29
|
27
|
7
|
5
|
7
|
5
|
|
4
|
ACGC
|
13
|
15
|
11
|
18
|
4
|
7
|
4
|
4
|
|
5
|
AAGG
|
0
|
0
|
0
|
0
|
0
|
1
|
3
|
1
|
Примечание: Жирным шрифтом выделены
мутантные аллели; * - Гестоз лёгкой и средней чтепени тяжести; ** - Тяжёлый
гестоз
Таблица 9. Рспределение частот гаплотипов
гена LEP в исследованных группах
|
№
|
Гаплотипы LEP
|
Частоты
гаплотипов в исследуемых группах (%)
|
|
|
Русские
|
Якуты
|
|
|
Контроль
|
Гестоз
|
Гестоз *
|
Гестоз**
|
Контроль
|
Гестоз
|
Гестоз *
|
Гестоз**
|
|
1
|
GATTA
|
26
|
28
|
34
|
22
|
18
|
11
|
14
|
19
|
|
2
|
AGCTG
|
24
|
20
|
20
|
22
|
6
|
7
|
4
|
3
|
|
3
|
GATCA
|
11
|
10
|
13
|
8
|
36
|
42
|
42
|
28
|
|
4
|
GGTTG
|
7
|
9
|
6
|
3
|
5
|
4
|
4
|
0
|
|
5
|
GGCTG
|
6
|
4
|
3
|
3
|
3
|
0
|
3
|
0
|
|
6
|
GACCG
|
5
|
5
|
4
|
5
|
3
|
2
|
2
|
0
|
|
7
|
GGTTA
|
4
|
4
|
0
|
7
|
0
|
0
|
2
|
0
|
|
8
|
GATTG
|
3
|
3
|
3
|
3
|
0
|
2
|
3
|
0
|
|
9
|
AGCTA
|
2
|
0
|
7
|
9
|
0
|
0
|
0
|
0
|
|
10
|
GGTCG
|
1
|
0
|
0
|
0
|
0
|
1
|
0
|
5
|
|
11
|
AGTTG
|
0
|
2
|
0
|
3
|
2
|
3
|
5
|
2
|
|
12
|
AATCA
|
0
|
0
|
0
|
0
|
7
|
3
|
2
|
5
|
|
13
|
GGTCA
|
0
|
0
|
0
|
0
|
6
|
7
|
4
|
12
|
|
14
|
AATTA
|
0
|
0
|
0
|
0
|
5
|
0
|
0
|
6
|
|
15
|
GGTTA
|
0
|
0
|
0
|
0
|
2
|
3
|
0
|
5
|
|
16
|
GGCCG
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
7
|
Примечание: Жирным шрифтом выделены
мутантные аллели; * - Гестоз лёгкой и средней чтепени тяжести; ** - Тяжёлый
гестоз
Кроме того, был проведён анализ
распределения частот гаплотипов между пациентками с гестозом различной степени
тяжести и контрольной группой в различных этнических выборках. Статистических
различий по гену ACVR2A не было показано ни для одной из изученных
популяций. Анализ частот гаплотипов гена LEP показал статистически
значимые отличия распределения между группой здоровых и пациенток с гестозом
лёгкой и средней степени только для популяции русских. Частота гаплотипа AGCTA была выше в группе
больных по сравнеию с данным показателем в группе здоровых (χ2=6,36; p=0,01; OR=3,59; Cl: 1,14 - 11,6). Также были установлены
статистически зачимые отличия между больными гестозом тяжёлой формы и
контрольной группой в популяции русских и якутов. Среди женщин, принадлежащих к
этнической группе русских, у больных было отмечено повышение частоты гаплотипа AGCTA (χ2=10,42; p=0,001; OR=4,48; Cl: 1,55 - 13,51). В
якутской популяции у пациенток с тяжёлой формой гестоза статистически значимо
повышены частоты гаплотипов GGTCA
(χ2=4,01; p=0,04; OR=2,08; Cl: 0,95 - 4,57) и GGCCG (χ2=15,52; p=0,00008; OR - не определён).
Полиморфизмы, которые возникли вследствие
мутаций, как правило, имеют определенную биологическую значимость относительно
приспособления к условиям окружающей среды и вследствие этого они распространились
путем природного отбора с частотой не менее 1% в пределах определенной
этнической или географической группы населения, которая характеризуется
отличными от других условиями существования и жизнедеятельности. Поскольку
однонуклеотидные полиморфизмы могут отвечать за наличие качественно новых
свойств организма, то частота их распространения будет отличаться между
различными этническими или географическими группами, соответственно
определенным условиям жизнедеятельности конкретной популяции.
Таким образом, получены доказательства
вовлеченности полиморфных вариантов гена LEP в молекулярные механизмы
развития гестоза как на уровне генотипов, так и на гаплотипическом уровне. Нами
показана ассоциация с гестозом трёх гаплотипов гена LEP: два из которых (GGTCA и GGCCG) значительно повышают
риск развития данной патологии в тяжёлой форме среди женщин, принадлежащих к
этнической группе якутов и один (AGCTA) повышает риск развития гестоза как лёгкой и
средней, так и тяжёлой формы гестоза у женщин из популяции русских. При анализе
частот гаплотипов гена ACVR2A не найдена ассоциация с
гестозом различной стпени тяжести во всех изученных группах.
Таким образом, полученные в настоящей
работе данные по изучению полиморфных вариантов генов LEP и ACVR2A
в популяциях русских, и якутов дополняют сведения о вариабельности этих генов и
могут служить основой для дальнейших исследований роли генов LEP и ACVR2A
в подверженности к гестозам и другим мультифакториальным состояниям.
Заключение
Гестоз относится к многофакторным состояниям. Поэтому можно
ожидать, что в его патогенезе принимают участие многие гены разных
метаболических путей. Патогенез гестоза предполагает участие в развитии болезни
нескольких систем (сосудистой, иммунной и др.). Также необходимо принять во внимание
влияние средовых факторов, весьма сложно поддающееся контролю. Несомненным
представляется то, что далеко не последнюю роль играют межэтнические различия.
Возможно, что в разных популяциях развитие гестоза определяется различными
генетическими маркерами.
Выявление аллелей генов, патологический эффект которых
реализуется при определённых неблагоприятных обстоятельствах, позволит
своевременно проводить профилактику заболевания, что является одной из задач
современной предиктивной медицины.
В результате проведённого исследования получена новая
информация в области физиологии генома человека. Проанализированы данные о
частотах встречаемости полиморфных вариантов генов LEP и ACVR2A в популяциях якутов и
русских. Охарактеризована специфика распределения частое гаплотипов генов LEP и ACVR2A в изученных популяциях в
контрольных выборках и в группах пациенток с гестозом различной степени
тяжести.
Показана ассоцияация полиморфизмов rs2167270 гена LEP и rs17742342 с тяжёлой формой
гестоза только в популяции русских. Найден протективный аллель (G) и генотип (GG) полиморфизма rs 8289412 гена LEP в отношении развитя
гестоза лёгкой и средней степени тяжести у русских. Также показаны гаплотипы
ассоциированные с развитием тяжёлой фрмы гестоза, у женщин из якутской популяции
(GGTCA и GGCCG) и гаплотипы,
ассоциированные с развитием как лёгкой и средней, так и тяжёлой степени гестоза
у русских женщин (AGCTA).
Сегодня уже известна целая гамма простых однонуклеотидных
полиморфизмов, связанных с определенными особенностями человека и влияющих на
состояние его здоровья. На изучении полиморфизмов простых нуклеотидов
основывается сегодня большинство коммерческих программ «генетического
паспорта». Однако, учитывая, что клиническая значимость большинства
полиморфизмов достоверно исследована только для определенной популяции, её
экстраполяция на другие группы требует основательного предварительного анализа
распространенности полиморфизма и его значимости при определенных условиях на
конкретной территории.
Выводы
1. При сравнительном анализе частот
аллелей и генотипов генов LEP и ACVR2A, были установлены
статистически значимые отличия в популяции русских по полиморфизму rs3828942 (LEP). В контрольной группе
отмечалось повышение частоты генотипа GG и аллеля G по сравнению с этими
показателями у пациенток с гестозом. Был сделан вывод, что аллель G и генотип GG имеют протективный
эффект. Также была обнаружена тенденция к ассоциации с гестозом полиморфизма rs2167270 гена LEP: было установлено
статистически значимое повышение частоты аллеля A и тенденция к ассоциации
с генотипом АА в группе больных, по сравнению с контрольной группой в русской
популяции. Статистически значимых ассоциаций генотипов и аллелей изученных
полиморфных вариантов генов LEP и ACVR2A с развитием гестоза в
якутской популяции не было установлено.
. Установлена ассоциация полиморфизмов
rs2167270 гена LEP и rs1774234 гена ACVR2A с развитием гестоза
тяжёлой степени в русской популяции. Также выявлен протективный эффект генотипа
GG и аллеля G полиморфизма rs3828942 гена LEP в отношении развития
гестоза лёгкой и средней степени тяжести в популяции русских. Ассоциаций
полиморфизмов генов LEP и ACVR2A с развитием гестоза
различной степени тяжести в якутской популяции не выявлено.
. Анализ распределения частот
гаплотипов генов LEP и ACVR2A между пациентками с
гестозом и контрольными группами, показал статистически значимую ассоциацию
гаплотипа AGCTA гена LEP с развитием как лёгкой и
средней, так и тяжёлой степени гестоза у русских женщин. Также в ходе данной
работы удалось установить ассоциацию гаплотипов GGTCA и GGCCG гена LEP с развитием тяжёлой формы
гестоза у женщин из популяции якутов. Статистически значимых отличий в
распределении гаплотипов гена ACVR2A между группами больных и
здоровых женщин в исследованных популяциях не установлено.
Список использованной
литературы
1. Абрамченко В.В. Теория гипокалыдаурии и оксидативного
стресса в возникновении гестоза и его профилактики препаратами кальция //
Проблемы репродукции, - 2002. Т.8. - №4. - С. 13-15.
. Абрамченко В.В. Фармакотерапия гестоза. Руководство
для врачей: СПб. СпецЛит. - 2005.-256 с.
. Айламазян Э.К., Тарасова М.А. Иммунологические методы
прогнозирования и диагностики позднего токсикоза беременных // Акушерство и
гинекология. - 2002. - №6. С. 39-41.
. Айламазян Э.К. К вопросу о маркерах повреждения
сосудистой стенки при позднем гестозе // Журнал акушерства и женских болезней.
1998. №1. С. 19-23.
. Акушерство / Под ред. Г.М. Савельевой. - М.:
Медицина, 2000. - С. 816.
. Анализ генома. Методы / Под ред. К. Дейвиса. - М.: Мир,
1990. - 243 с.
. Ахмедова Е.М. Гипергомоцистеинемия у беременных с
гестозом: автореф. дис. к.м.н. Москва. - 2003. - 26 с.
. Бакулев А.В. Эффективность дифференцированной терапии
артериальных гипертензий у беременных женщин с гестозом в зависимости от типов
гемодинамики: автореф. дис. к.м.н. - Екатеринбург. - 2004. 26 с.
. Балковая Л.Б. Эндотелиальная дисфункция при
хронической сердечной недостаточности // Медицина сегодня и завтра. - 1999. -
№1. - С. 31-37.
. Бачурина Т.И. Роль системы гемостаза в механизме
формирования плацентарной недостаточности при гестозе. - Новосибирск, 2002. -
27 с.
. Бобряшова Э.В. Использование препаратов магния и
малых доз аспирина при индивидуальном выборе профилактических мероприятий у
беременных группы высокого риска реализации гестоза: автореф. дис. к. м. н.
Самара - 2001. - 24 с.
12. Бочков
Н.П. Клиническая генетика. Учебник. 3-е изд. - М.: ГЭОТАР-МЕД, 2004. - 480 с.
13. Бурлев В.А. Ангиогенез и ангиогенные факторы роста в
регуляции репродуктивной системы у женщин / В.А. Бурлев, С.В. Павлович //
Пробл. репродукции. - 1999- №5 - С. 6-14.
. Бурлев В.А. Клинико-диагностическое значение фактора
роста плаценты у беременных с хронической плацентарной недостаточностью / В.А.
Бурлев, З.С. Зайдиева, B.JI. Тютюнник // Пробл. репродукции-2001.- №5. - С.
31-34.
. М. Валленберг X. С. Профилактика преэклампсии //
Акушерство и гинекология. 1998. - №5. С. 52-54.
. Василенко JI.B. Доклиническая диагностика и лечение
гестоза // Проблемы беременности. 2000. - №1. С. 26-30.
. Гланц С. Медико-биологическая статистика. Москва. -
Практика. -1998. - 459 с.
. Глик Б., Пастернак Дж. Молекулярная биотехнология.
Принципы и применение. Пер. с англ. - М.: Мир, 2002. - 589 с
. Городничева Ж.А. Особенности течения гестоза у
беременных с патологическим уровнем антител к мембранным фосфолипидам: автореф.
дис. к.м.н. Москва. - 1997. -22 с.
. Григорян Г.А. Прогнозирование возникновения гестозов
и синдрома задержки развития плода во втором триместре беременности методом
допплерометрии: диссертацияк. м.н. Москва. - 1992. - 182 с.
. Гущин, И.В. Гомеостаз при гестозе и способы коррекции
его измений (Экспериментальное иследование): Автореф. дис…. докт. мед. наук /
И.В. Гущин. - Москва, 1998. - 28 с.
. Двидян Л.Ю., Маланина Е.Н., Патогенетическое значение
факторов роста в развитии гестоза // Акушерство и гинекология. 2009. №1. - С.
52-54.
. Избранные лекции по акушерству и гинекологии / Под
ред. А.Н. Стрижакова. - Ростов н /Д: Феникс, 2000. - 512 с.
24. Иванов
В.И. 2005. Геномика - медицине [под ред. В.И. Иванова и Л.Л. Киселева]. М.:
Академкнига;, 392 с.
25. Карпенко JI.B., Егорова А.Т., Филиппов О.С.
Антифосфолипидные антитела при гестозе // Акушерство и гинекология. - 2006. №1.
- С. 44-46.
. Каюпова, Г.Ф. Течение и исход беременности у юных
женщин с гестозом: автореф. дис. к.м.н. Уфа. - 2003. - 22 с.
. Клинические лекции по акушерству и гинекологии / Под
ред. А.Н. Стрижакова, А.И. Давыдова, Л.Д. Белоцерковской - М.: Медицина, 2000.
- С. 34-48.
. Колесников А.Д. Параметры липопероксидации в
конденсате выдыхаемого воздуха как критерии прогноза развития гестоза: автореф.
дис. к.м.н. Иркутск. - 2000. -25 с.
. Коломоец Н.М. Эндотелиальная дисфункция и ее
клиническое значение // Военно-медицинский журнал. №5 - 2001.С 29-34.
. Кондратьева О.А. Клинико-лабораторная оценка динамики
иммунологических показателей при различных вариантах течения гестоза: автореф.
дис. к.м.н. Саратов - 2003. - 24 с.
. Корячкин В.А., Страшнов В.И. Анестезия и интенсивная
терапия. - Санкт - Петербургское мед. Издательство. 2004. - 465 с.
. Криворучко А.Ю. Роль системы плацентарных цитокинов в
патогенезе позднего гестоза: автореф. дис. к.м.н. СПб. - 2001. - 21 с.
. Кузнецова, О.В. Клинико-функцнональные характеристики
беременных с поздним гестозом средней и тяжелой степени: автореф. дис..к.м.н.
Омск. - 2002. -20 с.
. Кустаров В.Н. Гестоз Патогенез, симптоматика,
лечение. СПб. - Гиппократ. -2000. - 159 с.
. Макаров И.О. Функциональное состояние системы мать
плацента-плод при гестозе: автореф. дис..д.м.н. - Москва. - 1998. -48 с.
. Маркелова Н.Б. Изменения клеточного иммунитета при
гестозах беременных и их коррекция: дис..к.м.н. Астрахань. - 2004. - 138 с.
. Методические рекомендации «Базовые принципы
проведения анестезии и интенсивной терапии у беременных с гестозом». Москва. -
2005 г. Кулаков В.И. Серов В.Н. Шифман Е.М. и др.
. Милованов А.П. Патология системы Мать-плацента-плод.
Москва. - Медицина. - 1999. - 406 с.
. Милованов А.П. Патологоанатомический анализ причин
материнских смертей // Архив патологии. Приложение. 2003. - М.: Медицина. - 76
с.
. Минкевич К.В. Сравнительная оценка эффективности
различных методов магнезиальной терапии в комплексном лечении позднего
токсикоза беременных: дис. канд..к.м.н. - СПб. -1996. - 181 с.
. Павлов О.Г. Генетические аспекты гестозов (история и
состояние проблемы) // Акушерство и гинекология. 2005. - №3. - С. 8-10.
. Патсаев Т.А. Содержание сосудисто-эндотелиального
фактора роста в динамике беременности, осложненной преэклампсией // Журнал
акушерства и женских болезней. 2005. - Т. 54, №3. - С. 67-69.
. Радзинский В.Е. Некоторые аспекты патогенеза гестоза
и задержки ростаплода / В.Е. Радзинский, А.В. Иткес, Т.В. Галина и др. // Мать
и дитя: материалы 7-го форума. М., 2005 - С. 217-218.
. Ребриков Д.В., Саматов Г.А., Трофимов Д.Ю., Семёнов
П.А., Савилова А.М., Кофиади И.А., Абрамов Д.Д. ПЦР «в реальном времени» изд-во
М.: БИНОМ. Лаборатория знаний 2009, 233 С.
. Репина М.А. Преэклампсия и материнская смертность //
СПб. 2005 г.
. Рец Ю.В. Материнско-плодовые корреляции гемодинамики
при гестозе, возможности их коррекции в профилактике акушерских и перинатальных
осложнений: автореф. дис. к.м.н. Томск. - 2004. - 19 с.
. Савельева Г.М. Не11 р-синдром // Вестн. Рос. ассоц.
акушеров-гинекологов. 1997. - №2. С. 33-37.
. Свечников П.Д. Маркеры повреждения эндотелия при
беременности, осложненной гестозом: автореф. дис..к.м.н. СПб. - 2000. -23 с.
. Смирнова Ж.Д. Клиническое значение определения
нарушений в системе Протеина С у беременных с гестозами: автореф. дис..к.м.н. -
Москва. -2005.-24 с.
. Соловьева А.В. Коррекция нарушений тромбоцитарного
звена гемостаза витаминами-антиоксидантами и аспирином у беременных с поздним
гестозом: дис..к.м; н. Тюмень. - 1999. - 106 с.
. Стрижаков А.Н. Влияние плацентарных белков на
иммунорегуляторные клетки у женщин с нормально протекающей и осложненной гестозом
беременностью // Акушерство и гинекология. -1998. №5. С. 26-28.
. Стрижаков А.Н. Нарушения материнской и плодовой
гемодинамики в патогенезе гестоза // Вестник РААГ. 2001. - №8. С. 43-48.
. Филимончикова, И Д. Новые подходы к ранней
диагностике и ' профилактике гестоза // Акушерство и гинекология. 2005, - №1. -
С. 46.48.
. Храмушина Е.А. Клеточно-молекулярные критерии
диагностики, гестоза: автореф. дис…к.м! н. Омск. -, 2000. - 24 с.
. Чистякова Г.Н. К вопросу о поиске иммунологических
критериев развития гестоза / Г.Н. Чистякова, И.А. Газиева // Пробл. репродукции
2006 - №2. - С. 75.
. Шифман, Е.М. Клинико-физиологическое
обоснованиеинтенсивной терапии преэклампсии: автореф. дис. д-ра мед. Наук. 1.
Москва. - 2001. -46 с.
. Шифман Е.М. Преэклампсия, эклампсия, HELLP-синдром. -
Петрозаводск: Изд-во «ИнтелТек», 2003. -432 с.
. Шляхова И.Ю. Прогнозирование и профилактика развития
гестоза у беременных с сердечно-сосудистой патологией: автореф. дис..к.м.н.
Волгоград. - 2004. - 20 с.
. Щелкунов С.Н. Генетическая инженерия - Новосибирск:
Сиб. унив. изд-во, 2004. - 496 с.
. Эпидемиологические аспекты ОПГ-гестозов / С.С.
Дёгтева // Современные проблемы фундаментальной и клинической медицины /
СибГМУ. - Томск, 1999. - С. 109-110.
. Филимончикова, И.Д. Новые подходы к ранней
диагностике и профилактике гестоза / И.Д. Филимончикова, Г.В. Чижова //
Акушерство и гинекология. -2005. - №1. - С. 46-48.
62.
Бочков Н.П. Клиническая генетика. Учебник. 3-е изд. - М.: ГЭОТАР-МЕД, 2004. -
480 с.
. Иванов
В.И. 2005. Геномика - медицине [под ред. В.И. Иванова и Л.Л. Киселева]. М.:
Академкнига;, 392 с.
. Юдина
Е.В. Допплерография в акушерстве: итоги Российского мультицентрового
исследования // Пренатальная диагностика. 2003.1. Т.2, №3. С. 206-214.
. Юрченко
Т.В. Современные подходы к прогнозированию течения и оценке тяжести позднего
гестоза: автореф. дис..к.м.н. - Воронеж. 2005. - 20 с.
. Юсеф
В.Ж. Подходы к профилактике и терапии нарушений маточного кровообращения у
женщин с лёгкими формами позднего гестоза: автореф. дис..к.м.н. Ростов. - 2003.
- 21 с.
67. Altshuler D., Daly M.J., Lander E.S. Genetic Mapping in
Human Disease // Science. 2008. V. 322. P. 881-888.
68. Arngrímsson R,
Siguróaróóttir S, Frigge ML, Bjarnaóóttir
RI, Jónsson T, Stefánsson H, Baldursdóttir Á,
Einarsdóttir AS, Palsson B, Snorradôttir S, Lachmeijer AMA,
Nicolae D, Kong A, Bragason BT, Gulcher JR, Geirsson RT, Stefánsson K: A
Genome-Wide Scan Reveals a Maternal Susceptibility Locus for Pre-Eclampsia on
Chromosome 2p13. Hum Mol Genet 1999, 8 (9):1799-1805.]
69. Aggarwal PK, Jain V, Srinivasan R, Jha V. J
Hypertens. 2009 Oct; 27 (10):2044-50. Maternal EDN1 G5665T polymorphism
influences circulating endothelin-1 levels and plays a role in determination of
preeclampsia phenotype.
. Atis et al. Vascular endothelial growth
factor gene +813CC polymorphism of foetus is associated with preterm labour but
not with pre-eclampsia in Turkish pregnant women. Int J Immunogenet. 2012 Jan
18.
. Barden AE, Herbison CE, Beilin LJ,
Michael CA, Walters BN, Van Bockxmeer FMAssociation between the endothelin-1
gene Lys198Asn polymorphism blood pressure and plasma endothelin-1 levels in
normal and pre-eclamptic pregnancy. J Hypertens. 2001 Oct; 19 (10):1775-82.
. Barrett, J.C., et al. 2005 Haploview:
analysis and visualization of LD and haplotype maps. Bioinformatics 21263-265.
. Bienertová-Vasků J, Dostálová Z,
Kanková K, Bienert P, Vasků A, Unzeitig V. Is there any link
between severe pre-eclampsia and defined polymorphisms in leptin and
adiponectin genes? J Obstet Gynaecol Res. 2008 Oct; 34 (5):858-64.
. Bombell S, McGuire W. Cytokine
polymorphisms in women with recurrent pregnancy loss: meta-analysis. Aust N Z J
Obstet Gynaecol. 2008 V. 48 (2):147-54.
75. Bondestam
J, Horelli-Kuitunen N, Hildén K, Ritvos O, Aaltonen J: Assignment of
ACVR2 and ACVR2B the human activin receptor type II and IIB genes to
chromosome bands 2q22.2-q23.3 and 3p22 and the human follistatin gene (FST) to
chromosome 5q11.2 by FISH. Cytogenet Cell Genet 1999, 87 (3-4):219-220.
76. Breit
S, Ashman K, Wilting J, Rössler J, Hatzi E, Fotsis T, Schweigerer L: The
N-myc oncogene in human neuroblastoma cells: down-regulation of an
angiogenesis inhibitor identified as activin A. Cancer Res 2000, 60
(16):4596-4601.
77. Canto
P, Canto-Cetina T, Juárez-Velázquez R, Rosas-Vargas H,
Rangel-Villalobos H, Canizales-Quinteros S, Velázquez-Wong AC,
Villarreal-Molina MT, Fernández G, Coral-Vázquez R.
Methylenetetrahydrofolate reductase C677T and glutathione S-transferase P1
A313G are associated with a reduced risk of preeclampsia in Maya-Mestizo women.
Hypertens Res. 2008 May; 31 (5):1015-9.
. Chen et al. Angiotensin converting enzyme
insertion/deletion polymorphism and risk of pregnancy hypertensive disorders: a
meta-analysis. Journal of Renin-Angiotensin-Aldosterone System. 2011.
. Chen et al. Endothelial Nitric Oxide
Synthase Gene Polymorphisms (G894T, 4b/a and T-786C) and Preeclampsia:
Meta-Analysis of 18 Case-Control Studies. DNA Cell Biol. 2011.
. Choi KC, Kang SK, Nathwani PS, Cheng KW,
Auersperg N, Leung PC. Differential expression of activin/inhibin subunit and
activin receptor mRNAs in normal and neoplastic ovarian surface epithelium
(OSE). Mol Cell Endocrinol. 2001 Mar 28; 174 (1-2):99-110.
. Daher et al. Associations between
cytokine gene polymorphisms and recurrent pregnancy loss. J Reprod Immunol.
2003 Feb; 58 (1):69-77.
. Daher et al. Cytokine genotyping in
preeclampsia. Am J Reprod Immunol. 2006 Feb; 55 (2):130-5.
. Deacu E, Mori Y, Sato F, Yin J, Olaru A,
Sterian A, Xu Y, Wang S, Schulmann K, Berki A, Kan T, Abraham JM, Meltzer
SJActivin type II receptor restoration in ACVR2-deficient colon cancer cells
induces transforming growth factor-beta response pathway genes. Cancer Res.
2004 Nov 1; 64 (21):7690-6.
. Di Nisio et al. Thrombophilia and
outcomes of assisted reproduction technologies: a systematic review and
meta-analysis. Blood. 2011.
. Dudding TE, Attia J. The association
between adverse pregnancy outcomes and maternal factor V Leiden genotype: a
meta-analysis. Thromb Haemost. 2004 V. 91 (4):700-11.
. Evans D.M., Cardon L.R. 2004. Guidelines
for genotyping in genomewide linkage studies: single-nucleotide-polymorphism
maps versus microsatellite maps. Am. J. Hum. Genet. 75 (4), 687-692.
. Fitzpatrick E, Johnson MP, Dyer TD,
Forrest S, Elliott K, Blangero J, Brennecke SP, Moses EK. Genetic association
of the activin A receptor gene (ACVR2A) and pre-eclampsia. Mol Hum Reprod. 2009
Mar; 15 (3):195-204. Epub 2009 Jan 6.
. Florio P, Gabbanini M, Borges LE,
Bonaccorsi L, Pinzauti S, Reis FM, Boy Torres P, Rago G, Litta P, Petraglia F:
Reviews: activins and related proteins in the establishment of pregnancy.
Reprod Sci 2010, 17 (4):320-330.
. Fraser RF, 2nd, McAsey ME, Coney P (1998)
Inhibin-A and pro-alpha C are elevated in preeclamptic pregnancy and correlate
with human chorionic gonadotropin. Am J Reprod Immunol 40 (1): 37-42.
. Gabriel S.B., Schaffner S.F., Nguyen H.
et al. The structure of haplotype blocks in the human genome // Science. 2002.
V. 296. P. 2225-2229.
. Greene CS, Penrod NM, Williams SM, Moore
JH (2009) Failure to replicate a
. genetic association may provide important
clues about genetic architecture. PLoS One 4 (6): e5639.
. Guan et al. [Association of leptin level
and leptin receptor gene polymorphisms with susceptibility to severe pre-eclampsia.
Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 2011 Oct; 28 (5):562-7.
. Guttmacher, Alan E.; Manolio, Teri A.
(July 2010). «Genomewide association studies and assessment of the risk of
disease». N. Engl. J. Med. 363 (2): 166-76.
. Hempen PM, Zhang L, Bansal RK,
Iacobuzio-Donahue CA, Murphy KM, Maitra A, Vogelstein B, Whitehead RH,
Markowitz SD, Willson JK, Yeo CJ, Hruban RH, Kern SE. Evidence of selection for
clones having genetic inactivation of the activin A type II receptor (ACVR2)
gene in gastrointestinal cancers. Cancer Res. 2003 Mar 1; 63 (5):994-9.
97. Hoegh
AM, Borup R, Nielsen FC, Sørensen S, Hviid TVF: Gene Expression Profiling of
Placentas Affected by Pre-Eclampsia. J Biomed Biotechnol 2010, 2010:11, Article
ID 787545.
. John S., Shephard N., Liu G. et al. 2004.
Whole-genome scan, in a complex disease, using 11,245 single-nucleotide
polymorphisms: comparison with microsatellites. Am. J. Hum. Genet. 75 (1),
54-64.
. Jones RL, Stoikos C, Findlay JK,
Salamonsen LA: TGF - {beta} superfamily expression and actions in the
endometrium and placenta. Reproduction 2006, 132 (2):217-232.5.
. Johnson MP, Roten LT, Dyer TD, East CE,
Forsmo S, et al. (2009) The ERAP2 gene is associated with preeclampsia
in Australian and Norwegian populations. Hum Genet 126 (5): 655-666.
. Jung B, Doctolero RT, Tajima A, Nguyen
AK, Keku T, Sandler RS, Carethers JM. Loss of activin receptor type 2 protein
expression in microsatellite unstable colon cancers. Gastroenterology. 2004
Mar; 126 (3):654-9.
. Kamal M, El-Khayat W. Do serum
angiopoietin-1, angiopoietin-2, and their receptor Tie-2 and 4G/5G variant of
PAI-1 gene have a role in the pathogenesis of preeclampsia? J Investig Med.
2011 Oct; 59 (7):1147-50.
. Kim SY, Lim JH, Park SY, Yang JH, Kim MY,
Kim MH, Ryu HM. Am J Reprod Immunol. 2010 Apr 1; 63 (4):291-8. Epub 2009 Dec
31. Transforming growth factor-beta 1 gene polymorphisms in Korean patients
with pre-eclampsia.
. Kosmas et al. Association of C677T
polymorphism in the methylenetetrahydrofolate reductase gene with hypertension
in pregnancy and pre-eclampsia: a meta-analysis. J Hypertens. 2004 V. 22 (9).
P. 1655-62.
. Larsen MH, Hylenius S, Andersen AM, Hviid
TV. The 3'-untranslated region of the HLA-G gene in relation to pre-eclampsia:
revisited. Tissue Antigens. 2010 Mar; 75 (3):253-61. Epub 2010 Jan 12
106. Liu J,
Heikkilä P, Kahri AI, Voutilainen R. Expression of activin A
and its receptors in human pheochromocytomas. J Endocrinol. 2000 May; 165
(2):503-8
. Lokki AI, Klemetti MM, Heino S, Hiltunen
L, Heinonen S, Laivuori H. Association of the rs1424954 polymorphism of the
ACVR2A gene with the risk of pre-eclampsia is not replicated in a Finnish study
population. J. BMC Res Notes 2011 Dec 19; 4:545
. Matthew P. Johnson, Shaun P. Brennecke
Christine E. East, Harald H.H.
Göring, Jack W. Kent Jr, Thomas D. Dyer, Joanne M. Said, Linda T. Roten,
Ann-Charlotte Iversen, Lawrence J. Abraham, Seppo Heinonen, Eero Kajantie, Juha
Kere, Katja Kivinen, Anneli Pouta, Hannele Laivuori, for the FINNPEC
Study Group, Rigmor Austgulen, John Blangero, Eric K. Moses: Genome-Wide
Association Scan Identifies a Risk Locus for Preeclampsia on 2q14, Near the
Inhibin, Beta B Gene. PLoS One 2012, 7 (3), Article ID e33666.
. Medica et al. Genetic polymorphisms in
vasoactive genes and preeclampsia: a meta-analysis. Eur J Obstet Gynecol Reprod
Biol. 2007. V. 131 (2):115-26
. Molvarec et al. Association between tumor
necrosis factor (TNF) - alpha G-308A gene polymorphism and preeclampsia complicated
by severe fetal growth restriction. Clin Chim Acta. 2008 Jun; 392 (1-2):52-7
. Montague CT et al. Congenital leptin
deficiency is associated with severe early-onset obesity in humans. Nature
(1997 Jun 26) 387 (6636):903-8.
. Moses EK, Fitzpatrick E, Freed KA, Dyer
TD, Forrest S, Elliott K, Johnson MP, Blangero J, Brennecke SP: Objective
prioritization of positional candidate genes at a quantitative trait locus for
pre-eclampsia on 2q22. Mol Hum Reprod 2006, 12 (8):505-512.
. Moses EK, Lade JA, Guo GL, Wilton AN,
Grehan M, Freed K, Borg A, Terwilliger JD, North R, Cooper DW, Brennecke SP: A
genome scan infamilies from Australia and New Zealand confirms the presence of
a maternal susceptibility locus for pre-eclampsia, on chromosome 2. Am J Hum
Genet 2000, 67 (6):1581-1585
. Mouzat et al. A common polymorphism in
NR1H2 (LXRbeta) is associated with preeclampsia. BMC Med Genet. 2011 Oct 26;
12:145. doi: 10.1186/1471-2350-12-145.
115. Muravská
A et al. Association of pregnancy-associated plasma protein A polymorphism with
preeclampsia - a pilot study. Clin Biochem. 2011 Dec; 44 (17-18):1380-4.
. Muttukrishna S, Knight PG, Groome NP,
Redman CW, Ledger WL (1997) Activin A and inhibin A as possible endocrine
markers for pre-eclampsia. Lancet 349 (9061): 1285-8.
. Nagy B, Varkonyi T, Molvarec A, Lazar L,
Hupuczi P, Than NG, Rigo J. Leptin gene (TTTC) (n) microsatellite polymorphism
in pre-eclampsia and HELLP syndrome. Clin Chem Lab Med. 2009; 47 (9):1033-7.
. NCI-NHGRI Working Group on Replication in
Association Studies, Chanock SJ, Manolio T, Boehnke M, Boerwinkle E, et al.
(2007) Replicating genotype-phenotype associations. Nature 447 (7145): 655-660.
. Palei AC, Sandrim VC, Amaral LM, Machado
JS, Cavalli RC, Lacchini R, Duarte G, Tanus-Santos JE. [Epub ahead of print]
Matrix metalloproteinase-9 polymorphisms affect plasma MMP-9 levels and
antihypertensive therapy responsiveness in hypertensive disorders of pregnancy.
Pharmacogenomics J. 2011 Jul 19. doi: 10.1038/tpj.2011.31.
. Panoutsopoulou K., Zeggini E. 2009.
Finding common susceptibility variants for complex disease: past, present and
future. Brief Funct Genomic Proteo-mic., elp020.
. Pearson TA, Manolio TA (March 2008). «How
to interpret a genome-wide association study». JAMA 299 (11): 1335-44.
. Peng C, Huang T, Jeung E, Donaldson C,
Vale W, Leung P: Expression of the type II activin receptor gene in the human
placenta. Endocrinology 1993, 133 (6):3046-3049.
. Petraglia F, Aguzzoli L, Gallinelli A,
Florio P, Zonca M, et al. (1995) Hypertension in pregnancy: Changes in activin
A maternal serum concentration. Placenta 16 (5): 447-54.
. Phillips DJ, de Kretser DM, Hedger MP:
Activin and related proteins in inflammation: not just interested bystanders.
Cytokine Growth Factor Rev 2009, 20 (2):153-164.
. Redman CW, Sargent IL. Placental stress
and pre-eclampsia: A revised view. Placenta. 2009; 38-42.
. Roberts JM, Hubel CA. The two stage model
of preeclampsia: Variations on the theme. Placenta.2009; 32-7.
. Rodger et al. The association of factor V
leiden and prothrombin gene mutation and placenta-mediated pregnancy
complications: a systematic review and meta-analysis of prospective cohort
studies. PLoS Med. 2010 Jun 15; 7 (6):e1000292.
. Roten LT, Johnson MP, Forsmo S,
Fitzpatrick E, Dyer TD, et al. (2009) Association between the candidate
susceptibility gene ACVR2A on chromosome 2q22 and pre-eclampsia in a large
Norwegian population-based study (the HUNT study). Eur J Hum Genet 17 (2):
250-257.
. Salimi et al. Association of
angiotensin-converting enzyme intron 16 insertion/deletion and angiotensin II
type 1 receptor A1166C gene polymorphisms with preeclampsia in South East of
Iran. J Biomed Biotechnol. 2011; 2011:941515. Epub 2011 Jul 26.
. Schneider-Kolsky ME, Manuelpillai U,
Waldron K, Dole A, Wallace EM: The distribution of activin and activin
receptors in gestational tissues across human pregnancy and during labour.
Placenta 2002, 23 (4):294-302.
. Shim JY, Jun JK, Jung BK, Kim SH, Won HS,
Lee PR, Kim A. Vascular endothelial growth factor gene +936 C/T polymorphism is
associated with preeclampsia in Korean women. Am J Obstet Gynecol. 2007 Sep;
197 (3):271.e1-4.
. Shriner D, Vaughan LK, Padilla MA, Tiwari
HK (2007) Problems with genome-wide association studies. Science 316 (5833):
1840-1842.
.
134. Smith
C, Yndestad A, Halvorsen B, Ueland T, Wæhre T, Otterdal K, Scholz H,
Endresen K, Gullestad L, Froland SS, Damås JK, Aukrust P: Potential
anti-inflammatory role of activin A in acute coronary syndromes. J Am Coll
Cardiol 2004, 44 (2):369-375
. Sugathadasa BH, Tennekoon KH,
Karunanayake EH, Kumarasiri JM, Wijesundere AP. Association of -2548 G/A
polymorphism in the leptin gene with preeclampsia/pregnancy-induced
hypertension. Hypertens Pregnancy. 2010; 29 (4):366-74.
. Tang X, Guruju M, Rajendran GP, Isler CM,
Martin JN Jr, Kumar A. Hypertens Pregnancy. 2006; 25 (2):93-101. Role of C825T
polymorphism of GNbeta3 gene in preeclampsia.
. The International HapMap Consortium. The
International HapMap Project // Nature. 2003. V. 426. P. 789-796.
. Thomson G. 1995. Analysis of complex
human genetic traits: an ordered-notation method and new tests for mode of
inheritance. Am J Hum Genet. 57 (2), 474-86.
139. Vaskú
JA, Vaskú A, Dostálová Z, Bienert P. Association of leptin
genetic polymorphism -2548 G/A with gestational diabetes mellitus. Genes Nutr.
2006 Jun; 1 (2):117-23
. Vural P, Degirmencioglu S, Saral NY,
Demirkan A, Akgul C, Yildirim G, Issever H, Eroglu H. Tumor necrosis factor
alpha, interleukin-6 and interleukin-10 polymorphisms in preeclampsia. J Obstet
Gynaecol Res. 2010 Feb; 36 (1):64-71.
. Wall J.D., Pritchard J.K. Haplotype
blocks and linkage disequilibrium in the human genome // Nature Rev. Genet.
2003. V. 4. P. 587-597.
. Wang A, Rana S, Karumanchi SA (2009)
Preeclampsia: The role of angiogenic factors in its pathogenesis. Physiology
(Bethesda) 24: 147-158.
. Wiedemann A, Vocke F, Fitzgerald JS,
Markert UR, Jeschke U, Lohse P, Toth B. Leptin gene (TTTC) (n) microsatellite
polymorphism as well as leptin receptor R223Q and PPARgamma2 P12A substitutions
are not associated with hypertensive disorders in pregnancy. Am J Reprod
Immunol. 2010 Apr 1; 63 (4):310-7. Epub 2010 Jan 12.
. Wiwanitkit V. Correlation between
plasminogen activator inhibitor-1 4G/5G polymorphism and pre-eclampsia: an
appraisal. Arch Gynecol Obstet. 2006. V. 273 (6). P. 322-324.
. Wu et al. Screening for thrombophilia in
high-risk situations: systematic review and cost-effectiveness analysis. The
Thrombosis: Risk and Economic Assessment of Thrombophilia Screening (TREATS)
study. Health Technol Assess. 2006. V. 10 (11). P.101-110.
. Zafarmand et al. The angiotensinogen gene
M235T polymorphism and development of preeclampsia/eclampsia: a meta-analysis
and meta-regression of observational studies. J. Hypertens. 2008 Sep; 26 (9):1726-34.
. Zhang Z, Wang JY, Zhang LL, Guo S, Jia
LT, Li H, Li J, Ju J, Rong SH. Human leukocyte antigen-G 14 bp deletion
polymorphism in severe pre-eclampsia. 2010 May; 45 (5):348-52.
. Zusterzeel et al.
Methylenetetrahydrofolate reductase polymorphisms in preeclampsia and the HELLP
syndrome. Hypertens Pregnancy. 2000; 19 (3):299-307.
. The GeneCards Human [Electronic resource]
// GENECARDS.ORG: GeneCards is a searchable, integrated, database of human
genes that provides concise genomic related information, on all known and
predicted human genes. - Weizmann Institute of Science. - 1996.