Региональные особенности содержания и распределения ртути в водных экосистемах Оби
Курсовая
работа
Региональные особенности содержания и распределения ртути в водных
экосистемах Оби
Введение
водный ртуть экосистема
Уникальные биогеохимические и
экотоксикологические свойства ртути известны достаточно давно. Суть проблемы ртутного
загрязнения заключается не только в продолжающемся нарастании масштабов ее
поступления в биосферу. Увеличивающаяся общая антропогенная нагрузка на
природные комплексы, даже отдаленно не связана с ртутной, очень часто приводит
к тому, что уже имеющаяся в окружающей среде ртуть переходит в более подвижные
и токсичные формы [1].
Ртуть и её соединения относятся к
наиболее опасным токсичным веществам, являясь веществами 1-го класса опасности (чрезвычайно опасные), и их содержание строго
лимитируется во всех компонентах окружающей среды, питьевой воде, воздухе и
продуктах питания. Несмотря на то, что ртуть издавна используется в различных
отраслях деятельности человека и её токсичность известна с древних веков,
только в последние десятилетия появились новые сведения о поистине глобальном
ртутном загрязнении окружающей среды.
В 2003 г. Совет управляющих ЮНЕП на
основе Отчета о глобальной оценке выбросов ртути [2] пришел к выводу, что
масштабы глобального неблагоприятного воздействия ртути приводят к необходимости
организации международной кампании по снижению опасности для человека и живой
природы от выбросов ртути в окружающую среду.
Основной причиной для принятия
решения о необходимости мер, направленных на проблему ртутного загрязнения,
стал глобальный перенос ртути в окружающей среде. Для решения этих проблем была
создана программа ЮНЕП по ртути, а в октябре 2013 г. открыта для подписи
Минаматская конвенция по ртути (The Minamata Convention on Mercury), цель
которой заключается в охране здоровья человека и окружающей среды от
антропогенных выбросов и высвобождений ртути и ее соединений [20]. Этот
документ предусматривает взаимный обмен знаниями и данными о наличии и
перемещении ртути и ртутных соединений в окружающей среде, а также
географически репрезентативного мониторинга уровней ртути и ртутных соединений
в уязвимых группах населения и компонентах окружающей среды (Статья 19, пункт 1b) [21]. В новом отчете ЮНЕР
«Глобальная оценка ртути» [22] представлены оценки природных и техногенных
выбросов ртути в воздух и в водную среду от различных источников. В отчете
подчеркивается необходимость мониторинга и систематизации данных о ртути в
окружающей среде по всему миру для дальнейшего понимания транспорта и
глобального цикла ртути. Изучение ртути, поступающей в водную среду чрезвычайно
важно, так как именно в водных экосистемах вследствие метилирования
неорганические формы ртути превращаются в более токсичные и биодоступные
органические формы, делая возможным накопление и биомагнификацию ртути по
водным пищевым цепям [15]. Наиболее опасное концентрирование происходит в цепи:
вода - донные отложения - биота - рыбы - питающиеся рыбой птицы / животные /
человек.
1. Ртуть в водных экосистемах
В окружающую среду ртуть попадает в
результате комплексного действия физико-химических и биохимических процессов.
Ее пространственное перемещение происходит, по двум каналам - водному и
атмосферному. В глобальном масштабе более важным является второй. В пресные
вода суши она поступает при разрушении коренных пород, выщелачивании из рыхлых
отложений и почв, разложении растительности и водных организмов, а также при
выпадении атмосферных осадков. Среди природных источников поступления ртути в
атмосферу главная роль принадлежит дегазации земной коры (включая зоны ртутной
минерализации), вулканам и испарению из океанов (при фотовосстановлении Hg(II)
в водной толще до Hg(O)).
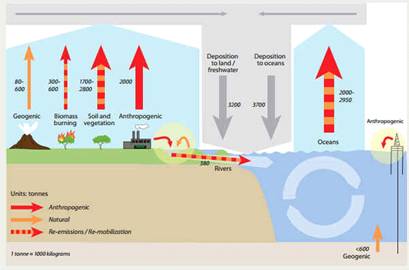
Рисунок 1. Глобальный цикл ртути [15]
Находясь в атмосфере, ртуть легко
может транспортироваться на значительные расстояния, выпадая затем на
поверхность земли вместе с осадками или благодаря сухому осаждению. Ее поток в
непосредственное окружение человека увеличился в индустриальную эпоху.
Некоторые виды хозяйственной деятельности возмущают естественные
биогеохимические циклы элемента, приводя к значительным отклонениям его
содержания от фоновых значений в различных природных объектах.
1.1 Важнейшие свойства
ртути
Ртуть является
элементом IIб Периодической системы Д.И. Менделеева. Её атомный номер 80,
атомная масса 200,59. В природе существует семь изотопов с атомными массами 196
(0,15%), 198 (10,12%), 199 (17,04%), 200 (23,13%), 201 (13,18%), 203 (29,8%),
204 (6,72%). Атомный радиус ртути 1,60 Ангстрем (для К=6), межъядерное
расстояние 3,005 Ангстрем. Потенциалы ионизации ртути 10,43 и 18,65 эВ, работа
выхода электрона из металла 4,52 эВ.
Ртуть - серебристо
- белый металл, обладающий низкой температурой плавления (-38,36°C). В твердом
виде - приобретает белый цвет и становится ковкой. Плотность металла зависит от
температуры и изменяется от 14,193 (- 38,36°C) до 13,546 (20°C) г/см3. Удельная
теплота плавления ртути 2,79 кал/г. Температура кипения ртути относительно
низка и составляет 356,66°C при 760 мм рт. ст.
В соединениях ртуть
проявляет степень окисления +2 и +1. Обладая высоким потенциалом ионизации,
высоким положительным окислительным потенциалом, ртуть является относительно
стойким в химическом отношении элементом. В соляной и разбавленной серной
кислотах и в щелочах ртуть не растворяется. Но она легко растворяется в азотной
кислоте и в царской водке, а при нагревании - в концентрированной серной
кислоте. Металлическая ртуть способна растворяться в органических
растворителях, а также в воде. Растворимость ее в воде зависит от рН раствора.
Еще одно свойство ртути
связано с тем, что при растворении в ней металлов образуются амальгамы -
металлические системы, одним из компонентов которых является ртуть. Это
используется в некоторых технологических процессах (амальгамной металлургии).
Ионы Hg (II) образуют большое
количество комплексных соединений с координационными числами 2 и 4. Имея
конфигурацию электронной оболочки d10, ртуть также может
образовывать комплексы с координационными числами 3, 5, 6 и 8. Во всех
комплексных соединениях связь ртуть-лиганд является ковалентной и весьма
прочной. Наиболее устойчивы комплексы с лигандами, содержащими атомы галогенов,
углерода, азота, фосфора и серы [2].
Она реагирует с галогенами (хлор,
йод, фтор, бром), серой, селеном, фосфором и другими неметаллами. Практическое
значение имеют йодная ртуть HgJ, хлористая ртуть (каломель) Hg2Cl2
и хлорная ртуть (сулема) HgCl2. При взаимодействии ртути с серой
образуется сульфид ртути HgS - самое распространенное в природе ее соединение,
в форме которого добывается почти вся ртуть. Оно известно в трех модификациях:
красная (идентичная минералу киноварь), черная (черный сульфид ртути, или
метациннабарит) и β-киноварь (в природных условиях не обнаружена). Из других
соединений ртути известны такие, как гремучая ртуть Hg(ONC)2, нитрат
Hg(NO3)2, сульфат (HgSO4) и сульфит (HgSO3)
ртути, красный и желтый йодид ртути и др. При воздействии на соли ртути аммиака
образуются комплексные соединения (белый плавкий преципитат HgCl.2NH3, белый неплавкий преципитат HgNH2Cl и
др.).
Существует большое количество
ртутьсодержащих органических соединений, в которых атомы металла связаны с
атомами углерода. Среди них выделяют две основных группы: 1) арилртутные
соединения, как правило синтетические, характеризующиеся присутствием в их
молекуле радикала ароматических углеводородов; 2) алкилртутные (метил- и
диметилртутные) соединения, имеющие в своем составе однозамещенный
углеводородный радикал и образующиеся в природных условиях (например, ион
метилртути СH3-Hg+). Химическая связь углерода и ртути
очень устойчива. Она не разрушается ни водой, ни слабыми кислотами, ни
основаниями. С позиций опасности для живых организмов (т.е. с позиций
токсикологии - науки о ядах) наиболее токсичными из металлоорганических
соединений ртути являются алкилртутные соединения с короткой цепью, прежде
всего, метилртуть [14].
Уникальный комплекс таких
физико-химических свойств ртути, как текучесть, однородное объемное расширение
в широком интервале температур, высокое поверхностное натяжение и
несмачиваемость стеклянных поверхностей, обусловливает ее широкое использование
в измерительных приборах (термометрах, барометрах, манометрах) [2].
Уникальные свойства сделали ртуть в
современных отраслях промышленности важным элементом. Нет такой отрасли, где бы
ни использовался этот необычный металл:
Металлургия:
Ø использует
свойство ртути растворять в себе большинство металлов, в результате чего
получаются амальгамы;
Ø целый
ряд важнейших сплавов получается с помощью ртути, находящих применение в
гальванопластике, гравировке и литографии;
Ø ртутные
соединения применяют в производстве драгоценных металлов.
Тяжёлое машиностроение:
Ø вакуумные
установки;
Ø современны
ртутные диффузионные насосы;
Ø тяжело
нагруженные гидродинамические подшипники; ртутнопаровые турбины содержат
большое количество ртути в жидком состоянии и его необходимо постоянно
пополнять.
Электротехническая промышленность:
Ø лампы
дневного света, кварцевые, люминесцентные;
Ø выпрямители
электрического тока, преобразующие трёхфазный ток в постоянный посредством
жидкого ртутного катода;
Ø сухие
батареи, технология изготовления которых включает применение ртути, сегодня на
них работают слуховые аппараты;
Ø аккумуляторы.
Приборостроение и радиотехническая
промышленность:
Ø контрольно-измерительные
приборы (манометры, ареометры, барометры, термометры), полярографы;
Ø ртутные
муфты входят в сборку миниатюрных двигателей для стиральных машин,
холодильников, кондиционеров;
Ø в
астрономии есть ртутный прибор - горизонт, где металл выступает в роли
идеальной зеркальной поверхности для наблюдения за небесными телами.
Ø В
горном деле ртуть помогает отделить от золота неметаллические примеси.
Ø Нефтеперерабатывающая
промышленность использует способность ртутных паров к точной регулировке
температур при очистке нефти.
Ø Военная
промышленность из ртути и её соединений получает «гремучую ртуть» - взрывчатое
вещество, закладываемое в детонаторы снарядов и гранат.
Ø Медицина
получает антисептические, противопаразитарные, мочегонные препараты ртути.
Стоматология изготавливает зубные протезы и пломбы из амальгамы олова, серебра
и кадмия.
Ø Сельское
хозяйство применяет органические соединения ртути как гербициды и для
протравливания семян.
Ø В
судостроении подводную часть морских судов покрывают специальной краской,
содержащей ртуть. Соединяясь с морским хлором, на покрытии днища образуется
сулема, от которой вредные бактерии гибнут.
Ø Органические
и неорганические соединения ртути находят применения в фотографии, пиротехнике,
при изготовлении художественных изделий из фарфора, дублении кожи, окрашивании
тканей. [6].
1.2 Содержание ртути в
водных экосистемах и источники ее поступления
Ртуть - редкий элемент. Ее средние
содержания в земной коре и основных типах горных пород оцениваются в 0,03-0,09 мг/кг, т.е. в 1 кг породы содержится 0,03-0,09 мг ртути, или 0,000003-0,000009% от
общей массы (для сравнения - одна ртутная лампа в зависимости от конструкции
может содержать от 20 до 560 мг ртути, или от 0,01 до 0,50% от массы). Масса ртути, сосредоточенная в поверхностном слое
земной коры мощностью в 1 км, составляет 100 000 000 000 т
(сто миллиардов тонн), из которых в ее собственных месторождениях находится
только 0,02%. Оставшаяся часть ртути существует в состоянии крайнего рассеяния,
по преимуществу в горных породах (в водах Мирового океана рассеяно 41,1 млн. т
ртути, что определяет невысокую среднюю концентрацию ртути в его водах - 0,03
мкг/л). Именно эта рассеянная ртуть создает природный геохимический фон, на
который накладывается ртутное загрязнение, обусловленное деятельностью человека
и приводящее к формированию в окружающей среде зон техногенного загрязнения.
Известно более 100 ртутных и
ртутьсодержащих минералов. Основным минералом, определяющим промышленную
значимость ртутных месторождений, является киноварь. Самородная ртуть,
метациннабарит, ливингстонит и ртутьсодержащие блеклые руды имеют резко
подчиненное значение и добываются попутно с киноварью. Размер кристаллов
киновари обычно варьируется в пределах от 2-3 до 0,1 мм; реже наблюдаются
кристаллы до 1 см, более крупные (3-5 см) составляют редкость. Теоретический
состав киновари: ртуть 86,2%, сера 13,8%. Но в ней часто обнаруживается примесь
15-20 элементов: кремния, алюминия, магния, меди, цинка, мышьяка, сурьмы,
серебра и др.
Всего в мире обнаружено около 5000
ртутных месторождений, рудных участков и рудопроявлений, получивших
самостоятельное название; из них в разное время разрабатывались около 500. Но
за всю историю ртутной промышленности подавляющая часть ртути (более 80%)
получена на 8 месторождениях: Альмаден (Испания), Идрия (Словения), Монте-Амиата
(Италия), Уанкавелика (Перу), Нью-Альмаден и Нью-Идрия (США), Никитовка
(Украина), Хайдаркан (Киргизия). Ртутные руды делятся на очень богатые (5-10%
ртути и более), богатые (около 1%), рядовые (0,2-0,3%, бедные (0,06-0,12%),
убогие (0,02-0,06%) и ртутьсодержащие (0,01-0,00001%). Руды большинства ныне
разрабатываемых месторождений ртути - это в основном рядовые руды [14].
Загрязнение
водоемов ртутью вызывает отравления водных животных и весьма опасно для
человека из-за накопления ее соединений в пищевых гидробионтах. Металлическая
ртуть и ее неорганические соли менее токсичны для рыб, чем органические
соединения. Высокая токсичность органических препаратов ртути объясняется тем,
что органический радикал способствует проникновению их в организм, что приводит
к тяжелому отравлению, поражению центральной нервной системы, печени, почек и
других органов за счет ингибирования тиоловых ферментов и биосинтеза белков.
Ртутные препараты обладают гонадотропным и эмбриотоксическим действием. Из
неорганических соединений на рыб действуют в основном растворимые соли ртути -
хлориды, сульфаты и нитраты. Токсичность ртути в мягкой воде выше, чем в
жесткой [14].
Согласно оценкам,
кустарная и мелкомасштабная золотодобыча (КМЗ) является источником выбросов
более чем 700 тонн в год ртути в атмосферу и, кроме того, 800 тонн в год ртути
поступает на землю и в воды, что делает ее крупнейшим антропогенным источником
ртути [15].
1.3
Поступление ртути в водные экосистемы
Распределение и миграция ртути в
окружающей среде осуществляются в виде круговорота двух типов. Во-первых,
глобального круговорота, включающего циркуляцию паров ртути в атмосфере (от
наземных источников в Мировой океан и наоборот). Во-вторых, локального
круговорота, основанного на процессах метилирования неорганической ртути,
поступающей главным образом из техногенных источников. Многие этапы локального
круговорота еще недостаточно ясны, но полагают, что он включает циркуляцию в
среде обитания диметилртути. Именно с круговоротом второго типа чаще всего
связано формирование опасных с экологических позиций ситуаций.
Поступающие в окружающую среду из
природных и техногенных источников ртуть и ее соединения подвергаются в ней
различным преобразованиям. Неорганические формы ртути (элементарная ртуть Hgo
и неорганический ион Hg2+) претерпевают преобразования в результате
окислительно-восстановительных процессов. Пары ртути окисляются в воде в
присутствии кислорода неорганическую двухвалентную ртуть (Hg2+),
чему в значительной мере способствуют присутствующие в водной среде
органические вещества, которых особенно много в зонах загрязнения. В свою
очередь, ионная ртуть, поступая или образуясь в воде, способна формировать
комплексные соединения с органическим веществом. Значение имеет взаимодействие
ртути с серой (сульфид-ионом), приводящее к образованию (в безкислородных
условиях) устойчивого сульфида ртути HgS, который, однако, в присутствии
кислорода может окисляться в растворимые соли - сульфит и сульфат ртути, что
обусловливает участие металла в последующих химических реакциях. Наряду с
окислением паров ртути образование Hg2+ может происходить при
разрушении ртутьорганических соединений.
Неорганическая ртуть Hg2+
претерпевает два важных вида превращений в окружающей среде. Первый - это
восстановление с образованием паров ртути. Этот процесс, являющийся ключевым в
глобальном круговороте ртути, изучен плохо. Известно, что некоторые бактерии
способны осуществлять это преобразование. Второй важной реакцией, которой
подвергается Hg2+ в природе, является ее превращение в метил- и диметилпроизводные
и их последующие взаимопревращения друг в друга. Эта реакция играет ключевую
роль в локальном круговороте ртути. Важно то, что метилирование ртути
происходит в самых различных условиях: в присутствии и отсутствии кислорода,
разными бактериями, в различных водоемах, в почвах и даже в атмосферном
воздухе. Особенно интенсивно процессы метилирования протекают в верхнем слое
богатых органическим веществом донных отложений водоемов, во взвешенном в воде
веществе, а также в слизи, покрывающей рыбу. Метилирование приводит к
образованию монометил- и диметилртутных соединений. Монометилртуть (CH3-Hg+,
обычно говорят и пишут просто «метилртуть»), обладая, как уже говорилось,
высоким сродством к биологическим молекулам, чрезвычайно активно накапливается
живыми организмами. Факторы биоконцентрирования, т.е. отношения содержания
метилртути в тканях рыб к ее концентрации в воде, могут достигать 10000-100000.
Диметилртуть (CH3)2Hg, отличаясь высокой растворимостью и
испаряемостью, улетучивается из воды в атмосферу, где может превращаться в
монометилртуть, удаляться с дождевыми осадками и возвращаться в водоемы и в
почву, завершая таким образом локальный круговорот ртути [12].
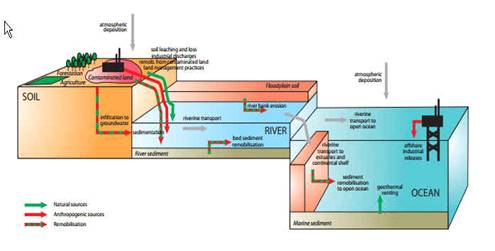
Рисунок 2. Основные
пути и источники ртути [15]
Повышенные
концентрации ртути в речных и морских водах отрицательно воздействуют на
состояние водных экосистем. При содержании ртути 0.018 мг/л в водах тормозятся
биохимические процессы очищения, а при 2.0 мг/л ртути - прекращаются.
Токсическое воздействие ртути проявляется для всех представителей водной
растительности и животного мира [2].
В большинстве
случаев, повышенный уровень ртути в воде замечается в районах, где есть
месторождения ртути. Сточная вода с предприятий по производству разных
лекарств, пестицидов, красителей в большинстве случаев содержат ртуть. Другим
важным источником загрязнения ртутью считаются тепловые электростанции (которые
используют как горючее уголь).
Природная вода
содержит ртуть в двух формах: взвешенную (в виде сорбированных соединений) и
растворённую (комплексные, минеральные соединения ртути). В определённых зонах
океанов, ртуть может появляться в виде метилртутных комплексов.
Содержание ртути в
реках в среднем - десятки доли микрограмма на литр воды, в морях - 0,03 мкг/л.
Самый большой уровень ртути содержится в подземной воде - 1 - 3 мкг/л.
Предельно-допустимые
концентрации ртути для водной среды:
Ø ПДК ртути в воде водных объектов хозяйственно-питьевого и
культурно-бытового водопользования - 0,5 мкг/л [ГН 2.1.5.1315-03],
Ø в водных объектах рыбохозяйственного назначения ПДК рыбхоз -
меньше 0,01 мкг/л [Приказ Росрыболовства от 18.01.2010 г. №20].
Таблица 1.
Содержание ртути в воде (мкг/л), взвешенном веществе, донных отложениях и
гидробионтах (мкг/г) [12]
|
Объект
|
В, мкг/л
|
ВВ, мкг/г
|
Зообентос
|
Рыбы
|
|
Р. Катунь, Анос
|
0,005-0,09
|
0,07-1,4
|
0,04-1,00
|
0,05-0,08
|
0,04-0,11
|
|
Р. Томь
|
0,007-0,15
|
0,01-60
|
0,07-3,2
|
0,01-0,08
|
0,01-1,9
|
Типичные фоновые
уровни валовой ртути (растворенные формы) в природных пресных водах составляют
0,03-0,07 мкг/л; в донных отложениях рек и пресноводных озер - 0,05-0,1 мг/кг;
в пресноводных растениях -0,04-0,06 мг/кг сухой массы. Обычно там, где нет
указаний на загрязнение ртутью, ее уровни в питьевых водах редко превышают 0,1
мкг/л. Ртуть, прежде всего метилртуть, относится к веществам, которые
накапливаются в пищевой цепи, простым образцом которой может быть, например,
следующий ряд: личинка - пескарь - окунь - щука - кошка. Это значит, что в
каждом последующем организме содержание метилртути обычно многократно выше,
нежели в предыдущем. Пищевые продукты, выращенные и полученные при соблюдении
необходимых условий, обычно характеризуются допустимым содержанием ртути [20].
Таблица 2.
Примерный диапазон концентраций ртути в различных объектах
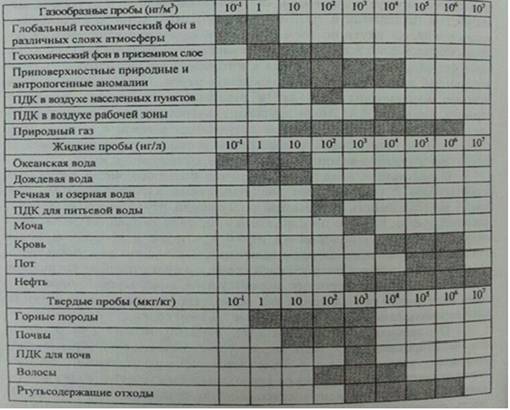
Из приведенных в
таблице 2 ориентировочных данных видно, что диапазон содержаний ртути в пробах
различного агрегатного состояния может составлять 7-9 порядков величин, при
этом для определения фоновых концентраций требуются анализаторы с ПО на уровней
доле пг ртути [8].
2. Методы определения ртути
В настоящее время разработано
большое количество методов определения ртути и ее соединений, таких как
атомно-абсорбционные (АА), атомно-флуоресцентные (АФ), атомно-эмиссионные (АЭ),
хроматографические (ХГ), нейтронно-активационные (НА), электрохимические (ЭХ),
спектрофотометрические (СФ), ICP-MS масс-спектрометрию с индуктивно-связанной плазмой (ИСП-МС) и др.
Методы определения характеризуются различными пределами обнаружения (ПО),
селективностью, экспрессностью, стоимостью аппаратурного оформления и
выполняемых анализов [2].
Определение содержания ртути в
объектах окружающей среды на уровне природного фона, контроль воды и воздуха с
точки зрения превышения ПДК, определение концентрации ртути в природном газе,
нефти и ртутьсодержащих отходах - это совершенно разные аналитические задачи,
требующие и соответствующей аппаратуры.
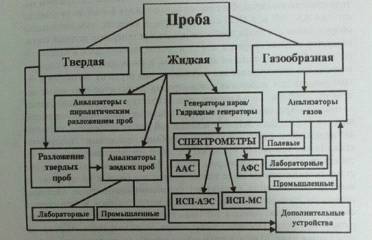
Рисунок 3. Примерная классификация
приборов для определения ртути
С целью системного рассмотрения
анализаторов ртути все существующие модели разделены по типу анализируемых
проб, то есть по их агрегатному состоянию - твердые, жидкие и газообразные
(рис. 3).
Эта схема позволяет оценить все
многообразие существующих сегодня на рынке приборов и дает представление об
области их возможного использования [8].
Предел обнаружения зависит от всей
аналитической процедуры, начиная с предварительной подготовки образца и
заканчивая количественным определением.
Для достижения необходимых значений
ПО ряда современных методов необходимо предварительное концентрирование
растворенной ртути или применение специальных приемов повышения
инструментальной чувствительности. Так, покрытие золотом, платиной или
палладием внутренней поверхности графитовой кюветы, значительно снижает ПО
прямого атомно-абсорбционного определения ртути. Однако наиболее перспективным
и универсальным для повышения чувствительности оказался метод перевода ртути в
газовую фазу после ее восстановления до летучей атомарной формы и последующего
концентрирования на коллекторах из благородных металлов. Он получил название
метода холодного пара (МХП) и в течение длительного времени широко используется
в мировой практике [4].
2.1
Метод холодного пара
Впервые метод
холодного пара с непламенным атомно-адсорбционным определением паров
восстановленной атомарной ртути (МХП-ААС) был предложен в 1963 г. сотрудниками
Физико-химического института им. А.В. Богатского АН УССР, г. Одессе, и позднее
в 1968 г. описан американскими учеными. Уже в 1976 г. он утвержден в США в
качестве стандартного для метода контроля за качеством природных и сточных вод
[2].
Основными стадиями
МХП является:
Ø восстановление - растворенная ртуть в водной фазе
восстанавливается до летучей атомарной ртути Нg0 с использованием различных восстановителей;
Ø аэрация - атомарная ртуть переводится в газовую фазу потоком
инертного газа или воздуха, барботируемого через анализируемую жидкость;
Ø детектирование - пары восстановленной ртути с потоком
газа-носителя поступают в оптическое устройство, где измеряют их концентрацию,
чаще всего поглощение излучения с длиной волны 253,7 нм.
ПО метода холодного
пара равен 0.2-0.5 мкг/л, линейная рабочая область - до 0.001-0.5 мкг/мл.
Недостаток метода -
наличие аналитических помех за счет:
Ø неселективной абсорбции паров воды, ацетона, бензола, сероводорода
и др.;
Ø подавление реакции восстановления в присутствии меди, серебра,
селена, теллура, палладия, платины, тиосульфатов, бромидов, иодидов и др. [8].
МХП достаточно
прост, чувствителен, экспрессен и в зависимости от приборного оснащения может
быть реализован как в специальных ртутных анализаторах, так и с использованием
приставок к атомно-абсорбционным, атомно-флуоресцентным спектрофотометрам,
атомно-эмиссионным спектрометрам, а также к хроматографам и
хромато-масс-спектрометрам. Использование таких специфических свойств атомарной
ртути, как образование амальгам с благородными металлами, позволило значительно
повысить чувствительность определения ртути за счет предварительного
концентрирования ее восстановленных паров на металлических сорбентах или
коллекторах, чаше всего золотых, золотоплатиновых или серебряных [2].
2.2
Метод атомной флуоресценции
Способ
преобразования паров восстановленной ртути с использованием АФС впервые описан
в 1971 г., но в течение длительного времени не находил широкого применения
из-за недостатка серийных приборов. По сравнению с атомно-адсорбционным
преобразованием МХП-АФС обладает рядом преимуществ:
Ø более высокой чувствительностью: ПО при использовании
предварительного амальгамирования паров ртути на золотых сорбентах может
достигать 0,06-0,1 нг/л, без предварительного концентрирования - 2 нг/л.;
Ø меньшим эффектом «памяти» и за счет этого - более легкой
автоматизацией метода;
Ø отсутствием мешающего влияния неорганических и органических
компонентов;
Ø более широкой областью линейности градуировочных характеристик -
несколько порядков величин (от 0,1 нг/л до 2 мг/л)
Были проведены
исследования по оптимизации условий определения ртути, включая выбор
восстановителя, методов разложения связанных форм ртути, подбор амальгамирующих
и газоосушающих устройств, временного режима и геометрических параметров
оптической системы. Флуоресценция паров ртути может возбуждаться излучением
ртутной лампы низкого давления, питаемой от низкочастотного генератора. Данный
способ определяет высокую эффективность возбуждения паров ртутит и позволяет
работать без дополнительной монохроматизации излучения.
Тем не менее, метод
АФ обнаружения паров ртути имеет недостатки, которые необходимо учитывать при
его использовании:
Ø Молекулы кислорода, азота и воды, присутствующие в газовой фазе,
оказывают мешающие воздействие путем тушения флуоресценции атомов ртути, для
устранения этого влияния необходимо продувание всех систем анализатора
высокочистым аргоном [16].
Ø Газообразный водород и большое количество паров воды, способствует
тушению флуоресценции атомов ртути.
Следовательно, при
восстановлении растворенной ртути лучше всего использовать хлорид олова [16,
17].
2.3 Анализаторы
ртути
Агентство охраны
окружающей среды США (EPA USA) определило три уровня проведения эколого-аналитических
исследований (Data Quality Objectives):
Ø общий контроль, проводимый в полевых условиях при помощи
портативных анализаторов и наборов для экспресс-анализа с целью обнаружения и
определения суммарного загрязнения;
Ø анализы, проводимые в экспедиционных условиях с помощью более
сложных компактных анализаторов;
Ø лабораторные исследования с использованием современных приборов и
строгим соблюдением требований нормативных документов.
За последние 20 лет
за рубежом разработано большое количество ртутных анализаторов и приставок,
генерирующих пары восстановленной ртути.
В России ассортимент
отечественных анализаторов всех трех уровней недостаточен, а технические и
метрологические характеристики не всегда удовлетворяют задачам экологического
контроля или мониторинга.
В настоящее время
рынок отечественного приборостроения стал пополняться анализаторами для
определения ртути в твердых, жидких и газообразных образцах. Анализаторы
представлены в таблицах 3 и 4 [2].
Таблица 3.
Атомно-адсорбционные анализаторы для определения ртути в растворах [8]
|
Производитель
|
Модель
|
П.О., мкг/л *
|
|
Aurora Instruments (Канада)
|
AI 3200
|
< 0.001
|
|
Buck Scientifie (США)
|
400 А 410
|
1,0 0,01
|
|
Leeman Labs (США)
|
Hydra AA
|
0.001
|
RA
- 3
|
0,001
|
|
Perkin - Elmer (США)
|
FIMS -100, -400
|
<0.005
|
|
«Люмэкс» (Россия)
|
РА - 915 с РП - 91
|
0,0005
|
|
НПО «Метрология» (Россия)
|
Юлия - 5К, -5КМ
|
0,02
|
|
«ЭкОН» (Россия)
|
УКР-1МЦ с ПАР-3М
|
0,005
|
Таблица 4.
Атомно-флуоресцентные анализаторы для определения ртути в растворах [8]
|
Производитель
|
Модель
|
П.О., нг/л
|
|
Analytik Jena AG (Гермнания)
|
MERCUR
|
<0.025
|
|
Leeman Labs (США)
|
Hudra AF, AF Gold
|
<0.05
|
|
PS Analytical (Великобритания)
|
10.025 Millenium
Merlin 10.035 Millenium Merlin 1631 10.45 Millenium Merlin
|
0.1* 0.1*/0.01
20*
|
|
Tekran (Канада)
|
Series 2600
|
< 0.1
|
* Предел
обнаружения без предварительного концентрирования
Большая часть
выпускаемых за рубежом и в нашей стране ртутных анализаторов и приставок
разработана на основе метода холодного пара, позволяющего значительно улучшить
чувствительность атомно-адсорбционного, атомно-флуоресцентного и некоторых
других видов обнаружения ртути [14].
2.4 Используемый в
работе анализатор
В Химико-аналитическом центре ИВЭП
СО РАН используется анализатор ртути Mercur DUO Plus (Analytik Jena, Германия), реализующий
метод холодного пара с атомно-абсорбционной и атомно-флуоресцентной детекцией,
комбинация которых позволяет определять широкий диапазон концентраций в
различных объектах окружающей среды (вода, атмосферные осадки, донные
отложения, почвы, биотические объекты) [12]. На рис. 1 в приложении А
представлена фотография Mercur DUO Plus.
Принцип действия анализатора основан
на эффектах поглощения и флуоресценции, который заключается в том, что ртуть,
содержащаяся в пробе, переводится в состояние атомного пара, который поглощает
падающее на него монохроматическое излучение и затем испускает вторичное
характеристическое излучение на другой длине волны.
В анализаторе установлены две ячейки
атомно-абсорбционная и флуоресцентная, в которых осуществляется регистрация
оптической плотности и интенсивности флуоресценции атомного пара ртути
соответственно [1].
Восстановление ртути в анализируемом
растворе производится при его смешении с восстановителем (раствором хлорида
олова) и носителем (раствор соляной кислоты). Подача растворов и удаление
жидких продуктов реакции осуществляется с помощью перистальтических насосов.
Пары ртути выдуваются из раствора с помощью аргона. Разделение газообразных и
жидких продуктов реакции производится в стеклянном сепараторе. Газообразные
продукты проходят через трубчатый мембранный осушитель и поступают либо в
аналитическую ячейку (абсорбционную или флоуресцентную), либо в золотой
концентратор. При нагреве золотого амальгамного концентратора накопленные пары
ртути поступают в аналитическую ячейку. В качестве источника излучения
используется ртутная лампа низкого давления. Регистрация аналитического сигнала
осуществляется с помощью поворотного ФЭУ (фотоэлектронный умножитель).
Управление процессом измерения и
обработки выходной информации осуществляется от IBM PC - совместимого
компьютера с помощью специального программного комплекса.
Основные метрологические и
технические характеристики прибора представлены в таблице 5.
Таблица 5. Основные метрологические и технические характеристики анализатора
ртути Mercur DUO Plus

3. Региональные уровни
ртути в водных экосистемах р. Обь
По ретроспективным данным
многолетних режимных исследований (1989-1992 гг.) было показано,
что ртутное загрязнение вод бассейна р. Катунь резко локализовано в зоне
влияния Акташского рудника [12]. В зоне непосредственного влияния Акташского
рудника и ртутных месторождений (бассейн р. Чибитки, включая р. Ярлы-Амры) содержание ртути во всех компонентах превышает
фоновые, а во многих случаях и предельно-допустимые концентрации. Концентрация
ртути в поверхностных водах и ДО резко уменьшается с удалением от этой зоны.
После впадения Чуи концентрация ртути в Катуни и других нижерасположенных
притоках, продолжает уменьшаться, достигая фоновых значений.
Химический состав поверхностных вод
Катуни связан с рудопроявлениями киновари.
Общее содержание ртути в
поверхностной воде вблизи Акташского месторождения составило около 1,0 мкг/л, в
устье Чуи 0,01 - 0,21 мкг/л. Далее концентрации ртути в воде уменьшались по
мере удаления от рудопроявлений до 0,08 - 0,17 мкг/л (створ п. Иня) и достигали
фоновых значений в замыкающих створах 0,005 - 0,09 мкг/л (пп. Эликмонар, Анос).
Взвешенное вещество (ВВ) на верхней Оби также транспортирует ртуть от устья Чуи
0,3 - 18,9 мг/кг постепенно снижая удельную концентрацию металла от 0,04 - 5,6
мг/кг до фоновых значений по мере удаления от ее месторождений. Во взвешенном
веществе Катуни происходит накопление тех элементов, которые образуют
естественные соединения, связанные с месторождениями и рудопроявлениями ртутной
(Hg, Ag, Zn, Cu) и свинцово-цинковой (Pb, Zn, Cu, Ag) формаций. Основной формой
нахождения ртути в твердом стоке Катуни является сорбционная. При этом удельные
концентрации других халькофильных элементов (Pb, Zn, Cu, Sn) на взвеси реки
Катунь в несколько раз больше, чем в глинах и сланцах мира 0,4 мг/кг.
Источниками их поступления в русловую сеть служат, в первую очередь,
месторождения ртутной, полиметаллической и других рудных формаций, а также зоны
глубинных разломов Горного Алтая (Чемал). Ртуть от источников на водосборе
распределяется в компоненты речной экосистемы [9].
В настоящее время в подавляющей
части бассейна р. Катунь существуют условия, неблагоприятные для метилирования
и аккумуляции ртути в биотических компонентах. Растворенная ртуть в водах р.
Катунь находится преимущественно в виде малодоступных гидроксокомплексов, а не
в катионных формах. Неблагоприятные условия для аккумуляции ртути определяются
физико-химическим составом Катунских вод. Это - низкие температуры, высокая
щелочность (> 1 мг-экв/л) и рН среды (7,8 - 8,5), значительные содержания
ионов Са2+, участвующих в катионном обмене и подавляющих поступление ртути в
биообъекты, а также низкие содержания органического вещества, являющегося
источником энергии для метилирующих ртуть бактерий. Все перечисленные факторы,
по данным мировой литературы, являются неблагоприятными для процессов
метилирования ртути, а, следовательно, и для ее накопления гидробионтами. Об
отсутствии накопления ртути свидетельствуют рассчитанные коэффициенты ее
аккумуляции в ряду: вода - донные отложения - фитобентос - зообентос - рыба.
Аккумуляция ртути фитобентосными
организмами выше, чем зообентосными, хотя процент органической ртути явно выше
у последних. Это свидетельствует о том, что ртуть относительно более
биодоступна для фитобентосных организмов, чем для зообентосных, но процессы
метилирования ярче выражены у зообентосных организмов. Следует отметить, что ни
в одной из проб мышечной ткани рыб не обнаружена ртуть в количествах,
превышающих ПДКp и доля метильной формы ртути в рыбе сравнительно невелика [12].
На р. Обь в черте Барнаула и ниже, а
также на Новосибирском водохранилище ИВЭП СО РАН проводился мониторинг в
течение многих лет. Ртуть также была в числе изучаемых микроэлементов.
Обработка этих данных и оценка современного уровня содержания ртути - и
является моей дальнейшей задачей.
Заключение
Таким образом, проанализировав
литературу, я оценила важность и актуальность темы с точки зрения рекомендаций
и выводов Глобального партнерства ЮНЕП по ртути, решений Минаматской ртутной
конвенции и ГБ проекта ИВЭП СО РАН «Пространственно-временная организация
водных экосистем и оценка влияния природных и антропогенных факторов на
формирование гидробиоценозов и качества поверхностных вод бассейна Оби и
Обь-Иртышского междуречья».
Изучив методы и приборы, их
возможности и особенности, я пришла к выводу, что оптимальным для задачи
определения ртути в природных водах является метод атомной флуоресценции с
концентрированием на золотом сорбенте. Он отличается более высокой
чувствительностью: предел обнаружения при использовании предварительного
амальгамирования паров ртути на золотом сорбенте может достигать 0,06-0,1 нг/л, без предварительного концентрирования - 2 нг/л.
Анализатор ртути Mercur демонстрирует хорошие аналитические характеристики:
низкий предел обнаружения, хорошая воспроизводимость, малый расход пробы на
анализ.
Ретроспективный анализ региональных
особенностей водных экосистем Оби показал, что ртутное загрязнение вод бассейна
р. Катунь резко локализовано в зоне влияния Акташского рудника, после впадения
Чуи концентрация ртути в Катуни и других нижерасположенных притоках, продолжает
уменьшаться, достигая фоновых значений и далее на участке реки Обь от г. Бийска до г. Барнаула влияние источников ртути
выходит на фоновый уровень. Определение концентраций ртути в пробах природных
вод р. Оби и анализ данных о содержании ртути в пробах, полученных на р. Оби в черте города Барнаула и в Новосибирском водохранилище в
различные сезоны необходимо для оценки современного уровня содержания ртути и
выявления возможного влияния антропогенных источников ее поступления в водные
экосистемы р. Обь.
Библиографический список
1 Костерина Е.В. Аналитическая точность до уровня нанограмма и
ниже: анализатор «Mercur» от Аналитик Йена // Ртуть. Проблемы геохимии,
экологии, аналитики: сб. науч. тр. / Москва, ИМГРЭ, 2005. с. 102 - 110.
Лапердина Т.Г. Определение
ртути в природных водах/ Новосибирск: Наука, 2000. 222 с.
Приказ Росрыболовства от 18 января 2010 г. №20 об утверждении
нормативов качества воды водных объектов рыбохозяйственного значения, в том
числе нормативов предельно допустимых концентраций вредных веществ в водах
водных объектов рыбохозяйственного значения.
4 Ртуть. Критерии санитарно-гигиенического состояния окружающей
среды: Пер. с англ. Женева: ВОЗ, 1979. 150 с.
5 Ртуть. Проблемы геохимии, экологии, аналитики: сб. науч. тр. /
Москва, ИМГРЭ, 2005. с. 35 - 54.
6 Ртуть. [Электронный ресурс] URL:
http://greenologia.ru/othody/metally/rtut (Дата обращения 25.12.2016)
Сухенко С.А. Ртутная
проблема в водохранилищах // Поведение ртути и других тяжелых
металлов в экосистемах: Аналит. обзор. Ч. 3. Закономерности
миграции и региональные особенности / ГПНТБ СО АН СССР. Новосибирск, 1989. 58 с.
Таций Ю.Г. Современная аппаратура для определения ртути. // Ртуть.
Проблемы геохимии, экологии и аналитики. Сборник научных трудов. М.: ИМГРЭ,
2005, 191 с.
Темерев С.В. Эколоко-химическая оценка состояния водных систем
бассейна Оби: дис. на соискание ученой степени д.хим. наук: Москва, 2008. 51 с.
Трахтенберг И.М., Коршун М.Н. Ртуть и её соединения в окружающей
среде (гигиенические и экологические аспекты). - Киев: Высшая школа, 1990. 232 с.
Хавезов И., Цалев Д. Атомно-адсорбционный анализ: Пер. с болг. Л.:
Химия, 1983. 144 с.
Эйрих С.С. Особенности распределения и миграции ртути в водных
экосистемах бассейнов рек Катуни и Томи: дисс. на соискание ученой степени
канд. хим. наук: Барнаул, 1999. 143 с.
Эйрих С., Швиковски М. Опыт использования атомно-флуоресцентного
анализатора «Mercur» для определения ультранизких концентраций ртути в пробах
льда и снега // Ртуть. Проблемы геохимии, экологии, аналитики: сб. науч. тр. /
Москва, ИМГРЭ, 2005. с. 111 - 114.
Янин Е.П. Ртуть,
человек, окружающая среда (краткий очерк). 31 с.
AMAP/UNEP, 2013. Technical Background Report for the Global
Mercury Assessment 2013
Chan C.C.Y., Sadana R.S. Automated determination of mercury at
ultra trace level in waters by gold amalgam preconcentration and cold vapour
atomic fluorescence spectrometry // Anal. Chim. Acta. 1993. Vol. 282. P.
109-115
17 Hintelmann H., Falter R., Ilgen G. et al. Determination of
artifactual formation of monomenthylmercury (CH3Hg+) in
environmental samples using stable Hg2+ isotopes with ISP-MS
detection: Calculation of contents applying species specific isotope addition
// Fresenius J. Anal. Chem. 1997. Vol. 358, №3. P. 363-370.
19 UNEP, 2002: Global Mercury Assessment, UNEP Chemicals, Geneva,
Switzerland, December 2002
20 UNEP Минаматская конвенция о ртути: [Электронный ресурс]. URL:
http://www.mercuryconvention.org/Convention/tabid/3426/Default.aspx (Дата
обращения 22.12.16)