Производство бария
Содержание
Введение
. Литературный обзор
.1 Мировые запасы бария
.2 Добыча бариевой руды
.3 Получение бария из руды
.4 Применение бария в производстве
.5 Воздействие бария и его соединений на организм
.6 Рекомендации по безопасности и охране здоровья
. Применение бария и кальция в качестве раскислителя при
выплавке стали
. Анализ соединений бария, образующихся при его применении в
производстве стали
.1 Контроль концентрации вредных соединений бария в воздухе
рабочей зоны
.2 Соединения бария, образующиеся при обработке стали на
агрегате ковш-печь
Выводы
Список использованных источников
Введение
В настоящее время улучшение свойств изделий из стали является одной из
актуальных задач металлургического производства. Одной из важных и эффективных
мер для улучшения эксплуатационных свойств стали, является удаление примесей
либо изменение состава и морфологии неметаллических включений и,
соответственно, выбор подходящего раскислителя и модифицирующей добавки.
Влияние присадок щелочноземельных и других активных элементов на свойства
стали изучается исследователями на протяжении более 40 лет. Практически во всех
работах отмечается положительный эффект от присадок комплексных сплавов,
содержащих в себе щелочноземельные и/или редкоземельные элементы. Такие сплавы
широко используются как для раскисления металла, так и для модифицирования
стали с получением более высоких прочностных и пластических свойств готового
металла. Наибольшее распространение комплексные сплавы-модификаторы получили в
литейном производстве. Модификаторы, в состав которых входит алюминий, кальций,
барий и другие элементы, успешно используют не только при выплавке стали, но и
при производстве цветных металлов и сплавов с особыми свойствами, например медь
и алюминий.
Обработка барием с целью изменения состава и морфологии оксидных и
сульфидных включений и повышения чистоты стали, является частным случаем
микролегирования жидкой стали. Результаты исследований показывают положительный
эффект. Обработка стали барийсодержащими сплавами может уменьшить количество
используемого алюминия; продукты раскисления легко всплывают в шлак; свойства
оставшихся в металле включений улучшаются, соответственно, улучшаются
механические свойства
За последнее десятилетие значительно возросло применение щелочноземельных
металлов, таких как кальций и барий. Соединения бария потенциально опасны для
здоровья человека. Они могут вызывать острые и хронические поражения отдельных
органов и систем, что должно приниматься во внимание при получении и применении
бариевых соединений.
.
Литературный обзор
1.1 Мировые
запасы бария
Барий - химический элемент 2-й группы периодической системы, атомный
номер 56, относительная атомная масса 137,33. Расположен в шестом периоде между
цезием и лантаном. Природный барий состоит из семи стабильных изотопов с
массовыми числами 130 (0,101 %), 132 (0,097 %), 134 (2,42 %), 135 (6,59 %), 136
(7,81 %), 137 (11,32 %) и 138 (71,66 %). Барий в большинстве химических
соединений проявляет максимальную степень окисления +2, но может иметь и
нулевую. В природе барий встречается только в двухвалентном состоянии [1].
В земной коре содержится 0,05 % бария. Это довольно
много - значительно больше, чем, например, свинца, олова, меди или ртути. В
чистом виде в земле его нет: барий активен, он входит в подгруппу щелочноземельных
металлов и, естественно, в минералах связан достаточно прочно [2]. Присутствует
он как в изверженных, так и в метаморфических и осадочных породах, где входит в
состав многих минералов, однако промышленное значение в настоящее время имеют
только два из них: барит и в меньшей степени витерит.
Барит или “тяжелый шпат”, представляет собой природный
сульфат бария (BaSO4), содержащий 65,7 % ВаО. В качестве наиболее часто
встречающихся примесей отмечаются: изоморфные- Sr, Pb, Ra; механические - оксиды
железа и марганца, сульфиды цветных металлов и железа, глинистое и органическое
вещество. Количество и состав примесей обуславливают разнообразие окраски
барита, которая бывает белой, от серой до черной, голубой, желтой, розовой,
бурой, коричневой, красной; прозрачные бесцветные кристаллы крайне редки.
Плотность химически чистого барита 4,48 г/см при 25 0С, у природных
баритов 4,3-4,7 г/см. Твердость по Моосу 3-3,5. Барит наблюдается в виде
зернистых образований или конкреций, изредка образует хорошо ограненные
таблитчатые кристаллы ромбической сингонии; хрупок; обладает стеклянным
блеском, на плоскостях спайности перламутровым; химически инертен, практически
нерастворим в воде, плохо растворятся (даже при нагревании) в соляной кислоте,
незначительно (10-12 %) в концентрированной серной кислоте [3].
Мировые минерально-сырьевые ресурсы барита оценивались в 1999 в 2 млрд.
тонн, значительная часть их сосредоточена в Китае (около 1 млрд. тонн) и в
Казахстане (0,5 млрд. тонн). Большие запасы барита есть и в США, Индии, Турции,
Марокко и Мексике. Российские ресурсы барита оцениваются в 10 миллионов тонн,
его добыча ведется на трех основных месторождениях, расположенных в Хакасии,
Кемеровской и Челябинской областях. Общая годовая добыча барита в мире
составляет около 7 миллионов тонн, Россия производит 5 тыс. тонн и импортирует
25 тыс. тонн барита в год [1].
Витерит - природный карбонат бария (ВаСО3),
содержащий 77,7 % ВаО; формирует шаровидные, почковидные, зернистые
образования; кристаллы бипирамидальной формы, встречаются двойники. По
физическим свойствам близок к бариту, имеет ту же плотность и твердость; цвет
белый, часто серый или желтоватый, может быть бесцветным. В отличие от барита
легко растворяется даже в слабых кислотах. Значительные концентрации витерита
крайне редки. Единственное крупное месторождение - Сеттлингстоун в
Великобритании. Поэтому промышленностью в основном потребляется достаточно
широко распространенный в природе барит [3].
1.2 Добыча
бариевой руды
В настоящее время при общей мировой добыче барита
свыше 7 млн т/год лидирующее положение занимают КНР (до 3,5 млн т), США (до 0,7
млн т), Индия (до 0,5 млн т) и Марокко (0,35 млн т), оставшаяся часть
приходится в основном на Мексику, Иран, Таиланд, Болгарию, Германию, Испанию,
Северную Корею и Турцию. В России максимум добычи составил 0,16 млн т (1996
г.), в Казахстане - 0,135 млн т (1994 г.), в Грузии - 0,012 млн т (1995 г.)
[4].
1.3 Получение
бария из руды
В настоящее время промышленностью разрабатываются месторождения барита,
среди которых по условиям образования могут быть выделены гидротермальные,
осадочные и месторождения выветривания. Каждый из этих типов включает
месторождения, крайне разнообразные по форме и размерам залежей,
взаимоотношениями с вмещающими породами, возрасту и составу руд. Промышленное
значение в настоящее время имеют лишь гидротермальные месторождения.
Требования к сырью.
В зависимости от сферы потребления барита изменяются и
требования к качеству исходного сырья. В настоящее время они регламентируются
ГОСТ 4682-74 “Концентрат баритовый”, в котором выделяются два промышленных
класса (А и Б) и шесть марок. Барит класса Б используется в нефти - и
газодобывающей промышленности, в других отраслях промышленности применяется
барит класса А. В обоих классах нормируется содержание сернокислого бария и
водорастворимых солей, которые в зависимости от марки не должны выходить за
пределы соответственно 90-95 и 0,25-0,45 %. Для класса А содержание некоторых
примесей в зависимости от марки не должно превышать (в %): SiO2
1,5-4,5; Fe2O3 0,5-2,5; СаО 0,5-7; для класса Б
нормируется также гранулометрический состав: содержание остатка на сите 0009К
не должно превышать 4 %, содержание фракции 5 мкм составляет более 5-20 % [3].
По минеральным ассоциациям баритовые руды делятся на
мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные
(содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn,
Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые
(содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и
барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а
в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и
ртути).
С практической точки зрения наибольший интерес
представляют гидротермальные жильные мономинеральные, барито-сульфидные и
барито-флюоритовые месторождения. Промышленное значение имеют также некоторые
метасоматические пластовые месторождения и элювиальные россыпи. Осадочные
месторождения, представляющие собой типичные химические осадки водных
бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные
компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных
концентрациях), поэтому они используются комплексно [2].
Основное
сырьё для получения бария - баритовый концентрат (80-95 % BaSO4),
который, в свою очередь, получают флотацией
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BB%D0%BE%D1%82%D0%B0%D1%86%D0%B8%D1%8F>
барита <https://ru.wikipedia.org/wiki/%D0%91%D0%B0%D1%80%D0%B8%D1%82>.
Сульфат бария
<https://ru.wikipedia.org/wiki/%D0%A1%D1%83%D0%BB%D1%8C%D1%84%D0%B0%D1%82_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
в дальнейшем восстанавливают коксом
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE%D1%83%D0%B3%D0%BE%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9_%D0%BA%D0%BE%D0%BA%D1%81>
или природным газом
<https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D1%80%D0%BE%D0%B4%D0%BD%D1%8B%D0%B9_%D0%B3%D0%B0%D0%B7>:
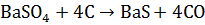 (1)
(1)
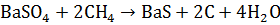 (2)
(2)
Далее
сульфид при нагревании гидролизуют до гидроксида бария
<https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%BE%D0%BA%D1%81%D0%B8%D0%B4_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
Ba(OH)2 или под действием CO2 превращают в нерастворимый
карбонат бария BaCO3, который затем переводят в оксид бария
<https://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
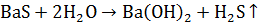 (3)
(3)
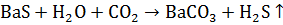 (4)
(4)
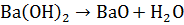 (5)
(5)
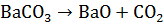 (6)3
+ C
(6)3
+ C 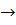 BaO + 2CO (7)
BaO + 2CO (7)
Металлический
барий получают из оксида восстановлением алюминием
<https://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8E%D0%BC%D0%B8%D0%BD%D0%B8%D0%B9>
[5]:
BaO + 2Al 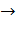 3Ba + Al2O3 (8)
3Ba + Al2O3 (8)
Впервые этот процеcc осуществил русский физико - химик Н.Н.Бекетов [1].
Сейчас процесс восстановления алюминием проводят в вакууме при температурах от
1200 до 1250 °C, при этом образующийся барий испаряется и конденсируется на
более холодных частях реактора.
Кроме того, барий можно получить электролизом расплавленной смеси
хлоридов бария и кальция.
1.4
Применение бария в производстве
Применение металлического бария весьма ограничено из-за его высокой
химической активности, соединения бария используются гораздо шире. В небольших
количествах барий используется в металлургии для очистки расплавленных меди и
свинца от примесей серы, кислорода и азота. Барий добавляют в типографские и
антифрикционные сплавы, сплав бария с никелем используется для изготовления
деталей радиоламп и электродов свечей зажигания в карбюраторных двигателях.
Вакуумные
электронные приборы
<https://ru.wikipedia.org/wiki/%D0%92%D0%B0%D0%BA%D1%83%D1%83%D0%BC%D0%BD%D1%8B%D0%B5_%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D1%8B%D0%B5_%D0%BF%D1%80%D0%B8%D0%B1%D0%BE%D1%80%D1%8B>
Металлический
барий, часто в сплаве
<https://ru.wikipedia.org/wiki/%D0%A1%D0%BF%D0%BB%D0%B0%D0%B2> с
алюминием
<https://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8E%D0%BC%D0%B8%D0%BD%D0%B8%D0%B9>
используется в качестве газопоглотителя (геттера <https://ru.wikipedia.org/wiki/%D0%93%D0%B5%D1%82%D1%82%D0%B5%D1%80_(%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%B2%D0%B0%D0%BA%D1%83%D1%83%D0%BC%D0%BD%D0%B0%D1%8F_%D1%82%D0%B5%D1%85%D0%BD%D0%B8%D0%BA%D0%B0)>)
в высоковакуумных электронных приборах.
Оксид
бария <https://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>,
в составе твёрдого раствора оксидов других щёлочноземельных металлов
<https://ru.wikipedia.org/wiki/%D0%A9%D1%91%D0%BB%D0%BE%D1%87%D0%BD%D0%BE%D0%B7%D0%B5%D0%BC%D0%B5%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5_%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D1%8B>
- кальция
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D0%BB%D1%8C%D1%86%D0%B8%D0%B9>
и стронция
<https://ru.wikipedia.org/wiki/%D0%A1%D1%82%D1%80%D0%BE%D0%BD%D1%86%D0%B8%D0%B9>
(CaO, SrO), используется в качестве активного слоя катодов
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%82%D0%BE%D0%B4> косвенного
накала.
Антикоррозионный
<https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D1%80%D0%BE%D0%B7%D0%B8%D1%8F>
материал
Барий
добавляется совместно с цирконием в жидкометаллические теплоносители
<https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BF%D0%BB%D0%BE%D0%BD%D0%BE%D1%81%D0%B8%D1%82%D0%B5%D0%BB%D1%8C>
(сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности
последних к трубопроводам, и в металлургии.
Сегнето-
<https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D0%B3%D0%BD%D0%B5%D1%82%D0%BE%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D0%BA>
и пьезоэлектрик
<https://ru.wikipedia.org/wiki/%D0%9F%D1%8C%D0%B5%D0%B7%D0%BE%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D0%BA>
Титанат
бария
<https://ru.wikipedia.org/wiki/%D0%A2%D0%B8%D1%82%D0%B0%D0%BD%D0%B0%D1%82_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
используется в качестве диэлектрика при изготовлении керамических конденсаторов
<https://ru.wikipedia.org/wiki/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D0%BA%D0%BE%D0%BD%D0%B4%D0%B5%D0%BD%D1%81%D0%B0%D1%82%D0%BE%D1%80>,
а также в качестве материала для пьезоэлектрических микрофонов и
пьезокерамических излучателей
<https://ru.wikipedia.org/wiki/%D0%9F%D1%8C%D0%B5%D0%B7%D0%BE%D0%BA%D0%B5%D1%80%D0%B0%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D0%B8%D0%B7%D0%BB%D1%83%D1%87%D0%B0%D1%82%D0%B5%D0%BB%D1%8C>.
Оптика
<https://ru.wikipedia.org/wiki/%D0%9E%D0%BF%D1%82%D0%B8%D0%BA%D0%B0>
Фторид
бария
<https://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80%D0%B8%D0%B4_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
применяется в виде монокристаллов в оптике (линзы, призмы).
Пиротехника
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B8%D1%80%D0%BE%D1%82%D0%B5%D1%85%D0%BD%D0%B8%D0%BA%D0%B0>
Пероксид
бария
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%BE%D0%BA%D1%81%D0%B8%D0%B4_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
используется для пиротехники и как окислитель. Нитрат бария
<https://ru.wikipedia.org/wiki/%D0%9D%D0%B8%D1%82%D1%80%D0%B0%D1%82_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
и хлорат бария
<https://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%BE%D1%80%D0%B0%D1%82_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
используется в пиротехнике для окрашивания пламени (зелёный огонь).
Атомно-водородная
энергетика
<https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D0%BE-%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%BD%D0%B0%D1%8F_%D1%8D%D0%BD%D0%B5%D1%80%D0%B3%D0%B5%D1%82%D0%B8%D0%BA%D0%B0>
Хромат
бария
<https://ru.wikipedia.org/wiki/%D0%A5%D1%80%D0%BE%D0%BC%D0%B0%D1%82_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
применяется при получении водорода и кислорода термохимическим способом (цикл
Ок-Ридж, США).
Высокотемпературная
сверхпроводимость
<https://ru.wikipedia.org/wiki/%D0%92%D1%8B%D1%81%D0%BE%D0%BA%D0%BE%D1%82%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%BD%D0%B0%D1%8F_%D1%81%D0%B2%D0%B5%D1%80%D1%85%D0%BF%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D1%8C>
Пероксид
бария
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%BE%D0%BA%D1%81%D0%B8%D0%B4_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
совместно с оксидами меди и редкоземельных металлов применяется для синтеза
сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
Ядерная
энергетика
<https://ru.wikipedia.org/wiki/%D0%AF%D0%B4%D0%B5%D1%80%D0%BD%D0%B0%D1%8F_%D1%8D%D0%BD%D0%B5%D1%80%D0%B3%D0%B5%D1%82%D0%B8%D0%BA%D0%B0>
Оксид
бария <https://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
применяется для варки специального сорта стекла - применяемого для покрытия
урановых стержней. Один из широкораспространённых типов таких стекол имеет
следующий состав: оксид фосфора - 61 %; ВаО - 32 %; оксид алюминия - 1,5 %;
оксид натрия - 5,5 %. В стекловарении для атомной промышленности применяется
также и фосфат бария
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%B0%D1%82_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>.
Химические
источники тока <https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D0%B8%D1%81%D1%82%D0%BE%D1%87%D0%BD%D0%B8%D0%BA%D0%B8_%D1%82%D0%BE%D0%BA%D0%B0>
Фторид
бария
<https://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80%D0%B8%D0%B4_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
используется в твердотельных фторионных аккумуляторных батареях в качестве
компонента фторидного электролита.
Оксид
бария
<https://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
используется в мощных медноокисных аккумуляторах в качестве компонента активной
массы (оксид бария - оксид меди).
Сульфат
бария
<https://ru.wikipedia.org/wiki/%D0%A1%D1%83%D0%BB%D1%8C%D1%84%D0%B0%D1%82_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>
применяется в качестве расширителя активной массы отрицательного электрода при
производстве свинцово-кислотных аккумуляторов.
Применение
в медицине
Сульфат
бария
<https://ru.wikipedia.org/wiki/%D0%A1%D1%83%D0%BB%D1%8C%D1%84%D0%B0%D1%82_%D0%B1%D0%B0%D1%80%D0%B8%D1%8F>,
нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного
вещества при медицинском обследовании желудочно-кишечного тракта. [5]
1.5
Воздействие бария и его соединений на организм
В отечественной и зарубежной литературе имеются многочисленные данные,
указывающие на широкий спектр действия соединений бария на организм человека. В
частности, воздействие бария неблагоприятно отражается на кроветворной,
сердечнососудистой и нервной системах, нарушаются функции печени и
желудочно-кишечного тракта, разрушается витамин C.
В условиях производства соединения бария поступают в организм в основном
в виде аэрозолей дезинтеграции через органы дыхания и в меньшей степени через
желудочно-кишечный тракт или поврежденную кожу.
Токсичность солей бария во многом зависит от степени их растворимости в
воде и биосредах организма. Наиболее токсичными являются такие соединения, как
хлористый, азотнокислый, углекислый, сернистый и гидроксид бария, а также оксид
и перекись его. Не растворимый в воде, кислотах и щелочах сернокислый барий
токсическими свойствами не обладает. Отравления соединениями бария по степени
тяжести могут носить как острый, так и хронический характер.
Хроническое отравление возникает при длительном поступлении через органы
дыхания малых количеств бариевых соединений в виде аэрозолей. В частности,
многолетнее поступление в легкие ультрадисперсного углекислого бария вызывает
общетоксическое действие на организм.
Результаты поликлинического обследования рабочих бариевого производства и
данные экспериментальных исследований при хронической ингаляционной затравке
животных пылью углекислого бария показали, что хроническая бариевая
интоксикация характеризуется нарушением сосудистого тонуса по гипер- и
гипотоническому типу, поражением миокарда с изменением функции сердечной
проводимости и нарушением фосфорно-кальциевого обмена в организме. При этом страдает
система кроветворения (снижение гемоглобина, лейкоцитоз, тромбопения) и
нарушается белковообразовательная и дезинтоксикационная функция печени, а также
угнетается активность ферментов.
Длительное поступление в легкие пыли нерастворимого сернокислого бария
вызывает у рабочих профессиональный пневмокониоз баритов. Пыль углекислого
бария также обладает выраженным фиброгенным действием. Для большинства
соединений бария характерно наличие местного раздражающего действия на кожу и
слизистые оболочки - последнее наиболее выражено у гидрата окиси бария.
В эксперименте на животных установлено, что барий обладает выраженной
способностью к кумуляции и долго задерживается в организме. Кроме того, ион
бария легко проникает через плацентарный барьер и в период лактации может
выделяться с молоком матери.
Предельно допустимая концентрация содержания аэрозолей бариевых
соединений в воздухе рабочей зоны установлена - для абсолютно не растворимых
(сернокислый барий) на уровне 6 мг/м3, для растворимых в
биологических средах организма (углекислый барий) на уровне 0,5 мг/м3.
Биологическая роль и токсичность.
Биологическая роль бария изучена недостаточно. В число
жизненно важных микроэлементов он не входит.
Все растворимые в воде соединения бария
высокотоксичны. Вследствие хорошей растворимости в воде из солей бария опасен
хлорид, а также нитрат, нитрит, хлорат и перхлорат. Хорошо растворимые в воде
соли бария быстро резорбируются в кишечнике.
Симптомы острого отравления солями бария:
слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота,
понос, повышенное кровяное давление, твёрдый неправильный пульс, судороги,
позже возможны и параличи, синюха лица и конечностей (конечности холодные),
обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая
до того, что отравленный не может кивнуть головой. Расстройство походки, а
также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум
в ушах, расстройство зрения.
В случае тяжёлого отравления смерть наступает внезапно
или в течение одних суток. Тяжёлые отравления наступают при приёме внутрь 0,2 -
0,5 г солей бария, смертельная доза 0,8 - 0,9 г.
Для оказании первой помощи необходимо промыть желудок
1 %-ным раствором сульфата натрия или магния. Клизмы из 10 %-ных растворов тех
же солей. Приём внутрь раствора тех же солей (20,0 ч. соли на 150,0 ч. воды) по
столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка
образовавшегося нерастворимого сульфата бария. Внутривенно 10-20 мл 3 %-ного
раствора сульфата натрия. Подкожно - камфора, кофеин, лобелин - по показаниям.
Тепло на ноги. Внутрь слизистые супы и молоко [5].
1.6
Рекомендации по безопасности и охране здоровья
Подходящие приспособления для мытья и другие
санитарные устройства должны быть обеспечены работникам, контактирующим с
токсичными растворимыми соединениями бария, должны быть установлены жесткие
правила индивидуальной гигиены. Курение, еда и питье на рабочем месте должны
быть строго запрещены. Полы в рабочих помещениях должны быть плотными и
регулярно мыться. Необходимо прилагать усилия для снижения концентрации
баритовой пыли в воздухе до минимума. Вдобавок, особое внимание следует уделять
наличию оксида кремния во взвешенной в воздухе пыли.
. Применение
бария и кальция в качестве раскислителя при выплавке стали
барий соединение сталь раскислитель
Рассматриваемая тема научно-исследовательской работы связана с
применением бария, кальция и других щелочноземельных металлов (ЩЗМ) в качестве
раскислителей и модификаторов неметаллических включений.
Анализ литературных данных о влиянии кальция и бария на свойства
углеродистой и низколегированной стали выявил некоторые общие положения о
механизмах модифицирования с использованием ЩЗМ.
Так, например, в ряде работ [6, 7] отмечается снижение загрязненности
модифицированной стали неметаллическими включениями, напрямую связывая этот
факт с наблюдаемым повышением ее жидкотекучести.
Кальций обладает прекрасным химическим свойством - весьма сильным
сродством к кислороду, но в то же время при температурах сталеварения находится
в газообразном состоянии. В результате, при одних и тех же температурах
модифицированный металл содержит меньше равновесного кислорода, а более раннее
и интенсивное образование включений повышает возможность их удаления в ковше и,
особенно, в изложнице. Применение кальциевого сплава для окончательного
раскисления обеспечивает контролируемые состав и форму неметаллических
включений и получение стали с низким содержанием кислорода.
Барий является поверхностно-активным элементом. Присадки бария могут хотя
бы на короткое время существенно понижать поверхностное натяжение стали и за
счет этого разрушать скопления неметаллических включений [8, 9].
Эффективность действия ЩЗМ, как модификаторов, связывали в основном с
очищением межзеренных границ. Это можно объяснить взаимодействием ЩЗМ с
кислородом, серой и фосфором и снижением их остаточных концентраций. Такое
явление имеет место, однако оно не является определяющим. Более существенным
является изменение строения металлического расплава. Оно происходит не только
при нагреве металла до критических температур [10], но и под действием других
факторов, в частности, обработки кальцием [11], который в силу размерного
несоответствия с атомами железа оказывает возмущающее действие на микростроение
расплава и приводит его к более равновесному состоянию. Это сопровождается
увеличением кинематической вязкости стали [10; 11], приводит к более
благоприятным условиям кристаллизации и формированию микроструктуры стали,
обладающей большей пластичностью.
Подобное влияние оказывает и барий. Но в отличие от кальция, он при
температурах ниже 1637 оС не испаряется из жидкой стали, может
частично окисляться и его иногда обнаруживают при микрорентгеноспектральном
анализе включений [7]. Барий из-за большого радиус атома, значительно превышающего
радиус атома железа, и почти в два раза меньшей плотности не способен
удерживаться в жидком расплаве и быстро удаляется. Этому также способствует и
различие в электронном строении атомов бария и железа. Проходя через жидкую
сталь, атомы бария, как и кальция, оказывают сильное возмущающее действие на ее
микростроение, которое приводит к формированию более равновесной структуры
расплава, а в дальнейшем - к кристаллизации металла с повышенными пластическими
свойствами. При введении после предварительного раскисления в жидкую сталь
FeSiCaBa-сплава его частицы после расплавления вступают в активное
взаимодействие с металлом. При этом железо и кремний растворяются в стали, а
оставшиеся жидкие частицы нерастворимого СаВа-сплава взаимодействуют с элементами,
к которым Са и Ва имеют высокое химическое сродство, в частности, с кислородом,
серой, фосфором и углеродом.
Примерное время химического взаимодействия заглубленного в сталь кальция
составляет всего 3-4 минуты [12].
В результате указанных процессов в стали на весьма короткое время, по
существу равное времени пребывания в ней Са и Ва, образуется высокодисперсная
самоорганизующаяся система из частиц Са и Ва, поведение которой и определяет
характер протекания процессов модифицирования. Именно возникновение огромного
множества микро- и наночастиц Ва и Са в металлическом расплаве при локальном
характере введения модификаторов позволяет объяснить и понять возможность
осуществления изменения микростроения и свойств всего объема жидкой стали,
которые в дальнейшем скажутся на изменении свойств готовых изделий.
Атомы бария и кальция в металле и при выходе на границу металл - шлак
соединяются с адсорбированными поверхностноактивными металлоидами (О, S и Р) и
в виде соединений BaO, BaS, ВаЗР2, CaO, CaS и СаЗР2
переходят в шлак. В силу малых размеров они легко поглощаются шлаком,
способствуя снижению содержания кислорода, серы и фосфора в стали.
Механизм модифицирования барием и другими ЩЗМ тесно связан с оптимальным
составом и способом приготовления барийсодержащего модификатора. Известны
способы модифицирования барием при условии подачи каждого из элементов
отдельно, с тем или иным носителем. Отдельно алюминий металлический, отдельно
силикокальций, силикобарий (алюмокальций, алюмобарий), ферроцерий либо
силикоцерий. Имеются представления о том, что эти элементы должны быть
предварительно сплавлены между собой с получением микрокристаллического
сплава-модификатора.
. Анализ
соединений бария, образующихся при его применении в производстве стали
3.1 Контроль
концентрации вредных соединений бария в воздухе рабочей зоны
Содержание вредных веществ в воздухе рабочей зоны подлежит контролю в
соответствии с требованиями методических указаний "Контроль содержания
вредных веществ в воздухе рабочей зоны", утвержденных Минздравом СССР от
29.09.85 г. N 3936-85 и методических указаний "Измерение концентраций
аэрозолей преимущественно фиброгенного действия", утвержденных Минздравом
СССР от 18.11.87 г. N 4436-87 [13-16].
Согласно постановлению от 30 апреля 2003 г. N 76 о введении в действие ГН
2.2.5.1313-03:
«На основании Федерального закона "О санитарно-эпидемиологическом
благополучии населения" от 30 марта 1999 г. N 52-ФЗ (Собрание
законодательства Российской Федерации, 1999, N 14, ст. 1650) и Положения о
государственном санитарно - эпидемиологическом нормировании, утвержденного
Постановлением Правительства Российской Федерации от 24 июля 2000 г. N 554
(Собрание законодательства Российской Федерации, 2000, N 31, ст. 3295)
постановляю:
«Ввести в действие с 15 июня 2003 года гигиенические нормативы
"Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей
зоны ГН 2.2.5.1313-03", утвержденные Главным государственным санитарным
врачом Российской Федерации 27 апреля 2003 г. Г.Г. Онищенко» [15].
Наряду с величинами ПДК в таблице 1 указан класс опасности и
преимущественное агрегатное состояние вещества в воздухе в условиях
производства. По степени воздействия на организм человека вредные вещества
подразделены на четыре класса опасности:- вещества чрезвычайно опасные,-
вещества высоко опасные,- вещества умеренно опасные,- вещества мало опасные, в
соответствии с классификацией ГОСТ 12.1.007-76.
"ССБТ". Вредные вещества. Классификация и общие требования
безопасности"
Величины ПДК и классы опасности веществ утверждает и, при необходимости,
пересматривает Минздрав России. Если в графе "Величина ПДК" приведены
две величины, то это означает, что в числителе максимальная, а в знаменателе -
среднесменная ПДК. В списке ПДК использовано обозначения - (а - аэрозоль)
При одновременном содержании в воздухе рабочей зоны нескольких вредных
веществ разнонаправленного действия (по заключению органов государственного
санитарно - эпидемиологического надзора) ПДК остаются такими же, как и при
изолированном действии.
При одновременном содержании в воздухе рабочей зоны нескольких вредных
веществ однонаправленного действия сумма отношений фактических концентраций
каждого из них (К, К1 ...Kn) в воздухе к их ПДК (ПДК, ПДК1 ... ПДКn) не должна
превышать единицы:
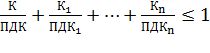 (9)
(9)
Таблица 1 - Предельно допустимые концентрации (ПДК) вредных веществ в
воздухе рабочей зоны [15, 16].
|
Наименование вещества
|
Величина ПДК, мг/м3
|
Преимущественное агрегатное состояние в условиях
производства
|
Класс опасности
|
Формула химического соединения
|
|
Барит
|
6
|
а
|
IV
|
BaSO4
|
|
Бария алюминат
|
0,1
|
а
|
II
|
Ba(AlO2)2
|
|
Бария алюмосиликат
|
1/0,5*
|
а
|
II
|
Ba[Al2Si2O8]
|
|
Бария гидроксид
|
0,3/0,1
|
а
|
II
|
Ba(OH)2
|
|
Бария карбонат
|
1,5/0,5
|
а
|
II
|
BaCO3
|
|
Бария нитрат
|
0,5
|
а
|
II
|
Ba(NO3)2
|
1,5/0,5
|
а
|
II
|
BaTi4O9
|
|
Бария фосфат двузамещенный
|
1,5/0,5
|
а
|
II
|
Ba3(PO4)2
|
|
Бария фторид
|
1/0,2
|
а
|
II
|
BaF2
|
|
Бария хлорид
|
1/0,3
|
а
|
II
|
BaCl2
|
|
Барий
|
0,1
|
а
|
II
|
Ba
|
|
Бария силикат
|
0,5
|
а
|
II
|
BaSiO3
|
|
Бария оксид
|
0,1**
|
а
|
II
|
BaO
|
|
Бария сульфид
|
0,1**
|
а
|
II
|
BaS
|
*Рабочей зоны/среднесуточная
**В документе ГН 2.2.5.1313-03 нет данных о соединениях оксид бария (BaO) и сульфид бария (BaS), поэтому примем ПДК этих веществ
как у бария (Ba), равную 0,1 мг/м3, т. к.
ПДК бария наименьшая.
.2 Соединения
бария, образующиеся при обработке стали на агрегате ковш-печь
В данной работе будут проанализированы соединения бария, образующиеся при
обработке металла на 100 тонном агрегате ковш-печь (АКП).
Для раскисления и модифицирования стали используется кальций в виде
силикокальция (SiCa) и барий в
виде ферроcиликобария (FeSiBa), которые вводятся по очереди. В расчете
рассматривается обработка стали ферроcиликобарием, поэтому система металл-шлак-газ приведена к моменту
окончания обработки стали силикокальцием.
Ферроcиликобарий будут подавать в тот
момент, когда в стали достигнуты требуемые содержания химических элементов,
кроме кремния и кислорода, а так же в металле не достигнуты низкое содержание и
необходимая форма неметаллических включений.
В качестве примера, выбрана сталь марки 09Г2С, в которую будет добавлятся
барий в виде ферросиликобария - 35 (FeSiBa35).
Определены исходные данные о составе и количестве газовой фазы, шлака,
металла и модифицирующей добавки для расчета в программе «TERRA»:
- Газовая фаза (воздух, при 20 0С и давлении 1 атм).
Количество воздуха 5 м3/т стали или 6 кг/т стали. При этом его
химический состав представлен в таблице 2:
Таблица 2 - Химический состав воздуха, %
- Шлак. При кратности 1 % масса шлака 1000 кг. Его химический
состав представлен в таблице 3:
Таблица 3 - Химический состав шлака, %
|
CaO
|
Al2O3
|
SiO2
|
MgO
|
|
55
|
35
|
5
|
5
|
- Металл (сталь марки 09Г2С). Масса металла принята равной 100
тоннам. Химический состав представлен в таблице 4:
Таблица 4 - Химический состав металла, %
|
C
|
Si
|
Mn
|
S
|
P
|
Cr
|
Ni
|
O
|
Fe
|
|
0,12
|
0,65
|
1,5
|
0,04
|
0,035
|
0,3
|
0,3
|
0,3
|
0,01
|
96,745
|
- Модифицирующая добавка (ферросиликобарий, FeSiBa35). Количество ферросиликобария 0,5
кг/т стали. Его химический состав представлен в таблице 5:
Таблица 5 - Химический состав металла ферросиликобария (FeSiBa35), %
Для ввода в программу «TERRA»
все данные были приведены к одной единице измерения - к килограммам. Исходные
данные по всем химическим элементам для ввода в программу «TERRA» представлен в таблице 6:
Таблица 6 - Количество химических элементов, кг
|
C
|
Si
|
Mn
|
S
|
P
|
Cr
|
Cu
|
|
120
|
680
|
1500
|
40
|
35
|
300
|
300
|
|
Ni
|
O
|
Fe
|
Al
|
Mg
|
Ba
|
N
|
|
300
|
504,52
|
96747,5
|
185,29
|
30
|
17,5
|
474
|
Для определения соединений бария и их количества данные о составе
металла, шлака и газа введены в программу «TERRA» (рисунок 1):



Рисунок 1 - Исходный химический состав системы «металл - шлак - газ»
введенный в программу «TERRA»
Так же в качестве исходных данных были приняты давление P= 0,1 МПа и
температура от 1800 до 3300 К, с шагом 20 К.
В результате были получены соединения бария и их концентрации при
различных температурах.
Были получены следующие соединения :
барий (Ba);
оксид бария (BaO);
сульфид бария (BaS);
силикат бария (BaSiO3);
алюминат бария (BaAl2O4).
График показывающий зависимость концентрации этих веществ от температуры
представлен на рисунке 2.
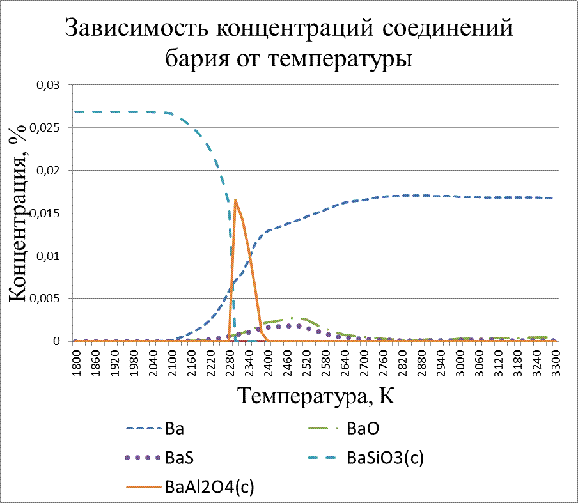
Рисунок 2 - Зависимость концентраций соединений бария от температуры
Далее было убрано вещество Ba2, так как концентрация Ba2 значительно ниже концентрации
остальных полученных соединений бария.
В итоге были выбраны четыре температуры при которых наблюдалось
значительное изменение концентрации какого-либо вещества.
Первая температура 2040 К. При этой температуре начинается снижение
концентрации силиката бария (BaSiO3(с)) и
повышение бария (Ba) за счет
распада BaSiO3 на Ba и SiO2.
Третья температура 2460 К. При этой температуре наблюдаются наивысшие
концентрации веществ: оксида бария (BaO) и сульфид бария (BaS).
Четвертая температура 2840 К. При этой температуре наблюдаются наивысшая
концентрация бария (Ba).
Далее для выбранных температур рассчитаем количество веществ найденных
соединений с учетом годовой производительности агрегата ковш-печь равной 1,2
млн. т/год. Примем равными нулю концентрации веществ, значения которых менее
0,001 %. Выбранные температуры и концентрации веществ представлены в таблице 2.
Таблица 2 - Концентрации найденных веществ в зависимости от температуры,
%
|
T, К
|
Ba
|
BaO
|
BaS
|
BaSiO3(c)
|
BaAl2O4(c)
|
|
2040
|
0
|
0
|
0
|
0,0269
|
0
|
|
2320
|
0,008
|
0,001
|
0,001
|
0
|
0,0143
|
|
2460
|
0,014
|
0,00275
|
0,00184
|
0
|
0
|
|
2840
|
0,017
|
0
|
0
|
0
|
0
|
Рассчитаем количества веществ для каждой из выбранных температур с учетом
годовой производительности. Для этого умножим каждую концентрацию на годовую
производительность 1,2 млн. т/год. Результаты представлены в таблице 3.
Таблица 3 - Количество веществ найденных соединений.
|
T, К
|
Количество вещества Bi, т
|
|
Ba
|
BaO
|
BaS
|
BaSiO3(c)
|
BaAl2O4(c)
|
|
2040
|
0
|
0
|
0
|
32232
|
0
|
|
2320
|
9600
|
1171,135
|
1084,352
|
0
|
17124
|
|
2460
|
16836
|
3300
|
2208
|
0
|
0
|
|
2840
|
20496
|
194,3364
|
0
|
0
|
0
|
Рассчитаем коэффициент агрессивности для каждого вещества Ai.
Формула нахождения агрессивности вещества:
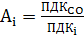 (10)
(10)
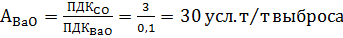
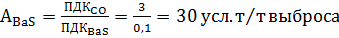
Тогда приведенная масса выбросов Мпр за год для количеств
веществ, соответствующих выбранным температурам рассчитывается по формуле (11):
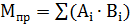 (11)
(11)
T2=2320 К
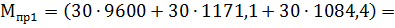 355665 усл. т/год
355665 усл. т/год
T3=2460 К
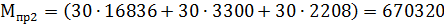 усл. т/год
усл. т/год
T4=2840 К
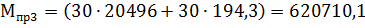 усл. т/год
усл. т/год
Приведенная масса выбросов Мпр на тонну стали:
 усл. т/т стали
усл. т/т стали
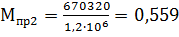 усл. т/т стали
усл. т/т стали
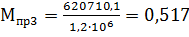 усл. т/т стали
усл. т/т стали
Вывод. Соединения бария полученные при расчете в программе «TERRA»
относятся ко II классу опасности, т. е. являются высоко опасными веществами.
Эти вещества подлежат контролю, т. к. они входят в состав вредных веществ
содержащихся в воздухе рабочей зоны.
Выводы
Основной задачей расчетов было определение вредных составляющих газовой
фазы и их возможного влияния на организм человека. Анализ соединений,
образующихся при взаимодействии между компонентами газовой, шлаковой и
металлической фаз, показал возможное образование бария, а также оксидов и
сульфидов бария.
Взаимодействие бария с воздухом сводится к образованию гидроксидов бария
(при переменном составе присадок бария). При увеличение присадок бария без изменения
состава и количества воздуха гидроксиды бария начинают разлагаться (при
температуре 1300-1400°С) и образовывать оксид бария (BaO). При неизменном
содержании бария и последующем увеличении присадок воздуха состав газовой фазы
был представлен прежде всего гидрооксидом бария и оксидом бария.
Поэтому в процессе выплавки стали с применением барийсодержащих
модификаторов необходимо блокировать подсосы воздуха при подаче ферросплава
(обеспечить минимальную вытяжку).
При взаимодействии бария с компонентами шлаковой фазы (плавиковым шпатом
и алюминиевым шлаком) возможно образование соединений хлорида и фторида бария,
которые входят в состав вредных веществ содержащихся в воздухе рабочей зоны и
подлежат контролю. Данные соединения выделяются в газовую фазу при температуре
1600-1650° С, при 1700° С отмечается образование соединений BaF2 и
BaCl2. В связи с этим шлакообразующие целесообразнее подавать при
низких температурах (меньше 1650° С) и обязательно в виде проволоки в глубину
расплава.
Список
использованных источников
1. <http://files.school-collection.edu.ru/dlrstore/965cf8d9-b573-fd22-b97b-9753e36f6ee1/1011837A.htm>
. <http://protown.ru/information/hide/5546.html>
. <http://mirznanii.com/a/327151/mirovaya-ekonomika-barit-tselestinovogo-syrya>
. <http://geo.web.ru/db/msg.html?uri=glava_9.htm&mid=1172887>
. <https://ru.wikipedia.org/wiki/%D0%91%D0%B0%D1%80%D0%B8%D0%B9>
6. Гольдштейн
Я.Е., Мизин В.Г. Модифицирование и микролегирование чугуна и стали. М.:
Металлургия, 1986. 270 с.
7. Голубцов
В.А. Теория и практика введения добавок в сталь вне печи // Черная металлургия.
Бюлл. НТИ. 2005. №12 с.45-50.
8. Рябчиков
И. В. Ферросплавы с редкоземельными и щелочноземельными металлами. М.:
Металлургия, 1983. 272 с.
9. Заславский
А.Я., Гусева З.Ф., Комиссарова Т.А., Филимонов С.Г. Влияние бария на
механические свойства стали, содержащей кальций // Металлы, 1986, № 3, с.
66-70.
. Баум
Б.А., Хасин Г.А., Тягунов Г.В. и др. Жидкая сталь. М. Металлургия. 1984. 208с.
. Гудов
А.Г. Исследование особенностей структурных состояний расплавов железа с целью
повышения эксплуатационных свойств твѐрдого металла. Автореферат дис. на
соиск .ученой степени к.т. н. Екатеринбург. 2005. 24с.
. Попель
С.И., Дерябин А.А. и др. Изв.ВУЗов. Черная металлургия. 1969. №7. с 38-41.
13. ГОСТ
12.1.007-76. "ССБТ". Вредные вещества. Классификация и общие
требования безопасности".
14. Общесоюзные
санитарно-гигиенические и санитарно-противоэпидемические правила и нормы
"Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей
зоны" (утв. Главным Государственным санитарным врачом СССР 26 мая 1988 г.
N 4617-88, с изменениями от 11 сентября 1991 г., 19 мая 1994 г.)
. ГН
2.2.5.1313-03 Химические факторы производственной седы. Предельно допустимые
концентрации (ПДК) вредных веществ в воздухе рабочей зоны. Гигиенические
нормативы. в редакции ГН 2.2.5.1827-03 дополнение № 1, ГН 2.2.5.2100-06
дополнение № 2, ГН 2.2.5.2241-07 дополнение № 3, ГН 2.2.5.2439-09 (дополнение №
4, ГН 2.2.5.2536-09 дополнение № 5) Зарегистрировано в Минюсте РФ 19 мая 2003
г.
. Перечень
основных действующих нормативных и методических документов по гигиене труда с
письмом Главного государственного санитарного врачам РФ от 6 января 2004 г. N
2510/92-04-32 "О действующих нормативных и методических документах по
гигиене труда" Методические рекомендации по гигиене труда и
оздоровительные мероприятия при работе с соединениями бария 1192-74