|
Абиотические факторы
|
Биотические факторы
|
|
Нагрузка на активный ил по БПК (ХПК)
|
Автохтонная микрофлора и фауна
|
|
Химический состав сточных вод
|
Аллохтонная микрофлора и микрофауна
|
|
Присутствие токсикантов
|
Взаимоотношения типа «хищник-жертва»
|
|
Сбалансированность питания
|
Скорость репродукции
|
|
Тип сооружения, определяющий размер биотопа (период
аэрации, гидравлические нагрузки)
|
Другие факторы
|
|
Уровень растворенного кислорода
|
|
|
Эффективность перемешивания иловой смеси
|
|
|
Температура
|
|
|
Активная реакция рН
|
|
|
Другие факторы
|
|
В условиях постоянного воздействия указанных абиотических факторов
местообитания организмов активного ила достаточно сложно формируются
биотические условия. В частности, на формирование сложного биоценоза активного
ила оказывают влияние ассоциативные взаимоотношения аллохтонной микрофлоры и
фауны, поступающей со сточной водой, с одной стороны, и автохтонных организмов,
постоянно присутствующих в биоценозе - с другой.
Одним из важнейших абиотических факторов развития экосистемы активного
ила является перемешивание путем аэрирования смеси ила и сточной воды,
благодаря чему обеспечивается снабжение кислородом смешанной популяции
организмов ила, распределенной в занимаемом пространстве аэротенка.
Основными компонентами слизистой матрицы хлопьев активного ила являются
внеклеточные полимерные вещества (ВПВ). В настоящее время наиболее известным
механизмом образования хлопьев ила является полимерно-мостиковый механизм.
.2 Биотрансформация соединений азота ,фосфора и серы
Биотрансформация соединений азота
Перед сооружениями биологической очистки ставится задача глубокого
удаления всех форм азотсодержащих веществ, что осуществляется в сложных
многостадийных процессах, которые требуют обеспечения различных условий среды.
В сточных водах азот представлен в основном в виде минеральной ( ,
,  ,
,  ) и органической (аминокислоты, белок
тканей организмов, органические соединения) составляющих. Методами химического
анализа определяются четыре формы: азот аммонийный, нитриты, нитраты, азот
общий или азот по Кьельдалю, который включает азот органический и азот
аммонийный (нитриты и нитраты отсутствуют в анализируемой пробе или
улетучиваются в процессе пробоподготовки).
) и органической (аминокислоты, белок
тканей организмов, органические соединения) составляющих. Методами химического
анализа определяются четыре формы: азот аммонийный, нитриты, нитраты, азот
общий или азот по Кьельдалю, который включает азот органический и азот
аммонийный (нитриты и нитраты отсутствуют в анализируемой пробе или
улетучиваются в процессе пробоподготовки).
В бытовых сточных водах азот - основная часть органических веществ,
представляющих конечные продукты метаболизма азота в организме человека. В виде
аммиака или мочевины в бытовых сточных водах присутствует 80-90% всех
азотсодержащих веществ. Аммонификация - это бактериальное превращение
органических соединений азота в неорганические формы, основной из которых является
аммиак, накапливающийся в процессе дезаминирования в результате протеолиза
белков растительного и животного происхождения, осуществляемого гетеротрофными
гнилостными (аммонифицирующими) бактериями в канализационной сети. Кроме
аммиака в результате аммонификации образуется фосфор и сероводород. Однако
этому процессу препятствуют низкая температура (менее 10 ºС), кислая рН, недостаточное время
нахождения сточных вод в системе.
Нитрификация ¾ сложный многоступенчатый процесс. Осуществляется в результате жизнедеятельности
и функциональной активности нитрифицирующих бактерий, которые относятся к
хемосинтезирующим автотрофам; присутствие в среде органических соединений
пагубно отражается на их развитии, поэтому нитрификация аммонийного азота
начинается в аэротенках только после практически полного окисления
углеродсодержащих соединений, характеризуемых показателем БПК. Ввиду того, что
нитрификация, достаточно медленный процесс, который еще более замедляется и
угнетается при недостатке растворенного кислорода в иловой смеси. Минимально
необходимое содержание растворенного кислорода для обеспечения начальной стадии
нитрификации должно превышать 1 мг/дм3. Нитриты - продукт неполного
окисления аммонийного азота.
Также нитрификаторы чувствительны к неприродной органике (пестициды,
гербициды) и к токсикантам: к цианистому калию, цианидам (0,65 мг/дм3),
фенолу, анилину, окиси углерода, метану, цинку, меди, никелю, ртути, хрому.
Практически все тяжелые металлы являются угнетающими нитрификаторов
токсикантами.
После того как органические вещества минерализуются, создаются условия
для развития бактерий - возбудителей первой фазы нитрификации, которую
осуществляют бактерии нескольких родов. Основными из них являются Nitrosomonas,
Nitrosocystis, Nitrosospira, Nitrosococcus, Nitrosolobus,
Nitrosovibrio.
Первая стадия нитрификации, окисление солей аммония в нитриты, протекает
по уравнению:
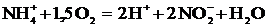 .
.
Наиболее благоприятная реакция среды для нитрифицирующих бактерий,
обеспечивающих первую стадию нитрификации, находится в интервале рН
7,2-8,6, особенно чувствительны они к сдвигу рН в кислую область.
Вторая стадия нитрификации - образование нитратов начинается только при
успешном завершении первой, поскольку избыток аммиака тормозит развитие
возбудителей второй фазы нитрификации. Вторая стадия нитрификации заключается в
окислении образовавшихся в первой фазе солей азотистой кислоты в соли азотной
кислоты. Процесс протекает в соответствии с уравнением
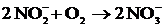 .
.
Осуществляют вторую стадию нитрификации бактерии родов Nitrobacter,
Nitrospina, Nitrococcus Nitrocystis, Nitrospira.
Единственным субстратом окисления для них являются нитриты. Скорости роста
бактериальной биомассы Nitrobacter (образование азота нитратов)
значительно бóльшие, чем Nitrosomonas (образование азота нитритов).
Бактерии второй стадии еще более чувствительны к неблагоприятным условиям
среды: содержанию растворенного кислорода, рH. В кислой среде эти бактерии не
развиваются, так как недиссоциированная молекула азотной кислоты для них
ядовита. В щелочной среде на них отрицательно влияет недиссоциированный ион
аммония. По этой причине бактерии второй стадии нитрификации функционируют в
узких пределах нейтральных значений рН 7,0-7,6. Нитратпродуцирующие бактерии
более требовательны к содержанию растворенного кислорода (при его содержании
3,5 мг/дм3 нитрификация на второй стадии достигает максимальных
значений). На окисление 1 мг нитритов до нитратов требуется 3,4 мг кислорода.
Для успешного протекания процесса нитрификации необходимо не только
поддерживать в иловой смеси достаточное количество растворенного кислорода, но
и подавать в 2-3 раза больше воздуха в начало аэротенка и в регенераторы, чем в
другие зоны аэротенков, а также обеспечить удовлетворительный режим удаления
ила из вторичных отстойников для предупреждения его залежей и возрастания в нем
кислородпоглощаемости.
Также для удовлетворительной нитрификации необходимы низкие нагрузки на
активный ил и большой возраст ила (не менее 4-5 сут). За счет большого возраста
ила удается сохранять необходимую численность нитрификаторов. Поддержание
низкого возраста предполагает более частую отгрузку ила и значительные потери
нитрификаторов, которые медленнее восстанавливают свою численность, чем
гетеротрофные бактерии. Поддержание возраста ила свыше 8-ми суток позволяет в
нитрифицирующем иле полностью восполнять потери нитрифицирующих бактерий,
вымывающихся потоком сточных вод и удаляемых при сбросе избыточного ила.
Наличие незначительных количеств окисленных форм азота в очищенных водах
свидетельствует об удовлетворительно завершенном процессе окисления органики и
начавшейся нитрификации. Присутствие NH4 (более 2,0 мг/дм3)
и NO2 (в десятых долях единиц) в очищенных водах говорит о
недостаточной глубине нитрификации. На сооружениях биологической очистки,
обеспечивающих глубокую нитрификацию, в очищенных водах весь азот представлен в
основном в форме нитратов, его содержание составляет не менее 5,0-6,0 и может
достигать 40,0 и более мг/дм3. Нитриты редко достигают десятых долей
единиц, даже если их образуется много в результате незавершенного процесса
нитрификации, они в значительной степени окисляются в процессе хлорирования и в
очищенных водах присутствуют в сотых долях единиц, а аммонийный азот не
превышает 1,0 мг/дм3.
Падение удельных нагрузок на активный ил (количество органических
загрязнений, выраженное показателем БПК, приходящееся на грамм сухого вещества
ила) позволяет повысить эффективность очистки, усилить нитрификацию и
провоцирует развитие денитрификации.
Таким образом, во вторичных отстойниках при ухудшении аэрационных условий
(содержание растворенного кислорода менее 1 мг/дм3) для хорошо
нитрифицирующего активного ила, особенно в летний период, в дневное время,
когда толща воды хорошо прогревается, могут наблюдаться явления денитрификации.
Денитрификация осуществляется многоступенчато. В основном ее обеспечивают
денитрифицирующие бактерии: Thiobacillus denitrificans, Pseudomonas
fluorescens, Ps. aeruginosa, Nitrococcus. Нитраты
используются микроорганизмами-денитрификаторами как акцепторы электронов. Для
их нормальной жизнедеятельности требуются бескислородные условия. К токсическому
действию поллютантов денитрификаторы менее чувствительны, чем нитрификаторы.
При денитрификации выделяется кислород - 2,86 мг при распаде нитратов и 1,73 мг
при распаде нитритов на 1 мг азота.
Процесс одновременной нитрификации-денитрификации постоянно присутствует
на всех сооружениях, обеспечивающих глубокую нитрификацию, поскольку всегда
имеются анаэробные зоны на разных участках биологической очистки. На
сооружениях биологической очистки сам по себе процесс денитрификации
положительный, поскольку позволяет освобождать воду от окисленных форм азота, а
сочетанием процессов нитрификации и денитрификации можно снижать содержание
неорганического азота на 90% и общего азота на 80-95%. Однако денитрификация
при обычной схеме очистки происходит в основном во вторичных отстойниках,
особенно часто в летний период и сопровождается значительным выносом хлопьев
активного ила, чему способствует образующийся газообразный азот в иловой массе
на дне вторичных отстойников. Кроме того, свободный азот образуется внутри
хлопьев, разрывает их, измельчает, и вынос взвешенных веществ еще более
усугубляется, так как рваные хлопья плохо флокулируют и коагулируют во
вторичных отстойниках.
На этих свойствах ила обеспечивать денитрификацию в условиях ухудшения
кислородных условий была предложена технология нитрификации-денитрификации.
1.3 Биотрансформация фосфора
В сточных водах фосфор может присутствовать в разных состояниях: в
растворенном, коллоидном и взвешенном. В нерастворимом состоянии фосфор в
основном находится на взвешенных частицах в виде труднорастворимых фосфатов
(например, многообразные соединения кальция и фосфора, как правило,
малорастворимые) и белковых органических веществ. Нерастворимый фосфор, прочно
связанный с другими соединениями, присутствующими в сточных водах, абсолютно
инертен для биологического процесса очистки и, поступая в водоем в виде
устойчивых минералов подобных ортофосфату кальция, не обогащает его фосфором, а
захоранивается в донных осадках. В поступающих на очистку сточных водах
основная доля соединений фосфора представлена в виде коллоидной и растворенной
форм фосфатов и ортофосфатов и растворенных форм полифосфатов. Фосфаты и
полифосфаты гидролизуются в результате биологической очистки в ортофосфаты, а
органический фосфор частично переходит в ортофосфаты, частично усваивается
активным илом, а частично остается в очищенных водах. Взвешенные формы
соединений фосфора частично осаждаются в первичных отстойниках, а частично
сорбируются на активном иле.
В биологических процессах, как на сооружениях биологической очистки, так
и в водоемах, принимающих сточные воды, участвуют растворимые биологически
усваиваемые формы фосфатов. Минеральный фосфор в растворенном состоянии - это
ортофосфорная кислота и ее анионы (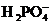 ,
,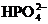 ,
,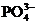 ). Органический фосфор в бытовых
сточных водах - это в основном метаболиты человека; полифосфаты органические -
это нуклеиновые кислоты; нуклеопротеиды - продукты жизнедеятельности гидробионтов
и человека. При гидрохимическом контроле трудно разделить общий фосфор на
составляющие растворимые, нерастворимые формы органического и минерального
фосфора.
). Органический фосфор в бытовых
сточных водах - это в основном метаболиты человека; полифосфаты органические -
это нуклеиновые кислоты; нуклеопротеиды - продукты жизнедеятельности гидробионтов
и человека. При гидрохимическом контроле трудно разделить общий фосфор на
составляющие растворимые, нерастворимые формы органического и минерального
фосфора.
ПДК полифосфатов (триполифосфат и гексаметафосфат) в воде водоемов,
используемых для питьевого, хозяйственно-бытового водоснабжения, для
рекреационного водопользования, а также в черте населенных мест, составляет 3,5
мг/дм3 в пересчете на ортофосфат-анион 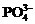 , лимитирующий показатель вредности -
органолептический. Для рыбохозяйственных водоемов ПДК полифосфатов составляет
от 0,05 до 0,2 мг/дм3 в зависимости от трофности водоема.
, лимитирующий показатель вредности -
органолептический. Для рыбохозяйственных водоемов ПДК полифосфатов составляет
от 0,05 до 0,2 мг/дм3 в зависимости от трофности водоема.
В аэробных условиях аэротенков полифосфаты и ортофосфаты усваиваются
организмами активного ила, а растворенные формы органического фосфора
минерализуются в ортофосфаты при помощи бактерий Moraxella, Artrobacter,
Bacteria subtilis и т.п.
Определенные группы бактерий активного ила обладают способностью
накапливать в своих клетках (в полифосфатных гранулах, так называемых зернах
волютина) растворенные формы фосфора, т.е. откладывать в запас для последующего
потребления. Таким образом, эти бактерии способны потреблять фосфора больше,
чем его требуется на прирост биомассы и энергетические потребности. В
литературе в основном при описании фосфорнакапливающих бактерий упоминается Acinetobacter,
однако таких бактерий в активном иле довольно много, это широко
распространенные роды: Pseudomonas, Aerobacter, Beggiatoa,
E.coli, Aeromonas, Zoogloea ramigera, так и реже
встречающиеся: Klebsiella, Enterobacter, Moraxella, Mycobacterium
и многие другие.
Кроме того, установлено, что нитрифицирующие бактерии также способны
накапливать полифосфаты в составе метахроматиновых гранул. Все указанные
бактерии отличаются от других микроорганизмов активного ила тем, что накопление
соединений фосфора в их клетках составляет довольно значительную величину -
1-3% сухой массы тела. Так, Acinetobacter calcoacitiaes
накапливает в аэробных условиях 0,4-0,5 ммоль/г сухой массы клетки за 1 ч и в
анаэробных условиях выделяет за 1 ч 0,015 ммоль/г сухой массы клетки. За счет
депонирования полифосфатов в клетках активного ила из сточных вод изымаются
растворимые соединения фосфора. Причем, в обычных условиях полной биологической
очистки с последующей нитрификацией, если нитрификация не глубокая (NO3-N
не более 5-6 мг/дм3), за счет потребления фосфатов бактериями в
аэротенках удаляется 10-30% растворенных форм фосфора. При понижении рН
сточных вод повышается растворимость фосфатов, и усиливаются оба процесса:
изъятие и накопление в иле и осаждение на нем в результате биофлокуляции, что
позволяет достичь в процессе биологической очистки 50% удаления соединений
фосфора.
Остальное количество нерастворимых соединений фосфора улавливается
активным илом в результате биосорбции, накапливаясь в избыточном активном иле и
с выносом взвешенных веществ из вторичных отстойников, попадает в природный
водоем, депонируясь в донных осадках.
Микроорганизмы, способные накапливать внутриклеточно в гранулах волютина
ортофосфаты, полифосфаты и связанный органический фосфор, используют его как
энергетический резерв, расходуемый на потребление субстрата в анаэробных
условиях. Эти бактерии в анаэробных условиях потребляют простые легкоокисляемые
органические субстраты, например, летучие жирные кислоты (среди которых
излюбленная уксусная кислота) и запасают их внутри клетки в виде
полигидроксиалканатов (наиболее распространен поли-b-гидроксибутират (ПГБ)), что
сопровождается внутриклеточной деградацией накопленных в аэробной стадии
соединений фосфора (рисунок 3, а). Энергия деградации (гидролизиса)
фосфатов расходуется на накопление и потребление легкоокисляемой органики,
клеточный синтез и транспортный перенос в процессе дыхания в анаэробных
условиях. Эти процессы сопровождаются отдачей накопленного клеткой фосфора в
воду.
При попадании бактерий в аэробную стадию накопленный субстрат в виде
полигидроксиалканатов начинает потребляться как источник углерода на питание и
прирост биомассы бактерий, что сопровождается выделением углекислого газа и
воды и повышенным потреблением из окружающей среды фосфатов ,которые
откладываются в клетках в полифосфатных гранулах.
Запасы фосфора в клетках бактерий могут достигать одной пятой части от
запасов азота в благоприятных и сокращаться до одной тридцатой части в
неблагоприятных для накопления фосфатов условиях. На вышеописанной цикличности
накопления и использования энергии накопленных соединений фосфора в клетках
бактерий основана технология глубокого изъятия из сточных вод соединений
фосфора при сочетании анаэробных и аэробных стадий биологической очистки.
Поддержание условий для благоприятного протекания анаэробного процесса, -
наличие восстановителей и полное отсутствие кислорода (даже химически
связанного), - играет решающую роль в дефосфотации. Биологический метод
глубокого удаления биогенных веществ (N, P) из сточных вод при сочетаниях
аэробной, аноксидной и анаэробной стадий очистки позволяет на реальных
сооружениях биологической очистки добиться содержания общего фосфора в
очищенных водах 1,0-1,5 мг/дм3, а содержания общего азота - 8-10
мг/дм3, включая белковый, аммонийный, нитритный и нитратный. Более
глубокого удаления фосфора - до 0,5 мг/дм3 удается достичь только
при дополнительном использовании реагентов.
2. Методы анализа микробных сообществ
2.1 Флюоресцентная in situ гибридизация
Основной проблемой, возникающей при исследованиях микробных агрегатов,
является непостоянство структуры и состава агрегатов, развивающихся в реальных
системах. Микробные агрегаты, образующиеся в системах очистки сточных вод,
состоят, в общем, из воды (часто более чем на 90 %), ВПВ (которые могут
составлять вплоть до 90 % от общего количества органических веществ), клеток,
различных неорганических частиц, сорбированных ионов, полярных и
неполярных органических молекул. В некоторых системах микробные агрегаты
аккумулируют значительное количество частиц неорганической природы, благодаря
адгезивным свойствам ВПВ. Эти частицы могут вносить существенный вклад в общую
массу агрегатов и превышать собственный вес биомассы. Так, например, биопленка
может выступать в роли своеобразного «клея», накапливая на своей поверхности
различные частицы. Таким образом, при отборе проб и исследованиях микробных
агрегатов обязательно необходимо учитывать присутствие абиотических
компонентов. Отбор флокул, микробных гранул и биопленки на взвешенных частицах
материала-носителя из реактора не представляет особой сложности. Иначе обстоит
дело с биопленкой в твердом фиксированном слое, так как большинство методов
анализа требует отделения части биопленки от поверхности подложки-носителя, и
лишь немногие методы позволяют анализировать биопленку непосредственно на
поверхности материала-носителя. Для удобства отбора проб биопленки
рекомендуется предусматривать в реакторе съемные части материала - носителя.
Существенно облегчают задачу мониторинга биопленки методы, позволяющие
проводить анализы in situ, т. е. непосредственно в системе исследования (основные из них будут
описаны ниже) [1]. Работа по созданию простых, точных и недеструктивных методов
для мониторинга микробных агрегатов в реальном времени является весьма
актуальной, и продолжается по сей день.
Важную роль в микроскопических исследованиях микробных агрегатов играют
также методы фиксации и хранения препаратов. Особенно широкое распространение в
последние годы получил метод криосекционирования биопленки и хранения
препаратов в замороженном виде.
Замороженные образцы биопленки могут храниться неограниченный срок и не
требуют дорогого оборудования или специального обслуживания.
Криосекционирование позволяет проводить множество анализов биопленки на одном
образце и, в отличие от применения нескольких цитохимических и молекулярных
методов, позволяет сохранять морфологию биопленки in situ. При отборе пробы необходимо
немедленно помещать образец (частицу носителя с биопленкой) в пробирку с
охлажденным, свежеприготовленным фиксатором и хранить на льду во время
транспортировки, чтобы предотвратить деформации. Пробы биопленки, которые
предполагается исследовать с применением иммуноцитохимических или ферментных
методов, лучше замораживать без фиксатора, чтобы не снижать реакционную
способность. Пробы, как правило, фиксируются свежеприготовленным раствором
параформальдегида в фосфатном буфере (рН=7,2), при этом конечная концентрация
параформальдегида в пробирке с образцом должна составлять 4 %. Затем пробирка
помещается на лед или в холодильник на 1-3 часа. Параформальдегид является
предпочтительным фиксатором в методе флюоресцентной in situ гибридизации (Fluorescent In Situ Hybridisation - FISH) для большинства Грам-отрицательных
бактерий. Для гибридизации большинства Грам-положительных бактерий
рекомендуется предварительно фиксировать пробы 50% раствором этанола при
температуре -20 0С. После фиксации образцы биопленки промываются
фосфатным буфером для удаления излишков фиксатора, а затем заключаются в
криогель. Некоторые способы окрашивания предпочтительнее применять до
заключения биопленки в криогель, при этом концентрированный краситель
добавляется в раствор фосфатного буфера при последней промывке. Излишки
красителя в этом случае удаляются промывкой фосфатным буфером за 10 мин до
помещения образца в криогель. В настоящее время разработано множество
специальных криогелей, отличающихся вязкостью и криозащитными свойствами
(способностью снижать образование кристаллов льда).
Некоторые не очень твердые носители для биопленки могут подвергаться
криосекционированию вместе с биопленкой, например мембраны, частицы растений,
некоторые виды пластика или минералов. В противном случае необходимо осторожно
погрузить в гель образец биопленкой вниз, а после замораживания аккуратно
удалить подложку-носитель. После погружения в гель образец выдерживают 15-30
мин при комнатной температуре, а затем замораживают. Замораживание необходимо
производить как можно быстрее, чтобы предотвратить образование кристаллов льда.
Для этого используют камеры глубокого замораживания или жидкий азот. Хранят
образцы в пластиковых пробирках при температуре -80 0С. При
криосекционировании важно, чтобы лезвие и рабочая поверхность криотома имели
одинаковую температуру перед началом процедуры. Для криосекционирования
биопленки наиболее оптимальной считается температура между -28 0С и
-19 0С. Образец предварительно помещают в камеру криостата примерно
на 30 мин для достижения равновесия по температуре. Срезы помещают на
предварительно обработанные и покрытые силаном предметные стекла. Такие стекла
не позволяют срезам биопленки деформироваться и смещаться при дальнейшей
обработке и хорошо сохраняют срезы в замороженном виде в течение нескольких
месяцев.
Срезы биопленки, полученные методом криосекционирования, можно окрашивать
различными способами и красителями, в зависимости от цели исследования, а также
провести FISH-анализ.
Гибридизация
Метод флюоресцентной in situ гибридизации (FISH)
позволяет идентифицировать индивидуальные бактериальные клетки путем инкубации
среза биопленки или гранулы непосредственно на предметном стекле вместе с
раствором генных зондов. Генный зонд представляет собой искусственно полученный
комплекс, состоящий из фрагмента специфической РНК - олигонуклеотида, содержащего
от 10 до 18 нуклеотидов, и флюоресцентной молекулы-маркера. При инкубации
клеток с раствором генных зондов происходит гибридизация между денатурированной
ДНК клеток и одноцепочечной РНК зонда, т.е. образование дуплекса ДНК-РНК в
результате взаимодействия комплементарных нуклеотидов. В процессе
микроскопирования необходимо установить длину волны, активизирующую
флюоресцентную молекулу-маркер и гибридизированные клетки можно будет наблюдать
в поле микроскопа. В настоящее время разработаны генные зонды, позволяющие
различать группы микроорганизмов на всех филогенетических уровнях. В таблице
2.1 представлены генные зонды, наиболее часто применяемые в экспериментальных
исследованиях.
Для каждой пробы, подготовленной к гибридизации, делают раствор гибридизационного
буфера (примерно 5 мл) и буфера для промывки препарата (примерно 50 мл). Состав
этих буферных растворов зависит от характера применяемого зонда.
Гибридизационный буфер, как правило, состоит из 0,9 М NaCl, 20 mM Tris/HCl, 0,01 % додецилсульфата натрия и формамида от 0 до 50
%, в зависимости от требуемой точности при применении данного генного зонда.
Буферный раствор для промывки имеет тот же состав, что и гибридизационный
буфер, но без формамида, а раствор NaCl добавляют в таком количестве, чтобы сохранить соотношение компонентов,
согласно прописи для ДНК-РНК гибридов. В соответствии с этим соотношением
необходимо вдвое сокращать концентрацию соли в промывочном буфере с каждым
возрастанием на 10 % использованной в гибридизационном буфере концентрации
формамида, то есть от 0,9 М NaCl
для 0 % формамида до 0,03 М NaCl
для 50 % формамида. Техника выполнения процедуры гибридизации предполагает
использование перчаток во избежание загрязнения препаратов и растворов
рибонуклеазой с поверхности рук. На небольшую (менее 1 см2) площадь
предметного стекла с пробой наносят 1 мкл раствора генного зонда и 8 мкл
гибридизационного буфера. Осторожно перемешивают кончиком пипетки каплю
нанесенных растворов, не задевая сам препарат и предметное стекло. Затем
необходимо аккуратно положить предметное стекло в пластиковую пробирку с
крышкой, поместить туда же полоску фильтровальной бумаги, смоченную 2 мл
гибридизационного буфера. Инкубацию проводят в плотно закрытых пробирках при 46
0С в течение 1,5 часа. После этого быстро переносят предметные
стекла в предварительно подогретый промывочный буфер и оставляют при 48 0С
на 15-20 минут. После промывочного буфера осторожно смывают остатки соли с
препарата дистиллированной водой, а затем проводят окрашивание препарата
4,6-диамидин-2-фенилиндолом. Дополнительное неспецифическое окрашивание
рекомендуется для проверки качества проведенной гибридизации: если при
микроскопировании препарата количество клеток, окрашенных
4,6-диамидин-2-фенилиндолом превышает количество гибридизированных клеток,
значит, гибридизации подверглись не все целевые клетки или препарат содержит
клетки, не идентифицируемые данным генным зондом. После окрашивания необходимо
оставить препарат для сушки на воздухе в темном месте. Данный метод требует
особой аккуратности, чтобы не смыть и не повредить препарат в ходе всех
процедур, а также большой осторожности, так как используемые реактивы
(формамид, 4,6-диамидин-2-фенилиндол и др.) являются канцерогенами.
Метод FISH-анализа является наиболее точным для
идентификации микроорганизмов в биопленке или других микробных агрегатах. Кроме
того, на одном препарате можно проводить несколько последовательных
гибридизаций с различными генными зондами. При этом нужно полностью проводить
процедуры гибридизации по очереди с каждым зондом, причем начинать с зонда,
требующего наибольшей концентрации формамида (50 %), а также необходимо
подбирать зонды с разными флюоресцирующими маркерами. Таким образом, можно
идентифицировать различные группы бактерий в микробных агрегатах, а также
определять их локализацию внутри агрегата при наблюдениях с помощью
конфокальной лазерной сканирующей микроскопии (Confocal Laser Scanning Microscopy - CLSM).
Выводы
биотрасформация очистка
сточный вода
Данная работа показывает, что биологическая очистка сточных вод - это
сложный процесс, состоящий из взаимодействия биогенного и техногенного
факторов. Технология биологической очистки основывается на биотрансформации
соединений поступающих в сточные воды. Главным компонентом воздействия является
активный ил. Он представляет собой смесь живых организмов и неорганической
составляющей.
Биотрансформация осуществляется непосредственно микроорганизмами
(биогенный фактор) входящими в состав активного ила. Для более эффективного
окисления соединений микроорганизмами требуются благоприятные условия, для их
роста и развития. Зная состав активного ила, а именно какие микроорганизмы его
населяют, можно регулировать их численность, изменяя условия среды. С помощью
различных биореакторов ( техногенный фактор).
Поскольку технологии биологической очистки сточных вод признаны наиболее
эффективными и безопасными по отношению к окружающей среде, анализ микробных
сообществ используемых в технологиях биологической очистки сточных вод весьма
актуален.
Ввиду рассмотренной выше работы можно подвести итог, что развитие
биотехнологий очистки сточных вод, а именно их модернизация, в связи с нынешней
экологией, является очень востребованной.
Список литературы
1. Синицын А.П. Иммобилизованные клетки микроорганизмов/
А.П. Синицын, Е.И. Райнина, В.И. Лозинский, С.Д. Спасов. - М.: Изд-во МГУ,
1994.- 288 с.
. Фауна аэротенков (атлас).-Л.: Наука, 1984.-264 с.
. Жмур Н.С. Управление процессом и контроль результата
очистки сточных вод на сооружениях с аэротенками. - М.: Луч, 1997. - 172 с.
4. Pike E.B. Ecological Aspects of Used-water
Treatment / C.R. Curds, H.A. Hawkes (Eds.). - London: Academic Press, 1975. -
P. 1.
5. Экологическая биотехнология / Под ред. К.Ф. Фостера и
Д.А.Дж. Вейза. - Л.: Химия, 1987. - 384 с.
. Техника защиты окружающей среды / А.И. Родионов,
В.Н. Клушин, Н.С. Торочешников. - М.: Химия, 1989.- 512 с.
7. Sezgin M., Jenkins D., Parker D.S. // Wat.
Pollut. Contr. Fed. - 1978. - V.50. - P. 362
. Blackbeard J.R., Ekama G.A., Marais G.V.R. //
Wat. Pollut. Contr. Fed. - 1986. - V.85. - P. 95; Segerer M. // Korr. Abwasser.
- 1984. - Bd. 31. - S. 1073; Pipes W.O. // Wat. Pollut. Contr. Fed. - 1978. -
V.50. - P. 628
. Kester A. // Manual on disposal of refinery
wastes.-1963.-4.-part A.-РР. 175-178.
10. Поруцкий Г.В. Биохимическая очистка сточных вод
органических производств. - М.: Химия, 1975. - 256 с.
. Голубовская Э.К. Биологические основы очистки воды.
- М.: Высш. шк., 1978. - 268 с.
12. Curds C.R., Cockburn A. Protozoa in biological
sewage-treatment processes // Wat. Res. - 1970. - V.4. - № 3. - PP. 225-249.