Биология фермантов
Введение
биологический фермент катализ
ингибирование
Ферменты - это белковые молекулы,
синтезируемые живыми клетками. В каждой клетке имеются сотни уличных ферментов.
С их помощью осуществляются многочисленные химические реакции, которые могут с
большой скоростью идти при температурах, подходящих для данного организма, т.е.
в пределах от 5 до 40°С. Чтобы эти реакции с той же скоростью дотекали вне
организма, потребовались бы высоте температуры и резкие изменения некоторых
других условий. Для клетки это означало бы гибель, обо вся работа клетки
строится таким образом, чтобы избежать любых сколько-нибудь заметных вменений в
нормальных условиях ее существования. Ферменты, следовательно, можно определить
как биологические катализаторы, т.е. как вещества, ускоряющие реакции. Они
абсолютно необходимы, потому что без них реакции в клетке протекали бы слишком
медленно и не могли поддерживать жизнь. Ферментативные реакции подразделяются
на анаболические (реакции синтеза) и катаболические (реакции распада).
Совокупность всех этих реакций в живой клетке или в живом организме составляет
то, что мы называем метаболизмом. Метаболизм, таким образом, слагается из
анаболизма и катаболизма. Примером фермента, участвующего в анаболизме, может
служить глутаминсинтетаза:
Глуоминовая кислота + Аммиак + АТФ
Глутаминсинтеза + Вода + АДФ + Фн
(АТФ - аденозинтрифосфат; АДФ -
аденозиндифосфат; Фн - неорганический фосфат). В качестве примера фермента,
участвующего в катаболизме, можно назвать мальтазу:
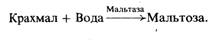
Обычно, для того чтобы превратить
данное исходное вещество через ряд промежуточных соединений в продукт (или
продукты), несколько ферментов действуют последовательно один за другим. Такая
последовательность реакций составляет так называемый метаболический путь. В
клетке работает одновременно много метаболических путей. Реакции протекают
согласованно, подчиняясь строгой регуляции, что объясняется специфической
природой ферментов. Один фермент обычно катализирует только одну реакцию. Таким
образом, ферменты служат для регулирования происходящих в клетке реакций и
обеспечивают надлежащую их скорость.
1. Катализ и энергия активации
Биологические катализаторы (т.е.
ферменты) характеризуются следующими основными свойствами: все ферменты
представляют собой глобулярные белки; они увеличивают скорость реакции, но сами
в этой реакции не расходуются; их присутствие не влияет ни на природу, ни на
свойства конечного продукта (или продуктов) реакции; очень малое количество
фермента вызывает превращение больших количеств субстрата; активность ферментов
меняется в зависимости от рН, температуры, давления и от концентраций как
субстрата, так и самого фермента; катализируемая реакция обратима; ферменты
обладают специфичностью, т.е. один фермент катализирует обычно только одну
реакцию.
Представим себе смесь бензина и
кислорода. Реакция между этими двумя веществами с термодинамической точки
зрения возможна, но она не пойдет без затраты некоторого количества энергии,
поступившей, например, в форме простой искры. Энергия, необходимая для того,
чтобы заставить субстраты вступить в реакцию, называется энергией активации
[Еа]. Чем больше требуемая энергия активации, тем ниже скорость реакции при
данной температуре. Ферменты, действуя как катализаторы, снижают энергию
активации, которая требуется для того, чтобы могла произойти реакция (рис. 1).
Они повышают общую скорость реакции, не изменяя в сколько-нибудь значительной
степени температуру, при которой эта реакция протекает.
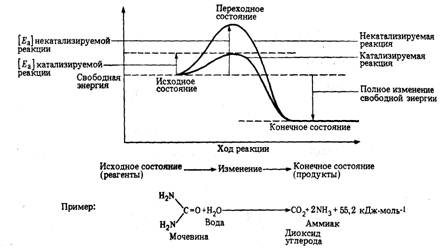
Рис. 1. Энергетические барьеры
катализируемой и некатализируемой реакций
Фермент, соединяясь с субстратом,
образует короткоживущий фермент-субстратный комплекс (рис. 2). В таком
комплексе шансы на то, что реакция произойдет, значительно возрастают. По
завершении реакции фермент-субстратный комплекс распадается на продукт (или
продукты) и фермент. Фермент в реакции не изменяется: по окончании реакции он
остается таким же, каким был до нее, и может теперь взаимодействовать с новой
молекулой субстрата:

Результаты тщательных исследований
показали, что молекулы большинства ферментов во много раз больше, чем молекулы
тех субстратов, которые атакует данный фермент, и что в контакт с субстратом в
фермент-субстратном комплексе вступает лишь очень небольшая часть молекулы
фермента - обычно от 3 до 12 аминокислотных остатков. Эту ее часть называют
активным центром фермента. Именно здесь происходит связывание субстрата или
субстратов (рис. 2). Роль остальных аминокислотных остатков, составляющих основную
массу фермента, состоит в том, чтобы обеспечить его молекуле правильную
глобулярную форму, которая, как мы увидим далее, очень важна для того, чтобы
активный центр фермента мог работать наиболее эффективно (рис. 3).
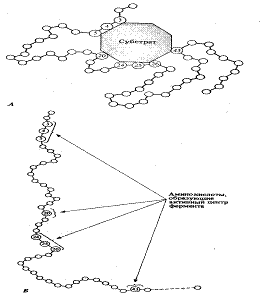
Рис. 2. А. Схематическое изображение
фермент-субстратного комплекса (субстрат присоединяется к ферменту в активном
центре последнего). Б. Положение аминокислотных остатков, образующих активный
центр фермента, в первичной структуре ферментного белка
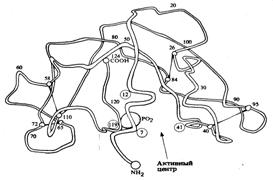
Рис. 3. Третичная структура
рибонуклеазы. В образовании активного центра участвуют аминокислотные остатки
12 и 119 (остатки гистидина), а также 7 и 41 (остатки лизина). Рибонуклеаза
катализирует гидролитическое расщепление рибонуклеиновых кислот до нуклеотидов
Ферменты обладают очень высокой
специфичностью. Фишер (Fischer) в 1890 г. высказал предположение, что эта специфичность
обусловливается особой формой молекулы фермента, точно соответствующей форме
молекулы субстрата (или субстратов). Эту гипотезу часто называют гипотезой
«ключа и замка»: субстрат сравнивается в ней с «ключом», который точно подходит
по форме к «замку», т.е. к ферменту (рис. 4).
Рис. 4. Фишеровская гипотеза «ключа
и замка» (1890 г.). Последовательность событий при связывании субстрата с
ферментом
Фермент-субстратный комплекс - это
«активированное» состояние, ведущее к образованию продуктов реакции.
Образовавшиеся продукты по форме уже не соответствуют активному центру. Они
отделяются от него (поступают в окружающую среду) после чего освободившийся
активный центр мм принимать новые молекулы субстрата.
В 1959 г. новую интерпретацию
гипотезы «ключа и замка» предложил Кошланд (Koshland). На основании данных,
позволявших считать ферменты и их активные центры физически более гибкими, чем
это оказалось вначале, он высказал мысль о динамическом взаимодействии между
ферментом и субстратом. Согласно этому представлению, субстрат, соединяясь с
ферментом, вызывает какие-то изменения в структуре последнего. Аминокислотные
остатки, составляющие активный центр фермента, примимают определенную форму,
которая дает возможность ферменту наиболее эффективным образом выполнять свою
функцию (рис. 5). Эту гипотезу называют гипотезой индуцированного соответствия.
Подходящей аналогией в этом случае может служить перчатка, которая при
надевании на руку соответствующим образом изменяет свою форму. С выяснением
отдельных деталей механизма различных реакций в эту гипотезу вносятся уточнения
Выяснилось, например, что молекулы субстрата в некоторых случаях несколько
изменяют свою форму еще до того, как вступить в соединение с ферментом.
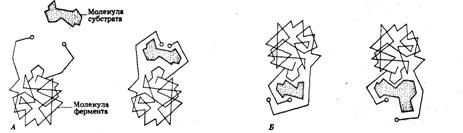
Рис. 5. Схема, иллюстрирующая
кошландовскую гипотезу «индуцированного соответствия». А. Соединяясь с
ферментом, субстрат вызывает в нем изменение, в результате которого активные
группы фермента сближаются. Б. Более мелкие или более крупные молекулы не
способны взаимодействовать с ферментом
2. Кофакторы ферментов.
Неорганические ионы (активаторы ферментов)
Многим ферментам для эффективной
работы требуются те или иные небелковые компоненты, называемые кофакторами.
Кофакторы были открыты, когда обнаружилось, что есть вещества, присутствие
которых совершенно необходимо для проявления каталитической активности
ферментов, хотя сами они в отличие от ферментов сохраняют стабильность при
довольно высоких температурах. Роль кофакторов могут играть различные вещества
- от простых неорганических ионов до сложных органических молекул; в одних случаях
они остаются неизменными в конце реакции, в других - регенерируют в результате
того или иного последующего процесса. Комплекс фермента с кофактором носит
название голофермент, а ферментная часть этого комплекса, без кофактора,
называется апоферментом. Кофакторы подразделяются на три типа: неорганические
ионы, простетические группы и коферменты. Функцию кофакторов выполняют многие
органические молекулы; некоторые из них близки к витаминам. Такая молекула
может быть связана с ферментом прочно (в этом случае ее называют простетической
группой), или слабо (и тогда ее называют коферментом). И в том, и в другом
случае эта молекула действует как переносчик групп атомов, отдельных атомов или
электронов, которые передаются по всему метаболическому пути от одного
метаболита к другому.
Предполагают, что эти ионы
заставляют молекулы фермента или субстрата принять форму, способствующую
образованию фермент-субстратного комплекса. Тем самым увеличиваются шансы на
то, что фермент и субстрат действительно прореагируют друг с другом, а,
следовательно, возрастает и скорость реакции, катализируемой данным ферментом.
Так, например, активность амилазы слюны повышается в присутствии хлорид-ионов.
Данная органическая молекула
занимает такое положение, в котором она может эффективно содействовать
каталитической функции своего фермента. Поясним это на примере
флавинадениндинуклеотида (ФАД). ФАД содержит рибофлавин (витамин В2),
который является водород-акцепторной частью его молекулы (рис. 6).
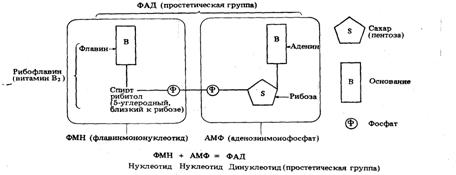
Рис. 6. Витамин как компонент
простетической группы (представлена структура ФАД-флавинаде-ниндинуклеотида)
Функция ФАД связана с окислительными
путями клетки, в частности с процессом дыхания, в котором ФАД играет роль
одного из переносчиков в дыхательной цепи:
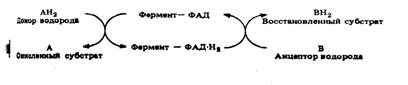
Конечный результат: 2Н переносятся
от А к В. В качестве связующего звена между А и В действует голофермент.
Гемм - это железосодержащая
простетическая группа. Его молекула имеет форму плоского кольца, в центре
которого находится атом железа (порфирнновое кольцо, такое же, как у
хлорофилла). Гем выполняет в организме ряд биологически важных функций.
В качестве простетической группы
цитохромов гем выступает как переносчик электронов. Присоединяя электроны,
железо восстанавливается до Fe(II), а отдавая их, окисляется до Fe(III). Гем, следовательно,
принимает участие в окислительно-восстановительных реакциях за счет обратимых
изменений валентности железа.
Гемоглобин и миоглобин-два
гемсодержащих белка, осуществляющих перенос кислорода. Железо находится в них в
восстановленной [Fe(II)] форме.
Гем входит в состав каталаз и
пероксидаз, катализирующих расщепление пероксида водорода до кислорода и воды.
Содержится он также и в некоторых других ферментах.
НАД - производное витамина,
известного под названием «никотиновая кислота», - может существовать как в
окисленной, так и в восстановленной форме. В окисленной форме НАД при катализе
играет роль акцептора водорода.
3. Скорость фермантивных
реакций
Скорость определяют по углу наклона
касательной к кривой на начальной стадии (а на рис. 8) реакции. Чем круче
наклон, тем больше скорость. Со временем скорость реакции обычно снижается, по
большей части в результате снижения концентрации субстрата.
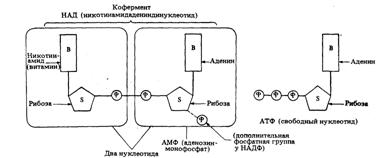
Рис. 7. Витамин как компонент
кофермента (представлены структуры НАД, НАДФ и АТФ)
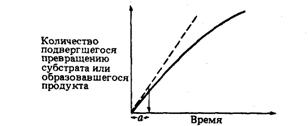
Рис. 8. Скорость ферментативной
реакции
При изучении влияния какого-либо
фактора на скорость ферментативной реакции все прочие факторы должны оставаться
неизменными и по возможности иметь оптимальное значение. Измерять следует
только начальные скорости, как указано выше.
При высокой концентрации субстрата и
при постоянстве других факторов, таких, как температура и рН, скорость
ферментативной реакции пропорциональна концентрации фермента (рис. 9). Катализ
осуществляется всегда в условиях, когда концентрация фермента гораздо ниже
концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и
скорость ферментативной реакции.
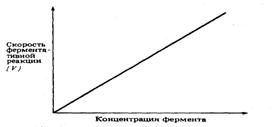
Рис. 9. Зависимость скорости
ферментативной реакции от концентрации фермента
При данной концентрации фермента
скорость ферментативной реакции возрастает с увеличением концентрации субстрата
(рис. 10). Теоретическая максимальная скорость реакции Vmax никогда не достигается,
но наступает момент, когда дальнейшее увеличение концентрации субстрата уже не
влечет за собой сколько-нибудь заметного изменения скорости реакции. Это
следует объяснить тем, что при высоких концентрациях субстрата активные центры
молекул фермента в любой данный момент оказываются практически насыщенными. Таким
образом, сколько бы ни было в наличии избыточного субстрата, он может
соединиться с ферментом лишь после того, как образовавшийся ранее
фермент-субстратный комплекс диссоциирует на продукт и свободный фермент.
Поэтому при высоких концентрациях субстрата скорость ферментативной реакции
лимитируется и концентрацией субстрата, и временем, которое требуется для
диссоциации фермент-субстратного комплекса.
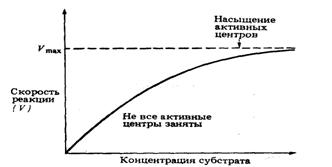
Рис. 10. Зависимость скорости
ферментативной реакции от концентрации субстрата
Влияние температуры на скорость
ферментативной реакции может быть выражено через температурный коэффициент Q10:
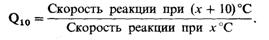
В пределах 0-40°С Q10 ферментативной
реакции равен 2. Иными словами, при каждом повышении температуры на 10°С
скорость ферментативной реакции удваивается. С повышением температуры движение
молекул ускоряется, и у молекул реагирующих веществ оказывается больше шансов
столкнуться друг с другом. Увеличивается, следовательно, и вероятность того,
что реакция между ними произойдет. Температура, обеспечивающая наибольшую
активность, называется оптимальной температурой. За пределами этого уровня
скорость ферментативной реакции снижается, несмотря на увеличение частоты
столкновений. Происходит это вследствие разрушения вторичной и третичной
структур фермента, иными словами, вследствие того, что фермент претерпевает
денатурацию (рис. 11).
Когда температура приближается к
точке замерзания или оказывается ниже ее, ферменты инактивируются, но
денатурации при этом не происходит. С повышением температуры их каталитическая
активность вновь восстанавливается.
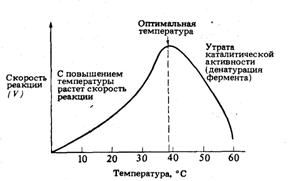
Рис. 11. Влияние температуры на
активность такого фермента, как амилаза слюны
В наше время для длительного
хранения пищевых продуктов широко используют такой способ, как быстрое их
замораживание. Оно предотвращает рост и размножение микроорганизмов, а также
инактивирует их пищеварительные ферменты, так что они оказываются уже не в
состоянии вызвать разложение пищевых продуктов. Инактивируются также и
ферменты, находящиеся в самих пищевых продуктах. Замороженные продукты не
должны размораживаться до того момента, как они понадобятся.
При постоянной температуре любой
фермент работает наиболее эффективно в узких пределах рН. Оптимальным считается
то значение рН, при котором реакция протекает с максимальной скоростью (рис. 12
и табл. 1). При более высоких и более низких рН активность фермента снижается.
Сдвиг рН меняет заряд ионизированных кислотных и основных групп, от которого
зависит специфичная форма молекул фермента. В результате изменяется форма
молекул фермента, и в первую очередь форма его активного центра. При слишком резких
сдвигах рН фермент денатурирует. Свойственный данному ферменту оптимум рН не
всегда совпадает с рН его непосредственного внутриклеточного окружения. Это
позволяет предположить, что среда, в которой находится фермент, в какой-то мере
регулирует его активность.
Рис. 12. Зависимость активности
фермента от рН
Оптимумы рН для
некоторых ферментов

4. Ингибирование
ферментов
Известны различные низкомолекулярные
соединения, которые могут тормозить ферментативные реакции. Такие соединения
называются ингибиторами ферментов. Ингибирование бывает обратимым и
необратимым.
При определенных условиях ингибитор
может быть легко отделен от фермента.
В этом случае вещество, по своей
структуре близкое к обычному субстрату фермента, соединяется с активным центром
фермента, но не может прореагировать с ним. Находясь здесь, оно преграждает
доступ к активному центру любой молекуле настоящего субстрата. Поскольку в этом
случае ингибитор и субстрат конкурируют за место на активном центре фермента,
эту форму ингибирования называют конкурентным ингибированием. Оно обратимо, так
как при увеличении концентрации субстрата скорость реакции возрастает.
Рис. 12 иллюстрирует один из
примеров конкурентного ингибирования.
Явление конкурентного ингибирования
используется в химиотерапии. Цель химиотерапии - уничтожить при помощи тех или
иных химических препаратов возбудителя болезни, не повреждая при этом ткани
организма-хозяина. Во время второй мировой войны для борьбы с инфекционными
заболеваниями широко применялись сульфаниламидные препараты, или
сульфаниламиды, производные сульфаниловой кислоты. Сульфаниламиды по своей
химической структуре близки к парааминобензойной кислоте (ПАБК) - необходимому
фактору роста многих патогенных бактерий. ПАБК требуется бактериям для синтеза
фолиевой кислоты, которая служит у них кофактором фермента. Действие
сульфаниламидов связано с нарушением синтеза фолиевой кислоты из ПАБК.
Животные клетки не чувствительны к
сульфанил-амидам, хотя им для некоторых реакций и требуется фолиевая кислота.
Объясняется это тем, что они используют предобразованную фолиевую кислоту;
метаболический путь, который обеспечивал бы ее синтез, у животных отсутствует.
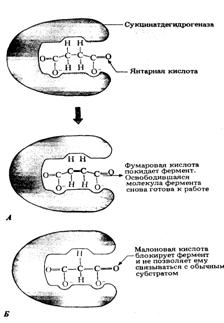
Рис. 13. Пример конкурентного
ингибирования. А. Фермент сукцинатдегидрогеназа катализирует превращение
янтарной кислоты в фумаровую. Б. Конкурентное ингибирование фермента малоновой
кислотой
Ингибиторы этого рода не родственны
по своей структуре субстрату данного фермента; в образовании комплекса с
ингибитором участвует в этом случае не активный центр фермента, а какая-нибудь
другая часть его молекулы (рис. 14). Образование комплекса влечет за собой
изменение глобулярной структуры фермента, и, хотя настоящий субстрат при этом к
ферменту все же присоединяется, катализ тем не менее оказывается невозможным. В
качестве примера можно привести цианид. Он связывается с ионами металлов,
выполняющими у некоторых ферментов роль простетической группы (в частности, с
ионами меди цитохромоксидазы), и подавляет активность этих ферментов. С
повышением концентрации ингибитора скорость ферментативной реакции все более
снижается. К моменту насыщения ингибитором она оказывается практически равной
нулю.
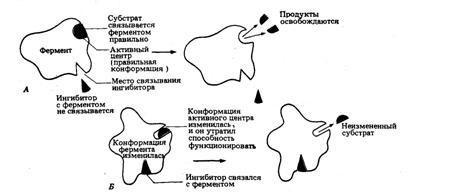
Рис. 14. Проявление неконкурентного
ингибирования. А. Нормальная реакция. Б. Неконкурентное ингибирование
Некоторые ферменты полностью
ингибируются очень малыми концентрациями ионов тяжелых металлов, например ионов
ртути (Hg2+), серебра (Ag+) и мышьяка (As+), или иодуксусной
кислотой. Эти вещества необратимо соединяются с сульф-гидрильными группами (-SH) и вызывают осаждение
ферментного белка.
Диизопропилфторфосфат (ДФФ) -
соединение из группы нервнопаралитических отравляющих веществ - образует
фермент-ингибиторный комплекс, связываясь с остатком аминокислоты серина,
находящимся в активном центре фермента ацетил-холинэстеразы. Этот фермент
инактивирует ацетил - холин, играющий роль нейромедиатора. Одна из функций
ацетилхолина заключается в обеспечении передачи нервного импульса от одного
нейрона к другому через синаптическую щель. Почти сразу после передачи
очередного импульса ацетилхолинэстераза инактивирует ацетилхолин, расщепляя его
на холин и уксусную кислоту. Освободившийся нейрон готов к передаче следующего
импульса. Если ацетилхолинэстераза ингибирована, то ацетилхолин накапливается,
нервные импульсы следуют один за другим и мышца длительное время не
расслабляется. В конце концов, наступает паралич или смерть. Некоторые из
применяемых в настоящее время инсектицидов (например, паратион) оказывают такое
же действие на насекомых.
Заключение
Начало эволюционной химии связывают
с 1950-1960 гг. Под эволюционными проблемами следует понимать проблемы синтеза
новых, сложных, высокоорганизованных соединений без участия человека.
Изучение строения и функционирования
ферментов в живой природе - это такая ступень химического познания, которая
откроет в дальнейшем создание принципиально новых химических технологий.
Подражание живой природе - есть химия будущего. И в тот день, когда в
лаборатории будет синтезирован первый фермент, т.е. биокатализатор, можно
сказать, что найден ключ к химии живой природы.
Химики пришли к выводу, что,
используя те же принципы, на которых построена химия организма, в будущем можно
построить новую химию, новое управление химическими процессами, где будут
созданы катализаторы такой степени специфичности, что далеко превзойдут
существующие в нашей промышленности. Это позволит выработать глобальную
стратегию преодоления экологического кризиса.
В этом плане перспективными являются
автокаталитические химические процессы, при которых катализатор не вводится в
систему извне, а образуется в результате реакции. Сначала такие реакции
протекают медленно, а затем постепенно ускоряются.
Список литературы
1. Бочкарев А.И. Концепция современного естествознания. -
Тольятти: Современник, 1998. - С. 91-94.
2. Варфоломеев С. Ферменты - самые понятные катализаторы //
Химия и жизнь. - 2000. - №10. - С. 8-13.
. Грин Н. Биология. Т.1. - М: Мир, 1993. - С. 195-210
. Дубнищева Т.Я. Концепции современного естествознания. -
М: Маркетинг, 2001. - С. 266-270.
. Кнорре Д.Г. Биологическая химия. - М: Высш. шк., 2000. -
С. 279-305.