Ассоциативные микроорганизмы тлей
Ассоциативные микроорганизмы тлей
Введение
Ассоциации растений с
микроорганизмами, стимулирующими их развитие, привлекают внимание ученых не
только с точки зрения исследования фундаментальных основ сосуществования и
взаимодействия различных организмов, но и возможного использования таких
ассоциаций в практике экологически ориентированного адаптивного
растениеводства.
Микроорганизмы, существующие внутри
растения, включая надземную, подземную части и семена, и благотворно влияющие
на их развитие, не вызывая симптомов заболевания (эндофитные микроорганизмы),
представляют как научный, так и практический интерес.
Они используют внутреннюю среду
растения - эндосферу, в качестве уникальной экологической ниши, защищающей их
от изменений окружающей растение внешней среды, которая возникла в результате
сотен миллионов лет совместной эволюции растений и бактерий.
Эндофитные бактерии колонизируют те
же экологические ниши в растении, что и болезнетворные микроорганизмы, и
поэтому служат перспективным биологическим средством для борьбы с
фитопатогенами, то есть выступают в роли так называемого «биоконтрольного»
агента.
В природе встречается широкий спектр
примеров взаимовыгодного симбиоза. От желудочных и кишечных бактерий, без
которых было бы невозможно пищеварение, до растений. Такие отношения успешны
всегда, когда они увеличивают шансы обоих партнёров на выживание.
Осуществляемые в ходе симбиоза действия или производимые вещества являются для
партнёров существенными и незаменимыми [1].
Открытие новых групп растительных
симбиозов и расширение числа видов среди таксонов растений, участвующих в
образовании ранее известных, позволяет предположить, что явление симбиоза - не
исключение, а скорее правило, закономерность в природе, и симбиотические
ассоциации представляют собой одну из основных форм существования жизни
Изучение межорганизменных отношений
в настоящее время приобрело всеобъемлющий характер и оказывает все более
заметное воздействие на развитие практически всех областей биологии. Доказано,
что индуцируя крупные изменения, симбиоз определяет становление новых форм
жизни, которые не могли бы возникнуть при эволюции свободноживущих организмов
[2].
Каждый микроорганизм
приспосабливается не только к неживым субстратам, но и к другим окружающим его
организмам. Подобная адаптация иногда приводит к приобретению особых
метаболических свойств, наделяющих обладателя способностью занимать
специфические ниши. Значительная часть бактерий участвует в конкурентной
борьбе, адаптируясь к сосуществованию с другими формами жизни [3].
В последнее десятилетие происходит
смена парадигмы симбиоза. На смену представлениям о них как о двухкомпонентных
системах в результате уточнения знаний об этом феномене приходит понимание
симбиозов как многокомпонентных систем, в которых помимо доминантного
микросимбионта, существуют и ассоциативные микросимбионты [4].
В силу того, что в последнее
десятилетие для многих симбиозов открыты новые многочисленные сопутствующие
микроорганизмы, назрела необходимость в выявлении и понимании роли таких ассоциативных
микроорганизмов симбионтов в функционировании симбиоза в целом.
В последнее десятилетие интерес в
общей микробиологии переместился от изучения чистых культур микроорганизмов к
новому объекту - микробному сообществу. При этом дарвиновская теория эволюции
путем конкуренции видов сменилась новой «анти-рыночной» парадигмой - эволюцией
видов в составе сообществ.
1. Обзор литературы
1.1 Систематическое
положение тлей
Отряд (Homoptera) включает в себя
большое число представителей равнокрылых насекомых. В мировой фауне известно
более 30000 видов равнокрылых, в фауне СНГ - более 4000 видов [6, 7].
На территории России наиболее важное
значение имеют следующие виды тлей.
. Тля злаковая (Schizaphis graminum Rondani, 1852).
. Тля вишневая (Myzus cerasi Fabricius, 1775).
3. Тля вязово-грушевая (Eriosoma lanuginosum Hart, 1839).
4. Тля гелихризовая (Brachycaudus helichrysi Kalt, 1843).
5. Тля грушево-зонтичная бурая (Anuraphis руrilaseri Shap,1847).
6. Тля зеленая персиковая (Myzodes persicae Sulzer, 1776).
7. Тля кровяная (Eriosoma lanigerum Hausm, 1802).
8. Тля хмелевая (Phorodon humuli Schrk, 1853).
9. Тля чертополоховая (Brachycaudus cardui L., 1869).
10. Тля листокрутка грушевая (Yezabura reaumuri Mordv, 1859).
Отличительными признаками подотряда
Aphidinae являются: голова трапециевидная, имеются усики, расположенные на лбу
или на антеннальных буграх, и состоящие, из 5-6 члеников. Дистальные сегменты
антенн разделены на две части: основание и шпиц. Тли имеют много фасеточных
глаз бурого, красного или черного цвета [7]. У насекомых, не обладающих
крыльями, органы зрения редуцированы, а голова дополнительно оборудована тремя
простыми глазками. Ротовой аппарат сосущего типа, представлен в виде
4-членикового хоботка. На груди расположены две пары перепончатых прозрачных
крыльев, вторая пара которых всегда меньше первой. Ноги ходильного типа,
передняя пара может быть прыгательной, конечности тонкие и довольно длинные.
Брюшко включает 9 сегментов, последний не развит. Личинка появляется путем
живорождения, у личинок первого возраста хоботок обычно длиннее по отношению к
телу [8].
1.2 Биологические
особенности тлей
Тли отличаются своей необычной
биологией. В борьбе за существование они приобрели удивительные приспособления
к условиям жизни [9 - 11].
Тлям среди немногих насекомых
свойственно живорождение. Крылатые и бескрылые живородящие самки рождают без
оплодотворения детенышей (личинок). При таком размножении численность тлей
колоссально увеличивается с наступлением благоприятных условий температуры и
влажности [12]. В короткий срок растения покрываются многочисленными колониями
тлей. Когда наступает ухудшение условий питания, ткани растений грубеют,
подсыхают, концентрация клеточного сока повышается, у бескрылых тлей наступает
голодание и вид может вымирать. Чтобы этого не произошло, в колонии бескрылых
тлей появляются крылатые особи, или расселительницы, они поднимаются в воздух в
поисках молодых и сочных растений. Поселившись на кормовых растениях, самки -
расселительницы продолжают размножаться живорождением.
Максимальное размножение тлей
происходит в июне - июле. В это время колонии тлей держатся на верхних, более
нежных листьях. Ко времени созревания зерновых культур численность тлей резко
сокращается.
Таков общий годовой цикл развития
тлей. Мигрирующие злаковые тли летом размножаются на злаках, а осенью
расселительницы перелетают на древесные растения, где откладываются яйца. У
однодомных тлей все развитие проходит на злаковых растениях.
Весной из перезимовавшего яйца
выходит личинка, которая развивается в бескрылую живородящую
самку-основательницу. Процесс живорождения идет в течение вегетационного
периода [13, 14].
В жаркую и сухую погоду много тлей
погибает. Препятствует размножению их также понижение температуры (ниже 15°С).
Ливневые дожди смывают тлей с растений [15].
В значительной степени снижают
численность тлей хищные и паразитические насекомые, птицы. Божьи коровки
(Coccinellidae) и их личинки уничтожают тлей в огромном количестве. О. С.
Морошкиной установлено, что за сутки жук поедает 68 взрослых тлей или 175
личинок, а личинка божьей коровки соответственно 90 и 270. Наиболее
многочисленна семиточечная божья коровка [16].
Тли разделяют на две биологические
группы - мигрирующие и немигрирующие (однодомные). Среди мигрирующих наиболее
распространены черемухово-злаковая тля, вязово-злаковая тля. Из однодомных не
мигрирующих тлей наиболее вредоносны: большая злаковая, ячменная, обыкновенная
злаковая [7].
Черемухово-злаковая тля
(Rhopalosiphum padi L.) - темно-зеленая, соковые трубочки слегка вздуты посредине;
усики сидят прямо на лбу, без выростов. Весной тли мигрируют на листья хлебных
и диких злаков. Наибольший вред наносит ранним посевам озимых колосовых
культур. Кроме колосовых, сильный вред причиняет кукурузе.
Вязово-злаковая тля (Tetraneura ulmi
L.) - тело вздутое, почти шаровидное, покрыто восковым налетом. Ноги короткие.
На листьях вяза образует гладкие толстостенные галлы. Мигрирует на злаки и
развивается на корнях яровых и озимых хлебов, на кукурузе, рисе.
Ячменная тля (Brachycolus noxius Mordv.): тело длинное, узкое,
желтовато-зеленого цвета; соковые трубочки очень мелкие; усики короче половины
длины тела. Вредит ячменю, пшенице, реже встречается на ржи и овсе. Колонии
тлей живут в верхних свернутых листьях. Массовое размножение происходит на орошаемых
участках.
Большая злаковая тля (Sitobion
avenae F.): тело зеленоватое, 2,5 - 3,2 мм; усики длинные сидят на особых
выступах на лбу; соковые трубочки черные и длинные. Живет на всех зерновых
культурах, заселяя листья, стебли и колосья; густых колоний не образует.
Наибольший ущерб приносит озимой и яровой пшенице, озимому и яровому ячменю,
ржи, овсу, кукурузе, сорго. Распространена повсеместно [11].
Обыкновенная злаковая тля (Schizafis
graminum). Крылатая живородящая самка длиной 1,6 мм, имеет зеленое брюшко,
голова и грудь бурые. Бескрылая живородящая самка зеленая длиной 2,7 - 2,9 мм,
характеризуется светло-зеленой окраской и продольной серединной полосой на
спинной поверхности. Усики достигают половины длины тела. Трубочки длинные,
цилиндрические, невздутые, светлые, только перед крышечкой буроватые, в 1,7 - 2
раза длиннее пальцевидного хвостика. Медиальная жилка на передних крыльях
ветвится один раз. Яйцекладущая самка не имеет крыльев, отличается от бескрылой
живородящей веретеновидиой формой тела и утолщенными голенями задних ног; длина
тела 2,2 мм. Яйца черного цвета, удлиненно-овальной формы. Жизненный цикл
однодомный. Зимует в стадии яйца на посевах озимых культур, а также на падалице
и диких злаках. В жизненном цикле происходит чередование полового и бесполых
поколений. В зоне наибольшей вредоносности массовое отрождение личинок
бескрылых партеногенетических самок из яиц обычно наблюдается в конце апреля -
начале мая. Продолжительность личиночного возраста составляет 8 - 15 дней.
Бескрылая партеногенетическая самка живет до 35 дней, отрождает до 80 личинок.
Вредитель питается сначала на озимых, а затем и на яровых культурах, в связи с
чем самки-расселительницы появляются в конце мая. Крылатая партеногенетическая
самка живет 17 - 20 дней и отрождает до 42 личинок. Насекомые живут большими
колониями как на верхней, так и нижней стороне листьев. К моменту выхода злаков
в трубку плотность тлей быстро увеличивается, так что огромные колонии могут
полностью покрывать листья. В сентябре при появлении всходов озимых культур
происходит лёт тлей на эти поля из мест летних резерваций. В конце
сентября-октябре появляются полоноски, которые рождают самцов и самок. Откладка
зимующих яиц происходит в октябре и продолжается до наступления морозов.
Плодовитость самок составляет 10 - 12 яиц, а продолжительность жизни - 38 - 40
дней. Яйца откладываются небольшими группами по 2 - 4 за влагалище листа [13,
14].
1.3 Эпифитная микрофлора
растений
Микроорганизмы,
развивающиеся на поверхности растений, получили название «эпифитов».
Микробы-эпифиты не паразитируют на растении, а растут за счет нормальных
выделений его тканей и имеющихся на поверхности растений небольших количеств
органических загрязнении (пыль и т. д.). Довольствоваться столь скудным
питанием могут далеко не все микроорганизмы, и поэтому состав эпифитной
микрофлоры довольно специфичен. Воздействие эпифитных микроорганизмов на
растительный организм может быть очень разнообразным в зависимости от
окружающих условий. В первые этапы прорастания зерна эпифитные микроорганизмы
начинают размножаться и переходят на корни и проросток. При пониженной
температуре интенсивнее развиваются более холодоустойчивые микроскопические
грибы, среди которых имеются факультативные и облигатные паразиты, в результате
чего резко понижается полевая всхожесть зерна.
Эпифитные
микроорганизмы, размножаясь на поверхности растений, создают биологический
барьер, препятствующий проникновению паразитов в растительные ткани. Усиливая
размножение эпифитной микрофлоры опрыскиванием растений питательными для них
растворами, удавалось увеличить антагонистическое действие эпифитов к
фитопатогенным микроорганизмам. В принципе с некоторыми болезнями растений
можно бороться, воздействуя на их эпифитную микрофлору.
Большую роль
эпифитные микроорганизмы играют при хранении зерна и семян. При созревании
зерна влажность сильно снижается и достигает уровня, когда размножение
микроорганизмов становится невозможным. В спелом зерне вся влага находится в
связанном состоянии и недоступна микроорганизмам.
Существование
эпифитных микроорганизмов на здоровом растении в значительной степени связано с
климатическими условиями. При благоприятных условиях, например, во влажную
погоду, количество эпифитных микроорганизмов значительно возрастает, а в сухую,
наоборот, уменьшается. У тех растений, которые интенсивнее выделяют продукты
обмена клеток, микрофлора богаче и разнообразнее.
Кроме стебля,
листьев и других надземных органов растений, микроорганизмы живут и на семенах.
Исключение составляют семена, плотно закрытые плодовыми или семенными
оболочками, например, стручки бобовых. В таких случаях до момента раскрытия
оболочек семена практически лишены микрофлоры.
Таким образом, в процессе развития
растения происходит накопление микрофлоры на поверхности всех его частей. В
данном случае отмечается значительное увеличение количества микробов к периоду
полной зрелости растения. На растении, как и в ризосфере, главным образом
размножаются неспороносные бактерии, а бациллы составляют лишь небольшой
процент бактериального эпифитного населения.
При уборке и обмолоте зерно сильно
загрязняется микроорганизмами. Большое значение при этом имеет пыль. Как
известно, в почве содержится огромное количество микроорганизмов, которые
сохраняются в пыли в жизнеспособном состоянии. Пыль, неизбежно поднимающаяся
при уборке и обмолоте зерна, попадает на его поверхность. Большая степень
запыленности приводит к более сильному обогащению зерна микробами.
Количество пыли и микробов,
задерживающихся на зерне, зависит отчасти от условий обмолота и запыленности
среды, но в значительной мере и от морфологических признаков зерна. Бороздка,
шероховатая поверхность эпидермиса или цветочные пленки способствуют скоплению
на поверхности зерна большего количества пыли и микроорганизмов. Поэтому зерно
злаковых в большей степени населено микроорганизмами, чем семена некоторых
масличных и бобовых, имеющих ровную, гладкую поверхность.
Во время многофазной уборки, когда
между косьбой и обмолотом зерно находится в колосе, иногда бурно развиваются
микроорганизмы на всей растительной массе, и в частности, на зерне. Это
происходит при неблагоприятных климатических условиях (дождливой погоде,
высокой относительной влажности воздуха и т. д.), а также значительной
влажности зерна. Особенно энергично микроорганизмы размножаются на зародыше,
влажность которого более высока, чем у остальных частей зерна. Если зерно при
этом не будет быстро обмолочено, убрано и высушено, то его частичная или полная
порча неизбежна.
Воздействие
эпифитных микроорганизмов на растительный организм может быть очень
разнообразным в зависимости от окружающих условий. В первые этапы прорастания
зерна эпифитные микроорганизмы начинают размножаться и переходят на корни и
проросток. При пониженной температуре интенсивнее развиваются более
холодоустойчивые микроскопические грибы, среди которых имеются факультативные и
облигатные паразиты, в результате чего резко понижается полевая всхожесть
зерна.
Большой интерес
представляют данные, показывающие, что протравливание семян кукурузы дает
наибольшую эффективность в условиях холодного климата. Это вполне понятно, так
как при низкой температуре почвы грибы более агрессивны, а иммунитет растений
снижен.
Микроорганизмы накапливаются в
зерновой массе во время перевозки ее к зернохранилищу. При этом загрязненные
транспортные средства могут быть не только источниками безвредных сапрофитных
микробов, но и некоторых видов патогенных микроорганизмов. В некоторых случаях
зерно загрязняется клещами. Недопустимо использовать для транспортировки зерна,
грязные машины, загрязненную тару и т. д. Поэтому зерно, взятое для анализа с
заготовительных пунктов или торговой сети, всегда более богато
микроорганизмами, чем то, которое получено непосредственно из колоса.
В отдельных случаях зерно может быть
в различной степени обсеменено микроорганизмами. Поэтому общая численность
микрофлоры зерна не может служить единственным критерием при оценке его
качества. В этом отношении значительно более характерен видовой состав
микроорганизмов зерна, Поэтому видовой состав микроорганизмов может быть использован
как показатель качества хранящегося зерна.
Грамм доброкачественного зерна может
содержать несколько миллионов зародышей микробов.
Однако резкое увеличение численности
микробов наблюдается лишь при различного рода порче (подмочка зерна, начавшийся
процесс самосогревания и т. д.). Семена пленчатых культур, а также кукурузы
(початки которой закрыты обертками) и бобовых (созревающие в стручках) после
обмолота оказываются более бедными микрофлорой, чем семена пшеницы и ржи. У
растений первой группы основная масса микроскопических существ развивается на
тех частях, которые прикрывают созревающее семя.
Большую часть бактериального
населения семян всех растений составляют неспороносные палочки из рода
Pseudomonas, активно размножающиеся на поверхности растений. Особенно часто
встречается Ps. herbicola, которая образует на твердых питательных средах
колонии золотисто-желтого цвета. Преобладание этой бактерии па зерне служит
показателем его хороших качеств. При всевозможных пороках этот микроорганизм
вытесняется другими. Нередко на зерне может быть найден Ps. fluorescens, дающий
флюоресцирующие колонии. Из бактерий других видов на зерно встречаются
микрококки, молочнокислые бактерии и т. д. На зернах кукурузы после удаления
оберток несколько увеличивается число микрококков. По этому признаку микрофлора
кукурузы несколько отличается от микронаселения других зерновых культур.
На зерне встречаются и другие
разнообразные представители бактериального мира, попадающие с пылью и
переносимые насекомыми. На поверхности зерна они сохраняются в пассивном
состоянии и поэтому их число невелико. К отмеченной категории можно отнести
маслянокислые бактерии и большинство бацилл.Грибов на поверхности растений и на
зерне немного, вероятно, их размножению препятствует слабая концентрация
питательных веществ.
Обычно грамм доброкачественного
зерна содержит несколько тысяч зародышей грибов.
Итак, можно сказать, что эпифитная
грибная микрофлора зерна не столь многочисленна. В ней обычно встречаются виды
рода Penicillium, составляющие нередко большинство грибных организмов. Род
Aspergillus представлен на здоровом зерне менее обильно. В зерне южного
происхождения роль грибов рода Aspergillus возрастает, так как почвы юга более
богаты грибами этого рода. В значительно меньшем количестве на зерне
встречаются другие грибы, принадлежащие к родам Gladosporium, Alternaria, Mucor
и т. д. Здесь же могут быть найдены и дрожжи.
В отличие от других злаков, на
свежеубранном зерне кукурузы встречаются грибы из родов Cephalosporium и
Fusarium. При хранении зерна количество этих грибов сильно уменьшается.
Актиномицеты не являются
существенным компонентом микрофлоры зерна и видовой состав их на этом субстрате
пока по привлекал внимания исследователей.
Эпифитная микрофлора зерна находится
на поверхности зерна и в нормальной обстановке не проникает в его ткани.
Болезнетворные микроорганизмы могут внедриться в зерно, которое становится
впоследствии источником распространения инфекции.
Фитопатологи обычно обращают
внимание только на резко проявляющиеся болезни растений. Между тем имеются
скрытые поражения, приносящие тем не менее значительный урон сельскому
хозяйству.
Грибы из рода Alternaria, переходя с
корневой системы растений на надземную часть, проникают в ткани растения,
сильно ослабляют ого рост и снижают урожай. Подобные грибы по существу вызывают
скрытые заболевания растений. Это говорит о необходимости бороться не только с
явными, но и скрытыми болезнями растений.
По своему химическому составу зерно
является весьма полноценной питательной средой для микроорганизмов. Трудность
проникновения внутрь зерна метатрофных микробов объясняется тем, что у него
имеются защитные средства. Здесь действует механический и активный иммунитет
растения.
У созревающего зерна довольно
большая влажность и на его поверхность путем экзосмоса поступают некоторые
питательные вещества. Это дает возможность микроорганизмам развиваться на
поверхности зерна. Энергичному экзосмосу содействуют и интенсивные
биохимические процессы, протекающие в зерне на ранних стадиях его развития.
К моменту полного созревания в зерне
уменьшается содержание более активных форм углеводов, но возрастает запас
крахмала и гемицеллюлез.
Падает активность гидролаз и
дыхания, снижается энергия и других ферментативных процессов. Особенно важно
то, что процесс созревания зерна связан с большой потерей воды. Зерно в стадии
молочной спелости содержит около 50% влаги; в момент восковой спелости
влажность падает до 25 %, при полной до 12%. Микроорганизмы могут размножаться
лишь на субстратах, достаточно богатых водой. Вполне созревшее зерно не может
считаться таким субстратом, так как вода в нем находится в связанной форме. На
спелом сухом зерне микробы сохраняются в покоящемся состоянии (анабиозе), при
этом их численность постепенно снижается. В случае подмочки зерна или его
увлажнения от других причин микроорганизмы в зерне начинают бурно размножаться
и вызывают его порчу.
Отдельные группы
микрофлоры начинают развиваться на зерне при разных уровнях влажности. Так, при
температуре около 15- 20°С некоторые грибы могут размножаться на зерне пшеницы
и кукурузы с влажностью 14,5-15%, а бактерии - при увлажнении зерна пшеницы до
17,5-18%. Для зерна различных культур имеется своя критическая влажность, при
которой на нем возможно размножение микроорганизмов. На семенах бобов при указанной
выше температуре грибы развиваются при влажности 16%, подсолнечника- 7-9%. Это
зависит от количества связанной воды у различных семян, что определяется их
структурой и химическим составом. Микроорганизмы начинают развиваться на зерне,
лишь, когда в нем появляется свободная вода, то есть степень увлажнения
превышает уровень связанной воды.
Степень увлажнения
хранящегося зерна зависит от влажности окружающего воздуха, К настоящему
времени установлены значения равновесной влажности семян и зерна растений при
различной влажности воздуха. Руководствуясь этими показателями, можно создавать
благоприятные условия для хранения зерна и семян.
Развитие
микроорганизмов на зерне и семенах зависит также от температуры. Эта
зависимость отмечается только для несколько увлажненного материала, так как на
сухом зерне независимо от температуры микроорганизмы не развиваются. При
повышенной влажности зерна микроорганизмы размножаются тем быстрее, чем выше
температура.
При температуре
100С даже довольно влажное зерно (18-19% влаги) может хорошо храниться, а при
15-20°С оно начинает быстро плесневеть и портиться бактериями. Для успешного
хранения зерна при более высокой температуре его влажность необходимо снизить.
Активное развитие
микроорганизмов в зерновой массе различных культур при одной и той же степени
увлажнения начинается в разные сроки. Пшеница, рожь, ячмень, горох, бобы и
гречиха более устойчивы. В просе, кукурузе и подсолнечнике микроорганизмы
развиваются быстрее и интенсивнее.
Следовательно, по
составу микрофлоры зерна можно судить об условиях его хранения.
При более или менее
длительном развитии микроорганизмов в результате их жизнедеятельности масса
зерна может разогреться. Зерновые массы имеют низкую теплопроводность и поэтому
хорошо аккумулируют тепло. Наряду с микроорганизмами тепло выделяется
вследствие дыхания зерна, развития насекомых и т. п. Глубоко зашедший процесс
разогревания зерна приводит к повышению его температуры до 60°С. Зерно при этом
нередко приобретает темную окраску - «обугливается», так как в нем образуются
темноокрашенные соединения меланоидной природы.
Сохранность урожая
овощей и плодов, имеющих большую влажность, определяется их иммунитетом и
созданием внешней среды, предупреждающей развитие микроорганизмов на их
поверхности.
1.4 Эндофитная
микрофлора растений
В последнее
десятилетие большинство сельскохозяйственных ориентированных исследований было
направлено на изучение ризосферных микроорганизмов. Среди них бактерии являются
наиболее технологичными как с точки зрения производства, так и применения
микробных препаратов в сельском хозяйстве. Это открывает перспективы
использования прокариоти-ческих микроорганизмов, благотворно влияющих на
развитие растений в различных условиях.
Эндофитные бактерии
колонизируют те же экологические ниши в растении, что и болезнетворные
микроорганизмы, и поэтому являются перспективным биологическим средством для
борьбы с фитопатогенами, то есть являются так называемым
"биоконтрольным" агентом. Установлено, что бактериальные эндофиты
способны ингибировать развитие насекомых-фитофагов и нематод, подавляя их
действие путем синтеза биологически активных соединений, обладающих
"антипатогенным" действием.
Изучение
"биохимического оружия" таких бактерий позволит выделить и
идентифицировать те химические соединения, которые могут быть использованы при
создании новых препаратов для борьбы с болезнями растений, животных и даже
человека.
Некоторые штаммы
эндофитных бактерий нашли применение при фиторемедиа ции почв, то есть очистке
техногенно загрязненных территорий путем создания специальных
растительно-бактериальных систем].
В обзоре
систематизированы литературные данные об эндофитных бактериях и их
использовании при разработке новых микробных препаратов, которые можно будет
применять в практике сельского хозяйства.
Биоразнообразие
эндофитных бактерий. Нишу эндофитов могут занять лишь те бактерии, которые
способны колонизировать межклеточные пространства различных частей растения, и
даже семян. Классические исследования биоразнообразия эндофитных бактерий
основывались на характеристике изолятов, полученных из внутренних тканей
различных растений после их тщательной поверхностной стерилизации.
Бактериальные эндофиты включают как грамположительные, так и грамотрицательные
виды, выделяемые из широкого спектра растений-хозяев.
1.3 Экологические
особенности тлей
Среди травянистых культурных
растений наибольшие площади посевов в мире занимает пшеница. По существующим
прогнозам ее потребление в составе продукции полевого растениеводства к 2020
году достигнет 40%.
Для многих государств пшеница
представляет стратегический ресурс. В числе насекомых, вредящих пшенице, во
всех районах ее возделывания отмечаются Настоящие тли. Они питаются как на
листьях, так и на колосьях и корнях. Подавляющее большинство тлей имеют сложный
жизненный цикл, включающий несколько партеногенетических поколений и одно
полоносное, - у однодомных - на тех же травянистых растениях-прокормителях, а у
двудомных, как правило, на деревьях или кустарниках.
У ряда видов с широкими ареалами,
включающими несколько ландшафтно-климатических зон, в полупустынных и
тропических регионах полоносное поколение может отсутствовать. Этими
особенностями, в сочетании с составом фитоценозов обочин полей и прилежащих
угодий, а также особенностями агротехники, определяются видовой состав тлей
заселяющих полевые культуры, сроки и интенсивность их заселения и, в конечном
счете, их потенциальная вредоносность.
Для лесостепной зоны России известно
23 вида тлей, питающихся на зерновых культурах.
Для развития и размножения тли
большое значение имеют температурные условия. Для каждого вида характерен
определённый температурный режим, при котором все жизненные процессы проходят
наиболее интенсивно [7]. Большие отклонения от оптимума вызывают нередко гибель
вредителя. Способность насекомых переносить длительное охлаждение различна не
только у отдельных видов, но даже у одного вида в зависимости от его
физиологического состояния. На размножение вредителей существенное влияние
оказывает взаимосвязь насекомых с другими животными организмами [11]. В биоценозе
складываются сложные «цепи питания», которые оказывают большое влияние на
взаимоотношения компонентов, заселяющих определённый биотоп [14]. Например,
различные виды тлей питаются соком растений, а выделяемые ими сахара служат
пищей муравьям, наездникам и некоторым мухам. Тлями питаются многие виды хищных
насекомых, например жуки и личинки кокцинеллид, личинки хризопы, личинки мух
журчалок. Тлей и их врагов - хищных насекомых - поедают разнообразные
насекомоядные птицы, которые, в свою очередь, становятся жертвами хищных птиц.
Нарушение в какой-то части сложившихся «цепей питания» приводит в ряде случаев
к существенному и непредвиденному или нежелательному изменению биоценоза в
целом [13].
Различные сочетания факторов внешней
среды вызывают у многих насекомых более или менее резкие изменения численности,
причины которых у разных видов неодинаковы. Решающую роль могут играть наличие
и состав пищи, погодные условия, воздействие хищников, паразитов и болезней и
т. д. [11]. Колебания численности - следствие соотношений между плодовитостью
вида и выживаемостью потомства, зависящей от условий среды и способности
организма приспособиться к ним [14].
Отдельные виды тлей имеют свои
ареалы. Черемухово-злаковая тля встречается в СНГ: вся европейская часть, на север
до Хибин, Кавказ, Казахстан, Сибирь, Дальний Восток.; вязово-злаковая тля
отмечена на Кавказе, в Средней Азии, южном Приморье; ячменная тля - в степной и
лесостепной зонах европейской части, в Казахстане и Средней Азии. Обыкновенная
злаковая тля распространена в степной зоне, на Кавказе, в Средней Азии, на юге
Сибири. Большая злаковая тля встречается в СНГ: лесостепная и степная зоны
европейской части, Кавказ, юг Сибири и Дальний Восток, Средняя Азия [11].
1.4 Симбиотические
микроорганизмы тлей
Степень значимости симбионтов для
организма хозяина варьирует в зависимости от того, к какому классу он
относится. Значимость облигатных симбионтов значительно выше, чем
факультативных. К примеру, устойчивость тлей к высоким температурам, как
выяснилось, определяется генетическими особенностями их симбионтов - бактерий
Buchnera. Главная проблема, с которой сталкивается организм при перегревании -
это изменение вторичной структуры белков (денатурация). В большинстве случаев
клетка в ответ на повышение температуры активирует ряд генов, их называют
генами теплового шока - heat - shock genes, которые в свою очередь кодируют ряд
специфических белков, называемых шаперонами. Их функция заключается в том, что
они «насильно» придают белкам нативную конфигурацию, не позволяя им
денатурировать. Так же бактерии Buchnera играют ключевую роль в питании тли
[17]. Вместо тлей биосинтезом аминокислот занимаются бактерии-симбионты,
которые, в свою очередь, снабжают организм хозяина всем спектром аминокислот.
Установлено, что в число таких аминокислот входят аргинин, триптофан, треонин,
гистидин, лейцин, изолейцин, лизин, валин и фенилаланин. Бактерия синтезирует
гораздо больше аминокислот, чем это ей необходимо, и избыток аминокислот
достается насекомому. Так же известно, что симбионты обеспечивают тлю
необходимыми аминокислотами ещё на стадии эмбрионального развития.
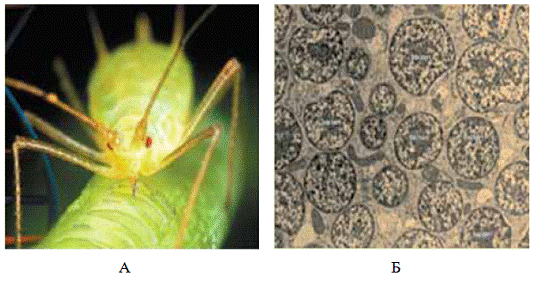
Рисунок 1 - Гороховая тля
Acyrthosiphon pisum Harris, 1776 (А) и внутриклеточный симбионт Buchnera (Б)
[17]
Установлено, что для нормального
существования Buchnera в организме хозяина необходимо, чтобы насекомое получало
достаточное количество калия, магния, железа, цинка, марганца, меди и кальция.
Это было доказано экспериментально, путем выращивания тли на синтетической
среде. Отсутствие вышеперечисленных элементов в рационе задерживало развитие
симбионтов в первом или втором поколении хозяев и приводило к полной их гибели
в последующих поколениях [18].является уникальным факультативным симбионтом,
так как это единственный пример причастности эндосимбионтов к изменению окраски
тела организма-хозяина. Наличие данного симбионта проявляется фенотипически.
Именно он изменяет окраску красных тлей на зеленую. Доказано это было следующим
образом: учеными была выведена линия красных тлей, для чистоты эксперимента с
минимально отличающимися геномами. Данные насекомые были разделены на две
опытные группы. Одну группу инфицировали бактериями Rickettsiella, а другую
оставили в качестве контроля. В результате организмы, у которых присутствовали
бактерии Rickettsiella изменили свой цвет. Это говорит о том, что Rickettsiella
каким-то образом активизирует выработку зеленых пигментов, что вызывает
изменение цвета тела [19].
Такая окраска тли в свою очередь
делает её менее уязвимой для божьих коровок, но более уязвимой для атак
наездников. Интересно, что большинство (около 80%) тлей, инфицированных
Rickettsiella, были также инфицированы симбиотическими бактериями Hamiltonella
или Serratia [20].
Позже была отмечена тенденция
большей выживаемости тли, зараженной комплексом симбионтов Rickettsiella,
Hamiltonella, в сравнении с неинфицированными организмами.
Наличие бактерии Regiella
insecticola обеспечивает устойчивость гороховой тли Acyrthosiphon pisium к грибковым патогенам,
таким как Coccidioides immitis и Blastomyces dermatitidis. Это было
экспериментально доказано путем создания изолированной группы тлей,
инфицированных Regiella insecticola, которая впоследствии подверглась заражению
патогенными грибами. По итогам эксперимента был сделан вывод, что данный штамм
в разы увеличивает устойчивость организма-хозяина к патогенным грибам. Так же наличие
симбионта снижает вероятность грибковой споруляции на погибших тлях, как
следствие снижение уровня передачи заболевания другим тлям [21].- это еще один
пример эндосимбионтов. Положительное влияние Wolbachia на организм хозяина
научно доказано. После излечения бактерий рода Wolbachia у организма хозяина
отмечается снижение плодовитости и приспособленности. Бактериями рода Wolbachia
инфицировано, по некоторым оценкам, около 20% всех видов
насекомых.
биологический тля
злаковый
1.4.1 Внутриклеточные
симбионты тли
К внутриклеточным симбионтам, или
эндосимбионтам, относят любой организм, который живет в клетках другого
организма, то есть, образует эндосимбиоз. Многие эндосимбионты являются
облигатными, т. е. эндосимбионт или хозяин не могут выжить друг без друга. Так
же встречаются и факультативные эндосимбионты, присутствие которых в организме
хозяина не является строго обязательным.
Эндосимбионты насекомых делятся на
две большие группы: «первичные» и «вторичные». Первичные эндосимбионты связаны
с организмом хозяев на протяжении долгого периода времени, предположительно от
10 до нескольких сотен миллионов лет. Они образуют облигатные ассоциации.
Культивирование таких бактерий, являющихся первичными эндосимбионтами.
Жизнеспособными являются в лучшем случае только несколько поколений тлей,
живущих без эндосимбионтов.
Вторичные эндосимбионты относятся к
не так давно сложившимся ассоциациям. Иногда они горизонтально передаются между
организмами хозяев [23].
У некоторых групп насекомых эти
эндосимбионты живут в специализированных клетках, называемых бактериоцитами
[17]. При созревании половых клеток у самок происходит миграция эндосимбионтов
из бактериоцитов в яйцеклетки, другими словами мать передает эндосимбионтов
своему потомству. В некоторых случаях, бактерии перемещаются в яйцо, как у
Buchnera, у других, таких как Wigglesworthia, они передаются с «молоком» для
развивающегося эмбриона насекомых.
Бактерии, в свою очередь, тоже
получают выгоду от таких взаимоотношений. Во-первых, на них снижается
воздействие хищников. Во-вторых, конкуренция со стороны других видов бактерий
отсутствует. В-третьих, бактерии всегда обеспечены достаточным количеством
питательных веществ и относительной экологической стабильностью внутри хозяина
[21].
Секвенирование генома облигатных эндосимбионтов
насекомых показывает, что их геном гораздо меньше в сравнение с геномом
бактерий, не вступающих в такой тип связи. Бактериальный геном потерял
множество генов в связи с таким существованием. Было выдвинуто несколько
теорий, объясняющих потерю генов. Первое предположение объясняло потерю генов
тем, что существование в щадящих условиях позволило бактериям выключить
некоторые механизмы защиты, и гены, ответственные за работы этих механизмов,
редуцировались. Другая теория предполагает, что относительно небольшое число
бактерий внутри каждого насекомого снизило эффективность естественного отбора,
что привело к потере генов на протяжении многих миллионов лет [24].
1.4.2 Внеклеточные
симбионты тли
Помимо внутриклеточных, очень важную
роль в жизни хозяев играют внеклеточные симбионты. Исследователи доказали
присутствие в пищеварительном тракте тли внеклеточных симбионтов из различных
систематических групп эубактерий [21]. Однако в данный момент не до конца
выявлены функции вторичных симбионтов и их значение для насекомых.
Предполагается их роль в осморегуляции. Тли питаются флоэмным соком, содержащим
высокие концентрации углеводов (прежде всего сахарозы и глюкозы), в связи с чем
подвергаются постоянному осмотическому стрессу. Известно несколько механизмов,
позволяющих насекомым избегать обезвоживания. Высокая концентрация сахарозы
непосредственно уменьшает усвоение сахара, синтез олигосахаридов замедляется,
тем самым снижается концентрация раствора и, следовательно, осмотическое
давление [25 - 28]. Кроме того, в желудок вода дополнительно поступает из
кишки, где осмотическое давление ниже.
Недавно был выявлен еще один
механизм осморегуляции тлей - это потребление ксилемного сока растений. Сок
ксилемы является более разбавленным, чем сок флоэмы: концентрация сахаров и
аминокислот в нем не превышает 1%. Дополнительным осморегуляторным механизмом
может служить способность внеклеточных симбионтов тли к использованию сахаров в
качестве источника углерода и энергии, тем самым в процессе своей
жизнедеятельности внеклеточные симбионты понижают концентрацию сахаров в
ксилемном соке, делая его более приемлемым для насекомого [29].
1.5 Тли как вредители
сельскохозяйственных культур
С давних времен известна высокая
вредоносность злаковых тлей. Вспышки их массового размножения в России
становились причиной гибели посевов или снижения урожаев еще в позапрошлом
столетии. И в настоящее время злаковые тли дают вспышки 2-3 раза в 10 лет,
потери урожая от них достигают 15 %.
В Западной Сибири условный недобор
зерна при сильной степени заселения тлями яровой пшеницы составляет 6 ц/га,
урожай с поврежденных посевов содержит до 66 % щуплых семян, что в 6 раз
больше, чем с неповрежденных.
На посевах зерновых культур нами
отмечено 5 видов злаковых тлей: большая злаковая, черемухово-злаковая,
обыкновенная злаковая, волосатая кукурузная. Среди них наиболее массовые виды -
большая злаковая и черемухово злаковая тли.
Ущерб, причиняемый вредителями и
болезнями растений, велик: мировые потери ежегодно составляют примерно 20 - 25%
потенциального мирового урожая продовольственных культур [8 -10].
Процесс циркуляции вирусов тесно
связан со способами их передачи, особенностями распространения и сохранения.
Знание этих вопросов дает возможность проведения биологически обоснованных
мероприятий по защите растений. Важным и малоизученным резервом снижения
численности вредных организмов являются регуляторы роста, которые, вызывая
физиолого-биохимические изме- нения в растительном организме, способны
оказывать определенное влияние на их развитие и без ущерба окружающей среде
решить проблему значительного снижения потерь от комплекса вирусов и
переносчиков на различных культурах. Физиологически активные вещества
существенно влияют на интенсивность процессов образования и оттока пластических
веществ из листьев в репродуктивные органы, водный режим, уровень содержания и
соотношение компонентов белкового комплекса и углеводов, при этом ингибируя
развитие популяций некоторых вредителей. Роль регуляторов роста и развития
растений резко возросла в последние годы в связи с широким применением
интенсивных технологий возделывания различных культур
Настоящая работа посвящена изучению
возможности снижения интенсивности распространения вирусов бобовых культур
посредством воздействия фитогормонов на развитие и векторные способности их
переносчиков.
Наибольший ущерб урожаю наносят
насекомые, что объясняется прежде всего их биологическими особенностями,
обилием видов, высокой плодовитостью и быстротой размножения.
Растительноядные насекомые
разделяются на многоядных, питающихся растениями разных семейств или питающихся
растениями разных видов одного семейства, или одноядных, - преимущественно
растениями какого-либо одного вида. Вредных насекомых классифицируют также по
группам повреждаемых ими культур - вредители хлебных злаков, вредители овощных
культур [15, 16].
Систематическое изменение человеком
в процессе сельскохозяйственного производства условий биотопа вызывает
соответствующую перестройку биоценологических связей и структуры биоценоза.
Образуются так называемые вторичные биотопы и агробиоценозы [15].
С одной стороны, некоторые одноядные
виды, питавшиеся ранее на специфичных для целины растениях, погибли, что
вызвало обеднение видового состава энтомофауны в новом культурном биотопе, с
другой стороны, некоторые виды насекомых, обитавшие раньше на диких злаках,
перешли на посевы пшеницы, где нашли изобилие более питательных кормов. Этим в
известной степени и объясняется быстрое увеличение численности пшеничного
трипса и серой зерновой совки. Предвидеть и регулировать подобные изменения -
важнейшая научная и практическая задача [10].
Многие представители подотряда тли
являются опаснейшими вредителями растений. Их негативное воздействие
заключается в следующем.
Тли повреждают кормовые растения,
тем самым истощения, уменьшая объем зеленой массы, плохому плодоношению,
преждевременному опадению листьев и образованию галлов, другим видам поражения
и деформации частей; в ряде случаев питание тлей заканчивается гибелью
растения, происходящей за несколько сезонов.
Повторяя новые и новые витки своего
жизненного цикла, тли способны практически бесконечно жить на одном и том же
субстрате, вызывая его усыхание. При этом, длительное питание этих насекомых
соками растений, содержащими мало белка, не мешает им успешно развиваться и
размножаться: у них нет необходимости в белковых веществах, так как, благодаря
симбиозу с азотофиксирующими бактериями, они способны усваивать азот прямо из
воздуха [8].
В процессе жизнедеятельности тли
выделяют сладковатые экскременты - медвяную росу, которую слизывают муравьи.
Таким образом, в «лице» муравьев они привлекают на возделываемые участки земли
и других вредителей растений. У этих насекомых закреплены механизмы взаимной
заботы друг о друге. Тли дают муравьям пищу, а те в ответ оберегают их от
хищников, переносят на неповрежденные сочные побеги и даже уносят самок в свои
муравейники на зиму. Судя по древним находкам - кусочкам янтаря, в которых
находили муравьев вместе с тлями - их взаимовыгодное существование имеет очень
длительную историю, поэтому разрушить эту связь и изгнать вредителей бывает
сложно, даже используя современные методы защиты растений.
Тли переносят фитопатогенные вирусы,
при этом, один и тот же вид насекомого способен распространять до 100
возбудителей опасных болезней растений [30, 31].
2. Материал и методы
Работа проводилась на базе кафедры
микробиологии и физиологии растений и лаборатории молекулярной биологии
биологического факультета Саратовского государственного университета имени Н.
Г. Чернышевского в период с 2015 по 2016 гг.
2.1 Материал
исследования
Объектом исследования являлась
пшеница сорта Волжанка, Жемчужина поволжья и злаковая тля (Schizaphis graminum)
(рисунок 1), собранная на растениях пшеницы сорта Волжанка и Жемчужина поволжья
в периоды колошения (май), цветения (июнь) и молочной спелости (июль) (рисунок
2,3) на полях ФГБНУ «Научно-исследовательский институт сельского хозяйства
Юго-Востока».
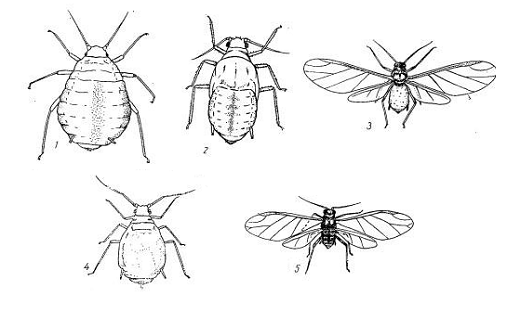
Рисунок 1 - Внешний вид злаковой тля
(Schizaphis graminum):
- основательница; 2 - нимфа; 3 -
крылатая девственница;
- бескрылая девственница; 5 - самец.

Рисунок 3 - Рожь сорта Волжанка в
периоды колошения (А), налива зерна (Б) и молочной спелости (В).
2.2 Методы исследования
Определение систематического
положения насекомых проводили по определителю Блэкман, Истоп [6].
Микробиологические исследования
осуществляли стандартными методами. Непосредственно перед бактериологическим
посевом насекомых усыпляли, обрабатывали в 70% - ном этаноле в течение пяти мин
для уничтожения микроорганизмов, обитающих на внешних покровах, затем промывали
в стерильном физиологическом растворе. 10 экземпляров тлей, обработанных таким
образом, растирали в ступке с 0,5 мл физиологического раствора. Установлено,
что средняя масса 10 особей тлей составляет 0,005 г, таким образом, исходное
разведение составляло 10-2. По 0,1 мл полученной суспензии высевали
на ГРМ - агар (Россия, Оболенск), картофельную среду (КС) следующего состава: H2O - 1 л, картофель - 200 г, агар - 20
г [36].
Посевы инкубировали при температуре
28ºС в течение 48 - 72 ч.
Затем проводили количественный учёт выделенных штаммов микроорганизмов и отсев
их на скошенные питательные среды для дальнейшего изучения.
Морфологические и культуральные
признаки изучали как на первичных посевах, так и на полученных чистых
культурах.
В ходе исследований нами были
изучены некоторые биологические свойства микроорганизмов, такие как:
способность штаммов к использованию различных сахаров (глюкоза, сахароза,
маннит, лактоза, ксилоза, арабиноза, мальтоза, сорбит), цитрата, способность к
гидролизу крахмала, желатина, продукции сероводорода, аммиака, индола. При
изучении ферментативной активности определяли наличие у выделенных штаммов
каталазы и оксидазы.
Так же проводилась работа по определению
устойчивости выделенных штаммов к абиотическим факторам. Нами была изучена
способность штаммов к росту при различных показателях pH среды (6, 8, 11),
концентрациях NaCl в среде (7, 10, 15%), действию температурного фактора (+10 и
+43°С).
Определение структуры микробоценозов
злаковой тли осуществляли с помощью определения индекса встречаемости и индекса
общности различных видов микроорганизмов по В. Н. Беклемишеву [37] с
соответствующей модификацией к изучаемым объектам.
Индекс встречаемости рассчитывали
как отношение числа проб, в которых обнаружены бактерии данного вида, к общему
числу проб, выраженное в процентах.
Идентификацию выделенных штаммов
проводили по Определителю бактерий Берджи [38].
Далее штаммы были изучены на наличие
ферментов, которые могут найти применение в различных биотехнологических
производствах. Нами были выбраны следующие ферменты: пектиназа, целлюлаза и
нитрогеназа. Наличие целюлазы определяли путем посева на среду Гетченсона -
Клейтона, в состав которой входили (г/л): KH2PO4 - 1,0,
MgSO4 - 0,5, FeSO4 - 0,01; NaNO3 - 2,5,
карбоксиметилцеллюлоза - 10, агар - 20.
Изучение способности к фиксации
молекулярного азота, связанной с наличием фермента нитрогеназы, осуществляли на
безазотистой среде Эшби следующего состава (г/л): маннит - 20,0, К2HPO4 - 0,2, MgSO4 - 0,2, NaCl - 0,2, K2SO4 - 0.1, CaCO3 - 5,0, агар - 20.0, pH 7,1 - 7,3.
Постановку всех тестов осуществляли
по общепринятым методикам [39].
3. Результаты
исследования
.1 Видовой состав и
численность ассоциативных микроорганизмов злаковой тли
На первом этапе работы нами
проводилось изучение основных микробиологических показателей (видовой состав,
численность, индекс встречаемости) ассоциативных микроорганизмов злаковой тли,
собранных на растении пшеницы: внешняя часть листа, внутренняя часть листа,
ризосферы и в самой тле.
В результате проведенных
исследований, из 600 ? особей злаковой тли, собранной в периоды колошения (май)
и молочной спелости (июль) с растений пшеницы и ржи.
Таблица 1. Морфологические и
культуральные признаки микроорганизмов злаковой тли
|
Виды бактерий
|
Морфологические признаки
|
Культуральные признаки
|
|
Bacillus
pseudomycoides
|
1.
|
2.
|
|
Bacillus barbaricus
|
палочковидные, грамположительные, спорообразующие подвижные
бактерии
|
Мелкая, непрозрачная, правильная, бесцветная, выпуклая,
блестящая
|
|
Bacillus horikoshi
|
1. Палочка грам + длинные
|
2. Средняя, правильная, полупрозрачная, цвет(оранж), выпуклая,
блестящая
|
|
Bacillus flexus
|
3. палочковидные, грамположительные, спорообразующие подвижные
бактерии
|
4. Мелкая, правильная, полупрозрачная, бесцветная, невыпуклая,
блестящая
|
|
Bacillus
psychrotolerans
|
1. палочковидные, грамположительные, спорообразующие подвижные
бактерии
|
2. Мелкая, правильная, полупрозрачная, бесцветная, невыпуклая,
блестящ
|
|
Kurthia sibirica
|
3. палочковидные, грамположительные, спорообразующие подвижные
бактерии
|
4. Мелкая, полупрозрачная, правильная, цвет.(ж), выпуклая,
шероховатая
|
|
Kurthia gibsonii
|
5. Бацилла грам +
|
6. Большая, полупрозрачная, неправильная, бесцветная, плоская,
блестящая
|
|
Micrococcus agilis
|
Кокки, диплококки, тетра, стафилококк
|
Средняя, непрозрачная, правильная, бесцветная, гладкая, выпуклая
|
|
Micrococcus lylae
|
Кокки грам +
|
Средняя, полупрозрачная, правильная, бесцветная, выпуклая,
блестящая
|
|
Micrococcus
sedentarius
|
7. Микрококк
|
8. Мелкая, непрозрачная, правильная, цвет(п), выпуклая, блестящ
|
|
Listeria innocua
|
3. спора
|
4. Средняя, правильная, непрозрачная, бесцветная, выпуклая,
блестящая
|
|
Listeria grayi
|
Бацилла
|
Средняя, полупрозрачная, неправильная, цвет(ж), плоская,
блестящая
|
Таблица 2. Индекс встречаемости и
количественные показатели микроорганизмов в ржи сорта «Волжанка» в период
колошения
|
Виды
|
Тля
|
Внешняя поверхность
листа
|
Внутренняя среда
|
Ризосфера
|
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
|
Kurthia sibirica
|
40%
|
5×103
|
80%
|
104
|
50%
|
2×103
|
70%
|
5×104
|
|
Bacillus
pseudomycoides
|
50%
|
5×103
|
70%
|
5×104
|
40%
|
104
|
20%
|
5×106
|
|
Bacillus barbaricus
|
50%
|
104
|
50%
|
2×103
|
20%
|
5×104
|
80%
|
105
|
|
Micrococcus agilis
|
10%
|
103
|
60%
|
3×105
|
20%
|
3×103
|
-
|
-
|
|
Micrococcus lylae
|
10%
|
103
|
100%
|
105
|
-
|
-
|
-
|
-
|
Исследование показало, что в мае в
период колошения, данные микроорганизмы были найдены во всех протестированных
объектах. В тле количественные показатели микроорганизмов варьировали в
диапазоне от 103 до 104 КОЕ в пробе, а максимальная
численность наблюдалась у Kurthia sibirica и Bacillus pseudomycoides. Индекс встречаемости изолированных штаммов находился в пределах
10% - 50%, а максимальный индекс встречаемости выявлен у бактерии Bacillus barbaricus. Количественные
показатели микроорганизмов на внешней части листа варьировали в диапазоне от 2×103 до 5×104 КОЕ в пробе.
Максимальная численность наблюдалась у Bacillus pseudomycoides.
Индекс встречаемости изолированных
штаммов на внешней части листа находился в пределах 50% - 100%. Максимальный
индекс встречаемости был у Micrococcus lylae. Во внутренней части листа количественные показатели
микроорганизмов варьировали от 2×103 до 5×104 КОЕ в пробе. Максимальная численность наблюдалась для Bacillus barbaricus. Индекс встречаемости
изолированных штаммов во внутренней части листа находился в пределах 20% - 50%.
Максимальный индекс встречаемости выявлен у Kurthia sibirica, а так же
микроорганизмы были обнаружены на корнях растения ржи и варьировали от 5×104 до 5×106 КОЕ в пробе.
Максимальная численность наблюдалась у Bacillus pseudomycoides. Индекс встречаемости
изолированных штаммов в ризосфере корнях ржи находился в пределах 20% - 80%.
Максимальный индекс встречаемости выявлен у Bacillus barbaricus.
биологический тля
злаковый
Таблица 3. Индекс встречаемости и
количественные показатели микроорганизмов в ржи сорта «Волжанка» в период
цветения
|
Виды
|
Тля
|
Внешняя пов. листа
|
Внутренняя среда
|
Ризосфера
|
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
|
9. Kurthia sibirica
|
50%
|
104
|
50%
|
103
|
40%
|
104
|
80%
|
5×105
|
|
10. Kurthia gibsonii
|
80%
|
103
|
80%
|
2×103
|
-
|
-
|
50%
|
4×104
|
|
11. Bacillus horikoshi
|
20%
|
5×103
|
20%
|
2×103
|
30%
|
4×105
|
10%
|
2×106
|
|
12. Bacillus
pseudomycoides
|
30%
|
5×103
|
40%
|
104
|
10%
|
103
|
20%
|
106
|
|
13. Bacillus
barbaricus
|
50%
|
104
|
20%
|
3×104
|
10%
|
5×103
|
30%
|
2×105
|
|
14. Bacillus flexus
|
10%
|
5×103
|
80%
|
2×105
|
50%
|
104
|
10%
|
105
|
|
15. Micrococcus
sedentarius
|
50%
|
5×103
|
20%
|
2×104
|
50%
|
4×104
|
-
|
-
|
|
16. Micrococcus lylae
|
40%
|
103
|
60%
|
105
|
40%
|
104
|
20%
|
103
|
В период цветения данные
микроорганизмы были найдены во всех протестированных объектах. В тле
количественные показатели микроорганизмов варьировали в диапазоне от 103 до
104 КОЕ в пробе, а максимальная численность наблюдалась у Kurthia gibsonii и Bacillus barbaricus. Индекс встречаемости
изолированных штаммов находился в пределах 10% - 80%, а максимальный индекс
встречаемости был у бактерии Kurthia gibsonii. Количественные показатели микроорганизмов на внешней части листа
варьировали в диапазоне от 103 до 2×105 КОЕ в пробе.
Максимальная численность наблюдалась у Bacillus flexus.
Индекс встречаемости изолированных
штаммов на внешней части листа находился в пределах 20% - 80%. Максимальный
индекс встречаемости были у Kurthia gibsonii и Bacillus flexus. Во внутренней части листа количественные
показатели микроорганизмов варьировали от 103 до 4×105 КОЕ в пробе. Максимальная численность наблюдалась для Bacillus barbaricus. Индекс встречаемости
изолированных штаммов во внутренней части листа находился в пределах 10% - 50%.
Максимальный индекс встречаемости выявлены у Bacillus flexus и Micrococcus sedentarius. Максимальный индекс
встречаемости обнаружены на корнях растения и варьировали от 103 до 2×106 КОЕ в пробе. Максимальная численность наблюдалась у Bacillus
horikoshi. Индекс встречаемости изолированных штаммов в ризосфере корнях ржи
находился в пределах 10% - 80%. Максимальный индекс встречаемости выявлен у Kurthia sibirica.
Таблица 4. Индекс встречаемости и
количественные показатели микроорганизмов в ржи сорта «Волжанка» в период
молочной спелости
|
Виды
|
Тля
|
Внешняя повер. листа
|
Ризосфера
|
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
|
5. Kurthia sibirica
|
20%
|
103
|
50%
|
5×103
|
40%
|
5×103
|
20%
|
105
|
|
6. Listeria innocua
|
10%
|
3×103
|
80%
|
2×103
|
80%
|
5×104
|
50%
|
103
|
|
7. Listeria grayi
|
20%
|
2×103
|
70%
|
3×103
|
50%
|
103
|
40%
|
5×103
|
|
8. Bacillus psychrot.
|
-
|
-
|
70%
|
2×105
|
-
|
-
|
10%
|
104
|
|
9. Bacillus flexus
|
-
|
-
|
60%
|
103
|
20%
|
5×103
|
20%
|
103
|
|
10. Bacillus horikoshi
|
-
|
-
|
50%
|
103
|
20%
|
5×103
|
10%
|
2×104
|
|
11. Micrococcus lylae
|
10%
|
103
|
80%
|
5×103
|
80%
|
5×103
|
50%
|
104
|
В период молочной спелости данные
микроорганизмы были найдены во всех протестированных объектах. В тле
количественные показатели микроорганизмов варьировали в диапазоне от 103до
3×103 КОЕ в
пробе, а максимальная численность наблюдалась у Listeria innocua. Индекс встречаемости
изолированных штаммов находился в пределах 10% - 20%, а максимальный индекс
встречаемости были у бактерий Listeria grayi и Kurthia sibirica. Количественные показатели микроорганизмов на внешней части листа
варьировали в диапазоне от 103 до 5×103КОЕ в пробе.
Максимальная численность наблюдалась у Kurthia sibirica и Micrococcus lylae. Индекс встречаемости
изолированных штаммов на внешней части листа находился в пределах 50% - 80%.
Максимальный индекс встречаемости были у Listeria innocua и Micrococcus lylae.
Во внутренней части листа
количественные показатели микроорганизмов варьировали от 103 до 5×104 КОЕ в пробе. Максимальная численность наблюдалась для Listeria innocua. Индекс встречаемости
изолированных штаммов во внутренней части листа находился в пределах 20% - 80%.
Максимальный индекс встречаемости выявлены у Listeria innocua и Micrococcus lylae. Максимальный индекс
встречаемости обнаружены в ризосфере корнях ржи варьировали от 103
до 2×104 КОЕ в пробе. Максимальная численность наблюдалась у Bacillus
horikoshi. Индекс встречаемости изолированных штаммов в ризосфере корнях ржи
находился в пределах 10% - 50%. Максимальный индекс встречаемости выявлены у Listeria innocua и Micrococcus lylae.
Таблица 5. Индекс встречаемости и
количественные показатели микроорганизмов в пшенице сорта «Жемчужина поволжья»
в период колошения
|
Виды
|
Тля
|
Внешняя поверхность листа
|
Внутренняя среда
|
Ризосфера
|
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
|
Kurthia sibirica
|
50%
|
103
|
80%
|
2×104
|
60%
|
3×103
|
80%
|
2×105
|
|
Bacillus pseudomycoides
|
40%
|
5×103
|
10%
|
5×104
|
10%
|
104
|
10%
|
4×107
|
|
Bacillus barbaricus
|
50%
|
5×103
|
70%
|
5×103
|
40%
|
2×104
|
40%
|
3×105
|
|
Micrococcus agilis
|
80%
|
103
|
40%
|
105
|
10%
|
4×103
|
-
|
-
|
В период колошения данные
микроорганизмы были найдены во всех протестированных объектах. В тле
количественные показатели микроорганизмов варьировали в диапазоне от 103 до
5×103 КОЕ в пробе, а максимальная численность наблюдалась у Bacillus pseudomycoides и Bacillus barbaricus. Индекс встречаемости
изолированных штаммов находился в пределах 40% - 80%, а максимальный индекс
встречаемости был у бактерии Micrococcus agilis. Количественные показатели микроорганизмов на внешней части листа
варьировали в диапазоне от 5×103 до 105 КОЕ в
пробе. Максимальная численность наблюдалась у Micrococcus agilis. Индекс встречаемости
изолированных штаммов на внешней части листа находился в пределах 10% - 80%.
Максимальный индекс встречаемости
был у Kurthia sibirica. Во внутренней части листа количественные показатели
микроорганизмов варьировали от 3×103 до 2×104 КОЕ в пробе. Максимальная численность наблюдалась для Bacillus barbaricus. Индекс встречаемости
изолированных штаммов во внутренней части листа находился в пределах 10% - 60%.
Максимальный индекс встречаемости выявлен у Kurthia sibirica, Максимальный индекс
встречаемости обнаружены на корнях растения и варьировали от 2×105 до 4×107 КОЕ в пробе.
Максимальная численность наблюдалась у Bacillus pseudomycoides. Индекс встречаемости
изолированных штаммов в ризосфере корнях пшеницы находился в пределах 10% -
80%. Максимальный индекс встречаемости выявлен у Kurthia sibirica.
Таблица 6. Индекс встречаемости и
количественные показатели микроорганизмов в пшенице сорта «Жемчужина поволжья»
в период цветения
|
Виды
|
Тля
|
Внешняя поверх. листа
|
Внутренняя среда
|
Ризосфера
|
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
|
Kurthia gibsonii
|
80%
|
103
|
80%
|
2×103
|
50%
|
103
|
50%
|
4×104
|
|
Kurthia sibirica
|
30%
|
5×103
|
40%
|
104
|
80
|
104
|
20%
|
104
|
|
Bacillus horikoshi
|
20%
|
2×103
|
20%
|
3×103
|
30%
|
4×105
|
10%
|
2×106
|
|
Bacillus pseudomycoides
|
50%
|
104
|
50%
|
103
|
40%
|
104
|
10%
|
105
|
|
Micrococcus sedentarius
|
40%
|
5×103
|
80%
|
5×104
|
50%
|
2×103
|
-
|
-
|
В период цветения данные
микроорганизмы были найдены во всех протестированных объектах. В тле
количественные показатели микроорганизмов варьировали в диапазоне от 103 до
104 КОЕ в пробе, а максимальная численность наблюдалась у Bacillus pseudomycoides. Индекс
встречаемости изолированных штаммов находился в пределах 20% - 80%, а максимальный
индекс встречаемости был у бактерии Kurthia gibsonii. Количественные показатели микроорганизмов на внешней части листа
варьировали в диапазоне от 103 до 5×104 КОЕ в пробе.
Максимальная численность наблюдалась у Micrococcus sedentarius. Индекс встречаемости
изолированных штаммов на внешней части листа находился в пределах 20% - 80%.
Максимальный индекс встречаемости были у Kurthia gibsonii и Micrococcus sedentarius.
Во внутренней части листа
количественные показатели микроорганизмов варьировали от 103 до 4×105 КОЕ в пробе. Максимальная численность наблюдалась для Bacillus
horikoshi. Индекс встречаемости изолированных штаммов во внутренней части листа
находился в пределах 30% - 50%. Максимальный индекс встречаемости выявлены у Kurthia gibsonii и Micrococcus sedentarius. Максимальный индекс
встречаемости обнаружены на корнях растения и варьировали от 104 до 2×106 КОЕ в пробе. Максимальная численность наблюдалась у Bacillus
horikoshi. Индекс встречаемости изолированных штаммов в ризосфере корнях
пшеницы находился в пределах 10% - 50%. Максимальный индекс встречаемости
выявлен у Kurthia gibsonii.
Таблица 7. Индекс встречаемости и
количественные показатели микроорганизмов в пшенице сорта «Жемчужина поволжья»
в период молочной спелости
|
Виды
|
Тля
|
Внешняя поверхность листа
|
Внутренняя среда
|
Ризосфера
|
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
ИВ
|
КОЕ
|
|
1. Listeria seeligeri
|
-
|
-
|
50%
|
5×103
|
40%
|
5×103
|
-
|
-
|
|
2. Listeria grayi
|
-
|
-
|
70%
|
3×104
|
20%
|
103
|
10%
|
103
|
|
3. Kurthia gibsonii
|
20%
|
103
|
60%
|
103
|
20%
|
5×103
|
20%
|
103
|
|
4. Bacillus horikoshi
|
10%
|
103
|
80%
|
5×103
|
90%
|
5×104
|
50%
|
105
|
|
5. Bacillus psychrotolerans
|
-
|
-
|
80%
|
5×103
|
10%
|
105
|
50%
|
2×105
|
|
6. Micrococcus lylae
|
20%
|
2×104
|
70%
|
2×105
|
10%
|
103
|
10%
|
103
|
В период молочной данные
микроорганизмы были найдены во всех протестированных объектах. В тле
количественные показатели микроорганизмов варьировали в диапазоне от 103 до
2×104 КОЕ в пробе, а максимальная численность наблюдалась у Micrococcus lylae. Индекс встречаемости
изолированных штаммов находился в пределах 10% - 50%, а максимальный индекс
встречаемости был у бактерий Kurthia gibsonii и Micrococcus lylae. Количественные показатели микроорганизмов на внешней части листа
варьировали в диапазоне от 103 до 2×105 КОЕ в пробе.
Максимальная численность наблюдалась у Micrococcus lylae. Индекс встречаемости
изолированных штаммов на внешней части листа находился в пределах 50% - 80%.
Максимальный индекс встречаемости были у Bacillus horikoshi и Bacillus psychrotolerans. Во внутренней
части листа количественные показатели микроорганизмов варьировали от 103
до 105 КОЕ в пробе. Максимальная численность наблюдалась для
Bacillus psychrotolerans. Индекс встречаемости изолированных штаммов во внутренней части
листа находился в пределах 20% - 90%. Максимальный индекс встречаемости выявлен
у Bacillus horikoshi, Максимальный индекс встречаемости обнаружены на корнях
растения и варьировали от 103 до 2×105 КОЕ в пробе.
Максимальная численность наблюдалась у Bacillus psychrotolerans. Индекс
встречаемости изолированных штаммов в ризосфере корнях пшеницы находился в
пределах 10% - 50%. Максимальный индекс встречаемости выявлены у Bacillus
horikoshi и Bacillus psychrotolerans.
Подводя итоги по выше изложенному
можно сказать, что многие виды микроорганизмов, такие как Bacillus horikoshi,
Bacillus psychrotolerans, Kurthia sibirica хорошо распространены во всех отделах растения. Это говорит о
том, что данные микроорганизмы имеют благоприятные условия для их
существования.
3.2 Биологические
свойства бактерий, выделенных из злаковой тли
В ходе постановки биохимических
тестов нами были проведены исследования сахаролитических свойств
микроорганизмов - ассоциантов злаковой тли (таблица 3). Результаты показали,
что все исследуемые виды способны расщеплять только 16,6% глюкозы и 25%
ксилозы, 41,6% видов утилизируют маннит и 33,6% сахарозу. Полученные данные
согласуются с данными о составе флоэмного сока, которым могут питаться злаковые
тли. В его состав входят различные углеводы [42].
Способность к редукции нитратов
проявляли все изолированные микроорганизмы - ассоцианты, что также связано с
особенностями питания насекомых. Основной источник питания злаковой тли -
ксилемный сок, в состав которого входят нитраты. Источником органического азота
для исследуемых насекомых является флоэмный сок, однако содержание аминокислот
в нем достаточно низкое [41]. Недостаток органического азота тли восполняют за
счёт азотофиксирующих ассоциативных микроорганизмов, к процессу фиксации
молекулярного азота были способны все изолированные виды бацилл.
Так же нами был изучен диапазон
устойчивости выделенных из тли бактерий к некоторым физико-химическим факторам:
температура, pH, концентрация NaCl в среде (таблица 4). Выявлено что, щелочное значение pH при 7% предпочитают 50%
изолятов, а при pH 10%, только 25%. Культивирование в 10°С было благоприятно для
66,6% изолятов, а для при 43°С было выделено в 50% исследуемых штаммов. Наличие
15% NaCl в среде стало летальным для 100% исследуемых штаммов.
Таблица 8. Биохимическая активность
микроорганизмов злаковой тли
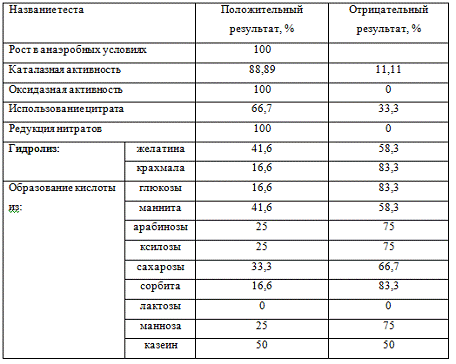
Таблица 9 Устойчивость
микроорганизмов злаковой тли к физико-химическим факторам
|
Название теста
|
Положительный результат, %
|
Отрицательный результат, %
|
|
Температура культивирования
|
10°С
|
66,6
|
33,3
|
|
43°С
|
50
|
50
|
|
Концентрация NaCl
|
7%
|
50
|
50
|
|
10%
|
25
|
75
|
|
15%
|
0
|
0
|
|
Диапазон pH
|
5
|
0
|
0
|
|
6
|
75
|
25
|
|
9
|
83,3
|
16,7
|
|
Диапазон pH
|
10
|
58,3
|
41,7
|
Таблица 10. Целлюлолитическая
активность выделенных штаммов
|
Виды бактерий
|
Целлюлолитическая активность
|
|
Bacillus pseudomycoides
|
+
|
|
Bacillus barbaricus
|
+
|
|
Bacillus horikoshi
|
+
|
|
Bacillus flexus
|
+
|
|
Bacillus psychrotolerans
|
+
|
|
Kurthia sibirica
|
-
|
|
Kurthia gibsonii
|
-
|
|
Micrococcus agilis
|
+
|
|
Micrococcus lylae
|
+
|
|
Micrococcus sedentarius
|
-
|
|
Listeria innocua
|
+
|
|
Listeria grayi
|
+
|
биологический тля
злаковый
Изучение способности к фиксации
молекулярного азота осуществлялась на безазотистой среде Эшби. (таблица 7). К
данному процессу были способны не все исследуемых штаммов (таблица 7), а именно
виды Kurthia и Micrococcus sedentarius
Таблица 11. Способность к фиксации
молекулярного азота
|
Виды бактерий
|
Фиксация N2
|
|
Bacillus pseudomycoides
|
+
|
|
Bacillus barbaricus
|
+
|
|
Bacillus horikoshi
|
+
|
|
Bacillus flexus
|
+
|
|
Bacillus psychrotolerans
|
+
|
|
Kurthia sibirica
|
+
|
|
Kurthia gibsonii
|
-
|
|
Micrococcus agilis
|
+
|
|
Micrococcus lylae
|
-
|
|
Micrococcus sedentarius
|
-
|
+
|
|
Listeria grayi
|
+
|
Таким образом, наши исследования
показали, что организм злаковой тли является средой обитания для узкого круга
сапрофитических бактерий. Насекомое обеспечивает этих бактерий пищевым
субстратом, сглаживает негативное влияние факторов внешней среды. Ассоциативные
бактерии же, в свою очередь, могут участвовать в решении ряда физиологических
проблем организма хозяина, связанных с питанием растительными соками.
Заключение
Микробиоценоз тлей - это активная
динамическая структура. Бактерии - ассоцианты могут снижать осмотическое
давление в пищеварительном канале тли за счёт активного потребления сахаров,
содержащихся в растительном соке. Так же ассоциативные бактерии могут обогащать
организм насекомого-хозяина азотом за счет фиксации молекулярного азота.
Изучение микробоценозов тли с
растениями - это важный этап разработки новых микробиологических методов
ограничения численности насекомых. Существующих биопрепаратов на основе
облигатных энтомопатогенов крайне мало и они имеют ряд недостатков. Причина
этого в высокой степени специализации таких микроорганизмов: гибель насекомых
влечет за собой отмирание самих возбудителей бактериозов.
Список использованных источников
1. Douglas, A. E. Symbiotic interaction / A. E.
Douglas. Oxford: Univer. Press, 1994. 148 p.
2. Маргелис, Л. Роль симбиоза в эволюции клетки / Л.
Маргелис. М.: Мир, 1983. 354 с.
3. URL: http://www.biology-online.org/dictionary/Symbiosis. Дата обращения: 18.03.2015
. Бухарин, О. В. Ассоциативный симбиоз / О. В. Бухарин,
Е. С. Лобакова, Н. В. Немцева, С. В. Черкасов. Екатеринбург: УрО РАН, 2007. 264
с.
. Проворов, Н. А. Генетические и молекулярные основы
симбиотических адаптаций / Н. А. Проворов, И. А. Тихонович // Успехи
современной биологии. 2014. Т. 134, № 3. С. 211 - 226.
6. Blackman, R. L. Aphids on the World's Herbaceous Plants
and Shrubs / R. L. Blackman, V. F. Eastop. St. Louis: Daya Publishing House,
2006. 1439 p.
. Favret, C. Catalog of the aphid genera described from the New World / C. Favret, G. L.
Miller, Nieto Nafría, F. Trans // Soc. Am. 2008. Vol. 133. P. 363 - 412.
8. Васильев, В. П. Вредители плодовых культур / В. П.
Васильев. М.: Государственное издательство сельскохозяйственной литературы, 1958.
399 с.
. Бровдий, В. М. Вредители сельскохозяйственных культур /
В. М. Бровдий. Киев: Урожай, 1973. 576 с.
. Горбачев, И. В. Защита растений от вредителей / В. В.
Горбачев, И. В. Гриценко, Ю. А. Захваткин. М.: Колос, 2002. 472 с.
. Мордвилко, А. К. Насекомые полужесткокрылые (Insecta
Hemiptera). Aphidodea. Фауна России и сопредельных стран, преимущественно по
коллекциям Зоологического Музея Императорской Академии Наук / А. К. Мордвилко.
Петроград: Типография Российской Академии Наук, 1919. Т. 1. 276 с.
12. Comstock, J. H. The Wings of Insects / J. H. Comstock.
New-York: Comstock Publishing, 1918. 430 p.
. Heie, O. E. Palaeontology and phylogeny. Aphids: Their
biology, natural enemies, and control / O. E Heie, A. K. Minks, P. Harrewijn.
Amsterdam: Elsevier, 1987. 568 p.
. Minks, A. K. Aphids: Their biology, natural enemies and
control / A. K. Minks, P. Harrewijn. Amsterdam: Elsevie, 1987. 485 p.
15. Дамрозе, И. П. Эколого-таксономическая и темпоральная
обусловленность распределения популяций крылатых тлей / И. П. Дамрозе. Елгава:
Москва, 1990. 180 с.
. Бобырь, А. Д. Защита растений от вредителей и болезней и
терапия вирусных болезней / А. Д. Бобырь. Киев: Наукова думка, 1962. 566 с.
17. Douglas, A. E. Nutritional Interactions in Insect-Microbial
Symbioses: Aphids and Their Symbiotic Bacteria Buchnera / A. E. Douglas //
Annual Review of Entomology. 1998. Vol. 43. P.
17 - 37.
18. Sauer, C. Bakterielle Endosymbiosen in Insekten / C. Sauer,
B. Hölldobler, R. Gross // Biospektrum. 2006.
Vol. 5. P. 359 - 363.
19. Hampton, O. R. The nature of bean yield reduction by bean
yellow andmosak viruses / O. R. Hampton // Annals of the Entomological Society
of America. 1975. Vol. 65. P. 1342 - 1346.
20. Kennedy, J. S. Benefits to aphids from feeding on galled
and virus-infected leaves / J. S. Kennedy // Nature. 1953. Vol. 195. P. 168 -
825.
21. Baumann, P. The prokaryotes / P. Baumann, N. A. Moranl. New-York: Springer, 2000. 526 p.
22. Tsuchida, Y. R. Distribution and diversity of Wolbachia in
different populations of the wheat aphid Sitobion miscanthi / Y. R. Tsuchida // Global Perspectives on Biology and Management. 2010.
Vol. 37. P. 265 - 272.
23. Van Der Wilk, F. Isolation and characterization of APSE -
1, a bacteriophage infecting the secondary endosymbiont of Acyrthosiphon pisum
/
F. Van Der Wilk, A. M. Dullemans, M. Verbeek, J. F. van den Heuvel // Virology.
1999. Vol. 15, №1. P. 104 - 108.
24. Dunbar, H. E. Aphid Thermal Tolerance Is Governed by a
Point Mutation in Bacterial Symbionts / H. E. Dunbar, A. C. Wilson, N. R.
Ferguson,
N. A. Moran // PLoS Biol. 2007. Vol. 15. P. 231 - 242.
. Wilkinson, T. L. Honeydew sugars and osmoregulation in
the Pea aphid Acyrthosiphon pisum / T. L. Wilkinson, D. A. Ashford, J.
Pritchard, A. E. Douglas // Journal of Experimental Biology. 1997. Vol. 11. P. 2137 - 2143.
26. Ashford, D. A. Living on a high Sugar diet: the fate of
sucrose ingested by a phloem feeding insect, the Pea aphid Acyrthosiphon pisum
/ D. A. Ashford, W. A. Smith, A. E. Douglas // Journal of Insect Physiology. 2000.
Vol. 46. P. 335 - 343.
27. Malone, M. The spittlebug Philaenus spumarius feeds from
mature xylem at the full hydraulic tension of the transpiration stream / M.
Malone, R. Watson, J. Pritchard // New Phytologist. 1999. Vol. 143. P. 261 - 271.
28. Powell, G. Xylem ingestion by winged aphids / G. Powell, J.
Hardie // Entomologia Experimentalis et Applicata. 2002. Vol. 104. P. 103 - 108.
29. Pompon, J. Role of xylem consumption on osmoregulation in
Macrosiphum euphorbiae / J. Pompon, D. Quiring, P. Giordanengo, Y. Pelletier //
Journal of Insect Physiology. 2010. Vol. 56. P.
610 - 615.