Молекулярно-генетическое исследование гибридизации степного орла и орла-могильника в природных популяциях
Оглавление
Введение
. Литературный обзор
.1 Эволюционные теории и гибридизация
.2 Фенотипические последствия гибридизации (примеры у птиц)
.3 Характеристика исследуемых видов
.3.1 Орёл-могильник
.3.2 Степной орёл
.4 Гибридизация в роде Aquila
. Молекулярные методы определения видов
.1 Методы (ПЦР, секвенирование)
.2 Маркеры (баркод и др.)
.3 Молекулярно-генетические исследования видов рода Aquila
. Постановка проблемы исследования
. Материалы и методы
.1 Выделение ДНК
.2 Разработка специфических праймеров для ПЦР
.3 Полимеразная цепная реакция (ПЦР)
.4 Горизонтальный электрофорез
.5 Очистка ПЦР-фрагментов в агарозном геле
.6 Секвенирование по Сэнгеру
.7 Обработка результатов
. Результаты
.1 Поиск маркеров
.2 Подбор праймеров
.3 Характеристика образцов предполагаемых гибридов
.4 Определение пола
.5 Ядерные маркеры
. Обсуждение результатов
.1 Определение пола
.2 Ядерные маркеры
.3 Критерии вида
Выводы
Список литературы
Введение
Актуальность проблемы. Дарвин не зря назвал свой главный труд «Происхождением видов».
Он понимал, что видообразование - основной процесс биологической эволюции
(Дарвин, 1991 - перевод 6-го издания). С точки зрения Дарвина ветви
эволюционного древа с течением времени все более удаляются друг от друга, что
означает необратимость дивергенции видов, произошедших некогда от общего
предка. Вместе с тем, во второй половине ХХ в. сформировалась концепция,
противоречащая теории традиционной дарвиновской дивергентной эволюции и
допускающая вторичное «срастание молодых, концевых побегов» древа эволюции в
результате гибридизации и формирование гибридогенных общностей (популяций,
видов) с новыми свойствами и с неожиданными вариациями развития. (Дарвин, 1991
- перевод 6-го издания), (Северцов, 1988).
Свою статью «Межвидовая гибридизация у птиц: эволюция в действии» (Панов,
2001) один из ведущих специалистов в области этологии Евгений Николаевич Панов
начал с цитаты: «Все, чего мы достигаем искусством, может осуществляться
тысячи и тысячи раз природой, и таким образом часто получаются случайные и добровольные
смешения между животными, и особенно - между птицами.. Кто может сосчитать
незаконные утехи между особями разных видов! Кто сумеет когда-нибудь отделить
бастардные ответвления от законных стволов, определить время их первого
возникновения, установить, одним словом, все следствия могущества Природы
<..> которое она знает, как применить для увеличения числа видов и
заполнения перерывов, их разделяющих». Так писал великий французский
натуралист Ж. Бюффон в «Естественной истории птиц» (1770). Эти слова можно
рассматривать в качестве одной из первых формулировок оформившейся концепции
ретикулярной, или сетчатой, эволюции, основанной на гибридизации (Панов, 2001).
Межвидовая гибридизация у птиц встречается очень часто (отмечена между
850 видами, это 10% мировой фауны). Случаи гибридизации учащаются, когда один
из двух гибридизируемых видов встречается редко. Уже один этот факт говорит,
что гибридизация относится к существенным лимитирующим факторам, отрицательно
влияющим на состояние популяций редких видов птиц (Хубиев, и др., 2012).
Одна из основных причин межвидовой гибридизации (в частном случае
- слияния видов) - нарушение естественных процессов под
воздействием антропогенных факторов (Панов, 1993). Влияние человека на
окружающую среду не проходит бесследно и один из показательных итогов -
исчезновение на Земле различных видов представителей флоры и фауны. Существенна
ли роль гибридизации в их исчезновении? Наше исследование, в этой связи,
вызвано определенным интересом изучения влияния гибридизации на популяции двух
малочисленных, занесенных в Красную Книгу, видов птиц - степного орла и орла
могильника, факты гибридизации которых неоднократно отмечены наблюдателями и
исследователями. Может ли межвидовая гибридизация стать угрозой для
существования одного из видов?
Термин «вид» впервые был предложен еще Аристотелем как совокупность
объектов, объединяемых по сходству. Лишь через 2000 лет, в 1693 г., английский
натуралист Дж. Рей придал понятию «вид» биологический смысл. Согласно Рею,
биологический вид - это совокупность особей, которые объединяются по двум
критериям: практической тождественности морфологических признаков и свободному
скрещиванию с воспроизведением признаков в потомстве. Теперь же, большинство
исследователей приходят к выводу, что морфологический критерий для определения
вида недостаточен (Медников, и др., 2001). К определению вида присоединились
генетики, взяв на вооружение принцип генетической изоляции видов. Однако
исследования по достоверным маркерам генетической специфичности вида малочисленны
и стали возможны лишь благодаря появлению новейших молекулярно- генетических
методов. Поиск и изучение специфичных молекулярно-
генетических маркеров, достоверно идентифицирующих видовые различия,
является актуальной задачей на пути изучения эволюции видов и факторов на неё
влияющих.
Цели и задачи исследования:
Цель работы
• Анализ предполагаемых природных
межвидовых гибридов степного орла и орла могильника молекулярно-генетическими
методами.
Задачи
• Подобрать потенциальные ядерные
маркеры межвидовой гибридизации;
• Определить пол предполагаемых
межвидовых гибридов молекулярно-генетическими методами;
• Установить последовательность
выбранных фрагментов ядерного генома у степного орла, орла могильника и
предполагаемых природных гибридов;
• Оценить эффективность выбранных
маркеров для выявления природных межвидовых гибридов степного орла и орла
могильника.
1.
Литературный обзор
1.1
Эволюционные теории и гибридизация
Гибридизация - объединение при образовании новой формы двух геномов, двух
наборов хромосом, происходящих от разных видов, символизируется на
филогенетической схеме слиянием отдельных не близко родственных генеалогических
линий-ветвей. Это создает картину уже не древа, а сети или «мангровой заросли».
Полученные от разных предков сходные (гомеологичные) хромосомы из-за неполной
гомологии не спариваются, что вызывает расстройство мейоза. Обычное половое
размножение становится невозможным, поэтому почти все виды гибридного
происхождения клонируются путем партеногенеза, гиногенеза и даже андрогенеза
(Grebelnyi, 2000).
Исторически одна из первых догадок о существовании полиплоидии и
гибридизации у позвоночных принадлежит шведскому зоологу Г. Свердсону
(Svardson, 1945). По его мнению, таким путем могло возникнуть семейство
лососевых рыб. Позже это предположение было доказано кариологическими
исследованиями и данными электрофореза, полученными в 1970-е годы B.C.
Кирпичниковым (Кирпичников, 1979).
Гибридизация видов - широко распространённое в природе явление,
способствующее видообразованию.
Ещё Карл Линней в XVIII веке в своём труде «Система природы» говорил:
«<…> исходя из первого растительного начала, было создано столько
различных растений, сколько мы имеем растительных порядков. Эти порядки
смешались в процессе размножения, так что получилось столько растений, сколько
сейчас существует родов. Природа смешала затем все эти формы <…> и из них
создала существующие ныне виды».
Линней предположил, что изначально сотворённые виды (первичные),
скрещиваясь между собой, могли дать множество вторичных видов. Однако шведский
учёный отмечал, что межвидовые гибриды у животных значительно более редки по
сравнению с растениями (Боркин, и др., 2013).
Современник Карла Линнея французский натуралист Жорж Бюффон, обсуждая
проблему гибридизации у животных, предложил в качестве критерия виды «половой
метод»: отсутствие потомства или бесплодность гибридов указывают на
принадлежность скрещиваемых родителей к разным видам, а плодовитость гибридов -
к одному.
Российский учёный Петр Симон Паллас в конце XVIII века отверг гипотезу
Линнея, перечислив «препятствия» для скрещивания между дикими видами (Паллас,
2011):
1) Непреодолимость инстинкта;
2) Бесплодие гибридов, их слабость и
несовершенство;
3) Рассеивание видов по различным
пределам земного шара (т.е географическая изоляция).
Основатель эволюционной теории Чарльз Дарвин также признавал, что
скрещивание разных видов приводит к бесплодным гибридам. Следует отметить, что
вся глава «Происхождения видов», посвященная анализу гибридизации, была
построена на опытах по скрещиванию растений, тогда как сведения о животных были
незначительны (Дарвин, 1991 - перевод 6-го издания).
Межвидовую гибридизацию у растений исследовал и французский ботаник Шарль
Нодэн, современник Дарвина. Нодэн полагал, что качественного различия между
видами, расами и разновидностями нет. На практике, по его мнению, очень трудно
разграничить гибриды (результат скрещивания разных видов) и помеси (результат
скрещивания рас и разновидностей). Ш. Нодэн отрицал возможность слияния разных
видов в один путём гибридизации (Нодэн, 1935).
Однако уже в начале XX века голландский ботаник Ян Лотси выдвинул
концепцию эволюции через гибридизацию видов. Учёный определял вид как группу
генетически близких особей. Из этого следовало, что все животные,
размножающиеся половым путём, должны рассматриваться как гибриды, поскольку все
особи, кроме клонов, генетически гетерогенны, а процесс видообразования
неизбежно ассоциируется с гибридизацией (Лотси, 1914).
В первой трети XX века некоторые зоологи также задумались о
формообразующей роли гибридизации. Немецкий орнитолог Эрвин Штреземанн в 1919
г. обсуждал возникновение гибридных популяций в зоне вторичного контакта
близкородственных видов птиц. Британский орнитолог Перси Р. Лоу в 1929 г.
выдвинул концепцию миктогонии (или плетогамии), которая объясняла многообразие
некоторых групп птиц на островах, например, вымерших моа Новой Зеландии или
галапагосских вьюрков, с помощью гибридизации. Предположение было отвергнуто,
но в наши дни оно снова привлекает к себе внимание.
Благодаря развитию молекулярных и цитогенетических методов во второй
половине XX века появилась возможность оценивать гибриды не только по
морфологическим признакам, но и на генетическом уровне. Последовавшие
исследовательские работы показали, насколько широко распространена гибридизация
в природе, и заставили по-новому взглянуть на значение гибридизации и на
проблему вида в целом.
Становится очевидно, что гибридизация может привести как к образованию
новых видов, так и к поглощению одного вида другим (интрогрессия генов). Последнее
представляет серьёзную опасность для угрожаемых видов, так как может повлечь за
собой их полное исчезновение. Угроза исчезновения особо остра при контакте
многочисленного вида с редким (Заславский, 1967). Например, интродукция
североамериканской кряквы Anas platyrhynchos в Новую Зеландию привела к
гибридизации с местной Anas superciliosa с образованием репродуктивно
успешных гибридов и билатеральной интрогрессией, что, по-видимому, приведёт к
потере идентичности аборигенной утки как отдельного вида (Rhymer, и др., 1994).
Постепенное накопление в смешанной популяции гибридов, вовлекаемых в процессы
размножения, приводит к дальнейшему размыванию четких границ между
взаимодействующими видами.
Следует отметить, что возможность гибридизации среди живых организмов
дала стимул к оформлению во второй половине ХХв концепции ретикулярной, или
сетчатой, эволюции (Боркин, и др., 1980). Сторонники этой теории, в противовес
дивергентной эволюции по Дарвину, допускают вторичное срастание концов
эволюционного древа в результате гибридизации и формирование гибридогенных
популяций или видов с новыми свойствами (Боркин и Даревский 1980; Васильев
1985; Даревский 1986, 1995; Гребельный 2008; Васильев и др. 2010).
Среди позвоночных гибридизации особенно подвержены птицы. Предполагаемые
гибриды двух представителей этого обширного класса и будут рассмотрены в данной
работе.
1.2 Фенотипические последствия гибридизации (примеры у птиц)
В апреле 1964 года в окрестностях посёлка Хасан Приморского края был
добыт гибридный самец обыкновенной и чёрной крякв. Кроме того, гибридные самцы
и самки наблюдались в Японии и Гонконге (Нечаев, и др., 2010).
Был отмечен случай межвидовой гибридизации у гаичек. В 1979 году на
острове Лодейном (вершина Кандалакшского залива Белого моря) было обнаружено
гнездо смешанной пары - самка пухляка Parus montanus и самец сероголовой
гаички P.сinctus. Впоследствии у пары родился гибридный птенец (Шутова,
2009). Образованию смешанной пары у этих видов гаичек, различающихся по
экологии и поведению, вероятно, способствовало островное положение территории,
большая мозаичность растительности, частое образование смешанных стай в
осенне-зимний период и низкая плотность гнездования.
Е.Н. Панов (Панов, 2001) был свидетелем успешного размножения смешанной
пары двух видов овсянок - обыкновенной (Emberiza citrinella) и
белошапочной (E.leucocephalos) - в зоне вторичного контакта.
Вполне логично предположить, что в данном случае процесс перемешивания
генофондов двух близких видов есть не что иное как функция времени. В пользу
этой гипотезы свидетельствуют, прежде всего, изменения, произошедшие за 30 лет
в популяции овсянок Новосибирской обл. Похоже, в данном случае мы столкнулись с
так называемой поглотительной гибридизацией, которая привела к исчезновению
фенотипа белошапочной овсянки и к формированию своеобразной полиморфной
популяции. (Панов, 2001).
1.3 Характеристика исследуемых видов
1.3.1 Орёл-могильник
Могильник - крупная птица семейства Ястребиных (лат. Aquila heliaca),
имеет тёмно-бурую окраску, белые пятна на лопатках (могут быть не выражены),
двуцветный чёрно-серый хвост (рис. 1).

Рисунок 1. Внешний вид орла-могильника
Гнездится в лесостепной и степной зонах Евразии от Венгрии и Балкан до
Закавказья, Средней Азии, Монголии, Забайкалья. Зимует на юге умеренной зоны, в
субтропиках и тропиках Евразии от Аравии до Китая и в долине Нила. Предпочитает
открытые ландшафты, гнездится в лесных балках, рощицах. Гнёзда строит на
больших деревьях. Вид редкий, занесён в Красные книги МСОП, России и
Казахстана. В России исчисляется несколькими сотнями пар (данные Красной Книги)
1.3.2 Степной орёл
Степной орёл (лат. Aquila nipalensis), хищная птица семейства
ястребиных, размером с могильника (рис.2).

Рисунок 2. Внешний вид степного орла
Окраска взрослой птицы однотонно-бурая разных оттенков, молодые птицы
буро-охристые со светлым надхвостьем и подхвостьем, белыми каймами по краю и
середине крыльев и по краю хвоста. Степной орёл обладает более длинным хвостом,
чем могильник. Обитает в полупустынях и пустынях Евразии, ареал смещён на юг и
на север по сравнению с могильником, доходит от Прикаспия до Тибета и
Маньчжурии. Зимует в тропиках и субтропиках Азии и Африки. Гнездится в сухих
целинных степях, горных цепях, последнее время стал селиться в агроландшафтах.
Гнездо строит на курганах, степных
увалах, одиноких деревьях, линиях ЛЭП (из-за чего много птиц гибнет),
иногда на ровной земле.
Степной орел Aquila nipalensis до недавнего времени был самым
многочисленным видом орлов Северной Евразии. С 2015 года степной орел включен в
Красный лист МСОП в статусе критически угрожаемого. Мировая численность
степного орла составляет 26-36,7 тыс. гнездящихся пар, основной ресурс вида
сосредоточен в Казахстане (данные
1.4 Гибридизация в роде Aquila
Гибридизация в роде Aquila встречается в природе нечасто. Описаны гибриды
для большого (A. clanga) и малого (A. pomarina) подорликов в зоне
их контакта в Польше, Беларуси, Прибалтике, на северо-западе Украины и
Европейской части России (Вяли, и др., 2001); (Домбровский, 2002). Вероятно,
причиной гибридизации этих видов служит антропогенное изменение местности,
осушение и мелиорация болотных массивов - основных местообитаний большого подорлика.
Это привело к вселению малого подорлика, самцы которого явились лучшими
добытчиками пропитания в изменившихся условиях.
Известны случаи естественной гибридизации беркута (Aquila chrysaetos)
с испанским орлом-могильником (Aquila [heliaca] adalberti) и малым
подорликом в Испании (McCarthy, 2006). Там же установлена гибридизация между
степным орлом и испанским орлом-могильником (R. Sanchez, pers. сomm; цитировано
по Карякин, 2016).
В Турции наблюдалась смешанная пара степного орла (самец) и орла-
могильника (самка), позже установлено успешное размножение этой пары (M.
Horvath, pers. сomm; цитировано по Карякин, 2016).
В Западном Казахстане, начиная с 2006 г., началось заметное сокращение
численности степного орла и одновременный рост численности орла-могильника,
который стал занимать места обитания степного орла. В зоне контакта обоих видов
на севере и юго-западе Западного Казахстана (кромка Урдинских песков)
происходит формирование смешанных пар.
На кромке Урдинских песков в 2013 г. в одном из гнёзд, ранее занимаемым
степным орлом, была обнаружена самка, идентифицированная как гибрид степного
орла и орла-могильника (AH-K1A - один из исследуемых нами образцов), и самец -
орёл-могильник. В гнезде находился 1 птенец, близкий по окраске к
орлу-могильнику, имеющий отличие лишь в более тёмном буром фоне кроющих верха
крыла (рис.3).

Рисунок 3. Гнездо (E, F), взрослая самка (А, В) и оперяющийся птенец (C,
D) вероятного гибрида степного орла и орла-могильника. 18.06.2013. Фото И. Карякина.
Кроме того, 21 июня 2013 г. в бассейне р. Есенанкаты было проверено
гнездо степного орла, известное с 2006 г. В гнезде была обнаружена взрослая
самка орла-могильника и самец степного орла, принёсший добычу самке.
июня 2015 г. на водоразделе рек Утва и Киыл было обнаружено гнездо,
известное с 2014 г. В гнезде находилась самка орла-могильника и 3 пуховых
птенца. Самец степного орла 4-х летнего возраста принёс самке добычу.
Гибридизация между степным орлом и орлом-могильником происходит не только
в Западном Казахстане.
В 2005 г. в Бетпак-Далы было обнаружено гнездо, в котором сидела самка
орла-могильника, а над ней летал самец степного орла (позже гнездо не
проверялось).
На Сорбулаке близ пос. Караой в Юго-восточном Казахстане в 2014 г.
наблюдался вероятный гибрид степного орла и орла-могильника. Внешне орёл был
близок по окраске к полувзрослому орлу-могильнику, но имел специфическую
охристую окраску темени и характерную для молодого степного орла белую
ювенильную полосу по низу крыла (Беляев, 2014; Коваленко, 2014).
Близкая по окраске птица (вероятный гибрид A. heliaca ×
nipalensis) была встречена в 2015 г. на юге
Оренбургской области близ Орска в скоплении из 4 степных орлов, 2
орлов-могильников, нескольких курганников и коршунов.
В 2010 г. в Даурии в гнезде на земле (рис. 4.) были найдены линные перья
(как изначально думалось, степного орла). Однако анализ D-петли
митохондриальной ДНК показал, что гаплотип идентичен одному из гаплотипов
орла-могильника. Возможно, речь идёт об интрогрессии митохондриального генома
могильника в геном степного орла, что может отражать события гибридизации
могильника со степным орлом при невозможности создать пару с особью своего
вида. Или же имела место попытка размножения смешанной пары. Данный образец
пера включён в исследование.




Рисунок 4. а - гнездо степного орла в Даурии, 2010 г.; б -
предполагаемый хозяин собранного пера. Фото И. Карякина
Все случаи формирования смешанных пар выявлены в зоне контакта двух видов
по периферии ареала степного орла при сокращении численности одного (степного
орла) и росте другого (как в Западном Казахстане), либо при сокращении
численности обоих и недостатке партнёров своего вида (как в Даурии).
2. Молекулярные методы определения видов
2.1 Методы (ПЦР, секвенирование)
Метод полимеразной цепной реакции (ПЦР) является одним из самых
универсальных, высокочувствительных и относительно простых в исполнении
молекулярных методов, который используется во многих областях биологии.
ПЦР представляет собой многократное копирование ДНК, которое проводится in
vitro. В процессе принимают участие 2 коротких олигонуклеотида (праймера),
которые гибридизуют противоположные концы интересующей нас последовательности
ДНК; фермент, катализирующий синтез новой цепи (чаще всего используют
термостабильную ДНК- полимеразу I - Taq-полимеразу, выделенную из бактерии Thermus
aquaticus); смесь четырёх дезоксирибонуклеозидтрифосфатов (дНТФ), из
которых строится новая цепь; реакционный буфер; вода; матрица в виде
растворённой ДНК.
Подготовленная смесь в пробирках помещается в амплификатор, где
циклически в 3 этапа (денатурация, отжиг праймеров, элонгация) происходит
реакция копирования ДНК. Каждому этапу цикла свойственна определённая
температура. На выходе получается большое количество копий исходной матрицы,
которые затем используют для идентификации нуклеотидной последовательности с
помощью метода секвенирования.
Секвенирование представляет собой определение нуклеотидной или
аминокислотной последовательности. Секвенирование ДНК (sequencing) - это общее
название методов, которые позволяют установить последовательность нуклеотидов в
молекуле ДНК. В настоящее время нет ни одного метода секвенирования, который бы
работал для молекулы ДНК целиком; все они устроены так: сначала готовится
большое число небольших участков ДНК (молекула ДНК многократно клонируется и
«разрезается» в случайных местах), а потом читается каждый участок по
отдельности. Широко используемым вариантом секвенирования небольших
ПЦР-фрагментов является секвенирование по Сэнгеру (метод обрыва цепи).
Для реакции требуются праймеры, гибридизующие специфические участки
нужной цепи ДНК; четыре пробирки, в каждой из которых находятся четыре
дезоксинуклеотида (один из них - изотопно меченный) и один из четырёх
дидезоксинуклеотидов (ддНТФ). Дидезоксинуклеотид - искусственно полученный
нуклеотид, лишённый 2’- и 3’-гидроксильных групп при углеродных атомах
сахарного кольца. Поскольку в норме у дезоксинуклеотида отсутствует лишь
2’-гидроксильная группа, а удлинение цепи во время репликации ДНК происходит в
результате присоединения нуклеозидтрифосфата к 3’-гидроксильной группе, то при
присоединении дидезоксинуклеотида (с отсутствующей 3’-гидроксильной группой)
синтез цепи останавливается. Остановка синтеза является ключевым этапом в
методе Сэнгера (Sanger, et al., 1977).
После окончания ферментативного синтеза при участии ДНК- полимеразы в
каждой пробирке оказывается уникальный набор олигонуклеотидов, каждый из
которых содержит праймерную последовательность. Затем в пробирки добавляют
формамид, обеспечивающий расхождение цепей, и проводят электрофорез в
полиакриламидном геле на четырёх дорожках. Такой процесс позволяет разделить
одноцепочечные фрагменты ДНК (Глик, и др., 2002). Современные приборы позволяют
проводить капиллярный электрофорез, с помощью которого молекулы разделяются по
заряду и размеру в заполненном электролитом тонком капилляре. Анализ продуктов
секвенирования проводят на различных секвенаторах, далее результаты
обрабатывают с помощью программных пакетов.
2.2 Маркеры (баркод и др.)
Молекулярными, или генетическими маркерами называются анализируемые
фрагменты ДНК, которые соответствуют гену или некодирующему участку генома и
различаются по вариантам аллелей у исследуемых таксономических групп. Основные
классы молекулярных маркеров (Хлесткина, 2013) приведены ниже:
• AFLP (amplified fragment length polymorphism) - полиморфизм
длины амплифицированных фрагментов.
• CAPS (cleaved amplified polymorphic sequences) - расщепленные
амплифицированные полиморфные последовательности.
• DArT (diversity array technology) - ДНК-чип технология для
изучения разнообразия.
• IRAP (inter-retrotransposon amplified polуmorphism) -
полиморфизм амплифицированных последовательностей между ретротранспозонами.
• ISSR (inter simple sequence repeats) - межмикросателлитные
последовательности.
• RAPD (random amplified polymorphic DNA) - случайно
амплифицированная полиморфная ДНК.
• RFLP (restriction fragment length polymorphism) - полиморфизм
длины рестрикционных фрагментов.
• SCAR (sequence characterized amplified region) -
амплифицированная область, охарактеризованная нуклеотидной последовательностью.
• SNP (single-nucleotide polymorphism) - однонуклеотидный
полиморфизм.
• SSAP (sequence-specific amplification polymorphism) -
полиморфизм сиквенс-специфичной амплификации.
• SSCP (single strand conformation polуmorphism) - полиморфизм
конформации одноцепочечной ДНК.
• SSR (simple sequence repeats) - простые повторяющиеся
последовательности (микросателлиты).
• STS (sequence tagged site) - сайт/локус, маркированный
нуклеотидной последовательностью.
Данные маркеры могут исследоваться с помощью разных методов, таких как
блот-гибридизация, ПЦР-реакция и ДНК-чипы. Молекулярные маркеры широко
используются в популяционной генетике, в исследованиях генетического
разнообразия и в филогенетических исследованиях.
Одним из способов молекулярной идентификации вида зявляется т.н.
баркодирование или «штрих-кодирование» ДНК. Баркодом являются общие для разных
видов короткие маркеры (500-600 bp) в последовательности митохондриальной ДНК,
для которых показано наличие межвидового полиморфизма. У позвоночных это, как
правило, фрагменты гена цитохрома b, у беспозвоночных - первая
субъединица цитохромоксидазы - COI. На основании уже установленных
последовательностей ДНК-баркода строится филогенетическое дерево видов, в
результате чего методом ДНК-баркодинга можно определять таксономическую
принадлежность неизвестного образца в рамках уже известной классификации
(Абрамсон, 2009).
2.3 Молекулярно-генетические исследования видов рода Aquila
В России исследования по генетическому разнообразию орла- могильника Aquila
heliaca не проводились, однако популяции этих птиц изучались на территориях
Испании, Словакии и Казахстана.
Генетическое разнообразие степного орла практически не изучено. В работе
Зиневич Л.С. с соавторами (Зиневич, и др., 2016) впервые было предпринять
исследование разнообразия и состояния природных популяций степного орла
методами молекулярной генетики.
Для целей молекулярно-генетического исследования был использован «золотой
стандарт» неинвазивных методов в популяционной генетике хищных птиц - выделение
ДНК из линных перьев. Были исследованы 94 образца: 83 степных орла, 10
могильников, 1 гибрид. В качестве маркера определена последовательность
контрольного района (D-петли) митохондриального генома. Анализ проводили с
помощью ПЦР и секвенирования по Сэнгеру полной последовательности D-петли с
использованием библиотеки специфических праймеров. На завершающей стадии
использовался филогенетический анализ гаплотипов методом максимальной
парсимонии и анализ их распределения в ранее выделенных популяционных
группировках.
Результатом анализа структуры D-петли рода Aquila стали новые данные: гибридизация генетический aquila секвенирование
• впервые установлена полная последовательность D-петли
степного орла, а также орла могильника; среднее значение попарных генетических
расстояний между степным орлом и могильником по данным мтДНК составляет 0.25;
• гипервариабельный участок D-петли содержит 7 сайтов
однонуклеотидных замен; данный фрагмент является информативным для исследования
внутривидового разнообразия на уровне данного вида.
Путем анализа гипервариабельного участка D-петли авторы пришли к
заключениям, что:
• наиболее древний гаплотип A и его ближайшие
производные B и J встречаются только в отдельных популяциях:
Калмыцкой и Западноказахстанской на западе, и Западномонгольской и Тувинской на
востоке - предположительных центрах видообразования;
• не выявлено специфических групп гаплотипов для западных и
восточных популяций;
• гипервариабельный участок D-петли является перспективным
маркером для оценки состояния генетического разнообразия популяций степного
орла.
• Для выявления случаев природной гибридизации степного орла и
орла могильника требуется поиск молекулярных маркеров.
По результатам определения последовательности контрольного региона
(D-петли) митохондриального генома степного орла было выявлено два случая
предполагаемой интрогрессии митохондриального генома орла- могильника в геном
степного орла (Зиневич, и др., 2016). Поскольку фенотипически птицы также имели
признаки гибридизации, наши дальнейшие исследования посвящены выявлению
молекулярных маркеров в ядерном геноме этих птиц.
3. Постановка проблемы исследования
Несмотря на большое количество описанных случаев гибридизации степного
орла и орла могильника в природе и об успешном размножении фертильных гибридов,
до сих пор не существует подтверждения фактов гибридизации методами
молекулярно-генетического анализа. Выявленные нами случаи формирования
смешанных пар наблюдаются в зоне контакта двух видов по периферии ареала
степного орла при сокращении численности одного (степного орла) и росте другого
(в Западном Казахстане), либо при сокращении численности обоих и недостатке
партнёров своего вида (в Даурии). Поскольку численность степного орла
продолжает сокращаться, процесс гибридизации может усилиться и это явление
требует более тщательного изучения, однако до настоящего времени не выявлено
надежных маркеров, позволяющих выявлять случаи природной гибридизации между
этими видами.
Поиск эффективных молекулярных маркеров, позволяющих подтвердить и
исследовать явление межвидовой гибридизации малочисленных и стремительно
исчезающих видов хищных птиц - орла- могильника и степного орла в природе,
является актуальной научной проблемой, разрешение которой также имеет
практическое значение для выработки стратегий по сохранению популяций редких
птиц.
4. Материалы и методы
1. Выделение ДНК из мезенхимы пера
2. Разработка специфических праймеров
. Полимеразная цепная реакция (ПЦР)
. Горизонтальный электрофорез
. Секвенирование по Сэнгеру
6. Обработка результатов
4.1
Выделение ДНК
Реагенты и материалы:
1. Пинцеты с заостренными концами
2. Лезвия
. Набор для выделения ДНК DNA Prep200 Kit (Diatome, Россия):
Лизирующий реагент, 10-кратный Солевой буфер, сорбент NucleoS, элюирующий
раствор ЭкстраГен.
Выделение ДНК из мезенхимной пульпы пера (Horváth,
et al., 2005) проводили
методом сорбции на микрочастицах на основе диоксида кремния (silica) с помощью
коммерческого набора Diatome DNA Prep200 Kit по протоколу производителя с
некоторыми модификациями.
Для забора мезенхимы пера использовали микрохирургические инструменты:
пинцеты с заостренными концами, лезвия. Из очина пера вырезали участок,
содержащий мезенхимную пульпу, в котором делали продольный разрез, чтобы
облегчить доступ лизирующего реагента к крови. Вырезанный фрагмент пера
помещали в стерильную микроцентрифужную пробирку объемом 1,5 мл и заливали
Лизирующим реагентом (400 мкл). Образец инкубировали не менее 8 часов при
температуре +4°С. Затем термостатировали образец 120 мин при температуре 65°С и
центрифугировали 1 мин. при 5000g. Прозрачный супернатант переносили в чистую
пробирку, куда добавляли 15 мкл суспензии сорбента NucleoS, предварительно
перемешанного на вортексе.
Для связывания ДНК с микрочастицами пробирку со смесью помещали в ротатор
и перемешивали 20 мин. Далее центрифугировали 10 сек при 5000g. Не задевая
осадка, удаляли супернатант с помощью водоструйного насоса. К осадку добавляли
200 мкл Лизирующего реагента, тщательно перемешивали на вортексе до гомогенного
состояния. Добавляли в пробирку 0,5 мл рабочего раствора Солевого буфера
(предварительно 5 мл 10-кратного Солевого буфера доводили бидистиллированной
водой до метки 50 мл и 96% этиловым спиртом до метки 150 мл). Центрифугировали
10 сек при 5000g. Удаляли супернатант, не задевая осадка, с помощью
водоструйного насоса. Добавляли в пробирку 0,5 мл Солевого буфера, перемешивали
содержимое пробирки на вортексе, центрифугировали 10 сек при 5000g и осторожно
удаляли супернатант с помощью насоса. Снова добавляли Солевой буфер и повторяли
процедуру отмывки.
Сушили осадок при температуре 55°С в течение 10 мин, добавляли 50 мкл
элюирующего раствора ЭкстраГен и суспендировали содержимое пробирки на вортексе
10 сек до получения гомогенной суспензии, потом термостатировали 5 мин при
65°С. Ещё раз суспендировали содержимое пробирки на вортексе и центрифугировали
2 мин при 10000 g для осаждения микрочастиц. Супернатант, содержащий выделенную
ДНК, переносили в чистую пробирку и в дальнейшем хранили при температуре -20°С.
Поскольку при выделении из линного пера концентрация и сохранность ДНК в пробе
невелики, оценку качества выделения проводили по результатам ПЦР на фрагмент
D-петли митохондриального генома (фрагмент AND2).
4.2 Разработка специфических праймеров для ПЦР
Последовательности праймеров и температуры отжига приведены в Таблице 1.
Таблица 1.
Последовательности праймеров и температуры отжига.
|
Название
|
Последовательность 5’-3’
|
Температура отжига (°C)
|
|
AND2 (Карякин, и др., 2016)
|
for: CCCCCGGGCTAAATCCATGCC
rev: CCGCGATTAAGAGGCAGAA
|
57
|
|
AK1-6*
|
for:
CAGCCTCCCCATCCCAGCAAAGA, rev: TCCCCGCGTCCACGTAGAGCAG
|
65
|
|
BF7*
|
for: GGTGGCAGTGCTAAGGACA,
rev: TGAAGCAGCTAAGAAAAACAGT
|
57
|
Подбор специфических праймеров на выбранные участки ядерного генома (*)
проводили с помощью программы PrimerSelect из программного пакета LaserGene
(DNAStar, США). Специфичность праймеров проверяли с помощью онлайн-инструмента
Primer BLAST (NCBI). Для исследования структуры D-петли митохондриального
генома степного орла и орла могильника использовали ранее разработанную
библиотеку праймеров AND (Карякин, и др., 2016).
4.3 Полимеразная цепная реакция (ПЦР)
Реактивы:
a) Набор Encyclo Plus PCR kit (Евроген, Россия): 50X смесь
полимераз Encyclo, 5X Encyclo Red буфер, смесь дезоксинуклеозидтрифосфатов (10
мМ каждого), стерильная вода для ПЦР.
b) Специфические праймеры (Синтол, Россия)
Протокол:
1) Смеси для ПЦР приготовляли согласно протоколу производителя. На
объём одной пробы в 20мкл использовали по 0,4мкл рабочих растворов праймеров
(10пМ); 0,4мкл 50-кратных дНТФ; 4мкл 5-кратного буфера; 0,5- 1мкл матрицы;
0,4мкл 50-кратной Taq-полимеразы; оставшийся объём дополняли деионизированной
водой.
2) ПЦР с «горячим стартом» и финальной элонгацией 5 мин. при 72°С
проводили на приборе VeritiFast (Applied Biosystems, США). Параметры цикла
реакции: 95°C 30 секунд (денатурация), 55-65°C 30 секунд (отжиг праймеров),
72°C 45 секунд (элонгация), 35 циклов.
4.4 Горизонтальный электрофорез
Реактивы:
1. 50-кратный ТАЕ-буфер (Tris-base 2M, EDTA 0.05M, Укс. к-та
~1.56M).
2. Агароза Biochemical grade (Helicon, Россия).
3. Бромистый этидий (Sigma, США). Протокол:
1. Приготовление 1х ТАЕ-буфера.
10мл 50х ТАЕ-буфера разбавляли дистиллированной водой до отметки
мл. Рабочий трис-ацетатный буфер: Tris-acetate 40mM, EDTA 1mM, рН=7,6.
2. Заливка агарозного геля
В 60 мл буфера ТАЕ растворяли при нагревании (в микроволновой печи)
агарозу (0,6 г для 1% геля). Охлаждали полученный раствор примерно до 60°C,
добавляли 1,5 мкл бромистого этидия на гель. Размешивали, заливали гель в
собранную камеру для заливки (Helicon, Россия). После того, как гель застывал,
переносили гель в камеру для фореза, наливали в камеру буфер ТАЕ, удаляли
гребенки из геля.
3. Нанесение образцов
3 мкл ПЦР-смеси, содержащей краситель в составе 5х Red буфера, наносили в
лунки геля.
4. Гель-электрофорез
Форез проводили при 120 Вольт с помощью источника тока (Эльф, ДНК-
технология, Россия) 80 мА в течение получаса. Оценивали расположение образцов
по положению лидирующего красителя.
5. Анализ геля проводили на приборе Gel Doc XR 170-8170 170-8171
(Bio-Rad).
6. При наличии дополнительных продуктов ПЦР на электрофоретическом
геле проводили очистку специфического продукта с помощью силика-колонок.
4.5
Очистка ПЦР-фрагментов в агарозном геле
Реагенты и материалы:
1. Набор GeneJET Gel Extraction Kit (Thermo Scientific, США)
2. Этиловый спирт 96% перегнанный
. Микрохирургические инструменты: глазной пинцет, лезвия.
Протокол:
1. С помощью стерильных лезвий и пинцета вырезали из геля
фрагмент, содержащий специфический продукт, помещали в предварительно
взвешенную микроцентрифужную пробирку.
2. По весу геля добавляли двукратный объем Binding buffer,
инкубировали при 55°С до полного растворения агарозы.
3. Переносили содержимое пробирки на колонки, центрифугировали 1
мин. при 5000 g, удаляли фильтрат.
4. На колонку наносили 100 мкл Binding buffer, повторяли
центрифугирование, удаляли фильтрат.
. Центрифугировали колонку с ДНК 1 мин при 5000 g, чтобы удалить
остатки спиртосодержащего буфера.
. Переносили колонку в чистую микроцентрифужную пробирку,
наносили на колонку 20 мкл Elution Buffer, инкубировали 5 мин при 65С и
центрифугировали 1 мин при 14000 g.
. 1 мкл элюата, содержащего очищенную ДНК, наносили на гель для
проверки качества очистки методом электрофореза (см. выше).
4.6
Секвенирование по Сэнгеру
Перед секвенированием проводили переосаждение ДНК с помощью 70% этанола и
ацетата аммония (125 мМ), центрифугировали в течение 20мин. Остатки исходного
буфера удаляли, добавляли к переосажденным и высушенным образцам по 1мкл 4
пкмоль растворов соответствующих праймеров (отдельно прямого, отдельно
обратного), проводили сиквенсовую реакцию с помощью красителя BigDye 3.1
(Applied Biosystems, США). Проводили денатурацию полученных продуктов
формамидом, после чего ставили капиллярный электрофорез в полиакриламидном
геле. Полученные результаты анализировали с помощью секвенатора ABI 3500
(Applied Biosystems, США).
4.7 Обработка результатов
Обработку результатов секвенирования проводили с помощью программ SeqMan
и EditSeq программного пакета LaserGene (DNAStar, США). Полученные
консенсусные последовательности выравнивали для поиска полиморфных сайтов в
программном пакете Mega 5.2 (MEGA, США).
Поиск по подобию, сравнение представленной последовательности с
последовательностями в базе данных GenBank (для выбора подобных нуклеотидных
последовательностей из более чем 70,000 организмов) осуществляли с помощью Standard Nucleotide BLAST на интернет-ресурсе
https://blast.ncbi.nlm.nih.gov/Blast.cgi.
5. Результаты
5.1 Поиск маркеров
В базе данных GenBank были найдены последовательности трех широко
распространенных ядерных маркеров для степного орла Aquila nipalensis и
орла-могильника Aquila heliaca: 3 интрон гена лактатдегидрогеназы, 6
экзон гена аденилаткиназы и 7 интрон гена бета-фибриногена.
a. Aquila heliaca partial ldh gene for lactate
dehydrogenase, intron 3
GenBank number: AJ601502.1
Aquila nipalensis partial ldh gene for lactate
dehydrogenase, intron 3
GenBank number: AJ601503.1
b. Aquila heliaca partial ak1 gene for
adenylate kinase 1, exon 6
GenBank number: AJ601473.1
Aquila nipalensis partial ak1 gene for adenylate
kinase 1, exon 6
GenBank number: AJ601474.1
c. Aquila heliaca beta-fibrinogen gene, intron
7 and partial cds
GenBank number: AY987198.1
Aquila nipalensis beta-fibrinogen gene, intron 7 and
partial cds
GenBank number: AY987199.1
В первом случае по результатам проведения анализа BLAST нуклеотидные
последовательности не имели различий и совпадали на 100%. В случае с
аденилаткиназой наблюдалось 99% идентичности, т.к. имелись несовпадение пары
нуклеотидов и двунуклеотидная вставка в последовательности у орла-могильника; в
третьем случае с бета- фибриногеном наблюдалось 98% идентичности, поскольку
имелось 2 инсерции в последовательности у могильника и несовпадение одной пары
нуклеотидов.
5.2 Подбор праймеров
К маркерам аденилаткиназы и бета-фибриногена с помощью программы Primer
Select (DNAStar, США) были подобраны специфические праймеры AK1-6 и BF7.
Критериями подбора праймеров для ПЦР были: температура отжига (45- 65°С),
длина праймера (17-24 bp), длина продукта (350-500 bp), отсутствие или
минимальное количество вторичных структур (димеров и селф-димеров праймеров,
т.н. «шпилек»), специфичность к объектам исследования.
Характеристики предложенных программой пар праймеров к фрагменту BF7
приведены на Рисунке 5.
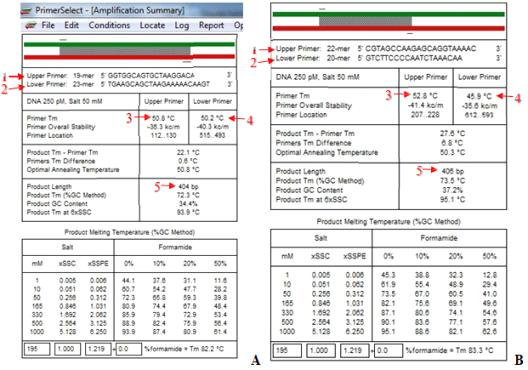
Рисунок 5. «Amplification summary» программы PrimerSelect для подобранных
пар праймеров. А - BF7 var. 1, B - BF7 var. 2; 1 -
последовательность прямого праймера, 2 - последовательность обратного
праймера, 3 - температура отжига прямого праймера, 4 -
температура отжига обратного праймера, 5 - длина продукта
Кроме того, начальная температура отжига была проверена по упрощенной
формуле по GC-составу праймеров:
Ta = (N[G]+ N[C])*4 + (N[A]+ N[T])*2 - 5
Диапазон температуры отжига лежит в пределах Ta ± 5°C
Последовательности подобранных праймеров и температуры отжига указаны в
Таблице 2.
Таблица 2.
Последовательности специфических праймеров и температуры отжига
|
Название пары
|
Последовательность 5’-3’
|
Расчетная температура
отжига по GC-составу
|
|
AK1-6
|
for:
CAGCCTCCCCATCCCAGCAAAGA, rev: TCCCCGCGTCCACGTAGAGCAG
|
69°C 69°C
|
|
BF7 var 1
|
for: GGTGGCAGTGCTAAGGACA,
rev: TGAAGCAGCTAAGAAAAACAGT
|
55°C 55°C
|
|
BF7 var 2
|
for:
CGTAGCCAAGAGCAGGTAAAAC, rev: GTCTTCCCCAATCTAAACAA
|
61°C 51°C
|
Специфичность праймеров к выбранным последовательностям проверяли с
помощью онлайн-поиска в Primer BLAST (NCBI, США) на возможность специфического
связывания с ДНК Homo sapiens и грибов группы Ascomycota -
возможных источников контаминирующей ДНК в пробах. Кроме того, проверяли
специфичность связывания с ДНК близкородственных видов рода Aquila,
чтобы получить максимально универсальную систему анализа последовательностей
данных маркеров внутри рода.
В результате проведенного анализа пара праймеров BF7 var 2 была исключена
из дальнейшего анализа из-за значительной разницы в температурах отжига и
отсутствия универсальности (наличия замен на 3’- конце последовательности
праймера у Aquila chrysaetos).
Результаты ПЦР для пар праймеров AK1-6 и BF7 var.1 (далее BF7) приведены
на Рисунке 6.
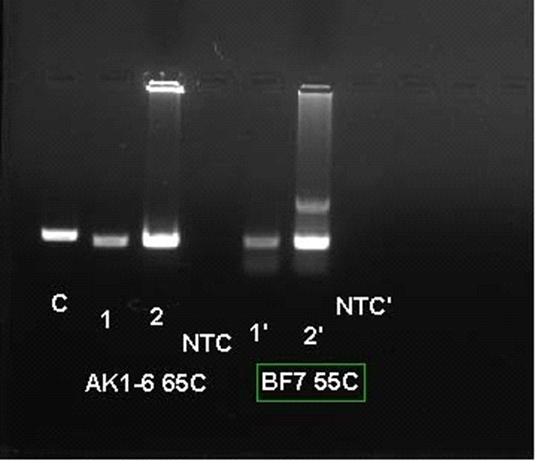
Рисунок 6. Гель-электрофорез продуктов ПЦР-реакции с праймерами AK1-6
(Ta=65°C) и BF7 (Ta=55°C). 1 - Aquila heliaca, 2 -
Aquila nipalensis. С - маркерный ПЦР-фрагмент размером 493 bp: NTC
- контрольная ПЦР-смесь без добавления ДНК.
Видно, что праймеры AK1-6 позволяют получить специфический продукт с
высоким выходом и без неспецифического связывания. На электрофореграммах
продуктов амплификации с праймерами BF7 присутствуют как специфический продукт,
так и продукты неспецифического связывания в виде дополнительных полос, поэтому
для секвенирования данного маркера требуется дальнейшая очистка ПЦР-продуктов в
геле.
5.3 Характеристика образцов предполагаемых гибридов
AH-K1A - перо особи, найденной в гнезде степного орла на дереве на кромке
Урдинских песков в 2013 г. Птица была похожа на гибрид степного
орла и орла-могильника, предположительно являлась самкой. В гнезде
находился самец орла-могильника и 1 птенец, близкий по окраске к орлу-
могильнику, но с более тёмным бурым фоном кроющих верха крыла. D-петля
митохондриального генома линного пера взрослой птицы из гнезда соответствовала
орлу-могильнику.
АN12 - линное перо, найденное в типичном гнезде степного орла на земле в
2010г. в Даурии. Кроме того, была сфотографирована птица с нехарактерной
окраской. Анализ D-петли митохондриальной ДНК показал, что гаплотип также
идентичен одному из гаплотипов орла-могильника.
Кроме того, в анализ последовательности бета-фибриногена 7 интрона был
включен образец ДНК из пера, собранного с гнезда 162AN в 2008 году, для
которого не удалось получить последовательность митохондриальной ДНК по причине
отсутствия специфического связывания праймеров, подобранных для степного орла и
орла могильника и невозможности визуально определить принадлежность пера (рис.
7).

Рисунок 7. Перо образца 162AN (Даурия, 2010 г.)
5.4 Определение пола
Результаты ПЦР-анализа образцов ДНК предполагаемых гибридов с
универсальными праймерами для определения пола у птиц (Fridolfsson, Ellegren,
1999) по фрагменту гена АТФ-зависимой хеликазы CHD1, расположенном в половых
хромосомах, приведены на Рисунке 8.
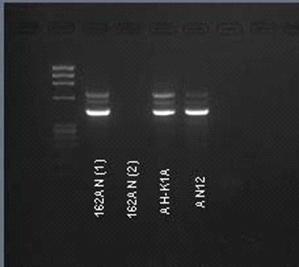
Рисунок 8. ПЦР фрагментов половых хромосом с универсальными праймерами
для определения пола птиц (Fridolfsson, Ellegren, 1999). АН-К1А, AN12 -
предполагаемые гибриды (самки)
На электрофореграммах образцов AH-K1A и AN12 присутствуют две полосы -
размером около 450 bp и более 600 bp. Кроме того, наблюдается присутствие еще
одной полосы между этими двумя полосами. Согласно оригинальной методике, полоса
400-450 bp у беркута соответствует продукту амплификации фрагмента W-хромосомы,
полоса более 600 bp - продукту амплификации фрагмента Z-хромосомы. Таким
образом, оба исследуемых образца принадлежат самкам. Наличие третьей полосы
между фрагментами половых хромосом может быть связано с неспецифическим
связыванием праймеров у степного орла и более высокой чувствительностью
полимеразы по сравнению с оригинальным исследованием, проведенным для беркута.
Кроме того, для сравнения нами были проанализированы с помощью
универсальных праймеров шесть образцов ДНК птенцов филина Bubo bubo.
Результаты молекулярного определения пола приведены на Рисунке 9.
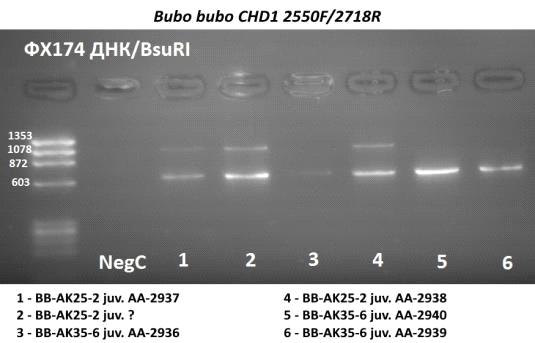
Рисунок 9. ПЦР фрагментов половых хромосом для определения пола птенцов
филина. NegC - негативный контроль, ФХ174 ДНК/BsuRI -
маркер размера молекулярных фрагментов.
У филинов ПЦР-продукты имеют другие размеры: около 1200 bp (что
соответствует продукту W-хромосомы у сов) и около 700 bp (для Z-хромосомы у
сов) соответственно.
5.5 Ядерные маркеры
Нами были проанализированы последовательности фрагмента 6 экзона
аденилаткиназы 1 у 4 степных орлов, 1 могильника, 2 предполагаемых гибридов.
Поскольку полиморфизм по данному участку представляет собой двухбуквенную
инсерцию, в случае гетерозиготы интерпретация
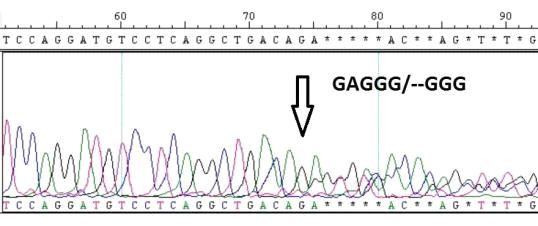
Рисунок 10. Хроматограмма с двухбуквенной инсерцией в гетерозиготе.
Результаты анализа в программе BLAST и полного выравнивания представлены
в Таблице 3 и на Рисунке 11 соответственно (степной орел, могильник, беркут).
Таблица 3.
Результаты анализа в программе BLAST
|
Вид
|
bp (относительно AY987203.1
- Aq. chrys.)
|
AK1-6
|
|
204
|
210
|
270
|
298
|
292-293
|
|
Степной орел
|
T/K (2/2)
|
G (4)
|
C/S (2/2)
|
A/R/G (2/1/1)
|
+/- (1/3)
|
|
Могильник
|
T/K/G (2/1/1)
|
G/R/A (1/2/1)
|
C/S/G (2/1/1)
|
A/R/G (2/1/1)
|
+ (1/1)
|
|
Гибриды (?)
|
G (2)
|
R/A (1/1)
|
S/G (1/1)
|
G (2)
|
± (2)*
|
* гетерозигота определялась визуально по наложению пиков на
хроматограмме
Для 6 экзона аденилаткиназы 1 в 1 случае мы наблюдали двухбуквенную
инсерцию в гомозиготе у птицы с фенотипом и митохондриальным геномом степного
орла. Оба предполагаемых гибрида имели инсерцию в гетерозиготе. Ранее
зафиксированные полиморфизмы по сайтам 204, 270, 298 в 7 интроне
бета-фибриногена оказались неспецифичны для степного орла и могильника. По
сайту 210 мы не наблюдали гетерозиготы или замены у
степного орла.
Последовательность 7 интрона бета-фибриногена образца 162AN совпала с
последовательностями степного орла и могильника на 97%, но на 99%
соответствовала последовательности этого участка у черного грифа (Aegypius
monachus) и на 99% у африканского ушастого грифа (Torgos tracheliotos)
(рис. 11). Поскольку местом сбора образца является Алтае- Саянский регион -
участок ареала только черного грифа - данный образец был определен как линное
перо Aegypius monachus.
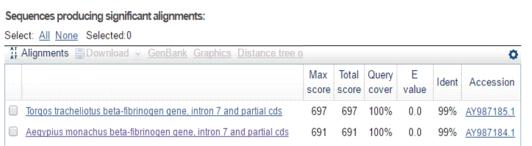
Рисунок 11. Результат проверки последовательности 7 интрона
бета-фибриногена образца 162AN в программе BLAST (NCBI, США)
6. Обсуждение результатов
6.1 Определение пола
Подтверждение
возможности интрогрессии митохондриального генома. По результатам определения пола
предполагаемые гибриды являются самками, следовательно, возможна дальнейшая
интрогрессия митохондриального генома орла могильника в геном степного орла у
их потомков.
Определение
пола у филинов.
Полученные нами результаты ПЦР с универсальными праймерами для определения пола
у птенцов филина Bubo bubo не только иллюстрируют возможности
молекулярно-генетического анализа в исследованиях природных популяций хищных
птиц, но и имеют фундаментальное и практическое значение. Ранее считалось
(Wang, et al., 2008), что у европейского филина и нескольких удаленных видов
сов (болотной совы и пятнистой совки) размер интрона в гене хеликазы CHD1 в
половых хромосомах W и Z совпадают, что довольно трудно объяснить с точки
зрения эволюции нерекомбинирующих половых хромосом у сов. Кроме того, в силу
большого размера ПЦР-продукта W-хромосомы у сов (Fridolfsson, et al., 1999)
данную методику невозможно использовать для определения их пола по линным
перьям, где ДНК сильно фрагментирована, и даже для крови и перьевых трубок
птенцов существует значительная вероятность ошибочного определения самки как
самца. Наши результаты указывают на то, что у европейского филина размер
интрона гена CHD1 W-хромосомы такой же, как у прочих сов. Для окончательного
подтверждения этого результата необходимо установить последовательность
ПЦР-продуктов путем секвенирования, что позволит в дальнейшем разработать на
основе последовательностей интрона гена CHD1 W и Z-хромосом систему
молекулярного определения пола для филина и, возможно, для других сов,
пригодную для определения пола по линным перьям.
6.2 Ядерные маркеры
Оба фрагмента у степного орла и могильника несут предковые полиморфизмы и
не могут каждый в отдельности служить для выявления гибридов, что хорошо
согласуется с известными данными для иных ядерных маркеров - у венгерских
коллег (Szilvia, 2015).
Однако выбранный нами фрагмент бета-фибриногена позволил определить
линное перо черного грифа. Таким образом, 7 интрон бета- фибриногена не
является подходящим маркером для выявления гибридов степного орла и орла
могильника, однако является маркёром для более удалённых видов (чёрного грифа Aegypius
monachus) и может быть использован для определения видовой принадлежности
линных перьев, собранных в природе.
6.3 Критерии вида
Выявление межвидовой гибридизации даёт основания задуматься о критериях
вида и видообразовании. Становится ясно, что критерий репродуктивной изоляции
уже не является решающим при присвоении видового статуса.
Как отметил Гаррисон (Harrison, et al., 2014), репродуктивная изоляция
является характеристикой не целого генома, а каких-то областей генома. Это
позволяет границам вида быть полупроницаемыми. Благодаря такой
полупроницаемости происходит гибридизация между видами. Но даже если два вида
скрещиваются, у них некоторая часть генотипа остаётся не подверженной
гибридизации. Поэтому эти два вида по сути остаются «репродуктивно
изолированными» в том смысле, что они не сливаются в одну популяцию, несмотря
на утечку некоторых генов.
Выводы
1. Последовательность 3 интрона гена лактатдегидрогеназы у
степного орла и орла могильника совпадает полностью, в 7 интроне бета-
фибриногена наблюдаются мононуклеотидные замены, 6 экзон гена аденилаткиназы 1
у орла могильника содержит двухбуквенную инсерцию.
2. Предполагаемые природные гибриды являются самками и могут
служить источником интрогрессии митохондриального генома орла могильника в
популяции степного орла.
. Универсальные праймеры 2550F и 2718R для определения пола у
птиц позволяют получить ПЦР-продукты, характерные для большинства сов, у
европейского филина Bubo bubo.
. Выбранные фрагменты 7 интрона бета-фибриногена и 6 экзона
аденилаткиназы 1 содержат общие для двух видов сайты полиморфизма, однако
комбинация детектированных замен указывает на гибридное происхождение
исследованных птиц.
. Выбранные фрагменты ядерного генома не могут служить
эффективными маркерами для выявления природных гибридов степного орла и орла
могильника, однако 7 интрон бета-фибриногена является маркёром для более
удалённых видов (чёрного грифа Aegypius monachus) и может быть
использован для определения видовой принадлежности линных перьев, собранных в
природе.
. В настоящее время в природных популяциях степного орла и орла
могильника происходит межвидовая гибридизация, приводящая к интрогрессии
митохондриального генома орла могильника в популяции степного орла и ядерного
генома степного орла - в популяции могильника.
Степной орел и орел могильник являются близкородственными видами с
отсутствием строгой репродуктивной изоляции и высокой гомологией ядерных геномов.
При сокращении их численности происходит взламывание изолирующих барьеров,
приводящее к интрогрессии генома одного вида в популяции другого и размыванию
межвидовых различий. Явление межвидовой гибридизации может стать угрозой для
существования степного орла как вида в ареале орла могильника.
Для дальнейшего изучения экологической и эволюционной роли межвидовой
гибридизации необходимо:
1. Сравнить полные последовательности ядерного и митохондриального
геномов степного орла и орла могильника методами NGS для выявления статусных
генов, ответственных за межвидовые различия.
2. Провести множественные сравнения видоспецифических
морфологических и поведенческих признаков и ядерных маркеров для выявления
генетических основ видоспецифических различий.
Список
литературы
1. Altukhov Yu. P. Intraspecific Genetic
Diversity. Monitoring, Conservation and Management [Книга]. - Berlin : Heidelberg:
Springer-Verlag, 2006. - Т. 10.1007/3-540-30963-2.
2. Anderson Edgar INTROGRESSIVE
HYBRIDIZATION [Книга]. - New York, London :
John Wiley & Sons, Chapman & Hall, Limited/, 1949. - PAUL A., DAVID R.,
FRANCIS O.
3. Fridolfsson AK и Ellegren H A simple and universal
method for molecular sexing of non-ratite birds. [Статья] // J Avian Biol. 30:116-121. - 1999 г.
4. Grebelnyi The mechanisms of
unisexual reproduction and pure either maternal or paternal inheritance. [Отчет]. - St. Petersburg :
Zoological Institute, Russian Academy of Sciences, 2000.
5. Harrison Richard G. и Larson Erica L. Hybridization,
Introgression, and the Nature of Species Boundaries [Статья] // Journal of Heredity, 105 (S1):
795-809. - 2014 г.
6. Horváth
MB [и др.] An overlooked DNA source for
non-invasive genetic analysis in birds [Статья] // J Avian Biol, 36:84-88. - 2005 г.
7. McCarthy Eugene M. Handbook of Avian Hybrids
of the World [Книга]. - New York : Oxford
University Press, Inc., 2006.
8. Olszewski A. и Matusiak J. Breeding of a mixed pair
of the Greater Spotted Eagle Clanga clanga and the Lesser Spotted Eagle Clanga
pomarina in Central Poland. - Warshawa : Kampinos National Park., 2016 г. - Т. 5.
9. Randler C. Avian hybridization, mixed
pairing and female choice. [Журнал]. - [б.м.] : Animal Behaviour., 2002 г. - 1 : Т. 63.
10. Rhymer JM, Williams MJ и Braun MJ Mitochondrial analysis of
gene flow between New Zealand mallards (Anas platyrhynchos) and grey ducks (A.
superciliosa). [Журнал].
- [б.м.] : Auk 111:970-978., 1994 г.
11. Sanger F., Niclein S. и Coulson A.R. DNA sequencing with chain-
terminating inhibitors [Статья] // Proc Natl Acad Sci
USA. С. 5463-5467. - 1977 г. - Т. Т. 74.
12. Svardson G. Chromosome studies on
Salmonidae. [Статья] // Fish Res. -
Drottingholm : Rep. Swed. State Ins., 1945 г. - 23:1-51.
13. Szilvia Jakab A parlagi sas (Aquila
Heliaca) és a pusztai sas (Aquila Nipalensis)
hibridizációjának molekuláris vizsgálata [Журнал]. - 2015 г.
14. VÄLI
Ü. Mitochondrial
pseudo-control region in old world eagles (genus Aquila) [Статья] // Molecular Ecology. - Tartu :
Institute of Zoology and Hydrobiology, University of Tartu., 2002 г. - 11.
15. Wang L.C. [и др.] Sex identification of owls (family
Strigidae) using oligonucleotide microarrays. [Статья] // The Journal of Heredity 99: 187-192. -
2008 г.
16. Zink Robert M. The role of subspecies in
obscuring avian biological diversity and misleading conservation policy. [Книга]. - London : The Royal
Society, 2004.
17. Абрамсон Н. И. МОЛЕКУЛЯРНЫЕ МАРКЕРЫ, ФИЛОГЕОГРАФИЯ И ПОИСК КРИТЕРИЯ
РАЗГРАНИЧЕНИЯ ВИДОВ. [Статья] // Труды Зоологического института РАН. - Санкт
Петербург : Зоологический институт РАН, 2009 г. - Приложение № 1.
19. Алтухов Ю. П. Генетические процессы в популяциях. [Книга]. -
Москва : ИКЦ «Академкнига», 2003. - Т. 431 c.
20. Боркин Л. Я. и Даревский И. С. Сетчатое (гибридогенное)
видообразование у позвоночных. С. 485-506. [Журнал]. - [б.м.] : Журн. общ.
биол., 1980 г. - 4 : Т. 41.
21. Боркин Л. Я. и Литвинчук С. Н. ГИБРИДИЗАЦИЯ, ВИДООБРАЗОВАНИЕ И
СИСТЕМАТИКА ЖИВОТНЫХ. [Статья] // Труды
Зоологического института РАН. - Санкт-Петербург, :
Зоологический институт, Российская академия наук, 2013 г. - Приложение № 2,.
22. Боркин Л. Я. Сетчатое видообразование: эволюция не по Дарвину? // Доклад.
- Санкт-Петербург : Зоологический институт РАН, 2010 г.
23. Бурковский О. А. и Васик О. Н. Первая регистрация гибрида
бургомистра Larus hyperboreus и восточносибирской чайки L. vegae у берегов
Южного Приморья. [Журнал]. - [б.м.] : Русский орнитологический журнал, 2016 г.
- 1266 : Т. 26.
24. Водолажский Д.И. Вимерс М., Страдомский Б.В. Сравнительный анализ
последовательностей митохондриальной и ядерной ДНК голубянок подрода
Polyommatus (s. str.) Latreille, 1804 (Lepidoptera: Lycaenidae: Polyommatus).
[Статья] // Кавказский энтомол. бюллетень. - [б.м.] : CAUCASIAN ENTOMOLOGICAL
BULL., 2009 г. - 5 (1).
25. Вяли Ю.И. и Лыхмус А.А. Актуальные проблемы изучения и охраны
птиц Восточной Европы и Северной Азии. Материалы Международной конференции (XI
Орнитологическая конференция). С. 154- 155 [Конференция] // Характеристика
гибридов большого и малого подорлика (Aquila clanga x pomarina). - Казань :
[б.н.], 2001.
26. Глик Б. и Пастернак Дж. Молекулярная биотехнология. Принципы
и применение. [Книга]. - Москва : Мир, 2002.
27. Глущенко Ю. Н. Темпы пополнения авифаунистического списка Приморского края в
начале XXI столетия. [Статья] // ЖИВОТНЫЙ И РАСТИТЕЛЬНЫЙ МИР ДАЛЬНЕГО ВОСТОКА.
- Владивосток : Дальневосточный федеральный университет, 2016 г. - Научное
электронное издание.
28. Грант В. Эволюция организмов. [Книга]. - Москва : Мир, 1982.
29. Дарвин Ч.
Происхождение видов путём естественного отбора, или Сохранение благоприятных рас в борьбе за жизнь (On the Origin of Species by Means
of Natural Selection, or the Preservation of Favoured Races in the Struggle
for Life). [Книга]. - Лондон (1859), Санкт-Петербург :
«НАУКА», 1991 -
перевод 6-го издания.
30. Даревский И. С. Видообразование путем гибридизации у животных.
[Статья] // Методы исследования в экологии и этологии. - Пущино : НЦ биол иссл.
АН СССР, 1986 г. - Сборник трудов. - С. 35-73.
31. Домбровский В.Ч. Гибридизация малого (Aquila pomarina) и большого
(Aquila clanga) подорликов в Беларуси: правило или исключение? [Статья] //
Subbuteo №5(1). С. 23-31. - 2002 г.
32. Заславский В.А. Репродуктивное самоуничтожение как экологический
фактор (экологические последствия генетического взаимодействия популяций).
[Журнал]. - [б.м.] : Журнал общей биологии., 1967 г. - 1 : Т. 28.
33. Зиневич Л.С. [и др.] Генетическое разнообразие популяций
степного орла в условиях быстрого сокращения численности вида. [15-
Zinevich-etal-21-09-2016.pdf]. - ФГБУН Институт биологии развития им. Н.К.
Кольцова РАН; ООО «Сибэкоцентр». : при поддержке проекта ПРООН/ГЭФ/Минприроды
России «Совершенствование системы и механизмов управления ООПТ в степном биоме
России»., 2016 г.
34. Карташов Н. Н. Систематика птиц. [Книга]. - Москва : «Высшая школа», 1974.
35. Карякин И.В. [и др.] ПОПУЛЯЦИОННАЯ СТРУКТУРА АРЕАЛА
СТЕПНОГО ОРЛА И ПРЕДВАРИТЕЛЬНЫЕ ДАННЫЕ ПО ГЕНЕТИЧЕСКОМУ РАЗНООБРАЗИЮ ЕГО
ПОПУЛЯЦИЙ И СТАТУСУ ПОДВИДОВ. [Журнал]. - [б.м.] : Журнал «Пернатые хищники и
их охрана / Raptors Conservation», 2016 г. - 32.
36. Карякин И.В. Коваленко А.В., ПЕРВЫЙ СЛУЧАЙ УСПЕШНОГО ВЫВЕДЕНИЯ
ПОТОМСТВА СМЕШАННОЙ ПАРОЙ СТЕПНОГО ОРЛА И ОРЛА-МОГИЛЬНИКА В ЗАПАДНОМ КАЗАХСТАНЕ
И РЕГИСТРАЦИИ ВЕРОЯТНЫХ ГИБРИДОВ МЕЖДУ СТЕПНЫМ ОРЛОМ И ОРЛОМ-МОГИЛЬНИКОМ В
РОССИИ И КАЗАХСТАНЕ. [Журнал]. - [б.м.] : Пернатые хищники и их охрана, 2016 г.
- 32.
37. Кирпичников В.С. Генетические основы селекции рыб [Книга]. -
Ленинград : Наука, 1979.
38. Коблик Евгений А. Разнообразие птиц (по материалам экспозиции
зоологического музея МГУ). [Книга]. - Москва : Ордена "Знак почета"
издательство Московского университета, 2001. - Т. 1-4.
39. Кобозева Е.В. ДИССЕРТАЦИЯ на соискание ученой степени кандидата
биологических наук. // Видовая специфичность и таксономические взамоотношения
видов StY-геномной группы рода Elymus L. Азиатской России. - Новосибирск :
[б.н.], 2014 г.
40. Коляда А.С. (составитель) Животный и растительный мир Дальнего
Востока. [Статья]. - Владивосток : Дальневосточный федеральный университет,
2016 г. - Электронный ресурс. - 27.
41. Комиссия по генетическим ресурсам в сфере продовольствия
и сельского хозяйства. Продовольственная и сельскохозяйственная организация
Объединенных Наций. Молекулярные
маркеры - инструмент исследования генетического разнообразия. [Отчет]. -
Рим-Москва : Agriculture and Consumer Protection, 2010.
42. Лотси Я. Опыты с видовыми гибридами и соображения о возможности
эволюции при постоянстве видов. [Раздел книги] // Новые идеи в биологии.
Сборник 4. С Наследственность I. С. 112-123. - СПб. : Образование, 1914.
43. Майр Э. Зоологический вид и эволюция. [Книга]. - Москва :
"МИР", 1968.
44. Медников Б.М., Шубина Е.А. и Мельникова М.Н. Молекулярные механизмы генетической
изоляции. [Журнал]. - [б.м.] : Журнал "Природа", 2001 г. - 5.
45. Мельникова М. Н. и др. Исследование полиморфизма и
дивергенции геномной ДНК на видовом и популяционном уровне (на примере пород
диких и домашних овец). [Журнал]. - [б.м.] : Генетика., 1995 г. - 8 : Т. 31.
46. Моргун В. (главный редактор) Типы молекулярно-генетических
маркеров и их применение. [Статья] // Физиология и биохимия культ. растений. -
Киев : Институт физиологии растений и генетики НАН Украины, 2002 г. - 4 : Т.
34.
47. Нечаев В.А. [и др.] Гибриды между обыкновенной (Anas
platyrhynchos L.) и черной (Anas (poecilorhyncha) zonorhyncha Swinhoe) кряквами
в Приморском краегенетики Сибирского отделения Российской академии наук.
[Статья] // Вестник ДВО РАН. - Владивосток : ДВО РАН, 2010 г. - 4.
48. Нодэн Ш. Новые исследования над гибридностью у растений. [Раздел
книги] // Избранные работы о растительных гибридах. С. 9-155 / авт. книги Огюстэн
Сажрэ Шарль Нодэн, Грегор Мендель. - Москва-Ленинград: : Государственное
издательство биологической и медицинской литературы (Классики биологии и
медицины)., 1935.
49. П.С. Паллас Мемуар об изменчивости животных (Mémoire
sur la Variation des Animaux). Историко-биологические исследования. [Книга]. - Санкт-Петербург :
[б.н.], 2011.
50. Паллас П.С. Мемуар об изменчивости животных (Mémoire
sur la Variation des Animaux). Историко-биологические исследования. [Книга]. - Санкт-Петербург : [б.н.],
2011.
51. Панов Е. Н. «Гибридизация и проблема вида у позвоночных». Сборник под
ред. О. Л. Россолимо. // Границы вида и гибридизация у птиц. - Москва : Изд-во
МГУ, 1993 г.
52. Панов Е. Н. Межвидовая гибридизация у птиц: эволюция в действии.
[Журнал]. - [б.м.] : Журн. Природа, 2001 г. - № 6.
53. Панов Н. Е. Границы вида и гибридизация у птиц. [Статья] //
"Гибридизация и проблема вида у позвоночных". Сборник под ред. О.Л.
Россолимо. - [б.м.] : Изд-во МГУ, 1993 г.
54. Рубцов А. С. Эволюционная роль гибридизации у птиц на примере обыкновенной
(Emberiza citrinella) и белошапочной (E. leucocephalos) овсянок. [Книга]. -
Москва : Государственный Дарвиновский музей., 2009.
55. Северцов А. Н. Главные направления эволюционного процесса.
Морфобиологическая теория эволюции. [Книга]. - Москва-Ленинград : Гос. изд-во
биол. и мед. лит-ры., 1934.
56. Северцов А. С. Современные концепции вида [Статья] //
Бюллетень. - [б.м.] : МОИП. Отд. биол., 1988 г. - 6 С. 3-15.
: Т. 93.
57. Спиридонова Л. Н. ИНТРОГРЕССИЯ МАРКЕРОВ ЯДЕРНОЙ И МИТОХОНДРИАЛЬНОЙ ДНК
Mus musculus musculus В АБОРИГЕННЫЕ ПОПУЛЯЦИИ МЫШЕЙ СРЕДНЕЙ АЗИИ (M. m.
wagneri) И ЮГА СИБИРИ (M. m. gansuensis). [Статья] // МОЛЕКУЛЯРНАЯ БИОЛОГИЯ. -
Владивосток : [б.н.], 2014 г. - 1 : Т. 48.
58. Хлесткина Е. К. МОЛЕКУЛЯРНЫЕ МАРКЕРЫ В ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЯХ И В
СЕЛЕКЦИИ. [Статья] // Вавиловский журнал генетики и селекции. - Новосибирск :
Федеральное государственное бюджетное учреждение науки Институт цитологии и
генетики Сибирского отделения Российской академии наук., 2013 г. - 4/2 : Т. 17.
59. Хубиев А.Б. и Караваев А.А. Лимитирующие факторы, влияющие на
состояние популяций редких видов птиц Карачаево-Черкесии. [Журнал] //
Современные проблемы науки и образования. № 2. - 2012 г. - стр. 351.
60. Шутова Е. В. О случае гибридизации пухляка Parus montanus и сероголовой
гаички P. cinctus в естественных условиях. [Журнал]. - [б.м.] : Русский
орнитологический журнал, 2009 г. - 473 : Т. 18.