Молекулярно-генетическая характеристика рекомбинантных форм вируса иммунодефицита человека 1 типа, выявленных на территории Республики Беларусь
ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ
«РЕСПУБЛИКАНСКИЙ НАУЧНО-ПРАКТИЧЕСКИЙ
ЦЕНТР ЭПИДЕМИОЛОГИИ И МИКРОБИОЛОГИИ»
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ
ХАРАКТЕРИСТИКА РЕКОМБИНАНТНЫХ ФОРМ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА 1 ТИПА, ВЫЯВЛЕННЫХ НА ТЕРРИТОРИИ РЕСПУБЛИКИ
БЕЛАРУСЬ
ВВЕДЕНИЕ
Вирус иммунодефицита человека (ВИЧ) является одной из наиболее значимых
угроз для глобального здоровья человечества. Согласно современной классификации
выделяют 2 типа ВИЧ: ВИЧ-1 и ВИЧ-2, основной вклад в эпидемию вносит ВИЧ-1,
распространение которого в мире носит характер пандемии[1, 2], и на конец2014
года в мире насчитывалось около 36,9 миллиона человек, живущих с ВИЧ-инфекцией
[3]. По данным ООН, 30-40 миллионов человек умерло от синдрома приобретенного
иммунодефицита (СПИД) с момента первого упоминания о ВИЧ-инфекции в начале 80-х
годов XX века [4].
Одним из основных препятствий в борьбе с эпидемией ВИЧ/СПИД в мире
является высокая скорость геномных мутаций и, как следствие, высокое
генетическое разнообразие вируса. Результат такой высокой изменчивости -
ускользание вируса от воздействий иммунной системы, возникновение мутаций
резистентности и последующая невосприимчивость к терапии. Фундаментом
генетического разнообразия ВИЧ-1 являются, по крайней мере, 3 фактора:
многократное внедрение вируса в человеческую популяцию, низкая точность и
высокая рекомбиногенность обратной транскриптазы ВИЧ-1, а также высокий уровень
генетической гетерогенности вируса в инфицированном организме, называемый
«квазивид».
При коинфекции человека двумя и более различными субтипами ВИЧ в процессе
репликации вируса могут возникать рекомбинантные формы. Такие вирусы содержат
генетический материал от разных родительских вариантов ВИЧ. Это создает
дополнительную проблему при разработке вакцин, поскольку, согласно рекомендациям
ООН, кандидатные вакцины должны создаваться на основе штаммов вирусов,
доминирующих в конкретном регионе. Кроме этого, рекомбинантные формы могут
наследовать мутации резистентности от родительских вариантов, тем самым снижая
эффективность высокоактивной антиретровирусной терапии (ВААРТ).
В Республике Беларусь за последние 5 лет ежегодно регистрируется более
1000 новых случаев ВИЧ-инфицирования, а за 2015 год количество выявляемых
случаев превысило 2000. Хотя доминирующим субтипом ВИЧ-1 в Беларуси является
субтип A1, зарегистрировано появление циркулирующих рекомбинантных форм (ЦРФ)
ВИЧ-1, а также впервые выявлена новая уникальная рекомбинантная форма (УРФ)
ВИЧ-1 AB, ранее никем не описанная.
Все это создает предпосылку для выявления и молекулярно-генетического
анализа рекомбинантных форм ВИЧ-1 на территории Республики Беларусь.
Связь работы с крупными научными программами и темами
Тема диссертационного исследования и научный руководитель были утверждены
приказом директора РНПЦ эпидемиологии и микробиологии от 29.12.2012№ 56.
Исследования были выполнены в государственном учреждении «Республиканский
научно-практический центр эпидемиологии и микробиологии» по заданию 02.16
«Разработать диагностическую тест-систему для определения мутаций
резистентности ВИЧ-1» (2013-2015гг., № госрегистрации 20115329 от 16.12.2011);
по заданию 01.08 «Разработать и внедрить в практику здравоохранения систему
молекулярно-эпидемиологического мониторинга за ВИЧ/СПИД, подготовить и внедрить
контрольную панель сывороток крови на основе преобладающих в Беларуси субтипов
ВИЧ-1» (2011-2013 гг., № госрегистрации 20115334 от 16.12.2011) в рамках
выполнения ГНТП «Новые технологии диагностики, лечения и профилактики»,
подпрограмма «Инфекции и микробиологические нанотехнологии»; по заданию 4.14
«Разработать тест-систему ПЦР на основе консенсусных последовательностей гена pol
для диагностики и генотипирования ВИЧ-1» в рамках выполнения Подпрограммы 1
«Инновационные биотехнологии в Республике Беларусь», МЦП ЕврАзЭС «Инновационные
биотехнологии» на 2014-2015 гг.
Цель и задачи исследования
Цель исследования: дать молекулярно-генетическую характеристику
рекомбинантных форм ВИЧ-1, выявленных на территории Республики Беларусь.
Задачи исследования:
. Провести молекулярно-генетический скрининг ВИЧ-1, выявленного на
территории Беларуси за период 2008-2015 годов.
. Определить спектр и распространенность рекомбинантных форм ВИЧ-1 в
популяции ВИЧ-инфицированных пациентов, проживающих на территории Республики
Беларусь.
. Установить филогенетические связи выявленных рекомбинантных форм ВИЧ-1,
определить направления заноса вирусов на территорию страны, выявить мутации
резистентности к антиретровирусным препаратам.
. Изучить структуру полноразмерного генома новой уникальной
рекомбинантной формы ВИЧ-1 и установить ее происхождение.
Научная новизна
1. Установлено, что на территории Республики Беларусь за период 2008-2015
гг. доминировал ВИЧ-1 субтипа А1, на который приходилось 90,7%. Кроме субтипа
А1 выявлено 15 случаев ВИЧ-инфекции (4,9%), вызванных рекомбинантными формами
ВИЧ-1, 9 случаев (3,0%) - субтипом В, и по 2 случая (0,7% каждый) - субтипами C и G.
. Впервые на территории Республики Беларусь в популяции
ВИЧ-инфицированных пациентов определен спектр рекомбинантных форм ВИЧ-1,
выявлено три типа циркулирующих рекомбинантных форм ВИЧ-1: CRF03_AB - 8 (2,6%),
CRF02_AG - 4 (1,3%), CRF06_cpx - 2 (0,7%), и одна уникальная рекомбинантная
форма ВИЧ-1 (0,3%).
. Установлены многократные случаи заноса циркулирующих рекомбинантных
форм ВИЧ-1 на территорию Беларуси: CRF03_AB - занесена в результате шести
независимых событий, два из которых привели к дальнейшему распространению
CRF03_AB уже на территории страны, CRF02_AG - занесена в результате трех
событий, в двух случаях происхождением вируса является территория Западной
Африки и в одном случае две CRF02_AG (ВИЧ-инфицированные мать и ее ребенок)
происходят из Узбекистана, две CRF06_cpx были занесены в результате одного
события - родственны ВИЧ-1, описанному на территории Эстонии.
. Впервые секвенирован и описан полноразмерный геном уникальной
рекомбинантной формы ВИЧ-1 Mos. Установлено, что ее геном имеет мозаичную
структуру и состоит из ВИЧ-1 субтипов А1 (~80%) и В (~20%), встраивание субтипа
В произошло в структурных генах gag и pol.
Метод кластерного филогенетического анализа показал, что фрагменты субтипов А1
и В относятся к вариантам ВИЧ-1 AFSU и
BFSU, получившим распространение на
территории стран бывшего СССР.
Положения, выносимые на защиту
1. На территории Республики Беларусь за период 2008-2015 гг. доминировал
ВИЧ-1 субтипа А1, на который приходилось 90,7% (207 из 303) проанализированных
сиквенсов ДНК по участку гена pol. Рекомбинантные формы ВИЧ-1 по частоте
встречаемости находись на втором месте - 4,9% (15) от всех проанализированных
последовательностей ДНК: CRF03_AB - 8 (2,6%), CRF02_AG - 4 (1,3%), CRF06_cpx -
2 (0,7%), и в одном случае (0,3%) выявлена уникальная рекомбинантная форма
ВИЧ-1 между субтипами A1 и B. Выявлено 9 случаев (3,0%) ВИЧ-инфекции, вызванной
субтипом В, и по 2 случая (0,7% каждый), вызванных субтипами С и G ВИЧ-1
соответственно.
. Рекомбинантные формы ВИЧ-1 занесены на территорию Республики Беларусь в
результате множественных событий. Наиболее часто встречаемая рекомбинантная
форма CRF03_AB занесена в результате шести независимых событий, вероятнее
всего, с территорий России и Литвы. Два события привели к дальнейшему
распространению CRF03_AB уже на территории страны. Рекомбинантная форма
CRF02_AG занесена на территорию страны из трех независимых источников: в двух
случаях вирус происходит с территории Западной Африки, в одном случае две
CRF02_AG (ВИЧ-инфицированные мать и ее ребенок) - с территории Узбекистана. Две
CRF06_cpx занесены на территорию Беларуси в результате одного события,
вероятнее всего, из Эстонии.
. Новая уникальная рекомбинантная форма ВИЧ-1 Mos является результатом
рекомбинации ВИЧ-1 субтипов А1 и В, встраивание фрагментов генома субтипа В
произошло в структурных генах ВИЧ-1 gag и pol. На долю ВИЧ-1
субтипа А1 приходится порядка 80% генома УРФ ВИЧ-1 Mos, на субтип B - 20%.
Геном ВИЧ-1 Mos состоит из фрагментов геномов ВИЧ-1 AFSU/BFSU, получивших
распространение на территории стран бывшего СССР, и не является рекомбинантной
формой CRF03_AB.
Личный вклад соискателя ученой степени
Научным руководителем предложены тема диссертационной работы и ее
методическое решение. Соискатель самостоятельно определил цель и задачи
исследования, выбор методов и объем исследований. Автор лично выполнил
первичную обработку исследуемого материала (сыворотки и плазмы крови),
полученного от ВИЧ-инфицированных пациентов, получил сиквенсы участка генов gag-pol
исследуемых образцов, создал электронную базу данных для
внутрилабораторного хранения и учета информации о пациентах. Диссертант
полностью провел филогенетический анализ и молекулярно-генетические исследования
рекомбинантных форм ВИЧ-1, выявленных на территории Республики Беларусь,
установил их структуры геномов, профили резистентности, а также происхождение и
распространение на территории страны. Автором пополнена международная база
данных Genbank 241 нуклеотидной последовательностью ВИЧ-1 областей генов gag-pol
и 1 полноразмерным геномом ВИЧ-1 субтипа А1. На основании проведенных
исследований получен патент на новую уникальную рекомбинантную форму ВИЧ-1 Mos
№ 18124 [31-A] (вклад соискателя - 30%).
Основные научные результаты представлены в статьях с долей личного
участия соискателя соответственно: [1-A, 2-A] - 50%, [3-A] - 30%, [4-A] - 70%,
[5-A] - 50%, [6-A, 7-A] - 10%, [8-A] - 70%, [9-A, 10-A] - 10%, [11-A] - 30%,
[12-A] - 80% (в среднем 39%); в материалах научных форумов и тезисах докладов
[13-A, 14-A] - 30%, [15-A] - 30%, [16-A, 17-A] - 20%, [18-A] - 70%, [19-A] -
30%, [20-A-22-A] - 10%, [23-A] - 70% (в среднем 30%); в сборниках рецензируемых
научных трудов [24-A-28-A] - 20% (в среднем 20%). На основании проведенных
исследований утверждены 2 инструкции по применению: по генотипированию и
определению мутаций резистентности в геноме ВИЧ-1 [29-A, 30-A] (вклад
соискателя 30%).
Апробация диссертации и информация об использовании ее
результатов
Основные положения работы были доложены и обсуждены на конференции
«Основы инфекционной патологии человека» (30-31 октября 2014 г., г. Минск,
Беларусь); на 12 ежегодной конференции Балтийской Антивирусной Сети «Вирусные
инфекции регионального значения» (3-5 октября 2015 г., г. Москва, Россия);
мини-симпозиуме «Молекулярная эпидемиология ВИЧ-1 и вирусных гепатитов в
Балтийском регионе» (19-21 марта 2015 г., Каролинский Институт, г. Стокгольм,
Швеция). Результаты проведенных исследованийбыли использованы при созданииотечественной
диагностической тест-системы для определения мутаций резистентности и
генотипирования ВИЧ-1 «Бел ВИЧ-1 резистентность-генотип» - регистрационное
удостоверение № ИМ-7.103886, для создания контрольной панели «Панель
контрольная сывороток крови, содержащих и не содержащих антитела к
специфическим белкам ВИЧ-1 и ВИЧ-2 и антигены ВИЧ-1» - регистрационное
удостоверение № ИМ-7.102188.
Опубликование результатов диссертации
Результаты диссертационной работы опубликованы в 31 научной работе, из
них 12 - статьи в журналах, включенных в перечень научных изданий ВАК (объем
5,9 авторских листа), 11 - в материалах научно-практических конференций (объем
3,3 авторских листа), 5 - в сборниках рецензируемых научных трудов (1,1
авторских листа), 2 - в инструктивно-методических рекомендациях, 1 - патент.
Общий объем публикаций составляет 10,3 авторских листа.
Структура и объем диссертации
Диссертационная работа состоит из введения, общей характеристики работы,
обзора литературы, главы, посвященной описанию материалов и методов
исследований, 3 глав результатов собственных исследований, заключения,
библиографического списка (190англоязычных и 7 русскоязычных источников),
списка работ соискателя, 5 приложений. Работа изложена на 137 страницах,
содержит 18 таблиц и 38 рисунков.
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
.1
История открытия ВИЧ
В конце 80-х - начале 81-х гг. прошлого века в США среди мужчин,
практикующих секс с мужчинами (МСМ), и потребителей инъекционных наркотиков
(ПИН) без известных на то время причин были выявлены случаи пневмоцистной
пневмонии [5, 6]. Практически в это же время появились сообщения об обнаружении
у еще одних МСМ редкой формы онкологического заболевания кожи - саркомы Капоши
[7, 8]. Оба эти заболевания представляют собой редкие оппортунистические инфекции,
проявляющиеся у лиц с серьезными нарушениями иммунной системы. Вскоре после
первых сообщений о вспышке данных заболеваний в США стали появляться сообщения
о схожих симптомах и в других частях света. Состояние, при котором возникали
эти инфекции, назвали синдромом приобретенного иммунодефицита (СПИД), однако
причина СПИДа стала известна лишь в 1983г., когда независимо друг от друга в
Институте Пастера во Франции под руководством Люка Монтанье и в Национальном
институте рака в США под руководством Роберта Галло был изолирован новый
ретровирус, названный вначале вирусом, ассоциированным с лимфаденопатией
(lymphadenopathy-associated virus, or LAV) [9] и Т-лимфотропным вирусом
человека [10]. В 1986 году обнаружили, что эти два вируса генетически
идентичны, и им было присвоено наименование «вирус иммунодефицита человека»
(ВИЧ) [11]. В 2008-м Люк Монтанье и Франсуаза Барр-Синусси были удостоены
Нобелевской премии в области физиологии и медицины «за открытие вируса
иммунодефицита человека» [12].
1.2
Организация генома и кодируемые белки ВИЧ
Генетический материал ВИЧпредставлен двумя копиями положительно-смысловой
(+)РНК. Длина молекулы РНК составляет в среднем около 9700 нуклеотидов и
содержит 3 рамки считывания(рисунок 1.1)[13].

Как и у всех вирусов Семейства Retroviridae, геном ВИЧсодержит 3
основных структурных гена gag, pol и env, кодирующих
структурные белки вируса и ферменты, необходимые для вирусной репликации.
Помимо структурных, геном ВИЧ-1 включает гены tat, rev, nef,
vif, vpr и vpu (vpx у ВИЧ-2)[14],кодирующие белки,
которые участвуют в регуляции экспрессии других вирусных генов и поддержании
латентной стадии вируса(таблица 1.1)[15].
Таблица 1.1. - Продукты генов ВИЧ-1и их основные функции
|
Наименование
|
Обозна-чение
|
Размер, кДа
|
Функция
|
|
Структурные
белки
|
|
Group-specific
antigen
|
Gag
|
|
|
|
Матрикс
|
MA
|
p17
|
Взаимодействие
с env
|
|
Капсид
|
CA
|
p24
|
Формирует
капсид
|
|
Нуклеокапсид
|
NC
|
p7
|
Связывание и
стабилизация РНК
|
|
Кор
|
-
|
p6
|
Связывание с vpr
|
|
Polymerase
|
Pol
|
|
|
|
Протеаза
|
PR
|
p15
|
Протеолитическое
расщепление gag и pol
|
|
Обратная
транскриптаза
|
RT
|
p66
|
Обратная
транскрипция
|
|
Интеграза
|
IN
|
p31
|
Интеграция
провирусной ДНК
|
|
Envelope
|
|
|
|
|
Гликопротеин
120
|
SU
|
gp120
|
Проникновение
ВИЧв клетку
|
|
Гликопротеин
41
|
TM
|
gp41
|
Слияние клетки
и вируса
|
|
Регуляторные
белки
|
|
Трансактиватор
транскрипции
|
Tat
|
p14
|
Активация
вирусной транскрипции
|
|
Регулятор
экспрессии вирусных белков
|
Rev
|
p19
|
Регуляция
продукции вирусной мРНК, экспорт несплайсированной РНК
|
|
Вспомогательные
белки
|
|
Белок
инфективности вириона
|
Vif
|
p23
|
Содействует
созреванию и инфективности вириона
|
|
Вирусный
белок R
|
Vpr
|
p18
|
Усиливает
репликацию вируса, обеспечивает ядерную локализацию преинтеграционного
комплекса
|
|
Вирусный
белок U
|
Vpu
|
p16
|
Усиливает
высвобождение вирионов из клетки, снижает экспрессию CD4- и ГКГ 1-типа
|
На 5’- и 3’-концах вирусной РНК находятся длинные концевые повторы (long
terminal repeat, LTR), обеспечивающие инициацию, регуляцию и терминацию
транскрипции, регуляцию упаковки генома в капсид и некоторые другие функции.
.3
Структура вириона ВИЧ
Вирусные частицы ВИЧимеют сферическую форму размером 100-120 нм,
окруженную липидной мембраной(рисунок 1.2).
Липидная мембрана образована из клеточной мембраны клетки-хозяина, в
которой происходила репликация вириона. Каждая вирусная частица содержит 72
гликопротеиновых комплекса gp160, интегрированных в липидную мембрану [16].
Данные комплексы являются рецепторами вируса и состоят из двух вирусных белков:
поверхностного gp120 и трансмембранного gp41. К внутренней поверхности мембраны
прикреплен матриксный белок p17.
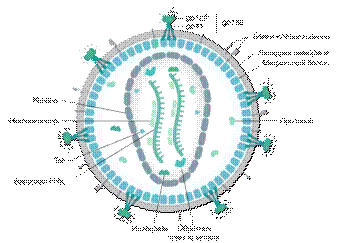
Капсид ВИЧсостоит из белка p24 и имеет коническую форму, суженная часть
которого взаимодействует с оболочкой вириона. Внутри капсида находятся две
молекулы однонитевой РНК (ssRNA), которые стабилизированы нуклеокапсидным
белком p7. В капсиде также инкапсулированы вирусные ферменты: обратная
транскриптаза, интеграза и протеаза, некоторые вспомогательные белки ВИЧ.
.4
Жизненный цикл ВИЧ
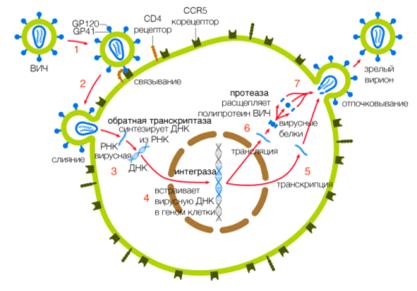
Жизненный цикл ВИЧможно разделить на несколько этапов(рисунок 1.3):
Связывание с рецепторами и корецепторами
клетки-мишени
В начале исследований ВИЧ-инфекции был выявлен главный рецептор, с
которым связывается вирус, - это гликопротеин CD4 (cluster of differentiation
4), найденный на поверхности иммунных клеток (Т-хелперов, макрофагов, моноцитов
и дендритных клеток). Внедрение в клетку-мишень обеспечивается связыванием
трехмерного гликопротеина ВИЧgp120 одновременно с рецептором CD4 и корецептором
CCR5 или CXCR4 [17, 18].
Гликопротеин gp120 ВИЧсостоит из ~500 аминокислот и включает в себя 5
константных (C1-C5) и 5 вариабельных (V1-V5) областей различной длины. Домен
связывания с CD4 находится в нескольких эпитопах областей V1-V2 и С2, C3, C4 и
C5 [19].
Вначале происходит связывание CD4-связывающего домена gp120 с рецептором
CD4. Это приводит к структурным изменениям молекулы gp120, открывая
хемокин-связывающий домен. Данный домен, в свою очередь, связывается с одним из
корецепторов клетки-мишени, что является сигналом для начала конформационных
изменений трансмембранного белка gp41.
Проникновение ВИЧв клетку-мишень
После связывания gp120 ВИЧс рецептором CD4 и одним из корецепторов
конформационные изменения в gp41 приводят к внедрению N-терминального
гидрофобного региона этого протеина в мембрану клетки-мишени [20]. Результатом
данного внедрения является слияние мембран вируса и клетки-мишени и, как
следствие, попадание компонентов ВИЧв цитоплазму клетки [21].
После проникновения компонентов вируса в цитоплазму клетки вирусная РНК и
ферменты находятся внутри матрикса, который разрушается под действием p38
MAP-киназы (MAPK) [22] и нуклеокапсида, разрушаемого циклофилином А (CypA)
[23]. В результате этого генетический материал и ферменты вируса попадают в
цитоплазму клетки-мишени, что приводит к инициации обратной транскрипции.
Обратная транскрипция
В цитоплазме клетки вирусная обратная транскриптаза (ОТ) при помощи
фермента РНКазы H преобразует вирусную РНК в двухцепочечную ДНК методом
обратной транскрипции. Было высказано предположение, что обратная транскрипция
может происходить и в вирионе до внедрения в клетку, однако данный процесс
сильно ограничен низкой концентрацией дНТФ внутри вириона [24].
Переход вирусного генома из РНК в ДНК происходит с помощью механизма,
устраняющего два препятствия, с которыми сталкивается вирус в процессе
репликации. Во-первых, требование системы РНК-праймера исключает точное
транскрибирование генома в ДНК от начала до конца, так как не было бы никакого
способа, чтобы скопировать область связывания праймера. Во-вторых, поскольку
новые вирусные геномы должны быть получены с помощью клеточной РНК-полимеразы
II, сигналы, соответствующие прямому синтезу РНК, должны находиться до начала
сайта инициации транскрипции за пределами области, подлежащей копированию. С этой
целью ВИЧ, как и остальные ретровирусы, синтезируют в обоих 5’- и 3’-концах ДНК
дополнительную копию последовательностей, присутствующих только один раз в
РНК-геноме, U5 и U3. Таким образом,длинные концевые повторы (LTR) (U3-R-U5)
содержат практически все cis-активные элементы, необходимые для событий,
которые происходят на уровне ДНК, то есть интеграции и экспрессии провирусной
ДНК[25].
Инициация обратной транскрипцииВИЧпроисходит путем связывания клеточной
транспортной РНК tRNALys3, выступающей в качестве праймера [26], с сайтом
связывания праймера (primer binding site, PBS), расположенным на расстоянии
приблизительно 180 нуклеотидов от 5’-конца вирусной РНК(рисунок 1.4, A). После
связывания происходит синтез участков R и U5 кДНК, образуя таким образом
гетеродуплекс РНК/ДНК, который является субстратом для РНКазы H(рисунок 1.4,
B). РНКаза H расщепляет 5’-конец вирусной РНК, высвобождая вновь
синтезированную (-)цепь ДНК. Концы вирусной РНК являются повторяющимися
последовательностями, называемыми R. Эти повторы действуют как мост, который
позволяет вновь синтезированной (-)цепи ДНК переходить от 5’- к 3’-концу
вирусной РНК(рисунок 1.4, С). Было показано, что вновь синтезированная (-)цепь
ДНК может связываться с 3’-концом любой из двух молекул РНК, упакованных в
геном ретровируса [27, 28].
После связывания (-)цепи ДНК с R-областью 3’-конца РНК происходит синтез
полной (-)цепи ДНК(рисунок 1.4, D). РНКаза H расщепляет РНК ВИЧ, за исключением
участка, богатого пуринами (полипуриновый тракт, polypurine tract, ppt)(рисунок
1.4, E). Данный участок является резистентным к РНКаза H и служит праймером для
инициации синтеза (+)цепи ДНК на матрице (-)цепи ДНК. ОТ ВИЧсинтезирует не
только копию (-)цепи ДНК, но также первые 18 нуклеотидов праймера tRNALys3. Как
только tRNA была скопирована в ДНК (+)цепи, она становится субстратом для
РНКазы Н. Большинство ретровирусов удаляют всю tRNA, но ОТ ВИЧявляется
исключением. Она оставляет один рибонуклеотид аденин на 5’-конце (-)цепи ДНК
[29]. Расщепление tRNALys3 высвобождает участок PBS (primerbindingsite, сайт посадки праймера) на (+)цепи
ДНК, который комплементаренPBS (-)цепи ДНК. Эти два комплементарных участка
связываются между собой (рисунок 1.4, F), и происходит достраивание (+)цепи
ДНК(рисунок 1.4, G).
В процессе обратной транскрипции синтезируется ДНК, которая длиннее
РНК-матрицы: оба конца ДНК содержат последовательности с каждого конца РНК (U3
от 3’-конца и U5 от 5'-конца). Таким образом, каждый конец вирусной ДНК имеет
ту же последовательность, U3-R-U5, которая после интеграции в геном
клетки-хозяина будет являться концами провируса ВИЧ.
Интеграция вирусного генома в геном
клетки-хозяина
Синтезированная двухцепочечная провирусная ДНК формирует
пре-интеграционный комплекс с белками клетки-хозяина, вирусными белками интегразой,
vpr и матриксным белком p17. Сигнал ядерной локализации внутри p17
направляет комплекс в ядро клетки [30, 31]. В ядре клетки геном ВИЧв виде
двойной спирали ДНК интегрируется в геном клетки-хозяина путем сплайсинга с
помощью фермента интегразы ВИЧ[32]. Результаты исследований показали, что
провирусная ДНК предпочтительно интегрируется в области кодирования активных
генов клетки [33]. Интегрированная форма генома ВИЧизвестна как «провирус» и
реплицируется как часть нормального клеточного генома. Регуляция экспрессии
генов ВИЧвключает в себя комплексное взаимодействие между
хроматин-ассоциированной провирусной ДНК, клеточным фактором транскрипции и
вирусным трансактиватором транскрипции Tat [34]. Несплайсированная
полноразмерная РНК обладает характеристиками эукариотической клеточной мРНК,
поскольку содержит кэп на 5’-конце и полиаденилирована на 3’-конце [35]. Данная
РНК используется как для продукции вирусных структурных и регуляторных белков,
так и для формирования новых вирусных частиц.
Транскрипция провирусной ДНК и синтез вирусных
белков
LTR ВИЧ служат сайтами инициации транскрипции и содержат cis-актиновые
элементы, необходимые для синтеза РНК. Транскрипция инициируется в области
перехода U3/R LTR ВИЧ. Сайт U3 содержит множество элементов (LBP-1, NFκB,
LEF, Ets, USF-1, NFAT-1), которые направляют РНК-полимеразу II (pol II) к провирусной ДНК ВИЧ.
Транскрипция с LTR ВИЧприводит к синтезу большого количества (более 30) копий
вирусной РНК [36].
Эти РНК разделяются на 3 больших класса:
. несплайсированные РНК, которые функционируют как мРНК для Gag и
прекурсора полипротеина Gag-Pol, и данные РНК пакуются в дочерние вирионы как
генетический материал нового вируса;
. частично сплайсированные мРНК размером ~5 т.п.н., кодирующие
вирусные белки Env, Vpu, Vif и Vpr;
. небольшие, размером около 1,7-2,0 т.п.н., полностью
сплайсированные мРНК, которые транслируются в белки Rev, Tat и Nef.
На первой стадии ВИЧ-инфекции образуются полностью сплайсированные
небольшие мРНК, инициирующие транскрипцию ранних регуляторных белков ВИЧTat,
Rev и Nef [37-39]. Белок Tat связывается с TAR-петлей, формирующейся на
5’-конце продукта транскрипции и значительно ускоряет транскрипцию [34, 40].
Белок Rev взаимодействует с участком РНК RRE (Rev Response Element),
образующимся на поздней фазе репликации ВИЧ. Данный комплекс из RRE и
нескольких молекул Rev экспортируется в цитоплазму с помощью Rev-зависимого
пути экспорта. Для этого комплекс Rev-RRE использует комплекс человеческих
белков, содержащих белок экспортин-1 (XPO1/CRM1) и Ran-GTP. Образовавшийся
комплекс Rev-RRE-Xpo1/RanGTP уже экспортируется в цитоплазму клетки и
транслируется для синтеза остальных белков ВИЧили пакуется в качестве генома
новых копий вируса [41].
Обычно трансляция мРНК в эукариотических клетках включает в себя поиск
стартового кодона AUG, однако поскольку LTR ВИЧсодержат множество структурных
регионов, таких как TAR, PBS, поли(А)-хвост, то обычный рибосомальный механизм
поиска последовательности AUG на мРНК ВИЧне эффективен[42]. Кроме того,
некоторые мРНК ВИЧсодержат последовательность AUG в области UTR (untranslated
region), что может помешать инициации трансляции с истинного стартового кодона.
Было предложено два основныхмеханизма, позволяющих инициировать трансляцию мРНК
ВИЧальтернативными способами. Поскольку мРНК полиаденилирована, то она может
быть транслирована через обычную кэп-зависимую инициацию трансляции или через
связывание IRES (англ. Internal Ribosome Entry Site - участок внутренней
посадки рибосомы[43-45]. После связывания с рибосомой РНК становится матрицей
для синтеза вирусных белков.
Сборка вириона и продукция вируса
После синтеза полного набора вирусных белков начинается процесс сборки
нового вириона ВИЧ. Для сборки инфективного вириона необходимо наличие двух
копий вирусной РНК, вирусного праймера обратной транскрипции tRNALys3[26],
полипротеинов Env, Gag и трех вирусных ферментов: протеазы, обратной
транскриптазы и интегразы. Сборка ВИЧпроисходит на плазматической мембране
инфицированной клетки. Все компоненты, необходимые для сборки вируса, доставляются
к плазматической мембране с помощью транспортных систем инфицированной клетки
[46].
Главную роль в сборке вируса играет прекурсор полипротеин Gag,
Pr55Gag[47, 48]. Он состоит из матрикса (МА), капсида (CA), нуклеокапсида (NC),
домена p6, а также включает два белка SP1 и SP2.МА-домен, ответственный за
связывание Pr55Gag с клеточной мембраной, способствует включению вирусных
гликопротеинов Env в образующиеся вирионы ВИЧ. СА обеспечивает мультимеризацию
Gag в процессе сборки вириона, NC присоединяет вирусные РНК и способствует
сборке вириона, домен p6 присоединяет ESCRT (the endosomal sorting complexes
required for transport), который катализирует процесс отделения от мембраны
клетки, способствуя, таким образом, отпочкованию вируса [49, 50].
.5
Механизмы рекомбинации ВИЧ
Скорость рекомбинации ретровирусов выше, чем для большинства других
вирусов, а скорость рекомбинации ВИЧ выше, чем у других ретровирусов, таких как
вирус лейкемии мышей и вирус некроза селезенки[51-54]. Анализ геномов ВИЧ путем
прямого секвенирования показал, что рекомбинации в процессе синтеза ДНК -
явление довольно частое [55-59]. Во время синтеза (-)цепи ДНК ОТ ВИЧможет
«переключаться» между двумя РНК, упакованными в вирион, с использованием каждой
из них в качестве матрицы для синтеза ДНК. Таким образом, рекомбинантную ДНК
могут генерировать только те вирионы, в которых были упакованы две генетически
различные молекулы РНК [60].
Необходимо соблюдение нескольких условий для генерации новой
рекомбинантной формы ВИЧ: во-первых, клетка, в которой происходит репликация
вируса, должна быть инфицирована более чем одним вирусом. Во-вторых, молекулы
РНК от двух разных провирусов должны быть упакованы в один вирион. В третьих,
во время обратной транскрипции ОТ должна переключаться между матрицами РНК для
генерирования рекомбинантной ДНК-копии ВИЧ, которая должна быть интегрирована в
геном клетки-мишени. И, наконец, такой рекомбинантный провирус должен обладать
свойством генерировать вирусы, способные к инфицированию и репликации. По этим
причинам факторы, влияющие на любой из таких этапов, могут оказывать влияние на
рекомбинацию. В настоящее время мало известно о том, как часто клетки-мишени у
пациентов инфицируются более чем одним ВИЧ-1 (двойная инфекция). В культуре
клеток двойная инфекция встречается чаще, чем предполагалось, в сравнении со
случайными событиями [61]. Такой результат, по крайней мере, связан с тем, что
некоторые клетки имеют больше рецепторов/корецепторов и, следовательно, более
восприимчивы к инфекции ВИЧ-1 [62]. Двойная инфекция возрастает, когда ВИЧ-1
передается через клеточно-опосредованные события, поскольку множество вирусов
передаются от клетки-донора в клетки-мишени [61].
Во время сборки ВИЧ-1белок p24
упаковывает полноразмерную РНК в виде диметра, следовательно, выбор молекулы
РНК происходит до капсидирования РНК-геномов. Основным фактором, определяющим
выбор той или иной РНК, является сигнал инициации димеризации (dimerization
initiation signal, DIS), расположенный в 5’-области нетранслируемой РНК ВИЧ-1
[63]. Большинство ВИЧ-1 субтипов B и D имеют последовательность GCGCGC в DIS,
тогда как большинство ВИЧ-1 субтипов А, С, F и G имеют последовательность
GTGCAC, хотя возможны и другие последовательности [64,65]. Считается, что
палиндромная последовательность в DIS способствует связыванию оснований двух
РНК, что инициирует димеризацию РНК. Другие последовательности нуклеотидов в
геноме вируса также могут оказывать влияние на частоту РНК гетеродимеризации,
хотя и с менее выраженным эффектом, чем DIS [66].
Скорость рекомбинации ВИЧ-1 была измерена с использованием маркерных
генов. Эти результаты показали, что скорость рекомбинации пропорциональна
увеличению расстояния между двумя аллелями, когда расстояние между маркерами
составляет менее 600 нуклеотидов, а максимально возможная скорость рекомбинации
достигается, когда две аллели разделены между собой 1300 нуклеотидами [54, 67].
Несмотря на то, что рекомбинация происходит на протяжении всего генома
ВИЧ-1, структура РНК может влиять на частоту рекомбинации определенных областей[68].
Гомология нуклеотидных последовательностей может влиять как на скорость
рекомбинации ВИЧ, так и на распределение точек разрыва генома [69, 70].
Например, рекомбинация возникает гораздо чаще между двумя РНК ВИЧ-1 одного
субтипа, чем между РНК различных субтипов, упакованных вместе в один вирион
[59].
Существует несколько предположений о причинах рекомбинации генетического
материала ретровирусов. Одна из теорий гласит, что адаптивное значение
рекомбинации происходит от ее способности восстанавливать генетические
повреждения, в том числеу РНК-содержащих вирусов[71]. Действительно, в первых
работах по изучению рекомбинации ретровирусов было высказано предположение о
существовании модели «принудительного выбора» (forced copy-choice model), когда
ОТ переключается с одной матрицы РНК на другую, если в матрице имеются
повреждения (разрывы) [72]. Однако дальнейшие исследования показали, что
репликация вируса происходит с одинаковой частотой как на целых, так и на
поврежденных матрицах РНК [73], и экспериментально индуцированные генетические
нарушения в РНК не привели к более высокой частоте возникновения рекомбинаций
[74]. В дальнейшем эта модель была пересмотрена, дополнена и переименована в
модель «динамического выбора» (dynamic copy-choice model) [75]. Эта модель
предполагает, что баланс между полимеразной активностью и активностью РНКазы Н
вирусной ОТ определяет стабильность связи между синтезируемой ДНК и матрицей
РНК, и что смещение этого баланса влияет на скорость рекомбинации. Если баланс
смещается в сторону большей активности РНКазы Н по отношению к полимеразной
активности ОТ, то возникает снижение взаимодействия между синтезируемой ДНК и
матрицей РНК из-за диссоциации гетеродуплекса РНК/ДНК и происходит переключение
ОТ на другую РНК-матрицу [75]. Обратный эффект, при котором активность РНКазы H
снижается, а полимеразная активность ОТ возрастает, показал снижение частоты
переключения между матрицами РНК [76, 77].
Наконец, для закрепления рекомбинации такие вирусы должны эффективно
реплицироваться в новых клетках-мишенях. Большинство случаев переключения между
РНК-матрицами являются комплементарными, то есть точки разрыва у матричной и
синтезируемой молекулами совпадают [57, 78]. Однако, поскольку рекомбинанты
содержат участки геномов каждого из «родителей», эти последовательности могут
или не могут работать вместе эффективно [69, 79]. Особенно это выражено в
случае, когда два родительских вирусных генома разделены большим генетическим
расстоянием (например, когда родительские вирусы относятся к различным субтипам
или группам). По этой причине многие вновь созданные межсубтипные
рекомбинантные формы вирусов устраняются путем естественной селекции во время
репликации вируса [59]. Создание жизнеспособной межсубтипной рекомбинантной
формы сталкивается с множеством проблем: возможное снижение эффективности
соупаковывания РНК, относительно неэффективное переключение между
РНК-матрицами, а также снижение репликации. Тем не менее, согласно
консервативной оценке, около 20% всех циркулирующих в настоящее время вариантов
ВИЧ являются межсубтипными рекомбинантными формами ВИЧ[80]. Это доказывает, что
рекомбинация является основной движущей силой эволюции в популяцииВИЧ.
1.6
Рецепторы и тропизм ВИЧ
Первый рецептор ВИЧ, CD4 (clusterofdifferentiation 4), был идентифицирован уже в 1984 г.[81-83]. Вскоре после
этого выяснилось, что одного CD4 недостаточно для проникновения ВИЧв
клетку-мишень. Первым результатом поиска других рецепторов, важных для
проникновения ВИЧ, стало открытие в 1995 г. трех хемокинов подсемейства СС: RANTES
(CCL5), MIP-1a (CCL3) и MIP-1b (CCL4), которые продемонстрировали
сильное ингибирование ВИЧ-инфекции in vitro[84]. В марте следующего года
хемокиновый рецептор CXCR4 был идентифицирован, как необходимый для связывания
ВИЧкорецептор [85]. Эти открытия стимулировали целую серию исследований, и в
этом же году был открыт второй корецептор ВИЧ- CCR5[86-89]. Также был открыт и
специфический лиганд для CXCR4 - SDF-1 (CXCL12) [90, 91]. Третьим важным
открытием в этот короткий период стало обнаружение, что делеция размером в 32
нуклеотида в участке, кодирующем ген CCR5 (CCR5-D32), приводит к резистентности к ВИЧ[92, 93].
ВИЧможет инфицировать различные клетки, такие как Т-лимфоциты и
макрофаги, которые экспрессируют молекулу CD4 на поверхности мембраны. Тропизм
ВИЧраньше обозначал тип клетки, которую ВИЧинфицировал и в которой размножался.
Так, в исследованиях биологических свойств ВИЧбыло обнаружено, что изоляты ВИЧ,
выделенные от пациентов на ранней стадии ВИЧ-инфекции, обычно способны
инфицировать макрофаги и первичные культуры CD4+ Т-лимфоцитов, но не способны
размножаться в трансформированных Т-клеточных линиях[94, 95]. Для обозначения
таких вирусов применялись термины М-тропный (макрофаготропный), NSI-изолят (от
англ. non-sincytium inducting), то есть не способный образовывать синцитий, а
также SL-изолят (от англ. slow/low - медленно/низко) - из-за низкой скорости
репликации в Т-клеточных линиях [96, 97]. Спустя несколько лет после
инфицирования, у пациентов образуются штаммы ВИЧ, которые способны размножаться
в Т-клеточных линиях, при этом либо сохраняя, либо теряя способность
инфицировать макрофаги. Такие штаммы ВИЧназывались Т-тропными, SL-изолятами (от
англ. sincytium inducting), RH-изолятами (от англ. rapid/high - быстро/высоко)
[98], или вирусами с двойным тропизмом [99]. После открытия корецепторов
ВИЧстали понятны причины различия биологических свойств вируса: М-тропный вирус
использует в качестве корецептора CCR5, T-тропные штаммы ВИЧиспользуют в
качестве корецептора CXCR4 или оба корецептора. [100]. Современная
фенотипическая классификация ВИЧоснована на использовании этих корецепторов:
корецептор CCR5 - R5 вирус, CXCR4 - Х4 или R5X4 вирус, если ВИЧ использует 2
корецептора [101]. Использование того или иного корецептора вирусом
определяется областью V3 белка gp120[102-104].
.7
Патогенез ВИЧ-инфекции
Течение ВИЧ-инфекции при отсутствии антиретровирусной терапииможно
разделить на 3 стадии: острую, хроническую и СПИД (рисунок 1.5)[105].
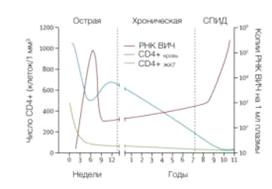
Острая (симптомная) фаза обычно начинается спустя две недели с момента
инфицирования и длитсяоколо месяца. Наблюдаются симптомы, характерные для
гриппа: повышение температуры тела, ломота, а также увеличение лимфатических
узлов. В этой фазе ВИЧстремительно распространяется к лимфоузлам желудочно-кишечного
тракта, в котором происходит быстрое истощение пула CD4+ЖКТ Т-лимфоцитов. Это
возникает как из-за естественного истощения пула, так и в результате
опознавания натуральными киллерами (НК) инфицированных клеток с помощью
киллер-подобных иммуноглобулиновых рецепторов (KIRs) [106].
Острая фаза также характеризуется значительным ростом количества вируса в
крови (вирусной нагрузки), доходящей до 105-106копий РНК ВИЧ/мл плазмы крови. В
конце острой фазы наступает стабилизация ВИЧ-инфекции вследствие антивирусного
иммунного ответа и переход ее в хроническую (латентную) фазу.
Иммунный ответ снижает вирусную нагрузку до ~3x104 копий РНК ВИЧ/мл
плазмы (так называемый сет-поинт) [107]. Тем не менее уровень CD4+ Т-лимфоцитов
периферической крови продолжает снижаться из-за постоянного восполнения пула
погибших клеток, что приводит к истощению иммунной системы. Кроме этого, в
хронической фазе ВИЧ-инфекции создается вирусный резервуар из пула
инфицированных клеток. Это долгоживущие, невосприимчивые к ВААРТ Т-клетки
памяти, макрофаги и дендритные клетки [108]. Хроническая фаза может длиться до
10 лет, на продолжительность времени влияют как генетические особенности
организма, так и вирусные факторы. Сам пациент не испытывает каких-либо
симптомов, однако наблюдается хроническая активация иммунной системы, в
частности повышение уровня активированных клеток иммунной системы и
воспалительных цитокинов.
Когда уровень CD4+ Т-лимфоцитов снижается до 200 клеток в 1 мкл крови и
менее, наступает стадия СПИД. Развитие данной стадии характеризуется
прогрессивной генерализированной лимфаденопатией, оппортунистическими
инфекциями (напр. пневмоцистная пневмония) и нетипичными онкологическими
заболеваниями (напр. саркома Капоши). Без ВААРТ пациенты со СПИД обычно живут
не более трех лет, а при диагностировании опасной оппортунистической инфекции
ожидаемый период жизни пациента снижается до одного года [105].
.8
Терапия ВИЧ-инфекции
В 1987 г. появился первый антиретровирусный препарат зидовудин,
нуклеозидный ингибитор обратной транскриптазы (НИОТ). Изначально он был
синтезирован как средство против рака, но в дальнейшем было обнаружено, что он
блокирует обратную транскрипцию ВИЧ[109,110]. Однако к данному препарату очень
быстро развивалась резистентность, и в первые годы, когда зидовудин назначали в
очень высоких дозах (1500 мг/сутки), наблюдалось выраженное угнетение
кроветворения [111]. В начале 1990-х годов были синтезированы и начали
применяться первые ингибиторы протеазы (ИП) и ненуклеозидные ингибиторы
обратной транскриптазы (ННИОТ), однако только в 1997 г. были опубликованы
статьи [112, 113], в которых говорилось о существенном преимуществе
комбинированной терапии, включающей 2 НИОТ и ИП(индинавир). Такая
комбинированная терапия минимум трех различных антиретровирусных препаратов
стала называться высокоактивной антиретровирусной терапией (ВААРТ), поскольку
она значительно снижала заболеваемость оппортунистическими инфекциями и, как
следствие, смертность от ВИЧ-инфекции [114].
По состоянию на март 2011 г. для лечения ВИЧ-инфекции разрешены к
применению 30 отдельных и комбинированных препаратов, направленных на
подавление репликации вируса. Эти препараты принадлежат к пяти
фармакологическим группам:
. нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы
(НИОТ);
. ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ);
. ингибиторы протеазы (ИП);
. ингибиторы проникновения (блокаторы корецепторов и ингибиторы
слияния);
. ингибиторы интегразы (ИИ).
В Республике Беларусь до недавнего времени применялись только 3 из 5
групп препаратов: НИОТ, ННИОТ и ИП. В 2015 году началось применение одного
препарата из группы ИИ.
Несмотря на свою высокую эффективность, ВААРТ не приводит к
полномуизлечению пациента от ВИЧ, поэтомуприем препаратов необходим на
протяжении всей жизни ВИЧ-инфицированного. В настоящее время исследования в
области терапии ВИЧ-инфекции направлены как раз на то, чтобы элиминировать
латентные клетки, содержащие провирус ВИЧв своем геноме [115].
.9
Генетическое разнообразие ВИЧ
Одними из основных особенностей ВИЧявляются высокие генетическое
разнообразие и скорость эволюции вируса. Это обусловлено, по крайней мере,
тремя факторами: множественным проникновением ВИЧв человеческую популяцию,
низкой точностью и высокой рекомбиногенностью вирусной обратной транскриптазы,
а также высокой скоростью размножения вируса [116]. Время жизни ВИЧв плазме
крови и ВИЧ-продуцирующих клетках составляет 1-2 дня, и за это время образуется
порядка 1010 новых копий вируса [117, 118]. Особенностью обратной транскриптазы
ВИЧявляется отсутствие репарационной активности и, как следствие, генерация
большого числа «ошибок» при репликации: 1-4 нуклеотидных замены/геном/раунд
репликации [119]. Другая особенность обратной транскриптазы ВИЧ- способность
«перескакивать» с одной цепи РНК на другую, вызывая рекомбинацию генома вируса
[55]. Рекомбинация - один из наиболее значимых факторов, ускоряющих эволюцию
ВИЧ, и она происходит, по разным расчетам, от 2 до 9 раз/геном/раунд репликации
[27, 57, 120, 121].
Высокий уровень генетического разнообразия ВИЧпривел к тому, что стало
необходимо классифицировать различные генетические варианты вируса. Для
классификации ВИЧиспользуется метод филогенетического анализа нуклеотидных
последовательностей их геномов. Данная методика позволяет определить степень родства
нуклеотидов и, как следствие, самих вирусов.
Согласно современной филогенетической классификации, ВИЧделится на типы,
группы, субтипы и рекомбинантные формы (рисунок 1.6). Различают 2 типа ВИЧ:
первый и второй (ВИЧ-1 и ВИЧ-2 соответственно). ВИЧ-1 родственен с вирусами,
найденными у горилл и шимпанзе, обитающих в Западной Африке, а источником ВИЧ-2
являются черные мангобеи [2]. Филогенетический анализ показал, что внутри
первого типа изоляты ВИЧ-1 образуют 4 кластера, названных группами M, N, O и P [1,
122, 123].
Группа М (major) - в нее входит подавляющее большинство штаммовВИЧ-1. В
свою очередь, группа М разделяется на субтипы (подгруппы) и рекомбинантные
формы. В настоящее время выделяют 9 субтипов ВИЧ, обозначающихся A (A1-A4), B,
C, D, F (F1 и F2), G, H, J и K. Сиквенсы внутри субтипа или суб-субтипа более
близки между собой, чем с сиквенсами других субтипов на протяжении всего их
генома. Рекомбинантные формы ВИЧ-1 являются результатом рекомбинации геномов
различных субтипов. Рекомбинантная форма ВИЧ-1 называется циркулирующей, если
описано не менее трех, эпидемиологически не связанных случаев инфицирования
вирусом с идентичной рекомбинантной структурой и охарактеризовано не менее двух
полноразмерных геномов данного вируса. Циркулирующим рекомбинантным формам
присваивается название по очередности их открытия с последующим указанием
субтипов, из которых состоит данный геном. Сегменты, для которых невозможно
определить родительский субтип, обозначаютсябуквой U (от англ. unclassified).
Если рекомбинантная форма состоит из трех и более различных субтипов ВИЧ, то
такой форме присваивается аббревиатура «cpx»(от англ. complex). В настоящее
время выявлено 72 ЦРФ ВИЧ-1 и 1 ЦРФ ВИЧ-2 [124]. Уникальные рекомбинантные
формы выявлены только у единичных, эпидемиологически связанных пациентов
(например: мать-ребенок).
Вирусы группы О (outlier), вероятнее всего, передались в человеческую
популяцию от диких горилл [125] и наиболее распространены в Камеруне, где в
1997 году более 2% пациентов были заражены вирусами данной группы,и в соседних
центральноафриканских странах [126].
Группа N (non-M, non-O) представлена вирусами, циркулирующими только в
Камеруне [127]. В 2011 г. единичный случай выявлен также во Франции.
Вирус группы P был впервые обнаружен в 2009 г. в Камеруне у
ВИЧ-инфицированной женщины. Генетически этот вариант ВИЧ-1 близок к вирусу
иммунодефицита горилл (SIVgor) и не проявлял никаких признаков рекомбинации с
другими известными группами[122].Исследователи предположили, что данный вирус
образует новую группу ВИЧ, не относящуюся к уже известным группам M, N или O.
Позже данное предположение было подтверждено другой группой исследователей,
которые обнаружили второй ВИЧ, принадлежащий к группе P. Этот вирус был выявлен
у ВИЧ-серопозитивного пациента мужского пола в больнице Камеруна, подтверждая
таким образом, что ВИЧ-1 группы P реплицируется в организме человека [123].
Различные генетические формы ВИЧ-1 зачастую локализованы в отдельных
географических регионах. Наиболее часто встречаемые формы вируса - ВИЧ-1 субтипа
А1 (12,3% всех случаев ВИЧ-инфекции в мире), субтипы B (10,2%), C (49,9%) и G
(6,3%), а также CRF01_AE (4,7%) и CRF02_AG (4,8%) (рисунок 1.7)[128].В Северной
Америке, Западной Европе и Австралии превалирующим является ВИЧ-1 субтипа B, в
странах бывшего СССР - субтипа А1 и CRF03_AB. Доминирующий в пандемии ВИЧ-1
субтипа С локализованв основном в Южной и Восточной Африке, а также в Индии,
где наблюдается наиболее сложная ситуация с эпидемией ВИЧ-1 в мире. Среди ЦРФ
ВИЧ-1 превалирующей считается CRF02_AG, которая является наиболее часто
встречаемой формой ВИЧ-1 в Западной Африке. Для сравнения, в других регионах
нигде не наблюдается такой высокой превалентности рекомбинантных форм над
«чистыми» субтипами ВИЧ-1. Очевидным исключением из регионального превалирования
субтипов ВИЧ-1 является регион Западной и Центральной Африки, в котором
наблюдается широкая вариабельность генетических форм ВИЧ-1 [124]. Это также
может свидетельствовать о попаданииВИЧ-1 в человеческую популяцию именно в этом
районе [129,
130].
Распространение
ВИЧ-1 на территории стран бывшего СССР
Первые случаи ВИЧ-инфекции на территории СССР были зарегистрированы в
1987 г. в Ленинграде (совр. Санкт-Петербург) [131] и до 1994 г., уже после
распада СССР, эпидемия ВИЧна этой территории носила случайный характер. У
пациентов, выявленных в данный период на территории Российской Федерации, было
обнаружено 8 субтипов ВИЧ-1: А1, В, С, D, E, F, G и H, доминирующим из которых
являлся ВИЧ-1 субтипа B[132]. Вторым по значимости был субтип G, вызвавший вспышку
ВИЧ-инфекции в Элисте, Республика Калмыкия[133]. Остальные субтипы выявлялись
значительно реже и были связаны в основном с половым путем передачи [134].Все
выявляемые вирусы не были генетически близкими друг другу, что
свидетельствовало о множественном проникновении вируса на территорию России
[135].
Эпидемия ВИЧ на территории бывшего СССР началась в 1994-1996 гг. и была
вызвана стремительной передачей вируса среди потребителей инъекционных
наркотиков. Эпидемия началась в южных городах Украины: г. Одесса (3500 случаев
ВИЧ-инфекции среди ПИН) и г. Николаев (2000 случаев передачи среди
ПИН,зарегистрированных с 1994 по 2000 гг.) [136, 137]. В дальнейшем эти
варианты вируса вызвали вспышки эпидемии ВИЧв других городах Украины (Киев,
Донецк), России (Санкт-Петербург, Саратов, Пермь и др.) [138, 139] и Беларуси
(Светлогорск) [140]. Позже вспышки ВИЧ-инфекции среди ПИН выявились на
территориях других стран бывшего СССР, включая Балтийский регион: Латвия, Литва
и Эстония[141-143], Кавказ: Азербайджан и Грузия [144,145], Центральная Азия:
Казахстан, Узбекистан, Дагестан и Таджикистан [146-148], a также на территории
Молдовы [149]. Подавляющее большинство вирусов было выявлено среди потребителей
инъекционных наркотиков, и эти варианты вируса относились к крайне генетически
гомогенному варианту ВИЧ-1 субтипа А1, названному AFSU (или AIDU) [136]. Данный вариант вируса быстро стал
преобладающим на территориях всех этих государств, за исключением Эстонии, в
которой доминирующим является рекомбинантная форма CRF06_cpx [150]. Хотя первые
вспышки ВИЧ-инфекции были зарегистрированы в конце 1994 г. на юге Украины,
ретроспективный анализ образцов, собранных в Одессе в 1993 г., выявил несколько
случаев инфицирования вариантом ВИЧ, филогенетически близким к AFSU, однако данный вариант имел более
низкий уровень распространения и передавался в основном половым путем [151].
Вариант вируса AFSU
впоследствии стал одним из родительских форм вируса для рекомбинантной формы,
вызвавшей вспышку ВИЧ-инфекции в Калининграде - CRF03_AB. Позже был
идентифицирован второй родительский вариант: ВИЧ-1 субтипа B - популяция
вирусов, названная BFSU (или BIDU) [152]. Данная популяция вирусов была
выявлена в другом южном украинском городе - Николаеве. Штаммы данного вируса
также отличались чрезвычайно низким уровнем генетического разнообразия,
характерным для общего источника заражения. При этом не удалось показать
близкое генетическое родство данного варианта ни с одним штаммом субтипа В,
обнаруженным ранее в странах бывшего СССР, Западной Европе или США.
Предположительно, источником этой вспышки мог быть штамм ВИЧ-1 из Польши [153].
На сегодняшний день ВИЧ-1 субтипа А1 по-прежнему остается доминирующим на
территории стран бывшего СССР:в Латвии[154], Литве, Украине [155], Российской Федерации[156], стран Кавказского региона[146, 148,
157, 158]. Исключениеиз этого списка - Эстония, где превалирующим вариантом
ВИЧ-1 является циркулирующая рекомбинантная формаCRF06_cpx.
Ожидаемо, генетические дистанции между вирусами субтипа А1 увеличились, с 1-3
до 6-8%, как из-за естественного вирусного разнообразия, так и из-за изменения
основного пути передачи вируса с внутривенного введения наркотических средств
на гетеросексуальный путь [160, 161].
Происхождение варианта ВИЧ-1 AFSU
Вариант AFSUпредставляет одну из самых больших групп ВИЧ,
идентифицированных в глобальной пандемии, что привело к одной из самых быстро
растущих эпидемий ВИЧ-1 в мире. Происхождение этого варианта до сих пор
вызывало вопросы из-за противоречивых предложенныхгипотез. В 2007 г. М. Томсон
с соавторами филогенетически выявили сиквенсы из Демократической Республики
Конго (ДРК), которые формировали кластер вместе с образцами ВИЧ-1 из
Санкт-Петербурга, Россия, полученными в 1992-1994 гг. от пациентов,
заразившихся ВИЧ-1 гетеросексуальным путем. Образцы из ДРК находились в
основании кластера, что свидетельствовало об их анцестральности по отношению к
AFSU[151].
Годом позже, в 2008-м, Ч. Рива с соавторами выдвинул гипотезу о том, что
AFSUпроизошел из Гвинеи. Они выявили
ВИЧ-1 А1 (под именем 60 000), который был генетически очень близок кAFSU. Вирус был найден у пациента из г.
Конакри, столицы Республики Гвинея, который иммигрировал в Италию. Данный
изолят также находился в основании кластера, сформированного вариантами AFSU[162].
В 2015 г. Франциско Диез-Ферте с соавторами[163] повторили исследования о
происхождении AFSU с
использованием байесовских филодинамических подходов, основанных на теории
коалесценции, и вывели наиболее вероятную эволюционную гипотезу о происхождении
AIDU. Согласно их исследованиям, AFSUимеет достоверное происхождение из Демократической Республики Конго,
постериорная достоверность байесовской статистки составила 0,84 по анализу
фрагмента C2-V2-V3. Гипотеза, предложенная Ч. Ривой в 2008 г., не нашла
подтверждения. Так, постериорная достоверность кластера с изолятом 60 000 из
Республики Гвинея составила всего 0,0003.
Филогеографический анализ фрагмента p24gag выявил, что AFSU-вариант появился в Одессе
приблизительно в 1984 г. (1982-1987гг.), то есть приблизительно за 10 лет до
начала распространения среди инъекционных наркоманов. Изначально
распространение вируса происходило преимущественно половым путем, о чем
свидетельствуют образцы, расположенные у основания кластера и принадлежащие
пациентам, которые были инфицированы гетеросексуально не позже 1993 г. Анализ
фрагмента C2-V2-V3 гена env также указал на появление AFSUв г. Одессе в 1984 г. Комбинированные
результаты обоих анализов указывают интервал для tMRCA (время наиболее близкого
общего предка) AFSU- 1982-1987 гг.
Таким образом, вариант AFSUпоявился
в украинском городе Одессе приблизительно в 1984 г., за 10 лет до начала
эпидемии на территории стран бывшего СССР.
.10
Эпидемия ВИЧ-1 на территории Беларуси
Первый случай ВИЧ-инфекции на территории Беларусибыл выявлен в РНПЦ
эпидемиологии и микробиологии в 1986 г. у студента из Бурунди. В 1990 г. был
зарегистрирован первый случай СПИДа в стране у женщины - жительницы Беларуси
[164]. С 1986 по 1996 гг. количество случаев ВИЧ/СПИД, выявляемых ежегодно в
Беларуси, варьировало от 12 до 14, и на 1 января 1996 г. было официально
зарегистрировано 113 случаев ВИЧ-инфекции. 66% всех случаев ассоциировано с
половым путем передачи вируса.Молекулярно-эпидемиологические исследования
показали доминирование генетически гетерогенного ВИЧ-1, главным образом,
субтипа С [140]. Летом 1996 г. в г. Светлогорске Гомельской области был
зафиксирован резкий рост случаев выявления ВИЧ-инфекции у лиц, являвшихся
потребителями инъекционных наркотиков. Так, в июле 1996-го было зафиксировано
60 случаев ВИЧ-инфекции, а на 1 ноября 1997 г. общее число случаев ВИЧ-инфекции
составило уже 1728, 85% из которых выявлено у ПИН. В отличие от Украины и
России, где эпидемия ВИЧ-1 поразила различные географические регионы, в
Беларуси эпидемия была ограничена в основном г. Светлогорском, на долю которого
приходилось более 70%всех случаев ВИЧ-инфекции среди ПИН. В Светлогорске с
населением в 72 000 человек ВИЧ-1 был диагностирован у более чем 1200 из 14 000
инъекционных наркоманов, из которых 88% являлись лицами в возрасте 18-29 лет.
Молекулярные исследования показали, что вспышка была вызвана ВИЧ-1 субтипа А1,
который генетически идентичен вирусам у ПИН в Южной Украине и Центральной и
Южной России [140].
По состоянию на 1 декабря 2015г. в Республике Беларусь зарегистрировано
19 605 случаев ВИЧ-инфекции, количество людей, живущих с ВИЧ-1 - 15 069,
показатель распространенности составил 158,9 на 100 тысяч населения[165].
За период 1996-2008 гг. на территории Беларуси по-прежнему доминирующим
оставался ВИЧ-1 субтипа А1, вариант AFSU, на долю которого приходилось около 95% от всех случаев ВИЧ-инфекции. В
четырех случаяхбыло выявлено инфицирование ВИЧ-1 субтипом В. Данные изоляты при
филогенетическом анализе не были близкими между собой и, вероятно, явились
результатом четырех эпидемиологически независимыхзаносов[166]. Помимо субтипов
А1 и B, выявлены варианты ВИЧ-1 субтипов С,
G, CRF02_AG, CRF03_AB, CRF06_cpx, а также уникальная рекомбинантная форма ВИЧ-1
AFSU/BFSU.
Филогенетическая
систематика
Филогенетическая систематика, или филогенетика - наука, изучающая
эволюционные отношения между разными видами на Земле. Эволюционный процесс
можно рассматривать как процесс ветвления, и результаты обычно представлены в
форме бифуркационного филогенетического дерева (phylogenetic tree), на котором
ветви от двух любых таксонов соединены в одном узле. Порядок узлов и ветвление
дерева составляют топологию филогенетического дерева, длины ветвей дерева
соответствуют генетическому расстоянию между таксонами. Высокая скорость
эволюционной изменчивости ВИЧделает его идеальной моделью для изучения
эволюционного процесса и позволяет проследить эволюцию в режиме «реального
времени» [167].
Эволюционный процесс включает в себя изменения генома в виде инсерций,
делеций, замен нуклеотидов и рекомбинационные события. Эволюционные отношения
изучаются методом попарного сравнения, поэтому первым и важным этапом
филогенетического анализа является создание алаймента сиквенсов (sequence
alignment) нуклеотидов или аминокислот. Далее выводы о филогенетических
отношениях будут зависеть от выбранной модели нуклеотидных замен (substitution
model) для данного алаймента, модели реконструкции дерева и, в конечном счете,
от оценки статистической достоверности отношений на филогенетическом дереве.
Модели нуклеотидных замен
Два сиквенса (таксона), у которых один общий предок (узел), могут
развиваться независимо друг от друга. Наиболее простой подход к измерению
дивергенции между сиквенсами - расчет числа различий в сайте, обозначаемых
генетической дистанцией, или p-дистанцией (p-distance). К
сожалению, когда дивергенция очень высокая, p-дистанция не точно
оценивает количество замен, произошедших на самом деле. Например, параллельная
замена, при которой оба связанных таксона приобрели одну и ту же замену в одном
и том же сайте, таким образом скрывая эволюционное событие, на самом деле
произошедшее. Подобным образом влияют на недостоверный расчетp-дистанции
и обратные мутации, например, А → С →А, в случае которых замена, на
самом деле произошедшая, не учитывается. И, наконец, в сайте может произойти
несколько замен: A → G → T, но только одна замена, A → T,
будет учитываться. С целью более точного вычисления эволюционных изменений было
предложено несколько моделей нуклеотидных замен. Все эти модели относятся к
классу цепей Маркова с дискретным и непрерывным временем, в которых
используется матрица интенсивностей Q для указания относительной
скорости замены каждого нуклеотида на протяжении всей длинысиквенса.
Более того, все модели принимают во внимание следующие положения:
. скорость замены основания i на основание j не
зависит от основания, которое находилось в данном сайте до i;
. скорость замен неизменна во времени;
. относительная скорость изменений нуклеотидов A,G,T,C -
одинаковая.
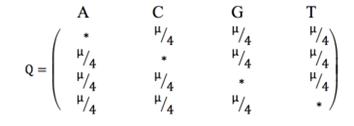
Наиболее простая модель нуклеотидных замен - модельJC69(Jukes and Cantor,
1969), которая предполагает, что все нуклеотиды имеют одинаковую частоту
появления (25% каждый): πA= πG= πT= πC=
¼, где π
- частота появления
каждого нуклеотида, и каждый нуклеотид имеет равную вероятность быть замененным
любым другим (рисунок 1.8)[168].
В модели JC69 частота замены всех нуклеотидов равна 1:a=b=c=d=e=
= f=1. Q-матрица данной модели имеет вид, показанный на рисунке
1.9.
Эта модель быстро стала усложняться, так какначало увеличиваться
количество расчетных параметров в Q-матрице. Появились другие модели
замен, такие как K80 (Kimura 2-parameter, Kimura, 1980), F81 (Felsenstein,
1981), HKY85 (Hasegawa, Kishino and Yano, 1985), T92 (Tamura 1992), T93 (Tamura
and Nei, 1993) и GTR: Generalised time-reversible (Tavaré,
1986)[169-172].
модель является наиболее сложной моделью нуклеотидных замен и включает 8
свободных расчетных параметров [173, 174]. В этой модели каждый нуклеотид имеет
свою собственную частоту замен: πA + πG + πT +
πC = 1 и различную
скорость замены основания i на основание j: a+b+c+d+e+f=1(рисунок
1.10).
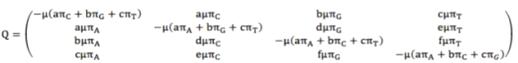
Промежуточные модели, такие как HKY85, рассчитывают индивидуальную
частоту появления каждого нуклеотида и различные скорости замены нуклеотидов
для транзиций (А → G, C → T) и трансверсий (А → С, G →
T). Предположение, что частота нуклеотидных замен одинакова на протяжении всего
сиквенса и в каждом сайте с равной вероятностью может произойти мутация, с
биологической точки зрения часто не верно. Например, хорошо известно, что
третья позиция в кодоне, кодирующем аминокислоту, изменяется чаще, чем первая и
вторая позиции кодона. Чтобы учесть этот факт, обычно используется модель
нуклеотидных замен, позволяющая рассчитать гетерогенность между сайтами и
предполагать, что некоторые сайты являются инвариантными. Было обнаружено, что
расчет гетерогенности сайтов хорошо описывается гамма-распределением (G), при
котором каждый сайт имеет свою степень изменения нуклеотидов.
Модели реконструкции филогенетических деревьев
Следующим шагом определения филогенетических отношений является выбор
соответствующей модели реконструкции филогенетического дерева. Наиболее ранние
и простые модели - дистанционные, в основном модель «минимальной эволюции»
(minimum evolution, ME) и кластерный анализ. Обе модели реконструируют дерево,
используя матрицу попарных генетических дистанций. Методы кластеризации, как,
например, UPGMA (Unweighted Pair Group Method with Arithmetic
Mean), предполагают постоянную скорость эволюции во времени и реконструируют
деревья, поэтапно группируя сиквенсы с наименьшей дистанцией между ними.
Сиквенсы кластрируются, основываясь на усреднении расстояний, то есть глубина
дивергенции - это дистанция между сиквенсами А и В, деленная на 2. Методы,
рассчитывающие минимальную эволюцию, как, например, neighbor-joining (NJ),
сходны с методами кластерного анализа, но они не предполагают постоянную
скорость эволюции всей «родословной» филогенетического дерева. Более того,
методы минимальной эволюции основываются на данных, обратных средним
дистанциям. Так, дистанция между двумя сиквенсами равна сумме длин ветвей между
ними, а не средним дистанциям. Метод NJ работает следующим образом: он
конвертирует алаймент сиквенсов в матрицу дистанций, которая отображает
расчетную эволюционную дистанцию между всеми сиквенсами в алайменте. Когда
матрица построена, алгоритм находит пару таксонов с наибольшей схожестью и
соединяет их с так называемым наиболее близким общим предком (MRCA, most resent
common ancestor), представляющим собой узел, соединяющий эти два таксона. Далее
дистанции от них до MRCA рассчитываются в зависимости от выбранной модели
нуклеотидных замен и, в конечном итоге, определяются расстояния от MRCA до всех
таксонов в алайменте. В результате образуется новая матрица, где два первых
таксона представляют один наиболее близкий общий предок, MRCA и алгоритм
начинает заново рассчитывать расстояния до оставшихся таксонов. Этот процесс
повторяется до тех пор, пока все таксоны не будут включены в филогенетическое
дерево.
Метод максимального правдоподобия (Maximum Likelihood, ML) позволяет
вычислить условную вероятность параметров относительно данных и модели [175].
Метод заключается в следующем: на основе выборки данных и предполагаемой модели
(нормальное распределение) алгоритм случайным образом предлагает значения
параметров (среднего значения и дисперсии). Затем эти два значения параметров,
а также сами наблюдаемые данные подставляются в формулу функции правдоподобия.
После расчета получается число - значение правдоподобности. Затем алгоритм ML
предлагает новые два значения среднего и дисперсии (или одно из них), опять
вычисляет правдоподобность и проверяется, как изменилось ее значение - если оно
возросло, алгоритм считает, что он движется в правильном направлении, и
предложенные новые параметры более точно описывают данные. Полученные значения принимаются
как текущие, и алгоритм продолжает вычисления. Если же значение
правдоподобности уменьшилось, то параметры эти считаются неверными, и алгоритм
продолжает поиск от тех параметров, что были до этого. Такой поиск идет до тех
пор, пока не будет найден так называемый пик функции правдоподобия - такое ее
состояние, когда изменение параметров в любом направлении будет приводить к
уменьшению значения правдоподобности. Однако число возможных деревьев
значительно возрастает с ростом числа таксонов в алайменте, и при их количестве
более 10 осуществить поиск всех вероятных деревьев целиком - задача практически
невозможная из-за лимита вычислительных возможностей.Для решения этой проблемы
в ML были предложены несколько стратегий, которые исследуют части филогенетических
деревьев. Таковымиявляются SPR - subtree pruning and regrafting, NNI - nearest neighbor
interchange и TBR - tree bisection and
reconnection. Все три
метода используют специальные правила для генерации нового «переделанного»
дерева из заданного стартового дерева. Для каждого нового дерева вычисляется
значение максимального правдоподобия, и дерево с наибольшим значением
используется для повторения процесса.
Оценка достоверности филогенетического анализа
Недостатком обоих моделей NJ и ML является то, что они производят только
расчеты филогенетических дистанций, без какого-либо статистического расчета
филогенетических связей в дереве. В начале эта проблема решилась путем
использования метода, называемого «статистический бутстрэп» (bootstrapping) [176].
Данный метод относится к классу методов генерации повторной выборки. Суть его
заключается в многократной генерации серий образцов (псевдорепликатов), в
которых заменены местами сайты в алайменте, включая замены (то есть позиция в
алайменте может быть использована несколько раз). Псевдорепликаты при этом
имеют длину, равную исходному алайменту. Далее с каждым алайментом
псевдорепликатов строится филогенетическое дерево и вычисляется количество
кластеров с каждым сиквенсом. Значение бутстрэпа показывает, сколько раз
сиквенсы в алайменте кластрируются вместе. Например, если алаймент состоит из 4
образцов A, B, C и D, алгоритм бутстрэп построит 4 псевдофилогенетических
дерева. И если в 3 из 4 случаев на этих деревьях образцы A и B будут
кластрироваться вместе, то значение бутстрэпа для данных образцов составит 75.
Другим классом методов вычисления достоверности филогенетического дерева
являются методы, основанные на длине ветви (branch length methods). К ним
относятся:
· zero-branch length test (тестнулевойдлиныветви);
· aLRT (approximately likelihood ratio
test, тест приблизительного правдоподобия);
· SH-aLRT (Shimodaira-Hasegawa
+approximately likelihood ratio test, тест Шимодаира-Хасегава + тест
приблизительного правдоподобия).
Среди данных методов наиболее совершенным является SH-aLRT. aLRT очень
близок к LRT (тест отношения правдоподобия), используемому для проверки
ограничений на параметры статистических моделей, оцененных на основе выборочных
данных. aLRT имеет «нулевую гипотезу», то есть тестируемая ветвь
филогенетического дерева имеет нулевую длину. Изначально этот тест базировался
на критерии хи-квадрат [177]. Внедрение в aLRT теста Шимодариа-Хасегавы (SH)
оптимизировало процедуру тестирования статистики «нулевой гипотезы»
филогенетической ветви [178]. Кроме этого, SH-aLRT надежный даже для коротких
ветвей филогенетического дерева, в отличие от метода бутстрэп [179].
Таким образом, для изучения генетического разнообразия, распространения и
молекулярной эпидемиологии ВИЧ филогенетический анализ ВИЧ является наиболее
эффективным методом [180, 181].
Анализ литературных данных показывает, что проблема ВИЧ-инфекции остается
актуальной. Высокая скорость репликации вируса, низкая точность обратной
транскрипции, интегративный механизм взаимодействия с чувствительной клеткой,
многократное проникновение разных вариантов вируса в популяцию человекапривели
к высокому генетическому разнообразию ВИЧ, что значительно усложнило лечение
ВИЧ-инфицированных пациентов и разработку эффективной вакцины.
Определение субтипов ВИЧ, направлений их заноса и распространения на
территории страны дает возможность расшифровывать вспышки ВИЧ-инфекции,
заражение через кровь и ее продукты, умышленные случаи инфицирования.
Рекомбинантные формы ВИЧ представляют отдельную проблему, поскольку наследуют
гено- и фенотипические признаки от родительских вариантов ВИЧ различных
субтипов. Такие эволюционные события, как рекомбинация, могут привести к
появлению вариантов вируса с новыми биологическими свойствами.В этой связи
определение субтипов и рекомбинантных форм ВИЧ в разных странах, в том числе и
на территории Республики Беларусь, остается весьма значимым и актуальным
направлением научных исследований.
Не менее важны контроль за эффективностью лечения ВИЧ-инфицированных
пациентов и своевременное определение мутаций резистентности в геноме ВИЧ к
препаратам антиретровирусной терапии. Применяемые в настоящее время на
территории Республики Беларусь зарубежные тест-системы для генотипирования и
выявления мутаций резистентности ВИЧ к антиретровирусным препаратам весьма
дорогостоящие, и создание отечественного набора даст возможность сэкономить
значительные валютные средства.
Обозначенные проблемы составили предмет нашего научного интереса при
проведении настоящих диссертационных исследований.
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ
.1
Характеристика образцов
В работе использовались образцы сыворотки/плазмы крови, полученные от
ВИЧ-инфицированных пациентов, состоящих на учете в лечебно-профилактических
учреждениях (ЛПУ) Республики Беларусь, а также от пациентов, у которых впервые
выявлена ВИЧ-инфекция в лаборатории диагностики ВИЧи сопутствующих инфекций
РНПЦ эпидемиологии и микробиологии. Образцы были получены в рамках исследований
на определение резистентности ВИЧ-1 к антиретровирусным препаратам,
молекулярно-генетического скрининга, количества вируса (вирусной нагрузки) и
маркеров ВИЧ-инфекции. Всего проанализировано более 2000 образцов
сыворотки/плазмы крови, поступивших в лабораторию в 2008-2015 гг., для
исследования на наличие маркеров ВИЧ-инфекции и определения вирусной нагрузки.
С целью выявления рекомбинантных форм вработе было использовано 302сиквенса
участка гена polВИЧ-1,
полученных в лаборатории диагностики ВИЧи сопутствующих инфекций начиная с 1996
г.и зарегистрированных в Genbank. Один сиквенс, изолят 98BY10443, был взят из
Genbank (AF414006.1). Данный сиквенс получен А. Е. Машарским от
ВИЧ-инфицированного пациента из г. Могилева, который заразился парентеральным
путем в г. Калининграде, Россия[182].
Таким образом, в диссертационной работе использовано 303 сиквенса участка
гена pol и полноразмерного генома ВИЧ-1.Основные данные по пациентам, от
которых получены образцы крови, представлены вприложении А.
Получение
сыворотки/плазмы крови
Плазма/сыворотка крови для проведения вирусологических и молекулярно-генетических
исследований была поучена путем центрифугирования цельной крови, содержащей/не
содержащей ЭДТА, при 3000 об/мин в течение 15 минут. Хранение сыворотки/плазмы
осуществлялось в завинчивающихся одноразовых пробирках объемом 1,5-2,0 мл при
температуре минус 70 ℃.
.2
Скрининг сыворотки/плазмы крови на наличие маркеров ВИЧ-инфекции
Скрининг сыворотки/плазмы крови методом иммуноферментного анализа
использовался для первичной диагностики ВИЧ-инфекции в поступивших образцах при
условии, что диагноз ВИЧ-инфекции не был предварительно установлен в других ЛПУ
Республики Беларусь.
Для выявления серологических маркеров ВИЧ-инфекции использовались наборы
реагентов для иммуноферментного выявления антител к ВИЧ-1,2 и антигена р24 ВИЧ:
КомбиБест ВИЧ-1,2 АГ/АТ (ЗАО «Вектор-Бест», Россия) и набор реагентов для
иммуноферментного выявления и подтверждения наличия антигена р24 ВИЧ: ВИЧ
р24-антиген-ИФА-БЕСТ (ЗАО «Вектор-Бест», Россия), согласно прилагаемым к
наборам инструкциям.
Количественное
определение РНК ВИЧ
В исследуемых образцах при наличии подтвержденной ВИЧ-инфекции и/или
серологических маркеров ВИЧ-инфекции определялось количество РНК ВИЧ(вирусная
нагрузка) с использованием набора реагентов для выявления и количественного
определения РНК вируса иммунодефицита человека методом ОТ-ПЦР в режиме
реального времени: РеалБест РНК ВИЧколичественный (ЗАО «Вектор-Бест», Россия)
на амплификаторе CFX96 (BioRad, США), согласно прилагаемой к набору
инструкции.
Для экстракции РНК и последующего синтеза ДНК ВИЧиспользовались образцы с
вирусной нагрузкой не менее 2000 копий РНК ВИЧна 1 мл сыворотки/плазмы крови.
Выделение
РНК ВИЧ
Выделение РНК ВИЧпроводилось с использованием коммерческих наборов
различных производителей, согласно прилагаемым к ним инструкциям:
1. ViroSeq Sample Preparation Module (Abbott Molecular,
США). Объем плазмы крови - 0,5 мл;
. Рибо-Сорб (АмплиСенс, Россия). Объем сыворотки/плазмы крови -
0,1 мл;
. Рибо-Преп (АмплиСенс, Россия). Объем сыворотки/плазмы крови -
0,1 мл.
Полученная РНК хранилась в пробирках объемом 0,6 мл при температуре минус
(20-70) ℃.
Определение
участка генома ВИЧдля секвенирования
и филогенетического анализа
С целью определения участка секвенирования генома ВИЧдля последующего
генотипирования и филогенетического анализа был осуществлен анализ всех
имеющихся референсных последовательностей ВИЧв международной базе данных
сиквенсов ВИЧHIV sequence
database(#"896330.files/image007.jpg">
Для амплификацииучастка гена polсобственными праймерами были подобраны пары праймеров,
позволяющие синтезировать участок, кодирующий протеазу и 2/3 участка,
кодирующего обратную транскриптазу ВИЧ. Размер амплифицируемого фрагмента
генома ВИЧ-1 составил порядка 1500 п.н. (рисунок 2.2).
Таблица 2.2.- Пары праймеров для амплификации фрагмента гена pol
ВИЧ
|
Праймер
|
Нуклеотидная
последовательность праймера
|
Координата
относительно HXB2
|
|
PR1S1
|
GAAAAAGGGCTGTTGGAAATGTGGAA
|
2016 →
2038
|
|
P1AOT,1
|
AAATTTAGGAGTCTTTCCCCATATTACTATGC
|
3685 ←
3716
|
|
PROS-22
|
GCTAATTTTTTAGGGAAGATCTGGCCTT
|
2080 →2102
|
|
RTOA2
|
TGCCTCTGTTAATTGTTTTACATCATTAGTGTG
|
3630 ←
3662
|
Праймер для обратной транскрипции.
Праймер для первого раунда ПЦР.
Праймер для второго раунда ПЦР.
Синтез
полноразмерного генома ВИЧ
Для амплификации полноразмерного генома ВИЧ-1 были использованы пары
праймеров, позволяющие амплифицировать все структурные гены вируса, а также
часть 5’- и 3’-LTR ВИЧ. Данные пары праймеров условно делят геном ВИЧ-1 на 4
перекрывающихся фрагмента, обозначенных A, B, C и D(рисунок 2.3).
Нуклеотидные последовательности праймеров для амплификации
полноразмерного генома ВИЧ-1 и их координаты относительно HXB2 указаны в
таблице 2.3.
Таблица 2.3. - Пары праймеров, использованные для амплификации
полноразмерного генома ВИЧ
|
Фраг-мент
|
Праймер
|
Нуклеотидная
последовательность праймера
|
Координата в
HXB2
|
|
A
|
5’R11
|
AGATCTGAGCCTGGGAGCTCTCTGG
|
473 → 497
|
|
PROAOT,1
|
TTTATGGCAAATACTGGAGTATTGTATGGA
|
2740 ←
2711
|
|
5’RU5S2
|
GCTTCAAGTAGTGTGTGCCCGTCTG
|
546 → 570
|
|
PRTA2
|
CTTTTGGGCCATCCATTCCTG
|
2590 ←
2610
|
|
B
|
PROS2b1
|
GCTAATTTTTTAGGGAARATYTGGCCTT
|
2080 →
2107
|
|
Pol OA1OT,1
|
TCTCCTGTATGCAGACCCCAATATGT
|
5242 ←
5267
|
|
PRTS2
|
AGCCCCACCAGAAGAGAGCTT
|
2157 →
2177
|
|
5’HIV-NA2
|
CCCTAGTGGGATGTGTACTTCTGAACTTA
|
5192 ←
5220
|
|
C
|
3’HIV-OS31
|
TACAGTGCAGGGGAAAGAATAATAGACATAATA
|
4809 →
4841
|
|
gp120-OAOT,1
|
TGTCTGGCCTGTACCGTCAGCG
|
7831 ←
7852
|
|
3’HIV-OS2
|
CAAAATTTTCGGGTTTATTACAGGGACA
|
4890 →
4917
|
|
gp41-AS2
|
GCTTCCTGCTGCTCCCAAGAACC
|
7786 ←
7808
|
|
D
|
gp41-nefOS-21
|
TTGAACCAYTAGGAGTAGCACCCAC
|
7696 →
7720
|
|
Nef-AS4OT,1
|
AGAGAGACCCAGTACAGGCAAAAAGC
|
9523 ←
9548
|
|
gp120-S2
|
ACCAAGGCAAAGAGAAGAGTGGTG
|
7719 →
7742
|
|
3’Nef 32
|
GTACAGGCAAAAAGCAGCTGCTTATATG
|
9510 ←
9537
|
Праймер для обратной транскрипции.
Праймер для первого раунда ПЦР.
Праймер для второго раунда ПЦР.
Обозначения:
→ - прямой праймер.
← - обратный праймер.
Регистрация
продуктов амплификации
Детекция продуктов амплификации проводилась методом горизонтального
электрофореза в 1,7%-ном агарозном геле (Sigma, США). Буфер для нанесения
использовался DNA Gel Loading Dye (6X) (Thermo Fisher, США). Электрофорез
проводился в горизонтальной камере для электрофореза.Электрофоретический буфер
- 0,5 TAE (20 ммоль Трис, 10 ммоль уксусная к-та, 0,5 ммоль ЭДТА), напряжение
электрического поля - 10 В/см расстояния между электродами, время проведения
электрофореза - 18 минут. В качестве интеркалирующего красителя ДНК
использовался бромистый этидий. Регистрация ДНК проводилась в проходящем
УФ-свете (312 нм) трансиллюминатора UVT-1 (Россия). Длина амплифицированных
фрагментов определялась относительно маркера молекулярного веса - 100-1500 п.н.
с шагом 100 п.н. (различных производителей). Положительными считались образцы,
которые имели полосу на геле на уровне, соответствующем размеру
амплифицируемого фрагмента.
Очистка
продуктов амплификации после ПЦР
Для проведения секвенирующей ПЦР положительные образцы очищались от
остатков праймеров, дНТФ и ДНК-полимеразы с использованием наборов QIAquick PCR
Purification Kit (QIAGEN, США) и Clean Up Enzyme Mix (Abbott Molecular, США),
согласно инструкциям к применению наборов.
Секвенирующая
ПЦР
Реакция секвенирования проводилась по методу Сэнгера [183]с
использованием терминаторов BigDye Termination Cycle Sequencing Kit v.3.1
(Applied Biosystems®, США), а также специфических праймеров для амплификации
ДНК ВИЧ,согласно инструкции к применению набора.
Очистка
продуктов амплификации после секвенирующей ПЦР
Амликоны после секвенирующей ПЦР очищались методом преципитации ДНК с
ацетатом натрия. Для этого готовилась смесь холодного (-20 ºС) 96%-ного этанола и 3-молярного
ацетата натрия объемом 50 мкл и 2 мкл на образец соответственно. К смеси
добавлялось 20 мкл продукта амплификации, после чего смесь центрифугировалась
при следующих условиях: время 30 мин, температура +4 ºС, скорость 13 000 g. Супернатант
удалялся и осадок промывался холодным (-20 ºС) 70%-ным этанолом с последующим
центрифугированием: время 5 мин, температура +20 ºС, скорость 13 000 g. Далее
супернатант удалялся и осадок высушивался при 95 ºС в течение 2 мин. Высушенный осадок
растворялся в 20 мкл формамида Hi-Di™ Formamide (Applied Biosystems®), после
чего прогревался при 95 ºС в течение 2 мин.
Получение
электрофореграмм и сборка контига
Электрофореграммы исследуемых образцов были получены на автоматическом
генетическом анализаторе ABI PRISM® 3100-Avant™ Genetic Analyzer (Applied
Biosystems®).Анализ электрофореграмм и сборка контига осуществлялись с помощью
программного обеспечения Sequencing Analysis Software™ (Applied Biosystems®) и
Geneious® v8 (Biomatters Ltd.).
Выравнивание
последовательностей нуклеотидов
Множественное выравнивание последовательностей нуклеотидов (multiple
sequence alignment) проводилось с помощью алгоритма ClustalW alignment [184] и
MAFFT [185,
186].
Получение
референсных сиквенсов
Поиск генетически близких референсных сиквенсов ВИЧосуществлялсяс помощьюBLAST (Basic Local Alignment Search Tool, #"896330.files/image008.jpg">
С целью проверки внутрисубтипной рекомбинации для первых 400 нуклеотидов
всех исследуемых CRF03_AB, относящихся к субтипу А ВИЧ, были найдены 10
наиболее генетически близких референсов онлайн-программой BLAST. Результаты
поиска показали, что все найденные референсы относятся к варианту ВИЧ-1 AFSU,
получившему распространение на территории стран бывшего СССР, включая Беларусь.
Не было выявлено ни одного анцестрального референсного сиквенса, с которым
могла быть внутрисубтипная рекомбинация, как это было установлено программой
REGA. Такой результат может быть обусловлен некоторыми заменами нуклеотидов в
сиквенсах исследуемых образцов, что делает их генетически ближе к консенсусному
сиквенсу субтипа А1, генетически отличного от варианта ВИЧ-1 АFSU, из генома
которого состоят сегменты субтипа А1 в CRF03_AB. Таким образом,исследуемые
образцы Mg_15 и MnObl_61 являются «чистыми» CRF03_AB.
Образцы Mn_8 и PV_29 были идентифицированы программой REGA как
рекомбинантные формы между субтипами B и D ВИЧ, однако другие методы
генотипирования не подтвердили наличия вставки генома субтипа D. Как и в случае
с образцами Mg_15 и MnObl_61, такой результат получился из-за единичных
изменений в геноме исследуемых образцов, что сделало их генетически ближе к
ВИЧ-1 субтипа D в середине генома. При визуальном анализе нуклеотидных и
аминокислотных последовательностей референсных сиквенсов субтипов B и D ВИЧ-1 и
исследуемых образцов в участке рекомбинации не было выявлено существенных
отличий Mn_8 и PV_29 от консенсусных сиквенсов субтипа В.
При филогенетическом анализе образец Mn_21 кластрировался вместе с
образцами ВИЧ-1 субтипа А1 варианта AFSU, однако программы REGA и jpHMM показали наличие вставок
ВИЧ-1 субтипа B, отличных от CRF03_AB, идентифицировав, таким образом,
уникальную рекомбинантную форму ВИЧ. Подробнее о ней написано в главе 5 данной
работы.
При генотипировании образца Mg_3 с использованием программ COMET, REGA и
jpHMM было определено, что данный образец является субтипом G ВИЧ. Однако при
построении филогенетического дерева образец Mg_3 оказалсяв субкластере с
циркулирующей рекомбинантной формой CRF43_02G. В то же время варианты
циркулирующей рекомбинантной формы CRF43_02G, находящиеся в Genbank,
формировали между собой отдельный суб-субкластер (Приложение Б). Анализ точек
рекомбинации показал, что точка разрыва генома CRF43_02G находится в позиции
3325, то есть начиная с нуклеотида 3325 начинается последовательность генома
циркулирующей рекомбинантной формы CRF02_AG.
В свою очередь, CRF02_AG имеет разрыв генома в координате 3275, начиная с
которой геном ВИЧ-1 представлен субтипом А(рисунок 3.4).
С целью проверки, содержит ли образец Mg_3 геном субтипа А, был проведен
визуальный анализ нуклеотидной и аминокислотной последовательностей Mg_3 в
алайменте с референсными сиквенсами ВИЧ-1 субтипов A и G. В результате выявлен
только один нуклеотид А в позиции 3439, который характерен для субтипа А (А1 и
А2), в то время как у ВИЧ-1 субтипа G в данной позиции находится нуклеотид
С(рисунок 3.5).
Данная позиция является второй в триплетном коде аминокислоты, и в случае
нахождения нуклеотида С образуется триплет GCR, кодирующий аминокислоту аланин.
Нуклеотид А в триплете RAR кодирует аминокислоты лизин или глутаминовую
кислоту, являющиеся консенсусными для субтипа А. Все остальные нуклеотидные и
аминокислотные последовательности образца Mg_3 относились к субтипу G. Таким
образом, образецMg_3 был определен как ВИЧ-1 субтипа G.
В большинстве случаев все различные методы генотипирования ВИЧ-1 дают
одинаковые результаты.Различиярезультатов, вероятнее всего, обусловлены
различными алгоритмами генотипирования образцовВИЧ-1 (филогенетический анализ,
бутскан-анализ) и/или различными консенсусными сиквенсами, с которыми
сравнивается исследуемый образец.
Распространенность
субтипов ВИЧ-1 на территории Беларуси
Проведенные исследования по генотипированию показали, что ВИЧ-1 субтипа
А1 в анализируемый период оставался доминирующим на территории Беларуси. На его
долю среди всех исследованных 303 образцов ДНК приходилось 275 случаев, что
составляло 90,7%. Кроме субтипа А1, было выявлено 9 случаев инфицирования ВИЧ-1
субтипа В (3,0%), по 2 случая приходилось на инфицирование субтипами ВИЧ-1 С и
G (по 0,7%). В 15 (4,9%) образцах были выявлены рекомбинантные формы ВИЧ. Более
половины случаев от всех обнаруженных рекомбинантных форм приходилось на
CRF03_AB - 8 (2,6%), на CRF02_AG - 4 (1,3%), на CRF06_cpx - 2 (0,7%) и в одном
случае выявлена уникальная рекомбинантная форма (УРФ) ВИЧ-1 между субтипами A1
и B(таблица 3.6).
Таблица 3.6. - Распределение субтипов и рекомбинантных форм ВИЧ-1 по
сумме результатов генотипирования различными методами
|
Субтип ВИЧ-1
|
n
|
%
|
|
A1
|
275
|
90,7
|
|
B
|
9
|
3,0
|
|
C
|
2
|
0,7
|
|
G
|
2
|
0,7
|
|
CRF02_AG
|
1,3
|
|
CRF03_AB
|
8
|
2,6
|
|
CRF06_cpx
|
2
|
0,7
|
|
URF_AB
|
1
|
0,3
|
Наибольшее распространение ВИЧ-1 субтипа А1 было выявлено у ПИН - 119 из
275 (43,2%), средний возраст данной группы пациентов составил 33,7±5,8 лет. На
втором месте - лица, инфицированные половым путем - 102 пациента (33,7%),
средний возраст составил 31,4±8,0 лет. В 42 случаях материал был получен от
детей в возрасте до 18 лет, рожденных от ВИЧ-инфицированных матерей. Не удалось
установить путь инфицирования в 12 случаях.
ВИЧ-1 субтипа Bвыявлялся,
главным образом, у лиц, инфицированных половым путем - 6 из 9 случаев, включая
2 МСМ. Средний возраст пациентов в данной группе составил 32,5±8,0 лет. В одном
случае субтип В был выявлен у ПИН, мужчины 1976 г.р. из г. Орши Витебской
области. В двух случаях образцы крови были получены от лиц, явившихся
реципиентами крови от ВИЧ-инфицированного пациента. Это женщина 1929 г.р. и
мужчина 1947 г.р., (образцы PV_31
и PV_30 соответственно), проживающие в г.
Витебске.
ВИЧ-1 субтипа С выявлен у семейной пары - образцы Mn_22 и Mn_39. Оба
партнера были инфицированы половым путем, один из которых явился источником
вируса для другого партнера.
Субтип Gбыл определен в образцах Mg_3 - женщины 1986 г.р. из г. Могилева
и RES_646 - мужчины 1983 г.р. из г.
Барановичи, который был инфицирован половым путем.
Рекомбинантные формы ВИЧ-1 были выявлены у пациентов с различным путем
инфицирования. УРФ Mosи 2 ЦРФ CRF02_AGбыли определены у детей, рожденных ВИЧ-инфицированными матерями,
у ПИНв 3 случаях были выявлены CRF03_ABи в 2 - CRF06_cpx.
Наибольшее количество случаев ВИЧ-инфекции рекомбинантными формами ВИЧ-1 было
определено среди лиц, инфицированных половым путем - 5 случаев инфицирования CRF03_ABи 2 случая - CRF02_AG.
Таким образом, по проведенным в данной главе молекулярно-генетическим
исследованиям можно сделать следующие выводы:
на территории Республики Беларусь в популяции пациентов с ВИЧ/СПИД за
анализируемый период 2008-2015 гг. доминировал ВИЧ-1 субтипа А1, на который приходилось
90,7% от 303 проанализированных сиквенсов ДНК по участку гена pol.
Данный субтип передавался как парентерально при внутривенном введении
наркотиков (43,2%), так и половым путем (33,7%). Средний возраст этих групп
пациентов составил 33,7 и 31,4 лет соответственно;
рекомбинантные формы ВИЧ-1 по частоте встречаемости находись на втором
месте - 4,9% (15) от всех проанализированных последовательностей ДНК. Более
половины случаев от всех обнаруженных рекомбинантных форм приходилось на
CRF03_AB - 8 (2,6%), на CRF02_AG - 4 (1,3%), на CRF06_cpx - 2 (0,7%) и в одном
случае выявлена уникальная рекомбинантная форма ВИЧ-1 между субтипами A1 и B;
субтип В был выявлен в 9 (3%) случаях ВИЧ-1-инфекции, субтипы Cи G - в двух случаях каждый (по 0,7% каждый).
ГЛАВА 4. РЕКОМБИНАНТНЫЕ ФОРМЫ ВИЧ-1, ВЫЯВЛЕННЫЕ НА ТЕРРИТОРИИ
РЕСПУБЛИКИ БЕЛАРУСЬ
На следующем этапе исследований предстояло выяснить происхождение
рекомбинантных форм ВИЧ-1. Являются ли они результатом заноса из-за пределов
страны, либо рекомбинантные события в геноме вируса произошли на территории
Республики Беларусь.
На основании сиквенсов гена pol, а также секвенирования
полноразмерного генома было выявлено 15 случаев ВИЧ-инфекции, вызванных
рекомбинантными формами ВИЧ-1. Более половины всех случаев (8 из 15)
приходилось на CRF03_AB, четыре случая вызваны CRF02_AG, два случая -
CRF06_cpx. В одном случае выявлена уникальная рекомбинантная форма ВИЧ-1 между
субтипами А1 и В, данные по выявленным рекомбинантным формам представлены в
таблице 4.1.
Таблица 4.1. - Рекомбинантные формы ВИЧ-1, выявленные в Беларуси
|
Образец
|
Рекомбинантная
форма
|
Город
|
Область
|
Путь
инфицирования
|
|
FN995208
|
CRF02_AG
|
Чаусы
|
Могилевская
|
Вертикальный
|
|
Mn_59
|
|
Минск
|
Минская
|
Вертикальный
|
|
Mn_60
|
|
Минск
|
Минская
|
Половой
|
|
RES_649
|
|
Минск
|
Минская
|
Половой
|
|
Gr_3
|
CRF03_AB
|
Лида
|
Гродненская
|
Половой
|
|
Gr_8
|
|
Лида
|
Гродненская
|
Половой
|
|
Mg_8
|
|
Могилев
|
Могилевская
|
Половой
|
|
Mg_15
|
|
Осиповичи
|
Могилевская
|
Половой
|
|
MnObl_15
|
|
|
Минская
|
Половой
|
|
MnObl_61
|
|
|
Минская
|
ПИН
|
|
RES_634
|
|
Дзержинск
|
Минская
|
ПИН
|
|
98BY10443
|
|
Могилев
|
Могилевская
|
ПИН
|
|
MnObl_27
|
CRF06_cpx
|
Логойск
|
Минская
|
ПИН
|
|
MnObl_28
|
|
Логойск
|
Минская
|
ПИН
|
|
Mn_21
|
URF_AB
|
Минск
|
Минская
|
Вертикальный
|
Циркулирующая
рекомбинантная форма CRF02_AG
Первый случай инфицирования рекомбинантной формой CRF02_AG был выявлен в
2003 г. в Могилевской области у ребенка, рожденного ВИЧ-инфицированной матерью.
Материал от матери и отца ребенка в лабораторию диагностики ВИЧи сопутствующих
инфекций не поступал, поэтому можно предположить, что как минимум еще два
случая ВИЧ-инфекции CRF02_AGв настоящее время остаются не
зарегистрированными - у матери и отца ребенка. В 2014 г. в г. Минске были
выявлены еще 2 случая ВИЧ-инфекции, связанные с рекомбинантной формой CRF02_AG, - у матери 1986 г.р. и ее ребенка 2012 г.р. Последний, на
начало 2016 г., случай инфицирования CRF02_AGвыявлен также в г. Минске у мужчины
1966 г.р.
Молекулярно-генетическая характеристикаCRF02_AG
Структуры геномов рекомбинантных форм CRF03_AB,
выявленных на территории Беларуси, показаны на рисунке 4.1. В качестве
эталонного образца использован референснойштамм IbNG (Genbank:
L39106).
Как видно из рисунка 4.1, структуры геномов исследуемых образцов
совпадают с референсной CRF02_AG. Все образцы содержат фрагменты
субтипа G в начале гена polдлинойпорядка 1000 п.н., за которым
следует фрагмент субтипаA.
Стоит отметить, что из-за короткой длины нуклеотидов в начале анализируемого
участка перед фрагментом субтипа GпрограммаjpHMM не всегда смогла установить, к
какому субтипу принадлежат первые 40-60 нуклеотидов(таблица 4.2).
Таблица 4.2. - Координаты фрагментов субтипов исследуемых образцов CRF02_AG, полученных с помощью программы jpHMM. Координаты указаны относительно HXB2
|
Образец
|
Координа-та
начала фрагмента
|
Неопреде-ленный
участок
|
Интервал
рекомби-нации
|
Координа-та
конца фрагмента
|
Субтип
|
|
FN995208
|
2160
|
-
|
2206-2247
|
2208
|
A1
|
|
2209
|
-
|
3126-3235
|
3197
|
G
|
|
3198
|
-
|
-
|
3582
|
A1
|
|
Mn_60
|
2160
|
2160-2229
|
-
|
2229
|
A2
|
|
2230
|
2230-2254
|
3199-3269
|
3233
|
G
|
|
3234
|
-
|
-
|
3582
|
A1
|
|
Mn_59
|
2160
|
2160-2212
|
-
|
2212
|
K
|
|
2213
|
2213-2221
|
3127-3268
|
3194
|
G
|
|
3195
|
-
|
-
|
3582
|
A1
|
|
RES_649
|
2160
|
2160-2208
|
-
|
2208
|
A1
|
|
2209
|
2209-2221
|
3208-3284
|
3209
|
G
|
|
3210
|
-
|
-
|
3582
|
A1
|
Для сравнительного анализа между собой и консенсусным сиквенсом CRF02_AGIbNGчетыресиквенса были объединены в один алаймент
относительно IbNG и выравнены по длине.Длина алаймента
составила 1422 нуклеотида, из которых 1212(85,2%)былиидентичнымиреференсу
сайта.Попарная идентичность (pairwise identity) между
сиквенсами составила 93,1%.геном вирус иммунодефицит
кровь
Для установления происхождения рекомбинантной формы CRF02_AG методом
филогенетического анализа был осуществлен поиск 10 генетически близких
сиквенсов с применением программы BLAST для каждого из исследуемых образцов,
при этом их сиквенсы были укорочены до 1011 п.н. После удаления повторяющихся
референсов создали алаймент, содержащий 39 референсных последовательностей и
четыре исследуемых образца. Длина алаймента составила 1011 п.н.
Как видно из данных, представленных на рисунке 4.3, на филогенетическом
дереве исследуемые образцы образовали 3 независимых достоверных кластера, что
говорит о трех разных событиях заноса данной рекомбинантной формы на территорию
Беларуси.Образец RES_649
сформировал кластер с референсами из Нигерии, Буркина-Фасо, Сенегала и
Великобритании (рисунок 4.3, кластер 1). Топология таксонов внутри данного
кластера указывает на то, что сиквенсы RES_649 и 66051 из Великобритании произошли от референса ORAV232 из Буркина-Фасо, однако значение SH-aLRTэтой группы сиквенсов составляет всего 0,789, поэтому
с уверенностью данное предположение утверждать нельзя. Если обратиться к
географии данных стран, то можно обнаружить, что Нигерия, Буркина-Фасо и
Сенегал географически расположены рядом, на северо-западе африканского
континента, а принимая во внимание, что значение SH-aLRTкластера 1
составляет 0,946, можно утверждать, что образец RES_649 был занесен на территорию Беларуси с
северо-запада африканского континента.
Что касается референса из Великобритании, то эпидемические данные в Genbankпо данному сиквенсу отсутствуют и,
вероятнее всего, сиквенс был получен из образца крови, взятого у мигранта с
африканского континента.
Образец FN995208 на филогенетическом дереве
сформировалидостоверный кластер с референсами из Камеруна(рисунок 4.3, кластер
2), значение SH-aLRTсоставило0,966. В данный кластер также входит один
референс из Демократической Республики Конго. По результатам филогенетического
анализа можно достоверно утверждать, что FN995208 имеет «африканского» предка из Камеруна и не связан с
рекомбинантными формами A/G, получившими распространение на территории
стран бывшего СССР.
Образцы Mn_59 и Mn_60 находятся в кластере, сформированномреференсными
сиквенсами ВИЧ-1 из Узбекистана(рисунок 4.3, кластер 3), которые, в свою
очередь, были изолированы и секвенированы от ВИЧ-инфицированных пациентов,
вовлеченных во вспышку в этой стране, связанной с Западно-Африканской
рекомбинантной формой CRF02_AG [197]. Кластрирование образцов Mn_59 и Mn_60 с данными референсами достоверно указывает на то, что
данный вирус был занесен в Беларусь с территории Узбекистана. Кроме
этого,изоляты Mn_59 и Mn_60 образуют кластер между собой со значением SH-aLRT -
0,998, патристическая дистанция между этими образцами составляет всего 0,005,
что свидетельствует об их крайне высокой генетической гомогенности и
происхождении из одного источника. Результаты филогенетического анализа
подтверждают и эпидемиологические данные, что ребенок,Mn_59, был рожден своей ВИЧ-инфицированной матерью, Mn_60.
Циркулирующая
рекомбинантная форма CRF03_AB
Впервые CRF03_AB на территории Беларуси была идентифицирована в 2000 г.
Данный образец получили от ВИЧ-инфицированного пациента из г. Могилева, который
заразился парентеральным путем в г. Калининграде, Россия. Первоначально данный
образец был идентифицирован как ВИЧ-1 субтипа B, однако дальнейшие исследования
А. Е. Машарского совместно с В. Ф. Ереминым достоверно показали, что образец
98BY10443 представляет собой рекомбинантную форму ВИЧ-1 CRF03_AB [182].Другой
случай, связанный с рекомбинантной формой CRF03_AB, был выявлен в 2008 г. в г.
Жодино Минской области у пациента 33 лет. Данный случай также был связан с
внутривенным употреблением наркотиков. В 2010 г. выявлено сразу 4 случая
инфицирования CRF03_AB, и все были обусловлены половым путем передачи вируса. Два
из этих случаев были выявлены в г. Лиде Гродненской области - у мужчины 29 лет
и женщины 27 лет, один случай выявили в г. Любани Минской области у женщины 29
лет и еще один- в г. Бобруйске Могилевской области, так же у женщины в возрасте
31 года. В 2013 г.CRF03 была
выявлена у 41-летней женщины из г. Осиповичи Могилевской обл., и последний
случай инфицирования CRF03_ABвыявлен в августе 2015 г. у
38-летнего мужчины из г. Дзержинска Минской области.
Молекулярно-генетическая характеристика CRF03_AB
Структура геномов рекомбинантных форм CRF03_AB,
выявленных на территории Беларуси, показана на рисунке 4.4. Координаты точек
рекомбинации получены с помощью программы jpHMM, в качестве референсногообразца использован штамм Kal153 (Genbank: AF193276).
Как видно из рисунка 4.4, все выявленные на территории Беларуси CRF03_AB
имели структуру, идентичную референсному штаммуKal153, полученному от пациента, проживавшего в г.
Калининграде, Россия. Координаты точек рекомбинации у всех образцов находились
в диапазоне координат 2667-2773, у референсного штаммаKal153 - в точке с координатой 2688, относительно HXB2. Не было выявлено вставок
фрагментов геномов других субтипов ВИЧ-1.Координаты фрагментов субтипов
исследуемых образцов CRF03_AB, полученных с помощью программы jpHMM приведены в таблице 4.3.
Таблица 4.3 - Координаты фрагментов субтипов исследуемых образцов CRF03_AB, полученных с помощью программы jpHMM. Координаты указаны относительно HXB2
|
Образец
|
Координата
начала фрагмента
|
Интервал
рекомбинации
|
Координата
конца фрагмента
|
Субтип
|
|
98BY10443
|
2160
|
2670-2733
|
2687
|
A1
|
|
2688
|
-
|
3583
|
B
|
|
RES_634
|
2160
|
2670-2733
|
2687
|
A1
|
|
2688
|
-
|
3521
|
B
|
|
MnObl_15
|
2160
|
2670-2733
|
2687
|
A1
|
|
2688
|
-
|
3521
|
B
|
|
Gr_8
|
2160
|
2667-2732
|
2668
|
A1
|
|
2669
|
-
|
3521
|
B
|
|
Gr_3
|
2160
|
2667-2732
|
2668
|
A1
|
|
2669
|
-
|
3521
|
B
|
|
Mg_8
|
2160
|
2670-2733
|
2687
|
A1
|
|
2688
|
-
|
3521
|
B
|
|
Mg_15
|
2160
|
2671-2778
|
2744
|
A1
|
|
2745
|
-
|
3521
|
B
|
|
MnObl_61
|
2160
|
2667-2752
|
2702
|
A1
|
|
2703
|
-
|
3521
|
B
|
Для сравнительного анализа между собой и консенсусным сиквенсом CRF03_ABKal153все сиквенсы были объединены в один алаймент
относительно Kal153и выравнены по длине. Длина
алаймента составила 1437 нуклеотидов, из которых 1258 (87,5%) являлись
идентичными сайту референса. Попарная идентичность (pairwise identity) между сиквенсами
составила 96,4% (рисунок 4.5).
Определение направлений заноса и распространения CRF03_AB на территории Беларуси
Для определения направления заносов и распространения вируса на
территории Беларуси путем поиска наиболее оптимального числа референсов для
филогенетического анализа по результатам поиска методом BLAST были получены 25
референсных последовательностей ВИЧ-1 по участку гена pol. Длина алаймента вместе с
исследуемыми образцами составила 1029 п.н., в референс-изоляте DQ328559 из
Азербайджана 17 недостающих нуклеотидов 3’-конца были заменены на «N» с целью
сохранения генетической информации в алайменте. Результаты филогенетического
анализа рекомбинантной формы CRF03_AB представлены на рисунке 4.6.
На филогенетическом дереве не было выявлено ни одного достоверного
кластера, сформированного как исследуемыми образцами, так и референсными
последовательностями ВИЧ, со значением SH-aLRT³0,9. Два кластера со значением SH-aLRT 0,996 и 1 были сформированы
исследуемыми образцами из Беларуси - Gr_3/Gr_8 и MnObl_15/Mg_8 соответственно.
Это достоверно указывает на одного общего предка для каждой пары в кластере и
на внутреннее распространении CRF03_AB на территории Беларуси. Отсутствие
связей остальных исследуемых образцов между собой говорит об их независимом
проникновении на территорию страны. Таким образом, рекомбинантная форма
CRF03_AB была занесена в результате пяти независимых событий, два из которых
привели к передаче вируса уже на территории Беларуси.
Достоверно установить пути заноса циркулирующей рекомбинантной формы CRF03_ABна территорию Беларуси не удалось. Вероятно, это связано с
лимитом референс-сиквенсов CRF03_ABв Genbankи HIVSequenceDatabase по участку гена pol. Проведенный анализ сиквенсов в HIVsequencedatabase показал, что общее количество
референсных сиквенсов CRF03_AB составило 366, однако большинство данных
сиквенсов относилось к фрагментам генов ВИЧ-1 gag (100) и env(172)(рисунок 4.7).
По гену gagпрактическивсе
найденные референсы, обозначенные в базах данных как CRF02_AG,
оказались из Литвы (75) и Беларуси (21), обладающие крайне низкой генетической
разнородностью. Стоит также отметить, что в базах данных субтипы сиквенсов не
всегда установлены верно. Так, при поиске референсных сиквенсов для
филогенетического анализа исследуемых CRF03_ABбыли найдены сиквенсы, которые
обозначили как субтип B.
Однако в ходе определения структурыгеномов данных референсных сиквенсов
установлено, что они являются CRF03_AB.
По фрагменту gp120 гена envдлина референсов максимально
достигала 378 п.н., а алаймент из всех референсов для данного сегмента генома
составил всего 225 п.н., что не достаточно для установления достоверных
филогенетических связей между вирусами.
Стоит обратить внимание на патристические дистанции между образцами
Gr_3/Gr_8 и MnObl_15/Mg_8. Так, дистанция между Gr_3 и Gr_8 составила 0,002, в
то время как между MnObl_15 и Mg_8 - 0,034, кроме того, между MnObl_15 и Mg_8
не обнаружено никаких эпидемиологических связей. Все это дает основание
утверждать, что в Беларуси циркулирует еще как минимум один вариант CRF03_AB,
генетически близкий к сиквенсам и, вероятно, имеющий эпидемические связи с
образцами MnObl_15 и Mg_8.
Как было отмечено в данном разделе, субтип ВИЧ-1 уреференсных сиквенсов
установлен не всегда верно. Все найденные референсные сиквенсы в данном
исследовании являются CRF03_AB.Однако, как видно на
филогенетическом дереве(рисунок 4.6),в базы данных многие из них загружены как
ВИЧ-1субтипаB.
Циркулирующая
рекомбинантная форма CRF06_cpx
Два случая инфицирования рекомбинантной формойCRF06_cpxвыявлены
в 2008 г. у близких родственников, брата и сестры - 28 и 30 лет соответственно,
проживавших в г. Логойске Минской области.Оба пациента, MnObl_27 и MnObl_28, были инфицированы парентеральным путем.
Молекулярно-генетическаяхарактеристикаCRF06_cpx
Для сравнения структуры геномов выявленных CRF06_cpx был взят референсный
штамм BFP90 (Genbank: AF064699). Координаты рекомбинаций образцов MnObl_26,
MnObl_27 и BFP90 получены с помощью программы jpHMM. Дополнительно структура
генома BFP90, установленная в 2002 г., была взята из HIV sequence database
(BFP90*). Структуры геномов данных сиквенсов показаны на рисунке 4.8. Программа
jpHMMпоказала, что в структуре генома
образца MnObl_26 содержатся фрагменты геномов
ВИЧ-1 субтипов G, Bи C. Образец MnObl_27
содержит фрагменты геномов ВИЧ-1 субтипов Gи C, как и у
референсного сиквенса BFP90,
и не содержит фрагментов субтипа B.
Стоит отметить, что часть геномов у всех образцов является неопределяемой (N/A), то естьв данном участке генома программа не смогла
установить родительский субтип ВИЧ.
Дополнительно был проведен сравнительный анализ нуклеотидных и их
транслированных аминокислотных последовательностей образцов MnObl_26 и MnObl_27 cреференсными
сиквенсами, полученными с помощью программы BLASTдля филогенетического анализа. Замечено, что
генетической особенностью выявленных рекомбинантных форм CRF06_cpx, а также
CRF06_cpx, получивших распространение в Эстонии, является инсерция аминокислот
серина или аспарагина в положении 38 гена polВИЧ-1 по сравнению с
другими референсными сиквенсами CRF06_cpx(рисунок 4.9).
Определение направлений заноса и распространения CRF06_cpxна территории Беларуси
Для проведения филогенетического анализа выявленных на территории
Беларуси двух CRF06_cpx с помощью программы BLASTосуществлен поиск 20 генетически близких референсных
сиквенсов для каждого из исследуемых образцов. После удаления повторяющихся все
сиквенсы были объединены в алаймент, содержащий 19референс-сиквенсов и 2
выявленных CRF06_cpx. Длина алаймента составила 1417 п.н. Результат
филогенетического анализа показан на рисунке 4.10.
Как видно изрисунка 4.10, исследуемые образцы MnObl_27 и MnObl_28
сформировали кластерс референсными сиквенсами из Эстонии, значение SH-aLRTкластера составило 1. Кроме этого, оба исследуемых
образца сформировали субкластер между собой, значение SHкоторого 0,904, что свидетельствует об одном источнике их
происхождения. Таким образом, по результатам филогенетического анализа, занос CRF06_cpxна территорию Беларуси следует считать единичным
событием. Дальнейшей передачи вируса внутри страны в ходе
молекулярно-эпидемиологического скринига выявлено не было.
Мутации
резистентности и чувствительность к АРП
выявленных рекомбинантных форм ВИЧ-1
Путем анализа нуклеотидных последовательностей участка гена pol исследуемые образцы были
проанализированы на наличие мутаций резистентности и чувствительности к трем
группам АРП: ИП, НИОТ и ННИОТ.
Мутации резистентности к АРП
Среди 15 рекомбинантных форм ВИЧ-1 мутации резистентности выявлены у 7
образцов(таблица 4.4).
Таблица 4.4. - Мутации резистентности к АРП, выявленные в рекомбинантных
формах ВИЧ-1 на территории Беларуси
|
Имя
|
Рекомбинантная
форма
|
Мутации кИП
|
МутациикНИОТ
|
Мутации кННИОТ
|
|
RES_649
|
CRF02_AG
|
M46I,
L76V L10V, K20I
|
M41L,
D67E, V75M, M184V, L210W, T215Y
|
V90I,
K103N, E138Q, K238T
|
|
98BY10443
|
CRF03_AB
|
-
|
-
|
-
|
|
FN995208
|
CRF02_AG
|
L10I, K20I*
|
M41L,
D67N, T69N, K70R, V75M, M184V, T215F, K219Q
|
K103S, G190A
|
|
Mn_59
|
CRF02_AG
|
K20I*
|
-
|
-
|
|
Mn_60
|
CRF02_AG
|
K20I*
|
-
|
-
|
|
Gr_8
|
CRF03_AB
|
-
|
-
|
-
|
|
Mg_8
|
CRF03_AB
|
-
|
-
|
-
|
|
MnObl_15
|
CRF03_AB
|
-
|
-
|
-
|
|
RES_634
|
CRF03_AB
|
-
|
M184V
|
-
|
|
Gr_3
|
CRF03_AB
|
-
|
-
|
-
|
|
MnObl_61
|
CRF03_AB
|
L10LV
|
-
|
K103S, G190A
|
|
Mg_15
|
CRF03_AB
|
T74S
|
-
|
K103N, V179T,
G190A
|
|
MnObl_27
|
CRF06_cpx
|
K20I*
|
M184V
|
K103N
|
|
MnObl_28
|
CRF06_cpx
|
K20I*
|
-
|
K103N, K238T
|
|
Mn_21
|
URF_AB
|
-
|
-
|
* K20I - не является мутацией резистентности у ВИЧ-1 субтипа G и рекомбинантных формах, содержащих
фрагмент ВИЧ-1 G в сегменте,
кодирующем протеазу, поскольку изолейцин (I) - консенсусная аминокислота в данном положении.
Образец RES_649содержал мутации резистентности ко
всем трем группам АРП. Мутации ИП M46I, L76V привели к высокому уровню
резистентности к фосампренавиру, к индинавиру, лопинавиру и нелфинавиру выявлен
средний уровень резистентности и низкий - к дарунавиру. Мутации M41L, D67E,
V75M, M184V, L210W, T215Y привели к высокому уровню резистентности ко всем
препаратам группы НИОТ, а мутации V90I, K103N, E138Q, K238T - к различному
уровню резистентности ко всем препаратам группы ННИОТ. Так, к препаратам
эфавиренцу и невирапину выявлен высокий уровень резистентности, к рилпивирину -
низкий уровень, к этравирину - потенциальный низкий уровень резистентности.
В геноме изолята FN995208 не было
выявлено мутаций резистентности высокого уровня к ИП. Мутации M184V, K103S и G190A, определенные в участке гена pol, кодирующем фермент обратную
транскриптазу, ведут к высокому уровню резистентности ко всем ингибиторам
обратной транскриптазы, за исключением двух ННИОТ: этравирина и рилпивирина, к
которым наблюдается низкий уровень устойчивости вируса. Таким образом, для
данного пациента была необходима корректировка схемы лечения с включением
других групп препаратов, таких как ингибиторы интегразы и/или ингибиторы
слияния ВИЧ.
Изолят MnObl_27 оказался чувствителен ко всем препаратам из класса
ИП, а также к зидовудину, ставудину и тенофовиру (НИОТ) и этравирину и
рилпивирину (ННИОТ), но имел мутацию высокого уровня в положении M184V,ведущую
к устойчивости к ламивудину и эмтрицитабину (НИОТ) и мутацию в положении K103N, ведущую к устойчивости к невирапину, делавирдину и
эфавиренцу (ННИОТ).
MnObl_28 содержал 2 мутации, обе из которых привели к высокому уровню резистентности
к препаратам ННИОТ эфавиренцу, делавирдину и невирапину.
Изолят RES_634 содержал только мутацию в положении M184V, которая приводит к высокому уровню резистентности к
ламивудину и эмтрицитабину.
Высокий уровень резистентности к эфавиренцу/невирапину и низкий - к
этравирину/рилпивирину группы ННИОТ, связанный с мутациями в положенииK103S и
G190A,выявлен у изолята MnObl_61. К препаратам групп ИП и НИОТ данный
изолят чувствителен.
В геноме изолята Mg_15
наблюдается такой же уровень резистентности к ННИОТ, связанный с мутациями
K103N и G190A, как и у изолята MnObl_61, кроме этого, наличие мутации T74S в
участке, кодирующем протеазу, приводит к низкому уровню резистентности к
нелфинавиру.
Таким образом, в исследуемых образцах, за исключением RES_649, не наблюдается
высокого уровня резистентности к препаратам ИП. Среди мутаций резистентности к
НИОТ у всех резистентных форм выявляется мутация M184I, которая встречается у
64,4% пациентов с резистентностью к НИОТ в Беларуси. У двух пациентовRES_649 и
FN995208 (CRF02_AG) диагностирована резистентность ко всем препаратам группы
ингибиторов обратной транскриптазы ВИЧ. У всех пациентов, резистентных к ННИОТ
и инфицированных ЦРФ ВИЧ, встречается мутация K103N/S, которая выявляетя в 45%
случаев всех резистентных к ННИОТ пациентов в Беларуси.
Чувствительностьк АРП
Чувствительность исследуемых рекомбинантных форм к АРПгрупп ИП, НИОТ и
ННИОТ указана в таблице 4.5.
Уровень чувствительности/резистентности к АРП определялся путем сравнения
аминокислотных последовательностей исследуемого образца и дикого штамма ВИЧс
известным уровнем чувствительности к АРП. Различают пять степеней
резистентности к АРП.
Чувствителен - нет признаков снижения чувствительности к ВААРТ по
сравнению с диким типом вируса.
Потенциальный низкий уровень резистентности - вирус, вероятно, полностью
чувствителен к АРП, однако геном содержит мутации, которые могут указывать на
предыдущие воздействия АРП.
Низкий уровень резистентности - вирус содержит мутации, которые
могут приводить к снижению чувствительности вируса к АРП в условиях invitroи/или у пациентов при наличии таких
мутаций может быть не оптимальный вирусологический ответ на лечение ВААРТ.
Средний уровень резистентности - чувствительность вируса к АРП
ниже, чем при низком уровне резистентности, однако выше, чем при высоком уровне
резистентности. АРП, к которым вирус имеет средний уровень резистентности,
следует применять только в том случае, если АРП имеют высокий генетический
барьер к резистентности (напр., некоторые ингибиторы в комбинации с ритонавиром)
или при лимите других АРП.
Высокий уровень резистентности - мутации, выявляемые в сиквенсе
вируса аналогичны тем, которые наблюдаются у вирусов с наиболее высоким уровнем
лекарственной устойчивости invitro. Клинические данные показывают, что у пациентов, инфицированных
вирусами, имеющими такие мутации, как правило, низкий уровень ответа или вообще
нет вирусологического ответа на лечение АРП.
Таблица 4.5. - Уровень чувствительности выявленных рекомбинантных форм
ВИЧ-1 к АРП
|
URFMos
|
98BY10443
|
RES
634
|
Mn
Obl 15
|
Gr 8
|
Gr 3
|
Mg 8
|
Mg
15
|
Mn
Obl 61
|
FN995208
|
Mn
60
|
Mn
59
|
RES
649
|
Mn
Obl 27
|
Mn
Obl 28
|
|
ИП
|
|
atazanavir/r
(ATV/r)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
|
darunavir/r
(DRV/r)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
LLR
|
S
|
S
|
|
fosamprenavir/r
(FPV/r)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
HLR
|
S
|
S
|
|
indinavir/r
(IDV/r)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
IR
|
S
|
S
|
|
lopinavir/r
(LPV/r)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
IR
|
S
|
S
|
|
nelfinavir
(NFV)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
LLR
|
LLR
|
PLLR*
|
PLLR*
|
PLLR*
|
IR
|
PLLR*
|
PLLR*
|
|
saquinavir/r
(SQV/r)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
|
tipranavir/r
(TPV/r)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
|
НИОТ
|
|
lamivudine
(3TC)
|
S
|
S
|
HLR
|
S
|
S
|
S
|
S
|
S
|
S
|
HLR
|
S
|
S
|
HLR
|
HLR
|
S
|
|
abacavir
(ABC)
|
S
|
S
|
LLR
|
S
|
S
|
S
|
S
|
S
|
S
|
HLR
|
S
|
S
|
HLR
|
LLR
|
S
|
|
zidovudine
(AZT)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
HLR
|
S
|
S
|
HLR
|
S
|
S
|
|
stavudine
(D4T)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
HLR
|
S
|
S
|
HLR
|
S
|
S
|
|
didanosine
(DDI)
|
S
|
S
|
PLLR
|
S
|
S
|
S
|
S
|
S
|
S
|
HLR
|
S
|
S
|
HLR
|
PLLR
|
S
|
|
emtricitabine
(FTC)
|
S
|
S
|
HLR
|
S
|
S
|
S
|
S
|
S
|
S
|
HLR
|
S
|
S
|
HLR
|
HLR
|
S
|
|
tenofovir
(TDF)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
HLR
|
S
|
S
|
HLR
|
S
|
S
|
|
ННИОТ
|
|
efavirenz
(EFV)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
HLR
|
HLR
|
HLR
|
S
|
S
|
HLR
|
HLR
|
HLR
|
|
etravirine
(ETR)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
LLR
|
LLR
|
LLR
|
S
|
S
|
PLLR
|
S
|
S
|
|
nevirapine
(NVP)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
HLR
|
HLR
|
HLR
|
S
|
S
|
HLR
|
HLR
|
HLR
|
|
rilpivirine
(RPV)
|
S
|
S
|
S
|
S
|
S
|
S
|
S
|
LLR
|
LLR
|
LLR
|
S
|
S
|
LLR
|
S
|
S
|
Обозначения:Susceptible Чувствителен Potential low-level resistance
Потенциальный низкий уровень резистентности Low-level resistance Низкий
уровень резистентности Intermediate resistance Средний уровень
резистентности High-level resistance Высокий уровень резистентности
* В данном случае нет снижения уровня резистентности, поскольку снижение
чувствительности в этом случае обусловлено заменой аминокислот Kна Iв положении 20 (мутация K20I), однако в
геноме ВИЧ-1 субтипа G и
рекомбинантных формах, содержащих фрагмент генома ВИЧ-1 субтипа Gв сегменте, кодирующем
протеазу,изолейцин (I) является
консенсусной аминокислотой в данном положении.
Таким образом, на основании проведенных в данной главе исследований можно
сделать следующие выводы:
у пациентов с ВИЧ/СПИД, проживающих на территории Республики Беларусь,
среди рекомбинантных форм ВИЧ-1 наиболее часто (53,3%) встречается CRF03_AB;
методом филогенетического анализа установлено шесть независимых событий
заносаCRF03_AB на территорию Беларуси, два из которых привели к дальнейшему
распространению данной рекомбинантной формыВИЧ-1 уже на территории страны.
Первых два случая ВИЧ-инфекции CRF03_AB были связаны с потреблением
инъекционных наркотиков на начальном этапе эпидемии ВИЧ-1 в 1996-1997 гг.
(образцы 98BY10443 и MnObl_61). Последующие случаи инфицирования CRF03_AB обусловлены гетеросексуальным путем передачи;
отсутствие достоверных кластеров с тремя и более таксонами при
филогенетическом анализе CRF03_AB свидетельствует о не связанных между
собой событий заноса вируса на территорию страны, не приведших к локальным
вспышкам ВИЧ-инфекции. Два выявленных случая CRF_03ABв г.
Лиде были связаны с умышленным случаем гетеросексуальной передачи вируса
ВИЧ-инфицированным партнером;
в четырех случаях (26,7%) ВИЧ-инфекции, вызванной рекомбинантными
формами,выявлена CRF02_AG.Методом филогенетического анализа установлено три
независимых события заноса данной ЦРФ на территорию страны: в двух случаях CRF02_AGбыла занесена в Беларусь с территории Западной Африки
(образцы FN995208 и RES_649), в одном случае (Mn_59 и Mn_60,
ВИЧ-инфицированные мать и ее ребенок) CRF02_AG- с территории Узбекистана;
в двух случаях ВИЧ-инфекции рекомбинантными формами (13,3%) выявлена CRF06_cpx. Методом филогенетического анализа установлено, что CRF06_cpxбыла занесена на территорию Беларуси из Эстонии из
среды потребителей инъекционных наркотиков;
ГЛАВА 5. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА УНИКАЛЬНОЙ
РЕКОМБИНАНТНОЙ ФОРМЫ ВИЧ-1 MOS
В результате проведенных исследований по генотипированию и
филогенетическому анализуобнаружена новая уникальная рекомбинантная форма ВИЧ-1
(изолят Mos), имеющая в составе генома вставки
последовательностей субтипов А1 и В вируса, но отличающаяся от известной циркулирующей
рекомбинантной формы CRF03_AB. На описанную автором уникальную
рекомбинантную форму - изолят Mos-
получен патент № 18124, начало действия - 29.04.2011.
Молекулярно-генетическая
характеристика УРФMos по участкам генов gag, polиenv
В 2010 г. в лабораторию диагностики ВИЧи сопутствующих инфекций из дома
ребенка от девочки 6 лет, находящейся на ВААРТ, поступил образец крови для
определения мутаций резистентности ВИЧ-1 к АРП.
При определении субтипа ВИЧ-1 методом филогенетического анализа сегмента
гена pol образец кластрировался с субтипом А1, но отличался от других
анализируемых образцов консенсуса IDU-A(AFSU) и референс-последовательности (AF004885). Среднее
значение p-дистанций между референсными
сиквенсами субтипа А1 из России, Украины, консенсусом IDU-Aи
изолятом Mosсоставило 0,068, в то время как между референсными сиквенсами
субтипа В - 0,094. По сегменту гена polизолят Mosбыл наиболее близок к
референсу AF413987 (субтип А1 из Украины), p-дистанция составила 0,066(рисунок 5.1, А).
Анализ участка p17/p24гена gag показал, что средниеp-дистанции
по данному участку с референсами субтипа А1 составили 0,129, в то время как с
референсами субтипа В - 0,075(рисунок 5.1, Б).Эволюционная дистанция по
сегменту гена env между ВИЧ-1 Mos и референс-последовательностями
CRF03_AB (AF414006, Беларусь и AF193276.1, Россия, Калининград) составила
0,121, в то время как между самими референс-последовательностями - 0,013. По
этому же сегменту средние p-дистанции между ВИЧ-1 Mos и
референс-последовательностями ВИЧ-1 субтипов А1 и В составили 0,155 и 0,323
соответственно(рисунок 5.1, В).
Таким образом, изолят Mosбыл отнесен к уникальной рекомбинантной форме
ВИЧ-1 со структурой BgagApolAenv. Сиквенсы сегментов генов gag, pol
и env данной рекомбинантной формы были загружены в EMBL/Genbank/DDBJ под
номерами FR775442.1, FN995656.1 и FR775443.1 соответственно.
Структура
полноразмерного геномаУРФMos
Для установления точной структуры уникальной рекомбинантной формы ВИЧ-1
Mos и выявления точек разрыва генома была получена последовательность
нуклеотидов полноразмерного генома данного изолята. Амплифицированныйфрагмент,
равный 8968 п.н., охватывает последовательности, кодирующие все белки ВИЧ-1 и
частично LTR. Координаты относительно референс-типа ВИЧ-1 HXB2 соответствовали
последовательностям 556-9517.
С использованием программы jpHMMустановлены структура генома и координаты
рекомбинационных событий изолята Mos.Геном уникальной рекомбинантной формы
ВИЧ-1 Mos представляет собой ВИЧ-1 субтипа А1 со встроенными в четырех местах
сегментами генома ВИЧ-1 субтипа В, встраивание фрагментов ВИЧ-1 субтипаВ
произошло в структурных генах gag и pol(рисунок 5.2).
Доминирующим в структуре генома Mosявляется ВИЧ-1 субтипа А1, занимающий порядка 80% генома - 7214 п.н. На
долю ВИЧ-1 субтипа В приходится около 20% - 1965 п.н.
Сравнительный анализ генома Mosс уже известной рекомбинантной формой CRF03_ABпоказал,
что Mosне является результатом рекомбинации
с CRF03_AB, и в геноме Mosотсутствуют
фрагменты данной ЦРФ. Об этом свидетельствуют различные структуры геномов
рекомбинантных форм и не совпадение ни одной из точек разрыва генома,
показанные на рисунке 5.3.Так, у рекомбинантной формы CRF03_AB первая точка
рекомбинациинаходится в координате 2688 относительно HXB2, в то время как у УРФMosв данном участке генома находится
сегмент субтипа А1, координаты которого 2449±7 ⟷ 2990±41, что исключает совпадение
рекомбинационных точек в этом участке генома. Вторая координата рекомбинации у CRF03_AB - переход генома ВИЧ-1 субтипа Bв субтип А1 - находится в точке с координатой 8650. В геноме
УРФ Mosсегмент субтипа A1на 3’-конце начинается в координатах
4819±70. Таким образом, геном УРФ Mos является результатом рекомбинации геномов ВИЧ-1 «чистых» субтипов A1и B и не содержит фрагмента генома CRF03_AB.
Происхождение
УРФ Mos
С целью определения происхождения уникальной рекомбинантной формы, ее
геном был разделен на 9 сегментов, относящихся к различным субтипам ВИЧ-1
(рисунок 5.4), согласно координатам точек разрыва генома(таблица 5.1).
Таблица 5.1. - Координаты сегментов изолята Mos, их размер и соответствующий субтип ВИЧ-1. Координаты
указаны относительно референсного сиквенса HXB2
|
Сегмент
|
Координата
|
Длина сегмента,
п.н.
|
Субтип ВИЧ-1
|
|
A_1
|
556-994
|
438
|
A1
|
|
B_2
|
995-1813
|
818
|
B
|
|
A_3
|
1814-2174
|
360
|
A1
|
|
B_4
|
2175-2443
|
268
|
B
|
|
A_5
|
2444-2975
|
531
|
A1
|
|
B_6
|
2976-3185
|
209
|
B
|
|
A_7
|
3186-4205
|
1019
|
A1
|
|
B_8
|
4206-4806
|
600
|
B
|
|
A_9
|
6225-8795
|
2570
|
A1
|
Первым этапом наших исследований являлось определение участков генома
Mos, наиболее подходящих для поиска референсов и проведения филогенетического анализа.
С этой целью был применен поиск с помощью программы BLAST для выявления
географического распределения генетически близких изолятов. Как показали
результаты поиска, все найденные референсы ВИЧ-1 с совпадением нуклеотидов не
менее 98% относились к странам бывшего СССР. Следующим шагом стало определение
участков, наиболее подходящих для филогенетического анализа. Критерием отбора
являлось наличие наибольшего количества референсов для конкретного исследуемого
сегмента. С этой целью были загружены все имеющиеся в базе данных Genbank
референс-последовательности ВИЧ-1 субтипов А1 (4476 сиквенсов) и В (479
сиквенсов), с которыми построено два алаймента относительно УРФ Mos.
Визуализация алаймента помогла определить, какие сегменты изолята Mosнаиболее
целесообразно использовать для филогенетического анализа(рисунок 5.5).
Изрисунка 5.5 видно, что наибольшее количество референсов ВИЧ-1 обоих
субтипов, А1и B, имеется для фрагмента гена pol, кодирующего протеазу и часть
обратной транскриптазы ВИЧ. Это соответствует сегментам А5, небольшой части
сегмента А9,B4 и B6 генома Mos.
Ввиду того, что для анализа сегментов субтипа Вреференсов оказалось почти в 10
раз меньше, чем для субтипа А1 (286 и 2530 соответственно), для анализа был
взятсегментB8 субтипа B - от начала участка, кодирующего интегразу ВИЧ-1 (таблица
5.2). Сегмент B6 был исключен из анализа, поскольку
референсы для филогенетического анализа, найденные с помощью BLAST, оказались идентичными, как для
сегмента B4.
Таблица 5.2. - Сегменты изолята Mos, их длина, координаты
относительнореференс-типа ВИЧ-1 HXB2 и субтип ВИЧ, к которому сегмент
относится, взятые для филогенетического анализа
|
Сегмент
|
Длина, п.н.
|
Координата
|
Субтип ВИЧ
|
|
А5
|
548
|
2445 →
2992
|
A1
|
|
А9
|
575
|
6856 →
7438
|
A1
|
|
В2
|
844
|
995 →
1838
|
B
|
|
В4
|
301
|
2156 →
2456
|
B
|
|
В8
|
545
|
4230 →
4774
|
B
|
Для построения филогенетических деревьев с исследуемыми сегментами с
помощью BLASTбыл произведен повторный поиск
20наиболее генетически близких референс-последовательностей ВИЧ-1 для сегментов
А5, А9, В2, В4 и В8. Готовые алайменты с субтип-референсами ВИЧ-1, включая
рекомбинантные формы, получены из базы данных LosAlamosHIVSequenceDatabase. Все сиквенсы были выравнены и
отредактированы вручную. Референс-сиквенсы группы Pудалены из алайментов.Референс-субтипы ВИЧ, а также некоторые
кластеры сгруппированы для более наглядного изображения филогенетического
дерева.
Филогенетический анализ сегментов генома субтипа A1
Алаймент сиквенсов ВИЧ-1 для филогенетического анализа сегмента А1
изолята Mosсодержал 171 сиквенс, длина которого составила
548 п.н. На основании алаймента было построено ML-филогенетическое дерево, показанное на рисунке 5.6.
Как видно из данных, представленных на филогенетическом дереве на рисунке
5.7,референсные сиквенсы, полученные встранах бывшего СССР, сформировали
кластер, значение SH-aLRT которого составило 0,986. Исследуемый фрагмент Mos_A5
располагался внутри данного кластера, однако не формировал субкластер ни с
одним из референсов.
Все референсные сиквенсы, найденные с помощью программы BLAST, сформировали большой кластер с
высоким уровнем генетической гомогенности, значение SH-aLRTкластера
составило 0,996. Исследуемый фрагмент изолята Mosнаходился внутри данного кластера, однако субкластер
одним из референсных сиквенсов выявлен не был. Высокое значение SH-aLRT кластера с референсными сиквенсами, в основном из
стран бывшего СССР, свидетельствует о том, что данные сиквенсы являются
вариантами ВИЧ-1 AFSU, к которому относится и исследуемый сегмент генома
изолята Mos.
Таким образом, по результатам филогенетического анализа двухсегментов
генома, относящихся к субтипу А1 ВИЧ-1, не было найдено генетически близких
референсных сиквенсов ВИЧ, с которыми изолят Mosсформировал кластер со значением SH-aLRT ≥0,85. На основании результатов анализа невозможно
сказать, принадлежат ли фрагменты генома, относящиеся к субтипу А1, к штаммам,
циркулирующим на территории Республики Беларусь. Достоверно можно утверждать,
что сегменты субтипа А1 в геноме УРФ Mosпринадлежат варианту ВИЧ-1 AFSU,
распространенному на территории стран бывшего СССР.
Филогенетический анализ сегментов генома субтипа B
По результатам филогенетического анализа сегмента B2 генома Mosустановлена достоверная генетическая
близость с референсными сиквенсами из Грузии (98GEMZ003), России (11RU21n)и США (E6574TOB8U), которые
сформировали кластер со значением SH-aLRT - 0,999(рисунок 5.8).
Анализ сегмента B4
выявил генетическую близость с референсными сиквенсами из Грузии, России,
Беларуси и группы референсов из Таиланда (сгруппированы на филогенетическом
дереве) и формировал с ними кластер (выделен синим), значение SH-aLRT которого составило 0,942(рисунок 5.9).
В ходе филогенетического анализа установлено, что сегментB8изолята Mosсформировал кластер с
референсными сиквенсами, представляющими рекомбинантную формуCRF03_ABиз Калининграда (KAL153_2), России (RU9800), Беларуси (98BY10443), а также с сиквенсами
«чистого» субтипа B из США (E6574TOB8U) и
Грузии (98GEMZ003)(рисунок 5.10). Значение SH-aLRTкластера с образцом Mosсоставило 0,979.
По результатам филогенетического анализа сегментов субтипа B изолята Mosнайдены генетически
близкие сиквенсы изГрузии98GEMZ003 и России11RU21n.С референсом из
США E6574TOB8U исследуемые сегменты кластрировались при анализе сегментов B2 и B8, а при анализе сегмента B4 выявлены также генетически близкие референсы из Беларуси и
Таиланда.
Какие-либо эпидемиологические данные по референсам из США (E6574TOB8U, Genbank: GQ371853, GU728194)
и России (11RU21n, Genbank: JX500708)
в базе данных Genbankотсутствуют. Про референс 98GEMZ003 в
Genbank (DQ207943) указано, что данный пациент, вероятно, инфицирован на
Украине на раннем этапе эпидемии ВИЧ-1 в бывшем СССР (год сбора образца -
1998).
Стоит обратить внимание на размеры генетически близких референсных
сиквенсов ВИЧ, найденных методом филогенетического анализа. Так, сиквенсы
98GEMZ003, E6574TOB8U и 11RU21n представляют собой полноразмерные геномы ВИЧ-1
субтипа B, сиквенсы KAL153_2 и 98BY10443 являются полноразмерными сиквенсами
ЦРФ CRF03_AB, а сиквенс Mn_9 и группа сиквенсов из Таиланда содержат только
последовательно относящиеся лишь к фрагменту гена pol, кодирующего
протеазу и часть обратной транскриптазы ВИЧ.С референсными сиквенсами98GEMZ003
и 11RU21n участки генома Mosобразуют
кластеры при филогенетическом анализе всех трех исследуемых фрагментов субтипа B, в то время как с референсом E6574TOB8U
кластеры были образованы только по сегментам B2 и B8,
кодирующимp17/p24 гена gagи
интегразу гена pol
соответственно. При этом не было обнаружено генетической близости с E6574TOB8U в
участке гена pol,
кодирующего протеазу ВИЧ.
Таким образом, по результатам филогенетического анализа сегментов,
относящихся к субтипу BВИЧ,
выявлено только два референсных сиквенса, имеющих генетическую близость c Mosна протяжении всего исследуемого
генома -98GEMZ003 и 11RU21n. Однако принимая во внимание, что два этих сиквенса
были получены от пациентов, проживающих в разных регионах, невозможно точно
установить географическое происхождение УРФ Mosпо субтипу В. Можно лишь достоверно утверждать, что
фрагменты субтипа Bгенома Mosпринадлежат варианту ВИЧ-1 субтипа B, получившего распространение на
территории бывшего СССР - BFSU.
По результатам филогенетического анализа сегментов генома изолята Mos, относящихся к различным субтипам
ВИЧ, достоверно можно лишь утверждать, что геном изолята состоит из субтипов
ВИЧ-1 А1 и В, вызвавших эпидемию ВИЧ-1 на территории стран бывшего СССР
(таблица 5.3). Установить,в каких географических регионах распространены эти
изоляты ВИЧ-1,не удалось.
Таблица 5.3. - Сумма результатов филогенетического анализа сегментов
генома УРФ Mos, относящихся к разным субтипам ВИЧ
|
Сегмент
|
Субтип ВИЧ
|
Генетически
близкий референс
|
Регион
|
SH-aLRT
|
|
A5
|
A1
|
AFSU
|
Страны
бывшего СССР
|
0,986
|
|
А9
|
A1
|
AFSU
|
Страны
бывшего СССР
|
0,996
|
|
В2
|
B
|
98GEMZ003 E6574TOB8U 11RU21n
|
Грузия
США Россия
|
0,999
|
|
В4
|
B
|
98GEMZ003 Mn_9 11RU21n -
|
Грузия
Беларусь Россия Таиланд
|
0,942
|
|
В8
|
B,
CRF03_AB
|
98GEMZ003
E6574TOB8U 11RU21n KAL153_2 98BY10443
|
Грузия США
Россия Россия Беларусь
|
0,979
|
Таким образом, на основании проведенных исследований в данной главе можно
сделать следующие выводы:
уникальная рекомбинантная форма ВИЧ-1 Mos является результатом
рекомбинации ВИЧ-1 субтипов А1 и В;
встраивание фрагментов генома субтипа В произошло в структурных генах
ВИЧ-1 gag и pol;
в геноме Mos не выявлено фрагментов рекомбинантной формы CRF03_AB;
на долю ВИЧ-1 субтипа А1 приходится порядка 80% генома УРФ Mos, на субтип
B - 20%;
методом филогенетического анализа определено, что геном Mos состоит из
фрагментов геномов ВИЧ, получивших распространение на территории стран бывшего
СССР. Более точную географическую локализацию на данный момент времени
установить не удалось.
ЗАКЛЮЧЕНИЕ
Основные
научные результаты диссертации
1. На протяжении 2008-2015 гг. субтип А1 оставался доминирующим в эпидемии
ВИЧ-инфекции на территории Республики Беларусь во всех группах населения:
потребителей инъекционных наркотиков; лиц, инфицированных половым путем; а
также у детей, рожденных ВИЧ-инфицированными матерями. На долю данного субтипа
пришлось 90,7% (275 из 303) проанализированных случаев ВИЧ-инфекции. При
филогенетическом анализе все образцы субтипа А1 формировали кластер с высоким
уровнем генетической однородности, значение SH-aLRT данного кластера составило
1, что свидетельствует о том, что все образцы ВИЧ-1 данного субтипа,
циркулировавшие на территории Беларуси в популяции ВИЧ-инфицированных
пациентов, являлись вариантом AFSU, вызвавшим эпидемию ВИЧ-инфекции на
территории других стран бывшего СССР. Кроме субтипа А1, на территории Беларуси
были выявлены ВИЧ-1 субтипов B, C, G, ЦРФ CRF02_AG, CRF03_AB, CRF06_cpx, УРФ
ВИЧ-1, названная Mos [2-А, 3-А, 4-А, 5-А, 6-А, 7-А, 9-А, 10-А, 12-А, 13-А,
15-А, 16-А, 17-А, 22-А, 23-А, 27-А].
. Выявлено 15 случаев ВИЧ-инфекции, вызванных рекомбинантными формами
ВИЧ-1, что составляет 4,9% от всех случаев ВИЧ-инфекции на территории Беларуси.
Более половины всех случаев (8 из 15) приходится на CRF03_AB, четыре случая
вызваны CRF02_AG, два случая - CRF06_cpx. Уникальная рекомбинантная форма ВИЧ-1
между субтипами А1 и В определена у одного пациента [12-А].
. Установлено 6 независимых событий заноса CRF03_AB на территорию
Беларуси, вероятнее всего из России и Литвы, 2 из которых привели к
распространению CRF03_AB внутри страны. Обнаружено 2 достоверных кластера,
содержащих по 2 выявленных CRF03_AB в каждом. В первом случае в кластере было 2
образца из г. Лиды (Gr_3 и Gr_8), второй кластер содержал сиквенсы от двух
ВИЧ-инфицированных пациентов женского пола (Mg_8 и MnObl_15), не имеющих между
собой эпидемических связей. Это дает право предположить, что на территории
Беларуси остается не выявленным еще как минимум один случай ВИЧ-инфекции
CRF03_AB, имеющий связи с Mg_8 и/или MnObl_15. Найдено 3 независимых кластера
CRF02_AG с референсными сиквенсами, что указывало на три независимых события
заноса CRF02_AG на территорию Беларуси. В двух случаях исследуемые образцы
кластрировались с референсными сиквенсами из Западной Африки и в одном
(ВИЧ-инфицированные мать и ее ребенок) - с референсами из Узбекистана.
Поскольку мать и ребенок - близкие родственники, два этих случая ВИЧ-инфекции
являются одним событием заноса CRF02_AG. Основываясь на эпидемиологических
данных, еще как минимум 2 случая инфицирования CRF02_AG остаются не выявленными
- ВИЧ-инфекция обоих родителей ребенка (образец FN995208). Две CRF06_cpx,
выявленные у близких родственников, - брата и сестры, являющихся ПИН, при
филогенетическом анализе формировали достоверный кластер с референсными
сиквенсами из Эстонии, что указывает на происхождение данной ЦРФ из Эстонии
[12-А].
. Мутации резистентности у рекомбинантных форм ВИЧ-1 в большинстве
случаев возникали к ингибиторам обратной транскриптазы: НИОТ и ННИОТ. В участке
гена pol всех изолятов, имеющих резистентность к НИОТ, установлена
мутация M184V, вызывающая снижение чувствительности к ламивудину и
эмтрицитабину. Выявлен штамм ВИЧ-1, имеющий резистентность к препаратам трех
классов - ИП, НИОТ и ННИОТ, применяемых в Беларуси, а также установлены случаи
инфицирования резистентными формами ВИЧ-1 [1-А, 8-А, 11-А, 14-А, 19-А, 20-А,
21-А, 24-А, 25-А, 26-А, 28-А].
. Новая уникальная рекомбинантная форма ВИЧ-1 Mos, выявленная у ребенка,
рожденного ВИЧ-инфицированной матерью, состоит из генома ВИЧ-1 субтипа А1, на
который приходится порядка 80%, и фрагментов генома ВИЧ-1 субтипа В (~20%
генома Mos). Встраивание фрагментов субтипа В произошло в структурных генах gag
и pol. Сравнительный анализ УРФ Mos с CRF03_AB показал, что геном Mos не
является CRF03_AB и не содержит ее фрагментов в своем геноме. Методом
филогенетического анализа установлено, что геном Mos состоит из геномов ВИЧ-1
вариантов AFSU и BFSU, получивших распространение на территории стран бывшего
СССР. Однако не было выявлено достоверных кластеров с референсными сиквенсами
ВИЧ-1 из одного географического региона [3-А, 4-А, 5-А, 12-А, 18-А].
Рекомендации
по практическому использованию результатов
Результаты диссертационного исследования использованы для
усовершенствования диагностики и молекулярно-эпидемиологического мониторинга
ВИЧ-1, что нашло отражение в нормативно-правовых актах Министерства
здравоохранения Республики Беларусь:
метод определения подтипа ВИЧ-1: инструкция по применению № 251-1213 :
утв. М-вом здравоохранения Респ. Беларусь 11.07.2014 [29-А];
метод определения мутаций резистентности ВИЧ-1 к лекарственным средствам
антиретровирусной терапии: инструкция по применению № 163-1214, утв. М-вом
здравоохранения Респ. Беларусь 07.05.2015 [30-А].
Получен патент «Новая уникальная рекомбинантная форма ВИЧ-1», № 18124 от
30.04.2014 [31-А].
На основании проведенных исследований разработана диагностическая
тест-система для генотипирования и определения мутаций резистентности ВИЧ-1
«Бел-ВИЧ-1 резистентность-генотип» (№ ИМ-7.103886). Данная тест-система
выявляет мутации в участке гена polВИЧ-1, ответственные за возникновение
резистентности вируса к АРП. Результатом использования тест-системы станет
адекватная антиретровирусная терапия, что позволит улучшить качество жизни
ВИЧ-инфицированных пациентов и предотвратить дальнейшее распространение ВИЧ-1
на территории Республики Беларусь.
Созданная «Контрольная панель сывороток крови, содержащих и не содержащих
антитела к специфическим белкам ВИЧ-1 и ВИЧ-2 и антигены ВИЧ-1» (№ ИМ-7.102188)
позволят проводить контроль за качеством скрининга ВИЧ-1 на территории Беларуси
серологическими методами.
В международную базу данных Genbank внесен 241 сиквенс по участку геновgag-polВИЧ-1,
из них ВИЧ-1 субтипов A1 - 223, B - 6, C - 2, G - 1, CRF02_AG - 1, CRF03_AB -
5, CRF06_cpx - 2, УРФ ВИЧ-1 и один полноразмерный геном ВИЧ-1 субтипа А1,
образец PV_85. Данные сиквенсы могут быть использованы в качестве референсных
сиквенсов при проведении филогенетического анализа с целью определения динамики
распространения ВИЧ-1 как на территориях стран бывшего СССР, так и во всем
мире, а также молекулярно-эпидемиологического мониторинга ВИЧ-1 на территории
Республики Беларусь. На основании полноразмерного сиквенса возможно создание
кандидатных вакцин против ВИЧ-1, распространенных в определенном географическом
регионе.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Cohen,
M.S. The spread, treatment, and prevention of HIV-1: evolution of a global
pandemic. / M.S. Cohen [et al.] // The Journal of clinical investigation. -
2008. - Vol. 118. - № 4. - P. 1244-1254., P.M. Origins of HIV and the AIDS
pandemic. / P.M. Sharp, B.H. Hahn // Cold Spring Harb Perspect Med. - 2011. -
Vol. 1. - № 1. - P. a006841-a006841.General, U.N. UN Millenium Development
Report /. U.N. Secretary-General. - UN Department of Public In, 2010., M.S.
Pneumocystis carinii pneumonia and mucosal candidiasis in previously healthy
homosexual men: evidence of a new acquired cellular immunodeficiency. / M.S.
Gottlieb [et al.] // The New England journal of medicine. - 1981. - Vol. 305. -
№ 24. - P. 1425-1431.for Disease Control (CDC). A cluster of Kaposi's sarcoma
and Pneumocystis carinii pneumonia among homosexual male residents of Los
Angeles and Orange Counties, California. / Centers for Disease Control (CDC) //
MMWR. Morbidity and mortality weekly report. - 1982. - Vol. 31. - № 23. - P.
305-307.for Disease Control (CDC). Kaposi's sarcoma and Pneumocystis pneumonia
among homosexual men--New York City and California. / Centers for Disease
Control (CDC) // MMWR. Morbidity and mortality weekly report. - 1981. - Vol.
30. - № 25. - P. 305-308.Kien, A.E. Disseminated Kaposi's sarcoma syndrome in
young homosexual men. / A.E. Friedman-Kien // Journal of the American Academy
of Dermatology. - 1981. - Vol. 5. - № 4. - P. 468-471.
Barré-Sinoussi, F.
Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired
immune deficiency syndrome (AIDS). / F. Barré-Sinoussi [et al.] //
Science (New York, N.Y.). - 1983. - Vol. 220. - № 4599. - P. 868-871., R.C.
Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome
(AIDS). / R.C. Gallo [et al.] // Science (New York, N.Y.). - 1983. - Vol. 220.
- № 4599. - P. 865-867., J. What to call the AIDS virus? / J. Coffin [et al.]
// Nature. - 1986. - Vol. 321. - № 6065. - P. 10.
Nobelförsamlingen PRESS RELEASE
2008-10-06. -
Stockholm, 2008. - 4 p., B.G. Structural biology of HIV. / B.G. Turner, M.F.
Summers // Journal of Molecular Biology. - 1999. - Vol. 285. - № 1. - P. 1-32.,
E. Novel factors interfering with human immunodeficiency virus-type 1
replication in vivo and in vitro. / E. Vicenzi, G. Poli // Tissue antigens. -
2013. - Vol. 81. - № 2. - P. 61-71., A.D. HIV-1: fifteen proteins and an RNA. /
A.D. Frankel, J.A. Young // Annual review of biochemistry. - 1998. - Vol. 67. -
№ 1. - P. 1-25., P. Distribution and three-dimensional structure of AIDS virus
envelope spikes. / P. Zhu [et al.] // Nature. - 2006. - Vol. 441. - № 7095. -
P. 847-852., D.C. HIV entry and its inhibition. / D.C. Chan, P.S. Kim // Cell.
- 1998. - Vol. 93. - № 5. - P. 681-684., R. The HIV-1 envelope glycoproteins:
fusogens, antigens, and immunogens. / R. Wyatt, J. Sodroski // Science (New
York, N.Y.). - 1998. - Vol. 280. - № 5371. - P. 1884-1888., W.A. Structure of
an HIV gp120 envelope glycoprotein in complex with the CD4 receptor and a
neutralizing human antibody / W.A. Hendrickson [et al.] // Nature. - 1998. -
Vol. 393. - № 6686. - P. 648-659., D.M. Mechanisms of viral membrane fusion and
its inhibition. / D.M. Eckert, P.S. Kim // Annual review of biochemistry. -
2001. - Vol. 70. - № 1. - P. 777-810., G.B. Evidence that the transition of
HIV-1 gp41 into a six-helix bundle, not the bundle configuration, induces
membrane fusion. / G.B. Melikyan [et al.] // The Journal of cell biology. -
2000. - Vol. 151. - № 2. - P. 413-423., P.S. The critical role of p38 MAP
kinase in T cell HIV-1 replication. / P.S. Cohen [et al.] // Molecular medicine
(Cambridge, Mass.). - 1997. - Vol. 3. - № 5. - P. 339-346., T. Cyclophilin
Interactions with Incoming Human Immunodeficiency Virus Type 1 Capsids with
Opposing Effects on Infectivity in Human Cells / T. Hatziioannou [et al.] //
Journal of virology. - 2004. - Vol. 79. - № 1. - P. 176-183., H. Reverse
transcription takes place within extracellular HIV-1 virions: potential
biological significance. / H. Zhang [et al.] // AIDS research and human
retroviruses. - 1993. - Vol. 9. - № 12. - P. 1287-1296., H.
The HIV-1 reverse transcription (RT) process as target for RT inhibitors. / H.
Jonckheere, J. Anné, E. De Clercq // Medicinal research reviews. - 2000.
- Vol. 20. -
№ 2. - P. 129-154., L. tRNA(Lys3): the primer tRNA for reverse transcription in
HIV-1. / L. Kleiman // IUBMB Life. - 2002. - Vol. 53. - № 2. - P. 107-114., W.
Retroviral recombination and reverse transcription / W. Hu, H. Temin //
Science. - 1990. - Vol. 250. - № 4985. - P. 1227-1233., H. The Nature of Human
Immunodeficiency Virus Type 1 Strand Transfers / H. Yu [et al.] // The Journal
of biological chemistry. - 1998. - Vol. 273. - № 43. - P. 28384-28391., J.S.
Specificity of human immunodeficiency virus-1 reverse transcriptase-associated
ribonuclease H in removal of the minus-strand primer, tRNA(Lys3). / J.S. Smith,
M.J. Roth // The Journal of biological chemistry. - 1992. - Vol. 267. - № 21. -
P. 15071-15079., R.A. Nuclear import of human immunodeficiency virus type-1
preintegration complexes. / R.A. Fouchier, M.H. Malim // Adv Virus Res. - 1999.
- Vol. 52. - P. 275-299., A.G. Phosphorylation-dependent human immunodeficiency
virus type 1 infection and nuclear targeting of viral DNA. / A.G. Bukrinskaya
[et al.] // Proceedings of the National Academy of Sciences of the United
States of America. - 1996. - Vol. 93. - № 1. - P. 367-371., F.D. Retroviral DNA
integration directed by HIV integration protein in vitro. / F.D. Bushman, T. Fujiwara,
R. Craigie // Science (New York, N.Y.). - 1990. - Vol. 249. - № 4976. - P.
1555-1558.
Schröder, A.R.W.
HIV-1 integration in the human genome favors active genes and local hotspots. /
A.R.W. Schröder [et al.] // Cell. - 2002. - Vol. 110. - № 4. - P. 521-529., A.T. The
HIV-1 Tat Protein Has a Versatile Role in Activating Viral Transcription / A.T.
Das, A. Harwig, B. Berkhout // Journal of virology. - 2011. - Vol. 85. - № 18.
- P. 9506-9516.Breyne, S. In vitro studies reveal that different modes of initiation
on HIV-1 mRNA have different levels of requirement for eukaryotic initiation
factor 4F. / S. de Breyne [et al.] // The FEBS journal. - 2012. - Vol. 279. - №
17. - P. 3098-3111., D.F. Alternative splicing of human immunodeficiency virus
type 1 mRNA modulates viral protein expression, replication, and infectivity. /
D.F. Purcell, M.A. Martin // Journal of virology. - 1993. - Vol. 67. - № 11. -
P. 6365-6378., G. An inducible transcription factor activates expression of
human immunodeficiency virus in T cells. / G. Nabel, D. Baltimore // Nature. -
1987. - Vol. 326. - № 6114. - P. 711-713., K.A. The Role of RNA Polymerase II
Elongation Control in HIV-1 Gene Expression, Replication, and Latency / K.A.
Nilson, D.H. Price // Genetics Research International. - 2011. - Vol. 2011. - №
20. - P. 1-9., K. Identification and purification of a human
immunoglobulin-enhancer-binding protein (NF-kappa B) that activates
transcription from a human immunodeficiency virus type 1 promoter in vitro. /
K. Kawakami, C. Scheidereit, R.G. Roeder // Proceedings of the National Academy
of Sciences of the United States of America. - 1988. - Vol. 85. - № 13. - P.
4700-4704., T. High rates of human immunodeficiency virus type 1 recombination:
near-random segregation of markers one kilobase apart in one round of viral
replication. / T. Rhodes, H. Wargo, W.-S. Hu // Journal of virology. - 2003. -
Vol. 77. - № 20. - P. 11193-11200., R. The structure of HIV-1 genomic RNA in
the gp120 gene determines a recombination hot spot in vivo. / R. Galetto [et
al.] // The Journal of biological chemistry. - 2004. - Vol. 279. - № 35. - P.
36625-36632., H.A. Influence of sequence identity and unique breakpoints on the
frequency of intersubtype HIV-1 recombination / H.A. Baird [et al.] //
Retrovirology. - 2006. - Vol. 3. - № 1. - P. 91., J. Identifying the Important
HIV-1 Recombination Breakpoints / J. Archer [et al.] // PLoS computational
biology. - 2008. - Vol. 4. - № 9. - P. e1000178., R.E. Adaptive value of sex in
microbial pathogens. / R.E. Michod, H. Bernstein, A.M. Nedelcu // Infection,
Genetics and Evolution. - 2008. - Vol. 8. - № 3. - P. 267-285., J.M. Structure,
replication, and recombination of retrovirus genomes: some unifying hypotheses.
/ J.M. Coffin // The Journal of general virology. - 1979. - Vol. 42. - № 1. -
P. 1-26., H. High-frequency deletion between homologous sequences during
retrotransposition of Ty elements in Saccharomyces cerevisiae. / H. Xu, J.D.
Boeke // Proceedings of the National Academy of Sciences of the United States
of America. - 1987. - Vol. 84. - № 23. - P. 8553-8557., W.S. Effect of gamma
radiation on retroviral recombination. / W.S. Hu, H.M. Temin // Journal of
virology. - 1992. - Vol. 66. - № 7. - P. 4457-4463., C.K. Dynamic copy choice:
Steady state between murine leukemia virus polymerase and polymerase-dependent
RNase H activity determines frequency of in vivo template switching / C.K.
Hwang, E.S. Svarovskaia, V.K. Pathak // Proceedings of the National Academy of
Sciences of the United States of America. - 2001. - Vol. 98. - № 21. - P.
12209-12214., G.N. Mechanism for nucleoside analog-mediated abrogation of HIV-1
replication: Balance between RNase H activity and nucleotide excision / G.N.
Nikolenko [et al.] // Proceedings of the National Academy of Sciences of the United
States of America. - 2005. - Vol. 102. - № 6. - P. 2093-2098., G.N. Mutations
in the connection domain of HIV-1 reverse transcriptase increase
3“-azido-3-”deoxythymidine resistance / G.N. Nikolenko [et al.] // Proceedings
of the National Academy of Sciences of the United States of America. - 2007. -
Vol. 104. - № 1. - P. 317-322., M.P.S. Long-range Recombination Gradient
between HIV-1 Subtypes B and C Variants Caused by Sequence Differences in the
Dimerization Initiation Signal Region / M.P.S. Chin [et al.] // Journal of
Molecular Biology. - 2008. - Vol. 377. - № 5. - P. 1324-1333.Loriere, E.
Molecular Mechanisms of Recombination Restriction in the Envelope Gene of the
Human Immunodeficiency Virus / E. Simon-Loriere [et al.] // PLoS Pathogens. -
2009. - Vol. 5. - № 5. - P. e1000418., J. Global and regional distribution of
HIV-1 genetic subtypes and recombinants in 2004 / J. Hemelaar [et al.] // AIDS.
- 2006. - Vol. 20. - № 16. - P. W13-W23., D. T-lymphocyte T4 molecule behaves
as the receptor for human retrovirus LAV. / D. Klatzmann [et al.] // Nature. -
1984. - Vol. 312. - № 5996. - P. 767-768., A.G. The CD4 (T4) antigen is an
essential component of the receptor for the AIDS retrovirus. / A.G. Dalgleish
[et al.] // Nature. - 1984. - Vol. 312. - № 5996. - P. 763-767., D. Selective
tropism of lymphadenopathy associated virus (LAV) for helper-inducer T
lymphocytes. / D. Klatzmann [et al.] // Science (New York, N.Y.). - 1984. -
Vol. 225. - № 4657. - P. 59-63., F. Identification of RANTES, MIP-1 alpha, and
MIP-1 beta as the major HIV-suppressive factors produced by CD8+ T cells. / F.
Cocchi [et al.] // Science (New York, N.Y.). - 1995. - Vol. 270. - № 5243. - P.
1811-1815.
Монографии
и статьи в рецензируемых научных журналах
1-A. Мутация
резистентности ВИЧ-1 у детей, получавших высокоактивную антиретровирусную
терапию / В.Ф. Еремин, Е.Л. Гасич, С.В. Сосинович, Г.В. Лапицкая, О.Н. Суетнов,
С.В. Еремин, В.С. Ильенкова, И.А. Карпов // Здравоохранение. - 2010. - №. 10. -
С. 56-62.
2-A. Еремин,
В.Ф. Характеристика эпидемического процесса по ВИЧ/СПИДу в Беларуси / В.Ф.
Еремин, Е.Л. Гасич, С.В. Сосинович // Здравоохранение. - 2010. - № 12. - С.
23-26.
-A. Еремин,
В.Ф. Новая уникальная рекомбинантная форма ВИЧ-1, выявленная в Беларуси / В.Ф.
Еремин, Е.Л. Гасич, С.В. Сосинович // Доклады Национальной Академии наук
Беларуси. - 2011. - Т. 55. - № 3. - С. 103-109.
4-A. Eremin,
V.F. A new unique recombinant HIV type 1 isolated from a child born to an
HIV-infected mother. / V.F. Eremin, E.L. Gasich, S.V. Sasinovich // AIDS research
and human retroviruses. - 2011. - Vol. 27. - № 12. - P. 1323-1326.
5-A. Еремин,
В.Ф. Новая уникальная рекомбинантная форма ВИЧ-1, выявленная в Беларуси / В.Ф.
Еремин, Е.Л. Гасич, С.В. Сосинович // Вопросы вирусологии. - 2012. - Т. 57. - №
3. - С. 9-13.
-A. Молекулярная
эпидемиология ВИЧ/СПИД в Беларуси (2008-2011) / В.Ф. Еремин, Е.Л. Гасич, С.В.
Сосинович, О.Н. Суетнов, П.Н. Грушко, Т.П. Грушко, В.С. Ильенкова, Н.А.
Горбунова, Е.Г. Амбарцумян, И.А. Карпов // Здравоохранение. - 2012. - № 1. - С.
25-34.
-A. Особенности
развития эпидемии ВИЧ/СПИД в Гомельской области в 1987-2006 гг.: эпидемиология,
молекулярная эпидемиология. Сообщение 1 / В.Ф. Еремин, Е.Л. Гасич, О.Н.
Суетнов, Т.П. Грушко, П.Н. Грушко, С.В. Сосинович, В.В. Лукашов, Э.В. Карамов
// Здравоохранение. - 2012. - № 9. - С. 27-35.
8-A. HIV
Drug Resistance at Patients on HAART and Transmitted HIV Drug Resistance
(tHIVDR) in Treatment Naive Patients in Belarus / V. Eremin, E. Gasich, S.
Sasinovich, O. Suetnov, I. Kucherov // Journal of AIDS & Clinical Research.
- 2013. - Vol. 4. - № 12. - 1000258.
9-A. Особенности
развития эпидемии ВИЧ/СПИД в Гомельской области в 1999 - 2006 гг. Сообщение 2 /
В.Ф. Еремин, Е.Л. Гасич, О.Н. Суетнов, Т.П. Грушко, П.Н. Грушко, С.В.
Сосинович, В.В. Лукашов// Здравоохранение. - 2013. - № 3. - С. 21-29.
-A. Особенности
развития эпидемии ВИЧ/СПИДа в Гомельской области в 2008-2011 гг. Сообщение 3 /
В.Ф. Еремин, Е.Л. Гасич, О.Н. Суетнов, Т.П. Грушко, П.Н. Грушко, С.В.
Сосинович, В.С. Ильенкова, Е.Г. Фисенко, И.А. Карпов // Здравоохранение. -
2013. - №. 4. - С. 14-26.
-A. Еремин,
В.Ф. Мутации резистентности вируса ВИЧ-1 у пациентов с ВИЧ/СПИДом, находящихся
на ВААРТ и не получавших АРП / В.Ф. Еремин, Е.Л. Гасич, С.В. Сосинович //
Здравоохранение. - 2014. - № 10. - С. 24-30.
-A. Сосинович
С.В. Рекомбинантные формы ВИЧ-1, выявленные в Беларуси: типы,
происхождение и распространение / С.В. Сосинович, В.Ф. Еремин, Е.Л. Гасич //
Здравоохранение. - 2016. - №7. - С.74-80.
Статьи в
материалах научных форумов, тезисы докладов
13-A. Eremin,
V. New CRF HIV, revealed in Belarus / V. Eremin, E. Gasich, S. Sasinovich //
6Th IAS Conference on Pathogenesis treatment and prevention,17-20 Jul. 2011. -
Rome, 2011. - CDA011.
14-A. The
HIV-1 resistance mutations revealed at patients on HAART in Belarus / V.
Eremin, E. Gasich, S. Sasinovich, O. Suetnov, T. Grushko, P. Grushko, V.
Iljenkova // Antibiotic resistance and infection control ARIC, European
Conference, 17 Nov. 2011 / ed.: A. Mickienė
[et al.]. - Kaunas, 2011. - P.27.
15-A. Eremin,
V. A new unique recombinant HIV type 1 isolated in Belarus / V. Eremin, E.
Gasich, S. Sasinovich // Antibiotic resistance and infection control ARIC,
European Conference, 17 Nov. 2011 / ed.: A. Mickienė
[et al.]. - Kaunas, 2011. - P. 41.
-A. HIV/AIDS
molecular epidemiology in Belarus, 2008-2011 / V. Eremin, E. Gasich, S.
Sasinovich, O. Suetnov, T. Grushko, P. Grushko, V. Iljenkova, N. Gorbunova, I.
Karpov // Antibiotic resistance and infection control
ARIC, European Conference, 17 Nov. 2011 / ed.: A. Mickienė [et al.]. -
Kaunas, 2011. - P. 42.
-A. Eremin,
V.F. A new unique recombinant HIV-1 revealed in Belarus / V.F. Eremin, E.L.
Gasich, S.V. Sasinovich // Retrovirology. - 2012. - Vol. 9. - Suppl. 1. - P.
32.
-A. Complete
genome sequence of new unique recombinant HIV type 1 isolated from a child born
to an HIV-infected mother / S. Sasinovich, V. Eremin, E. Gasich, M. Thomson //
BMC Infectious Diseases. - 2014. - Vol. 14. - Suppl. 2. - P. 62.
19-A. Еремин,
В.Ф. Новая уникальная рекомбинантная форма ВИЧ-1 с высоким уровнем
резистентности / В.Ф. Еремин, Е.Л. Гасич, С.В. Сосинович // Инфекционные
болезни : сб. науч. тр. V ежегодного Всероссийского Конгресса по инфекционным
болезням, г. Москва, 25-27 марта 2013 г. / ФГУН ЦНИИЭ Роспотребнадзора ;
редкол.: В.И. Покровский (гл. ред.) [и др.]. - Москва, 2013. - С. 138.
-A. Мутации
резистентности, выявляемые у детей / В.Ф. Еремин, Е.Л. Гасич, С.В. Сосинович,
И.И. Кучеров, О.Н. Суетнов, Н.А. Горбунова, В.С. Ильенкова, И.А. Карпов //
Инфекционные болезни : сб. науч. тр.V ежегодного Всероссийского Конгресса по
инфекционным болезням, г. Москва, 25-27 марта 2013 г. / ФГУН ЦНИИЭ
Роспотребнадзора ; редкол.: В.И. Покровский(гл. ред.) [и др.]. - Москва, 2013.
- С.139.
-A. Мутации
резистентности, выявляемые у взрослых пациентов с ВИЧ/СПИД, находящихся на
высокоактивной антиретровирусной терапии / В.Ф. Еремин, Е.Л. Гасич, С.В.
Сосинович, О.Н. Суетнов, Н.А. Горбунова, В.С. Ильенкова, И.А. Карпов //
Инфекционные болезни : сб. науч. тр.V ежегодного Всероссийского Конгресса по
инфекционным болезням, г. Москва, 25-27 марта 2013 г. / ФГУН ЦНИИЭ
Роспотребнадзора ; редкол.: В.И. Покровский (гл. ред.) [и др.]. - Москва, 2013.
- С.139.
-A. Молекулярная
эпидемиология ВИЧ/СПИД в Беларуси, 2008-2012 гг. / В.Ф. Еремин, Е.Л. Гасич,
С.В. Сосинович, О.Н. Суетнов, Т.П. Грушко, П.Н. Грушко, В.С. Ильенкова, Н.А.
Горбунова, Е.Г. Фисенко, И.А. Карпов // Инфекционные болезни : сб. науч. тр. V
ежегодного Всероссийского Конгресса по инфекционным болезням, г. Москва, 25-27
марта 2013 г. / ФГУН ЦНИИЭ Роспотребнадзора ; редкол.: В.И. Покровский (гл.
ред.) [и др.]. - Москва, 2013. - С. 140.
-A.
Кластерный филогенетический анализ ВИЧ-1 субтипа А варианта FSU из разных групп
риска в Беларуси свидетельствует о множественной передаче вируса из группы
потребителей инъекционных наркотиков в группу с половым путем передачи / С.
Сосинович, В. Еремин, Е. Гасич, П. Медстранд // Медицинская вирусология. -
2016. - Т. ХХХ. - №1. - С.64.
Статьи в
сборниках рецензируемых научных трудов
24-A. Мутации
резистентности, выявляемые у пациентов с ВИЧ/СПИД, находящихся на ВААРТ / В.Ф.
Еремин Гасич Е.Л., С.В. Сосинович, О.Н. Суетнов, Н.А. Горбунова, В.С.Ильенкова,
П.Н. Грушко, Т.П. Грушко, А.И. Василенко, И.А. Карпов // Современные проблемы
инфекционной патологии человека: сб. науч. тр. / М-во здравоохранения Респ.
Беларусь, ГУ «Респ. науч.-практ. центр эпидемиологии и микробиологии»; редкол.:
Г.М. Игнатьев (гл. ред.) [и др.]. - Минск, 2011. -Вып. 4. - С. 262-267.
25-A. Первичная
и приобретенная резистентность у пациентов с ВИЧ/СПИД в Беларуси / В.Ф. Еремин,
Е.Л. Гасич, С.В. Сосинович, В.С. Ильенкова, И.Ю. Ерамова, И.А. Карпов //
Современные проблемы инфекционной патологии человека :сб. науч. тр. / М-во
здравоохранения Респ. Беларусь, Респ. науч.-практ. центр эпидемиологии и
микробиологии ; редкол.: Л.П. Титов (гл. ред.) [и др.]. - Минск, 2012. - Вып.
5.-С. 152-157.
-A. Мутации
резистентности, выявляемые у пациентов с ВИЧ/СПИД, находящихся на ВААРТ / В.Ф.
Еремин, Е.Л. Гасич, С.В. Сосинович, И.И. Кучеров, М.В. Домнич, О.Н. Суетнов //
Молекулярная диагностика - 2014 : материалы VIII Всероссийской науч.-практ.
конф. с междунар. участ., г. Москва, 18-20 март. 2010 г. / ФГУН ЦНИИЭ
Роспотребнадзора ; редкол.: В.И. Покровский (гл. ред.) [и др.].- Москва, 2014.
- Т. 1. - С. 51-52.
-A. Подтипы
ВИЧ-1 в Беларуси, 2013 год / В.Ф. Еремин, Е.Л. Гасич, С.В. Сосинович, М.В.
Домнич, Е.А. Шишкин, Е.И. Нестеровская, Е.Г. Фисенко, И.А. Карпов, Н.Д.
Коломиец // Молекулярная диагностика - 2014 : материалы VIII Всероссийской
науч.-практ. конф. с междунар. участ., г. Москва, 18-20 март. 2010 г. / ФГУН
ЦНИИЭ Роспотребнадзора ; редкол.: В.И. Покровский (гл. ред.) [и др.].- Москва,
2014. - Т. 1. - C. 52-53.
-A. Мутации
резистентности высокого уровня у детей, находящихся на ВААРТ / В.Ф. Еремин,
Е.Л. Гасич, С.В. Сосинович, И.И. Кучеров, М.В. Домнич, А.А. Ключарева //
Молекулярная диагностика - 2014 : материалы VIII Всероссийской науч.-практ.
конф. с междунар. участ., г. Москва, 18-20 март. 2010 г. / ФГУН ЦНИИЭ
Роспотребнадзора ; редкол.: В.И. Покровский (гл. ред.) [и др.].- Москва, 2014.
- Т. 1. - C. 51-52.
Инструктивно-методическая
документация
29-A. Метод
определения подтипа ВИЧ-1 : инструкция по применению №251- 1213 : утв. М-вом
здравоохранения Респ. Беларусь 11.07.2014 / авт.-разраб. : В.Ф. Еремин, Е.Л.
Гасич, С.В. Сосинович, Е.А. Шишкин, Е.И. Нестеровская, М.В. Домнич, О.Н.
Суетнов. - Минск : РНПЦ эпидемиологии и микробиологии, 2014. - 10 с.
30-A. Метод
определения мутаций резистентности ВИЧ-1 к лекарственным средствам
антиретровирусной терапии : инструкция по применению №163-1214 : утв. М-вом
здравоохранения Респ. Беларусь
07.05.2015 / разраб.: В.Ф. Еремин, Е.Л. Гасич, С.В. Сосинович, М.В. Домнич,
И.И. Кучеров, А.С. Немира, О.Л. Матлах. - Минск : РНПЦ эпидемиологии и
микробиологии, 2015. - 11 с.
ПЕРЕЧЕНЬ
СОКРАЩЕНИЙ
|
АРП
|
антиретровирусные
препараты
|
|
ВААРТ
|
высокоактивная
антиретровирусная терапия
|
|
ВИЧ
|
вирус
иммунодефицита человека
|
|
ВИЧ-1
|
вирус
иммунодефицита человека первого типа
|
|
ДНК
|
дезоксирибонуклеиновая
кислота
|
|
дНТФ
|
дезоксинуклеотидтрифосфат
|
|
ИП
|
ингибиторы
протеазы
|
|
кДНК
|
комплементарная
ДНК
|
|
мРНК
|
матричная РНК
|
|
МСМ
|
мужчина,
практикующий секс с мужчиной
|
|
НИОТ
|
нуклеозидные
ингибиторы обратной транскриптазы
|
|
ННИОТ
|
ненуклеозидные
ингибиторы обратной транскриптазы
|
|
ОТ
|
обратная
транскриптаза
|
|
п.н.
|
пара
нуклеотидов
|
|
ПИН
|
потребитель инъекционных
наркотиков
|
|
ПЦР
|
полимеразная
цепная реакция
|
|
РНК
|
рибонуклеиновая
кислота
|
|
СПИД
|
синдром
приобретенного иммунодефицита
|
|
СССР
|
Союз Советских
Социалистических Республик
|
|
УРФ
|
уникальная
рекомбинантная форма
|
|
ЦРФ
|
циркулирующая
рекомбинантная форма
|
|
aLRT
|
approximate
likelihood ratio test (тест приблизительного отношения правдоподобия)
|
|
CRF
|
circulating
recombinant form (циркулирующая рекомбинантная форма)
|
|
FSU
|
Former Soviet
Union (страны бывшего СССР)
|
|
HIV
|
human
immunodeficiency virus (вирус иммунодефицита человека)
|
|
LTR
|
long terminal
repeat (длинный концевой повтор)
|
|
ML
|
Maximum
Likelihood (метод максимального правдоподобия)
|
|
SH
|
Shimodaira-Hasegawa
(тест Шимодаира-Хасегава)
|
|
tRNA
|
transport RNA
(транспортная РНК)
|
ПРИЛОЖЕНИЕ
ОСНОВНЫЕ ДАННЫЕ ПО ОБРАЗЦАМ, ИСПОЛЬЗОВАННЫМ В ДИССЕРТАЦИОННОЙ
РАБОТЕ
|
Образец
|
Город
|
Область
|
Пол
|
Г.р.
|
Сбор
|
Путь
|
Genbank
|
|
1
|
Br_1
|
Пинск
|
Брестская
|
муж
|
1975
|
2008
|
ПИН
|
HE657466
|
|
2
|
Br_2
|
Брест
|
Брестская
|
жен
|
1984
|
2010
|
Половой
|
HE657470
|
|
3
|
Br_3
|
Пинск
|
Брестская
|
жен
|
1984
|
2010
|
Половой
|
HE657467
|
|
4
|
Br_4
|
Брест
|
Брестская
|
муж
|
1986
|
2010
|
ПИН
|
HE657537
|
|
5
|
Br_5
|
Микашевичи
|
Брестская
|
муж
|
1971
|
2010
|
ПИН
|
HE657468
|
|
6
|
Br_6
|
Микашевичи
|
Брестская
|
муж
|
1977
|
2010
|
ПИН
|
HE657472
|
|
7
|
Br_7
|
Пинск
|
Брестская
|
жен
|
1971
|
2010
|
Половой
|
HE657535
|
|
8
|
Br_9
|
Барановичи
|
Брестская
|
жен
|
1984
|
2010
|
Половой
|
HE657474
|
|
9
|
Br_10
|
Барановичи
|
Брестская
|
муж
|
1976
|
2010
|
ПИН
|
HE657471
|
|
10
|
Br_11
|
Дрогичин
|
Брестская
|
жен
|
1965
|
2011
|
Половой
|
HE657475
|
|
11
|
Br_12
|
Микашевичи
|
Брестская
|
муж
|
1972
|
2011
|
ПИН
|
HE657473
|
Br_13
|
Брест
|
Брестская
|
муж
|
1979
|
2011
|
Половой
|
HE657465
|
|
13
|
Br_14
|
Пинск
|
Брестская
|
муж
|
1981
|
2010
|
ПИН
|
HE657469
|
|
14
|
Br_15
|
Пинск
|
Брестская
|
жен
|
1979
|
2011
|
Половой
|
HE657506
|
|
15
|
Br_16
|
Пинск
|
Брестская
|
жен
|
1983
|
2011
|
Половой
|
HE657476
|
|
16
|
Br_17
|
Пинск
|
Брестская
|
муж
|
1987
|
2011
|
ПИН
|
HE657507
|
|
17
|
Br_18
|
Пинск
|
Брестская
|
муж
|
1974
|
2008
|
Половой
|
HE657536
|
|
18
|
Br_19
|
Столин
|
Брестская
|
жен
|
2000
|
2008
|
Вертикальный
|
HE657505
|
|
19
|
Br_20
|
Барановичи
|
Брестская
|
муж
|
1972
|
2012
|
ПИН
|
HF679264
|
|
20
|
Br_21
|
Столин
|
Брестская
|
муж
|
1972
|
2011
|
ПИН
|
HF679265
|
|
21
|
Br_22
|
Барановичи
|
Брестская
|
жен
|
1975
|
2012
|
ПИН
|
HF679266
|
|
22
|
Br_23
|
Пинск
|
Брестская
|
муж
|
2005
|
2012
|
Вертикальный
|
HF679276
|
|
23
|
Br_24
|
Брест
|
Брестская
|
муж
|
1977
|
2012
|
ПИН
|
HF679271
|
|
24
|
Br_25
|
Пинск
|
Брестская
|
жен
|
1990
|
2012
|
Половой
|
HF679269
|
|
25
|
Br_26
|
Пинск
|
Брестская
|
муж
|
1984
|
2012
|
ПИН
|
HF679270
|
|
26
|
Br_27
|
Брест
|
Брестская
|
муж
|
1955
|
2012
|
ПИН
|
HF679277
|
|
27
|
Br_28
|
Лесная
|
Брестская
|
жен
|
1980
|
2012
|
Половой
|
HF679274
|
|
28
|
Br_29
|
Иванковичи
|
Брестская
|
жен
|
1982
|
2012
|
Половой
|
HF679273
|
|
29
|
Br_30
|
Брест
|
Брестская
|
жен
|
1983
|
2011
|
Половой
|
|
|
30
|
Br_32
|
Химковичи
|
Брестская
|
муж
|
1979
|
2012
|
ПИН
|
LN600131
|
|
31
|
Br_33
|
Пинск
|
Брестская
|
жен
|
1988
|
2012
|
Половой
|
LN600137
|
|
32
|
Br_34
|
Молотковичи
|
Брестская
|
муж
|
1961
|
2012
|
Половой
|
LN600132
|
|
33
|
Br_37
|
Застружье
|
Брестская
|
муж
|
2007
|
2013
|
Вертикальный
|
LN600133
|
|
34
|
Br_38
|
Барановичи
|
Брестская
|
муж
|
1986
|
2013
|
ПИН
|
LN600134
|
|
35
|
Br_40
|
Пинск
|
Брестская
|
жен
|
1981
|
2013
|
ПИН
|
LN600135
|
|
36
|
Br_41
|
Барановичи
|
Брестская
|
жен
|
1990
|
2013
|
Половой
|
LN600136
|
|
37
|
Br_42
|
Брест
|
Брестская
|
жен
|
1978
|
2014
|
Половой
|
LN600139
|
|
38
|
Br_48
|
Барановичи
|
Брестская
|
жен
|
1990
|
2013
|
Половой
|
LN600138
|
|
39
|
PV_57
|
Русино
|
Брестская
|
жен
|
1979
|
2013
|
Не
указан
|
|
|
40
|
RES_134
|
Пинск
|
Брестская
|
жен
|
1983
|
2011
|
Не
указан
|
|
|
41
|
RES_621
|
Барановичи
|
Брестская
|
муж
|
1960
|
2015
|
Не
указан
|
|
|
42
|
RES_646
|
Барановичи
|
Брестская
|
муж
|
1983
|
2015
|
Половой
|
|
|
43
|
Vit_1
|
Витебск
|
Витебская
|
муж
|
1978
|
2009
|
ПИН
|
HE657490
|
|
44
|
Vit_2
|
Витебск
|
Витебская
|
жен
|
1978
|
2008
|
Половой
|
HE657489
|
|
45
|
Vit_3
|
Городок
|
Витебская
|
муж
|
1981
|
2011
|
ПИН
|
HE657491
|
|
46
|
Vit_4
|
Витебск
|
Витебская
|
муж
|
2003
|
2011
|
Вертикальный
|
HF679260
|
|
47
|
Vit_5
|
Толочин
|
Витебская
|
муж
|
1976
|
2012
|
ПИН
|
HF679261
|
|
48
|
Vit_6
|
Орша
|
Витебская
|
муж
|
1976
|
2012
|
ПИН
|
HF679262
|
|
49
|
Vit_7
|
Полоцк
|
Витебская
|
муж
|
1954
|
2012
|
Половой
|
HF679263
|
|
50
|
PV_7
|
Витебск
|
Витебская
|
жен
|
1988
|
2012
|
Половой
|
|
|
51
|
PV_10
|
Витебск
|
Витебская
|
жен
|
1975
|
Не
указан
|
|
|
52
|
PV_19
|
Витебск
|
Витебская
|
муж
|
2007
|
2012
|
Вертикальный
|
|
|
53
|
PV_29
|
Витебск
|
Витебская
|
муж
|
1988
|
2013
|
МСМ
|
|
|
54
|
PV_30
|
Витебск
|
Витебская
|
муж
|
1947
|
2013
|
Препараты
крови
|
|
|
55
|
PV_31
|
Витебск
|
Витебская
|
жен
|
1929
|
2013
|
Препараты
крови
|
|
|
56
|
PV_88
|
Борова
|
Витебская
|
жен
|
1979
|
2013
|
Половой
|
|
|
57
|
Mn_1
|
Минск
|
Минск
|
муж
|
1978
|
2010
|
ПИН
|
HE657460
|
|
58
|
Mn_2
|
Минск
|
Минск
|
жен
|
1982
|
2010
|
Половой
|
HE657463
|
|
59
|
Mn_3
|
Минск
|
Минск
|
муж
|
1974
|
2008
|
ПИН
|
HE657500
|
|
60
|
Mn_4
|
Минск
|
Минск
|
муж
|
1981
|
2008
|
ПИН
|
HE657452
|
|
61
|
Mn_5
|
Минск
|
Минск
|
жен
|
1983
|
2010
|
ПИН
|
HE657461
|
|
62
|
Mn_6
|
Минск
|
Минск
|
муж
|
1982
|
2010
|
ПИН
|
HE657462
|
|
63
|
Mn_7
|
Минск
|
Минск
|
жен
|
2003
|
2008
|
Вертикальный
|
HF679239
|
|
64
|
Mn_8
|
Минск
|
Минск
|
муж
|
1971
|
2010
|
Половой
|
HE657464
|
|
65
|
Mn_9
|
Минск
|
Минск
|
жен
|
1975
|
2010
|
Половой
|
HE657455
|
|
66
|
Mn_10
|
Минск
|
Минск
|
жен
|
1982
|
2010
|
Половой
|
HF679238
|
|
67
|
Mn_11
|
Минск
|
Минск
|
жен
|
1974
|
2010
|
Половой
|
HE657459
|
|
68
|
Mn_12
|
Минск
|
Минск
|
жен
|
1985
|
2010
|
Половой
|
HE657456
|
|
69
|
Mn_13
|
Минск
|
Минск
|
муж
|
1981
|
2010
|
ПИН
|
HF679237
|
|
70
|
Mn_14
|
Минск
|
Минск
|
муж
|
1989
|
2010
|
МСМ
|
HE657453
|
|
71
|
Mn_15
|
Минск
|
Минск
|
муж
|
1977
|
2010
|
Половой
|
HE657458
|
|
72
|
Mn_16
|
Минск
|
Минск
|
муж
|
1968
|
2010
|
Половой
|
HE657454
|
|
73
|
Mn_17
|
Минск
|
Минск
|
муж
|
1983
|
2010
|
ПИН
|
HF679236
|
|
74
|
Mn_18
|
Минск
|
Минск
|
жен
|
1978
|
2010
|
Половой
|
HE657457
|
|
75
|
Mn_19
|
Минск
|
Минск
|
жен
|
1978
|
2010
|
ПИН
|
HF679240
|
|
76
|
Mn_20
|
Минск
|
Минск
|
жен
|
1984
|
2010
|
Половой
|
HE657502
|
|
77
|
Mn_21
|
Минск
|
Минск
|
жен
|
2004
|
2010
|
Вертикальный
|
FN995656
|
|
78
|
Mn_22
|
Минск
|
Минск
|
муж
|
1965
|
2010
|
Половой
|
HE657501
|
|
79
|
Mn_23
|
Минск
|
Минск
|
муж
|
2003
|
2008
|
Вертикальный
|
HF679241
|
|
80
|
Mn_24
|
Минск
|
Минск
|
жен
|
2004
|
2007
|
Вертикальный
|
HF679242
|
|
81
|
Mn_25
|
Минск
|
Минск
|
жен
|
1990
|
2008
|
Половой
|
HF679243
|
|
82
|
Mn_27
|
Минск
|
Минск
|
муж
|
2003
|
2008
|
Вертикальный
|
HF679245
|
|
83
|
Mn_28
|
Минск
|
Минск
|
муж
|
2003
|
2008
|
Вертикальный
|
HF679246
|
|
84
|
Mn_29
|
Минск
|
Минск
|
муж
|
1976
|
2011
|
ПИН
|
HF679247
|
|
85
|
Mn_30
|
Минск
|
Минск
|
жен
|
1975
|
2012
|
Половой
|
HF679248
|
|
86
|
Mn_31
|
Минск
|
Минск
|
муж
|
1983
|
2012
|
ПИН
|
HF679249
|
|
87
|
Mn_32
|
Минск
|
Минск
|
муж
|
1973
|
2012
|
ПИН
|
HF679250
|
|
88
|
Mn_34
|
Минск
|
Минск
|
жен
|
1979
|
2012
|
Половой
|
HF679252
|
|
89
|
Mn_35
|
Минск
|
Минск
|
муж
|
2005
|
2012
|
Вертикальный
|
HF679253
|
|
90
|
Mn_36
|
Минск
|
Минск
|
жен
|
2009
|
2012
|
Вертикальный
|
HF679254
|
|
91
|
Mn_37
|
Минск
|
муж
|
1970
|
2012
|
Половой
|
HF679255
|
|
92
|
Mn_38
|
Минск
|
Минск
|
муж
|
1951
|
2012
|
ПИН
|
HF679256
|
|
93
|
Mn_39
|
Минск
|
Минск
|
жен
|
1960
|
2009
|
Половой
|
HF679257
|
|
94
|
Mn_40
|
Минск
|
Минск
|
муж
|
1978
|
2008
|
ПИН
|
HF679258
|
|
95
|
Mn_41
|
Минск
|
Минск
|
жен
|
2010
|
2012
|
Вертикальный
|
HF679259
|
|
96
|
Mn_59
|
Минск
|
Минск
|
муж
|
2014
|
2014
|
Вертикальный
|
|
|
97
|
Mn_60
|
Минск
|
Минск
|
жен
|
1989
|
2014
|
Половой
|
|
|
98
|
PV_195
|
Минск
|
Минск
|
муж
|
1982
|
2015
|
ПИН
|
|
|
99
|
PV_203
|
Минск
|
Минск
|
муж
|
1975
|
2015
|
ПИН
|
|
|
100
|
PV_28
|
Минск
|
Минск
|
жен
|
1981
|
2012
|
Половой
|
|
|
101
|
PV_85
|
Минск
|
Минск
|
жен
|
1985
|
2013
|
Половой
|
|
|
102
|
RES_210
|
Минск
|
Минск
|
муж
|
1977
|
2012
|
ПИН
|
|
|
103
|
RES_359
|
Минск
|
Минск
|
жен
|
1984
|
2013
|
Половой
|
|
|
104
|
RES_603
|
Минск
|
Минск
|
жен
|
2005
|
2015
|
Вертикальный
|
|
|
105
|
RES_620
|
Минск
|
Минск
|
муж
|
1982
|
2015
|
ПИН
|
|
|
106
|
RES_622
|
Минск
|
Минск
|
муж
|
1985
|
2015
|
Не
указан
|
|
|
107
|
RES_649
|
Минск
|
Минск
|
муж
|
1966
|
2015
|
Половой
|
|
|
108
|
Gom_1
|
Светлогорск
|
Гомельская
|
жен
|
1980
|
2010
|
Половой
|
HE657432
|
|
109
|
Gom_2
|
Светлогорск
|
Гомельская
|
муж
|
1971
|
2010
|
Половой
|
HE657447
|
|
110
|
Gom_3
|
Светлогорск
|
Гомельская
|
муж
|
1975
|
2010
|
Половой
|
HE657534
|
|
111
|
Gom_4
|
Светлогорск
|
Гомельская
|
муж
|
1974
|
2010
|
Половой
|
HE657451
|
|
112
|
Gom_5
|
Светлогорск
|
Гомельская
|
жен
|
1983
|
2010
|
Половой
|
HE657445
|
|
113
|
Gom_6
|
Светлогорск
|
Гомельская
|
жен
|
1984
|
2010
|
Половой
|
HE657446
|
|
114
|
Gom_7
|
Светлогорск
|
Гомельская
|
жен
|
1968
|
2010
|
Половой
|
HE657443
|
|
115
|
Gom_8
|
Светлогорск
|
Гомельская
|
муж
|
1975
|
2010
|
Половой
|
HE657440
|
|
116
|
Gom_9
|
Светлогорск
|
Гомельская
|
жен
|
1982
|
2010
|
Половой
|
HE657533
|
|
117
|
Gom_10
|
Светлогорск
|
Гомельская
|
жен
|
1984
|
2010
|
Половой
|
HE657450
|
|
118
|
Gom_11
|
Светлогорск
|
Гомельская
|
жен
|
1980
|
2010
|
Половой
|
HE657442
|
|
119
|
Gom_12
|
Светлогорск
|
Гомельская
|
жен
|
2003
|
2010
|
Вертикальный
|
HE657439
|
|
120
|
Gom_13
|
Светлогорск
|
Гомельская
|
жен
|
1977
|
2010
|
ПИН
|
HE657437
|
|
121
|
Gom_14
|
Светлогорск
|
Гомельская
|
муж
|
1999
|
2010
|
Вертикальный
|
HE657438
|
|
122
|
Gom_15
|
Светлогорск
|
Гомельская
|
жен
|
1979
|
2010
|
ПИН
|
HE657444
|
|
123
|
Gom_16
|
Светлогорск
|
Гомельская
|
жен
|
1979
|
2010
|
ПИН
|
HE657449
|
|
124
|
Gom_17
|
Светлогорск
|
Гомельская
|
жен
|
1996
|
2010
|
Вертикальный
|
HE657430
|
|
125
|
Gom_18
|
Светлогорск
|
Гомельская
|
жен
|
1977
|
2010
|
ПИН
|
HE657532
|
|
126
|
Gom_19
|
Гомель
|
Гомельская
|
муж
|
1980
|
2009
|
ПИН
|
HE657436
|
|
127
|
Gom_20
|
Гомель
|
Гомельская
|
жен
|
1989
|
2009
|
Половой
|
HE657435
|
|
128
|
Gom_21
|
Светлогорск
|
Гомельская
|
жен
|
1986
|
2011
|
Половой
|
HE657503
|
|
129
|
Gom_22
|
Светлогорск
|
Гомельская
|
жен
|
1979
|
2011
|
Половой
|
HE657504
|
|
130
|
Gom_23
|
Ивье
|
Гомельская
|
жен
|
1996
|
2008
|
Вертикальный
|
HE657434
|
|
131
|
Gom_24
|
Светлогорск
|
Гомельская
|
жен
|
1998
|
Вертикальный
|
HE657441
|
|
132
|
Gom_25
|
Светлогорск
|
Гомельская
|
муж
|
2002
|
2010
|
Вертикальный
|
HE657448
|
|
133
|
Gom_26
|
Светлогорск
|
Гомельская
|
муж
|
1996
|
2008
|
Вертикальный
|
HE657433
|
|
134
|
Gom_27
|
Светлогорск
|
Гомельская
|
жен
|
2001
|
2010
|
Вертикальный
|
HE657431
|
|
135
|
Gom_29
|
Светлогорск
|
Гомельская
|
муж
|
1975
|
2012
|
Половой
|
HF679272
|
|
136
|
Gom_30
|
Речица
|
Гомельская
|
жен
|
1989
|
2012
|
Половой
|
HF679275
|
|
137
|
Gom_31
|
Мозырь
|
Гомельская
|
жен
|
1983
|
2012
|
Половой
|
KM190951
|
|
138
|
Gom_39
|
Речица
|
Гомельская
|
жен
|
2000
|
2013
|
Вертикальный
|
KM190968
|
|
139
|
Gom_40
|
Гомель
|
Гомельская
|
муж
|
1985
|
2013
|
Половой
|
KM190969
|
|
140
|
Gom_41
|
Мозырь
|
Гомельская
|
муж
|
2004
|
2013
|
Вертикальный
|
KM190970
|
|
141
|
Gom_42
|
Светлогорск
|
Гомельская
|
жен
|
1975
|
2013
|
Половой
|
KM190946
|
|
142
|
Gom_43
|
Светлогорск
|
Гомельская
|
жен
|
2013
|
2014
|
Вертикальный
|
KM190971
|
|
143
|
Gom_44
|
Жодино
|
Гомельская
|
муж
|
1971
|
2014
|
ПИН
|
KM190947
|
|
144
|
Gom_45
|
Жлобин
|
Гомельская
|
жен
|
1984
|
2014
|
Половой
|
KM190972
|
|
145
|
Gom_46
|
Жлобин
|
Гомельская
|
муж
|
1964
|
2014
|
Половой
|
KM190973
|
|
146
|
Gom_47
|
Жлобин
|
Гомельская
|
муж
|
1976
|
2014
|
ПИН
|
KM190974
|
|
147
|
Gom_48
|
Жлобин
|
Гомельская
|
жен
|
1974
|
2014
|
ПИН
|
KM190949
|
|
148
|
Gom_49
|
Жлобин
|
Гомельская
|
муж
|
1986
|
2014
|
Половой
|
KM190950
|
|
149
|
Gom_50
|
Жлобин
|
Гомельская
|
муж
|
1982
|
2014
|
ПИН
|
KM190975
|
|
150
|
Gom_51
|
Жлобин
|
Гомельская
|
муж
|
1979
|
2014
|
ПИН
|
KM190952
|
|
151
|
Gom_52
|
Жлобин
|
Гомельская
|
жен
|
1987
|
2014
|
Половой
|
KM190948
|
|
152
|
Gom_53
|
Жлобин
|
Гомельская
|
жен
|
1972
|
2014
|
Половой
|
KM190976
|
|
153
|
Mn_33
|
Жлобин
|
Гомельская
|
муж
|
1983
|
2012
|
ПИН
|
HF679251
|
|
154
|
PV_106
|
Светлогорск
|
Гомельская
|
жен
|
1960
|
2013
|
Половой
|
|
|
155
|
PV_108
|
Светлогорск
|
Гомельская
|
муж
|
1975
|
2013
|
Половой
|
|
|
156
|
RES_576a
|
Жлобин
|
Гомельская
|
муж
|
1976
|
2015
|
ПИН
|
|
|
157
|
RES_619
|
Гомель
|
Гомельская
|
муж
|
2006
|
2015
|
Вертикальный
|
|
|
158
|
Gr_1
|
Лида
|
Гродненская
|
муж
|
1981
|
2010
|
Половой
|
HE657478
|
|
159
|
Gr_2
|
Огородники
|
Гродненская
|
жен
|
1978
|
2010
|
Половой
|
HE657480
|
|
160
|
Gr_3
|
Лида
|
Гродненская
|
муж
|
1981
|
2010
|
Половой
|
FR773523
|
|
161
|
Gr_4
|
Лида
|
Гродненская
|
жен
|
1982
|
2010
|
Половой
|
HE657481
|
|
162
|
Gr_5
|
Лида
|
Гродненская
|
жен
|
1988
|
2010
|
Половой
|
HE657482
|
|
163
|
Gr_7
|
Гродно
|
Гродненская
|
муж
|
1974
|
2009
|
ПИН
|
HE657539
|
|
164
|
Gr_8
|
Лида
|
Гродненская
|
жен
|
1983
|
2010
|
Половой
|
HE657485
|
|
165
|
Gr_9
|
Лида
|
Гродненская
|
жен
|
1975
|
2011
|
ПИН
|
HE657488
|
|
166
|
Gr_10
|
Лида
|
Гродненская
|
жен
|
1978
|
2011
|
Половой
|
HE657487
|
|
167
|
Gr_11
|
Лида
|
Гродненская
|
муж
|
1966
|
2011
|
ПИН
|
HE657486
|
|
168
|
Gr_12
|
Гродно
|
Гродненская
|
жен
|
1974
|
2010
|
ПИН
|
HE657484
|
|
169
|
Gr_13
|
Гродно
|
Гродненская
|
муж
|
1977
|
2010
|
Половой
|
HE657479
|
|
170
|
Gr_14
|
Гродно
|
Гродненская
|
муж
|
1981
|
2010
|
ПИН
|
HE657477
|
|
171
|
Гродно
|
Гродненская
|
муж
|
1978
|
2009
|
ПИН
|
HE657538
|
|
172
|
Gr_16
|
Гродно
|
Гродненская
|
муж
|
1975
|
2010
|
ПИН
|
HE657483
|
|
173
|
Gr_17
|
Лида
|
Гродненская
|
муж
|
2007
|
2008
|
Вертикальный
|
HF679267
|
|
174
|
RES_53
|
Лида
|
Гродненская
|
жен
|
1978
|
2011
|
Не
указан
|
|
|
175
|
MnObl_1
|
Марьина
Горка
|
Минская
|
муж
|
1959
|
2010
|
Половой
|
HE577613
|
|
176
|
MnObl_2
|
Колодищи
|
Минская
|
муж
|
1981
|
2010
|
ПИН
|
HE577614
|
|
177
|
MnObl_3
|
Светлогорск
|
Минская
|
жен
|
2004
|
2010
|
Вертикальный
|
HE577615
|
|
178
|
MnObl_4
|
Слуцк
|
Минская
|
муж
|
1971
|
2010
|
ПИН
|
HE577616
|
|
179
|
MnObl_5
|
Копыль
|
Минская
|
жен
|
1978
|
2010
|
Половой
|
HE577617
|
|
180
|
MnObl_6
|
Копыль
|
Минская
|
муж
|
1975
|
2010
|
ПИН
|
HE577618
|
|
181
|
MnObl_7
|
Жодино
|
Минская
|
муж
|
-
|
2013
|
ПИН
|
|
|
182
|
MnObl_8
|
Солигорск
|
Минская
|
жен
|
1986
|
2010
|
Половой
|
HE657520
|
|
183
|
MnObl_9
|
Асавец
|
Минская
|
муж
|
1976
|
2008
|
Половой
|
HE657510
|
|
184
|
MnObl_10
|
Слуцк
|
Минская
|
муж
|
1976
|
2010
|
ПИН
|
HE657527
|
|
185
|
MnObl_11
|
Лучники
|
Минская
|
муж
|
1972
|
2010
|
Половой
|
HE657528
|
|
186
|
MnObl_12
|
Жодино
|
Минская
|
жен
|
1970
|
2010
|
Половой
|
HE657530
|
|
187
|
MnObl_13
|
Устраль
|
Минская
|
муж
|
1965
|
2010
|
Половой
|
HE657531
|
|
188
|
MnObl_14
|
Дворище
|
Минская
|
муж
|
1990
|
2010
|
Половой
|
HE657519
|
|
189
|
MnObl_15
|
-
|
Минская
|
жен
|
1981
|
-
|
Половой
|
FR729475
|
|
190
|
MnObl_16
|
Жодино
|
Минская
|
жен
|
1978
|
2008
|
ПИН
|
HE657523
|
|
191
|
MnObl_17
|
Солигорск
|
Минская
|
жен
|
1987
|
2010
|
ПИН
|
HE657529
|
|
192
|
MnObl_18
|
-
|
Минская
|
муж
|
1978
|
2010
|
Половой
|
HE657514
|
|
193
|
MnObl_19
|
Сергеи
|
Минская
|
муж
|
1978
|
2010
|
ПИН
|
HE657513
|
|
194
|
MnObl_20
|
Дубники
|
Минская
|
муж
|
1973
|
2011
|
ПИН
|
HE657511
|
|
195
|
MnObl_21
|
Речень
|
Минская
|
жен
|
1988
|
2011
|
Половой
|
HE657509
|
|
196
|
MnObl_22
|
|
Минская
|
жен
|
1983
|
2011
|
ПИН
|
HE657512
|
|
197
|
MnObl_23
|
Гай
|
Минская
|
муж
|
1981
|
2010
|
ПИН
|
HE657515
|
|
198
|
MnObl_24
|
Слуцк
|
Минская
|
жен
|
1968
|
2010
|
Половой
|
HE657525
|
|
199
|
MnObl_25
|
Старобин
|
Минская
|
жен
|
1982
|
2008
|
ПИН
|
HE657522
|
|
200
|
MnObl_26
|
Колодищи
|
Минская
|
жен
|
1985
|
2009
|
Половой
|
HE657521
|
|
201
|
MnObl_27
|
|
Минская
|
муж
|
1980
|
2010
|
ПИН
|
FR686469
|
|
202
|
MnObl_28
|
|
Минская
|
жен
|
1982
|
2010
|
ПИН
|
FR686468
|
|
203
|
MnObl_29
|
Усяжье
|
Минская
|
жен
|
1969
|
2010
|
Половой
|
HE657524
|
|
204
|
MnObl_30
|
Жодино
|
Минская
|
муж
|
1979
|
2010
|
ПИН
|
HE657516
|
|
205
|
MnObl_31
|
Лучники
|
Минская
|
жен
|
1985
|
2010
|
Половой
|
HE657526
|
|
206
|
MnObl_32
|
Минск
|
Минская
|
муж
|
1977
|
2010
|
ПИН
|
HE657518
|
|
207
|
MnObl_33
|
Борисов
|
Минская
|
жен
|
2008
|
2011
|
Вертикальный
|
HE657542
|
|
208
|
MnObl_34
|
Солигорск
|
Минская
|
муж
|
1976
|
2010
|
ПИН
|
HE657540
|
|
209
|
MnObl_35
|
Жодино
|
Минская
|
муж
|
1981
|
2010
|
Половой
|
HE657541
|
|
210
|
MnObl_36
|
|
Минская
|
жен
|
1973
|
2011
|
HF679220
|
|
211
|
MnObl_37
|
|
Минская
|
муж
|
2004
|
2010
|
Вертикальный
|
HF679211
|
|
212
|
MnObl_38
|
|
Минская
|
жен
|
1986
|
2012
|
Половой
|
HF679225
|
|
213
|
MnObl_39
|
Дубники
|
Минская
|
жен
|
1983
|
2010
|
Половой
|
HE657499
|
|
214
|
MnObl_40
|
Солигорск
|
Минская
|
жен
|
1974
|
2011
|
Половой
|
HF679227
|
|
215
|
MnObl_42
|
Юзефово
|
Минская
|
жен
|
1985
|
2011
|
Половой
|
HF679229
|
|
216
|
MnObl_43
|
Солигорск
|
Минская
|
муж
|
1968
|
2011
|
ПИН
|
HF679228
|
|
217
|
MnObl_44
|
Шиповичи
|
Минская
|
жен
|
1983
|
2012
|
Половой
|
HF679219
|
|
218
|
MnObl_45
|
Колодищи
|
Минская
|
муж
|
1971
|
2012
|
ПИН
|
HF679217
|
|
219
|
MnObl_46
|
Жодино
|
Минская
|
муж
|
2003
|
2012
|
Вертикальный
|
HF679224
|
|
220
|
MnObl_47
|
Солигорск
|
Минская
|
жен
|
1967
|
2012
|
Половой
|
HF679230
|
|
221
|
MnObl_48
|
Солигорск
|
Минская
|
муж
|
1981
|
2012
|
ПИН
|
HF679235
|
|
222
|
MnObl_49
|
Солигорск
|
Минская
|
муж
|
1977
|
2012
|
Половой
|
HF679232
|
|
223
|
MnObl_50
|
Солигорск
|
Минская
|
жен
|
1982
|
2012
|
Половой
|
HF679216
|
|
224
|
MnObl_51
|
Солигорск
|
Минская
|
муж
|
2002
|
2008
|
Вертикальный
|
HF679233
|
|
225
|
MnObl_53
|
Закольное
|
Минская
|
муж
|
1985
|
2012
|
ПИН
|
HF679231
|
|
226
|
MnObl_54
|
|
Минская
|
жен
|
2011
|
2012
|
Вертикальный
|
|
|
227
|
MnObl_55
|
Жодино
|
Минская
|
муж
|
1984
|
2012
|
ПИН
|
HF679218
|
|
228
|
MnObl_56
|
Кривичи
|
Минская
|
жен
|
1980
|
2012
|
Половой
|
HF679210
|
|
229
|
MnObl_57
|
Солигорск
|
Минская
|
муж
|
1970
|
2012
|
ПИН
|
HF679212
|
|
230
|
MnObl_58
|
Старобин
|
Минская
|
муж
|
1981
|
2012
|
ПИН
|
HF679234
|
|
231
|
MnObl_59
|
Слуцк
|
Минская
|
жен
|
2012
|
2012
|
Вертикальный
|
HF679215
|
|
232
|
MnObl_60
|
Жодино
|
Минская
|
муж
|
1983
|
2012
|
ПИН
|
HF679222
|
|
233
|
MnObl_61
|
|
Минская
|
муж
|
1975
|
2008
|
ПИН
|
|
|
234
|
MnObl_62
|
Жодино
|
Минская
|
муж
|
1976
|
2012
|
ПИН
|
HF679221
|
|
235
|
MnObl_63
|
Клецк
|
Минская
|
муж
|
1972
|
2012
|
ПИН
|
HF586690
|
|
236
|
MnObl_64
|
Красная
Дубрава
|
Минская
|
муж
|
1976
|
2008
|
ПИН
|
HF679214
|
|
237
|
MnObl_65
|
Слуцк
|
Минская
|
жен
|
2004
|
2012
|
Вертикальный
|
HF679226
|
|
238
|
MnObl_66
|
|
Минская
|
муж
|
1984
|
2008
|
ПИН
|
HF679209
|
|
239
|
MnObl_67
|
Нарочь
|
Минская
|
жен
|
2004
|
2012
|
Вертикальный
|
HF679223
|
|
240
|
MnObl_68
|
Жодино
|
Минская
|
муж
|
-
|
2013
|
ПИН
|
|
|
241
|
MnObl_69
|
Солигорск
|
Минская
|
жен
|
1985
|
2010
|
Половой
|
HE657517
|
|
242
|
MnObl_70
|
Лесная
|
Минская
|
жен
|
1987
|
2012
|
Половой
|
|
|
243
|
MnObl_71
|
Жодино
|
Минская
|
муж
|
1973
|
2012
|
ПИН
|
|
|
244
|
MnObl_72
|
Жодино
|
Минская
|
муж
|
-
|
2012
|
ПИН
|
|
|
245
|
MnObl_73
|
Солигорск
|
Минская
|
жен
|
1980
|
2012
|
ПИН
|
KM190956
|
|
246
|
MnObl_74
|
Яджар
|
Минская
|
муж
|
1978
|
2012
|
ПИН
|
KM190957
|
|
247
|
MnObl_75
|
Солигорск
|
Минская
|
муж
|
2004
|
2012
|
Вертикальный
|
KM190958
|
|
248
|
MnObl_77
|
Жодино
|
Минская
|
муж
|
1984
|
2013
|
ПИН
|
KM190959
|
|
249
|
MnObl_78
|
Борисов
|
Минская
|
жен
|
1988
|
2013
|
Половой
|
KM190960
|
|
250
|
MnObl_79
|
Жодино
|
Минская
|
муж
|
-
|
2013
|
ПИН
|
KM190961
|
MnObl_80
|
Жодино
|
Минская
|
муж
|
1979
|
2013
|
ПИН
|
KM190953
|
|
252
|
MnObl_81
|
Жодино
|
Минская
|
муж
|
-
|
2013
|
ПИН
|
KM190962
|
|
253
|
MnObl_82
|
Жодино
|
Минская
|
муж
|
-
|
2013
|
ПИН
|
KM190963
|
|
254
|
MnObl_83
|
Жодино
|
Минская
|
муж
|
-
|
2013
|
ПИН
|
KM190954
|
|
255
|
MnObl_84
|
Жодино
|
Минская
|
муж
|
1983
|
2013
|
ПИН
|
KM190964
|
|
256
|
MnObl_85
|
Жодино
|
Минская
|
муж
|
-
|
2013
|
ПИН
|
KM190965
|
|
257
|
MnObl_86
|
Жодино
|
Минская
|
муж
|
-
|
2013
|
ПИН
|
KM190955
|
|
258
|
MnObl_87
|
Жодино
|
Минская
|
муж
|
-
|
2013
|
ПИН
|
KM190966
|
|
259
|
MnObl_88
|
Жодино
|
Минская
|
муж
|
1982
|
2013
|
ПИН
|
KM190967
|
|
260
|
MnObl_89
|
Жодино
|
Минская
|
муж
|
1981
|
2013
|
Половой
|
|
|
261
|
MnObl_90
|
Жодино
|
Минская
|
муж
|
1979
|
2013
|
ПИН
|
|
|
262
|
MnObl_91
|
Слуцк
|
Минская
|
муж
|
2012
|
2012
|
Вертикальный
|
|
|
263
|
MnObl_92
|
Сергиевичи
|
Минская
|
жен
|
2004
|
2012
|
Вертикальный
|
|
|
264
|
MnObl_93
|
Жодино
|
Минская
|
муж
|
1973
|
2012
|
ПИН
|
|
|
265
|
MnObl_94
|
Кривичи
|
Минская
|
муж
|
1974
|
2013
|
ПИН
|
|
|
266
|
MnObl_95
|
Солигорск
|
Минская
|
жен
|
1977
|
2013
|
Не
указан
|
|
|
267
|
MnObl_96
|
Борисов
|
Минская
|
муж
|
1982
|
2013
|
Не
указан
|
|
|
268
|
MnObl_97
|
Солигорск
|
Минская
|
муж
|
2013
|
2013
|
Вертикальный
|
|
|
269
|
MnObl_98
|
Борисов
|
Минская
|
муж
|
1975
|
2010
|
ПИН
|
|
|
270
|
MnObl_99
|
-
|
Минская
|
жен
|
1993
|
2013
|
Половой
|
|
|
271
|
MnObl_100
|
-
|
Минская
|
жен
|
2013
|
2013
|
Вертикальный
|
|
|
272
|
MnObl_101
|
Солигорск
|
Минская
|
муж
|
1978
|
2014
|
ПИН
|
|
|
273
|
MnObl_103
|
Солигорск
|
Минская
|
муж
|
1978
|
2014
|
Не
указан
|
|
|
274
|
MnObl_104
|
Борисов
|
Минская
|
муж
|
1974
|
2014
|
Не
указан
|
|
|
275
|
MnObl_105
|
Слуцк
|
Минская
|
жен
|
2012
|
2012
|
Вертикальный
|
|
|
276
|
MnObl_106
|
Колодищи
|
Минская
|
муж
|
1973
|
2012
|
ПИН
|
|
|
277
|
MnObl_107
|
Солигорск
|
Минская
|
муж
|
1975
|
2010
|
ПИН
|
|
|
278
|
MnObl_108
|
Солигорск
|
Минская
|
жен
|
1976
|
2011
|
Половой
|
|
|
279
|
MnObl_109
|
Солигорск
|
Минская
|
муж
|
1974
|
2011
|
ПИН
|
|
|
280
|
MnObl_110
|
Борисов
|
Минская
|
муж
|
1982
|
2014
|
ПИН
|
|
|
281
|
MnObl_111
|
Новый
Ражом
|
Минская
|
жен
|
1978
|
2011
|
Половой
|
|
|
282
|
Mn_26
|
Крупки
|
Минская
|
жен
|
1997
|
2008
|
Половой
|
HF679244
|
|
283
|
RES_634
|
Дзержинск
|
Минская
|
муж
|
1977
|
2015
|
ПИН
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|