Применение Drosophila melanogaster в целях биотестирования
Оглавление
Введение
Глава 1. Биотестирование, как метод экологического исследования
.1 Суть биотестирования и предъявляемые к его методам требования
.1.1 Требования к методам биотестирования
.1.2 Подходы биотестирования
.2 Методы биотестирования
.3 Место биотестирования на молекулярно - генетическом уровне
Глава 2. Методика экспериментов
Глава 3. Характеристика Drosophila melanogaster как модельного
биологического объекта
.1 История использования дрозофилы как модельного объекта в биологических
исследованиях
.2 Особенности Drosophila melanogaster как тест - объекта
.3. Питательные среды для поддержания линий дрозофил.
.4. Метод учёта частоты доминантных летальных мутаций у Drosophila
melanogaster
Глава 4. Пути повышения эффективности использования Drosophila
melanogaster в биотестировании
.1 Сложности, возникающие в биотестировании
.2 Пути решения проблем биотестирования с использованием Drosophila
melanogaster
Заключение
Список литературы
Введение
Многие известные заболевания человека имеют
соответствие в генетическом коде плодовой мушки. Исследования на дрозофиле
помогают понять фундаментальные биологические процессы, которые непосредственно
связаны с человеком и его здоровьем. Они используются в моделировании некоторых
заболеваний человека, например, таких как, болезни Паркинсона, Хантингтона и
Альцгеймера, а также для изучения механизмов, которые лежат в основе рака,
диабета, иммунитета, наркотической зависимости и многих других.melanogaster
широко используется и для оценки качества окружающей среды. Так же она является
генетической моделью при исследованиях насекомых, которые могут переносить
опасные инфекционные болезни человека (Например, Culex pipiens - Вирус Западного Нила, Anopheles gambiae - малярию, Aedes aegypu - лихорадку
Денге). Результаты исследований, полученные на дрозофиле, также дают ключ к
пониманию генетических процессов, выявляемых при изучении важных для сельского
хозяйства насекомых, таких как пчелы и тутовый шелкопряд, и насекомых -
вредителей, к которым относится саранча и многие виды жуков и тлей.
Актуальность темы дипломной работы состоит в том, что
Drosophila melanogaster широко используется и имеет огромное значение в жизни
человека. Но во время ее культивирования и использования в исследованиях можно
столкнуться с рядом проблем, которые необходимо изучать для облегчения работы с
ней. Кроме того, существует мало литературы по методам ее культивирования.
Объект исследования - методика культивирования и
использования Drosophila melanogaster в биотестировании.
Предмет исследования - эффективность методики.
Цель работы - разработать методы оптимизации
использования Drosophila melanogaster в целях биотестирования.
Для того чтобы достигнуть поставленной цели были
поставлены следующие задачи:
.Выделить проблемы, связанные с биотестированием
Drosophila melanogaster.
. Найти подходы к реализации решения проблем.
. Экспериментальным путем установить эффективность
собственных и известных из литературы путей повышения эффективности
использования Drosophila melanogaster как тест - объекта.
Глава 1.
Биотестирование, как метод экологического исследования
1.1 Суть биотестирования и
предъявляемые к его методам требования
молекулярный генетический дрозофила
биотестирование
Биотестирование - это такая процедура установления
токсичности среды, при которой специальные тест - объекты информируют об
опасности, при этом не зависят от того, какие вещества и в каком сочетании
вызывают изменения жизненно важных функций [Ляшенко, 2012].
Определение характера и степени токсичности
тестируемой среды и является целью биотестирования.
Само биотестирование основано на регистрации
биологически важных показателей, так называемых тест - функций, исследуемых
тест - объектов. После регистрации этих показателей производиться оценка их
состояния в соответствии с выбранным критерием токсичности. В свою очередь тест
- функции бывают биологические и физиологические. К биологическим функциям
относятся выживаемость, плодовитость, размножение и качество потомства, а к
физиологическим - дыхание, показатели крови, активность питания, обмен веществ
[Ляшенко, 2012].
Тест - объектами (или иначе тест - организмами)
называют такие биологические объекты, которые используют для оценки токсичности
химических веществ. Проявляющийся токсический эффект регистрируют и оценивают в
эксперименте.
Биотестирование в отличие от аналитических методов
подразумевает слежение за антропогенными и природными процессами в
биологических средах, которые включают всю совокупность взаимодействия агентов
внешней среды с живым, в том числе и такие как выяснение ответной реакции
биосред на антропогенные и природные воздействия [Иваныкина, 2010]. Такими
ответами могут служить реакции на стресс - факторы. Методы имеют много
преимуществ. Например, они более информативны для определения прямой реакции
экосистемы на антропогенное воздействие. С помощью данных подходов в
экологическом мониторинге можно получать объективную, а также количественную
оценку процессов регенерирования объектов окружающей среды. Можно также,
благодаря этим методам, оценить эффективность мероприятий по охране природы
[Балакирев, 2013]. Также еще одним достоинством метода является определение
общей токсичности, которые создаются присутствием экотоксикантов, не
нормирующиеся существующими стандартами, но обладающие способностью вызывать
разнообразные генотоксические, токсические, цитотоксические или мутагенные
эффекты [Журавлева, 2006].
Кроме того, химико-аналитические и гидрохимические
методы могут быть неэффективными, в силу их недостаточно высокой
чувствительности. Биота может подвергаться токсическим воздействиям, которые не
регистрируются техническими средствами связи с тем, что любой аналитический
датчик не способен воспринимать такие низкие концентрации веществ по сравнению
с живыми объектами [Мелехова, 2007].
В основе биотестирования лежит метод биологического
моделирования. В определенной мере всякая модель является специфической формой
отражения действительности. При биотестировании происходит перенос знаний с
примитивной системы (смоделированной в лаборатории) на более сложную систему (экосистема
в реальных условиях) [Маячкина, 2009]. По некоторым данным биотестирование -
обязательное дополнение к химическому анализу, а также является интегральным
методом оценки токсичности водной среды [Туманов, Постнов, 1983]. В стандарты
по контролю качества вод различного назначения включены и методы
биотестирования [Александрова, 2013].
Для того чтобы оценить состояние разных организмов,
находящихся под воздействием естественных или антропогенных факторов проводят
тестирование на биологических объектах, которые представляют собой комплекс
различных подходов. Эффективность физиологических процессов, которые
обеспечивают нормальное функционирование организма (например, такие как
дыхание, обмен веществ, активность питания и тому подобное) является основным
показателем их состояния. На воздействие среды организм реагирует посредством
сложной физиологической системы буферных гомеостатических механизмов, но только
при оптимальных условиях поддерживает оптимальное протекание процессов
развития. Под воздействием неблагоприятных условий гомеостаз может быть
нарушен, что приводит к состоянию стресса. Эти нарушения могут происходить до
появления изменений, которые используются параметрами жизнеспособности. Таким
образом, методы биотестирования, основываются на исследовании механизмов
гомеостаза и его эффективности, а также позволяют уловить присутствие
воздействия стресс - фактора раньше, чем другие, обычно используемые методы
[Мелехова, 2007].
1.1.1 Требования к методам
биотестирования
Для того чтобы быть пригодным для использования методы
биотестирования должны соответствовать определенным требованиям. Эти требования
мы рассмотрим ниже.
Чувствительность является одним из наиболее важных
требований применяемых методов. В настоящее время возрастает потребность в таких
методах, когда становится необходимым оценивать не только необратимые изменения
в среде, но и первоначальные незначительные отклонения в системе, когда еще ее
можно вернуть в прежнее нормальное состояние.
Так же методы должны быть универсальны как в отношении
химического, биологического или физического оцениваемого воздействия, так и
вида живых существ и экосистем, по отношению к которым проводится такая оценка.
Также система должна быть относительно доступной и простой, пригодной для
широкого использования. Существует много современных молекулярно -
биологических тестов оценки качества среды, но в силу своей высокой стоимости и
технологической сложности они оказываются недоступными.
Так же немало значимы и другие требования. Например,
они должны характеризовать наиболее важные и общие параметры жизнедеятельности
биоты. Применяться для оценки любых экологических изменений среды. Быть
адекватными для любого вида живых существ и любого типа воздействия. Методы
биотестирования должны быть приспособлены для использования исследований в
природе и для лабораторного моделирования.
1.1.2 Подходы биотестирования
Подходами можно условно назвать совокупность методов,
которые характеризуют сходные процессы происходящими с тест - объектами под
влиянием антропогенных факторов. Существует шесть основных подходов:
морфологический, физиологический, генетический, биофизический, биохимический и
иммунологический. Эти методы биотестирования пригодны для оценки любой водной и
наземной экосистемы по тест - функциям растений и животных. По комплексу
морфологических, генетических, физиологических, биохимических, биофизических и
иммунологических параметров можно определять состояние живых организмов.
Применяемый комплекс методов исследования и тестов охватывает разные стороны
индивидуального развития организма, обеспечивая интегральную оценку состояния
биоты и качества среды в целом.
Морфологический подход
При техногенном воздействии на природные экосистемы
происходит снижение численности популяций. В значительной мере на это влияет эмбриональная
и личиночная смертность. Эмбрионы и личинки особо чувствительны к повреждающим
факторам. Воздействие стрессора на организм приводит к несоответствию нормам
строения разных морфологических признаков. Процессы воспроизведения организмов
- это сложная цепь взаимозаменяемых событий.
Процессы воспроизведения организмов - это сложная цепь
взаимозаменяемых событий. Любое из этих звеньев может нарушить воздействием
токсичной среды. Чтобы диагностировать влияние воздействия загрязнений на
морфологические характеристики используют методы оценки флуктуирующей
асимметрии.
Симметрия как вид согласованности отдельных частей
живых организмов имеет общебиологическое значение. В настоящее время для
биологических объектов использует классификацию асимметрий по Л. Ван Валену
[Захаров, 1987]. Согласно этой классификации асимметрия подразделяется на три
типа: направленная асимметрия, антиасимметрия и флуктуирующая асимметрия. Речь
идет о направленной асимметрии в том случае, когда структура на одной стороне
развита больше, чем на другой (например, сердце млекопитающих). Если же
развитие структуры идет больше на одно из сторон, то это антиасимметрия
(например, правша и левша в популяции человека). А если отклонения
незначительные ненаправленные от строгой билатеральной симметрии, то это уже
флуктуирующая асимметрия.
Если организм неспособен развиваться по точно
определенному плану, то это можно говорить, что это результат, флуктуирующий
асимметрии. Различия между сторонами не передаются на генетическом уровне и не
обладают адаптационным значением. Флуктуирующая асимметрия характеризует
состояние морфогенетического гомеостаза, выступая в качестве меры стабильности
развития. Морфогенетический гомеостаз - это способность организма к
формированию генетически предопределенного фенотипа при его минимальном уровне
индивидуальных нарушений. Отсюда следует, что флуктуирующая асимметрия один из
наиболее обычных доступных для анализа проявлений случайной изменчивости
развития.
Величина асимметрии реагирует на разные стрессоры антропогенного
характера, поэтому она может служить мерой нарушения развития организма.
Реальность использования асимметрии в биоиндикации была доказана многими
авторами на примере разных растений и животных. Флуктуирующая асимметрия - это
один из общих онтогенетических показателей, которые характеризуют стабильность
индивидуального развития, а также дают оценку состояния природных популяций и
зависят от состояния среды. Таким образом, величину флуктуирующей асимметрии, а
также ее зависимость от определенных факторов можно определить только на
популяционном уровне. Кроме того, В. М. Захаров показал, что флуктуирующая
асимметрия - практически единственная форма фенотипической изменчивости с
известной причиной обусловленности [Захаров, 1987].
Физиологический подход
Наиболее важная характеристика этого подхода - это
энергетика физиологических процессов, которая очень чувствительна к стрессовому
воздействию среды. Энергетический обмен может быть наиболее экономичным лишь в
оптимальных для этого условиях. Интенсивность энергетического обмена аэробного
организма можно определить, измерив, скорость потребления кислорода. Организм
при оптимальных условиях находится на самом низком энергетическом уровне, а при
ухудшении условий увеличивается потребность в кислороде.
Другая основная характеристика для оценки стрессовых
воздействий, - это темп и ритмика ростовых процессов.
Поведенческая активность живых организмов является
важной характеристикой физиологических процессов. Свойства внешней среды
проявляются в интенсивности воздействия на популяцию или организм отдельных
факторов или их комбинаций.
Степень отклонения исследуемых от стандартных
поведенческих реакций животных является одним из первичных и регистрируемых на
визуальном уровне сигналов изменений в окружающей среде. Этот сигнал может быть
отнесен к реакциям «первого ранга».
Наибольший интерес представляют типы поведения,
которые относятся к эволюционно-универсальным реакциям и свойственны всем
эукариотам, включая человека. К таким феноменам относятся спонтанная двигательная
активность как врожденная форма поведения и память - приобретенная форма
поведения.
В целом поведение животных рассматривается как
неустойчивое взаимодействие приобретенных и врожденных элементарных реакций.
Эти реакции необходимы для быстрой и эффективной адаптации к условиям среды.
Изучение поведения является сложным процессом, который требует очень тщательных
наблюдений в природе, подкрепленных лабораторными экспериментами.
Закономерности поведения, которые возникли у
простейших в ходе эволюции, так же сохраняются и у более развитых животных.
Таким образом, поведение - эволюционно обусловленный показатель состояния
физиологии животного. Таким образом, на основании изменений в поведении
животных одного вида можно прогнозировать нарушения поведения животных другого
вида. На выбор форм поведения для биотестирования влияет их чувствительностью к
изменениям, которые происходят в окружающей среде [Мелехова, 2007].
Генетический подход
Мутагенную активность среды характеризует наличие и
степень проявления генетических изменений, а возможность сохранения этих
генетических изменений в популяциях отражает эффективность функционирования
иммунной системы организмов.
В норме клетка элиминирует и распознает многие
генетические нарушения (например, посредством иммунной системы или за счет
внутриклеточных систем происходит апоптоз клетки). Индикатором стресса является
превышение спонтанного уровня таких нарушений. Генетические изменения
выявляются на различных уровнях: генном, хромосомном и геномном. По этим уровням
выделяют следующие типы мутаций: генные, хромосомные и геномные. Генные, или
точковые, мутации делятся на две группы: вставки или выпадения нуклеотидов,
которые приводят к сдвигу рамки считывания генетического кода и замена
оснований в ДНК. Так же их подразделяют на прямые и обратные (реверсии).
Мутации типа сдвига рамки считывания менее склонны к спонтанным реверсиям, чем
мутации типа замен оснований. Хромосомные аберрации или перестройки - тип
мутаций, при которых происходят различные нарушения структуры хромосом. А
геномными называются такие мутации, при которых происходит изменение количества
хромосом в ядре.
Генетические тесты относительно просты,
высокочувствительны и хорошо воспроизводимы. Они основываются на оценке
изменения хромосом в соматических клетках, например, таких как изменения
кариотипа, хромосомные аберрации, сестринские хроматидные обмены и другие.
Для того чтобы выявить канцерогены и мутагены на
практике применяют краткосрочные генетические тесты.
В качестве канцерогенов идентифицированы относительно
немногие химические вещества. Однако канцерогенная активность в основном
определяется на основании способности вещества вызывать опухоль у лабораторных
животных в результате воздействия их на протяжении жизни. Такие исследования
могут занимать много времени (2 - 3 года), а также требуют
высококвалифицированных специалистов и реактивы, которые находятся в дефиците.
Это стало причиной поиска альтернативных путей выявления химических веществ,
обладающих канцерогенными свойствами. В результате были разработаны
сравнительно недорогие тесты, во многих из которых используют другие
биологические системы вместо цельного организма млекопитающих. Такие тесты
стали называть краткосрочными, так как на проведение таких тестов требуется
меньше времени, чем для классических долгосрочных исследований на грызунах.
Известно, что причиной значительной доли заболеваний у
человека являются генетические дефекты. Но еще неизвестно, в какой степени
химические вещества, присутствующие в окружающей среде обусловливают генетические
болезни. Это неудивительно, так как вероятность опасности для здоровья
определяется только на протяжении жизни, по меньшей мере, одного поколения.
Почти все краткосрочные тесты позволяют получить
результаты максимум в течение нескольких недель. Многие из них проводят на
специальных экспериментальных биологических системах, не используя целостные
живые организмы (то есть in vitro). Так же они демонстрируют на основе
хромосомных нарушений, генных мутаций или повреждения ДНК, при этом многие из
них являются тестами. В таких тестах применяется очень широкий спектр
организмов от бактерий и дрожжей до насекомых, растений и культивируемых клеток
млекопитающих.
Существуют также краткосрочные тесты, в которых
лабораторные животные подвергаются воздействию изучаемого химического вещества
на протяжении определенного времени: от нескольких часов до нескольких недель.
Хотя в литературе описано более ста тест - систем для
исследования генотоксичности, на деле же регулярно применяются менее 20 из них,
а некоторые вообще доступны только в специализированных лабораториях [Мелехова,
2007].
Биофизический подход
Биофизические методы контроля качества среды всегда
основываются на инструментальном определении нарушений биохимических и
биофизических процессов тестируемых организмов. Одни из таких процессов
позволяют регистрировать способность к генерированию электрических потенциалов,
другие же оценивают показатели электропроводности тканей, третьи - изменения
функций мембранных структур клеток и т.д.
Биохимический подход
По результату биохимических реакций, уровню
ферментативной активности и накоплению установленных продуктов обмена можно
оценить критическое воздействие среды. В ответ на стрессовое воздействие нужную
информацию могут дать некоторые показатели основных биохимических процессов
(например, концентрации хлорофилла у фотосинтезирующих растений), структуры ДНК
в результате биохимических реакций (например, при оксидантном стрессе) и
изменения содержания в организме определенных биохимических соединений
(например, терпеноидов) [Мелехова, 2007].
Иммунологический подход
Цитогенетический подход характеризирует эффективность
иммунной системы организма в отношении элиминации клеток с генетическими
нарушениями. Для его дополнения используют развернутую оценку изменений
иммунореактивности животного, а так же исследуют параметры иммунитета
(например, состав крови и гемолимфы, наличие антител в жидкостях организма,
концентрации белков плазмы).
Изучение изменений врожденного и приобретенного
иммунитета у животных (позвоночных и беспозвоночных) во время оценки состояния
окружающей среды является сутью иммунологического подхода. Для этого критерием
состояния служат параметры иммунитета животных, их популяций и сообществ
экосистем при техногенном воздействии и в нормальных условиях [Мелехова, 2007].
1.2 Методы биотестирования
В биотестировании применяется множество различных
методов. Некоторые из них мы рассмотрим ниже.
Метод индивидуальных линий парамеций
Этот метод применяется для определения острой
летальной токсичности воды. Основан он на определении количества погибших или
обездвиженных особей после размещения в тестируемой воде или вытяжке. Признаком
острой летальной токсичности этого теста является обездвиживание или гибель 50%
и больше особей за 1 час в тестируемой воде в сравнении с их исходным
количеством. В качестве тест - объектов используют специальную лабораторную
монокультуру Paramecium caudatum Ehrenberg (то есть одноклеточные организмы
размером 180 - 300 мкм). Питаются они мелкими жгутиконосцами, водорослями и
бактериями. Для выращивания культуру парамеций используют водопроводную воду
без содержания свободного хлора (то есть дехлорированную). В эту воду добавляют
пастеризованное молоко, разбавленное в 20 раз такой же водой. В основном
культуру инфузорий пересевают только один раз в месяц, но при необходимости
пересев проводят один раз в три недели. Для кормления инфузорий используют
молоко, разбавленное в 20 раз водопроводной дехлорированной водой. Кормят
культуру каждый день. Оптимальная температурой для содержания культуры
парамеций является температура 24-28°С. Культуру можно оставлять при комнатной
температуре. Так же ее содержат в темноте, чтобы не развивались водоросли
[Галицкая,2011].
Этот метод применяется для определения острой
токсичности поверхностных, пресных, грунтовых, питьевых и сточных вод.
Метод оценки токсичности воды с использованием
параметров хемилюминесценции
Метод основан на определении параметров индуцированной
хемилюминесценции (ХЛ) воды или водных экстрактов донных осадков в системе
перекись водорода - люминол в ТРИС-Н1 буфере (pH = 7,4).
Хемилюминесценция - это свечение тел, которое вызвано
химическим воздействием (например, свечение фосфора при медленном окислении),
или при протекании химической реакции (например, каталитические реакции
некоторых эфиров щавелевой кислоты с пероксидом водорода в присутствии
люминофора). Хемилюминесценция связана с тепловыделяющими химическими
процессами. Возникает она в результате рекомбинации образующихся в системе
свободных радикалов - химически и биологически активных соединений, являющихся
продуктами одноэлектронных (свободнорадикальных) окислительно-восстановительных
реакций. Соединение-индуктор вводится в систему, чтобы придать протекающим в
ней свободнорадикальным реакциям цепной или лавинообразный характер и тем самым
спровоцировать так называемую медленную вспышку хемилюминесценции. Оценка
токсичности ведется по интегральному параметру, представляющему собой среднее
арифметическое из всех отклонений исследуемых параметров ХЛ опытной пробы от
соответствующих параметров контрольной пробы, независимо от знака отклонения
[Корпакова, 2007].
Метод предназначен для контроля качества окружающей
среды, экспресс - оценки содержания токсических веществ в биологических
жидкостях и выявления неблагоприятной экологической ситуации.
Метод оценки токсичности по изменению люминесценции
светящихся бактерий
Биотесты микробиосенсор В17-677F (на основе светящихся
лиофилизированных бактерий Photobacterium phosphoreum из коллекции культур
ИБСО) и микробиосенсор ЕСК (на основе генетически модифицированного штама E.
coli Z905, несущего плазмиду PHL1 с lux-геном из Photobacterium leiognathi)
разработаны в институте биофизики СО РАН. Биотесты являются стандартными тест -
объектами для измерения интегральной токсичности исследуемых водных образцов,
исключают потребность культивирования и поддержания бактериальных культур с
маркерным lux-геном.
Отобранные пробы воды хранят при 40°С, затем
анализируют с их предварительной фильтрацией и без нее. К клеточной суспензии,
содержащей 109-1010 клеток/мл (в 3% растворе хлорида натрия), добавляются
растворы с определенной концентрацией токсикантов. Интенсивность бактериальной
люминесценции измеряется с использованием стандартной методики с помощью
биолюминометра, который создан в Институте биофизики.
Токсичность образца оценивается по величине
биолюминесцентного индекса, который рассчитывается по формуле (1):
БИ=(Io/Ik) или БИ=(Io/Ik)100%,(1)
где БИ - остаточная относительная активность
люминесценции,o - интенсивность свечения бактерий в опытном кювете,k
- интенсивность люминесценции бактерий в контрольном кювете.
«Норма» БИ = 0,8 - 1,2 отн. Ед. или 80 -120 %
[Родичева, 2004].
Применяется данный метод для оценки загрязнения
природных водных источников, промышленных стоков и почв.
Метод биотестирования с помощью Daphnia magna
В качестве тест - объектов используются лабораторные
монокультуры рачков - фильтраторов Daphnia magna Str. Daphnia magna Str
является стандартной тест - объектом в водной токсикологии [Зерщикова, 2004].
Дафнии относятся к роду ветвистоухие рачки. Рачок
овальной формы, передвигается в воде скачками при помощи антенн, которые
развитых несоразмерно с телом. Само тело неявно сегментировано на головной,
грудной и брюшной отделы и сжато с боков. Самки крупнее самцов в 2 - 2,5 раза.
Снаружи туловище покрывает прозрачный двустворчатый хитиновый панцирь, который
состоит из двух слоев и несет защитную функцию туловища вместе с 5 парами
конечностей. В пространстве между верхней и верхнебоковой стенками раковины и
спиной туловища образуется выводковую камеру. В этой камере вынашиваются яйца,
а также протекает их эмбриональное развитие. В основном дафнии отлавливают в
теплое время года. В осеннее время можно собрать эфиппии в больших количествах
на поверхности воды, из которых можно выводить культуру. Но в этом случае,
невозможно заранее предугадать какие именно виды, будут преобладать.
Оптимальные условия для дафний: свет 14 - 16 часов в
день, pH = 7,2 - 8,0, температура 20 - 24°С, слабая аэрация. При содержании
дафний в лабораторных условиях их ежедневно подкармливают хлореллой (200 тыс.
клеток/мл) или пекарскими дрожжами (2мл суспензии на 1 л воды). В нормальных
условиях вода должна быть слабо-зеленого или слабо-коричневого цвета, а при
неблагоприятных условиях она обретает коричневый цвет.
В качестве корма также используются хлебопекарные
дрожжи. Для этого 1 г свежих или 0,3 воздушно-сухих дрожжей заливают 100мл
дистиллированной воды. После набухания дрожжей все тщательно перемешивают.
Образовавшуюся суспензию отстаивают в течение 30 минут. Недостаточную жидкость
в пропорциях 3 мл на 1 л воды добавляют в сосуды с дафниями. При средней
плотности тест - культуры 20-30 половозрелых самок в 1 л воды подкармливание
проводят 1 - 2 раза в неделю.
Спустя несколько месяцев культура дафний истощается. В
этом случае рекомендуется устроить им «зимовку» для стимулирования откладки
эфипииев. Достаточно просто уменьшить интенсивность кормежки, а потом и вообще
перестать их подкармливать и немного понизить температуру, чтобы образовалась
масса эфиппиев [Бубнов, 2007].
Дафний для опытов разводят в лабораторных условиях.
Для контроля можно использовать аквариумную воду с постоянной аэрацией, в
которой культивировали рачков. Опыты проводятся в стеклянных сосудах
вместимостью 300 см3. В сосуды помещают по шесть экземпляров 5-6 -
суточных дафний, в трех повторностях на каждый опыт. Токсичность определяют по
гибели 50% дафний и более в опыте по сравнению с контролем согласно шкале
токсичности Н.С. Строганова. В ходе опытов регистрируются такие показатели, как
выживаемость, физиологическое состояние дафний и симптомы гибели [Мичукова,
2006].
Данный метод применяется для определения качества
сточных, природных вод, системы хозяйственно - питьевого водоснабжения, донных
отложений.test
Для проведения мониторинга окружающей среды на
цитогенетическом уровне эксперты Всемирной организации здравоохранения
рекомендуют использовать в качестве стандартного Allium test. В этом тесте
объектом исследования является меристема проростков корешков лука посевного -
Allium cepa сорта Штут-гартен-Ризен.
Луковицы A. cepa помещаются в стаканчики на 25 мл с
тестируемыми растворами. Так же параллельно с этими опытами закладывается
контроль.
Для соответствия современного стандарта по проведению
опытов по этому методу проводят повторность, используя при этом по три луковицы
каждого варианта. Луковицы проращивают в течение четырех дней. Затем срезаются
у каждой луковицы корни под основание донца и проводят оценку токсического и
митозмодифицирующего действия. В первом случае определяют длину корней и
исследуют изменение длины корней, что является показателем токсичности
изучаемого фактора и используется в качестве краткосрочного скрининг - теста.
Методика эксперимента следующая: проращивают луковицы в течение четырех дней,
далее измеряют длину каждого корешка. Затем определяется среднее арифметическое
(X) и ошибка среднего (m) для варианта опыта. После измерений корни фиксируются
в фиксаторе Кларка. Для цитогенетического анализа, согласно методике готовятся
препараты давленых корневых меристем (по 9 препаратов на вариант опыта).
Для определения митозмодифицирующего действия
используют показатели митотического индекса (MI, %). Он определяется как
отношение числа делящихся клеток к общему числу рассмотренных на препарате
клеток. Чтобы вскрыть причины изменения митотической активности, анализируется
продолжительность каждой фазы митоза, и определяются фазные индексы. Фазные
индексы - это отношение количества клеток, находящихся на стадии профазы,
метафазы и так далее, к общему количеству проанализированных митозов.
Обозначаются они следующим образом ПИ, % - профазный индекс; МИ, % - метафазный
и тому подобное. Проводится сравнение долей различных фаз в контрольных и
опытных вариантах.test является экономичным, так как на нем (в отличие от
микроорганизмов) можно регистрировать все типы генетических повреждений:
геномные, хромосомные, генные, а также в свою очередь позволяет выявлять
мутагены (непосредственно повреждающие ДНК) и промутагены (генетически
безопасные факторы, но приобретающие мутагенную активность в процессе
метаболизма в организме) [Песня, 2012].
Данный метод используется для анализа мутагенности, митотоксичности
и токсичности различных факторов. А также для мониторинга окружающей среды.
Методика биотестирования по гибели пресноводных
аквариумных рыб Poecillia Reticulata Peters (гуппи)
В качестве тест - объектов используют мальков гуппи в
возрасте от 24 до 48 ч. Для выведения этих мальков используют рыб не старше 2
лет (продолжительность жизни гуппи 3 - 3,5 года), без каких - либо признаков на
заболевания.
Самцов и самок, использующих в тестировании содержать
в отдельных аквариумах, так как совместное содержание влияет на рост самцов. В
этом случае они будут расти медленнее, чем должны. Половозрелые гуппи имеют
четко развитые половые признаки. Это облегчает их сортировку. Самки достигают
длину до 6 см. Самцы же мельче, длиной примерно 3-4 см. Также самцов и самок
можно различить по их окраске. Самцы более яркие, чем самки, у них преобладают
серовато-коричневые тона с очень яркими красными, голубыми, зелеными и черными
пятнами. Самки же чаще желто-зеленые. Анальный плавник у самок и молодых самцов
округлый. С возрастом, в период полового созревания, анальный плавник самцов
начинает удлиняться и превращается в подвижный гоноподий.
Для содержания производителей используют любые
аквариумы с постоянной температурой воды 25±1°С.
Посадки производят со следующей плотностью: самцы на 1
- 2 дм3 воды на экземпляр, самок - не менее 4 дм3. Перед
тем как разместить рыб аквариумы засаживают растениями без жестких, режущих
кромок. Предпочтение стоит отдать густым мелколистным, плавающим растениям
(например, риччия, сальвиния). В аквариуме должно быть свободное пространство
для плаванья.
Освещаются аквариумы верхним светом не менее 8 ч в
сутки. В качестве источника света можно использовать обычные лампы дневного
света.
Для разведения и содержания производителей используют
только питьевую воду. Ее отстаивают в течение 7 суток, аэрируют, фильтруют, и
затем термостатируют 25±1°С. В такой воде должно содержаться не менее 4 мг/дм3
растворенного кислорода. Один раз в месяц 1/3часть воды меняют на свежую.
Добавлять воду нужно именно той же температуры, что и в аквариуме. При
испарении воды в аквариум добавляют дистиллированную воду. Корм рыбам дают в
таком количестве, чтобы они могли съесть все без остатка за 3 - 5 минут.
Для получения мальков для тестирования, самок и самцов
помещают в один аквариум. Гуппи относятся к рыбам с внутренним развитием икры,
которые способны к нересту полностью оформившихся мальков.
По темному пятну перед анальным плавником самки можно
определить ее готовность к нересту. При этом форма брюшка становиться похоже на
прямоугольник и становится намного шире спины.
Самку, готовую к нересту, помещают в отдельную
посудину для нереста, вместимостью не менее 4 дм3 и содержащую
большое количество мелколистных растений. Нерестовые посудины наполняют водой
такого же качества, как и для содержания производителей с постоянной
температурой 25±1°С.
Самки поедают своих мальков, поэтому их следуют
удалять после нереста. Для кормления мальков используют специальную «пыль», в
состав которой входит: эвглена, молоди ветвистоусых рачков, инфузории,
коловратки и личинки веслоногих рачков. Если такая «пыль» отсутствует, то можно
их кормить перетертой сухой дафнией, а также любым другим сухим кормом. На 100
рыб такого корма необходимо не более 1 грамма в сутки. С ростом рыб, в их рацион
вводятся резаный трубочник, мотыль, коретра и другие живые корма. Одно- и
двухдневных мальков кормят по 5 раз в день, более взрослых 2-3 раза.
Для избегания неравномерности развития мальков их
сортируют и постепенно переводят из нерестовых посудин в аквариумы вместимостью
50дм3, а далее 200 дм3. Воду в аквариумы заливают такую
же, как и для производителей гуппи.
Тестируемые организмы (возрастом 1 - 2 суток) перед
постановкой экспериментов проверяют на пригодность для биотестирования. Для
этого устанавливают среднюю летальную концентрацию раствора эталонного вещества
C2Cr2O7 за 24 часа биотестирования (ЛК50
за 24ч). Готовят C2Cr2O7 известный
концентрацией 10 мг/дм3, используя при этом дистиллированную воду.
Далее из исходного раствора готовят серию растворов с концентрациями C2Cr2O7
от 100 до 200 мг/дм3 с интервалом 25 мг/дм3, используя
культивационную воду.
Биотестирование этих растворов проводят
продолжительностью 24 часа в соответствии со следующими операциями:
.Разбавленная проба воды или водной вытяжки, буровых
растворов и растворы с различными концентрациями вещества (смеси веществ)
готовят прибавлением определенного объема анализируемой пробы в дехлорированную
питьевую воду.
.Приготовленные пробы воды или водной вытяжки, буровых
растворов и растворы с различными концентрациями вещества (смеси веществ)
наливают в сосуды по 5 дм3, то есть закладывают опыт. Другие сосуды
наполняют таким же образом дехлорированной питьевой водой для контроля.
Повторность опытов и в контроле трехкратная.
.В каждый из опытных и контрольных сосудов помещают по
10 экземпляров гуппи в возрасте от 24 до 48 ч.
.Продолжительность биотестирования составляет 96 ч. Во
время биотестирования рыб не кормят.
.Ежедневно подсчитывается количество живых рыб, и
удаляются погибшие особи. Погибшими считают рыб, которые не подают признаков
движения и дыхания при прикосновении к ним стеклянной палочки.
Полученные результаты заносят в таблицу и строят
график зависимости «% погибших рыб - время». По графику находят ЛТ50
для C2Cr2O7.
На основании полученных результатов рассчитывают ЛК50
за 24 ч для C2Cr2O7. Если полученная величина
ЛК50 для C2Cr2O7 за 24 ч находится
в экспериментально установленном диапазоне реагирования тест - объектов 106 -
175 мг/дм3, гуппи пригодны для биотестирования. Если ЛК50
за 24 ч для C2Cr2O7 не находится в указанном
диапазоне реагирования, то проверяют условия культивирования тест - объектов,
чтобы выяснить причины ухудшения состояния культуры.
Методика основана на установлении разницы между
количеством погибших рыб в контрольной воде и воде с токсичными веществами, что
и является критерием острой летальной токсичности. Гибель рыб 50% или более в
опыте по сравнению с контролем в течение 96 ч [Бубнов, 2007].
Метод применяется для установления токсичности
подземных, поверхностных и сточных вод, буровых растворов, донных отложений,
водных растворов отдельных веществ и их смесей.
1.3 Место биотестирования на
молекулярно - генетическом уровне
Этот метод не самый популярный, но используется для
оценки качества окружающей среды. Например, для оценки степени токсического
загрязнения среды наряду с широко распространенными методами химического
анализа активно используются и методы биотестирования. А использование Daphnia
magna и вовсе является обязательным в России при установлении ПДК отдельных
веществ в воде рыбохозяйственных водоемах [Хмырева, 2010].
Так же методы биотестирования охватывают почву, водные
объекты, нижние слои атмосферы. Специалисты разных областей науки используют
методы биотестирования. Например, в сельском хозяйстве для быстрого
тестирования кормов на токсичность, в гуманитарной и ветеринарной медицине для
исследования свойств внутренних сред высших организмов, в экологической
токсикологии для анализа вод и почв и так далее [Терехова, 2011]. С помощью
методов биотестирования, которые в основном разработаны для природных, питьевых
и сточных вод, можно осуществлять интегральную оценку качества почв. В качестве
наиболее распространенных тест - объектов используют пресноводных рачков
Daphnia magna, инфузорий, микробные биосенсоры, и другие. Из-за специфического
содержания тест - культур, не все методы биотестирования можно использовать в
качестве оперативных.
Также методы биотестирования используются для
понимания и изучения биологических процессов человека, которые могут быть
связаны с его заболеваниями. Например, такие как врожденный иммунный ответ,
продолжительность жизни, васкулогенез, обучение и память, циркадные ритмы,
регуляция роста и так далее [Юрченко и другие, 2015].
Глава 2.
Методика экспериментов
Для изучения различных этапов работы с Drosophila
melanogaster выполнялись модельные эксперименты с различными продуктами
питания. Для экспериментов использовали дрозофил линии vestigial (vg), культивируемые при средней температуре равной 23ºС в течении длительного времени на
кафедре зоологии и экологии ВоГУ. Мухи выращивались на среде, состоящей из
агар-агара, манной крупы, сахара и дрожжей. Срок развития составлял в среднем 9
дней.
Для изучения путей, приводящих к повышению
эффективности культивирования Drosophila melanogaster, использовали
классический биологический эксперимент.
Опыт культивирования дрозофил в течение двух лет
показал, что культуру часто поражают плесневые грибы. Для изучения
закономерностей их появления и разработки метода борьбы изучались факты
поражения среды плесневыми грибами. С этой целью фиксировалось степень
поражения субстрата на пятый день.
Поскольку существует мнение, что культура заражается
плесневыми грибами с помощью мух, был проведен эксперимент по их стерилизации.
Стерилизация - процесс уничтожения всех видов микроорганизмов, включая грибы, с
помощью химического или физического воздействия. Суть эксперимента заключалась
в следующем: мух пересаживали на соду.
Поскольку определенную трудность составляет, пересадка
мух на субстрат изучались способы иммобилизации тест - объекта с минимальной
смертностью. Рассмотрены следующие методы: пересадка пупарий на субстрат и
уменьшение активности мух при помощи понижения температуры.
В ходе экспериментов наблюдалось появление плесневых
грибов, а также смертность мух от пониженных температур. В первом случае
эмпирически определялось проективное покрытие субстрата плесневыми грибами. А
во втором эксперименте, мы пересаживали мух в чашки Петри и помешали их в
холодильник и морозильную камеру. В каждой чашке было по 10 мух. Всего было
заложено 10 опытных образцов. Через каждую минуту доставали по одной чашки
Петри (остальные оставались в холодильнике и морозильной камере при
температуре: +1ºС и -15ºС). Спустя две минуты производился
подсчет выживших мух.
Для экспериментов мы использовали следующие
оборудование: холодильник, морозильную камеру, чашки Петри, секундомер, уличный
термометр.
Поддержание линий дрозофилы
Для поддержания линии получали ряд последовательных
поколений, сохраняя их гомозиготность. Засорения можно избежать путём
постоянного контроля и оценки чистоты линии при каждой пересадки мух,
используемых для дальнейшего размножения.
Оптимальной считается среда не более 1-2 дней
приготовления. Использование более «старой» среды не целесообразно. При
проведении опытов по скрещиванию самцы находились вместе с самками около 4-5
суток. После этого, во избежание перенаселения, родительское поколение удаляли
из баночки [Козак, 2007].
Культуру держали при температуре
24 - 25ºС,
поскольку при этой температуре цикл развития равен приблизительно 10 суткам.
Для поддержания линий некоторыми авторами рекомендуется температура 20ºС (цикл примерно будет равен 12 - 15
дней). При температуре 27ºС цикл развития сокращается до 9 суток. С понижением
температуры цикл развития сильно замедляется [Медведев, 1968].
Приготовление питательной среды
Основными компонентами использованной среды для
культивирования являются сахар, дрожжи, манная крупа, вода и агар-агар (табл.
1) [Медведев, 1968].
Таблица 1 - Состав питательной среды для дрозофилы (в
расчёте на определённое количество бутылок)
|
Количество бутылок
|
5
|
10
|
20
|
30
|
40
|
50
|
60
|
70
|
80
|
|
Вода
|
100
|
200
|
300
|
400
|
500
|
600
|
700
|
800
|
900
|
|
Агар
|
1,2
|
2,5
|
3,8
|
5,1
|
6,4
|
7,7
|
9,0
|
10,2
|
11,5
|
|
Дрожжи
|
11,5
|
21,4
|
32
|
43
|
54
|
64
|
75
|
86
|
94
|
|
Манная крупа
|
4
|
7
|
11
|
14
|
18
|
21
|
25
|
29
|
32
|
|
Сахар
|
4
|
7
|
11
|
14
|
18
|
21
|
25
|
29
|
32
|
На технических весах взвешивали все составные части
среды. К навеске агар-агара добавляли соответствующее количество холодной воды
и дрожжи, периодически помешивая, доводили до кипения. Варили среду в
стеклянной колбе, поскольку в эмалированной посуде она, как правило, пригорает.
По истечении 30-минутного кипения добавляли сахарный
песок и манную крупу и постоянно помешивали, чтобы избежать образования
сгустков манной крупы. Кипятили 15 минут.
После окончания варки среду охлаждали до 60-70ºС и разливали в специальные баночки,
которые заранее стерилизовали в жарочном шкафу. Разливали среду так, чтобы она
не попадала на стенки. Баночки закрывали стерильными ватными пробками. Такая
среда пригодна для использования в течение двух-трех дней при условии хранения
её в холодильнике.
Глава 3.
Характеристика Drosophila melanogaster как модельного биологического объекта
.1 История использования дрозофилы
как модельного объекта в биологических исследованиях
На протяжении столетий Drosophila melanogaster занимает центральное место в
генетических исследованиях и является главным модельным объектом в
экспериментальной биологии. В сущности, история открытий на дрозофиле
показывает этапы становления генетики. Безусловно, генетика конечной целью
своего применения видит человека, но в силу этических и биологических ограничений,
человек не может рассматриваться как объект генетических экспериментов [Юрченко
и другие, 2015].
К 1913 году Т.Х. Морган выявил уже целый ряд различных
мутаций дрозофилы, которые приводили к изменению морфологии крыла и окраски
глаз. Эти мутации также были сцеплены с полом. Далее, продолжая свои
исследования, Т.Х. Морган задумался о причинах того, что некоторые гены
наследовались реже, чем того следовало ожидать. Он предположил, что хромосомы,
которые собраны в пары, могут расщепляться и обмениваться своими участками,
генами. Этот процесс был назван кроссинговером. В последствие на основе этого
выдвинули, а затем подтвердили предположение о линейном расположении генов в
хромосомном материале. А расстояние между генами было условлено измерять с
помощью условных единиц, которые в последствие были именуемы от фамилии ученого
- морганидами.
Работа Т.Х. Моргана и его сотрудников позволила
увязать в единое целое данные цитологии и генетики, а также позволила создать
хромосомную теорию наследственности.
За это открытие в 1933 году Т.Х. Морган был награжден
Нобелевской премией по медицине и стал первым ученым-генетиком, который получил
эту премию. А благодаря своему взносу в работу Моргана, дрозофила стала
экспериментальной моделью [Юрченко и другие, 2015].
В 1926 году ученый Герман Джозеф Мёллер, ученик Т.Х.
Моргана, провел ряд опытов по воздействию рентгеновского излучения на живые
организмы. В качестве модельного объекта снова выступила дрозофила. В
результате своих исследованиях он выявил четкую взаимосвязь между дозой
радиационного облучения и количеством летальных мутаций в популяции дрозофил. С
этими данными в 1927 году Г.Д. Мёллер выступил на V международном Генетическом
Конгрессе в Берлине. В 1928 году результаты его исследований были подтверждены
на осах и кукурузе, а 1946 году за свои работы в области мутагенного действия
рентгеновских лучей Г.Д. Мёллер была присуждена Нобелевская премия по
физиологии и медицине [Юрченко и другие, 2015].
С дрозофилой работал и русский ученый Феодосий
Григорьевич Добржанский, она являлась генетическим объектом в его
исследованиях. В свое время он стажировался в лаборатории Т.Х. Моргана. Ф. Г.
Добржанский смог установить генетические основы полиморфизма популяций
дрозофилы - подразделяя их на репродуктивно изолированные (не способные
скрещиваться друг с другом) группы. Ф.Г. Добржанский показал, что преимущества
разных рас дрозофилы проявляются при разных условиях, определяемых, например,
временем года, характером доступной пищи, температурой окружающей среды,
высотой над уровнем моря. Совместно с Д.М. Смитом он определял скорость
естественного отбора в природных, а затем и в экспериментальных популяциях.
Исследования Ф.Г. Добржанского создали предпосылки для объяснения механизма
формирования новых рас и видов и позволили построить синтетическую теорию
эволюции [Захаров, 2010].
В 1917 г. Николаем Константиновичем Кольцовым была
организована лаборатория генетики на базе Института экспериментальной биологии,
в которой с 1921-1929 гг. работал Сергей Сергеевич Четвериков. В 1925 - 1926
годах проводилось первое в мире широкомасштабное экспериментальное исследование
насыщенности природных популяций дрозофилы наследственными изменениями -
мутациями. Вместе с С.С. Четвериковым участвовала его жена А.И. Четверикова и
10 его ближайших учеников и сотрудников, которые входили в состав лаборатории
генетики: Н.К. Беляев, Б.Л. Астауров, С.М. Гершензон, Е.И. Балкашина, Е.А.
Тимофеева - Ресовская, Н.В. Тимофеев - Ресовский, С.Р. Царапкин, А.Н. Промптов,
Д.Д. Ромашов, П.Ф. Рокицкий [Бабков, 1985; Фандо, 2005]. В 1922 году С.С.
Четвериков с успехом провел свои исследования. Эксперименты были проведены на
местных и привезенных Г.Д. Мёллером видах дрозофилы. В 1926 г. публикуют
основополагающую статью ученого «О некоторых моментах эволюционного процесса с
точки зрения современной генетики», которая положила начало популяционной
генетике. С.С. Четвериков доказал, что мутации в природных популяциях животных
не исчезают, могут накапливаться в гетерозиготном состоянии и давать материал
для изменчивости и естественного отбора. В этой статье ученому удалось связать
учение Дарвина и законы наследственности, установленные генетикой. Сходные
работы в этой области были выполнены зарубежными исследователями - англичанами
Р. Э. Фишером и Дж. Холдейном и американцем С. Райтом в 1930-е гг.
Исследования в области популяционной генетике,
заложенные С.С. Четвериковым в Кольцовском институте, были продолжены под
руководством Николая Петровича Дубинина. Им были организованы и выполнены
экспериментальные и теоретические работы в области популяционной генетики. Был
проведен ряд экспериментов, в которых было показано наличие в популяциях
дрозофил генетического груза - летальных и сублетальных мутаций. Вместе с А.С.
Серебровским в работах по ступенчатому аллеломорфизму гена scute были показаны «делимость» гена и
явление комплементарности. Он опубликовал ряд важных научных работ по структуре
и функциям хромосом, среди которых работы Н.П. Дубинина и В.В. Хвостовой по
цитологическому анализу эффекта положения на уникальной модели cubitus interruptus D. melanogaster.
В 1957 году Н.П. Дубинин является основателем, а также
назначен и избран директором - организатором Института цитологии и генетики
Сибирского отделения АН СССР в Новосибирске (Этот институт положил начало
возрождению генетики в СССР, в нем были заложены и получили свое развитие
многие направления генетики). ИЦиГ СО РАН и в настоящее время остается самым
крупным академическим институтом биологического профиля.
В 1959 году Н.П. Дубинин был снят с должности
директора ИЦиГ СО АН СССР, но в 1966 году ему представилась возможность
основывать еще один институт - Институт общей генетики АН СССР. В этот институт
он пригласил ряд видных генетиков - Р.П. Мартынову, А.Н. Луткову, Ю.П. Мирюту и
в их числе и генетиков, занимающихся дрозофилами - З.С. Никоро и Ю.Я. Керкиса.
В последующие годы по приглашению директора ИЦиГ СО АН СССР Д.К. Беляева в
институт приехали В.В. Хвостова и Р.Л. Берг. Р.Л. Берг организовала в
Новосибирске лабораторию генетики популяций [Колосова и другие, 2003]. При
исследовании природных популяций D. melanogaster Р.Л. Берг и другими представителями
советской школы популяционной генетики было показано, что мутационный процесс в
них не равномерен. В природных популяциях D. melanogaster были
обнаружены периоды вспышек мутабильности и повышенной концентрации по ряду
сцепленных с полом генов yellow,
white и singed в динамики частоты видимых мутаций и мутационного
процесса в течение длительного периода времени. А выделяемые при этом аллели
этих генов были не стабильны, что указывало на их инсерционную природу [Берг и
др., 1941; Грешензон, 1941; Дусеева, 1948; Берг, 1961; Иванов, Голубовский,
1977; Захаров, Голубовский, 1985; Голубовский и другие, 1987].
При исследованиях на дрозофиле впервые был обнаружен
ряд важных результатов о природе наследования генов и генетических феноменов.
Например, такие как эффект положения генов, дозовая компенсация, мобильные
генетические элементы или транспозоны, тандемные дупликации и неравный
кроссинговер, клонирование гена white
и другие.
В 1970-х гг. с самого начала внедрения рекомбинативной
ДНК, одной из первых была клонирована и охарактеризована ДНК дрозофилы. В
исследованиях была показана прямая связь между мутантным фенотипом и
молекулярными повреждениями в геноме у многоклеточного организма.
В ходе исследований с использованием дрозофилы в
течение нескольких десятилетий продолжили путь к пониманию центральных
регуляторных механизмов, которые лежат в основе развития животных. Во время
исследований был выявлен ряд сигнальных систем, таких как Notch, Wnt и hedgehog. Нарушения, в которых приводит в настоящее время к возникновению широко
распространенных человеческих болезней, в перечень которых входят сердечно -
сосудистые, онкологические и неврологические расстройства.
В 1995 году Э. Льюис, Э. Вишаус и К. Нюсляйн -
Фольхард за открытие генетического контроля эмбрионального развития получили
Нобелевскую премию по физиологии и медицине.
Работы Э. Льюиса в области генетики развития были
выполнены на Drosophila melanogaster и заложили основание современному
пониманию универсальных эволюционно закрепленных правил, которые контролируют
развитие животного организма.
Э. Вишаус так же проводил свои исследования на
дрозофиле. Его работа была сфокусирована на изменениях, происходящих на ранних
этапах развития в эмбрионе [Юрченко и другие, 2015].
Ричард Эксел и его коллеги изучили функции генов,
отвечающих за восприятие вкуса у плодовой мушки. Они продолжили исследования
молекулярных биологов из Йельского университета Питера Клайна и Джона Карлсона,
идентифицировавших комплекс генов под общим названием GR, которые отвечают за
формирование вкусовых рецепторов дрозофил: кодируемые ими белки присутствуют
преимущественно в хоботках, ножках и усиках насекомых. Было обнаружено большое
сходство между GR и обонятельными генами дрозофилы, что позволяет предположить,
что у отдаленных предков мух за распознавание вкуса и запаха отвечали одни и те
же гены, и лишь в процессе эволюции постепенно произошло их разделение на
"вкусовые" и "обонятельные".
По мнению исследователей, дальнейшее изучение белков,
отвечающих за распознавание вкуса и запаха, может привести к революции в
сельском хозяйстве: можно будет создавать экологически чистые препараты,
способные сделать сельскохозяйственные культуры невкусными или дурно пахнущими
для насекомых-вредителей [Axel,
2001].
Так же имеется информация, что культуру дрозофил
используют для исследований в космосе. На них исследуют влияние невесомости и
условий космоса на иммунитет. Так, к примеру, дрозофилы, которые в течение
нескольких дней жили на борту шаттла «Дискавери», оказались уязвимы для грибков
- паразитов. В рамках эксперимента мух после полетов, заразили спорами
паразитических грибов и болезнетворными бактериями. Результаты этих опытов
позволили предположить, что гравитация напрямую влияет на работу Toll-рецепторов,
которые отвечают за иммунную реакцию в случае взаимодействия с грибками [Жизнь
в космосе сделала мушек уязвимыми для заражения плесневыми грибками, 2014]
Также был проведен другой эксперимент в космосе.
Космонавты, которые работали на космической станции, выяснили, что дрозофилы в
космических условиях размножаются лучше, чем на Земле. Ученые планируют изучить
изменения, которые возникли в их белках, особенно в белках клеточного скелета,
и оценить реакцию на стресс. А также проанализировать активность генов в
космосе в сравнении с активностью генов контрольной группы мух на Земле и
изучить влияние космической радиации на живые объекты в космосе [Маркина,
2014].
.2 Особенности Drosophila
melanogaster как тест - объекта
Drosophila melanogaster, так же имеет название
плодовая, банановая, уксусная муха. Класс Insecta, отряд Diptera, семейство
Drosophilidae. В природе обитает «дикий тип» дрозофилы (нормальный). Наиболее
часто используется в генетических экспериментах. В современной научной
литературе по биологии она часто упоминается как просто «дрозофила» или
«плодовая мушка». Насекомое было причислено к роду Drosophila морфологически,
тогда как современные генетические исследования относят её к роду Sophophora
[Для сохранения дрозофилы…, 2009].
У дрозофилы жёлто - коричневая окраска с поперечными
черными кольцами поперёк живота и красные глаза (рис. 1). Половой диморфизм
выражен ярко: самцы заметно меньше самок, а также их задняя часть тела темнее.
Самки в длину около 2,5 мм, для неопытного человека, пытающегося различить
самцов и самок с применением микроскопа, возможно, наиболее отличительной
отметкой будет, является группа остроконечных волос, которые окружают анус и
гениталии самца.

Рисунок 1 - Внешний вид D. Melanogaster
У дрозофилы жизненный цикл зависит от температуры. При
температуре равной 25 °C цикл составляет 10 дней, а при 18 °C - примерно в два
раза больше. Самки откладывают яйца в загнивающий фрукт или другой органический
материал. В среднем одна самка откладывает около 400 яиц (эмбрионов), каждое из
которых около 0,5 мм в длину (рис. 2). Через 24 часа яйца раскрываются.
Вылупившиеся из них личинки растут на протяжении 5 дней, при этом они дважды
линяют за это время: через 24 и 48 часов после рождения (рис. 3). Личинки
питаются микроорганизмами, которые разлагают фрукт, а также и самим сахаром,
содержащиеся во фрукте. Потом личинки закупориваются в пупарий и претерпевают
пятидневную стадию метаморфоза, в результате которого возникают взрослые особи
(рис.4).

Рисунок 2 - Яйцо D. Melanogaster

Рисунок 3 - Личинка D. melanogaster
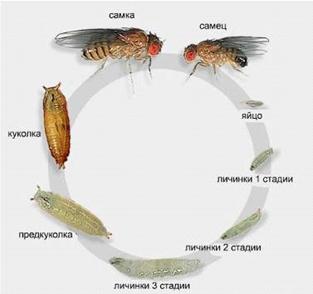
Рисунок 4 - Жизненный цикл D. melanogaster
Первое спаривание у самки может произойти не ранее чем
через 12 часов после появления из кокона. Самки сохраняют сперму от самцов, с
которыми они спариваются, для использования ее позже. Именно муху женского пола
нужно отобрать до её первого спаривания (то есть девственную самку) и
убедиться, что она спаривается только с конкретным самцом, которым выбран для
эксперимента. Оплодотворённая самка может быть «возвращена в девственницы»
путём длительной инкубации при температуре 10 °C. Эта температура убивает
сперму дрозофилы.
Геном D. Melanogaster содержит 4 пары хромосом: X/Y
пара и три аутосомы, маркируемых как 2, 3 и 4. Четвёртая хромосома точковидная
и в ряде исследований её не принимают во внимание; X (или первая), 2 и 3-я
хромосомы - метацентрические. Геном состоит из порядка 132 миллионов оснований
и приблизительно 13 767 генов. В настоящее время геном секвенирован и
аннотирован.
Кариотип: 8 хромосом (2n) [Rasch
и другие,1971].
Геном: 0,18 (0,12-0,21) пг [Detailed Record for Drosophila melanogaster].
Дрозофилам свойственно XY-определение пола. Важной и
отличительной чертой механизма определения пола дрозофил от человека является
то, что на пол влияет не наличие Y-хромосомы, а отношение числа Х-хромосом к
числу аутосом. В дальнейшем, имеется в виду гаплоидный набор аутосом (n=4).
Если отношение равно 1, то особь развивается в самку, а если равно 1/2 - в
самца. При нарушениях образуются бесплодные особи. Если отношение X-хромосом к
аутосомам промежуточное между единицей и 1/2, то это интерсексы, если отношение
меньше 1/2, то это суперсамцы, а при отношении больше 1 образуются суперсамки.
Наличие Y-хромосомы никак не влияет на пол, но в ней находятся гены,
ответственные за сперматогенез. Поэтому самцы без нее стерильны (табл. 2).
Таблица 2- Хромосомное определение пола D.
melanogaster
|
Число X-хромосом
|
Число аутосом в гаплоидном
наборе
|
Отношение числа X-хромосом
к числу аутосом
|
Пол (фенотип)
|
|
3
|
2
|
1,5
|
Суперсамка
|
|
2
|
2
|
1
|
Самка
|
|
2
|
3
|
0,(6)
|
Интерсекс
|
|
1
|
2
|
0,5
|
Самец
|
|
1
|
3
|
0,(3)
|
Суперсамец
|
В 1971 году Рон Конопка и Сеймур Бенцер опубликовали
работу, озаглавленную «Clock mutants of Drosophila melanogaster». В этой работе
были описаны первые мутации, влияющие на поведение дрозофилы. В природных
условиях мушки демонстрируют активный ритм с периодом примерно 24 часа. Учёные
нашли мутантов с более быстрыми и более медленными испорченными ритмами жизни -
мушек, которые двигались и отдыхали в произвольные интервалы времени.
Исследования на протяжении 30 лет показали, что эти мутации (и другие похожие)
затрагивают группу генов и их производные, отвечающие за биохимические или
молекулярные часы.
.3 Питательные среды для поддержания
линий дрозофил
Помимо использованной нами (смотри главу 2) существуют
и другие рецепты питательной среды для дрозофилы. Некоторые из них мы рассмотрим
ниже.
. Питательная среда Харвея Петерсона.
В стандартном контейнере Deli (название марки
контейнера) или в стаканчике на 24 или 32 унции (1 унция равна 29,56 мл.)
смешиваются следующие ингредиенты:
· 1/2 чашки теплой воды;
· 1/2 столовая ложка сахара;
· 1 столовая ложка сухого молока;
· 4 - 6 столовых ложек растворимого
картофельного пюре;
· 5 - 15 гранул пекарских дрожжей.
Сначала нужно растворить сахар в теплой воде и
добавить в него сухое молоко. Затем все тщательно перемешать и добавить
картофельное пюре. Количество добавляемого пюре зависит от уровня влажности, в
которой будет находиться культура и от ее вентиляции. Если добавить
недостаточное количество картофельного пюре, то среда будет влажной. А если
добавить слишком много, то среды подсохнет. В первом случае влажность помешает
доставанию мух и контейнера, а во втором случае мухи не смогут нормально
размножаться. После добавления картофельного пюре нужно хорошо перемешать
картошку с другими ингредиентами. Дать отстояться несколько минут до застывания
и посыпать все дрожжами. Далее поместить на среду 25- 50 плодовых мух. Этот
метод хорош для приготовления большого количества питательной среды.
Сначала нужно вскипятить:
· 1 раздавленный банан;
· 1/2 банок концентрата грейпфрутового
сока;
· 14 унций яблочного пюре (около 400
мл);
· 1/8 чашки черной патоки.
Нужно остудить вскипяченную смесь до терпимой
температуры и вылить 6 ложек в контейнер. Добавить в этот контейнер 6 столовых
ложек сухой смеси, которую готовят следующим способом: смешивают 1 чашку
растворимого картофельного пюре и 1/2 чашку пивных дрожжей. Далее добавляют 2-4
столовые ложки водно-уксусной смеси (1 чашка воды смешивается с 1 чашкой
уксуса) и все хорошо перемешивается. Количество добавления водно-уксусной смеси
зависит от влажности места, в котором находится культура, а также от вентиляции
контейнеров. После того как смесь застынет на нее помешают 25-50 плодовых мушек
[Edmonds, 2007].
3.4 Метод учёта частоты доминантных летальных мутаций
у Drosophila melanogaster
Метод учёта частоты доминантных летальных мутаций у
Drosophila melanogaster - это генетический тест, позволяющий установить
мутагенен ли фактор в отношении половых клеток. Мутагенность фактора
учитывается за счет не развившихся эмбрионов. Этот метод генотоксикологии очень
простой, экономичный и высокочувствительный для выявления мутагенного эффекта
самых различных факторов (как для суммарной мутагенной активности, так и для
индивидуальных загрязнителей) [Прохорова, 2001; Schmid, 1961].
Метод учёта частоты доминантных летальных мутаций у
Drosophila melanogaster получил широкую известность еще в 50-70-х годах. Тогда
он использовался активно и повсеместно. С помощью его выяснили мутагенность
химических соединений (напр. этиленимина) и особенно гамма - лучей. Важную роль
в становлении метода сыграли работы Мэри Л. Александер [Schmid, 1961; Mary, 1964]. Метод до сих пор не потерял своей
актуальности и используется в биотестирование в настоящее время [Песня и
другие, 2011].
Данный метод используют для тестирования мутагенности:
.Природных сред: воды и почвы
.Химических веществ
.Доз радиации
.Электромагнитных излучений и полей [Песня и другие,
2011].
Кроме того, этот метод также рекомендован в качестве
теста на канцерогены [Sobels,
1976].
Для этого метода объектом была выбрана Drosophila
melanogaster, так как она обладает рядом полезных свойств. Drosophila
melanogaster один из наиболее хорошо изученных модельных объектов генетики
высших организмов. Около 2/3 генов, которые отвечают за болезни у человека,
обнаруживают сходство в геноме дрозофилы.
Базовые биохимические процессы в клетках Drosophila
melanogaster и млекопитающих совпадают. Достоинством Drosophila melanogaster
можно считать микросомальную активацию веществ, происходящих в их процессе метаболизма,
в результате которых промутагены превращаются в мутагены. Это позволяет выявить
мутагены, приобретающие в процессе метаболизма [Sobels, 1976].
Всемирная организация здравоохранения рекомендует
использовать тесты с Drosophila melanogaster для исследования токсической и
мутагенной активности антропогенных ксенобиотиков [ВОЗ, 1989].
Для постановки опыта используют линии дрозофилы с
очень низкой спонтанной мутагенностью по отношению мутаций некоторых типов
(ДЛМ, РСПЛМ, некоторых хромосомных мутаций). Это делает дрозофил очень удобными
для опытов, цель которых выяснение различий эффектов индуцированного
мутагенеза.
Воздействию фактора подвергают только самцов. При
изучении влияния электромагнитных излучений нужно подобрать емкость из
материала с наименьшими отражающими свойствами. Если нужно изучить мутагенное
действие химического соединения, то его в необходимой концентрации примешивают
в питательную среду. Для того чтобы изучить мутагенную активность воды или
почвы, используют стаканчики в качестве емкости, на дно которых наливают 5 мл
исследуемой воды (или вытяжки из почвы). На дно этого стаканчика помещают
металлическую сеточку таким образом, чтобы вода касалась только нижней ее
поверхности. Затем на эту сеточку помещают самцов, которые предварительно были
посажены на трехчасовое голодание. Параллельно с проводящими экспериментами
ставится интактный контроль. По окончании экспозиции самцов их скрещивают с
самками. Скрещивание проводят в чашках Петри, на дно которых заранее была
залита агаризованная среда. В чашках мух содержат примерно трое суток, после
этого через сутки отсаживают самцов, а через двое суток - самок. Чашки Петри, в
которые были отложены яйца, помещают в термостат на пять суток, чтобы личинки
вышли из яйца. По истечении этого времени проводится подсчет яиц под
микроскопом [Изюмов и другие, 1976].
Доминантные летальные мутации, вызываются факторами в
сперматозоидах, что приводит к гибели зиготы. А также они могут вызываться за
счёт возникновения в эмбриогенезе, дефицита в геноме в результате хромосомных
аберраций, или за счёт различных повреждений, которые приводят к блоку
редупликации. Поздние или ранние эмбриональные летали (ПЭЛ и РЭЛ) - это два
класса ДЛМ, которые можно хорошо определить визуально. В ПЭЛ яйца бывают
коричневого, палевого или жёлтого цвета, а в РЭЛ - они белые, а внутри них
видны белые непрозрачные уплотнения. Это остатки этапов сегрегации эмбриона [Werner, 1961; Mary, 1964]. Ведется подсчет на стадии яйца, а точнее
считается количество личинок, которые развились из яйца и количество
неразвившихся яиц. Так же есть вероятность, что мухи при воздействии на них
мутагенов могут откладывать неоплодотворенные яйца. Причиной этого являются
физиологические повреждения сперматозоидов или же снижение половой активности
самцов. Для определения частоты ДЛМ существуют два варианта. В первом варианте
идет подсчет общего количества развившихся и неразвившихся яиц. Погибшие яйца
считают как количество леталей [Mary, 1964]. Во втором варианте за летали
учитываются только ПЭЛ и РЭЛ. Частота ДЛМ - рассчитывается по формуле (2):
ДЛМ = n / N * 100 %,(2)
где n -
количество неразвившихся яиц, - общее число отложенных яиц.
Глава 4. Пути
повышения эффективности использования Drosophila melanogaster в биотестировании
.1 Сложности, возникающие в биотестировании
Информация, содержащаяся в этом разделе, составляет
секрет производства и не может быть размещена в открытом доступе.
4.2 Пути решения проблем биотестирования с
использованием Drosophila melanogaster
Информация, содержащаяся в этом разделе, составляет
секрет производства и не может быть размещена в открытом доступе.
Заключение
Целью дипломной работы была разработка методов
оптимизации использования Drosophila melanogaster в целях биотестирования
В ходе решения поставленной цели были решены следующие
задачи:
. Выделены следующие проблемы, связанные с
биотестированием Drosophila melanogaster: появление плесневых грибов на
питательной среде, проблема внесения тестируемых продуктов и мух на субстрат.
. Экспериментальным путем установлена эффективность
собственных и известных из литературы путей повышения эффективности
использования Drosophila melanogaster как тест - объекта. Добавление
пропионовой кислоты снижает вероятность плесневых грибов на 14%. А опыты с
содой и препаратом Липтобэк Эдванс Аква оказались неэффективными. В опыте с
содой 100% смертность мух, а в опытах с препаратом Липтобэк Эдванс Аква 100%
появление плесневых грибов.
На основании проведенного исследования были сделаны
следующие выводы:
. Drosophila melanogaster до сих пор является
удобным и информативным модельным объектом для проведения исследований.
. Плесневые грибы поражают питательную среду
независимо от наличия в ней мух.
. Для избавления от плесневых грибов наиболее
эффективным средством является добавление спирта в питательную среду дрозофил.
. Возможна пересадка тест - объектов на стадии
пупарии. Однако недостатком этого метода является невозможность прогнозирования
половой принадлежности вылупившихся имаго. Кроме того, существует большой риск
повреждения пупария при переносе.
. Для снижения активности тест-объектов при
температуре +1ºС мух можно держать до 5 минут, а при - 15ºС не больше 3-х минут.
Список литературы
1. Александрова В.В. Биотестирование как современный метод оценки
токсичности природных и сточных вод / В.В. Александрова // Монография:
Нижневартовск государственного университета 2013: Монография. - Нижневартовск:
НВГУ, 2013. - 119 с.
. Бабков В.В. Московская школа эволюционной генетики / В.В. Бабков
// М.:Наука,1985.
. Балакирев И.В. Применение методов биоиндикации при экологическом
мониторинге объектов добычи газа / И.В. Балакирев, А.С. Никишова, Е.Е.
Ильякова, С.И. Липник // Научно - технический сборник вести газовой науки. -
2013. - №2. - С. 118 - 121.
. Берг Р.Л. Генетический анализ двух природных популяций Drosophila melanogaster / Р.Л. Берг, Э.Б. Бриссенден, В.Т.
Александрийская, К.Ф. Галковская // Журнал общей биологии, 1941. - 2(1). С.
143-158.
. Берг Р.Л. Мутация «желтая» (yellow) в популяции Drosophila melanogaster / Р.Л. Берг // Умани. Вести.
Ленингр. Университета. - Сер. Биология, 1961. - 1(3). - С. 77-89.
. Бубнов А.Г. Биотестовый анализ - интегральный метод оценки
качества объектов окружающей среды / А.Г. Бубнов, С.А. Буймова, А.А. Гущин и
др.; под ред. В.И. Гриневича. - Иваново: ГОУ ВПО Ивановский государственный
химико-технологический университет, 2007. - 112 с.
. ВОЗ Руководство по краткосрочным тестам для выявления мутагенных
и канцерогенных химических веществ. Женева: ВОЗ, 1989. -189 с.
. Галицкая П.Ю. Тестирование отходов, почв, материалов с
использованием живых систем / П.Ю. Галицкая, С.Ю.Селивановская, Р.Х.Гумерова //
Казань: Казанский университет, 2011. - 47 с.
. Гершензон С.М. Новые данные по генетике природных популяций Drosophila fasctata / С.М. Гершензон // Сборник работ по
генетике.- Киев: Институт зоологии АН УССР, 1941.- С. 4-5.
. Голубовский М.Д. Анализ нестабильности аллелей гена yellow, выделенных из природной популяции
дрозофил в период вспышки мутабильности / М.Д. Голубовский, И.К. Захаров, О.А.
Соколова // Генетика, 1987. - 23(9). - С. 1595 - 1603.
. Для сохранения дрозофилы генетики решили переименовать мух
[Электронный ресурс] - Lenta.ru, 21 января 2009. - Режим доступа:
https://lenta.ru/news/2009/01/21/drosophila
. Дусеева Н.Д. О распространении высокой мутабильности в
популяциях Drosophila melanogaster / Н.Д. Дусеева // Докл. АН СССР,
1948. - 59(1). - С. 151-153.
. Жизнь в космосе сделала мушек уязвимыми для заражения грибком,
2014 [Электронный ресурс]. - Режим доступа:
http://ria.ru/science/20140125/991251013.html.
. Журавлева Н.В. Комплексная оценка токсичности промышленных
отходов предприятий Кемеровской области / Н.В.Журавлева, Т.Н.Воропаева, О.В.
Иваныкина // Вестник Кузбасского государственного технического университета. -
2006. - №6. - С. 86 - 89.
. Захаров В.М. Асимметрия животных (популяционно -
филогенетический подход) / В.М. Захаров // М.: Наука, 1987. - 216 с.
. Захаров И.А. Феодосий Григорьевич Добржанский - 110 лет со дня
рождения / И.А. Захаров // Москва: Вестник ВОГиС, 2010. - Т. 14. - № 2. - С.
213 - 222.
. Захаров И.К. Возвращение моды на мутацию yellow в природной популяции Drosophila melanogaster / И.К. Захаров, М.Д. Голубовский //
Умани. - Генетика, 1985. - 21(8). - С. 1298-1305.
. Зерщикова Т.А. Изучение качества воды в реке Везелка методом
биотестирования с использованием дафний / Т.А. Зерщикова, Л.П. Флоринская //
Успехи современного естествознания. - 2004. - №11. - С. 109 - 110.
. Иванов Ю.Н. Повышение мутабильности и появление мутационно
нестабильных аллелей локуса singed
в популяциях Drosophila melanogaster / Ю.Н. Иванов, М.Д. Голубовский //
Генетика, 1977. - 13(4).- С. 655-666.
. Иваныкина Т.В. Актуальность биоиндикации растений в условиях
техногенного загрязнения / Т. В. Иваныкина // Вестник Амурского
государственного университета. - 2010. - №51. - С. 81 - 83.
. Изюмов Ю.Г. Реализация повреждений, индуцированных этиленнимином
на разных стадиях сперматогенеза, при хранении спермы в семяприемниках
интактных самок / Ю.Г. Изюмов, Е.М. Литвинова, П.Я. Шварцман; Л.: Изд.-во ЛГПИ
им. А. И. Герцена, 1976. - С. 64-70.
. Козак М.Ф. Дрозофила - модельный объект генетики:
учебно-методическое пособие / М.Ф. Козак. - Астрахань: Астраханский
университет, 2007. - 87 с.
. Колосова Л.Д. Раиса Львовна Берг: к 90-летию со дня рождения /
Л.Д. Колосова, С.И. Малецкий, И.К. Захаров // Информационный вестник ВОГиС,
2003. - 24/25. - С. 11-17.
. Корпакова И.Г. Методологические проблемы оценки токсичности
компонентов среды методами биотестирования / И.Г. Корпакова, Д.Ф. Афанасьев,
И.Е. Цибульский и др. // Защитник окружающей среды в нефтегазовом комплексе. -
2007. - №9. - С. 23 - 29.
. Ляшенко О.А. Биоиндикация и биотестирование в охране окружающей
среды / О.А. Ляшенко. - СПб.: СПб ГТУРП, 2012. - 67 с.
. Маркина Н. Дрозофилы в условиях невесомости размножаются лучше,
чем на Земле [Электронный ресурс]: Газета.ru, 2014. - Режим доступа:
http://www.gazeta.ru/science/2014/11/12_a_6298353.shtml.
. Маячкина Н.В. Особенности биотестирования почв с целью их
экотоксикологической оценки / Н.В. Маячкина, М.В. Чугунова // Вестник Нижегородского
университета им. Н.И. Лобачевского. - 2009. - №1. - С. 84 - 93.
. Медведев Н.Н. Практическая генетика / Н.Н. Медведев. - М.:
Наука, 1968. - 294 с.
. Мелехова О.П. Биологический контроль окружающей среды:
биоиндикация и биотестирование / О.П. Мелехова, Е.И. Егорова, Т.И. Евсеева и
др.; под ред. О.П. Мелеховой и Е.И. Егоровой. - М.: Академия, 2007. - 288 с.
. Мичукова М.В. Изучение токсичности сточных вод
целлюлозно-бумажного производства методом биотестирования на Daphnia Magna Str. / М.В. Мичукова, А.В. Канарский, З.А. Канарская //
Вестник Казанского технологического университета. - 2006. - №1. - С. 95 - 102.
. Песня Д.С. Исследование токсического и генотоксических эффектов
синтетических пищевых красителей методом Allium test / Д.С. Песня, А.В. Романовский,
И.М. Прохорова // Ярославский педагогический вестник. - 2012. - №3. - С.86 -
93.
. Прохорова И.М. Система тестов для оценки генотоксической
активности факторов среды / И.М. Прохорова // Ярославль, 2001.
. Родичева Э.К. Биолюминесцентные биотесты на основе светящихся
бактерий для экологического мониторинга / Э.К. Родичева, А.М. Кузнецова, С.Е.
Медведева // Вестник ОГУ. - 2004. - №5. - С. 96 - 100.
. Самин Д.К. Сто великих научных открытий / Д.К. Самин // М.:
Вече, 2000.
. Соколова Н. В. Лечение пищевой чайной содой [Электронный
ресурс]. - Режим доступа:
http://www.ayzdorov.ru/novosti_5_lechenie_pishevoii_sodoii.php.
. Терехова В.А. Биотестирование почв: подходы и проблемы / В.А.
Терехова // Почвоведение. - 2011. - №2. - С. 190 - 198.
. Туманов А.А. Водные беспозвоночные как аналитические индикаторы
/ А.А. Туманов, И.Е. Постнов // Гидробиологический журнал. 1983. Т. 19. № 5. С.
3-16.
. Фандо Р.А. Формирование научных школ в отечественной генетике в
1930-1940-е гг. / Р.А. Фандо // М.: Дом И.И. Шумиловой, 2005
. Хмырева Н.А. Мониторинг качества питьевой воды в г. Кемерово /
Н.А. Хмырева, А.Ю. Игнатова, Е.А. Макаревич // Вестник Кузбасского государственного
технического университета. - 2010. - №6. - С.148 - 150.
. Юрченко Н.Н. История открытий на дрозофиле - этапы развития
генетики / Н.Н. Юрченко, А.В. Иванников, И.К. Захаров // Вавиловский журнал
селекции и генетики. - Новосибирск: Институт цитологии и генетики СО РАН, 2015.
- Т. 10. - №1. - С. 39 - 49.
. Юрченко Н.Н. История открытий на дрозофиле - этапы развития
генетики / Н.Н. Юрченко, А.В. Иванников, И.К. Захаров // Институт цитологии и
генетики СО РАН (Новосибирск), 2015. - Т. 19.- №1. - С. 39 - 49
. Юрченко Н.Н. Современная генетика локуса white у Drosophila melanogaster / Н.Н. Юрченко, М.Д. Голубовский //
Генетика. - 1998. - №24(4). - С. 581 - 591.
44. Axel R. A chemosensory gene family encoding candidate
gustatory and olfactory receptors in Drosophila / R. Axel, K. Scott, R Jr.
Brady, A. Cravchik, P. Morozov, A. Rzhetsky, C. Zuker // Cell. - 2001. -
104(5). - P. 661-73.
. Detailed Record for Drosophila melanogaster [Электронный ресурс] Режим доступа: http://www.genomesize.com/result_species.php?id=3942.
. Devin Edmonds
Culturing Fruit Flies / Перевод с английского - Е. Дедовская и А. Громов //
[Электронный ресурс], 2007. - Режим доступа:
http://vitawater.ru/terra/auth-mat/edmonds/droso.shtml.
47. Mary L. A. Dose rate effect in the developing germ
cells of male Drosophila / Mary L. Alexander, Janet Bergendahl // Genetics,
1964. - 49(1). - P. 1-16.
. Rasch E.M. The DNA content of sperm of Drosophila
melanogaster / E.M. Rasch, H.J. Barr, R.W. Rasch // Chromosoma, 1971. - 33(1).
- P. 1-18.
. Schmid W. The effect of carbon monoxide as a
respiratory inhibitor on the production of dominant lethal mutations by X-rays
in Drosophila / W. Schmid // Genetics, 1961. - 46(6). - P. 663-670.
. Sobels F.H. Assaying potential carcinogens with
Drosophila / F.H. Sobels, E. Vogel // Environ Health Perspect, 1976. - 15. - P.
141 - 146.