Выбор метода формирования липосомальных контейнеров со встроенными в них полупроводниковыми наночастицами
Введение
Основными направлениями применения липосомальных контейнеров на
сегодняшний день являются фармакология, медицина и косметика. Липосомы широко
используются в качестве контейнеров для инкапсулирования, транспортирования и
контролируемого высвобождения лекарственных препаратов и биологически активных
веществ. В силу своей структурной особенности и способности к самоорганизации
липосомы являются удобной системой для использования в задачах
имуннохимичсекого анализа, основанного на детекции флуоресценции.
Липосомы образованы фосфолипидами - амфифильными соединениями, молекулы
которых состоят из двух частей, радикальным образом различающихся по своему
отношению к водному окружению. Это придает фосфолипидным молекулам свойство
самопроизвольно образовывать в воде мембраны, которые представляют собой
двойной слой липидных молекул, обычно называемый липидным бислоем. Строение
липосомы представлено на рисунке 1.

Рис. 1. Строение липосомы
Стремление максимально ограничить контакт неполярных цепей липида с водой
приводит к тому, что бислой при его достаточной протяженности замыкается сам на
себя, образуя полые оболочечные структуры.
Свойства липосом определяются прежде всего наличием у них замкнутой
мембранной оболочки. Несмотря на молекулярную толщину (около 4 нм), липидный
бислой отличается исключительной механической прочностью и гибкостью. В
жидкокристаллическом состоянии бислоя его компоненты обладают высокой
молекулярной подвижностью, так что в целом мембрана ведет себя как достаточно
жидкая, текучая фаза. Благодаря этому липосомы сохраняют целостность при
различных повреждающих воздействиях, а их мембрана обладает способностью к
самозалечиванию возникающих в ней структурных дефектов. Вместе с тем гибкость
бислоя и его текучесть придают липосомам высокую пластичность. Так, липосомы
меняют размеры и форму в ответ на изменение осмотической концентрации внешнего
водного раствора.
Липосомы являются удобными наноконтейнерами для встраивания в них
флуоресцентных наночастиц, которые используются в иммунохимических
тест-система. Липосомы позволяют работать как с гидрофильными, так и с
гидрофобными веществами, обладают достаточной стабильностью в водных растворах.
Иммунохимические тест-системы широко распространены в качестве инструмента
для определения содержания вредных веществ (токсикантов) в продуктах питания,
питьевой воде, физиологических жидкостях, тканях, природных и сточных водах.
Техногенные источники опасности в последние годы становятся более
серьезными факторами экологического риска, чем природные. В Москве
насчитывается более 70 химически опасных объектов. К химически опасным объектам
Москвы относятся две группы предприятий. Первая группа - промышленные
предприятия, на которых опасные химические вещества являются исходным сырьем,
образуются на промежуточных стадиях технологических процессов, являются
конечными продуктами, используются при производстве тех или иных изделий.
Вторая группа - это многочисленные объекты пищевой промышленности, в которой
сильнодействующие ядовитые вещества используются в холодильных установках и
морозильниках (аммиак), оптовые продуктовые базы (аммиак), водоочистные станции
(хлор), объекты Мосводоканала, склады и базы химических реактивов и кислот, ТЭЦ
(аммиак, серная и соляная кислота), автозаправочные станции (бензин, дизельное
топливо) и другие. Нужно отметить, что 50 из 70 химически опасных объектов
относятся ко второй группе. Причем, объекты второй группы, как правило,
располагаются обычно в черте города - в густонаселенных районах.
Среди множества токсичных веществ, образующихся при производстве энергии
сжиганием ископаемых видов топлива наиболее опасными являются вещества группы
ПАУ (полиароматические углеводороды). Группа ПАУ объединяет вещества, для
которых характерно наличие в химической структуре трех и более конденсированных
бензольных колец. Простейшие вещества из группы ПАУ - антрацен и фенантрен.
Актуальность
работы
Для определения содержания ПАУ в сточных водах в последние годы в мире
большое развитие получил метод высокоэффективной жидкостной хроматографии
(ВЭЖХ).
Однако, несмотря на высокую точность и надежность метод ВЭЖХ обладает
рядом серьезных недостатков:
Необходимость длительной пробоподготовки образцов;
Невозможность проведения анализа вне лаборатории;
Высокая квалификация обслуживающего персонала.
Наиболее распространенными для экспресс-анализа содержания токсичных
веществ, на данный момент, являются тест-системы, аналитическим сигналом в
которых является изменение цвета тестового слоя. Но данный метод не достаточно
эффективен, так как является качественным и зависит от естественной окраски
тестируемой жидкости.
Таким образом, важной и актуальной задачей является разработка
эффективной мобильной системы для количественного определения следов
ароматических и полиароматических углеводородов как маркеров загрязнения
сточных вод ТЭЦ.
Флуоресцентные тест-системы пока не так распространены, но имеют больше
оснований для развития, так как характеризуются высокой чувствительностью и
являются менее зависимыми от естественной окраски тестируемой жидкости.
В применяемых на сегодняшний день методах анализа, основанных на
люминесцентном типе детекции, применяются маркеры в виде квантовых точек
(например, CdSe/ZnS). Схема подготовки образца для иммунохимического анализа с
использованием квантовых точек представлена на рисунке 2. На первой стадии
поверхность тестового слоя тест-системы наносятся антитела, специфичные к
определяемому токсиканту. Далее, через тест-систему пропускают пробу
исследуемой жидкости. В случае, если определяемый токсикант присутствует в
пробе, его молекулы связываются антителами на поверхности тестового слоя. Затем
через тест-систему пропускают заранее подготовленный раствор коньюгата,
представляющий собой молекулярную пару определяемого токсиканта и
флуоресцентной метки - квантовой точкой. В случае, если определяемый токсикант
присутствует в пробе в количестве, превышающем установленный предел, связывания
конъюгатов антителами на поверхности тестового слоя тест-системы не происходит.
В обратном случае, антитела связываются с конъюгатами через присутствующие в их
составе молекулы определяемого вещества.
липосомальный контейнер полупроводниковый
наночастица
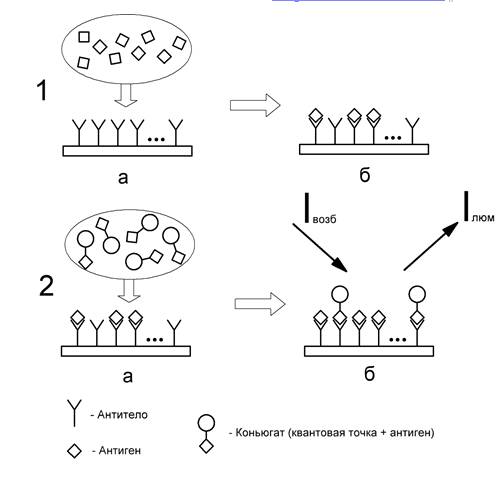
Рис. 2. Принцип реализации иммунохимического определения присутствия
аналита (определяемого вещества) в пробе с помощью использования квантовых
точек в качестве флуоресцентной «метки»
После выполнения вышеописанных процедур поверхность тестового слоя
тест-системы освещается излучением, возбуждающим флуоресценцию квантовых точек.
Таким образом, интенсивность флуоресценции зависит обратно пропорционально от
количества определяемого вещества в исследуемом образце.
Предельно допустимое содержание токсичных веществ ограничивает
динамический диапазон изменения интенсивности флуоресценции квантовых точек в
тест-системах, что требует в свою очередь применения прецизионного
стационарного оборудования для количественных измерений. Для создания мобильных
измерительных устройств необходимо идти также по пути увеличения
чувствительности, отношения сигнал/шум тест-систем.
Перспективным способом увеличения чувствительности иммунохимических
тест-систем с флуоресцентной детекцией является использование липосомальных
наноконтейнеров, наполненных квантовыми точками.
Использование наноконтейнеров позволяет связать с одной молекулой
определяемого токсиканта несколько люминесцентных меток, что приведет к
увеличению интенсивности флуоресценции. Принцип использования наноконтейнеров
для увеличения аналитического сигнала на примере липосом, наполненных квантовыми
точками, приведен на рисунке 2.
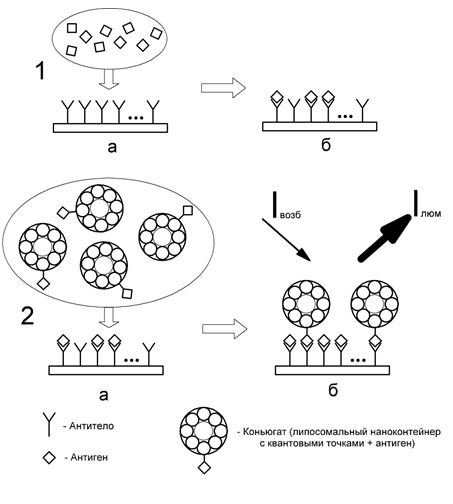
Рис. 3. Принцип использования наноконтейнеров для увеличения
аналитического сигнала
Постановка задачи
Известно, что спектральные характеристики квантовых точек зависят, в том
числе, от их размеров. Использование квантовых точек определенного размера
позволяет получать наполненные липосомальные наноконтейнеры с заданным спектром
флуоресценции.
Уровень флуоресценции липосомального наноконтейнера зависит от количества
встроенных в него квантовых точек. Количество квантовых точек, встроенных в
липосомальный наноконтейнер, зависит, в том числе, от размера наноконтейнера и
самих квантовых точек. Для обеспечения воспроизводимости измерений уровня
флуоресценции при проведении иммунохимического анализа на наличие вредных
веществ и определения их количества необходимо использовать методы формирования
липосомальных контейнеров со встроенными наночастицами, которые дают
минимальный разброс по диаметру липосом. Выбор метода формирования липосомальных
контейнеров со встроенными в них полупроводниковыми наночастицами,
обеспечивающего минимальный разброс значений диаметра липосомальных
контейнеров. Для достижения поставленной цели необходимо решить следующие
задачи:
провести сравнительный анализ методов формирования липосомальных
контейнеров со встроенными в них полупроводниковыми наночастицами CdSe/ZnS.
- выбрать рациональные методы и средства измерения геометрических свойств
полупроводниковых наночастиц и липосомальных контейнеров со встроенными полупроводниковыми
наночастицами;
провести калибровку выбранных средств измерений;
провести измерения геометрических свойств полупроводниковых наночастиц
CdSe/ZnS;
провести измерения геометрических свойств липосомальных контейнеров
изготовленных исследуемыми методами;
2. Основная часть
.1 Анализ
методов встраивания полупроводниковых наночастиц в липосомальные контейнеры
Механизмы формирования липосомальных контейнеров со встроенными
наночастицами хорошо изучены и описаны во многих статьях [13, 14, 16, 18, 21].
Ниже приведен анализ наиболее распространенных и изученных методов
получения липосом, к которым относятся:
обращение фаз;
гидратация сухой пленки;
озвучивание ультразвуком;
экструзия;
инжекция;
методы, основанные на удалении детергентов
метод спонтанной везикуляции;
метод «замораживания - оттаивания».
При приготовлении липосом в препаративном масштабе приходится решать
немало технических вопросов, связанных с очисткой липидов, их нестабильностью,
контролированием размера липосом, их агрегацией, низкой эффективностью
«захвата» и т. д. Ни один из имеющихся многочисленных методов получения липосом
не решает перечисленные проблемы полностью. Ниже рассмотрены относительные
преимущества и недостатки указанных методов.
Методом обращения фаз можно получать мультиламеллярные везикулы (МЛВ) или
гигантские (≥1 мкм) одноламеллярные везикулы (ГОВ). Липиды растворяют в
органическом растворителе и полученный раствор упаривают в вакууме в роторном
испарителе. При этом липиды остаются на стенках колбы в виде пленки (для облегчения
последующего ресуспендирования пленка должна быть возможно более тонкой). В
колбу с пленкой добавляют водный буферный раствор и встряхивают ее рукой или
механическим способом или же перемешивают содержимое скоростной мешалкой.
Иногда встряхивание проводят в присутствии стеклянных шариков. Температура в
процессе ресуспендирования всегда должна быть выше температуры фазового
перехода липида. Если для приготовления липосом используют смесь липидов,
температура процесса должна быть выше температуры фазового перехода наиболее
высокоплавкого компонента липидной смеси. На последней стадии приготовления
полученные липосомы выдерживают в водной среде в течение нескольких часов для
установления равновесия.
Продолжительность и интенсивность перемешивания имеют решающее влияние на
размер образующихся везикул. Для получения везикул с большим числом слоев
используют либо кратковременное энергичное перемешивание («вортексирование»),
либо осторожное перемешивание в течение длительного времени. В последнем случае
образуются везикулы с большим внутренним объемом, чем в первом [1]. Другой
способ увеличения внутреннего объема везикул состоит в том, что в состав
исходной липидной смеси вводят 10 - 20% отрицательно заряженного липида.
По методу гидратации сухой пленки фосфолипиды и квантовые точки
растворяют в органическом растворителе, и полученный раствор упаривают в
вакууме в роторном испарителе. При этом липиды остаются на стенках колбы в виде
пленки (для облегчения последующего ресуспендирования пленка должна быть как можно
более тонкой). В колбу с пленкой добавляют водную фракцию и встряхивают ее
рукой или механическим способом, или же перемешивают содержимое скоростной
мешалкой. Иногда встряхивание проводят в присутствии стеклянных шариков.
Температура в процессе ресуспендирования всегда должна быть выше температуры
фазового перехода фосфолипида. Если для приготовления липосом используют смесь
фосфолипидов, температура процесса должна быть выше температуры фазового
перехода наиболее высокоплавкого компонента фосфолипидной смеси. На последней
стадии приготовления полученные липосомы выдерживают в водной среде в течение
нескольких часов для установления равновесия.
Продолжительность и интенсивность перемешивания имеют решающее влияние на
размер образующихся липосом. Для получения липосом с большим числом слоев
используют либо кратковременное энергичное перемешивание («вортексирование»),
либо осторожное перемешивание в течение длительного времени.
Методом озвучивание ультразвуком можно получать малые (<50 нм)
одноламеллярные везикулы (МОВ). Механизм этого процесса не вполне ясен.
Некоторые авторы предполагают, что ультразвуковая обработка приводит к
постепенному уменьшению размеров МЛВ [2], другие считают, что процесс состоит
из ряда дискретных стадий [3].
Для того чтобы сократить продолжительность озвучивания, его, как правило,
проводят, погружая металлический наконечник источника ультразвука
непосредственно в суспензию МЛВ [4 - 7]. Многие авторы, однако, предпочитают
«наружное» озвучивание с помощью соникатора «банного» типа [8]. Основные
недостатки первого способа состоят в том, что он сопровождается значительным
разрушением фосфолипидов и приводит к образованию аэрозолей, загрязняющих
атмосферу в рабочем помещении. Загрязнения могут оказаться вредными при
приготовлении липосом с использованием радиоактивных, токсичных или
канцерогенных материалов. Кроме того, полученные этим способом MOB обычно содержат примеси титана и
других металлов, входящих в состав наконечника, которые необходимо отделить от
образца.
«Банный» способ озвучивания свободен от этих недостатков и позволяет
работать с меньшими объемами суспензии МЛВ. Однако при этом удлиняется время
озвучивания, а полученный препарат менее однороден и часто содержит
значительные остаточные количества МЛВ.
Независимо от применяемого метода необходим тщательный контроль
температуры среды во время озвучивания. Обычно стараются проводить процесс при
возможно более низкой температуре, которая, однако, должна быть выше
температуры фазового перехода наиболее высокоплавкого компонента смеси, так как
в противном случае образуются нестабильные везикулы, мембрана которых имеет
структурные дефекты. Такие дефекты удается устранить путем нагревания суспензии
до температуры, превышающей температуру фазового перехода липидов. Однако при
этом происходит также и слияние MOB с
образованием более крупных агрегатов [9]. Прогрев препарата рекомендуется
проводить всегда, независимо от температуры озвучивания, так как при этом
стабильность препарата увеличивается. Однако, несмотря на все указанные меры препараты
MOB, как правило, неустойчивы и медленно
агрегируют.
Следует иметь в виду, что озвученные препараты MOB всегда неоднородны по размерам везикул. По мере
увеличения времени озвучивания препараты становятся более однородными, однако
при этом увеличивается и степень разложения фосфолипидов. Как уже
упоминалось, при непродолжительном озвучивании или при использовании соникатора
«банного» типа получают смеси MOB и
МЛВ. Их разделение можно осуществить с помощью гель-хроматографии [6],
ультрацентрифугирования [10 - 11], экструзии [12] или фильтрования через
миллипорные фильтры [13].
Основной недостаток всех препаратов MOB - низкая эффективность включения (0, 1-1, 0%, или от
0, 2 до 1, 5 л на моль липида).
Все методы получения везикул, основанные на встряхивании или
перемешивании, приводят к препаратам с неоднородными размерами везикул. Более
однородные препараты получают с помощью экструзионного метода.
Данным методом можно получать малые одноламеллярные везикулы. По этому
методу водную дисперсию МЛВ помещают в прибор с узким отверстием, так
называемый пресс Френча, и подвергают быстрой экструзии при повышенном
давлении. Уже при первом пассаже около 70% липида образует суспензию MOB. При вторичной экструзии выход MOB превышает 95%. Размер полученных MOB составляет 150-500 А и не зависит от
температуры. Температура процесса экструзии влияет, однако, на проницаемость
образующихся частиц [14, 15].
Основные преимущества метода экструзии по сравнению с ультразвуковой
обработкой состоят в том, что полученные MOB не содержат частиц титана, степень перекисного
окисления резко снижается и приготовление MOB не сопровождается образованием аэрозолей. Метод
экструзии позволяет получить липосомальные препараты с высокой концентрацией
липида и не требует концентрирования или диализа. Сообщалось также, что
полученные экструзионным методом MOB
более стабильны при хранении, чем MOB, приготовленные с помощью ультразвука [15].
Методом инжекции можно получать малые одноламеллярные везикулы и
большие одноламеллярные везикулы (БОВ).
При приготовлении МОВ разрушения липидов и образования аэрозолей удается
избежать путем впрыскивания в водную среду раствора фосфолипидов в летучем
органическом растворителе с последующим упариванием растворителя [16 - 20].
Согласно первоначальному варианту этого метода [20] спиртовой раствор
фосфолипидов быстро впрыскивают с помощью шприца в перемешиваемую водную среду.
При достаточно быстром перемешивании и пониженном давлении спонтанно образуются
MOB, напоминающие по параметрам MOB, приготовленные с помощью
ультразвука. Размер везикул сильно зависит от концентрации фосфолипида и
спирта. Для образования везикул с небольшим диаметром необходимо, чтобы
концентрация фосфолипида не превышала 40 мМ, а конечная концентрация спирта
должна быть не более 7, 5%. Хотя суммарный внутренний объем полученных липосом
несколько больше, чем в случае озвученных MOB, эффективность включения остается очень низкой из-за
большого разбавления.
Другой недостаток инжекционного метода состоит в том, что полученные
липосомы содержат некоторое остаточное количество спирта, для удаления которого
препарат приходится подвергать диализу или многократному промыванию водой.
Размер и степень гетерогенности везикул, полученных методом инжекции,
можно до некоторой степени варьировать путем изменения скорости впрыскивания и
перемешивания, а также концентрации липида в этаноле. Ускорение впрыскивания
приводит к образованию более мелких везикул [21], а при повышении концентрации
фосфолипида в спирте диаметр везикул увеличивается до 1000 А и более [19].
Для объяснения этих зависимостей было предположено, что при впрыскивании
этанольного раствора в воду фосфолипиды первоначально образуют мицеллы [21].
Медленная инжекция способствует образованию мицеллярных структур, которые
частично захватываются формирующимися везикулами, что и приводит к образованию
более крупных частиц. При предварительном добавлении спирта в среду до инжекции
процесс захвата мицелл подавляется, в результате чего образуются
одноламеллярные везикулы меньшего размера.
Метод этанольной инжекции может быть использован для получения БОВ при
условии достаточного повышения концентрации липидов в исходном этанольном
растворе [19, 22].
С помощью метода, основанного на удалении детергентов, МОВ образуются
спонтанно при удалении детергента из водной смеси детергента и фосфолипидов.
Для освобождения от детергента используют диализ, центрифугирование или
гель-фильтрацию. Преимущество этих методов состоит в том, что они приводят к
гомогенным популяциям везикул, отличающихся относительно высокой «захватывающей»
способностью (степенью включения). Основной недостаток - некоторое количество
детергента всегда остается в липосомах.
Диализ впервые был описан Кагава и Рэкером в 1971 году [23]. При диализе
смесей, содержащих фосфолипиды, белки и холат или дезоксихолат, они наблюдали
образование протеолипосом. При использовании обычных диализных мешков
образующиеся липосомы неоднородны по размерам, однако при использовании
специальной ячейки в контролируемых условиях позволяет получать достаточно
гомогенные препараты МОВ со средним диаметром 50 нм [24]. Критическое значение
для размера образующихся везикул имеет исходное соотношение фосфолипида и
детергента: при избытке детергента образубтся более крупные везикулы. Также
удаление детергента может быть осуществлено методами центрифугирования и
гель-фильтрации.
Еще один метод удаления детергента основан на селективной адсорбции
детергента в присутствии фосфолипидов [25]. Согласно этому методу дисперсию
фосфолипидов в детергенте инкубируют с адсорбентом, фильтруют через стеклянную
вату и осаждают образовавшиеся везикулы центрифугированием при 150000g. Остается невыясненной зависимость
размера везикул от таких параметров приготовления везикул, как температура,
концентрация, содержание детергента, а также остаточное содержание детергента в
полученных липосомах.
Методом спонтанной везикуляции можно получать малые одноламеллярные
везикулы. При быстром подщелачивании водных дисперсий, содержащих фосфатидовую
кислоту или смесь фосфатидовой кислоты с фосфатидил-холином, спонтанно
образуются везикулы, которые остаются стабильными при нейтральном рН [26, 27].
Полученные таким образом липосомы могут быть разделены гель-фильтрацией на
фракцию MOB и фракцию, состоящую из более
крупных частиц (>100 нм). Механизм этого процесса везикуляции не вполне
ясен. Вероятно, он связан с ионизацией фосфатных групп, приводящей к увеличению
поверхностной плотности отрицательных зарядов.
Степень везикуляции зависит от значения рН и от отношения фосфатидовая
кислота/фосфатидилхолин. При увеличении этого отношения доля MOB уменьшается. Диаметр образовавшихся MOB возрастает при увеличении
концентрации хлористого натрия в исходной смеси и уменьшается при увеличении
значения рН и скорости процессе подщелачивания. При быстром, в течение 1 с,
подщелачивании до рН 9 или выше выход MOB составляет более 70%. Выход MOB увеличивается также в присутствии хлористого натрия. Полученные этим
способом из фосфатидовой кислоты MOB
включают около 0, 5 л водной фазы на каждый моль фосфолипида. Фракция крупных
частиц состоит в основном из больших однола-меллярных везикул.
Получение БОВ методом замораживания-оттаивания, имеющих большую
захватывающую емкость, основано на быстром замораживании озвученных
фосфолипидных дисперсий с последующим оттаиванием и непродолжительным вторичным
озвучиванием [28]. Метод пригоден для получения БОВ, состоящих из смесей
фосфатидилхолина с кислым фосфоли-пидом (фосфатидилсерином) или с положительно
заряженным ал-киламином, но не позволяет получать везикулы из одного
фосфатидилхолина. Полученные указанным способом препараты БОВ неоднородны по
размерам (диаметр от 50 до 500 нм); внутренний объем составляет около 10 л на
моль фосфолипида. В присутствии сахаров, двухвалентных катионов и в условиях
высокой ионной силы эффективность захвата резко падает. На
основании
выполненного
анализа
можно
сделать
вывод,
что
наиболее
подходящими
методами,
которые
обеспечит
размер
формируемых
липосомальных
контейнеров
порядка
~100
нм
и
минимальный
разброс
по
диаметру
являются
метод
гидратации
сухой
пленки
и
метод
выпаривания
в
обращенной
среде.
2.2 Выбор методов и средств измерений геометрических параметров
липосомальных контейнеров и полупроводниковых наночастиц
К настоящему времени разработано большое количество аналитических
методов, пригодных для выделения и характеризации наночастиц. Выбор пригодности
того или иного метода определяется спецификой решаемой задачи и характером
исследуемого нанообъекта и содержащей его матрицы. Ряд задач, которые требуется
решить при исследовании материала, содержащего наночастицы, включает
обнаружение, идентификацию, определение параметров наночастиц и их содержания в
материале. Получение всей необходимой информации об объекте исследования с
помощью одного метода является затруднительным, поэтому полную информацию в
конечном итоге можно получить лишь с помощью правильной комбинации различных
методов.
Набор характеристик выбранного метода, которые важно учитывать для
решения конкретной задачи, включает в себя: предел обнаружения целевого
объекта, полнота выявления, степень сохранения исходного состояния, точность
измерения, универсальность подхода для анализа разных объектов, влияние
мешающих факторов, таких как матричные эффекты и т.д. [1]
Микроскопические методы объединяют в своем семействе подходы, основанные
на рассеянии различных типов излучений на наночастицах, а также подходы,
основанные на сканирующем зондировании.
Оптическая микроскопия, в общем случае не позволяет регистрировать
объекты диаметром ниже 100 нм, что определяется теоретическим пределом
разрешения, связанным с минимальной длиной волны видимого света около 400 нм.
Хотя существуют оптические подходы, которые позволяют разглядеть более мелкие
объекты (около 50 нм), например, оптическая сканирующая микроскопия ближнего
поля, чаще всего оптическая микроскопия больше подходит для анализа агрегатов,
нежели отдельных наночастиц. [1, 2]
Рентгеновская микроскопия характеризуется более высокой разрешающей
способностью, вследствие того, что длина волны рентгеновского излучения лежит в
пределах 0, 001 -100 нм. В реальности, однако, разрешающая способность данного
метода ограничивается возможностями техники фокусировки рентгеновских лучей, и
составляет около 30 нм. Рентгеновские микроскопы используют отражательную или
проекционную технику измерения, которые основаны соответственно на преломлении
и пропускании рентгеновских лучей. Во втором случае, благодаря существованию
зависимости поглощения рентгеновских лучей от типа атомов, удается получить
информацию как о структуре, так и о химическом составе нанообъекта.[1]
Сканирующая конфокальная лазерная микроскопия является менее
распространенным методом в практике анализа наночастиц. Связано это, прежде
всего, с возможностью определения таким способом только флуоресцирующих
наночастиц (к таковым можно отнести, например, квантовые точки). Данный тип
микроскопии обладает возможностью анализа наночастиц в объеме материала, а не
только на его поверхности, что определяет особое место сканирующей конфокальной
лазерной микроскопии в ряду микроскопических техник.
Электронная микроскопия наиболее часто используется для анализа
наноматериалов благодаря высокой разрешающей способности, возможности анализа
большого круга нанообъектов, а также широкому диапазону определяемых
концентраций наночастиц (1-100 мг/л). Электронная микроскопия подразделяется на
сканирующую электронную микроскопию(СЭМ), основанную на рассеянии электронов на
поверхности образца с последующей их фокусировкой, и просвечивающую электронную
микроскопию(ПЭМ), основанную на пропускании фокусированного потока электронов
через образец. Благодаря высокой разрешающей способности электронная
микроскопия позволяет визуализировать наночастицы диаметром до субнанометрового
и характеризовать их по размеру и форме частиц, оценивать степень дисперсности,
агрегации и концентрацию в образце. Данный метод позволяет детектировать
наночастицы в сложных матрицах, например, в продуктах питания; водных,
воздушных и почвенных пробах; в биологических объектах: тканях и органах,
клетках, биологических жидкостях.
Дополнение электронной микроскопии такими методами как cпектpоcкопия
xаpактеpиcтичеcкиx потерь энергии электронов, или методом локальной дифракции
электpонов позволяет значительно расширить возможности, получая, например
информацию о кристаллической структуре наночастиц.
Отдельным преимуществом ПЭМ является возможность анализа всего объема
препарата, что позволяет проводить подсчет количества частиц точнее, чем при
сканировании поверхности.
К основным недостаткам метода следует отнести прежде всего возможность
анализа только электронно-плотных материалов, вследствие чего электронная
микроскопия плохо применима для анализа объектов, состоящих из легких атомов
(1-3 периоды таблицы Менделеева), в том числе углерода. Это ограничение
исключает возможность анализа большого класса важных технологических наночастиц,
таких как нанотрубки, фуллерены и др. Еще одним важным недостатком метода
является значительный матричный эффект. Поэтому результаты анализа и
возникновение различных артефактов в значительной степени зависят от способа и
условий пробоподготовки, которая зачастую является сложным продолжительным
процессом. Кроме того, во время пробоподготовки образца для электронной
микроскопии могут индуцироваться процессы, влияющие на состояние нанообъектов,
которые отсутствуют в исходном материале, например, агглютинация частиц.
Дополнительные проблемы возникают при анализе наночастиц в биоматериале. Так
электронно-плотные частицы оксида титана на электронных микрофотографиях сходны
с гранулами гликогена и рибосомами, а частицы полистирола - с везикулами.
Характеристика наночаcтиц в «естественной» среде проводится с применением
других методов, например, таких как сканирующая электронная микроскопия в
естественной среде (ЕСЭМ).
Особенностью метода является то, что электронная пушка и фокусирующие
линзы микроскопа находятся в глубоком вакууме, а ячейка с образцом изолирована
от других частей прибора. В таком случае анализируемый образец находится в
исходном окружении. Это дает ЕСЭМ два основных преимущества: возможность
характеристики аналита в гидратированном состоянии и отсутствие необходимости
фиксации и контрастирования исследуемого объекта. ЕСЭМ, как и традиционную СЭМ,
можно совмещать с энеpгодиcпеpcионной рентгеновской спектроскопией с помощью
применения специальной приставки. К недостаткам ЕСЭМ можно отнести то, что
анализу подвергается лишь приповерхностный слой образца, а разрешающая
способность метода уменьшается до ~ 100 нм. Таким образом, метод применим
скорее к анализу агрегатов, нежели отдельных наночастиц.[1, 3, 4]
Сканирующая зондовая микроскопия (СЗМ) объединяет такие методы как
атомно-силовая, сканирующая туннельная, магнитно-силовая, фрикционно-силовая,
сканирующая тепловая микроскопии и сканирующая микроскопия ионной проводимости.
Для анализа наноматериалов из них наиболее часто применяется атомно-силовая
микроскопия (АСМ). В АСМ измеряются слабые (от пико-до наноньютонов) силы
ван-дер-ваальсового взаимодействия между острием (кантилевером) и поверхностью
сканируемого материала, и, таким образом, вырисовывается рельеф поверхности
образца. Разрешающая способность такого сканирования при этом может достигать
нескольких ангстремов, и лимитируется размерами острия кантилевера. Отметим,
что при этом определяемые АСМ размеры поверхностных объектов оказываются
несколько большими, чем реальные. АСМ дает возможность визуализации частиц в
естественной среде, предоставляя трехмерную информацию об объекте, в отличие от
таких методов как ПЭМ, которые позволяют получать лишь двумерную проекцию
изображения. Приготовление твердых образцов для АСМ, как и для ПЭМ, проводится
с использованием техники получения ультратонких срезов на микротоме.
Применяются также методы химического травления поверхности полученного среза.
Объем анализируемого материала при использовании техники срезов минимален,
поэтому вероятность обнаружения наночастиц в таком случае значительно ниже, чем
при приготовлении образца из жидкого материала. Методы сканирующей микроскопии
обладают рядом преимуществ по сравнению с электронной микроскопией, прежде
всего связанных с возможностью анализа не только электронно-плотных объектов и
способностью визуализации трехмерного рельефа поверхности. В то же время
сканирующие методы уступают ПЭМ по возможности обнаружения и визуализации
частиц в толще образца, а также по площади обзора (на 3-4 порядка). Кроме того,
взаимодействие зонда и образца зачастую порождает комплекс факторов, искажающих
реальную картину и затрудняющих корректную интерпретацию данных.
Хотя обычно использование АСМ не позволяет получить данные о химическом
составе объекта, в последнее время появились методы, позволяющие
идентифицировать состав на основании данных о силовых характеристиках
взаимодействия (например, метод химической силовой микроскопии). АСМ в режиме
электросиловой микроскопии значительно расширяет возможности определения наночастиц
в сложных матриксах.
Сущность метода заключается в обнаружении отличий в диэлектрических
свойствах наночастиц и их окружения. При этом поверхность сканируется в двух
режимах: в стандартном режиме для визуализации профиля поверхности и
электросиловом режиме, при котором кантилевер, на который подается постоянное
напряжение, проходит на заданном уровне над образцом для создания карты
изменения электрических свойств поверхности. Наибольшую информацию дает
измерение фазы колебания кантилевера. Полученная карта используется в качестве
«маски», которая затем используется для отсечения объектов отличающихся по фазе
колебания кантилевера от соответствующего значения, характерного для
конкретного вида наночастиц. Наложение «маски» на топографический профиль позволяет
обнаружить искомые наночастицы.
Кроме АСМ другим часто используемым вариантом СЗМ является сканирующая
туннельная микроскопия (СТМ), основанная на детектировании электронов,
проходящих через зазор между острием зонда, находящегося под напряжением, и сканируемой
поверхностью. Поскольку вероятность прохождения электронов через потенциальный
барьер зависит не только от величины зазора, но и от химического состава
поверхности, СТМ позволяет получать информацию об электрических свойствах
материала. Разрешающая способность метода составляет около 1 нм. Меньшая
распространенность СТМ по сравнению с АСМ в области анализа объектов,
содержащих наночастицы, связана с тем, то СТМ применима только для анализа
токопроводящих материалов - металлов или полупроводников.[1, 5]
Методы рассеяния излучения, применяемые для анализа наночастиц, включают
в себя динамическое лазерное светорассеяние, малоугловое рассеяние нейтронов и
малоугловое рассеяние рентгеновских лучей.
Динамическое лазерное светорассеяние (ДЛС) позволяет установить
гидродинамический радиус частиц и степень их агрегации. Одно из достоинств ДЛС
- быстрота получения результата (несколько минут). Использование в данном
методе трансмиссионных решеток и одновременной регистрации рассеянного и
дифрагированного света позволяет уменьшить влияние шума на автокорреляционную
кривую в 20 - 30 раз. Поскольку в рассеяние света вносят вклад любые частицы и
макромолекулы в растворе, при анализе смесей, содержащих частицы с широким
разбросом по размерам, возникают значительные трудности, поэтому ДЛС часто
совмещают с различными методами разделения частиц. [1, 6]
Применяются также и методы гидролитического разрушения макромолекул.
Метод малоуглового рассеяния рентгеновских лучей (МРР) позволяет
детектировать неоднородности вещества, размер которых существенно превышает
длину волны излучения (0, 01 - 1 нм). Эффект малоуглового рассеяния
рентгеновских лучей возникает при наличии в системе равномерно распределенных
неоднородностей размером 1 - 100 нм. Данный метод является весьма информативным,
поскольку зависимость интенсивности рассеянного света от угла рассеяния
позволяет рассчитать такие параметры как размер, форма, фазовый состав и даже
изучить внутреннюю структуру.
Метод малоуглового рассеяния нейтронов по своей функциональности весьма
схож с методом МРР и, хотя данный метод пока не нашел широкого применения для
анализа наночастиц, существуют исследования, подтверждающие перспективность его
применения в этой области. [1]
Спектроскопические методы анализа весьма обширны, и часто используются в
практике анализа наночастиц, однако за редкими исключениями они не позволяют
выявлять наночастицы напрямую в многокомпонентных смесях. Поэтому эти методы,
как правило, применяются после селективного выделения нанообъектов из смеси.
Исключением. например, могут являться случаи определения флуоресцирующих
наночастиц. Спектрофотометрические методы особенно часто применяются для
анализа наночастиц органических полимеров или фуллеренов. В частности, для
количественного определения фуллеренов успешно применяется ИК-спектроскопия с
Фурье-преобразованием.
Методы флуоресцентной спектроскопии особенно подходят для анализа
квантовых точек, обладающих ярко выраженными флуоресцентными свойствами. В этом
случае негативное влияние матрицы проб может быть устранено обработкой
разрушающими реагентами, но следует помнить, что кислые среды могут вызывать
разрушение квантовых точек.
Атомно-эмиссионная спектроскопия, например, один из ее видов -
спектроскопия лазерного разложения (СЛР) также успешно применяется для анализа
наноматериалов. Удобство СЛР заключается в его пригодности для исследования
материала вне зависимости от физического состояния образца, но для
количественного определения СЛР должен быть откалиброван с использованием
альтернативных методов. [1, 7]
Весьма информативными методами являются методы спектроскопии
светорассеяния: спектроскопия корреляционного релеевского светорассеяния,
основанная на эффекте поверхностного плазмонного резонанса, и спектроскопия
комбинационного рассеяния (СКР) (рамановская спектроскопия) - рассеяние
оптического света, сопровождающееся изменением его частоты. Количество и
расположение линий в спектре СКР зависит от внутреннего строения исследуемого
объекта. СКР позволяет обнаруживать наночастицы даже в таких сложных объектах
как органы животных.
Спектроскопия ядерного магнитного резонанса (ЯМР) позволяет анализировать
объекты, в том числе наночастицы, содержащие элементы с некомпенсированным
ядерным спином. Частоты, на которых резонируют ядра, позволяют сделать вывод об
их местном электронном окружении. С помощью диффузионной спектроскопии ЯМР,
одной из разновидностей метода, можно вычислить коэффициент диффузии
наночастиц, и сделать вывод об их размерах.
Рентгеноспектральные методы, включая рентгеновскую фотоэлектронную (РФЭС),
рентгеновскую флуоресцентную (РФС), рентгеновскую абсорбционную (РАС)
спектроскопии используют для выявления и количественного определения элементов
за исключением водорода и гелия. В эмиссионных методах (РФЭС и РФС)
регистрируются электроны, испущенные возбужденными рентгеновским излучением
атомами. Измеряя энергию испущенных электронов можно сделать вывод об энергии
химической связи, что дает также косвенную информацию о ближайшем окружении
элемента, состоянии связи и окислении. РАС, напротив, дает информацию об
элементах на основании спектра поглощения рентгеновского излучения. Из других
спектральных методов, реже применяемых в анализе наночастиц, следует отметить
методы электронного парамагнитного резонанса, мессбауэровскую спектрометрию,
электронную Оже-спектрометрию и трехмерную флуоресцентную матричную
спектрофотометрию возбуждения эмиссии.
Отдельного внимания из спектрометрических методов заслуживает
масс-спектрометрия (МС) - метод разделения и измерения заряженных частиц по
массовым числам (масса/заряд). МС позволяет определять состав объекта,
проводить качественный и количественный состав многокомпонентных смесей,
устанавливать изотопный состав. Часто МС применяют совместно с методами
проточного полевого фракционирования или хроматографии, что позволяет разделять
частицы по размеру или составу и получать количественные и качественные
характеристики отдельных фракций.
Для количественного определения индивидуальных наночаcтиц после придания
им электрического заряда применяются методы масс-спектрометрии единичных
частиц, позволяющие регистрировать очень высокие значения массовыхчисел для
тяжёлых заряженных наночаcтиц. К этим методам относится, в частности
аэрозольная времяпролетная масс-спектрометрия.
В области анализа наночастиц в последнее время широкое распространение
получили так называемые «счетчики частиц» - устройства, в которых используется
эффект изменения электропроводности слабого электролита при попадании в него
наночастиц - эти изменения и позволяют регистрировать наночастицы. Анализ проводится
в жидкой фазе. В случае если анализ проводится для частиц, взвешенных в газе,
может использоваться дифференциальный анализатор мобильности. В таких приборах
используется различная подвижность ионизированных высокоэнергетическим
излучением частиц в однородном электростатическом поле. Одно из преимуществ
метода - неразрушающее воздействие на частицы и возможность повторного анализа
материала в том числе альтернативными методами. Комбинация использования
дифференциального анализатора мобильности с конденсационным счетчиком позволяет
получить целый комплекс параметров наночастиц, которые сперва разделяются по
электрофоретической подвижности, а затем происходит измерение их
концентрационных и размерных характеристик. Необходимость перевода наночастиц в
газовую фазу делает крайне затруднительным использование этих методов для
анализа биологических образцов без дополнительной сложной пробоподготовки.
Однако в последнее время активно ведутся исследования для адаптации данных
методов для анализа наночастиц в жидких средах. [1]
Иммунохимические методы основаны на специфическом взаимодействии аналита
с антителами. Образование иммунного комплекса может измеряться как
опосредованно, с помощью различных меток (ферментных, флуоресцентных,
радиоактивных и др.), так и напрямую, например, в иммуносенсорах. Главное
достоинство иммуноаналитических методов - высокая селективность иммунного
взаимодействия, благодаря которой становится возможным определение целевого
объекта с высокой специфичностью в многокомпонентных смесях без необходимости
сложной пробоподготовки или предварительного разделения смеси. Главной же
сложностью применения иммуноаналитических методик к анализу наночастиц является
получение антител к наночастицам, которые в отличие от природных биополимеров,
таких как белки, не имеют ярко выраженных антигенных свойств, поскольку
однородные объекты характеризуются низкой антигенностью. Кроме того, при
попадании наночастиц в организм зачастую происходит их взаимодействие с его
биомолекулами с образованием конъюгатов, поэтому антитела часто вырабатываются
не на саму наночастицу, а на её комплекс с биомолекулой. Дополнительную
проблему представляет чувствительность антител к некоторым агрессивным
растворителям, поскольку далеко не все наночастицы растворимы в водных средах.
Тем не менее существует ряд удачных примеров получения моно- и поликлональных
антител на различные наночастицы и успешной реализации иммунохимического
определения соответствующих наночастиц с высокой чувствительностью и
специфичностью.[1]
Таким образом, для оценки геометрических параметров липосом и квантовых
точек, исследуемых в данной работе, наиболее применимы динамическое лазерное
рассеяние и атомно-силовая микроскопия.
2.3 Описание
выбранных средств измерений геометрических параметров липосомальных контейнеров
и полупроводниковых наночастиц
.3.1
Анализатор размеров частиц Zetatrac
Для измерения размеров наночастиц используется метод динамического
рассеяния света (ДРС). Данный метод позволяет определить коэффициент диффузии
дисперсных частиц в жидкости путем анализа характерного времени флуктуаций
интенсивности рассеянного света. Далее из коэффициента диффузии рассчитывается
радиус наночастиц. Когда световой луч падает на частицы, происходит
взаимодействие электромагнитной волны с неоднородной средой и свет
рассеивается. Основное предположение теории ДРС заключается в том, что
рассеянный свет имеет ту же частоту, что и возбуждающий луч света. Однако, для
стороннего наблюдателя возникает оптический эффект Доплера по отношению к
движению частиц. Частота рассеянного света Δω смещается малыми сдвигами,
пропорциональными скорости частиц v:
Δω = s · v(1)
Интенсивность рассеянного света не постоянна, но флуктуирует около
среднего значения <I>.
На рисунке 4 показаны флуктуации интенсивности рассеянного света в соответствии
с тепловым движением рассеянных частиц. На левом рисунке показан график для
больших частиц - флуктуации медленные, на правом для маленьких - флуктуации
быстрые.
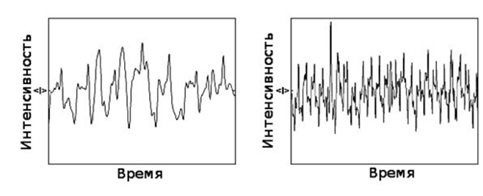
Рис.4. Флуктуации интенсивности рассеянного света в соответствии с
тепловым движением рассеянных частиц
Проходящий сквозь среду луч встречает на пути огромное количество частиц,
движущихся во всех направлениях с различными скоростями. Таким образом,
получается непрерывный спектр вероятности частотных сдвигов S (ω), который имеет центром частоту
возбуждающего луча ω0. На рисунке 5 показан график распределения
спектральной плоскости вероятности частотных сдвигов в рассеянном свете с
Броуновским движением частиц в суспензии.
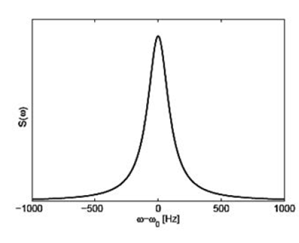
Рис. 5. График распределения спектральной плоскости вероятности частотных
сдвигов в рассеянном свете
В качестве примера рассмотрим диффузию монодисперсных наночастиц,
взвешенных в жидкости. Хаотическое броуновское движение дисперсных частиц
вызывает микроскопические флуктуации их локальной концентрации. В свою очередь,
эти флуктуации приводят к локальным неоднородностям показателя преломления
среды. При прохождении лазерного луча через такую среду часть света будет
рассеяна на этих неоднородностях. Флуктуации интенсивности рассеянного света
будут соответствовать флуктуациям локальной концентрации дисперсных частиц.
Информация о коэффициенте диффузии частиц содержится в зависящей от времени
корреляционной функции флуктуаций интенсивности.
Временная автокорреляционная функция согласно определению имеет следующий
вид:
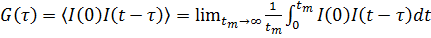
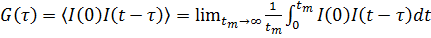 (2)
(2)
где
интенсивность I имеет различные значения во время t и (t-τ). t m - это время интегрирования (время накопления
корреляционной функции), τ - время задержки между двумя точками во времени.
Очевидно, что при τ = 0, автокорреляционная функция равна
среднеквадратичной интенсивности 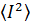
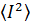 . Для
больших времен корреляция отсутствует, и автокорреляционная функция равна
квадрату средней интенсивности рассеяния:
. Для
больших времен корреляция отсутствует, и автокорреляционная функция равна
квадрату средней интенсивности рассеяния:
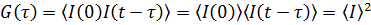
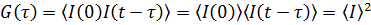 (3)
(3)
В
соответствии с гипотезой Онзагера, релаксация микроскопических флуктуаций
концентрации к равновесному состоянию может быть описана первым законом Фика
(уравнением диффузии):
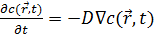
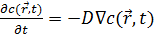 (4)
(4)
Где
r - вектор позиции, c(r, t) - концентрация и D - коэффициент диффузии частиц.
Можно показать, что автокорреляционная функция интенсивности экспоненциально
затухает во времени и характерное время релаксации однозначно связано с D.
Корреляционная функция интенсивности рассеянного света имеет вид:
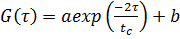
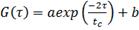 (5)
(5)
где
в соответствии с решением уравнения диффузии обратное время корреляции равно:
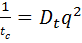
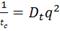 (6)
(6)
Флуктуации
волнового вектора света описывается следующим выражением:

 (7)
(7)
В
выражениях 4-6: a и b -
экспериментальные константы, n- показатель преломления жидкости, в которой
взвешены дисперсные частицы, λ - длина
волны лазерного света и θ - угол рассеяния.

Рис.
6. Схема процесса рассеяния света
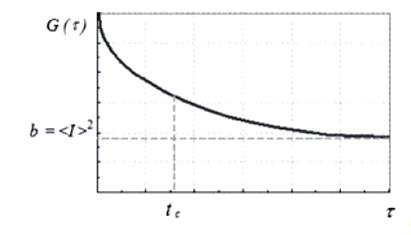
Рис.
7. Автокорреляционная функция рассеянного света.
Константы
tc, a и b могут быть найдены путем аппроксимации
измеренной корреляционной функции теоретической экспоненциальной функцией. Если
форма частиц известна или задана, их размер может быть рассчитан с
использованием соответствующей формулы. Например, для сферических частиц можно
использовать формулу Стокса-Эйнштейна:
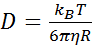
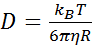 (8)
(8)
где
kB - константа Больцмана, T - абсолютная температура и η - сдвиговая вязкость среды, в которой взвешены
частицы радиуса R.
С
помощью динамического рассеяния света может быть решена также задача измерения
вязкости жидкости. Для случая рассеяния света на дисперсных частицах известного
размера, измеренное характерное время флуктуаций позволяет рассчитать вязкость
жидкости. Проблема аппроксимации экспериментальных данных проста для рассмотренного
случая рассеяния света монодисперсными сферическими частицами. Для
полидисперсных образцов интерпретация экспериментальных данных усложняется. Для
реально достижимой точности измерений могут быть получены только два-три
параметра полидисперсного распределения: средний размер частиц, ширина
распределения и асимметрия распределения.Zetatrac - один
из самых современных анализаторов динамического светорассеяния, позволяющий
работать с высокодисперсными системами в субмикронном диапазоне размеров.
Внешний вид показан на рисунке 8, а схема его измерительной ячейки на рисунке
9.
Анализатор
размеров частиц лазерный Zetatrack предназначен для измерения размеров частиц в
суспензиях, эмульсиях и порошкообразных материалах. Областью применения
анализатора является контроль технологических процессов и качества продукции в
фармацевтической и химической промышленностях, а также научные исследования в
области коллоидной химии и биотехнологии. В основу работы установки положен
метод лазерной дифракции. Суть этого метода определения размеров частиц
основывается на том, что регистрируются не сами частицы, а рассеянный свет от
этих частиц (или дифракционная картинка) и угол рассеяния света универсально
пропорционален размеру частиц. Рассеянное частицами излучение регистрируется
под разными углами с помощью высокочувствительного многоэлементного кремниевого
детектора - фотодиодной матрицы. Излучение полупроводниковых лазеров с помощью
линзы фокусируются в плоскость детектора, проходя при этом через измерительную
кювету в которой осуществляется проток анализируемой суспензии, эмульсии или
сухого порошкообразного материала. При наличии в кювете частиц наблюдается
рассеяние света (дифракция). Индикатриса рассеяния (угловая зависимость
интенсивности рассеянного излучения) определяется размером частиц и длиной
волны лазера (последняя постоянна). Измерение индикатриссы и последующая
программная обработка результатов позволяет за считанные минуты определить
характер распределения частиц по размерам (дисперсионный состав) данной системы.
Фотодиодные матрицы обеспечивают одновременное измерение интенсивности
рассеянного излучения. Экспериментальные значения индикатриссы рассеяния
получаются в результате усреднения данных о светорассении, регистрируемых через
каждые 2 мс. Установив программно длительность анализа например 2 минуты, вы
тем самым фактически выполните 6000 измерений.
Ни
один из традиционных методов дисперсионного анализа (седиментационный, ситовой
или микроскопический) не позволят в такой короткий промежуток времени выполнить
такое количество измерений. Кроме того, при исследовании, например суспензий и
эмульсий, за две минуты все исследуемые частицы успевают пройти через
измерительную кювету несколько раз, что обеспечивает получение устойчивых и в
высокой степени воспроизводимых результатов.
Огромным
преимуществом такой скорости анализа, становится возможность не только контроля
необходимой дисперсности материала, но и наблюдение в режиме реального времени
за процессами агломерации.

Рис.
8. Внешний вид прибора Zetatrac
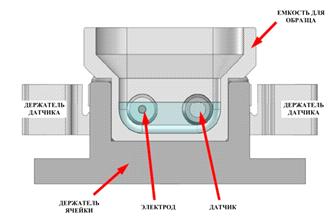
Рис.
9. Измерительная ячейка анализатора частиц Microtrac Zetatrac
В
базовой комплектации предназначен для оперативного определения распределения
частиц по размерам при помощи динамического рассеяния света материалов в виде
суспензий и эмульсий, диапазон измеряемых размеров 0, 8 нм...6, 5 мкм.
Конструкция
прибора оптимизирована для решения сразу трех задач: определения размеров
дисперсной фазы, её зета-потенциала и средневзвешенной молекулярной массы.
Оптическая система анализатора не требует юстировки, и за счет этого
обеспечивается высокая воспроизводимость результатов и долговечность прибора.
Анализатор
размера частиц и зета-потенциала частиц Zetatrac (Зетатрак) управляется
посредством программного обеспечения Microtrac FLEX. Пример диалоговых окон
контроля уровня измеряемого сигнала программного интерфейса показан на рисунке
10, а результатов измерений на рисунке 11.
Microtrac
соответствует стандарту ISO 22412, принятому для измерения динамического
светорассеяния. Технические характеристики прибора представлены в таблице 1.
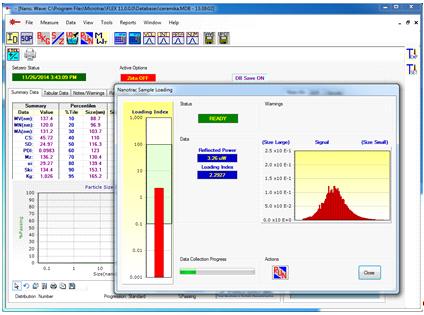
Рис.
10. Диалоговое окно интерфейса программного обеспечения Microtrac FLEX для
контроля уровня измеряемого сигнала
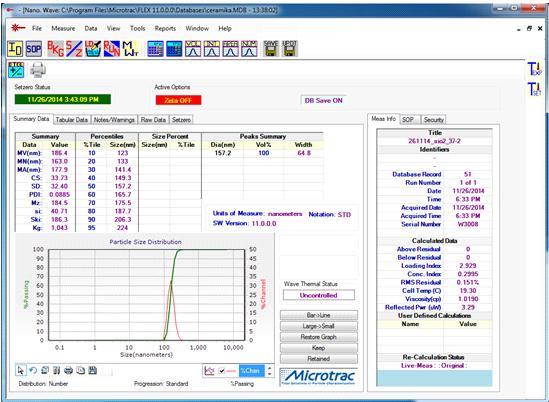
Рис.
11. Вид окна интерфейса программного обеспечения Microtrac FLEX с результатами
измерений
Таблица 1. Технические характеристики прибора Microtrac Zetatrac
|
характеристика
|
значение
|
|
Общие
|
|
модель
|
Microtrac Zetatrac
|
|
объем интегрированной
ячейки образца
|
От 0, 7 до 3 мл
|
|
диапазон измерений частиц
|
от 0, 8 нм до 6.5 мкм
|
|
концентрация
|
от 0.01% мин. до 40% макс.
(типовой образец)
|
|
Диапазон рН
|
от 3 до 11
|
|
Зета-потенциал
|
|
|
диапазон
|
От -125 до +125 мВ
|
|
точность
|
±4 мВ
|
|
Электрофоретическая
подвижность
|
|
диапазон
|
От -10 до +10 нм/сек на
вольт/см
|
|
точность
|
±0, 3 нм/сек на вольт/см
|
|
угол измерения
|
180°
|
|
Пределы концентрации
|
|
верхний
|
до 40%
|
|
нижний
|
0, 1 мг/мл Ликозина
|
|
Оптические компоненты
|
|
лазерный диод
|
780 нм длина волны, 3 мВт
номинал класс 111Б
|
|
Эксплуатационные
характеристики
|
|
требования электропитания
|
От 100 до 240 ВА, от 47 до
63 Гц, 10 Ватт максимально
|
|
температура
|
От 10 до 50°C, ±0, 1°C
|
|
влажность
|
до 90% без конденсации
|
|
габаритные размеры (ШхГхВ)
|
16, 8 х 40, 6 х 16, 5 см
|
|
вес
|
5, 2 кг
|
2.3.2
Атомно-силовой микроскоп Agilent AFM 5420
Атомно-силовой микроскоп относится к классу сканирующих зондовых
микроскопов, предназначенных для получения изображения поверхности и её
локальных характеристик. Процесс построения изображения основан на сканировании
поверхности зондом. В общем случае позволяет получить трёхмерное изображение
поверхности (топографию) с высоким разрешением.
Принцип работы АСМ основан на регистрации межатомных (Ван-дер-Ваальсовых)
взаимодействий между острием исследующего зонда и исследуемой поверхностью.
Принципиальная схема устройства атомно-силового микроскопа представлена на
рисунке 12. Ключевым элементом прибора является зонд, расположенный на
свободном конце упругой консоли, называемой кантилевером. Взаимодействие зонда
с исследуемой поверхностью приводит к изгибу кантилевера, величина которого
пропорциональна величинам действующих сил. Кантилеверы, как правило,
изготавливаются из кремния.
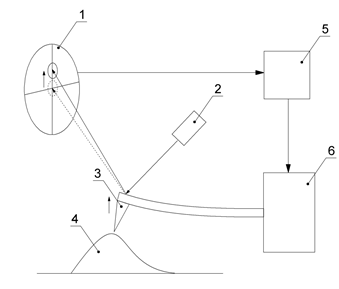
Рис. 12. Схема работы атомно-силового микроскопа. 1.Фотодетектор;
2.Лазер; 3.Зонд; 4.Образец; 5.Система обратной связи; 6. Пъезокерамический
привод XYZ сканера.
Изгибающийся под действием поверхностных сил кантилевер перемещает
отраженный от поверхности свободного конца луч, положение которого в пространстве
регистрируется с помощью четырехсекционного фотоприемника.
Относительное перемещение зонда и образца осуществляется
пьезоэлектрическим сканером, точность перемещения которого составляет десятые
доли ангстрема. Во время сканирования электронная система прибора регистрирует
и поддерживает постоянной величину взаимодействия зонда с поверхностью (т.е.
постоянный изгиб кантилевера), сближая или отдаляя их. Таким образом, в
процессе (рисунок 13) сканирования зонд огибает поверхность, а совокупность траекторий
его перемещения повторяет рельеф поверхности выбранного участка.
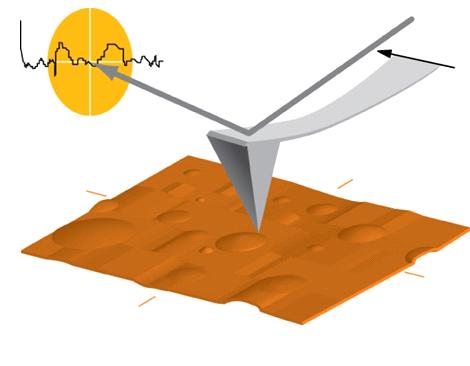
Рис. 13. Иллюстрация процесса сканирования поверхности зондом
атомно-силового микроскопа
Получаемые измерительные данные преобразуются компьютером в трехмерное
изображение, которое выводится на экран монитора.
Высокая чувствительность и разрешающая способность делает АСМ эффективным
средством для изучения геометрических и физических свойств объектов с
молекулярной и кристаллической структурами.
Значительную роль в точности регистрации данных и в выборе их диапазона
играют характеристики используемого зонда - радиус закругления кончика его
острия и коэффициент упругости кантилевера. Кончик может иметь форму тетраэдра,
пирамиды или конуса. На рисунке 14 представлены микрофотографии зондов на
консоли кантилевера.

Рис. 14. Микрофотографии зондов
Выбор зонда и геометрии кончика, силы упругости кантилевера и резонансных
частот определяется областью применения, типос поверхностиисследуемого образца,
средой сканированияи типом получаемого в результате исследования изображения.
Их упругие константы колеблются от 0, 001 до 150 Н/м, а резонансные частоты -
от 50 до 300 кГц.
Технически характеристики
Сканнер.
Диапазоны сканирования:
по осям X и Y - 9 мкм;
по оси Z - 2 мкм.
Уровень шума сканера:
в плоскости XY - <1 Å (СКО);
по оси Z - <0, 2 Å (СКО).
Кантилевер.
Кремниевый кантилевер Type II MACLever фирмы Agilent Technologies со
следующими номинальными характеристиками:
резонансная частота - 75 КГц;
постоянная силы - 2.8 Н/м;
радиус кончика зонда - до 10 нм.
Методы измерений
В контактном режиме зонд сканирует в постоянном контакте с поверхностью.
Главная особенность этого метода - это пространственное разрешение, вплоть до
атомного. Атомное разрешение обуславливается наличием сил трения во время сканирования,
которые периодически удерживая зонд, изгибют при этом кантилевер. Разрешение
определяется усредненным по площади эффективным контактом зонда с поверхностью.
Эффективность контактного режима сильно ограничена возможностью механического
перемещения исследуемых объектов; возможностью неконтролируемого разрушения
адсорбированных слоев, зонда и/или образца; искажением данных и
препятствованием сканированию поверхностными слоями, и практической
невозможностью исследования поверхностей с развитым рельефом. При относительно
сильных взаимодействиях зонд-поверхность контактный режим либо совсем
нечувствителен к мягким поверхностям (зонд их прокалывает и соскребает), либо
наличие этих объектов приводит к появлению артефактов и искажениям на
изображении топографии (зонд вязнет в них или перемещает). На поверхности с
развитым рельефом зонд либо быстро стирается, теряя свою остроту, либо
застревает в каком-либо углублении и стоит, раскачиваясь во время сканирования.
Для сканирования образцов с развитым рельефом или хрупкой структурой
применяется модуляционный метод. Отличительной чертой данного метода является
сканирование зондом, который колеблется около положения равновесия. При
взаимодействии зонда с поверхностью параметры колебательного процесса изменяются
в зависимости от расстояния и ее свойств. В процессе сканирования над
исследуемым участком электронная система управления поддерживает постоянным
среднее расстояние между зондом и поверхностью таким, чтобы амплитуда или
частота колебаний зонда сохранялась равной заданной величине. В результате,
траектория перемещения зонда без учета гармонической составляющей огибает
рельеф поверхности. Так что координаты этой траектории составляют образ
исследуемой поверхности. К модуляционному методу относится прерывисто-контактный
режим. В этом режиме зонд колеблется на резонансой частоте с довольно большой
амплитудой (до 500 нм) вблизи поверхности, касаясь ее. В процессе сканирования
амплитуда колебаний поддерживается постоянной за счет изменения среднего
расстояния зонд-образец электронной системой управления. Так как колебания
производятся на резонансной частоте зонда, то резкий контакт зонда с
поверхностью образца отсутствует и не регистрируется, а траектория перемещения
зонда имеет форму циклоиды. Большая амплитуда колебаний обеспечивает отрыв
зонда от поверхности, затрудняемый адгезионными силами, которые приводят к
сдвигу фазы регистрируемого сигнала. Таким образом, в формирование
регистрируемой траектории сканирования основной вклад вносят адгезионные силы,
величина скачка зонда к поверхности, рельеф поверхности и рельеф
адсорбированных слоев.
Контактный и прерывисто-контактный методы включают в себя следующие
режимы измерения:
а) Режим фазовых изображений.
В прерывисто-контактном методе за счет уменьшения сил трения в нем
уменьшились воздействия на исследуемые объекты и связанные с этими проблемы
перемещения и повреждения из и зонда. При этом, из-за уменьшения расстояния
между зондом и образцом, метод обладает хорошей разрешающей способностью. Режим
фазовых изображений, относящийся к прерывисто-контактной методике, выделяет
информацию об адгезионных силах. В этом режиме отображается не рельеф, а
механическое свойство поверхности. В прерывисто-контактном методе измеряется,
одновременно с топографией, сдвиг фазы между подаваемым и регистрируемым
сигналами. По сути своей, это задержка измеряемого сигнала, которая
определяется временем, которое зонд находится в контакте с поверхностью, и,
которое, очевидно, пропорционально величине силы адгезии зонда с поверхностью.
Таким образом, результатом использования этого режима является карта, которая
косвенно характеризует распределение силы адгезии по исследуемому участку.
б) Режим токовой чувствительности.
В данном режиме используется зонд, покрытый токопроводящей пленкой, для
измерения проводимости и рельефа поверхности исследуемого образца. К
токопроводящим кантилеверу и подложке с исследуемым образцом прикладывается
напряжение смещения. В результате этого возникает ток, значение которого
определяется сопротивлением образца в зоне контакта с кантилевером, и который
регистрируется системой. Результатом является картина распределения
сопротивления измеренной области образца.
в) Магнитный режим.
С помощью магнитного режима исследуется взаимодействие между зондом
покрытым ферромагнитным покрытием и ферромагнитным или парамагнитным образцом
для построения картины распределения доменных структур. Система регистрирует
изменения фазы кантилевера, обусловленные межатомной магнитной силой, которая
оказывает более сильное влияние на отталкивание наконечника и образца, чем силы
Ван-дер-Ваальса. Стандартное изображение рельефа поверхности измеренного
участка образца можно получить при помощи прерывисто-контактного режима. Затем
два изображения отображаются одновременно и с их помощью определяется
зависимость между магнитной структурой и рельефом поверхности образца.
г) Электростатический режим.
Электростатический режим является качественным режимом исследования
изменений естественного и наведенного электростатического поля на поверхности
образца. Между зондом и исследуемым образцом прикладывается напряжение
смещения, что позволяет определить локальные участки статических зарядов и
измерить их концентрацию.
Система регистрирует изменения фазовой характеристики кантилевера,
которые обусловливаются взаимодействием токопроводящего зонда и
электростатического поля поверхности исследуемого образца. Как правило,
изображения получаются путем регистрации изменения фазы колебаний при заданной
частоте.
Состав оборудования АСМ Agilent AFM 5420
Фотография АСМ-микроскопа Agilent AFM 5420, который применялся в ходе
исследований представлена на рисунке 15.

Рис.15. Фотография атомно-силового микроскопа Agilent AFM 5420
Оборудование АСМ состоит из следующих функциональных компонентов,
обеспечивающих методики измерения, которые были изложены выше:
. Контроллер;
. Блок электроники;
3. Виброзащитная камера;
4. Микроскоп;
. Компьютер.
6. Программное обеспечение.
Контроллер (рисунок 16) подает высокое напряжение на пъезоэлектрические
элементы сканнера и обеспечивает проведение измерения в разных режимах
сканирования.

Рис. 16. Фотография контроллера для управления АСМ Agilent AFM 5420
Блок электроники (рисунок 17) принимает измерительные данные от
детектора, передает их на контроллер и отображает на цифровых индикаторах 1 и
2.

Рис. 17. Блок электроники. 1, 2. Индикаторы; 3. Тумблер “Open/Close”; 4. Кнопка выключения
Тумблер “Open/Close” (3) необходим для установки
положения кантилевера перед измерением и служит для перемещения кантилевера относительно
исследуемого образца по высоте в ручном режиме. Также, блок электроники
формирует напряжение колебаний, необходимые для сканирования образца в
прерывисто-контактном режиме.
Виброзащитная камера (рисунок 18) с мраморной платформой, подвешенной на
демпфирующих жгутах, защищает микроскоп от вибраций, воздушной турбулентности и
акустических шумов, которые отрицательно влияют на процесс измерения. Кроме
этого, камера компенсирует колебания температур.

Рис. 18. Виброзащитная камера
Микроскоп
Фотография микроскопа приведена на рисунке 19.

Рис. 19. Фотография микроскопа, где: 1 - видеосистема; 2 - сканер; 3 -
детектор; 4 - насадка и зонд; 5 - предметный столик с регулировкой по осям Х и
У; 6 - основание микроскопа.
Микроскоп из следующих основных компонентов:
. Видеосистема. Видеосистема предназначена для исследования
поверхности образца с целью выбора интересующего участка, в котором будет
проводиться измерение. В состав видеосистемы входит видеокамера и оптика,
встроенные в основание микроскопа.
. Сканер. Сканер содержит систему прецизионного позиционирования
зонда, элементы которого изготовлены из пьезокерамических материалов. Сканер
обеспечивает позиционирование с высокой точностью в трех координатах Х, У и Z.
. Детектор. Съемный фотодиодный детектор принимает отраженный от
кантилевера лазерный луч. Детектор размещается в корпус сканера. Детектор
делится на четыре сегмента, что обеспечивает одновременную регистрацию изгиба и
скручивания зонда для анализа взаимодействия зонда с поверхностью образца.
. Насадка и зонд. Насадка предназначена для крепления зонда. Зонд
надежно удерживается насадкой при сканировании.
. Предметный столик с регулировкой по осям Х и У. Предметный
столик позволяет надежно закрепить исследуемый образец. С помощью поворотных
ручек осуществляется ручное позиционирование.
. Основание микроскопа.
Программное обеспечение
Микроскоп комплектуется программным обеспечением PicoView, представляющий
мощный программный пакет для управления настройкой режимов измерения,
сканированием, калибровкой системы и т.д. Также, программа позволяет
подстраивать параметры измерения в процессе сканирования, сохранять и
обрабатывать полученные результаты измерения. Программа имеет окна управления
видеокамерой. Окна интерфейса программы представлены на рисунках 20 и 21.
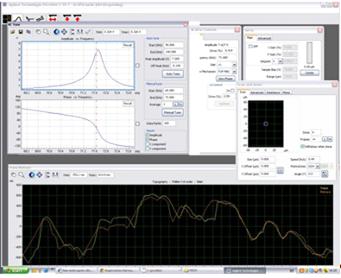
Рис. 20. Окно настройки и управления атомно-силовым микроскопом Agilent
AFM 5420

Рис. 21. Окно интерфейса с результатами измерений на атомно-силовым
микроскопе Agilent AFM 5420
2.4
Экспериментальные исследования
.4.1 Описание процедуры формирования липосомальных контейнеров со
встроенными полупроводниковыми наночастицами
Процесс формировании липосом методом гидратации сухой пленк сводится к
следующей последовательности операций:
. 70 мг (94 µмоль) фосфолипидов (Lipoid S75) и 30 пмоль гидрофобных квантовых точек (lem = 577 nm) в толуоле (52 µл) растворяются в 1 мл хлороформа в
круглодонной колбе (V = 10 мл) при
воздействии ультразвуком при 45оС;
. В образовавшийся раствор добавляется 3 мл воды;
. Выпаривается хлороформ с помощью роторного испарителя;
. Добавляется еще 3 мл воды;
. В течение 60 минут перемешивается раствор с образовавшимися
липосомами при температуре 45оС;
. Раствор подвергается воздействию ультразвука в течение 5 минут
для достижения необходимого размера частиц (оценочно - 100 нм).
Схема данного метода представлена на рисунке 22, а.
Процесс формировании липосом методом выпаривания в обращенной среде
сводится к следующей последовательности операций:
Порядок формирования липосомальных наноконтейнеров, наполненных
квантовыми точками CdSe/ZnS методом выпаривания:
. 70 мг (94 µмоль) фосфолипидов (Lipoid S75) было растворено в 1 мл хлороформа в круглодонной колбе (V = 10 мл);
. Выпаривается хлороформ с помощью роторного испарителя до
образования пленки фосфолипидов на стенках колбы;
. Добавляется 6 мл воды, содержащей 5 µмоль квантовых точек CdSe/ZnS;
. Перемешивание в течение 30 минут при 45оС;
. Воздействие ультразвука в течение 5 минут для достижения
приемлемого размера частиц (оценочно - 100 нм).
Схема данного метода представлена на рисунке 22, б.
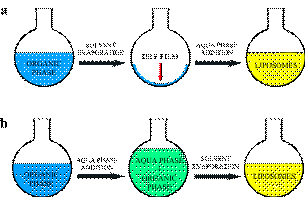
Рис. 22. а) схема получения липосом по методу гидратации сухой пленки, б)
схема получения липосом с помощью выпаривания в обращенной фазе.
Липосомы были изготовлены с использованием следующих материалов:
Фосфолипиды марки Lipoid S80 (Lipoid GMBH, Германия);
Хлороформ (ЗАО "База№1Химреактивов", Россия);
Полупроводниковые наночастицы (квантовые точки) CdSe/ZnS,
предоставленные СГУ имени Н.Г. Чернышевского.
Для
изготовления липосом применялось следующее оборудование:
- Магнитная мешалка Magnetic stirrer MMS 3000;
- Магнитная
мешалка с подогревом Heidolph MR Hei-Tec;
Ванна 1 л;
Печь Binder.
Приготовленные
для исследования суспензии липосом со встроенными наночастицами на рисунках 23
и 24.

Рис.23.
Липосомы полученные методом гидратации сухой пленки.

Рис.24.
Липосомы, полученные методом выпаривания в обращенной фазе.
2.4.2
Калибровка атомно-силового микроскопа
Калибровка микроскопа Agilent 5420 AFM/STM с помощью калибровочных мер
длины TGZ1, TGZ2, TGZ3.
Меры TGZ1, TGZ2, TGZ3 (далее - меры TGZ) относятся к
классу мер рельефных нанометрового диапазона и предназначены для передачи
размера единицы длины в диапазоне 10-9 ÷ 10-4 м и поверки
(калибровки) оптических ближнего поля, растровых электронных, сканирующих
туннельных и атомно-силовых микроскопов и других средств измерений малой длины.
Область применения: оснащение органов государственной и ведомственной
метрологических служб, оснащение лабораторий и испытательных центров, оснащение
научных и учебных лабораторий, применяющих указанное оборудование для
калибровки.
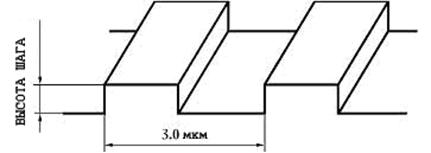
Меры представляет собой совокупность шаговых структур
на поверхности квадратной кремниевой монокристаллической пластины с размерами
квадрата со стороной не более 5 мм, поверхность которой ориентирована
параллельно кристаллографической плоскости (100). Мера состоит из одинаковых
шаговых структур с прямоугольной геометрической формой элемента рельефа шаговой
структуры (Рисунки 25, 26 и 27). Основные технические характеристики мер
приведены в таблице 1.
|
|
|
Рисунок 25 - Схематическое
изображение фрагмента меры
|
|

|
|
Рисунок 26 -
РЭМ-изображение фрагмента меры
|
|
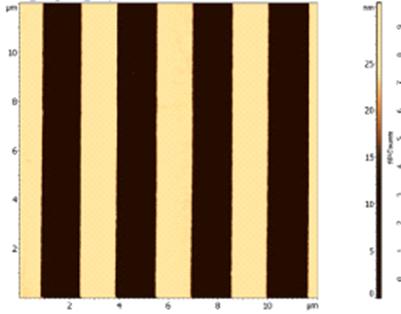
|
|
Рисунок 27 -
АСМ-изображение фрагмента меры
|
Таблица 2. Основные технические характеристики мер.
|
Наименование
|
Значение
|
|
Номинальное значение шага
шаговой структуры меры, мкм
|
3, 00
|
|
Допустимое отклонение от
номинального значения шага периодической структуры не более, мкм
|
± 0, 01
|
|
Диапазоны значений высоты
выступов в шаговых структурах меры, нм - мера TGZ1 - мера TGZ2 - мера TGZ3
|
21, 4 107 560
|
|
Пределы допускаемых
значений абсолютной погрешности определения высоты выступов в шаговых
структурах не более, нм - мера TGZ1 - мера TGZ2 - мера TGZ3
|
±1, 5 ±2 ±2, 6
|
|
Условия эксплуатации: а)
При работе на воздухе - температура окружающего воздуха, °С - относительная
влажность, % - атмосферное давление, Па б) При работе в вакуумных условиях -
диапазон значений остаточного давления в камере образцов микроскопа, Па -
температура держателя образца, оС
|
20 ± 3 65 ± 15 (100
±4)·103 1·10-4 ÷ 270 20 ± 3
|
|
Масса меры должна быть не
более, кг
|
0, 005
|
|
Габаритные размеры меры, мм
|
5.0×5.0×0.5
|
|
Размеры рабочей области
меры, мм
|
3.0×3.0
|
Калибровка атомно-силового микроскопа включает выполнение следующих
действий:
) Включить микроскоп в соответствии с его руководством по эксплуатации;
) Установить меру TGZ1 в держатель микроскопа, подлежащего калибровке;
)Установить кантилевер;
) Навести источник лазерного излучения на основание кантилевера;
) Установить скорость сканирования исходя из технических характеристик
микроскопа;
) Произвести сканирование;
) На полученном фотоизображении измерения выполняются на аттестованной
части меры;
) Сделать снимок;
9)
Построить 5 сечений одного периода профиля мер, записать полученный результат
измерения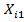
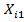 ..
Повторить измерение в двух точках со сдвигом вдоль аттестованной части меры;
..
Повторить измерение в двух точках со сдвигом вдоль аттестованной части меры;
)
Построить 5 сечений профиля меры, записать полученный результат измерения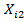
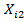 .
Повторить измерение в двух точках со сдвигом вдоль аттестованной части меры;
.
Повторить измерение в двух точках со сдвигом вдоль аттестованной части меры;
)
Построить 5 измерений высоты профиля меры, записать полученный результат измерения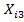
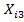 .
Повторить измерение в двух точках со сдвигом вдоль аттестованной части меры;
.
Повторить измерение в двух точках со сдвигом вдоль аттестованной части меры;
)
Повторить измерения высоты профиля 
 . и
. и 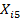
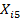 согласно
п.5.2 - 5.10 для мер TGZ2, TGZ3;
согласно
п.5.2 - 5.10 для мер TGZ2, TGZ3;
)
Для 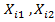
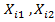 ,
, 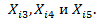
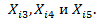 произвести
обработку результатов измерений по п.6.1-6.5;
произвести
обработку результатов измерений по п.6.1-6.5;
)
Если заказчик заявляет калибровку двух и более сканеров, производится его
замена и повторение операций по п. 5.2 - 5.13.
Обработка
результатов измерений производится в следующем порядке:
1)
Рассчитать среднее арифметическое значение результатов измерений для 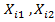
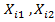 ,
, 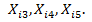
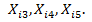 по
формуле 9.
по
формуле 9.
|
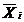 = = 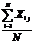 ,(9) ,(9)
|
|
где N - число измерений, N=15; 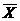 - среднее значение;
- среднее значение;
|
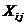 - значение i-го результат измерения. - значение i-го результат измерения.
|
|
2)
Рассчитать средние квадратические отклонения результатов измерений, для 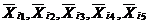 по формуле 10:
по формуле 10:
|
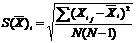 ,(10) ,(10)
|
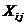 - значение i-го результат измерения. - значение i-го результат измерения.
|
|
3)
Определить границы неисключенной систематической погрешности 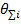 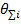 результата
измерений путем суммирования неисключенных систематических погрешностей средств
измерений, метода и погрешностей результата
измерений путем суммирования неисключенных систематических погрешностей средств
измерений, метода и погрешностей 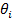 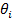 ,
вызванные другими источниками. Эти границы вычисляются по формуле 11: ,
вызванные другими источниками. Эти границы вычисляются по формуле 11:
) В соответствии с РМГ 43-2001 рассчитать неопределенность результата
измерений калибруемого прибора.
Рассчитать стандартную неопределенность, оцененную по типу В, по формуле
6:
Рассчитать суммарную стандартную неопределенность по формуле 7:
|
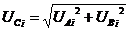 ,(16) ,(16)
|
|
Рассчитать расширенную неопределенность при коэффициенте охвата k=2 по формуле 8
|
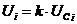 ,(17) ,(17)
|
|
) За результаты измерений расширенной неопределенности
принимают наибольшее полученное значение во всем диапазоне измерений.
В ходе измерений были получены АСМ-изображения, которые обрабатывались с
помощью ПО Gwiddyon. На рисунках 28 и 29 представлены пример полученного
изображения и его 3D-реконструкция.

Рис. 28. 2D-изображение меры

Рис. 29. 3D-реконструкция меры
Результаты были получены при следующих параметрах сканирования:
. Скорость сканирования: 0, 5 Гц;
2. Чувствительность обратной связи (Gain): 8.6
. Размер области сканирования: 35х35 мкм2;
. Разрешение кадра: 512х512.
Результаты калибровки, включая неопределенность, представлены в таблицах
3 - 7.
Таблица 3. Результаты измерений шага шаговой структуры TGZ1 (3, 00±0, 01)
мкм
|
№
|
Измеренное значение, мкм
|
Среднее значение, мкм
|
Неопределенность
|
|
|
|
по типу А, мкм
|
по типу B, мкм
|
Суммарная, мкм
|
Расширенная, мкм
|
|
1
|
2, 94
|
2, 94
|
0, 01
|
0, 01
|
0, 03
|
0, 06
|
|
2
|
2, 94
|
|
|
|
|
|
|
3
|
2, 94
|
|
|
|
|
|
|
4
|
2, 97
|
|
|
|
|
|
|
5
|
2, 94
|
|
|
|
|
|
|
6
|
2, 94
|
|
|
|
|
|
|
7
|
2, 94
|
|
|
|
|
|
|
8
|
2, 95
|
|
|
|
|
|
|
9
|
2, 95
|
|
|
|
|
|
|
10
|
2, 94
|
|
|
|
|
|
|
11
|
2, 95
|
|
|
|
|
|
|
12
|
2, 96
|
|
|
|
|
|
|
13
|
2, 94
|
|
|
|
|
|
|
14
|
2, 95
|
|
|
|
|
|
|
15
|
2, 94
|
|
|
|
|
|
Таблица 4. Результаты измерений высоты выступов шаговой структуры TGZ1
(21, 4±1, 5) нм
|
№
|
Измеренное значение, нм
|
Среднее значение, нм
|
Неопределенность
|
|
|
|
по типу А, нм
|
по типу B, нм
|
Суммарная, нм
|
Расширенная, нм
|
|
1
|
21, 84
|
21, 9
|
0, 1
|
0, 9
|
0, 9
|
1, 8
|
|
2
|
22, 11
|
|
|
|
|
|
|
3
|
21, 9
|
|
|
|
|
|
|
4
|
21, 85
|
|
|
|
|
|
|
5
|
21, 1
|
|
|
|
|
|
|
6
|
22, 05
|
|
|
|
|
|
|
7
|
22, 03
|
|
|
|
|
|
|
8
|
22, 08
|
|
|
|
|
|
|
9
|
21, 95
|
|
|
|
|
|
|
10
|
22, 11
|
|
|
|
|
|
|
11
|
22, 01
|
|
|
|
|
|
|
12
|
22, 01
|
|
|
|
|
|
|
13
|
21, 09
|
|
|
|
|
|
|
14
|
22, 04
|
|
|
|
|
|
|
15
|
22, 38
|
|
|
|
|
|
Таблица 5 Результаты измерений шага шаговой структуры TGZ2 (3, 00±0, 01)
мкм
|
№
|
Измеренное значение, мкм
|
Среднее значение, мкм
|
Неопределенность
|
|
|
|
по типу А, мкм
|
по типу B, мкм
|
Суммарная, мкм
|
Расширенная, мкм
|
|
1
|
3, 03
|
2, 95
|
0, 02
|
0, 06
|
0, 12
|
0, 12
|
|
2
|
2, 94
|
|
|
|
|
|
|
3
|
2, 94
|
|
|
|
|
|
|
4
|
2, 93
|
|
|
|
|
|
|
5
|
2, 94
|
|
|
|
|
|
|
6
|
2, 95
|
|
|
|
|
|
|
7
|
2, 94
|
|
|
|
|
|
|
8
|
2, 95
|
|
|
|
|
|
|
9
|
2, 94
|
|
|
|
|
|
|
10
|
2, 94
|
|
|
|
|
|
|
11
|
2, 94
|
|
|
|
|
|
|
12
|
2, 95
|
|
|
|
|
|
|
13
|
2, 94
|
|
|
|
|
|
|
14
|
2, 94
|
|
|
|
|
|
|
15
|
2, 95
|
|
|
|
|
|
Таблица 6. Результаты измерений высоты выступов шаговой структуры TGZ2
(107±2) нм
|
№
|
Измеренное значение, нм
|
Среднее значение, нм
|
Неопределенность
|
|
|
|
по типу А, нм
|
по типу B, нм
|
Суммарная, нм
|
Расширенная, нм
|
|
1
|
113, 2
|
112, 0
|
0, 1
|
3
|
3
|
6
|
|
2
|
111, 8
|
|
|
|
|
|
|
3
|
111, 3
|
|
|
|
|
|
|
4
|
111, 7
|
|
|
|
|
|
|
5
|
111, 0
|
|
|
|
|
|
|
6
|
111, 8
|
|
|
|
|
|
|
7
|
112, 3
|
|
|
|
|
|
|
8
|
112, 5
|
|
|
|
|
|
|
9
|
112, 8
|
|
|
|
|
|
|
10
|
111, 7
|
|
|
|
|
|
|
11
|
112, 0
|
|
|
|
|
|
|
12
|
112, 1
|
|
|
|
|
|
|
13
|
112, 0
|
|
|
|
|
|
|
14
|
112, 0
|
|
|
|
|
|
|
15
|
111, 8
|
|
|
|
|
|
Таблица 7. Результаты измерений высоты выступов шаговой структуры TGZ3
(560±2, 6) нм
|
№
|
Измеренное значение, нм
|
Среднее значение, нм
|
Неопределенность
|
|
|
|
по типу А, нм
|
по типу B, нм
|
Суммарная, нм
|
Расширенная, нм
|
|
1
|
551, 4
|
553, 3
|
0, 3
|
4, 1
|
4, 1
|
8, 2
|
|
2
|
551, 4
|
|
|
|
|
|
|
3
|
551, 4
|
|
|
|
|
|
|
4
|
551, 4
|
|
|
|
|
|
|
5
|
552, 4
|
|
|
|
|
|
|
6
|
554, 1
|
|
|
|
|
|
|
7
|
554, 1
|
|
|
|
|
|
|
8
|
554, 4
|
|
|
|
|
|
|
9
|
554, 1
|
|
|
|
|
|
|
10
|
554, 1
|
|
|
|
|
|
|
11
|
554, 4
|
|
|
|
|
|
|
12
|
554, 1
|
|
|
|
|
|
|
13
|
554, 1
|
|
|
|
|
|
|
14
|
554, 4
|
|
|
|
|
|
|
15
|
554, 1
|
|
|
|
|
|
Значения параметров сканирования не регламентируются методикой
калибровки. Дается лишь рекомендация установить скорость сканирования в
соответствии с техническими характеристиками микроскопа.
В ходе работы были получены топографии мер TGZ1 при различных скоростях
сканирования (0, 3/0, 5/0, 7 Гц).
Профили рельефа представлены на рисунках 30 - 31.
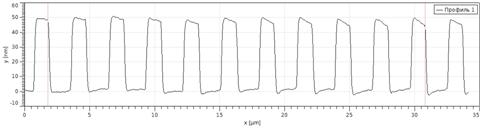
Рис. 30. Профиль рельефа, полученного при сканировании со скоростью 0, 3
Гц
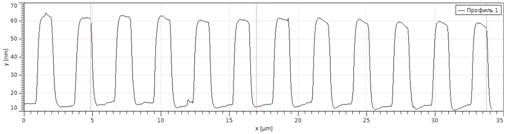
Рис. 31. Профиль рельефа, полученного при сканировании со скоростью 0, 5
Гц
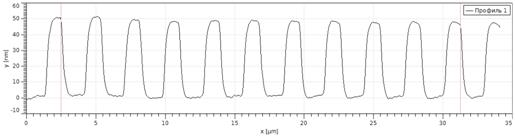
Рис. 32. Профиль рельефа, полученного при сканировании со скоростью 0, 9
Гц
Среднее значение шага меры, измеренных с помощью профилей, составило: при
скорости сканирования 0, 3 Гц - 3, 0 мкм; при скорости 0, 5 Гц - 2, 95 мкм, при
скорости 0, 9 Гц - 2, 97 мкм.
2.4.3
Калибровка анализатора частиц
Для калибровки анализатора частиц использовался стандартный образец
суспензии монодисперсных частиц фирмы Duke Scientific Corporation (Thermo Fisher Scientific Corporation). Частицы были аттестованы с помощью
ТЭМ Национального Института Стандартов и Технологий (NIST, Гейтерсберг). Частицы представляют собой полимерные
микросферы диаметром (102±3)нм. В Таблице приведены технические характеристики
стандартного образца. Сертификат калибровки приведен в Приложении.
Таблица 8. Технические характеристики стандартного образца 3100А
|
Материал
|
Полистирол
|
|
Относительное объемное
содержание частиц твердой фазы, %
|
1
|
|
Диаметр, нм
|
102±3
|
|
Концентрация частиц, г/см3
|
1, 05
|
|
Показатель преломления на
длине волны 589 нм
|
1, 59
|
2.4.4
Измерение геометрических параметров липосомальных контейнеров и
полупроводниковых наночастиц методами атомно-силовой микроскопии
Измерения образцов липосомальных контейнеров и полупроводниковых
наночастиц выполнялись по следующей методике:
) Включить все блоки измерительного комплекса;
) В зависимости от исследуемого образца и режима измерения выбрать
необходимый тип кантилевера;
) В зависимости от области, которую необходимо исследовать, выбрать
сканер на 9 мкм или на 90 мкм;
) При помощи специальных приспособлений установить кантилевер в насадку;
) Установить насадку в сканер;
) Установить сканер в станину микроскопа, подключить разъемы;
) Устновить в сканер фотодетектор, подключить разъемы;
) В программе микроскопа выбрать требуемый режим измерения - контактный
или прерывисто-контактный;
) Произвести юстировку лазерного луча и фотодетектора;
) В случае измерения в осцилляционном режиме выполнить настройку на
рабочую частоту кантилевера;
) Установить исследуемый образец на предметный столик;
) Сфокусировать видеосистему на кончик кантилевера;
) Используя видеосистему для контроля, нажатием тумблера “Close/Open” (на блоке электроники) подвести кончик кантилевера
максимально близко к поверхности исследуемого образца;
) Далее действия производятся в программе;
) Нажатием кнопки “Approach” выполнить автоматическое "приземление" кантилевера на
поверхность образца;
) Установить начальное значение параметров чувствительности “I Gain” и “P Gain” (как правило - 10 %);
) Ввести значение скорости сканирования “Scan Speed” в линиях в секунду. Как правило, для начала
устанавливается 1 линия в секунду;
) Установить разрешение сканирования 1024;
) Задав сначала большую область сканирования, выполнить несколько
проходов сканера, с помощью кнопки “Down”;
) Найти на полученном изображении интересующие области, и исследовать их,
уменьшив область сканирования;
) Для получения оптимального качества изображения и уменьшения количества
шума, экспериментировать с настройками чувствительности и усиления;
) После получения изображений интересующих областей остановить процесс
сканирования повторным нажатием кнопки “Down”;
) Сохранить измерительные данные с указанием названия образца;
) По завершении измерения необходимо отвести кантилевер от поверхности
образца, нажав кнопку “Withdraw”;
) В ПО для обработки результатов выполнить действия для получения данных
о профиле поверхности, шероховатости, получить изображения 3D-модели поверхности и т.д.;
) Сохранить обработанные данные;
) Выйти из ПО микроскопа, выключить питание всех блоков измерительного
комплекса.
Методами атомно-силовой микроскопии (АСМ) определялись геометрические
параметры исследуемых образцов в составе сухих пленок. В связи с тем, что
липосома имеет в своей основе хрупкую конструкцию для контактных методов АСМ
диагностики, был выбран амплитудно-модуляционный режим измерения топологии
поверхности пленки. В таком режиме сканирующий зонд АСМ (кантелевер), совершая
колебания с контролируемой амплитудой, касается измеряемого объекта не постоянно,
а с частотой, соответствующей резонансу колебаний зонда, что приводит к
уменьшению давления зонда на поверхность.
АСМ данные топологии участков пленок на основе липосом были получены с
помощью АСМ оборудования фирмы Agilent Technologies Inc (USA) AFM 5420. В ходе исследования
использовался пьезосканер с диапазонами перемещений по осям XY и Z - 9х9х2 мкм3.
Уровень шума для данного сканера составляет <1 Å (СКО) в плоскости XY и <0.2 Å (СКО) по оси Z. Перед началом
исследований микроскоп был откалиброван на тестовых образцах TGX11 и TGZ02.
Определение геометрических параметров осуществлялось с помощью программного
модуля Gwyddion предназначенного для визуализации и
анализа данных, полученных с помощью измерительных средств сканирующей зондовой
микроскопии (в том числе АСМ).
Сканирование поверхности образца осуществлялось на нескольких участках
(до 5). Максимальный размер области сканирования составил 9х9 мкм2,
минимальный - 1х1 мкм. Частота развертки сканирования составила до 1 Гц. В
качестве зонда применялся кремниевый кантилевер Type II MACLever фирмы Agilent
Technologies со следующими номинальными характеристиками: резонансная частота -
75 КГц; постоянная силы - 2.8 Н/м; радиус кончика - до 10 нм.
На рисунке 29 представлены результаты исследования образцов, содержащих
полупровониковые наночастицы, липосомы без квантовых точек и липосомы,
наполненные квантовыми точками.
  
а. б.
в
Рис. 29. Результаты исследования образцов, содержащих а)
полупроводниковые наночастицы, б, в) липосомы со встроенными наночастицами.
В таблице 9 представлены результаты определения геометрических параметров
(значение высоты по Z)
полупроводниковых наночастиц, липосомальных контейнеров, изготовленных методом
гидратации сухой пленки и липосомальных контейнеров, изготовленных методом
выпаривания в обращенной фазе.
Таблица 9. Результаты определения диаметра полупроводниковых наночастиц,
липосомальных контейнеров
|
Название образца
|
Выборка (N),
шт.
|
Размер частиц, нм
|
Ст.отклонение (σ), нм
|
|
Полупроводниковые
наночастицы
|
50
|
10±1, 8
|
2
|
|
Липосомальные контейнеры,
изготовленные методом гидратации сухой пленки
|
20
|
70±1, 8
|
5, 6
|
|
Липосомальные контейнеры,
изготовленные методом выпаривания в обращенной фазе
|
20
|
80±1, 8
|
13
|
Следует отметить, что АСМ методы малопригодны для измерения липосом. При
исследовании липосом в воздушной среде, контейнеры при испарении воды начинают
разрушаться. Дополнительно искажение геометрии контейнеров вызвано воздействием
зонда при измерениях в режиме постоянного контакта и прерывистого контакта.
При измерениях в водной среде липосомы не фиксируются на подложке, что
приводит к нарушению стабильности контакта зонда и поверхности контейнера.
.5.5 Измерение геометрических параметров липосомальных контейнеров и
полупроводниковых наночастиц с помощью метода динамического лазерного рассеяния
Измерения образцов липосомальных контейнеров и полупроводниковых
наночастиц выполнялись по следующей методике:
) Включить анализатор частиц. Включить компьютер и запустить программу FLEX. Дать анализатору прогреться в
течение 15 минут. Температура в помещении также должна быть постоянной.
) В программе FLEX, нажав на
кнопу «SOP» на панели управления, выставить
параметры растворителя (показатель преломления, вязкость при температурах 20 и
30о.С), параметры исследуемых частиц (показатель преломления, если
частицы не являются поглощающими), время анализа, количество актов анализа,
название образца.
) Поместить в рабочую ячейку анализатора раствор сравнения,
представляющий собой растворитель, для записи сигнала фона. Следить, чтобы во
время внесения раствора не образовывались пузырьки воздуха.
) Записать фоновый сигнал растворителя, нажав на кнопку «S/Z» на панели управления.
) Удалить растворитель из ячейки анализатора частиц и поместить туда
исследуемый раствор. Следить, чтобы во время внесения раствора не
образовывались пузырьки воздуха.
) Нажать на кнопку "LD" на панели инструментов программы FLEX, чтобы запустить экран загрузки
анализатора частиц. Программа определит концентрацию образца. Точные показатели
преломления для частиц и растворителя необходимы имеено здесь для правильного
расчета концентрации. Если «полоса загрузки» слева находится в допустимых
пределах, в верхней части окна появится статус «Ready», после чего можно
приступить к измерениям, нажав на кнопку «RUN». Если концентрация образца слишком высока («полоса
загрузки» слева выше верхнего допустимого предела) необходимо разбавить образец
и повторить операцию. Если концентрация слишком низка, и «полоса загрузки» ниже
допустимого предела, появится статус «ADD SAMPLE» (добавьте
образец).
) Закрыть программу, сохранив полученные данные.
) Тщательно промыть рабочую ячейку анализатора сначала специальным
раствором, поставляемым в комплекте с прибором, затем - дистиллированной водой.
) Выключить анализатор частиц. Выключить компьютер.
В таблице 10 представлены результаты определения геометрических параметров
полупроводниковых наночастицчастиц, липосомальных контейнеров, изготовленных
методом гидратации сухой пленки и липосомальных контейнеров, изготовленных
методом выпаривания в обращенной фазе.
Таблица 10. Результаты измерений полупроводниковых наночастиц и
липосомальных контейнеров
|
Название образца
|
Размер частиц
(пиковоезначение), нм
|
Разброс, нм
|
|
Полупроводниковые
наночастицы
|
8
|
±4 нм
|
|
Липосомальные контейнеры,
изготовленные методом гидратации сухой пленки
|
90
|
±10 нм
|
|
Липосомальные контейнеры,
изготовленные методом выпаривания в обращенной фазе
|
95
|
±30 нм
|
На рисунках 30 и 31 представлены графики распределения частиц по размерам
в исследованных образцах, полученные на анализаторе частиц Zetatrack (Microtrac, США).
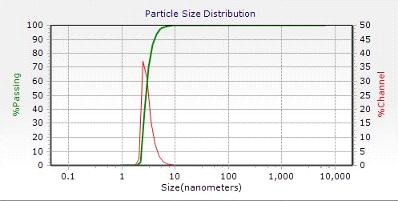
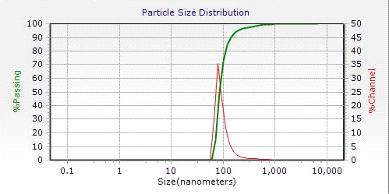
б
Рис. 30. Графики распределения частиц по размерам в исследованных
образцах, полученные на анализаторе частиц. а) полупроводниковые наночастицы,
б) липосомальные контейнеры, изготовленные методом гидратации сухой пленки.
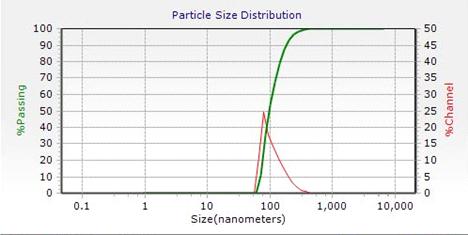
в
Рис. 31. График распределения частиц по размерам в исследованных образцах
липосомальных контейнеров, изготовленных методом выпаривания в обращенной фазе,
полученные на анализаторе частиц
Заключение
В рамках дипломной работы были решены следующие задачи:
Был проведен сравнительный анализ 8 методов формирования липосомальных
контейнеров со встроенными в них полупроводниковыми наночастицами CdSe/ZnS. По
результатам анализа были выбраны для исследования 2 метода изготовления липосом
и встраивания в них полупроводниковых наночастиц: метод обращения фаз и метод
гидратации сухой пленки. Исследование методов заключалось в измерении среднего
значения диаметра липосомальных контейнеров формируемых двумя методами и
определении разброса значений диаметра;
Были выбраны рациональные методы и средства измерения геометрических
свойств полупроводниковых частиц и липосомальных контейнеров со встроенными
полупроводниковыми наночастицами. Для измерения полупроводниковых наночастиц
рациональными методами являются АСМ и ДРС, для измерения липосомальных
контейнеров;
В целях обеспечения единства измерений была проведена калибровка
выбранных средств измерений;
Были проведены измерения геометрических свойств полупроводниковых
наночастиц CdSe/ZnS. Среднее значение диаметра полупроводниковых наночастиц
измеренных методами АСМ составило 10 нм с неопределенностью ±1, 8 нм. Среднее
значение диаметра полупроводниковых наночастиц измеренных методами ДРС
составило 8 нм;
Были проведены измерения геометрических свойств липосомальных контейнеров
изготовленных исследуемыми методами. Среднее значение диаметр липосомальных
контейнеров, изготовленные методом гидратации сухой пленки составил 90 нм с
разбросом по диаметру - ±10 нм. Среднее значение диаметра липосомальных
контейнеров, изготовленных методом выпаривания в обращенной фазе составил 95 нм
с разбросом по диаметру - ±30 нм.
На основании измерений липосомальных контейнеров можно сделать вывод, что
метод гидратации сухой пленки обеспечивает минимальный разброс значений
диаметра.
Список использованных источников
1. В. Л.
Миронов «Основы сканирующей зондовой микроскопии». Учебное пособие для
студентов старших курсов высших учебных заведений;
. Нагорнов
Ю.С., Ясников И.С., Тюрьков М.Н. «Способы исследования поверхности методами
атомно-силовой и электронной микроскопии». Учебное пособие;
. А.Г.
Сергеев «Нанометрология», 2011г;
. А.Г.Дивин,
С.В. Пономарев «Методы и средства измерений, испытаний и контроля»
.
Учебно-методические материалы Института биохимии им. А.Н.Баха РАН:
«Сравнительный анализ методов выделения, очистки, идентификации и определения
содержания ТНЧ в биоматериале, используемых в отечественной и зарубежной
практике, в том числе методов, разрабатываемых в проектах Рамочных программ ЕС
и рекомендуемых нормативами Европейского Союза.»;
6.
Douglas B. Murphy, Michael W. Davidson FUNDAMENTALS OF LIGHT MICROSCOPY AND
ELECTRONIC IMAGING A JOHN WILEY & SONS, INC., 2012;
.
Stephen J. Pennycook Peter D. Nellist Scanning Transmission Electron
Microscopy. Imaging and Analysis, Springer, 2011;
Williams,
David B., Carter, C. Barry Transmission Electron Microscopy, Springer, 2009;
9. Yi Zhang
<http://link.springer.com/search?facet-creator=%22Yi+Zhang%22>, Jun Hu
<http://link.springer.com/search?facet-creator=%22Jun+Hu%22>, Xudong Xiao
<http://link.springer.com/search?facet-creator=%22Xudong+Xiao%22> The
Application of STM and AFM in Nanoprocess and Fabrication, Microsystems and
Nanotechnology <http://link.springer.com/book/10.1007/978-3-642-18293-8>,
2012;
. A. S. Kozlov
<http://link.springer.com/search?facet-creator=%22A.+S.+Kozlov%22>, A. K.
Petrov <http://link.springer.com/search?facet-creator=%22A.+K.+Petrov%22>,
N. A. Vinokurov
<http://link.springer.com/search?facet-creator=%22N.+A.+Vinokurov%22>
Study of nanoobjects of different nature using submillimeter laser ablation
Optoelectronics, Instrumentation and Data Processing <http://link.springer.com/journal/11974>,
Volume 47, Issue 4 <http://link.springer.com/journal/11974/47/4/page/1>,
2011;
. Lakowicz, Joseph
R. Principles of Fluorescence Spectroscopy, 3rd edition, Springer,
2006.
12. Безруков Д.А.,
канд.дисс.: Технологии получения комбинированных липосомальных препаратов
доксорубицина, МИТХТ им.М.В.Ломоносова, 2007.
13. Olson F., Hunt
C.A., Szoka F.C. et al. Preparation of liposome of defined size distribution by
extrusions through polycarbonate membranes. - Biochim. et Biophys. acta, 1979,
vol. 557, p.9-23.
14. Биотехнология получения
лекарственных и иммуногенных липосомальных композиций, используемых в лечении
экспериментальных особо опасных инфекций и получении сырья для производства
медицинских иммунобиологических препаратов. Таран Татьяна Викторовна,
диссертация... доктора медицинских наук; ГОУВПО "Ставропольский
государственный университет"], Ставрополь, 2004
15 Evaluation of
the high-pressure extrusion technique as a method for sizing plasmid
DNA-containing cationic liposomes.Carstens
MG
<http://www.ncbi.nlm.nih.gov/pubmed?term=%22Carstens%20MG%22%5BAuthor%5D>,
van der Maaden K
<http://www.ncbi.nlm.nih.gov/pubmed?term=%22van%20der%20Maaden%20K%22%5BAuthor%5D>,
van der Velden D <http://www.ncbi.nlm.nih.gov/pubmed?term=%22van%20der%20Velden%20D%22%5BAuthor%5D>,
Ottenhoff TH
<http://www.ncbi.nlm.nih.gov/pubmed?term=%22Ottenhoff%20TH%22%5BAuthor%5D>,
Melief CJ
<http://www.ncbi.nlm.nih.gov/pubmed?term=%22Melief%20CJ%22%5BAuthor%5D>,
Ossendorp F <http://www.ncbi.nlm.nih.gov/pubmed?term=%22Ossendorp%20F%22%5BAuthor%5D>,
Bouwstra JA
<http://www.ncbi.nlm.nih.gov/pubmed?term=%22Bouwstra%20JA%22%5BAuthor%5D>,
Jiskoot W
<http://www.ncbi.nlm.nih.gov/pubmed?term=%22Jiskoot%20W%22%5BAuthor%5D>.,
J Liposome Res., 2011
16.Berden J.A.,
Barker R.W., Radda G.K. NMR studies on phospholipids bilayers: some factors
affecting lipid distribution. - Biochim. et Biophys. acta, 1975, vol. 375,
p.186-208.
.Hauser H.O. The
effect of ultrasonic irradiation on the chemical structure of egg lecithin. -
Biochim. and Biophys. Res. Communs, 1971, vol. 45, p.1049-1055
. Huang C. Studies
on phosphatidylcholine vesicles: Formation and physical characteristics. -
Biochemistry, 1969, vol. 8, p. 344-359
.Papahadjopoulos
D., Watkins J.C. Phospholipid model membranes. ll. Permeability properties of
hydrated liquid crystals. Biochim. et Biophys. acta, 1967, vol. 135, p.639-652
Lawaczek K.,
Kainosho M., Chan S.J. The formation and annealing of structural defects in
lipid bilayer vesicles. - Biochim. et Biophys. acta, 1976, vol. 43, p.313-330
.Roseman M.,
Litman B.J., Thompson T.E. Transbilayer exchange of phosphatidylethanolamine
for phosphatidylcholine and N-acetimidoylphosphatidylethabolamine in
single-walled bilayer vesicles. - Biochemistry, 1975, vol. 14, p.4826-4830
.Watts A., Marsh
D., Knowles P.E. Characterization of dymiristoylphosphatidylcholine vesicles
and their dimensional changes through the phase transition: molecular control
of membrane morphology. - Biochemistry, 1978, vol. 17, p.1792-1801
.Ohno M., Sakai
T., Tsuchida E. et al. Interaction of human erythrocyte ghosts or liposomes
with polyethylene glycol detected by fluorescence polarization. - Biochim. and
Biophys. Res. Communs, 1981, vol. 102, p.426-431
.Dearden S.J.,
Hunter T.F., Philp J. A rapid method for the preparation of microvesicles of
egg yolk lecithin. - Biochim. et Biophys. acta, 1982, vol. 689, p.415-418
.Kremer J.M.H.,
Esker M.W.J., Pathmamanoharan C., Wiersema P.H. Vesicles of variable diameter
prepared by a modified injection method. - Biochemistry, 1977, vol. 16,
p.3933-3935
.Schieren H.,
Rudolph S., Finkelstein M. et al. Comparison of large unilamellar vesicles
prepared by a pethroleum ether vaporization method with multilamellar vesicles.
- Biochim. et Biophys. acta, 1979, vol. 572, p.137-153
27. Липосомы в биологических
системах. Под редакцией Г.Грегориадиса, А.Аллисона, Москва, «Медицина», 1983
. Измерение размеров
наночастиц методом динамического рассеяния света, Т.Н. Лупанова ЦКП ИБГ РАН
Методическое пособие Москва 2013г;
29. Huang C.
Studies on phosphatidylcholine vesicles: Formation and physical
characteristics. - Biochemistry, 1969, vol. 8, p. 344-359;
30. Метрологическое
обеспечение нанотехнологий и продукции наноиндустрии. Под ред. В.Н.Крутикова.
Учебное пособие. Москва «Логос», 2011г.
Похожие работы на - Выбор метода формирования липосомальных контейнеров со встроенными в них полупроводниковыми наночастицами
|