Новые возможности применения диметилацеталя диметилформамида при получении производных органических соединений для их хроматографического и хромато-масс-спектрометрического анализа
Санкт-Петербургский
государственный университет
Химический
институт
Кафедра
органической химии
Дипломная
работа
Новые
возможности применения диметилацеталя диметилформамида при получении
производных органических соединений для их хроматографического и
хромато-масс-спектрометрического анализа
Студентки 5 курса
Пушкаревой Татьяны Ивановны
Научный руководитель
д.х.н., проф. Зенкевич Игорь
Георгиевич.
Санкт-Петербург
2015 г.
Содержание
Введение
. Обзор литературных данных
.1 Синтез диалкилацеталей
диметилформамида
.2 Реакции диалкилацеталей
диметилформамида
.2.1 Алкилирование соединений,
содержащих группы с активными атомами водорода
.2.2 Диметилацеталь диметилформамида
как эквивалент карбонильной группы при образовании оснований Шиффа в реакции с
первичными аминами
.2.3 Реакции вторичных аминов с
DMF-DMA
.2.4 Другие реакции DMF-DMA в
органическом синтезе
.3 Применение диметилацеталя
диметилформамида в качестве реагента для дериватизации аналитов в газовой
хроматографии
.3.1 Алкилирование соединений с
активными атомами водорода
.3.2 Получение N-DMAM производных
первичных аминов
.3.3 Взаимодействие вторичных аминов
с DMF-DMA
.3.4 Получение производных
аминокислот
. Экспериментальная часть
.1 Реагенты
.2 Условия проведения реакции
.3 Условия газохроматографического
анализа
.4 Условия масс-спектрометрического
анализа
.5 Обработка результатов
. Обсуждение результатов
.1 Особенности выбора неподвижной
фазы
.2 Проверка возможности
дериватизации аминокислот DMF-DMA на модельных соединениях
.3 Методы расчета RI с
использованием аддитивных схем
.4 Закономерности
масс-спектрометрического распада N-DMAM производных аминов
.5 Механизм реакции дериватизации
аминокислот DMF-DMA
.6 Особенности реакции DMF-DMA с
аминокислотами содержащими -SH, -NH-, -OH группы
.7 Закономерности
масс-спектрометрического распада N-DMAM-Me производных аминокислот
.8 Идентификация продуктов
взаимодействия DMF-DMA с аминокислотами с использованием аддитивной схемы
.9 Дериватизация карбонильных
соединений DMF-DMA. Идентификация продуктов взаимодействия карбонильных
соединений и DMF-DMA с использованием аддитивных схем
.10 Закономерности
масс-спектрометрического распада DMAM производных карбонильных соединений
Выводы
Список литературы
Приложение
Введение
Непосредственный газохроматографический
анализ нелетучих и термически нестабильных соединений невозможен. Для его
осуществления в стадию пробоподготовки может быть включена обработка аналитов
различными реагентами с целью получения их производных (дериватизация). В
газовой хроматографии это необходимо для перевода нелетучих соединений в более
летучие производные, снижения их полярности, и, как следствие, улучшения
хроматографических характеристик.
Однако далеко не все возможные органические
реакции находят применение в аналитических целях. Для реакций дериватизации
существует несколько критериев [1]:
· Экспериментальные операции должны быть
максимально простыми. Предпочтительно проведение реакции при комнатной
температуре за минимальное время. Для сокращения времени допустимо нагревание
реакционных смесей в запаянных ампулах. Возможно проведение реакции при
дозировании реакционной смеси в нагретый испаритель хроматографа или
хромато-масс-спектрометра (так называемая флеш-дериватизация).
· Количество стадий должно быть
минимальным. Многостадийные процессы должны соответствовать принципу "single
pot". Процедура
не должна включать извлечение производных, удаление избытка реагентов и
побочные, а побочные продукты не должны влиять на проведение анализа, и должны
легко отделяться от целевых веществ.
· Выходы продуктов должны быть
максимальными и воспроизводимыми.
· Реакция одного субстрата с одним
реагентом должна приводить к образованию, желательно, одного производного.
При наличии в соединении нескольких
функциональных групп с активными атомами водорода для получения летучих
производных требуется их одновременная замена на ковалентно связанные
фрагменты. В середине 1970-х годов был предложен новый тип реагентов для
одновременной дериватизации -СO2H
и -NH2
групп - диалкилацетали N,N-диметилформамида.
К настоящему времени эти реагенты получили широкое распространение, особенно
диметилацеталь N,N-диметилформамида
(1, DMF-DMA). Используют также диэтил-, диизопропил- и ди-трет-бутилацетали
диметилформамида.
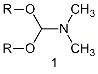
R = CH3, CH2CH3,
CH(CH3)2, C(CH3)3.
Свободные аминокислоты (2) разлагаются при
плавлении, поэтому для газохроматографического определения их необходимо
переводить в летучие, термически стабильные производные. DMF-DMA
взаимодействует с первичными аминами X-NH2
[2] с образованием формамидинов или, иначе, N-(диметиламино)метиленовых
производных аминов или N,N-диметил-формимидамидов Х-N=CH-N(CH3)2
(3), и, в то же время, обеспечивает превращение карбоксильных групп в
метоксикарбонильные. Таким образом, модификация обеих функциональных групп
происходит в одну стадию, достаточно быстро, выделение продуктов не требуется,
из каждой аминокислоты обычно образуется только одно производное.
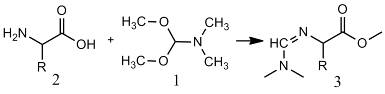
DMF-DMA
можно использовать и как реагент для дериватизации других соединений. Вторичные
амины образуют N-формильные
производные [3]. Кроме того, DMF-DMA
используют для алкилирования других соединений, содержащих группы с активными
атомами водорода, в том числе карбоновых кислот, фенолов и тиолов [4].
Литературный обзор включает сравнительную
характеристику химических свойств реагентов класса диалкилацеталей
диметилформамида, определяющих возможности их применения в газовой
хроматографии. При рассмотрении свойств этих реагентов была обнаружена еще одна
интересная для газохроматографического анализа реакция. Это взаимодействие DMF-DMA
с соединениями, содержащими активные CH3-
и CH2-группы,
которое приводит к образованию N-DMAM
производных в α-положениях к
карбонильной группе. Ранее эту реакцию использовали только в синтетических
целях. Её возможности в качестве реакции дериватизации в настоящей работе
охарактеризованы впервые.
Содержание настоящей дипломной работы составило
предмет двух статей (в печати) [5,6] и двух сообщений на Всероссийской и
международной конференциях [7,8].
1. Обзор литературных данных
.1 Синтез диалкилацеталей
диметилформамида
При взаимодействии комплекса тетрафторбората
триэтилоксония (4) с N,N-диметилформамидом получается тетрафторборатная соль
(5). Обработка этой соли этилатом натрия приводит к получению диэтилацеталя N,N-диметилформамида
(6). Ацетали других диалкиламидов (7) с выходами 50-60 % образуются при обмене
диметиламиногруппы в реакции с диалкиламинами с более высокими температурами
кипения.
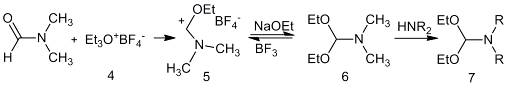
Возможен синтез ацеталей амидов из
имидоилхлорида, который получали из N,N-диалкиламидов (8) и фосгена,
тионилхлорида или пентахлорида фосфора. Имидоилхлориды (9) при взаимодействии с
двумя эквивалентами алкоголята натрия через промежуточные хлорангидриды
амидоэфиров (10) образуют ацетали (11).
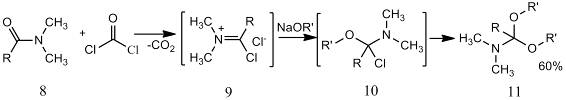
Известен метод синтеза ацеталей амидов из
дихлорамина (12), который получают реакцией диалкиламинов с дихлоркарбеном.
Дихлорамин далее обрабатывают алкоголятом натрия.
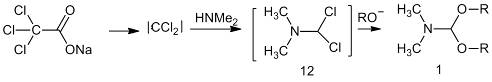
Алкилирование DMF
диметилсульфатом дает катион (13), алкоголиз которого также приводит к
получению ацеталей амидов [9].
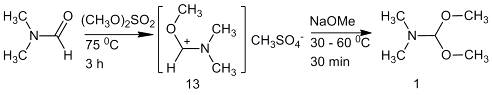
Последний метод часто используют на практике.
Первую стадию проводят при нагревании реакционной смеси при 75 °С
в течение трех часов. Вторую - при 30-60 °С в течение 30
минут с последующим понижением температуры до -5 °С проводят в
петролейном эфире [10, 11]. Этот метод был оптимизирован для промышленного
использования при мольном соотношении метилата натрия и диметилсульфата 1.2:1.
Эти условия позволяют увеличить выход продукта с 40-70 % до 76-80 %, а его
чистота достигает 98 % [12].
Метоксигруппы и метиновый протон DMF-DMA
способны к дейтерообмену с CD3OD
[13].
.2 Реакции диалкилацеталей
диметилформамида
.2.1 Алкилирование соединений,
содержащих группы с активными атомами водорода
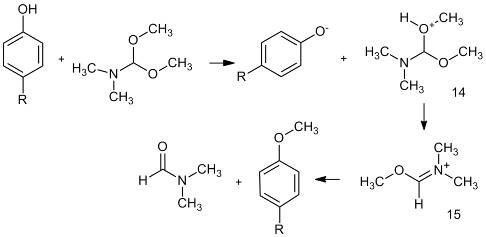
При алкилировании фенолов DMF-DMA
по гидроксильной группе отмечено некоторое влияние природы заместителей в
бензольном кольце на скорость реакции. При наличии электроноакцепторных групп в
пара-положении реакция идет быстрее, чем в случае донорных заместителей.
Реакцию можно проводить как при обычном нагревании, так и при микроволновом
облучении, что предпочтительно для термически неустойчивых субстратов [14].
Реакция метилирования крезола очень
чувствительна к увеличению температуры и мощности микроволнового излучения,
однако, по мнению авторов [14], увеличение ее скорости обусловлено только
тепловым эффектом. Полагают что, увеличение скорости реакции фенолов с
электроноакцепторными заместителями в пара-положениях обусловлено
уменьшением их констант кислотности (pKa),
что приводит к увеличению концентрации катионов алкоксиаммония (14), являющихся
интермедиатами в этой реакции. Если в соединении присутствуют две группы с
активными атомами водорода (16, 17), то в реакцию вступают обе. Реакция
алкилирования легко идет в бензоле [15], толуоле [16] и других растворителях.
Кроме того, DMF-DMA
реагирует с соединениями, содержащими активные CH3-группы,
например, п-гидроксиацетофеноном с образованием енаминокетона (18) [14].
.2.2 Диметилацеталь диметилформамида
как эквивалент карбонильной группы при образовании оснований Шиффа в реакции с
первичными аминами
Антраниловую кислоту (19), 2- и
4-аминоникотиновые кислоты и 3-аминоизоникотиновую кислоту (20) вводили в
реакцию с DMF-DMA
с целью последующего получения различных производных хинозалина [17, 18].
Сначала из этих кислот получают амидиноэфиры (21, 22), которые далее
подвергаются катализируемой кислотой циклизации при добавлении алифатического
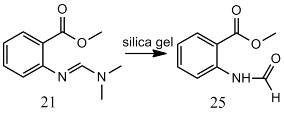
амина с образованием 3-замещенных хинозалин-4-онов (23, 25). Очистка
промежуточных соединений трудоемка (перегонка при пониженном давлении) из-за
нестабильности промежуточных амидиноэфиров (21), которые могут подвергаться
гидролизу на силикагеле с образованием соответствующих N-формильных
производных (24). Модификацию обеих групп (карбоксильной и амино) проводят при
микроволновом облучении в течение не менее 15 минут. Наличие
электроноакцеторных заместителей в бензольном кольце не влияет на реакцию образования
амидиноэфира [17].
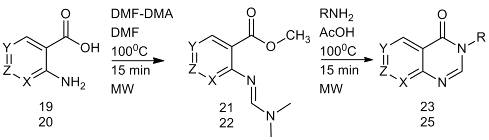
Реакция 19 и 20 с DMF-DMA.
19: X = CH,
Z = CH,
Y = CH
- антраниловая кислота, 20: X
= N, Z
= CH, Y
= CH -
2-аминоникотиновая кислота, X
= CH, Z
= CH, Y
= N -
4-аминоникотиновая кислота, X
= CH, Z
= N, Y
= CH -
3-аминоизоникотиновая кислота.
По данным кинетических экспериментов
установлено, что модификация аминогрупп происходит за пять минут при
температуре не выше 100 °С и микроволновом облучении, тогда
как образование эфира требует большего времени (15 минут) в тех же условиях
[18].
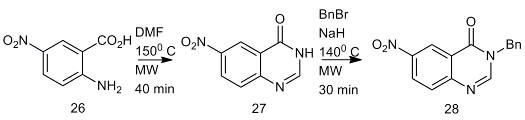
Можно сравнить два варианта синтеза соединения
(28), чтобы показать эффективность использования DMF-DMA.
В первом варианте синтеза получение 6-нитро-3H-хиназолин-4-она (27) проводят
при микроволновом нагреве 5-нитроантраниловой кислоты (26) c
5 экв DMF (150° C).
Продукт циклизации алкилируют бензилбромидом в положение 3 в присутствии
гидрида натрия при атмосферном давлении.
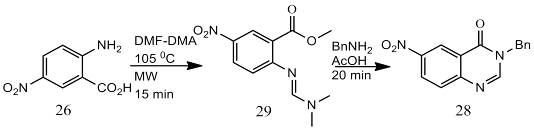
В другом варианте синтеза соединения (28)
5-нитроантраниловую кислоту (26) сначала обрабатывают DMF-DMA
при микроволновом нагреве при температуре 105 °С в течение 15 мин. Полученный N,N-диметилформамидин
(29) нагревают с бензиламином в присутствии уксусной кислоты в течение 20
минут. Соединение (28) было получено в две стадии с хорошим выходом (92 %),
следовательно, этот вариант можно считать более эффективным и более простым
[19].
DMF-DMA
используют в качестве реагента для обратимой защиты первичных аминогрупп.
Получаемые при этом основания Шиффа вступают в различные реакции с сохранением
защитной группы (30), после чего защиту снимают концентрированной кислотой или
водным раствором аммиака (28 %) в этаноле при 40 ºС
в течение пяти часов [20].
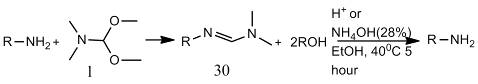
В статье [21] описано одностадийное
преобразование аминогруппы в 1,3,4-триазольный фрагмент. Соединение (31)
обрабатывали смесью DMF-DMA
и формилгидразина в ацетонитриле с получением соединения (32), которое далее
алкилировали с образованием (33) [21].
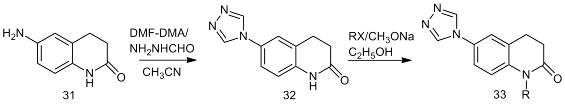
.2.3 Реакции вторичных аминов с
DMF-DMA
DMF-DMA
реагирует со вторичными аминами с образованием новых ацеталей (34). Обменная
реакция амина происходит с одной метоксигруппой диалкилацеталя
диметилформамида, продуктом является соединение (35). Обмен второй
метоксигруппы приводит к ортамиду (36).
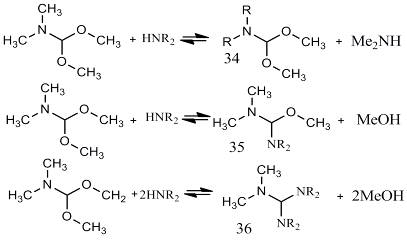
Реакционная способность аминов по отношению к DMF-DMA
возрастает в ряду: N-метиланилин
(не реагирует), пирролидин (не образует аминалей, ацетали получаются только при
нагревании), морфолин (аминали при 30 °С, ацеталь при
нагревании), пиперидин (аминали, ацеталь при 30 °С),
диметиламин (равновесие достигается в течение двух минут). Какие-либо корреляции
между скоростями реакций и основностью аминов не выявлены. Меньшую
реакционную способность пиперидина по сравнению с диметиламином объясняют
стерическими факторами [13].
1.2.4 Другие реакции DMF-DMA в
органическом синтезе
Выше уже было упомянуто взаимодействие DMF-DMA
с соединениями, содержащими активные группы -CH3,
что приводит к образованию продуктов с двойными связями С=С. Один из примеров
таких свойств DMF-DMA
- реакция Леймгрубера-Батчо (Leimgruber-Batcho). Она включает следующие стадии
[22]:
1. Конденсация 2-метил-3-нитропиридина с
диметилацеталем N,N-диметилформамида. Реакция идёт при кислом катализе [23];
. Алкилирование или ацилирование промежуточного
енамина;
. Циклизация промежуточно образующихся N-DMAM
производных с образованием азаиндолов.
Функционализация С-3 атома индолов основана на
электроноизбыточных свойствах этих гетероциклов. Однако если один атом углерода
в бензольном кольце заменен атомом азота, прямая функционализация С-3 положения
азаиндолов невозможна, поскольку азаиндольные гетероциклы
электрононедостаточны. Прямая функционализация С-3 положения азаиндолов
ограничена ацилированием под действием кислот Льюиса, галогенированием, и
участием в реакции Манниха [22].
Двухстадийный синтез Леймгрубера-Батчо
используют для синтеза 4- и 6-азаиндолов из соответствующих
2-метил-3-нитропиридина (38) или 4-метил-3-нитропиридина (37), которые
конденсируют с DMF-DMA
с получением интермедиатов (39) и (40). Последующее восстановление нитрогруппы
сопровождается их циклизацией с образованием 6-аза- (41) или 4-азаиндола (42).
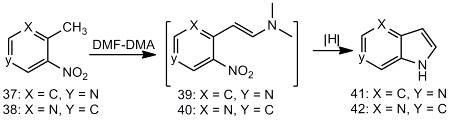
Интермедиаты (39) и (40) (енамины) могут
вступать в реакции с электрофильными реагентами с получением замещенных
енаминов (43) и (44). Последующее восстановление нитрогруппы сопровождается
циклизацией и приводит к 3-замещенным азаиндолам (45) и (46).
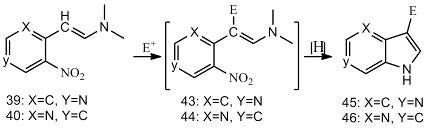
Алкилирование (39) (например, бензилбромидом,
4-фенилбензилбромидом, бромистым аллилом, 2-диэтиламиноэтилбромидом) легко
происходит в присутствии основания Хюнига (изо-Pr2NEt)
в диоксане при 115 °С [24].
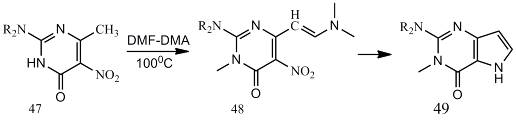
Аналогично, 5-нитропиримидин-4(3Н)-оны (47) в
результате обработки DMF-DMA
при 100 °С образуют (Е)-енамины (48). Их каталитическое гидрирование
приводит к пирроло[3,2-d]пиримидинам (49) [25].
В реакции соединения 50 с DMF-DMA
в безводном DMF получается
соответствующий пиразоло[3,4-d]пиримидин (51) [24].
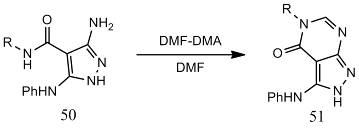
R -
9,10-антрахинон-2-ил.
Взаимодействие соединения (52) с DMF-DMA
в сухом диоксане дает
2-циано-3-диметиламино-N-(9,10-диоксо-9,10-дигидро-антрацен-2-ил)акриламид
(53), который может быть преобразован в производное пиразола (54) при
нагревании с гидразин-гидратом [25].
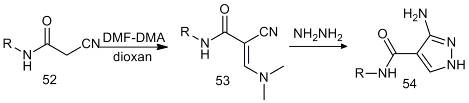
R -
9,10-антрахинон-2-ил.
Соединения (55) легко реагируют с DMF-DMA
в толуоле при 80 °С, с образованием енаминов (56) с выходами 80-90 %.
Полученные енамины темно-красного цвета, твердые, хорошо растворяются в
толуоле, дихлорметане и спирте [26].
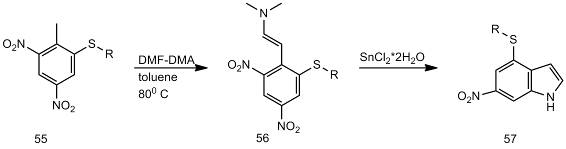
При обработке енаминов (56) SnCl2´2H2O
в смеси CH2Cl2 / МеОН (1: 1) были получены
соответствующие индолы с выходами более 50 %. Хлорид олова (II), был
использован по двум причинам: во-первых, этот реагент не восстанавливает
нитрогруппы в ароматическом кольце, а, во-вторых, реакция протекает при
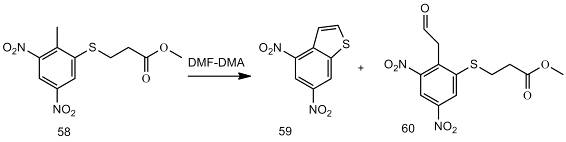
комнатной температуре. В аналогичной реакции образуется продукт гидролиза
енамина (60) [26].
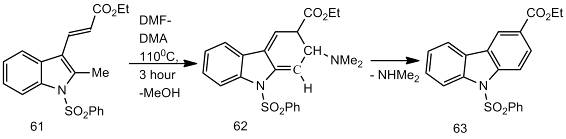
Взаимодействии соединения (61) с DMF-DMA
при 100-120 °С также приводит к образованию соответствующего енамина. При его
циклизации происходит образование соединения (62), при отщеплении диметиламина
от которого получается соответствующий карбазол (63) [27].
.3 Применение диметилацеталя
диметилформамида в качестве реагента для дериватизации аналитов в газовой
хроматографии
.3.1 Алкилирование соединений с
активными атомами водорода
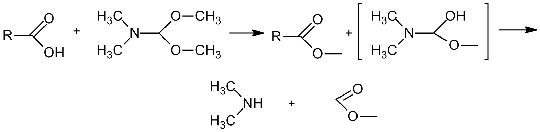
Диалкилацетали диметилформамида могут быть
использованы в газохроматографическом анализе для дериватизации различных
функциональных групп, содержащих активные атомы водорода, например, для
превращения кислот в их метиловые эфиры. Выделение производных не требуется,
реакционные смеси можно непосредственно дозировать в газовый хроматограф [4].
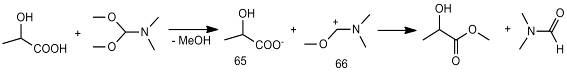
По литературным данным основным продуктом реакций с участием DMF-DMA
является DMF. Механизм
метилирования кислот, как полагают, включает образование карбоксилат-иона кислоты
(65) и катиона реагента (66) [24].
Карбоновые кислоты, фенолы и тиолы вступают в
реакцию с DMF-DMA
с образованием соответствующих алкильных производных, спиртовые гидроксильные
группы не подвергаются метилированию. Дериватизация молочной, миндальной,
яблочной и винной кислот происходит менее чем за одну минуту. Реакция идет
только после растворения аналитов. Такой способ дериватизации подходит для
флэш-алкилирования в момент ввода образцов в хроматограф, что позволяет
анализировать соединения в наномолярых количествах.
Обычная процедура дериватизации включает
растворение аналита в 0.5 мл смеси DMF-DMA
и выбранного растворителя (1:1) при нагревании до 100 ºС.
В качестве таких растворителей для жирных кислот рекомендован пиридин, для
аминокислот - ацетонитрил [4]. В альтернативном методе смешивают 50 мг кислоты
и 1 мл DMF-DMA в запаянных
ампулах, которые нагревают при 60 °С в течение 10 - 15 минут или до полного
растворения аналита с последующим газохроматографическим анализом [4].
.3.2 Получение N-DMAM производных
первичных аминов
Дериватизация первичных аминов диалкилацеталями N,N-диметилформамида
приводит к образованию оснований Шиффа (68) [2, 29].
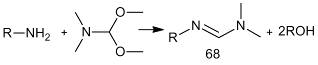
На примере циклооктиламина было показано, что
его взаимодействие с DMF-DMA
в различных растворителях (пиридин, бензол, диметилформамид, хлороформ,
дихлорметан, ацетонитрил, изооктан, метанол) идет с количественными выходами.
Максимальный выход продукта реакции был зафиксирован через 10 мин после начала
реакции, оптимальная температура проведения реакции 100 °С,
при более высокой температуре происходит термическая деградация реагента [2].
.3.3 Взаимодействие вторичных аминов
с DMF-DMA
Взаимодействие вторичных аминов с
диметилацеталем диметилформамида приводит к образованию N-формильных
производных (71). Формильные производные элюируются позже исходных аналитов.
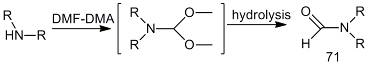
мкг вторичного амина смешивали со 100 мкл
ацеталя, нагревали при 80 °С в течение 30 мин. Реакционные
смеси либо сразу дозировали в хроматограф, либо разбавляли 1 мл воды и дважды
экстрагировали 5 мл этилацетата [30]. Продуктом реакции диалкилацеталей N,N-диметилформамида
с дезипрамином (72) оказывается N-формилдезипрамин
(74). Строение продуктов авторы доказывают на основании закономерностей их
масс-спектрометрической фрагментации [31].
.3.4 Получение производных
аминокислот
Для газохроматографического анализа аминокислот
необходима дериватизация обеих функциональных групп. Большинство методов
дериватизации этих соединений основаны на алкилировании карбоксильной группы с
последующим ацилированием аминогруппы (N-трифторацетильные производные
метиловых эфиров, N-ацетилпроизводные пропиловых эфиров, N-трифторацетил-н-бутиловые
эфиры и др.). Получение TMS-производных
возможно в одну стадию, но оно приводит к нескольким продуктам.
Реакция DMF-DMA
с аминокислотами идет только после их растворения. Следовательно, основной
проблемой их дериватизации представляется выбор подходящих растворителей.
Большинство аминокислот реагирует в течение 20 минут с DMF-DMA
в смеси с ацетонитрилом (1:1) при 100 ºС.
Для растворения аспарагиновой кислоты в этой смеси требуется больше времени
(почти один час). Для всех аминокислот отмечено образование единственных
производных, в которых модифицированы обе функциональные группы [23, 32]. В
лизине обе аминогруппы подвергаются дериватизации. DMF-DMA
перед использованием рекомендуется высушивать и перегонять (из-за примесей,
мешающих определению производных глицина и аланина). Все полученные производные
могут быть использованы для газохроматографического анализа [32].
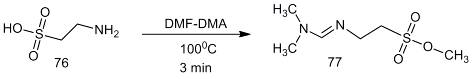
Рассматриваемый метод дериватизации был применен
для определения таурина (76) в плазме крови человека. Кристаллическую аминокислоту
нагревали в закрытой виале в смеси с 0.01 мл ацетонитрила и 0.01 мл DMF-DMA
при 100 ºС
в течение трех минут. Для детектирования N-DMAM
производного таурина (77)
использовали масс-cпектрометр
[33].
Гидроксизамещенные аминокислоты дают
соответствующие производные без метилирования гидроксильных групп, их
дополнительная модификация предполагает получение TMS-эфиров
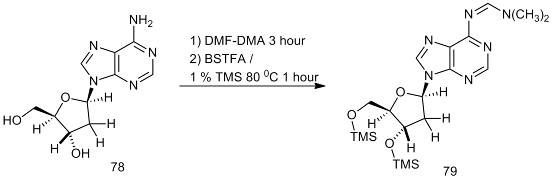
[32]. Примером таких соединений является нуклеозид (78). Для
хроматографического анализа сначала проводят его реакцию с DMF-DMA
с получением N-DMAM
производного, затем О-силанизацию BSTFA
и/или TMCS. Реакция c
DMF-DMA
при комнатной температуре приводит к единственному продукту, время реакции три
часа. После выпаривания избытка реагента получают TMS-производное
(79) и проводят его хромато-масс-спектрометрический анализ [34, 35].
Этот метод можно использовать также для
аминокислот, содержащих вторичные аминогруппы. При этом образуются формильные
производные эфиров.
Кристаллические аминокислоты (10-50 мкг)
растворяли в DMF-DMA
(100 мкл) в реакционной виале (1 мл) и нагревали при 100 °С в течение 15 мин.
После охлаждения добавляли 200 мкл воды и затем смесь экстрагировали
хлороформом (500 мкл). Хлороформный слой использовали для
хромато-масс-спектрометрического анализа (82).
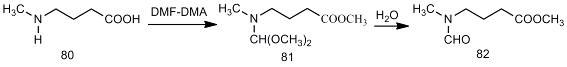
Примером аминокислот со вторичной аминогруппой
является 4-(метиламино)бутановая кислота (80). При газохроматографическом
анализе N-DMAM
производного 4-(метиламино)бутановой кислоты на хроматограмме регистрируются
два пика. Компонент с меньшим временем удерживания представляет собой продукт
трансаминирования (81). После добавления воды к реакционной смеси его пик
исчезает, тогда как второй - увеливается. Это позволило предположить, что N-формильное
производное (82) образуется в результате гидролиза промежуточного продукта (81)
[3].
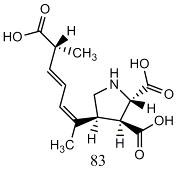
Еще одним примером эффективного применения DMF-DMA
для дериватизации соединений с несколькими активными атомами водорода является
домоевая кислота (83), содержащая три карбоксильные группы и одну вторичную
аминогруппу [36].
В ходе изучения литературы выяснены новые
возможности использования DMF-DMA
в органическом анализе. Реакцию DMF-DMA
c соединениями,
содержащими активные метильные и/или метиленовые группы в α-полжени
к карбонильной группе, до настоящего времени использовали только в
синтетических целях. Следует изучить возможность её применения в аналитических
целях.
2. Экспериментальная часть
.1 Реагенты
Для работы мы использовали: диметилацеталь
диметилформамида (Aldrich),
содержание основного компонента ~ 93%; набор аминокислот (Cerna)
х.ч.; смесь реперных н-алканов C7-C19
с нечетным числом атомов углерода в молекуле (раствор в н-гексане);
дихлорметан х.ч. в качестве растворителя.
.2 Условия проведения реакции
диметилацеталь диметилформамид
реагент хроматография
Реакцию дериватизации проводили, используя
избыток реагента (50 мкл на 1-2 мг аминокислоты), при нагревании в воздушном
термостате до 80 °С в течении часа, в некоторых случаях потребовалось более
длительное нагревание и повышение температуры до 100 °С (метионин, глутаминовая
кислота, аргинин, лизин, триптофан, тирозин, треонин). Из-за низкой температуры
кипения DMF-DMA
(102-108 °C), для
предотвращения его испарения, реакции проводили в запаянных стеклянных ампулах
длиной 4-5 см с внутренним диаметром 3 мм. О протекании реакции судили по
растворению аминокислоты. Для большинства аминокислот растворитель не
потребовался, но для дериватизации гистидина, глицина и треонина, в качестве
растворителя брали ацетонитрил и DMF.
Соотношение растворитель: DMF-DMA
1:1. В ацетонитриле реакция протекает быстрее, потому что в щелочной среде
растворителя не протонируются -COO-
и -NH2 группы.
Для газохроматографического анализа использовали непосредственно полученные
реакционные смеси, для хромато-масс-спектрометрического анализа их разбавляли
дихлорметаном в соотношении ~ 1 : 100.
В случае карбонильных соединений реакцию
дериватизации проводили, так же используя избыток реагента (50 мкл на 20 мкл
аналита), при нагревании в воздушном термостате до 100 °С в течении часа,
иногда требовалось большее время и повышение температуры до 110 °С, реакции
проводили в запаянных стеклянных ампулах. О протекании реакции судили по
появлению желтой или оранжевой окраски реакционной смеси. Появление
темно-красной окраски свидетельствовало о протекании реакции конденсации
карбонильного соединения (аналит). Для хромато-масс-спектрометрического анализа
реакционные смеси разбавляли дихлорметаном в соотношении ~ 1 : 100.
.3 Условия газохроматографического
анализа
Газохроматографический анализ проводили на
хроматографе Хроматэк-Кристалл 5000.2 с пламенно-ионизационным детектором и
колонкой со стандартной полидиметилсилоксановой фазой BPX-1
(длина 10 м, внутренний диаметр 0.53 мм, толщина пленки фазы 2.65 мкм). Анализ
проводили в режиме программирования температуры от 70 до 200 °С со скоростью 5
°С/мин. Расход газа носителя (азот) 5.3 мл/мин, линейная скорость 43 см/сек,
деление потока 6 : 1. Температура испарителя 220 °C, температура детектора 250
°C. объем дозируемых проб 0.2-0.3 мкл.
.4 Условия масс-спектрометрического
анализа
Хромато-масс-спектрометрический анализ проводили
на хромато-масс-спектрометре Shimadzu
GC-2010 Plus
в режиме ионизации электронным ударом, колонка RTX-5
MS (длина 30 м,
внутренний диаметр 0.32 мм, толщина пленки фазы 0.25 мкм). Анализ проводили в
режиме программирования температуры от 70 до 200 °С со скоростью 5 °С/мин. Газ
носитель (гелий), объемная скорость 1,79 мл/мин, деление потока 10 : 1.
Температура ионного источника 200 °C, температура интерфейса 250 °C, объем
дозируемых проб 0.2-0.3 мкл.
.5 Обработка результатов
Расчет линейно-логарифмических индексов удерживания
проводили по формуле:
RIx = RIk + (RIk+m - RIk)
 (3.1)
(3.1)
где 
 (3.2)
(3.2)
где 
 (3.3)
(3.3)
где RIx, t'R,x - индекс
удерживания и время удерживания определяемого соединения;
RIk, t'R,k - индекс
удерживания и время удерживания реперного соединения с k атомов
углерода в молекуле;
RIk+m, t'R,k+m - индекс
удерживания и время удерживания реперного соединения с k+m атомов
углерода в молекуле.
Работа выполнена с использованием
оборудования Ресурсного образовательного центра по направлению
"Химия" при Химическом институте Санкт-Петербургского
государственного университета.
3. Обсуждение результатов
.1 Особенности выбора неподвижной
фазы
Численные значения RI определяются
полярностью используемой в хроматографической колонке неподвижной фазы. По этой
причине отнесение таких аналитических характеристик к числу свойств
органических соединений возможно только при выборе стандартной неподвижной фазы
для их определения. В настоящее время из всего многообразия таких фаз в
качестве стандартных чаще всего используют неполярные полидиметилсилоксановые
эластомеры, практически идентичные по своим характеристикам (SE-30, OV-101,
SP-2100, DB-1 и т. д.) [37]. Значения газохроматографических индексов удерживания
всех N-DMAM производных определены на стандартной неполярной
полидиметилсилоксановой неподвижной фазе ВРХ-1 и на аналогичной более полярной
фазе RТХ-5, содержащей 5 % фенильных групп. По классификации, принятой в базе
данных [38], фазы последнего типа относят к типу "semi-standard".
Для простейших N-DMAM производных аминов
среднее значение разностей RI(RTX-5) -RI(ВРХ-1) составляет 14 ± 4 ед. индекса
(Табл. 1), что типично для слабо полярных соединений.
.2 Проверка возможности
дериватизации аминокислот DMF-DMA на модельных соединениях
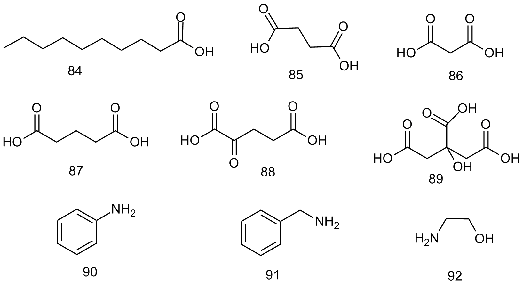
Возможности дериватизации аминокислот DMF-DMA
были проверены на примерах нескольких моно-, ди-, трикарбоновых кислот и
первичных аминов: декановой (84), янтарной (85), малоновой (86), глутаровой
(87), α-кетоглутаровой
(88), лимонной (89), анилина (90), бензиламина (91) и моноэтаноламина (92).
Для некоторых монокарбоновых кислот и первичных
аминов возможен непосредственный газохроматографический анализ, что дает
возможность оценки степени дериватизации по соотношению площадей пиков
продуктов реакции и субстратов. В Табл. 1 Приложения приведены
газохроматографические индексы удерживания исходных соединений (RI) и данные
для продуктов реакции, в том числе значения RIэксп, справочные
величины RIсправ и стандартные масс-спектры. Во всех случаях на
хроматограммах не были обнаружены сигналы исходных соединений, что эквивалентно
степени их конверсии ~ 100 %.
Образование метиловых эфиров карбоновых кислот
во всех рассматриваемых случаях не требует иных подтверждений (в сочетании с
информацией о природе исходных соединений и характере реакции), кроме
определения их индексов удерживания. Индексы удерживания некоторых N-DMAM
производных (в том числе анилина и бензиламина) известны [38], но, тем не менее,
все N-DMAM производные впервые охарактеризованы масс-спектрами. Значение
индекса удерживания продукта взаимодействия α-кетоглутаровой
кислоты с DMF-DMA не характерно для метилового эфира дикарбоновой кислоты. Для
идентификации полученного соединения был записан масс-спектр, исходя из
которого можно сделать вывод о структуре продукта реакции (93). Получение этого
продукта подтверждает целесообразность специального рассмотрения реакции
DMF-DMA с активными метиленовыми и метильными группами, находящимися в α-положении
к карбонильной группе.
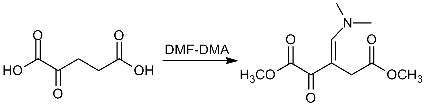 (93) (4.1)
(93) (4.1)
.3 Методы расчета RI с
использованием аддитивных схем
Многочисленные известные методы расчета RI
отдельных групп простейших органических соединений по аддитивным схемам основаны
на суммировании вкладов соответствующих структурных инкрементов ΔRIi
.
[37]
RIx
= ΣkiΔRIi
(4.2)
Из всех алгоритмов оценок RIx
по
соотношениям вида (4.2) наибольшее распространение получили методы, включающие
использование экспериментально определенной величины RI0
некоторого базового соединения (чаще всего простейшего гомолога) в сочетании с
наборами инкрементов различных заместителей ΔRIj.
[37]
RIx
= ΣkjΔRIj
+ RI0
(4.3)
В качестве инкремента индексов удерживания
структурного преобразования соединений в различных реакциях может быть выбрано
число, которое переводит значение RIx
реагента
или сумму ΣRIx
нескольких
реагентов в соответствующие параметры продуктов. Тогда в простейшем случае для
описания изомерных превращений A
→
C или процессов
взаимодействия с общим реагентом Z
в соответствии со схемой A
+ Z →
C + … расчетное
соотношение имеет вид:
RIA + ΔRIR
= RIC; (4.4)
откуда ΔRIR
= RIC + RIA
(4.5)
Для обобщения полученных значений ΔRIR,
характеризующих единичные соотношения между величинами RIx
исходных и конечных веществ в схеме процесса, проверки их воспроизводимости для
разных пар конкретных соединений и, фактически, хроматографической
характеристики данного преобразования структуры, необходима статистическая
обработка серий величин ΔRIR
с расчетом средних значений ΔRIR
и их стандартных отклонений. Стандартные отклонения величин RIx
вычисляемых на основании соотношения (4.5) оценивают с учетом погрешностей всех
составляющих [37].
A → C…
RIC = RIA + ΔRIR ;
Sc = 
 (4.6)
(4.6)
Исходя из выше сказанного, важной
газохроматографической характеристикой представляется среднее значение
разностей индексов удерживания N-DMAM производных
и исходных субстратов ΔRIR
соответствующее следующему структурному преобразованию:
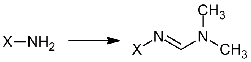 (4.7)
(4.7)
ΔRIR можно
предварительно оценить по данным даже для трех соединений (Табл. 4.1). Эта
величина является основой простейшей аддитивной схемы, которая позволяет
оценивать индексы удерживания продуктов органических реакций по данным для
исходных веществ. В нашем случае эта величина равна 396 ± 16.
Таблица 4.1. Вычисление значения структурного
инкремента ΔRIR
для структурного преобразования (4.7).
|
Амин
|
ΔRIR = RIN-DMAM
- RIамин
|
SA
|
SC
|
|
Анилин
|
408
|
13
|
21
|
|
Бензиламин
|
402
|
10
|
19
|
|
Этаноламин
|
377
|
23
|
28
|
|
Среднее
ΔRIR
|
396
|
|
|
S0R
|
16
|
|
Вычислены инкременты преобразования гидразинов в
амидразоны в реакции с DMF-DMA
(R1R2N-NH2
→ R1R2N-N=CH-N(CH3)2).
ΔRI
=
262 ± 13 на основе реакций с двумя гидразинами: дибутилгидразин,
монокротилгидразин.
.4 Закономерности
масс-спектрометрического распада N-DMAM производных аминов
Наличие в N-DMAM
производных аминов p-π
систем сопряжения -N=CH-N<
объясняет высокую интенсивность сигналов молекулярных ионов в их масс-спектрах
[39]. Однако в их масс-спектрах наиболее интенсивны сигналы ионов с m/z
44 [соответствуют фрагменту N(CH3)2],
[M - 44] = [M
- N(CH3)2],
а в отдельных случаях (производное бензиламина) с m/z
91 [C7H7],
m/z
71 = [M - 91] = [(CH3)2NCHN]
и (производное этаноламина) с m/z
85
= [M - CH2OH].
.5 Механизм реакции дериватизации
аминокислот DMF-DMA
Механизм реакции DMF-DMA с аминокислотами был
рассмотрен в обзоре литературы. Однако здесь стоит отметить, что, по нашим
данным, ни в исходном реагенте (содержание основного компонента - 93 %), ни в
составе реакционных смесей диметилформамид (индекс удерживания на стандартных
неполярных полидиметилсилоксановых неподвижных фазах 749 ± 16) не был обнаружен
в заметных количествах. Это позволяет предположить, что промежуточные
моноалкилацетали диметилформамида могут далее распадаться не как полуацетали, а
как аминали, т.е. с образованием диметиламина и (в случае DMF-DMA)
метилформиата:
 (4.8)
(4.8)
Оба таких продукта характеризуются весьма малыми
индексами удерживания на стандартных неполярных фазах (диметиламин 383 ± 15,
метилформиат 386 ± 10) и, следовательно, не только не мешают определению
целевых продуктов реакции, но и, фактически, в отличие от диметилформамида, при
хромато-масс-спектрометрическом анализе даже не отделяются от сигнала
растворителя (СН 2С 12, RI 515 ± 7).
.6 Особенности реакции DMF-DMA с
аминокислотами содержащими -SH, -NH-, -OH группы
Поскольку диалкилацетали диметилформамида
вступают в реакции не только с карбоновыми кислотами, но и фенолами и тиолами,
не удивительно, что в смеси продуктов взаимодействия тирозина с DMF-DMA
обнаружены два компонента, один из которых соответствует "нормальному"
N-DMAM производному этой аминокислоты (М = 250), а второй образуется в
результате дополнительного метилирования фенольной гидроксильной группы (М =
264). Сигналы молекулярных ионов в спектрах этих производных отсутствуют, но в
обоих случаях надежно регистрируются сигналы ионов [М - СО 2СН 3]
с т/z 191 и 205, соответственно (см. Табл. 1. Приложения).
Поведение аминокислот, содержащих вторичные
аминогруппы или группы -NН в ароматических системах (пролин, триптофан),
полностью согласуется с известными химическими свойствами DMF-DMA [11]. Так как
образование N-DMAM продуктов для них невозможно, они превращаются в N-формильные
производные. Так, единственным продуктом дериватизации пролина (М = 115)
оказывается соединение с молекулярной массой 157 (ΔМ
= 42), что соответствует метилированию карбоксильной группы (ΔМ
= 14) и N-формилированию (ΔМ
= 28). В случае триптофана [2-амино-3-(1Н-индол-3-ил)пропановая кислота]
обнаружены два продукта дериватизации: N-DMAM-Me производное и вторичный
продукт его N-формилирования (см. Табл. 1).
N-DMAM-Me
производные глицина и гистидина удалось получить только в растворителях (DMF,
ацетонитрил). Реакция идет быстрее в ацетонитриле (1 час). Использовали смесь
DMF-DMA : ацетонитрил 1:1.
.7 Закономерности масс-спектрометрического
распада N-DMAM-Me производных аминокислот
В Табл. 1 приведены значения индексов
удерживания и стандартные масс-спектры продуктов взаимодействия с DMF-DMA
для некоторых аминокислот.
Среднее значение разности RI(RTX-5)
- RI(BPX-1)
для N-DMAM
производных аминокислот составляет 46 ± 14 ед. индекса (Табл. 1. Приложения),
что характеризует их как более полярные соединения по сравнению с аналогичными
производными монофункциональных первичных аминов.
В масс-спектрах N-DMAM-Me
производных аминокислот (для целевых продуктов использован символ N-DMAM-Me,
так как обе функциональные группы (-CO2H
и -NH2)
взаимодействуют с DMF-DMA)
интенсивность пиков молекулярных ионов заметно ниже чем в масс-спектрах
производных аминов. Присутствие в молекуле нескольких альтернативных центров
локализации заряда молекулярных ионов закономерно уменьшает значения Iотн(М)
[39] (для производного моноэтаноламина - 11 %), а для некоторых аминокислот они
достигают всего нескольких десятых долей %. Сигналы молекулярных ионов были
найдены только в масс-спектрах производных глицина, аланина, валина,
аспарагиновой и глутаминовой кислот, метионина и фенилаланина. Для всех
остальных кислот их относительные интенсивности не превышают 0.1 - 0.2 %. Для
большинства производных наиболее интенсивны пики с молекулярной массой 44
принадлежащие ионам [N(CH3)2]+
(m/z
44, Iотн
50-100 %). Другой особенностью спектров является наличие пиков обусловленных
потерей метоксикарбонильных групп [M
- CO2CH3]
= [M - 59], Iотн
от 0 до 100 %. Потеря боковой цепи приводит к появлению пиков ионов [M
- R] m/z
143, Iотн
от 0 до 100 %. В отдельных случаях присутствуют сигналы [M
- N(CH3)2]+.
При наличии гидроксильных групп во фрагментах R
(серин, треонин) характеристичными становятся сигналы ионов [M
- H2O]+
и соответствующие им вторичные ионы этой серии. Аргинин, который, судя по
значению RI = 1842 ± 1,
образует бис-N-DMAM-Ме производное по аминогруппе и гуанидиновому
фрагменту молекулы, характеризуется практически не интерпретируемым
масс-спектром. Аналогичные особенности типичны и для масс-спектра бис-N-DMAM-Me
производного лизина.
Влияние структуры боковой цепи на закономерности
распада N-DMAM-Me производных аминокислот может быть проиллюстрировано
при сравнении спектров производных лейцина и изолейцина. В лейцине основным
направлением фрагментации является потеря сложноэфирной группы с появлением
сигнала, соответствующего ионам [M - CO2CH3] = [M - 59], m/z
141, а для изолейцина главным направлением является потеря боковой цепи с
появлением сигнала, соответствующего ионам [M - R] = [M - 57], m/z 143.
Индексы удерживания этих изомеров практически одинаковы (1342 ± 1, 1344 ± 1).
Таким образом, проведение анализа этих изомерных аминокислот в виде N-DMAM-Me
производных позволяет легко их различить. В случае же пары изолейцин -
норлейцин указанные масс-спектрометрические признаки практически совпадают, но
значения RI существенно различаются, что типично для изомеров с неодинаковым
числом разветвлений углеродного скелета в бутильной группе.
.8 Идентификация продуктов
взаимодействия DMF-DMA с аминокислотами с использованием аддитивной схемы
На основе полученных индексов удерживания для
N-DMAM-Me производных аминокислот, также может быть создана аддитивная схема,
основанная на структурном преобразовании:
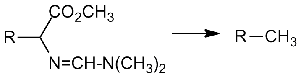 (4.9)
(4.9)
Для оценки значений индексов удерживания N-DMAM-Me
производных аминокислот по значениям RI(R-CH3)
целесообразно вычислить коэффициенты регрессионного уравнения вместо среднего
значения ΔRIR:
RI[R-CH(CO2CH3)-N=CH-N(CH3)2]
= a + b RI[R-CH3] (4.10)
a =886 ± 36, b
= 0.95 ± 0.04, r = 0.992, S0
=
48 N = 9
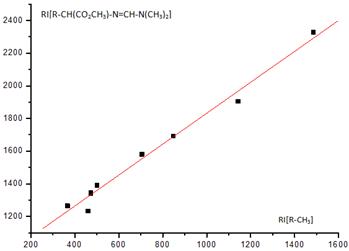
Рис. 1. Линейная зависимость
индексов удерживания N-DMAM производных
аминокислот от индексов удерживания их структурных аналогов, содержащих
метильные группы вместо фрагмента -CH(CO2CH3)-N=CH-N(CH3)2
RI [R-CH3] = a + b
RI[R-CH(CO2CH3)-N=CH-N(CH3)2] (4.11)
a = -911 ± 78, b
= 1.04 ± 0.05, r = 0.992, S0
= 50, N = 9
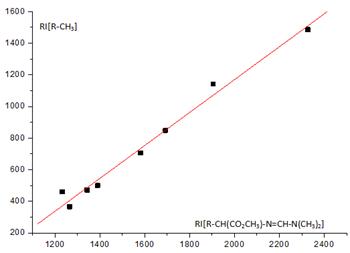
Рис. 2. Линейная зависимость индексов
удерживания структурных аналогов аминокислот, содержащих метильные группы
вместо фрагмента -CH(CO2CH3)-N=CH-N(CH3)2
от индексов удерживания N-DMAM
производных аминокислот.
Величины генеральной дисперсии S0
определяют точность получаемых результатов, которая составляет около 48-50
единиц индекса. Уравнение (4.10) предназначено для оценки RI
N-DMAM
производных по значениям RI
их простейших структурных аналогов вида R-CH3.
Второе же, наоборот, позволяет оценивать значения RI
таких аналогов по значениям индексов удерживания производных аминокислот.
Сочетание этих двух уравнений позволяет не только получать необходимые оценки RI,
но и контролировать правильность экспериментальных данных. Такие возможности
можно проиллюстрировать следующими примерами.
Пример 1. N-DMAM
производное
цистеина (HSCH2CH(NH2)CO2H)
в ходе работы не было получено ввиду отсутствия аминокислоты. Проведем оценку
значения индекса удерживания производного, учитывая возможность метилирования
сульфгидрильной группы, и, как следствие, образования двух видов производных: Cys-N-DMAM-Me
и Cys-N-DMAM-Me2.
В качестве структурных аналогов выберем этантиол (HSCH2CH3,
RI = 502 ± 8) и
метилэтилсульфид (CH3SCH2CH3,
RI = 605 ± 10). Используя
уравнение (4.10) получим индексы удерживания: RI
(Cys-N-DMAM-Me)
= 1363 ± 36, RI (Cys-N-DMAM-Me2)
= 1461 ± 36.
Пример 2. N-DMAM-Me
производное лизина характеризуется практически не интерпретируемым
масс-спектром. Определение его структуры может быть проведено по индексу
удерживания (RI = 1961 ±
1).
Исходя из свойств DMF-DMA,
лизин при взаимодействии с ним должен образовывать бис-N-DMAM-Me
производное (CH3)2N-CH=N-(CH2)4CH(CO2CH3)-N=CH-N(CH3)2.
Для доказательства его структуры, сначала оценим индекс удерживания его
структурного аналога (CH3)2N-CH=N-(CH2)4CH3,
используя уравнение (4.11) и RI
(N-DMAM-Me)
= 1961 ± 1. Учитывая ориентировочный характер вычислений, оценки погрешностей
результатов в них опущены. RI((CH3)2N-CH=N-(CH2)4CH3)
= 1128.
Далее оценим значение индекса удерживания
1-пентанамина. Инкремент соответствующий трансформации (CH3)2N-CH=N-(CH2)4CH3
→ H2N(CH2)4,
был посчитан ранее и равен 396 ± 16. Тогда индекс удерживания 1-пентанамина
равен: 1128 - 396 = 732. Так как его справочное значение RI
=
717 ± 9, такое совпадение является однозначным подтверждением структуры бис-N-DMAM-Me
производного лизина.
Таким образом, описанные аддитивные схемы,
позволяют подтверждать структуру продуктов реакции, используя только
газохроматографические индексы удерживания.
При исключении из рассмотрения серина, значение
генеральной дисперсии существенно снижается. Возможно, это происходит из-за
образования молекулярных связей N....H-O
в N-DMAM
производном серина приводит к занижению значения RI
RI[R-CH(CO2CH3)-N=CH-N(CH3)2]
= a + b RI[R-CH3] (4.10')
a =914 ± 26, b = 0.92 ± 0.03, r =
0.996, S0 = 32 N = 8
RI [R-CH3] = a + b
RI[R-CH(CO2CH3)-N=CH-N(CH3)2] (4.11')
a = -979 ± 60, b
= 1.07 ± 0.04, r = 0.996, S0
= 35, N = 8
.9 Дериватизация карбонильных
соединений DMF-DMA. Идентификация продуктов взаимодействия карбонильных
соединений и DMF-DMA с использованием аддитивных схем
Второй частью моей дипломной работы стала
проверка возможности дериватизации соединений с активными метильной и
метиленовой группами.
Результаты дериватизации
(газохроматографические индексы удерживания и масс-спектры продуктов)
представлены в Табл. 1 Приложения. Реакция идет селективно, в 
 -положение к карбонильной группе.
-положение к карбонильной группе.
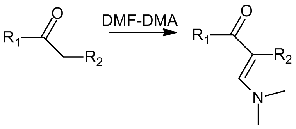 (4.12)
(4.12)
На основании полученных результатов могут быть
вычислены инкременты этих структурных преобразований для различных типов
исходных соединений:
X-CH3 →
X-CH=CH-N(CH3)2 (4.13)
X-CH2-R →
X-C(-R)=CH-N(CH3)2 (4.14)
Этот инкремент представляет собой среднее
значение разностей индексов DMAM производных и исходных субстратов, ΔRIi.
Экспериментальные данные, представленные в Табл. 1 Приложения, требуют
вычисления отдельных инкрементов для различных типов исходных соединений.
Инкременты приведены в Табл. 4.3.
Табл. 4.2. Значения структурных инкрементов ΔRIi
для
различных соединений. (* единичные данные
представлены без стандартных отклонений.)
|
Номер
инкремента ΔRIi
|
Фрагменты
структур исходных соединений
|
Инкременты
превращений (4.13) и (4.14), (ΔRIi)
|
|
1
|
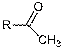
|
709
± 19
|
|
2
|
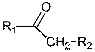
|
630
± 19
|
|
3
|
|
801
± 8
|
|
4
|
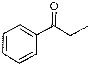
|
640*
|
|
5
|
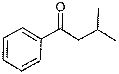
|
451
|
|
6
|
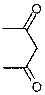
|
746
|
|
7
|
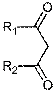
|
675
± 21
|
|
8
|
|
525
|
|
9
|
|
700
|
Инкремент ΔRI1
вычислен
на основе данных для шести соединений (производные 2-гексанона, 2-пентанона,
2-гептанона, ацетона, 2-бутанона и метилацетата, образовавшегося в результате
гидролиза и последующего декарбоксилирования диметилмалоната); ΔRI2
- трех
(производные 2-гексанона, 2-петанона и 2-гептанона);
ΔRI3 - двух (производные
ацетофенона, п-метилацетофенона). ΔRI4
и
ΔRI5
существенно
различаются, их усреднение нецелесообразно. Такие различия этих инкрементов
можно объяснить влиянием разветвленного алкильного радикала в DMAM
производном изовалерофенона, что приводит к нарушению сопряжения в фрагменте O=C-C(R)=CH-N(CH3)2
и, как следствие, уменьшению индекса. ΔRI6
(ацетилацетон)
не дает однозначного ответа о том, по какой группе идет реакция (CH3-
или -CH2-).
Однако, большей реакционной способностью обладает -CH2
группа. Значение инкремента ΔRI7
результат
усреднения значений ΔRI DMAM-
производных ацетоуксусного эфира и диметилмалоната. Существенное различие ΔRI8
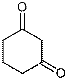
и
ΔRI9
обусловлено
уменьшением сопряжения в фрагменте -CH=CH-NMe2
DMAM производного
циклогексан-1,3-диона из-за стерических затруднений.
.10 Закономерности
масс-спектрометрического распада DMAM производных карбонильных соединений
Для всех DMAM
производных карбонильных соединений получены масс-спектры электронного удара,
обнаружены некоторые специфические закономерности распада.
В масс-спектрах электронной ионизации DMAM
производных карбонильных соединений выявлен интенсивный пик [M-17].
Можно предположить, что происходит отщепление -OH,
которое может происходить в результате 1,6-миграции атома водорода к кислороду.
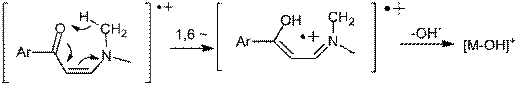 (4.15)
(4.15)
Для подтверждения механизма протекания
1,6-миграции в молекулярных ионах DMAM
производных карбонильных соединений можно предложить следующие методы:
. Измерение точных масс. Для реализации
этого метода необходим хромато-масс-спектрометр высокого разрешения, такое
оборудование было не доступно в ходе выполнения дипломной работы.
. Использование дейтерированного аналога DMF-DMA
для проведения дериватизации. При
масс-спектрометрическом распаде полученного DMAM
производного в масс-спектрах будет наблюдаться пик иона [M-OD].
Однако синтез дейтерированного аналога представляется слишком трудоемкой
операцией, которая требует специального оснащения лаборатории.
. Аналогия с [1,4] - миграцией атома водорода
в нитрозаминах Доказательством может служить аналогия 1,6-миграции атома
водорода в молекулярных ионах DMAM
производных карбонильных соединений с хорошо изученным в масс-спектрометрии
процессом [1,4] - миграции атома водорода в нитрозаминах. Мы воспользовались
этим вариантом.
Основным направлением фрагментации молекулярных
ионов алифатических нитрозаминов является потеря радикала OH.,
с появлением в масс-спектре пика [M-17]
[40].
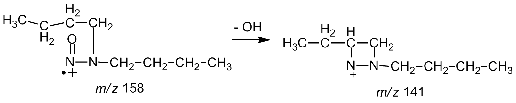 (4.16)
(4.16)
 (4.17)
(4.17)
В Масс-спектрах DMAM
производных ароматических кетонов относительные интенсивности пиков ионов [M-17]
достаточно высоки: ацетофенон - 100 %, п-метилацетофенон - 100 %,
пропиофенон - 76 % но, этилбензилкетон -3 %. С появлением других направлений
распада, интенсивность пика [M-17]
снижается. Так происходит при мас-спектрометрическом распаде алифатических
кетонов (в спектре производного изовалерофенона пик [M-17]
не наблюдается). Для молекулярных ионов алифатических кетонов, содержащих атом
водорода в γ-положении,
альтернативным процессом является перегруппировка Мак-Лафферти (1,5-миграция).
 (4.18)
(4.18)
Перегруппировка Мак-Лафферти невозможна для DMAM
производных кетонов по CH2
-группе.
Она может происходить только при масс-спектрометрическом распаде производных
алифатических кетонов. В случае CH2-DMAM
производных кетонов её протеканию мешает наличие сопряжения в фрагменте -CH=C(R)-C(-CH=CH-N(CH3)2)=O.
Для масс-спектров таких CH2-DMAM
производных характерно наличие пика иона [M-17],
указывающего на 1,6-миграцию. DMAM
производные тех же кетонов по CH3-группе
характеризуются наличием пика перегруппировки Мак-Лафферти и отсутствием
1,6-миграции водорода. Относительные интенсивности этих пиков для некоторых DMAM
производных приведены в Табл. 4.3.
Табл. 4.3. Относительные интенсивности наиболее
характерных пиков в спектрах DMAM
производных кетонов.
|
Исходное
карбонильное соединение и структура его DMAM
производного
|
α
распад
[M-отщепляющийся
фрагмент] = молекулярная масса иона, интенсивность
|
β распад
То же
|
Перегруппировка
Мак-Лафферти То же
|
1,6-миграция
То же
|
|
2-пентанон
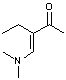
|
[M-CH3] =126, 100
|
|
[M-17] = 124, 35
|
|
|
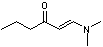 [M-C3H7] = 98,
100 [M-C3H7] = 98,
100
|
|
|
|
|
|
2-гексанон
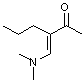
|
[M-C2H5] =126,
100
|
|
[M-17] = 138, 6
|
|
|
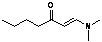 [M-C4H9] = 98, 100[M-C3H6]
= 113, 18 [M-C4H9] = 98, 100[M-C3H6]
= 113, 18
|
|
|
|
|
|
2-гептанон
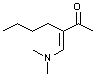
|
[M-C3H7]=126, 100
|
|
[M-17] = 152,
2
|
|
|
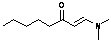 [M-C5H11] = 98, 100[M-C4H8]
= 113, 20 [M-C5H11] = 98, 100[M-C4H8]
= 113, 20
|
|
|
|
|
|
2-бутанон
|
|
|
[M-17] = 110,
49
|
|
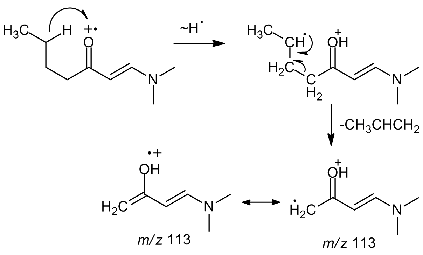
В результате проведения реакции 2-бутанона с DMF-DMA
в реакционной смеси обнаружено только CH2-DMAM
производное 2-бутанона. При масс-спектрометрическом распаде не может идти β-распад
из-за отсутствия β атома
углерода в молекуле DMAM
производного 2-бутанона, поэтому главным становится процесс 1,6-миграции атома
водорода. Интенсивность пика соответствующего иону [M-17]
довольно высока (49), что свидетельствует о значительном вкладе 1,6-миграции
атома водорода в процесс распада. В масс-спектре DMAM
производного метилацетата, образовавшегося в результате гидролиза и
последующего декарбоксилирования диметилмалоната, наиболее интенсивен пик иона
[M-CH3O]
= 98. 1,6-Миграция практически не идет, I[M-17]
= 2.
Реакция ацетилацетона с DMF-DMA
приводит к получению DMAM
производного по CH2
-группе. Этот факт следует из закономерностей масс-спектрометрического распада.
Пик с массовым числом 140 соответствует иону [M-CH3],
а ион с массовым числом 98 соответствует отщеплению фрагмента CH2CO
от иона [M-CH3],
что свидетельствует о последовательном отщеплении сначала CH3-
группы от одной ацильной группы и последующем отщеплении CH2CO
-группы от другой ацильной группы DMAM
производного ацетилацетона. Аналогичные рассуждения могут быть применены для
определения структуры DMAM
производного ацетоуксусного эфира, в масс-спектрах которого присутствуют пики M[M-C2H5O]
= 140 и M[M-C2H5O-CH2CO]
= 98, в ацетоуксусном эфире идет 1,6-миграция атома водорода.
В масс-спектре DMAM
производного циклогексанона I[M-17]
= 3, а DMAM
производного циклогексан-1,3-диона I[M-17]
= 3.
Таким образом, в ходе работы были рассмотрены
химические свойства DMF-DMA,
на основании которых рассмотрены возможности использования этого реагента для
дериватизации некоторых классов органических соединений с целью получения
производных для хроматографического анализа.
Выводы
1. Охарактеризованы возможности использования
диметилацеталядиметилформамида для получения производных органических
соединений для их газохроматографического и/или
хромато-масс-спектрометрического анализа. Показано что этот реагент пригоден не
только для превращения карбоновых кислот в их метиловые эфиры а первичных
аминов в соответствующие амидины, но и соединений с активными метильными и/или
метиленовыми группами в их диметиламинометиленовые производные.
2. Продукты взаимодействия 20 важнейших
аминокислот с диметилацеталемдиметилформамида охарактеризованы стандартными
масс-спектрами и индексами удерживания на стандартных неполярных фазах. Установлены
основные закономерности их масс-спектрометрической фрагментации. На примерах
пролина и триптофана подтверждено, что соединения с группами NH
образуют N-формильные
производные.
. Для оценки индексов удерживания N-диметиламинометиленовых
производных метиловых эфиров аминокислот H2NCHXCO2H
предложен метод структурной аналогии с использованием индексов удерживания
соединений типа X-CH3.
Вычислены параметры соответствующего регрессионного уравнения, позволяющего
оценивать индексы удерживания с точностью ± 26.
. Определены средние значения разностей
газохроматографических индексов удерживания органических соединений разных
классов (амины, гидразины, ароматические, алифатические и алициклические
карбонильные соединения), позволяющие уточнять особенности их структуры.
. В молекулярных ионах
1-арил-3-(диметиламино)-2-пропен-1-онов обнаружена не известная ранее миграция
атома водорода приводящая в появлению интенсивных сигналов ионов [M-OH]+
в их масс-спектрах.
Список литературы
. Zenkevich
I. G. Derivatization of Analytes in chromatography: General Aspects. In
Encyclopedia of Chromatography. 3rd Edn. New York: Taylor &
Francis, 2010.Vol.1. P. 561-566.
2. Barcel´o-Barrachina
E., Santos F. J., Puignou L., Galceran M. T., Comparison of dimethylformamide
dialkylacetal derivatization reagents for the analysis of heterocyclic amines
in meat extracts by gas chromatography-mass spectrometry // Anal. Chim. Acta.
2005. Vol. 545. P. 209-217.
3. Reistad R., Rossland O.
J., Latva-Kala K. J., Rasmussen T., Vikse R., Becher G., Alexander J.
Heterocyclic Aromatic Amines in Human Urine Following a Fried Meat Meal // Food
Chem. Toxicol. 1997. N. 35. P. 945-955.
4. Orata F. Derivatization
Reactions and Reagents for Gas Chromatography Analysis. In Advanced Gas
Chromatography - Progress in Agricultural, Biomedical and Industrial
Applications. Ed. M.A. Mohd. InTech Europe (on-line). 2012. 460 p.
5. Зенкевич И.Г., Пушкарева
Т.И. Хроматографическая и хромато-масс-спектрометрическая характеристика
производных аминокислот, образующихся при их взаимодействии с диметилацеталем
диметилформамида // Журнал общей химии. 2015. Т. 85. В печати.
. Пушкарева Т.И., Зенкевич
И.Г. Диалкилацетали диметилформамида: свойства и применение для получения
производных в газовой хроматографии // Вестник СПбГУ. Сер. 4. 2015. В печати.
7. Pushkareva T. I.,
Zenkevich I.G. Amino acid derivatization with DMF-DMA. IX Internat. conf.
"Mendeleev-2015". St. Peterburg. April 7-10, 2015. p. 285.
8. Пушкарева Т.И., Зенкевич
И.Г. Хромато-масс-спектрометрическая характеристика продуктов дериватизации
аминокислот диметилацеталем диметилформамида. Всерос. конф. "Теория и
практика хоматографии". Самара. Май 24-29. 2015. стр. ХХХ.
9. Abdulla
R. F., Brinkmeyer R. S. The chemistry of formamide acetals // Tetrahedron.
1979. Vol. 35. N. 14. P. 1675-1735.
10. Li
K., Feng J., Sun H., Wang, Zhiliang T. L., Niu C., Zhang Y., Zhong H., Geng D.,
Zhang M., Chen H. Preparation of floxuridine like compounds as antitumor agents
// Faming Zhuanli Shenqing. Patent. 2012. 27 p.
11. Lin R., Weaner L. E.
Facile synthesis of stable isotope-labeled antibacterial agent RWJ-416457 and
its metabolite // J. Label. Comp. Radiopharmaceuticals. 2012. Vol. 55. N. 8. P.
296-299.
12. Yi P., Wei C., Yong T.
Optimization on synthesis technology of N,N-dimethylformamide
dimethyl acetal // Jingxi Huagong Zhongjianti. 2008. Vol. 38. N. 5. P. 25-26.
13. Wawer I., Osek J. lH
and 13C Nuclear Magnetic Resonance Identification of the Products of
the Reaction of N,N-Dialkylformamide Dimethyl Acetals with Secondary Amines //
J. Chem. Soc., Perkin Trans. 2. 1985. P. 1669-1671.
15. Ludwig J., Bovens S.,
Brauch C., Elfringhoff A.S., Lehr M. Design and Synthesis of
1-Indol-1-yl-propan-2-ones as Inhibitors of Human Cytosolic Phospholipase A2r
// J. Med. Chem. 2006. Vol. 49. P. 2611-2620.
16. Tsai T.-Y., Hsu T., Chen
C.-T., Cheng J.-H., Chiou M.-C., Huang C.-H., Tseng Y.-J., Yeh T.-K., Huang
C.-Y., Yeh K.-C., Huang Y.-W., Wu S.-H., Wang M.-H., Chen X., Chao Y.-S.,
Jiaang W.-T. Rational design and synthesis of potent and long-lasting glutamic
acid-based dipeptidyl peptidase IV inhibitors // Bioorg. Med. Chem. Lett. 2009.
Vol. 19. P. 1908-1912.
17. Gupton J. T., Miller J.
F., Bryant R. D., Maloney P. R., Foster. B. S. The preparation of aromatic
amidino esters and their reaction with primary amines // Tetrahedron. 1987.
Vol. 43. N 8. P. 1747-1752.
18. Deau E., Hedou D.,
Chosson E., Levacher V., Besson T. Convenient one-pot synthesis of
N3-substituted pyrido[2,3-d]-, pyrido[3,4-d]-,
pyrido[4,3-d]-pyrimidin-4(3H)-ones, and quinazolin-4(3H)-ones analogs //
Tetrahedron Lett. 2013. Vol. 54 P. 3518-3521.
19. Osei-Twum E. Y., Mamer
0. A., Quilliam M. A., Gergely R.
N-dimethylaminomethyllene-O-trialkylsilyl derivatives of nucleosides for
chromatography and mass spectrometry // Nucleosides & Nucleotides. 1990. Vol.
9. N 3. P. 369-372.
. He L., Pei H., Ma L.,
Pu Y., Chen J., Liu Z., Ran Y., Lei L., Fu S., Tang M., Peng A., Long C., Chen
L. Synthesis and lipid-lowering evaluation of 3-methyl-1H-purine-2,6-dione
derivatives as potent and orally available anti-obesity agents // Eur. J. Med.
Chem. 2014. Vol. 87. P. 595-610.
21. Deng X.-Q., Song M.-X.,
Zheng Y., Quan Z.-S. Design, synthesis and evaluation of the antidepressant and
anticonvulsant activities of triazole-containing quinolinones // Eur. J. Med.
Chem. 2014. Vol. 73. P. 217-224.
22. Zhu J., Wong H., Zhang
Z., Yin Z., Meanwell N. A., Kadow J. F., Wang T. An effective procedure for the
preparation of 3-substituted-4- or 6-azaindoles from ortho-methyl nitro
pyridines // Tetrahedron Lett. 2006. Vol. 47. P. 5653-5656.
23. Davey R. M., Stamford N.
P. J. Catalytic enamines from dialkylamide-dialkylacetals // Tetrahedron Lett.
2012. Vol. 53. N. 20. P. 2537-2539.
. Husek P., Macek K. Gas
chromatography of amino acids // J. Chromatogr. 1975. Vol. 113. P. 139-230.
25. Linz S., Müller J.,
Hübner H., Gmeiner P., Troschütz R. Design, synthesis and dopamine D4
receptor binding activities of new N-heteroaromatic 5/6-ring Mannich bases //
Bioorg. Med. Chem. 2009. Vol. 17. P. 4448-4458.
. Rozhkov V. V.,
Synthesis of 6-nitro-4-sulfanyl-1H-indole derivatives from
2,4,6-trinitrotoluene // Tetrahedron. 2014. Vol. 70. P. 3595-3600.
. Sureshbabu R.,
Balamurugan R., Mohanakrishnan A. K. Synthesis of substituted carbazoles via
electrocyclization of in situ generated enamines from
1-phenylsulfonyl-2/(3)-methyl-3/(2)-vinylindoles and DMF-DMA // Tetrahedron.
2009. Vol. 65. P. 3582-3591.
28. Meierhenrich U., Thiemann
W. H. P., Rosenbauer H. Pyrolytic methylation assisted enantioseparation of
chiral hydroxycarboxylic acids // J. Anal. Appl. Pyrolysis. 2001. Vol. 60. P. 13-26.
. Kataoka H.
Derivatization reactions for the determination of amines by gas chromatography
and their applications in environmental analysis // J. Chromatogr. 1996. Vol.
733. P. 19-34.
30. Thenot J-P., Ruo T. I.,
Bouwsma O. J. Formylation of secondary mines with dimethylformamide
dimethylacetal // Anal. Lett. 1980. Vol. A9. N 13. P. 759-769.
31. Nayar M. S. B., Callery
P. S. Formylation of secondary amines with diakyl acetals of dimethylformamide
// Anal. Lett. 1980. Vol. A7. N 13. P. 625-634.
. Thenot J. P., Horning
E. C. Amino acid N-dimethylaminomethylene alkyl esters new derivatives for GC
and GC-MS studies // Anal. Lett. 1972. Vol. 5. N 8. P. 519-529.
33. Irving C. S., Klein P.
D. Isolation and Derivatization of Plasma Taurine for Stable Isotope Analysis
by Gas Chromatography-Mass Spectrometry // Anal. Biochem. 1980. Vol. 107. P.
251-259.
. Osei-Twum E. Y.
Chemical derivatization for liquid chromatography and mass spectrometry of
nucleosides and their analogs // Thesis submitted to the School of Graduate
Studies in Partial Fulfillment of the Requirement for the Degree Master of
Science. McMaster University. 1981.
35. Osei-Twum E. Y., Mamer 0.
A., Quilliam M. A., Gergely R.
N-Dimethylaminomethylene-O-trialkylsilyl derivatives of nucleosides for chromatography
and mass spectrometry // Nucleosides & Nucleotides. 1990. Vol. 9. N 3. P.
369-372.
. Hadley S. W., Braun S.
K., Wekell M. M. Confirmation of Domoic Acid as an N-Formyl-O-Methyl Derivative
in Shellfish Tissues by Gas Chromatography - Mass Spectrometry // Seafood
Safety, Processing Biotechnol. 1997. P. 25-32.
37. Зенкевич И.Г.
Хроматографическая характеристика органических реакций на основе аддитивности
изменения газохроматографических параметров удерживания реагентов и продуктов
// Журн. орг. химии. 1992 г. Т. 28. Вып. 9. С. 1827 - 1840.
38. The NIST 14 Mass
Spectral Library (NIST/2014/EPA/NIH). Software/Data Version (NIST14); NIST
Standart Reference Database, Number 69, 2014. National Institute of Standards
and Technology, Gaithersburg, MD 20899; #"882789.files/image065.jpg">
|
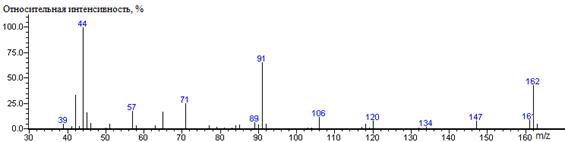
Бензиламин,
994 ± 10
|
162
- 107 = 55
|
1408
|
1396 ± 2 (BPX-1) 1407 ± 2 (RTX-5)
|
N'-бензил-N,N-диметилформимидамид
163(5),
162(46) М, 161(9), 147(9), 134(3), 132(2), 120(8), 119(2), 118(6),
117(3), 106(13), 104(2), 103(2), 92(6), 91(65) [С 6Н 5СН
2], 90(5), 89(7), 85(5), 84(4), 83(2), 81(2), 79(3), 77(4), 71(26)
[(СН 3)2NCHN], 65(17), 63(4), 58(4),
57(18), 51(5), 50(2), 46(6), 45(17), 44(100) [N(СН 3)2],
43(3), 42(34), 41(4), 39(6)
|
|
|
|
Моноэтаноламин,
675 ± 23
|
116
- 61 = 55
|
-
|
1052 ± 2 (BPX-1) 1064 ± 2 (RTX-5)
|
N'-(2-гидроксиэтил)-N,N-диметилформимидамид 116(11)
М,
98(3), 86(4), 85(61) [М
- СН 2OН],
72(3), 71(3), 58(2), 57(4), 46(4), 45(14), 44(100) [N(СН 3)2], 43(6), 42(34),
41(7)
|
|
|
|
Каприновая
кислота 1378 ± 10
|
186
- 172 = 14
|
1312
± 7
|
1313
(BPX-1)
|
Метилкапрат. Не требуется. Для
идентификации достаточно индекса удерживания.
|
|
Янтарная
кислота-
|
146
- 118 = 28
|
1015
± 17
|
1008
± 3 (BPX-1)
|
Диметилсукцинат. То же.
|
|
Глутаровая
кислота
|
160
- 132 = 28
|
1113
± 15
|
1106
± 1 (BPX-1)
|
Диметилглутарат. То же.
|
|
Малоновая
кислота-
|
132
- 104 = 28
|
912
± 33
|
948
± 3 (BPX-1)
|
Диметилмалонат. То же
|
|
Лимонная
кислота-
|
234
- 192 = 42
|
1438
± 18
|
1422
± 1 (BPX-1) 1425 ± 1 (BPX-1) 1475 ± 1 (RTX-5)
|
Триметиловый эфир лимонной кислоты. То же
|
|
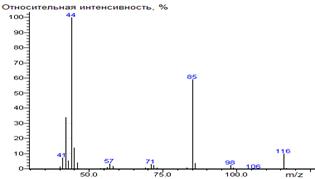
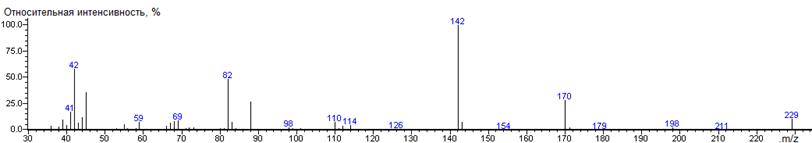
α-кетоглутаровая
кислота-
|
229
- 146 = 83
|
-
|
1845
± 7 (BPX-1) 1848 ±
7 (BPX-1) 1927 ±
1 (RTX-5)
|
диметил-3-((диметиламино)метилен)-2-оксопентандиоат
38(2),
39(10), 41(17), 42 (58), 43 (7), 44 (8), 45 (36), 53 (2), 55 (5), 59 (7), 66
(4), 67 (7), 68 (9), 69 (9), 72 (3), 73 (3), 82 (49), 83 (8), 84 (2), 88
(27), 98 (3), 101 (2), 110 (8), 112 (4), 114 (5), 142 (100) [M-CO2CH3-CO], 143
(8), 170 (29) [M-CO2CH3], 171
(2), 198 (3), 229 (11) M
|
|
|
|
Начиная
с глицина и далее масс-спектры приведены в последовательности увеличения
значений m/z.
|
|
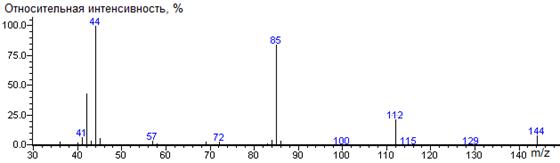
Глицин
A-H
|
144
- 75 = 69
|
|
-1178 ± 4 (RTX-5)
|
Gly-N-DMAM-Me 36(3),
40(2), 41(7), 42(44), 43(4), 44(100) [N(CH3)2], 45(6),
57(4), 69(3), 72(3), 84(5), 85(84) [M-CO2CH3], 86(4),
112(22), 144(9) M
|
|
|
|
Аланин
A-CH3
|
158
- 89 = 69
|
|
1143 ± 3 (BPX-1) 1175 ± 2 (RTX-5)
|
Ala-N-DMAM-Me 41(3),
42(22), 43(3), 44(100) [N(CH3)2], 45(5), 46(4), 55(4),
56(11), 57(5), 58(3), 72(7), 83(3), 99(94) [M-CO2CH3],
100(6), 158(5) M
|
|
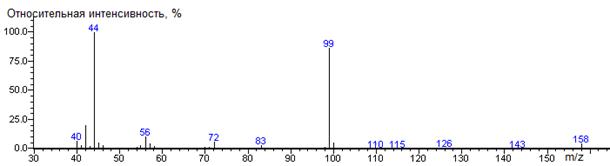
|
|
Серин
A-CH2OH
|
174
- 105 = 69
|
|
1233 (BPX-1) 1280 ± 1 (RTX-5)
|
Ser-N-DMAM-Me 41(4),
42(33), 43(10), 44(100) [N(CH3)2], 45(5), 54(15),
54(2), 55(4), 56(5), 71(3), 72(3), 80(2), 95(3), 96(26), 97(31) [M-H2O-CO2CH3],
98(2), 124(13), 156(21) [M-H2O], 173(0.3) [M-H]
|
|
|
|
Пролин
A-
(2-пирролидинил)
|
157
- 115 = 42
|
|
1332 ± 1 (BPX-1) 1387 ± 3 (RTX-5)
|
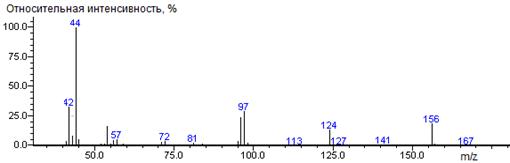
Метиловый эфир N-формилпролина
38(2),
39(7), 41(26), 42(11), 43(29), 44(10), 45(2), 50(2), 51(3), 55(2), 68(14),
69(3), 70(90) [M-CO2CH3-CO], 71(60), 73(2), 77(5),
86(20),98(100)
[M-CO2CH3], 99(7), 106(3), 129(8), 157(5) M
|
|
|
|
Валин
A-CH(CH3)2
|
186
- 117 = 69
|
|
1265 ± 2 (BPX-1) 1288 ± 2 (RTX-5)
|
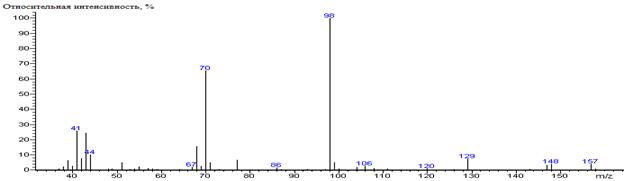
Val-N-DMAM-Me 39(3),
41(8), 42(21), 43(4), 44(100) [N(CH3)2], 45(5), 46(15),
55(9), 56(4), 57(13), 59(4), 68(2), 71(4), 72(6), 73(4), 82(2), 83(5), 84(4),
127(60) [M-CO2CH3], 128(5), 142(3), 143(76) [M-C3H7],
144(5), 186(3) M
|
|
|
|
Норлейцин
A-C4H9
|
200
- 131 = 69
|
|
1390 ± 1 (BPX-1) 1426 ± 3 (RTX-5)
|
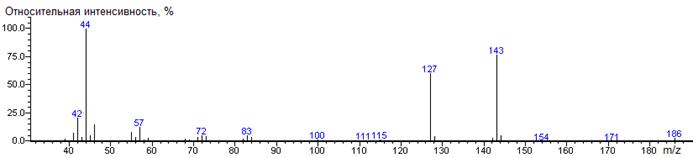
nor-Leu-N-DMAM-Me 39(2),
41(9), 42(21), 43(10), 44(100) [N(CH3)2], 45(6),
46(10), 54(3), 55(6), 56(5), 57(9), 58(3), 59(3), 69(4), 70(3), 71(7), 72(6),
73(8), 83(4), 84(6), 85(18), 96(2), 97(5), 98(4), 99(9), 100(2), 112(5),
140(3), 141(85) [M-CO2CH3], 142(8), 143(17) [M-C4H9],
156(38) [M-N(CH3)2], 157(5), 200(0.2) M
|
|
|
|
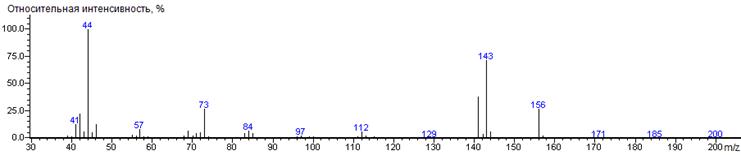
Изолейцин A-CH(CH3)C2H5
|
200
- 131 = 69
|
|
1344 ± 1 (BPX-1) 1380 ± 2 (RTX-5)
|
Ile-N-DMAM-Me 39(3),
41(13), 42(23), 43(6), 44(100) [N(CH3)2], 45(6),
46(14), 55(3), 56(3), 57(8), 59(2), 68(2), 69(7), 70(2), 71(5), 72(6),
73(28), 83(5), 84(7), 85(5), 97(2), 111(2), 112(6),113(3), 141(39) [M-CO2CH3],
142(4), 143(75) [M-C4H9], 144(7), 156(28) [M-N(CH3)2],
157(3), 200 (0.1) [M]
|
|
|
|
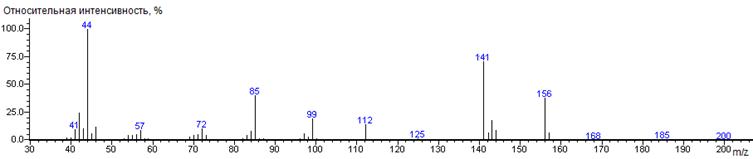
Лейцин
A-CH2CH(CH3)2
|
200
- 131 = 69
|
|
1342 ± 1 (BPX-1) 1380 ± 2 (RTX-5)
|
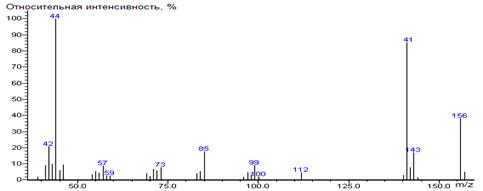
Leu-N-DMAM-Me 39(2),
41(9), 42(25), 43(10), 44(100) [N(CH3)2], 45(6),
46(12), 53(4), 55(5), 56(5), 57(9), 58(2), 69(3), 70(4), 71(5), 72(10),
73(5), 83(4), 84(8), 85(40), 86(2), 97(6), 98(3), 99(20), 100(2), 112(14),
141(72) [M-CO2CH3], 142(64), 143(18) [M-C4H9],
144(9), 156(39) [M-N(CH3)2], 157(7), 200(0.1) M
|
|
|
|
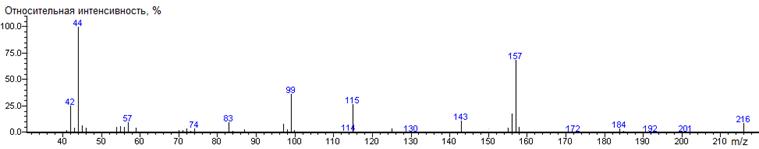
Аспарагиновая
кислота A-CH2CO2H
|
216
- 133 = 83
|
|
1460 ± 1 (BPX-1) 1515 ± 1 (RTX-5)
|
Asp-N-DMAM-Me2 41(3),
42(26), 43(4), 44(100) [N(CH3)2], 45(7), 46(5), 54(6),
54(6), 56(5), 57(9), 58(5), 70(2), 71(2), 72(3), 74(3), 83(9), 83(2), 87(3),
97(8), 98(3), 99(36), 99(2), 115(27), 125(4), 143(11), 155(5),156(18),
157(69) [M-CO2CH3], 158(6), 184(4), 185(2), 216(10) M
|
|
|
|
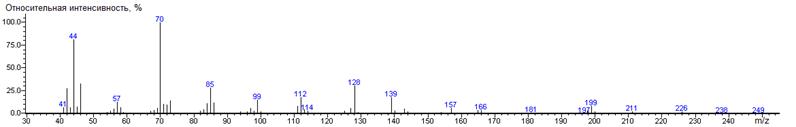
Лизин
A-(CH2)4NH2
|
270
- 146 = 124
|
|
1961 ± 1 (BPX-1) 1969 ± 0 (RTX-5)
|
Lis-bis-N-DMAM-Me 41(7),
42(28), 43(7), 44 (81) [N(CH3)2], 45(8), 46(33), 55(3),
56(6), 57(13), 58(7), 67(3), 68(4), 69(7), 70(100) [(CH3)2N-CN],
71(11), 72(10), 73(15), 82(3), 83(5), 84(11), 85(29), 86(12), 94(3), 95(3),
97(6), 98(4), 99(15), 100(3), 111(9), 112(18), 113(5), 114(3), 125(3),
127(6), 128(31), 129(2), 139(18), 140(3), 143(6), 144(3), 154(2), 157(6),
165(4), 166(4), 197(5), 199(8), 200(3), 211(3) [M-CO2CH3],
226(3)
|
|
|
|
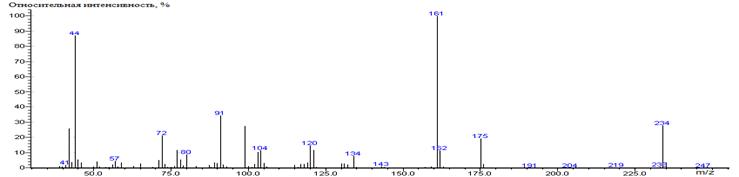
Глутаминовая
кислота A-(CH2)2-CO2H
|
230
- 147 = 83
|
|
1578 ± 2 (BPX-1) 1637 ± 1 (RTX-5)
|
Glu-N-DMAM-Me2 39(3),
41(12), 42(38), 43(7), 44(85) [N(CH3)2], 45(8), 46(20),
54(3), 55(4), 56(5), 57(18), 58(3), 59(6), 68(5), 69(2), 70(8), 71(8), 72(6),
73(16), 83(5), 84(6), 85(6), 95(2), 96(2), 97(10), 98(3), 99(4), 111(100)
[M-CO2CH3-HCO2CH3], 112(9),
139(8), 143(12), 155(11), 157(29), 158(2), 169(4), 170(19), 171(47) [M-CO2CH3],
172(4), 198(4), 199(10), 230(10) M
|
|
|
|
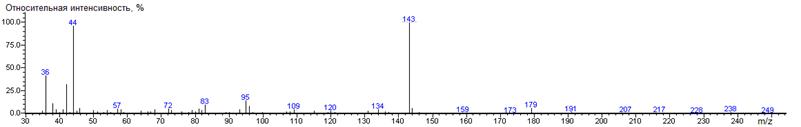
Гистидин
A-CH2-(3-имидазолил
|
224
- 155 = 69
|
|
-
(BPX-1) 2006 ± 2 (RTX-5)
|
His-N-DMAM-Me 35(16),
36(88), 37(4), 38(30), 39(6), 40(7), 41(5), 42(26), 43(6), 44(100), 45(12),
46(7), 50(4), 52(3), 53(2), 54(4), 55(3), 56(3), 57(6), 58(7), 59(2), 66(4),
67(2), 68(3), 71(2), 72(7), 73(5), 79(4), 80(2), 81(6), 82(3), 83(8), 84(4),
87(3), 89(3), 93(6), 95(12), 96(7), 100(4), 105(2), 107(3), 109(4), 115(3),
119(3), 120(12), 121(4), 134(4), 143(81), 144(7), 179(6),
|
|
|
|
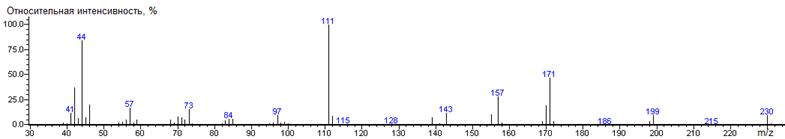
Метионин
A-(CH2)2SCH3
|
218
- 149 = 69
|
|
1581 ± 2 (BPX-1) 1638 ± 1 (RTX-5)
|
Met-N-DMAM-Me 35(4),
39(3), 41(11), 42(37), 43(4), 44(100) [N(CH3)2],
45(12), 46(9), 47(3), 54(4), 55(3), 56(5), 57(18), 58(4), 59(3), 61(44),
68(4), 70(5), 71(6), 72(6), 73(4), 74(2), 75(2), 83(6), 84(38), 85(8), 87(3),
97(24), 99(10), 104(3), 111(61) [M-CO2CH3-CH3SH],
112(64), 113(4), 128(5), 143(21) [M-(CH2)2SCH3],
144(42), 145(3), 157(83) [M-CH3SCH2], 158(7), 159(16)
[M-CO2CH3], 174(2), 186(2), 203(3), 218(5) M
|
|
|
|
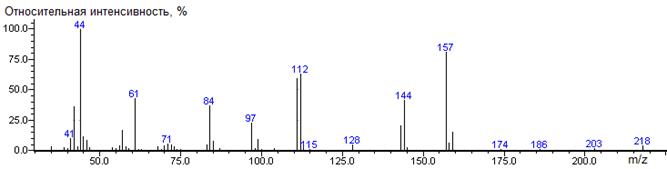
Фенилаланин
A-CH2C6H5
|
234
- 165 = 69
|
|
1692 ± 0 (BPX-1) 1734 ± 2 (RTX-5)
|
Phe-N-DMAM-Me 41(2),
42(26), 43(4), 44(87) [N(CH3)2], 45(6), 46(4), 51(4),
56(2), 57(5), 59(4), 65(3), 71(5), 72(21), 73(3), 77(12), 78(6), 80(9),
87(2), 89(4), 90(3), 91(35), 92(2), 99(28), 102(3), 103(11), 104(12), 105(3),
115(2), 117(3), 118(3), 119(4), 120(15), 121(12), 130(3), 131(3), 132(2),
134(8), 161(100) [M-C6H5CH2], 162(12),
175(20) [M-CO2CH3], 176(3), 234(28) M, 235(4)
|
|
|
|
Аргинин
А-(CH2)3NHC(NH2)=NH
|
298
- 174 = 124
|
|
1842 ± 1 (BPX-1) 2055 ± 25 (RTX-5)
|
Arg-bis-N-DMAM-Me 39(3),
41(10), 42(51), 43(20), 44(100) [N(CH3)2], 45(8),
46(18), 53(3), 54(4), 55(8), 56(12), 57(19), 58(8), 59(2), 67(2), 68(7),
69(4), 70(12), 71(18) [(CH3)2NCHN], 72(34), 73(13),
80(6), 82(7), 83(12), 84(5), 85(25), 86(2), 96(5), 97(21), 98(57), 99(50),
100(37), 101(2), 111(7), 113(4), 123(2), 124(3), 125(28), 126(5), 128(21),
129(3), 140(5), 141(3), 142(8), 143(5), 151(3), 152(5), 157(4), 184(36),
185(6), 186(3), 197(3), 212(6)
|
|
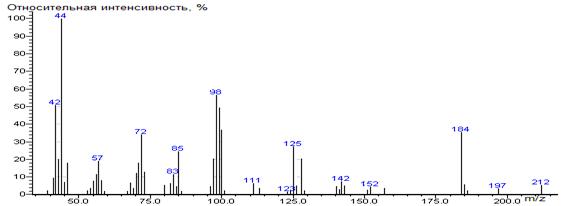
|
|
Тирозин
A-CH2-(4-C6H4OH)
|
250
- 181 = 69
|
|
Tyr-N-DMAM-Me2: 1905
± 20 (BPX-1) 1987 ± 4 (RTX-5) Tyr-N-DMAM-Me: 1953
± 23 (BPX-1) 2038 ±5 (RTX-5)
|
Tyr-N-DMAM-Me2:
36(5), 38(2), 40(9), 41(2), 42(23), 43(3), 44(100) [N(CH3)2],
45(7), 46(6), 55(2), 56(2), 57(7), 65(3), 72(5), 77(5), 83(4), 84(4), 91(4),
103(6), 121(9), 143(57) [(CH3)2NCHNCHCO2CH3],
144(4), 205(5) [M-CO2CH3] Tyr-N-DMAM-Me:
36(4), 39(3), 40(7), 41(3), 42(23), 43(4), 44(100) [N(CH3)2],
45(7), 46(10), 51(2), 57(7), 58(3), 65(3), 71(3), 72(4), 73(4), 74(2), 77(4),
83(6), 84(3), 91(5), 94(2), 96(4), 107(6), 115(2), 120(2), 121(3), 143(53)
[(CH3)2NCHNCHCO2CH3], 144(5),
191(4) [M-CO2CH3]
|
|
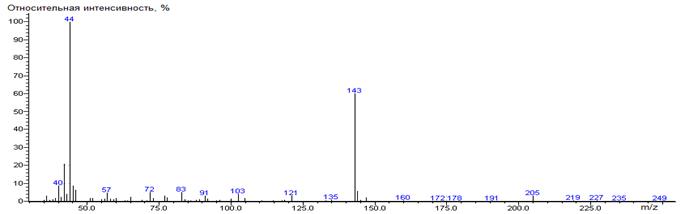
|
|
Триптофан
A-CH2-(3-индолил)
|
273
- 204 = 69
|
|
2321 ± 15 (RTX-5) 2327 ± 43
(BPX-1) 2374
± 17 (RTX-5)
|
Trp-N-DMAM-Me: 42(19),
44(55) [N(CH3)2], 45(3), 46(6), 57(6), 72(4), 77(6),
83(4), 84(6), 102(2), 103(4), 107(4), 112(12), 115(8), 130(26), 131(3),
142(2), 143(100) [(CH3)2NCHNCHCO2CH3],
144(29), 145(3), 169(4), 214(5) [M-CO2CH3] N-формил-
Trp-N-DMAM-Me: 42(15), 44(46) [N(CH3)2],
45(2), 46(3), 57(3), 72(3), 77(3), 83(3), 115(5), 130(8), 143(100) [(CH3)2NCHNCHCO2CH3],
144(10), 169(2), 242(4) [M-CO2CH3]
|
|
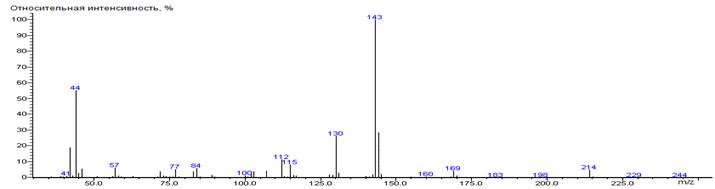 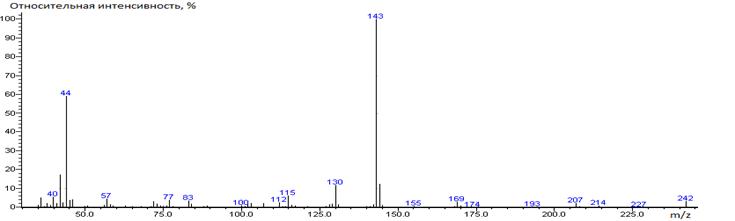
|
|
Ацетофенон
1067
|
175
- 120 = 55
|
|
1862
± 0 (RTX-5)
|
3-(диметиламино)-1-фенилпроп-2-ен-1-он 39(3),
41(5), 42(40), 43(9), 44(8), 45(2), 50(6), 51(19), 52(3), 53(3), 54(5),
55(30), 56(2), 63(2), 68(3), 70(25), 73(3), 74(10), 76(3), 77(38), 78(4),
82(7), 91(17), 98(98) [M-C6H5], 99(6),
102(3), 103(6), 104(2), 105(28), 106(2), 115(3), 117(3), 130(2), 131(9),
132(6), 133(3), 143(7), 144(3), 158(100) [M-OH], 159(12), 160(6), 174(6),
175(34) M, 176(4)
|
|
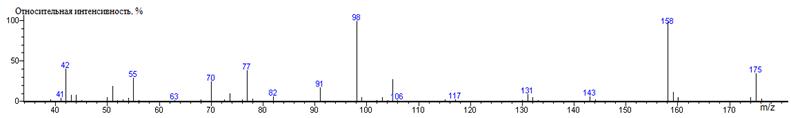
|
|
п-Метилацетофенон 1174 ± 16
|
189
- 134 = 55
|
|
1981
± 2 (RTX-5)
|
3-(диметиламино)-1-(п-толуил)проп-2-ен-1-он 35(7), 38(3), 39(11), 40(2),
41(7), 42(41), 43(9), 44(10), 45(3), 50(2), 51(6), 53(4), 54(5), 55(32),
56(2), 62(2), 63(7), 64(2), 65(23), 66(2), 68(4), 69(2), 70(31), 77(8),
80(4), 80(13), 82(11), 89(8), 90(4), 91(34), 92(3), 98(86) [M-C7H7],
99(5), 103(3), 105(19), 115(7), 116(2), 117(4), 118(2), 119(33), 120(3),
130(3), 131(9), 132(2), 144(3), 145(6), 146(4), 157(7), 158(10), 172(100)
[M-OH], 173(14), 174(11), 175(4), 188(5), 189(34) M, 190(4)
|
|
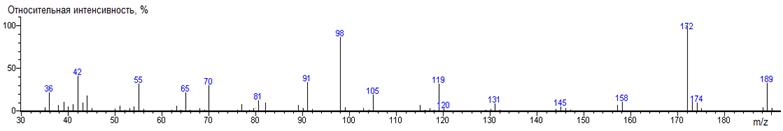
|
|
Пропио-фенон,
1165
|
189 - 134 = 55
|
|
1805
± 3 (RTX-5)
|
4-(диметиламино)-1-фенилбут-3-ен-1-он 39(12),
40(3), 41(20), 42(100), 43(11), 44(33), 45(6), 50(6), 51(26), 52(2),53(3),
55(9), 56(4), 58(23), 63 (2), 65(2), 66(3), 67(4), 68(27), 69(19), 70(3),
72(2), 75(2), 76(4), 77(88) [C6H5], 78(9),
79(2), 80(14), 82(11), 84(40), 85(3), 91(22), 96(4), 103(4), 105(75) [C6H5CO], 106(6),
112(54), 113(4), 115(12), 116(4), 117(11), 118(2), 129(2), 131(7), 144(3),
145(5), 157(9), 158(2), 172(76) [M-OH], 173(10), 174(8), 188(5),
189(16) M
|
|
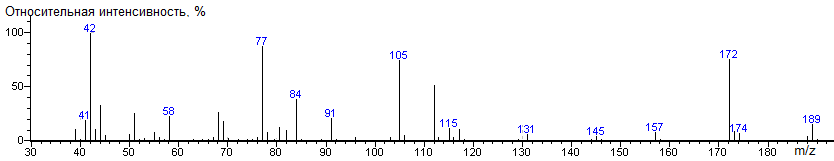
|
|
1-фенилбутан
-2-он, 1235
|
203
- 148 = 55
|
|
1798
(RTX-5)
|
1-(диметиламино)-2-фенилпент-1-ен-3-он 36(5), 38(2), 39(7), 40(3), 41(4), 42(44),
43(5), 44(12), 45(4), 50(3), 51(9), 52(4), 55(2), 57(9), 62(2), 63(10),
64(2), 65(5), 71(3), 72(9), 73(4), 74(3), 75(4), 76(11), 77(23), 78(4),
79(3), 84(7), 87(3), 89(21), 90(6), 91(15), 102(22), 103(17), 104(5),
105(14), 115(11), 116(53), 117(14), 118(3), 119(2), 128(2), 129(5), 130(17),
131(62), 132(7), 144(37), 145(6), 146(19), 147(2), 174(100), 175(12), 186(3)
[M-OH], 202(2), 203(36) M, 204(6)
|
|
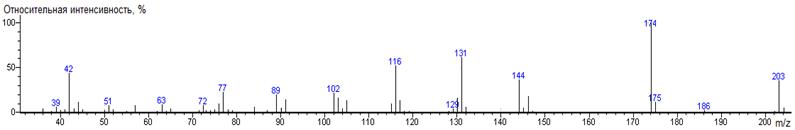
|
|
Изовалерофенон,
1289 ± 1
|
217
- 162 = 55
|
|
1740
± 1 (RTX-5)
|
2-((диметиламино)метилен)-3-метил-1-фенилбутан-1-он
35(3),
36(18), 38(7), 39(6), 40(6), 41(12), 42(24), 43(10), 44(23), 45(5), 50(3),
51(10), 53(6), 55(6), 56(2), 57(8), 58(11), 65(2), 67(3), 69(2), 70(3),
71(7), 72(3), 74(2), 76(2), 77(55), 78(4), 79(3), 80(3), 81(6), 82(14),
83(2), 84(3), 85(6), 91(8), 94(3), 96(9), 97(3), 98(55), 99(5), 105(100) [C6H5CO], 106(9),
112(9), 113(2), 115(3), 128(3), 140(3), 158(4), 159(3), 200(11) [M-OH], 202(25) [M-CH3], 203(4),
217(10) M, 218(2)
|
|
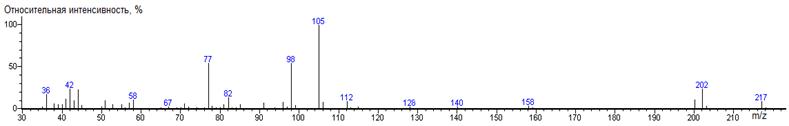
|
|
2-гексанон, 780
|
155
- 100 = 55
|
|
1397
± 1 (RTX-5) (производное
по CH2-группе) 1489 (RTX-5) (производное
по CH3-группе)
|
3-((диметиламино)метилен)гексан-2-он 36(5), 38(2), 39(9), 40(2),
41(13), 42(46), 43(37), 44(21), 45(4), 53(4), 55(7), 56(3), 58 (7), 65(2),
66(2), 67(5), 68(7), 69(4), 70(3), 80(2), 81(3), 82(25), 83(5), 84(44),
85(5), 94(3), 96(5), 97(4), 98(11), 110(4), 112(5) [M-C3H7],
126(100) [M-C2H5], 127(8),
138(6) [M-OH], 140(15) [M-CH3], 155(22)
M, 156(2) 1-(диметиламино)гепт-1-ен-3-он 39(2),
41(5), 42(16), 43(5), 44(2), 54(2), 55(14), 56(3), 70(6), 71(9), 96(4),
98(100) [M-C4H9], 99(6),
113(18) [CH2=C(OH)CHCHN(CH3)2],
155(5) M
|
|
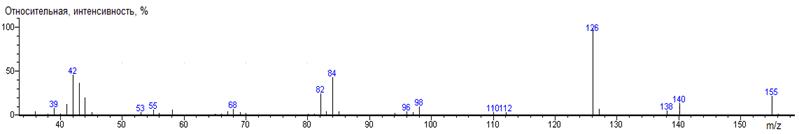 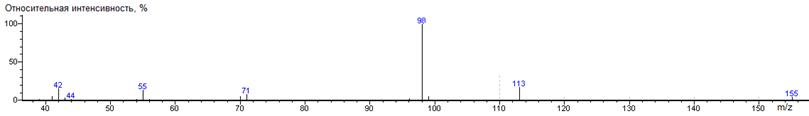
|
|
2-петанон, 672
|
141
- 86 = 55
|
|
1323
± 1 (RTX-5) (производное
по CH2-группе) 1383 ± 2 (RTX-5) (производное
по CH3-группе)
|
3-((диметиламино)метилен)пентан-2-он 36(3),
38(2), 39(11), 41(18), 42(75), 43(53), 44 (39), 45(4), 51(4), 52(2), 53(7),
54(2), 55(15), 56(5), 58(24), 66(3), 67(7), 68(21), 69(9), 70(3), 71(2),
74(3), 80(3), 81(4), 82(30), 83(15), 84(53), 85(6), 94(2), 96(11), 97(3),
98(37), 99(4), 108(3), 110(3), 124(35) [M-OH], 125(4), 126(100) [M-CH3], 127(8),
141(36) M, 142(3) 1-(диметиламино)гекс-1-ен-3-он 41(4),
42(13), 43(6), 44(2), 45(2), 55(9), 70(5), 71(4), 97(2), 98(100) [M-C3H7], 99(6),
113(3), 141(9) M
|
|
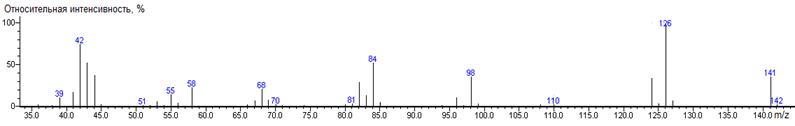 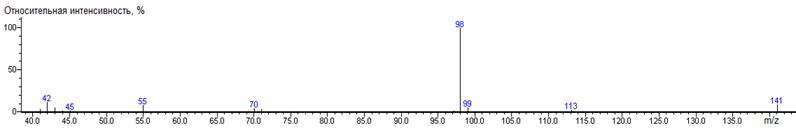
|
|
2-гептанон, 866 ± 16
|
169
- 114 = 55
|
|
1488
± 0 (RTX-5)
(производное по CH2-группе)
1593 ± 1 (RTX-5)
(производное по CH3-группе)
|
3-((диметиламино)метилен)гептан-2-он 35(4),
36(30), 38(10), 39(6), 40(5), 41(11), 42(36), 43(33), 44(23), 45(10), 46(5),
53(3), 55(6), 56(3), 58(8), 66(2), 67(4), 68(5), 69(4),70(4), 71(2), 79(2),
81(4), 82(17), 83(4), 84(51), 85(6), 94(3), 96(5), 98(17), 108(3), 110(4),
111(4), 112(6), 124(3), 126(100) [M-C3H7], 127(7),
152(2) [M-OH], 154(7), 169(18) M 1-(диметиламино)окт-1-ен-3-он 41(4),
42(10), 43(5), 55(9), 70(5), 71(11), 96(4), 98(100) [M-C5H9], 99(6),
113(20) [CH2=C(OH)CHCHN(CH3)2],
126(3), 169(5) M
|
|
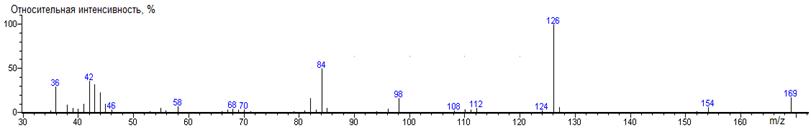 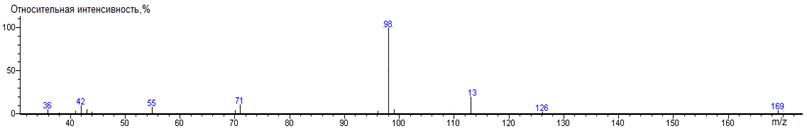
|
|
Ацетон,
475 ± 12
|
113
- 58 = 55
|
|
1208
±4
|
4-(диметиламино)бут-3-ен-2-он 35(4),
36(10), 38(5), 39(6), 40(3), 41(11), 42(61), 43(32), 44(9), 52(3), 53(4),
54(7), 55(36), 56(8), 68(6), 69(3), 70(18), 82(4), 84(3), 96(13), 97(3),
98(100) [M-CH3], 99(6),
113(48) M, 114(4)
|
|
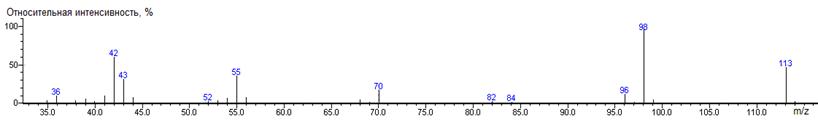
|
|
2-бутанон, 585 ± 14
|
127
- 72 = 55
|
|
1270
± 2
|
4-(диметиламино)-3-метилбут-3-ен-2-он 36(4),
38(5), 39(23), 40(6), 41(25), 42(64), 43(54), 44(92) [N(CH3)2],
45(6), 46(2), 51(2), 52(2), 53 (5), 54(6), 55(26), 56(62), 57(9), 58(3),
66(2), 67(7), 68(18), 69(21), 70(8), 71(4), 72(12), 82(7), 83(3), 84(42),
85(5), 94(4), 95(4), 96(3), 98(6), 110(49) [M-OH], 111(4), 112(100) [M-CH3], 113(9),
127(55) M, 128(4)
|
|
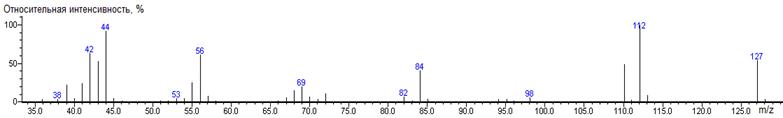
|
|
Метилацетат,
520 ± 10
|
129
- 74 = 55
|
|
1211
± 4
|
метил-3-(диметиламино)акрилат 41(6),
42(38), 43(9), 44(5), 45(7), 53(2), 54(5), 55(24), 56(4), 68(7), 69(4),
70(31), 71(7), 72(3), 82(8), 84(3), 96(2), 97(7), 98(100) [M-CH3O], 99(6),
112(2) [M-OH], 114(16) [M-CH3], 129(27)
M
|
|
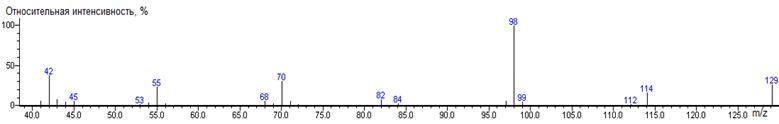
|
|
Ацетилацетон,
775 ± 12
|
155
- 100 = 55
|
|
1521
± 0
|
3-((диметиламино)метилен)пентан-2,4-дион 39(5), 41(7), 42(33), 43(45), 44(12), 53(7),
54(2), 55(14), 56(3), 68(4), 69(3), 70(9), 80(4), 81(2), 82(4), 84(2), 94(2),
96(9), 98(100) [M-CH3-CH2CO], 99(6),
112(3), 122(5), 138(2), 140(49) [M-CH3], 141(3),
155(11) M
|
|
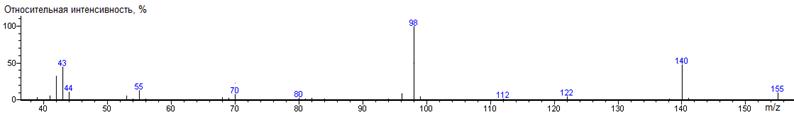
|
|
Ацетоуксусный
эфир, 910
|
185
- 130 = 55
|
|
1600
± 1
|
этил-2-((диметиламино)метилен)-3-оксобутаноат 39(4),
41(10), 42(51), 43(51), 44(18), 45(2), 46(4), 53(9), 54(4), 55(26), 56(2),
68(12), 69(7), 70(11), 71(2), 72(2), 74(4), 81(2), 82(24), 83(3), 84(4),
96(14), 97(5), 98(100) [M-C2H5O-CH2CO], 99(6),
114(4), 124(84), 125(5), 126(15), 139(2), 140(26) [M-C2H5O], 141(2),
142(22), 156(2), 168(8) [M-OH], 170(35)
[M-CH3], 171(3),
185(19) M
|
|
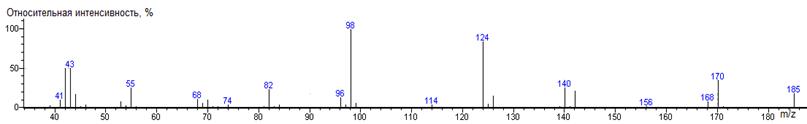
|
|
Диметилмалонат,
903 ± 11
|
187
- 132 = 55
|
|
1563
|
диметил-2-((диметиламино)метилен)малонат 39(3),
41(18), 42(74), 43(44), 44(16), 45(33), 52(2), 53(13), 54(3), 55(12), 59(10),
67(5), 68(30), 69(34), 70(6), 72(13), 81(3), 82(6), 83(8), 84(2), 85(4),
87(3), 88(30), 96(13), 97(33), 98(19), 99(2), 100(2), 112(4), 113(8), 114(2),
124(100), 125(22), 126(10), 128(9), 140(4), 155(11), 156(46) [M-OCH3], 157(3),
187(20) M
|
|
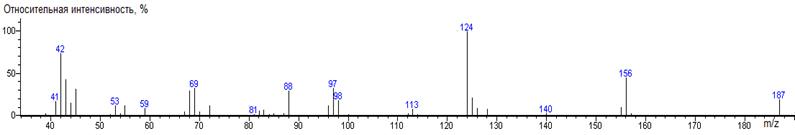
|
|
Циклоксанон,
898
|
153
- 98 = 55
|
|
1598
± 1
|
2-((диметиламино)метилен)циклогексанон 36(4),
38(4), 39(29), 40(6), 41(40), 42(100), 43(24), 44(47), 45(3), 50(3), 51(7),
52(5), 53(17), 54(6), 55(20), 56(5), 57(5), 58(13), 61(6), 65(5), 66(7),
67(14), 68(24), 69(13), 70(5), 71(6), 77(5), 79(15), 80(9), 81(26), 82(92),
83(9), 84(18), 93(2), 94(16), 95(7), 96(31), 97(19), 98(6), 107(2), 108(7),
109(8), 110(37), 111(5), 112(3), 122(2), 124(15), 125(2), 136(31) [M-OH], 137(3), 138(80) [M-CH3], 139(7),
152(8), 153(59) M, 154(6)
|
|
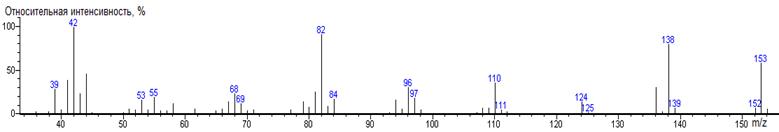
|
|
Циклогексан-1,3-дион,
1290
|
167
- 112 = 55
|
|
1795
± 0
|
2-((диметиламино)метилен)циклогексан-1,3-ион 35(19),
36(13), 38(21), 39(24), 42(100), 44(43), 45(7), 47(3), 49(4), 50(2), 52(4),
53(23), 54(11), 55(8), 62(3), 64(3), 67(2), 68(47), 69(60), 73(3), 80(14),
81(5), 82(7), 90(3), 94(5), 95(2), 96(11), 97(31), 98(41), 102(3), 103(4),
107(3), 111(3), 116(6), 124(60) [M-CH3CO], 130(8),
131(11), 132(5), 137(7), 138(4), 139(9), 143(2), 144(6), 150(3) [M-OH], 151(5), 152(24) [M-CH3], 166(2),
167(35) M
|
|
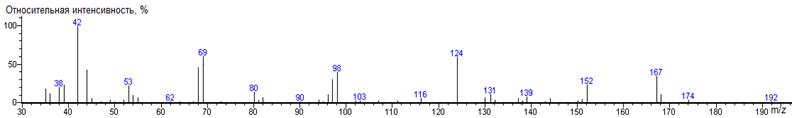
|
|
Дибутилгидразин,
1051 ± 7
|
199
- 144 = 55
|
|
1322
± 1
|
N',N'-дибутил-N,N-диметилформогидразонамид
36(2),
39(3), 41(20), 42(31), 43(15), 44(100), 45(3), 46(16), 55(5), 56(5), 57(16),
58(32), 59(2), 70(7), 71(10), 72(12), 73(31), 84(14), 85(3), 86(5), 98(3),
99(3), 100(13), 111(5), 113(4), 114(26) [M-C3H7-C3H7],
156(74) [M-C3H7], 157(7), 199(21) M, 200(3)
|
|
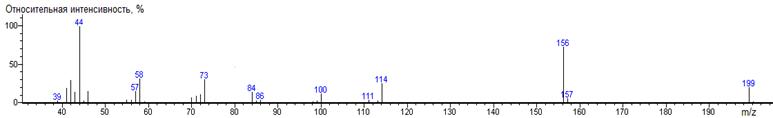
|
|
Монокротилгидразин,
830 ± 2
|
141
- 86 = 55
|
|
1083
± 2
|
N'-(бут-2-ен-1-ил)-N,N-диметилформогидразонамид
36(8),
38(3), 39(3), 41(4), 42(28), 43(13), 44(100) [N(CH3)2],
45(4), 46(25), 54(5), 55 (4), 56(3), 57(4), 69(2), 70(2), 71(4), 84(2),
86(34) [M-NCHN(CH3)2], 126(14) [M-CH3],
138(2), 139(2), 141(18) M
|
|
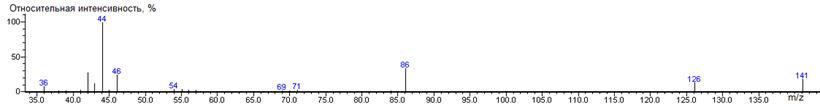
|
|
|
|
|
|
|
|
|
|
|