Результаты исследования проб хозяйственно-питьевого водоснабжения п. Новоорск за 2012-2014 годы
Введение
эпидемический вода питьевой
В конце 20-го века со всей остротой встала
проблема обеспечения всего населения планеты доброкачественной питьевой водой,
которую можно отнести к первостепенной и самой приоритетной для человечества.
Установлено, что 1100 млн. людей на Земле не обеспечено доброкачественной
водой. Эта проблема остается актуальной и в начале 21-го века.
Вода относится к основным факторам,
влияющим на здоровье людей. Отрицательное воздействие на организм человека
могут оказывать не только вещества-загрязнители, но и естественные компоненты
природных вод, если их концентрация значительно выше или ниже содержания
необходимого для нормальной жизнедеятельности человека.
Пресная вода на нашей планете составляет
только 2.5% мировых запасов, вся остальная масса - соленые воды морей и
океанов. А если вспомнить, что 75% пресной воды «законсервировано» в горных
ледниках и полярных шапках, еще 24% находится под землей в виде грунтовых вод,
а еще 0.5% рассредоточено в почве в виде влаги, то получается, что на наиболее
доступный и дешевый источники воды - реки, озера и прочие наземные водоемы
приходится чуть больше 0.01% мировых запасов воды. Как видите, фраза «самые
ценные ресурсы - водные» - не пустой звук.
Однако эти самые ценные ресурсы, увы, уже
не обладают высоким качеством. Как известно, количество воды на Земле
неизменно, меняются только ее. Так, у воды, выпавшей на сушу в виде дождя, есть
два пути: в первом варианте она, собираясь в ручьи и реки, попадает в озера и
водохранилища, так называемые поверхностные источники водозабора, во втором
вода, просачиваясь через почву и подпочвенные слои, пополняет запасы грунтовых
вод. Собственно, поверхностные и грунтовые воды и составляют два основных
источника водоснабжения.
Оба вида воды имеют свои проблемы.
Качество поверхностной воды из открытого источника зависит от количества и
частоты осадков, и, разумеется, от экологической ситуации в регионе. Выпадающие
осадки несут с собой определенное количество нерастворенных частиц (пыль,
вулканический пепел, пыльца растений, бактерии, грибковые споры и более крупные
микроорганизмы). Из океана в дождевые воды при испарении поступают ионы натрия,
магния, кальция и калия, а также хлорид- и сульфат- ионы). Промышленные выбросы
в атмосферу добавляют в «коктейль» органические растворители и оксиды азота и
серы (кстати, это и есть основная причина выпадения «кислотных дождей»). Вносят
свою лепту и химикаты, применяемые в сельском хозяйстве. В целом поверхностные
воды характеризуются относительной мягкостью, высоким содержанием органики и
наличием микроорганизмов.
Большая часть дождевой и талой воды
просачивается в почву, где растворяет содержащиеся в почвенном слое
органические вещества. Конечно, природа позаботилась о всего рода «фильтре» -
залегающие глубже песчаные, глинистые и известняковые слои отфильтровывают
органические вещества, но вода начинает насыщаться солями и микроэлементами. В
наиболее существенных количествах в грунтовых водах содержатся, как правило,
кальций, магний, железо и в меньшей степени марганец (катионы). Вместе с
распространенными в воде карбонатами, гидрокарбонатами, сульфатами и хлоридами
они образуют соли, концентрация которых в воде от глубины слоя: в наиболее
«старых» глубоких водах концентрация солей настолько велика, что вода
становится явственно солоноватой. К этому типу относятся большинство известных
минеральных вод. Наиболее качественную воду получают из известняковых слоев, но
глубина их залегания может быть достаточно большой и добраться до них -
удовольствие не из дешевых. Соответственно, грунтовые воды характеризуются
достаточно высокой минерализацией, жесткостью, низким содержанием органики и
практически полным отсутствием микроорганизмов [2].
Ситуация с питьевой водой в России
характеризуется как критическая - это прямая угроза здоровью населения. В связи
с этим Государственной думой разработан проект Федерального закона «О питьевой
воде», в котором впервые в нашей стране предпринята попытка правового
регулирования в сфере питьевого водоснабжения. С 1 января 2007 года действует
новый «Водный кодекс», который является законодательным актом по
водопользованию.
Природная питьевая вода является
безальтернативным условием существования людей на Земле, важнейшим фактором их
экологической безопасности и здоровой жизни. Но в настоящее время наблюдается
общая нехватка, постепенное уничтожение и растущее загрязнение источников
пресной воды. Это свидетельствует об отсутствии у населения соответствующей
информации и знаний о необходимости и способах защиты водоисточников.
Россия богата водными ресурсами (около 20%
мировых запасов пресных поверхностных и подземных вод), но все возрастающее их
загрязнение промышленными, сельскохозяйственными и бытовыми отходами вызывает
опасение за водно-экологическую обстановку многих регионов.
В Водном кодексе Российской Федерации
говорится, что «воды являются важнейшим компонентом окружающей и природной
среды, возобновляемым, ограниченным и уязвимым природным ресурсом, используются
и охраняются в Российской Федерации как основа жизни и деятельности народов,
проживающих на ее территории, обеспечивают экономическое, социальное,
экологическое благополучие населения, существование животного и растительного
мира».
На необходимость осуществления мер по
коррекции поступления биогенных элементов, в том числе йода и других микронутриентов,
указано в постановлении Правительства РФ от 5 сентября 1999 г. №1119 «О мерах
по профилактике заболеваний, связанных с дефицитом йода».
Несмотря на создавшееся положение, в
большинстве субъектов РФ не принимаются действенные меры как по проведению
своевременного ремонта и реконструкции разводящих сетей и водоочистных
сооружений, так и по использованию имеющихся возможностей восполнения дефицита
в организме биогенных элементов за счет рациональных поставок доброкачественной
бутилированной питьевой воды.
Связи с этим основной целью работы
является исследование проб хозяйственно-питьевого водоснабжения п. Новоорск в
период с 2012 по 2014 годы. Для выполнения подставленной цели необходимо решить
следующие задачи:
. По литературным данным рассмотреть
влияние воды на состояние здоровья человека;
. Оценить качество питьевой воды
исследуемой территории;
. Осуществить мониторинг качества
воды за период с 2012 по 2014 годы.
1.
Сведения о влиянии воды на здоровье человека
Прописная истина гласит - «человек состоит
из воды». Мозг взрослого человека состоит из воды на 74,5%, кровь - на 83%, в
мышцах воды 75,8%, в костях - 22%. Человеческий зародыш - сплошная вода: в
трехдневном эмбрионе ее 97%, в трехмесячном - 91%, а в восьмимесячном - 81%.
Потеря всего 3% воды организмом лишает человека возможности бегать, 5% - лишает
возможности переносить существенные физические нагрузки, а потеря организмом
10% воды представляет опасность для жизни [2].
Достаточное поступление воды в организм
является одним из основных условий здорового образа жизни. Вода активно
участвует в химических реакциях, проходящих в нашем теле, доставляет
питательные вещества в каждую клетку, выводит токсины, излишки солей.
Определенное и постоянное содержание воды
- одно из необходимых условий существования живого организма. Человек
чрезвычайно остро изучает изменение содержание воды в организме и может прожить
без нее всего несколько суток. При потере воды до 2% массы тела (1-1,5 л.)
появляется жажда, при утрате 6-8% наступает полуобморочное состояние, при
нехватке 10% появляются галлюцинации, нарушается глотание, при потере воды в
объеме 12% от массы тела человек погибает.
Недостаточное потребление воды нарушает
нормальную жизнедеятельность организма: появляется и снижается работоспособность,
нарушаются процессы пищеварения и усвоения пищи, замедляется течение
биохимических реакций, увеличивается вязкость крови, что создает, условия
образования тромбов. Без воды невозможна регуляция теплообмена организма с
окружающей средой и поддержание постоянной температуры тела. Поскольку мозг на
75% состоит из воды, относительное его обезвоживание вызывает у клеток мозга
сильнейший стресс. Обезвоживание негативно влияет на важнейшие функции
организма, ослабляя его и делая уязвимым для болезней.
В РФ так же имеют место значительные
затраты, связанные с компенсацией негативного влияния на здоровье людей
питьевой воды, не соответствующей гигиеническим требованиям по содержанию
основных биогенных элементов. Свыше 65% населения РФ проживает в условиях
дефицита йода, что в ряде случаев является причиной развития врожденных
аномалий, повышенной перинатальной смертности, снижения умственных способностей
у детей и взрослых, глухонемоты.
В РФ практически повсеместно имеется
недостаток фтора в питьевой воде, что обусловливает заболеваемость более 60%
детей кариесом зубов, а в Оренбургской области до 90-98%.
Избыток кальция и повышенная жесткость в
подземных источниках питьевой воды увеличивает риск развития мочекаменной
болезни, приводит к нарушению состояния водно-солевого обмена, раннему
обызвествлению костей, замедлению роста скелета у детей.
Установлена связь дефицита селена со
снижением устойчивости организма к развитию заболеваний, с ростом
сердечно-сосудистой патологии и онкологических заболеваний, снижением иммунной
реактивности организма и повышением детской смертности.
Около трети водопроводов РФ подают воду с
повышенным содержанием железа, что способствует развитию аллергических реакций,
болезней крови. В ряде населенных мест, использующих подземные водоисточники,
отмечаются повышенные уровни содержания натрия, хлоридов и сульфатов, что
увеличивает число заболеваний гипертонической болезнью и желудочно-кишечного
тракта.
Вместе с тем, по данным Института питания
РАМН, в настоящее время недостаток поступления биогенных элементов с пищевыми
продуктами составляет: по кальцию -30-40%, по йоду - 80%, по селену - 80-100%,
что определяет необходимость их восполнения с питьевой водой.
Влияние недоброкачественной воды на
здоровье населения может проявляться по-разному:
) в виде инфекционных заболеваний и
инвазий;
) неинфекционных заболеваний
химической этиологии, в том числе эндемических;
) неприятных психических ощущений,
вызванных плохими органолептическими свойствами воды, иногда достигающих такой
силы, что люди отказываются ее пить. Именно в предупреждении таких
отрицательных последствий для здоровья населения состоит гигиеническое, в том
числе эпидемическое и эндемическое значение воды.
2.
Характеристика отдельных показателей качества питьевой воды
2.1
Качество питьевой воды
Традиционно для оценки качества воды в
водном объекте или в источнике водоснабжения, если речь идет о получении воды
для питья, используются физико-органолептические, химико-органолептические и
санитарно-бактериологические показатели. К физико-органолептическим показателям
качества воды относят температуру, запахи и привкусы, цветность и мутность.
Химико-органолептические показатели характеризуют химический состав воды.
Обычно к их числу относят водородный показатель воды рН, жесткость и щелочность,
минерализацию (сухой остаток), а также содержание главных ионов. К
санитарно-бактериологическим показателям относят общую бактериальную
загрязненность воды и загрязненность ее кишечной палочкой, содержание в воде
токсичных и радиоактивных микрокомпонентов. В зависимости от загрязненности
водного объекта и назначения воды предъявляются и дополнительные требования к
ее качеству.
Остановимся подробнее на таких терминах,
как качество, показатели качества и нормы качества воды.
Качество - это характеристика состава и
свойств воды, определяющая ее пригодность для конкретных видов водопользования.
Показатели качества - это перечень свойств
воды, численные значения которых сравнивают с нормами качества воды.
Нормы качества - это установленные
значения показателей качества воды для конкретных видов водопользования.
Показатели качества и нормы качества воды
не являются жестко установленными и неизменными. С ухудшением состояния
окружающей среды в результате ее загрязнения, установлением
причинно-следственной связи между количественной и качественной
характеристиками загрязнения и негативными изменениями изменяются показатели и
нормы качества. Как правило, они становятся более жесткими. В то же время на
эти показатели и нормы непосредственное влияние оказывает экономическая
целесообразность. Можно научно обосновать высокие нормы качества питьевой воды,
но высокая стоимость производства воды такого качества не позволит обеспечить
массовый ее сбыт.
Дефицит пресной воды приводит к
необходимости использования для питьевых целей очищенных сточных вод, которые в
основном и пополняют запасы грунтовой воды. К 2000 г. из 24 крупнейших городов
мира 12 будут находиться в Азии, в районах с ограниченными водными ресурсами.
Вполне вероятным решением проблемы дефицита пресной воды будет использование
для питьевого водоснабжения очищенных и рециркуляционных сточных вод [14].
.2
Эпидемическое значение воды
Роль воды в механизме передачи
возбудителей кишечных инфекций, развития эпидемий и пандемий человечество
осознало задолго до открытия патогенных микроорганизмов. Тем не менее, сегодня
эта проблема остается весьма актуальной, несмотря на распространение
централизованного водоснабжения населенных пунктов и усовершенствование методов
обеззараживания. Поэтому при решении вопросов по обеспечению населения водой,
прежде всего необходимо предотвратить появление и распространение возбудителей
инфекционных болезней, способных передаваться через воду. Это достигается
постоянным обеспечением населения доброкачественной водой в достаточном количестве.
При нарушении тех или иных гигиенических требований и санитарных правил, как во
время организации водоснабжения населенного пункта, так и при дальнейшей
эксплуатации водопровода, может возникнуть чрезвычайно опасная, даже
катастрофическая ситуация.
Так, например, пониженное содержание фтора
в питьевой воде способствует разрушению зубной эмали и развитию
стоматологической патологии. Недостаток йода, что характерно для нашего
эндемичного в этом плане региона, вызывает заболевания щитовидной железы.
Бактериальное загрязнение природных вод
представляет собой опасность возникновения и распространения инфекционных
заболеваний, включая особо опасные инфекции.
Содержание в природных водах солей тяжелых
металлов, остатков нефтепродуктов и прочих вредных примесей может вызывать
онкологическую патологию и множество других опасных болезней. Население
наиболее подвержено заболеванием почечно-каменной болезни, предопределяемой
составом употребляемой воды [12].
.3
Хозяйственно-бытовое и народнохозяйственное значение воды
Гигиеническое значение воды не
исчерпывается лишь ее физиологической ролью и непосредственным влиянием на
здоровье населения. Большое ее количество расходуется на гигиенические,
хозяйственно-бытовые и производственные нужды. Так, использование воды в
достаточном количестве способствует формированию навыков личной гигиены. Воду
широко используют для оздоровительных целей, во время проведения спортивных
мероприятий, для гидротерапии в лечебно-профилактических учреждениях. Вода
играет важную роль в создании оптимальных бытовых условий в жилых домах,
общественных, в том числе лечебно-профилактических, учреждениях, на
промышленных предприятиях. Ее используют для влажной уборки помещений,
поддержания в чистоте предметов быта и ухода, стирки белья, приготовления пищи,
мытья посуды и др.
Воду используют для производственных нужд
на всех без исключения промышленных предприятиях. Иногда технологические
процессы предусматривают использование не просто водопроводной воды, а
специально подготовленной: деминерализованной, деионизированной, умягченной
воды. Строгие требования к качеству воды следует предъявлять в текстильной
промышленности в процессе производства и крашения тканей, на фармацевтических
предприятиях во время изготовления лекарственных средств, в пищевой
промышленности при приготовлении продуктов питания и напитков, в атомной
энергетике и т.п. В больших количествах ее используют в сельском хозяйстве (для
орошения в растениеводстве и садоводстве, в теплицах, птицеводческих и
животноводческих комплексах). Много водопроводной воды тратят на мытье улиц и
орошение зеленых насаждений в пределах населенных пунктов. Обязателен так
называемый пожарный запас воды.
Таким образом, трудно переоценить значение
воды для обеспечения жизнедеятельности человека, сохранения и укрепления
здоровья населения, обеспечения высокой степени санитарного благоустройства
населенных пунктов, создания санитарных условий для проживания и удовлетворения
народнохозяйственных нужд общества.
Питьевая вода, непосредственно
используемая населением, должна быть доброкачественной, то есть иметь хорошие
органолептические свойства, быть безвредной по химическому, в том числе и
радионуклидному, составу. Водой с хорошими органолептическими свойствами
считают такую, которая не имеет запаха, вкуса и привкуса, прозрачную, не
окрашенную, не содержащую заметных на глаз примесей (пленок, осадка, взвешенных
веществ и т.п.), прохладную.
Безвредной по химическому составу является
такая вода, употребление которой не приведет к возникновению неинфекционных
заболеваний химической этиологии (эндемических заболеваний, техногенных
хронических и острых отравлений и т.п.) у людей и их потомков. Это должно быть
гарантировано и для самых чувствительных групп населения (новорожденных, детей,
беременных, людей пожилого возраста и др.), и в условиях использования ее на
протяжении всей жизни, и с учетом вероятности комбинированного действия
химических веществ при одновременном наличии в воде. Исходя из этого,
концентрация в воде опасных для здоровья химических веществ не должна превышать
ПДК, установленных на основе глубоких санитарно-токсикологических исследований.
В то же время питьевая вода должна быть
физиологически полноценной, ее минеральный состав, содержание микроэлементов
(фтора, йода, селена и т.п.) должны быть адекватными биологическим потребностям
организма. Кроме того, вода должна быть безвредной в радиационном отношении,
т.е. содержать безопасное количество природных радионуклидов и иметь такую
суммарную объемную α- и β-радиоактивность, которая не превышает гигиенического норматива
[18].
.4
Органолептические свойства воды
Органолептические свойства воды - это те
ее признаки, которые воспринимаются органами чувств человека и оцениваются по
интенсивности восприятия.
Обонятельные, вкусовые, зрительные,
тепловые ощущения обусловлены физическими характеристиками воды и наличием в
ней определенных химических веществ (органических, минеральных солей, газов).
Именно они и придают воде запах, вкус, привкус, окраску, мутность и т.п.
Поэтому органолептические свойства воды характеризуются
показателями двух подгрупп: физико-органолептическими, представляющими собой
совокупность органолептических признаков, воспринимаемых органами чувств, и
химико-органолептическими, свидетельствующими о содержании определенных
химических веществ, способных раздражать соответствующие анализаторы и
обусловливать то или иное ощущение.
Часто отмечаются случаи, когда примеси в
питьевой воде не являются непосредственной причиной болезни, однако оказывают
опосредованное негативное воздействие на здоровье, ухудшая органолептические
свойства воды.
Осадок, непривычная окраска, запах и
привкус издавна являлись признаками недоброкачественности воды, вызывали у
человека отвращение и чувство возможной опасности для здоровья, заставляли
искать другие источники водоснабжения, которые могли оказаться опасными в
эпидемическом плане несмотря на хорошие органолептические свойства.
Хорошие органолептические свойства воды
положительно влияют на организм человека. Так, приятная на вкус вода повышает
остроту зрения и частоту сердечных сокращений, неприятная - снижает. Нельзя не
учитывать и эстетическое влияние органолептических свойств воды. Тут уместно
вспомнить слова Ф.Ф. Эрисмана: «Было бы непростительной ошибкой считать
удовлетворение такой эстетической потребности роскошью, поскольку тут эстетика
и гигиена сливаются настолько, что разделить их практически не представляется
возможным».
Физико-органолептические
свойства
Запах - показатель качества воды,
определяемый органолептическим методом с помощью обоняния на основании шкалы
силы запаха. На запах воды оказывают влияние состав растворенных веществ,
температура, значения рН и целый ряд прочих факторов. Интенсивность запаха воды
определяют экспертным путем при 20°С и 60°С и измеряют в баллах, согласно
требованиям.
По характеру запахи делят на две группы:
естественного происхождения (живущие и
отмершие в воде организмы, загнивающие растительные остатки и др.);
искусственного происхождения (примеси
промышленных и сельскохозяйственных сточных вод).
Запахи второй группы (искусственного
происхождения) называют по определяющим запах веществам: хлорный, бензиновый и
т.д. [4].
Однако для оценки и сравнения качества
воды недостаточно такой характеристики. Понятно, что один и тот же запах может
иметь различную интенсивность.
Учитывая изложенное выше, для
характеристики интенсивности запахов воды еще в 1914 г. в США предложили
пятибалльную шкалу: 0 - запах не ощущается, его не выявляет даже опытный
одоратор; 1 - не определяется потребителем, но обнаруживается опытным
одоратором; 2 - слабый, обнаруживается потребителем только в том случае, если
указать на него; 3 - заметный, обнаруживается потребителем и вызывает его
неодобрение; 4 - отчетливый, обращающий на себя внимание и делающий воду не
пригодной для питья; 5 - очень сильный, определяемый на расстоянии, вследствие
чего вода не пригодна для употребления (см. табл. 1).
Таблица 1
|
Интенсивность запаха
|
Характер появления запаха
|
Оценка интенсивности, балл
|
|
Нет
|
Запах не ощущается
|
0
|
|
Очень слабая
|
Запах не ощущается потребителем, но обнаруживаются
при лабораторном исследовании
|
1
|
|
Слабая
|
Запах замечается потребителем, если обратить на
это его внимание
|
2
|
|
Заметная
|
Запах легко замечается и вызывает
неодобрительный отзыв о воде
|
3
|
|
Отчетливая
|
Запах обращает на себя внимание и заставляет
воздержаться от питья
|
4
|
|
Очень сильная
|
Запах настолько сильный, что делают воду
непригодной к употреблению
|
5
|
С повышением температуры ухудшается
растворимость в воде газов. К тому же увеличивается летучесть растворимых в
воде органических веществ, что приводит к повышению давления их пара над
поверхностью воды. Из-за этого единица объема воздуха содержит больше молекул
вещества, и как следствие, в большей мере раздражаются рецепторы анализатора
обоняния, т.е. запах усиливается.
Кроме того, под влиянием высокой
температуры в воде могут происходить химические превращения и появляться новые
вещества с запахом. Поэтому запах воды оценивают как при комнатной температуре
(20°С), так и при ее нагревании до 60°С.
Экспериментально в опытах на животных
доказано, что изменение запаха воды рефлекторно воздействует на питьевой режим
и физиологические функции организма. Особенно это касается неприятных запахов,
которые обусловливают защитную условно-рефлекторную реакцию, заставляя
отказываться от употребления такой воды.
Качественной можно считать лишь такую
воду, которая, по мнению потребителей, не имеет запаха. Обычные люди не
чувствуют запаха интенсивностью 0 и 1 балл по пятибалльной шкале. Запах
интенсивностью 2 балла чувствуют лишь некоторые потребители (до 10% населения),
и лишь в том случае, если обратить на это их внимание. При повышении
интенсивности запах становится ощутимым для всех потребителей без какого-либо
предупреждения.
Поэтому интенсивность запаха питьевой
водопроводной воды не должна превышать 2 баллов. Кроме того, следует учитывать,
что воду подогревают для приготовления горячих напитков и первых блюд, а это
может привести к усилению ее запаха. Именно поэтому питьевая вода должна иметь
запах интенсивностью не выше 2 баллов при температуре как 20°С, так и 60°С, что
и отражено в государственном стандарте на питьевую водопроводную воду.
Вкус и привкус - способность содержащихся
в воде химических веществ после взаимодействия со слюной раздражать вкусовые
сосочки, расположенные на поверхности языка, и обусловливать соответствующие
ощущения.
Различают четыре основных вида вкуса:
соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений называются
привкусами (щелочной, металлический, вяжущий и т.п.). Интенсивность вкуса и
привкуса определяют при 20°С и оценивают по пятибалльной системе, согласно ГОСТ
3351-74 «Вода питьевая. Методы определения вкуса, запаха, цветности и
мутности».
Качественную характеристику оттенков
вкусовых ощущений - привкуса - выражают описательно: хлорный, рыбный,
горьковатый и так далее. Наиболее распространенный соленый вкус воды чаще всего
обусловлен растворенным в воде хлоридом натрия, горький - сульфатом магния,
кислый - избытком свободного диоксида углерода и т.д. [4].
Для характеристики интенсивности вкусов и
привкусов воды была предложена пятибалльная шкала, аналогичная пятибалльной
шкале интенсивности запахов.
Запах, вкус и привкус воды имеют
существенное значение. Во-первых, если они неприятны и легко определяются
потребителями, то это ограничивает потребление питьевой воды и заставляет
искать новые источники. Во-вторых, специфические запах, вкус и привкус
свидетельствуют о загрязнении воды вследствие попадания в водоем (источник
водоснабжения) сточных вод промышленных предприятий или поверхностного стока с
сельскохозяйственных угодий. В-третьих, естественный запах, вкус и привкус
свидетельствуют о том, что в воде есть определенные органические и
неорганические вещества, образовавшиеся в результате жизнедеятельности водных
организмов (водорослей, актиномицетов, грибов и т.п.) и биохимических процессов
превращения органических соединений (гуминовых веществ), которые попали в воду
из почвы. Эти вещества могут быть биологически активными, небезразличными для
здоровья, обладать аллергическими свойствами и т.п. И, наконец, запах, вкус и
привкус являются показателями эффективности очистки воды на водопроводных
станциях.
Качественной можно считать только такую
воду, которая, по оценке потребителей, не имеет вкуса и привкуса. Обычные люди
не ощущают вкус и привкус интенсивностью 0 и 1 балл. Вкус и привкус
интенсивностью 2 балла чувствуют только некоторые потребители (до 10%
населения), и лишь при условии предупреждения, то есть если обратить на это их
внимание. При повышении интенсивности вкус и привкус становятся ощутимыми для
всех потребителей без какого-либо предупреждения. Поэтому интенсивность вкуса и
привкуса питьевой водопроводной воды не должна превышать 2 баллов, что и
отражено в государственном стандарте на питьевую водопроводную воду.
Цветность - показатель качества воды,
обусловленный главным образом присутствием в воде гуминовых и фульфовых кислот,
а также соединений железа (Fe3+).
Количество этих веществ зависит от
геологических условий в водоносных горизонтах и от количества и размеров
торфяников в бассейне исследуемой реки. Так, наибольшую цветность имеют
поверхностные воды рек и озер, расположенных в зонах торфяных болот и
заболоченных лесов, наименьшую - в степях и степных зонах. Зимой содержание
органических веществ в природных водах минимальное, в то время как весной в период
половодья и паводков, а также летом в период массового развития водорослей -
цветения воды - оно повышается. Подземные воды, как правило, имеют меньшую
цветность, чем поверхностные. Таким образом, высокая цветность является
тревожным признаком, свидетельствующим о неблагополучии воды. При этом очень
важно выяснить причину цветности, так как методы удаления, например, железа и
органических соединений отличаются. Наличие же органики не только ухудшает
органолептические свойства воды, приводит к возникновению посторонних запахов,
но и вызывает резкое снижение концентрации растворенного в воде кислорода, что
может быть критично для ряда процессов водоочистки. Некоторые в принципе
безвредные органические соединения, вступая в химические реакции (например, с хлором),
способны образовывать очень вредные и опасные для здоровья [4].
Для измерения уровня цветности разработана
хромово-кобальтовая шкала, имитирующая цветность природной воды. Эта шкала
представляет собой растворы калия хромата, кобальта сульфата и серной кислоты в
воде. Чем выше концентрация этих веществ, тем интенсивнее желто-коричневое
окрашивание раствора и больше цветность. Для оценки цветности воды можно
использовать и платиново-кобальтовую шкалу (см. табл. 2). Цветность воды
измеряют в градусах путем сравнения ее интенсивности с окрашиванием растворов
хромово-кобальтовой или платиново-кобальтовой шкалы. Раньше это сравнение
осуществляли визуально, а в настоящее время используют спектрофотометры и
фотоколориметры.
Таблица 2
|
Цветность
|
Единица измерения, градус
|
|
Очень малая
|
до 25
|
|
Малая
|
более 25 до 50
|
|
Средняя
|
более 50 до 80
|
|
Высокая
|
более 80 до 120
|
|
Очень высокая
|
более 120
|
Практически бесцветной можно считать лишь
такую воду, цветность которой не воспринимается глазом и не превышает 20
градусов.
Кроме цветности, следует помнить и об
окраске воды. Она связана с загрязнением воды веществами органического и
неорганического происхождения, в частности красителями, которые могут попадать
в водоемы со сточными водами предприятий легкой промышленности, некоторыми
неорганическими соединениями железа, марганца, меди как природного, так и
техногенного происхождения.
Так, железо и марганец могут окрашивать
воду в цвета от красного до черного, медь - от бледно-голубого до
сине-зеленого, т.е. загрязненная стоками промышленных предприятий вода может
иметь неестественный цвет.
Окраску определяют визуально или
фотометрическим методом после удаления взвешенных веществ путем фильтрования.
Визуально изучают цвет, оттенок, интенсивность окраски воды. Для этого воду
наливают в цилиндр с плоским дном. На расстоянии 4 см от дна размещают лист
белой бумаги. Через столбик воды в цилиндре рассматривают лист и оценивают его
цвет. Воду из цилиндра сливают до тех пор, пока цвет не будет восприниматься
как белый, присущий всему листу бумаги. Измеряют высоту столбика, при котором
исчезает окрашивание. Окраска воды не должна определяться в столбике высотой 20
см. Иногда, если окраска очень интенсивная, возникает потребность в разведении
исследуемой воды дистиллированной водой. Интенсивность и характер окраски воды
можно установить, измерив спектрофотометром или фотоколориметром ее оптическую
плотность для световых волн различной длины.
Необычные цветность и окраска воды
ограничивают ее употребление и заставляют искать новые источники водоснабжения.
Однако вода новых источников может оказаться опасной в эпидемиологическом
отношении и содержать токсические вещества. Кроме того, повышение окраски и
цветности воды может свидетельствовать о ее загрязнении промышленными сточными
водами.
Вода с высокой цветностью может быть
биологически активной за счет гуминовых органических веществ. Известно, что в
результате действия гуминовых кислот на 50-100% повышается проницаемость стенок
кишечника для катионов Са, Mg, Fe, Mn, Zn, сульфат-ионов. И наконец, цветность является
показателем эффективности очистки (обесцвечивания) воды на очистных
сооружениях.
Мутность - природное свойство воды,
обусловленное наличием в ней взвешенных веществ органического и минерального
происхождения (глины, ила, органических коллоидов, планктона и т.п.).
Противоположная характеристика воды -
прозрачность, то есть ее способность пропускать световые лучи. Чем больше в
воде взвешенных веществ, тем выше ее мутность, то есть меньше прозрачность. Для
количественной оценки прозрачности воды был предложен метод Снеллена. Воду
наливают в цилиндр с плоским дном. На расстоянии 4 см от дна размещают
стандартный шрифт. Высота букв составляет 4 см, а толщина - 0,5 мм. Воду из
цилиндра сливают до тех пор, пока через ее столбик можно будет прочитать буквы.
Высота этого столбика (в сантиметрах) и характеризует прозрачность воды.
Прозрачная, по мнению потребителя, вода в случае измерения по методу Снеллена
имеет прозрачность не менее 30 см (см. табл. 3).
Таблица 3
|
ПрозрачностьЕдиница измерения, см
|
|
|
Прозрачная
|
Более 30
|
|
Маломутная
|
Более 25 до 30
|
|
Средней мутности
|
Более 20 до 25
|
|
Мутная
|
Более 10 до 20
|
|
Очень мутная
|
Менее 10
|
В России мутность определяют
фотометрическим путем сравнения проб исследуемой воды со стандартными
суспензиями. Результат измерений выражают в мг/дм3 при использовании основной
стандартной суспензии каолина или в ЕМ/дм3 (единицы мутности на дм3) при
использовании основной стандартной суспензии формазина. Последнюю единицу
измерения называют также Единица Мутности по Формазину (ЕМФ) или в западной
терминологии FTU (Formazine Turbidity Unit). 1FTU=1ЕМФ=1ЕМ/ дм3. В последнее
время в качестве основной во всем мире утвердилась фотометрическая методика
измерения мутности по формазину [4].
Мутность тесно связана с другими
свойствами воды, прежде всего с цветностью, запахом и привкусом. Так, гуминовые
вещества, определяющие цветность воды, делают ее мутной (за счет коллоидной
фракции), придают ей естественный запах и привкус. Красноватый цвет
свидетельствует о наличии в воде железа гидроксида (III). Такая вода мутная, со
специфическим вяжущим привкусом.
Мутность влияет на микробиологические
показатели качества воды. Данные литературы свидетельствуют о том, что
обеззараживание мутной воды хлором в течение 30 мин даже при остаточном,
свободном активном хлоре на уровне 0,3-0,5 мг/л неэффективно относительно
кишечных бактерий и вирусов (например, возбудителей гепатита А). В то же время
осветление и обесцвечивание воды на очистных сооружениях, направленные на
удаление взвешенных и гуминовых веществ, способствуют удалению 90% бактерий
[17].
Установлено, что хлорированная мутная вода
может быть опасной для здоровья вследствие образования хлорорганических
соединений - токсичных и даже канцерогенных. Мутность воды свидетельствует о ее
загрязнении органическими и неорганическими веществами, которые могут быть
вредными для здоровья человека или образовывать вредные вещества во время
обработки воды (например, хлорирования). Мутность является показателем
эффективности осветления воды на очистных сооружениях.
Химико-органолептические
свойства воды
Химические вещества, определяющие
органолептические свойства воды. Кроме органолептических показателей основной
группы (физико-органолептических), следует обратить внимание на группу
химико-органолептических показателей.
К показателям, характеризующим природный
химический состав воды, относятся: сухой остаток, водородный показатель (рН),
жесткость общая, содержание железа, сульфатов, хлоридов, марганца, меди, цинка.
Сухой остаток - это количество
растворенных веществ, преимущественно минеральных солей, в 1 л воды. Количество
органических веществ в сухом остатке составляет не более 10%, поэтому можно
считать, что этот показатель характеризует общую минерализацию воды.
Воду с сухим остатком до 1000 мг/л
называют пресной. Именно такая минерализация свойственна воде рек, большинства
пресных озер и водохранилищ. Воду называют солоноватой, если ее минерализация
составляет 1000-3000 мг/л, и соленой при минерализации свыше 3000 мг/л, что
характерно для воды морей и океанов [15].
Водородный показатель (рН) является
основой кислотно-основного состояния, которое достигается в воде благодаря
наличию различных растворимых соединений.
Величина рН определяется количественным
соотношением в воде ионов Н+ и ОН-, образующихся при
диссоциации воды. Если ионы ОН- в воде преобладают-то есть рН>7,
то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+
- рН<7 - кислую (см. табл. 4). В дистиллированной воде эти ионы будут
уравновешивать друг друга и рН будет приблизительно равен 7. При растворении в
воде различных химических веществ, как природных, так и антропогенных, этот
баланс нарушается, что приводит к изменению уровня рН [4].
Таблица 4
|
Тип водыВеличина рН
|
|
|
сильнокислые воды
|
< 3
|
|
кислые воды
|
3 - 5
|
|
слабокислые воды
|
5 - 6,5
|
|
нейтральные воды
|
6,5 - 7,5
|
|
слабощелочные воды
|
7,5 - 8,5
|
|
щелочные воды
|
8,5 - 9,5
|
|
сильнощелочные воды
|
> 9,5
|
В зависимости от величины pH может
изменяться скорость протекания химических реакций, степень коррозионной
агрессивности воды, токсичность загрязняющих веществ и многое другое.
Обычно уровень рН находится в пределах,
при которых он не влияет на потребительские качества воды. При высоких уровнях
(рН>11) вода приобретает характерную мылкость, неприятный запах, способна
вызывать раздражение глаз и кожи. Низкий pH<4 тоже может вызывать неприятные
ощущения. Влияет pH и на жизнь водных организмов. Для питьевой и
хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до
9 единиц [3].
Жесткость. Различают общую, карбонатную,
постоянную и устранимую жесткость.
Общая жесткость - это природное свойство
воды, обусловленное наличием так называемых солей жесткости, т.е. всех солей
кальция и магния в сырой воде (сульфатов, хлоридов, карбонатов, гидрокарбонатов
и др.).
Карбонатная жесткость - это жесткость,
обусловленная присутствием гидрокарбонатов и карбонатов Са2+ и Mg2+, растворенных в сырой
воде.
Устранимая, или гидрокарбонатная,
жесткость - это жесткость, которую удается устранить при кипячении воды. Она
обусловлена гидрокарбонатами Са2+ и Mg2+, которые во время
кипячения воды превращаются в нерастворимые карбонаты, и выпадают в осадок:
Са(НСО3)2 = СаСО3
+ Н2О + CО2↑
Mg(HCО3)2
= MgCО3 + Н2О
+ CО2↑
Под постоянной жесткостью понимают
жесткость кипяченой воды в течение 1 часа, которая обусловлена наличием
хлоридов и сульфатов Са2+ и Mg2+, не выпадающих в осадок.
Сегодня общую жесткость воды выражают в единицах ммоль/дм3.
Характеристика вод по значению общей
жесткости:
Таблица 5
|
Группа водЕдиница измерения, ммоль/дм3
|
|
|
Очень мягкая
|
до 1,5
|
|
Мягкая
|
1,5 - 4,0
|
|
Средней жесткости
|
4,0 - 8,0
|
|
Жесткая
|
8,0 - 12,0
|
|
Очень жесткая
|
более 12
|
Известно, что значительное содержание
солей жесткости, особенно магния сульфата, придает воде горький вкус.
Потребители ощущают этот вкус, если общая жесткость воды превышает 7 ммоль/дм3.
Чтобы вода не имела горького вкуса интенсивностью выше 2 баллов, ее общая
жесткость не должна превышать 7 ммоль/дм3. Иначе говоря,
доброкачественная вода должна быть мягкой (с общей жесткостью до 3,5 ммоль/дм3)
или умеренно жесткой (от 3,5 до 7 ммоль/дм3). То есть верхний предел
общей жесткости питьевой воды - 7 ммоль/дм3 - установлен на
основании ее влияния на органолептические свойства.
Со временем было доказано, что в
зависимости от жесткости вода по-разному влияет на здоровье людей. Резкий
переход при пользовании от мягкой воды к жесткой, а иногда и наоборот, может
вызвать у людей диспепсию. В районах с жарким климатом пользование водой с
высокой жесткостью приводит к ухудшению течения мочекаменной болезни. Вода с
высокой жесткостью способствует развитию дерматита.
К тому же надо учитывать, что с повышением
жесткости воды усложняется кулинарная обработка пищевых продуктов, а именно:
хуже развариваются мясо и бобовые, плохо заваривается чай, образуется накипь на
стенках посуды.
Однако и очень мягкая вода может
отрицательно влиять на организм вследствие уменьшения поступления прежде всего
кальция. Известно, что кальций выполняет в организме множество функций, в том
числе пластическую: он крайне необходим для остеогенеза и репарации костей (в
костях содержится 99% кальция), принимает участие в образовании дентина.
Кальций необходим для поддержания нервно-мышечного возбуждения, участвует в
процессах свертывания крови, влияет на проницаемость биологических мембран.
Суточная потребность взрослого человека в кальции колеблется от 800 до 1100 мг
(от 1000 мг/сут. в возрасте до 7 лет и почти 1400 мг - в возрасте 14-18 лет).
Во время беременности потребность в нем повышается до 1500 мг/сут., во время
грудного вскармливания - до 1800-2000 мг/сут.
Хлориды и сульфаты распространены в
природе в виде солей натрия, калия, кальция, магния и других металлов. Они
составляют большую часть сухого остатка пресных вод. Наличие хлоридов и
сульфатов в воде водоемов может быть обусловлено природными процессами
вымывания их из почвы, а также загрязнением водоема различными сточными водами.
Природное содержание хлоридов и сульфатов
в воде поверхностных водоемов незначительно и в большинстве случаев колеблется
в пределах нескольких десятков миллиграммов на литр.
Хлориды в воде - это лишние и вредные
примеси в воде. И если анализ воды показал, что их количество больше, чем
нужно, то - их нужно удалять из воды. Почти все природные воды, дождевая вода,
сточные воды содержат хлорид-ионы. Присутствие хлоридов объясняется
присутствием в породах наиболее распространенной на Земле соли - хлорида натрия
[1].
ПДК хлоридов в воде согласно СанПиН
2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного
водоснабжения. Санитарная охрана источников» составляет 350 мг/дм3.
Повышенные содержания хлоридов ухудшают вкусовые качества воды, делают
ее малопригодной для питьевого водоснабжения и ограничивают применение для
многих технических и хозяйственных целей, а также для орошения
сельскохозяйственных угодий [16].
Если в питьевой воде есть ионы натрия, то
концентрация хлоридов выше 250 мг/дм3 придает воде соленый вкус.
Концентрации хлоридов и их колебания, в том числе суточные, могут служить одним
из критериев загрязненности водоема хозяйственно-бытовыми стоками.
Сульфаты, как и хлориды, влияют на
органолептические свойства воды. Они придают ей горький вкус. Пороговые
концентрации по влиянию на вкус воды составляют для натрия, кальция и магния
сульфата соответственно 500, 900 и 600 мг/дм3. Горький вкус
становится ощутимым для большинства потребителей, если содержание сульфатов в
воде превышает 500 мг/л. Кроме того, сульфаты в количестве 1-2 г. оказывают
слабительное действие. Также влияет вода, если содержит 700 мг/дм3
магния сульфата.
Кроме того, сульфаты и хлориды в питьевой
водопроводной воде всегда содержатся одновременно. Поэтому они оказывают
комбинированное воздействие на вкусовые рецепторы, результатом которого
является усиление вкусовых ощущений. И если в отдельности хлориды в
концентрации 350 мг/дм3, а сульфаты - 500 мг/дм3 не
ухудшают органолептических свойств воды, то присутствуя одновременно они
придают ощутимый вкус интенсивностью свыше 2 баллов.
Нитраты. Нитраты - это соли азотной
кислоты, наличие которых как правило вызвано поступлением в воду хозяйственно-бытовых
и промышленных стоков, а также стоков воды с сельскохозяйственных угодий,
обрабатываемых азотосодержащими удобрениями, и с атмосферными осадками.
3.
Объекты и методы исследования
.1
Общие сведения
На территории Новоорского района функционируют
26 водопроводов, размещенные в 23 населенных пунктах. В 2-х населенных пунктах
(с. Можаровка, с. Тасбулак) в питьевых целях используется вода из артезианских
скважин и общественных колодцев.
В п. Энергетик для хозяйственно-питьевого
водоснабжения используется вода из открытого водоема. В других населенных
пунктах вода используется из артезианских скважин.
Общая численность населения в Новоорском
районе составляет 30261 человек, из них централизованным питьевым
водоснабжением пользуется 29694 человек (или 98,1%) от всего населения района).
В целях обеспечения населения района
достаточным количеством воды питьевого качества, начиная с 1997 года проведена
определенная работа, направленная на внедрение и выполнение требований СанПиН
2.1.4.1074-01 «Вода питьевая…».
При выполнении данной работы проведены
исследования проб воды по показателям:
Физико-органолептические показатели: запах
(ГОСТ 3351-74), вкус (ГОСТ 3351-74), цветность (ГОСТ 3351-74, ГОСТ Р
52769-2007), мутность (ГОСТ 3351-74).
Химико-органолептические показатели:
водородный показатель pH (ИСО 10523), сухой остаток (ГОСТ 18164-72),
жесткость (ГОСТ Р 52407-2005), хлориды (ГОСТ 4245-72), сульфаты (ГОСТ 4389-72),
нитраты (ГОСТ 18826-73).
3.2
Объекты исследования
В 2012 году нами были проведены исследования
проб со скважины №1, скважины №3, скважины №6 в п. Новоорск и с водонапорной
башни с. Большестепное, Новоорского района. Дата отбора проб 10 октября 2012
года.
В 2013 году проведены исследования проб со
скважин в микрорайоне Водстрой, ПУ-32, скважины в совхозе «Новоорский» и с
артезианской скважины с. Тасбулак Новоорского района. Дата отбора проб 7
сентября 2013 года. Данные были получены в лаборатории факультета экологии
ЧелГУ. Некоторые показатели, рассмотренные в данной работе, имеют обобщенный
характер. Также был рассмотрен показатель общей минерализации, который
показывает количество содержащихся в воде растворенных веществ (неорганические
соли, органические вещества). Замеры проводились лабораторным анализатором
жидкости серии «АНИОН 4100».
В 2014 году нами были исследованы пробы с
8 скважин п. Новоорск:
Водопровод Ц.У. ООО «Золотой колос» -
скважина №3 (0796);
Водопровод Ц.У. ООО «Золотой колос» -
скважина №11 (0798);
Водопровод ПУ-71 - скважина №2 (0800);
Водопровод п. Новоорск - скважина №6
(0802);
Водопровод п. Новоорск - скважина №7
(0804);
0806;
Водопровод у ПРБ - скважина (0808);
0810;
Отбор проб проводился в период летней
производственной практики, то есть с 30 июня по 27 июля 2014 года. Две пробы
(0806 и 0810) были закодированы и, следственно, точное расположение скважин не
указывается.
Данные были получены в
санитарно-гигиенической лаборатории филиала Федерального бюджетного учреждения
здравоохранения «Центр гигиены и эпидемиологии в Оренбургской области в
Новоорском, Адамовском, Кваркенском районах».
3.3
Методы исследования
Запах
(ГОСТ 3351-74)
Характер запаха воды определяют ощущением
воспринимаемого запаха (землистый, хлорный, нефтепродуктов и др.).
Определение запаха при 20°С.
В колбу с притертой пробкой вместимостью
250-350 см. отмеривают 100 см. испытуемой воды температурой 20°С. Колбу
закрывают пробкой, содержимое колбы несколько раз перемешивают вращательными
движениями, после чего колбу открывают и определяют характер и интенсивность
запаха.
Определение запаха при 60°С.
В колбу отмеривают 100 см. испытуемой
воды. Горлышко колбы закрывают часовым стеклом и подогревают на водяной бане до
50-60°С.
Содержимое колбы несколько раз
перемешивают вращательными движениями. Сдвигая стекло в сторону, быстро
определяют характер и интенсивность запаха.
Интенсивность запаха воды определяют при
20 и 60°С и оценивают по пятибалльной системе согласно требованиям табл. 6 [5].
Таблица 6
|
Обозначение запаха
|
Характер запаха
|
Примерный род запаха
|
|
А
|
Ароматический
|
Огуречный, цветочный
|
|
Б
|
Болотный
|
Илистый, тинистый
|
|
Г
|
Гнилостный
|
Фекальный, сточный
|
|
Д
|
Древесный
|
Запах мокрой щепы, древесной коры
|
|
З
|
Землистый
|
Прелый, запах свежевспаханной земли, глинистый
|
|
П
|
Плесневый
|
Затухлый, застойный
|
|
Р
|
Рыбный
|
Запах рыбьего жира, рыбный
|
|
С
|
Сероводородный
|
Запах тухлых яиц
|
|
Т
|
Травянистый
|
Запах скошенной травы, сена
|
|
Н
|
Неопределенный
|
Запахи естественного происхождения, не
попадающие под предыдущие определения
|
Вкус
(ГОСТ 3351-74)
Характер вкуса или привкуса определяют
ощущением воспринимаемого вкуса или привкуса (соленый, кислый, щелочной,
металлический и т.д.).
Испытуемую воду набирают в рот малыми
порциями, не проглатывая, задерживают 3-5 с.
Интенсивность вкуса и привкуса определяют
при 20°С и оценивают по пятибалльной системе согласно требованиям табл. 7 [5].
Таблица 7
|
Интенсивность вкуса и привкуса
|
Характер появления вкуса и привкуса
|
Оценка интенсивности, балл
|
|
Нет
|
Вкус и привкус не ощущаются
|
0
|
|
Очень слабая
|
Вкус и привкус не ощущаются потребителем, но
обнаруживаются при лабораторном исследовании
|
1
|
|
Слабая
|
Вкус и привкус замечаются потребителем, если
обратить на это его внимание
|
2
|
|
Заметная
|
Вкус и привкус легко замечаются и вызывают
неодобрительный отзыв о воде
|
3
|
|
Отчетливая
|
Вкус и привкус обращают на себя внимание и
заставляют воздержаться от питья
|
4
|
|
Очень сильная
|
Вкус и привкус настолько сильные, что делают
воду непригодной к употреблению
|
5
|
Цветность
(ГОСТ 3351-74, ГОСТ Р 52769-2007)
В цилиндр Несслера отмеривают 100 см.
профильтрованной через мембранный фильтр исследуемой воды и сравнивают со
шкалой цветности, производя просмотр сверху на белом фоне. Если исследуемая
проба воды имеет цветность выше 70°, пробу следует разбавить дистиллированной
водой в определенном соотношении до получения окраски исследуемой воды,
сравнимой с окраской шкалы цветности.
Полученный результат умножают на число,
соответствующее разбавлению.
При определении цветности с помощью
электрофотоколориметра используют кюветы толщиной поглощающего свет слоя 5-10
см. Контрольной жидкостью служит дистиллированная вода, из которой удалены
взвешенные вещества путем фильтрации через мембранные фильтры №4.
Оптическая плотность фильтрата исследуемой
пробы воды измеряют в синей части спектра со светофильтром при λ=413 нм.
Цветность определяют по градуировочному
графику и выражают в градусах цветности [5].
Мутность
(ГОСТ 3351-74)
В кювету с толщиной поглощающего свет слоя
100 мм вносят хорошо взболтанную испытуемую пробу и измеряют оптическую
плотность в зеленой части спектра (λ=530 нм). Если цветность
измеряемой воды ниже 10° по Сr-Со шкале, то контрольной жидкостью служит
бидистиллированная вода. Если цветность измеряемой пробы выше 10° Сr-Со шкалы,
то контрольной жидкостью служит испытуемая вода, из которой удалены взвешенные
вещества центрифугированием (центрифугируют 5 мин при 3000 мин-1)
или фильтрованием через мембранный фильтр с диаметром пор 0,5-0,8 мкм.
Содержание мутности в мг/дм3
или ЕМ/дм3 определяют по соответствующему градуировочному графику.
Окончательный результат определения выражают в мг/дм3 по каолину
[5].
Сухой
остаток (ГОСТ 18164-72)
При определении сухого остатка сначала
проводят выпаривание основной массы пробы, которая может составлять 250-500 мл.
Далее оставшуюся часть пробы высушивают во взвешенной, доведенной до постоянной
массы чашке (стакане, тигле) в сушильном шкафу в стандартных условиях в два
этапа. На первом этапе высушивание проводят при температуре 103-105°С в течение
1-2 часов. При этом удаляются влага и все летучие органические вещества, однако
сохраняется почти вся кристаллизационная вода солей - кристаллогидратов. На
втором этапе высушивание проводят при температуре 178-182°С также в течение 1-2
часов. В этих условиях разлагаются кристаллогидраты, более полно испаряются и
разлагаются органические вещества, разлагаются также некоторые соли - например,
гидрокарбонаты до карбонатов и далее до оксидов (частично или полностью).
Величину сухого остатка определяют по разности масс остатка пробы до и после
высушивания, причем иногда выполняют промежуточное взвешивание - после
высушивания при температуре 103-105°С. Взвешивание выполняют на аналитических
весах с погрешностью не более ±1 мг (лучше ±0,1 мг). Перед взвешиванием тигель
необходимо охладить до комнатной температуры.
Определение сухого остатка без добавления
соды (проводят в день отбора пробы).
250-500 см профильтрованной воды выпаривают в
предварительно высушенной до постоянной массы фарфоровой чашке. Выпаривание
ведут на водяной бане с дистиллированной водой. Затем чашку с сухим остатком
помещают в термостат при 110°С и сушат до постоянной массы.
профильтрованной воды выпаривают в
предварительно высушенной до постоянной массы фарфоровой чашке. Выпаривание
ведут на водяной бане с дистиллированной водой. Затем чашку с сухим остатком
помещают в термостат при 110°С и сушат до постоянной массы.
Сухой остаток (X), мг/дм3,
вычисляют по формуле:
X = (m-m1)*100/V,
где m - масса чашки с сухим
остатком, мг;
m1 - масса пустой чашки, мг;
V - объем воды, взятый для
определения, см.
Данный метод определения сухого остатка
дает несколько завышенные результаты вследствие гидролиза и гигроскопичности
хлоридов магния и кальция и трудной отдачи кристаллизационной воды сульфатами
кальция и магния. Эти недостатки устраняют прибавлением к выпариваемой воде
химически чистого карбоната натрия. При этом хлориды, сульфаты кальция и магния
переходят в безводные карбонаты, а из натриевых солей лишь сульфат натрия
обладает кристаллизационной водой, но ее полностью удаляют высушиванием сухого
остатка при 150-180°С.
Определение сухого остатка с добавлением
соды.
250-500 см профильтрованной воды выпаривают в
фарфоровой чашке, высушенной до постоянной массы при 150°С. После того как в
чашку прилита последняя порция воды, вносят пипеткой 25 см3 точного
1%-ного раствора углекислого натрия с таким расчетом, чтобы масса прибавленной
соды примерно в два раза превышала массу предполагаемого сухого остатка. Для
обычных пресных вод достаточно добавить 250 мг безводной соды (25 см3
1%-ного раствора Na2CO3).
Раствор хорошо перемешивают стеклянной палочкой. Палочку обмывают
дистиллированной водой, собирая воду в чашку с осадком. Выпаренный с содой
сухой остаток высушивают до постоянной массы при 150°С. Чашку с сухим остатком
помещают в холодный термостат и затем поднимают температуру до 150°С. Разность
в массе между чашкой с сухим остатком и первоначальной массой чашки и соды (1
см3 раствора соды содержит 10 мг Na2CO3) дает значение сухого остатка во взятом объеме воды.
профильтрованной воды выпаривают в
фарфоровой чашке, высушенной до постоянной массы при 150°С. После того как в
чашку прилита последняя порция воды, вносят пипеткой 25 см3 точного
1%-ного раствора углекислого натрия с таким расчетом, чтобы масса прибавленной
соды примерно в два раза превышала массу предполагаемого сухого остатка. Для
обычных пресных вод достаточно добавить 250 мг безводной соды (25 см3
1%-ного раствора Na2CO3).
Раствор хорошо перемешивают стеклянной палочкой. Палочку обмывают
дистиллированной водой, собирая воду в чашку с осадком. Выпаренный с содой
сухой остаток высушивают до постоянной массы при 150°С. Чашку с сухим остатком
помещают в холодный термостат и затем поднимают температуру до 150°С. Разность
в массе между чашкой с сухим остатком и первоначальной массой чашки и соды (1
см3 раствора соды содержит 10 мг Na2CO3) дает значение сухого остатка во взятом объеме воды.
Сухой остаток (X), мг/дм3,
вычисляют по формуле:
X = m - (m1+m2)*100/V,
где m - масса чашки с сухим
остатком, мг;
m1 - масса пустой чашки, мг;
m2 - масса добавленной соды,
мг;
V - объем воды, взятый для
определения, см.
Расхождения между результатами повторных
определений не должны превышать 10 мг/дм3, если сухой остаток не
превышает 500 мг/дм3; при более высоких концентрациях расхождение не
должно превышать 2 отн.% [6].
Жесткость
(ГОСТ Р 52407-2005)
Выполняют два определения, для чего пробу
анализируемой воды делят на две части.
В колбу вместимостью 250 см3
помещают первую часть аликвоты пробы анализируемой воды объемом 100 см3,
5 см3 буферного раствора от 5 до 7 капель раствора индикатора или от
0,05 до 0,1 г сухой смеси индикатора и титруют раствором трилона Б.
Вторую часть аликвоты пробы объемом 100 см3
помещают в колбу вместимостью 250 см3, добавляют 5 см3
буферного раствора, от 5 до 7 капель раствора индикатора или от 0,05 до 0,1 г
сухой смеси индикатора, добавляют раствор трилона Б, которого берут на 0,5 см3
меньше, чем пошло на первое титрование, быстро и тщательно перемешивают и
титруют (дотитровывают).
Обработка результатов определения.
Жесткость воды Ж,°Ж, вычисляют по формуле:
Ж=M*F*K*Vтр/Vпр,
где M - коэффициент пересчета,
равный 2 Cтр, где Cтр - концентрация раствора трилона Б, моль/м3 (ммоль/дм3),
(как правило M=50);
F - множитель разбавления
исходной пробы воды при консервировании (как правило, F=1);
K - коэффициент поправки к
концентрации раствора трилона Б, вычисленный по формуле K=10/V;
Vтр - объем раствора трилона
Б, израсходованный на титрование, см3;
Vпр - объем пробы воды,
взятой для анализа, см3.
За результат измерения принимают
среднеарифметическое значение результатов двух определений. Приемлемость
результатов определений оценивают исходя из условия
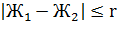 ,
,
где r - предел повторяемости;
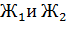 - результаты
определений°Ж.
- результаты
определений°Ж.
Если расхождение между двумя результатами
превышает установленное значение, то определение жесткости воды повторяют [7].
Хлориды
(ГОСТ 4245-72)
Качественное определение
В колориметрическую пробирку наливают 5 см3
воды и добавляют три капли 10%-ного раствора азотнокислого серебра. Примерное
содержание хлор-иона определяют по осадку или мути в соответствии с
требованиями табл. 8.
Таблица 8
|
Характеристика осадка или мути
|
Содержание, мг/дм3
|
|
1. Опалесценция или слабая муть
|
1-10
|
|
2. Сильная муть
|
10-50
|
|
3. Образуются хлопья, осаждаются не сразу
|
50-100
|
|
4. Белый объемный осадок
|
Более 100
|
Количественное определение
В зависимости от результатов качественного
определения отбирают 100 см3 испытуемой воды или меньший ее объем
(10-50 см3) и доводят до 100 см3 дистиллированной водой.
Без разбавления определяются хлориды в концентрации до 100 мг/дм3.
pН титруемой пробы должен быть в пределах 6-10. Если вода мутная, ее фильтруют
через беззольный фильтр, промытый горячей водой. Если вода имеет цветность выше
30°, пробу обесцвечивают добавлением гидроокиси алюминия. Для этого к 200 см3
пробы добавляют 6 см3 суспензии гидроокиси алюминия, а смесь
встряхивают до обесцвечивания жидкости. Затем пробу фильтруют через беззольный
фильтр. Первые порции фильтрата отбрасывают. Отмеренный объем воды вносят в две
конические колбы и прибавляют по 1 см3 раствора хромовокислого
калия. Одну пробу титруют раствором азотнокислого серебра до появления слабого
оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При
значительном содержании хлоридов образуется осадок AgCl, мешающий определению. В
этом случае к оттитрованной первой пробе приливают 2-3 капли титрованного
раствора NaCl до исчезновения оранжевого оттенка, затем титруют вторую пробу,
пользуясь первой как контрольной пробой.
Определению мешают: ортофосфаты в
концентрации, превышающей 25 мг/дм3; железо в концентрации более 10
мг/дм3. Бромиды и йодиды определяются в концентрациях, эквивалентных
Cl- При обычном содержании в
водопроводной воде они не мешают определению.
Содержание хлор-иона (Х), мг/дм3,
вычисляют по формуле
Х = ν*K*g*1000/V, где
ν
- количество
азотнокислого серебра, израсходованное на титрование, см3;
K - поправочный
коэффициент к титру раствора нитрата серебра;
g - количество хлор-иона,
соответствующее 1 см3 раствора азотнокислого серебра, мг;
V - объем пробы, взятый
для определения, см3.
Расхождения между результатами повторных
определений при содержании Cl - от 20 до 200 мг/дм3 - 2 мг/дм3;
при более высоком содержании - 2 отн.% [8].
Сульфаты
(ГОСТ 4389-72)
Качественная проба
В колориметрическую пробирку диаметром
14-15 мм наливают 10 см3 исследуемой воды, добавляют 0,5 см3
соляной кислоты (1:5). Одновременно готовят стандартную шкалу. Для этого в
такие же пробирки наливают 2, 4, 8 см3 рабочего раствора
сернокислого калия и 1,6; 3,2; 6,4 см3 основного раствора K2SO4 и доводят
дистиллированной водой до 10 см3, получая таким образом стандартную
шкалу с содержанием: 10, 20, 40, 80, 160, 320 мг/дм3 сульфат-иона.
Прибавляют в каждую пробирку по 0,5 см3 соляной кислоты (1:5), затем
в исследуемую воду и образцовые растворы по 2 см3 5%-ного раствора
хлористого бария, закрывают пробками, перемешивают и сравнивают со стандартной
шкалой.
Количественное определение
В зависимости от предполагаемого
содержания сульфат-иона (качественная проба) отмеривают 100-500 см3
воды с таким расчетом, чтобы концентрация SO42 - не превышала 25-30 мг в
100 см3 пробы. В случае необходимости воду разбавляют. К отмеренному
объему профильтрованной исследуемой воды в стакан добавляют 2-3 капли раствора
метилового оранжевого и соляную кислоту (1:1) до розовой окраски раствора.
Смесь нагревают до кипения и выпаривают до 50 см3. Дают отстояться
раствору, при наличии мути или хлопьев фильтруют через беззольный фильтр «синяя
лента». Фильтр промывают дистиллированной водой, подкисленной соляной кислотой,
фильтрат вместе с промывными водами выпаривают в стакане до 50 см3.
В кипящий раствор при помешивании приливают 10 см3 горячего раствора
хлористого бария. Раствор с осадком нагревают на горячей водяной бане. Когда
раствор осветлится, проверяют полноту осаждения, прибавляя к прозрачному
раствору 1-2 капли хлористого бария. Отсутствие мути указывает на полноту
осаждения. Стакан накрывают часовым стеклом и нагревают 1-2 ч на горячей
водяной или песчаной бане и оставляют до следующего дня при комнатной
температуре. На следующий день раствор фильтруют через плотный беззольный
фильтр «синяя лента», который рекомендуется предварительно промыть горячей
дистиллированной водой.
Осадок BaSO4 несколько раз
декантируют дистиллированной водой, отфильтровывая воду через беззольный фильтр
«синяя лента», затем осадок количественно переносят на тот же фильтр стеклянной
палочкой с резиновым наконечником. Осадок на фильтре промывают горячей
дистиллированной водой до отрицательной реакции на хлор-ион. К пробе фильтрата
в пробирке прибавляют несколько капель раствора азотнокислого серебра.
Фильтр с осадком помещают в предварительно
прокаленный и взвешенный тигель, просушивают, обугливают на электроплитке, не
допуская воспламенения, а затем прокаливают в муфеле при температуре, не
превышающей 800°С, и доступе воздуха до получения осадка белого цвета.
Охлаждают в эксикаторе, взвешивают и вновь прокаливают до постоянной массы.
Подсчет результатов
Содержание сульфатов (X), мг/дм3,
вычисляют по формуле
X = (а-б)*0,4115*1000/V, где
а - масса тигля с осадком, мг;
,4115 - коэффициент для пересчета ВаSO4
на SO42-;
V - объем воды, взятый для
определения, см3 [9].
Нитраты
(ГОСТ 18826-73)
Колорометрический метод с салициловокислым
нитрием.
Определению мешают: цветность воды,
влияние которой устраняют так же, как и в методе с фенолдисульфокислотой;
хлориды в концентрации, превышающей 200 мг/дм3, которые удаляют
добавлением раствора сернокислого серебра к 100 см3 исследуемой воды
в количестве, эквивалентном содержанию хлор-иона. Осадок хлорида серебра
отфильтровывают или отделяют центрифугированием; нитриты в концентрации 1-2 мг/
дм3 и железо в концентрации более 0,5 мг/дм3. Влияние
железа может быть устранено добавлением 8-10 капель раствора калия-натрия
виннокислого перед выпариванием воды в фарфоровой чашке.
см3 исследуемой воды помещают в
фарфоровую чашку. Прибавляют 1 см3 раствора салициловокислого натрия
и выпаривают на водяной бане досуха. После охлаждения сухой остаток увлажняют 1
см3 концентрированной серной кислоты, тщательно растирают его
стеклянной палочкой и оставляют на 10 мин. Затем добавляют 5-10 см3
дистиллированной воды и количественно переносят в мерную колбу вместимостью 50
см3. Прибавляют 7 см3 10 н. раствора едкого натра,
доводят объем дистиллированной водой до метки и перемешивают. В течение 10 мин
после прибавления едкого натра окраска не изменяется. Сравнение интенсивности окраски
исследуемой пробы проводят фотометрическим методом, измеряя оптическую
плотность раствора с фиолетовым светофильтром в кюветах с толщиной рабочего
слоя 1-5 см. Из найденных значений оптической плотности вычитают оптическую
плотность нулевой пробы и по калибровочному графику находят содержание
нитратов.
Построение калибровочного графика
Для приготовления стандартных растворов в
колориметрические пробирки с отметкой на 10 см3 отбирают 0,0; 0,5;
1,0; 2,0; 3,0; 4,0; 6,0 и 10 см3 рабочего стандартного раствора
азотнокислого калия (1 см3 - 0,01 мг N) и доводят дистиллированной
водой до отметки. Содержание нитратного азота в растворах соответственно будет
равно 0,5; 1,0; 2,0; 3,0; 4,0; 6,0; 10,0 мг/ дм3. Затем растворы
переносят в фарфоровые чашки, прибавляют по 1 см3 раствора
салициловокислого натрия и выпаривают на водяной бане досуха. Сухой остаток
обрабатывают так же, как описано при анализе пробы исследуемой воды. Оптическую
плотность окрашенных растворов измеряют с помощью электрофотоколориметра, используя
фиолетовый светофильтр и кюветы с толщиной рабочего слоя 1-5 см. Из полученных
величин вычитают оптическую плотность нулевой пробы и результаты наносят на
график.
Содержание нитратов (X), мг/ дм3,
вычисляют по формуле в пересчете на нитратный азот:
X = C, где
C - содержание нитратов, найденное по графику, мг/ дм3 [10].
4.
Результаты исследования проб хозяйственно-питьевого водоснабжения п. Новоорск
за 2012-2014 годы
4.1
Исследования в 2012 году
По результатам проведенных лабораторных исследований проб
питьевой воды в пунктах п. Новоорск и с. Большестепное (табл. 9), отмечалось
превышение показателя общей жесткости и сухого остатка. В 50% проб уровень
общей жесткости составил 9,4 и 17,0 ммоль/дм3, при норме 7,0
ммоль/дм3. Так же в 50% проб уровень сухого остатка составил 1220 и
3059,0 мг/дм3, при норме 1000 мг/дм3.
В 25% проб наблюдается превышение
показателя pH. Значение характеристики по НД в пределах от 6 до 8, а в пробах
показатель равнялся 9.
Сульфаты, хлориды, нитраты и
органолептические показатели, не превышают требований к качеству воды.
Таблица 9
|
Наименование показателей
|
НД на методы исследования
|
Единицы измерения
|
Значение характеристики по НД
|
Пункты отбора
|
Значение характеристики при испытании
|
|
Запах при 20оС и при нагревании до
60оС
|
ГОСТ 3351-74
|
Баллы
|
2
|
№1
|
1
|
|
|
|
|
№3
|
1
|
|
|
|
|
№6
|
1
|
|
|
|
|
Башня
|
1
|
|
Вкус
|
ГОСТ 3351-74
|
Баллы
|
2
|
№1
|
1
|
|
|
|
|
№3
|
1
|
|
|
|
|
№6
|
1
|
|
|
|
|
Башня
|
3
|
|
Цветность
|
ГОСТ 3351-74, ГОСТ Р 52769-2007
|
Градусы
|
20 (25)
|
№1
|
3,1+ 1,3
|
|
|
|
|
№3
|
1,65+0,69
|
|
|
|
|
№6
|
3,1+1,3
|
|
|
|
|
Башня
|
3,1
|
|
Мутность
|
ГОСТ 3351-74
|
ЕМФ
|
1,5 (2)
|
№1
|
0,1+0,0168
|
|
|
|
|
№3
|
0,1+0,0168
|
|
|
|
|
№6
|
0,1+0,0168
|
|
|
|
|
Башня
|
0,1
|
|
pH
|
ИСО 10523
|
Единицы
|
6-8
|
№1
|
7,55+0,168
|
|
|
|
|
№3
|
7,62+0,168
|
|
|
|
|
№6
|
7,56+0,168
|
|
|
|
|
Башня
|
8,90
|
|
Сухой остаток
|
ГОСТ 18164-72
|
мг/дм3
|
1000 (1500)
|
№1
|
1125,0+94,5
|
|
|
|
|
№3
|
320,5+25,4
|
|
|
|
|
№6
|
475,0+39,9
|
|
|
|
|
Башня
|
3059,0
|
|
Жесткость
|
ГОСТ Р 52407-2005
|
ммоль/дм3
|
7,0
|
№1
|
8,4+1,06
|
|
|
|
|
№3
|
4,07+0,59
|
|
|
|
|
№6
|
5,6+0,7
|
|
|
|
|
Башня
|
17,0
|
|
Сульфаты
|
ГОСТ 4389-72
|
мг/дм3
|
<200
|
№1
|
48,4+3,4
|
|
|
|
|
№3
|
53,1+2,85
|
|
|
|
|
№6
|
49,3+0,25
|
|
|
|
|
Башня
|
550,0
|
|
Хлориды
|
ГОСТ 4245-72
|
мг/дм3
|
10
|
№1
|
6,1+1,8
|
|
|
|
|
№3
|
4,8+0,3
|
|
|
|
|
№6
|
4,1+0,1
|
|
|
|
|
Башня
|
>100
|
|
Нитраты
|
ГОСТ 18826-73
|
мг/дм3
|
45
|
№1
|
43,2+1,5
|
|
|
|
|
№3
|
39,1+0,8
|
|
|
|
|
№6
|
38,7+0,75
|
|
|
|
|
Башня
|
44,0
|
4.2
Исследования в 2013 году
Проведенные исследования проб со скважин в
микрорайоне Водстрой, ПУ-32, скважины в совхозе «Новоорский» и с артезианской
скважины с. Тасбулак Новоорского района представлены в таблице 9.
По характеру и степени минерализации,
исследованные пробы питьевой воды являются слабоминерализованными до 1-2 г./л
(табл. 10).
Таблица 10
|
Наименование показателей
|
НД на методы исследования
|
Единицы измерения
|
Значение характеристики по НД
|
Пункты отбора
|
Значение характеристики при испытании
|
|
Запах при 20оС и при нагревании до
60оС
|
ГОСТ 3351-74
|
Баллы
|
2
|
Водстрой
|
0
|
|
|
|
|
ПУ-32
|
1
|
|
|
|
|
совхоз
|
0
|
|
|
|
|
Тасбулак
|
0
|
|
Вкус
|
ГОСТ 3351-74
|
Баллы
|
2
|
Водстрой
|
0
|
|
|
|
|
ПУ-32
|
1
|
|
|
|
|
совхоз
|
1
|
|
|
|
|
Тасбулак
|
1
|
|
Цветность
|
ГОСТ 3351-74, ГОСТ Р 52769-2007
|
Градусы
|
20 (25)
|
Водстрой
|
2
|
|
|
|
|
ПУ-32
|
5
|
|
|
|
|
совхоз
|
4
|
|
|
|
|
Тасбулак
|
3
|
|
Мутность
|
ГОСТ 3351-74
|
ЕМФ
|
1,5 (2)
|
Водстрой
|
0
|
|
|
|
|
ПУ-32
|
1
|
|
|
|
|
совхоз
|
0
|
|
|
|
|
Тасбулак
|
1
|
|
pH
|
ИСО 10523
|
Единицы
|
6-9
|
Водстрой
|
7,27
|
|
|
|
|
ПУ-32
|
6,82
|
|
|
|
|
совхоз
|
6,93
|
|
|
|
|
Тасбулак
|
8,08
|
|
Сухой остаток
|
ГОСТ 18164-72
|
мг/дм3
|
1000 (1500)
|
Водстрой
|
200
|
|
|
|
|
ПУ-32
|
800
|
|
|
|
|
совхоз
|
1200
|
|
|
|
|
Тасбулак
|
600
|
|
Жесткость
|
ГОСТ Р 52407-2005
|
ммоль/дм3
|
7,0
|
Водстрой
|
6,6
|
|
|
|
|
ПУ-32
|
10,3
|
|
|
|
|
совхоз
|
13,3
|
|
|
|
|
Тасбулак
|
6,6
|
|
Сульфаты
|
ГОСТ 4389-72
|
мг/дм3
|
<200
|
Водстрой
|
10-100
|
|
|
|
|
ПУ-32
|
5-10
|
|
|
|
|
совхоз
|
100
|
|
|
|
|
Тасбулак
|
10-100
|
|
Хлориды
|
ГОСТ 4245-72)
|
мг/дм3
|
10
|
Водстрой
|
1-10
|
|
|
|
|
ПУ-32
|
1-10
|
|
|
|
|
Совхоз
|
1-10
|
|
|
|
|
Тасбулак
|
1-10
|
|
Нитраты
|
ГОСТ 18826-73
|
мг/дм3
|
45
|
Водстрой
|
40
|
|
|
|
|
ПУ-32
|
42,3
|
|
|
|
|
Совхоз
|
44
|
|
|
|
|
Тасбулак
|
43
|
4.3
Исследования в 2014 году
Качество воды в 8 скважинах п. Новоорск по
показателям цветности и содержания нитратов не соответствовали требованиям
СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды
централизованных систем питьевого водоснабжения. Контроль качества».
Высокий показатель цветности воды, может
носить биологический характер, из-за высокого содержания в ней гуминовых
веществ.
Таблица 11
|
Наименование показателей
|
НД на методы исследования
|
Единицы измерения
|
Значение характеристики по НД
|
Пункты отбора (код пробы)
|
Значение характеристики при испытании
|
|
Запах при 20оС и при нагревании до
60оС
|
ГОСТ 3351-74
|
Баллы
|
2
|
№3
|
1
|
|
|
|
|
№11
|
1
|
|
|
|
|
№2
|
1
|
|
|
|
|
№6
|
1
|
|
|
|
|
№7
|
1
|
|
|
|
|
0806
|
1
|
|
|
|
|
Водопровод у ПРБ
|
1
|
|
|
|
|
0810
|
1
|
|
Вкус
|
ГОСТ 3351-74
|
Баллы
|
2
|
№3
|
1
|
|
|
|
|
№11
|
1
|
|
|
|
|
№2
|
1
|
|
|
|
|
№6
|
1
|
|
|
|
|
№7
|
1
|
|
|
|
|
0806
|
1
|
|
|
|
|
Водопровод у ПРБ
|
1
|
|
|
|
|
0810
|
1
|
|
Цветность
|
ГОСТ 3351-74, ГОСТ Р 52769-2007
|
Градусы
|
20 (25)
|
№3
|
5
|
|
|
|
|
№11
|
5
|
|
|
|
|
№2
|
2,26
|
|
|
|
|
№6
|
27
|
|
|
|
|
№7
|
10,1
|
|
|
|
|
0806
|
23,6
|
|
|
|
|
Водопровод у ПРБ
|
5
|
|
|
|
|
0810
|
6,74
|
|
Мутность
|
ГОСТ 3351-74
|
ЕМФ
|
1,5 (2)
|
№3
|
0,5
|
|
|
|
|
№11
|
0,5
|
|
|
|
|
№2
|
0,5
|
|
|
|
|
№6
|
0,66
|
0,5
|
|
|
|
|
0806
|
0,88
|
|
|
|
|
Водопровод у ПРБ
|
0,5
|
|
|
|
|
0810
|
0,5
|
|
pH
|
ИСО 10523
|
Единицы
|
6-8
|
№3
|
7,48
|
|
|
|
|
№11
|
7,43
|
|
|
|
|
№2
|
7,49
|
|
|
|
|
№6
|
7,53
|
|
|
|
|
№7
|
7,46
|
|
|
|
|
0806
|
7,49
|
|
|
|
|
Водопровод у ПРБ
|
7,62
|
|
|
|
|
0810
|
7,67
|
|
Сухой остаток 685,5
|
ГОСТ 18164-72
|
мг/дм3
|
1000 (1500)
|
№3
|
670,4
|
|
|
|
|
№11
|
692,7
|
|
|
|
|
№2
|
672,5
|
|
|
|
|
№6
|
694,2
|
|
|
|
|
№7
|
685,4
|
|
|
|
|
0806
|
683,2
|
|
|
|
|
Водопровод у ПРБ
|
696,4
|
|
|
|
|
0810
|
689,7
|
|
Жесткость 9,3
|
ГОСТ Р 52407-2005
|
ммоль/дм3
|
7,0
|
№3
|
7,3
|
|
|
|
|
№11
|
8,46
|
|
|
|
|
№2
|
10,1
|
|
|
|
|
№6
|
10,75
|
|
|
|
|
№7
|
9,6
|
|
|
|
|
0806
|
8,7
|
|
|
|
|
Водопровод у ПРБ
|
9,8
|
|
|
|
|
0810
|
10,1
|
|
Сульфаты 53
|
ГОСТ 4389-72
|
мг/дм3
|
<200
|
№3
|
48,1
|
|
|
|
|
№11
|
56,4
|
|
|
|
|
№2
|
52,1
|
|
|
|
|
№6
|
49,56
|
|
|
|
|
№7
|
51,3
|
|
|
|
|
0806
|
58,1
|
|
|
|
|
Водопровод у ПРБ
|
54,75
|
|
|
|
|
0810
|
53,6
|
|
Хлориды 5,1
|
ГОСТ 4245-72
|
мг/дм3
|
10
|
№3
|
6,4
|
|
|
|
|
№11
|
4,8
|
|
|
|
|
№2
|
4,65
|
|
|
|
|
№6
|
5,1
|
|
|
|
|
№7
|
5,0
|
|
|
|
|
0806
|
4,85
|
|
|
|
|
Водопровод у ПРБ
|
4,9
|
|
|
|
|
0810
|
5,2
|
|
Нитраты
|
ГОСТ 18826-73
|
мг/дм3
|
45
|
№3
|
108,4
|
|
|
|
|
№11
|
108,4
|
|
|
|
|
№2
|
35
|
|
|
|
|
№6
|
11,3
|
|
|
|
|
№7
|
11,7
|
|
|
|
|
0806
|
10,8
|
|
|
|
|
Водопровод у ПРБ
|
31,6
|
|
|
|
|
0810
|
67,7
|
По результатам исследования проб в период
с 2012 по 2014 годы составлена таблица с показателями качества хозяйственно
питьевого водоснабжения (см. табл. 12).
При составлении данной таблицы не
учитывались данные так называемых контрастных проб. Контрастные пробы:
водонапорная башня с. Большестепное в 2012 году и артезианская скважина с.
Тасбулак.
Что мы видим в данной таблице:
Установленная в ходе исследования величина
общей жесткости составила 10,07 ммоль/дм3, что характеризует ее как
жесткая. Следует отметить, что п. Новоорск находится в водоносном горизонте
галечников и песков в пойме Урала. Вдоль восточной границы района проходит
Акжарско-Джусинский гребень, заполненный отложениями известняков и мраморов
карбона.
Особую опасность представляют нитраты.
Нитраты - соли азотной кислоты, которые появляются в воде по причине
использования азотосодержащих удобрений в сельскохозяйственной деятельности или
же, как последствие биологической очистки. Таким образом, нитраты в чистом
виде, с полей, попадают в грунтовые воды, откуда потом в колодцы или неглубокие
скважины (табл. 11). При эксплуатации вышеуказанных источников воды,
периодически необходимо производить ее анализ на наличие подобных загрязнений,
а также предупреждать их попадание в организм человека посредством установки
фильтрующих средств.
Таблица 12
|
Наименование показателей
|
НД на методы исследования
|
Единицы измерения
|
Значение характеристики по НД
|
Значение характеристики при испытании
|
|
|
|
|
2012
|
2013
|
2014
|
|
Запах при 20оС и при нагревании до
60оС
|
ГОСТ 3351-74
|
Баллы
|
2
|
1
|
0,3
|
1
|
|
Вкус
|
ГОСТ 3351-74
|
Баллы
|
2
|
1
|
1
|
1
|
|
Цветность
|
ГОСТ 3351-74, ГОСТ Р 52769-2007
|
Градусы
|
20 (25)
|
2,62
|
3,0
|
10,59
|
|
Мутность
|
ГОСТ 3351-74
|
ЕМФ
|
1,5 (2)
|
0,1
|
0,5
|
0,57
|
|
pH
|
ИСО 10523
|
Единицы
|
6-8
|
7,58
|
7
|
7,52
|
|
Сухой остаток
|
ГОСТ 18164-72
|
мг/дм3
|
1000 (1500)
|
640,2
|
733,4
|
685,5
|
|
Жесткость
|
ГОСТ Р 52407-2005
|
ммоль/дм3
|
7,0
|
6,03
|
10,07
|
9,3
|
|
Сульфаты
|
ГОСТ 4389-72
|
мг/дм3
|
<200
|
50,3
|
54,2
|
53
|
|
Хлориды
|
ГОСТ 4245-72
|
мг/дм3
|
10
|
5,0
|
5,5
|
5,1
|
|
Нитраты
|
ГОСТ 18826-73
|
мг/дм3
|
45
|
40,3
|
42,0
|
48,11
|
Выводы
. В период исследования, содержание сухого остатка в
некоторых пробах составило от 1220 мг/дм3, что превышало норму 1,2 раза и
относилось к солоноватым. Но в дальнейшем данный показатель пошел на убыль;
. Регламентируемые значения рН составляют 6-8. Нами
выявлено, что превышение этого показателя не наблюдается;
3. В ходе исследования выявлено, что
качество воды по органолептическим показателям соответствует требованиям;
4. По характеру и степени минерализации, исследованные
пробы питьевой воды являются слабоминерализованными до 1-2 г./л;
. В ходе исследований выявлено превышение нитратов,
которые появляются в воде по причине использования азотосодержащих удобрений в
сельскохозяйственной деятельности или же, как последствие биологической
очистки;
. Установленная в ходе исследования величина общей
жесткости составила 10,07 ммоль/дм3, что характеризует ее как
жесткая. Следует отметить, что п. Новоорск находится в водоносном горизонте
галечников и песков в пойме Урала. Вдоль восточной границы района проходит
Акжарско-Джусинский гребень, заполненный отложениями известняков и мраморов
карбона, чем и обусловлен данный показатель.
Список
литературы
1. А.А. Чибилёв. природное наследие
Оренбургской области. - // Учебное пособие. - // Оренбург: Оренбургское книжное
издательство, 1996. - 384 с. ISBN 5-88788-015-5
2. Альянс Нева - новейшие технологии
водоочистки [Электронный ресурс] - 2008 // Человек и вода. Влияние примесей на
организм человека: Официальный сайт. - URL: http://
http://alliance-neva.ru/interesnye_fakty_o_vode/chelovek_i_voda_vlijanie_primesejj_na_organizm_cheloveka
(дата обращения 25.04.2015).
3. Анализ воды - Консультационно
образовательный портал [Электронный ресурс] - 2013 // Хлориды в воде:
Официальный сайт. - URL: http://a-water.info/vred/xloridy-v-vode/ (дата
обращения 16.09.2013).
4. Водэко - Общие сведения о воде
[Электронный ресурс] - 2015 // Основные показатели качества воды: Официальный
сайт. - URL: http:// http://vodeco.ru/water-info/osnovnie-pokazateli.html (дата
обращения 26.094.2015).
5. ГОСТ 3351-74. «Вода питьевая. Методы
определения вкуса, запаха, цветности и мутности».
6. ГОСТ 18164-72. «Вода питьевая. Метод
определения содержания сухого остатка».
7. ГОСТ Р 52407-2005. «Вода питьевая. Методы
определения жесткости».
8. ГОСТ 4245-72. «Вода питьевая. Методы
определения содержания хлоридов».
9. ГОСТ 4389-72. «Вода питьевая. Методы
определения содержания сульфатов».
10. ГОСТ 18826-73. «Вода питьевая. Методы определения
содержания нитратов».
11. ГОСТ Р 51232-98. «Вода питьевая. Общие требования
к организации и методам контроля качества».
12. Государственный контроль качества воды. - // 2-е
изд., перераб. и доп. - // М.: ИПК Издательство стандартов, 2003. - 776 с.
13. Главный контрольно-испытательный центр питьевой
воды [Электронный ресурс] - 2013 // Водородный показатель (pH): Официальный
сайт. - URL: http://www.gicpv.ru/him31-5.htm (дата обращения 16.09.2013).
14. Ликбез - Небесполезные знания [Электронный
ресурс] - 2005 // Показатели качества питьевой воды: Официальный сайт. - URL:
http:// http://ecoflash.narod.ru/likbez_6.htm (дата обращения 26.04.2015).
15. Постановление Правительства Российской федерации
от 24 июня 2000 г. №554 «Об утверждении положения о государственной санитарно -
эпидемиологической службе Российской Федерации и Положения о государственном
санитарно-эпидемиологическом нормировании».
16. Природа Оренбургской области [Электронный ресурс]
- 2012 // Подземные воды Оренбургской области: Официальный сайт. - URL:
http://oren-icn.ru/index.php/enzoren/klimatwater/1630-2012-04-09-07-47-36 (дата
обращения 12.04.2014).
17. Российский химико-аналитический портал
[Электронный ресурс] - 2009 // Сухой остаток: Официальный сайт. - URL:
http://www.anchem.ru/literature/books/muraviev/034.asp (дата обращения
16.09.2013).
18. СанПиН 2.1.4.1110-02 «Зоны санитарной охраны
источников водоснабжения и водопроводов питьевого назначения».
19. СанПин 2.1.4.1074-01 «Питьевая вода.
Гигиенические требования к качеству воды централизованных систем питьевого
водоснабжения. Контроль качества».
20. СП 1.1.1058-01 «Организация и проведение
производственного контроля за соблюдением санитарных правил и выполнением
санитарно-противоэпидемических (профилактических) мероприятий».