Микрофлора нефтешламов и нефтезагрязненных грунтов различного происхождения
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное
образовательное учреждение
высшего профессионального образования
"КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ"
(ФГБОУ ВПО "КубГУ")
Кафедра генетики, микробиологии и
биотехнологии
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА
БАКАЛАВРА
Микрофлора нефтешламов и
нефтезагрязненных грунтов различного происхождения
Работу выполнила И.А. Ярыш
Факультет биологический
Направление 06.03.01 Биология
Научный руководитель, канд. биол. наук, проф. Э.В. Карасёва
Нормоконтролёр, канд. биол. наук, доц. Г.Г. Вяткина
Краснодар 2015
Реферат
Курсовая работа выполнена на _____ страницах
машинописного текста. В работу включено девять таблиц, один рисунок и шесть
приложений. Библиографический список содержит 32 источника.
Ключевые слова: ИДЕНТИФИКАЦИЯ, МИКРОБОЦЕНОЗ, НЕФТЕШЛАМ,
ГРУНТ, БУРОВОЙ ШЛАМ, ВРЕМЯ-ПРОЛЁТНАЯ МАСС-СПЕКТРОМЕТРИЯ, ХРОМАТОГРАФИЯ.
Целью работы было изучение микробиологических сообществ в
нефтезагрязнённых субстратах различных по происхождению, а также изучение
морфологических и культуральных признаков выделенных штаммов и их идентификация
по белковомым профилям время-пролётной масс-спектрометрии (МАЛДИ).
Объектом исследования послужили образцы грунта, нефтешлама
различного срока хранения, доставленные с полигона ООО "АPБ" Абинского района,
ст. Хомская, а также буровые шламы Кошильского и Тюменского месторождения
Сибири.
Был применён комплексный подход: изучались
морфолого-культуральные признаки и осуществлена идентификация выделенных 88
культур при помощи МАЛДИ. Проводился сравнительный анализ результатов
идентификации по белковым профилям с морфолого-культуральными признаками.
В результате чего выделенные штаммы были определены до вида
или рода.
Содержание
Обозначения и сокращения
Введение
1. Аналитический обзор
1.1 Микрофлора почвогрунтов
1.2 Таксономическое разнообразие микрофлоры нефтешламов различного
срока хранения и происхождения
2. Материал и методы
2.1 Объект исследования
2.2 Питательные среды, используемые для культивирования
микроорганизмов
2.3 Подготовка материала к исследованию
2.4 Количественный учет микроорганизмов
2.5 Идентификация выделенных культур
2.5.1 Морфологические и культуральные признаки
2.5.2 МАЛДИ как метод идентификации микроорганизмов
2.5.3 Микроскопирование с использованием фазово-контрастного
микроскопа
2.5.4 Тест на определение миколовых кислот
2.5.5 Учёт нефтеокисляющей активности
3. Микрофлора нефтешламов и нефтезагрязгрязнённых грунтов
различного происхождения
3.1 Таксономическое разнообразие микроорганизмов
3.2 Анализ микрофлоры исследуемых образцов и учёт нефтеокисляющей
активности выделенных культур
Заключение
Библиографический список
Приложения
Обозначения
и сокращения
КОЕ - колониеобразующие единицы
ПА - питательный агар
R2 - низкоуглеродистая питательная среда
КМЦ - карбоксиметилцеллюлоза
МАЛДИ - время-пролётная масс-спектрометрия
HCCA - α-циано-4-гидроксикоричная
кислота
Введение
Почва является одним из ключевых биосферных факторов,
определяющих само существование живых организмов и всей жизнедеятельности на
планете. Утрата почвой лишь нескольких функций непременно отразится на
устойчивости биосферы в худшую сторону, особенно негативно это скажется на
геохимических связях между звеньями природной среды [Яковлев, Прохоров,
Решетина, 2001].
Бурное развитие нефтяной и нефтехимической промышленности
сопровождается привнесением в природную среду вредных углеродных загрязнителей;
среди них наибольшую опасность представляют сырая нефть, нефтешламы, грунты с
нефтью и другими токсическими веществами.
Естественное самоочищение природных экосистем происходит
обычно с недостаточно высокой скоростью, особенно при массированных
загрязнениях и в регионах с пониженной температурой. В условиях почти полной
репрессии
функциональной активности почвенной флоры и фауны
определяющая роль в деградации нефтепродуктов в почве принадлежит
микроорганизмам [Создание и применения…, 2000].
Например, такие микроорганизмы как Bacillus cereus, Staphilococcus хylosus, Pseudomonas araginosa растут с достаточно
высокой скоростью в присутствии нефти и нефтепродуктов и используют нефть как
единственный источник углерода и энергии. Это создает возможность
перспективного использования этих микроорганизмов в процессе биоремедиации
[Сопрунов, Клюякова, 2007].
Так показано, что консорциум микроорганизмов, состоящих из
культур Rhodococcus sp., Pseudomonas sp, Аrthrobacter sp. при внесении в
нефтезагрязнённую почву интенсивно активируют жизнедеятельность аборегенной
нефтеокисляющей микрофлоры и процессы окисления нефтепродуктов в почвых различных
климатических зон [Хомякова, Ботвинко, Нетрусов, 2003, Использование бактерии…,
2003].
Поэтому изучение микрофлоры нефтезагрязнённых почв, а также
отдельных сообществ микроорганизмов (например, нефтеокисляющих бактерий)
позволяет использовать их свойства в процессе биоремедиации.
Традиционные методы анализа микробных сообществ не позволяют
выделить и учитывать все разнообразие форм микроорганизмов в шламе, грунте.
поэтому требуется использование новых и нестандартных методологических подходов
к изучению биоразнообразию методами МАЛДИ.
Целью настоящей работы является: изучение микробных сообществ
нефтезагрязнённых субстратов.
Для достижения поставленной цели были сформулированы
следующие задачи:
. Выделение чистых культур микроорганизмов из нефтешламов
и грунтов различного происхождения.
2. Изучение культуральных и морфологических признаков
выделенных штаммов.
. Идентификация выделенных культур по белковым
профилям методом МАЛДИ масс-спектрометрии.
. Использование секвенирование гена 16 рРНК для идентификации
культур.
. Определение нефтеокисляющей активности выделенных
культур.
1.
Аналитический обзор
1.1
Микрофлора почвогрунтов
Грунт - собирательное название горных пород, залегающих
преимущественно в пределах зоны выветривания. Из-за малой дисперсности, а также
отсутствия органической и биологической составляющих, грунты обладают
значительно меньшими сорбционными и буферными свойствами, практически не
обладают плодородием [Современный энциклопедический словарь "Химия",
1998].
Микроорганизмы широко представлены в грунтах разного
генезиса. Численность микробов в подпочвенных слоях в пересчете на 1 г
субстрата находится в пределах 105 - 107 клеток, и это
меньше, чем в почвенном слое, примерно на 1-3 порядка [Humic substances…, 1998, Оборин, 2005].
Также характерно снижение численности микробов в подпочвенных толщах с глубиной
[Sinclair, Ghiorse, 1989]. Живые организмы
могут находиться в грунте на поверхности твердой минеральной части, в поровом
растворе, в порах, трещинах, кавернах и пустотах. Например, в скальных грунтах
с пористостью в десятые и сотые доли процента биомасса организмов не может быть
значительной, а рыхлые, пористые грунты, способны иметь значительную биомассу
живой составляющей [Teske, 2005]. В дисперсных грунтах же подавляющее количество
микроорганизмов адсорбировано на поверхности твёрдой фазы. Адсорбция микробных
клеток на поверхности твердых частиц экологически целесообразна, так как
большинство источников питания находится в природе в нерастворимом состоянии и
прямой контакт клеток с твердым питательным субстратом облегчает использование
последнего [Звягинцев, 1973, Attached and unattached microbial…, 2001].
Уже выявлено, бактерии, которые способны разрушать нефть,
можно встретить не только в почвах, загрязнённых нефтью, в нефтешламах, но и
они также могут быть выделены из любой полевой, лесной, луговой почвы [Бактерии
- деструкторы…, 2001].
.2
Таксономическое разнообразие микрофлоры нефтешламов различного срока хранения и
происхождения
В настоящее время на предприятиях добычи, переработки и
транспортировки нефти скопилось большое количество нефтешламов, образующихся в
результате зачистки резервуаров нефти или продуктов ее переработки. В составе
нефтешлама от 10 до 50 % составляют нефтепродукты; от 5 до 60 % - вода; от 2 до
40 % - механические примеси [Перспективные методы очистки…, 2005].
Нефтешламы - отходы хранения и переработки нефти. Состав и
свойства конкретного нефтешлама определяется сортом нефти и особенностями
формирования. В целом, в состав нефтешлама входят тяжелые фракции нефти и
мелкодисперсный минеральный грунт. В случае длительного хранения в амбарах -
накопителях говорят о выветренных нефтешламах. Следует отметить, что и
токсичность, и биологическая доступность (способность быть утилизированными)
нефтепродуктов определяются, в первую очередь, одним и тем же фактором -
растворимостью. Таким образом, наиболее токсичные фракции нефти первыми
подвергаются обезвреживанию в ходе биоремедиации, конечно, если их концентрация
не подавляет нефтеокисляющие микроорганизмы [Якушева, Никоноров, Кияненко,
2002].
В составе шламов, кроме нефти и ее производных, находятся от
40 % до 70 % различных загрязняющих веществ. Так, отличительной особенностью
нефтехимических шламов является наличие в их составе помимо нефтяных
углеводородов бензолов, толуолов, фенолов, ксилолов, стирола, ацетофенона,
ацетонитрила, метилфенилкарбинола, метилэтилкетона, опасность которых связана с
токсическим, иммунотоксическим и канцерогенным потенциалом. Также нефтешламы
обладают радиоактивностью, превышающей нормативные требования, что связано с
наличием в них таких радиоактивных элементов, как радий и барий [Особенности
распределения…, 2006].
Нефтешлам, отобранный из верхних слоёв амбаров, содержит
достаточно большое количество углеводородов "дизельной фракции", находящихся
в пределах 50 - 80 % масс. Концентрация парафинов в нижних слоях выше, чем в
верхних [Особенности химического состава…, 2002].
С поверхности нефтешлама выделяют штаммы бактерий
преимущественно родов: Pstudomonas, Васillus, Rhodococcus [Волченко, Карасёва,
2006].
В состав нефтешлама входят ксенобиотики, относящиеся к
различным классам химических соединений, о суммарном метаболическом потенциале
исследуемой микрофлоры судят по степени допустимости нефтешлама как
единственного источника органического и минерального питания. Проявляется
тенденция к снижению численности с глубиной залегания соответствующих
горизонтов: общего количества микробных клеток - 1011-108 КОЕ/г,
аэробных гетеротрофов - 1011-107 КОЕ/г, спорообразующих
бактерий - 109-106 КОЕ/г, актиномицетов-104-103КОЕ/г
[Никитина, Зарипова, Частухина, 2000].
При исследовании нефтяных пластов были найдены
бактерии-деструкторы нефти, чаще относящиеся к аэробным термофильным
углеводородокисляющим бактериям и факультативно анаэробным, способным потреблять
индивидуальные углеводороды и нефть, а также продукты окисления нефти - низшие
спирты и летучие кислоты. Такими бактериями являются Bacillus licheniformis, Bacillus subtilis, Bacillus megaterium [Выбор активного
микроорганизма - деструктора…, 1995].
Такие рода как: Rhodococcus, Pseudomonas являются основными
компонентами углеводородокисляющих бактериоценозов как почвенных, так и водных
экосистем [Родококки как природный сорбент…, 1986].
Представители рода Pseudomonas плохо переносит условия
конкуренции, но быстро заселяют новые ниши благодаря высокой скорости роста.
Они чувствительны к низкой температуре и солнечному ультрафиолету. Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas putida, Pseudomonas boreopolis способны усваивать лёгкие
парафины и нафталин, а также представителей этого рода выделяют в процессе
утилизации мазута [Видовая структура…, 1994].
Из микробного сообщества, существующего в экстремальных
условиях нефтешлама (рН 1,15), выделены и изучены 13 штаммов бактерий,
идентифицированные как Corynebacterium spр., Diezia. maris и Bacillus sp.,
способные к деструкции углеводородов в широком диапазоне рН. [Плешакова, 2010].
Бактерии, принадлежащие к роду Bacillus, являются активными
деструкторами сырой нефти. К ним относят Bacillus subtilis и Bacillus megaterium, характеризующийся широким
спектром утилизации углеводородов, в том числе моно - и полициклических
соединений, которые плохо деструктируются микроорганизмами [Биодеградация
углеводородов…, 1994, Выделение и характеристика, 1997].
А.А. Худорормов и соавторы [Влияние источника углерода…,
2012] выявили, что обезвреживание нефтешламов затруднено из-за практически
полного отсутствия в них углеводородокисляющих микроорганизмов или крайней
скудостью ее, объясняющегося токсичным действием высокой концентрации
нефтепродуктов, присутствием тяжелых фракций углеводородов, отсутствием
структурированности, нарушением аэрации и водного баланса, а также содержанием
дополнительных поллютантов. Так, содержание в нефтешламах тяжёлых металлов
могут замедлять или полностью подавлять рост микроорганизмов. Ими было
выявлено, что наибольшую нефтеокисляющую активность в присутствии металлов
сохраняют штаммы, относящиеся к роду Rhodococcus, Gordonia, Arthobacter, а наименьшую активность
проявляет штамм Micrococcus.
Так были опровергнуты данные о выделении преимущественно
спорообразующих форм из нефтешламов длительного срока хранения. Напротив были
обнаружены микроорганизмы различных таксономических групп, в том числе ранее не
отмечаемых, таких как: р. Chromobacterium, р. Agromyces, Сitrobacter [Беседина, 2007].
Также установлено, что для видового состава микрофлоры
очищаемых нефтешламов характерна смена грамположительных спорообразующих форм
неспорообразующими - актиномицетами [Неведрова, 2002].
Буровые шламы представляют собой продукт, состоящий из
твердых и жидких компонентов. Образующийся на забое выбуренный шлам
взаимодействует с буровым раствором. В результате этого частицы горных пород
адсорбируют на поверхности различные компоненты бурового раствора и в таком
виде остаются длительное время на буровой площадке, в частности, в шламовых
амбарах [Ягафарова, Барахнина, 2006].
В микробных сообществах буровых шламов доминируют
углеводородокисляющие микроорганизмы. Выявлены микроорганизмы, способные к
разложению различных ксенобиотиков. Например, Bacillus firmus, Solibacillus silvestris, Bacillus circulans характеризовались
отчетливы ростом на среде с бензолом [Беляков, Плешакова, 2013].
Э.В. Карасёва и соавторы [Нефтеокисляющий штамм…, 2012]
обнаружили, что снижается фитотоксичность загрязненной нефтью почвы при
обработке культурой Rhodococcus erythropolis B2. Способность родококков
выделять фитостимуляторы при деструкции углеводородов даёт возможность
использовать данной штамм как фитостимулирующую культуру при рекультивации
нефтезагрязненных почв, а также в фиторемедиационном этапе очистки различных
нефтесодержащих отходов.
микрофлора нефтешлам нефтезагрязненный грунт
2. Материал и
методы
Работа проведена на кафедре генетики, микробиологии и
биотехнологии Кубанского государственного университета г. Краснодара, 2014
году.
2.1 Объект
исследования
Объектом исследования послужили образцы грунта, нефтешлама
различного срока хранения, доставленные с полигона ООО "АPБ" Абинского района,
ст. Хомская, а также буровые шламы Кошильского и Тюменского месторождения
Сибири.
|
Свежий шлам
|
Шлам
длительного срока хранения
|
Шлам в процессе
биоремедиации
|
Нефтезагрязнённый
грунт
|
Незагрязнённый
грунт
|
|
Срок
загрязнения (год)
|
Меньше 1
|
80лет
|
1
|
1
|
|
2.2
Питательные среды, используемые для культивирования микроорганизмов
Для выделения микроорганизмов из образцов использовалась
стандартная среда: питательный агар производства ЗАО
"Научно-исследовательский центр фармакотерапии". А также
использовались следующие среды:
Низкоуглеродистая среда R2, состав (г/л):
дрожжевой экстракт - 0,5;
пептон ферментативный - 1; декстроза - 0,5; крахмал
растворимый - 0,5; пируват натрия - 0,3; K2HPO4 - 0,3; MgSO4 ×7Н2О - 0,05; агар-агар - 18; казеиновые кислоты - 0,5; H2O (водопр.) - 1000.
2.3
Подготовка материала к исследованию
Предпосевная подготовка материала заключалась в том, что
навеску образца грунта, нефтешлама весом 5 г помещались во флакон с 50 мл
стерильного физиологического раствора. Затем флаконы взбалтывали на качалке при
130 об/мин. 15 мин.
.4
Количественный учет микроорганизмов
Для количественного учёта микроорганизмов в грунте,
нефтешламе использовался метод предельных разведений методом Коха с последующим
высевом на соответствующие питательные среды: питательный агар (ПА),
малоуглеродистую среду R2. Для посева на ПА, среду R2 делались разведения -
10-2, 10-3, 10-4, 10-5.
Инкубировали микроорганизмы в термостате при температуре 30 ℃ в течение 4 дней.
Учёт результатов производили на 7-е. сутки. На плотных средах
концентрацию клеток определяли исходя из числа выросших колоний [Практикум по
микробиологии, 1976].
.5
Идентификация выделенных культур
2.5.1
Морфологические и культуральные признаки
Морфологические и культуральные признаки выделенных культур
определяли, выращивая культуры на ПА и на, низкоуглеродистой среде R2. К морфологическим
признакам относят: определение формы клеток, у палочковидных отмечают форму
концов клеток, размера, подвижности клеток, способности к спорообразованию,
расположение спор в клетках, наличие капсул и клеточных включений. Данные были
получены путем микроскопирования с использованием фазово-контрастного
микроскопа Ergoval (Carl Zeiss) и окраски по Граму, а также с применением KOH - теста. К культуральным
признакам относят: оптические свойства, характер поверхности, профиль, край,
размеры, консистенция колоний.
2.5.2 МАЛДИ
как метод идентификации микроорганизмов
Для анализа масс-спектральных белковых профилей культуры
выращивали на среде R2: (27 ℃, 48 ч), культуры предварительно сеяли штрихом на
чашках Петри. Клетки (~ одну колонию) с чашки Петри втиранием переносили с
помощью тонкого стерильного шпателя на стальную пластинку-мишень, сверху
наносили 0,7 мкл раствора матрицы (α-циано-4-гидроксикоричная
кислота [HCCA] в 50 % -ном водном растворе ацетонитрила, содержавшем 2,5 %
трифторуксусной кислоты) и высушивали на воздухе при комнатной температуре.
Спектры регистрировали в линейном режиме с задержанной экстракцией ионов на
приборе "Autoflex Speed" ("Bruker Daltonics”). Время задержки -
350 нс, ускоряющее напряжение - 20 кВ. Запись спектров проводили в режиме
положительных ионов; диапазон регистрируемых масс составлял 2-20 кДа.
Результирующие спектры каждого препарата штаммов получали суммированием
спектров, зарегистрированных в 10-15 точках анализируемых препаратов при 500
ударах лазера.
Обработку масс-спектров производили с помощью программных
пакетов "Flex analysis 3.3" и " "Bruker Daltonics”.
Для сравнения степени идентичности видов методом МАЛДИ
применились такие показатели как:
|
Диапозон
|
Описание
|
Категория совпадения
|
Цвет
|
Символы
|
|
2.300 - 3.000
|
Идентификация
до вида
|
А
|
Зелёный
|
(+++)
|
|
2.000 - 2.299
|
Безопасная
идентификация до рода, вероятная до вида
|
В
|
Зелёный
|
(++)
|
|
1.700 - 1.999
|
Вероятная
идентификация до рода
|
В
|
Желтый
|
(+)
|
|
0.000-1.699
|
Ненадежная
идентификация
|
С
|
Красный
|
(-)
|
2.5.3
Микроскопирование с использованием фазово-контрастного микроскопа
Для изучения формы и размера клеток использовался препарат
"раздавленная капля" 24 - часовых культур, выращенных на чашках Петри
с дальнейшим изучением культур под фазово-конрастным микроскопом Ergoval (Carl Zeiss) с использованием
иммерсионного объктива 90Х.
При этом наблюдаемые в микроскопе препараты в тех частях, где
имеются "амплитудные" смещения световых волн, являются контрастными,
а в тех частях, где имеются "фазовые" смещения - малоконтрастными.
Посредством фазово-контрастного приспособления микроскопа имеющиеся фазовые
неконтрастные колебания искусственно превращаются в колебания с иной
амплитудой, вследствие чего фазовые элементы препарата делаются столь же
контрастными, как и амплитудные, от чего изображение всего исследуемого объекта
становится контрастным и отчетливым.
.5.4 Тест на
определение миколовых кислот
1. 10 мг сухой биомассы поместить в гидролизную пробирку
и добавить 1 мл метанола, 1 мл толуола, 0,04 мл конц. Н2SO4, перемещать.
2. Метанолиз 12-16 ч, 75℃.
. После охлаждения добавить 0,2 мл гексана, интенсивно
встряхивать.
. Гексановый экстракт нанести на Silufol (Merck) и разогнать в системе
гексан-диэтиловый эфир (85: 15).
. После высушивания хроматограма проявляется 5% -ным
раствором фосфорномолибденовой кислоты в спирте при нагревании. Миколовые
кислоты видны как синие пятна на жёлтом фоне. Визуализируются (Merck) под УФ-лучами.
Пластины Silufol перед использованием очищаются в системе хлороформ-метанол
(9:1) и активируются 1ч при 100-120℃. Метиловые эфиры
миколовых кислот (МЭМК) частично разрушатся уже через 12 ч после метанолиза.
Системва для камеры: гексан 42,5, эфир 7,5 мл.
.5.5 Учёт
нефтеокисляющей активности
Учёт нефтеокисляющей активности проводился в течении 7-ми
суток по схеме:
"-" - роста нет, неэмульгированная нефтяная плёнка
на поверхности;
"+" - слабый рост, частичная эмульгация;
"++" - рост, частичная эмульгация, слабое
помутнение среды;
"+++" - рост, полная эмульгация, помутнение среды;
"++++" - полная деструкция нефтяной пленки.
3. Микрофлора
нефтешламов и нефтезагрязгрязнённых грунтов различного происхождения
В работе были использованы образцы грунта, нефтешлама
различного срока хранения, взятые с полигона ООО "АPБ" Абинского района,
ст. Хомская, а также буровые отходы Западной Сибири. При этом были выделены 94
чистых культур микроорганизмов для последующего изучения их культуральных и
морфологических признаков.
Таблица 1 - Высеваемость микроорганизмов (КОЕ/г) из грунта и
нефтешламов на 7-е сутки
|
Питательная
среда
|
Свежий шлам
|
Шлам
длительного срока хранения
|
Шлам в процессе
биоремедиа-ции
|
Нефтезагрязнённый
грунт
|
Незагрязнённый
грунт
|
|
ПА
|
1,5 ×107
|
9× 106
|
5×106
|
5×106
|
5×106
|
|
R2
|
2×108
|
5×108
|
7,5×107
|
9×106
|
8,2×108
|
Таблица 2 - Высеваемость из микроорганизмов (КОЕ/г) из
буровых шламов
|
Питательная
среда
|
Тюменское
месторождение
|
Кошильское
месторождение
|
|
ПА
|
2 ×106
|
3× 106
|
|
R2
|
2,5×107
|
4,5×108
|
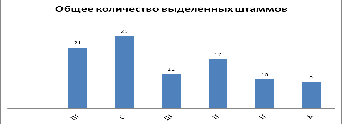
Рисунок 1 - Общее количество выделенных штаммов
Согласно полученным данным наибольшая численность
микроорганизмов порядка 108 наблюдалась в образце с незагрязнённым
грунтом, а наименьшая порядка 106 - в образце с буровыми отходами
Западной Сибири. Высеваемость микроорганизмов, а также наивысшее
таксономическое разнообразие форм бактерий наблюдалось на низкоуглеродистой
среде R2.
.1
Таксономическое разнообразие микроорганизмов
Выделенные штаммы были идентифицированы на основании
морфолого-культуральных признаков и по белковому профилю с использование
время-пролётной масс-спектрометрии (МАЛДИ). Полученные данные представлены в
таблице 3, 4, 5, 6, 7.
Таблица 3 - Морфологические и культуральные признаки штаммов,
выделенных из незагрязнённого грунта
|
Штамм
|
Культуральные
признаки (описание колоний)
|
Морфологические
признаки
|
Окраска по
Граму
|
|
3.7
|
Розовые,
округлые, гладкие, маслянистые
|
Кокки,
расположены группами и одиночно (по 2-4), спор нет
|
Г-
|
|
3.6 (2); 3.22
|
Светло -
бежевые, округлые, маслянистые, гладкие
|
Прямые палочки,
3-3,5 мкм, склонны объединяться в цепочки, субтерминальное расположение спор,
споры цилиндрической формы, Ø 0,7-0,8 мкм
|
Г+
|
|
3.33
|
Бежевые, округлые, маслянистые
|
Прямые палочки,
1,5-2 мкм, терминальное расположение спор, споры округлой формы, Ø 0,8 - 0,9 мкм
|
Г+
|
|
3.5
|
Бежевые,
округлые, врастающие в агар, рельефные
|
Прямые палочки,
3-4 мкм, субтерминальное расположение спор, споры цилиндрической формы, Ø 0,7 - 0,9
|
Г+
|
|
3.13
|
Белые,
округлые, гладкие, маслянистые, однородные
|
Палочки, 2-4
мкм, терминальное расположение спор, споры округлой формы, Ø 0,4 - 0,5
|
Г+
|
|
3.8 (2)
|
Бело-бежевые,
округлые, гладкие неоднородные
|
Палочки, 2-4
мкм, склонны объединяться в цепочки, споры цилиндрической формы, Ø 1.5 мкм
|
Г+
|
|
3.2
|
Бело-бежевые,
округлые. бургистые
|
Палочки, 3 -
3,5 мкм, склонны объединяться в цепочки, споры цилиндрической формы, Ø 0,7 - 0,8 мкм
|
Г+
|
|
3.33а
|
Светло-бежевые,
округлые маслянистые, гладкие
|
Правильные
палочки, субтерминальное расположение спор, эндоспоры, Ø 0,6-0,7 мкм
|
Г+
|
|
3.6
|
Светло-бежевые,
округлые, гладкие, однородные
|
Прямые палочки,
3-4 мкм, склонны объединяться в цепочки, субтерминальное и терминальное
расположение спор, споры цилиндрической формы, Ø 2 мкм
|
Г+
|
|
3.8 (1)
|
Бело-бежевые,
округлые, гладкие, неоднородные
|
Палочки, 3-5
мкм, субтерминальное расположение спор. споры цилиндрической формы, Ø 2 мкм
|
Г+
|
|
3.9
|
Белые, округлые, гладкие, однородные
|
Короткие
палочки, 1-1,5 мкм, встречаются удлинённые кокки, спор нет, делятся
перетяжкой, Ø 1-1,2
мкм
|
Г-
|
|
3.10
|
Светло-бежевые,
округлые, гладкие однородные
|
Одиночные
палочки, 1-2 мкм, спор нет, Ø 0,2-0,4 мкм
|
Г-
|
|
3.11 (2)
|
Белые,
волнистые, мелкозернистые, ризоидные
|
Прямые палочки,
1-1,5 мкм, терминальное и субтерминальное расположение спор, споры
цилиндрической формы, Ø
0,7-0,8 мкм
|
Г+
|
|
3.1 (2) б
|
Светло -
бежевые, округлые, с фестончитым краем
|
Палочки, 1-1,5
мкм, субтерминальное расположение спор, споры округлой формы, Ø 0,7-0,8 мкм
|
Г+
|
|
3.12
|
Белые,
округлые, гладкие, плёнчатые
|
Правильные
палочки, 1,5-2 мкм, без спор,Ø 0,2-0,3 мкм
|
Г-
|
|
3.2 (1) a
|
Светло-бежевые,
округлые, складчатые
|
Правильные
палочки, 1-1,5 мкм, спор нет, Ø 0.2-0,3
|
Г-
|
Согласно таблице 3 из незагрязнённого грунта было выделено 17
штаммов микроорганизмов из них: 4 Г - палочки: 3.9, 3.10, 3.12, 3.2
(1) а, 1 Г - кокк: 3.7, а также 12 культур Г+ палочек со
спорами: 3.6 (2); 3.22, 3.33, 3.5, 3.13, 3.8 (2), 3.2, 3.3 (2), 3.6, 3.8
(1),3.11 (2), 3.1 (2) б.
Таблица 4 - Морфологические и культуральные признаки штаммов,
выделенных из шлама длительного срока хранения
|
Штамм
|
Культуральные
признаки (описание колоний)
|
Морфологические
признаки
|
Окраска по
Граму
|
|
2.9; 2.8
|
Белые, округлые, гладкие, однородные.
|
Кокки, но и
встречаются палочки, спор нет
|
Г-
|
|
2.11
|
Белая,
округлая, гладкая, маслянистая
|
Палочки, 1-1,5
мкм, спор нет, Ø
0.2-0,3 мкм
|
Г-
|
|
2.2 (2)
|
Желтые,
складчатые, концентрические, маслянистые
|
Палочки, спор
нет, 1-1,5 мкм, Ø 0,2 -
0,4 мкм
|
Г-
|
|
2.3
|
Бежевые, округлые, гладкие, однородные
|
Прямые палочки,
3-4 мкм, субтерминальное расположение спор, споры цилиндрической формы, Ø 0,3-0,4 мкм
|
Г+
|
|
2.4
|
светло -
жёлтые, округлые, гладкие, маслянистые
|
Палочки, 1 - 2
мкм, деление бинарное, Ø 0,8
мкм
|
Г+
|
|
2.5
|
Розовые,
округлые, гладкие, маслянистые
|
Кокки, но и
встречаются палочки, спор нет
|
Г-
|
|
2.6
|
Белые,
округлые, гладкие, маслянистые,. полупрозрачные
|
Правильные
палочки, 2-4 мкм, спор нет, Ø 0,5-0,7 мкм
|
Г-
|
|
2.7
|
Белые,
округлые, гладкие, маслянистые, плёнчатые, однородные
|
Прямые палочки,
1-1,5мкм, спор нет, Ø
0,4-0,5 мкм
|
Г-
|
|
2.1
|
Оранжевые,
округлые, полупрозрачные, плёнчатые
|
Палочки, 1-1,5
мкм, спор нет, Ø
0,3-0,4 мкм
|
Г-
|
|
2.10
|
Белые, округлые, неоднородные, тестообразные
|
Правильные
палочки, 3-4 мкм, субтерминальное расположение спор, споры цилиндрической
формы, Ø
0,8-0,9мкм
|
Г+
|
|
2.13
|
Бежевые,
гладкие, однородные, концентрические
|
Правильные
палочки, 1-2 мкм, субтерминальное и терминальное расположение спор, споры
цилиндрической формы, Ø
0,8-0,9 мкм
|
Г+
|
Согласно таблице 4 из шлама длительного срока хранения
выделено 12 изолятов из них: 5 Г - палочек без спор: 2.11, 2.2 (2),
2.6, 2.1, 2.7; 3 Г - кокки: 2.9; 2.8, 2.5; 4 Г+ палочки
со спорами: 2.3, 2.4, 2.10, 2.13.
Таблица 5 - Морфологические и культуральные признаки штаммов,
выделенных из свежего шлама
|
Штамм
|
Культуральные
признаки (описание колоний)
|
Морфологические
признаки
|
Окраска по
Граму
|
|
1.4
|
Светло-бежевые,
складчатые, гладкие, маслянистые, однородные
|
Прямые палочки,
1-1,5 мкм, спор нет, Ø 0,4 -
0,5 мкм
|
Г-
|
|
1.11
|
Светло -
розовые, округлые, гладкие, однородные
|
Палочки, 1,5-2
мкм, спор нет, Ø 0,3 -
0,4 мкм
|
Г-
|
|
1.9
|
Светло-бежевые,
гладкие, маслянистые, однородные
|
Прямые палочки,
1-3 мкм концы закруглены, спор нет, Ø 0,7 мкм
|
Г-
|
|
1.10
|
Светло-бежевые,
гладкие, маслянистые, однородные
|
Палочки, 1,5-2
мкм, спор нет, Ø 0,7 -
0,8 мкм
|
Г-
|
|
1.14
|
Светло-бежевые,
округлые, гладкие, неоднородные, маслянистые
|
Прямые палочки,
до 5 мкм, концы закруглены, спор нет, Ø 0,7 мкм
|
Г-
|
|
1.5 (2) б (2)
|
Светло -
бежевые, гладкие, маслянистые
|
Прямые палочки,
2-2,5 мкм, спор нет, Ø
0,8-0,9 мкм
|
Г-
|
|
1.17
|
Светло-бежевые,
складчатые, маслянистые, плёнчатые
|
Правильные
палочки,2-2,5 мкм, спор нет, Ø 0,4 - 0,5мкм
|
Г-
|
|
1.26
|
Бежевые,
гладкие, маслянистые
|
Прямые палочки,
2-2,5мкм, терминальное и субтерминальное расположение спор, споры
цилиндрической формы, Ø
0,7-0,8 мкм
|
Г+
|
|
1.10 (2); 1.24
|
Светло -
бежевые, складчатые., маслянистые, плёнчатые
|
Правильные
палочки, 1-1,5 мкм, спор нет, Ø 0,4-0,5 мкм
|
Г-
|
|
1.6
|
Светло-бежевые,
складчатые, маслянистые, плёнчатые
|
Прямые палочки,
2-3мкм, спор нет, Ø
0,4-0,5 мкм
|
Г-
|
|
1.7; 1.1
|
Прямые палочки,
1-1,5мкм, спор нет, Ø
0,6-0,7 мкм
|
Г-
|
|
1.21
|
Светло -
бежевые, складчатые, плёнчатые
|
Прямые палочки,
2-3мкм, спор нет, Ø
0,4-0,5 мкм
|
Г-
|
|
1.8 (2)
|
Светло -
бежевые, складчатые,. плёнчатые
|
Прямые палочки,
1-2 мкм, концы закруглены, спор нет, Ø 0,7мкм
|
Г-
|
|
1.19
|
Светло -
бежевые, складчатые, плёнчатые
|
Прямые палочки,
2-3мкм, спор нет, Ø
0,4-0,5 мкм
|
Г-
|
|
1.22 (1); 1.22
(2)
|
Белые,
концентрические, мелкозернистые
|
Прямые палочки,
1,5 - 2 мкм, субтерминальное расположение спор, споры цилиндрической формы, Ø 0,7 - 0,9 мкм
|
Г+
|
|
1.3
|
Белые,
округлые, гладкие, однородные, плёнчатые
|
Кокки, но и
встречаются палочки, спор нет
|
Г-
|
|
1.2
|
Светло-бежевые,
округлые, гладкие, однородные
|
Неправильной
формы, разнообразны по размерам, встречаются в цепочках
|
Г-
|
|
1.20
|
Жёлтые,
складчатые, концентрические, мелкозернистые
|
Палочки, до 5
мкм, субтерминальное расположение спор, споры вытянутой цилиндрической формы,
Ø 0,7
мкм
|
Г+
|
|
1.18
|
Светло-бежевые,
округлые, маслянистые
|
Прямые палочки,
2-мкм, спор нет, Ø 0,6
мкм
|
Г-
|
|
1.15
|
Бежевые,
округлые, гладкие, маслянистые
|
Одиночные
кокки, объединяются в скопления
|
Г-
|
|
1.13
|
Розовые,
округлые, гладкие, маслянистые
|
Кокки,
объединяются в скопления (небольшие агломераты), клетки не расходятся после
деления
|
Г-
|
Согласно таблице 5 из свежего шлама выделено 25 штаммов
микроорганизмов из них: 17 Г - палочек без спор: 1.4, 1.11, 1.9,
1.10, 1.14,1.5 (2) б (2), 1.17, 1.10 (2); 1.24, 1.6, 1.7; 1.1, 1.21, 1.8 (2),
1.19, 1.18, 1.15; 3 Г - кокков: 1.13, 1.15, 1.3; 5 Г+ палочек
со спорами: 1.22 (1); 1.22 (2); 1.16, 1.26, 1.20; неправильной формы Г - палочки:
1.2.
Таблица 6 - Морфологические и культуральные признаки штаммов,
выделенных из нефтезагрязнённого грунта
|
Штамм
|
Культуральные
признаки (описание колоний)
|
Морфологические
признаки
|
Окраска по
Граму
|
|
4.11
|
Белые, маслянистые, мелкозернистые
|
Кокки, но и
встречаются палочки, спор нет
|
Г-
|
|
4.7
|
Белые, гладкие, маслянистые, мелкозернистые
|
Палочки, 1,5 -
2 мкм, спор нет, Ø 0,7
мкм
|
Г-
|
|
4.5 (1) а; 4.5
(2)
|
Светло -
зелёные, маслянистые, округлые
|
Правильные
палочки, 2-2,5 мкм, клетки часто образуют зигзагообразные цепочки,
субтерминальное расположение спор, споры вытянутой цилиндрической формы, Ø 0,7-0,8 мкм
|
Г+
|
|
4.9
|
Белые,
складчатые, маслянистые
|
Палочки, 2-2,5
мкм, субтерминальное расположение спор, споры цилиндрической формы, Ø 0,7-0,8 мкм
|
Г+
|
|
4.13
|
Полупрозрачные, округлые, гладкие.
|
Палочки, 1-1,5
мкм, спор нет, Ø
0,5мкм
|
Г-
|
|
4.6 (2)
|
Белые, концентрические, маслянистые
|
Прямые палочки,
3-4 мкм, субтерминальное расположение спор, споры цилиндрической формы, Ø 0,7 - 0,9 мкм
|
Г+
|
|
4.1
|
Белые, концентрические, маслянистые,
мелкозернистые
|
Прямые палочки,
до 7 мкм, субтерминальное расположение спор, споры округлой формы, Ø 1,5 мкм
|
Г+
|
|
4.3
|
Бежевые,
округлые, полупрозрачные, маслянистые, однородные
|
Прямые
одиночные палочки, 1-1,5мкм, спор нет, Ø 0,6-0,7 мкм
|
Г-
|
|
4.4
|
Светло-бежевые,
округлые, маслянистые
|
Прямые палочки,
2мкм, спор нет, Ø 0,6
мкм
|
Г-
|
Согласно таблице 6 из нефтезагрязнённого грунта выделено 10
изолятов из них: 4 Г - палочки без спор: 4.13, 4.3, 4.4, 4.7; 1 Г
- кокк: 4.11; 5 Г+ палочки со спорами 4.5 (1) а,
4.5 (2), 4.6 (2), 4.1, 4.9.
Таблица 7 - Морфологические и культуральные признаки штаммов,
выделенных из шлама в процессе биоремедиации
|
Штамм
|
Культуральные
признаки (описание колоний)
|
Морфологические
признаки
|
Окраска по
Граму
|
|
5.17
|
Светло-желтые,
складчатые, волнистые, плёнчатые
|
Палочки, 1 мкм,
субтерминальное расположение спор, споры вытянуто цилиндрические, Ø 0,4 мкм
|
Г+
|
|
5.9 (1)
|
Светло-бежевые,
складчатые, волнистые, маслянистые
|
Кокки,
находятся группами по 2-6, разнообразны по форме и длине
|
Г-
|
|
5.19
|
Светло -
жёлтые, гладкие, складчатые
|
Правильные
палочки, субтерминальное расположение спор, споры цилиндрической формы, Ø 0,8-0,9 мкм, длина 2,5-3 мкм
|
Г+
|
|
5.21 (1)
|
Белые,
складчатые, маслянистые, волнистые
|
Правильные
палочки, заострённые концы, субтерминальное расположение спор, споры
цилиндрической формы, Ø 0,7
мкм, длина 1,5-2,3 мкм
|
Г+
|
|
5.18 (1)
|
Светло -
бежевые, округлые, гладкие, маслянистые
|
Прямые палочки,
субтерминальное расположение спор, споры цилиндрической формы, Ø0,.3-0,4 мкм, длина 2-3 мкм
|
Г+
|
|
5.18 (2)
|
Светло -
бежевые, округлые, гладкие, маслянистые
|
Палочки,
встречаются палисадные структуры, V-образные
структуры, разнообразные по форме и длине
|
Г-
|
|
5.18 (3)
|
Светло -
бежевые, округлые, гладкие, маслянистые
|
Прямые палочки,
2 мкм, субтерминальное расположение спор, споры цилиндрической формы, Ø0,5 мкм
|
Г+
|
|
5.21 (2)
|
Бежевые,
маслянистые, волнистые
|
Палочки, 2 мкм,
субтерминальное расположение спор, споры округлой формы, Ø 0,6 мкм
|
Г+
|
|
5.12
|
Жёлтые, волнистые
|
Палочки, 3-4 до
5 мкм, иногда в виде нитей, концы заострены,Ø0,7-0,9 мкм
|
Г-
|
|
5.4 (2)
|
Желтые,
концентрические, маслянистые
|
Одиночные
палочки, 1,5 мкм, субтерминальное и терминальное расположение спор, споры
округлой формы, Ø 0,5
мкм
|
Г+
|
|
5.4 (1);
|
Желтые,
концентрические, маслянистые
|
Кокки, но
некоторые палочки находятся группами по 2-6, разнообразны по форме и длине
|
Г-
|
|
5.16
|
Светло-жёлтые,
складчатые, маслянистые
|
Прямые палочки,
длина 2-3 мкм, без спор, Ø 0,.3-0,4 мкм
|
Г-
|
|
5.10; 5.14
|
Бежевые,
складчатые, маслянистые
|
Палочки, 3-4
мкм, склонны объединяться в цепочки, субтерминальное и терминальное
расположение спор, споры цилиндрической формы, Ø 2 мкм
|
Г+
|
|
5.1
|
Светло-жёлтые,
концентрические, плёнчатые
|
Прямые палочки,
2-3 мкм, без спор, Ø0,.3-0,4
мкм
|
Г-
|
|
5.7; 5.8
|
Белые,
округлые, гладкие, маслянистые, выделяют водорастворимый пигмент
|
Прямые палочки,
2-4 мкм, спор нет, Ø0,3-0,4
мкм
|
Г-
|
|
5.15
|
Белые, гладкие, маслянистые, однородные
|
Палочки, 1-2
мкм, склонны объединению, деление перетяжкой, слегка неправильной формы, Ø 0,5 - 0,7 мкм
|
Г-
|
|
5.3
|
Светло-оранжевые,
гладкие, маслянистые
|
Палочки, 3 мкм,
спор нет, Ø 0,5
мкм
|
Г-
|
|
5.13
|
Жёлтые,
гладкие, маслянистые
|
Палочки, 3-4
мкм спор нет, Ø 0,3
мкм
|
Г-
|
|
5.5
|
Белые, гладкие, маслянистые, однородные
|
Прямые палочки,
2-3 мкм спор нет, Ø 0,5
мкм
|
Г-
|
Согласно таблице 7 из шлама в процессе биоремедиации выделено
21 изолятов из них: 7 Г - палочек без спор: 5.12, 5.16, 5.1, 5.7,
5.8; 5.3, 5.5, 5.13; 3 Г - кокка: 5.4, 5.4 (1); 5.9 (1); 2 Г - палочки
неправильной формы:
.15, 5.18 (2); 7 Г+ палочек со спорами: 5.17,5.19,
5.21 (1), 5.18 (1), 5.21 (2), 5.10, 5.14.
Таблица 8 - Морфологические и культуральные признаки штаммов,
выделенных из буровых отходов Западной Сибири
|
Штамм
|
Культуральные
признаки (описание колоний)
|
Морфологические
признаки
|
Окраска по
Граму
|
|
2.22 1а (1);
2.22 1 а (2)
|
Красные,
гладкие, округлые
|
Палочки,
неправильной формы, V-формы,
разнообразные по форме и длине
|
Г-
|
|
5.5у 5.1
|
Бежевые,
округлые, гладкие
|
Палочки, 2-3
мкм, спор нет, Ø 0,4
мкм
|
Г-
|
|
№ 5 5А
|
Бежевые,
гладкие, маслянистые
|
Палочки, 2-3
мкм, спор нет, Ø 0,4
мкм
|
Г-
|
|
2A
|
Бежевые,
гладкие, маслянистые
|
Присутствуют
палочки и кокки, разнообразные по размерам
|
Г-
|
|
№7 2.1 2a
|
Бежевые,
гладкие, маслянистые
|
Присутствуют
палочки и кокки, разнообразные по размерам
|
Г-
|
|
№3 2.1
|
Бежевые,
гладкие, маслянистые
|
Присутствуют
палочки и кокки, разнообразные по размерам
|
Г-
|
|
P 9
|
Желтоватые,
складчатая, маслянистая
|
Толстые палочки
2-3 мкм, эндоспоры
|
Г+
|
|
№ 6 4.4 Б
|
Бежевые,
гладкие, масялнистые
|
Тонкие
правильные палочки 1-2 мкм, без спор, 0,6 мкм
|
Г-
|
Согласно таблице 8 из буровых отходов Западной Сибири
выделено 9 изолятов из них: 3 Г - палочки: № 6, 5.5у 5.1; 5 Г -
неправильной формы палочки и кокки: 2.22 1а (1),2.22 1 а (2), № 7, № 3, №
1, 1Г+ палочка с эндоспорами: Р 9.
Далее для более детального изучения выделенных штаммов
использовался метод время-пролётной масс-спектрометрии (МАЛДИ). Полученные
результаты представлены в Приложении А, Б, В, Г, Д, Е.
Идентификация выделенных культур по белковым профилям
показала, что разные штаммы являлись представителями одного вида. Мы
предполагаем, что данная картина обусловлена случайным выбором культуры
независимо от их реальной численности в исследуемых образцах.
Для проверки результатов идентификации, полученные с помощью МАЛДИ,
проводилось сравнение идентифицированных штаммов с их морфолого-культуральными
признаками.
Таблица 9 - Список изолятов идентифицированных до вида или
рода
|
№ изолята
|
Вид (род)
|
Признак
идентификации
|
Источник
выделения
|
|
1.11 (С) (-)
|
Pseudomonas
|
Морфолого-культу
ральные признаки
|
Свежий шлам
|
|
1.13 (А) (++)
|
Kocuria
rosea
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.14 (С) (-)
|
Pseudomonas
|
Морфолого-культуральные
признаки
|
Свежий шлам
|
|
1.16 (С) (-)
|
Arthobacter
kerguelensis
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Свежий шлам
|
|
1.9 (В) (+)
|
Рseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.10 (С) (-)
|
Рseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.4 (В) (+)
|
Рseudomonas
|
МАЛДИ, морфолого-культуральные
признаки
|
Свежий шлам
|
|
1.6 (B) (+)
|
Рseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.8 (2) (А) (++)
|
Рseudomonas stutzeri
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.2 (B) (++)
|
Arthrobacter crystallopoietes
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.3 (В) (+)
|
Асinetobacter
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежего шлам
|
|
1.20 (С) (-)
|
Рseudomonas хаnthomarina
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Свежий шлам
|
|
1.21 (С) (-)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.22 (1); 1.22
(2) (В) (+)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежегий шлам
|
|
1.18 (В) (+)
|
Рseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.17 (А) (++)
|
Рseudomonas stutzeri
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.19
(В) (+)
|
Рseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.26 (В) (+)
|
Рseudomonas
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Свежий шлам
|
|
1.10 (2); 1.24
(С) (-)
|
Pseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.5 (2) б2 (С)
(-)
|
Рseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Свежий шлам
|
|
1.1; 1.7 (А)
(++)
|
Рseudomonas stutzeri
|
МАЛДИ, морфолого-культуральные
признаки
|
Свежий шлам
|
|
1.15 (С) (-)
|
Stenotrophomonas
maltophilia (PХ) 23086229 MLD
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Свежий шлам
|
|
2.10 (В) (+)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам длительного
срока хранения
|
|
2.11 (А) (++)
|
Рseudomonas mandelii
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам
длительного срока хранения
|
|
2.13 (В) (+)
|
Вacillus
|
МАЛДИ,
морфологокультуральные признаки
|
Шлам
длительного срока хранения
|
|
2.3 (С) (-)
|
Clostridium
innocuum
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам
длительного срока хранения
|
|
2.4 (С) (-)
|
Staphylococcus
vitulinus
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам
длительного срока хранения
|
|
2.5 (С) (-)
|
Tsukamurella
|
Морфолого-культуральные
признаки
|
Шлам
длительного срока хранения
|
|
2.8; 2.9 (В) (+)
|
Аcinetobacter lwoffii
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам
длительного срока хранения
|
|
2.2 (2) (А)
(++)
|
Рseudomonas stutzeri
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам
длительного срока хранения
|
|
2.6 (С) (-)
|
Clostridium
bifermintas
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам
длительного срока хранения
|
|
2.7 (С) (-)
|
Еnretococcus faecium
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам
длительного срока хранения
|
|
2.1 (С) (-)
|
Аromatoleum buckelii
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам
длительного срока хранения
|
|
3.1 (2) б (С)
(-)
|
Novosphingobium
resinovorum DSM 10700 HAM
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Незагрязнённый
грунт
|
Chryseobacterium
scophthalmum
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Незагрязнённый
грунт
|
|
3.22 (В) (+)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Незагрязнённый
грунт
|
|
3.33 (В) (+)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Незагрязнённый
грунт
|
|
3.6 (С) (-)
|
Staрhylococcus hominis ssp novobiosepticus
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Незагрязнённый
грунт
|
|
3.8 (1) (С) (-)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Незагрязнённый
грунт
|
|
3.9 (В) (+)
|
Асinetobacter
|
МАЛДИ,
морфолого-культуральные признаки
|
Незагрязнённый
грунт
|
|
3.10 (А) (++)
|
Рseudomonas
stutzeri
|
МАЛДИ,
морфолого-культуральные признаки
|
Незагрязнённый
грунт
|
|
3.11 (2) (А)
(++)
|
Bacillus
licheniformis
|
МАЛДИ,
морфолого-культуральные признаки
|
Незагрязнённый
грунт
|
|
3.12 (А) (++)
|
Rhizobium
radiobacter
|
МАЛДИ,
морфолого-культуральные признаки
|
Незагрязнённый
грунт
|
|
3.6 (2) (В) (+)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Незагрязнённый
грунт
|
|
3.2 (1) а (В)
(+)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Незагрязнённый
грунт
|
|
3.33а (С) (-)
|
Lodderomyces
elongisporus
|
Не соответствует
идентификации по морфолого-культуральным признакам
|
Незагрязнённый
грунт
|
|
3.5 (С) (-)
|
Тrauera
chlorobenzoica
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Незагрязнённый
грунт
|
|
3.13 (А) (++)
|
Аcinetobacter
johnsonii
|
Не соответствует
идентификации по морфолого-культуральным признакам
|
Незагрязнённый
грунт
|
|
3.7 (В) (+)
|
Kocuria
rosea
|
МАЛДИ,
морфолого-культуральные признаки
|
Незагрязнённый
грунт
|
|
4.1 (С) (-)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Нефтезагрязнёный
грунт
|
|
4.5 (2); 4.5
(1) а (В) (++)
|
Enterobacter
(cloacae)
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Нефтезагрязнёный
грунт
|
|
4.6 (2) (С) (-)
|
Bacillus
thuringiensis DSM 2046T DSM
|
МАЛДИ,
морфолого-культуральные признаки
|
Нефтезагрязнёный
грунт
|
|
4.7 (А) (++)
|
Асinetobacter
lwoffii
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Нефтезагрязнёный
грунт
|
|
4.11 (А) (++)
|
Аcinetobacter
johnsonii
|
МАЛДИ,
морфолого-культуральные признаки
|
Нефтезагрязнёный
грунт
|
|
4.9 (В) (+)
|
Enterobacter
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Нефтезагрязнёный
грунт
|
|
4.13 (С) (-)
|
Lactobacillus
amylovorus
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Нефтезагрязнёный
грунт
|
|
4.3 (А) (++)
|
Pseudomonas
chlororaphis
|
МАЛДИ,
морфолого-культуральные признаки
|
Нефтезагрязнёный
грунт
|
|
4.4 (С) (-)
|
Рseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Нефтезагрязнёный
грунт
|
|
5.9 (1) (С) (-)
|
Сlostridium
cochlearium 1050 NCTC 2909 BOG
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам в процессе
биоремедиации
|
|
5.10; 5.14 (А)
(++)
|
Рseudomonas
stutzeri
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.17 (С) (-)
|
Clostridium
sphenoides
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам в процессе
биоремедиации
|
|
5.19 (С) (-)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.12 (С) (-)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.18 (1) (С)
(-)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.18 (2) (С)
(-)
|
Bacillus
safensis
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам в процессе
биоремедиации
|
|
5.18 (3) (С) (-)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.4 (2) (С) (-)
|
Trichosporon
mucoides
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам в процессе
биоремедиации
|
|
5.4 (1) (С) (-)
|
Trichosporon
mucoides
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам в процессе
биоремедиации
|
|
5.16 (В) (+)
|
Рseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.21 (1) (С)
(-)
|
+Bacillus
|
МАЛДИ, морфолого-культуральные
признаки
|
Шлам в процессе
биоремедиации
|
|
5.21 (2) (С)
(-)
|
Bacillus
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.1 (А) (++)
|
Рseudomonas
stutzeri
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.7; 5.8 (С)
(-)
|
Рseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.15 (А) (++)
|
Rhizobium
radiobacter
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.3 (А) (++)
|
Eхiguobacterium
aurantiacum
|
МАЛДИ,
морфолого-культуральные признаки
|
Шлам в процессе
биоремедиации
|
|
5.5 (С) (-)
|
Lactobacillus
parahlantarum
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам в процессе
биоремедиации
|
|
5.13 (С) (-)
|
Stenotrophomonas
maltophilla
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Шлам в процессе
биоремедиации
|
|
2А №1 (А) (++)
|
Rhodococcus
erythropolis
|
МАЛДИ,
морфолого-культуральные признаки
|
Буровые отходы
Западной Сибири
|
|
2.22 1а (1) (В)
(+)
|
Dietzia
maris
|
МАЛДИ,
морфолого-культуральные признаки
|
Буровые отходы
Западной Сибири
|
|
2.22 1а (2) (С)
(-)
|
Acidovoraх avenae ssp avenae DSM 7227 HAM
|
Не
соответствует идентификации по морфолого-культуральным признакам
|
Буровые отходы
Западной Сибири
|
|
5.5у 5.1 (В)
(+)
|
Pseudomonas
|
МАЛДИ,
морфолого-культуральные признаки
|
Буровые отходы
Западной Сибири
|
|
№ 5 5А (А) (++)
|
Acinetobacter
shindleri
|
МАЛДИ,
морфолого-культуральные признаки
|
Буровые отходы
Западной Сибири
|
|
№7 2.1 2a (А) (++)
|
Rhodococcus
erythropolis
|
МАЛДИ,
морфолого-культуральные признаки
|
Буровые отходы
Западной Сибири
|
|
№3 2.1 (А) (++)
|
Rhodococcus
erythropolis
|
МАЛДИ,
морфолого-культуральные признаки
|
Буровые отходы
Западной Сибири
|
|
P 9 С (-)
|
Васillus
|
морфолого-культуральные
признаки
|
Буровые отходы
Западной Сибири
|
|
№ 6 4.4 Б С (-)
|
Рseudomonas
|
морфолого-культуральные
признаки
|
Буровые отходы
Западной Сибири
|
Согласно таблице 9 из 94 изолятов по белковому профилю и
морфолого-культуральным признакам до вида идентифицированы 24 культуры:
Pseudomonas stutzeri: 5.1, 3.10,
1.17, 1.1, 1.8 (2), 5.14, 5.10, 2.2 (2)
Аcinetobacter johnsonii: 4.11, 3.13
Аcinetobacter lwofii: 4.7
Bacillus thuringiensis: 4.6 (2)
Kocuria rosea: 1.13
Аrthrobacter crystallopoietes: 1.2
Pseudomonas mandelii: 2.11
Bacillus licheniformis: 3.11
Rhizobium radiobacter: 3.12
Eхiguobacterium
aurantiacum: 5.3
Pseudomonas chlororaphis: 4.3shindleri: № 5 5А
Dietzia maris: 2.22 1 а (1)
Rhodococcus erythropolis: 2А, №7 2.1 2a, №3 2.1
Также до рода идентифицировано культур:
р Рseudomonas (18 культур): 5.7, 5.8,
5 5у 5.1, 4.4, 5.16, 1.11, 1.14, 1.9, 1.10, 1.4, 1.6, 1.7, 1.18, 1.19, 1.26,
1.10 (2), 1.24; 1.5 (2) б (2).
р. Bacillus (16 культур): 3.3 (2), 3.8
(1), 3.6 (2), 4.1, 2.10, 2.13, 3.22,,
.19, 5.12, 5.18 (1), 5.18 (3), 5.21 (1), 1.22
(1), 1.22 (2), 3.2 (1) а, 5.21 (2)
р. Acinetobacter: 1.3, 3.9, 2.8,
2.9
р. Tsukamurella: 2.5
32 культуры не идентифицированы: 1.15, 1.16, 2.3, 2.4, 2.6,
2.7, 2.1, 3.1 (2) б, 3.8 (2), 3.6, 3.33, 3.5, 4.9, 4.13, 5.9 (1), 5.17, 5.4
(2), 5.4 (1), 5.5, 5.13, 2.22 1а (2),5.18 (2).1.20, 1.21, 5.15, № 6 4.4Б, P9, 3.33а, 4.5 (2), 4.5
(1) а, 3.7, 1.3
Это связано с тем, что база данных МАЛДИ ориентирована на
патогенных и условно патогенных микроорганизмов человека, а не на почвенную
микрофлору. Поэтому большинство штаммов не идентифицированы (0.000-1.699).
Таким образом, можно считать метод МАЛДИ не достоверным при
определении видового состава почв, что подтверждается морфолого-культуральными
признаками.
Как уже выяснено, из 94 штаммов не идентифицировано 32. Из
них 4 культуры: активные нефтеокисляющие штаммы, выделенные из буровых отходов
Западной Сибири: №7 2.1 2a, №3 2.1, № 6 4.4 Б, P 9, были отправлены на
перепроверку их таксономической принадлежности во Всероссийскую коллекцию
микроорганизмов (ВКМ) ИБФМ им. Г.К. Скрябина РАН, г. Пущено.
Таблица 10 - Результаты идентификации культур методом МАЛДИ
(г. Пущено)
|
Номер
анализируемого образца
|
Подходящая
характеристика
|
Оценка значения
|
Цвет
|
|
№72.1 2a
|
Rhodococcus
erythropolis
|
1.887
|
Желтый
|
|
№32.1
|
Rhodococcus
erythropolis
|
1.836
|
Желтый
|
|
№6 4.4 Б
|
Ненадежная
идентификация
|
1.634
|
Красный
|
|
Р9
|
Ненадежная
идентификация
|
1.166
|
Красный
|
В результате проведенной идентификации методом МАЛДИ до вида
определилось 2 штамма: №7 2.1 2a, №3 2.1 Культуры № 6 4.4 Б, P 9 не были
идентифицированы методом МАЛДИ. Для них было произведено ПРЦ с последующим
секвенированием гена 16р РНК
Таблиц 11 - Уровни сходства по генам 16S рРНК исследуемых
штаммов с ближайшими типовыми штаммами
|
Штамм ВКМ
|
Ближайший
типовой штамм
|
% сходства
|
|
Pseudomonas sp.
№6
|
Pseudomonas
stutzeri ATCC 17588 (T)
|
98.77
|
|
Bacilus sp.8
(P9)
|
Bacilus
beringensis BR035 (T)
|
99.74
|
В результате проведённого анализа штаммы были
идентифицированы как Pseudomonas stutzeri, Bacilus beringensis.
Также среди неидентифицированных 32 культур методом МАЛДИ
были представители филума Асtinobacteria. Для таких штаммов 4.5 1
(а), 4.5 (2), 2А, 3.7, 2.1, 1.3 был произведён тест на определение содержание
миколовых кислот. В результате чего культуры были все отнесены к р. Rhodococcus sp.
Остальные же 24 неидентифицированных штамма были отнесены к
различным группам по определителю Берджи (9-го издания).
Таблица - 12 Распределение неидентифицированных
штаммов в различные группы по определителю Берджи (9-е издание)
|
Образец
|
Группа 4.
Грамотриц., Аэробные/ микроаэробные палочки и кокки
|
Группа 18.
Грамполож. палочки и кокки, образ. эндоспоры
|
Группа 20.
Грамполож. неспорообразующ. палочки неправ. формы
|
|
Незагрязненный
грунт
|
-
|
Г +,
прямые палочки, 3-4 мкм, субтермин. распол. спор, споры цилиндрической формы,
Ø 0,7 -
0,9
|
-
|
|
Нефтеза-грязнённый
грунт
|
Г-,
прямые палочки, 1-1,5 мкм, спор нет, Ø 0,5мкм
|
Г +,
палочки, 2-2,5 мкм, субтерминальное расположение спор, споры цилиндрической
формы, Ø
0,7-0,8 мкм
|
Г +,
правильные палочки, 2-2,5 мкм, клетки часто образуют зигзагообразные цепочки,
субтерминальное расположение спор, споры вытянутой цилиндрической формы, Ø 0,7-0,8 мкм
|
|
Свежий шлам
|
Г-,
прямые палочки, 2-3 мкм спор нет, Ø 0,4-0,5 мкм
|
Г +,
правильные палочки, с заострёнными концами, 2-3 мкм, субтерминальное распол.
спор, споры цилиндрические, Ø 0,5-0,7 мкм
|
Г +,
одиночные кокки, объединяются в скопления, встречаются палисадные структуры, V-образные структуры
|
|
Шлам в процессе
биоремедиации
|
Г-,
прямые палочки, 2-3 мкм спор нет, Ø 0,5 мкм
|
Г+,
палочки, 1 мкм, субтерминальное распол. спор, споры вытянуто цилиндрические, Ø 0,4 мкм
|
Г+,
палочки, встречаются палисадные структуры, V-образные структуры, разнообразные по форме и длине, спор нет
|
|
Шлам
длительного срока хранения
|
Г-,
прямые палочки, 1-1,5мкм, спор нет, Ø 0,4-0,5 мкм
|
Г+,
прямые палочки, 3-4 мкм, субтерминальное распол. спор, споры цилиндрической
формы, Ø
0,3-0,4 мкм
|
-
|
|
Буровые отходы
Западной Сибири
|
Г +,
прямые палочки, 2-3 мкм спор нет, Ø 0,5 мкм
|
-
|
-
|
Так, в незагрязнённом грунте неидентифицированы 4 культуры
отнесенны к группе 18 (грамположит. палочки и кокки образ. эндоспоры), в шламе
длительного рока хранения 5 штаммов относящ. к группе 4и 18. Самый большое
количество недентифициранных штаммов (9культур) наблюдается в шламе в процессе
биоремедиации, такие культуры по определителю были отнесены к 4,18,20 группам,
что говорит об активной биоочистке и высоком видовом разнообразии и
преобладанием актинобактерий в образце (основных бодемструктров нефти в
нефтешламах).
3.2 Анализ
микрофлоры исследуемых образцов и учёт нефтеокисляющей активности выделенных
культур
В результате проведённой идентификации различными методами
было выявлено, что:
В образце с незагрязнённым грунтом из 17 выделенных штаммов
преобладал р. Ваcillus (8 культур), кроме того в образце с меньшей
частотой встречались представители рода Pseudomonas, Аcinetobacter, Kocuria, Rhizobium, что свидельствует о
большом микробиологическом разнообразии в чистом грунте, здесь встречаются как
биодеструкторы нефти, так и обычные представитель микрофлоры почв.
В образце с нефтезагрязнённым грунтом можно заметить более
низкий видовой состав, по сравнению с незагрязнённым грунтом, так из 10
выделенных штаммов наиболее часто встречаются Pseudomonas, Аcinetobacter, Ваcillus что, предположительно,
связано с развитием узкоспециализированного сообщества микроорганизмов
биодеструкторов нефти.
В образце со свежим шламом, где наблюдается высокое
разнообразие (из 25 штаммов) преобладают р. Pseudomonas.
Это объясняется тем, что представители это рода плохо
переносит условия конкуренции, но быстро заселяют новые ниши благодаря высокой
скорости роста и способности усваивать лёгкие парафины и нафталины нефти, а
также свидетельствует о начальных процессах биоремедиционных процессов. Также
встречаются представители родов Аcinetobacter, Ваcillus,Kocuria, Аrthrobacter.
В шламе длительного срока хранения же из 12 культур
преобладают р. Pseudomonas, Ваcillus, Аrthrobacter, Tsukamurella, что свидетельствует
постепенной смене грамположительных спорообразующих форм неспорообразующими
формами.
В шламе в процессе биоремедиации из 22 - х выделенных
изолятов преобладают рода: Ваcillus, Pseudomonas, а выявлены
представители рода Rhizоbium, Eхiguobacterium, что также
свидетельствует об процессах биодеструкции и формировании нефтеокисляющих
сообществ микроорганизмов.
В буровых отходах Западной Сибири наблюдается наименьшее
видовое разнообразие и преобладание нефтеокисляющих бактерий из таких родов
как: Аcinetobacter, Pseudomonas, Dietzia, Rhodococcus.
Обнаружили, что представители рода Pseudomonas чаще всего встречались в
образце со свежим шламом, доставленным с полигона ООО "АРБ" Абинского
района, ст. Хомская.
Это свидетельствует о том, что в данном образце происходят
начальные стадии биоремедиации. А представители рода Bacillus чаще всего встречались в
образце со шламом в процессе биоремедиации с того же полигона. Это показывает,
что в данном образце интенсивно происходит процесс деструкции нефти.
|
Количество
неиден-тифицированных штаммов
|
4
|
4
|
4
|
8
|
5
|
3
|
|
Нефтеокислящ.
активность
|
++++ (1) ++ (1)
+ (10) (5)
|
++ (2) + (8)
|
+++ (1) ++ (2)
+ (21) (2)
|
+++ (4) ++ (2)
+ (14) (2)
|
+++ (2) ++ (1)
+ (10)
|
++ (2) ++++ (1)
+++ (2)
|
|
Tsukamurella
|
-
|
-
|
-
|
-
|
1
|
-
|
|
Rhodococcus
|
-
|
-
|
-
|
-
|
-
|
3
|
|
Dietzia
|
-
|
-
|
-
|
-
|
-
|
1
|
|
Eхiguobacte-rium
|
-
|
-
|
-
|
1
|
-
|
-
|
|
Rhizobium
|
1
|
-
|
1
|
-
|
-
|
|
Аrthrobacter
|
-
|
-
|
1
|
-
|
-
|
-
|
|
Kocuria
|
1
|
-
|
1
|
-
|
-
|
-
|
|
Bacillus
|
8
|
2
|
1
|
6
|
2
|
-
|
|
Аcinetobacter
|
2
|
2
|
1
|
-
|
2
|
1
|
|
Pseudomonas
|
1
|
2
|
13
|
6
|
2
|
1
|
|
Количество
выделенных штаммов
|
17
|
10
|
25
|
22
|
12
|
8
|
|
Образец
|
Незагрязненный
грунт
|
Нефтеза-грязнённый
грунт
|
Свежий шлам
|
Шлам в процессе
биореме-диации
|
Шлам
длительного срока хранения
|
Буровые отходы
Запад. Сибири
|
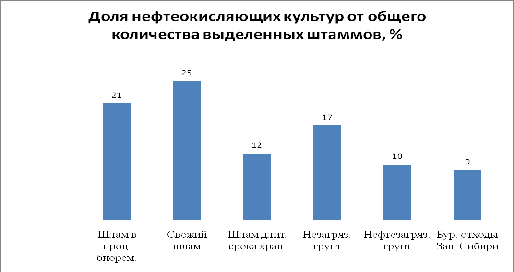
Рисунок 3 - Доля нефтеокисляющих культур от общего количества
выделенных штаммов, %
Нефтеокисляющая активность штаммов в исследуемых образцах:
Незагрязнённый грунт 17 штаммов из них:
Kocuria rosea (++++)
Рseudomonas stutzeri (++)
10 (+): 6 Bacillus sp, Аcinetobacter
johnsonii, Acinetobacter sp, Rhizobium radiobacter, Bacillus licheniformis
Нефтезагрязнённый грунт10 штаммов из них:
2 (++) Группа 18 Грамполож. палочки и кокки,
образ. эндоспоры;
8 (+): Аcinetobacter
johnsonii, Аcinetobacter lwofii, Bacillus thuringiensis,
Pseudomonas chlororaphis, Pseudomonas sp, Bacillus sp,
1 Г +, прямые палочки. Группа 4.
Грамотриц., Аэробные/микроаэробные палочки и кокки (++)
1 Группа 18. Грамполож. палочки и кокки, образ.
эндоспоры
Свежий шлам25 штаммов из них:
Kocuria rosea (+++),
Рseudomonas sр (++),Bacillus
sp (++),
21 (+): 11Pseudomonas
sp,5Рseudomonas stutzeri, Bacillus sp, 2 Группа 18. Грамполож. палочки и
кокки, образ. эндоспоры, 2Группа4. Грамотриц., Аэробные/микроаэробные
палочки и кокки
Шлам в процессе биоремедиации 21 штамм из них:
Г+, палочки. Группа 20. Грамполож.
неспорообразующ. палочки неправ. формы (+++), 2 Рseudomonas sp (+++)
Bacillus sp (++), Рseudomonas
stutzeri (++)
14 (+): 1Eхiguobacterium
aurantiacum
3 Рseudomonas
stutzeri
4 Bacillus sp
1Группа4. Грамотриц.,
Аэробные/микроаэробные палочки и кокки
1Группа 20. Грамполож. неспорообразующ. палочки
неправ. формы
2Группа 18. Грамполож. палочки и кокки, образ.
эндоспоры 2Группа4. Грамотриц., Аэробные/микроаэробные палочки и кокки
Шлам длительного срока хранения 12 штаммов из
них:
2Acinetobacter sp (+++)sp.
(++)
9 (+): 2 Bacillus sp, 1Рseudomonas
stutzeri, 1Pseudomonas mandelii,
4Группа4. Грамотриц., Аэробные/микроаэробные
палочки и кокки
Группа 18. Грамполож. палочки и кокки, образ.
эндоспоры
Буровые отходы Сибири 9:
Аcinetobacter shindleri (++)
2Г +, прямые палочки. Группа4.
Грамотриц., Аэробные/микроаэробные палочки и кокки, 1 Г - Acinetobacter shindleri,Рseudomonasstutzri,Bacilus beringensis (++)
Dietzia maris (+++)
Rhodococcus erythropolis (++++);
Заключение
По результатам проделанной работы можно сделать следующие
выводы:
. Из выделенных 91 штаммов преобладали р. Bacillus, Pseudomonas, Acinetobacter, самым распространённым
видом среди образцов являлся Pseudomonas stutzeri.
2. Результаты, полученные с помощью метода МАЛДИ
масс-спектрометрии, не всегда согласуются с данными, полученными на основании
морфолого-культуральных признаков.
. Из 92 штамма 14 относятся к филуму Actinobacteria,
что составляет 16% от общего числа выделенных культур.
4. Из 94 выделенных культур 90 являются нефтеокисляющими
штаммами, свидетельствует об активной деструкции углеводородов в данных
образцах.
Библиографический
список
1. Oборин А.А., Рубинштейн Л.М., Хмурчик В.Т. Роль подземной
микробиоты в потоках углерода в верхней части литосферы // Геология, геофизика
и разработка нефтяных и газовых месторождений. 2005. № 9-10. С.34-36.
2. Бактерии-деструкторы
полициклических ароматических углеводородов, выделенные из почв и донных отложений
района солеразработок / Е.Г. Плотникова [и др.] // Микробиология. 2001. Т.70. №
1. С.61 - 70.
. Беседина
E.Н. Микрофлора нефтешлама
длительного срока хранения, подвергнутого биоремидиации / Дипломная работа.
Краснодар. 2007.63с.
. Видовая
структура угеводородокисляющих бактериоценозов водных экосистем разных
климатических зон / Т.М. Коронелли [и др.] // Микробиология. 1994. Т.63. № 5.
С.917 - 922.
. Влияние
источника углерода на устойчивость к тяжёлым металлам штаммов нефтеокисляющих
актинобактерий, используемых в процессах биоремидиации / А.А. Худокормов [и
др.] // Научный журнал КубГАУ. 2012. Т.9. № 83. С.1-10.
. Выбор
активного микроорганизма - деструктора углеводородов для очистки
нефтезагрязнённых почв / Е.В. Стабникова [и др.] // Прикладная биохимия и
микробиология. 1995. № 5. Т.31. С.534 - 539.
. Звягинцев
Д.Г. Взаимодействие микроорганизмов с твёрдыми поверхностями. 1973. Изд-во
МГУ.176 с.
. Неведрова
О.А. Микробиологический контроль процессов биоремидиации нефтешламов и
нефтезагрязненных почв / Дипломная работа. Краснодар. 2002.44с.
. Особенности
распределения и физиологического состояния микроорганизмов нефтешлама - отхода
нефтяного производства / Е.В. Никитина [и др.] // Микробиология. 2003. Т.72. №
15. С.699-706.
. Особенности
химического состава нефтешлама - отхода нефтехимического производства / О.И.
Якушева [и др.] // Материалы 6 Международной концеренции "Нефтехимия -
2002". 2002. С.271 - 276.
. Перспективные
методы очистки нефтешламов и нефтесодержащих сточных вод / С.Н. Степаненко [и
др.] // Фундаментальные исследования. 2005. № 6. С.76-79.
. Плешакова
Е.В. Эколого-функциональные аспекты микробной ремедиации нефтезагрязнённых
почв. Автореферат дис. д. б. н. 2010.48 с.
. Родококки
как природный сорбент углеводородов / С.Г. Коронелли [и др.] // Микробиология.
1986. Т.55. № 4. С.683 - 685.
14. Ягафарова
Г.Г., Барахнина В.Б. Утилизация экологически опасных бурвых отходов //
Нефтегазовое дело. 2006. № 2. С.48-61.
. Беляков
А.Ю., Плешакова Е.В. Скрининг микроорганизмов-деструкторов // Известия
Саратовского университета. Новая серия. Серия. Химия. Биология. Экология. 2013.
Т.13. № 4. С.39-41.
16. Яковлев
А.С., Прохоров А.Н., Решетина Т.В. Об охране почв // Бюллетень
"Использование и охрана природных ресурсов в России". 2001. № 7.
С.49-52.
. Создание
и применения жидкого препарата на основе ассоциации нефтеокисляющих бактерий /
В.А. Чугуров [и др.] // Прикладная биохимия и микробиология. 2000. Т 36. № 6.
С.666-671.
. Сопрунов
О.Б., Клюянова М.А. Штаммы - деструкторы нефтяных углеводородов // Вестник
АГТУ. 2007. Т.36. № 1. С.180-182.
. Хомякова
Д.В., Ботвинко И.В., Нетрусов А.И. Выделение психроактивных углеродокисляющих
бактерий из нефтезагрязнённых почв // Прикладная биохимия и микробиология.
2003. Т 39. № 6. С.661-664.
. Биодеградация
углеводородов Rhodococcus sp. (R.ruber) 1718 и Rhodococcus sp. (R. erythopolis) 1715/А.А. Мац [и др.] //
Тезисные доклады Международного симпозиума "Интродукция микроорганизмов в
окружающую среду", 18-21 апреля 1994.1994. С.68 - 69.
. Большой
Энциклопедический словарь "Химия" / под ред. Кнунянц. М., 1998.800с.
. Выделение
и характеристика микроорганизмов - деструкторов полициклических ароматических
углеводородов / И.Ф. Пунтус [и др.] // Микробиология. 1997. Т.66. № 2.
С.269-272.
. Якушева
О.И., Никоноров В.Н., Кияненко Г.В. Особенности химического состава нефтешлама
- отхода нефтехимического производства // Материалы 6 Международной конференции
" Нефтехимия-2002". 2002. С.271 - 276.
. Нефтеокисляющий
штамм Rhodococcus erythopolis В2 как основа создания
биопрепарата для ликвидации углеводородных загрязнений и рекультивации земель /
Э.В. Карасёва [и др.] // Научный журнал КубГАУ. 2012. Т.9. № 83. С.1-13.
. Использование
бактерии Arthobacter при биоремедиации нефтезагрязнённых почв / Н.Б.
Градова [и др.] // Прикладная биохимия и микробиология. 2003. Т.39. № 3. С.318
- 322.
. Волченко
Н.Н., Карасёва Э.В. Скрининг углеводородокисляющих бактерий - продуцентов
поверхностно - активных веществ биологической природы и их применение в опыте
по ремедиации нефтезарязнённой почвы и нефтешлама // Биотехнология. 2006. № 2.
С.57 - 62.
. Никитина
Е.В., Зарипов С.А., Частухина И.Б. Нефтешлам - источник
микроорганизмов-деструкторов // Международная конференция студентов и
аспирантов "Локомотив-2000", 10-14 апреля 2000.2000. С.143 - 144.
. Тeske A. P. Тhe deep subsurface
biosphere is alive and well // Trends in Microbiology. 2005. Vol.13. № 9. P.402
- 404.
. Attached and unattached microbial communities in a
simulated basalt a simulated aquifer under fracture - and porous-flow
conditions / Lehman R. M [et al.] // Аррlied and Environmental Microbiology. 2001.
Vol.67. № 6. P.27.
30. Humic substances as a mediator for microbially catalised
metal reduction / Lovley D. R [et al.] // Acta Hydrochimica et Hydrobiologia.
1998. Vol.26. № 3. Р.152-157.
. Sinclair J. L.,. Ghiorse W.С. Distribution of aerobic
bacteria,рrotozoa,algae
and fungi in deep subsurface sediments // Geomicrobiol. J. 1989. Vol.7. № 1.
P.9-16.
32. Практикум
по микробиологии / под. ред. Н.С. Егорова. Изд-во МГУ. 1976.306 с.
Приложения
Приложение А
Таблица А 1 - Результаты идентификации культур по белковым
профилям (МАЛДИ), выделенные из свежего шлама
|
Номер
анализируемого образца
|
Лучшее
совпадение
|
Оценка значения
|
Второе лучшее
совпадения
|
Оценка значения
|
|
1.11 (С) (-)
|
Pseudomonas
aeruginosa
|
1.203
|
Pseudomonas
aeruginosa
|
1.176
|
|
1.13 (А) (++)
|
Kocuria
rosea
|
2.001
|
Kocuria роlaris
|
1.924
|
|
1.14 (С) (-)
|
Pseudomonas
libanensis
|
1.492
|
Ненадежная
идентификация
|
|
|
1.16 (С) (-)
|
Arthobacter
kerguelensis
|
1.413
|
Ненадежная
идентификация
|
|
|
1.9 (В) (+)
|
Рseudomonas stutzeri
|
1.774
|
Ненадежная
идентификация
|
1.471
|
|
1.10 (С) (-)
|
Рseudomonas stutzeri
|
1.415
|
Ненадежная
идентификация
|
|
|
1.4 (В) (+)
|
Рseudomonas stutzeri
|
1.791
|
Рseudomonas stutzeri
|
1.771
|
|
1.6 (B) (+)
|
Рseudomonas хаnthomarina
|
1.737
|
Ненадежная
идентификация
|
1.557
|
|
1.7; 1.1 (С) (-)
|
Рseudomonas stutzeri
|
2.196
|
Рseudomonas stutzeri
|
2.04
|
|
1.8 (2) (А) (++)
|
Рseudomonas stutzeri
|
2.11
|
Рseudomonas stutzeri
|
2.09
|
|
1.2 (А) (++)
|
Arthrobacter crystallopoietes
|
2.001
|
Ненадежная
идентификация
|
|
|
1.3
|
Асinetobacter lwoffii
|
1.334
|
Асinetobacter lwoffii
|
1.302
|
|
1.20 (С) (-)
|
Рseudomonas хаnthomarina
|
1.472
|
Ненадежная
идентификация
|
|
|
1.21 (С) (-)
|
Bacillus
acidicola
|
1.383
|
Ненадежная
идентификация
|
|
|
1.22 (1); 1.22 (2)
|
Bacillus simplex
|
1.771
|
Bacillus muralis
|
1.705
|
|
1.18 (В) (+)
|
Рseudomonas stutzeri
|
1.714
|
Ненадежная
идентификация
|
|
|
1.17 (А) (++)
|
Рseudomonas stutzeri
|
2.09
|
Ненадежная
идентификация
|
|
|
1.19
(В) (+)
|
Рseudomonas stutzeri
|
1.821
|
Ненадежная
идентификация
|
|
|
1.26 (В) (+)
|
Рseudomonas хanthomarina
|
1.737
|
Ненадежная
идентификация
|
|
|
1.10 (2); 1.24 (С) (-)
|
Pseudomonas
stutzeri B367 UFL
|
1,604
|
|
|
|
1.5 (2) б2 (С)
(-)
|
Рseudomonas stutzeri
|
1.524
|
Ненадежная
идентификация
|
|
|
1.15 (С) (-)
|
Stenotrophomonas
maltophilia (PХ) 23086229 MLD
|
1.417
|
|
|
Приложение Б
Таблица Б 1 - Результаты идентификации культур по белковым
профилям (МАЛДИ), выделенные из шлама длительного хранения
|
Номер
анализируемого образца
|
Лучшее
совпадение
|
Оценка значения
|
Второе лучшее
совпадения
|
Оценка значения
|
|
2.9; 2.8 (А)
(++)
|
Асinetobacter lwoffii
|
2.081
|
Асinetobacter lwoffii
|
2.016
|
|
2.10 (В) (+)
|
Bacillus
thuringiensis
|
1.822
|
Bacillus certus
|
1.807
|
|
2.11 (А) (++)
|
Рseudomonas mandelii
|
2.191
|
Рseudomonas frederiksbergensis
|
1.987
|
|
2.13 (В) (+)
|
Вacillus firmus
|
1.721
|
Ненадежная
идентификация
|
1.43
|
|
2.3 (С) (-)
|
Clostridium
innocuum
|
1.446
|
Ненадежная
идентификация
|
1.293
|
|
2.4 (С) (-)
|
Staphylococcus
vitulinus
|
1.221
|
Ненадежная
идентификация
|
1.216
|
|
2.5 (С) (-)
|
Tsukamurella
sp
|
1.372
|
Ненадежная
идентификация
|
1.28
|
|
2.2 (2) (А)
(++)
|
Рseudomonas stutzeri
|
2.175
|
Рseudomonas stutzeri
|
2.105
|
|
2.6 (С) (-)
|
Clostridium
bifermintas
|
1.372
|
Ненадежная
идентификация
|
|
|
2.7 (С) (-)
|
Еnretococcus faecium
|
1.073
|
Ненадежная
идентификация
|
|
|
2.1 (С) (-)
|
Аromatoleum buckelii
|
1.49
|
Ненадежная
идентификация
|
|
Приложение В
Таблица В 1 - Результаты идентификации культур по белковым
профилям (МАЛДИ), выделенные из незагрязнённого грунта
|
Номер
анализируемого образцаЛучшее совпадениеОценка значенияВторое лучшее
совпаденияОценка значения
|
|
|
|
|
|
3.1 (2) б (С)
(-)
|
Novosphingobium
resinovorum DSM 10700 HAM
|
1,374
|
|
|
|
3.8 (2) (С) (-)
|
Chryseobacterium
scophthalmum
|
1.611
|
Ненадежная
идентификация
|
1.447
|
|
3.22 (В) (+)
|
Bacillus
muralis
|
1.702
|
Ненадежная
идентификация
|
1.682
|
|
3.33 (В) (+)
|
Bacillus
аrsenicus
|
1.851
|
Ненадежная
идентификация
|
1.563
|
|
3.6 (С) (-)
|
Stahylococcus
hominis ssp novobiosepticus
|
1.339
|
Ненадежная
идентификация
|
1.317
|
|
3.8 (1) (С) (-)
|
Bacillus
megaterium
|
1.611
|
|
1.447
|
|
3.9 (В) (+)
|
Асinetobacter lwoffii
|
1.938
|
Асinetobacter lwoffii
|
1.915
|
|
3.10 (А) (++)
|
Рseudomonas stutzeri
|
2.015
|
Рseudomonas stutzeri
|
1.911
|
|
3.11 (2) (А)
(++)
|
Bacillus
licheniformis
|
2.045
|
Ненадежная
идентификация
|
1.571
|
|
3.12 (А) (++)
|
Rhizobium
radiobacter
|
2.217
|
Rhizobium
radiobacter
|
2.182
|
|
3.6 (2) (В) (+)
|
Bacillus
simрlex
|
1.861
|
Ненадежная
идентификация
|
|
|
3.2 (1) а
|
Bacillus
simрlex
|
1.861
|
Ненадежная
идентификация
|
|
|
3.33а (С) (-)
|
Lodderomyces
elongisporus
|
1.286
|
|
|
3.5 (С) (-)
|
Тrauera chlorobenzoica
|
1.305
|
Ненадежная
идентификация
|
|
|
3.13 (А) (++)
|
Аcinetobacter johnsonii
|
2.298
|
Аcinetobacter johnsonii
|
2.243
|
|
3.7 (В) (+)
|
Kocuria
rosea
|
1.881
|
Kocuria
rosea
|
1.819
|
Приложение Г
Таблица Г 1 - Результаты идентификации культур по белковым
профилям (МАЛДИ), выделенные из шлама в процессе биоремидиации
|
Номер
анализируемого образцаЛучшее совпадениеОценка значенияВторое лучшее
совпаденияОценка значения
|
|
|
|
|
|
5.9 (1) (С) (-)
|
Сlostridium cochlearium 1050
NCTC 2909 BOG
|
1,395
|
|
|
|
5.10; 5.14 (А) (++)
|
Рseudomonas stutzeri
|
2.06
|
Рseudomonas stutzeri
|
2.049
|
|
5.17 (С) (-)
|
Clostridium
sphenoides
|
1.331
|
Ненадежная
идентификация
|
1.323
|
|
5.19 (С) (-)
|
Bacillus
pumilus
|
1.555
|
Ненадежная
идентификация
|
1.547
|
|
5.12 (С) (-)
|
Bacillus
horikoshii
|
1.698
|
Ненадежная
идентификация
|
|
|
5.18 (1) (С) (-)
|
Bacillus
safensis
|
1.243
|
Не надежная
идентификация
|
1.229
|
|
5.18 (2) (С) (-)
|
Bacillus
safensis
|
1.243
|
Ненадежная
идентификация
|
1.229
|
|
5.18 (3) (С) (-)
|
Bacillus
safensis
|
1.243
|
Ненадежная
идентификация
|
1.229
|
|
5.4 (2) (С) (-)
|
Trichosporon
mucoides
|
1.384
|
Ненадежная
идентификация
|
1.361
|
|
5.4 (1) (С) (-)
|
Trichosporon
mucoides
|
1.384
|
Ненадежная
идентификация
|
1.361
|
|
5.16 (В) (+)
|
Рseudomonas stutzeri
|
1.73
|
Ненадежная
идентификация
|
|
|
5.21 (1) (С)
(-)
|
Bacillus
pumilus
|
1.436
|
Не надежная
идентификация
|
|
|
5.21 (2) (С)
(-)
|
Bacillus
pumilus
|
1.436
|
Не надежная
идентификация
|
|
|
5.1 (А) (++)
|
Рseudomonas stutzeri
|
2.15
|
Рseudomonas stutzeri
|
2.033
|
|
5.7; 5.8 (С)
(-)
|
Рseudomonas хаnthomarinа
|
1.539
|
Ненадежная
идентификация
|
|
|
5.15 (А) (++)
|
Rhizobium
radiobacter
|
2.128
|
Rhizobium
radiobacter
|
2.126
|
|
5.3 (А) (++)
|
Eхiguobacterium aurantiacum
|
2.18
|
Ненадежная
идентификация
|
|
|
5.5 (С) (-)
|
Lactobacillus
parahlantarum
|
1.355
|
Ненадежная
идентификация
|
|
|
5.13 (С) (-)
|
Stenotrophomonas
maltophilla
|
1278
|
Ненадежная
идентификация
|
|
Приложение Д
Таблица Д 1 - Результаты идентификации культур по белковым
профилям (МАЛДИ), выделенные из буровых отходов Западной Сибири
|
Номер
анализируемого образца
|
Лучшее
совпадение
|
Оценка значения
|
Второе лучшее
совпадения
|
Оценка значения
|
|
2А (А) (++)
|
Rhodococcus
erythropolis
|
2.217
|
Rhodococcus
erythropolis
|
1.735
|
|
2.22 1а (1); 2.22 1а (2) (В) (+)
|
Dietzia
maris
|
1.758
|
|
|
|
5.5у 5.1 (В) (+)
|
Pseudomonas
mendocina
|
1.814
|
Pseudomonas oleovorans
|
1.806
|
|
№ 5 5А (А)
(++)
|
Acinetobacter
shindleri
|
2.052
|
Ненадежная
идентификация
|
|
|
№7 2.1 2a (В) (+)
|
Rhodococcus
erythropolis
|
1.887
|
|
|
|
№3 2.1 (В) (+)
|
Rhodococcus
erythropolis
|
1.836
|
|
|
|
P 9 (С) (-)
|
Васillus
|
|
|
|
|
№ 6 4.4 Б (С)
(-)
|
Рseudomonas
|
|
|
|
Приложение Е
Таблица Е 1 - Результаты идентификации выделенных культур по
белковым профилям (МАЛДИ), выделенные из нефтезагрязнённого грунта
|
Номер
анализируемого образца
|
Лучшее
совпадение
|
Оценка значения
|
Второе лучшее
совпадения
|
Оценка значения
|
|
4.1 (С) (-)
|
Bacillus megaterium
|
1.589
|
Ненадежная
идентификация
|
|
|
4.5 (2); 4.5 (1)
а (В) (++)
|
Enterobacter
cloacae
|
2.161
|
Enterobacter
ludwigii
|
2.081
|
|
4.6 (2) (С) (-)
|
Bacillus
thuringiensis DSM 2046T DSM
|
1.679
|
|
|
|
4.7 (А) (++)
|
Асinetobacter lwoffii
|
2.048
|
Асinetobacter lwoffii
|
2.03
|
|
4.11 (А) (++)
|
Аcinetobacter johnsonii
|
2.275
|
Аcinetobacter johnsonii
|
2.213
|
|
4.9 (В) (+)
|
Enterobacter
cloacae
|
1.782
|
Ненадежная
идентификация
|
|
|
4.13 (С) (-)
|
Lactobacillus
amylovorus
|
1.424
|
Не надежная
идентификация
|
|
|
4.3 (А) (++)
|
Pseudomonas
chlororaphis
|
2.014
|
Pseudomonas
kilonrnsis
|
|
|
4.4 (С) (-)
|
Рseudomonas stutzeri
|
1.653
|
Ненадежная
идентификация
|
|
Приложение Ж
Сиквенс фрагмента гена 16S рРНК штамма №6CCATGCCGCGTGTGTGAAGAAGGTCTTCGGATTGTAAAGCACTTTAAGTTGGGAGGAAGGGCAGTAAGCTAATACCTTGCTGTTTTGACGTTACCGACAGAATAAGCACCGGCTAACTTCGTGCCAGCAGCCGCGGTAATACGAAGGGTGCAAGCGTTAATCGGAATTACTGGGCGTAAAGCGCGCGTAGGTGGTTCGTTAAGTTGGATGTGAAAGCCCCGGGCTCAACCTGGGAACTGCATCCAAAACTGGCGAGCTAGAGTATGGCAGAGGGTGGTGGAATTTCCTGTGTAGCGGTGAAATGCGTAGATATAGGAAGGAACACCAGTGGCGAAGGCGACCACCTGGGCTAATACTGACACTGAGGTGCGAAAGCGTGGGGAGCAAACAGGATTAGATACCCTGGTAGTCCACGCCGTAAACGATGTCGACTAGCCGTTGGGATCCTTGAGATCTTAGTGGCGCAGCTAACGCaTTAAGT
Сиквенс фрагмента гена 16S рРНК штамма 8
(P9)GGACGAAAGTCTGACGGAGCAACGCCGCGTGAGTGATGAAGGTTTTCGGATCGTAAAACTCTGTTGTTAGGGAAGAACAAGTACCGGAGTAACTGCCGGTACCTTGACGGTACCTAACCAGAAAGCCACGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGTGGCAAGCGTTGTCCGGAATTATTGGGCGTAAAGCGCGCGCAGGTGGTCTCTTAAGTCTGATGTGAAAGCCCCCGGCTCAACCGGGGAGGGTCATTGGAAACTGGGAGACTTGAGTGCAGGAGAGAAGAGTGGAATTCCACGTGTAGCGGTGAAATGCGTAGAGATGTGGAGGAACACCAGTGGCGAAGGCGACTCTTTGGCCTGTAACTGACACTGAGGCGCGAAAGCGTGGGGAGCAAACAGGATTAGATACCCTGGTAGTCCACGCCGTAAACGATGAGTGCTAAGTGTTAGAGGGTTTCCGCCCTTTAGTGCTGCAGCAAACGCATTAАGCAСTCCGCСTGG